N° 3641 Office parlementaire d'évaluation des choix scientifiques et technologiques L'impact éventuel de la consommation des drogues Annexes I à VI ANNEXES 145 Annexe I : Liste des personnes auditionnées 147 Annexe II : Communication sur le cannabis du Professeur Ferreri et du Docteur Nuss aux entretiens de Bichat 2001 149 Annexe III : Communication sur le cannabis du Professeur Costentin à l'Académie nationale de médecine sur les données neurobiologiques récentes 155 Annexe IV : Conseil National du Sida (Rapport 2000 - Extrait) 165 Annexe V : Communication du Professeur Mura devant l'Académie Nationale de médecine sur l'accidentologie et les drogues illicites 169 Annexe VI : Etude de la Caisse Nationale d'Assurance Maladie maternité sur les benzodiazépine 179
Retour au sommaire et à l'introduction du rapport
Annexe I : Institutions Mme Nicole Maestracci 1 , Déléguée interministérielle de lutte contre la drogue et la toxicomanie Mme Danielle Vaseur, Chargée de mission au Comité Français d'éducation pour la Santé Pr Roger Henrion, Ancien Président de l'Observatoire français des toxicomanie Rapporteur de l'Académie de médecine Pr.Claude Got, Président de l'Observatoire français des drogues et toxicomanies et Jean Michel Costes Directeur de l'Observatoire français des drogues et toxicomanies Dr.Christofini, Président et DR Ange Mésandri, Chargé de mission Association Française des techniciens et ingénieurs de sécurité et médecins du travail Commissaire Bouchet, Chargé de mission auprès du Directeur Général de la police Nationale Mme Nathalie Foix, Substitut du Procureur de la République auprès du TGI de Versailles Mme Serre Directeur Général de Boucharda-Récordi, Docteur Catherine Lassale, Directeur des affaires scientifiques, pharmaceutiques et médicales du syndicat national de l'industrie pharmaceutique & Mme Anne Euxibie attachée parlementaire du SNIP Médecins et chercheurs Pr. Bernard Roques1, Responsable de l'Unité de recherche 266 de l'INSERM Pr. Daly, Hôpital Fernand-Widal ; Dr Jean-François Solal, psychiatre Dr William Lowenstein, Hôpital Pompidou, centre soins pour toxicomanes, Dr Isabelle Ferrand, Psychiatre à l'hôpital Cochin Pr Francis Cabalero1Université Paris X, auteur du précis de droit de la drogue Jean-Paul Tassin, Directeur de recherchesINSERM Pr. Lagier Hôpital Fernand Widal Dr. Nuss, Hôpital Saint Antoine Etats-Unis M.Bakouche , Attaché pour la science et la technologie, représentant de l'INSERM Ambassade de France Pr. Marc Galanter Directeur, division of alcoholism and drug abuse, New-York University Pr.Hebert D Kleber Professor of psychiatry Columbia University, New-York Dr Eric J.Simon, Professor of Psychiatry & Pharmacology, New-York University School of medecine Dr Steven W. Gust, acting Director, international program, National Institute on drug abuse. Glen R Hanson Director Division of neuroscience and behavioral research, National Institute on drug abuse (NIDA) David Shurtleff, Deputy Director Division of neuroscience and behavioral research , NIDA Dr Antonio Noronha, NIDA Branch Chief Neuroscience Research, National Institute on Alcohol Abuse and Alcoholism (NIAAA) Margaret M Murray, NIAAA Dr. Jeffrey Foote, Deputy Director alcohol research and treatment programs, The Mount Sinaï Medical center, New-York Annexe II : Le cannabis : données scientifiques récentes Philippe NUSS2, Maurice FERRERI 3 Outre ses différentes propriétés psycholeptiques et médicinales, le cannabis semble posséder une propriété rarement décrite, celle de générer de la confusion et de l'amalgame. En effet, dès lors que l'on tente de se faire une opinion sur ses effets, on se trouve dans l'incapacité de trouver des références nuancées sur cette substance qui, à l'évidence, mérite une approche subtile de sa complexité. Les différentes sources sur lesquelles on tente de se fonder sont rarement clairement établies dans un champ clair et homogène. A titre d'exemple, l'historique de la culture et de l'usage du chanvre (tel qu'on le trouve sur le site delta 9 de yahoo) mélange immédiatement ceux de la fibre végétale, utilisée depuis l'antiquité et source d'un commerce encouragé avec l'usage de la fleur. Si l'on s'intéresse aux débats sur les politiques de santé publique vis à vis du cannabis dans les différents pays du monde, on assiste à des descriptions décontextualisées qui ne prennent pas en compte la position générale du pays vis à vis des toxiques, ses buts sanitaires. Ainsi, considérant une position partielle d'un dispositif dans un pays (par exemple la libéralisation de la consommation de cannabis), on feint de croire qu'il suffirait de superposer les expériences dont l'évaluation est jugée positive pour définir une politique idéale qui serait la somme des différentes expériences partiellement analysées. Chacun est bien conscient du fait qu'il s'agit, plutôt que d'additivité, de cohérence interne d'une politique de santé. La prise de conscience écologique s'est amalgamée à la défense du cannabis par le biais de son origine naturelle bien qu'elle ne soit en aucune manière preuve d'inocuité pour l'homme. Par contiguïté, une culture musicale, mais aussi un marché de vêtements et de produits de toutes sortes issus du cannabis entretiennent une économie florissante et ne semblent pas créer, quoiqu'on puisse affirmer, de réelle alternative à l'économie de marché. De même, des données obtenues dans un domaine (par exemple l'effet antalgique du cannabis) sont-elles surgénéralisées dès lors qu'on en conclut à une innocuité : les opiacés, dont l'action antalgique est bien connue, ne sont pas pour autant sans danger. Le rapport établi par le Professeur Roques en 1998 (11) a tenté d'éviter cette tendance à la simplification et à la surgénéralisation qui s'instaure souvent dès lors que l'on tente de statuer sur la dangerosité des psychotropes. C'est en effet à partir d'une analyse complexe qu'il a tenté d'établir un palmarès de la dangerosité des drogues. Concernant le cannabis, le rapport fait état d'une faible dangerosité. En pondérant, puis en les additionnant, des dimensions comme la dépendance, la neurotoxicité, la toxicité générale, la dangerosité sociale, le rapport fait état d'un coefficient résultant faible (Tableau I). Le point le plus critiquable de ce rapport concernant le cannabis nous semble résulter de l'absence de prise en compte des aspects psychopathologiques individuels et de la dimension de fragilité génétique (17) chez les consommateurs (14, 17, 4). Ces aspects sont spécifiques au cannabis dont on a décrit les variations d'effets en fonction des sujets. De même, les dimensions temporelles comme par exemple des spécificités liées à l'âge des consommateurs (le très jeune âge actuellement des usagers de cannabis) et à l'effet cumulé de la consommation (les effets du cannabis ne sont vraisemblablement pas les mêmes pour des doses espacées que pour des doses importantes et cumulées) n'ont pas été prises en compte concernant le cannabis. On sait pourtant qu'une exposition prolongée et importante de cannabis peut entraîner des effets délétères chez le sujet schizophrène via le métabolisme des phospholipides (1). Les paramètres d'appréciation de la dangerosité potentielle du cannabis sont donc nombreux, aussi nombreux que ceux incitant à sa banalisation. Le fait est qu'ils ne sont pas du même niveau et que les amalgamer, c'est être certain de ne pouvoir disposer que de la croyance pour se faire une opinion. Il nous semble donc plus judicieux de définir, au sein d'un champ volontairement restreint (en l'occurrence, en ce qui nous concerne, les résultats scientifiques des études sur les effets neuropsychologiques du cannabis), les données scientifiques dont nous disposons. L'arbitrage, notamment concernant la libéralisation ou la dépénalisation de l'usage, étant un compromis de nature politique, issu d'un débat ayant pris en compte le niveau de danger de la substance. Ce choix témoignera du niveau de dangerosité qu'une société accepte d'assumer. Notre propos est de faire part de travaux récents sur des points précis du cannabis afin de participer au débat, sans prétendre le trancher. Ceci appartient au choix social et non pas au champ médical. Nous ferons donc appel à une revue récente (1998-2001 pour la plupart) de la littérature scientifique, parue dans les revues référencées les plus reconnues pour leur rigueur, pour donner un aperçu des effets psychopharmacologiques du cannabis. Un premier point mérite d'être souligné. Il concerne le caractère encore imprécis des données dont nous disposons ; ceci est en partie lié à des aspects méthodologiques. En effet, la plante cannabis sativa comporte plusieurs substances qui possèdent des actions psychotropes différentes. La substance qui paraît la plus importante est le tetrahydrocannabinol (delta9-THC); mais d'autres, comme le cannabidiol (CBD), le cannabinol et le cannabigerol (CBG) ont des effets propres et peuvent également moduler l'action psychotrope globale (par exemple, CBD réduit l'anxiété induite préalablement par THC). Par ailleurs, le type de substance utilisées dans les essais cliniques et pharmacologiques ne correspondent pas bien souvent aux produits consommés par les utilisateurs (herbe, résine de telle ou telle provenance) en termes de concentration et de mode d'administration. Une standardisation des extraits, les plus proches possibles des consommations réelles, paraît nécessaire. En outre, beaucoup d'inconnues demeurent d'un point de vue pharmacologique concernant l'action du cannabis. Toutefois, de nombreux arguments scientifiques, issus de travaux rigoureux et répliqués, viennent appuyer les impressions cliniques négatives sur le cannabis généralement reconnues par les praticiens en charge de jeunes présentant des troubles psychopathologiques. Le cannabis est habituellement incriminé (16) comme favorisant l'éclosion, les rechutes et la résistance thérapeutiques de troubles comme la schizophrénie, les troubles bipolaires et les troubles paniques (18, 19, 15). Ceci est partiellement appuyé par les résultats scientifiques. En outre, une tolérance croisée et une additivité du cannabis avec les effets de l'alcool a bien été mise en évidence. Un autre point important résulte du fait que l'effet du cannabis, contrairement à la plupart des drogues, ne présente pas une activité psychotrope toujours identique. Suivant la dose (quantité de THC absorbée), la forme de consommation, l'expérience que le consommateur a du cannabis, la structure de sa personnalité, son état d'esprit du moment, et le contexte dans lequel la consommation s'insère, des effets parfois opposés peuvent se produire simultanément ou successivement. Le cannabis agit avant tout sur le cortex cérébral, le système limbique, l'hypothalamus, l'hypophyse, le cervelet, mais aussi sur d'autres parties du corps comme la rate et l'intestin. On a pu mettre en évidence en 1988 l'existence de récepteurs spécifiques (CB1 et CB2) pour les cannabinoïdes dans le cerveau ainsi que l'existence de ligands endogènes pour ces derniers ; ils ont la particularité d'être des phospholipides dérivés de l'acide arachidonique. Tableau I
(*) : pas de toxicité pour la méthadone et la morphine en usage thérapeutique; Les effets psychiques induits par le cannabis sont connus ; ils comprennent: : Modification de la conscience, perception exacerbée du son et de la lumière Association très riche, accompagnées d'un besoin de bavarder et de rire Euphorie et disparition des inhibitions Conscience accrue de soi Modification de la perception du temps Relâchement intellectuel, manque d'entrain Baisse de la productivité et de la concentration, pensée fragmentaire Perturbation de la mémoire à court terme et ralentissement du temps de réaction Indifférence et détachement vis-à-vis de l'environnement Etats occasionnels et atypiques de désorientation, de confusion, d'angoisse, de panique et de délire. Malgré son origine naturelle, le cannabis n'est pas dénué d'action toxique somatique. On retiendra surtout les effets liés au fait de le fumer (troubles pulmonaires, bronchite chronique, cancers des voies aériennes supérieures) et les fréquents retards de croissance chez le f_tus ainsi que les troubles du comportement chez le nouveau-né. Nous insisterons seulement sur deux points concernant l'action potentiellement délétère du cannabis au plan psychologique et/ou psychiatrique. Nous développerons les effets cognitifs du cannabis et présenterons les résultats des études animales sur l'action du cannabis sur le système de récompense. Ces données peuvent bien entendu cohabiter avec d'autres, aussi rigoureuses au plan scientifiques, mettant en valeur les effets thérapeutiques du cannabis. Compte tenu de la répartition des récepteurs au cannabis (hippocampe notamment) (10) et de l'action du cannabis sur le cortex préfrontal (2, 6) des troubles cognitifs importants sont retrouvés chez tous les consommateurs. Les troubles mnésiques présents chez tous les sujets lors des tests cognitifs lorsqu'il y a prise de cannabis semblent être dus à l'action inhibitrice du cannabis sur l'activité Gaba hippocampique impliquée dans les processus de mémoire de travail (8) et à l'hypofrontalité induite. On note en outre une action systématique du cannabis sur les processus attentionnels, la perception temporelle (5) mais aussi les apprentissages, la fluence verbale, la rapidité procédurale et la dextérité manuelle (3). Dans la plupart des essais chez l'homme, les sujets altérés au plan des tests ne perçoivent pas subjectivement la diminution pourtant significative de leurs performances. Les interactions du cannabis avec la dopamine, l'acétylcholine, les opiacés, et les systèmes gabaergiques ont été démontrées dans plusieurs structures de cerveau. Chez l'animal, le blocage sélectif des récepteurs CB1 par le SR 141716 modifie la perception de la valeur appétitive des renforçateurs positifs (nourriture, cocaïne, morphine) et réduit la motivation pour la consommation de sucrose, de bière et d'alcool. Ceci témoigne du fait que l'incitation positive et/ou les processus de motivation pourraient être sous une commande permissive de mécanismes liés au CB1 (2). Les modèles d'auto administration et les test de préférence de la place, habituellement retenus pour attester d'un processus de renforcement opérant d'une molécule, sont paradoxaux en ce qui concerne le cannabis : positifs pour certain, négatifs pour d'autres (12, 13). Les cannabinoïdes sont donc impliqués dans les processus de dépendance. De même, l'implication du cannabis sur les neuromédiateurs dans le système de récompense et l'augmentation de la prise de cannabis en réponse au stress soulignent l'implication du cannabis au sein de ce système. Cette activation s'opère grâce à des mécanismes spécifiques, différents de ceux mis en jeu par les autres toxiques. On citera aussi à ce propos les interactions (mais aussi l'indépendance) du système opiacé avec les cannabinoïdes. En conclusion, il paraît important de considérer d'un point de vue médical psychopathologique que le cannabis présente des effets psychotropes délétères. Cependant, l'importance de son rôle dans la physiopathologie des troubles psychiques reste encore à définir avec plus de précision. Les adolescents constituent une population sur laquelle une attention particulière doit être portée (9) vis à vis du cannabis. C'est pourquoi un regard éclairé autant par l'expérience que par les résultats d'études nombreuses et complexes nous paraît un des éléments majeurs du débat sur la dépénalisation ; l'aveuglement passionnel ne nous paraissant pas susceptible de le nourrir de façon citoyenne. Annexe III : Bull. Acad. Natte Méd., 2002, 186, n° 2,... - ..., séance du 19 février 2002 Données neurobiologiques récentes sur le cannabis Récent neurobiological data on cannabis Jean COSTENTIN* RÉSUMÉ L'inquiétante croissance de l'usage du cannabis suscite un regain d'intérêt pour les mécanismes neurobiologiques qui sous-tendent ses activités diverses et en particulier toxicomaniaques, intrinsèques ou croisées avec d'autres drogues, ainsi que sur les méfaits qui en découlent. On décrit ici les éléments qui authentifient chez l'animal une dépendance psychique commune à toutes les drogues, une dépendance physique, laquelle servait jusqu'à maintenant à qualifier les "drogues dures", effet incitatif que paraît exercer le cannabis vis-à-vis de l'usage d'autres drogues, en particulier de l'héroïne. Enfin seront envisagées les relations étroites qu'entretient le cannabis avec la schizophrénie. Nombre de ces données récentes, loin de relativiser la toxicité psychique du cannabis, soulignent au contraire sa dangerosité potentielle. mots-clés : cannabis. héroînodépendance. troubles liés substance toxique .schizophrénie. SUMMARY The alarming increase in cannabis abuse has triggered a renewed interest in the neurobiological mechanisms which underlie its effects, particularly as regards its addictive properties either intrinsic or when crossed with other narcotics as well as its subsequent damage. We here report an evaluation of experimental data : which reveal in animals a psychological dependence, common to all addictive drugs ; a physical dependence, which is considered up to now as the characteristic of "hard addictive drugs" ; the incentive effect that cannabis should exert on the inclination to abuse other addictive drugs, especially heroin ; and finally the close relationships which seem to exist between cannabis and schizophrenia. Most of these recent data are far from reassuring as regards cannabis psychotoxicity. Furthermore they underline its potential danger and prompt increased caution. key-words (Index Medicus) : cannabis. heroindependence. substance-related disorders. schizophrenia. INTRODUCTION Le cannabis était utilisé en Chine, il y a 5 000 ans, comme une panacée. Depuis lors, on en trouve l'usage dans diverses indications diversement justifiées, voire manifestement erronées (paludisme par exemple). Ces usages reculèrent au rythme de l'avènement, dans ces indications, de molécules de synthèse aux effets plus spécifiques et plus puissants. Le constat d'une dépendance consacra son déclin et conduisit à sa prohibition (convention de Genève de 1925). L'accroissement actuel de la consommation de cannabis qualifiée d'irrésistible en raison de la faiblesse des dispositifs qui devraient la contenir, le propulse sur le devant de la scène. Pour en relativiser les dangers on se réfère à l'usage fréquent qui est fait, dans des sociétés sans alcool, de produits faiblement dosés en delta-9-tétrahydrocannabinol 'Correspondant de l'Académie nationale de médecine. Unité de Neuropsychopharmacologie, UMR 6036 CNRS, Faculté de Médecine et Pharmacie, 22 Bd Gambetta - 76183 Rouen cedex 1. Tirés-à-part : Professeur Jean COST.ENTIN, à l'adresse ci-dessus. Article reçu le 3l décembre 2001, accepté le 14 janvier 2002. (THC), le principe actif majeur du cannabis. Pourtant l'environnement dans notre pays est à divers cgards différent. Tableau 1. - Le cannabis au cours du temps - 3 000 ans avant J.C., en Chine : description d'usages thérapeutiques (justifiés ou fantaisistes) ; - XIXcmesiècle : regain d'intérêt thérapeutique ; - XXèmc siècle: le déclin; - 1925 : sa prohibition ; - 1964 : découverte du delta-9-tétrahydrocannabinol, son principe actif majeur ; - 1988 : clonage du récepteur CB1 ; - 1992 : l'anandamide : l'éthanolamide de l'acide arachidonique, considéré comme le ligand endogène deCB, ; - 1993 : clonage du récepteur CB2 ; - 1995 : sélection d'un antagoniste CB1, le SR 141 716A ; - 1999 : création d'une lignée de Souris privées du récepteur CB1 Parmi les nombreuses questions que soulève la toxicomanie au cannabis nous focaliserons notre propos sur les éléments qui authentifient chez l'animal la dépendance psychique ainsi que la dépendance physique à cette drogue ; nous évoquerons les relations qui pourraient relier l'usage du cannabis à celui de l'héroïne, ainsi enfin que celles pouvant exister entre le cannabis et la schizophrénie. Dépendances psychique et physique au cannabis Les deux degrés de pharmacodépendance, psychique et physique, sont désormais expérimentalement établis chez l'animal. L'épreuve de "préférence de place conditionnée" repose sur le fait que l'animal développe une attirance ou au contraire une répulsion pour un environnement dans lequel il a préalablement éprouvé respectivement un état de plaisir (effet appétitif) ou au contraire un état d'inconfort, de désagrément, (effet aversif). Dans cette épreuve, et contre toute attente, des aversions de place sous THC ont été constatées chez le Rat [1,2] et chez la Souris [3J. Cette aversion de place étant prévenue par l'antagoniste de référence des récepteurs CB,, le SR 141716. L'existence d'effets dysphoriques pourrait expliquer ce résultat inattendu. Le choix des doses aurait pu être inadéquat, comme le suggère le fait que le recours à de faibles doses de THC a permis à Lepore et coll. [4] de mettre en évidence, chez la Souris, une préférence de place. Le fait d'administrer du THC préalablement aux administrations qui ont été ensuite pratiquées lors du conditionnement a permis de révéler une préférence de place conditionnée pour une dose faible de THC [5]. L'administration préalable pourrait avoir créé une tolérance aux effets aversifs, donnant ultérieurement libre cours aux effets appétitifs. Également chez la Souris, Martelotta et coll. [6] ont pu mettre en évidence l'auto-administration d'un agoniste CB,, le WIN 55-212-2. Le cannabis, à l'instar de toutes les drogues, accroît l'activité électrique des neurones dopaminergiques qui prennent naissance dans l'aire de îegmentum ventral du mésencéphale et qui se projettent en particulier sur le noyau accumbens ou le cortex préfrontal. Il agit ce faisant en stimulant des récepteurs CB, [7]. Cet effet du THC est partagé par d'autres agonistes directs des récepteurs CB,. L'accroissement de la libération de dopamine dans la -2- Coque ("shell") du noyau accumbens et dans le cortex préfrontal est un maillon essentiel du "système de récompense" (8,9). Ceci apparente la dopamine à l'amine du plaisir (10). Lors du sevrage du THC, l'activité électrique spontanée des neurones dopaminergiques méso-accumbiques se trouve très diminuée, ce qui correspond à une anhédonie (ll). La survenue de manifestations somatiques lors du sevrage d'une drogue, spontanée ou précipitée par un antagoniste, est le critère jusqu'à maintenant habituel qui permet de classer celle-ci parmi les "drogues dures", donnant lieu à dépendance physique. Les manifestations cliniques du sevrage chez les consommateurs de cannabis ne sont pas prononcées sans doute du fait d'une grande rémanence du THC dans l'organisme, en relation avec l'important stockage dans les lipides que permet sa grande lipophilie et la lente libération de ceux-ci. Ainsi les récepteurs CB1, ne connaissent pas d'arrêt brutal de leur stimulation. Pourtant des manifestations de sevrage ont été détectées chez des fumeurs de cannabis [12-14] ; il s'agit d'anxiété, d'irritabilité, d'anorexie, de gastralgies.... L'avènement d'un antagoniste des récepteurs CB1, le SR 141 716, a permis de lever brutalement la stimulation des récepteurs CB1, opérée par le THC, déterminant chez le rat [15-17], chez la Souris [18], ou chez le Chien [19], des manifestations de sevrage. Elles diffèrent de celles de l'anaadamide (le dérivé éthanolamide de l'acide arachidonique, qui apparaît comme un ligand endogène des récepteurs CB1), qui sont plus discrètes. A l'arrêt d'une administration chronique aux rats d'un agoniste CB1 de synthèse, (le WIN 55232-2), survient un syndrome de sevrage, componant des mouvements d'ébrouement et des frottements de la face. Il n'est alors pas besoin d'administrer un antagoniste des récepteurs CB1 (tel le SR 141 716) pour que ces manifestations apparaissent [20]. Le syndrome d'abstinence au HU210 (agoniste CB1,) précipité par un antagoniste CB1 (le SR 141 716) s'accompagne d'une libération marquée du Corticotropin Releasing Factor (CRF), et de manifestations d'anxiété à l'identique de ce qui est observé avec d'autres drogues [21]. Les auteurs en concluent que les cannabinoïdes induisent au long cours des processus neuro-adaptatifs qui peuvent engendrer une vulnérabilité à d'autres drogues. Relation entre la dépendance au cannabis et celle à d'autres drogues Le blocage des récepteurs CB1, par le SR 141 716, s'oppose à l'établissement de la préférence de place qu'aurait dû induire la cocaïne [2]. Pourtant tous les effets appétitifs de la cocaïne ne semblent pas passer par les récepteurs CB1 puisque les souris privées de ces récepteurs ("knock out CB1, = CB1 -/- deletion du gène codant ce récepteur) manifestent une préférence de place en réponse à la cocaïne [22] et continuent de s'auto-administrer celle-ci. Chez le Rat, le blocage des récepteurs CB1 par le SR 141 716 diminue la consommation de sucre et d'alcool [23, 24]. A l'opposé la stimulation de ces récepteurs accroît l'appétence pour les boissons alcoolisées (la bière chez le Rat) [25]). Les relations avec les systèmes opioïdergiques sont particulièrement importantes à considérer pour expliquer le fait que la grande majorité des toxicomanes à l'héroïne ont été préalablement des utilisateurs du cannabis. Le blocage des récepteurs CB1, inhibe le comportement de préférence de place conditionné par la morphine [2]. Tanda et coll. [9] ont constaté que le THC et l'héroïne exercent des effets similaires sur la transmission dopaminergiquc mésolimbique, via la mise en jeu de récepteurs opioïdes de type mu (ul). Ceci fait dire aux auteurs que si leurs résultats ne constituent pas la preuve -3- directe d'une relation de causalité entre la consommation de cannabis et celle d'héroïne, ils sont néanmoins en accord avec cette possibilité. Les souris dépourvues de récepteurs CB1 ne s'auto-administrent plus de morphine. En revanche, elles continuent de s'auto -administrer de la cocaïne, comme on l'a dit, ainsi que de l'amphétamine et de la nicotine (26). Chez ces mêmes souris CB1 -/-, la morphine n'induit plus de libération de dopamine dans le noyau accumbens [27] ; ses effets analgésiques persistent, une tolérance à ceux-ci peut toujours se développer à la faveur d'administrations répétées, mais l'auto-administration de morphine es! très notablement diminuée. L'intensité du syndrome d'abstinence à la morphine, précipité par la naloxone, est significativement diminuée sur 7 des 9 expressions explorées [28]. Cette importante étude souligne que l'administration au long cours d'un antagoniste CB,, mimant en cela ce qui est observé chez les souris privées de ce récepteur, pourrait être un moyen de prévention d'une dépendance aux opiacés.... Manifestant encore les relations qui existent entre les systèmes cannabinoïdergiques et les systèmes endorphinergiques, Navarre et coll. [29] ont constaté que chez le Rat rendu dépendant à la morphine l'antagoniste CB1, le SR 141 716, induisait un syndrome de sevrage. De pins, chez le rat rendu dépendant aux cannabinoïdes par des administrations répétées d'un agoniste CB1,, (le HU210), l'antagoniste préférentiel des récepteurs opioïdes, de type mu, la naloxone, induit un syndrome qui ressemble à celui du sevrage morphinique. Chez les souris CB1 -/-on n'observe pas la sensibilisation aux effets excito-locomoteurs de la morphine, qui se développe à la faveur d'administrations répétées chez les souris normales, CB1 -/- [28, 27]. Ce phénomène de sensibilisation, c'est-à-dire d'accroissement progressif de la réponse locomotrice en réponse à une même dose de drogue, est l'opposé d'une tolérance. Il s'observe avec divers agents toxicomanogènes. Gorriti et coll. [30] ont constaté que l'administration chronique de THC induisait une sensibilisation aux effets psychomoteurs de l'amphétamine chez le Rat. Dans le même esprit il a été montré que l'administration semi-chronique d'un agoniste CB1 de synthèse, (le WIN 55212-2), modifiait considérablement les effets de l'héroïne. Alors que celle-ci suscitait, chez les rats témoins, une catalepsie (équivalent du syndrome extrapyramidal humain), elle induisait au contraire chez les animaux prétraités par le WIN une hyperactivitc locomotrice et des stéréotypies [3l]. L'intrication des systèmes cannabinoïdergiques et endorphinergiques, révélée par ces expériences récentes, sans encore accéder au niveau de la certitude, donne une base mécanistique au constat que la plupart des héroïnomanes ont préalablement abusé du cannabis. Selon une métaphore empruntée à la teinturerie, le cannabis mordancerait la fibre sur laquelle l'héroïne se fixerait avec une plus grande facilité. Le THC préparerait le toxicomane à percevoir d'emblée, et sur un mode accentué, le "plaisir" qu'il éprouve lors des premiers usages d'héroïne, conduisant à leur répétition, avec l'extrême détérioration qui cri résulte. Relations entre le cannabis et la schizophrénie Les effets psychotropes du cannabis sont variés, ils empruntent pour plusieurs d'entre eux au registre des expressions psychotiques. Parmi les principaux effets caractérisés citons : une euphorie aiguë, une discordance idéique, une désorientation temporelle, de possibles hallucinations, des troubles de la coordination, des perturbations de la mémoire opérationnelle, des modifications des temps de réaction, une diminution de l'attention -4- sélective, des perturbations de la formation des concepts (32-34). Il existe donc diverses similitudes avec la scizophrénie. Le fait qu'un nombre important d'usagers du cannabis développe des manifestations psychotiques aiguës, bien identifiées dans les classifications internationales des maladies mentales (DSM-IY, CIM 10) ainsi qu'une enquête française montrant que 36 % des schizophrènes hospitalisés étaient ou avaient été dépendants au cannabis, redoublent l'intérêt de rechercher le lien pouvant exister entre cannabis et schizophrénie. A l'hypothèse qui prévalait dans les années 70, d'une psychose cannabique intrinsèque [35-40], alors que la schizophrénie demeurait au plan neurobiologique complètement mystérieuse, tend désormais à se substituer un modèle dans lequel le schizophrène manifesterait une appétence particulière pour le cannabis. Celui-ci corrigerait manifestations déficitaires de la maladie, (anhédonisme, dysthymie, cataplexie...) en relançant l'activité du système donaminergique mésocortical, l'hypoactivité de celui-ci étant la conséquence tardive (à l'adolescence et au-delà) d'un trouble neuro-développemental, dont les prémices seraient pergravidiques. La consommation de cannabis ayant aussi pour effet d'activer le système dopaminergique mésolimbique déterminerait alors des manifestations positives tie la schizophrénie, décompensant un état latent, ou aggravant les troubles, ou créant une résistance aux traitements antipsychotiques [41]. "L'ivresse cannabique" survient pour de fortes doses de THC (300-500μg/kg), soit environ dix "joints" (i.e. cigarettes associant au tabac ou bien la marijuana = "herbe", correspondant aux feuilles, tiges et sommités fleuries séchées, soit la résine de la plante = "shit"). Cela peut correspondre à un nombre moindre de "joints" quand ils sont confectionnés avec des produits "surdosés" en THC, hélas désormais disponibles. Cette "ivresse" est en fait une expérience psychotique transitoire, comportant une dissociation de la pensée, des convictions délirantes, des illusions et hallucinations. En fonction des manifestations prevalences, des formes où domine l'excitation, des formes délirantes, des formes pseudo-autistiques ont été distinguées [42]. Plusieurs études montrent sans ambiguïté que l'abus du cannabis précède l'apparition de la schizophrénie [41-46]. Dans une étude longitudinale de 45 000 conscrits suédois, Andreasson et coll. [47] ont montré que le risque de développer une schizophrénie était de cinquante fois plus élevé chez les sujets qui avaient consommé du cannabis. Il a été établi très récemment en outre une relation entre l'usage de drogues, dont le cannabis, qui prédomine dans le sexe masculin et le mauvais pronostic de la schizophrénie [48]. Il existe quelques substrats neurobiologiques à ces interrelations morbides, en fonction des interactions mises en évidence entre la transmission dopaminergique (pierre angulaire du processus psychotique) et les systèmes endocannabinoïdergiques/anandamidergiques [49, 50]. On notera encore qu'il existe chez les schizophrènes une anomalie du métabolisme de l'acide arachidonique, précurseur de l'anandamide [51] et que le taux de ce dernier est anormalement élevé dans le liquide céphalo-rachidien des schizophrènes [52]. CONCLUSION L'adolescence et les quelques années qui la suivent constituent une étape très sensible, critique, de la vie de tout Homme. Elle comporte des recherches, des incertitudes, des prises de repères, il s'y contracte des habitudes ; c'est le temps fort de la formation aux activités manuelles et intellectuelles, de la culture, des examens, des concours ; c'est l'heure où se structure, s'affirme la personnalité, où s'effectuent des choix déterminants, où le besoin de transgression des interdits ou simplement de désobéissance est fort, où l'esprit grégaire se développe, où l'adhésion aux modes s'opère, où la sexualité se découvre et s'assouvit souvent, dans le contexte des MST : c'est la période où hélas, chez un à deux pour cent des individus, se démasque la schizophrénie ; c'est aussi celui des ravages opérés par les accidents de la circulation, des crises existentielles, des suicides, de la découverte et parfois de la submersion dans les drogues ; bref, c'est la période où les espoirs le disputent aux dangers. Dans cette tranche d'âge la propension à expérimenter le cannabis a littéralement explosé au cours des vingt ans écoulés. Les pouvoirs publies n'ont pas su empêcher sa diffusion et les interrogations concernant sa dangerosité sont évidemment d'une actualité brûlante. Elles ont suscité diverses études visant à y répondre. Nous avons analysé ici les données qui en sont issues pour répondre aux quelques questions que nous souhaitions considérer. Avec des particularités de diverses natures, il apparaît ainsi que le cannabis : - suscite une dépendance psychique, ce qui est une caractéristique commune à toutes les drogues. Présente chez l'homme, elle n'a pas été très facile à révéler chez le rongeur, en raison du choix des doses et d'effets aversifs qui ne s'effacent qu'après plusieurs administrations ; - suscite un,; dépendance physique, qui a été jusqu'alors le critère servant à caractériser les "drogues dures". Elle est discrète en raison de la longue rémanence du THC dans l'organisme, assurée par son stockage dans les éléments lipidiques. Elle est prouvée chez l'animal en la précipitant par l'administration d'un antagoniste des récepteurs CB, ; - entretient avec les systèmes endorphiniques (opioïdes endogènes) des relations étroites qui incitent à croire que le passage du cannabis à l'héroïne n'est pas fortuit ; ce premier constituant une voie d'accès privilégiée à cette dernière ; - apparaît en embuscade sur le terrain prémorbide de la schizophrénie, objet d'une appétence redoublée, il donne alors lieu à un usage répété qui précipiterait sa décompensation de la maladie. Ces données, jointes à d'autres non examinées ici, loin de relativiser la psychotoxicité du cannabis le parent de tous les attributs d'une drogue. Elles soulignent qu'il existe désormais des arguments reliant son usage à celui de l'héroïne ; tandis que d'autres montrent les connivences qui relient cet usage à la schizophrénie. Ces données sont en contradiction flagrante avec le discours lénifiant que tiennent ceux qui, pour s'attacher la considération de la jeunesse ("jeunisme"), prennent le risque en prônant la libre circulation du cannabis de mettre davantage cette jeunesse en danger. BIBLIOGRAPHIE [1] CHEER J.F., kendael D.A., marsden C.A. - Cannabinoid receptors and reward in thé rat : a conditioned place preference study. Psychophannacol., 2000, 151, 25-30. [2] CHAPERON F., soubrié P., puech A.J., thiebot M.H. - Involvement of centra! cannabincid CB, receptor in thé establishment of place conditioning in rats. Psychopharmacol, 1998, l35, 324-332. [3] HUTCHESON D.M., TZAVARA E.T., SMADJA C., VALJEANT E., ROSUES B.P., HANOUNE J., maldonado R. - Behavioral and biochemical evidence for signs of abstinence in mice chronically treated with dclta-9-tetruhydrocannabinol. Brit. J. Pharmacol., 1998, 125, 1567-1577. -6 - [4]. LEPORE M.., VOREL S.R., LOWINSON J., GARDNER E.L. - Conditionned place preference induced by delta-9-tetrahydrocannabinol = comparison with cocaïne, morphine and food reward. Life Sci., 1995, 56, 2073-2080 [5] valjeant II., maldonaco R. - A behavioral model lu reveai place preference to cciia-9-tetrahydrocannabinol in mice. Psychopharmacol., 2000, 147, 436-438. [6] martellota M.C., Cossu G., fattore L., cessa G.L., fratta W. - Self administration of the cannabinoicl receptor agonist WIN 55,212-21 in drug naive mice. Neuroscience., 1998, 55, 327-330. [7] FRENCH E.D. - Delta-9-tetrahydrocannabinol excites rat ventral tegmental area dopaminergic neurons through activation of cannabinoid CB, but not opioid receptor. Neurosci. Lett., 1997, 226, 159-162. [8] chen J., parades W., Li J., smith D., lowtnson J., gardner E.L. - Delta-9-tetrahydrocannabinol produces i:a!oxone blockade enhancement of presynaptic basal dopamine efflux in nucleus accwnbens of conscious, freely-moving rats, as measured by intracerebral microdialysis. Psychopharmacol., 1990, 702, 156-162. [9] TANDA G., PONTIERI F.E., Dl chiara G. - Cannabinoid and heroin activation of mesolimbic dopaminergic transmission by a common ul opioid receptor mechanism. Science, 1997, 276, 2048-2050. [10] COSTENTIN ]. - Dopamine, aminé du plaisir. In L'anhédonie. Ed. M.-L. Bourgeois Masson. ed. 1999,97-116. [II] DIANA M., melis M., muntoni A.L., GESSA G.L. - Mesolimbic dopaminergic decline after cannabinoid withdrawal. Proc. Natl. Acad. Sci., 1998, 95, 10269-10273. [12] haney M., ward A.S., comer S.D., foltin R.W., fischman M.W. - Abstinence symptoms following smoked marijuana in humans. Psychopharmacol., 1999,141, 395-404. [13] KOURI E.M., POPE H.G., LUKAS S.E. - Changes in aggressive behavior during withdrawal from long term marijuana Psychopharmacol., 1999, 143, 302-308. [14] ckowley T.J., macdonald M.J., withmore E.A., mikulich S.K. - Cannabis dependence, withdrawal and reinforcing effects among adolescent with conduct symptoms and substance use disorders. Drug Alcohol Depend., 1998, 50, 27-37. [15] TSOU PATRICK S., WALKER J.M.- Physical withdrawal in rats tolerant to delta-9-tetrahydrocannabinol precipitated by a cannabinoid receptor antagonist Eur. J. Pharmacol., 1995, 250, R13-R15. [16] ACETO M.D., SCATES S.M., lowe J.A., MARTIN B.R. - Dependence studies on delta 9 tetra hydrocannabinol / Studies on precipitated and abrupt withdrawal. J. Pharmacol. Exp. Ther., 1996,275, 1290-1295. [17] BEARDSLEY P.M., MARTIN B.R. - Effects of the CB, receptor antagonist SR 141 716A, after delta-9-tetrahydrocannabinol withdrawal. Eur. J. Pharmacol., 2000, 357, 47-53. [18] COOK S.A., LOWE J.A., MARTIN B.R. - CB, receptor antagonist precipitates withdrawal in mice chronically exposed to delta-9-tetrahydrocannabinol. J. Pharmacol. Exp. Ther., 1998, 255, 1150-1156. [19] lichtman A.M., wiley J.L., lavecchia K.L., neviaser ST., arthur D.B., martin B.R. - Effects of SR 141716 A after acute or chronic cannabinoid administration in drogs. Eur. J. Pharmacol., 1998, 357, 139-148. [20] ACETO M.D., SCATES S.M., MARTIN B.R. - Spontaneous and precipitated withdrawal with a synthetic cannabinoid WIN 55212-2. European J. Pharmacol., 2001, 416, 75-81. -7- [21] RODRIGUEZ DE FONSECA F. , CARRERA M..R.A., NAVARRO M. KOOB G.B., WEISS F. - Activation of corticotrophin-releasing factor in the limbic system during cannabinoid withdrawal. Science, 1997, 276, 2050-2054 [22] MART1N M., ledent C.. parmentier M., maldonado R., valverde 0. - Cocaine, but not morphine, induces conditioned place preference and sensitization to locomotor responses in CB, knock-out mice. Europ. J. Pharmacoi, 2000, 12, 4038-4046. [23] arnone M., maruani J., chaperon F., thiebot M.H., poncelet M., soubrié P., lefur G. - Selective inhibition of sucrose and ethanol intake by SR 141 1716, an antagonist of central cannabinoid (CB1) receptors. Psychopharmacoi, 1997, 132, 104-106. [24] gallatte J.E., saharov T., mallet P.E., mcgregor J.S. - Increased motivation for beer in rats following administration of a cannabinoid CB, receptor agonist. European J. Pharmacoi., 1999,370,233-240. [25] freedland S.J., siiarpe A.L., samson H.H., porrino LJ. - Effects of SR 141 716A on ethanol and sucrose self administration. Alcohol Clin. Exp. Res., 2001, 25, [2], 277-282. [26] Cossu G., ledent C., fattore L., imperato A.K., bôhme G.A., parmentier M., fratta W. - Cannabinoid CB1 receptor knockout mice fail to self-administer morphine but not other drugs of abuse. Behavioural Brain Res., 2001, 118, [1], 61-65. [27] mascia M.S., obinu M.C., ledent C., parmentier M., bôhme G.A., imperato A., FRATTA W. - Lack of morphine-induced dopamine release in the nucleus accumbens of cannabinoid CB (1) receptor knock out mice. European J. Pharmacoi, 1999, 383, R1-R2. [28] ledent C., valverde 0., Cossu G., petitet F., aubert J.F., beslot F. bôhme G.A., imperato A., pedrazzino T., roques B.P., vassart G., fratta W., parmentier M. -Unresponsiveness to cannabinoids and reduced addictive effects of opiates in CBj receptor knockout mice. Science, 1999, 283, 401-404. [29] NAVARRO M. et coll. - CB1 Cannabinoid receptor antagonist-induced opiate withdrawal in morphine dependent rats. NeuroReport, 1998, 9, 3397-3402. [30] gorriti M.A., rodriguez DE fonseca F., navarro M., palomo T. - Chronic delta-9-letrahydrocannabinol ireatrnent induces sensitization to the psychomotor effects of amphetamine in rats. European J. Pharmacoi., 1999, 365, 133-142. [31] pontieri F.E., monnazzi P., scontrini A., buttarelli F.R. - Behavioral sensitization to heroin by cannabinoid prc-treatment in the rat. European J. Pharmacoi, 2001, 421, R1-R3. [32] ABOOD M.E., MARTIN B.R. - Neurobiology of marijuana use. Trends in Pharmacological. Science, 1992, 13, 202-207. [33] SKOSNIK P.O., spatz-glenn L., PARK S. - Cannabis use is associated with schizotypy and attentional desinhibition. Schizophrenia Res., 2001, 48, 83-92. [34] FLETCHER J.P. et coll. - Cognitive correlates of long term cannabis use in Costa Rican men. Arch. Gen. Psych., 1996, 53, [11], 1051-1057. [35] CHOPRA G.S., SMITH J.W. - Psychotic reactions following cannabis use in east indians. Arch. Gen. Psych., 1974,30, 24-27. [36] BEAUBRUN M.H., KNIGHT F. - Psychiatric assessment of 30 chronic users of cannabis and 30 matched controls. Am. J. Psychiat., 1973, 730, 309-311. [37]BOWMAN M., PlHL R.O. - Psychological effects of chronic heavy use. A controlled study, of intellectual functioning in chronic users of high potency cannabis. Psychopharm., 1972, 29, 159-170. [38] hai.ikas J.A., goodwin D.W., GUZE S.B. - Marijuana use and psychiatric illness. Arch. Gen. pat., 1972. 27. 162-165. -8- [39] NEGRETE J.C. - Psychological adverse effects of cannabis smoking : a tentative classification. Can. Med. Assess. J., 1973, 108, 195-202 [40] SPENCER D.J. - Cannabis induced psychosis. Brit. J. Addict, 1970, 65, 369-372 [41] LlNSZEN D.H., DlN'JHMANS P.M.. LHNION M.E. - Cannabis abuse and thé course of recent-onset schizophrenic disorders. Arch. Gen. Psych., 1994, 57, [4], 273-279. [42] Expertise collective - Cannabis : Quels effets sur le comportement et la santé - Synthèse et recommandations. Ed. INSERM, 2001. [43] breakhy W.R., goodell H., lorenz P.C., Me. hugh P.R. - Hallucinogenic drugs as précipitants of schizophrenia. Psycho!. Med., 1974, 4, 255-261. [44] CASPARI D. - Cannabis and schizophrenia : results of a follow-up study. Arch. Psychiatry Clin. Neurosci., 1999, 249, 45-49. [45] verdoux H., mury M., besancon G., BOURGEOIS M. - Étude comparative des conduites loxicomaniaques dans les troubles bipolaires, schizophréniques et schizoaffectifs. L'Encéphale, 1996, XXII, 95-101. [46] baigent M., HOLME G., hafnhr R.J. - Self reports of the interaction between substance abuse and schizophrenia. Aust NZJ. Psychiat., 1995, 29, 69-74. [47] andreasson S., allebeck P., engstrom A., rydberg U. - Cannabis and schizophrenia. A longitudinal study of Swedish conscripts. Lancet, 1987, 1483-1485. [48] CANTOR-GRAAE E., nordstrom L.G., McNEIL T.F. - Substance abuse in schizophrenia : a review of the literature and a study of correlates in Sweden. Schizophrenia Res., 2001, 48, 69-82. [49] giuffrida A., parsons E.H., kerr T.M., rodriguez DE fonseca F., navarro M., PlOMELLI D. - Dopamine activation of endogenous cannabinoid signalling in dorsal striatum. Nature Neurosci., 1999,2, [4], 358-363. [50] tayi.or D.A., sitaram B.R., ELLIOT-BAKER S. - Effect of delta-9-tetrahydrocannabinol on the release of dopamine in the coq^us striatum of the rat. In Marijuana : an international research report Australian Government Publishing Service, Camberra Eds. Chcsher G, Cons roe P., Musty T., 1988. [51] yao J.K., VAN KAMMEN O.P., gurklis J.A. - Abnormal incorporation of arachidonic acid into platelets of drug-free patients with schizophrenia. Psych. Res., 1996, 60, 11-21. [52] eevveke P.M., giuffrida A., wurster U., emrich H.M., riomelli D. - Elevated endogenous cannabinoids in schizophrenia. NeuroReport, 1999. -9- Annexe IV : Les nouveaux risques de la substitution L'utilisation massive de Subutex, et à moindre escient de certains sulfates de morphine destinés à une absorption per os, nécessite à plus d'un titre que soient prises des précautions dans les conditions de prescription, de délivrance et de suivi des traitements. On sait depuis les premières études, mais le problème semble s'amplifier, que le Subutex et les sulfates de morphine constituent des ingrédients centraux de polyconsommations d'usagers démunis et qu'il en résulte de nombreux dangers sur le plan sanitaire. En tout premier lieu, des interrogations subsistent sur l'adaptation de la forme galénique choisie à tous les usagers qui en consomment. En effet, le Subutex destiné à une absorption sublinguale, est très fréquemment utilisé par voie parentérale. Les estimations de départ faisaient état d'un détournement vers la voie injectable de 12 à 20%174 environ. Les données les plus récentes ne laissent pas d'inquiéter et d'appeler des réponses de la part des pouvoirs publics. Ainsi, l'enquête « PES » avance une part de 44,6% d'injecteurs quotidiens du Subutex parmi ses consommateurs, 78,7% admettant l'injecter « de temps en temps »175. Or il apparaît176 que le Subutex cause une dégradation très rapide du réseau veineux lorsqu'il est injecté, du fait des additifs à la buprénorphine dans la forme galénique disponible. De même que certains sulfates de morphine, il peut aussi être à l'origine de chocs anaphylactiques létaux. Accessible parce que peu coûteux et légal, le Subutex® devient localement le soutien essentiel de polytoxicomanies des consommateurs les plus précaires177. L'usage avéré de Subutex® par voie intraveineuse nécessite donc en second lieu de mieux prendre en compte sa place dans la recomposition de certains comportements d'usage. Une étude à paraître a permis d'établir des relations statistiques selon lesquelles l'injection de Subutex® (47% des personnes interrogées lors de cette étude) est associée à des marqueurs de risques spécifiques : revenus autres que ceux du travail, absence d'activité professionnelle, précarité de l'habitat, sérologie positive au VIH ou pour le VHC, précocité de la première injection, utilisation d'un autre produit en injection, usage de cannabis, de cocaïne, de crack, de Skénan®178. 174[MILDT, 1999, p. 81]. 175 [Lert, Emmanuelli, Valenciano, 1999], p. 19. 176 [Bouhnik, Jacob, Maillard, Touzé, 1999]. 177 Plusieurs études rapportent d'ailleurs des primo-injections au Subutex®, pour lequel le risque de surdose est modéré. 178 [Boissonnas, 2000]. Injecté pour potentialiser les effets de bien-être - faibles par la voie sublinguale - mais surtout fréquemment associé à d'autres produits (hypnotiques, dérivés de morphine, codéines et benzodiazépines), le Subutex® devient très dangereux. Ces injections impliquent une aggravation des risques pouvant causer la mort de Finjecteur ; la saturation des récepteurs centraux aux opiacés et la potentialisation des effets par l'association à certaines molécules sont à l'origine de sévères détresses respiratoires179. Pur ou associé à d'autres médicaments détournés, le Subutex est en outre utilisé pour gérer la « descente » de crack ou de cocaïne. Il permet d'amoindrir les effets secondaires consécutifs à l'absorption de ces drogues. Or ces psychostimulants peuvent donner lieu à des effets dévastateurs par rapport à l'héroïne : déstructuration des comportements sociaux et, ponctuellement, déchaînements de violence. A la dépendance au Subutex® (qui selon des témoignages d'injecteurs engendre des états de manque très pénibles180) s'ajoute de surcroît le caractère très compulsif de la consommation de crack ou de cocaïne. La répétition du geste d'injection à intervalles de temps rapprochés, dans des conditions sanitaires souvent déplorables, augmente les risques de partage et de contamination par le VIH et les virus des hépatites. Fréquemment fumés ou prisés, ces produits peuvent aussi accroître les risques de contamination par les hépatites quand le matériel d'absorption est partagé (et c'est souvent le cas dans les contextes de consommation de rue qui les caractérisent181). Toutes ces remarques pourraient se révéler n'être le reflet que de situations locales et ponctuelles si on en connaissait l'ampleur réelle. Or le dispositif de soins est conçu historiquement autour de la dépendance aux opiacés et ne permet pas de relater avec certitude la fréquence de ces pratiques. Les informations statistiques sur les consommations de Subutex®, la vente de seringues et les usages de cocaïne recèlent en revanche des hypothèses qui appellent des réponses scientifiquement étayées et rapides . La gravité des risques sociaux (marginalisation et précarisation), institutionnels (répression), et bien entendu sanitaires, que les consommations en question impliquent, est en effet susceptible de fragiliser une partie des dispositifs d'intervention médico-sociale, en particulier l'intervention de première ligne. En dernier lieu, et probablement en étroite liaison avec les phénomènes décrits ci-dessus183, le Subutex connaît une diffusion probablement plus large que ce qu'indiquent les statistiques de ventes fondées sur des estimations de doses/usager/jour184. Comme évoqué précédemment, il existe un marché noir du Subutex, notamment en région parisienne, alimenté par les prescriptions multiples ou falsifiées185, le troc de substances ou leur revente, le non-respect des posologies indiquées. L'usage incontrôlé qui en résulte nécessite que soient étudiées les solutions thérapeutiques à même de remédier à la dépendance à ce produit. 179 (Storogenko, 1999) 180 [Bouhnik, Jacob, Maillard, Touzé, 1999]. 181 Voir [Lert, Emmanuelli, Valenciano, 1999], p. 23. 182 La croissance des ventes de Subutex® est étroitement corrélée avec l'augmentation de l'utilisation de seringues - en certains endroits de kits d'injection - et contemporaine de l'augmentation très rapide des ILS pour usage de cocaïne. 183 Voir [Emmanuelli, 2000], tome 1, p. 30. 184[OFDT, 1999], p. 108. 185 Un dispositif de surveillance est expérimenté pour mieux connaître l'ampleur du problème. Voir [Lapeyre- Mestreef a/H, 2000]. Au c_ur des risques liés aux nouvelles consommations, la diffusion de Subutex (et dans une moindre mesure les sulfates de morphine en cachets) nécessite que soient envisagés les moyens de contrôle de ses conditions d'utilisation, et de réduction des dangers que peut impliquer sa galénique. A défaut de quoi mésusages et détournements pourraient remettre en cause l'ensemble du dispositif de réduction des risques et notamment de la substitution. Ce contrôle ne saurait, sauf à redéfinir les fondements de la réduction des risques, être assumé par la voie répressive186 ; il incombe aux pouvoirs publics de prendre en considération le fait qu'une partie des usagers sous traitement de substitution poursuivent des pratiques d'injection plus ou moins fréquentes. 186 Sauf à considérer le Subutex® comme un stupéfiant. Les témoignages d'usagers appréhendés par les forces de l'ordre et interrogés pour avoir transporté du Subutex® sans disposer de prescription motivent d'ailleurs une réflexion n'engageant pas seulement les acteurs de santé publique. Voir (Bouhnik, Jacob, Maillard, Touzé, 1999). La délivrance du Subutex® a été fractionnée en durées limitées à sept jours. Annexe V : Bull. Acad. Natle Méd., 2002,186, n° 2,... - ..., séance du 19 février 2002 Accidentologie et drogues illicites Road accidents and illicit drugs Patrick MURA* RÉSUMÉ Si, depuis 1958, des efforts très importants ont été faits pour lutter contre la conduite sous l'emprise de l'alcool, de très nombreuses études et observations ont montré que le cannabis, la cocaïne, les amphétamines et les opiacés étaient, eux aussi, souvent impliqués dans la survenue des accidents de la route. Parmi les milieux biologiques accessibles, la salive représente le milieu le plus adapté pour mettre en évidence un usage récent de ces substances tandis que le sang est incontestablement le seul milieu biologique utilisable pour la confirmation et la quantification. Des méthodes analytiques fiables sont désormais disponibles. Tous les éléments sont donc réunis pour mettre en place des actions de prévention dont des dépistages de conduite sous influence. Nos voisins de la Sarre ont donné l'exemple en effectuant des contrôles très fréquents, et cela s'est traduit par une baisse considérable du nombre de morts et de blessés sur les routes de cette région. mots-clés : troubles liés substance toxique. accident circulation. SUMMARY Since 1958, many efforts have been made to fight against driving under the influence of alcohol. As a result of numerous studies, it appears that illicit drugs such as cannabis, cocaine, amphetamines and opiates are often involved in traffic accidents. Among biological media easily accessible, saliva is considered as the most suitable medium for revealing a recent use whereas blood is undoubtedly the only medium which can be used for confirmation and quantification. Reliable analytical methods are now available. So, all elements are gathered for undertaking a real prevention program, including drugs of abuse testing in drivers. In Germany, Sarland has set us an example with very frequent roadside drug testing, and such an action conduced to a very important decrease in the number of fatal and corporal road accidents in this country. key-words (Index Medicus) : substance-related disorders. accidents, traffic. INTRODUCTION La mise en évidence des effets néfastes de l'alcool sur la sécurité routière a conduit, par ordonnance du 15 décembre 1958, à un texte législatif réprimant la conduite d'un véhicule sous l'emprise d'un état alcoolique. La loi du 18 mai 1965 a permis le dépistage dans l'air expiré et, en cas de positivité, un prélèvement sanguin afin d'évaluer le degré d'imprégnation alcoolique. Le 9 juillet 1970, une loi fixait le seuil maximum légal à 0,80 g/1, avec délit à partir de 1,2 g/1. La loi du 12 juillet 1978 autorisait les contrôles préventifs sur décision du Procureur de la République. Un seuil légal d'alcool dans l'air expiré a été défini par la loi du 8 décembre 1983. En 1994, un double seuil est établi : contravention entre 0,70 g/1 et 0,80 g/1, délit au-delà [1]. Depuis 1995, ce seuil légal est de 0,5 g/l [2]. * Laboratoire de Biochimie et Toxicologie - Centre Hospitalier Universitaire - BP 577 - 86021 Poitiers cedex. Tirés-à-part : Professeur Patrick MURA, à l'adresse ci-dessus. Article reçu le 4 janvier 2002, accepté le 14 janvier 2002. Bull. Acad. NatleMéd., 2002,186, n° 2,... -..., séance du 19 février 2002 Durant ces quatre dernières décennies, l'alcoolisation des conducteurs a ainsi été la cible prioritaire des pouvoirs publics dans un but de plus grande sécurité routière. Ce faisant, un nouveau problème de société est apparu : une augmentation de plus en plus importante de la consommation de stupéfiants. Si le nombre des usagers d'héroïne semble être en diminution ces dernières années grâce à la mise en place des traitements de substitution, il n'en va pas de même pour la cocaïne, les amphétamines avec l'ecstasy et surtout pour le cannabis, notamment chez tes jeunes. Une enquête récente a en effet montré que la proportion de jeunes de 18 ans avouant consommer du cannabis plus de 10 fois par an avait évolué considérablement de 1993 à 1999, passant de 3 % à 14 % chez les filles et de 11 à 29 % chez les garçons [3]. Tous les stupéfiants précités sont des produits psychotropes. En 1996, selon les spécialistes de la circulation routière, les excès de vitesse et la conduite sous influence de produits psychotropes constituaient les deux principales causes des accidents de la route [4, 5]. Il n'est donc pas surprenant que de nombreux pays aient mis en place une législation sanctionnant l'usage de stupéfiants par les conducteurs [6]. Une directive (n° 91/439/CEE) relative au permis de conduire, arrêtée le 29 juillet 1991 par le Conseil des Communautés Européennes, est entrée en vigueur le 1er juillet 1996, s'imposant aux pays membres de l'Union Européenne à compter de cette date. Elle énonçait que « le permis de conduire ne doit être ni délivré ni renouvelé à tout candidat ou conducteur en état de dépendance vis-à-vis de substances à action psychotrope ou qui, sans être dépendant, en abuse régulièrement.... ou qui consomme régulièrement des substances psychotropes, quelle qu'en soit la forme, susceptibles de compromettre son aptitude à conduire sans danger, si la quantité absorbée est telle qu'elle exerce une influence néfaste sur la conduite. Il en est de même pour tout autre médicament ou association de médicaments qui exerce une influence sur l'aptitude à conduire ...». En France, il a fallu attendre juin 1999 pour qu'un texte de loi soit promulgué en ce sens [7]. Il précise qu'il est ajouté au titre Ier du code de la route (partie législative) un article L. 3-1 ainsi rédigé : « Les officiers ou agents de police judiciaire font procéder sur tout conducteur d'un véhicule impliqué dans un accident mortel de la circulation à des épreuves de dépistage et, lorsqu'elles se révèlent positives ou sont impossibles, ou lorsque le conducteur refuse de les subir, à des analyses et examens médicaux, cliniques et biologiques, en vue d'établir s'il conduisait sous l'influence de substances ou plantes classées comme stupéfiants... Un décret en Conseil d'État détermine les conditions d'application du présent article ». Le décret du 27 août 2001 [8] et l'arrêté du 5 septembre 2001 [9] précisent que le dépistage sera réalisé dans les urines tandis que la confirmation sera effectuée sur le sang. Par ailleurs, trois éléments nouveaux sont ajoutés : - ne sont concernés que les accidents immédiatement mortels ; - en cas de présence de stupéfiants, une recherche de médicaments psycho-actifs sera entreprise ; - une copie du dossier incluant les résultats biologiques sera transmise à l'Observatoire Français des Drogues et Toxicomanies aux fins de réaliser une étude épidémiologique. Comme l'indique une circulaire du ministère de la justice en date du 2l septembre 2001, cette étude épidémiologique, dont les résultats définitifs seront communiqués en 2004, a pour objectif principal de « déterminer quel est le rôle de la consommation de stupéfiants dans la commission des accidents de circulation». Cette circulaire précise qu'en l'état actuel des textes législatifs, « ces dispositions n'ont aucune incidence juridique sur la responsabilité pénale d'un conducteur auteur d'un homicide volontaire ». Bull. Acad. Natle Méd., 2002,186, n° 2,... - .... séance du 19 février 2002 Les effets délétères d'une consommation récente de stupéfiants sur l'aptitude à conduire un véhicule ne sont-ils pas démontrés ? Existe t-il des raisons scientifiques pour privilégier ce dépistage dans le cas des accidents mortels ? Disposons-nous aujourd'hui des moyens techniques nécessaires pour entreprendre des dépistages systématiques chez les conducteurs, comme cela se fait pour l'alcool ? Quels sont les résultats obtenus chez nos voisins européens ayant mis en place de tels dépistages systématiques ? LES PRODUITS ET LEUR ÉVOLUTION Le cannabis, les opiacés, les amphétamines et la cocaïne sont encore actuellement les principaux produits psychotropes pouvant être disponibles en France sur le marché clandestin. Cependant, depuis quelques années, d'autres produits apparaissent comme le Khat (arbuste cultivé en Ethiopie et au Yemen), le Kava (plante très consommée en Nouvelle-Calédonie et responsable de nombreux accidents de la circulation), l'Iboga (arbuste africain dont les racines ont des propriétés hallucinogènes), le yagé (boisson hallucinogène provenant d'Amazonie), etc. La consommation de datura stramonium, semble revenir à la mode pour les fortes illusions sensorielles qu'elle provoque et il en va de même avec les champignons hallucinogènes, comme les psilocybes. Le cannabis Le principal principe psycho-actif est le delta-9 tétrahydrocannabinol (THC). Afin de savoir s'il y avait eu ces dernières années une évolution dans les concentrations en THC dans les produits à base de cannabis retrouvés en France, une étude récente [10] a regroupé les résultats d'analyses obtenus depuis 1993 sur des produits de saisies effectuées en France par les services des douanes, de la police nationale, de la gendarmerie nationale et de divers laboratoires d'expertises toxicologiques. Cette étude révèle que depuis 1996, bien que d'une façon générale les teneurs en principe actif observées dans la majorité des échantillons n'aient pas beaucoup évolué (environ 8 % pour l'herbe et 10 % pour la résine), sont apparus des échantillons à base de cannabis très fortement concentrés en THC. Au cours de l'année 2000, 3 % des échantillons d'herbe et 18 % des échantillons de résine analysés contenaient plus de 15 % de THC. De façon exceptionnelle, des échantillons contenaient jusqu'à 30 % de THC. Ces fortes teneurs sont principalement liées à l'arrivée de nouveaux produits sur le marché français : la « skunk » (variété de fleurs de cannabis originaire des Etats-Unis et des Pays-Bas), la « super-skunk » (version améliorée de skunk) et le « pollen » (étamines des plants mâles). En effet, grâce à des techniques horticoles très avancées (cultures sous serres, hydroponiques, avec des conditions de luminosité et de température optimales), les Néerlandais réussissent désormais à obtenir des variétés à très forte teneur en THC [11]. Amphétamines Parmi les nombreuses molécules appartenant à cette famille, F ecstasy en constitue le symbole et sa consommation chez les jeunes est en augmentation constante, notamment avec le développement des rave-parties. Si le principe actif contenu dans les comprimés d'ecstasy est théoriquement le méthylène-dioxy-3,4-méthamphétamine ou MDMA, ce n'est pas toujours le cas dans la réalité. En effet, sous l'appellation ecstasy, sont retrouvés des comprimés aux compositions très diverses (amphétamine ou autres dérivés amphétaminiques, associés ou non à d'autres produits, placebos, etc.). Opiacés et cocaïne Bull. Acad. NatleMéd.. 2002,186. n° 2,... -.... séance du 19 février 2002 A l'inverse du cannabis et des amphétamines, les opiacés illicites sont de moins en moins consommés en France. L'héroïne la plus consommée en France est l'héroïne brune ou «Brown sugar», dans laquelle le principe actif, la diacétylmorphine, est mélangé avec d'autres produits comme de la caféine, aspirine, paracetamol. Les teneurs en principe actif sont généralement comprises entre 5 et 13 %. La consommation de cocaïne reste marginale en France. En revanche, il semblerait que l'utilisation du « crack » (cocaïne base) soit en augmentation depuis quelques années [12]. Ses effets sont redoutables et dans certaines régions du monde comme la Guadeloupe ou la Martinique, le crack est la cause de très nombreux accidents de la voie publique. POTENTIEL ACCIDENTOGÈNE D'UNE CONSOMMATION DE STUPÉFIANTS La mise en évidence des risques d'accidents liés à un usage récent de stupéfiants repose sur différentes observations : les mécanismes d'action des principes actifs de ces substances et leurs effets sur le comportement des consommateurs, les données apportées par des études sur simulateur de conduite, les tests de conduite en situation réelle, ainsi que les résultats d'études épidémiologiques. Effets sur le comportement des consommateurs Les effets du cannabis, lors d'un usage occasionnel, sont principalement [13] : - des modifications de la perception du temps et des distances ; - des perturbations de la mémoire à court terme ; - des perturbations sensorielles : perception exacerbée des sons et surtout des modifications de la vision associées à une mydriase, une diplopie et un nystagmus ; - des troubles thymiques et dissociatifs avec euphorie, anxiété, agressivité, dépersonnalisation avec disparition des inhibitions et indifférence vis-à-vis de l'environnement, une conscience accrue de soi ; - des hallucinations et délires exceptionnels mais possibles, notamment avec les nouveaux produits très concentrés en cannabinoïdes ; - une diminution des performances intellectuelles (baisse de la productivité et de la concentration avec une pensée fragmentaire), motrices et cognitives. On peut noter aussi une décompensation psychotique se traduisant par un syndrome délirant organique dont le thème le plus fréquent est la persécution et associe anxiété, tremblements, incoordination motrice. Lors d'un usage fréquent et prolongé de cannabis, des crises d'angoisse aiguë peuvent survenir au cours desquelles un véritable état de panique s'installe. Par ailleurs, un syndrome amotivationnel est classiquement observé chez les usagers chroniques. Les effets des morphiniques, incompatibles avec la conduite automobile, consistent en une diminution importante voire majeure de l'attention, des réflexes, de la conscience du danger et des obstacles [14]. Les effets de la cocaïne et des amphétamines sur l'aptitude à conduire un véhicule sont très voisins et sont liés à la stimulation du système nerveux central [12]. L'hyperactivité motrice et l'euphorie sont constantes, conduisant à des comportements irrationnels et notamment à des prises de risques accrues. Avec les amphétamines, la mydriase se traduit par une plus grande sensibilité aux éblouissements dus au soleil ou à l'éclairage des voitures ainsi qu'à une acuité visuelle diminuée. Tests sur simulateurs de conduite Bull. Acad. Nolle Méd.. 2002,186, n° 2,... - ..., séance du 19 février2002 De très nombreuses études ont montré que l'utilisation de tels tests confirmait les altérations significatives de la capacité à conduire un véhicule observables chez les sujets ayant consommé des produits psychotropes. Barnett et coll. [15] ont montré, chez des sujets ayant fumé une cigarette de cannabis, que les effets négatifs (diminution du temps de réponse, sorties de route) du cannabis sur les performances de conduite étaient à leur maximum 15 min après consommation et qu'ils étaient observables pendant plusieurs heures (2 à 7 selon les paramètres étudiés). Par ailleurs ces auteurs ont montré, chez des sujets ayant fumé des cigarettes contenant différentes concentrations en principe actif, l'existence d'une relation significative entre le nombre d'erreurs de conduite et la concentration en principe actif, dans le sang. Tests en situation réelle De tels tests, qu'ils soient effectués en circuit ouvert ou fermé, sont irréalisables en France. Les seules expériences françaises ont été effectuées par des journalistes, sous contrôle de scientifiques et de médecins anonymes [16, 17]. Après avoir consommé du cannabis et/ou de l'ecstasy, leurs aptitudes à conduire un véhicule ont été évaluées sur circuit fermé. Les principaux résultats ont été les suivants : - des perturbations très notables de la vision, surtout de nuit : temps de récupération après éblouissement augmenté, mauvaise appréciation des distances, erreurs de vision des couleurs ; - des sorties de trajectoire en virage ; - des temps de réaction augmentés avec des distances de freinage très allongées (plus 5 à 12 m à 80 km/h) ; - des prises de risques importantes, surtout après consommation d'ecstasy. Études épidémiologiques réalisées en France Les études réalisées en France ces dernières années [18-22] ont montré que certaines substances psychoactives illicites étaient fréquemment retrouvées dans les urines et/ou le sang de conducteurs impliqués dans un accident de la voie publique. Toutes ces études ont révélé que le cannabis était la drogue illicite la plus fréquemment détectée. Il s'agissait cependant d'études à caractère simplement descriptif. En effet, l'absence de population témoin et/ou l'utilisation de l'urine comme milieu biologique d'investigation ne leur permettaient pas d'établir un lien de causalité entre cette consommation et la survenue de l'accident. Pour la première fois en France, une étude multicentrique [23] a permis récemment d'estimer le risque relatif d'accident associé à un usage récent de substances psychoactives, en analysant le sang de 900 conducteurs accidentés et en comparant les résultats à ceux de 900 sujets témoins. Les analyses, réalisées sur le sang à l'aide des méthodes analytiques les plus performantes à ce jour, concernaient les produits suivants : cannabis, amphétamines, opiacés, cocaïne, alcool, ainsi que la recherche des principaux médicaments psychoactifs. Des différences de prévalences très significatives (p < 0,01) étaient observées chez les moins de 27 ans pour le cannabis (20 % des conducteurs et 9% des témoins), quel que soit l'âge pour la morphine (2,6 % des conducteurs et 0,4 % des témoins) et pour l'alcool (26 % des conducteurs et 9 % des témoins). Parmi les conducteurs positifs au cannabis, celui-ci était seul présent chez 60 % d'entre eux. L'analyse statistique de ces résultats (calcul des odds-ratios) a permis de montrer que, chez les moins de 27 ans, la fréquence des accidents était multipliée par : - 1,8 avec les médicaments ; - 2,5 avec le cannabis seul ; Bull. Acad. Natle Méd., 2002,186, n° 2,...-..., séance du 19 février 2002 · - 3,8 avec l'alcool seul ; - 4,8 avec l'association alcool-cannabis ; - et par 9 avec la morphine. En conclusion, ces résultats ont confirmé qu'une consommation récente de substances psychoactives était de nature à fortement altérer les capacités à conduire un véhicule en toute sécurité, et tout particulièrement chez les jeunes conducteurs. ACCIDENTS MORTELS ET CORPORELS : QUELLES DIFFÉRENCES ? Selon la législation française actuelle, le dépistage des stupéfiants est obligatoire chez les conducteurs impliqués dans un accident immédiatement mortel [7] tandis qu'il est seulement possible [24] dans le cas des accidents corporels. A notre connaissance, aucun substrat scientifique ne permet de privilégier le dépistage des stupéfiants dans le cas des accidents mortels. Une étude multicentrique réalisée en France 1999 [21] a en effet montré qu'il n'y avait pas de différence entre les prévalences de l'usage de stupéfiants observées chez des conducteurs impliqués dans un accident mortel de la circulation et celles observées dans les cas d'accidents corporels graves. CARACTÉRISATION BIOLOGIQUE D'UNE CONDUITE SOUS INFLUENCE Démontrer par l'analyse biologique qu'une personne a consommé une substance psychoactive est une chose aisée. Montrer qu'au moment des faits (contrôle, accident, etc.) le sujet est sous influence, c'est-à-dire que son aptitude à conduire un véhicule est altérée, peut être a priori beaucoup plus difficile. Néanmoins, les progrès technologiques de ces dernières années et les très nombreux travaux réalisés en pharmacologie et en toxicologie sur ce sujet permettent aujourd'hui de proposer des solutions. Dépistage Urine Son principal avantage est qu'actuellement tous les tests rapides de dépistage ont été conçus pour l'urine. On y retrouve essentiellement les produits du métabolisme, à fortes concentrations. Cependant les inconvénients de ce milieu sont nombreux. Une réaction positive dans les urines ne permettra pas de distinguer une consommation récente d'une consommation datant de quelques jours, voire de plusieurs semaines dans le cas du cannabis [25]. Par ailleurs, le recueil urinaire n'est pas facile, peut présenter un caractère humiliant, et les possibilités d'adultération sont nombreuses et bien connues des toxicomanes. Pour les laboratoires ayant une fréquence faible de demandes et/ou pour d'éventuels dépistages réalisés « sur site », certaines sociétés commercialisent des tests unitaires faisant appel à rimmunochromatographie, fournissant une réponse en 5 à 10 minutes seulement et n'utilisant que quelques gouttes d'urine. Certains d'entre eux détectent simultanément les quatre principales classes de stupéfiants (cannabis, opiacés, amphétamines et cocaïne) avec des performances tout à fait satisfaisantes [26]. La mise en _uvre d'une technique de dépistage ayant conduit à un résultat positif dans les urines doit toujours être suivie d'une technique de confirmation. En effet, avec toute technique immunologique, les anticorps peuvent présenter des réactivités croisées avec des composés apparentés, et parfois même avec des composés de structure très différente ce qui se traduit par des résultats faussement positifs. Bull. Acad. NolleMéd.. 2002,186. n° 2,... - ..., séance du 19 février 2002 Salive La salive a été l'objet de nombreuses études et revues de la littérature [27, 28]. Elle pourrait constituer un bon milieu de dépistage car elle est facilement accessible, son recueil n'est pas vulnérant, mais surtout car la présence des différentes substances reflète une consommation récente (non détectables 2 à 10 heures après). Bien que ce milieu soit donc potentiellement intéressant et notamment dans des buts de dépistages de masse, il n'existe à ce jour aucun test rapide adapté à ce milieu biologique. En effet, tous les tests rapides commercialisés à ce jour ont été conçus pour les urines et donc pour détecter la présence des metabolites et non des principes actifs, seuls composés retrouvés dans la salive [29]. A défaut de pouvoir être réalisés sur le lieu de l'accident ou du contrôle, les dépistages salivaires sont bien entendu d'ores et déjà réalisables dans les laboratoires spécialisés. Sueur La sueur constitue un très mauvais milieu d'investigation parce que ce milieu est exposé à une contamination par l'environnement et que la présence de stupéfiants dans la sueur ne reflète pas obligatoirement un usage récent. La persistance des substances dans ce milieu est entièrement dépendante du moment du dernier lavage. Si certaines substances comme la cocaïne ou les amphétamines sont facilement excrétées dans la sueur, il n'en est pas de même pour le cannabis pour lequel le principe actif n'y est excrété qu'en très faibles quantités. Par ailleurs, il n'existe à ce jour aucun dispositif commercial fiable adapté au dépistage rapide des drogues illicites dans la sueur. Le Drugwipe® (Securetec, Ottobrunn, Allemagne) a été proposé il y a quelques années pour dépister la présence de drogues par simple essuyage du front. Plusieurs travaux ont cependant montré que l'utilisation de ce test conduisait à de nombreux résultats faussement négatifs et faussement positifs [26, 29]. Confirmation Le sang est le seul liquide biologique approprié pour confirmer un usage récent de substances psycho-actives. En effet, seule l'analyse du sang par des méthodes spécifiques permet de différencier principes actifs et metabolites inactifs et d'effectuer parallèlement une analyse quantitative dont les résultats peuvent donner lieu à interprétation. Les méthodes immunochimiques ne sont pas utilisables pour ce milieu en raison d'une mauvaise sensibilité (conduisant à des résultats faussement négatifs) et d'une mauvaise spécificité, responsable de résultats faussement positifs [30]. Parmi les méthodes séparatives, la plupart des auteurs [31, 32] indiquent que la méthode actuellement la plus fiable est la chromatographie en phase gazeuse avec détection par spectrométrie de masse (GC-MS). En ce qui concerne le cannabis, l'analyse du sang par GC-MS permet d'estimer le temps écoulé entre le moment de la dernière consommation et celui de la prise de sang, avec un intervalle de confiance de 92 % [33]. De nombreuses techniques reposant sur cette méthodologie et applicables pour le sang ont été développées, dont certaines sont recommandées par la Société Française de Toxicologie Analytique pour la confirmation de la présence de drogues illicites dans le sang des conducteurs [34-36]. Restitution du permis de conduire Les cheveux incorporent la plupart des xénobiotiques présents dans le sang et la sueur. Si l'analyse des cheveux ne permet pas de mettre en évidence une consommation datant de quelques heures, elle présente néanmoins un intérêt considérable. En effet la recherche de substances psycho-actives dans les cheveux, grâce à une analyse séquentielle (en coupant les cheveux en segments de l cm), renseigne sur le vécu toxicomaniaque d'un sujet [37]. ·L'abstinence est mieux définie par cette approche que par un suivi dans les urines. Cela pourrait être d'une grande utilité pour confirmer une consommation régulière (en cas de litige) ou encore pour vérifier que le sujet a arrêté de consommer lorsqu'il s'agira de restituer un permis de conduire après suspension de celui-ci pour infraction à la législation. INITIATIVES EUROPÉENNES : L'EXEMPLE DE LA SARRE Si la peur du gendarme a démontré son efficacité avec l'alcool, il devrait logiquement en être de même avec les drogues illicites. Cette hypothèse a été très clairement démontrée par une expérience unique, réalisée en 2000 en Allemagne dans la région de la Sarre. Dans cette région, à partir du 1er janvier 2000, des dépistages de drogues ont été effectués de façon très fréquente au cours des week-ends chez les jeunes de moins de 25 ans. Le tableau suivant regroupe les résultats obtenus par cette opération au cours des 8 premiers mois de l'année 2000 ainsi que ceux obtenus dans le reste de l'Allemagne pendant cette même période.
CONCLUSION Les connaissances des mécanismes d'action des drogues illicites, les résultats des études épidémiologiques, des tests sur simulateur de conduite ou encore des tests en situation réelle, démontrent bien les effets délétères de ces produits sur l'aptitude à conduire un véhicule en toute sécurité (pour soi-même et pour les autres). L'exemple de la Sarre a montré qu'une politique de prévention active pouvait résulter en une diminution considérable du nombre des accidents de la route. En France, les pouvoirs publics ont estimé que d'autres études épidémiologiques étaient encore nécessaires avant de mettre en place une véritable politique de prévention, reposant sur l'information mais aussi sur la mise en place de dépistages systématiques. Dans l'attente du développement de tests rapides adaptés à la salive et utilisables au bord des routes, de nombreux laboratoires de toxicologie sont pourtant d'ores et déjà compétents pour effectuer la recherche des drogues illicites dans la salive. Il nous apparaît donc indispensable de mettre en place une législation visant à réprimer l'usage des psychotropes illicites chez les conducteurs, sans attendre qu'il y ait eu mort d'homme. N° 3641 N° 259 ____ ___ ASSEMBLÉE NATIONALE SÉNAT CONSTITUTION DU 4 OCTOBRE 1958 ONZIÈME LÉGISLATURE SESSION ORDINAIRE DE 2001 - 2002 ____________________________________ ____________________________________ Enregistré à la présidence de l'Assemblée nationale Annexe au procès-verbal Le 20 février 2002 de la séance du 21 février 2002 ________________________ OFFICE PARLEMENTAIRE D'ÉVALUATION DES CHOIX SCIENTIFIQUES ET TECHNOLOGIQUES ________________________ RAPPORT SUR L'IMPACT ÉVENTUEL DE LA CONSOMMATION DES DROGUES SUR LA SANTÉ MENTALE DE LEURS CONSOMMATEURS Par M. Christian CABAL Député __________ __________ Déposé sur le Bureau de l'Assemblée nationale Déposé sur le Bureau du Sénat par M. Jean-Yves LE DÉAUT, par M. Henri REVOL, Président de l'Office Premier Vice-Président de l'Office _____________________________________________________________________________ Drogue TABLE DES MATIERES INTRODUCTION 9 I. La définition des drogues 10 II. Drogue et approche scientifique 12 III. Un débat toujours passionnel 14 PREMIÈRE PARTIE : L'ACTION DES PRINCIPALES DROGUES SUR LE CERVEAU 17 CHAPITRE I : UNE ALCHIMIE COMPLEXE 19 Section I : Les termes du débat scientifique 19 A) Les notions de drogue et de santé mentale 19 B) L'existence de divergences d'appréciation sur l'effet des produits 21 Section II : Le consensus scientifique existe sur la description des mécanismes actionnant le circuit de récompense du cerveau. 24 A) Le rôle majeur de la dopamine 24 B) Les effets de long terme sur le cerveau suscitent beaucoup d'interrogations scientifiques. 26 Section III : Les modifications du cerveau sous l'effet de drogues sont aujourd'hui reconnues 28 CHAPITRE II : LA PRINCIPALE DES DROGUES À EFFET PERTURBATEUR : LE CANNABIS 31 Section I : Un relatif consensus scientifique sur les effets à court terme du cannabis 32 A) Le principe actif du cannabis 32 B) Les effets évidents du cannabis 33 1) Les effets du cannabis selon l'Académie nationale de médecine 34 2) Les effets du cannabis selon le « rapport Roques » 35 3) Les effets du cannabis pour l'INSERM 37 4) Les effets du cannabis pour la Commission fédérale helvétique sur les questions liées aux drogues 37 Section II : Les effets à long terme du cannabis suscitent beaucoup d'interrogations 39 A) Les dangers objet d'un consensus 39 1) Le cancer des voies respiratoires 39 2) Les dangers pour la femme enceinte et le f_tus 40 3) L'existence d'états psychotiques 41 B) Les dangers du cannabis objets de controverse scientifique 42 1) Une véritable interrogation sur le risque de développement de maladies mentales 42 2) Le risque au regard de la schizophrénie est mal quantifié mais réel 43 a) Les études américaines 43 b) Le sentiment de l'INSERM 44 c) L'explication scientifique 45 3) Les activités à risques 45 Section III : L'analyse du Rapporteur 48 A) L'effet du cannabis varie considérablement en fonction des consommateurs 48 1) Les conséquences à long terme d'une forte consommation de cannabis sur le cerveau demeurent un objet de controverse 49 2) Un débat scientifique sur l'effet des doses cumulées doit être engagé 51 B) La dépendance 52 C) Des fonctions thérapeutiques indéniables 53 Conclusion : La récréation des adultes ou la protection de la jeunesse ? 54 CHAPITRE III : LES AUTRES DROGUES À EFFET PERTURBATEUR : LE LSD, LES CHAMPIGNONS HALLUCINOGÈNES (MESCALINE, PSILOCIBINE ET LES SOLVANTS) 55 Section I : Le LSD et les champignons hallucinogènes 55 Section II - Les solvants 57 CHAPITRE IV : LES DROGUES À EFFET STIMULANTS : LA COCAÏNE, LE CRACK, LES AMPHÉTAMINES, L'ECSTASY... ET LES PRODUITS DES RAVES PARTIES 59 Section I : Les caractéristiques communes aux différents produits 59 Section II - La cocaïne et le crack 60 A) Les effets immédiats de la cocaïne et du crack 62 B) L'analyse du Rapporteur 63 1) Les dangers traditionnels 63 2) Les nouveaux dangers : l'effet désinhibiteur 64 Section III - Amphétaminiques et psychostimulants 66 A) Le constat 66 B) Les effets de ces produits 67 Section IV - L'ecstasy 68 A) Le bilan dressé par l'Observatoire français des toxicomanies 68 B) L'expertise collective publiée par l'INSERM en juin 1998 69 C) L'analyse du Rapporteur : des dangers graves 70 Section V : Les drogues de synthèse utilisées dans les raves parties 71 A) Les difficultés d'identification des produits 71 B) La kétamine 72 C) Le gamma OH,GHB 74 D) Le protoxyde d'azote 74 Conclusion : 75 CHAPITRE V : LES OPIACÉS : L'HÉROÏNE, LA CODEÏNE, LA MORPHINE, L'OPIUM... 77 Section I : Les effets des opiacés 78 Section II : L'analyse du Rapporteur 80 Section III : La mise en _uvre d'une politique de substitution 82 Section IV : Les sulfates de morphine 84 Section V : L'usage du Rachacha 85 A) Le produit 85 B) Disponibilité saisonnière et limitée 85 C) Modalités de consommation 85 CHAPITRE VI : LES MÉDICAMENTS PSYCHOTROPES DÉTOURNÉS DE LEUR USAGE (BENZODIAZÉPINES...) 87 Section I : Les effets des hypnotiques et sédatifs euphorisants barbituriques rapides, benzodiazépines 88 Section II : L'analyse du Rapporteur 90 A) La situation 90 B) Le rôle de l'industrie pharmaceutique 91 Conclusion de la première partie 94 DEUXIÈME PARTIE : LA NÉCESSITÉ D'UNE DÉMARCHE SCIENTIFIQUE 95 CHAPITRE I : LA DIVERSITÉ DES COMPORTEMENTS ET DES PRODUITS IMPOSE UNE APPROCHE NOUVELLE 97 Section I : La nécessité de construire un discours sur les drogues intégrant des éléments de consensus à partir des avancées scientifiques les plus récentes 98 A) La clarification des principales notions utiles à la compréhension de la toxicomanie 98 B) La nécessité d'élaborer une grille d'analyse commune au corps médical 101 C) La nécessité de battir un discours scientifique admis par l'opinion 102 Section II : L'élaboration d'un discours scientifiques sur les dangers des drogues doit intégrer les polytoxicomanies 104 A) Le lien entre toxicomanie et alcool 105 B) La difficulté d'intégrer les polyconsommations d'alcool des toxicomanes dans l'approche du problème 106 CHAPITRE II : LES INSUFFISANCES DE LA CONNAISSANCE 111 Section I : Les études à conduire sur la nature des drogues 112 Section II : Les études à mener sur l'action des drogues 114 A) Les paramètres de la dépendance 114 B) Le caractère irréversible des troubles 115 C) Les dangers pour la jeunesse 116 D) Les interactions avec l'alcool 118 E) La génétique 118 F) Le risque (ou l'absence de risque) de passage du cannabis à des drogues plus dure 119 G) La recherche en neuropsychiatrie doit être développée 120 CHAPITRE III : STRATÉGIE POUR UNE DYNAMISATION DE LA RECHERCHE 121 Section I : Un constat de carence de la recherche scientifique 121 A) L'analyse de la Cour des Comptes 121 B) L'analyse du Rapporteur 125 Section II : Les dispositions du plan triennal relatives à la recherche 127 Section III : Stratégie pour dynamiser la recherche 133 A) La nécessité de susciter des vocations de chercheurs 133 B) La levée d'obstacles juridiques 133 C) La mise en place d'une agence de moyens 134 1) L'exemple américain 134 2) La proposition du Rapporteur 135 CONCLUSION 137 RECOMMANDATIONS 139 EXAMEN DU RAPPORT PAR L'OFFICE 141 ANNEXES 145 Annexe I : Liste des personnes auditionnées 147 Annexe II : Communication sur le cannabis du Professeur Ferreri et du Docteur Nuss aux entretiens de Bichat 2001 149 Annexe III : Communication sur le cannabis du Professeur Costentin à l'Académie nationale de médecine sur les données neurobiologiques récentes 155 Annexe IV : Conseil National du Sida (Rapport 2000 - Extrait) 165 Annexe V : Communication du Professeur Mura devant l'Académie Nationale de médecine sur l'accidentologie et les drogues illicites 169 Annexe VI : Etude de la Caisse Nationale d'Assurance Maladie maternité sur les benzodiazépine 179 Annexe VII : Principales données statistiques sur la toxicomanie 185 Annexe VIII : Loi n°70-1320 relative aux mesures sanitaires de lutte contre la toxicomanieet la répression du trafic ... 191 Annexe IX : Discours du Président George W. Bush (extrait) 203 ANNEXES - Annexe I : - Annexe II : - Annexe III : - Annexe IV : - Annexe V : - Annexe VI : - Annexe VII : - Annexe VIII : - Annexe IX : Annexe VI : Le Régime Général de l'Assurance Maladie a donc décidé de faire un bilan de l'état de la consommation de ces trois spécialités (Tranxène® 50 mg, Nordaz® 15 mg, Rohypnol® 1 mg) et de dresser le profil des consommateurs et des prescripteurs. En 2000, le montant remboursable par l'Assurance Maladie des anxiolytiques et des hypnotiques non barbituriques seuls est en légère décroissance (-2,4% et -5,6%). Néanmoins, le nombre de boîtes délivrées sur la même période reste élevé : 52 millions pour les anxiolytiques et 32 millions pour les hypnotiques. Tranxène® 50 mg, Nordaz® 15 mg, et Rohypnol® 1 mg représentent respectivement 1 million, 266 mille et 3,8 millions de boîtes. Méthodologie en bref L'étude a porté sur une période allant du 1er juin 1999 au 31 janvier 2000 et s'est déroulée dans dix régions (Alsace, Aquitaine, Auvergne, Bourgogne, Centre, Champagne-Ardenne, Midi-Pyrénées, Nord-Pas-de-Calais, Provence-Alpes-Côte-d'Azur et Rhône-Alpes) en utilisant les données issues du codage des médicaments selon une méthodologie commune. Pour chacune des trois spécialités, les populations étudiées ont été constituées à partir de la base recensant les patients du Régime Général pour lesquels au moins une prescription du produit a été établie au cours du mois de juin 1999. Les populations sélectionnées dans les régions de l'étude (échantillon aléatoire ou exhaustivité selon les cas) comptaient 10 052 patients pour le Tranxène® 50 mg, 5 315 patients pour le Nordaz® 15 mg et 17 910 patients pour le Rohypnol® 1 mg. Une exploitation de ces bases a permis de relever les consommations individuelles (approchées par les ordonnances présentées au remboursement) et de suivre les patients sur huit mois. Des indicateurs ont été calculés tels que la posologie moyenne par patient et la durée de traitement. 20 à 40 % des patients dépassent les posologies usuelles maximales recommandées Les patients consommant une de ces trois benzo-diazépines étaient majoritairement des femmes (54,6 % de femmes pour Tranxène® , 69,4 % pour Nîordaz®, 59,0 9< pour Rohypnol®). L'âge moyen des patients était de 49 ans pour Tranxène®, 54 ans pour Nordaz® et 61 ans pour Rohypnol®. Pour chaque patient, une posologie journalière a été calculée sur la base des quantités de médicaments délivrés. Cette posologie a été comparée au référentiel de l'AMM qui préconisait une posologie usuelle maximale de 100 mg/j pour Tranxène®, de 15 mg/j pour Nordaz® et 1 mg/j pour Rohypnol® . Plus de 36 % des patients consommant du Nordaz® 15 mg et du Rohypnol® 1 mg, et environ 23 % des patients consommant du Tranxène® 50 mg ont dépassé les posologies usuelles maximales. 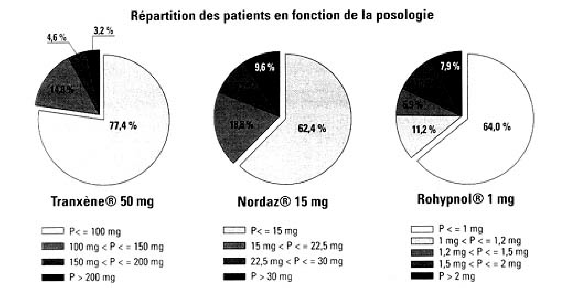 La consommation de Tranxène® et Rohypnol® à des posologies élevées concerne les patients les plus jeunes. Entre 20 et 40 ans, 50 % des patients consommant du Rohypnol® et 30 '/< des patients consommant du Tranxène® dépassent la posologie usuelle maximale recommandée. Si pour Tranxène®, cette proportion devient résiduelle à partir clé 65 ans, pour Rohypnol®, malgré une diminution clé la proportion de dépassement avec l'âge, plus de 30 % des patients consomment encore à des posologies élevées. Et ce, alors que l'AMM recommande pour les sujets âgés des posologies diminuées de moitié. Pour Nordaz® 15 mg, le dépassement de la posologie concerne toutes les classes d'âges. Entre 45 et 65 ans, plus de 40 % des patients dépassent la posologie usuelle maximale recommandée. Pour les trois médicaments étudiés, les patients dépassant la posologie usuelle maximale ont consommé trois fois plus de produit que ceux qui respectaient la posologie. 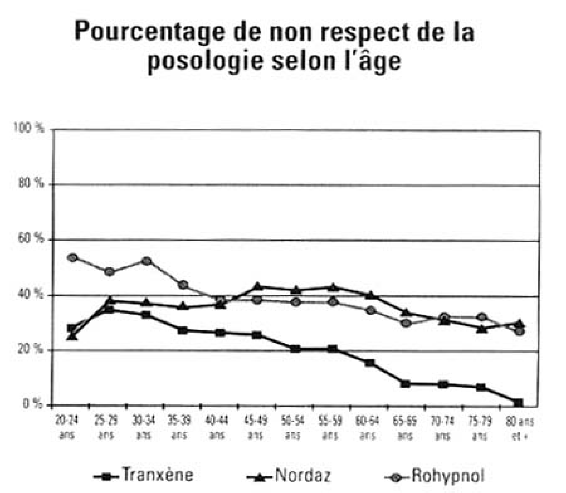 Pour chacune des trois spécialités, les hommes étaient plus nombreux que les femmes à dépasser ces posologies journalières et consommaient ces produits aux posologies les plus élevées. Pour les patients dépassant la posologie usuelle maximale, ces trois produits étaient prescrits exclusivement par des généralistes dans : 68 % des cas pour Tranxène®, 64 % pour Nordaz®, 83 % pour Rohypnol®. La région Alsace a identifié les cas de non-respect des référentiels. Ainsi, l'AMM prévoit des situations dans lesquelles la posologie usuelle peut être dépassée : seuls 15 à 20 % des patients dépassant la posologie correspondent à ces situations 30 à 50 % des patients dépassent les durées de traitement préconisées La durée de traitement par patient a été définie comme le nombre de jours entre les dates extrêmes de ses délivrances relevées sur la période d'étude (1er juin 1999- 31 janvier 2000). La durée de traite-ment a été comparée au référentiel de l'AMM qui préconisait une durée maximale de 12 semaines pour Tranxène® 50 mg et Nordaz® 15 mg et de 4 semaines pour Rohypnol® 1 mg. 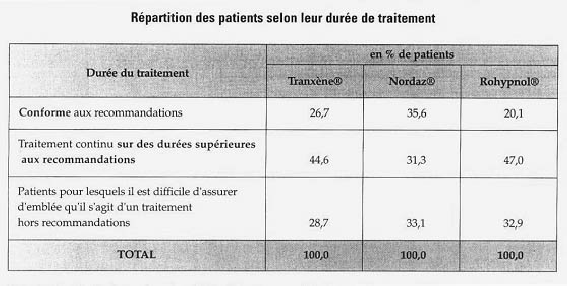 Les durées de traitement préconisées étaient dépassées dans près de la moitié des cas pour Tranxène® 50 mg et Rohypnol® 1 mg, et dans près d'un tiers des cas pour Nordaz® 15 mg. Seule une minorité de patients a consommé l'un des trois produits sur une période conforme aux référentiels (20,1 % pour Rohypnol®, 26,7 % pour Tranxène® et 35,6 % pour Nordaz®). Les patients consommant aux posologies élevées dépassaient également dans leur grande majorité la durée de traitement. Ce résultat suggère fortement une dépendance des patients aux produits. L'étude complémentaire de la région Alsace confirme que la raison principale du dépassement de la durée de traitement est une dépendance psychologique ou physique. Pour chaque produit, l'étude sur les dix régions a également mis en évidence un comportement déviant de certains patients : le nombre élevé de délivrances constatées pour ces patients peut difficilement correspondre, a priori, à un usage médical et à une consommation personnelle. Par exemple, nous avons relevé 142 délivrances pour un patient donné dans la région Nord Pas de Calais sur les huit mois de l'étude. Dépendance, baisse de vigilance : Les proportions importantes de patients dépassant les posologies et les durées de traitement usuelles dans dix régions françaises suscitent des questions quant à l'impact de cette consommation sur la vie quotidienne, et ce d'autant plus qu'une partie de cette population est sans doute en activité. La population consommant Tranxène® 50 mg et Niordaz® 15 mg sur des durées de traitement plus ou moins continues, concerne des personnes dont les besoins en matière de benzodiazépines sont, a priori, exagérés par rapport aux recommandations. Cette population entre dans le cadre d'une dépendance psychologique voire physique, quel que soit le produit utilisé. Les dépassements pourraient être réduits par une information très ciblée délivrée aux prescripteurs et aux consommateurs rappelant de façon beaucoup plus générale que les benzodiazépines sont des molécules caractérisées par leur impact sur la vigilance. Pour le Rohypnol®, la question soulevée à propos des dérives d'utilisation est de nature à remettre en cause le produit lui-même : le Rohypnol® 1 mg possède une puissance d'action sans commune mesure avec les nécessités de la prescription dans les difficultés d'endormissement banales en particulier chez les sujets âgés. La puissance d'action concerne au premier chef le pouvoir de ce produit d'engendrer une toxicomanie et sa capacité à créer une dépendance. Chez les sujets âgés consommant du Rohypnol® de manière durable dans le temps, on suppose la iatrogénie considérable qui peut être créée chez des personnes dont la mémoire, la tonicité musculaire et la vigilance diurne doivent être impérativement protégées. Il existe à l'heure actuelle de nombreuses alternatives. Depuis février 2001, Rohypnol® est soumis aux mêmes modalités de prescription et de délivrance que les stupéfiants. Ces nouvelles règles obligatoires devraient permettre d'enrayer les dérives d'utilisation de ce produit. Les dernières données disponibles montrent déjà une forte diminution des ventes. La baisse de vigilance consciente ou non de la part des consommateurs de benzodiazépines peut entraîner des risques plus importants d'accident de la route, d'accident du travail, ... Chez la personne âgée, la consommation à des doses élevées entraîne un risque de chute important (fracture du col du fémur) lié à une vigilance amoindrie. En conclusion, il est nécessaire de rappeler au corps médical les RMO et les recommandations de bonnes pratiques, de souligner l'importance des écarts aux référentiels et d'insister sur la nécessité d'utiliser ces produits de façon plus rationnelle dans le cadre des référentiels . Par la publication de ces résultats, l'Assurance Maladie souhaite sensibiliser le grand public sur les benzodiazépines, médicaments qui font baisser la vigilance et qui peuvent créer une situation de dépendance psychologique ou physique. L'objectif est de rendre l'usager responsable en l'informant sur les "bonnes pratiques de consommation" (des difficultés d'endormissement ou des manifestations d'anxiété ne sont pas systématiquement pathologiques et ne nécessitent donc pas l'usage continu de spécialités non dénuées de danger) et sur les méfaits inhérents à un usage prolongé de ces produits. L'Assurance Maladie s'efforcera de mettre en place un suivi de ces produits. _______________ N° 3641.- Rapport de M. Christian Cabal sur l'impact éventuel de la consommation des drogues sur la santé mentale de leurs consommateurs (Office d'évalation des choix scientifiques). 2 Praticien hospitalier, Service de psychiatrie Hôpital Saint-Antoine. 3 Chef du service de psychiatrie et de psychologie médicale, Hôpital Saint-Antoine, 184 rue du faubourg Saint-Antoine, 75571 Paris cedex 12 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

