

N° 2698
______
ASSEMBLÉE NATIONALE
CONSTITUTION DU 4 OCTOBRE 1958
TREIZIÈME LÉGISLATURE
Enregistré à la Présidence de l'Assemblée nationale le 6 juillet 2010.
RAPPORT
FAIT
AU NOM DE LA COMMISSION D’ENQUÊTE sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1),
Président
M. Jean-Christophe Lagarde,
Rapporteur
M. Jean-Pierre Door,
Députés.
——
INTRODUCTION 7
I.- UNE CAMPAGNE DE VACCINATION AUX RÉSULTATS DÉCEVANTS COMME DANS LA PLUPART DES AUTRES PAYS 11
A. UN BILAN INSUFFISANT AU REGARD DES MOYENS ENGAGÉS 11
1. Un échec de santé publique 11
a) Un faible taux de vaccination 11
b) Une incompréhension entre les autorités sanitaires et les professionnels de santé 13
2. Un coût financier certes important, mais moins que prévu initialement 14
a) De nombreux chiffres ont été avancés successivement, puis revus à la baisse 15
b) Des résiliations de contrats coûteuses 16
c) Des stocks non écoulés 20
d) Des coûts importants de fonctionnement 22
e) Les autres dépenses induites par la campagne de vaccination 26
B. UN MÊME CONSTAT D’INSUFFISANCE DE LA VACCINATION DANS LA PLUPART DES AUTRES PAYS 29
1. De très rares exceptions 30
2. Des résultats tout aussi décevants ailleurs 31
II.- UNE CAMPAGNE DE VACCINATION PLACÉE SOUS L’ÉGIDE DU PRINCIPE DE PRÉCAUTION 35
A. DES INCERTITUDES ET DES DOUTES IMPORTANTS QUI ONT COMMANDÉ UNE APPLICATION RESPONSABLE DU PRINCIPE DE PRÉCAUTION 36
1. De nombreuses incertitudes 36
a) Sur le virus 37
b) Sur les délais d’obtention des vaccins 39
2. Une préstratégie vaccinale visant une protection complète de la population 44
a) Le choix d’une couverture d’environ 75 % de la population 44
b) Fallait-il retenir un objectif de vaccination aussi large ? 46
B. UNE NÉGOCIATION DES CONTRATS DÉLICATE 48
1. Des marges de manœuvre réduites 49
a) Les impératifs d’une négociation rapide permettant de répondre aux besoins identifiés 49
b) Des contraintes qui ont pesé sur la négociation des contrats 51
2. D’autres options qui auraient été envisageables 58
a) Un objectif plus souple en termes de couverture vaccinale 58
b) Des contrats plus facilement modulables 61
III.- UNE CAMPAGNE DE VACCINATION VOLONTARISTE MAIS D’UNE APPLICATION TROP RIGIDE 65
A. UN DISPOSITIF MÛREMENT RÉFLÉCHI POUR DES MENACES SANITAIRES GRAVES 65
1. Un plan de lutte contre la pandémie issu des dispositifs de lutte contre la grippe aviaire A(H5N1) 65
a) Le règlement sanitaire international, instrument juridique contraignant mais indispensable 65
b) Au plan national, un arsenal prévu pour des menaces sanitaires graves 67
2. Un pilotage spécifique à la gestion de crise 72
a) Au niveau national, de multiples intervenants coordonnés par un cadre interministériel renforcé 74
b) Une expertise déterminante et abondante 76
c) Un pilotage territorial essentiellement assuré par le ministère de l’intérieur 79
B. DES CENTRES DE VACCINATION CONTESTÉS DANS LEUR PRINCIPE 80
1. Un choix de vaccination collective, dans des centres spécifiques, motivé par de réelles contraintes 81
a) Des contraintes de santé publique 81
b) Des contraintes logistiques 82
2. Un dispositif insuffisant pour mener rapidement une campagne de vaccination pandémique 83
3. D’autres voies explorables 84
a) Le recours à la médecine ambulatoire 84
b) L’appel aux établissements de santé 86
c) L’organisation de campagnes déconcentrées de vaccination dans les communautés de taille importante 87
C. UNE MISE EN œUVRE QUI A MANQUÉ DE SOUPLESSE 88
1. Des difficultés liées aux règles de fonctionnement des centres 88
a) Un parcours de vaccination progressivement ajusté 88
b) Des protocoles parfois inhabituels 89
2. Des problèmes de gestion opérationnelle qui ont pu être résolus grâce aux efforts consentis par les personnels et les collectivités locales 90
a) Des administrations déconcentrées parfois mal armées pour appliquer les directives 90
b) La confusion entourant les réquisitions 91
c) Des horaires d’ouverture et des lieux parfois peu adaptés 93
d) Des problèmes logistiques résolus grâce aux initiatives individuelles 95
IV.- UNE CAMPAGNE DE VACCINATION BOUDÉE 97
A. UN MESSAGE DE SANTÉ PUBLIQUE PERDU DANS LE BROUILLARD MÉDIATIQUE 97
1. Une multiplicité des messages sanitaires source de confusion 97
a) Sur le risque lié à la pandémie 97
b) Sur la stratégie vaccinale 98
c) Les réticences des personnels soignants 98
2. Des médias parfois excessifs 99
a) Un large écho donné à des prises de position de personnalités extérieures à l’expertise sanitaire 99
b) Des informations oscillant entre alarmisme et banalisation 100
c) Des messages inquiétants sur la sûreté des vaccins 101
3. Sur internet, un débat concurrent qui a débordé les autorités 102
a) La propagation de rumeurs inquiétantes par des canaux variés 102
b) Des rumeurs au service d’intérêts divers 102
B. DES ERREURS DANS LA COMMUNICATION DES POUVOIRS PUBLICS 103
1. Une campagne institutionnelle classique souvent inappropriée 104
a) Le recours à des instruments traditionnels qui n’ont pas suffisamment pris en compte l’état d’esprit de la population 104
b) L’absence de réaction appropriée des autorités face aux rumeurs 107
2. La nécessité d’un débat public sur les risques de pandémie ou de crise sanitaire grave 108
3. Des professionnels de santé insuffisamment associés 109
a) Une information inadaptée qui n’a pas permis de susciter l’adhésion 109
b) Une formation sur la vaccination sans doute incomplète 110
CONCLUSION 113
LISTE DES QUARANTE-DEUX PROPOSITIONS 115
CONTRIBUTIONS 121
CONTRIBUTION DE MME JACQUELINE FRAYSSE, DÉPUTÉE DES
HAUTS-DE-SEINE (GROUPE GDR) ET MEMBRE DE LA COMMISSION D’ENQUÊTE 121
CONTRIBUTION DES DÉPUTÉS DU GROUPE SRC MEMBRES DE LA COMMISSION D’ENQUÊTE 125
TRAVAUX EN COMMISSION 129
ANNEXES 155
ANNEXE 1 : RÉSOLUTION CRÉANT LA COMMISSION D’ENQUÊTE 155
ANNEXE 2 : COMPOSITION DE LA COMMISSION D’ENQUÊTE 156
ANNEXE 3 : ÉLÉMENTS DE COMPARAISON INTERNATIONALE SUR LES STRATÉGIES VACCINALES 157
ANNEXE 4 : TABLEAU CHRONOLOGIQUE DE LA LUTTE CONTRE LE VIRUS A(H1N1) 158
ANNEXE 5 : LETTRE DU PRÉSIDENT JEAN-CHRISTOPHE LAGARDE AU DOCTEUR MARGARET CHAN, DIRECTRICE GÉNÉRALE DE L’ORGANISATION MONDIALE DE LA SANTÉ 169
ANNEXE 6 : COMPTES RENDUS DES AUDITIONS 170
Le présent rapport conclut les travaux de la commission d’enquête sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1) (1). Cette commission avait été créée par la résolution n° 427 adoptée par l’Assemblée nationale le 24 février 2010 (2) dans les conditions prévues par l’article 141 de son Règlement, lequel permet à un président de groupe d’opposition ou de groupe minoritaire de demander un débat sur une proposition de résolution tendant à la création d’une commission d’enquête, celle-ci ne pouvant être alors rejetée qu’à la majorité des trois cinquièmes des membres de l’Assemblée.
C’est naturellement à M. Jean-Christophe Lagarde, premier signataire de la proposition de résolution ayant conduit à la création de la commission d’enquête, qu’est revenue la présidence de cette instance, en application de l’article 143 du Règlement.
La commission d’enquête, composée de trente représentants de tous les groupes politiques de l’Assemblée (3) a procédé à cinquante-deux auditions entre le 31 mars et le 6 juillet 2010 pour entendre soixante-quinze personnalités de tous horizons : scientifiques et experts, représentants des personnels de santé, responsables d’établissements publics et d’administrations centrales et déconcentrées, représentants des collectivités locales, corps de contrôle de l’État, industriels pharmaceutiques, représentants d’instances européennes ou encore journalistes (4).
Si votre rapporteur a souhaité s’en tenir strictement au champ d’investigation fixé par la résolution ayant créé la commission d’enquête – la campagne de vaccination et rien que la campagne de vaccination –, ces auditions ont permis d’aborder de nombreux aspects de la lutte contre les pandémies. L’ensemble des membres de la commission ont pu poser toutes les questions qu’ils souhaitaient, et il a été donné une suite favorable à toutes leurs demandes d’auditions dans le cadre très contraint par les délais d’investigation fixés par l’article 6 de l’ordonnance n° 58-1100 du 17 novembre 1958 relative au fonctionnement des assemblées parlementaires (5). S’il n’a pas été possible d’entendre des représentants de l’Organisation mondiale de la santé, c’est uniquement parce que cette organisation a décliné par courriel du 16 avril 2010 de M. Keiji Fukuda, conseiller spécial de la direction générale sur la lutte contre la pandémie (6) les invitations lancées par le secrétariat dès le 25 mars (7). Les dispositions relatives aux pouvoirs de contrainte des commissions d’enquête empêchaient bien évidemment d’aller plus loin, l’Organisation mondiale de la santé étant une organisation internationale qui siège à Genève. Le Président Jean-Christophe Lagarde a néanmoins marqué l’incompréhension et le mécontentement de la commission dans un courrier adressé à sa directrice générale (8) qui n’a fâcheusement pas reçu de réponse.
La perspective stricte et objective retenue par votre rapporteur était d’autant plus justifiée que plusieurs travaux parlementaires concomitants se sont déroulés ou se déroulent encore sur la lutte contre la pandémie. La commission des affaires sociales de l’Assemblée nationale a bien entendu auditionné Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports – à quatre reprises –, M. Didier Houssin, directeur général de la santé, Mme Françoise Weber, directrice générale de l’Institut de veille sanitaire et M. Jean Marimbert, directeur général de l’Agence française de sécurité des produits de santé ayant été amenés à ces occasions à répondre également aux questions des commissaires. Le Sénat a, pour sa part créé, le 10 février 2010, une commission d’enquête sur le rôle des firmes pharmaceutiques dans la gestion par le Gouvernement de la grippe A(H1N1)v. L’Office parlementaire d’évaluation des choix scientifiques et technologiques a pour sa part mené un travail approfondi sur la mutation des virus et la gestion des pandémies (9), tandis que la Commission des questions sociales, de la santé et de la famille de l’Assemblée parlementaire du Conseil de l’Europe a adopté le 7 juin 2010, après l’audition de huit personnalités très majoritairement critiques à l’égard des stratégies vaccinales menées en Europe (10), un rapport acide sur la gestion de la pandémie H1N1 (11).
On ne trouvera donc pas dans le présent rapport d’analyses approfondies sur le rôle de l’Organisation mondiale de la santé et notamment de ses experts, la façon d’être ou de trouver plus expert que les experts, la question des liens d’intérêts susceptibles d’exister entre experts et laboratoires, les plans de continuité d’activité, l’efficacité et les modalités d’utilisation des antiviraux ou la pertinence des procédures d’autorisation de mise sur le marché retenues pour les vaccins pandémiques. Ces questions sont importantes mais il n’appartenait pas à votre rapporteur de les traiter, le seul sujet de l’organisation de la campagne de vaccination étant au demeurant suffisamment complexe pour éviter toute dispersion.
Pour la commission d’enquête de l’Assemblée nationale, il ne s’est pas agi d’accuser mais de réfléchir sereinement sur les insuffisances de la campagne de vaccination. Non pour la dénigrer mais pour réussir la prochaine, car le pays devra nécessairement affronter une autre pandémie, c’est-à-dire une attaque de virus au départ, par définition, inconnu, voire « facétieux » pour reprendre le mot employé par Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports (12).
En effet, si l’appareil d’État s’est globalement remarquablement mobilisé (et s’est parfaitement tenu à la disposition de la commission d’enquête), les professionnels de santé puis les Français n’ont pas adhéré aux objectifs de la campagne de vaccination. Là est la question centrale. Là réside la préoccupation de votre rapporteur : l’heure est donc au bilan de la crise sanitaire et surtout au rétablissement de la confiance des Français dans les politiques de santé publique, du sens de l’intérêt collectif, et de relations claires et normalisées avec les professionnels de santé.
Au terme des travaux de la commission d’enquête, dont votre rapporteur se plaît à souligner le sérieux et le caractère constamment constructif, il s’avère que la campagne de vaccination a certes abouti, en termes de couverture vaccinale au regard des moyens engagés, à un résultat décevant mais, à vrai dire, que cette situation a été partagée par de nombreux autres pays (I).
En réalité, les pouvoirs publics se sont attachés, face aux doutes et incertitudes sur le comportement du virus, à faire une application responsable du principe de précaution qui les a conduits à décider d’une vaccination massive de la population et à négocier des contrats de commande de vaccins dans des conditions délicates (II).
Mais la campagne de vaccination, volontariste, s’est en pratique révélée sans doute d’une application trop rigide, malgré ses ajustements, car elle prenait appui sur des dispositifs prévus pour des pandémies plus graves, et reposait essentiellement sur des centres de vaccination dont le principe même était contesté (III).
Enfin, la campagne de vaccination a été indéniablement boudée par les Français : le message sanitaire délivré par les pouvoirs publics a été opacifié par un véritable brouillard médiatique, tandis que la communication institutionnelle, utilisant des instruments traditionnels, n’a pas su prendre la mesure de l’état d’esprit de la population et réagir correctement pour susciter son adhésion (IV).
Tels sont les aspects successivement développés dans le présent rapport, lequel présente naturellement une série de préconisations, toutes inspirées par un souci d’efficacité, et le sens des responsabilités qui doit être celui de la Représentation nationale, au bénéfice de la santé des Français.
I.- UNE CAMPAGNE DE VACCINATION AUX RÉSULTATS DÉCEVANTS COMME DANS LA PLUPART DES AUTRES PAYS
Les résultats de la campagne de vaccination contre le virus A(H1N1) sont indéniablement insatisfaisants : seule une très faible partie de la population a adhéré à la vaccination, alors même que les moyens, logistiques et financiers, déployés pour organiser la campagne, ont été particulièrement importants. Toutefois, la France n’est pas le seul pays à accuser un tel échec : celui-ci est très largement partagé.
A. UN BILAN INSUFFISANT AU REGARD DES MOYENS ENGAGÉS
Un double constat doit être dressé à l’issue de la campagne de vaccination contre le virus A(H1N1) : d’une part, un objectif de vaccination massive de la population loin d’être atteint, et d’autre part, un mécontentement des professionnels de santé, en particulier des médecins et infirmiers libéraux, qui semblent s’être durablement éloignés des autorités sanitaires.
a) Un faible taux de vaccination
Selon les informations fournies par le directeur général de la Caisse nationale d’assurance maladie des travailleurs salariés (CNAMTS), M. Frédéric van Roekeghem, le nombre total de personnes vaccinées en France contre la grippe A(H1N1) pourrait s’élever en définitive à 5,7 millions, donnée qui correspond au nombre de coupons « remontés » à la caisse. Environ 350 000 coupons ne peuvent toutefois être traités statistiquement, soit par manque d’informations, soit parce qu’ils sont illisibles. Les données fiables concerneraient donc 5,36 millions de coupons.
Le département des urgences sanitaires évalue de la même manière la couverture vaccinale à 5,36 millions de personnes au 1er juin 2010, soit moins de 8,5 % de la population totale. Notons également que, d’après la direction générale de la santé, le nombre de deuxièmes doses qui ont été injectées s’établirait à 563 299.
Le bilan de la vaccination au 1er juin 2010
Nombre de personnes vaccinées | |
Centres de vaccination |
4 168 021 |
Équipes mobiles de vaccination en milieu scolaire et hors scolaire (notamment établissements médico-sociaux) |
553 937 |
Établissements de santé (1) |
520 753 |
Médecine libérale |
16 385 |
Centres de secours (personnels de secours) |
36 080 |
Centres de rétention |
360 |
Grandes administrations et grandes entreprises (vaccination autonome) |
2 687 |
Français résidant à l’étranger |
62 763 |
Total |
5 360 986 |
(1) Vaccination des personnels des établissements, de leur entourage, des patients pris en charge par les établissements de santé ainsi de la population générale dans le cadre de l’élargissement du dispositif.
Source : département des urgences sanitaires.
À la date de l’adoption du présent rapport, il était toutefois impossible de connaître précisément la ventilation par type de population du taux de couverture vaccinale : le directeur de la Caisse nationale d’assurance maladie des travailleurs salariés, M. Frédéric van Roekeghem, a justifié devant la commission (13) le retard avec lequel ces données seraient disponibles, expliquant que la protection des données de santé exigée par la Commission nationale de l’informatique et des libertés (14) supposait une reconstitution de celles-ci par croisement des fichiers internes de la caisse avec les bases vaccinales. Ce travail, actuellement en cours en liaison avec l’Agence française de sécurité sanitaire des produits de santé et l’Institut de veille sanitaire, devrait à terme permettre d’opérer un suivi plus fin de la vaccination, et à terme, d’identifier précisément les publics immunisés, ce qui est essentiel pour assurer une préparation cohérente de la prochaine campagne de vaccination contre la grippe saisonnière.
Les premières estimations fournies par l’Institut de veille sanitaire et transmises par M. Didier Houssin, directeur général de la santé, à la commission d’enquête, font toutefois état d’un taux de vaccination qui pourrait se situer entre 25 % et 30 % pour les femmes enceintes et pour les enfants entre six et vingt-quatre mois, et entre 15 % et 20 % pour les personnes en affection de longue durée, catégories « à risque ». Ce taux serait de 30 % pour les professionnels de santé pris dans leur globalité et de 10 % pour les enfants de vingt-quatre mois à onze ans.
Enfin, il semblerait que les personnes défavorisées se soient très peu soumises à la vaccination contre le virus A(H1N1). C’est en tout cas le constat dressé tant par l’inspection générale des affaires sociales, intervenue en fin de campagne dans les Hauts-de-Seine sur la question de l’accès à la vaccination des personnes les plus démunies (15), et par M. Nacer Meddah, ancien préfet de
Seine-Saint-Denis (16) : la corrélation significative observée entre le taux de vaccination et le profil socio-économique des populations est évidemment très préoccupante, la santé des familles modestes étant déjà moins suivie par la médecine de ville. Une future opération de santé publique de cette envergure se devra de prendre en compte ce constat.
b) Une incompréhension entre les autorités sanitaires et les professionnels de santé
Selon M. Didier Tabuteau, conseiller d’État et directeur de chaire Santé à l’Institut d’études politiques de Paris, la campagne de vaccination contre la grippe A(H1N1) a été un « rendez-vous manqué avec la santé publique » dans la mesure où elle « a ravivé les tensions entre médecins et pouvoirs publics » (17). De la même manière, M. Claude Le Pen, professeur de sciences économiques à l’université de Paris-Dauphine, a jugé que si une nouvelle campagne massive de vaccination devait être envisagée, « on n’écarterait sans doute pas du dispositif l’extraordinaire potentiel que constituent les 50 000 médecins libéraux, les 60 000 infirmières, les 3 000 hôpitaux et les 22 000 officines du pays. Ces professionnels ont très mal ressenti leur exclusion et émis des anticorps davantage du fait de cette exclusion que de la politique sanitaire proprement dite » (18).
Lors de leur audition par la commission d’enquête, les syndicats et ordres professionnels de santé ont d’ailleurs tous exprimé leur mécontentement quant aux modalités d’organisation de la campagne de vaccination comme au regard de leur association à la préparation à la pandémie (19). Le reproche principal adressé aux pouvoirs publics concerne la mise en place de centres de vaccination dédiés, qui a alimenté le sentiment que les autorités sanitaires tournaient le dos aux professionnels de santé, médecins généralistes, infirmiers libéraux et pharmaciens exerçant leur activité partout sur le territoire. Ceux-ci considèrent en effet que lors du déclenchement d’une crise sanitaire et dans un contexte d’urgence, mieux vaut s’appuyer sur un dispositif éprouvé que d’en mettre en place un nouveau ex nihilo. Ils ont souvent estimé que les médecins généralistes auraient pu assurer la vaccination contre le virus A(H1N1) en coordination avec le réseau des officines, au moins en complément des centres de vaccination, – le cas échéant auprès de certains publics spécifiques amenés à consulter régulièrement – mettant en avant, au même titre que les infirmiers libéraux, leurs consultations quotidiennes avec des patients dont ils connaissent les facteurs de risque.
Le non recours aux professionnels de santé libéraux leur a ainsi semblé contradictoire, alors même que la loi n° 2009-879 du 21 juillet 2009 portant réforme de l'hôpital et relative aux patients, à la santé et aux territoires a consacré la notion de médecine générale de premier recours.
Le caractère dommageable de l’absence de recours à la médecine de ville pour l’organisation de la campagne de vaccination a également été souligné par l’Académie nationale de médecine, dans un communiqué publié le 13 octobre 2009. L’un de ses membres, M. Pierre Bégué, a rappelé devant la commission (20) que celle-ci a été mal comprise, alors même qu’une enquête aurait mis en évidence que plus de 60 % d’entre eux auraient accepté d’y participer. Outre le constat d’une désunion entre les autorités sanitaires et les professionnels de santé, forcément regrettable, leur mise à l’écart n’est pas étrangère au faible bilan de la vaccination de la population générale. En effet, si le taux de vaccination des médecins hospitaliers s’est révélé élevé – 65 % à l’Assistance Publique – Hôpitaux de Paris et 60 % pour les Hospices civils de Lyon –, il semblerait que les médecins généralistes aient été moins nombreux à se soumettre à la vaccination, allant parfois jusqu’à la déconseiller à leurs patients. Une méfiance encore plus forte a été constatée auprès des infirmiers, le syndicat national des personnels infirmiers ayant fait connaître, par la voix de son secrétaire général, M. Thierry Amouroux, son hostilité au vaccin contre le virus A(H1N1) et ayant notamment mis en cause sa sécurité. Des interrogations sur l’intérêt de la vaccination contre le virus A(H1N1) ont également été formulées par les infirmières scolaires.
Ce bilan que l’on ne peut que déplorer est porteur d’enseignements : il eut été préférable que le tissu sanitaire de terrain soit associé à une initiative de santé publique de cette ampleur, et il faudra y veiller à l’avenir, a fortiori dans un contexte de crise sanitaire. Comme l’a rappelé M. Bernard Bégaud, pharmacologue, à la commission d’enquête : « tout aurait dû être fait pour que les médecins se comportent comme des relais et non comme fossoyeurs du message sanitaire » (21).
2. Un coût financier certes important, mais moins que prévu initialement
D’après les données fournies par le ministère de la santé, le coût final de la campagne de vaccination se situerait autour de 600 millions d’euros : il serait donc deux fois et demi inférieur aux prévisions initiales de l’ordre de 1,5 milliard d’euros, pour un périmètre de dépenses néanmoins plus large, puisqu’il inclurait notamment le coût de l’acquisition des masques, dont les stocks étaient déjà largement existants.
a) De nombreux chiffres ont été avancés successivement, puis revus à la baisse
● La première estimation avancée s’établissait autour de 1,5 milliard d’euros, selon les données fournies par la ministre de la santé et des sports elle-même lors de son audition par la commission des affaires sociales de notre assemblée le 16 septembre 2009. Il s’agissait toutefois d’une évaluation correspondant à l’ensemble des moyens financiers mobilisés pour la préparation à la pandémie de grippe A(H1N1). La ventilation était la suivante :
– 1,136 milliard d’euros directement pris en charge par l’établissement public de réponse aux urgences sanitaires, dont 876 millions d’euros non prévus dans la programmation budgétaire initiale : l’essentiel de la dépense nouvelle était constitué par l’acquisition des vaccins pour un montant évalué à 808 millions d’euros.
– l’indemnisation des professionnels réquisitionnés pour la vaccination était estimée à 290 millions d’euros, selon une estimation alors fournie par l’assurance maladie.
– 52,8 millions d’euros de frais étaient également envisagés par l’assurance maladie pour la mise en place du dispositif de traçabilité et de suivi de la vaccination (bons, acheminement du courrier, équipement et logiciel informatique).
– l’indemnisation des personnels administratifs et la prise en charge des frais engagés par les collectivités territoriales pour la mise à disposition des locaux et leur entretien étaient évaluées à 94,5 millions d’euros.
– enfin, les prévisions de dépenses supplémentaires de communication engagées par l’Institut national de prévention et d’éducation pour la santé avoisinaient 12,9 millions d’euros.
● Très tôt, au début du mois d’octobre, grâce à l’obtention pour les vaccins de leur autorisation de mise sur le marché, le coût de l’acquisition des vaccins a pu être revu à la baisse, par l’application d’un taux de taxe sur la valeur ajoutée révisé à 5,5 %, au lieu de 19,6 %.
Coût initial d’acquisition des vaccins
Fabricants |
Spécialités |
Commande initiale (en nombre de doses) |
Caractéristiques du vaccin |
Prix unitaire en euros hors taxes |
Coût total en millions d’euros hors taxes |
Coût total en millions d’euros toutes taxes comprises |
GlaxoSmithKline |
Pandemrix |
50 000 000 |
Multidoses |
7 |
350 |
369,25 |
Sanofi-Pasteur |
Panenza |
28 000 000 |
300 000 monodoses |
6,25 |
175 |
184,63 |
Novartis |
Focetria |
16 000 000 |
5,8 millions de monodoses (avenant notifié le 13 octobre 2009) |
9,34 |
149,44 |
157,659 |
Baxter |
Celvapan |
50 000 |
Multidoses |
10 |
0,5 |
0,528 |
Total |
94 000 000 |
674,94 |
712,06 | |||
Source : données issues de l’Établissement public de réponse aux urgences sanitaires.
● Le 6 juin dernier, la ministre de la santé et des sports a annoncé une nouvelle révision à la baisse du coût final de la campagne de vaccination, l’estimant « entre 490 et 510 millions d’euros » (22), répartis comme suit :
– 420 millions d’euros pour le coût final de l’acquisition des vaccins et seringues (y compris les frais de résiliation des contrats avec les laboratoires), les dépenses de logistique, l’indemnisation des professionnels de santé réquisitionnés et l’envoi des bons de vaccination par l’assurance maladie ;
– et 90 millions d’euros à la charge du ministère de l’intérieur pour la gestion des centres de vaccination.
Cette estimation reste provisoire : en effet, la procédure de résiliation des marchés n’a pas totalement abouti avec l’un des trois laboratoires concernés, d’autre postes de dépenses restant à ce stade évaluatifs, en particulier celui de l’indemnisation des professionnels réquisitionnés pour assurer la vaccination dans les centres.
b) Des résiliations de contrats coûteuses
Le 4 janvier 2010, l’État a notifié à trois laboratoires la résiliation unilatérale de 50 millions de doses de vaccins. Comme l’a expliqué M. Thierry Coudert, directeur général de l’établissement public de réponse aux urgences sanitaires, à la commission d’enquête (23), les marchés publics conclus préalablement avec Sanofi Pasteur et Novartis en 2005 et qui ont été modifiés par un avenant pour la mise au point d’un vaccin contre le virus A(H1N1), étaient régis par les dispositions du cahier des clauses administratives générales dans sa version de 1977 (24), qui prévoient la possibilité d’une résiliation du marché par la personne publique. S’agissant du nouveau contrat signé avec le laboratoire GlaxoSmithKline, comme d’ailleurs pour les deux autres, l’État a utilisé ses prérogatives de puissance publique : la jurisprudence administrative lui reconnaît en effet classiquement un pouvoir de résiliation unilatérale même sans texte et en l’absence d’une stipulation contractuelle expresse (25). En l’espèce, cette résiliation a pu se fonder sur un motif d’intérêt général, d’autant plus évident que le passage à un schéma vaccinal à une injection unique a été entériné le 27 novembre 2009 par l’agence européenne du médicament, alors que la commande initiale tenait compte d’une nécessité de double injection.
L’indemnisation proposée par l’État a été fixée au prorata des quantités non livrées, en l’occurrence 16 % du montant des doses annulées, soit :
– 2 millions d’euros pour le laboratoire Sanofi Pasteur, pour 2 millions de doses annulées, les 9 millions de doses initialement annulées l’ayant été à l’initiative du laboratoire ;
– 10,46 millions d’euros pour le laboratoire Novartis, avec l’annulation de 7 millions de doses ;
– et enfin, 35,84 millions d’euros pour le laboratoire GlaxoSmithKline, pour 32 millions de doses annulées.
Si un accord transactionnel sur l’indemnisation proposée a été acceptée par les deux premiers industriels, les discussions se poursuivent toujours avec le laboratoire GlaxoSmithKline : comme l’a indiqué son président, M. Hervé Gisserot, à la commission d’enquête (26), il souhaiterait obtenir une indemnisation à hauteur des deux tiers de la commande initiale, niveau équivalent à ce qui aurait été arbitré par d’autres États ayant procédé à des résiliations équivalentes, notamment l’Allemagne, le Royaume-Uni, les Pays-Bas, la Belgique et le Japon. Une telle demande équivaut à un montant de 233,33 millions d’euros. Toutefois, d’après la direction générale de la santé, le laboratoire aurait depuis lors formulé une nouvelle proposition pour son indemnisation à hauteur de 108,53 millions d’euros, somme qui reste néanmoins trois fois supérieure à celle avancée par l’Établissement public de réponse aux urgences sanitaires.
Au total, le coût de l’indemnisation pourrait s’élever à 48,3 millions d’euros pour l’Établissement public de réponse aux urgences sanitaires, dans l’hypothèse d’un non recours au contentieux. Or, le coût hors taxes à l’acquisition des 50 millions de doses annulées s’établissait à 358,13 millions d’euros : l’économie réalisée grâce à la résiliation serait donc de 309,83 millions d’euros hors taxes et de 329,53 millions d’euros toutes taxes comprises.
Coût final de l’acquisition des vaccins
Fabricants |
Modification de la commande |
Commande après résiliation partielle |
Montant hors taxes de la commande modifiée |
Montant de TVA payée |
Montant toutes taxes comprises de la commande modifiée |
Montant des indemnisations suite à la résiliation |
Coût final de l’acquisition des vaccins |
GlaxoSmithKline |
–32 000 000 |
18 000 000 |
126 000 000 |
6 930 000 |
132 930 000 |
35 840 000 |
168 770 000 |
Novartis |
–7 000 000 |
9 000 000 |
84 060 000 |
4 623 300 |
88 683 300 |
10 460 000 |
99 143 300 |
Sanofi |
–(9 000 000 (1) +2 000 000) (2) |
17 000 000 |
106 250 000 |
5 843 750 |
112 093 750 |
2 000 000 |
114 093 750 |
Baxter |
– |
50 000 |
500 000 |
27 500 |
527 500 |
– |
527 500 |
Total |
–50 000 000 |
44 050 000 |
316 810 000 |
17 421 000 |
334 234 550 |
48 300 000 |
382 534 550 |
(1) Offre spontanée du laboratoire.
(2) Décision de l’État.
Source : données direction générale de la santé et Établissement public de réponse aux urgences sanitaires.
Le coût final de l’acquisition des vaccins pourrait donc être revu à la baisse : il serait in fine de 382,53 millions d’euros.
La résiliation de 50 millions de doses de vaccins n’a pas réglé le problème de la disproportion entre le nombre de vaccins dont dispose la France et le taux de vaccination de sa population. Cet écart est à l’origine d’un stock important de vaccins, évalué à 20,95 millions de doses.
État du stock de vaccins au 5 mai 2010
(En nombre de doses)
Doses de vaccins livrées par les laboratoires |
44 052 200 | |
Sorties des sites de stockage de l’ÉPRUS |
Établissements de santé |
1 565 700 |
Sorties départements d’outre-mer |
459 600 | |
Sorties centres de vaccination |
9 160 000 | |
Dons à l’Organisation mondiale de la santé |
9 400 000 | |
Sorties officines |
1 277 000 | |
Ministère des affaires étrangères, collectivités et pays d’outre-mer |
858 000 | |
Vente au Qatar |
300 000 | |
Campagne interne des ministères |
83 500 | |
Total |
23 103 800 | |
Stock disponible total au 5 mai 2010 |
Dépositaire ÉPRUS |
18 464 700 |
Répartiteurs pharmaceutiques |
2 483 700 | |
Total |
20 948 400 | |
Stock physique au 05 mai 2010 |
Dépositaires ÉPRUS |
18 464 700 |
Répartiteurs pharmaceutiques |
2 483 700 | |
Don à l’organisation mondiale de la santé en attente d’enlèvement |
3 365 000 | |
Total |
24 313 400 | |
Source : Établissement public de réponse aux urgences sanitaires.
En excluant les dons de vaccins à l’Organisation mondiale de la santé, ceux qui ont été rétrocédés au Qatar et enfin ceux qui ont été mobilisés dans le cadre de la campagne interne des ministères, le nombre de doses mises en distribution sur le territoire s’établit à 13,32 millions. Or, en tenant compte d’une estimation de 5 360 968 personnes vaccinées et de 563 299 personnes qui auraient reçu une seconde injection, soit 5 5924 267 doses utilisées pour la vaccination, le sort de 7 396 015 doses doit être retracé, ce que présente le tableau suivant :
Sort des doses de vaccins non utilisées pour la vaccination
Nombre de doses | |
Doses toujours en place |
3 100 799 |
Établissements de santé |
1 044 947 |
Officines |
1 260 615 |
Autres |
795 237 |
Doses reprises dans les centres |
1 460 320 |
Réintégrées en quarantaine |
836 320 |
Mises au rebut |
624 000 |
Pertes de doses (fautes d’asepsie, bris de flacons, rupture de la chaîne du froid, flacons entamés, etc.) |
2 834 896 |
Total des doses non utilisées pour la vaccination |
7 396 015 |
Source : direction générale de la santé.
Près de 3,46 millions de doses de vaccins auront donc finalement été jetées ou mises au rebut – avec 2,83 millions de doses perdues et 0,62 million de doses mises au rebut –, soit une quantité particulièrement importante, surtout au regard du nombre de personnes finalement vaccinées, puisque le nombre de doses ainsi perdues représente plus de la moitié du nombre des personnes vaccinées : 64,5 %. Cette situation qui met en cause les modalités retenues pour organiser la campagne de vaccination, pose indéniablement problème. Le conditionnement des vaccins, essentiellement présentés en multidoses, joue, à n’en pas douter, un rôle non négligeable dans le niveau de perte constaté : si les contraintes de délais de mise à disposition des vaccins qui ont pesé sur les négociations avec les laboratoires expliquent que les commandes aient principalement porté sur des multidoses, il conviendrait à l’avenir de favoriser, autant que faire se peut, l’acquisition de vaccins en monodose afin de limiter le gaspillage.
Par ailleurs, selon les données fournies par l’Établissement public de réponse aux urgences sanitaires, sur un stock d’un peu moins de 21 millions de doses, la durée de péremption des vaccins se situe entre juillet et octobre 2010 pour un peu de plus de 12 millions d’entre eux, et entre mars et novembre 2011 pour un peu plus de 9 millions de doses. Ces dernières correspondent au vaccin Pandemrix, qui présente un conditionnement séparé de l’antigène et de l’adjuvant. Or, si la durée de conservation de l’antigène est de dix-huit mois, elle est de trente-six mois pour l’adjuvant : ce dernier pourrait donc utilement être sollicité pour être combiné avec un autre antigène dans le cadre d’une autre opération de vaccination. On notera toutefois que ce vaccin est conditionné en boîtes de cinquante flacons de dix doses : son utilisation ne pourra donc a priori être envisagée que dans le cadre d’une campagne de vaccination collective.
S’agissant des doses arrivant à péremption à la fin de l’année, 3,95 millions d’entre elles concerneraient des vaccins conditionnés en monodoses. Une utilisation de ces derniers dans le cadre d’une éventuelle nouvelle campagne de vaccination contre le virus A(H1N1) à l’automne 2010 aurait donc pu être envisagée selon des modalités proches de celle contre la grippe saisonnière, par le biais des médecins généralistes : toutefois, selon les données fournies par la direction générale de la santé, 2,14 millions de ces monodoses arriverait à péremption fin septembre, les 1,81 million de doses restantes étant périmées à l’échéance de fin octobre. L’emploi de ces vaccins serait donc soumis à l’organisation précoce d’une campagne de vaccination saisonnière.
d) Des coûts importants de fonctionnement
Ces coûts sont constitués par l’indemnisation des personnels mobilisés
– professionnels de santé d’une part, personnels administratifs d’autre part –, par les dépenses de fonctionnement des centres de vaccination et enfin par la mise en place du dispositif de suivi et de traçabilité au travers des bons de vaccination.
● L’indemnisation des professionnels de santé s’élèverait à 103,5 millions d’euros. Elle doit être intégralement assumée par l’État.
Cependant, selon les données fournies par la direction générale de la santé, elle pourrait finalement représenter un coût inférieur : en effet, les premières estimations sont fondées sur plusieurs hypothèses, dont la durée de la campagne (onze semaines), le nombre de centres de vaccination (600 centres sur un total de 1 100 centres envisagé initialement), leur dimensionnement et leurs amplitudes horaires, le coût horaire des professionnels de santé dont les barèmes d’indemnisation ont été fixés par arrêté (27), et la composition des équipes de vaccination.
Les durées réelles d’ouverture des centres pourraient se révéler inférieures aux prévisions, de même que la proportion que pourraient représenter finalement les professionnels de santé dans les équipes de vaccination. Une circulaire du 22 mars 2010 adressée aux préfets et aux services fiscaux territoriaux appelle à traiter en priorité le paiement de ces indemnités sur la base des attestations de présence. Celui-ci accuse en effet un important retard : au 20 juin 2010, selon les données fournies par la Caisse nationale d’assurance maladie des travailleurs salariés, les indemnités d’ores et déjà liquidées s’établissaient à 12,36 millions d’euros pour les médecins et infirmiers libéraux réquisitionnés et au 31 mai, elles représentaient 1,47 million d’euros pour les professionnels de santé salariés. Le montant des dépenses sur ce dernier poste est toutefois appelé à évoluer encore sensiblement, les délais de transmission des dossiers par les différents employeurs concernés étant relativement long. Au 20 avril, les personnels indemnisés par l’Établissement public de réponse aux urgences sanitaires l’avaient été à hauteur de 2,8 millions d’euros.
Outre qu’il emprunte des circuits de financement multiples en fonction des catégories de personnels (28), le processus d’indemnisation des professionnels de santé se révèle donc particulièrement long : près de six mois après la fin de la campagne, de nombreux professionnels continuent d’attendre leur rémunération à ce titre, ce qui, au demeurant, rend très difficile toute démarche d’évaluation du coût final sur ce poste. En effet, si celui-ci représentera in fine un montant très certainement inférieur aux prévisions, les données disponibles ne permettent pas de le déterminer précisément : un coût final d’une cinquantaine de millions d’euros semble plausible, bien que légèrement optimiste.
Évidemment, si votre rapporteur comprend les difficultés du processus, il ne peut que regretter les retards de paiement : ils ne sont pas faits pour renforcer la confiance des professionnels de santé dans la politique de santé publique.
● L’indemnisation des personnels administratifs représenterait quant à elle un coût de 68,3 millions d’euros, dont la ventilation est récapitulée dans le tableau suivant :
Dépenses de personnel administratif
(En millions d’euros)
Catégories |
Coût |
Partenaires extérieurs à la fonction publique (notamment associations) |
6,4 |
Fonctionnaires territoriaux (remboursement aux collectivités territoriales) |
21,9 |
Vacataires |
40 |
Total |
68,3 |
Source : direction de la sécurité civile.
● Le fonctionnement des centres de vaccination aurait coûté 23 millions d’euros – 17,3 millions d’euros de frais d’équipement des centres et 5,7 millions d’euros d’indemnisation des locaux.
Mais le coût de la mise à disposition de locaux par les municipalités pourrait en réalité être plus élevé : c’est du moins ce qu’un certain nombre d’entre elles – par la voix de l’association des maires de grandes villes de France – ont fait savoir au ministère de l’intérieur, jugeant les barèmes fixés (29) insuffisants pour couvrir les frais réels liés à leur mise à disposition pendant la durée de la campagne.
● Le coût du dispositif des bons de vaccination est estimé à 48,85 millions d’euros par la Caisse nationale d’assurance maladie des travailleurs salariés.
La caisse a élaboré la formule du bon de vaccination au cours du mois de juillet et a obtenu l’aval du ministère de la santé le 11 août pour sa mise en place. Autorisée à déroger aux règles de mise en concurrence du code des marchés publics en raison des délais très courts qui lui étaient impartis, la caisse a en réalité choisi de gérer en interne l’extraction des données pour des raisons de confidentialité et a passé un marché pour l’exploitation et la remontée de l’information, ainsi que l’élaboration d’une base internet permettant d’assurer le suivi et la traçabilité de toutes les opérations.
La ventilation par poste de dépense du coût total du traitement des bons de vaccination se présente ainsi :
Coût du dispositif des bons de vaccination
(En euros)
Dépenses |
Coût |
Infrastructure, conception et traitement (scannérisation des coupons et stockage des données) |
20 210 351 |
Part ferme |
|
Matériels et logiciels |
6 188 698 |
Conception de la solution |
8 219 176 |
Part variable |
|
Levée de la tranche conditionnelle (initialisation du dispositif de numérisation) |
771 817 |
Numérisation des coupons (coût prévisionnel) (1) |
+ 924 049 |
Hébergement prévisionnel jusqu’à mi-avril 2010 |
3 748 820 |
Conception, développement et mise en œuvre Ameli-coupons |
266 708 |
Conception, développement et mise en œuvre du site internet sécurisé |
1 015 131 |
Dépenses d’éditique |
28 136 957 |
7 000 000 d’affranchissement à 0,31 € |
2 170 0000 |
Solde en affranchissement à 0,41 € |
23 911 785 |
Papier |
398 434 |
Enveloppes |
1 141 117 |
Impression |
515 621 |
Dépenses de routage des coupons |
501 100 |
Fourniture de 200 000 enveloppes « T » |
104 100 |
Acheminement des coupons vers la plateforme de scannérisation |
397 000 |
Total général hors coûts internes |
48 848 408 |
(1) Ce coût prévisionnel n’est pas intégré à ce stade dans le coût final.
Source : Caisse nationale d’assurance maladie des travailleurs salariés.
On observe que les dépenses d’infrastructure, de conception, et de traitement des coupons et des données ont représenté 20,21 millions d’euros au total. Comme l’a indiqué à notre commission d’enquête le directeur de la caisse nationale d’assurance maladie des travailleurs salariés, M. Frédéric van Roekeghem (30), ce marché comportait « une somme ferme pour l’élaboration de la solution », à hauteur de 14,4 millions, « et une part variable, fonction du nombre de coupons réellement exploités ». S’agissant de la part ferme, 6,2 millions d’euros correspondent à la fourniture de matériels qui pourront être réutilisés par la caisse dans ses opérations courantes : le coût réel lié à la conception, au développement et à l’intégration de la solution représente donc 8,2 millions d’euros. La part variable comportait plusieurs unités d’œuvre, dont, notamment :
– l’hébergement, l’exploitation, le stockage et l’accès aux données, pour un coût mensuel de 750 000 euros, soit 3,75 millions d’euros au total ;
– la numérisation des coupons, avec la levée de la tranche conditionnelle correspondant à l’initialisation du dispositif pour 0,78 million d’euros, et par la suite, un prix dégressif au million de coupons, par tranche de vingt millions : seule la première tranche a donc été facturée, pour un total de six millions de coupons à hauteur de 0,92 million d’euros.
Les dépenses d’éditique et de routage des coupons se sont établies à 28,64 millions d’euros.
Il faut ajouter à ces dépenses les coûts de gestion interne des centres éditiques interrégionaux qui traitent les plis postaux des caisses primaires d’assurance maladie, évalués à 2,2 millions d’euros.
e) Les autres dépenses induites par la campagne de vaccination
À l’ensemble des dépenses déjà retracées, il convient d’ajouter :
– les frais induits par les consommables médicaux – seringues et collecteurs, compresses, solutions hydroalcooliques, etc. – pour un montant total de 9,44 millions d’euros à la charge de l’Établissement public de réponse aux urgences sanitaires ;
– le coût des prestations logistiques, qui recouvrent notamment les opérations de distribution effectuées en grande partie par les répartiteurs pharmaceutiques, et qui représentent 21 millions d’euros, comme l’indique le tableau suivant ;
Dépenses logistiques directement liées à la pandémie A(H1N1)
du 24 avril 2009 au 5 mai 2010
(En euros)
Opérations |
Montants |
Service de stockage, de distribution et de gestion des flux de produits |
3 749 203 |
Destruction de produits périmés ou mis en rebut |
100 000 |
Transport de produits de santé |
2 402 487 |
Mise à disposition des plateformes de réception, stockage, déstockage et d’approvisionnement |
9 613 742 |
Ravitaillement des centres de vaccination ou des officines en vaccins et seringues |
1 359 842 |
Ravitaillement des officines en antiviraux et masques |
1 736 116 |
Masques, antiviraux et kits vaccination officines |
2 000 000 |
Opérations de manutention liées à la reprise des stocks retournés |
70 000 |
Total |
21 031 390 |
Source : Établissement public de réponse aux urgences sanitaires.
– la gestion spécifique des déchets liés à la vaccination, qui correspondent à des déchets d’activité de soins à risque infectieux, et qui a mobilisé 1,6 million d’euros ;
– et enfin, les dépenses de communication qui s’élèveraient à 10,13 millions d’euros, et dont le tableau suivant retrace la ventilation pour chacune des instances concernées :
Dépenses de communication relatives à la grippe A(H1N1)
(En millions d’euros)
Structures administratives |
Coût |
Direction générale de la santé et délégation à l’information et à la communication du ministère chargé de la santé |
3,44 |
Institut national de prévention et d’éducation pour la santé |
6,078 |
Service d’information du Gouvernement |
0,612 |
Total |
10,13 |
Source : direction générale de la santé et service d’information du Gouvernement.
*
* *
Le coût total de la campagne de vaccination s’élèverait donc à 668,35 millions d’euros, soit un montant sensiblement plus élevé que les dernières estimations données par la ministre de la santé et des sports et plus proche des données intermédiaires fournies par le direction générale de la santé : en effet, la récente réévaluation à la baisse du coût de la campagne – entre 490 et 510 millions d’euros – tiendrait, d’une part, à la révision des dépenses d’indemnisation des professionnels de santé, dont le ministère estime qu’elles pourraient in fine être ramenées autour d’une vingtaine de millions d’euros et, d’autre part, à la non prise en compte des vaccins donnés à l’Organisation mondiale de la santé, pour un total de 73 millions d’euros. Or, si l’on peut juger admissible la réévaluation du coût des réquisitions – bien que l’estimation finale du ministère apparaisse optimiste –, il est plus difficile de comprendre l’exclusion des dons de vaccins à l’Organisation mondiale de la santé du dispositif global : si ceux-ci n’entrent pas, en effet, dans les frais de la campagne nationale, ils sont bien partie intégrante du coût global lié aux vaccins. Ces derniers n’ont en effet pas été achetés dans l’objectif d’être rétrocédés et leur coût reste bien assumé par la France. En formulant l’hypothèse d’une révision à la baisse du coût final de l’indemnisation des professionnels de santé, à hauteur de 50 millions d’euros, le coût total de la campagne de vaccination s’établirait à environ 615 millions d’euros.
Ce montant est évidemment considérable. Est-il excessif ou déraisonnable ? Votre rapporteur ne le pense pas au regard des enjeux : protéger la population contre un risque pandémique grave – même s’il le fut moins que prévu – et tester pour la première fois dans l’histoire du pays, en grandeur réelle, les moyens de l’État pour faire face à une crise sanitaire d’ampleur. Affirmer, comme certaines personnes auditionnées par la commission, que les sommes dépensées auraient pu être mieux employées ailleurs, c’est faire preuve d’une irresponsabilité dont il est heureux finalement que la France ait eu les moyens, contrairement à de nombreux États, d’éviter le poids historique. Votre rapporteur y reviendra lors de ses développements sur le principe de précaution.
Ces évaluations devraient être affinées par la Cour des comptes dans le cadre des travaux qu’elle mène à le demande du Sénat sur l’utilisation des fonds destinés à lutter contre la pandémie et dont les conclusions devraient être remises en septembre prochain : le Parlement devra y être bien entendu particulièrement attentif.
Le financement de ces dépenses a été assuré par trois canaux : l’État pour la majeure partie des dépenses, l’assurance maladie – pour la mise en place du dispositif des bons de vaccination et pour sa part dans le financement de l’Établissement public de réponse aux urgences sanitaires –, et enfin, une contribution des organismes complémentaires.
Les crédits d’État se répartissent de la façon suivante :
Financement de la campagne de vaccination par l’État
(En millions d’euros)
Autorisation d’engagement |
Crédits de paiement | |
Mission Santé |
450,5 |
531,1 |
Décret d’avance pour l’achat par l’ÉPRUS de masques de protection à destination des autres ministères |
46,2 |
46,2 |
Crédits ouverts en loi de finances rectificative pour 2009 |
404,3 |
484,9 |
- Avance pour le remboursement à l’assurance maladie des frais d’indemnisation des personnels de santé |
50 |
50 |
- Versement à l’ÉPRUS (1) |
352,4 |
433 |
- Dépenses de communication de l’INPES |
1,9 |
1,9 |
Mission Sécurité civile |
100 |
100 |
Ouverture de crédits au titre des dépenses accidentelles et imprévisibles |
15 |
15 |
Décret d’avance pour le financement du fonctionnement des centres de vaccination |
25 |
25 |
Crédits ouverts en loi de finances rectificative pour 2009 pour le financement du fonctionnement des centres de vaccination |
60 |
60 |
Total des crédits ouverts |
550,5 |
631,1 |
Total des crédits après minoration |
450,5 |
532 |
(1) Cette somme initiale a finalement été minorée de 100 millions d’euros en autorisations d’engagement et de 99,14 millions d’euros en crédits de paiement, compte tenu de l’annulation de la commande de 50 millions de doses de vaccins.
Source : rapports annuels de performances des missions Santé et Sécurité civile pour 2009.
L’assurance maladie assume pour sa part le financement du dispositif des bons de vaccination ; s’agissant de la rémunération des professionnels de santé réquisitionnés pour assurer la vaccination, les dépenses engagées par la caisse pour une partie de ces personnels lui sont remboursées par l’État : il conviendra de vérifier que ce remboursement sera bien intégral et ne laissera pas de reste à charge pour l’assurance maladie.
Enfin, le principe d’une contribution exceptionnelle des organismes complémentaires avait été inscrit en loi de financement de la sécurité sociale pour 2010 (31) : assise sur le chiffre d’affaire « santé » de ces organismes, cette contribution, fixée au taux initial de 0,94 %, avait été calibrée de façon à correspondre au montant qu’ils auraient pris en charge au titre du ticket modérateur si les voies normales de remboursement du vaccin avaient pu être utilisées, soit 35 % pour une population couverte par une assurance complémentaire de l’ordre de 93 %. Le taux de cette contribution a, dans un second temps, été revu à la baisse pour être fixé à 0,77 % en loi de finances rectificative pour 2009 (32), afin de tenir compte de la réduction du taux de la taxe sur la valeur ajoutée applicable aux vaccins après obtention de leur autorisation de mise sur le marché et du don de 9,4 millions de doses de vaccin à l’Organisation mondiale de la santé. Le rendement de la contribution, initialement estimé à 300 millions d’euros, a donc été révisé à hauteur de 250 millions d’euros environ. Compte tenu d’un coût final des vaccins plus faible que prévu au regard de l’annulation de la commande de 50 millions de doses, il conviendra d’ajuster le taux de cette contribution lors de la prochaine loi de financement de la sécurité sociale. Il conviendra également de revoir l’affectation du produit de cette recette exceptionnelle : il est en effet censé être versé à la Caisse nationale d’assurance maladie des travailleurs salariés. Or, c’est bien l’Établissement public de réponse aux urgences sanitaires qui a assumé le coût de l’acquisition des vaccins.
B. UN MÊME CONSTAT D’INSUFFISANCE DE LA VACCINATION DANS LA PLUPART DES AUTRES PAYS
Si la campagne de vaccination française peut apparaître comme l’échec d’une entreprise de santé publique, celui-ci est loin d’être isolé. Peu de pays – en dehors de la Suède, du Canada et dans une moindre mesure des États-Unis - ont réussi à mobiliser leur population et à susciter une adhésion massive à la vaccination, alors même que la plupart d’entre eux se sont engagés, comme la France, dans une importante opération d’acquisition de vaccins.
Un tableau en annexe retrace les stratégies vaccinales suivies par quelques États et leurs bilans, bien que ceux-ci soient souvent difficiles à établir, peu de pays ayant procédé à la mise en place d’un dispositif de traçabilité unifié et suffisamment fiable à l’image de ce qui a été entrepris en France.
● La Suède a procédé, à l’été 2009, à l’acquisition de 18 millions de doses de vaccins auprès du laboratoire GlaxoSmithKline. Sur une population de 9,28 millions d’habitants, environ 6 millions de personnes ont été vaccinées, soit 64,5 % de la population. La vaccination a été principalement effectuée dans les centres de santé primaires qui dépendent des conseils régionaux. Toutefois, un grand nombre d’enfants se sont fait vacciner dans les services médicaux scolaires. Les communes ont également participé à la campagne de vaccination par le biais de la mise en place de structures ad hoc, tandis que les hôpitaux ont, pour leur part, aménagé des lieux en leur sein pour assurer la vaccination des personnels hospitaliers et des patients. C’est essentiellement l’organisation du système de soins et la diffusion d’une véritable culture de santé publique au sein de la population suédoise qui permettent de rendre compte du bilan positif de la vaccination contre la grippe A(H1N1) en Suède.
Le passage à une injection unique a conduit les autorités suédoises à demander la suspension des livraisons de vaccins au-delà de 10 millions de doses et à rechercher une solution négociée pour la reprise par GlaxoSmithKline des 8 millions de doses non encore livrées, démarche qui ne semble toutefois pas avoir abouti à ce jour.
● Au Canada, le gouvernement fédéral avait passé une commande générale de 50,4 millions de doses, dans l’objectif de vacciner, avec deux doses par personne, 75 % d’une population qui s’établit à environ 34 millions d’habitants.
En dépit du caractère incertain des données disponibles, ce qui ne laisse pas de surprendre, entre un tiers et 45 % de la population canadienne serait vaccinée, avec une forte disparité selon les provinces. Ainsi, dans les provinces atlantiques, près des deux tiers de la population ont été vaccinés. Cette proportion s’établit à 57 % de la population au Québec et à 40 % pour l’Ontario, tandis que les provinces de l’ouest ont été les moins réactives, avec moins d’un tiers de personnes vaccinées. Ce sont en effet les provinces qui sont compétentes pour organiser la vaccination : les structures de vaccination ont donc varié également selon les provinces, bien qu’elles aient globalement eu recours soit aux médecins traitants, soit aux cliniques publiques, soit à ces deux types de prise en charge pour assurer la vaccination. Il y a vraisemblablement deux facteurs explicatifs du succès de la campagne de vaccination : d’une part, le traumatisme de l’épisode du syndrome respiratoire aigu sévère (SRAS) qui a frappé Toronto au printemps 2003, qui a provoqué le décès de 43 personnes en quelques semaines et a coûté 8 milliards d’euros à l’économie canadienne et, d’autre part, la présence de certains cas particulièrement graves de grippe A(H1N1) dès la première vague de pandémie au printemps 2009.
● Les États-Unis ont procédé à l’acquisition de 229 millions de doses de vaccins sans adjuvant auprès de cinq laboratoires, pour un montant total de 1,5 milliard de dollars. Au terme de la campagne de vaccination, 70 millions d’Américains auraient été vaccinés, soit 23,4 % de la population. Les États fédérés ont organisé la vaccination sur leur territoire : les sites de vaccination retenus ont donc été divers, cabinets médicaux, écoles, centres de santé ou pharmacies. Le bilan relativement satisfaisant tient probablement à la précocité de la pandémie de grippe A(H1N1) aux États-Unis – les premiers cas confirmés l’ayant été en Californie le 24 avril 2009 – et à l’existence d’un vaccin sous forme de spray nasal, dont le mode d’administration est donc considérablement simplifié par comparaison avec un vaccin requérant une injection (33).
On relèvera que les autorités américaines n’ont pas engagé de procédure de résiliation des contrats : leur choix de commandes de vaccins en vrac a en effet allongé la durée de conservation de ces derniers. Ils seront donc intégrés au stock stratégique national et pourraient notamment servir à la fabrication éventuelle du vaccin trivalent contre la grippe saisonnière 2010-2011.
● D’autres pays se sont aussi distingués par un taux de vaccination relativement satisfaisant, de l’ordre de 32,3 % de la population aux Pays-Bas, entre 30 et 40 % de la population en Hongrie et plus de 45 % de la population en Norvège. Mais les populations concernées étaient relativement peu nombreuses ; les problèmes logistiques à régler étaient évidemment moins lourds que dans les « grands » pays.
2. Des résultats tout aussi décevants ailleurs
Dans la plupart des autres États, le bilan est comparable à la France : des commandes considérables, un stock important de vaccins non utilisés, un taux de vaccination qui peine à atteindre 10 % de la population et qui s’établit parfois bien en deçà.
Ce constat vaut pour l’Allemagne, qui a fait l’acquisition de 50 millions de doses de vaccins et préréservé 90 millions de doses supplémentaires avec l’objectif de vacciner la totalité de la population, soit 82,1 millions d’habitants. La campagne de vaccination aura finalement permis de vacciner 8,2 millions de personnes, soit 10 % de la population. Sur la base de la commande ferme, 34 millions de vaccins ont été livrés et 16 millions de doses ont été annulées par les autorités allemandes.
Au Royaume-Uni, 7,4 % de la population aurait été vaccinée, soit 4,54 millions de personnes, pour des commandes initiales de 90 millions de doses auprès de deux laboratoires. Une clause d’arrêt des livraisons en cas de nécessité que contenait l’un des contrats a été activée, mais les autorités britanniques ont néanmoins dû procéder à la résiliation de l’autre commande.
En Belgique, le taux de vaccination de la population serait de 6,6 %, avec un peu plus de 700 000 sujets vaccinés, pour une commande initiale de 12,6 millions de doses, qui répondait à l’objectif de vaccination de 100 % de la population. Devant la faible adhésion de la population, l’État belge a été amené à annuler, en accord avec le laboratoire GlaxoSmithKline, le tiers de sa commande initiale, soit 4 millions de doses, pour un montant de 33 millions d’euros.
En Espagne, les chiffres relatifs au taux de vaccination doivent être pris avec précaution, les données, disparates, émanant des communautés autonomes : on estime qu’entre 1,8 et 2,5 millions de personnes auraient été vaccinées sur une population totale de 46,66 millions d’habitants. Les autorités espagnoles n’ont en définitive acheté que 13 millions de doses : les contrats initialement conclus pour 37 millions de doses contenaient en effet une clause de restitution des vaccins non utilisés.
L’écho de la campagne de vaccination en Italie est encore plus faible : environ 865 000 personnes seulement auraient été vaccinées sur une population de plus de 60,1 millions d’habitants. Or, l’État italien avait procédé à l’acquisition de 24 millions de doses de vaccin : il s’emploierait à demander la conversion des doses restantes commandées mais non livrées en d’autres produits, notamment en vaccins contre la grippe saisonnière.
Bien que les données soient peu comparables, la Chine aurait, quant à elle, commandé 138,7 millions de doses de vaccins auprès de dix entreprises pharmaceutiques nationales, avec pour objectif la vaccination de 10 % de la population au printemps 2010. Le taux de vaccination de la population chinoise atteindrait finalement autour de 6,4 % au 15 mars 2010, avec 85,4 millions de personnes vaccinées. Il resterait à ce jour environ 70 millions de doses non utilisées.
Enfin, rappelons le cas particulier de la Pologne, qui a fait le choix de ne pas organiser de campagne de vaccination contre le virus A(H1N1), la ministre de la santé, Mme Ewa Kopacz, ayant notamment remis en cause devant le Parlement polonais la sécurité des vaccins, pourtant évaluée par l’Agence européenne du médicament. Comme l’a indiqué Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports, devant la commission d’enquête (34), la Pologne avait toutefois engagé des démarches pour l’acquisition de vaccins : il semblerait donc que ses négociations avec les laboratoires n’aient pu aboutir, le Gouvernement polonais ayant jugé les conditions offertes par les groupes pharmaceutiques inacceptables, tant sur le plan tarifaire qu’en termes de restriction du champ de responsabilité des industriels. Comme l’a rappelé la ministre, le système de veille sanitaire polonais présente également des insuffisances : le nombre de cas de grippe saisonnière y semble par exemple largement sous-évalué.
Les initiatives à géométrie variable prises par les États membres de l’Union européenne et les maigres résultats généralement obtenus en termes de vaccination plaident en faveur d’un véritable travail d’évaluation au niveau communautaire.
Proposition n° 1 : Établir un bilan critique au niveau communautaire des campagnes de vaccination menées par les États membres, afin de dégager des pistes d’amélioration pour la gestion de futures éventuelles pandémies grippales.
Comme l’a indiqué M. John Ryan, chef de l’unité « Menaces sur la santé » au sein de la direction générale de la santé de la Commission européenne, à la commission d’enquête, une agence extérieure a été chargée d’analyser les politiques nationales menées en matière de vaccination contre le virus A(H1N1) : ses travaux alimenteront, au début du mois de juillet prochain, les débats d’une conférence qui doit se tenir, sous la présidence belge de l’Union, ainsi qu’un Conseil des ministre informel sur le sujet. La révision du plan pandémique de l’Union européenne, qui date de 2005, pourrait être proposée dans ce cadre.
II.- UNE CAMPAGNE DE VACCINATION PLACÉE SOUS L’ÉGIDE DU PRINCIPE DE PRÉCAUTION
Dans quel contexte d’appréhension du risque se trouvait-on lors du déclenchement de la pandémie de grippe A(H1N1) à la fin du mois d’avril 2009 ? La réponse à cette question est essentielle pour juger du bien-fondé des décisions qui ont été prises par les pouvoirs publics, s’agissant tant de l’acquisition des vaccins que des modalités d’organisation de la campagne de vaccination.
Les réflexions sur la notion de risque distinguent classiquement la prudence, qui concerne des risques avérés et dont on peut évaluer la fréquence d’occurrence, la prévention, qui concerne des risques avérés mais dont on ne peut évaluer la fréquence d’occurrence et enfin, la précaution, qui concerne des risques probables, non avérés et dont la portée n’est pas, en l’état des connaissances scientifiques et techniques du moment, connue. C’est cette dernière modalité d’appréhension du risque qui a été aménagée dans le corpus normatif français avec la loi n° 95-101 du 2 février 1995 relative au renforcement de la protection de l’environnement dite « loi Barnier », et qui a ensuite été érigée en norme constitutionnelle par la loi constitutionnelle n° 2005-205 du 1er mars 2005 relative à la Charte de l'environnement, pour le seul domaine environnemental (35).
Or, le risque constitué avec l’apparition, au printemps 2009, du virus A(H1N1) et sa propagation rapide du Mexique aux États-Unis puis aux autres continents, ne semble pas devoir relever d’une logique de précaution, puisqu’il s’agissait, dès le début, d’un risque avéré. L’invocation de ce principe a pourtant été constante, tant de la part des autorités publiques que des experts qui ont eu l’occasion de s’exprimer sur ce sujet : en effet, si l’existence du risque de pandémie ne faisait pas de doute, les incertitudes étaient telles que les décisions prises par les pouvoirs publics se sont de facto inscrites dans une logique de précaution, cherchant à proportionner la réponse à une situation dont il fallait mesurer l’ampleur et l’intensité nouvelles à chaque instant. Ainsi, M. Didier Tabuteau, conseiller d’État et directeur de la chaire Santé de l’Institut d’études politiques de Paris a-t-il rappelé devant la commission d’enquête (36) que « le principe de précaution est d’abord un principe de proportionnalité ».
Par-delà la querelle des mots, la question qui s’est posée à la commission d’enquête est la suivante : « la réponse donnée par les pouvoirs publics a-t-elle été proportionnée au risque qui est apparu, au moment où elle a été apportée ? ». Or, de ce point de vue, on ne peut nier que les incertitudes concernant la contagiosité, la virulence et les caractéristiques du virus étaient telles au printemps que la décision des autorités publiques de procéder à l’acquisition massive de vaccins, dans l’objectif de pouvoir proposer la vaccination à l’ensemble de la population, n’apparaît pas excessive. Si elle apparaît telle aujourd’hui, c’est précisément a posteriori, parce que les données virologiques et épidémiologiques ont été affinées.
Selon M. Claude Le Pen, professeur de sciences économiques à l’université de Paris-Dauphine (37), la réponse peut également être excessive « par crainte d’une réponse insuffisante ». C’est alors la logique même du principe de précaution qui doit être mise en cause : celle-ci serait immanquablement vouée à l’échec, car « comment proportionner une réponse à un risque inconnu » ? Néanmoins, ici encore, c’est toujours seulement ex post que peut être jugée la décision prise, une fois le risque totalement connu.
Or, un jugement ex post, pour être objectif, suppose d’analyser la décision politique dans le contexte où elle a été prise.
A. DES INCERTITUDES ET DES DOUTES IMPORTANTS QUI ONT COMMANDÉ UNE APPLICATION RESPONSABLE DU PRINCIPE DE PRÉCAUTION
Le contexte d’incertitude dans lequel la principale décision a été prise
– celle de l’acquisition des vaccins, le 3 juillet 2009 – concernait tant le nouveau virus lui-même que la capacité des États à se doter à temps de l’arme du vaccin et d’une stratégie vaccinale.
« Le virus de la grippe est un virus facétieux et trompeur » : c’est par ces mots que le professeur Claude Hannoun, à l’origine en 1950 du premier vaccin antigrippal français, a souhaité rappeler à la commission d’enquête (38) le caractère foncièrement imprévisible de la grippe, qui reste, soixante ans après la mise en point du premier vaccin, relativement mal connue.
Le virus apparu en avril 2009 au Mexique est un variant du virus A(H1N1) déjà connu pour avoir frappé en 1918, mais également en 1957. Le désastre de la grippe espagnole – avec un virus hautement contagieux et pathogène, puisqu’il a provoqué la mort de 20 à 50 millions de personnes dans le monde, même si l’état de santé général et la dénutrition des populations infectées au sortir de la Grande guerre a eu sa part de responsabilité – n’était pas sans susciter les plus grandes inquiétudes lors de l’identification du virus de la grippe A, d’autant plus que la seule certitude, dès le début de la pandémie, concernait la forte contagiosité de ce nouveau virus.
Lors de l’apparition du virus au Mexique, puis de la confirmation le 24 avril 2009 aux États-Unis de sept cas affectés par la souche de virus A(H1N1), les incertitudes étaient donc nombreuses et l’inquiétude alimentée par des informations pour le moins alarmantes. En effet, le Mexique avait déclaré l’état d’alerte nationale le 22 avril et déplorait l’existence de 800 cas d’infection respiratoire souvent sévère ayant entraîné une soixantaine de décès de personnes âgées de 5 à 45 ans, sans que ces cas n’aient toutefois été confirmés. Le 30 avril, en revanche, sur 1 928 cas suspects au Mexique, 99 cas avaient été confirmés virologiquement, ayant abouti à 8 décès. Les données épidémiologiques restaient cependant très parcellaires ; le principe d’une propagation rapide du virus était en revanche établi, puisqu’à cette date, il avait également été identifié en Espagne, au Royaume-Uni, en France, aux Pays-Bas, mais également en Nouvelle-Zélande et en Australie.
Au cours du mois de mai, la propagation du virus sur le continent américain et en Europe a permis de mettre en évidence que, en dehors du Mexique, la majorité des cas étaient bénins, avec une létalité qui semblait se révéler être du même ordre de grandeur que la grippe saisonnière : c’est ce qui a amené l’Organisation mondiale de la santé à qualifier la pandémie de « modérément grave » le 11 juin 2009 lors de sa déclaration de passage en phase 6.
Toutefois, comme l’a indiqué Mme Françoise Weber, directrice générale de l’institut de veille sanitaire à notre commission d’enquête (39), on ne pouvait exclure pendant cette première phase l’hypothèse d’un taux d’attaque plus important et de formes sévères chez des populations jeunes ou chez certaines populations comme les femmes enceintes. C’est en effet au cours de l’été que sont apparus les premiers cas graves ayant nécessité un recours à des soins intensifs.
La moindre virulence du virus A(H1N1) s’est précisée à partir du mois de septembre avec le premier bilan qui a pu être dressé de la phase pandémique dans l’hémisphère Sud. Toutefois, une intensification de l’épidémie lors de son passage à l’hémisphère Nord ne pouvait être exclue, pas plus d’ailleurs qu’une éventuelle mutation du virus.
Ce n’est que dans une troisième phase, à la fin du mois de novembre, qu’il a été possible de déterminer avec plus de précision le taux d’attaque réel du virus.
Celui-ci s’est donc révélé globalement moins agressif et moins létal que ce l’on craignait, avec notamment un nombre de formes asymptomatiques ou peu symptomatiques plus nombreuses que pendant la grippe saisonnière (40). Toutefois, alors que celle-ci frappe très majoritairement les personnes âgées de plus de soixante-cinq ans (90 % des décès dus au virus), les taux d’attaque du virus A(H1N1) les plus importants concernaient les jeunes adultes et les enfants, la protection relative des personnes âgées étant vraisemblablement liée à leur immunisation par le passé par contact avec un virus apparenté. Ainsi, les taux d’hospitalisation les plus élevés ont concerné des enfants de moins de cinq ans et en particulier des enfants de moins d’un an. Entre un quart et la moitié des patients hospitalisés ou décédés et qui étaient infectés par le virus A(H1N1) ne présentaient aucun risque médical connu. Alors que les femmes enceintes ne représentent qu’un à deux pour cent de la population, elles ont constitué, parmi les personnes atteintes par le virus A(H1N1), 7 % à 10 % des patients hospitalisés, 6 % à 9 % des patients en soins intensifs et 6 % à 10 % des décès, avec un risque encore plus élevé au troisième trimestre de grossesse. Un même risque accru a été constaté pour les personnes atteintes d’obésité (41).
Répartition des cas de grippe A(H1N1) par âge
Les jeunes enfants et les personnes âgées ont été relativement moins touchés que les enfants et les jeunes adultes. Le schéma statistique ci-dessous, dont les données proviennent du Canada, se retrouve dans de nombreux autres pays. Les données en provenance des États-Unis montrent que les enfants de moins de cinq ans ont été particulièrement résistants.
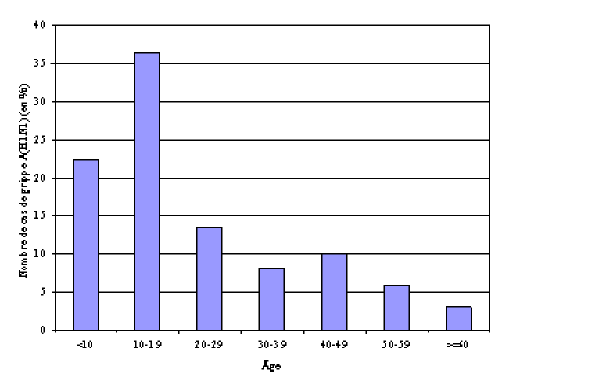
Source : Revue Nature, avril 2010 : « Portrait of a year-old pandemic ».
Une étude américaine (42), publiée un an après le début de la pandémie met en évidence que, si la mortalité directement attribuable au virus A(H1N1) représente moins de la moitié du nombre de décès habituellement liés à la grippe saisonnière, elle a touché beaucoup plus cruellement des personnes jeunes : le nombre d’années de vies perdues se révèle trois à quatre fois supérieur à celui provoqué par un virus H3N2 saisonnier virulent et cinq fois supérieur à une grippe saisonnière classique de type A(H1N1) ou B. Il serait en réalité du même ordre que celui entraîné par la pandémie de grippe de 1968.
Comme l’a rappelé M. Didier Houssin, directeur général de la santé devant la commission d’enquête (43), il convient d’ailleurs de distinguer entre la virulence d’un virus et son taux d’attaque : si la dangerosité du virus s’est révélée assez tôt – dès le mois de mai – à peu près égale à celle d’une grippe saisonnière, son taux d’attaque pouvait néanmoins se révéler plus important, dans la mesure où un virus dont la virulence est faible mais qui touche une proportion importante d’une population non immunisée entraîne mécaniquement un nombre de décès plus élevé. C’est ce taux d’attaque, ou plus exactement les incertitudes l’entourant, et non la virulence du virus, qui a justifié les campagnes de vaccination massive entreprises par de nombreux États.
D’ailleurs, selon les dernières données épidémiologiques publiées par l’Institut de veille sanitaire le 20 avril 2010, 1 334 cas graves et 312 décès ont été notifiés en France depuis le début de l’épidémie. Parmi eux, 273 cas graves et 50 décès sont survenus chez des personnes n’ayant pas de facteur de risque. Selon les chiffres publiés par l’Organisation mondiale de la santé, la grippe A(H1N1) a provoqué le décès de plus de 18 138 personnes dans le monde, données récusant clairement le qualificatif de « grippette » qui a pu être employé.
b) Sur les délais d’obtention des vaccins
Outre les incertitudes pesant sur le virus lui-même, la prise de décision des autorités sanitaires a été fortement contrainte par les délais d’obtention de vaccins que les laboratoires pharmaceutiques ont finalement mis au point en six mois.
C’est l’Organisation mondiale de la santé qui est en principe chargée d’assurer le développement des souches vaccinales, en collaboration avec son réseau international de centres collaborateurs et de la mettre à disposition des fabricants. Or, la livraison de la souche du nouveau virus, initialement prévue le 12 mai par l’organisation, a été reportée à la fin de ce même mois. Celle-ci a parallèlement adressé aux laboratoires des recommandations pour le partage de l’appareil de production entre la poursuite de la fabrication de vaccins bivalents et trivalents contre la grippe saisonnière et la production du nouveau vaccin contre le virus A(H1N1). Les laboratoires n’ont ainsi pu lancer leur processus de production qu’au début du mois de juin 2009, alors que s’engageait déjà une « course aux vaccins » dans la plupart des États.
La forte contrainte pesant sur les délais explique en partie que plusieurs pays européens se soient tournés vers des vaccins produits sur culture cellulaire et non sur œufs : cette technologie permet en effet la mise à disposition de vaccins commerciaux dans des délais beaucoup plus rapides – en général, douze semaines –, comme l’a expliqué devant la commission d’enquête M. Philippe Chêne, président de Baxter France (44). La France a ainsi procédé à une commande d’appoint auprès de ce laboratoire et a pu obtenir la livraison des premières doses dès la fin du mois d’août 2009, qui ont été conservées sur le site français du fabricant jusqu’à l’obtention de l’autorisation de mise sur le marché le 7 octobre.
Plusieurs problèmes ont ensuite dû être progressivement réglés, problèmes qui expliquent les délais pour la disponibilité des vaccins et qui ont donc très largement influencé les négociations menées avec les laboratoires pharmaceutiques et par conséquent, la teneur de commandes finales.
● Une première difficulté a concerné le niveau du rendement de la souche mise à disposition des fabricants : la productivité d’une souche peut en effet varier de 30 à 100 %, comme l’a indiqué M. Jacques Berger, directeur général délégué de Sanofi Pasteur à la commission d’enquête (45). Les fabricants n’ont donc pu s’engager que sur un calendrier de livraison indicatif.
● Le deuxième obstacle a été constitué par les capacités de production du vaccin contre le virus A(H1N1) par les laboratoires pharmaceutiques : ces capacités sont limitées et sont conditionnées par le calendrier de fabrication du vaccin contre la grippe saisonnière. Elles expliquent également que l’essentiel des vaccins ait été fabriqué en multidoses.
M. Jacques Berger, directeur général délégué de Sanofi Pasteur, a ainsi rappelé à la commission d’enquête (46) que son laboratoire, qui couvre environ 40 % des besoins mondiaux en vaccins contre la grippe saisonnière, a dû relever le défi de la production de deux formes de vaccin contre la grippe A(H1N1), avec et sans adjuvant (47), tout en poursuivant la production déjà programmée. C’est pourquoi la production du vaccin saisonnier a été brièvement interrompue en France au début du mois de juin, avec la mise à disposition de la souche virale A(H1N1), pour permettre la production des premiers lots cliniques du nouveau vaccin, ces derniers déterminant le délai d’obtention d’une autorisation de mise sur le marché. Les capacités de production de Sanofi Pasteur n’auraient d’ailleurs pas été équivalentes dans l’hypothèse d’un déclenchement de la pandémie à une autre période de l’année : le laboratoire disposait en effet d’une « fenêtre de tir » entre la fin de la production de vaccin saisonnier pour l’hémisphère Nord et le début de la fabrication du vaccin saisonnier pour l’hémisphère Sud, qui lui a permis de mobiliser , à partir de la fin de l’été, son outil de production pour la mise au point du vaccin contre le virus A(H1N1) (48).
La mise à disposition la plus rapide possible des vaccins a fortement contraint les modalités de fabrication du vaccin et en particulier, son conditionnement. Le choix de doses unitaires aurait sensiblement retardé la livraison des quantités qui avaient été commandées : c’est ce que confirment, unanimement, les représentants des quatre laboratoires pharmaceutiques entendus par la commission d’enquête (49). M. Hervé Gisserot, président de GlaxoSmithKline France, a ainsi indiqué à la commission d’enquête (50) que le principal goulet d’étranglement de la fabrication d’un vaccin pandémique n’est pas la production de l’antigène, mais le remplissage des flacons. Ces capacités limitées associées à une demande importante et urgente ne pouvaient que conduire à privilégier la fabrication de vaccins en format multidoses.
Le directeur général de Novartis vaccins et diagnostics, M. Alexandre Sudarskis, a rappelé (51) que si 65 % des vaccins produits par son laboratoire pour la France ont finalement été livrés en monodoses, les délais de fabrication d’un vaccin sous ce seul conditionnement auraient été nettement plus longs. En l’occurrence, les chaînes de production du laboratoire étaient adaptées à ce type de production ; des unités de remplissage et de conditionnement dans d’autres usines du groupe et chez des fournisseurs tiers ont néanmoins dû être sollicitées. En tout état de cause, il n’aurait pas été envisageable pour les laboratoires d’assurer dans des délais aussi contraints ne serait-ce que la moitié de la production totale d’un vaccin pandémique sous cette forme.
● Le troisième problème a concerné le délai d’obtention de l’autorisation de mise sur le marché des vaccins : l’utilisation des vaccins commandés par la France et l’ensemble des autres États était conditionnée à l’autorisation de l’utilisation de ces produits par les autorités réglementaires compétentes.
Le recours à la procédure de « mock-up », décrite ci-dessous, pour trois (52) des quatre vaccins commandés par la France a en réalité permis la délivrance assez rapide d’une autorisation de mise sur le marché pour ces produits, celles-ci ayant été accordées entre fin septembre et début octobre. Le quatrième vaccin, Panenza du laboratoire Sanofi Pasteur, validé sur la base d’une procédure décentralisée, n’a pu être autorisé qu’à la mi-novembre.
Dans le cadre de ses travaux, la commission d’enquête s’est évidemment interrogée sur la plus grande rapidité de la procédure américaine d’autorisation de mise sur le marché : l’un des vaccins acquis par les États-Unis a en effet pu obtenir sa mise sur le marché dès le 15 septembre. Comme a néanmoins pu le rappeler M. Jean Marimbert, directeur général de l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) devant la commission d’enquête (53), la procédure américaine « comporte une part de pari ». Elle ne s’est en effet pas fondée sur la moindre donnée clinique préalable : mais a autorisé des vaccins pandémiques sur la base d’un raisonnement par simple extrapolation par rapport aux actualisations régulières du virus de la grippe saisonnière. Elle a donc fait le postulat que le virus A(H1N1) se comporterait de manière assez semblable à une souche variante du virus saisonnier habituel.
On peut dès lors considérer que la procédure européenne est parvenue à ménager les exigences de sécurité sanitaire et celle d’une relative rapidité : en effet, pour trois des quatre vaccins concernés, moins de cinq mois se sont écoulés entre les négociations entamées par la France avec les laboratoires et l’autorisation de mise sur le marché dont ont pu bénéficier ces produits. Pour autant, ceux-ci ont été soumis à une procédure parfaitement sécurisée, puisqu’elle s’est fondée, comme pour la procédure de droit commun, sur l’analyse des résultats progressivement obtenus des essais cliniques sur ces vaccins. Parler à satiété de processus « bâclé » relève donc à l’évidence de la désinformation.
Les diverses procédures d’autorisation de mise sur le marché ● La procédure européenne de « mock-up » ou prototype En 2005, dans le cadre de la mise au point de vaccins pandémiques contre le virus H5N1, l’Agence européenne du médicament a introduit une procédure exceptionnelle destinée à permettre de soumettre à son contrôle et à son évaluation des dossiers de vaccins pandémiques prototypes (« mock-up ») – autrement dit, des vaccins maquettes - qui pourraient être utilisés seulement dans le cadre d’une pandémie déclarée, soit un passage à la phase 6 par l’Organisation mondiale de la santé. Une procédure d’évaluation des vaccins dans un cadre habituel, hors de toute situation de pandémie, qui a été menée avec la souche H5N1 par le biais d’essais cliniques, a ainsi permis à trois vaccins d’obtenir un premier feu vert de l’Agence européenne du médicament à la fin de l’année 2008 et au début de l’année 2009. À la suite de la mise à disposition de la souche A(H1N1), la déclaration par l’organisation mondiale de la santé de l’état de pandémie mondiale le 11 juin 2009 et du début de la fabrication du vaccin pandémique H1N1, l’Agence européenne du médicament a procédé à une évaluation complémentaire qui a consisté : – d’une part, à partir des dossiers des vaccins prototypes, à valider le processus de production avec cette nouvelle souche virale ; – et d’autre part, à partir de l’extrapolation des résultats des essais cliniques réalisés avec la souche prépandémique A(H5N1), de donner une autorisation de mise sur le marché pour les vaccins pandémiques fabriqués avec la souche A(H1N1)v. Cette extrapolation repose sur l’idée que si l’on obtient d’une part, un certain niveau d’immunogénicité et d’autre part, un certain profil de tolérance pour un vaccin contre la grippe H5N1, ces résultats pourraient être extrapolés contre une souche pandémique quelle qu’elle soit, en recourant aux mêmes techniques de fabrication et de contrôle et en ne modifiant que l’antigène. Parallèlement, les essais cliniques sur les vaccins produits avec la souche A(H1N1)v ont été analysés au fur et à mesure de leur disponibilité par l’Agence. C’est dans le cadre de cette procédure qu’ont été autorisés trois des quatre vaccins commandés par la France à l’été. L’Agence européenne du médicament a émis le 25 septembre 2009 un avis positif pour deux vaccins (Pandemrix du laboratoire GlaxoSmithKline et Focetria du laboratoire Novartis), l’autorisation de mise sur le marché ayant été accordée par la Commission européenne le 29 septembre 2009. Le vaccin Celvapan du laboratoire Baxter a reçu un avis positif de l’Agence européenne du médicament le 2 octobre 2009 pour une autorisation de mise sur le marché accordée par la Commission européenne le 6 octobre 2009. ● La procédure décentralisée de reconnaissance mutuelle Cette procédure consiste, pour un laboratoire, à déposer un dossier pour l’évaluation d’un produit de santé dans un ou plusieurs États membres. L’un d’eux est alors désigné comme État membre de référence pour l’évaluation du dossier de ce vaccin : ce fut le cas de la France pour l’évaluation du vaccin Panenza du laboratoire Sanofi Pasteur, qui, ne disposant pas d’un dossier prototype « mock-up » qui aurait préalablement été déposé pour un vaccin pré-pandémique H5N1, ne pouvait donc bénéficier de la procédure centralisée. L’instruction du dossier a été réalisée selon une méthodologie homogène avec celle utilisée dans le cadre de la procédure centralisée. Dans le cadre de cette procédure décentralisée commune à plusieurs États-membres, l’Agence française de sécurité sanitaire des produits de santé a ainsi accordé le 16 novembre 2009 une autorisation de mise sur le marché au vaccin grippal pandémique Panenza du laboratoire Sanofi Pasteur. ● La procédure américaine d’autorisation de mise sur le marché La procédure d’autorisation de mise sur le marché des vaccins pandémiques H1N1 suivie par la Food and Drug Administration, autorité en charge de l’évaluation des produits de santé aux États-Unis, s’est également fondée sur un raisonnement par extrapolation. La différence avec la procédure européenne dite de « mock up » tient au point de référence, qui est le dossier clinique développé sur le vaccin H5N1 pour l’évaluation européenne, alors que l’autorité américaine s’appuie principalement sur les données antérieures liées aux vaccins contre la grippe saisonnière. |
L’expérience de la pandémie de grippe A(H1N1) reste en tout état de cause riche d’enseignements : elle a en effet conduit à une mobilisation sans précédent des industriels, qui ont fait preuve dans ce contexte de crise, d’une grande réactivité et d’une véritable capacité d’adaptation de leurs chaînes de production. Elle permet de mettre en évidence l’importance d’un travail commun avec les pouvoirs publics sur la définition des priorités de disponibilité des vaccins : ce travail gagnerait à être mené plus en amont, afin d’évaluer plus précisément les capacités réelles de production des laboratoires pharmaceutiques, ainsi que les contraintes qui pèsent sur leurs chaînes de production en vrac et sur leurs chaînes de remplissage. En l’espèce, il eut été intéressant de déterminer ex ante les capacités de production des industriels en vaccins monodoses et les délais dans lesquels cette production aurait pu être assurée.
Proposition n° 2 : Engager un dialogue avec les industriels afin de mieux évaluer leurs capacités de production et les contraintes pesant sur les modalités de production, en particulier dans le domaine des vaccins.
Les nombreuses incertitudes qui ont entouré, d’une part, les caractéristiques du virus A(H1N1) - tant sa virulence que le moment de son attaque dans l’hémisphère Nord ou son éventuelle mutation – et, d’autre part, la disponibilité des vaccins, conduisent néanmoins à examiner la pertinence de la préstratégie vaccinale retenue par les autorités.
2. Une préstratégie vaccinale visant une protection complète de la population
Pourquoi la France a-t-elle fait le choix de commander 94 millions de doses de vaccins ? Cette décision, prise le 3 juillet 2009 par le Premier ministre, est aisément explicable : il s’agit en revanche de savoir si elle était justifiée.
a) Le choix d’une couverture d’environ 75 % de la population
Une question préalable a été posée de manière récurrente tout au long des travaux de la commission d’enquête : pour quelles raisons le principe d’une double injection a-t-il été entériné pour l’ensemble des vaccins développés contre le virus A(H1N1) ? Ce principe fut en effet déterminant pour expliquer la quantité importante de vaccins dont la France, comme de nombreux autres États, a fait l’acquisition, et le coût final qu’ont représenté les commandes de vaccins, puisque le passage à la recommandation d’une injection unique pour les personnes âgées de cinq ans à cinquante-neuf ans, n’a été annoncé par le Haut conseil de la santé publique que le 27 novembre (54), conduisant ainsi à rendre inutile la moitié des doses acquises.
Comme on l’a vu, trois des quatre vaccins développés contre le virus A(H1N1) ont été autorisés sur le fondement de la procédure de « mock-up », selon une méthode d’extrapolation des résultats des essais cliniques réalisés sur les vaccins maquettes déjà développés contre le virus H5N1. Or, comme l’a indiqué M. Patrick Le Courtois, chef de l’unité « Évaluation avant autorisation pour les médicaments à usage humain » à l’Agence européenne du médicament, entendu par la commission (55), « ces derniers ont été testés entre 2007 et 2009 sur des populations naïves qui n’ont jamais été en contact avec le virus et qui n’ont donc aucune protection immunitaire. Les études ont [alors] montré que deux doses de vaccin étaient nécessaires pour atteindre une réponse immunologique suffisante ». L’autorisation de mise sur le marché des vaccins contre le virus A(H1N1) s’est donc fondée sur un schéma à deux doses, qui n’a pu être réexaminé qu’à l’aune des résultats des premiers essais cliniques, qui n’ont été disponibles qu’à partir du début du mois d’octobre. Une durée d’exploitation progressive de ces résultats a ensuite été nécessaire avant de permettre le passage officiel à un schéma de dose unique (56).
Sous l’hypothèse d’une double injection qui a donc prévalu jusqu’après le lancement effectif de la campagne de vaccination, trois scénarios ont été préalablement envisagés par les pouvoirs publics :
– la vaccination de la totalité de la population, qui nécessitait la commande de 130 millions de doses de vaccins ;
– la vaccination de la totalité de la population de moins de soixante-cinq ans et l’injection d’une seule dose pour les plus de soixante-cinq ans, dans la mesure où ces derniers bénéficient déjà d’une certaine immunité grâce à la vaccination contre la grippe saisonnière, hypothèse qui supposait l’acquisition de 119 millions de doses ;
– et enfin, la vaccination d’une population plus restreinte, se limitant notamment aux jeunes, aux personnes fragiles et aux personnes à rôle critique en cas de pandémie (PARCEP), pour laquelle 60 millions de doses s’avéraient indispensables.
C’est le deuxième scénario qui a été privilégié le 3 juillet, le principe qui a prévalu étant de se mettre en situation de pouvoir proposer la vaccination à toute personne qui le souhaiterait. Avec l’application d’un taux de compliance de 75 % (57), il a donc été proposé d’acquérir 94 millions de doses destinées à la vaccination de 47 millions de personnes.
b) Fallait-il retenir un objectif de vaccination aussi large ?
Afin de déterminer le choix le plus adapté à cette menace de pandémie marquée par de nombreuses incertitudes, les pouvoirs publics ont évidemment sollicité l’avis des instances d’expertise qui les entourent, en l’occurrence du Comité de lutte contre la grippe et du Haut conseil de la santé publique.
Consulté le 8 mai par le directeur général de la santé sur cette question, le Comité de lutte contre la grippe a considéré le 10 mai qu’« une vaccination d’une partie de la population française pourrait être suffisante pour obtenir une réduction très significative de l’impact de la grippe A(H1N1) ». Il reprenait toutefois les recommandations antérieurement émises pour le virus H5N1, selon lesquelles il convenait de disposer d’un vaccin pour l’ensemble de la population (58), et à défaut, de vacciner certaines tranches de la population en fonction de l’efficacité de cette stratégie sur l’évolution de la pandémie.
Lors de son audition par la commission d’enquête (59), le président du Haut conseil de la santé publique, M. Roger Salamon, a rappelé que le premier avis rendu par le Haut conseil sur la pertinence de l’utilisation d’un vaccin contre le virus A(H1N1), rendu le 26 juin, distinguait deux cas :
– en cas de disponibilité d’un vaccin avant le déclenchement de l’épidémie, l’objectif prioritaire serait de vacciner les enfants, et le cas échéant toutes les personnes pouvant être source d’épidémie.
– dans l’hypothèse où le vaccin ne serait disponible qu’après la propagation du virus, la logique qui devrait prévaloir serait la protection, d’une part, des personnes indispensables pour assurer la continuité de l’État, des personnels de secours et des professionnels de santé, et d’autre part, des personnes à risque.
Avis du Haut conseil de la santé publique du 26 juin 2009 (extrait) Après avis du Comité technique des vaccinations, le Haut conseil de la santé publique estime, compte tenu des nombreuses incertitudes concernant aussi bien la maladie que les vaccins ainsi que des potentiels aléas des études de modélisation, ne pas être à même de proposer à ce jour des recommandations concernant la stratégie d’utilisation des futurs vaccins pandémiques A(H1N1)v. Le Haut Conseil de la santé publique souligne, qu’au travers de ces modèles : – la vaccination précoce des enfants représente la stratégie la plus efficace pour enrayer le développement de la pandémie ; – en l’absence de possibilité de vacciner les enfants, la vaccination précoce (dans les 15 jours suivant le début de la circulation active du virus) des adultes de 18 à 60 ans aurait un impact sur l’évolution de la pandémie sous réserve d’une couverture vaccinale rapidement élevée ; – une vaccination décalée des enfants en fonction de l’évolution des AMM pourrait avoir un intérêt ; – toutefois, la mise en place d’une vaccination au-delà de 30 jours suivant le début de la circulation active du nouveau virus A(H1N1)v en France aurait un impact très limité sur l’évolution de la vague pandémique en cours en France, quelle que soit la population ciblée ; – l’intérêt de la vaccination, outre son effet sur l’évolution de la pandémie, doit être évalué par rapport au bénéfice individuel des patients vaccinés : en situation de pandémie installée, le vaccin pourrait garder un intérêt chez les sujets ayant échappé à la maladie (en perspective d’une vague ultérieure), et surtout chez les sujets à risque de grippe sévère, c’est à dire les populations identifiées par le suivi de l’épidémiologie de la pandémie, les femmes enceintes et les personnes actuellement ciblés par les recommandations de vaccination contre la grippe saisonnière. Cependant l’épidémiologie actuelle du virus A(H1N1)v montre que les personnes âgées de 60 ans et plus ne représentent pas une population à risque. |
Il y a en réalité, comme l’a exposé M. Jean-Claude Manuguerra (60), président du Comité de lutte contre la grippe, deux façons d’envisager l’apport du vaccin : un aspect collectif et un aspect individuel, distinction qui rejoint peu ou prou la différence entre la vaccination prépandémique et la vaccination pandémique. Les méthodes de modélisation montrent qu’avant la propagation du virus, la vaccination des populations jeunes et des enfants permet de diminuer l’impact de la pandémie, en réduisant à la fois son intensité, sa circulation et la mortalité dans l’hypothèse où celle-ci serait élevée : dans ce contexte, l’intérêt collectif de la vaccination est évident. Néanmoins, dès lors que la pandémie est déclarée, la vaccination ne peut plus prétendre avoir d’« effet barrière » : son seul intérêt demeure la protection individuelle, et cet intérêt persiste même après le pic de l’épidémie.
On ne peut donc pas se fonder sur le seul argument selon lequel l’arrivée trop tardive du vaccin était connue d’avance pour justifier le recours à une stratégie vaccinale limitée à une petite partie de la population et juger qu’une commande massive de vaccins était foncièrement disproportionnée. La prise en compte de l’intérêt de la protection individuelle ne saurait en effet être balayée d’un revers de la main. Dans son avis du 22 juin 2009, le Comité de lutte contre la grippe considérait déjà que « la mise à disposition des vaccins prépandémiques interviendra vraisemblablement alors que la pandémie grippale sera largement installée. Dès lors, cette mesure apparaîtra davantage comme une mesure de protection individuelle plutôt que comme une mesure de santé publique destinée à enrayer la pandémie (61) ». C’est d’ailleurs l’un des éléments qui l’a amené à exclure le principe d’une obligation vaccinale, que la commission d’enquête juge en effet devoir être écarté dans une situation de pandémie.
Il est dès lors difficile de conclure des recommandations émises par ces instances d’expertise que les autorités ont fait le mauvais choix ou qu’elles auraient pris une décision manifestement excessive : en effet, l’objectif d’être en mesure de proposer la vaccination à l’ensemble de la population ne saurait être fondamentalement contesté. Les Français, si profondément attachés au principe d’égalité, ne peuvent que partager ce raisonnement. De la même façon d’ailleurs, qu’attachés au principe de liberté, ils ne peuvent qu’approuver, à l’instar du Haut comité de la santé publique, le rejet d’une quelconque obligation vaccinale qui a été finalement décidé. Reste néanmoins la question de la commande ferme de 94 millions de doses de vaccins : était-il opportun d’acquérir d’emblée une telle quantité de vaccins ? L’examen des négociations menées avec les laboratoires permet d’éclairer les décisions prises.
B. UNE NÉGOCIATION DES CONTRATS DÉLICATE
Les premiers contacts avec les laboratoires pharmaceutiques ont été noués par la direction générale de la santé à partir du 30 avril : il s’agissait avant tout pour les pouvoirs publics d’évaluer, d’une part, les capacités de production des industriels dans un contexte qui allait rapidement devenir celui d’une « course au vaccin » de l’ensemble des États (62), et de déterminer, d’autre part, quel type de vaccin les laboratoires pourraient produire, et en particulier sous quelle forme et selon quel calendrier. La contrainte temporelle fut en effet un élément décisif du processus de négociation.
1. Des marges de manœuvre réduites
a) Les impératifs d’une négociation rapide permettant de répondre aux besoins identifiés
● Des autorités liées par des contrats prépandémiques
Dans le processus de négociation pour l’acquisition des vaccins contre le virus A(H1N1), la France s’est rapidement trouvée dans une situation difficile.
Elle disposait en effet de deux contrats prépandémiques conclus dans le cadre de la préparation à la pandémie de grippe aviaire A(H5N1) :
– le premier avait été conclu le 29 juillet 2005 avec le laboratoire Novartis qui avait soumissionné à un appel d’offres lancé par le gouvernement français en février et qui portait sur deux lots de vaccins, l’un contre le virus de la grippe aviaire, l’autre contre un virus pandémique mutant. Ce contrat portait sur une tranche ferme de 600 000 traitements contre le virus H5N1 et trois tranches conditionnelles de 12 millions de traitements contre le même virus ou tout autre virus grippal pandémique. Comme l’a rappelé devant la commission (63) M. Alexandre Sudarskis, directeur général de Novartis vaccins et diagnostics, la première tranche a d’ailleurs été exécutée en juin 2009. Au cours du mois de mai 2009, les échanges poursuivis avec la direction générale de la santé ont rapidement permis de mettre en évidence que les capacités de production du laboratoire seraient relativement limitées.
– le second contrat, de même type, conclu avec le laboratoire Sanofi Pasteur le 27 octobre 2005, comportait deux tranches conditionnelles portant chacune sur l’acquisition de 14 millions de traitements vaccinaux contre le virus H5N1 ou tout autre virus grippal pandémique. Or, comme l’a indiqué le directeur général de la santé, M. Didier Houssin devant la commission d’enquête (64), le vaccin Emerflu contre le H5N1 développé par Sanofi Pasteur s’est vu refuser son autorisation de mise sur le marché par l’agence européenne du médicament le 20 mars 2009, réduisant ainsi les espoirs d’une livraison précoce d’un nouveau vaccin contre le virus A(H1N1), dans l’hypothèse d’un affermissement d’une ou des deux tranches conditionnelles de ce marché.
Au regard de ces deux données, les pouvoirs publics ont donc rapidement entériné l’idée qu’il leur faudrait solliciter d’autres acteurs si le principe d’une vaccination large de la population devait être retenu : rappelons en effet que le schéma qui prévalait à l’époque était celui d’une double dose.
● La volonté de conclure rapidement d’autres contrats
C’est dans cet état d’esprit que les pouvoirs publics se sont tournés vers le fournisseur apparaissant le plus avancé dans le processus de préparation de la fabrication d’un vaccin contre le virus A(H1N1), le laboratoire GlaxoSmithKline. Ne disposant à ce stade d’aucun contrat avec ce laboratoire, la marge de manœuvre des autorités sanitaires françaises s’en est trouvée d’autant plus réduite que ce fournisseur s’était dit prêt à s’engager à mettre à disposition de la France 50 millions de doses par livraisons étalées d’octobre à décembre 2009 à condition qu’un engagement ferme soit contracté avant le 12 mai à minuit.
Le feu vert donné par le Premier ministre le 11 mai a ainsi conduit le cabinet de la ministre chargée de la santé à adresser le 14 mai au laboratoire une lettre d’intention portant sur la préréservation de 50 millions de doses du futur vaccin pour un montant 75 millions d’euros (65). La production du vaccin Pandemrix a alors débuté le 22 juin.
Le vaccin développé par GlaxoSmithKline présentait un triple avantage :
– il bénéficiait déjà d’une approbation de l’Agence européenne du médicament pour son dossier de vaccin prototype H5N1, ce qui pouvait donc laisser présager une disponibilité plus précoce du futur vaccin ;
– la présence d’un adjuvant permettait de réduire significativement la quantité d’antigène nécessaire et assurait une meilleure protection, ce qui n’était pas anodin en l’absence d’éléments sur le rendement de la souche A(H1N1) ;
– et enfin, le conditionnement séparé de l’adjuvant et de l’antigène permettrait d’utiliser le vaccin au-delà de la pandémie, ce qui est à ce jour un élément dont il convient de tenir compte pour l’évaluation des stocks de vaccins non utilisés et dans la perspective d’une éventuelle possibilité d’utilisation de l’adjuvant dans d’autres circonstances.
Par ailleurs, des contacts avaient également été noués dès le mois de mai avec le laboratoire Baxter, dans la mesure où son vaccin, Celvapan, produit à partir de la technologie de culture cellulaire, présentait aussi un certain nombre d’avantages spécifiques, comme l’a rappelé M. Philippe Chêne, président de Baxter France devant la commission d’enquête (66) :
– outre le délai de fabrication plus court déjà évoqué, ce vaccin ne comporte pas d’adjuvant et peut donc être proposé prioritairement à certaines populations, comme les jeunes enfants ou les femmes enceintes.
– dans la mesure où il s’affranchit de produits cultivés sur œufs, il constitue une solution particulièrement adaptée dans le cas d’un virus aviaire, mais surtout, en l’occurrence, il convient aux patients allergiques aux protéines d’œufs.
C’est au regard de ces caractéristiques que les autorités sanitaires ont finalement aussi passé auprès du laboratoire Baxter une commande d’appoint de 50 000 doses de vaccins contre le virus A(H1N1).
b) Des contraintes qui ont pesé sur la négociation des contrats
Le 6 juillet 2009, la ministre de la santé et des sports a chargé l’Établissement public de réponse aux urgences sanitaires de mener toutes les actions nécessaires en vue de signer des contrats avec les quatre laboratoires mentionnés ci-dessus, comme l’a indiqué son directeur général, M. Thierry Coudert, devant la commission d’enquête (67). Quatre questions étaient à régler :
● La question des prix pratiqués par les laboratoires
Deux procédures ont été mises en œuvre pour aboutir à l’acquisition des 94 millions de doses de vaccins contre le virus A(H1N1), la première consistant à affermir des tranches conditionnelles prévues dans les deux marchés publics déjà existants et la seconde à conclure deux nouveaux marchés.
L’Établissement public de réponse aux urgences sanitaires a ainsi conclu :
– le 8 juillet 2009 avec le laboratoire Sanofi Pasteur un avenant au marché public initial, prévoyant l’affermissement de sa première tranche conditionnelle à hauteur de 28 millions de doses de vaccins non adjuvantés contre le virus A(H1N1), pour un prix de 6,25 euros hors taxes par dose, soit 175 millions d’euros hors taxes ;
– le 29 juillet 2009 avec le laboratoire Novartis un avenant au marché de 2005, prévoyant l’affermissement de sa première tranche conditionnelle, qui a été ce faisant portée à 16 millions de doses de vaccin contre le virus A(H1N1), pour un prix de 9,34 euros hors taxes par dose, soit 149,44 millions d’euros hors taxes ;
Par ailleurs, deux nouveaux marchés ont été conclus par l’Établissement public de réponse aux urgences sanitaires sous l’empire du 7° de l’article 3 du code des marchés publics, qui instaure une exclusion du champ d’application des dispositions de ce code pour les contrats dont l’exécution doit s’accompagner de mesures particulières de sécurité ou pour lesquels la protection des intérêts essentiels de l’État l’exige, et qui autorise à ce titre la conclusion de marchés sans publicité ni mise en concurrence, ce qui se comprend compte tenu de la situation ;
– le 10 juillet 2009, un marché avec le laboratoire GlaxoSmithKline, conformément à la lettre d’intention adressée le 14 mai, portant sur l’acquisition de 50 millions de doses au prix unitaire de 7 euros hors taxes, pour un montant total de 350 millions d’euros hors taxes ;
– le 10 août 2009, un marché avec le laboratoire Baxter portant sur une commande d’appoint de 50 000 doses au prix unitaire de 10 euros hors taxes, pour un montant total de 500 000 euros hors taxes.
Il convient de signaler que les deux contrats d’affermissement ont été assortis de tranches conditionnelles permettant de porter, en cas de besoin, le nombre total de doses commandées de 94 à 130 millions de doses, – 8 millions de doses supplémentaires pour le marché conclu avec Novartis et 28 millions de doses supplémentaires pour le contrat conclu avec Sanofi Pasteur. Il s’agissait donc bien de se garder la possibilité de proposer in fine la vaccination à l’ensemble de la population, toujours dans la perspective de doubles injections.
Le total des commandes initiales effectuées par l’Établissement public de réponse aux urgences sanitaires s’est donc établie à 94 050 000 doses de vaccins pour un montant de 674,9 millions d’euros hors taxes.
Consulté par le ministère de la santé sur les prix pratiqués par les laboratoires, le président du comité économique des produits de santé, M. Noël Renaudin, a jugé que ceux-ci ne lui semblaient pas abusifs : ils se situent en effet dans une fourchette comprise entre 6,25 euros et 10 euros. Les différences de prix sont principalement liées aux caractéristiques des vaccins : le tarif relativement plus important du vaccin Celvapan du laboratoire Baxter est lié au caractère modeste de la commande, mais également à sa technologie, la culture cellulaire, et enfin, à l’absence d’adjuvant ; le prix pratiqué par le laboratoire Novartis tient à la fourniture, avec le vaccin, du matériel d’injection.
Le contexte international d’une « course aux vaccins » des États n’a bien entendu pas placé les pouvoirs publics dans une position de force pour la négociation des conditions tarifaires de l’acquisition des vaccins : le laboratoire Baxter, qui s’était initialement engagé à fournir 4 millions de doses, a annulé son offre au cours de l’été pour des raisons de production et a ainsi prélevé les 50 000 doses finalement destinées à la France sur ses contrats de réservation préalables, tandis que Novartis a réduit son offre initiale de 24 à 16 millions de doses, preuves que la pression de la demande internationale était particulièrement intense. On doit toutefois souligner que le prix pratiqué par le laboratoire GlaxoSmithKline est équivalent à celui qui a été proposé à ses autres clients européens, dont certains, comme l’Allemagne et le Royaume-Uni disposaient pourtant de contrats de préréservation avec le laboratoire.
● La question de la responsabilité contractuelle des laboratoires
Le processus de négociation des contrats qui a été mené au début de l’été 2009 a achoppé sur un point particulier, celui de la responsabilité des industriels. Ce point a en effet été abordé par la ministre de la santé et des sports lors de la réunion interministérielle du 3 juillet 2009, durant laquelle elle a exposé la clause d’irresponsabilité demandée par les quatre laboratoires dans l’utilisation des vaccins, y compris pour les vices qui tiendraient à la qualité intrinsèque du produit et alors que la vaccination ne présenterait pas un caractère obligatoire. L’État a finalement obtenu de revenir sur cette clause, qualifiée de « scélérate » par la ministre de la santé et des sports (68). L’enjeu de la négociation a donc été, comme l’a indiqué M. Jean Marimbert, directeur général de l’Agence française de sécurité sanitaire des produits de santé (69), de faire prendre en charge cette responsabilité par les laboratoires, tout en se rapprochant du régime de responsabilité défini à l’article L. 3131-3 du code de la santé publique, certes plus favorable aux fabricants, qui prévoit qu’en cas de menace sanitaire grave, ceux-ci ne puissent être tenus pour responsables des dommages résultant de l’utilisation d’un médicament en dehors des indications thérapeutiques ou des conditions normales d’utilisation prévues par son autorisation de mise sur le marché ou de son autorisation temporaire d’utilisation, ou bien celle d’un médicament ne faisant l’objet d’aucune de ces autorisations.
Il est en effet normal, dans les conditions exceptionnelles qui prévalaient, que les laboratoires cherchent à se prémunir contre l’engagement de leur responsabilité dans le cadre des opérations de vaccination et que cette responsabilité soit assumée par l’État, quand bien même les conditions de l’article L. 3131-3 du code de la santé publique n’étaient pas réunies au moment de la signature des contrats (70). Il n’en demeure pas moins qu’il était essentiel de faire assumer aux industriels leurs obligations sur la sécurité intrinsèque de leurs produits. L’absence d’une telle clause n’aurait d’ailleurs fait qu’alimenter les soupçons sur la qualité des vaccins.
C’est la raison pour laquelle, à l’initiative de la France, l’ensemble des États membres de l’Union européenne ont opposé un refus commun à l’introduction d’une clause d’irresponsabilité des laboratoires du fait d’éventuels produits défectueux, comme l’a indiqué M. Didier Houssin, directeur général de la santé, à la commission d’enquête (71) : cette coordination des États a sans aucun doute pesé dans la balance et explique certainement que les laboratoires y aient finalement renoncé. Si la France était restée isolée, elle n’aurait peut-être pas réussi à obtenir gain de cause sur ce point ; néanmoins le partage des responsabilités finalement acquis n’a pas été compris par l’opinion.
● La question des délais de livraison des vaccins
Lors de la réunion interministérielle du 20 mai 2009, un premier calendrier prévisionnel des livraisons des différents vaccins a été présenté par le directeur général de la santé : celles-ci devaient être échelonnées entre octobre et décembre, sauf pour le vaccin Celvapan sans adjuvant et sur culture cellulaire, pour lequel la commande très marginale, devait pouvoir être honorée dès le mois de septembre. En tout état de cause, à cette date, il était clair que le lancement de la campagne de vaccination ne pouvait être opéré avant la fin du mois d’octobre, sous la condition supplémentaire que les vaccins aient bien obtenu à cette date leur autorisation de mise sur le marché.
Il apparaît donc clairement que les conditions, notamment financières, des négociations, étaient largement tributaires des possibilités d’obtenir les vaccins à temps pour qu’une campagne de vaccination puisse être menée avant la fin du pic pandémique – puisqu’il était déjà établi que ceux-ci ne seraient pas disponibles avant la propagation du virus dans l’hémisphère Nord.
Les échéanciers de livraisons, purement indicatifs, figurant dans les contrats conclus avec les fabricants, sont récapitulés dans le tableau suivant.
Calendrier prévisionnel de livraison des vaccins
(En nombre de doses)
Vaccins |
Total des commandes (nombre de doses) |
Hypothèses de rendement de la souche |
Août |
Septembre / Octobre |
Octobre / Novembre |
Novembre / Décembre |
Décembre / Janvier |
Janvier / Février |
Février/ Mars |
Mars / Avril |
Celvapan |
50 000 |
12 000 |
38 000 |
|||||||
Pandemrix (GlaxoSmithKine) |
50 000 000 |
22,5 µg |
4 934 000 |
5 434 000 |
5 434 000 |
5 434 000 |
5 434 000 |
5 434 000 |
17 896 000 | |
34 µg |
7 651 000 |
8 151 000 |
8 151 000 |
8 151 000 |
17 896 000 |
|||||
45 µg |
10 368 000 |
10 868 000 |
10 868 000 |
17 896 000 |
||||||
Septembre |
Octobre |
Novembre |
Décembre |
Janvier |
||||||
Focetria |
Tranche ferme : 16 000 000 |
Hypothèse 1 : ≈30 % |
1 500 000 |
2 500 000 |
4 500 000 |
1 000 000 à 2 000 000 par mois |
||||
Hypothèse 2 : ≈60 % |
3 000 000 |
6 000 000 |
10 000 000 |
2 000 000 à 3 000 000 par mois |
||||||
Hypothèse 3 : ≈100 % |
5 000 000 |
10 000 000 |
16 000 000 |
|||||||
Panenza |
Tranche ferme : 28 000 000 |
Semaine 49 : 10 000 000 |
||||||||
Source : contrats conclus avec les quatre laboratoires.
S’agissant des livraisons effectives, on constate que le retard accusé par rapport aux prévisions initiales est mineur, au moins pour les premières. En revanche, elles ont été finalement plus échelonnées que prévu, le calendrier des livraisons s’étant poursuivi jusqu’après la mi-février 2010 pour deux des quatre laboratoires.
Étalement effectif des livraisons
(En nombre de doses)
GSK (Pandemrix) |
Sanofi (Panenza) |
Novartis (Focetria) |
Baxter (Celvapan) | ||||
Semaines |
Multidoses |
Multidoses |
Monodoses |
Multidoses |
Monodoses boîtes de 10 |
Monodoses boîtes de 1 |
Multidoses |
41 (2009) |
1 072 000 |
||||||
42 |
574 000 |
||||||
43 |
1 315 500 |
||||||
44 |
1 243 500 |
||||||
45 |
|||||||
46 |
1 438 000 |
1 100 000 |
300 000 |
603 200 |
249 820 |
203 362 |
12 000 |
47 |
285 500 |
1 181 700 |
1 003 590 |
||||
48 |
1 676 500 |
529 440 |
|||||
49 |
2 207 500 |
3 300 000 |
871 720 |
190 851 |
|||
50 |
1 052 500 |
1 197 100 |
661 130 |
463 819 |
38 000 | ||
51 |
4 607 700 |
447 320 |
|||||
52 |
734 000 |
1 717 400 |
413 710 |
||||
53 |
739 000 |
3 354 200 |
396 510 |
||||
01 (2010) |
635 000 |
201 700 |
455 570 |
||||
02 |
502 500 |
||||||
03 |
439 500 |
||||||
04 |
934 500 |
||||||
05 |
|||||||
06 |
1 660 50 |
1 777 100 |
|||||
07 |
1 490 500 |
845 300 |
|||||
Total des doses |
18 000 500 |
16 701 700 |
300 000 |
3 183 700 |
5 028 810 |
858 032 |
50 000 |
Total du fabricant |
18 000 500 |
16 701 700 |
9 070 542 |
50 000 | |||
Source : Établissement public de réponse aux urgences sanitaires.
● La question du conditionnement des vaccins
Un autre élément qui, à l’évidence, a joué un rôle non négligeable dans la fixation du prix des vaccins et a constitué un critère que l’État se devait de prendre en compte pour fixer les modalités d’organisation de la campagne de vaccination, a été constitué par les conditionnements. En effet, la plus grande partie des commandes effectuées portait sur une présentation des vaccins en flacons multidoses : le vaccin Pandemix du laboratoire GlaxoSmithKline était présenté en boîtes de 50 flacons de 10 doses d’antigène accompagnés de 25 flacons d’adjuvant, le vaccin Celvapan de Baxter en boîte de 20 flacons de 10 doses et les vaccins Focetria de Novartis et Panenza de Sanofi Pasteur en boîtes de 10 flacons de 10 doses.
Toutefois, ces deux derniers laboratoires ont également mis à disposition des seringues préremplies en monodose en boîtes de dix ou d’une seringue. Il est vrai que le contrat avec le laboratoire Novartis, précisait qu’une partie de sa production serait livrée en monodoses dans la limite de 10 % de la commande. Ce sont finalement près de 5,9 millions de vaccins qui ont été acheminés sous cette forme sur un total d’un peu plus de 9 millions de doses de vaccins finalement livrées. Cette proportion plus importante de conditionnement en monodose correspond à une demande de l’Établissement public de réponse aux urgences sanitaires, notifiée le 13 octobre par un avenant au contrat, que le laboratoire s’est efforcé de satisfaire, comme l’a indiqué M. Alexandre Sudarskis, directeur général de Novartis vaccins et diagnostics, à la commission d’enquête (72).
Cette question du conditionnement est apparue essentielle à la commission d’enquête : elle est en effet à mettre en relation avec les modalités d’organisation de la campagne et la mise en place de centres de vaccination dédiés, dans la mesure où le conditionnement de l’essentiel des vaccins en flacons multidoses fut l’une des raisons avancées pour justifier le choix d’un schéma de vaccination collective. La commission s’est en particulier interrogée sur la date de disponibilité des vaccins monodoses mentionnées ci-dessus : à la fin du mois de novembre, près de 2,3 millions de monodoses étaient disponibles, les 7 millions supplémentaires finalement livrés l’ayant été au cours du mois de décembre. Aurait-on, dès lors, pu envisager une filière de vaccination parallèle, en particulier auprès des médecins généralistes, le cas échéant limitée à certaines catégories de population ? Si une telle hypothèse est théoriquement séduisante a posteriori, elle semblait en tout état de cause difficile à envisager dans la pratique, à partir du moment où l’organisation logistique de la campagne, à travers les centres de vaccination, était d’ores et déjà achevée à la mi-novembre. Un basculement, même restreint, sur de nouvelles modalités de vaccination, ne serait pas apparu cohérent : difficile à organiser en un temps très limité, il aurait eu pour effet de brouiller le dispositif mis en place.
Pour l’avenir, la commission ne peut pourtant que préconiser l’acquisition, autant que faire se peut, de vaccins en conditionnement séparé, et cela, afin de disposer d’une souplesse supplémentaire pour l’organisation de la vaccination. En l’occurrence, les laboratoires entendus par la commission d’enquête ont été unanimes pour reconnaître que les délais impartis pour la fabrication des vaccins contre le virus A(H1N1) ne permettaient pas d’envisager une production qui aurait été totalement ou même majoritairement conditionnée en monodoses : un tel choix aurait en effet reporté la livraison des vaccins à 2010.
2. D’autres options qui auraient été envisageables
Au-delà des contraintes identifiées, d’autres options auraient-elles pu être envisagées ? Ne fallait-il pas ab initio se fixer un objectif de couverture vaccinale moins important ? Et de façon concomitante, ne fallait-il pas procéder à des commandes plus modestes, quitte à en revoir le niveau au regard de l’évolution de la pandémie et du souhait de vaccination des Français ? L’enjeu de ce questionnement est à l’évidence celui de l’adaptabilité des mesures prises par les pouvoirs publics.
a) Un objectif plus souple en termes de couverture vaccinale
La question est double : il s’agit de savoir si une stratégie vaccinale ciblée pouvait être arrêtée dès le départ et, le cas échéant, si un revirement vers une couverture vaccinale plus modeste pouvait être opéré au cours du processus de décision.
● Fallait-il se fixer un objectif plus modeste de couverture vaccinale ?
Selon les avis des experts entendus par la commission d’enquête, une stratégie de vaccination barrière suppose l’immunisation de 30 % de la population (73), ce qui permet d’enrayer la propagation exponentielle d’une épidémie ou d’une pandémie. Ce modèle n’a toutefois jamais été éprouvé dans les faits : aucun pays n’a en réalité jamais appliqué une telle stratégie de vaccination. Pour autant, aucun modèle mathématique n’évoque non plus la nécessité de vacciner la totalité de la population. La stratégie systématiquement retenue est celle du ciblage des populations à risques.
C’est la fixation de telles priorités qui a été demandé au Haut conseil de la santé publique : dans son avis du 7 septembre 2009, celui-ci a ainsi défini un ordre de priorité pour la vaccination en raison des délais de mise à disposition des vaccins :
Avis du Haut conseil de la santé publique du 7 septembre 2009 : (extraits) Il est recommandé de vacciner : • en priorité, les personnels de santé, médico-sociaux et de secours, en commençant par ceux qui sont amenés à être en contact fréquent et étroit avec des malades grippés ou porteurs de facteurs de risque. L’objectif est de protéger le système de prise en charge des malades. Une morbidité importante liée à la pandémie chez ces personnels mettrait en péril la capacité des services de santé et de secours à s’occuper des patients atteints de grippe et d’autres affections engageant le pronostic vital. En outre, ces personnels s’ils sont infectés, pourraient transmettre le virus à d’autres patients vulnérables et être à l’origine de flambées nosocomiales. Il est nécessaire que les services de santé puissent continuer à fonctionner au fur et à mesure du déroulement de la pandémie. • Et par ordre de priorité, les groupes de population détaillés dans le tableau suivant : Groupes de population Priorité Objectifs Femmes enceintes à partir du début du 2ème trimestre 1 Réduire le risque de formes graves et de décès, surtout au cours des deuxième et troisième trimestres de la grossesse Entourage des nourrissons de moins de 6 mois (c’est-à-dire parents, fratrie et, le cas échéant, l’adulte en charge de la garde de l’enfant incluant le personnel de la petite enfance en charge de ces nourrissons : stratégie de « cocooning ») 1 Réduire le risque de formes graves et de décès chez les nourrissons de moins de six mois qui ne peuvent pas être vaccinés Nourrissons âgés de 6 à 23 mois avec facteur de risque 1 Réduire le risque de formes graves et de décès. Ce groupe comprend des nourrissons atteints de pathologies chroniques sévères Sujets âgés de 2 à 64 ans avec facteur de risque 2 Réduire le risque de formes graves et de décès. Ce groupe comprend des personnes atteintes de pathologies chroniques sévères Nourrissons âgés de 6 à 23 mois sans facteur de risque 3 Réduire la transmission et le risque de formes graves et de décès Sujets âgés de 65 ans et plus avec facteur de risque 3 Réduire le risque de formes graves et de décès Sujets âgés de 2 à 18 ans sans facteur de risque 4 Réduire la transmission Sujets âgés de 19 ans et plus sans facteur de risque 5 Réduire le risque de formes graves et de décès * Cette priorité pourra être revue si une absence de sur-risque de décès chez les nourrissons de moins de six mois sans co-morbidité se confirme. ** En fonction des circonstances épidémiologiques et de la disponibilité des vaccins pandémiques (si l’objectif est de contribuer à freiner la dynamique épidémique), ce groupe est susceptible d’être considéré avec un ordre de priorité plus élevé. |
Ces ordres de priorité ont d’ailleurs été très légèrement revus le 2 octobre 2009 par le haut conseil au regard des nouvelles données épidémiologiques et des décisions de l’Agence européenne du médicament.
Toutefois, comme l’a indiqué le professeur Antoine Flahault, directeur de l’école des hautes études en santé publique, concernant le ciblage des populations à risque, « bien que systématiquement utilisée, cette dernière stratégie n’a jamais été évaluée correctement » (74). Des études très controversées sur son efficacité ont d’ailleurs été menées aux États-Unis : la réduction de 50 % de la mortalité des personnes âgées grâce à la vaccination contre la grippe saisonnière n’a jamais été observée statistiquement pendant les vagues épidémiques.
Au total, aucune stratégie de vaccination ne peut a priori être privilégiée plutôt qu’une autre : les données scientifiques sont à cet égard insuffisantes. Il convient impérativement de pallier cette carence pour l’avenir, afin de disposer d’une meilleure capacité d’opérer des choix de santé publique en cas d’apparition d’un nouveau virus pandémique.
Proposition n° 3 : Mettre en place des études épidémiologiques, par un suivi statistique ou de cohortes, lors de toute future campagne de vaccination.
La généralisation d’un suivi épidémiologique à l’occasion des campagnes de vaccination doit se doubler, en aval, d’un même suivi en matière de pharmacovigilance à moyen et long terme. En effet, comme tout médicament, un vaccin entraîne des effets secondaires dont il faut pouvoir mesurer l’ampleur et la gravité.
Compte tenu de l’envergure de la campagne de vaccination contre le virus A(H1N1) sur une période très réduite, un dispositif renforcé de surveillance des effets indésirables de l’utilisation des vaccins a d’ailleurs été mis en place par l’Agence française de sécurité sanitaire des produits de santé dès le mois d’octobre 2009 : ce dispositif permet, outre le signalement par les professionnels de santé, à tout patient de déclarer directement un éventuel effet indésirable.
Dans le cas du virus A(H1N1), le processus de décision a donc bien pris en compte une stratégie de ciblage des populations à risque, mais en la retenant comme un objectif de priorité de l’accès au vaccin, à l’intérieur d’une stratégie plus globale de vaccination de 75 % de la population. La question de savoir s’il convenait de retenir cet objectif initial a quant à elle déjà été discutée.
● Fallait-il commander d’emblée l’ensemble des vaccins ?
Les raisons qui ont conduit les pouvoirs publics à retenir l’objectif d’une couverture de 75 % de la population ont déjà été évoqués : il s’agissait de se mettre en mesure de proposer la vaccination à l’ensemble de la population, et ce choix ne peut fondamentalement être contesté dans le contexte où il a été fait. S’il est irrémédiable au regard du coût d’acquisition des vaccins, ce choix n’est pourtant pas en soi intangible et définitif : il était en effet tout à fait envisageable de prévoir une vaccination massive de la population, et au regard des données épidémiologiques progressivement disponibles, de revoir la cible de vaccination.
Ainsi, l’ordre de priorité recommandé par le Haut conseil de la santé publique aurait-il pu être mis à profit à l’automne par les pouvoirs publics, lorsque des éléments rassurants sur la virulence du virus sont devenus plus tangibles, pour proposer la vaccination à ces publics, tout en rappelant que l’élargissement de la vaccination à l’ensemble de la population restait possible, puisque l’on disposait de vaccins en quantité suffisamment importante.
Le problème qui est ici posé est celui de la réversibilité des décisions politiques et de ses conséquences. Le choix d’un revirement aurait théoriquement tout à fait pu être opéré : il supposait néanmoins de revenir sur le déploiement logistique et l’organisation territoriale qui avaient été privilégiés, avec la mise en place des centres de vaccination dédiés. Le double pilotage du ministère de l’intérieur et du ministère de la santé n’aurait certainement pas facilité une telle remise en cause d’un dispositif déjà largement opérationnel. Mais plus encore, comme l’a indiqué M. Claude Le Pen, professeur de sciences économiques à l’université Paris-Dauphine : « Quant à changer de politique en cours de route, c’est très difficile. La tentation d’un gouvernement est de rester droit dans ses bottes, de peur de troubler davantage l’opinion publique en changeant de politique ».
b) Des contrats plus facilement modulables
Le problème de la révision, en cours de route, de la stratégie vaccinale ne règle pas celui, essentiel, du coût de l’opération pour les finances publiques. En effet, une fois que les vaccins étaient commandés et les contrats signés, l’engagement financier était réalisé, et la révision à la baisse du coût de l’acquisition des vaccins n’a pu être effectuée que par le biais d’une part des reventes de doses – qui ont été très marginales, puisqu’elles ont concerné 380 000 doses au total – et, d’autre part, par la résiliation unilatérale d’une partie des commandes non livrées, à hauteur de 50 millions de doses. L’indemnisation des industriels, par laquelle passe cette résiliation, est, comme on l’a vu, elle-même coûteuse : elle ne correspond pas à une pure et simple annulation sans frais.
Dès lors, il semble essentiel de revoir la politique de contractualisation de l’Établissement public de réponse aux urgences sanitaires pour l’acquisition de traitements, de produits de santé et de matériels.
L’article 72 (75) du code des marchés publics prévoit déjà la possibilité de passer des marchés à tranches conditionnelles, et cette procédure est largement utilisée pour les produits de santé, dispositifs médicaux et matériels gérés par l’établissement au sein de ce que l’on appelle le « stock national santé » : rappelons que deux des quatre contrats portant sur l’acquisition de vaccins contre le virus A(H1N1) ont consisté dans des avenants portant affermissement de tranches conditionnelles de marchés conclus préalablement, en 2005. Ces avenants ont d’ailleurs prévu de nouvelles tranches conditionnelles, pour l’acquisition éventuelle de 36 millions de doses supplémentaires, ce qui aurait porté le total des commandes à 140 millions de doses de vaccins.
L’enjeu est donc de déterminer si l’établissement aurait pu revoir à la baisse le niveau des tranches qui ont été affermies avec Novartis et Sanofi Pasteur, et prévoir un niveau de commandes inférieur pour le nouveau contrat conclu avec GlaxoSmithKline, le dernier contrat, d’appoint, signé avec Baxter ne représentant qu’un très faible volume de traitements. Une telle méthode aurait permis d’éviter le coût lié à la résiliation unilatérale des trois contrats – 48,5 millions d’euros – sans compter les honoraires d’avocats qu’elle a impliqués, à hauteur de 300 000 euros pour l’Établissement public de réponse aux urgences sanitaires.
Si une telle option apparaît raisonnable et doit évidemment être recommandée, le contexte dans lequel les négociations ont été menées n’a pas permis à la France de procéder à de telles commandes graduées. En effet, alors qu’elle ne disposait pas d’un contrat de préréservation avec le laboratoire GlaxoSmithKline, ce dernier a clairement refusé de s’engager à produire 50 millions de doses de vaccins en l’absence d’un engagement ferme de l’État : c’est ce qui ressort tant du compte rendu de la réunion interministérielle du 11 mai 2009 que des auditions des industriels menées par la commission d’enquête (76). Un même refus a été opposé par Novartis concernant la première tranche qui a finalement été affermie à hauteur de 16 millions de doses. Autrement dit, soit la France souhaitait acquérir une quantité importante de vaccins pour pouvoir être en mesure de proposer la vaccination à l’ensemble de la population et alors elle ne pouvait envisager de procéder à des commandes modulables ou révisables, soit son engagement ferme portait sur de moindres quantités, et elle n’était alors pas assurée de pouvoir procéder à des commandes complémentaires en cas de besoin, les trois laboratoires concernés lui ayant fait savoir que dans cette hypothèse, les livraisons ne pourraient être effectuées avant 2010. Rappelons que Sanofi Pasteur a produit des vaccins contre le virus A(H1N1) pour vingt-deux pays au total, et que GlaxoSmithKline a été sollicité par une très grande partie des pays acquéreurs de vaccins et a approvisionné, outre la France, le Royaume-Uni, l’Allemagne et les États-Unis.
Proposition n° 4 : Favoriser le recours aux marchés à tranches conditionnelles dans toute situation de crise sanitaire et, en particulier, pour l’acquisition des produits de santé et matériels destinés à alimenter le « stock national santé ».
Cette préconisation n’a cependant de sens que sous la condition que les États ne se trouvent pas dans un rapport de forces qui leur serait durablement défavorable face aux laboratoires. Or, de ce point de vue, on constate un manque de coordination évident entre les États, et en particulier au niveau européen. Chaque État s’est lancé, sans coordination avec aucun autre État, dans une « course au vaccin » : la commission d’enquête a ainsi établi que les pouvoirs publics français n’ont eu, à aucun stade de la négociation avec les industriels et jusqu’à la signature des contrats, une idée des prix pratiqués par les laboratoires vis-à-vis des autres pays ni des quantités commandées par ces derniers. Comme l’a d’ailleurs reconnu la ministre chargée de la santé, « le désordre européen dans le processus global de négociation a finalement coûté cher (77) ». La mise en place d’une stratégie d’achats mutualisée au niveau communautaire doit donc être plus que jamais recherchée : une approche commune d’acquisition de vaccins et d’antiviraux est d’ailleurs aujourd’hui étudiée par la Commission européenne, comme l’a indiqué M. John Ryan, chef de l’unité « Menaces sur la santé » au sein de la direction générale de la santé de la Commission européenne. Sans aller jusqu’à une commande consolidée qui pose clairement un problème financier aux États membres, un travail coordonné aurait, à l’avenir, l’avantage d’atténuer la position de force des laboratoires dans le contexte de déclenchement d’une éventuelle nouvelle pandémie.
Proposition n° 5 : Promouvoir, au niveau communautaire, une meilleure coordination entre les États membres en matière de gestion de crise sanitaire et la mise en place d’une stratégie mutualisée d’achats de vaccins.
Une dernière question peut toutefois être posée : ne fallait-il pas envisager une éventuelle renégociation des contrats avant la résiliation unilatérale décidée le 4 janvier ? En effet, après que le Haut conseil de la santé publique a entériné le passage à une injection unique pour la vaccination, c’est au début du mois de décembre que le ministère de la santé a semblé anticiper un excès de stocks de vaccins, et a ainsi commencé à envisager des scénarios alternatifs, comme celui de la cession d’une partie de ces vaccins. Les possibilités de revente de vaccins à d’autres États apparaissaient toutefois maigres, au regard de la situation sanitaire dans laquelle se trouvaient la plupart des pays, avec le constat d’une faible virulence du virus et le passage à une seule injection pour immuniser la population. Dès lors, seule l’annulation d’une partie des commandes s’offrait comme une issue sérieuse : le laboratoire Sanofi a d’ailleurs proposé spontanément au ministère la réduction de 9 millions de doses de la commande initiale vraisemblablement le 23 décembre 2009, comme l’a indiqué son directeur général délégué, M. Jacques Berger à la commission d’enquête (78). On peut dès lors émettre l’hypothèse qu’une résiliation plus précoce – tout au plus d’un mois – aurait permis de réduire le stock de vaccins non utilisés même si elle n’aurait en tout état de cause pas entraîné de gain financier considérable, dans la mesure où résiliation entraîne indemnisation des industriels. Une renégociation en bonne et due forme des contrats, permettant à l’État de renoncer, avec l’accord des laboratoires, à une partie des acquisitions, restait en tout cas, malheureusement, peu envisageable.
Une certaine souplesse des contrats, bien que très théorique en l’espèce, aurait donc permis de limiter le coût financier de l’opération : la principale leçon de l’expérience de la campagne de vaccination, sur le plan financier, reste celle de la nécessité de se ménager des marges de manœuvres, afin de pouvoir se réadapter plus facilement aux nouvelles connaissances et aux changements dans l’évolution de la pandémie. Pour reprendre les mots du directeur général de la santé, M. Didier Houssin devant la commission d’enquête (79), il convient de se donner les moyens de « débrayer », de « freiner » lorsque la situation l’exige. Telle est bien d’ailleurs la seconde dimension du principe de précaution tel qu’inscrit dans la Charte de l’environnement de 2004 (80), celle d’une réponse graduée : comme l’a indiqué M. Didier Tabuteau devant la commission d’enquête (81), « la réévaluation permanente des décisions est une nécessité et cette capacité de se remettre en cause à mesure qu’évoluent les connaissances est la meilleure manière d’appliquer l’obligation de précaution ».
Une telle riposte graduée est d’ailleurs tout aussi impérative sur le plan de l’organisation de la réponse à la crise sanitaire, en l’occurrence l’organisation de la campagne de vaccination.
III.- UNE CAMPAGNE DE VACCINATION VOLONTARISTE
MAIS D’UNE APPLICATION TROP RIGIDE
Les pouvoirs publics ont voulu apporter une réponse ambitieuse et volontariste à la pandémie en proposant une vaccination massive. Ils se sont pour cela appuyés sur un dispositif déjà préparé et dédié à la lutte contre les menaces sanitaires graves et notamment la grippe aviaire A(H5N1). Mais, sur certains points, celui-ci s’est révélé inadapté pour contrer une pandémie de moindre sévérité.
En outre, le choix de procéder à une vaccination collective a conduit à mettre en place un système de vaccination reposant sur des centres ad hoc faisant l’impasse sur la médecine ambulatoire. Ce choix a pu être contesté et s’est révélé parfois d’une application délicate sur le terrain. Surtout, il n’a pas permis de remporter le défi d’une couverture vaccinale importante de la population.
A. UN DISPOSITIF MÛREMENT RÉFLÉCHI POUR DES MENACES SANITAIRES GRAVES
Les outils disponibles pour lutter contre une pandémie grippale, tant au niveau international que national, sont tous issus de la volonté de répondre à des menaces particulièrement graves. Au vu de l’expérience, la question de leur adéquation à la gestion d’une pandémie de moindre sévérité mérite aujourd’hui d’être posée.
1. Un plan de lutte contre la pandémie issu des dispositifs de lutte contre la grippe aviaire A(H5N1)
La France est un des pays les mieux armés pour faire face à un risque de pandémie grippale grave grâce à son plan de prévention et de lutte spécifiquement dédié à cette menace. Celui-ci est étroitement lié au plan mondial de préparation à une pandémie de grippe de l’Organisation mondiale de la santé, lui-même conçu en lien avec le règlement sanitaire international.
a) Le règlement sanitaire international, instrument juridique contraignant mais indispensable
● Le règlement sanitaire international, un cadre de référence essentiel
Le règlement sanitaire international a été adopté par l’Assemblée mondiale de la santé en 2005 et est entré en vigueur le 15 juin 2007. Juridiquement contraignant pour les cent quatre-vingt-quatorze États parties, il prévoit plusieurs étapes dans l’action des pouvoirs publics en cas de menace pandémique. En particulier, son article 6 impose aux États de notifier à l’Organisation mondiale de la santé, « dans les vingt-quatre heures », « tout évènement (…) pouvant constituer une urgence de santé publique de portée internationale (82) ». Cette obligation concerne en particulier les cas de « grippe humaine causée par un nouveau sous-type ».
Le directeur général de l’organisation doit alors déterminer si l’événement en cause constitue effectivement une urgence de santé publique de portée internationale. Il décide également, en application du plan mondial de préparation à une pandémie de grippe, des phases de pandémie mondiale, le niveau 6 correspondant à la phase d’alerte maximale. Rappelons que l’organisation n’a en aucune façon le caractère de gouvernement sanitaire mondial et n’impose donc pas aux États de prendre des mesures spécifiques : elle émet simplement des recommandations valables pour tous les pays, ceux disposant de systèmes de santé publique éprouvés comme ceux qui en sont dépourvus et pour lesquels un niveau d’alerte élevé implique par exemple plus d’actions publiques. La déclaration de la phase de pandémie n’emporte pas d’obligation pour les États mais constitue un cadre de référence essentiel pour qu’ils puissent coordonner leurs actions afin de faire face à la crise sanitaire.
Par ailleurs, l’Organisation mondiale de la santé joue un rôle fondamental en cas de pandémie émergente puisque c’est elle qui choisit la souche devant être utilisée pour les vaccins pandémiques, la met à disposition gratuitement auprès des laboratoires pharmaceutiques et annonce si elle recommande de passer ou non de la production de vaccins saisonniers à celle de vaccins pandémiques.
● Un règlement à faire évoluer sur certains points
En application des lignes directrices révisant le plan mondial de préparation à une pandémie de grippe du mois d’avril 2009, et conformément au règlement sanitaire international, « dès que possible, l’OMS fournira une évaluation de la gravité de la pandémie », évaluation qui doit être menée au moyen d’une graduation en trois points (bénigne, modérée, grave).
Cette phrase est loin d’être anodine, car de nombreuses critiques ont été émises quant à la définition même de la pandémie par l’organisation, qui aurait été expurgée de toute notion de gravité lors de la révision du plan mondial. Cette interprétation est contestée par l’organisation qui fait valoir que ces éléments figuraient dans des documents annexes.
Il est en l’état difficile de trancher sur la question de savoir si la gravité a, un jour, constitué un critère de définition de la pandémie, d’autant plus que la commission d’enquête n’a pu auditionner de représentant de l’organisation pour être éclairée, comme votre rapporteur l’a indiqué ; ce qui importe est de constater qu’en application du nouveau plan mondial, la déclaration de pandémie est indépendante de la sévérité constatée de la maladie et qu’elle repose essentiellement sur les critères de contagiosité du virus et de sa diffusion géographique. Ce n’est qu’en addition de la déclaration de pandémie que l’organisation en évalue la gravité, et c’est d’ailleurs ce qu’elle a fait pour la grippe A(H1N1), la qualifiant de « modérée » dès le 11 juin 2009.
La question est aujourd’hui la suivante : face à une pandémie dont on estime qu’elle est probablement peu sévère, est-il pertinent de recourir à « l’artillerie lourde », à savoir le passage et le maintien, au niveau international, au niveau d’alerte 6 ? De l’avis de tous les intervenants auprès de la commission d’enquête, la réponse est négative. Il convient donc de revoir la définition de la pandémie et cette approche est d’ailleurs partagée au niveau européen, comme l’a souligné M. John Ryan, chef de l’unité « Menaces sur la santé » au sein de la direction générale de la santé de la Commission européenne (83), qui a en outre insisté sur la nécessité d’une approche concordante de cette question par l’Union européenne et l’Organisation mondiale de la santé.
Proposition n° 6 : Œuvrer pour que les États membres adoptent une position commune, appuyée par la Commission européenne, afin de demander à l’Organisation mondiale de la santé une révision de la définition de la pandémie intégrant un critère de gravité.
b) Au plan national, un arsenal prévu pour des menaces sanitaires graves
La France dispose de plusieurs instruments pour faire face à une pandémie : ceux prévus par la loi n° 2007-294 du 5 mars 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur et le plan national de prévention et de lutte contre la pandémie grippale.
● La loi de 2007 : des moyens humains et logistiques au fonctionnement satisfaisant mais à renforcer
La loi du 5 mars 2007 précitée a constitué une étape importante pour doter la France de moyens opérationnels de gestion des pandémies. Elle a en particulier créé l’Établissement de préparation et de réponse aux urgences sanitaires, qui a joué un rôle essentiel dans la campagne de vaccination : il lui revient en effet, à la demande du ministre chargé de la santé, d’acquérir, fabriquer, importer, distribuer et exporter des produits et services nécessaires en cas de crise sanitaire.
Il a donc connu, avec la grippe A(H1N1), son « baptême du feu », pour reprendre les termes de M. Thierry Coudert (84), son directeur, puisqu’il a dû acquérir les vaccins et articles consommables, prendre en charge les vaccins fournis par les fabricants et concevoir un dispositif logistique pour les stocker et les distribuer. L’établissement a également procédé aux modifications unilatérales de contrat demandées par la ministre chargée de la santé.
Quel bilan tirer de son action ?
Nous ne reviendrons sur la question de la négociation des contrats, largement évoquée plus haut et dont on a vu le peu de marges de manœuvre qu’elle présentait, que pour souligner deux points. En premier lieu, l’établissement était relativement contraint puisque, comme l’a rapporté son directeur à la commission d’enquête (85), les premières discussions avec les fabricants de vaccins avaient été menées par le ministère de la santé et des sports afin de déterminer leur capacité à répondre aux besoins français dans des délais et conditions satisfaisants. Des lettres d’intention non contractuelles avaient été adressées aux laboratoires sans que l’établissement n’ait participé à cette étape.
N’aurait-il pas été préférable d’associer, dès le départ, l’établissement aux décisions prises par son autorité de tutelle afin qu’il ne soit pas simplement « mis devant le fait accompli » ? Sans remettre en question la primauté qui doit évidemment revenir à la décision politique, on peut penser que l’efficacité de l’action de l’établissement passe aussi par sa participation, dès le début de la crise, aux négociations, y compris non contractuelles, ne serait-ce que pour l’affirmer pour la suite des négociations comme interlocuteur naturel des fabricants de vaccins et faciliter son action ultérieure.
En second lieu, il est regrettable que cet établissement n’ait manifestement pas disposé des ressources et compétences nécessaires pour mener les négociations. En effet, ainsi que l’a rapporté M. Thierry Coudert à la commission d’enquête (1), il a fallu recourir aux services M. Noël Renaudin, président du Comité économique des produits de santé et spécialiste en matière de fixation des prix des médicaments afin qu’il fournisse des éléments de comparaison internationale sur le prix des vaccins. Une telle situation n’est pas satisfaisante : la structure chargée de négocier des commandes doit pouvoir compter sur ses propres compétences pour mener efficacement sa mission.
Au-delà de ces observations, on peut relever un réel motif de satisfaction : pour ce test « en grandeur nature », l’établissement s’est globalement bien acquitté de ses missions logistiques comme l’ont constaté plusieurs personnes auditionnées par la commission. Sa qualification d’établissement pharmaceutique a, à cet égard, constitué un réel atout.
Mandaté pour délivrer les vaccins, l’établissement s’est acquitté de cette tâche avec efficacité, même si, ici ou là, quelques dysfonctionnements ont pu être observés qui ont nécessité des ajustements mineurs : par exemple, des centres de vaccination ont été bien pourvus en vaccins mais pas en articles consommables, ou bien quelques tensions résiduelles liées à de légers retards dans les livraisons se sont fait jour. Cette réactivité logistique doit être saluée : n’oublions pas que c’était la première fois que l’établissement devait faire face à une opération d’une telle envergure. Il a su faire la preuve de son utilité dans des situations de crise sanitaire.
Proposition n° 7 : Renforcer le rôle de l’Établissement de préparation et de réponse aux urgences sanitaires en l’associant en amont à la prise de contact avec les laboratoires et aux prénégociations.
Proposition n° 8 : Renforcer les moyens de l’Établissement de préparation et de réponse aux urgences sanitaires en matière d’expertise du prix des produits de santé afin d’accroître son efficacité dans les négociations.
● Le plan de prévention et de lutte contre la pandémie grippale, un dispositif à assouplir et préciser
L’élaboration de ce plan avait été confiée au secrétariat général de la défense nationale (86) en raison de son caractère interministériel. Arrêté au mois d’octobre 2004, il a depuis été révisé quatre fois et la pandémie de grippe A(H1N1) a donné lieu à l’application de sa dernière version, en date du 20 février 2009.
La France a été l’un des tous premiers États à se doter d’un tel instrument, mais ce choix a été partagé par un grand nombre d’autres pays. L’Organisation mondiale de la santé recense ainsi plus de trente plans nationaux sur divers continents : en Asie, sur le continent américain, en Europe, en Océanie ou en Afrique. La qualité du plan français a cependant été soulignée par de nombreuses instances : il a ainsi bénéficié d’une appréciation très positive de la London school of hygiene and tropical medicine, et son évaluation par la Commission européenne et le Centre européen pour la prévention et le contrôle des maladies a permis de souligner l’atout que constitue son caractère intersectoriel.
Sa toute première application a néanmoins permis de constater qu’il n’était pas exempt de quelques défauts et qu’en particulier, il était peu adapté à la gestion d’une pandémie de gravité modérée. Ce plan serait-il alors la première victime de la pandémie de grippe A(H1N1) ?
Certes, selon M. Francis Delon, secrétaire général de la défense et de la sécurité nationale (87), « contrairement à ce que l’on entend parfois, il ne s’agit pas d’une mécanique implacable mais d’un instrument très flexible », d’une « boîte à outils » comme l’a appelé M. Didier Houssin, directeur général de la santé lors de sa seconde audition (88). D’ailleurs, les pouvoirs publics ont su adopter des mesures d’adaptation tout au long de la gestion de la pandémie, comme l’a souligné Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports (89).
Mesures d’adaptation prises tout au long de la gestion de la pandémie
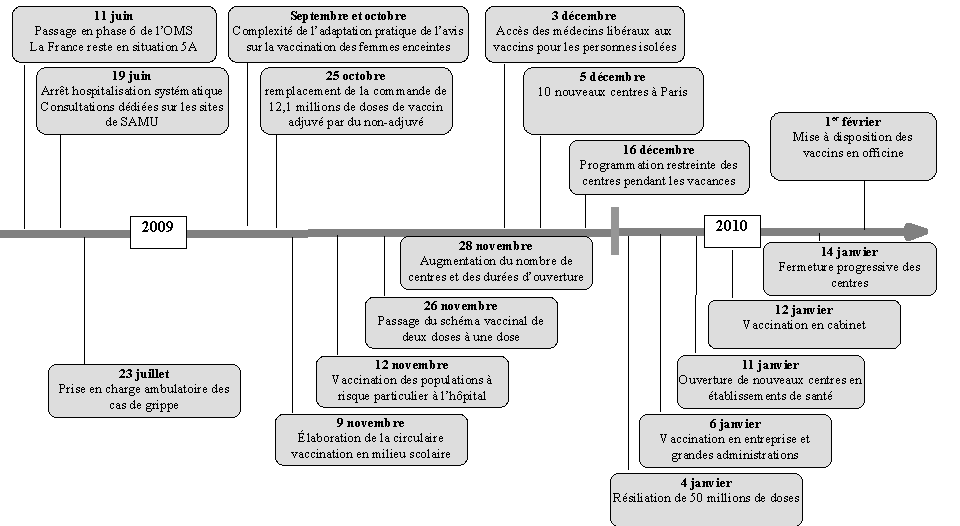 Source : Ministère de la santé et des sports.
Source : Ministère de la santé et des sports.
Toutefois, l’affirmation de la flexibilité du plan mérite d’être nuancée. Il a indiscutablement été une « boîte à outils » très précieuse en période prépandémique. Son caractère intersectoriel a sans doute permis d’élaborer au début de la crise une stratégie d’endiguement tant dans le domaine des transports qu’en milieu scolaire, et a également permis aux administrations, grandes entreprises et collectivités de se mettre en ordre de bataille en cas de pic pandémique grave, en élaborant des plans de continuité d’activité.
Mais l’étroite corrélation des situations définies par le plan français avec les phases d’alerte déclarées par l’Organisation mondiale de la santé, dont on a vu que leur définition devrait être revue, n’a, à l’évidence, pas constitué un facteur de souplesse pour gérer la crise et les Français ont indéniablement perçu l’application du plan comme excessivement rigide malgré les adaptations dont elle a fait l’objet.
Phases de pandémie grippale définies par l’Organisation mondiale de la santé
et par le plan français de prévention et de lutte contre la pandémie grippale
Phases définies par l’Organisation mondiale de la santé |
Situations du plan français | |
Période à transmission animale prédominante | ||
Phase 1 |
Pas de nouveau virus grippal animal circulant chez l’homme. |
Situation 1 : Pas de nouveau virus grippal animal circulant chez l’homme. |
Phase 2 |
Un virus animal, connu pour avoir provoqué des infections chez l’homme, a été identifié sur des animaux sauvages et domestiques. |
Situations 2 : Épizootie – À l’étranger : situation 2A – En France : situation 2B |
Phase 3 |
Un virus animal ou hybride animal-humain provoque des infections sporadiques ou de petits foyers chez des humains, sans transmission interhumaine. |
Situations 3 : Cas humains isolés – À l’étranger : situation 3A – En France : situation 4B |
Période d’alerte pandémique (pré-pandémique) | ||
Phase 4 |
Transmission interhumaine efficace. |
Situations 4 : Début de transmission interhumaine efficace – À l’étranger : situation 4A – En France : situation 4B |
Phase 5 |
Extension géographique de la transmission interhumaine d’un virus grippal animal ou hybride animal-humain. |
Situations 5 : Extension géographique de la transmission interhumaine du virus : – À l’étranger : situation 5A – En France : situation 5B |
Phase 6 |
Situation 6 : Pandémie | |
Fin de vague et fin de pandémie | ||
Phases |
Post-pic (fin de vague pandémique) : décroissance du nombre des cas dans la plupart des États. Possibilité d’une nouvelle vague pandémique. |
Situation 7 : Fin de vague pandémique ou fin de pandémie. |
Post-pandémique : le nombre de cas correspond à ceux d’une grippe saisonnière. | ||
Source : Plan national de prévention et de lutte « Pandémie grippale », Secrétariat général de la défense nationale.
Comme on peut le constater, le plan français ne prévoit pas de réelle évaluation du risque en cas de pandémie. Il se borne à préciser que « si nécessaire, [les mesures] sont à adapter notamment en fonction des caractéristiques épidémiologiques du virus. »
L’argument qui consiste à dire que les pouvoirs publics ne sont pas tenus de mettre en œuvre toutes les mesures proposées peut être entendu. Cela a d’ailleurs été le cas puisque les plans de continuité d’activité, par exemple, n’ont pas été activés. Mais le plan doit être un guide efficace dans la conduite opérationnelle de la crise qui nécessite de réagir dans l’urgence. Cette tâche n’est pas aisée lorsqu’on dispose d’un catalogue exhaustif de mesures non graduées en fonction du critère de gravité de la pandémie. Ainsi, alors que le plan distingue les situations sanitaires de niveau 5B et de niveau 6, il les traite par la suite par une seule et même fiche d’aide à la décision. Ce choix, légitime pour une pandémie grave, semble moins opérationnel en cas de sévérité modérée.
Il ne s’agit pas d’alléger le plan, qui doit bien permettre de faire face à des situations sanitaires graves. En revanche, il doit désormais être adapté à la possibilité de survenance d’une pandémie grippale de sévérité modérée et présenter de manière claire les mesures pouvant être prises dans un tel cas de figure.
Par ailleurs, il ressort des auditions menées par la commission d’enquête que la déclinaison des instruments de la « boîte à outils » s’est révélée insuffisante pour faire face à la situation puisqu’il a fallu « inventer » les modalités d’une campagne de vaccination collective, ainsi que l’a rapporté M. Yann Jounot, directeur de la planification de sécurité nationale (90). Ce point a également été souligné par M. Didier Houssin, directeur général de la santé, qui a ainsi précisé que l’expertise était « peu développée » (91) concernant l’organisation concrète de la vaccination pandémique.
Or, c’est bien le rôle du plan que de proposer des solutions « clef en main » pour faciliter la gestion de la crise. Il convient donc de remédier rapidement à son insuffisance concernant les modalités de planification de campagnes de vaccination si nous voulons être correctement préparés à la survenue de pandémies qui pourraient être bien plus graves que celle que nous venons de connaître.
Proposition n° 9 : Adapter le plan français de prévention et de lutte contre la pandémie grippale afin d’y renforcer l’évaluation de la gravité du risque encouru et mieux identifier les catégories de mesures à prendre, non seulement par niveau d’alerte, mais aussi en fonction de la sévérité de la pandémie.
Proposition n° 10 : Préciser, dans le plan de prévention et de lutte contre la pandémie grippale, les modalités d’organisation d’une campagne de vaccination pandémique.
2. Un pilotage spécifique à la gestion de crise
Le pilotage de la gestion de crise a directement résulté de l’application du plan de prévention et de lutte contre la pandémie grippale. Caractérisé par une multiplicité d’intervenants, il peut sans doute être amélioré au vu de l’expérience de 2009.
![]()
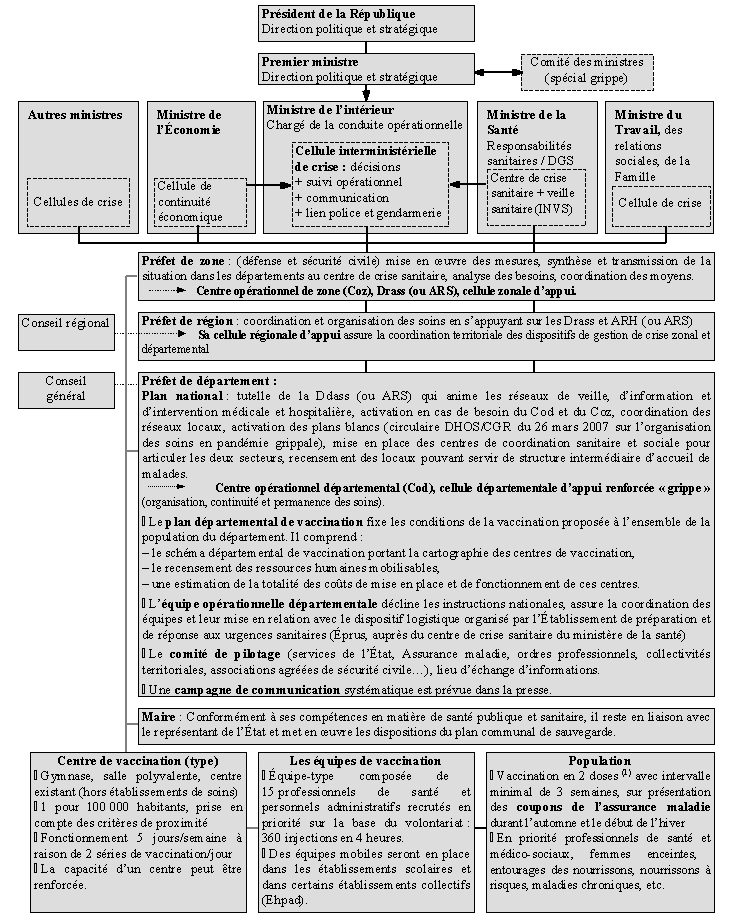
![]()
Source : Espace social européen n° 907 – 18-24 septembre 2009.
a) Au niveau national, de multiples intervenants coordonnés par un cadre interministériel renforcé
● La prise des décisions stratégiques par le Premier ministre
Conformément au plan français, c’est au Premier ministre qu’il est revenu de définir la réponse politique et stratégique à la crise. Comme en font état les compte rendus des réunions interministérielles que les membres de la commission d’enquête ont pu consulter, c’est donc lui qui a décidé le passage à la situation 5B du plan, le transfert du pilotage de la crise du ministère de la santé vers le ministère de l’intérieur, ou, le 14 mai 2009, d’examiner la combinaison d’achats de vaccins permettant « d’assurer la couverture vaccinale de l’ensemble de la population française, par une ou deux injections selon les besoins médicaux » (92). C’est enfin le Premier ministre qui, le 3 juillet 2009, a donné son accord pour l’achat de 90 millions de doses et une stratégie de vaccination gratuite et non obligatoire, et approuvé, le 24 septembre 2009, l’ordre de priorité établi pour la campagne de vaccination.
● Une responsabilité du pilotage opérationnel confiée au ministère de l’intérieur avec la mise en place d’une cellule interministérielle de crise
Le plan de prévention et de lutte contre la pandémie grippale prévoit qu’à partir de la situation 3B, le ministre de l’intérieur met en place auprès de lui, s’il le juge nécessaire, une cellule interministérielle de crise à vocation décisionnelle.
Cette cellule, appuyée par le centre opérationnel de gestion interministériel des crises du ministère de l’intérieur, a donc été activée, pour la première fois, le 30 avril 2009. Elle a tenu quarante-trois réunions. Le relevé de ses décisions montre que le choix de recourir rapidement à un cadre interministériel resserré autour des principaux ministères intéressés a constitué un atout indéniable dans la gestion de la crise.
Cette structure a su se montrer efficace en assurant aux administrations concernées une information synthétique sur la situation sanitaire et les expertises réalisées. De ce fait, les décisions ont pu être rapidement prises et ont revêtu un véritable caractère opérationnel – sur la stratégie vaccinale, l’organisation des centres de vaccination ou encore les conditions de réquisition des personnels par exemple. La cellule a en outre permis d’assurer l’unicité du message délivré par les divers participants, ce qui est extrêmement important en situation de crise.
On peut néanmoins regretter, comme on le verra plus loin (93), que la composante de la cellule dédiée à la communication gouvernementale n’ait pas été plus directement associée à la prise de décision pour mieux tenir compte de l’état d’esprit de la population à l’égard de la campagne.
● Le rôle essentiel du pôle sanitaire parmi les autres intervenants
De nombreux départements ministériels étaient représentés au sein de la cellule interministérielle ; en particulier, le ministère de l’éducation nationale a été très actif pour préparer la campagne de vaccination dans les établissements d’enseignement. Mais le ministère de la santé a, indiscutablement, joué un rôle d’appui essentiel dans la gestion de la crise qui était avant tout une crise sanitaire : comme l’a indiqué Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports (94), son ministère a été largement associé à la préparation de la campagne, puis à son pilotage et à son suivi. En son sein, le département des urgences sanitaires a joué un rôle majeur en début de crise avant de « passer la main » au ministère de l’intérieur, ainsi que l’a exposé son chef M. Thierry Gentilhomme (95). Votre rapporteur a également eu l’occasion de constater que son centre opérationnel de réception et de régulation des urgences sanitaires et sociales a été fortement sollicité pour réceptionner les alertes sanitaires et tient à saluer son action qui a été essentielle.
● Quelle appréciation porter sur cette organisation ?
En tout début de crise, les incertitudes étaient telles sur le plan sanitaire, concernant non seulement la nature et la gravité du virus mais aussi la fiabilité des informations dont on dispose, qu’il était pertinent que le pilotage opérationnel soit assuré par le ministère de la santé et plus particulièrement le département des urgences sanitaires.
Ce choix semble donc satisfaisant, à une réserve près : il a manifestement été délicat pour le département des urgences sanitaires, lors de la première semaine de la crise, de donner des instructions aux préfets et aux autres administrations. Il a d’ailleurs jugé nécessaire, dès le 24 avril 2009, de disposer d’un officier de liaison de la sécurité civile pour être en réseau avec le ministère de l’intérieur. Cette solution pourrait utilement être retenue pour la gestion de prochaines pandémies.
En milieu de crise, le plan français prévoit une coordination assurée par le seul ministère de l’intérieur. En pratique, la composante sanitaire de la crise a conduit, par pragmatisme, à octroyer au ministère de la santé un rôle plus important que celui qui lui était initialement destiné, comme en ont témoigné, par exemple, les points de presse conjoints des ministres chargés de l’intérieur et de la santé. Ce choix, qui s’est imposé de lui-même, pourrait probablement être intégré dans le plan.
On peut en revanche s’interroger sur la pertinence de la présence, au sein de la cellule interministérielle de crise, de certains intervenants indirectement concernés, comme le secrétariat général de la défense et de la sécurité nationale dont le rôle a été très limité dans la gestion opérationnelle d’une crise qui, de toute évidence, ne menaçait pas la continuité des activités considérées comme vitales pour le pays.
Proposition n° 11 : Prévoir, dès le début d’une crise pandémique, une liaison formalisée et bien identifiée entre les services du ministère de la santé chargés de la gestion de la crise et le ministère de l’intérieur.
Proposition n° 12 : Privilégier une composition souple de la cellule interministérielle de crise en y reconnaissant le rôle essentiel d’appui du ministère de la santé en cas de crise sanitaire et en adaptant sa composition à la gravité de la pandémie.
b) Une expertise déterminante et abondante
L’ensemble des décisions politiques lors de la gestion de la pandémie ont été éclairées par d’abondants avis d’instances d’expertise. Ce point a pu être décrié par certains, aux motivations variées, qui ont jugé que les experts, dont ils ont contesté parfois les compétences ou l’indépendance, se sont ainsi substitués aux autorités décisionnaires.
Les auditions auxquelles a procédé la commission d’enquête ne permettent pourtant pas d’arriver à cette conclusion. Au contraire, il apparaît que les nombreuses instances consultatives auxquelles il a été fait appel ont été particulièrement soucieuses de ne pas empiéter sur le champ de la décision politique et ont cherché, avec rigueur et respect de la collégialité qui permet la confrontation des positions, à fournir aux pouvoirs publics les données scientifiques dont elles disposaient.
Pour sa part, le Gouvernement a multiplié les saisines afin d’être éclairé de manière aussi complète et transparente que possible par ces instances, de telle que sorte que les décisions prises puissent être régulièrement évaluées, ne soient jamais irréversibles et liées à l’avis d’un seul expert. Ainsi en a-t-il été par exemple de la décision de lancement de la campagne de vaccination, conforme à l’avis du Haut conseil de la santé publique du 2 octobre 2009 dans lequel celui-ci estimait que « la balance bénéfice/risque [était] en faveur du démarrage de la vaccination ».
La question qui se pose n’est pas celle de l’indépendance des scientifiques auxquels il a été fait appel – qu’on serait d’ailleurs bien en peine de remplacer par des personnalités de compétences équivalentes –, mais celle de la profusion de leurs avis, à des stades divers de la pandémie, et de l’articulation de ces expertises entre elles. À cet égard, plusieurs actions paraissent devoir être envisagées au vu de l’expérience de 2009 :
● Coordonner les actions de veille sanitaire
La surveillance sanitaire au plan national est exercée par de multiples acteurs, dont les principaux sont l’Institut de veille sanitaire, établissement public, le réseau Sentinelles, unité mixte de recherche de l’Institut national de la santé et de la recherche médicale, et les groupes régionaux d’observation de la grippe, constitués de médecins et pharmaciens. Ce réseau national est complété, au plan européen, par le Centre européen pour la prévention et le contrôle des maladies (ECDC), agence de l’Union européenne dont le siège est à Stockholm. Chacune de ces instances diffuse des bulletins de veille ; l’abondance d’informations et de leurs sources ainsi que le choix d’indicateurs divers et variés nuisent pourtant à la clarté du message délivré aux autorités sanitaires alors que celles-ci ont justement besoin, en situation de crise, d’un éclairage aussi univoque que possible.
Il semble indispensable de rationaliser cette organisation et des démarches en ce sens sont d’ailleurs en cours, avec la mise en place d’une définition harmonisée du syndrome grippal, comme l’a signalé à la commission d’enquête M. Thierry Blanchon, responsable adjoint du réseau Sentinelles (96).
Proposition n° 13 : Poursuivre l’effort de mise en œuvre d’un réseau unifié de surveillance épidémiologique à l’échelle européenne en mettant l’accent sur une définition commune du syndrome grippal, en lien avec le Centre européen pour la prévention et le contrôle des maladies, et rapprocher les méthodes de surveillance pour disposer d’indicateurs précis, fiables et harmonisés.
● Rationaliser les rapports entre le Comité de lutte contre la grippe et le Haut conseil de la santé publique
Le Comité de lutte contre la grippe, dont l’intervention est expressément prévue par le plan de prévention et de lutte contre la pandémie, a joué un rôle essentiel tant pour évaluer la nature du virus en cause que pour émettre des hypothèses de préstratégie vaccinale. Ses travaux ont sans aucun doute été précieux aux instances décisionnaires. Mais quelle articulation entre ses interventions et les avis du Haut conseil de la santé publique, qui lui n’a été saisi qu’en « seconde main », selon les termes de M. Roger Salamon, président du collège (97), le 11 juin 2009, date de déclaration de la pandémie par l’Organisation mondiale de la santé ? Quel est le positionnement exact du Comité de lutte contre la grippe, instance de conseil créée par arrêté et placée auprès de la ministre chargée de la santé, par rapport au Haut conseil de la santé publique, certes créé par la loi, mais dont les membres sont également nommés par la même autorité et dont le comité a parfois constitué un groupe de travail ? Tout cela mérite d’être clarifié, d’autant que les avis du haut conseil sont publics, au contraire de ceux du comité.
Par ailleurs, on peut regretter que les pouvoirs publics aient saisi le haut conseil après l’engagement des négociations sur les commandes de vaccins. Ce point est évidemment à mettre en rapport avec l’observation précédente, puisque le Gouvernement bénéficiait déjà de l’expertise du Comité de lutte contre la grippe. Il semble donc aujourd’hui nécessaire de formaliser plus strictement les modalités d’intervention de cette instance afin de garantir une expertise approfondie et plurielle avant que ne soient prises les décisions.
● Renforcer le Haut conseil de la santé publique en créant en son sein une commission spécialisée sur les risques épidémiques
Le Haut conseil de la santé publique joue évidemment un rôle essentiel par ses avis en situation de pandémie, mais il ne dispose pas en son sein de structure permettant d’apprécier le risque épidémique dans ses aspects autres que médicaux. Or, comme le montre l’expérience, la gestion d’une crise pandémique suppose de prendre également en compte sa dimension sociétale et des contraintes logistiques et territoriales. Nous manquons d’une instance collégiale capable de conseiller les autorités sur l’ensemble de ces aspects.
Votre rapporteur suggère donc, en s’inspirant de sa proposition de loi visant à renforcer la coordination contre les risques épidémiques (98), de créer, au sein du haut conseil, une commission spécialisée sur les risques épidémiques qui permettrait, par ses travaux, de mieux coordonner l’action publique au niveau des zones de défense. Elle serait composée notamment de sociologues, de représentants des collectivités locales, de personnalités qualifiées dans le domaine de la gestion de crise et de médecins délégués dans les zones de défense, nommés par arrêté du ministre chargé de la santé. Elle contribuerait aux avis du haut conseil en leur apportant un éclairage plus opérationnel.
Proposition n° 14 : Intégrer le Comité de lutte contre la grippe dans le Haut conseil de la santé publique dont il pourrait constituer un groupe de travail, ce qui garantirait la publicité de ses travaux.
Proposition n° 15 : Prévoir une saisine précoce et systématique du Haut conseil de la santé publique en cas de risque pandémique.
Proposition n° 16 : Créer au sein du Haut conseil de la santé publique une commission spécialisée sur les risques épidémiques, à la composition plurielle, pour renforcer le caractère opérationnel des avis du haut conseil.
● Une intervention efficace des agences chargées de l’évaluation des vaccins
Comme on l’a vu plus haut, l’Agence européenne du médicament et l’Agence française de sécurité sanitaire des produits de santé ont joué un rôle majeur en délivrant les autorisations de mise sur le marché des vaccins pandémiques. Elles ont accompli leurs missions avec diligence et efficacité, puisque le faible décalage entre la délivrance de ces autorisations et l’octroi d’autorisations par les autorités sanitaires américaines résulte d’une procédure d’examen des produits plus poussée, reposant sur des essais cliniques, qui a permis de s’assurer tant de l’efficacité des vaccins que de leur tolérance. L’agence française a par ailleurs mené un travail approfondi de pharmacovigilance en établissant, pour la première fois, un recueil des effets indésirables accessible non seulement aux professionnels de santé mais aussi aux particuliers.
La controverse qui est apparue s’agissant de la décision de passer de deux à une injection de vaccin n’a pas lieu d’être : comme cela a été expliqué à la commission d’enquête par M. Patrick Le Courtois, membre de l’Agence européenne du médicament (99), même si des données préliminaires semblaient montrer l’efficacité du vaccin avec une seule dose, « l’obsession » de l’agence a été de disposer d’essais définitifs pour la garantir. C’est donc la rigueur qui a prévalu, ce dont on doit se féliciter compte tenu du contexte d’urgence qui prévalait à l’époque.
c) Un pilotage territorial essentiellement assuré par le ministère de l’intérieur
En application du plan de prévention et de lutte contre la pandémie grippale, le ministère de l’intérieur a été le pivot de la mise en œuvre territoriale des consignes élaborées par la cellule interministérielle de crise. Les préfectures ont ainsi été chargées, en s’appuyant sur une équipe départementale comprenant notamment les services de santé déconcentrés, de définir les modalités matérielles de l’organisation de la vaccination – par un recensement des lieux de vaccination, la définition des ressources humaines nécessaires et la préaffectation des populations aux centres.
Cette mise en œuvre a donné lieu à une mobilisation remarquable du réseau des préfectures, dont l’engagement doit être salué. Mais la production de près de quarante circulaires interministérielles n’a pas empêché des situations parfois contrastées concernant l’organisation matérielle de la campagne de vaccination, comme l’a d’ailleurs reconnu M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales (100) : les disparités territoriales l’ont par moment emporté sur l’unicité du corps préfectoral, inégalement armé pour faire face à la pandémie.
La même observation peut être formulée s’agissant des directions des affaires sanitaires et sociales, qui avaient notamment pour mission de gérer les réquisitions de professionnels de santé et dont les interventions ont été diversement couronnées de succès. Les dysfonctionnements constatés sur ce point doivent donc constituer un enseignement pour les nouvelles agences régionales de santé qui ont remplacé les directions.
Il semble aujourd’hui nécessaire d’améliorer cette organisation en renforçant les prérogatives des préfets des sept zones de défense : ceux-ci sont en effet plus aptes à réagir rapidement que près de cent préfets et vingt-deux agences régionales de santé. On obtiendrait ainsi une réponse à la crise qui serait à la fois territorialisée et coordonnée.
C’est pourquoi votre rapporteur propose de créer, dans chaque zone de défense, un conseil zonal qui serait particulièrement compétent en matière de crises sanitaires et de risque pandémique et constituerait un outil précieux de concertation et de coordination sur le plan territorial, comme il l’avait suggéré dans sa proposition de loi visant à renforcer la coordination contre les risques épidémiques. Les conseils zonaux, présidés par les préfet de zone, comprendraient notamment des délégués de la commission spécialisée sur le risque épidémique du Haut conseil de la santé publique, les préfets de région et de département, les chefs des circonscriptions militaires, des représentants des administrations déconcentrées, des unions régionales des professionnels de santé et des collectivités locales et les directeurs d’agence régionale de santé.
Enfin, on ne saurait trop insister sur le rôle déterminant des communes pour faire face à la crise : elles ont mis à disposition leurs locaux pour y établir les centres de vaccination et se sont intensément mobilisées. Toutefois, comme on le verra plus loin, elles ont souffert de ne pas être suffisamment associées à la préparation de la campagne. Ce point pourrait être amélioré en consultant, en amont de campagnes de vaccination pandémique, les principales associations les représentant au niveau national.
Proposition n° 17 : Renforcer le rôle des zones de défense comme échelon territorial de déclinaison des directives nationales ; instaurer un responsable décentralisé du département des urgences sanitaires dans chaque zone de défense ; adapter l’organisation de l’Établissement de préparation aux urgences sanitaires à ces zones pour que ses stocks soient gérés au niveau de ces échelons ; prévoir, au sein de chaque agence régionale de santé, un référent « zone de défense ».
Proposition n° 18 : Instituer dans chaque zone de défense un conseil zonal de préparation aux crises sanitaires présidé par le préfet de zone et composé de représentants de l’ensemble des acteurs de la gestion de crise sur le terrain.
Proposition n° 19 : Informer régulièrement les collectivités locales sur l’architecture générale d’une campagne de vaccination de grande ampleur. Cette information serait délivrée par le ministère de l’intérieur après consultation des principales associations de collectivités.
B. DES CENTRES DE VACCINATION CONTESTÉS DANS LEUR PRINCIPE
Le recours à des centres de vaccination collective a recueilli un accueil plus que mitigé : par les professionnels de santé libéraux en premier lieu, qui y ont vu, à tort, une mise en cause de leur capacité à assurer une opération de prévention sanitaire qui relève de leurs missions ; par les Français ensuite, qui n’ont pas compris la mise en place d’un dispositif jugé contraignant et l’exclusion de leur médecin traitant. Ces critiques sont compréhensibles, mais le choix de structures spécifiques a répondu à des contraintes réelles. Était-il approprié et pouvait-on explorer d’autres voies ?
1. Un choix de vaccination collective, dans des centres spécifiques, motivé par de réelles contraintes
Pour la toute première fois, la France a dû mettre en place une campagne de vaccination visant 47 millions de personnes dans un contexte de pandémie et devant donc se dérouler rapidement – en quatre mois –, dans un contexte particulièrement contraint.
Il fallait d’abord tenir compte du choix fondamental de mettre en œuvre une vaccination gratuite, qui excluait donc un recours à la médecine ambulatoire. Il fallait également tenir compte de contraintes de santé publique et logistiques. Le plan de prévention et de lutte étant resté silencieux sur la question de l’organisation matérielle d’une telle campagne, « l’invention » des centres a cherché à répondre à ces contraintes.
a) Des contraintes de santé publique
● Éviter que le système de soins ne soit surchargé
Le premier souci des pouvoirs publics a été de garantir qu’en période de pandémie, les services de santé puissent faire face à l’afflux éventuel de patients touchés par le virus A(H1N1). À cet effet, les plans blancs ont été activés au sein des hôpitaux, mais demeurait la question de la gestion des patients par les médecins généralistes libéraux : à la fin du mois de juillet et au début du mois d’août, lorsqu’a été élaboré le système de vaccination, les interrogations étaient encore importantes concernant l’impact potentiel du virus. Il apparaissait qu’il était très contagieux, d’une virulence certes modérée mais susceptible de provoquer des cas très sévères dans des catégories inhabituelles de la population. La crainte légitime était celle d’une saturation de l’offre de soins, ne permettant pas de mener, en parallèle, une campagne de vaccination massive dans les cabinets médicaux. L’objectif était donc de limiter la pression sur l’activité normale du secteur médical, ce qui a conduit à décider d’une vaccination dans des structures dédiées.
● Assurer la séparation des flux de personnes malades et de personnes à vacciner
Ainsi que cela a été souligné par la circulaire conjointe des ministres chargés de l’intérieur et de la santé du 21 août 2009 relative à la planification logistique de la campagne de vaccination, le souci était de mettre en œuvre une organisation robuste face aux aléas liés au déroulement de l’épidémie. Non seulement il était craint un pic épidémique risquant de conduire à la saturation des cabinets médicaux, mais il était également souhaité, conformément d’ailleurs au plan de prévention et de lutte contre la pandémie grippale, de freiner la transmission du virus. Dès lors, la séparation des flux entre personnes malades et personnes à vacciner semblait s’imposer et l’orientation de ces dernières vers des structures spécifiques, distinctes des lieux d’accueil des patients, répondait à cette exigence.
b) Des contraintes logistiques
Mais ce furent, de toute évidence, les contraintes logistiques qui ont été les plus importantes, conduisant à mettre en œuvre une vaccination collective et de ce fait à choisir une organisation reposant sur des centres de vaccination.
● Tenir compte du conditionnement des vaccins en multidose pour leur administration et leur stockage
Indiscutablement, le mode de conditionnement des vaccins a constitué l’une des plus fortes contraintes pour la campagne de vaccination. Nous ne reviendrons pas sur les raisons ayant conduit au choix de ce conditionnement (101) ; au stade auquel a été décidée l’organisation de la campagne de vaccination, celui-ci constituait désormais une donnée à intégrer à la réflexion.
Le stockage des vaccins nécessitait de respecter strictement la chaîne du froid ; ces produits ne pouvaient en outre être conservés plus de vingt-quatre heures après ouverture. Sauf à envisager un gaspillage important – alors que l’on craignait à l’époque une pénurie –, il fallait donc, autant que faire se peut, mettre en place une organisation permettant de consommer des flacons entiers en une journée. La vaccination collective s’est donc imposée comme le mode d’organisation le plus rationnel pour répondre à cette contrainte, même si chacun sait que le corps médical dispose de réfrigérateurs et est en mesure de vacciner.
● Garantir le respect de l’ordre de vaccination des personnes prioritaires
Le caractère progressif des livraisons de vaccins et les divers avis du Haut conseil de la santé publique ont conduit rapidement à décider de procéder à la vaccination de la population selon l’ordre de priorité de certaines catégories, lié, d’une part, à leurs fonctions et leur proximité avec des publics fragiles (professionnels de santé) et, d’autre part, à leur vulnérabilité.
Dès lors qu’il avait été choisi de procéder ainsi – ce qui a d’ailleurs été une solution largement partagée par d’autres États – se posait la question des modalités de gestion de la vaccination de ces personnes prioritaires. Le choix d’une vaccination collective est rapidement apparu comme la solution permettant de répondre le plus facilement à cette exigence : en recourant à des bons, délivrés progressivement, il a été possible d’identifier ces personnes et de leur proposer une vaccination plus précoce que celle des autres catégories, tenant compte du calendrier des livraisons de vaccins, sans que le système de soins n’ait à adapter son organisation à cette contrainte.
● Assurer la traçabilité des injections et la pharmacovigilance
L’organisation de la campagne devait par ailleurs tenir compte, lors de son élaboration, de la diversité des vaccins utilisés, de la posologie recommandée à l’époque (injection de deux doses) et de l’exigence de mettre en place une pharmacovigilance efficace.
La variété des vaccins imposait en effet, pour la deuxième injection, d’administrer le même produit que lors de la première injection et donc de disposer d’éléments systématiques de traçabilité. La pharmacovigilance devait en outre reposer sur un système facilitant la centralisation rapide des données.
La prise en compte de ces exigences supposait d’accomplir des tâches administratives parfois longues et fastidieuses, comme l’a d’ailleurs souligné auprès de la commission d’enquête le docteur Jacques Fontan, responsable du centre de vaccination de Capbreton (102) : édition des bons de vaccination, travail de saisie informatique, ou encore rédaction de divers comptes rendus adressés à l’échelon départemental. Toujours par souci de ne pas alourdir l’activité des médecins libéraux, que l’on supposait devoir faire face à une charge de travail accrue pour traiter l’afflux de patients atteints par l’épidémie, il a donc été choisi de faire accomplir ces démarches par des centres dédiés, dotés de personnel administratif.
2. Un dispositif insuffisant pour mener rapidement une campagne de vaccination pandémique
Une fois acté le principe du recours à des centres ad hoc, il a fallu définir leurs contours. Deux critères ont été retenus pour leur création : ils devaient chacun correspondre à des bassins de population de 100 000 habitants au plus et chaque département devait compter au moins trois centres de vaccination.
Il a été finalement créé 1 168 centres de vaccination qui ont permis, en trois mois, de vacciner 9 % de la population. Les diverses phases de leur fonctionnement – faible décollage du 12 au 24 novembre, poussée exceptionnelle de l’affluence du 25 novembre au 16 décembre et décrue progressive du 17 décembre 2009 au 4 janvier 2010 – ont permis d’analyser leur capacité à fonctionner en période de forte affluence. Ainsi que l’a souligné M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales (103), la configuration de ce dispositif était adaptée pour vacciner de 200 000 à 250 000 personnes par jour, soit, au grand maximum, 1,5 million de personnes par semaine et 6 millions de personnes par mois.
Ces données sont tout à fait essentielles à l’indispensable réflexion sur l’organisation d’une future campagne de vaccination. Il aurait été très difficile d’atteindre l’objectif de vaccination de 47 millions de personnes en recourant aux seuls centres de vaccination : leur configuration et leur dimensionnement n’auraient pas permis de mener une campagne de vaccination massive et suffisamment rapide.
Les centres de vaccination n’étant pas suffisants pour relever le défi d’une vaccination de masse et rapide, quelles sont les pistes à explorer pour se préparer aux futures pandémies ?
a) Le recours à la médecine ambulatoire
● Une campagne de vaccination qui a pâti de l’exclusion de la médecine ambulatoire
La campagne de vaccination a souffert d’un grand paradoxe : elle n’a pas reposé sur les médecins généralistes et, d’une manière générale, les acteurs de la médecine de ville, alors que ceux-ci sont les interlocuteurs naturels de nos concitoyens sur les questions de santé, et sont rompus à l’exercice de la vaccination contre la grippe saisonnière.
La table ronde à laquelle a procédé la commission d’enquête avec les principaux syndicats des professions de santé (104) a pu montrer l’incompréhension qui en a résulté : M. Michel Chassang, président de la Confédération des syndicats médicaux, a ainsi parlé de « révolte » des médecins, jugeant que leur réseau de proximité avait été « court-circuité ». Il est vrai que certains arguments avancés pour justifier le recours aux centres de vaccination ont pu sembler maladroits, voire même désinvoltes, pour ces professionnels de santé : on leur a ainsi contesté leur capacité à garantir le respect de la chaîne du froid – alors qu’ils disposent bien évidemment des équipements nécessaires. Et on voit mal des médecins accepter de vacciner sans ces équipements.
Par ailleurs, il a été recouru à la médecine de ville dans un certain nombre d’autres pays, comme aux Pays-Bas, dans la plupart des Länder d’Allemagne ou en Belgique, ce qui aurait pu militer en faveur d’une telle solution en France. Les expériences étrangères doivent toutefois être analysées au prisme de l’organisation du système de santé propre à chaque État. Certes, en Belgique, les médecins généralistes ont été chargés de la vaccination et se sont procuré directement et gratuitement les doses de vaccins auprès des pharmacies. Mais, dans la pratique, ils se sont souvent regroupés autour des cercles de médecine générale pour procéder à des vaccinations de groupe, cette solution étant jugée plus rapide et plus opérationnelle. Les vaccinations se sont donc en général déroulées dans des salles mises à disposition par les communes.
Il n’en demeure pas moins qu’en France, les praticiens, exclus du dispositif, n’y ont pas adhéré ; ils n’ont donc pas joué leur rôle de relais essentiel des politiques de santé publique auprès de leurs patients, ce qui s’est finalement traduit par une couverture vaccinale très décevante.
● L’impossibilité de faire reposer une campagne de vaccination pandémique exclusivement sur la médecine ambulatoire
Si le rôle de la médecine ambulatoire doit être reconnu pour mener avec succès une campagne de vaccination pandémique, il convient de garder à l’esprit que celle-ci se déroule a priori dans un contexte d’incertitude scientifique : le virus est capable de muter, un deuxième pic peut survenir… Il faut donc impérativement préserver la capacité de l’offre de soins à faire face à un afflux de patients atteints par la maladie pour les traiter.
En outre, les médecins libéraux sont certes sans doute les mieux placés pour vacciner leurs patients habituels, mais se pose la question de la vaccination des personnes isolées et de certains publics défavorisés pour lesquels l’argument de la gratuité peut être important. Quand on vise une vaccination universelle, il faut mettre en place un dispositif permettant à tous d’en bénéficier.
Enfin, la capacité de la médecine ambulatoire à se consacrer à une vaccination pandémique n’est pas uniforme. La nécessité d’assurer une traçabilité suppose des formalités administratives longues et fastidieuses, que tous les cabinets ne pourraient assumer faute d’un secrétariat suffisamment étoffé. En cas de conditionnement des vaccins en multidose, leur activité doit être suffisamment importante pour pouvoir regrouper les vaccinations sur une journée – c’est sans doute le cas dans les cabinets de groupe ou les maisons de santé. Les professionnels doivent par ailleurs être suffisamment disponibles pour se ravitailler en vaccins. Enfin, ils doivent disposer de locaux permettant d’établir deux circuits séparés, l’un dédié aux malades et l’autre aux personnes à vacciner. La participation de la médecine ambulatoire doit donc reposer sur le volontariat pour tenir compte de ces contraintes matérielles. Les praticiens sont responsables ; ils savent si leurs conditions d’organisation leur permettent ou pas de participer à un dispositif de vaccination pandémique.
● Une piste à envisager : favoriser le recours à la médecine ambulatoire
Tous ces éléments conduisent à penser qu’une campagne de vaccination pandémique devrait favoriser le recours à la médecine ambulatoire tout en prévoyant un système parallèle capable de se consacrer uniquement à une vaccination collective. Le choix de l’une ou l’autre forme reposerait sur la personne souhaitant se faire vacciner. Cela aurait évidemment un coût, qui est, reconnaissons-le, difficile à évaluer : il dépendrait de la tarification de l’acte, de l’affluence dans les cabinets par rapport aux centres, et plus généralement de l’adhésion de la population à la vaccination. Mais ce coût doit être accepté si l’on veut une campagne qui produise des résultats en termes de couverture vaccinale.
Cette voie doit être sérieusement explorée, et dès à présent, pour être préparé à une future pandémie. Cela suppose une concertation approfondie avec les professions de santé pour déterminer les modalités de leur intervention.
Proposition n° 20 : Favoriser le recours à la médecine ambulatoire parallèlement à des centres de vaccination spécifiques en cas de campagne de vaccination pandémique.
Proposition n° 21 : Inscrire dans le champ des conventions nationales liant l’Union nationale des caisses d’assurance maladie et les syndicats de professionnels de santé les conditions d’exercice de la vaccination pandémique.
Proposition n° 22 : Entamer une concertation entre les agences régionales de santé et les représentants des professionnels de santé, en particulier les unions régionales et les conseils des ordres, pour inscrire dans les schémas régionaux d’organisation des soins les modalités concrètes de recours à la médecine ambulatoire pour une vaccination pandémique.
b) L’appel aux établissements de santé
Les hôpitaux ont été sollicités, à partir du 20 octobre 2009, pour vacciner les professionnels de santé qui figuraient parmi les populations prioritaires, avec un succès d’ailleurs mitigé, comme on l’a vu plus haut (105). Cette vaccination a par ailleurs été élargie à certains malades atteints d’affections chroniques, et, à compter du 3 décembre 2009, à l’entourage des personnels hospitaliers voire même, dans certains cas, aux populations avoisinantes (106). Aurait-on pu aller au-delà et envisager de pratiquer la vaccination de l’ensemble de la population dans les établissements de santé dont la localisation était évidemment mieux connue que celle de certains gymnases ou salles polyvalentes ?
En première approche, on pourrait être tenté de répondre par l’affirmative : en effet, pourquoi affecter à des centres de vaccination des personnels hospitaliers, notamment des internes, au risque de désorganiser les hôpitaux alors que l’on a manifestement eu les moyens, à un moment donné, de vacciner sur place ? C’est d’ailleurs la position qu’a défendue auprès de la commission d’enquête M. Benoît Leclercq, directeur général de l’Assistance publique – Hôpitaux de Paris, qui a estimé que « La vaccination du public aurait pu être organisée dans les hôpitaux, qui savent gérer des files d’attente et des prises de rendez-vous » (107).
Il convient en réalité de se replacer dans le contexte du début de la pandémie, caractérisé par une incertitude sur sa gravité et surtout son évolution. Dès lors, trois arguments militent contre l’organisation d’une campagne de vaccination généralisée dans les hôpitaux.
En premier lieu, comme l’a souligné M. Jean Leonetti, président de la Fédération hospitalière de France (108), il convient de préserver la mission essentielle des hôpitaux : traiter les cas graves. Décider d’organiser la vaccination dans les hôpitaux aurait consisté à accepter, par avance, de courir le risque que les moyens ainsi « détournés » ne puissent être affectés au traitement des cas les plus sévères causés par une éventuelle aggravation de la pandémie.
En deuxième lieu, il est difficilement envisageable de vacciner des personnes vulnérables, notamment des personnes appartenant aux catégories prioritaires, au même endroit ou à proximité de malades gravement atteints par le virus.
Enfin, se pose la question, loin d’être accessoire, des moyens et de la logistique : ainsi que l’a exposé M. Jean Leonetti, « la vaccination à l’hôpital n’est possible que sous certaines conditions : l’hôpital doit avoir des locaux vides suffisamment grands et il faut prévoir un apport supplémentaire de personnels extérieurs afin de ne pas déprogrammer les activités quotidiennes de l’hôpital, surtout en période hivernale où se développent d’autres pathologies. » En cas d’afflux soudain de personnes à vacciner, comme cela a pu être observé à la fin du mois de novembre dans les centres, les hôpitaux auraient eu le plus grand mal à assurer à la fois leurs missions traditionnelles et la vaccination.
Le recours systématique aux hôpitaux ne semble donc pas être la solution d’avenir. Tout au plus pourrait-on envisager un assouplissement du dispositif en les faisant participer à la vaccination de la population générale en toute fin de campagne, lorsqu’il est constaté que l’afflux dans les centres s’est tari.
c) L’organisation de campagnes déconcentrées de vaccination dans les communautés de taille importante
Une autre voie pouvant être explorée est celle de campagnes de vaccination déconcentrées, soit par des équipes mobiles, soit par des professionnels de santé exerçant sur place, dans les communautés de grande taille telles que les principaux opérateurs ou grandes entreprises, les administrations centrales ou même les services des collectivités territoriales les plus importantes, sur le modèle de ce qui a été réalisé à la toute fin de la campagne de vaccination. C’est aussi le choix qui a été fait pour la vaccination dans les collèges et les lycées et qui n’a pas connu de dysfonctionnements majeurs, grâce à la mobilisation des personnels de ces établissements. Il serait également utile d’avoir recours à des équipes mobiles pour vacciner les personnes isolées, en s’appuyant sur les réseaux de solidarité de proximité qui permettraient d’identifier et d’accéder à ces dernières, comme l’a suggéré M. Atanase Périfan, président de l’association Voisins solidaires (109).
Une telle solution ne pourrait évidemment pas constituer le seul mode de vaccination en raison du caractère très partiel de la population concernée. Elle ne serait en particulier pas adaptée à la vaccination des groupes prioritaires, géographiquement disséminés. Elle permettrait néanmoins, si l’on équipait les services de santé présents dans certaines grandes communautés et les équipes mobiles de matériel de transport et de stockage adéquat, de se plier à la contrainte d’un conditionnement des vaccins en multidose et de désengorger d’autant les lieux d’offre de soins ou les éventuels centres spécifiques. L’exigence de traçabilité serait satisfaite par la nécessité de présenter, pour chaque personne souhaitant se faire vacciner, son bon de vaccination.
Proposition n° 23 : Lorsque cela est possible, déconcentrer les vaccinations pandémiques dans les communautés de grande taille telles que les établissements scolaires, grandes entreprises et administrations qui bénéficient d’équipes médicales appropriées.
C. UNE MISE EN œUVRE QUI A MANQUÉ DE SOUPLESSE
On l’a vu, le choix d’une vaccination collective et la création des centres de vaccination ont résulté du souci de répondre, certes dans l’urgence mais le plus rationnellement possible, à certaines contraintes – dont on se rend compte, a posteriori, qu’elles ont parfois été surestimées. Ce souci de rationalité n’a hélas pas trouvé toute sa traduction dans la mise en œuvre, sur le terrain, de la campagne de vaccination qui a souffert d’imperfections.
1. Des difficultés liées aux règles de fonctionnement des centres
Les principes de fonctionnement des centres de vaccination ont été définis par la circulaire conjointe des ministres chargés de l’intérieur et de la santé, du 21 août 2009, relative à la planification logistique de la campagne de vaccination. Certains d’entre eux ont pu poser problème, ce qui a conduit à des adaptations bienvenues ; mais les protocoles utilisés ont donné lieu à des incompréhensions.
a) Un parcours de vaccination progressivement ajusté
La définition du parcours de vaccination a suscité des critiques dans sa version initiale. Le Gouvernement a su entendre la plupart d’entre elles et le dispositif a été adapté par la voie d’une circulaire conjointe des ministres chargés de l’intérieur et de la santé du 28 octobre 2009. Ces adaptations ont en outre tenu compte des résultats de simulations de fonctionnement de centres auxquelles il avait été procédé au mois de septembre, par exemple à Amiens et à Paris –simulations qui ont d’ailleurs constitué une excellente démarche et dont le principe doit être retenu pour l’avenir.
Il était ainsi initialement prévu que le médecin du centre ne reçoive que les personnes identifiées comme présentant un facteur de risque au vu de leurs réponses à un questionnaire médical ; ce point a été fortement contesté par les personnels infirmiers. Il a finalement été instauré un entretien systématique de toutes les personnes souhaitant se faire vacciner avec le médecin.
Le poste de chef de centre a par ailleurs été créé, afin de garantir une continuité dans le fonctionnement des centres ; le volet administratif des équipes de vaccination a été renforcé, ce qui était effectivement indispensable compte tenu de la lourdeur des tâches concernant l’édition des bons ou la traçabilité.
b) Des protocoles parfois inhabituels
La question du respect des bonnes pratiques au sein des centres a été largement évoquée par les professionnels de santé auprès de la commission d’enquête. Le fractionnement des tâches entre un agent chargé de la préparation de la vaccination, assurant la reconstitution du vaccin et le remplissage des seringues, un « agent vaccinateur » et un agent chargé de la traçabilité, relevant du personnel administratif, a en particulier suscité de fortes réserves de la part des personnels infirmiers qui ont même jugé qu’il constituait une « faute professionnelle » (110) et conduisait à des « conditions d’exercice incompatibles » avec la déontologie. Les étudiants en médecine ont également eu l’impression d’être mis en porte-à-faux, ce fractionnement des tâches étant très différent du protocole appliqué en milieu hospitalier. La question des bonnes pratiques a également été évoquée auprès de la commission d’enquête concernant les conditions d’utilisation d’aiguilles serties, non conformes aux protocoles habituels (111).
Le rythme prévu pour les injections a en outre semblé incompatible avec un exercice normal : il était en effet prévu qu’à plein régime, les centres permettent de vacciner une personne toutes les deux minutes ; les personnels infirmiers ont fortement critiqué cet objectif, qu’ils sont même allés jusqu’à comparer à de la « médecine vétérinaire » (112).
Le défi consistait à élaborer des protocoles permettant de mener une opération de vaccination collective, massive et rapide. Pour l’avenir, ce souci d’efficacité et de rapidité devra être préservé, mais sans doute faudra-t-il mieux associer les professionnels de santé à la préparation de cette opération pour éviter de les mettre dans des situations délicates en termes de respect des bonnes pratiques.
2. Des problèmes de gestion opérationnelle qui ont pu être résolus grâce aux efforts consentis par les personnels et les collectivités locales
a) Des administrations déconcentrées parfois mal armées pour appliquer les directives
La gestion opérationnelle de la campagne a été marquée par des situations locales très diverses. Alors que dans certains départements comme le Rhône, les opérations se sont bien déroulées, on a pu constater ailleurs des dysfonctionnements préoccupants, par exemple à Paris.
● Une réelle mobilisation des services et des personnels
Cette disparité était pour le moins paradoxale, car selon les propos confiés à votre rapporteur par M. Michel Lalande, directeur du préfet de police de Paris en 2003, les préfets, très affectés par l’épisode de la canicule et interprétant à l’époque les convocations de la commission d’enquête sur ses conséquences sanitaires et sociales (113) comme une marque de suspicion et de défiance à leur égard, se sont attachés, pour gérer la pandémie, à prendre toutes les dispositions prévues par les consignes nationales qui ont été généralement appliquées à la lettre.
Les personnels des préfectures et des directions des affaires sanitaires et sociales se sont remarquablement mobilisés et n’ont pas ménagé leurs efforts pour mettre les centres en ordre de marche à la date prévue, puis pour en superviser la gestion. Leur tâche n’était pourtant pas aisée, car ils ont eu à appliquer un nombre impressionnant de consignes nationales – une « frénésie » de circulaires a même été évoquée auprès de la commission d’enquête (114) –, qui ont d’ailleurs pu, pour certaines d’entres elles, se révéler contradictoires avec les messages diffusés par les médias car le souci constant était d’adapter la réponse à la réalité de la pandémie.
S’agissant du cas plus particulier des services du ministère de l’éducation nationale, la commission d’enquête a pu constater que des difficultés sont apparues sur le terrain en raison de consignes nationales insuffisamment claires. M. Claude Michellet, directeur de l’académie de Paris (115), a ainsi souligné qu’ont coexisté des documents d’information destinés aux parents élaborés à la fois par le rectorat et par l’échelon national, ce qui a entraîné un brouillage de la communication et une situation inconfortable pour les chefs d’établissements. Il a également déploré l’imprécision des directives concernant la réquisition des personnels soignants scolaires en cas de volontariat insuffisant, ou encore les modalités de fourniture des établissements en vaccins.
● Un pilotage territorial délicat dans un contexte très particulier
Le dispositif de pilotage territorial a indéniablement pâti de la disparition programmée des directions régionales et départementales des affaires sanitaires et sociales, celles-ci devant être remplacées par des agences régionales de santé. Elles disposaient de ce fait de moyens humains réduits pour mener une opération d’une telle ampleur. Elles étaient en outre, pour certaines, placées dans une situation délicate car parfois chargées de piloter les équipes opérationnelles départementales, ce qui impliquait qu’elles exercent sur d’autres services une autorité qui pouvait leur faire défaut. Cette situation s’est sans doute particulièrement fait sentir à Paris, doté d’une « architecture » institutionnelle complexe en raison du partage de compétences entre la préfecture et la préfecture de police. Nul doute que la création des agences régionales de santé devrait changer la donne si on leur reconnaît un rôle opérationnel dans la gestion des crises sanitaires.
b) La confusion entourant les réquisitions
● Le principe d’un recours au volontariat
Ainsi que l’a souligné M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales (116), il a rapidement été décidé que le principe devant guider la constitution des équipes des centres de vaccination était celui du volontariat des personnels. Le recours à la réquisition, mal compris, a répondu au souci de garantir une protection fonctionnelle et juridique aux personnels qui ont ainsi bénéficié d’une couverture assurantielle appropriée, notamment de leur responsabilité civile professionnelle.
Ce recours était juridiquement bien encadré : en application de l’article L. 3131-1 du code de la santé publique (117), l’article 3 de l’arrêté du 4 novembre 2009 relatif à la campagne de vaccination disposait que « pour les besoins de la campagne, le représentant de l’État procède à toute réquisition nécessaire ». Les conditions de réquisition, encadrées par l’article L. 3131-8 du code de la santé publique, furent en outre précisées par deux circulaires, l’une en date du 1er octobre 2009 concernant les personnels de santé et l’autre en date du 22 octobre 2009 pour les personnels administratifs et les locaux.
● Des consignes évolutives
Les consignes pour constituer les équipes des centres de vaccination ont été pour certaines assez évolutives. Alors que la circulaire du 21 août 2009 sur la planification logistique de la campagne de vaccination préconisait de solliciter prioritairement, pour les personnels de santé, ceux des centres de vaccination existants, des centres de santé, de la protection maternelle et infantile ou encore de la médecine scolaire, la circulaire du 1er octobre 2009 sur la mobilisation des professionnels de santé indiquait qu’il fallait finalement privilégier le recours aux élèves infirmiers, aux professionnels de santé retraités ou remplaçants.
Les mêmes observations valent pour la réquisition des personnels administratifs : d’après la circulaire du 21 août 2009, devait être privilégié le recours aux personnels des collectivités territoriales ; puis la circulaire du 22 octobre 2009 sur la mobilisation du personnel administratif et des locaux a préconisé de faire prioritairement appel aux agents des services déconcentrés de l’État.
● Le manque de volontaires et la nécessité d’ajustements dans l’urgence
Une part des problèmes opérationnels a résulté des difficultés rencontrées par les préfectures pour constituer les équipes de vaccination en raison d’un nombre insuffisant de volontaires. Ce point a été souligné par M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales ainsi que par M. Bernard Fragneau, ancien préfet du Loiret (118), et est confirmé par les relevés de décisions de la cellule interministérielle de crise.
Par ailleurs, comme on l’a vu, l’ordre de priorité des personnels de santé dont le volontariat devait être recherché a évolué au cours du temps. L’exigence de présence de deux médecins par équipe a rapidement conduit à constater un « déficit de volontaires dans la ressource médicale des centres » (119) et à encourager, au mois de novembre, les préfets à avoir recours aux internes et étudiants en médecine qui, dans la circulaire du 21 août 2009, ne figuraient respectivement qu’en huitième et sixième positions dans l’ordre d’appel.
Des ajustements ont donc dû être opérés dans l’urgence : à Paris, nombre de centres ont été amenés à fonctionner avec un seul médecin ; il a aussi parfois fallu recourir à des réquisitions « autoritaires » en l’absence de volontariat suffisant, comme dans les départements du Pas-de-Calais et de l’Aisne.
● Une application sur le terrain imparfaite
Lors des auditions qu’elle a conduites, la commission d’enquête a pu constater que les réquisitions de personnels ont pu, dans certains cas, se dérouler de manière confuse. Les étudiants en médecine (120) ont ainsi estimé qu’ils manquaient d’informations par les préfectures et les services déconcentrés de l’État sur leur statut, leur éventuel rôle dans les centres et les protocoles choisis. Les infirmières scolaires (121) ont, pour leur part, mal compris leur réquisition pour opérer dans des centres de vaccination alors qu’elles devaient également participer aux vaccinations en établissements d’enseignement et ont regretté que l’exercice de leurs missions traditionnelles en pâtisse.
La question de l’inadéquation des réquisitions a également été soulevée : les étudiants ont ainsi déploré que dans certains cas, elles aient eu lieu sans concertation avec leurs responsables pédagogiques, sans tenir compte des dates d’examen et parfois de manière très autoritaire, les infirmiers libéraux jugeant pour leur part qu’il leur était difficile de s’organiser lorsqu’ils étaient parfois sollicités la veille pour le lendemain. Les personnels de santé ont également critiqué les insuffisances constatées en matière de programmation des vacations établie par les administrations déconcentrées.
Ces problèmes – qui n’ont pas concerné tout le territoire – sont sans doute liés à la difficulté rencontrée par les préfectures et administrations déconcentrées pour constituer les équipes de vaccination dans des délais brefs. Gageons que les futures agences régionales de santé seront mieux armées pour mobiliser efficacement les professionnels de santé.
c) Des horaires d’ouverture et des lieux parfois peu adaptés
● Les tentatives d’adaptation des horaires d’ouverture
Les problèmes rencontrés pour procéder aux réquisitions ont aussi sans doute tenu aux difficultés liées à des variations parfois importantes dans les horaires d’ouverture des centres – variations liées, il est vrai, au souci d’adapter « l’offre » de vaccination à la « demande ».
Certes, des consignes nationales existaient : dès le mois d’octobre (122), elles insistaient sur la nécessité de favoriser l’ouverture des centres de vaccination en soirée et le samedi, à la fois pour répondre aux attentes de la population et pour faciliter la participation des étudiants à la campagne de vaccination. En pratique, les horaires ont été variables, l’impression étant parfois qu’on les ajustait avec un temps de retard ou qu’ils ne répondaient pas aux spécificités des territoires.
Les centres ont au départ fonctionné « au ralenti », jusqu’à ce que soit constatée une forte affluence à partir du 24 novembre 2009, après qu’eut été signalée une mutation du virus en Norvège. Cette affluence a donné lieu à des engorgements, moindres cependant que ceux constatés dans d’autres pays : au Canada, des gens sont allés jusqu’à se battre pour être vaccinés. Le 3 décembre 2009, afin de tenir compte de la demande croissante de vaccination, le Président de la République a donc décidé de renforcer significativement le dispositif pour viser le triplement de l’activité quotidienne de vaccination dans les centres. Ceux-ci ont alors ouvert le week-end et avec une plus grande amplitude horaire, jusqu’à la fin de l’année, y compris le jour de Noël et le 31 décembre où un afflux massif de personnes souhaitant se faire vacciner était quand même peu probable. Ils ont de surcroît été maintenus largement ouverts alors que l’affluence y était devenue très faible, ce qui a pu conduire les équipes de vaccination à s’interroger sur l’intérêt de leur présence dans des centres quasiment vides.
Ces fluctuations d’horaires n’ont pas été sans poser problème : les préfets ont ainsi exprimé « de manière récurrente le souhait de voir mis en œuvre un dispositif d’information téléphonique adapté permettant d’assurer les renseignements publics sur les horaires d’ouverture des centres » (123) et ont dû adapter leur communication sur la question des horaires en temps réel, ce qui n’a pas aidé à informer la population. Si l’on avait laissé aux préfectures une plus grande latitude en matière de détermination des horaires, en association avec les communes mettant à disposition les locaux, on aurait sans doute pu parvenir à une gestion des centres tenant mieux compte de l’affluence constatée ou prévisible et des besoins de la population.
● Des lieux choisis pour établir les centres parfois mal adaptés
Le principe d’une vaccination collective ayant été arrêté, s’est posée la question du choix des lieux dans lesquels elle serait pratiquée. Le compte rendu de la réunion de la cellule interministérielle de crise en date du 22 juillet 2009 montre que le souci de la gestion de l’ordre public a conduit le ministère de l’intérieur à privilégier des lieux comme les gymnases et éviter par exemple les établissements scolaires, le ministère de la santé insistant pour sa part sur la nécessité de recourir à des lieux de proximité afin d’inciter autant que possible à la vaccination et limiter le risque d’une sous-utilisation des vaccins.
Lors des auditions qu’elle a menées, la commission d’enquête a pu constater que les lieux choisis ont pu susciter des critiques, notamment de la part de collectivités territoriales qui ont mis leurs locaux à disposition. Certaines ont regretté de ne pas avoir été suffisamment sollicitées en amont sur ce point, même si en principe leur accord devait être recherché.
Les solutions dégagées n’ont en outre pas toujours pris en compte les contraintes budgétaires pour les collectivités locales qui ont parfois dû gérer des annulations de spectacles ou de manifestations sportives résultant de la mise en place des centres. Certains lieux n’étaient en outre pas bien adaptés, du fait de leur configuration, à la mission des centres de vaccination, ce qui a conduit dans certains cas à les déplacer en cours de campagne (124). Des communes ont même pu travailler durant l’été à l’établissement d’un centre pour, au mois d’octobre, voir cette solution abandonnée au bénéfice du recours à des centres de vaccination situés dans des communes voisines (125).
d) Des problèmes logistiques résolus grâce aux initiatives individuelles
● Des problèmes dans la délivrance des bons de vaccination
Le recours à des bons de vaccination a obéi à la nécessité, d’une part, de convoquer les personnes à vacciner en respectant leur ordre de priorité, pour tenir compte de la livraison progressive des vaccins et, d’autre part, de garantir la traçabilité des opérations et la pharmacovigilance.
Ce système ne s’est pas montré totalement opérationnel : les bons ont parfois été délivrés avec retard et il a pu arriver, au sein d’un même foyer, que des personnes prioritaires reçoivent le leur après leur entourage, suscitant ainsi beaucoup d’incompréhension. La commission d’enquête a même été saisie du cas de la délivrance d’un bon à une personne décédée… Les centres ont par ailleurs dû gérer les demandes de vaccination de personnes dépourvues de bons et auxquelles ils ont répondu favorablement dès lors que l’affluence le leur permettait.
Ceci a conduit à éditer un grand nombre de bons sur place – au total, 2,693 millions. Or, on a pu constater, par endroits, des difficultés d’accès au système d’information AMELI Coupon pour lequel tous les codes d’accès n’avaient pas été délivrés au début de la campagne générale. Les personnels ont donc dû faire preuve d’une réelle adaptabilité et ne pas ménager leurs efforts pour allier pragmatisme et efficacité dans une situation parfois tendue.
● Quelques défauts dans l’approvisionnement des centres et des établissements scolaires
Si les livraisons de vaccins dans les centres n’ont pas vraiment connu de défaillances, il en a été autrement de la gestion des articles consommables, tels que compresses ou sparadrap, ou de la fourniture, en nombre suffisant, de certains documents officiels comme les certificats de vaccination ou les fiches de consultation médicale. Ces problèmes logistiques ont parfois dû être réglés par les communes qui ont fourni les centres en moyens adéquats. Parallèlement, on a pu voir des centres surapprovisionnés en certains articles ; ainsi, le centre de vaccination de Capbreton a reçu, en cours de campagne, de nombreux cartons de seringues sans avoir rien demandé et détenait, en fin de campagne, 24 000 seringues inutilisées (126).
Quelques dysfonctionnements ont également eu lieu s’agissant des établissements scolaires : selon M. Claude Michellet, directeur de l’académie de Paris (127), alors qu’il était prévu que les équipes mobiles se fournissent auprès des centres en vaccins et matériel, ce sont parfois les chefs d’établissements qui se sont rendus dans les centres, où l’affluence était importante à l’époque, pour effectuer cette tâche.
Les problèmes logistiques constatés ne doivent cependant pas cacher les motifs de satisfaction : au bout du compte, les professionnels de santé et les personnels administratifs ont su démontrer leur capacité à gérer un dispositif sanitaire complètement nouveau, qui certes a pu connaître des « ratés » mais a, grâce à la réactivité des acteurs de terrain, globalement accompli ses missions. Les insuffisances observées devraient donc à l’avenir être réglées si l’on met en place une évaluation et un suivi appropriés des besoins.
Proposition n° 24 : Réviser le volet territorial du plan de prévention et de lutte contre la pandémie grippale pour y intégrer les agences régionales de santé qui joueraient le rôle de « préfets sanitaires » en appui des préfets des zones de défense et seraient chargées de la mobilisation des personnels de santé, de la préparation sanitaire des centres et de rendre compte de leur activité auprès de la zone de défense, les préfectures de département se concentrant sur les autres aspects logistiques.
Proposition n° 25 : Établir et actualiser annuellement, dans chaque zone de défense, en liaison avec les agences régionales de santé et les unions régionales des professionnels de santé, une liste des personnels de santé volontaires pour participer à des opérations collectives de gestion de crise sanitaire.
Proposition n° 26 : Recenser dès aujourd’hui, dans chaque zone de défense, les lieux susceptibles d’être utilisés pour gérer une éventuelle campagne de vaccination pandémique.
Proposition n° 27 : Associer, au niveau départemental, les collectivités territoriales, les référents sanitaires des communes et les professionnels de santé lors du recensement des équipements à utiliser.
Proposition n° 28 : Attribuer aux préfectures de département une marge de manœuvre dans l’organisation matérielle des centres pour tenir compte, au mieux, des spécificités des territoires.
Proposition n° 29 : Renforcer le suivi et l’évaluation régulière du déroulement des opérations sur le terrain en établissant une chaîne de remontée des informations vers la préfecture de zone de défense.
IV.- UNE CAMPAGNE DE VACCINATION BOUDÉE
Le volontarisme des pouvoirs publics, qui visaient une vaccination large de la population, n’a pas été couronné de succès. La campagne de vaccination a véritablement été boudée par les Français que l’on a vus tout d’abord désemparés par l’affluence de messages contradictoires, puis franchement démobilisés.
A. UN MESSAGE DE SANTÉ PUBLIQUE PERDU DANS LE BROUILLARD MÉDIATIQUE
Un point a été unanimement relevé par les personnes auditionnées par la commission d’enquête : la crise de la grippe A(H1N1) a suscité un véritable emballement médiatique, avec des interventions multiples, parfois contradictoires et même cacophoniques, qui ont conduit les Français, perplexes, à douter à la fois de la nécessité de se faire vacciner et de la sûreté des vaccins. Parallèlement, la communication gouvernementale n’a pas su suffisamment s’adapter pour faire passer le message de santé publique. Dès lors, l’adhésion de nos concitoyens à la campagne n’a cessé de décroître. La communication devra donc, à l’avenir, être considérée comme un enjeu majeur de la gestion des pandémies.
1. Une multiplicité des messages sanitaires source de confusion
C’est peut-être la première fois que l’on a pu assister, dans les médias, à la mise sur la place publique d’un débat d’experts en santé publique qui ont fait part, pour ainsi dire en temps réel, de l’état d’avancement de leurs travaux et de leurs incertitudes. L’impression qui s’en est dégagée a été celle de la confusion, d’autant plus que les estimations, parfois contradictoires – mais toujours scientifiquement documentées – émanaient de personnalités dont les compétences étaient largement reconnues.
a) Sur le risque lié à la pandémie
L’évaluation du risque lié à la pandémie a donné lieu à de nombreuses estimations très médiatisées qui ont pu sembler être le signe de désaccords entre scientifiques alors qu’elles ne traduisaient que l’évolution de leurs connaissances sur le sujet. Alors qu’au départ on craignait un virus très virulent, il s’est révélé finalement plus bénin que prévu, mais très contagieux, avec le risque d’un grand nombre de malades assorti de cas graves atypiques. Les avis d’experts sur ce point étaient tout à fait convergents mais leur succession dans le temps a pu donner l’impression qu’en la matière, le consensus n’existait pas.
Ainsi, le 6 mai 2009, le professeur Antoine Flahault, directeur de l’École des hautes études en santé publique, accordait un entretien au journal Le Monde dans lequel il évoquait plusieurs scénarios d’évolution possible de la maladie ; selon lui le plus plausible était proche de la pandémie de 1968, à savoir « l’équivalent d’une grosse grippe saisonnière » touchant 35 % de la population, avec « un excès de mortalité de l’ordre de 20 000 à 30 000 décès » en France, nombres forcément impressionnants. En revanche, le 28 août 2009, le professeur François Bricaire, chef du service des maladies infectieuses et tropicales à la Pitié-Salpêtrière, déclarait au Figaro Magazine : « Cette grippe est majoritairement bénigne. »
On a même cru voir des contradictions marquées entre institutions chargées de l’expertise : ainsi, pour la dernière semaine d’août, l’Institut de veille sanitaire estimait à 6 000 le nombre de cas par semaine alors que le réseau de groupes régionaux d’observation de la grippe avançait le nombre de 25 000. En réalité, les indicateurs utilisés étaient différents, mais ces estimations apparemment divergentes n’ont certainement pas contribué à améliorer la compréhension du phénomène par la population.
Le débat sur la gravité estimée de la pandémie a naturellement dérivé sur la nécessité qu’il y aurait de mener une campagne de vaccination collective. On se souvient ainsi des propos, dans Le Monde du 6 août 2009, du professeur Marc Gentilini, professeur émérite des maladies infectieuses et tropicales à l’hôpital de La Pitié-Salpêtrière, président honoraire, membre de l’Académie nationale de médecine et membre du Conseil économique, social et environnemental, qui jugeait : « C’est une pandémie de l’indécence. Quand je regarde la situation de la planète, j’ai honte de voir tout ce qui est entrepris pour éviter cette grippe dont on ne sait que peu de chose. »
Ce sont même parfois de réelles contradictions qui ont été médiatisées. Le 4 juin 2009, Mme Sylvie Van der Werf, membre du Comité de lutte contre la grippe et directeur de l’unité de recherches « génétique moléculaire des virus respiratoires » à l’Institut Pasteur donnait un entretien au Figaro du 4 juin 2009 intitulé : « H1N1 : il va falloir vacciner tout le monde » – propos qu’elle a regrettés par la suite. Deux jours plus tard, le 6 juin, le professeur Antoine Flahault accordait pour sa part une interview au Parisien dans laquelle il déclarait que selon les simulations, « s’il ressort évidemment que, plus on vaccine, meilleure est la protection, il est montré aussi que vacciner 30 % de la population mondiale, toutes classes d’âge confondues, suffirait à arrêter la seconde vague épidémique attendue à la rentrée dans l’hémisphère Nord. »
c) Les réticences des personnels soignants
Des membres réputés du corps médical ont aussi fait part de leurs doutes et de leurs réticences à l’égard de la campagne de vaccination. L’évocation d’une « grippette » a eu, on s’en souvient, un effet sinon ravageur, du moins un très net retentissement. On rappellera également les prises de position, au mois d’octobre 2009, dans le Parisien, de M. Patrick Pelloux, président de l’Association des médecins urgentistes hospitaliers, qui déclarait : « Je ne vois pas l’intérêt scientifique de ce vaccin », et du professeur David Khayat, chef du service de cancérologie de l’hôpital de la Pitié-Salpêtrière, qui annonçait : « Non, je ne me ferai pas vacciner (…). J’attends les arguments qui justifieraient une telle vaccination de masse. »
Au-delà, c’est une bonne partie du corps des personnels soignant qui a fait savoir ses réticences à l’égard de la campagne de vaccination, que ce soit dans le cadre privé du cabinet médical ou publiquement par voie de communiqué de presse. Les médecins généralistes ont été très partagés sur l’utilité qu’il y aurait à se faire vacciner. Cette position a été également partagée par nombre des infirmiers ; le syndicat national des professionnels infirmiers a ainsi émis de sérieuses réserves en déclarant : « Injecter 94 millions de doses d’un produit sur lequel nous n’avons aucun recul peut poser un problème de santé publique. » (128)
Face à de telles prises de position, dont certaines étaient sans doute motivées par des considérations qui n’étaient pas que d’ordre médical, il était très difficile aux pouvoirs publics de délivrer un message sanitaire réellement audible sur la nécessité de se faire vacciner. Les opinions apparemment divergentes de scientifiques tous a priori compétents, donc crédibles, et les réticences des personnels soignants auraient sans doute dû appeler une communication appropriée pour justifier la stratégie choisie.
Peut-être aurait-il été utile, dans un tel contexte, de structurer le débat d’experts dans une instance exclusivement composée de scientifiques – par exemple autour de l’Académie nationale de médecine, référence « parlante » pour beaucoup de Français –, au cours d’une grande conférence médiatisée qui aurait permis de délivrer un message traduisant le consensus scientifique sur les incertitudes, le risque lié à la pandémie et la vaccination.
Proposition n° 30 : Instaurer, en cas d’alerte pandémique, une conférence nationale constituée des représentants des collèges scientifiques qui permettrait une communication consensuelle sur la nature du risque et les moyens médicaux disponibles pour y faire face.
2. Des médias parfois excessifs
On ne peut tenir les médias pour responsables des propos tenus par des personnalités qu’ils se bornent à reproduire ; mais force est de constater que le traitement de la grippe a donné lieu à un véritable emballement médiatique qui aurait parfois nécessité un certain recul.
a) Un large écho donné à des prises de position de personnalités extérieures à l’expertise sanitaire
Au-delà des scientifiques et chercheurs, de nombreuses personnalités extérieures au champ de l’expertise sanitaire proprement dite se sont exprimées non seulement sur la gestion de la pandémie par le Gouvernement, ce qui était parfaitement légitime, mais aussi sur la réalité du risque encouru du fait de la pandémie voire des vaccins. On a ainsi engagé la polémique sur des questions strictement scientifiques : une lettre ouverte envisageant la dangerosité des vaccins adjuvantés a, par exemple, sans aucun doute eu un impact très important.
Si l’on ajoute à cela la mise en cause du caractère régulier des contrats conclus avec les laboratoires producteurs de vaccins, les critiques émises à l’encontre d’une procédure de mise sur le marché jugée trop rapide, la suspicion jetée sur des experts siégeant dans les instances d’expertise collégiales, la dénonciation de l’absence de transparence de celles-ci et même du manque d’information des citoyens – alors que jamais auparavant les pouvoirs publics n’avaient mené une communication aussi abondante – le message sanitaire devient forcément brouillé.
La parole est libre, et c’est heureux ; après tout, chacun est responsable de ses propos. On peut néanmoins regretter qu’il n’ait pas été fait parfois preuve de plus de mesure et de distance et même, dans certains cas, de davantage de respect à l’égard des scientifiques. Car parallèlement, dans ce contexte déjà confus, se sont élevées des voix d’« experts médiatiques » autoproclamés ou en quête d’une gloire éphémère – sur les compétences desquels on ne s’est d’ailleurs pas forcément interrogé – et qui, procédant par raccourcis, sans souci de la nuance, ont pu s’ériger en chevaliers blancs pour finalement affirmer sans ambages et avec le ton de celui-qui-sait que la vaccination était plus dangereuse que la pandémie elle-même.
b) Des informations oscillant entre alarmisme et banalisation
Le traitement de la grippe A(H1N1) par les médias a donné lieu à un feuilleton quasi-quotidien faisant état d’événements d’importance variable et qui a eu un impact indéniable sur l’état d’esprit de la population. Comme l’a indiqué Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports (129), on a pu constater, lors de la pandémie, une certaine fébrilité des médias qui rendait difficile, pour les autorités, de « baisser le rhéostat » de la communication. Au tout début, la tonalité générale a été plus interrogative que véritablement alarmiste sur le virus de cette nouvelle grippe qui était alors dite « porcine » : il s’agissait de faire état des incertitudes, qui étaient nombreuses. L’apparition de premiers cas de grippe A(H1N1) en Europe, puis en France à la fin du mois d’avril a ensuite donné lieu à des reportages plus alarmistes, puis rassurants après que furent rendues les premières conclusions des travaux sur le virus, qui ne semblait pas très pathogène.
L’inquiétude est néanmoins reparue au mois de juin 2009, lorsque l’Organisation mondiale de la santé a décidé de passer à la phase 6 du niveau d’alerte pandémique. Mais au mois de juillet 2009, la plupart des médias soulignaient que la grippe A(H1N1) était moins grave que prévu. À partir du mois de septembre et désormais jusqu’à la fin de l’année, ils ont alors alimenté le débat sur la pertinence d’une campagne de vaccination générale qui en est venue à être mise en cause, alors même que certains s’alarmaient, au courant de l’été, du risque d’une indisponibilité des vaccins à la rentrée et de la dangerosité du virus.
c) Des messages inquiétants sur la sûreté des vaccins
Parallèlement à cette banalisation progressive de la grippe A(H1N1), est apparue une polémique largement médiatisée sur la sûreté des vaccins pandémiques, reposant sur des malentendus et des amalgames, qui a conduit à mettre en cause le recours aux adjuvants tout en s’inquiétant d’éventuels risques d’apparition du syndrome de Guillain-Barré (130). La France a ainsi été l’un des pays où le principal argument invoqué à l’encontre de la vaccination a été celui du risque encouru du fait de vaccins considérés comme insuffisamment sûrs.
C’est tout d’abord la procédure d’autorisation de mise sur le marché qui a été attaquée : était-il raisonnable d’injecter à des millions de personnes des produits fabriqués en quatre mois et testés sur « quelques milliers de cobayes » seulement ? Reconnaissons que face à ce questionnement destiné dans bien des cas à produire une forte impression, il était difficile de répondre simplement puisqu’il fallait pour cela décrire la complexe procédure de recours aux vaccins maquettes.
Le débat sur les adjuvants a également été fortement médiatisé : les vaccins auraient contenu des substances dont on connaîtrait mal la dangerosité puisqu’on n’osait pas en donner aux femmes enceintes et aux enfants âgés de six à vingt-quatre mois présentant des facteurs de risque – ce qui était en réalité une mesure de précaution liée au caractère très particulier de leur système immunitaire. De multiples interventions, et même des injonctions – « Les Français doivent savoir ce qu’on va leur injecter » (131) – ont donc été relayées sur ce sujet et ont contribué à alimenter les inquiétudes et les doutes. Certes, des experts reconnus ont tenté d’y répondre dans les médias mais l’argumentation scientifique est bien mal adaptée à cet exercice quand il s’agit davantage de frapper les esprits.
Pour ce qui concerne le syndrome de Guillain-Barré, jusque là méconnu du public, il a lui aussi pu connaître son « heure de gloire » médiatique, d’autant plus que le premier cas, constaté chez un personnel soignant vacciné, a été rendu public le 12 novembre 2009, date de lancement de la campagne visant la population générale. Les médias s’en sont évidemment emparés, d’autant plus qu’il était pour ainsi dire « attendu » (132), ne serait-ce que parce que statistiquement un tel syndrome apparaît indépendamment de la vaccination. Nul doute que l’attention qui lui a été portée, même si elle s’est traduite en général par un traitement correct du sujet, a contribué à renforcer la défiance des Français à l’égard de la campagne de vaccination.
3. Sur internet, un débat concurrent qui a débordé les autorités
a) La propagation de rumeurs inquiétantes par des canaux variés
C’est probablement sur internet que les rumeurs les plus folles ont pu courir sur la nature de la grippe A(H1N1) et sur les vaccins. Si certaines affirmations farfelues étaient à l’évidence faciles à contester, d’autres, plus subtiles et traduisant les doutes principaux de la population française, auraient sans doute mérité d’être traitées avec plus d’attention par les pouvoirs publics pour y répondre par une argumentation appropriée : ainsi en a-t-il été de l’inutilité et de l’inefficacité de la vaccination, de l’affirmation d’un lien de causalité entre adjuvants et syndrome de Guillain-Barré, ou encore de l’idée que les vaccins, élaborés dans l’urgence, auraient été insuffisamment testés.
La réponse à de telles affirmations est d’autant plus difficile qu’internet est, par excellence, le lieu de l’expression foisonnante et anonyme, où la distinction entre allégations non fondées et argumentation documentée est difficile à établir pour le non-spécialiste. La technique qui consiste à évoquer une « source sûre », autorisée parce qu’issue du monde médical, mais invérifiable, peut alors faire de véritables ravages. Or, le débat sur internet a été vif et nourri, en particulier par le biais de blogs, d’envoi massifs de courriels et des réseaux sociaux que sont Twitter ou Facebook. Non seulement les autorités sanitaires et les experts en ont été largement absents, mais ils ont même été débordés par l’afflux des messages émis.
b) Des rumeurs au service d’intérêts divers
La question se pose de la motivation des divers intervenants sur internet. Certains avaient pour objet de contester le recours à une campagne de vaccination collective – ce qui était légitime car il s’agissait de discuter d’orientations stratégiques ; en revanche, d’autres se sont appuyés sur ce nouvel outil de communication, très efficace, pour faire valoir des opinions tout à fait contestables.
On doit ainsi citer les lobbys anti-vaccinaux qui contestent le principe même du recours à la vaccination et qui ont pris une certaine ampleur depuis la campagne de vaccination contre l’hépatite B. Leur stratégie consiste généralement à nier l’efficacité et la sûreté des vaccins dont les risques d’effets secondaires seraient sous-évalués. Ils se fondent en général non sur de la documentation scientifique mais sur des témoignages, ce qui frappe bien évidemment les esprits ; ou bien ils procèdent par extrapolations hasardeuses, raccourcis et citations tronquées de travaux et d’études pour parer leurs arguments d’une aura scientifique. Ils ont, avant même la disponibilité des vaccins, puis lors de la campagne de vaccination, fait amplement valoir leurs positions qui constituent une régression scientifique et médicale non seulement scandaleuse mais dangereuse.
Au-delà, l’expression d’oppositions à la campagne de vaccination sur internet a constitué une réelle opportunité pour divers tenants de la théorie du complot. On a pu lire de tout : le virus aurait été créé par les laboratoires en assortissant un virus humain et un virus porcin, afin de commercialiser un vaccin dont la production aurait anticipé la pandémie – on a ainsi parlé de « grippe Sanofi » ; les vaccins seraient mortels ; la vaccination serait obligatoire et forcée ; ou encore, la pandémie aurait été créée de toutes pièces pour préparer un génocide mondial. Ainsi, au détour d’un appel contre la campagne de vaccination découvre-t-on que les « illuminati-reptiliens » auraient déclaré la guerre biologique à l’humanité pour voler son ADN…
De telles dérives sont tout à fait préoccupantes et doivent être prises en compte par les pouvoirs publics pour l’avenir ; une éducation aux médias est nécessaire. Nul doute que la mission d’information parlementaire récemment créée à l’Assemblée nationale sur la protection des droits de l’individu dans la révolution numérique (133) fera sur ce sujet des propositions très utiles.
Les autorités sanitaires, avec un message brouillé par des interventions multiples sur l’opportunité de la campagne de vaccination, débordées par un débat concurrent sur internet où elles n’ont pas su présenter leurs contre-arguments, ont-elles alors perdu la « bataille de la communication » ?
B. DES ERREURS DANS LA COMMUNICATION DES POUVOIRS PUBLICS
De l’avis de nombreuses personnes auditionnées par la commission d’enquête, et notamment du secteur des médias, la communication gouvernementale sur la campagne de vaccination s’est révélée certes abondante mais parfois inadaptée, ce qui a pu susciter des incompréhensions.
Elle a certes remporté de réels succès, s’agissant par exemple de la promotion des gestes barrières qui, de l’avis de l’ensemble des personnes auditionnées par la commission d’enquête, a donné lieu à de réels changements dans les comportements des Français. Mais elle n’a pas su se montrer suffisamment persuasive concernant la vaccination, puisque moins de 10 % de la population ont souhaité se faire vacciner.
1. Une campagne institutionnelle classique souvent inappropriée
La communication institutionnelle sur la campagne de vaccination, essentiellement axée sur l’information, n’a pas suffisamment pris en compte l’état de l’opinion publique et n’a pas su être réactive ; des signaux existaient cependant qui auraient dû inciter les autorités à mieux adapter leur réponse.
a) Le recours à des instruments traditionnels qui n’ont pas suffisamment pris en compte l’état d’esprit de la population
● Des instruments de communication traditionnels
La communication gouvernementale a utilisé des outils classiques : l’Institut national de prévention et d’éducation pour la santé a développé des spots télévisés ou radiodiffusés en s’appuyant sur les conventions nationales conclues par l’État avec Radio-France et France-Télévisions, des modules ont été diffusés sur internet et des affiches et annonces dans la presse ont été publiées. Parallèlement, le site internet www.pandemie-grippale.gouv.fr a été étoffé et une campagne de référencement de mots clés pour renvoi a été lancée.
Toutes ces actions avaient un but essentiellement informatif : l’objectif, légitime, était prioritairement d’exposer la situation sanitaire, les risques encourus en cas de pandémie et les moyens de s’en préserver. Il en a été de même des points de presse quotidiens des ministres de l’intérieur et de la santé à l’issue de chaque réunion de la cellule interministérielle de crise, dont le principe a été adopté dès le 1er mai 2009.
● Des maladresses
Ainsi que l’a souligné M. Thierry Saussez, directeur du service d’information du Gouvernement (134), la première étape de la communication gouvernementale a consisté à « maximiser la crise », l’État devant légitimement se préparer au pire, puis à dégager des marges de manœuvre tout en veillant à l’unicité de la parole du Gouvernement.
Ce dernier objectif a été remarquablement bien atteint : jamais les ministres n’ont délivré de messages divergents ou contradictoires quant à la nature du risque, son évolution ou la stratégie à adopter.
En revanche, la stratégie de maximisation du risque n’a pas réellement porté ses fruits. Elle a même, à un certain point, desservi le Gouvernement dont la communication est progressivement apparue en décalage avec la réalité de la pandémie, celle-ci se révélant moins grave que prévu. Alors qu’il aurait peut-être fallu « faire machine arrière » en termes de communication, ont ainsi été maintenus les points de presse réguliers des ministres chargés de l’intérieur et de la santé, même lorsque la situation sanitaire n’avait que peu évolué. Il est vrai que les autorités étaient dans une situation extrêmement inconfortable : les médias étant fortement demandeurs d’informations, tout silence de l’État aurait nourri les plus folles suspicions ; à l’inverse, une communication intense sur une pandémie finalement modérée s’exposait à être accusée d’alarmisme.
La stratégie adoptée a donné l’impression d’une réponse surdimensionnée, ce qui a entaché la campagne de vaccination du même soupçon. Or comme l’a souligné le professeur Pierre Bégué, membre de l’Académie nationale de médecine, « le profil particulier des malades admis en réanimation et décédés n’a été que rarement mentionné : la prédominance de la tranche d’âge des quinze à soixante-cinq ans et la mortalité de 20 % de personnes sans facteurs de risque ont été très peu commentées alors que ces éléments auraient mieux soutenu l’objectif ». (135)
Par ailleurs, certaines décisions ont donné lieu à une communication parfois inappropriée.
Ainsi en a-t-il été de la décision de passer de deux injections de vaccin à une seule : cette évolution, pressentie au cours du mois de septembre au vu des tests en cours, a été recommandée le 30 octobre 2009 par l’Organisation mondiale de la santé mais n’a été définitivement arrêtée par la France que le 27 novembre 2009 car il lui fallait attendre la modification de l’autorisation de mise sur le marché et l’accord de l’Agence européenne du médicament pour se prononcer. Cette exigence n’a pas donné lieu à une communication suffisamment claire. Nul doute que ce délai de plus d’un mois entre les recommandations internationales et la décision nationale a pu donner l’impression que les autorités françaises voulaient maintenir leur position contre toute évidence, alors que tel n’était pas le cas.
La communication à destination du grand public a en outre été parfois trop technique, voire même absconse : il était ainsi signalé, dans la fiche d’information sur la vaccination destinée aux parents des enfants scolarisés en collège ou en lycée que constituait une contre-indication absolue ou définitive l’allergie à l’ovalbumine ; il eut été sans doute été plus opérant de s’en tenir à des termes moins scientifiques mais plus éclairants. Certes, le ministère de l’éducation nationale avait élaboré un document beaucoup plus accessible, mais sa diffusion aux 12 millions d’élèves ne semble pas avoir été aussi générale que prévu.
Cela étant, le défi n’était pas facile à relever : il fallait délivrer une communication gouvernementale de qualité, accessible à tous et évolutive sur un sujet scientifique complexe, dans un contexte de frénésie médiatique qui supposait une parole gouvernementale abondante.
● Une prise en compte insuffisante de signaux pourtant éclairants sur l’état d’esprit de la population
La communication gouvernementale n’a en outre pas suffisamment pris en compte les signaux qui laissaient présager une faible intention de se faire vacciner. Comme l’a indiqué M. Michel Setbon, sociologue au Centre national de la recherche scientifique et à l’École des hautes études en santé publique (136), dès le mois de juin 2009, le service d’information du Gouvernement disposait des résultats d’une étude (137) pessimiste quant aux intentions de la population : 61 % des personnes interrogées étaient certes favorables à leur propre vaccination mais le niveau d’inquiétude était bas et laissait supposer un certain écart entre l’intention et l’action ; en décembre, au pic de la pandémie, 70 % des personnes interrogées déclaraient qu’elles refuseraient la vaccination même si leur médecin traitant la leur proposait.
Par ailleurs, au mois de septembre 2009, la cellule interministérielle de crise (138) disposait des résultats d’une étude qualitative de l’IFOP, menée à la fin du mois d’août et au début du mois de septembre, qui montrait déjà une tendance à l’attentisme de la population face à un risque considéré comme lointain et abstrait ; à la même période, la vaccination était en outre perçue de manière imprécise concernant l’efficacité du vaccin, les personnes prioritaires et le calendrier de la campagne ; il était déjà noté « une revendication particulière port[ant] sur la prééminence du médecin traitant en matière de vaccination, considéré comme un axe de proximité. »
Une étude de l’organisation Gallup pour l’Eurobaromètre européen du mois de décembre 2009 (139) montrait en outre que la France figurait parmi les pays européens dans lesquels l’intention de se faire vacciner était la plus faible (25 %) et parmi les trois pays où le taux de personnes interrogées ne croyant pas à l’efficacité et la sûreté des vaccins était le plus important (43 %).
Ces observations sont aujourd’hui confirmées par les résultats d’une étude de l’unité 912 de l’Institut national de la santé et de la recherche médicale (140) menée du 17 au 25 novembre 2009 qui permet de constater qu’à cette date, seulement 17 % des personnes interrogées avaient l’intention de se faire vacciner. Parmi celles qui refusaient la vaccination, plus de 70 % étaient inquiètes quant à la sûreté des vaccins. L’acceptation de la vaccination pandémique était en outre fortement liée à sa recommandation par le médecin : près de 60 % des personnes conseillées positivement souhaitaient se faire vacciner, contre environ 12 % pour celles qui n’avaient pas reçu un tel conseil.
Divers sondages d’opinion permettaient enfin de déterminer une nette érosion de l’intention de se faire vacciner au fil du temps, jusqu’à ce que soit constatée une mutation du virus en Norvège le 20 novembre 2009.
Évolution des résultats des sondages d’opinion
réalisés par le service d’information du Gouvernement
Date du sondage |
Intention de se faire vacciner « certainement » et « probablement » |
22 et 23 juillet 2009 |
67 % |
24 et 25 août 2009 |
65 % |
31 août et 1er septembre 2009 |
56 % |
14 et 15 septembre 2009 |
39 % |
14 et 15 octobre 2009 |
19 % |
4 et 5 novembre 2009 |
14 % |
27 et 30 novembre 2009 |
26 % |
Source : Ministère de la santé et des sports.
Doit-on, comme M. Michel Setbon, juger que « l’échec de la campagne de vaccination pouvait être prévu [, qu’on ne s’était] pas donné les moyens de l’anticiper et d’en tirer les conséquences opérationnelles » (141) ? On constate, à la lecture des relevés de décisions de la cellule interministérielle de crise, que les autorités étaient conscientes du décalage grandissant entre l’objectif d’une couverture vaccinale importante et les intentions de la population. Ce qui est regrettable, c’est certes que la communication n’ait pas été ajustée en conséquence, mais aussi que les décisions prises concernant l’organisation de la campagne n’aient pas mieux intégré la faible perception du risque par la population et la nécessité de susciter son adhésion et celle des professionnels de santé, notamment libéraux, à une campagne de vaccination que l’on souhaitait massive mais qui reposait sur la liberté de choix.
Proposition n° 31 : Au sein de la cellule interministérielle de crise, mieux associer le pôle « Communication » à la prise de décisions stratégiques.
Proposition n° 32 : Intégrer dans la prise de décision les études engagées sur la perception du risque par la population.
b) L’absence de réaction appropriée des autorités face aux rumeurs
Il faut reconnaître au service d’information du Gouvernement d’avoir identifié, dans une note du 5 décembre 2009, la place d’internet dans le débat sur la vaccination et la faible visibilité, sur ce média, des messages institutionnels jugés trop administratifs ou trop politiques. Il a alors préconisé de les adapter aux internautes pour optimiser leur compréhension et susciter l’adhésion, en étendant la communication gouvernementale à des sites non institutionnels. Mais cela ne s’est traduit que par une seule initiative : l’élaboration d’un partenariat avec le site internet www.doctissimo.fr pour y participer à des forums de discussion. La réponse, tardive, a donc été bien mince au regard de l’enjeu.
Il semble désormais indispensable que la communication gouvernementale envisage une présence plus importante sur ce média où se lancent les alertes et se forgent les opinions. Elle ne doit pas seulement délivrer de l’information officielle : il lui faut réagir aux rumeurs et présenter des contre-arguments.
On pourrait utilement s’inspirer de l’exemple du Centre pour la prévention et le contrôle des maladies d’Atlanta, doté d’une cellule de veille internet richement étoffée et qui permet aux autorités de détecter rapidement les rumeurs, notamment sur les réseaux sociaux, et d’y répondre. Il ne s’agit évidemment pas de mettre en place une surveillance à visée coercitive ou de censure. Il ne s’agit pas non plus de répondre de manière anonyme, au contraire : la réponse de l’État doit pouvoir être identifiée comme telle.
Proposition n° 33 : Renforcer le pôle de veille multimédia au sein du service d’information du Gouvernement et prévoir une réponse adaptée sur internet et surtout les réseaux sociaux.
2. La nécessité d’un débat public sur les risques de pandémie ou de crise sanitaire grave
Au-delà du débat d’experts et de la communication gouvernementale, la gestion d’une crise pandémique doit donner lieu à un grand débat public, comme l’a souligné M. Didier Tabuteau, conseiller d’État et directeur de la chaire Santé de l’Institut d’études politiques de Paris (142). On a vu que les Français ont mis en doute la stratégie adoptée par le Gouvernement, doute qui les a finalement détournés de la campagne de vaccination mise en place. C’est donc qu’il convenait de mieux en expliquer le contenu, par une argumentation détaillée, afin de parvenir sinon à un consensus sur cette stratégie, du moins à une discussion apaisée sur les moyens envisagés qui permettrait de répondre aux interrogations et parfois aux inquiétudes. La gestion de la crise pandémique a souffert d’être essentiellement tournée vers l’action.
Il est cependant difficile de gérer la crise et d’organiser en même temps le débat public ; il semble donc nécessaire de mener un tel travail de concertation et de débat en période interpandémique. Deux instances constituent des lieux privilégiés pour mener un tel débat : la Conférence nationale de santé et des états généraux de citoyens sur les enjeux de la vaccination.
La consultation de la Conférence nationale de santé doit permettre une discussion, par les principaux intéressés, de l’architecture même de la réponse gouvernementale à la pandémie. On peut donc se féliciter qu’elle ait été saisie par le directeur général de la santé, le 8 juin 2010, de la question de la concertation en temps de gestion de crise sanitaire pour tirer les enseignements de la gestion de la pandémie de grippe A(H1N1).
Par ailleurs, il serait sans doute opportun d’organiser, comme cela a été le cas pour la bioéthique, des états généraux sur les enjeux de la vaccination en général qui permettraient à un panel de citoyens représentatifs de la population, préalablement formés à la question, de mener un débat éclairé par les scientifiques sur la politique vaccinale en France. L’organisation de ces états généraux devrait bien sûr avoir lieu en période interpandémique car un tel dispositif serait trop lourd à mettre en œuvre lors d’une crise sanitaire.
Enfin, il est souhaitable que le Parlement exerce un examen régulier et approfondi des politiques de gestion des risques épidémiques. Ce travail a déjà commencé, comme en témoignent les travaux de la commission d’enquête et de l’Office parlementaire des choix scientifiques et technologiques. Plusieurs instruments sont disponibles : auditions régulières en commission, examen des crédits consacrés à la sécurité sanitaire ou encore groupe d’études consacré à cette question.
Proposition n° 34 : Intégrer, dans le plan de prévention et de lutte contre la pandémie grippale, les propositions émises par la Conférence nationale de santé sur la concertation en phase de préparation et de gestion de la crise sanitaire.
Proposition n° 35 : Organiser des états généraux sur les enjeux de la vaccination.
Proposition n° 36 : Évaluer régulièrement, au sein du Parlement, les politiques de gestion des risques épidémiques.
3. Des professionnels de santé insuffisamment associés
On l’a déjà évoqué plus haut : le choix de ne pas recourir à la médecine de ville pour la campagne de vaccination a largement contribué à une démobilisation de professionnels de santé dont le rôle en matière de délivrance des messages sanitaires et de prévention est essentiel. Au-delà, ils ont souffert d’une information jugée inadaptée et d’une formation sur la vaccination qui n’est pas suffisamment développée.
a) Une information inadaptée qui n’a pas permis de susciter l’adhésion
Lors des auditions qu’elle a menées, la commission d’enquête a pu constater un consensus au sein des professionnels de la médecine ambulatoire qui ont considéré avoir manqué d’informations tant sur la pandémie que sur la campagne (143).
Certes, la ministre chargée de la santé s’est attachée à rencontrer, dès l’été et à de nombreuses reprises, les syndicats et les ordres pour leur exposer à la fois la situation sanitaire et le dispositif retenu pour la campagne de vaccination. Mais les canaux de transmission de cette information se sont révélés insuffisants et inadaptés, ce qui a conduit les professionnels de santé libéraux à estimer qu’ils étaient traités avec désinvolture alors que tel n’était pas le cas. Ils ont alors dû chercher à s’informer par leurs propres moyens en consultant la presse spécialisée, les sites internet des institutions sanitaires ou même simplement les médias généralistes.
En réalité, l’organisation du système de soins de premier recours, très dispersée, constitue un atout en termes de maillage territorial mais pose des difficultés pour la communication. Les relais traditionnels sont nombreux : ordres, unions régionales des professions de santé, syndicats professionnels, réseau Sentinelles, groupes régionaux d’observation de la grippe et DGS-Urgent, service internet qui permet aux 60 000 professionnels qui y sont abonnés de recevoir automatiquement des messages du ministère de la santé sur des problèmes sanitaires urgents.
Malgré leur abondance, ces relais n’ont pas permis aux professionnels de santé de se considérer comme suffisamment informés, ce qui les a en partie conduits à adopter une attitude très réservée à l’égard de la campagne de vaccination. On pourrait remédier à cette situation en renforçant l’échelon régional qui permettrait de mieux diffuser l’information vers le réseau de soins de premier recours ; en parallèle, il semble indispensable de disposer d’outils fiables permettant de joindre rapidement les professionnels en cas d’alerte sanitaire.
Proposition n° 37 : Privilégier les unions régionales des professionnels de santé comme relais de l’information délivrée par le Gouvernement en cas de crise sanitaire.
Proposition n° 38 : Inciter les professionnels de santé à communiquer aux unions régionales des professionnels de santé et aux conseils départementaux des ordres leurs coordonnées électroniques.
b) Une formation sur la vaccination sans doute incomplète
La désaffection des personnels de santé que l’on a constatée lors de la campagne de vaccination contre la grippe A(H1N1), très préoccupante, était certes liée à un contexte particulier mais elle traduisait sans doute aussi le sentiment d’une partie d’entre eux qui sont moins convaincus des bienfaits de la vaccination.
La moindre recrudescence de maladies infectieuses telles que la poliomyélite, la tuberculose et la rougeole, grâce à des vaccins anciens, a pu faire oublier le danger potentiel qu’elles représentent, toutes catégories confondues. Cela se traduit d’ailleurs par un taux de vaccination des personnels de santé insuffisant : celui des infirmier libéraux contre la grippe saisonnière est ainsi de l’ordre de 30 %, bien éloigné de l’objectif de 75 % fixé par l’objectif n° 39 figurant en annexe de la loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique. Or la réussite d’une vaccination pandémique ne peut se passer de la mobilisation de l’ensemble des professionnels de santé : ils devraient en être les principaux promoteurs et être capables de répondre à leurs patients quand ceux-ci s’interrogent sur l’utilité de la vaccination ou les effets indésirables d’un vaccin.
Les auditions menées par la commission d’enquête ont permis de constater que ces professionnels se sont eux-mêmes considérés comme insuffisamment formés en matière de vaccination pandémique. Ainsi, M. Michel Chassang, président de la Confédération des syndicats médicaux français, a déploré « l’absence de formation préalable des professionnels » qui aurait permis « de préparer les professionnels à ce type de pandémie, mais surtout de (…) délivrer un message unique. » (144)
La nécessité de renforcer l’enseignement initial dans le domaine de la vaccinologie a été soulignée de manière insistante par le professeur Pierre Bégué, membre de l’Académie nationale de médecine (145), la France étant sur ce plan très en retard, notamment par rapport aux pays scandinaves et aux États-Unis. Mais un effort doit également être consenti en matière de développement professionnel continu : les modifications fréquentes du calendrier vaccinal et l’introduction de nouveaux vaccins nécessitent des adaptations régulières. Ce point avait d’ailleurs été déjà soulevé lors de travaux l’Office parlementaire d’évaluation des politiques de santé (146).
Enfin, il nous faut mener une campagne volontariste d’information du grand public pour rappeler les bienfaits de la vaccination et lutter contre le refus vaccinal et, plus largement, diffuser une culture de santé publique, notamment à l’égard des publics les plus défavorisés, pour pouvoir mobiliser nos concitoyens lors de la prochaine crise sanitaire. Le futur plan « santé » élaboré en concertation entre les ministères de la santé et de l’éducation nationale devrait, de ce point de vue, constituer une avancée intéressante.
Proposition n° 39 : Réaffirmer l’objectif indicatif de vaccination de 75 % des professionnels de santé contre la grippe saisonnière dans la prochaine loi de santé publique.
Proposition n° 40 : Renforcer l’enseignement initial en vaccinologie au cours des études de médecine générale.
Proposition n° 41 : Renforcer le développement professionnel continu des médecins en vaccinologie.
Proposition n° 42 : Prendre toute mesure d’information nécessaire à destination du grand public afin de lutter contre le refus vaccinal et diffuser une culture de santé publique, notamment afin que les Français aient une parfaite conscience des incertitudes scientifiques inévitables lors de l’apparition d’un nouveau virus, ce qui peut conduire les pouvoirs publics à modifier les mesures de prévention au fur et à mesure de l’évolution des connaissances.
La France, pour la première fois de son histoire, a eu à faire face à une pandémie de grippe A(H1N1). On a légitimement cru qu’elle donnerait lieu à une crise sanitaire grave et que, cette fois, nous serions capables de la prévenir et la contrôler. Imprévisible comme la plupart des virus, celui que nous avons eu à affronter s’est révélé finalement peu virulent, au point que la catastrophe un temps pressentie s’est transformée en une épidémie comparable à une grippe saisonnière ; en quelque sorte, une crise sans crise.
La pandémie que nous venons de connaître a été le formidable révélateur d’une crise de confiance : celle de nos concitoyens qui ne croient plus aux messages de prévention et de santé publique, se défient de la parole de l’État en période de crise sanitaire et préfèrent s’en remettre à d’autres sources d’information, aux intérêts divers mais très médiatisées.
Les folles rumeurs sur internet, les attaques violentes du lobby anti-vaccin ou encore les annonces spectaculaires de pseudo-experts en quête de gloire médiatique auront sans doute laissé des traces. Le sensationnalisme a prévalu sur les faits documentés ; la parole officielle a été décrédibilisée par des acteurs sur les motivations desquels on s’interroge encore.
Un tel constat n’est pas nouveau en période de crise sanitaire. La violence des propos sur internet a sans doute été une cause des problèmes connus par la campagne de vaccination, mais elle est aussi probablement la conséquence d’un mal plus profond de la société française qui semble avoir préféré l’irrationnel au rationnel.
Plus largement, on a pu constater le défi que constitue, aujourd’hui, la délivrance d’un message de santé publique qui s’attache à l’intérêt collectif, dans une société à l’individualisme croissant où chacun élabore sa propre balance bénéfice/risque et obéit à une logique personnelle.
Les leçons sont multiples.
Tout d’abord, la population ne croit qu’en ce qu’elle voit : face à un risque considéré comme abstrait, la nécessité de mesures de prévention est très difficile à faire admettre. En revanche, dès que le risque est avéré, tous y adhèrent et se mobilisent, à des degrés divers. Comme il ne provoque pas de gêne, le précepte d’un lavage des mains régulier est facilement accepté. À l’inverse, le port du masque, qui comporte de réels désagréments, n’a pas convaincu de son intérêt. Le risque raisonnable attaché à la vaccination n’a quant à lui été compris et accepté que par une minorité, et une minorité aisée et informée.
La défiance à l’égard de la vaccination constitue un défi pour l’avenir. Demain, il nous faudra peut-être faire face à une nouvelle pandémie à la gravité plus sévère. La mobilisation du corps social sera alors indispensable. Comment ferons-nous si l’on ne croit plus aux mesures de santé publique ? C’est dès aujourd’hui qu’il nous faut convaincre, expliquer et, s’il le faut, contre-argumenter.
Cela nécessite de s’appuyer sur les piliers que sont les professionnels de santé. Leur intervention est indispensable pour restaurer la confiance, surtout lorsque nos concitoyens veulent être éclairés sur la question centrale du rapport entre risque choisi en cas de vaccination et risque encouru en son absence. Le lien qu’ont su tisser les médecins de famille avec leurs patients est à cet égard trop précieux pour qu’on le distende.
Des points préoccupants exigent une réflexion spécifique et approfondie. Le refus de la vaccination par la majorité des personnels infirmiers doit ainsi être sérieusement étudié, car il est étonnant que des personnes particulièrement exposées au risque de pandémie aient préféré s’exposer à ce dernier plutôt qu’à celui, négligeable, résultant d’une mesure de prévention. Était-ce un refus circonstanciel ou traduisant une défiance plus profondément ancrée ?
Les inquiétudes sur l’efficacité et la sûreté des vaccins, qui se sont parfois transformées en peur, et la méconnaissance du rapport privilégié des médecins traitants avec les Français ont été autant d’éléments qui annonçaient la crise de défiance dont a souffert la campagne de vaccination. Il n’a dès lors pas été possible de surmonter les accusations de préparation hâtive et de surveillance insuffisante des effets secondaires, ni les réminiscences d’expériences passées qui ont pu marquer les esprits.
La crise n’a finalement pas eu lieu, et c’est heureux. Mais à l’évidence, les professionnels de santé et la population demandent un changement des règles ; celui-ci est aujourd’hui nécessaire pour obtenir l’adhésion de la population lorsque surviendra une pandémie grave. Cette requête a conduit à la création d’une commission d’enquête alors que les pouvoirs publics n’ont fait – et bien fait – que leur devoir, leurs apparentes tergiversations ne reflétant que la progression, en temps réel, des connaissances sur la pandémie à laquelle ils devaient faire face.
Après cet événement qui n’a pas causé de dommages d’une ampleur aussi grande que celle qu’on avait un temps prévue, nous avons aujourd’hui l’opportunité de réfléchir aux améliorations à apporter pour restaurer la confiance dans les politiques de santé publique et gérer au mieux les futures « crises ». Votre rapporteur espère que les travaux de la commission d’enquête auront contribué à cette réflexion collective.
LISTE DES QUARANTE-DEUX PROPOSITIONS
I.- SUR LE BILAN DE LA VACCINATION AU PLAN EUROPÉEN
– Établir un bilan critique au niveau communautaire des campagnes de vaccination menées par les États membres, afin de dégager des pistes d’amélioration pour la gestion de futures éventuelles pandémies grippales.
II.- SUR LES PROCÉDURES DE NÉGOCIATION AVEC LES LABORATOIRES
– Engager un dialogue avec les industriels afin de mieux évaluer leurs capacités de production et les contraintes pesant sur les modalités de production, en particulier dans le domaine des vaccins.
III.- SUR LA DÉFINITION DE LA STRATÉGIE VACCINALE
– Mettre en place des études épidémiologiques, par un suivi statistique ou de cohortes, lors de toute future campagne de vaccination.
IV.- SUR LA DÉMARCHE D’ACQUISITION DES PRODUITS DE SANTÉ
– Favoriser le recours aux marchés à tranches conditionnelles dans toute situation de crise sanitaire et, en particulier, pour l’acquisition des produits de santé et matériels destinés à alimenter le « stock national santé ».
– Promouvoir, au niveau communautaire, une meilleure coordination entre les États membres en matière de gestion de crise sanitaire et la mise en place d’une stratégie mutualisée d’achats de vaccins.
V.- SUR LA DÉFINITION DE LA PANDÉMIE
– Œuvrer pour que les États membres adoptent une position commune, appuyée par la Commission européenne, afin de demander à l’Organisation mondiale de la santé une révision de la définition de la pandémie intégrant un critère de gravité.
VI.- SUR LES OUTILS DISPONIBLES POUR LUTTER CONTRE LA PANDÉMIE
1. Renforcer l’Établissement de préparation et de réponse aux urgences sanitaires
– Renforcer le rôle de l’Établissement de préparation et de réponse aux urgences sanitaires en l’associant en amont à la prise de contact avec les laboratoires et aux prénégociations.
– Renforcer les moyens de l’Établissement de préparation et de réponse aux urgences sanitaires en matière d’expertise du prix des produits de santé afin d’accroître son efficacité dans les négociations.
2. Adapter et compléter le plan de prévention et de lutte contre la pandémie grippale
– Adapter le plan français de prévention et de lutte contre la pandémie grippale afin d’y renforcer l’évaluation de la gravité du risque encouru et mieux identifier les catégories de mesures à prendre, non seulement par niveau d’alerte, mais aussi en fonction de la sévérité de la pandémie.
– Préciser, dans le plan de prévention et de lutte contre la pandémie grippale, les modalités d’organisation d’une campagne de vaccination pandémique.
3. Opérer quelques ajustements dans le pilotage de gestion de crise
– Prévoir, dès le début d’une crise pandémique, une liaison formalisée et bien identifiée entre les services du ministère de la santé chargés de la gestion de la crise et le ministère de l’intérieur.
– Privilégier une composition souple de la cellule interministérielle de crise en y reconnaissant le rôle essentiel d’appui du ministère de la santé en cas de crise sanitaire et en adaptant sa composition à la gravité de la pandémie.
4. Conforter l’expertise
– Poursuivre l’effort de mise en œuvre d’un réseau unifié de surveillance épidémiologique à l’échelle européenne en mettant l’accent sur une définition commune du syndrome grippal, en lien avec le Centre européen pour la prévention et le contrôle des maladies, et rapprocher les méthodes de surveillance pour disposer d’indicateurs précis, fiables et harmonisés.
– Intégrer le Comité de lutte contre la grippe dans le Haut conseil de la santé publique dont il pourrait constituer un groupe de travail, ce qui garantirait la publicité de ses travaux.
– Prévoir une saisine précoce et systématique du Haut conseil de la santé publique en cas de risque pandémique.
– Créer au sein du Haut conseil de la santé publique une commission spécialisée sur les risques épidémiques, à la composition plurielle, pour renforcer le caractère opérationnel des avis du haut conseil.
5. Améliorer le pilotage territorial de la crise
– Renforcer le rôle des zones de défense comme échelon territorial de déclinaison des directives nationales ; instaurer un responsable décentralisé du département des urgences sanitaires dans chaque zone de défense ; adapter l’organisation de l’Établissement de préparation aux urgences sanitaires à ces zones pour que ses stocks soient gérés au niveau de ces échelons ; prévoir, au sein de chaque agence régionale de santé, un référent « zone de défense ».
– Instituer dans chaque zone de défense un conseil zonal de préparation aux crises sanitaires présidé par le préfet de zone et composé de représentants de l’ensemble des acteurs de la gestion de crise sur le terrain.
– Informer régulièrement les collectivités locales sur l’architecture générale d’une campagne de vaccination de grande ampleur. Cette information serait délivrée par le ministère de l’intérieur après consultation des principales associations de collectivités.
– Réviser le volet territorial du plan de prévention et de lutte contre la pandémie grippale pour y intégrer les agences régionales de santé qui joueraient le rôle de « préfets sanitaires » en appui des préfets des zones de défense et seraient chargées de la mobilisation des personnels de santé, de la préparation sanitaire des centres et de rendre compte de leur activité auprès de la zone de défense, les préfectures de département se concentrant sur les autres aspects logistiques.
– Établir et actualiser annuellement, dans chaque zone de défense, en liaison avec les agences régionales de santé et les unions régionales des professionnels de santé, une liste des personnels de santé volontaires pour participer à des opérations collectives de gestion de crise sanitaire.
– Recenser dès aujourd’hui, dans chaque zone de défense, les lieux susceptibles d’être utilisés pour gérer une éventuelle campagne de vaccination pandémique.
– Associer, au niveau départemental, les collectivités territoriales, les référents sanitaires des communes et les professionnels de santé lors du recensement des équipements à utiliser.
– Attribuer aux préfectures de département une marge de manœuvre dans l’organisation matérielle des centres pour tenir compte, au mieux, des spécificités des territoires.
– Renforcer le suivi et l’évaluation régulière du déroulement des opérations sur le terrain en établissant une chaîne de remontée des informations vers la préfecture de zone de défense.
6. Renforcer le rôle des professionnels de santé dans la vaccination pandémique
– Favoriser le recours à la médecine ambulatoire parallèlement à des centres de vaccination spécifiques en cas de campagne de vaccination pandémique.
– Inscrire dans le champ des conventions nationales liant l’Union nationale des caisses d’assurance maladie et les syndicats de professionnels de santé les conditions d’exercice de la vaccination pandémique.
– Entamer une concertation entre les agences régionales de santé et les représentants des professionnels de santé, en particulier les unions régionales et les conseils des ordres, pour inscrire dans les schémas régionaux d’organisation des soins les modalités concrètes de recours à la médecine ambulatoire pour une vaccination pandémique.
– Lorsque cela est possible, déconcentrer les vaccinations pandémiques dans les communautés de grande taille telles que les établissements scolaires, grandes entreprises et administrations qui bénéficient d’équipes médicales appropriées.
VII.- SUR LA COMMUNICATION
1. Instaurer le débat public et adapter la communication gouvernementale vers le grand public
– Instaurer, en cas d’alerte pandémique, une conférence nationale constituée des représentants des collèges scientifiques qui permettrait une communication consensuelle sur la nature du risque et les moyens médicaux disponibles pour y faire face.
– Au sein de la cellule interministérielle de crise, mieux associer le pôle « Communication » à la prise de décisions stratégiques.
– Intégrer dans la prise de décision les études engagées sur la perception du risque par la population.
– Renforcer le pôle de veille multimédia au sein du service d’information du Gouvernement et prévoir une réponse adaptée sur internet et surtout les réseaux sociaux.
– Intégrer, dans le plan de prévention et de lutte contre la pandémie grippale, les propositions émises par la Conférence nationale de santé sur la concertation en phase de préparation et de gestion de la crise sanitaire.
– Organiser des états généraux sur les enjeux de la vaccination.
– Évaluer régulièrement, au sein du Parlement, les politiques de gestion des risques épidémiques.
2. Améliorer les modalités d’information des professionnels de santé
– Privilégier les unions régionales des professionnels de santé comme relais de l’information délivrée par le Gouvernement en cas de crise sanitaire.
– Inciter les professionnels de santé à communiquer aux unions régionales des professionnels de santé et aux conseils départementaux des ordres leurs coordonnées électroniques.
3. Mener une politique vaccinale volontariste
– Réaffirmer l’objectif indicatif de vaccination de 75 % des professionnels de santé contre la grippe saisonnière dans la prochaine loi de santé publique.
– Renforcer l’enseignement initial en vaccinologie au cours des études de médecine générale.
– Renforcer le développement professionnel continu des médecins en vaccinologie.
– Prendre toute mesure d’information nécessaire à destination du grand public afin de lutter contre le refus vaccinal et diffuser une culture de santé publique, notamment afin que les Français aient une parfaite conscience des incertitudes scientifiques inévitables lors de l’apparition d’un nouveau virus, ce qui peut conduire les pouvoirs publics à modifier les mesures de prévention au fur et à mesure de l’évolution des connaissances.
CONTRIBUTION DE MME JACQUELINE FRAYSSE,
DÉPUTÉE DES HAUTS-DE-SEINE (GROUPE GDR)
ET MEMBRE DE LA COMMISSION D’ENQUÊTE
Si l’intérêt des auditions réalisées dans le cadre de la commission d’enquête sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1) est indiscutable, il convient de souligner un certain nombre de différences d’appréciation par rapport à ses conclusions, notamment concernant la responsabilité du Gouvernement, qui ne peut être minorée, et la conception trop restrictive de la démocratie sanitaire telle qu’esquissée dans ce rapport. Par ailleurs, un certain nombre de propositions peuvent être formulées concernant la nécessaire maîtrise publique de l’industrie pharmaceutique, gage d’efficacité et de transparence.
La situation inédite à laquelle le Gouvernement a dû faire face ne saurait l’absoudre des erreurs manifestes commises dans la gestion de cette crise.
Il est certes indéniable que le Gouvernement a dû composer avec les incertitudes et les doutes initiaux quant à la virulence du virus. La responsabilité de l’Organisation mondiale de la santé concernant l’évaluation du niveau des risques liés à la pandémie est également engagée. À ce propos, le refus des responsables de l’OMS de venir s’expliquer devant la commission d’enquête est d’autant plus regrettable qu’il ne peut qu’entretenir les doutes quant à l’indépendance de l’organisation mondiale, notamment vis-à-vis de l’industrie pharmaceutique.
Ce n’est pas tant l’application du principe de précaution qui peut être reprochée au Gouvernement, que la façon dont il a été mis en œuvre. Car le constat est accablant : non seulement la campagne de vaccination, au coût exorbitant, a été un fiasco, mais surtout, elle a durablement jeté sur les politiques de santé publique en général, et sur le principe des vaccinations en particulier, un voile de suspicion dont les conséquences pourraient être dramatiques si notre pays devait faire face à une pandémie plus virulente.
Manifestement, le Gouvernement a organisé le traitement des risques de la pandémie en s’enfermant dans un schéma rigide qui s’est avéré non seulement inadapté, mais au bout du compte contre-productif. Il est assez significatif à cet égard que la campagne de vaccination ait été guidée par le ministère de l’intérieur, et non pas par celui de la santé.
Il est par ailleurs regrettable que le Gouvernement n’ait pas cherché à conditionner l’achat des vaccins à l’évolution de la maladie, comme ont su le faire d’autres pays comme l’Espagne ou les États-Unis. Quant au choix de recourir à une campagne de vaccination de masse, il est d’autant plus discutable que l’Institut de veille sanitaire savait suffisamment tôt que les vaccins ne seraient pas disponibles en quantité suffisante avant le début de la première vague pandémique et recommandait une vaccination ciblée sur les personnes à risques, comme l’indique l’audition de la directrice générale de l’InVS.
De même, avec la mise à l’écart des médecins généralistes – outre que cette décision est en contradiction flagrante avec les déclarations de la ministre de la santé affirmant que les généralistes constituent les piliers de notre système de santé –, le Gouvernement s’est privé d’une source d’évaluation du développement et de la dangerosité de la pandémie, ainsi que d’un précieux relais.
La communication du Gouvernement a été à l’image de sa réponse sanitaire : rigide et inefficace. À sens unique, destinée à faire accepter par la population et les soignants des décisions prises dans le secret des cabinets ministériels et des réunions d’experts, cette communication, relayée pourtant par un matraquage médiatique d’une rare intensité, n’est pas parvenue à palier un manque patent de concertation. Elle n’a contribué qu’à décrédibiliser un peu plus la parole gouvernementale.
Au bout du compte, le débat a eu lieu, mais, en refusant de l’organiser, le Gouvernement n’a pu en éviter les excès. Les citoyens qui ne trouvaient pas dans la communication gouvernementale les éléments leur permettant de se forger une opinion se sont tournés vers d’autres sources, et notamment internet sur lequel des contributions fondées sur de véritables compétences, argumentées et constructives, pouvaient voisiner avec de folles rumeurs empreintes d’irrationalité. Seule l’organisation d’un débat public aurait permis de distinguer clairement les unes des autres. C’est l’un des principes de la démocratie sanitaire, et même de la démocratie en général, que le Gouvernement redoute.
Si les conclusions de la commission d’enquête évoquent bien ce déficit de démocratie sanitaire, elles donnent de celle-ci une définition trop restrictive.
On ne peut ainsi se contenter, comme le préconise le rapport, d’organiser des moments d’information entre les crises. Si des états généraux sur les enjeux de la vaccination peuvent être utiles, ils ne sauraient remplacer une action permanente et diversifiée de l’État en matière d’information dans le domaine de la santé publique et de la prévention. Quant à l’évaluation régulière par le Parlement des politiques de gestion des risques épidémiques, il s’agit là d’une évidence qu’il est regrettable de devoir rappeler.
Le rapport de la commission d’enquête propose également d’intégrer dans les plans de prévention et de lutte contre la pandémie grippale les recommandations de la Conférence nationale de santé. Cette proposition est d’autant plus pertinente que, dès 2008, cette même Conférence nationale de santé formulait déjà un certain nombre de propositions intéressantes (147) dont on ne peut que regretter aujourd’hui qu’elles n’aient pas davantage été prises en considération.
La Conférence nationale de santé préconisait ainsi la création d’un code de déontologie de l’expertise venant en appui des décisions en santé publique, le contrôle des liens d’intérêt, par une entité indépendante prestataire de services, des comités d’experts, par exemple l’Agence d’évaluation de la recherche et de l’enseignement supérieur (AERES), ou le renforcement des sanctions en cas de non-respect du code de déontologie.
Mais surtout, la Conférence nationale de santé proposait l’introduction d’un débat contradictoire sur des questions de santé publique en donnant aux représentants des associations agréées la possibilité de poser des questions à l’expert et d’émettre des observations qui seraient jointes au rapport final. « Cette procédure contradictoire, écrivaient les membres du bureau de la Conférence nationale de santé, faciliterait l’acceptabilité des décisions en santé publique par une participation en amont à l’expertise ».
Énumérant les différentes mesures législatives ayant permis de renforcer la participation des citoyens dans les politiques de protection de l’environnement (148), la Conférence nationale de santé s’étonnait enfin que ces efforts conduits dans le domaine de l’environnement n’aient pas été promus en matière de santé publique, alors même que le principe de précaution (149) est intimement lié à la question de la démocratie.
Il s’agit bien là d’un problème de conception de ce que doit être la concertation.
Elle ne saurait être conçue comme le moyen de faire accepter des décisions prises en amont, ou comme un moyen d’assurer l’adhésion des personnes concernées. Elle doit respecter chacun et s’attacher à convaincre, comme le précisait fort justement M. Hubert Blanc, premier président de la Commission nationale du débat public, lorsqu’il précisait que « la concertation en amont est une exigence démocratique contemporaine de la démocratie ; elle est une condition de l’efficacité. Elle oblige chacun à être meilleur : le décideur quand il doit faire comprendre ses choix, l’ingénieur quand il doit défendre ses solutions techniques, l’opposant qui ne peut se contenter d’une orchestration bruyante de l’indignation et du procès d’intention, mais doit dire lui aussi le pourquoi et le comment des solutions qu’il préconise » (150).
Il est dommage que ces principes de démocratie n’aient pas été appliqués à la gestion de la pandémie grippale. Une plus grande concertation, l’association des médecins de ville, leur mise à contribution en tant que source d’information en direction du Gouvernement sur la réalité de la pandémie et en direction des citoyens sur la meilleure façon d’y faire face ne sont en aucun cas contradictoires avec le principe de précaution. L’audition des chercheurs, sociologues, psychologues, historiens, qui se sont penchés sur l’histoire des épidémies et ont étudié le comportement des populations face aux risques pandémiques aurait permis de prévenir les réactions d’inquiétude, voire d’hostilité, des citoyens face à cette menace et à la campagne de vaccination. Une plus grande transparence sur les conflits d’intérêt, l’organisation d’auditions publiques, d’ailleurs prévues par la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, auraient été le plus sûr moyen d’assurer l’adhésion des citoyens.
Enfin, considérant l’influence prêtée aux experts dans la gestion de cette crise pandémique et leurs liens, réels ou supposés, avec l’industrie pharmaceutique, il apparait plus que jamais urgent de mettre en place un pôle public du médicament.
Les liens que peuvent entretenir certains experts qui ont conseillé le ministère de la santé ne suffisent pas à remettre en cause leur objectivité. Ces liens sont avant tout la conséquence de la faiblesse du financement public de la recherche en France qui conduit les chercheurs, encouragés en cela par le Gouvernement, à se tourner vers les entreprises privées pour faire financer tout ou partie de leurs travaux. Il n’en demeure pas moins que ces liens de dépendance et le fait qu’ils aient parfois été occultés ont jeté la suspicion sur la parole de ces experts et sur les décisions prises par le Gouvernement quant à l’intérêt de se faire vacciner et l’éventuelle dangerosité des vaccins. En ce sens, il s’agit bien d’une question de santé publique placée sous la responsabilité de l’État qui engage l’avenir et les futures campagnes de vaccination.
Le même doute subsiste concernant l’Organisation mondiale de la santé. La modification par l’OMS de la définition de la pandémie, en supprimant le critère de létalité, a en effet permis à l’organisation mondiale de déclencher prématurément le niveau 6 de l’alerte et d’enclencher ainsi la fabrication des vaccins et, surtout, le processus d’achat par les États.
Si la loi n° 2009-967 du 3 août 2009 de programmation relative à la mise en œuvre du Grenelle de l’environnement, dite « Grenelle I », a créé une instance de garantie de l’indépendance de l’expertise, celle-ci est toujours dans l’attente des décrets d’application. La portée de cette instance, dans tous les cas, ne pourra qu’être limitée, se contentant de faire la clarté sur les liens de dépendance des experts opérant en France.
D’une toute autre portée serait la création d’un pôle public du médicament, au service de l’intérêt général, où l’expertise des chercheurs œuvrant dans ce pôle ne devrait plus être troublée par des considérations financières.
Nous serons attentifs aux suites qui seront données au rapport de la commission d’enquête, comme à celui de l’Office parlementaire d’évaluation des choix scientifiques et technologiques. Car la mise en œuvre des recommandations formulées dépend essentiellement d’une volonté politique et d’une conception de la démocratie.
Paris, le 5 juillet 2010
CONTRIBUTION DES DÉPUTÉS DU GROUPE SRC
MEMBRES DE LA COMMISSION D’ENQUÊTE
Un gâchis dont toutes les leçons ne sont pas tirées
Les députés du groupe SRC avaient réclamé dès la première audition de la ministre de la santé, en juillet 2009, la création d’une mission d’information sur l’épidémie de grippe A(H1N1) afin de pouvoir éclairer nos concitoyens sur la gestion de cette crise sanitaire. La constitution d’une mission d’information aurait permis de mieux associer la Représentation nationale à son suivi car les quelques auditions de la ministre de la santé (dont une seulement du ministre de l’intérieur) accompagnée des responsables de l’administration n’étaient pas suffisantes. Il aurait été plus judicieux d’entendre l’ensemble des acteurs afin de rendre compte de tous les problèmes rencontrés et d’en tirer des leçons pour la gestion d’une éventuelle pandémie à l’avenir. La constitution de cette mission ne nous a jamais été accordée malgré des demandes réitérées, au motif que ce serait faire preuve de défiance à l’égard du Gouvernement, alors que le rôle des parlementaires est avant tout de contrôler son action.
Contre toute logique, la création de cette commission d’enquête a été toutefois accordée au groupe Nouveau Centre, avec un rapporteur issu de la majorité gouvernementale et en écartant donc tout membre de l’opposition de sa direction. Le président du groupe Nouveau Centre avait d’ailleurs assuré dans l’hémicycle qu’il n’était pas question de remettre en cause la politique du Gouvernement.
Malgré leur profond mécontentement devant la mise en place d’une commission d’enquête a minima, les députés du groupe SRC ont accepté d’y travailler mais sans illusions et sans véritables moyens. En effet, cette commission a été créée le 24 février mais elle a été mise en place seulement le 31 mars. Elle aura donc eu au total trois mois de travail effectif, au lieu des six mois prévus par le Règlement de l’Assemblée.
Le rapport qui en résulte n’est pas à la hauteur du véritable bilan qui aurait dû être tiré de ce vaste gâchis, même si certaines propositions ont tout de même tenu compte des constats flagrants qui sont ressortis des auditions : la vaccination de masse, le caractère rigide de l’organisation, des circulaires inapplicables, la mauvaise négociation des contrats pour les vaccins ou bien encore l’erreur de ne pas associer les médecins de ville.
Un objet d’enquête restreint dans sa définition et des lacunes importantes
L’objet de ses enquêtes a été limité à la gestion de la campagne de vaccination dont tout le monde a retenu les images surannées de ces gymnases, avec en alternance des salles vides ou des files d’attente interminables.
Mais l’objet de cette commission a été encore plus circonscrit par ses responsables. Ainsi on peut déplorer l’absence de toute analyse approfondie sur plusieurs points :
– les fameux contrats « dormants » avec les laboratoires pharmaceutiques qui entraient en action dès lors que l’OMS annonçait le passage en phase 6 de la pandémie. La commission a exclut de son champ d’investigation l’OMS, celle-ci ayant refusé d’être auditionnée.
– L’expertise scientifique n’est pas abordée alors que c’est un élément essentiel pour comprendre certains aspects de la gestion de cette pandémie. Le traitement des liens d’intérêts susceptibles d’exister entre les experts et les laboratoires a pourtant été au centre des polémiques.
– Les plans de continuité d’activité dans les entreprises et les administrations n’ont pas été traités.
– L’efficacité et les modalités d’utilisation des antiviraux ou la pertinence des procédures d’AMM retenues pour les vaccins pandémiques.
S’agissant des antiviraux, il aurait été utile d’approfondir bien plus ce sujet. En effet il serait urgent de prévoir des études cliniques sur le Tamiflu (dont les effets secondaires ne sont pas anodins), afin de faire la lumière sur sa réelle efficacité en matière de prévention, afin de savoir s’il peut-être administré aux populations les moins fragiles dans l’attente d’une vaccination puisqu’il a été démontré l’impossibilité de mener une vaccination de masse.
Concernant la pharmacovigilance, le rapport préconise de mener des enquêtes épidémiologiques. Mais une véritable pharmacovigilance nécessiterait de mettre en place un suivi à court terme, mais aussi à long terme, des personnes vaccinées pour approfondir la question des effets secondaires. Si ce travail n’est pas fait, on aura immanquablement à l’avenir de nouvelles polémiques sur la vaccination.
Le rapport indique que « à la date d’adoption du rapport il est impossible de connaître la ventilation par type de population du taux de couverture vaccinale ». Pourtant le directeur général de la santé a cité plusieurs fois des chiffres précis… Ce manque de statistiques et de bilan par la CNAM qui a géré les bons de vaccination laisse perplexe.
À l’automne prochain, le vaccin contre la grippe saisonnière sera trivalent (comme tous les ans) et il inclura le virus A(H1N1). Le rapport aurait dû proposer de prévenir les personnes prioritaires pour cette vaccination saisonnière qu’elles risquent d’être vaccinées une deuxième fois, voire même une troisième fois pour celles qui ont eu deux injections. Les personnes de plus de 65 ans seront donc vaccinées alors qu’elles n’étaient pas non prioritaires pour la vaccination de masse puisqu’elles ne figuraient pas dans les populations à risque concernant le H1N1.
Enfin, il convient de souligner que l’on comptabilise 3,46 millions de doses de vaccins gâchées (jetées ou mises au rebut), alors que l’on a environ 5,3 millions de personnes qui se sont fait vacciner. Le rapport montre bien sur ce point que les raisons de ce gâchis sont les modalités d’organisation de la vaccination et le conditionnement en multidoses. Cela met fin définitivement aux arguments du Gouvernement sur le choix de vacciner dans des centres plutôt que de laisser les médecins traitants s’en occuper.
On peut se poser des questions sur le devenir des stocks de vaccins, car on a à l’ÉPRUS près de 21 millions de doses, dont 12 millions qui périment en octobre 2010 et 9 millions qui périment en mars 2011.
Tout cela démontre l’incapacité du Gouvernement à adapter un dispositif qui était construit pour une éventuelle pandémie de grippe H5N1, et le manque total de prise en compte des retours d’expérience dès septembre 2009 de l’hémisphère Sud qui montraient la moindre virulence de cette grippe et dénombraient un nombre de cas constatés asymptomatiques de l’ordre de 70 %.
En conclusion, ce rapport n’est pas totalement satisfaisant même s’il reprend un certain nombre de critiques et d’interrogations qui ont été portées par les députés du groupe SRC et vivement contestées par la ministre de la santé.
Ses critiques sur la communication dans les médias et sur internet font l’impasse sur le manque de lisibilité des messages gouvernementaux. Or, il aurait été nécessaire de comprendre si cela tenait à un problème structurel ou bien à une mauvaise gestion conjoncturelle, ce qui n’implique pas les mêmes réponses.
Ce qui est certain, c’est que l’absence de débat public que nous avons dénoncé à plusieurs reprises relève de la responsabilité gouvernementale et permet d’expliquer la crise de confiance de la population et la remise en cause de la crédibilité des pouvoirs publics en matière de politique de santé publique.
La commission d’enquête sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1) se réunit le mardi 6 juillet à neuf heures quarante, sous la présidence de M. Jean-Christophe Lagarde, pour examiner le rapport d’enquête de M. Jean-Pierre Door, député.
M. le président Jean-Christophe Lagarde. Mes chers collègues, notre commission achève aujourd’hui ses travaux. Ils ont été intenses : nous avons procédé à 52 auditions et entendu 75 personnalités. Comme je l’avais annoncé en commençant, j’ai accepté de donner suite à de nombreuses demandes d’audition et de modifier le calendrier initialement fixé. C’est ainsi que nous avons pu entendre des représentants du laboratoire Roche, du directeur des affaires sanitaires et sociales de Paris, de l’Agence européenne du médicament et des syndicats professionnels de santé, de même que M. Marc Girard, l’association Voisins Solidaires et quelques autres. D’autres auditions étaient concevables, d’autres encore ont été demandées. Mais, comme vous le savez, je n’ai pu obtenir de réponse favorable de la part de l’Organisation mondiale de la santé, l’OMS, et les contraintes de calendrier nous interdisaient de prolonger nos travaux au-delà du 14 juillet et de la fin de la session extraordinaire.
Malgré tout, ces travaux ont été, je crois, empreints d’un grand sérieux. À cet égard, je tiens à remercier nos collègues les plus assidus : notre rapporteur Jean-Pierre Door, cela va de soi, M. Gérard Bapt, M. Jean Mallot, Mme Catherine Lemorton, Mme Catherine Génisson, Mme Marie-Louise Fort et M. Guy Lefrand, notamment.
Sur le fond, tous les aspects de la lutte contre la pandémie grippale n’ont pu être examinés dans le détail, mais tous les membres de la commission ont pu intervenir et s’exprimer sur tous les points qu’ils souhaitaient aborder. Surtout, si le rapport, consultable depuis le 30 juin – délai clairement annoncé et exceptionnellement long au regard des précédents –, ne traite que de la campagne de vaccination stricto sensu comme en avait prévenu notre rapporteur, chacun a été à même de présenter une contribution et, tout en restant d’une taille raisonnable – à peu près 120 pages sans les annexes – il reprend, sinon toutes, du moins la plupart des idées émises lors de notre réunion du 17 juin. Ce document est sans nul doute une mine d’informations et de suggestions et, à ce titre, il est appelé à être abondamment lu et commenté.
Il est à nouveau disponible dans cette salle. Dans la mesure où, aux termes de l’article 144-2 du règlement, il ne peut être rendu public avant cinq jours francs, je vous demanderai de vous abstenir de l’emporter. Je vous remercie de votre compréhension, tout en admettant que cette disposition constitue un archaïsme. Je saisirai d’ailleurs le président de l’Assemblée nationale de ce point qui me paraît assez curieux : pourquoi cinq jours, alors que nous allons adopter le rapport et qu’il lui sera remis dans quelques heures ?
Dernier point marquant notre volonté de transparence : pour la première fois depuis qu’existent des commissions d’enquête, cette dernière réunion fera l’objet, si vous n’y voyez pas d’inconvénient, d’un compte rendu. Ainsi, en sus des diverses contributions, les propos et analyses de chacun d’entre vous figureront dans le rapport publié.
Enfin, une conférence de presse destinée à présenter ce rapport est prévue, une fois écoulé le délai prévu à l’article 144-2, le 15 juillet prochain, salle Lamartine, à dix heures trente.
Mme Catherine Lemorton. Ayant commencé ses travaux le 31 mars, cette commission d’enquête – que je qualifierai de commission d’enquête
« a minima », en me référant à son intitulé – a travaillé non pas six mois, mais trois seulement et n’a donc pas traité l’ensemble des problèmes. Par conséquent, certains restent en suspens et ne manqueront pas de se reposer lors d’une prochaine pandémie. Je regrette ce manque de temps, car le sujet valait mieux – il ne s’agissait pas des infirmières bulgares !
Ensuite, ce rapport, non transportable et non photocopiable – mais soit : ce sont les règles applicables aux commissions d’enquête –, a été mis à notre disposition le jour de la semaine où le travail parlementaire est le plus intense, à savoir mercredi dernier. Dans la mesure où nous devions remettre notre contribution le lundi suivant, à dix-sept heures, nous ne pouvions le consulter que mercredi, jeudi et vendredi derniers, à des horaires déterminés. Or, c’est ce matin que les groupes politiques sont appelés à exprimer leur vote, sans avoir pu se réunir. Cela n’est pas acceptable au regard de l’importance du sujet.
Le flou persistera sur certains points qui ne sont pas mineurs, disais-je.
Premièrement, il est écrit, page 9 du projet de rapport, que l’efficacité des antiviraux ne sera pas évoquée. Or, si un point n’a pas fait l’unanimité pendant cette pandémie, c’est bien l’utilisation du Tamiflu à des fins préventives. Comme je l’ai expliqué lors de notre dernière réunion, dès lors qu’il est acquis que, même avec la contribution des médecins libéraux, l’on ne peut vacciner tout le monde lors d’une pandémie, il conviendrait que l’on s’assure de l’effet préventif du Tamiflu grâce à des essais cliniques sérieux réalisés dans les deux ou trois prochaines années, en vue de le prescrire aux populations les moins fragiles. Cette question demeurera en suspens.
Deuxièmement, le rapport ne consacre que deux lignes à la pharmacovigilance, pourtant essentielle eu égard aux effets secondaires des vaccins. Si un plan de pharmacovigilance a été mis en place à court terme, rien n’est précisé s’agissant d’un plan à moyen et long termes. Par conséquent, la population exprimera de nouveau les mêmes réticences vis-à-vis du vaccin.
Troisièmement, la question de l’expertise – aide à la décision politique – et celle des conflits d’intérêts sont écartées d’emblée. Je trouve également cela très choquant, monsieur le rapporteur, car ces sujets ont, eux aussi, été maintes fois abordés au cours de nos réunions.
Ces trois lacunes, que dénonce la contribution du groupe SRC, expliquent la méfiance et la non-adhésion de la population française au plan vaccinal.
M. Jean Mallot. Le rapport est-il définitif ou peut-il être modifié ?
M. le président Jean-Christophe Lagarde. Vous aviez la possibilité, dans un premier temps, de proposer une contribution. Vous pouvez également aujourd’hui proposer des modifications au rapporteur par le biais d’amendements écrits et présentés, ici, en séance. En effet, Monsieur Jean Mallot, nous devons voter sur un texte et non sur des intentions. C’est la raison pour laquelle j’avais souhaité un débat entre nous le 17 juin dernier : il a permis à certains, dont moi, d’exprimer leurs idées. Il appartenait au rapporteur de les reprendre ou non. Les commissaires prendront aujourd’hui position sur le rapport, en fonction de ses réponses.
Madame Catherine Lemorton, j’aurais préféré moi aussi que notre commission travaille un mois et demi de plus mais, honnêtement, je ne pense que nos collègues auraient fait preuve d’une grande assiduité au mois d’août. Déjà, les auditions programmées le jeudi ont rarement rassemblé plus de trois ou quatre d’entre eux…
La création de la commission d’enquête le 24 février ayant été suivie d’une période de suspension des travaux liée aux élections régionales, il est vrai que nous avons débuté nos travaux fin mars. Cela ne nous a pas empêchés, à un rythme soutenu j’en conviens, de réaliser 52 auditions pour entendre 75 personnes. Les commissaires ont pu poser toutes les questions qu’ils souhaitaient, y compris sur des sujets sortant du champ assigné à la Commission – ainsi sur les antiviraux que ne mentionnait pas la proposition de résolution présentée par le groupe Nouveau Centre ; pour autant, vous avez demandé l’audition du laboratoire Roche, je l’ai permise, et vous avez pu poser des questions à sa présidente.
La pharmacovigilance a souvent été évoquée au cours de nos réunions, c’est vrai, mais elle ne semble pas avoir posé de problème particulier dans cette campagne de vaccination. Au reste, elle fait l’objet d’une analyse dans le rapport.
Quant aux conflits d’intérêts, nous avions précisé dès le début de nos travaux qu’il serait regrettable que l’Assemblée nationale et le Sénat travaillent sur les mêmes sujets. Or, à la Haute assemblée, le groupe communiste a souhaité une commission d’enquête consacrée exclusivement à ce sujet. En ce qui nous concerne, nous avons voulu nous concentrer sur le problème de santé publique mais nous avons pu interroger les experts et les laboratoires sur cette question, et tous nous ont demandé de légiférer en faveur de plus de transparence. Ce sujet n’a donc nullement été éludé.
S’agissant des conditions de consultation du rapport, nous étions tenus par l’article 144-2 du Règlement mais vous avez disposé de délais plus longs que pour bon nombre de rapports de commission d’enquête. Il vous a même été possible de procéder à cette consultation en dehors des horaires fixés, comme peut en témoigner Mme Jacqueline Fraysse.
Enfin, les commissions d’enquête n’ont pas obligatoirement une durée de six mois. Il s’agit d’une durée maximale. J’ajoute que la plus célèbre, la commission sur l’affaire dite d’« Outreau », n’a auditionné que pendant trois mois, et la plupart des autres ont travaillé dans un temps du même ordre. La commission d’enquête du Sénat, qui avait prévu de poursuivre ses travaux jusqu’au 10 août, les arrêtera finalement le 28 juillet. De la même façon, il m’étonnerait fort que les travaux de la commission d’enquête que l’Assemblée vient de créer sur les mécanismes de spéculation affectant le fonctionnement des économies commencent avant septembre, car nos collègues ne procéderont certainement pas à des auditions au mois d’août.
Nous avons dû composer avec de nombreuses contraintes. D’ailleurs, pour tenir compte des classiques interruptions estivales, électorales et autres, je suggérerai au Président de l’Assemblée nationale une réforme du Règlement visant à porter la durée des commissions d’enquête de six ou neuf mois afin de travailler dans des conditions plus sereines.
M. le rapporteur Jean-Pierre Door. Le rapport que j’ai le plaisir de vous présenter aujourd’hui s’en tient, comme je vous l’ai annoncé à plusieurs reprises, aux thèmes figurant dans l’intitulé de la commission d’enquête : la programmation, l’explication et la gestion de la campagne de vaccination contre la grippe A(H1N1).
Je sais que nous avons eu l’occasion, lors de certaines auditions, d’évoquer des sujets très importants, tels que l’indépendance des experts, le rôle de l’Organisation mondiale de la santé (OMS), la pertinence de l’utilisation d’antiviraux ou encore les procédures d’autorisation de mise sur le marché utilisées pour les vaccins maquettes. Sciemment, je n’ai pas voulu traiter ces questions qui n’étaient pas au cœur de nos travaux et dont, en outre, se sont occupées ou s’occupent d’autres instances : l’Office parlementaire des choix scientifiques et technologiques, la commission d’enquête du Sénat, l’Assemblée parlementaire du Conseil de l’Europe.
J’en viens au fond proprement dit. Je n’ai pas cherché à nier l’évidence, à savoir que les résultats obtenus à l’issue de la campagne étaient décevants au regard des moyens engagés. Mais, comme vous tous je pense, j’ai été animé par la volonté de faire des propositions pour que nous fassions mieux la prochaine fois : mieux lors de la négociation des contrats, mieux pour la diffusion des messages de santé publique, mieux pour sensibiliser les Français à la vaccination, mieux enfin pour associer les professionnels de santé aux futures campagnes de vaccination pandémique.
Vous avez pu prendre connaissance de mon rapport. Je ne vais donc pas en détailler le contenu, mais simplement vous en rappeler les principales lignes.
La première partie du rapport traite précisément du bilan de la campagne de vaccination, qui est pour le moins insatisfaisant, à deux titres.
Tout d’abord, une acquisition massive de vaccins pour un faible taux de vaccination de la population – il a été évalué à 8,5 %.
En second lieu, une forte incompréhension entre les autorités sanitaires et le corps médical, en particulier les médecins généralistes, qui n’ont pas été associés à la campagne et ont donc eu le sentiment d’être exclus d’une opération d’ampleur en matière de santé publique.
Le tout pour un coût certes beaucoup moins élevé que le montant de 1,1 milliard d’euros avancé initialement puisque, pour la campagne de vaccination en elle-même, il s’établirait en définitive autour de 670 millions d’euros, mais pour un coût dont on doit reconnaître qu’il reste important, surtout au regard du résultat. À signaler toutefois un point finalement positif, bien qu’anecdotique pour nous : les vaccins produits en France ont été largement exportés : au premier trimestre 2010, ils étaient au septième rang des dix produits les plus exportés, devant les cosmétiques.
Il convient toutefois de relativiser ce bilan. Non pas pour minimiser le constat d’échec, réel, sur le plan de la santé publique, mais pour prendre acte du fait que la France n’est pas isolée. Hormis quelques-uns comme la Suède ou le Canada qui sont parvenus à susciter une réelle adhésion de la population à la vaccination, la plupart des États développés, en particulier ceux de l’Union européenne, accusent le même résultat : des commandes massives de vaccins, une très faible vaccination de la population et, par conséquent, des stocks importants de vaccins et des procédures de résiliation des commandes.
La deuxième partie du rapport vise donc à cerner les causes de cette situation, pour essayer de comprendre les choix qui ont été faits et d’avancer des propositions susceptibles d’améliorer la réponse sanitaire dans l’hypothèse d’une nouvelle pandémie.
Le contexte d’incertitude qui a prévalu jusqu’à l’automne a conduit à opérer des choix inspirés par le principe de précaution, dans le but de proportionner la réponse à l’ampleur de la menace. Ces incertitudes concernaient le virus A(H1N1), sa virulence, sa contagiosité, son taux d’attaque en fonction des types de populations – on pense notamment aux enfants, aux femmes enceintes ou aux personnes atteintes d’affections de longue durée.
C’est ce contexte qui permet d’éclairer les choix qui ont été faits au moment où ils ont été faits : celui de fixer un objectif de couverture vaccinale de plus de 70 % de la population et, par conséquent, celui de procéder à l’acquisition de 94 millions de doses de vaccins.
C’est aussi l’incertitude quant aux délais et aux modalités d’obtention des vaccins qui explique les très fortes contraintes ayant entouré la phase de négociation des contrats, laquelle a été, il faut le reconnaître, très délicate pour les pouvoirs publics, mais, encore une fois, pas seulement en France.
Et c’est toujours dans l’esprit du principe de précaution que le rapport avance un certain nombre de propositions, qui doivent permettre à l’avenir de prendre des mesures non seulement « proportionnées », mais – et c’est le second versant du principe de précaution –, des mesures « provisoires ».
Il faudrait, en premier lieu, que le principe du recours aux marchés à tranches conditionnelles soit généralisé pour l’acquisition de produits de santé et de matériels destinés à se préparer à des pandémies ou à les combattre.
De la même manière, une meilleure coordination entre les États membres de la Communauté européenne est urgente si l’on veut éviter qu’ils ne se retrouvent à nouveau en position de faiblesse face à l’industrie pharmaceutique.
Enfin, il est essentiel qu’un suivi statistique soit systématiquement mis en place lors de toute future campagne de vaccination : études épidémiologiques destinées à mieux connaître la virulence d’un virus et le taux d’immunisation de la population, ou suivis renforcés en matière de pharmacovigilance, comme ce fut le cas dans le cadre de la campagne de vaccination contre le virus A(H1N1).
La troisième partie du rapport traite de la relative rigidité observée dans la conduite de la campagne de vaccination sur le terrain.
Le dispositif utilisé pour lutter contre la pandémie avait été élaboré initialement pour faire face à des menaces sanitaires graves, comme la grippe aviaire. C’est le cas du règlement sanitaire international – RSI – auquel nous sommes soumis. Celui-ci constitue un cadre de référence essentiel pour le partage de l’alerte, mais il a conduit l’OMS à déclarer la situation de pandémie sans tenir compte de la virulence du virus. Je pense que nous nous accorderons tous sur une proposition qui consiste à œuvrer au niveau européen pour que l’OMS révise la définition de la pandémie en y intégrant un critère de gravité.
M. Gérard Bapt. Tout à fait.
M. le rapporteur. Au niveau national, nous avons utilisé deux outils principaux pour gérer la crise. Le premier était l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS). Je pense qu’il faut le renforcer pour mieux l’armer dans les négociations avec les laboratoires. Je propose donc de l’associer plus en amont aux pré-négociations, et de renforcer son expertise en matière de prix des produits de santé.
Le deuxième outil était le plan « pandémie grippale ». Même si les pouvoirs publics ont su prendre de nombreuses mesures d’adaptation, ce plan souffre selon moi de deux carences : la première est qu’il ne prévoit pas de graduer la réponse en fonction de la gravité du risque ; la seconde est que, s’il prévoit la mise en œuvre d’une vaccination pandémique, il est totalement muet sur les conditions d’organisation de celle-ci. Il faudra donc le compléter sur ces deux points.
J’en viens au pilotage de la crise. Je pense que le choix d’un cadre interministériel reposant sur la cellule interministérielle de crise – CIC – était un bon choix, qui s’est révélé opérationnel. Je suggère simplement de privilégier une composition plus souple de cette cellule.
Les décisions ont été éclairées par une expertise abondante. Beaucoup a été dit à ce sujet. Je considère pour ma part que le choix de recourir à des expertises collégiales, donc contradictoires, et menées par des personnes extrêmement compétentes, était essentiel.
Pour améliorer encore notre système d’expertise, je propose notamment d’intégrer le Comité de lutte contre la grippe dans le Haut conseil de la santé publique, ce qui garantirait la publicité de ses travaux ; de prévoir une saisine précoce et systématique du même haut conseil en cas de risque pandémique, et de créer en son sein une commission spécialisée dans les risques épidémiques, pour renforcer le caractère opérationnel de ses avis.
Pour ce qui concerne le pilotage des opérations au niveau territorial, des disparités ont été observées malgré la remarquable mobilisation des personnels. Je pense qu’à l’avenir il faudra renforcer le rôle de l’échelon zonal pour décliner les consignes nationales, avec un référent « zone de défense » dans les agences régionales de santé – ARS. Je propose aussi de créer un conseil zonal de préparation aux crises sanitaires et de mieux informer les collectivités locales, en consultant leurs associations sur l’organisation prévue pour les futures campagnes.
S’agissant du recours aux centres de vaccination, je pense que nous pourrions tous être d’accord pour dire que ce choix n’était pas optimal. Il répondait certes à de vraies contraintes, à la fois de santé publique et logistiques, mais, comme on l’a vu lors de l’audition de M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales, ce système n’aurait pas permis de vacciner 47 millions de personnes en quatre mois.
J’ai étudié d’autres pistes possibles. Je pense qu’il faut bien évidemment associer les médecins libéraux à la vaccination pandémique, même si je ne crois pas que tous pourraient faire face. Selon moi, c’est à eux de voir s’ils peuvent, ou non, gérer les contraintes logistiques et administratives. Le système doit donc reposer sur leur volontariat, et être complété par des centres de vaccination collective pour faire face à un éventuel pic pandémique. Je propose par conséquent, d’une part, d’inscrire dans le champ des négociations conventionnelles avec les caisses le mode d’exercice de la vaccination pandémique ; d’autre part, d’organiser une concertation entre les ARS et les représentants des professionnels de santé, en particulier les unions régionales, pour définir les modalités concrètes de recours à la médecine ambulatoire pour une vaccination pandémique.
Je ne développerai pas le constat des divers dysfonctionnements des centres, dont nous avons tous eu l’expérience.
Je m’attarderai cependant sur la faiblesse du volontariat, préoccupante pour l’avenir. Je pense qu’il faut renforcer le rôle des ARS qui doivent devenir probablement des préfets sanitaires et être chargées de mobiliser les professionnels de santé, par exemple en établissant dès à présent, en liaison avec leurs représentants, une liste de volontaires pour faire face aux futures crises.
La quatrième partie du rapport est consacrée à la désaffection des Français à l’égard de la campagne de vaccination, qu’ils ont clairement boudée.
Je considère d’abord que le message de santé publique a été brouillé par de nombreuses interventions, qui traduisaient pourtant souvent l’évolution des connaissances – des scientifiques comme des professionnels de santé – sur le risque encouru et sur les vaccins, mais qui ont semé la confusion dans l’esprit des Français. Il faudrait donc qu’à l’avenir soit organisée une conférence nationale, composée exclusivement de scientifiques, pour éviter toute interprétation politique et avoir une communication consensuelle sur la nature du risque et sur les moyens de le contrer.
J’ai également souligné l’emballement de médias relayant des prises de position parfois polémiques qui n’avaient rien à voir avec l’argumentation scientifique. Je me suis en outre penché sur un autre aspect préoccupant : celui du rôle d’internet, des réseaux sociaux, dans la diffusion de rumeurs qui ont conduit nos concitoyens à avoir plus peur de la vaccination que de la maladie elle-même.
Même si les ministres n’ont jamais tenu de discours divergents, nous avons tous constaté que, confronté à cet emballement médiatique, le Gouvernement n’a pas su avoir une communication appropriée : elle a été trop axée sur l’information, alors qu’elle aurait dû, à un moment donné, basculer dans la contre-argumentation. Cela n’a pas été le cas parce qu’on n’a pas su prendre en compte suffisamment tôt l’état d’esprit de la population.
Je fais donc trois propositions : mieux associer le pôle « Communication » de la CIC à la prise de décisions stratégiques ; intégrer dans la prise de décision les études engagées sur la perception du risque par la population ; renforcer le pôle de veille multimédia au sein du service d’information du Gouvernement et prévoir une réponse adaptée sur internet et, surtout, sur les réseaux sociaux.
Par ailleurs, il apparaît nécessaire d’organiser un débat public. Il peut difficilement avoir lieu pendant la crise, car on dispose alors de peu de temps. Je propose donc que soient organisés des états généraux sur les enjeux de la vaccination. Il me semble également utile que le Parlement évalue régulièrement les politiques de gestion des risques épidémiques.
Enfin, il faudra à l’avenir mieux informer les professionnels de santé. À cet égard, leurs unions régionales devraient jouer un rôle essentiel. Je propose donc de les privilégier comme relais de l’information en cas de crise sanitaire et d’inciter les professionnels à leur communiquer leurs coordonnées électroniques.
Enfin, pour mieux associer les professionnels de santé, je crois indispensable de renforcer leur formation, initiale et continue, en vaccinologie, aujourd’hui insuffisante au regard d’un calendrier vaccinal de plus en plus compliqué.
Il me semble, pour finir, nécessaire de mieux diffuser la culture de santé publique auprès de nos concitoyens, pour lutter contre le refus vaccinal.
Tels sont les principaux points développés dans mon rapport. J’espère que vous souscrirez à mes propositions, que je me suis efforcé de faire aussi consensuelles que possible.
Au total, j’estime que l’expérience de la campagne, malgré son bilan et ses dysfonctionnements, nous a permis de tester nos moyens de lutte contre les pandémies et de réfléchir, notamment au sein de notre commission d’enquête, sur les nombreuses pistes d’amélioration à explorer. C’est un acquis instructif.
Je résumerai, pour terminer, mes propositions :
– au niveau européen, établir un bilan critique des campagnes de vaccination menées par les États membres ;
– s’agissant des procédures de négociation avec les laboratoires, mieux évaluer en amont leurs capacités de production et leurs contraintes ;
– pour ce qui est de la définition de la stratégie vaccinale, mettre en place des études épidémiologiques, avec un suivi statistique ;
– concernant la démarche d’acquisition des produits de santé, recourir aux marchés à tranches conditionnelles et promouvoir, au niveau communautaire, une meilleure coordination entre les États membres et une mutualisation stratégique des achats de vaccins ;
– demander à l’Organisation mondiale de la santé de ne pas rester enfermée dans sa tour d’ivoire, et de réviser la définition de la pandémie en y intégrant le critère de gravité ;
– pour ce qui est des outils, renforcer l’ÉPRUS en l’associant en amont aux discussions avec les laboratoires et le doter d’une expertise plus approfondie en matière de prix des produits de santé ; compléter le plan de prévention français et l’adapter en fonction de la gravité du risque ; opérer quelques ajustements dans le pilotage de crise et rechercher, en particulier, une composition beaucoup plus souple de la cellule interministérielle ; renforcer l’expertise à l’échelle européenne ; intégrer le comité de lutte contre la grippe dans le Haut conseil de la santé publique, prévoir une saisine de ce même haut conseil et créer en son sein une commission spécialisée, améliorer le pilotage territorial de la crise ; renforcer le rôle des professionnels de santé ;
– s’agissant de la communication, instaurer le débat public et adapter la communication gouvernementale en direction du grand public ; améliorer les modalités d’information des professionnels de santé ;
– enfin, mener une politique vaccinale volontariste, en renforçant la formation professionnelle continue des médecins et l’enseignement initial en vaccinologie, et en réaffirmant les objectifs de santé publique dans le domaine de la vaccination.
M. Jean Mallot. Nous sommes donc appelés à prendre position sur un rapport qui est celui du rapporteur, et non, comme il est habituel ailleurs, celui de la commission.
Dans sa contribution rappelée par Mme Catherine Lemorton, le groupe SRC a regretté que ce document n’aborde pas trois questions qui ont pourtant eu une importance déterminante : le rôle de l’OMS, celui des experts dans les prises de décision – avec le problème des conflits d’intérêts –, et l’utilisation des antiviraux. À cela j’ajouterai trois observations.
Premièrement, il n’est pas approprié d’invoquer, dans l’affaire qui nous occupe, le principe de précaution : il suffit pour s’en convaincre de relire l’article 5 de la Charte de l’environnement. Le prérapport rédigé par nos collègues Alain Gest et Philippe Tourtelier, au nom du Comité d’évaluation et de contrôle, démontre d’ailleurs que ce principe fait l’objet d’une utilisation abusive, qui en dénature profondément l’esprit. Il serait donc opportun de supprimer cette notion du rapport, pour la remplacer par une référence au principe de prévention.
Deuxièmement, nous souhaitons tous pour l’avenir un plan de lutte contre les pandémies qui soit modulable, mais la question n’est pas celle-là puisque les auteurs du plan et les personnes chargées de le mettre en œuvre ont souligné, lors des auditions, qu’il l’est déjà. La vraie question est donc de savoir pourquoi il n’a pas été modulé – pourquoi les pouvoirs publics, le Gouvernement en particulier, n’ont pas su, à chaque étape, en faire un usage approprié. Or ce point non plus n’est pas suffisamment développé dans le rapport.
Troisièmement, nous regrettons tous le rôle d’internet, le fourmillement des messages contradictoires qui ont brouillé la perception du public, entraîné une défiance à l’égard de la vaccination et gêné la mise en place des dispositifs. Mais si ces messages néfastes ont pu se déployer, c’est parce qu’il n’y a pas eu de parole officielle constante, crédible, perçue comme sincère. Faute de référence permanente, tout a été mis sur le même plan.
Le Gouvernement n’a pas su communiquer, dit le rapporteur. Non : il n’a pas voulu ! Sa stratégie de communication était délibérée. Elle a d’ailleurs été clairement expliquée ici par ceux qui avaient charge de la mettre en œuvre, et c’est ce qui explique que certains journalistes aient pu parler de propagande et de manipulation de l’opinion. La conséquence a été catastrophique. Il faut donc que ce soit dit clairement.
M. Yves Bur. Je tiens d’abord à remercier M. le président et M. le rapporteur pour le travail réalisé, qui est considérable.
Cette pandémie grippale a mis en lumière certains dysfonctionnements. Il importe aujourd’hui d’en tirer toutes les conséquences, pour que les pouvoirs publics puissent remédier aux carences ou à l’inadaptation des décisions. La gestion d’un nouvel épisode de grippe devra être plus efficace.
Comme les débats l’ont montré, la lutte contre la pandémie pose la question de la relation entre le politique et les experts. Aujourd’hui, la position des experts est déterminante dans la prise de décision. Il faut savoir comment cette décision émerge et s’impose aux politiques : ces questions déterminantes pour l’avenir se posent à notre pays, mais aussi au niveau international, au sein de l’OMS, même si ce sujet ne relevait pas de la commission.
Il est nécessaire de faire évoluer les plans de prévention et de lutte contre la pandémie afin de mieux graduer la réponse en fonction de la gravité prévisible.
Concernant l’expertise – mais cela vaut aussi pour l’ensemble des professionnels de santé –, il est temps d’imposer une transparence totale de ses relations avec les laboratoires. La mission d’évaluation et de contrôle des lois de financement de la sécurité sociale a déjà souligné ce point, il faut à présent passer aux actes. Il n’y a pas de raison que nous ne parvenions pas à réaliser en France ce à quoi un certain nombre de grands laboratoires, notamment américains, sont prêts.
Ménager un vrai rôle aux professionnels de santé dans le dispositif me paraît indispensable, mais gardons-nous de ne faire place qu’aux médecins : il ne serait pas compréhensible de laisser de côté les infirmières, qui ont beaucoup contribué à la campagne de vaccination.
Les pouvoirs publics doivent promouvoir, auprès du grand public et des professionnels, une politique vaccinale qui reste un outil sans égal d’une politique de santé publique. Elle est affectée aujourd’hui d’un discrédit qui m’inquiète compte tenu de ses conséquences sanitaires potentielles – que l’on songe notamment à la recrudescence des cas de rougeole, due à une méfiance générale.
Enfin, il ne faut pas donner le sentiment que les choix arrêtés dans le cadre de la lutte contre une pandémie sont l’apanage de quelques experts. Il est indispensable d’associer davantage les usagers aux instances de décision pour accroître la transparence et conforter les stratégies retenues.
M. Guy Lefrand. À mon tour, je veux féliciter le rapporteur pour avoir su mener à bien un difficile travail de synthèse. Son rapport entre parfaitement dans le cadre posé par l’intitulé de la commission d’enquête.
Nos auditions ont fait apparaître un consensus : le politique a pris les bonnes décisions par rapport à ce qui nous a été proposé par l’OMS et par les experts. Les décisions initiales ont été validées, même si les modalités de mise en œuvre nécessitent d’être revues.
Dans un avenir proche, il sera nécessaire de s’interroger sur le rôle de l’expertise nationale et de l’expertise européenne, notamment sur les relations entre politiques et experts.
Je voudrais insister sur quatre points.
M. Yves Bur a raison : une place plus importante doit être faite, non pas seulement aux médecins libéraux, mais à l’ensemble des professionnels de santé, en particulier aux infirmières. Mais n’oublions pas non plus les pharmaciens, qui nous ont fait part de leurs remarques, et qui sont pas simplement distributeurs de médicaments, mais aussi, comme l’a reconnu la loi du 21 juillet 2009 portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires, des professionnels de santé de premier recours.
On a constaté l’incapacité gouvernementale non pas à communiquer, mais plutôt à contre-communiquer et à réagir à une communication hasardeuse ou provocatrice, pour ne pas dire plus, de certains groupes ou mouvements. Il faut donc envisager la création de cellules de contre-communication.
Nous devons travailler à une meilleure répartition des rôles, notamment entre le ministère de la santé et le ministère de l’intérieur. La cellule interministérielle de crise doit être beaucoup plus souple et le ministère de l’intérieur ne doit pas avoir une mainmise trop importante sur celle-ci : elle a probablement contribué au manque de flexibilité dénoncé par beaucoup.
Il est nécessaire, enfin, de revoir l’ensemble de nos plans « pandémie » et, surtout, de les faire évoluer en temps réel en fonction de l’évolution des connaissances et de la pandémie proprement dite.
Le groupe UMP votera bien évidemment ce rapport, dont les propositions sont parfaitement conformes à la mission assignée à cette commission d’enquête.
M. Jean-Paul Bacquet. Dans ce pays, on n’insiste pas assez sur l’absence de conception collective de la santé publique, l’individualisme l’emportant toujours.
Le risque majeur que nous courons aujourd’hui est le discrédit de la vaccination en général et de toute campagne de vaccination de masse en particulier. Il serait indispensable d’avoir un minimum d’informations sur les résultats des campagnes de vaccination. La reprise de la tuberculose dans certains départements, même si elle est davantage due à la précarité et à des formes de résistance, et l’attente de notre pays d’une vaccination contre le sida militent pour qu’on rappelle l’intérêt de la vaccination. En effet, régulièrement remise en question, elle n’apparaît pas comme un acquis définitif.
Monsieur le rapporteur, vous évoquez la médecine ambulatoire à deux reprises dans votre rapport. Page 85, vous faites le constat qu’elle n’a pas été utilisée et, page 111, vous formulez le vœu qu’elle le soit. Mais il faut aller plus loin. J’ai systématiquement demandé à nos différents interlocuteurs s’ils avaient eu connaissance des critiques faites sur ce point aux précédentes campagnes de vaccination – je pense en particulier à celle qui a été menée dans le Puy-de-Dôme contre la méningite. Tous ont répondu par la négative. Ne prenons pas le risque qu’il en soit de même avec la campagne de vaccination contre la grippe A ! Je souhaite par conséquent que vous fassiez mention de ces précédents.
M. Gérard Bapt. Il faut savoir gré au rapporteur de son important investissement personnel, mais aussi d’avoir su écouter et évoluer : c’est ainsi que je reconnais dans ses recommandations certaines de mes suggestions, par exemple sur les relations entre les experts français et le comité de lutte contre la grippe, d’une part, et le Haut conseil de santé publique, d’autre part.
J’approuve bien entendu son constat d’une crise de confiance. Tout le problème est cependant de savoir si le rapport donne tous les éléments permettant de remédier à cette défiance. Aux observations faites sur ce point par mes collègues, j’en ajouterai quatre.
Premièrement, la communication gouvernementale n’a pas aidé au maintien d’une confiance initiale, attestée par les sondages. Je pense en particulier à l’opacité entretenue sur le contenu des contrats. La presse avait recouru à la Commission d’accès aux documents administratifs – CADA –, mais l’avis de cette dernière avait été négligé et c’est moi qui, en tant que rapporteur spécial sur les crédits de la mission « Santé », ai dû aller les consulter à l’ÉPRUS pour les rendre publics !
En second lieu, il est regrettable que le rapport n’aborde pas la question du Tamiflu alors même que, durant la crise, des médecins ont fait des pétitions contre l’élargissement des recommandations, à titre préventif – et à demi-dose, certes –, à l’entourage de personnes susceptibles d’avoir contracté la maladie !
Je mentionnerai également le problème des contrats. L’ÉPRUS tiendra certainement compte des critiques formulées, notamment par un professeur de droit, sur la légalité des contrats prépandémiques. Reste que les laboratoires refusent systématiquement, même pour l’avenir, d’assumer la responsabilité de leurs produits de santé en cas de pandémie, alors qu’ils l’assument pour une vaccination : voilà qui ne pouvait inciter à la confiance ceux qui se souviennent de l’affaire de l’hépatite B, dans laquelle trois laboratoires sont mis en examen !
Quatrièmement, s’agissant de la pharmacovigilance, il faut renoncer à faire de la vaccination un sujet tabou. Au reste, cette question sera certainement abordée si le débat public proposé par le rapporteur a lieu. Cependant, les éléments épidémiologiques manquent : une seule étude sérieuse a été menée aux États-Unis sans donner de résultats concluants quant à l’efficacité de la vaccination contre la grippe saisonnière. Qu’en est-il alors contre la pandémie ?
Ensuite, certains points dans le rapport sont à mon sens contestables.
Les choix ont été faits au vu des données épidémiologiques connues au moment où ils ont été faits, indique M. le rapporteur. Pourtant, dès l’été, on savait ce qui s’était passé dans l’hémisphère Sud, notamment à La Réunion, et on aurait pu alors infléchir ces choix. Or ils sont restés intangibles.
Le docteur Martine Perez, responsable des pages « santé » du Figaro, nous a dit pendant la table ronde qu’à la place de la ministre, elle aurait agi de la même manière par précaution juridique. Mais 700 millions d’euros pour protéger juridiquement la ministre, n’est-ce pas bien cher ?
On a également pris ses précautions en matière d’éthique : l’avis 106 rendu en janvier 2009 par le Comité consultatif national d’éthique a servi à justifier la commande d’un nombre de vaccins suffisant pour répondre à toutes les demandes et couvrir 75 % de la population. Il reste qu’une telle décision prête pour le moins à discussion dès lors que ces vaccins n’ont été disponibles qu’une fois passé le pic pandémique.
Enfin, M. le rapporteur a avancé une proposition quasiment révolutionnaire, consistant à associer l’ÉPRUS à la fixation des prix. Cette suggestion concerne uniquement les vaccins et les antiviraux, j’imagine…
M. le rapporteur. Les matériels également.
M. Gérard Bapt. Quoi qu’il en soit, elle a le mérite de soulever le problème plus global de la fixation des prix des médicaments, dont M. Yves Bur et Mme Catherine Lemorton ont souvent rappelé qu’elle se faisait dans des conditions particulièrement opaques. Peut-être est-ce là un premier pas – dont je me féliciterais – vers une remise en cause des procédures actuelles.
Même si nous soutenons la plupart des recommandations formulées par M. le rapporteur – certaines fussent-elles particulièrement techniques, notamment en matière d’organisation –, notre groupe souhaite bénéficier d’une suspension de séance de cinq minutes, à l’issue de la discussion générale, afin de pouvoir arrêter définitivement sa position.
M. le président Jean-Christophe Lagarde. Elle vous sera bien entendu accordée.
M. Jean-Louis Touraine. Tout au long de cette crise grippale, nous sommes revenus sans cesse à la charge pour demander que les professionnels de santé – médecins généralistes, pédiatres et pharmaciens notamment – soient impliqués dans le processus de vaccination, dans la mesure où ils sont évidemment au cœur du système de soins et où ils disposent de toute la confiance de la population. On nous a, à chaque fois, opposé un refus, appuyé sur des arguments qui se sont tous révélés fallacieux. Autant que de rigidité, c’est d’entêtement qu’il faudrait parler à propos de l’attitude du Gouvernement. Celui-ci est resté sourd à toutes nos remarques, et a fait preuve d’une absence totale de réactivité et d’adaptabilité dont les conséquences sont, outre le faible taux de vaccination, un divorce entre le ministère de la santé et beaucoup de professionnels qui se sont sentis humiliés et déconsidérés, mais, également, une perte de confiance de l’ensemble de la population dans les politiques de santé publique comme dans l’utilité de la vaccination. Sans mesures fortes, je crains bien que cette confiance ne tarde à être restaurée.
M. Jacques Domergue. Je n’ai pu participer aux auditions de la commission d’enquête, retenu par mes fonctions de rapporteur au sein d’une mission qui travaillait parallèlement – ma collègue la présidente Catherine Lemorton ayant eu quant à elle la possibilité de s’en échapper parfois pour vous rejoindre –, mais, découvrant le rapport, je tiens à féliciter M. Jean-Pierre Door pour ce travail mesuré et pondéré qui vise, avant tout, à tirer les leçons de la crise que nous avons traversée.
En l’espèce, nous sommes confrontés à une situation plutôt inhabituelle : alors que les crises sanitaires conduisent d’ordinaire à dénoncer une insuffisance des précautions, c’est l’excès de celles-ci qu’on reproche, particulièrement du côté du groupe socialiste. J’espère que cette commission d’enquête contribuera à définir un juste équilibre à cet égard, pour le traitement des crises à venir.
Pour ma part, mesurant les difficultés qui allaient se faire jour, je me suis abstenu lorsqu’il s’est agi de voter le principe de précaution. Cependant, on peut comprendre les décisions prises par Mme la ministre de la santé et des sports sur le fondement d’études – notamment en provenance de l’OMS – qui étaient difficilement contestables. Comment d’ailleurs critiquer le souci qu’elle a eu de protéger l’ensemble de la population ? Toutefois, on aurait peut-être pu souhaiter plus de prudence quant à l’objectif qu’on se fixait : était-il bien réaliste de vouloir vacciner en quelques mois 47 millions de personnes ? Si l’on avait pensé à solliciter des experts en statistique et en logistique, sans doute auraient-ils démontré que c’était impossible, ce qui aurait conduit à revoir rapidement à la baisse le volume des commandes de vaccins.
En outre, la défiance dont a fait preuve la population à l’égard de la vaccination ne s’explique-t-elle pas par l’utilisation d’une arme de choc pour combattre une pandémie certes hautement contagieuse, mais peu grave ? À cela il faut ajouter le rôle des réseaux sociaux électroniques et l’attitude de certains professionnels de santé, qui ne se sont pas fait vacciner : tous facteurs qui, en l’absence d’une conception collective, ont favorisé une évaluation individuelle, voire individualiste, du rapport bénéfice/risque. Sans doute devrons-nous veiller, à l’avenir, à la façon dont sont diffusées les informations relatives à une pratique thérapeutique dont les bienfaits ne sont pourtant plus à démontrer.
À cet égard, les médecins généralistes auraient sans aucun doute eu un grand rôle à jouer, ce qui aurait évité qu’ils ne souffrent d’un sentiment d’exclusion. En revanche, que n’auraient pas dit nos collègues socialistes si la ministre de la santé avait décidé de les placer en première ligne en leur confiant une vaccination facturée 22 euros ? Je considère donc que l’organisation de cette vaccination de masse a été judicieuse, ses modalités pratiques – détermination des sites ou heures d’ouverture par exemple – dussent-elles être revues à l’avenir. Et, par ailleurs, cette crise aura eu au moins le mérite de faire que les médecins généralistes s’intéressent aujourd’hui beaucoup plus qu’auparavant aux problèmes généraux de santé publique.
Enfin, si M. Yves Bur a raison d’insister sur la nécessité d’une absolue transparence des expertises, cet objectif sera certainement difficile à atteindre, s’agissant d’interventions qui ont toujours un caractère d’urgence et sont donc peu propices à une évaluation scientifique pondérée. Ne pourrait-on dès lors envisager d’instituer un « conseil des sages », qui jouerait un rôle de modérateur en s’efforçant de faire prévaloir le bon sens ?
M. Michel Lejeune. Je tiens à féliciter M. le rapporteur pour son travail intéressant et équilibré – qui me semble néanmoins amendable sur un point, et un seul : je souhaiterais remplacer la mention du « principe de précaution » par celle du « principe de prévention », car nous étions en l’occurrence informés des risques encourus.
Mme Catherine Génisson. Je m’associe à cette remarque. Ce point met d’ailleurs en exergue la nécessité de revoir intégralement les fondements de nos politiques de santé publique, ainsi que l’ensemble de nos pratiques en la matière – sans donc se limiter au problème de la vaccination.
J’ajoute que nous ne déplorons pas tant un excès de mesures que leur inadaptation, ou, plus précisément, l’incapacité de les adapter à l’évolution des données, au fil de la crise.
Comme nombre de nos collègues, je considère que tous les professionnels de santé auraient dû être beaucoup plus associés à la gestion de la pandémie, non seulement en tant qu’acteurs, mais en tant que médiateurs et qu’agents en charge de l’information de la population. De ce point de vue, et puisqu’il est question d’une conférence nationale des collèges scientifiques, la création de passerelles entre scientifiques et praticiens me semblerait particulièrement opportune.
Enfin, parce que les politiques doivent assumer leurs responsabilités dans ce domaine comme dans d’autres, et ce en faisant abstraction de toute considération partisane, je suis également favorable à la création d’une mission parlementaire chaque fois que se pose un problème de santé publique similaire.
Mme Jacqueline Fraysse. Si ce rapport approfondi et intéressant sera sans aucun doute très utile, je le juge néanmoins trop clément à l’endroit du Gouvernement. Il souffre en outre d’une approche trop restrictive de ce qu’on pourrait appeler la démocratie sanitaire. Pour notre part, nous ne cesserons de dénoncer les lacunes de nos politiques de santé publique, lacunes sensibles aussi bien dans les pratiques que dans l’information ou dans l’éducation des jeunes à la santé, par exemple.
Des fautes graves ont été commises, dont les conséquences sont accablantes : coût exorbitant, fiasco total et discrédit touchant désormais l’ensemble des politiques de santé publique et la vaccination en particulier. Je n’ose envisager les drames qui risquent de survenir si nous devons être confrontés à une pandémie autrement plus virulente que celle que nous avons connue.
Non seulement la politique menée n’a pas été efficace, mais elle s’est montrée contre-productive, le Gouvernement ayant globalement fait preuve d’un entêtement coupable au lieu d’essayer de corriger le tir. S’agissant des laboratoires, il ne s’est pas montré particulièrement exigeant alors que l’exemple d’autres pays montre qu’on pouvait agir autrement. Nul ne songe, ici, à lui reprocher un excès de vigilance et de protection – comment aurait-il pu lire dans le marc de café et inventer des données scientifiques dont il ne disposait pas ? Mais son plan n’en a pas moins été irréaliste : au nom d’une protection aussi absolue que possible, la vigilance ne s’est exercée qu’au profit d’un nombre relativement restreint de personnes.
Je ne reviendrai pas sur la grave erreur que fut la mise à l’écart des médecins généralistes, mais je soulignerai que la communication gouvernementale a été déplorable, faute d’avoir fait leur part à l’ensemble des acteurs. On retrouve là le déficit de démocratie sanitaire que je dénonçais à l’instant. Ainsi, pourquoi ne s’est-on pas intéressé, par exemple, aux travaux de ce sociologue que nous avons auditionné et qui, portant sur le degré de conscience qu’ont les citoyens des problèmes de santé, auraient favorisé une meilleure adaptation de l’action gouvernementale ?
Si je me félicite que le rapport propose de tenir compte des recommandations issues du débat public de la conférence nationale de santé, je note également qu’il y avait été question, bien avant la pandémie, de la concertation en amont en tant qu’exigence contemporaine de la démocratie mais également en tant que condition de l’efficacité obligeant chacun à être meilleur, « le décideur quand il doit faire comprendre ses choix, l’ingénieur quand il doit défendre ses solutions techniques, l’opposant qui ne peut se contenter d’une orchestration bruyante de l’indignation et du procès d’intention mais doit dire lui aussi le pourquoi et le comment des solutions qu’il préconise ».
De surcroît, parce que la concertation la plus large s’impose, je regrette que le rapport ne mentionne pas l’importance de l’information publique au cœur même des crises sanitaires.
Enfin, la pandémie a montré combien la mise en place du pôle public du médicament que nous appelons de nos vœux depuis longtemps aurait été précieuse tant la soumission financière et décisionnelle aux laboratoires pharmaceutiques constitue un grave problème.
Mme Catherine Lemorton. Je me livrerai pour commencer à une petite autocritique : nous corrigerons notre contribution s’agissant du passage concernant l’OMS car ni le président ni le rapporteur de la commission d’enquête ne sont évidemment responsables du refus de cette organisation de venir s’expliquer devant nous.
M. le président Jean-Christophe Lagarde. Je vous en remercie d’autant plus que nous l’avons invitée à deux reprises.
Mme Catherine Lemorton. En ce qui concerne la pharmacovigilance, monsieur le rapporteur, nous ne sommes évidemment pas convaincus par votre réponse. Si cette dernière a été correctement menée à court terme, qu’en sera-t-il à moyen et à long terme pour les 5,8 millions de personnes qui ont été vaccinées ? Je rappelle à ce propos que, à tort ou à raison, la vaccination en quatre ans de plus de 20 millions de nos concitoyens contre l’hépatite B a « laissé des traces » dans la population et que deux laboratoires sont mis en examen depuis le mois de février 2008 pour tromperie aggravée quant au rapport bénéfice/risque de ce vaccin.
Je ne peux également me satisfaire, monsieur le rapporteur, de votre réponse concernant le laboratoire Roche : comment expliquer que, pendant dix ans, cette entreprise n’ait jamais mis en évidence l’intérêt préventif du Tamiflu ? Je ne serai donc rassurée que par des études indépendantes diligentées par les pouvoirs publics.
J’ai été sensible à votre étonnement presque naïf, monsieur le président, lorsque vous vous êtes rendu compte que le vaccin qui sera proposé en octobre 2010 contre la grippe saisonnière contiendra des anticorps de la grippe A(H1N1) : si nous voulons être crédibles auprès des Français, il conviendra d’être très clairs à ce sujet. Par ailleurs, un tel ajout me semble d’autant plus étonnant que, d’une part, la fin définitive de la pandémie sera déclarée d’ici à six mois et que, d’autre part, si les personnes âgées de plus de soixante-cinq ans n’ont pas compté parmi les publics prioritaires de la vaccination contre la grippe A(H1N1), les bons de vaccination qui seront envoyés aux mois d’octobre et de novembre les concernent particulièrement avec les personnes atteintes d’affections de longue durée ! Un devoir de vérité s’impose donc.
Enfin, je ne tiens pas à ce que l’on impute à nos concitoyens leur désaffection à l’endroit de la vaccination. Selon le rapport, page 37, « la moindre virulence du virus A(H1N1) s’est précisée à partir du mois de septembre avec le premier bilan qui a pu être dressé de la phase pandémique dans l’hémisphère Sud ». Comment expliquer, dès lors, la persistance du Gouvernement à rester « droit dans ses bottes » pour mettre en œuvre un plan quasiment militaire ? De plus, comment en vouloir à nos compatriotes d’avoir pris pour argent comptant les « informations » diffusées sur internet ?
Enfin, un de nos collègues a parlé naguère de « grippette », mais comment lui donner tort quand on sait que la grippe A(H1N1) a tué 18 000 personnes sur les 6,8 milliards d’habitants que compte notre globe et que 312 décès ont été constatés chez nous, en métropole, alors que 20 millions de Français ont été atteints par le virus ? Nos compatriotes ont eu tôt fait de calculer le rapport bénéfice/risque !
Mme Dominique Orliac. Outre que l’inadaptation des premières mesures était patente – appel du SAMU en cas de symptômes grippaux, prise rapide de Tamiflu et donc, pénurie généralisée –, la conduite à tenir était à géométrie variable, personne ne sachant exactement la manière dont les événements allaient se dérouler.
L’éviction des médecins généralistes a, quant à elle, été catastrophique, le Gouvernement faisant preuve d’un entêtement certain. À la question d’actualité que j’ai posée au mois de décembre à Mme la ministre de la santé concernant la participation de ces derniers à la vaccination de la population – non exclusive, bien entendu, de l’indispensable vaccination de masse en cas de pandémie virulente –, Mme Roselyne Bachelot-Narquin a répondu par une remarque sur l’inutilité de la polémique à laquelle, selon elle, je me livrais. Quatre semaines plus tard, pourtant, elle demandait aux médecins de s’engager dans ce processus alors que le pic pandémique était terminé et qu’un second pic était prétendument attendu au mois de février… lequel n’a pas eu lieu. Comment, dans ces conditions, ne pas s’interroger sur le sens gouvernemental de l’organisation, cette dernière ayant été en l’occurrence particulièrement coûteuse ? De surcroît, il est proprement scandaleux d’invoquer je ne sais quel risque d’enrichissement des médecins alors qu’ils auraient fort bien pu vacciner leurs patients dans le cadre des consultations normales.
Si ce rapport a le mérite de clarifier un certain nombre de points et de contribuer à ce que des erreurs ne se renouvellent pas en cas de survenue d’une nouvelle pandémie, j’estime que la mise en place d’une mission parlementaire aurait sans doute également permis d’élaborer d’autres mesures importantes.
Deux questions avant de conclure. Est-il exact qu’une vaccination ne saurait être efficace si 30 % de la population au moins n’est pas vaccinée ? Pourquoi un tel manque de transparence quant à la présence ou non d’adjuvants dans le vaccin, cette polémique ayant été également très préjudiciable à la campagne de vaccination ?
En cas de nouvelle pandémie, il importe – si difficile cela soit-il – de rétablir la confiance de la population à l’endroit d’une pratique qui a fait ses preuves depuis longtemps et d’associer comme ils doivent l’être l’ensemble des professionnels de santé à sa gestion.
M. Philippe Vitel. Je suis un peu étonné par le déroulement inhabituel de cette séance de remise de rapport mais la longue discussion que nous avons eue est sans doute utile pour certains collègues ayant besoin d’une session de rattrapage…
Si je remercie quant à moi Mme la ministre de la santé et des sports pour s’être conformée aux recommandations formulées par l’OMS, je regrette comme vous que cette organisation n’ait pas répondu favorablement à notre invitation.
Je garderai par ailleurs longtemps en mémoire l’audition de M. le ministre de l’intérieur, de l’outre-mer et des collectivités territoriales en notant le parfait antagonisme entre le type de vaccination choisie – la commande de 94 millions de doses – et le déroulement effectif des opérations.
Par ailleurs, à la page 119 de son rapport, M. le rapporteur évoque l’amélioration du pilotage territorial de la crise et développe d’excellentes idées qui gagneraient néanmoins à être précisées. Par exemple, comment envisagez-vous, monsieur le rapporteur, les relations entre unions régionales des professionnels de santé (URPS) et agences régionales de santé (ARS) dont vous évoquez le rôle de « préfets sanitaires », formule qui a justement fait bondir plus d’un syndicaliste médical ? Comment, en outre, dire la loi sans écouter les professionnels de santé auxquels on n’a d’ailleurs pas donné toute leur place dans l’amélioration de ce pilotage territorial ? Des propositions suffisamment claires doivent être formulées en la matière de manière à ce qu’elles ne puissent surtout pas être écartées quelles que soient les situations à venir.
M. le président Jean-Christophe Lagarde. En effet, Monsieur Philippe Vitel, le mode de fonctionnement de notre commission est inédit mais, outre qu’il me semble équilibré, nombre de collègues ont manifestement éprouvé le besoin de s’exprimer.
M. Rémi Delatte. À mon tour, je félicite M. le rapporteur pour la qualité de son intervention et de son travail sur un sujet très complexe.
J’ajoute, monsieur le président, monsieur le rapporteur, que vous avez eu raison de faire en sorte que nous restions dans les strictes limites du champs d’investigation fixé par la résolution.
Vos propositions visant à rétablir le crédit dont bénéficiait la vaccination jusqu’à la pandémie grippale, monsieur le rapporteur, sont, selon moi, très intéressantes. Vous avez ainsi raison de vouloir donner une dimension européenne à une telle stratégie afin de lui conférer une meilleur cohérence, mais, également, d’impliquer davantage l’ensemble des professionnels de santé et, enfin, d’accroître la communication institutionnelle – laquelle a moins fait défaut qu’elle n’a été rendue inaudible par l’action de différents groupes de pression.
Enfin, regrettant que le rapport ne mentionne pas la mobilisation rapide et efficace de l’ensemble de notre administration, je profite de cette intervention pour saluer les agents de l’État.
M. le rapporteur. Madame Jacqueline Fraysse, je suis convaincu que nous disons la même chose mais de façon différente tant en ce qui concerne la mise à l’écart des médecins généralistes que la communication, l’organisation du débat public, les états généraux sur les enjeux de la vaccination, l’évaluation régulière par le Parlement ou la conférence nationale de santé. Je suis par ailleurs très favorable à une écoute beaucoup plus attentive de l’opinion publique en la matière. Enfin, nous pouvons fort bien demander l’application immédiate du dispositif contenu dans l’amendement à la loi du 3 août 2009 de programmation relative à la mise en œuvre du Grenelle de l’environnement voté à l’unanimité par les deux chambres et visant à mettre en place une instance de garantie de l’indépendance des experts.
Monsieur Philippe Vitel, les agences régionales de santé ont précisément pour rôle de mobiliser les professionnels de santé dans le cadre du schéma régional d’organisation des soins. Il importe, en effet, de définir une organisation territoriale précise au sein de laquelle l’ensemble des ressources disponibles en cas de crise sanitaire seront recensées. Les URPS, quant à elles, visent à informer et à réunir l’ensemble des professionnels de santé sans distinction aucune.
Madame Dominique Orliac, comme vous venez de le faire, le rapport fait état des inquiétudes de la population concernant les adjuvants. Outre que la communication a sans doute été insuffisamment audible sur ce plan-là et qu’il conviendra de l’améliorer, je vous rappelle qu’en 1976 un grand nombre d’Américains ont développé le syndrome de Guillain-Barré suite à des injections de vaccins qui ne comportaient pourtant aucun adjuvant – d’où les rumeurs.
En ce qui concerne les principes de précaution et de prévention, je me permets de vous renvoyer à la page 35 du rapport définissant le premier comme « un principe de proportionnalité », la précaution s’exerçant à l’endroit d’un risque méconnu. Je cite également à la page suivante M. Claude Le Pen, professeur de sciences économiques, s’interrogeant précisément sur la difficulté à « proportionner une réponse à un risque inconnu ». J’ajoute que le rapport de M. Alain Gest fait lui-même état de l’application d’un tel principe à propos du virus de la grippe A(H1N1).
Madame Catherine Lemorton, vous avez raison de signaler que chacun de nos compatriotes a procédé à une évaluation personnelle du rapport bénéfice/risque de la vaccination. Je me permets à nouveau de renvoyer au rapport, en l’occurrence, à la page 115 : « on a pu constater le défi que constitue aujourd’hui la délivrance d’un message de santé publique qui s’attache à l’intérêt collectif dans une société à l’individualisme croissant où chacun élabore sa propre balance bénéfice/risque et obéit à une logique personnelle. » Par ailleurs, en ce qui concerne la pharmacovigilance, je suis disposé à ajouter à la page 60, après les mots : « La généralisation d’un suivi épidémiologique à l’occasion des campagnes de vaccination doit se doubler, en aval, d’un même suivi en matière de pharmacovigilance », les mots : « à moyen et à long terme ».
Monsieur Gérard Bapt, le rapport insiste, en effet, sur la nécessité de mener des études qui fassent également état des effets produits par les vaccins. Je rappelle, à ce propos, que l’Agence française de sécurité sanitaire des produits de santé a mis en place une procédure particulière et que Mme la ministre de la santé et des sports a confirmé que des études seraient réalisées à long terme sur les 5,8 millions de personnes ayant accepté de se faire vacciner contre la grippe A(H1N1). J’ajoute que les contrats ayant été rendus publics, il n’est plus pertinent d’évoquer je ne sais quelle opacité dans la fixation des prix. Quoi qu’il en soit, nous souhaitons que l’ÉPRUS participe en amont à ces négociations s’agissant des vaccins, des médicaments et des matériels médicaux dans le domaine strict de l’urgence sanitaire. J’ajoute que, s’agissant des laboratoires, Mme la ministre a refusé certaines clauses de responsabilité même si nous aurons besoin, à l’avenir, d’une stratégie européenne commune de négociation.
À M. Yves Bur, je rappellerais comme à Mme Jacqueline Fraysse que la loi du 3 août 2009 précitée dispose de la nécessité d’installer une instance de garantie de l’indépendance de l’expertise.
Monsieur Guy Lefrand, le rapport fait également état de la nécessité de la contre-argumentation. Il est par ailleurs exact que je n’ai pas mentionné les questions liées à l’utilisation du Tamiflu, la commission d’enquête portant sur la vaccination et non sur l’évaluation des médicaments.
Monsieur Rémi Delatte, la page 91 du rapport mentionne également la « réelle mobilisation des services et des personnels », notamment dans les préfectures et les directions départementales des affaires sanitaires et sociales, lesquels ne sauraient en effet supporter la responsabilité de quelque échec que ce soit.
Madame Catherine Génisson, le rapport préconise la prise en compte des diverses instances d’expertise, dont celle de l’Académie nationale de médecine ou des différents collèges scientifiques, afin que ces derniers soient au cœur de la conférence dont nous proposons l’organisation, les URPS ayant quant à elles, je le répète, une mission d’information et de déclinaison territoriale.
Monsieur Jacques Domergue, le rapport préconise également un recensement des lieux qui, à l’avenir, pourront être utilisés comme centres de vaccination. Ce sera alors aux préfets de zone de défense et aux responsables des collectivités territoriales de les préparer en amont de toute crise de manière à ce que, après la médecine ambulatoire, ils deviennent le deuxième pilier sanitaire des vaccinations.
Monsieur Jean-Paul Bacquet a, quant à lui, très justement rappelé qu’il convenait de réhabiliter les politiques vaccinales. Les états généraux de la vaccination iront en ce sens, de même que la lutte contre toutes les préventions à cet égard.
M. le président Jean-Christophe Lagarde. Je tiens à mon tour à remercier le rapporteur pour le travail accompli.
Le principal enseignement de nos travaux réside dans le changement de perception de la campagne de vaccination par les autorités sanitaires elles-mêmes. Entre la première audition du directeur général de la santé et la dernière, nous avons constaté un changement, et nos travaux n’y sont pas pour rien.
Si, sur le plan des résultats obtenus, la campagne de vaccination fut un échec, nous pouvons dire à l’issue de nos travaux qu’elle ne mérite ni les excès d’honneur dont elle a pu faire l’objet un certain temps, ni les excès d’indignité qui l’ont frappée début janvier – le Gouvernement n’a pas été totalement irresponsable dans cette affaire.
Ce rapport témoigne de l’ouverture dont le rapporteur a fait preuve sur les propositions qui nous ont été faites, qu’elles émanent des personnes que nous avons auditionnées ou de nos collègues. Si les premières rencontres entre le rapporteur et moi-même furent empreintes de difficultés, nous avons l’un et l’autre progressé pour aboutir à un document qui aidera le Gouvernement et peut-être l’Union européenne à faire face à une nouvelle pandémie et à tirer des leçons de ce qui s’est passé.
Le rapport insiste sur la nécessité d’adapter le plan de vaccination à la gravité de la pandémie. À cet égard, je dois dire que j’ai été très frappé par les propos du Secrétaire général de la défense et de la sécurité nationale, qui nous a affirmé que tout avait été parfait dans le meilleur des mondes ; quand je songe que c’est à lui qu’incombe la préparation des plans nationaux de réponse aux crises, j’ai quelque inquiétude sur notre capacité à nous adapter à toute crise qui pourrait survenir, dans quelque domaine que ce soit…
En matière de commandes de vaccins, la France, qui s’y était pourtant préparée avant les autres, s’est retrouvée en situation de faiblesse. Comme l’a souligné le rapporteur, il est regrettable que les États européens n’aient pas réussi à coordonner leurs commandes auprès des laboratoires pharmaceutiques. Si les Européens coordonnaient leurs productions, il serait sans doute possible de se procurer plus facilement des vaccins en monodoses.
S’agissant de l’OMS, je redis au nom de l’ensemble des membres de la commission d’enquête – et j’ai l’ai d’ailleurs indiqué à Mme la ministre de la santé et des sports – qu’il est scandaleux qu’une institution que les États européens financent, à qui ils délèguent un certain nombre de pouvoirs, ait refusé à deux reprises d’être entendue par notre commission d’enquête alors qu’elle ne se prive pas de s’exprimer ici ou là. Quant à la modification des règles de l’OMS relatives aux alertes pandémiques, elle constitue une avancée.
L’association du secteur libéral est une évidence pour tout le monde.
En ce qui concerne la transparence des relations entre les laboratoires et les experts, nous avons tous reconnu la nécessité de légiférer.
Il faut adapter la gestion de crise à la gravité de la pandémie : les plus graves doivent être gérées par le ministère de l’intérieur, les moins graves par le ministère de la santé.
N’étant pas un spécialiste de la santé publique, domaine qui relève du champ de compétences de la commission des affaires sociales, j’ai appris à quel point il est important que le public ait une connaissance préalable de l’incertitude dans laquelle se trouvent les pouvoirs publics face une pandémie – c’est d’ailleurs cette incertitude qui explique en grande partie les dysfonctionnements qui peuvent survenir. En effet, en pareil cas, le Gouvernement, quel qu’il soit, veut afficher des certitudes alors qu’en réalité il nage dans un océan d’incertitudes. Si nous voulons que la population adhère aux campagnes de vaccination, il faut parfaire sa connaissance des virus – à commencer par celui de la grippe – via des émissions télévisées ou la publication de documents. Souvenez-vous qu’au début, la méconnaissance de ce qu’était le sida a alimenté les fantasmes populaires. Lorsque survient un phénomène médical ou scientifique, la population ne peut adhérer à une politique de santé publique si elle ne dispose pas d’un minimum de connaissances.
Développer la politique vaccinale contre la grippe saisonnière, même si cela a un coût, nous permettrait d’utiliser les chaînes de production d’unidoses, de disposer de retours sur les cohortes, tant sur le plan de la pharmacovigilance que des habitudes de vaccination. Si les États-Unis ont mené à bien leur campagne de vaccination, c’est que beaucoup d’Américains se font vacciner contre la grippe saisonnière : ils se sont donc fait vacciner plus naturellement contre le nouveau virus.
Enfin, et c’est le membre de la commission des lois qui vous parle, je vous indique que malgré les discussions vives qui ont animé nos travaux à leurs débuts, je me félicite d’avoir participé à une commission d’enquête dont le but n’était pas de rechercher des coupables mais d’auditer des services publics. Dans notre pays, la commission d’enquête ne peut s’intéresser à un sujet traité par la justice, mais elle doit pouvoir approfondir notre connaissance des dysfonctionnements de services publics.
Avec l’autorisation du rapporteur, je propose un amendement écrit qui vise à compléter la proposition n° 42, à la page 114 du rapport par les mots :
« , notamment afin que les Français aient une parfaite conscience des incertitudes scientifiques inévitables lors de l’apparition d’un nouveau virus, ce qui peut conduire les pouvoirs publics à modifier les mesures de prévention au fur et à mesure de l’évolution de la connaissance scientifique. »
Il s’agit d’un problème politique, car la population attend des certitudes. Tant qu’elle ne saura pas que les responsables publics sont dans l’incertitude, ceux-ci seront mis en difficulté et parfois amenés à aller trop loin.
M. le rapporteur. Conscient de la nécessité de lutter contre le déni de risque et le refus vaccinal, et de développer la culture de santé publique, peu développée en France, j’accepte volontiers d’intégrer cet ajout.
M. le président Jean-Christophe Lagarde. Le rapporteur ayant accepté ma proposition, le rapport est ainsi rectifié.
M. Jean Mallot. Je préfèrerais faire état de « l’évolution des connaissances », car la connaissance n’est pas uniquement scientifique. Elle peut être sociologique, par exemple, s’agissant du comportement de telle ou telle population.
M. le rapporteur. Je suis d’accord.
M. le président Jean-Christophe Lagarde. Dont acte. Cet aménagement étant accepté par le rapporteur, il sera donc pris en compte.
Nous en venons aux explications de vote.
M. Gérard Bapt. Les députés du groupe socialiste jugent globalement très positives quasiment l’ensemble des recommandations qui figurent dans le rapport de M. Jean-Pierre Door.
Toutefois, si nous nous félicitons de l’existence de cette commission d’enquête, nous regrettons que son champ d’action ait été limité à la vaccination et n’ait pas été étendu au rôle de l’OMS et à l’usage des antiviraux.
Enfin, si nous ne sommes pas des « anti-vaccin », nous ne sommes pas non plus des partisans du « tout vaccin ». Lorsque vous préconisez, monsieur le président, de développer la vaccination contre la grippe saisonnière pour pouvoir produire davantage de vaccins, nous ne sommes pas d’accord avec vous. Pourquoi alors ne pas développer la production de vaccins contre les maladies négligées ou le chikungunya ?
Tout en reconnaissant la qualité du travail accompli par M. Jean-Pierre Door, notre groupe votera contre ce rapport.
M. le président Jean-Christophe Lagarde. Je rappelle que l’article 144-2 du Règlement de l’Assemblée nationale dispose que le rapport que vous vous apprêtez à voter, mes chers collègues, ne pourra être officiellement diffusé que dans les cinq jours francs suivant la publication, soit le 13 juillet. Nul doute que le rapporteur ne manquera pas de s’associer à moi pour dénoncer auprès du Président de l’Assemblée nationale l’anachronisme de cette procédure. En attendant, je vous demande de bien vouloir restituer les rapports qui vous ont été distribués.
Mme Jacqueline Fraysse. Je le dis d’emblée, je ne souhaite pas voter contre ce rapport que je juge intéressant et utile, tout au moins je l’espère.
Le rapporteur prétend que nous disons les mêmes choses, mais avec des mots différents : je ne partage pas totalement son appréciation. Je pense en effet que ce rapport atténue la responsabilité de l’État qui a fait preuve d’un autoritarisme grave, qui confine au mépris de la population et des intervenants
– c’est d’ailleurs de sa part une attitude constante, qui ne présage rien de bon pour l’avenir. Ce rapport manque de sévérité à l’égard de l’État, de réalisme et de détermination vis-à-vis des laboratoires pharmaceutiques qui réalisent des profits colossaux.
Cela dit, ne souhaitant pas voter contre ce rapport, je m’abstiendrai.
La Commission adopte le rapport de M. Jean-Pierre Door.
M. le président Jean-Christophe Lagarde. Mesdames, messieurs, je vous remercie.
La séance est levée à onze heures cinquante.
______________
ANNEXE 1 : RÉSOLUTION CRÉANT LA COMMISSION D’ENQUÊTE

TEXTE ADOPTÉ N° 427
« Petite loi »
______
ASSEMBLÉE NATIONALE
CONSTITUTION DU 4 OCTOBRE 1958
TREIZIÈME LÉGISLATURE
SESSION ORDINAIRE DE 2009-2010
24 février 2010
RÉSOLUTION
créant une commission d’enquête sur la manière dont a été programmée,
expliquée et gérée la campagne de vaccination
contre la grippe A(H1N1).
L’Assemblée nationale a adopté la résolution dont la teneur suit :
Article unique
Conformément aux articles 137 et suivants du Règlement, il est créé une commission d’enquête de trente membres sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1), dans le but de faire des propositions au Gouvernement pour rendre plus opérationnels, efficaces et réalistes nos futurs plans de vaccination contre les pandémies.
Délibéré en séance publique, à Paris, le 24 février 2010.
Le Président,
Signé : Bernard ACCOYER
ANNEXE 2 : COMPOSITION DE LA COMMISSION D’ENQUÊTE
(30 membres)
——
Groupe politique | |
M. Jean-Christophe Lagarde, président |
NC |
M. Jean-Pierre Door, rapporteur |
UMP |
M. Élie Aboud, vice-président |
UMP |
M. Guy Lefrand, vice-président |
UMP |
Mme Catherine Lemorton, vice-présidente |
SRC |
Mme Jacqueline Fraysse, vice-présidente |
GDR |
M. Michel Lejeune, secrétaire |
UMP |
M. Philippe Vitel, secrétaire |
UMP |
M. Gérard Bapt, secrétaire |
SRC |
Mme Marisol Touraine, secrétaire |
SRC |
M. Philippe Boënnec |
UMP |
Mme Valérie Boyer |
UMP |
M. Yves Bur |
UMP |
M. Patrice Debray |
UMP |
M. Bernard Debré |
UMP |
M. Rémi Delatte, à partir du 8 avril 2010 |
UMP |
M. Jacques Domergue |
UMP |
Mme Marie-Louise Fort |
UMP |
M. Sauveur Gandolfi-Scheit |
UMP |
M. Denis Jacquat |
UMP |
M. Paul Jeanneteau |
UMP |
M. Jean-François Mancel |
UMP |
M. Jean-Marie Rolland, démissionnaire le 8 avril 2010 |
UMP |
M. Jean-Paul Bacquet |
SRC |
M. Jean-Pierre Dufau |
SRC |
Mme Valérie Fourneyron |
SRC |
Mme Catherine Génisson |
SRC |
M. Jean-Marie Le Guen |
SRC |
M. Jean Mallot |
SRC |
Mme Dominique Orliac |
SRC |
M. Jean-Louis Touraine |
SRC |
SRC : groupe Socialiste, radical, citoyen et divers gauche
GDR : groupe de la Gauche démocrate et républicaine
ANNEXE 3 : ÉLÉMENTS DE COMPARAISON INTERNATIONALE SUR LES STRATÉGIES VACCINALES
Pays |
Nombre de doses de vaccins commandées |
Objectif de couverture vaccinale |
Taux de vaccination effectif |
Allemagne |
50 millions pour la commande ferme 90 millions supplémentaires en préréservation |
30 % de la population avec la commande ferme, 100 % de la population avec les préréservations |
10 % de la population |
Belgique |
12,6 millions de doses |
100 % de la population |
6 % de la population |
Espagne |
37 millions de doses |
40 % de la population |
Moins de 4 % de la population (1,8 millions de personnes) |
France |
94 millions de doses |
Entre 70 et 75 % de la population |
8,5 % de la population |
Italie |
24 millions de doses |
40 % de la population |
1,4 % de la population |
Pays-Bas |
34 millions de doses |
100 % de la population |
32 % de la population : 5,37 millions de personnes |
Royaume-Uni |
90 millions de doses |
Entre 70 et 75 % de la population |
7,4 % de la population : 4,54 millions de personnes |
Suède |
18 millions de doses |
100 % de la population |
64,5 % de la population : 6 millions de personnes |
États-Unis |
229 millions de doses |
75 % de la population |
23,4 % de la population : 70 millions de personnes |
Canada |
50,4 millions de doses |
Entre 75 et 80 % de la population |
Entre un tiers et 45 % de la population |
Chine |
101,8 millions de doses |
10 % de la population |
Environ 6 % de la population |
Japon |
153 millions de doses |
61 % de la population |
17,9 % de la population : 22,78 millions de personnes |
Russie |
34,36 millions de doses |
n.c |
9,7 % de la population : 13,8 millions de personnes |
Source : données issues de la direction générale de la santé.
ANNEXE 4 : TABLEAU CHRONOLOGIQUE
DE LA LUTTE CONTRE LE VIRUS A(H1N1)
Dates |
France |
Reste du monde |
17 avril |
États-Unis : identification, par le Center for Disease Control, de deux cas de syndrome respiratoire fébrile dus à une infection par un nouveau virus grippal d’origine porcine. | |
22 avril |
Mexique : déclaration d’état d’alerte national. | |
24 avril |
Première réunion interministérielle sur l’épidémie de grippe d’origine porcine au Mexique. |
L’OMS identifie le nouveau virus A(H1N1) 2009 sur la base de données partielles concernant le génome du virus. |
25 avril |
● Activation du centre de crise sanitaire. |
Réunion du comité d’urgence de l’OMS. |
● Première conférence de presse du ministère de la santé. |
||
● Première réunion du Comité de lutte contre la grippe. |
||
27 avril |
L’OMS décide le passage à la phase 4. Trois premiers cas sont identifiés en Europe. | |
28 avril |
Passage en situation 4A du plan de prévention et de lutte contre la pandémie grippale |
|
29 avril |
L’OMS décide le passage à la phase 5. | |
30 avril |
Passage en situation 5A et mise en place de la CIC. |
Conclusions du Conseil de l’Union européenne sur la nécessité de renforcer la coopération et le partage d’informations entre les États membres. |
1er mai |
● L’InVS confirme la présence en France de deux cas importés de grippe A(H1N1). |
La Commission européenne établit une définition de cas pour les sujets infectés par le virus A(H1N1). |
● 1ère réunion de la CIC : renforcement du dispositif d’information des voyageurs, lancement du recensement des stocks de masques. |
||
● Première conférence de presse conjointe des ministres chargés de l’intérieur et de la santé. |
||
2 mai |
2ème réunion de la CIC : équipement en masques FFP2 des professionnels exposés, achats de masques par l’ÉPRUS, annulation des voyages scolaires vers les zones à risque. |
615 cas de grippe A(H1N1) confirmés dans 15 pays. |
3 mai |
● Première évocation des capacités de production de vaccins des laboratoires lors d’une réunion interministérielle. |
|
● Avis de l’InVS sur la conduite à tenir par les professionnels de santé face à des cas suspects. |
||
● 3ème réunion de la CIC : création d’une zone d’accueil dédié à Roissy. |
||
4 mai |
● Avis de l’InVS sur l’analyse de l’état actuel de la menace pandémique et les critères de passage de la situation 5A à la situation 5B. |
|
● 4ème réunion de la CIC : envoi d’antiviraux au Mexique, recommandation sur la quarantaine à domicile, mobilisation des CODAMUPS. |
||
5 mai |
● 4 cas de grippe A(H1N1) en France. |
1 124 cas de grippe A(H1N1) notifiés par 21 pays, dont 25 décès. |
● 5ème réunion de la CIC. |
||
● 1ère campagne de communication de l’INPES sur la grippe et les gestes barrières (télévision, radio, presse). |
||
6 mai |
● L’InVS inclut 5 États des États-Unis (dont New York) dans les zones à risque. |
|
● 6ème réunion de la CIC. |
||
7 mai |
● 7ème réunion de la CIC : validation des besoins en masques des ministères. |
● Premières analyses de cas mettant en évidence une plus grande vulnérabilité des sujets jeunes et une plus grande fréquence des pneumonies et décès par rapport à la grippe saisonnière. |
● Confirmation de 12 cas au total de grippe A(H1N1). |
● Le laboratoire national de microbiologie de l’Agence de santé publique du Canada publie le séquençage total du génome du virus A(H1N1)2009 | |
● Lors d’une réunion interministérielle, le DGS mentionne que le nouveau virus n’aurait pas « les déterminants de virulence » identifiés dans le cas de la grippe espagnole de 1918. |
||
8 mai |
États-Unis et Mexique : mise en évidence d’un pourcentage inhabituel d’hospitalisations chez les sujets infectés par le virus A(H1N1). | |
10 mai |
● 8ème réunion de la CIC : point sur les perspectives de vaccination, instruction à l’ÉPRUS pour la commande de masques, validation du dispositif d’accueil dans les aéroports. |
|
● L’InVS mentionne que le virus A(H1N1) serait susceptible d’avoir un taux d’attaque très supérieur à celui de la grippe saisonnière. |
||
11 mai |
Lors d’une réunion interministérielle, premier bilan des concertations engagées avec les laboratoires ; il est notamment mentionné qu’une injection unique pourrait déjà apporter une part de protection. Le Premier ministre décide de la préréservation de 50 millions de doses de vaccins auprès du laboratoire GSK. |
Un article scientifique américain rapporte une sévérité clinique des cas de grippe A(H1N1) moindre que pour la grippe de 1918, comparable à celle de 1957 : taux d’attaque chez les enfants deux fois supérieur au taux d’attaque chez les adultes. |
12 mai |
9ème réunion de la CIC : point sur les négociations relatives à la préréservation des vaccins. |
|
14 mai |
● 10ème réunion de la CIC : point sur les préréservations et sur l’insuffisance de l’offre au regard de la demande mondiale. |
|
● Lettre d’intention à GSK pour la préréservation de 50 millions de doses de vaccins contre le virus A(H1N1). |
||
18 mai |
L’agence de santé publique britannique rapporte un taux de mortalité de 0,1 % des sujets symptomatiques aux Etats-Unis. | |
19 mai |
11ème réunion de la CIC : maintien du dispositif de prise en charge hospitalière. |
|
22 mai |
Le CDC d’Atlanta constate que la vaccination saisonnière ne protège pas contre le virus pandémique. | |
26 mai |
Lettre d’intérêt au laboratoire Baxter pour l’achat de 4 millions de doses pour une livraison fin septembre. |
|
27 mai |
Mise à disposition des industriels fabricants de vaccins de la souche semence fabriquée à partir de la souche A(H1N1) par les centres collaborateurs de l’OMS. | |
28 mai |
12ème réunion de la CIC : présentation de la stratégie d’achats de vaccins (une dose par personne, une seconde dose pour les catégories prioritaires et à terme, une seconde dose pour tous), réflexions sur la stratégie de vaccination. |
|
2 juin |
Première réunion de négociation entre l’ÉPRUS et GSK sur un contrat d’achat de 50 millions de doses. |
|
3 juin |
Lettres d’intention de réservation à Novartis et Sanofi Pasteur pour respectivement 24 et 15 millions de doses et demandes d’extension en fonction des capacités de production. |
|
5 juin |
● 3ème réunion du comité d’urgence de l’OMS. | |
● Plus de 21 000 cas confirmés de grippe A(H1N1) par 62 pays. | ||
10 juin |
● 13ème réunion de la CIC : hypothèse de première vague pandémique à l’été, confirmation de la prise en charge hospitalière des cas. |
|
● Diffusion de la première fiche de recommandation à destination des personnes malades et de leur entourage. |
||
11 juin |
● L’OMS décide le passage à la phase 6 : déclaration d’alerte pandémique. Le comité d’urgence ajoute que cette pandémie est, à ce stade, « de gravité modérée ». | |
● 28 774 cas de grippe A(H1N1) confirmés dans 74 pays, dont 144 décès. | ||
12 juin |
14ème réunion de la CIC : maintien de la France en situation 5A. |
|
16 juin |
15ème réunion de la CIC : annonce de la prochaine intégration de l’ensemble des États-Unis, de la Nouvelle-Zélande et de la Thaïlande en zones à risque, présentation des difficultés de négociation avec les industriels, préparation du basculement à la mi-juillet vers une prise en charge des malades par la médecine ambulatoire, validation de la doctrine de port du masque, préparation de la doctrine de fermeture des établissements scolaires. |
|
17 juin |
Avis de l’InVS sur les critères de fermeture des établissements scolaires en cas de survenue de cas de grippe A(H1N1). |
|
18 juin |
L’InVS confirme 133 cas de grippe A(H1N1) en France. |
|
22 juin |
● Avis du HCSP sur les limites de l’utilisation des vaccins contenant des adjuvants. ● Les négociations avec les industriels s’orientent vers la production de vaccins sans adjuvant (Sanofi Pasteur). |
|
26 juin |
● Avis du HCSP sur la pertinence de l’utilisation d’un vaccin pandémique dirigé contre le virus A(H1N1). |
|
● Le ministère de la santé décide que seuls les cas graves doivent faire l’objet d’une hospitalisation ; les autres cas sont pris en charge par les médecins traitants. |
||
1er juillet |
16ème réunion de la CIC : répartition des premières livraisons de masques entre ministères, définition et identification des personnels à rôle critique en pandémie (PARCEP). |
|
3 juillet |
● Réunion interministérielle : le Premier ministre valide la décision de commander 94 millions de doses de vaccins auprès de quatre laboratoires. ● Évocation de la clause d’irresponsabilité demandée par les laboratoires. |
|
L’InVS confirme 299 cas de grippe A(H1N1) en France. |
||
7 juillet |
Réunion informelle des ministres de la santé de l’UE : débat sur la vaccination contre le virus A(H1N1) et discussion, à l’initiative de la France, de la clause d’irresponsabilité demandée par les laboratoires. | |
8 juillet |
● Avis du HCSP sur la pertinence de l’utilisation d’un vaccin monovalent, sans adjuvant, contre le virus A(H1N1). |
|
● Signature d’un avenant au contrat avec le laboratoire Sanofi pour l’acquisition de 28 millions de doses de vaccins. |
||
10 juillet |
Signature définitive du contrat d’acquisition de 50 millions de doses de vaccins auprès de GSK. |
L’UE inscrit la grippe A(H1N1) dans la liste des maladies à déclaration obligatoire. |
13 juillet |
L’OMS publie des recommandations sur les stratégies vaccinales. | |
13 juillet |
Réunion à l’Élysée sur la situation épidémiologique, l’acquisition de vaccins, masques et antiviraux, le protocole de prise en charge des patients et les mesures prises face à un éventuel scénario noir. |
|
15 juillet |
17ème réunion de la CIC : élargissement à la médecine libérale de la prise en charge des cas programmé pour le 23 juillet, scénario d’une vaccination gratuite et non obligatoire proposée à l’ensemble de la population, signature des contrats pour l’acquisition de 94 millions de doses, actualisation des plans de continuité d’activité des ministères et travail du SGDN sur la définition des PARCEP. |
|
16 juillet |
L’InVS propose une adaptation de la surveillance épidémiologique et de gestion de la grippe A(H1N1) à La Réunion. |
L’agence de santé publique britannique relève une fréquence élevée de syndromes respiratoires aigus et une atteinte plus fréquente des enfants de moins de 14 ans. Prévision d’un taux d’attaque clinique de 30 %, d’un taux d’hospitalisation de 2 % et d’un taux de mortalité de 0,1 à 0,35 % des cas cliniques. |
21 juillet |
L’InVS annonce 483 authentifiés en France : fin de la surveillance individuelle des cas et passage au signalement et à l’investigation des cas groupés, à la surveillance populationnelle et au suivi des cas hospitalisés. |
|
22 juillet |
● 18ème réunion de la CIC : présentation des contraintes de la campagne de vaccination (présentation en flacons de 10 doses, dispositif de pharmacovigilance renforcé), lancement du travail de recensement des lieux possibles de vaccination et de la première circulaire d’organisation de la campagne vaccinale. |
|
● Conférence de presse sur l’élargissement de la prise en charge des patients au secteur ambulatoire et diffusion des premières fiches « mémo » à destination des professionnels de santé. |
||
23 juillet |
Élargissement du dispositif de prise en charge des patients à la médecine ambulatoire. |
|
29 juillet |
● 19ème réunion de la CIC : nécessité d’adapter les mesures du plan pandémie grippale, prévues pour une situation de pandémie liée au virus A(H5N1) ; discussion sur les populations prioritaires ; hypothèses de livraison des vaccins (4 à 5 millions de doses fin septembre, 8 à 10 en octobre, 15 en novembre et 42 en décembre), AMM conditionnelles des vaccins attendues fin septembre, préparation d’un document d’information dans le cadre de la rentrée scolaire. |
|
● Signature de l’avenant au contrat conclu avec Novartis pour l’acquisition de 16 millions de doses de vaccins. |
||
5 août |
20ème réunion de la CIC : évaluation des populations prioritaires, présentation des grandes lignes de la première circulaire sur l’organisation de la campagne vaccinale, projet d’instruction sur le port de masques FFP2 dans les administrations. |
|
6 août |
Avis de l’InVS sur les modalités d’évaluation de la gravité de la pandémie. |
|
10 août |
Signature définitive du contrat d’acquisition de 50 000 doses auprès du laboratoire Baxter. |
|
12 août |
21ème réunion de la CIC : présentation des principes de la circulaire sur l’organisation de la campagne vaccinale, recensement des sites utiles aux médecins pour communication aux préfets. |
|
13 août |
L’InVS publie une mise à jour des estimations d’hospitalisation et de décès, en nombre de cas. |
|
15 août |
Un article de presse britannique marque le début d’une campagne sur les craintes d’effets indésirables liés aux vaccins (syndrome de Guillain-Barré, utilisation d’adjuvants, etc.) | |
19 août |
22ème réunion de la CIC : annonce de l’arbitrage du Premier ministre sur le financement par l’État de la partie non sanitaire du fonctionnement des centres de vaccination, préparation de la campagne de vaccination des Français de l’étranger, mise à jour des fiches techniques annexées au plan pandémie. |
|
21 août |
Publication de la circulaire sur l’organisation territoriale de la campagne de vaccination. |
|
25 août |
Diffusion de la nouvelle campagne du ministère de la santé sur les gestes barrières. |
|
27 août |
● L’InVS publie un bilan de la situation en Australie et Nouvelle-Zélande : taux d’attaque élevé chez les 10-19 ans, proportion importante d’hospitalisations, décès majoritairement chez les plus de 60 ans et les sujets avec pathologies sous-jacentes. |
|
● 23ème réunion de la CIC : annonce d’une réunion des chefs des équipes opérationnelles départementales, demande aux préfets de réunir les médecins libéraux, point sur l’état prévisionnel des livraisons de vaccins et prévision d’étalement du calendrier du déroulement de la campagne pour l’adapter au plan de livraison. |
||
28 août |
Annonces de l’OMS : le virus A(H1N1) est dominant dans la plupart des régions du monde, pas de signe de mutation du virus, risque de submersion des services de soins intensifs, groupes d’âge plus jeunes touchés par le virus, cas graves et décès chez les moins de 50 ans ; risque accru pendant la grossesse et pour certains états pathologiques ; risque d’hospitalisations et de décès accru. | |
29 août |
Livraison de 12 000 doses du vaccin Celvapan (Baxter). |
|
2 septembre |
24ème réunion de la CIC : présentation du dispositif des bons de vaccination. |
|
Avis de l’InVS sur la doctrine de fermeture des établissements scolaires et universitaires en cas de survenue de cas de grippe A(H1N1). |
||
7 septembre |
Avis du HCSP sur les priorités sanitaires d’utilisation des vaccins pandémiques. |
|
8 septembre |
L’AFSSAPS publie les recommandations nationales sur les médicaments nécessaires dans un contexte de pandémie grippale. |
|
9 septembre |
25ème réunion de la CIC : présentation de l’avis du HCSP sur les priorités de la vaccination, précisions sur le financement de la campagne vaccinale, annonce d’une circulaire globale sur l’organisation de la campagne vaccinale. |
|
11 septembre |
Un article d’une revue scientifique mentionne que 50 % des sujets hospitalisés ne présentent pas de pathologie sous-jacente. | |
16 septembre |
26ème réunion de la CIC : présentation des taux d’attaque dans l’hémisphère Sud, prévision de la mise en place de 1 049 centres de vaccination, masse salariale de la campagne estimée autour de 300 millions d’euros. |
|
17 septembre |
L’InVS annonce que le seuil épidémique est franchi en France depuis deux semaines. |
|
23 septembre |
27ème réunion de la CIC : point sur les principaux jalons en matière de stratégie vaccinale et de vaccins, annonce de la proposition de ne pas retenir les PARCEP dans les populations prioritaires, présentation d’une circulaire sur la déprogrammation dans les établissements de santé. |
|
24 septembre |
● Lancement de la campagne de vaccination par le Premier ministre et fixation de l’ordre de priorité des populations. |
|
● 29 décès de patients porteurs du virus en France. |
||
28 septembre |
Publication par l’InVS des estimations de l’impact sanitaire de la pandémie. |
|
29 septembre |
Autorisation de mise sur le marché des vaccins Focetria (Novartis) et Pandemrix (GSK) par l’Agence européenne du médicament. | |
2 octobre |
Actualisation de l’avis du HCSP sur les priorités sanitaires d’utilisation des vaccins. |
Note explicative de l’Agence européenne du médicament sur l’AMM des vaccins pandémiques. |
5 octobre |
Le HCSP recommande le lancement de la campagne vaccinale le plus rapidement possible. |
Début de la campagne de vaccination aux États-unis. |
6 octobre |
Autorisation de mise sur le marché du vaccin Celvapan (Baxter) par l’Agence européenne du médicament. | |
7 octobre |
● 28ème réunion de la CIC : présentation du calendrier prévisionnel de livraison des vacins et du calendrier de lancement de la campagne (19 octobre dans les établissements de santé, entre le 3 et le 9 novembre dans les centres de vaccination). |
|
● Avis de l’AFSSAPS sur les adjuvants dans les vaccins pandémiques, les risques liés au thiomersal, le risque de survenue de syndrome de Guillain-Barré. Publication par l’AFSSAPS d’informations sur les vaccins pandémiques. |
||
9 octobre |
Première livraison de 1,1 million de doses de vaccins Pandemrix (GSK) en multidoses. |
|
12 octobre |
● Conclusion du conseil de l’UE sur la nécessaire coordination des États membres en matière de disponibilité des vaccins, stratégie de vaccination, processus réglementaire, information et communication, et coopération à l’échelle mondiale. | |
● Lancement de la campagne de vaccination en Suède. | ||
14 octobre |
30ème réunion de la CIC : présentation des derniers arbitrages du Premier ministre sur les modalités de financement de la campagne, validation de l’instruction de mobilisation des personnels administratifs, vaccination outre-mer, et demande du ministère de l’intérieur d’un arrêté global pour donner un cadre juridique à la campagne sur le fondement de l’article L. 3131-1 du code de la santé publique. |
|
15 octobre |
Note de l’AFSSAPS sur la surveillance des effets indésirables liés aux vaccins. |
Lancement de la campagne de vaccination en Italie. |
20 octobre |
Lancement de la campagne de vaccination dans les établissements de santé. |
● OMS : les données statistiques montrent une diminution des cas recensés sur le continent américain et un début de vague pandémique en Europe. |
● Lancement de la campagne de vaccination en Norvège. | ||
21 octobre |
Lancement de la campagne de vaccination en Grande-Bretagne. | |
26 octobre |
Lancement de la campagne de vaccination en Allemagne. | |
27 octobre |
Lancement de la campagne de vaccination en Autriche et au Luxembourg. | |
28 octobre |
31ème réunion de la CIC : point sur la circulaire globale sur l’organisation de la campagne vaccinale, ouverture au public des centres de vaccination prévue pour le 12 novembre, point sur le nombre de personnes vaccinées en établissements de santé, point sur l’organisation de la vaccination des scolaires. |
|
28 octobre |
Actualisation des recommandations du HCSP sur l’utilisation des vaccins pandémiques : recommandation du passage à une dose. |
|
30 octobre |
Le groupe d’experts de l’OMS recommande le passage à une dose unique pour les enfants de plus de 10 ans et les adultes. | |
1er novembre |
Lancement de la campagne de vaccination au Danemark. | |
4 novembre |
32ème réunion de la CIC : point sur la montée en puissance du dispositif des centres de vaccination, numéro national infogrippe, maintien d’un scénario de deux injections par personne, présentation de la circulaire sur la vaccination des scolaires, report au 9 novembre de la campagne de communication grand public |
|
7 novembre |
Lancement de la campagne de vaccination en Belgique. | |
9 novembre |
● Publication par l’AFSSAPS du premier bulletin de suivi de pharmacovigilance des vaccins. |
Lancement de la campagne de vaccination en Irlande. |
● Conférence de presse sur le lancement de la campagne de vaccination dans les centres et diffusion. |
||
10 novembre |
33ème réunion de la CIC : J-2 avant l’ouverture des centres, rappel sur l’ordre de priorité en matière de mobilisation des professionnels de santé, urgence d’une communication par les préfets d’une liste stabilisée des centres de vaccination à l’ÉPRUS. |
|
12 novembre |
● Ouverture des centres de vaccination. Suspicion d’un cas de syndrome de Guillain-Barré chez un personnel soignant vacciné. |
|
● Premières livraisons des vaccins Panenza (Sanofi) et Focetria (Novartis), dont une partie en monodoses. |
||
16 novembre |
Autorisation de mise sur le marché du vaccin Panenza (Sanofi Pasteur) par l’AFSSAPS : vaccin sans adjuvant destiné notamment à la vaccination des femmes enceintes et des nourrissons. |
Lancement de la campagne de vaccination en Espagne et en Grèce. |
17 novembre |
Fin de la surveillance des cas groupés par l’InVS, sauf pour ceux intervenant dans les populations à risque de complications. |
|
18 novembre |
34ème réunion de la CIC : point sur l’ouverture des centres de vaccination (centres peu fréquentés la première semaine et nombre de centres ouverts chaque jour en baisse), difficulté de mobilisation des médecins, programmation au 25 novembre du début de la vaccination dans les collèges et lycées et début décembre pour les écoles maternelles et primaires, mais en centre de vaccination, point sur les populations à vacciner par des équipes mobiles, présentation d’un comparatif sur l’organisation de la vaccination dans différents pays. |
|
19 novembre |
Organisation par l’InVS d’un séminaire d’échange d’expériences sur la pandémie dans l’hémisphère Sud. |
Recommandation par le Comité des produits de santé à usage humain de l’Agence européenne du médicament de passer à une dose de vaccin pour le Pandemrix et le Focetria. |
20 novembre |
L’institut norvégien de la santé publique informe l’OMS de la détection d’une mutation du virus A(H1N1). | |
23 novembre |
L’AFSSAPS met en ligne un formulaire de déclaration des événements indésirables à destination du grand public. |
Lancement de la campagne de vaccination aux Pays-Bas et en République tchèque. |
25 novembre |
35ème réunion de la CIC : fonctionnement des centres de vaccination (demande d’élargissement des plages d’ouverture, notamment le samedi), difficultés d’obtention des listes des médecins du travail, lancement de la campagne dans les établissements scolaires, annonce d’une prochaine décision de l’Agence européenne du médicament sur le passage à une injection unique. |
|
27 novembre |
Annonce du passage à une injection unique pour les adultes de moins de 60 ans et une partie des enfants, sur la base des données fournies par l’Agence européenne du médicament. |
Modification, par la Commission européenne, de l’AMM du Pandemrix et du Focetria pour passer à une seule dose. |
30 novembre |
Mesures décidées pour améliorer le fonctionnement des centres de vaccination, face à l’affluence du public. |
|
2 décembre |
36ème réunion de la CIC : annonce de l’élargissement des plages d’ouverture des centres, mission IGAS/IGA sur le fonctionnement des centres, appel en renfort de la Croix Rouge et d’associations pour l’accueil dans les centres, lancement d’une réflexion sur une vaccination autonome dans les administrations et les grandes entreprises, travaux sur la permanence des soins pendant les fêtes de fin d’année. |
|
3 décembre |
Décision du Président de la République de renforcer le fonctionnement des centres de vaccination et instructions du Premier ministre sur la mobilisation des personnels dans ces centres. |
|
4 décembre |
Bilan du déroulement des campagnes de vaccination au cours de la réunion des ministres de la santé du G7 et du Mexique à Londres. | |
8 décembre |
L’InVS publie une analyse des premiers cas graves liés la grippe A(H1N1) en France. |
|
9 décembre |
37ème réunion de la CIC : point sur l’amélioration de la situation dans les centres de vaccination, difficultés des équipes opérationnelles départementales à planifier l’activité des professionnels mobilisés, seconde campagne dans les collèges et lycées avec intégration des personnels de l’éducation nationale. |
|
10 décembre |
● Évolution des recommandations de prescription des antiviraux vers leur prescription systématique chez tous les patients présentant une grippe clinique. |
|
● Livraison des 38 000 doses restantes du vaccin Celvapan (Baxter). |
||
11 décembre |
Actualisation de la posologie des vaccins pandémiques par le HCSP. |
|
16 décembre |
38ème réunion de la CIC : poursuite de l’amélioration des conditions d’accueil dans les centres, signalement du refus de certains médecins d’être réquisitionnés, point sur l’adaptation du dispositif pour Noël et à partir de janvier 2010. |
|
21 décembre |
Mise à disposition des stocks gouvernementaux de Tamiflu et de Relenza dans les officines (mis à disposition gratuitement sur ordonnance). |
|
23 décembre |
39ème réunion du CIC : point sur la campagne vaccinale, présentation de la convention pour l’organisation d’une campagne autonome dans les grandes entreprises et administrations, présentation de la circulaire sur la seconde campagne dans les collèges et lycées. |
|
30 décembre |
40ème réunion de la CIC : point sur la campagne, ouverture des centres de vaccination situés en établissements de santé à la population générale, présentation des modalités d’ouverture des centres à partir du 4 janvier. |
|
4 janvier |
Annonce de la résiliation unilatérale de 50 millions de doses de vaccins. |
|
6 janvier |
41ème réunion de la CIC : point sur la campagne, début de la seconde campagne en établissement scolaire, début des vaccinations autonomes en entreprise, annonce d’une extension du nombre de centres en établissement de santé, présentation du dispositif d’extension de la vaccination à la médecine de ville. |
|
12 janvier |
● L’InVS déclare la fin de la vague pandémique en France. |
|
● Ouverture de la vaccination auprès des médecins généralistes. |
||
13 janvier |
42ème réunion de la CIC : point d’avancement sur la campagne de vaccination, fermeture des centres prévue le 6 mars avec débat sur le service minimum entre le 6 février et le 6 mars. |
|
21 janvier |
43ème et dernière réunion de la CIC : prévision de fermeture des centres. |
|
29 janvier |
Avis du HCSP sur la pertinence de la poursuite de la campagne de vaccination contre le virus A(H1N1). |
|
30 janvier |
Fermeture des centres de vaccination. |
|
31 janvier |
L’AFSSAPS juge que les signalements portés à sa connaissance sur les vaccins ne remettent pas en cause la balance bénéfice-risque. |
|
4 février |
Diffusion de l’annonce presse concernant la vaccination dans les cabinets médicaux. |
Glossaire des sigles utilisés
AFSSAPS : Agence française de sécurité sanitaire des produits de santé.
AMM : Autorisation de mise sur le marché.
CDC : Center for disease control (Centre pour la prévention et le contrôle des maladies).
CIC : Cellule interministérielle de crise.
CODAMUPS : Comité départemental de l’aide médicale urgente, de la permanence des soins et des transports sanitaires.
DGS : Directeur général de la santé.
ÉPRUS : Établissement de préparation et de réponse aux urgences sanitaires.
HCSP : Haut conseil de la santé publique.
IGA : Inspection générale de l’administration.
IGAS : Inspection générale des affaires sociales.
INPES : Institut national de prévention et d’éducation pour la santé.
InVS : Institut de veille sanitaire.
OMS : Organisation mondiale de la santé.
PARCEP : Personnels à rôle critique en pandémie.
ANNEXE 5 : LETTRE DU PRÉSIDENT JEAN-CHRISTOPHE LAGARDE AU DOCTEUR MARGARET CHAN,
DIRECTRICE GÉNÉRALE DE L’ORGANISATION MONDIALE DE LA SANTÉ
COMMISSION D’ENQUÊTE SUR LA MANIÈRE DONT A ÉTÉ PROGRAMMÉE, EXPLIQUÉE ET GÉRÉE LA CAMPAGNE DE VACCINATION CONTRE LA GRIPPE A(H1N1) |
RÉPUBLIQUE FRANÇAISE Paris, le 19 mai 2010 |
Madame la Directrice générale,
Dès sa constitution, la Commission d’enquête de l’Assemblée nationale française sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1) a souhaité entendre un représentant de l’Organisation mondiale de la santé afin qu’il expose la stratégie de l’Organisation contre la pandémie grippale et son impact sur les politiques menées dans les différents pays, et singulièrement en France.
Le docteur Sylvie Briand avait été contactée à cette fin. Malheureusement, le docteur Keiji Fukuda nous a fait part du refus de l’organisation de participer à une quelconque audition, fusse-t-elle par visioconférence, procédure qui avait été proposée.
L’ensemble des membres de la Commission d’enquête, toutes tendances politiques confondues, le regrette vivement. Ce refus ne peut qu’alimenter critiques et suspicions, et surtout est incompréhensible compte tenu de la précédente participation de l’Organisation mondiale de la santé – la vôtre – aux travaux de la mission d’information de l’Assemblée nationale sur la grippe H5N1 en novembre 2005 comme à différents colloques ou conférences dans divers pays, dont la France. De surcroît, l’attitude de votre organisation, financée par des contributions nationales, contraste singulièrement avec l’acceptation de la Commission européenne, de l’Agence européenne du médicament et du Centre européen pour la prévention et le contrôle des maladies.
Espérant que vous pourrez envisager un changement de position, une conférence à distance, – la Commission d’enquête n’étant en aucune façon un tribunal, mais visant simplement à proposer des pistes d’amélioration des procédures pour les prochaines campagnes de vaccination – je vous prie d’agréer, Madame la Directrice générale, l’expression de mes respectueux hommages.
Le Président,
e Lagarde
Dr Margaret Chan
Directrice générale de l’Organisation mondiale de la santé
Avenue Appia 20
1211 Genève 27
SUISSE
ANNEXE 6 : COMPTES RENDUS DES AUDITIONS
Les auditions sont présentées dans l’ordre chronologique des séances tenues par la commission d’enquête.
(Toutes les auditions, sauf indication contraire, ont été ouvertes à la presse.)
Audition de M. Didier Houssin, directeur général de la santé au ministère de la santé et des sports (Procès-verbal de la séance du mardi 6 avril 2010) 174
Audition de M. Thierry Coudert, directeur de l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS) (Procès-verbal de la séance du mardi 6 avril 2010) 189
Audition de Mme Françoise Weber, directrice générale de l’Institut de veille sanitaire (InVS) (Procès-verbal de la séance du mardi 6 avril 2010) 202
Audition de M. Bernard Boubé, préfet et ancien directeur de l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS) (Procès-verbal de la séance du mardi 6 avril 2010) 211
Audition de M. Benoît Leclercq, directeur général de l’Assistance publique – Hôpitaux de Paris (AP-HP) (Procès-verbal de la séance du mercredi 7 avril 2010) 218
Audition de Mme Annie Podeur, directrice générale de l’offre de soins au ministère de la santé et des sports (Procès-verbal de la séance du mercredi 7 avril 2010) 229
Audition de M. Laurent Degos, président du collège de la Haute Autorité de santé (HAS) (Procès-verbal de la séance du mercredi 7 avril 2010) 241
Audition de M. Claude Hannoun, professeur honoraire à l’Institut Pasteur (Procès-verbal de la séance du mardi 13 avril 2010) 249
Audition de M. le professeur Bernard Bégaud, pharmacologue (Procès-verbal de la séance du mardi 13 avril 2010) 261
Audition de M. le professeur Pierre Bégué, membre de l’Académie nationale de médecine (Procès-verbal de la séance du mardi 13 avril 2010) 266
Audition de M. Didier Tabuteau, conseiller d’État, directeur général de la Fondation Caisses d’épargne pour la solidarité et directeur de la chaire Santé de l’Institut d’études politiques de Paris et de M. Claude Le Pen, professeur de sciences économiques à l’université de Paris-Dauphine (Procès-verbal de la séance du mardi 13 avril 2010) 284
Audition de M. Christian Lajoux, président du LEEM (Les entreprises du médicament) (Procès-verbal de la séance du mardi 13 avril 2010) 297
Audition de M. Michel Setbon, sociologue au Centre national de la recherche scientifique et à l’École des hautes études en santé publique (Procès-verbal de la séance du mardi 13 avril 2010) 304
Audition de M. Antoine Flahault, directeur de l’École des hautes études en santé publique (Procès-verbal de la séance du mardi 27 avril 2010) 313
Table ronde réunissant des représentants d’ordres et de syndicats professionnels : M. Thierry Amouroux, secrétaire général du Syndicat des personnels infirmiers, M. Michel Chassang, président de la Confédération des syndicats médicaux français, M. Philippe Gaertner, président de la Fédération des syndicats pharmaceutiques de France, M. Claude Leicher, président de MG France, Mme Chloé Loyez, étudiante en troisième année du deuxième cycle d’études de médecine à l’Université Paris VI, présidente de l’Association nationale des étudiants en médecine de France, M. Grégory Murcier, président de l’Intersyndicat national des internes des hôpitaux, qui représente les internes de spécialité hors médecine générale, M. Martial Olivier-Koehret, médecin généraliste, ancien président de MG France, M. Matthieu Piccoli, étudiant en troisième année de deuxième cycle d’études de médecine à l’Université Paris-Descartes, représentant des étudiants en médecine d’Île-de-France, M. Patrick Romestaing, ORL libéral, président de la section Santé publique du Conseil national de l’Ordre des médecins et M. Philippe Tisserand, président de la Fédération nationale des infirmiers libéraux (Procès-verbal de la séance du mardi 27 avril 2010) 325
Audition de M. Jacques Berger, directeur général délégué de Sanofi Pasteur (Procès-verbal de la séance du mercredi 28 avril 2010) 359
Audition de M. Philippe Chêne, président de Baxter France (Procès-verbal de la séance du mercredi 28 avril 2010) 371
Audition de M. Hervé Gisserot, président de GlaxoSmithKline (Procès-verbal de la séance du mercredi 28 avril 2010) 377
Audition de M. Alexandre Sudarskis, directeur général de Novartis vaccins et diagnostics (Procès-verbal de la séance du mercredi 28 avril 2010) 387
Audition de M. Jean Marimbert, directeur général de l’Agence française de sécurité sanitaire des produits de santé (Procès-verbal de la séance du mercredi 5 mai 2010) 396
Audition de M. Claude Michellet, directeur de l’académie de Paris (Procès-verbal de la séance du mercredi 5 mai 2010) 408
Audition de M. Thierry Saussez, directeur du service d’information du Gouvernement (Procès-verbal de la séance du mercredi 5 mai 2010) 417
Audition de M. Yves Kerouédan, président de la Chambre syndicale de la répartition pharmaceutique, et de M. Emmanuel Déchin, secrétaire général (Procès-verbal de la séance du mercredi 5 mai 2010) 430
Audition de M. Thierry Gentilhomme, chef du département des urgences sanitaires de la direction générale de la santé au ministère de la santé et des sports (Procès-verbal de la séance du mercredi 5 mai 2010) 440
Audition de M. Francis Delon, secrétaire général de la défense et de la sécurité nationale et de M. Yann Jounot, directeur de la planification de sécurité nationale au ministère de l’intérieur, de l’outre-mer et des collectivités territoriales (Procès-verbal de la séance du mardi 11 mai 2010) 449
Audition de M. Roger Salamon, président du collège du Haut conseil de la santé publique (Procès-verbal de la séance du mardi 11 mai 2010) 465
Audition de M. le Professeur Marc Gentilini, professeur émérite des maladies infectieuses et tropicales à l’hôpital de La Pitié-Salpêtrière, président honoraire et membre de l’Académie nationale de médecine et membre du Conseil économique, social et environnemental, et de M. le Professeur François Bricaire, chef du service maladies infectieuses et tropicales à l’hôpital de La Pitié-Salpêtrière (Procès-verbal de la séance du mardi 11 mai 2010) 474
Audition de M. Paul Castel, directeur général des hospices civils de Lyon, président de la conférence des directeurs généraux de centres hospitaliers régionaux et universitaires (Procès-verbal de la séance du mardi 11 mai 2010) 485
Audition de M. John Ryan, chef de l’unité « Menaces sur la santé » au sein de la direction générale de la santé de la Commission européenne, de M. Patrick Le Courtois, membre de l’Agence européenne du médicament, et de M. Denis Coulombier, membre du Centre européen pour la prévention et le contrôle des maladies (Procès-verbal de la séance du mercredi 12 mai 2010) 491
Audition de Mme Sophie Kornowski-Bonnet, présidente du laboratoire Roche (Procès-verbal de la séance du mercredi 12 mai 2010) 512
Audition de M. Thierry Blanchon, responsable adjoint du réseau Sentinelles à l’Institut national de la santé et de la recherche médicale (INSERM) et de M. Jean-Marie Cohen, coordinateur national des groupes régionaux d’observation de la grippe (GROG) (Procès-verbal de la séance du mercredi 26 mai 2010) 516
Audition de M. Jean Leonetti, président de la Fédération hospitalière de France (Procès-verbal de la séance du mercredi 26 mai 2010) 532
Audition de M. Pierre Brodard, secrétaire général de la Fédération nationale des centres de santé (Procès-verbal de la séance du mercredi 26 mai 2010) 540
Audition de M. Frédéric van Roekeghem, directeur général de la Caisse nationale d’assurance maladie des travailleurs salariés (CNAMTS) (Procès-verbal de la séance du mercredi 26 mai 2010) 544
Table ronde réunissant des représentants de médias : M. Gérard Amsellem (Pratis TV), M. Paul Benkimoun (Le Monde), M. Alain Ducardonnet (LCI), M. Éric Favereau (Libération), M. Jean-Daniel Flaysakier (France 2), Mme Viviane Jungfer (TF1), M. Gérard Kouchner (Le Quotidien du médecin), M. Marc Payet (Le Parisien-Aujourd’hui en France), Mme Martine Perez (Le Figaro), M. Benoît Thévenet (France 5) et M. Jérôme Vincent (Le Point) (Procès-verbal de la séance du jeudi 27 mai 2010) 556
Audition de Mme Viviane Defrance, secrétaire générale adjointe du Syndicat des infirmières conseillères de santé (SNICS-FSU) (Procès-verbal de la séance du mardi 1er juin 2010) 580
Audition de M. Jacques Fontan, responsable du centre de vaccination de Capbreton (Procès-verbal de la séance du mercredi 2 juin 2010) 590
Audition de M. Philippe Coste, ancien directeur départemental des affaires sanitaires et sociales de Paris (Procès-verbal de la séance du mercredi 2 juin 2010) 599
Audition de Mme Valérie Lévy-Jurin, maire-adjointe de Nancy, présidente du réseau français des villes santé de l’Organisation mondiale de la santé, membre de l’Association des maires de France (Procès-verbal de la séance du mercredi 2 juin 2010) 603
Audition de M. Jean-Claude Manuguerra, président du Comité de lutte contre la grippe (Procès-verbal de la séance du mercredi 2 juin 2010) 606
Audition de M. Atanase Périfan, président de l’association Voisins solidaires (Procès-verbal de la séance du mercredi 2 juin 2010) 622
Audition de M. Pierre Boissier, chef de l’Inspection générale des affaires sociales (IGAS) (Procès-verbal de la séance du mercredi 9 juin 2010) 625
Audition de M. Nacer Meddah, préfet de Franche-Comté, ancien préfet de Seine-Saint-Denis (Procès-verbal de la séance du mercredi 9 juin 2010) 633
Audition de M. Bernard Fragneau, ancien préfet du Loiret (Procès-verbal de la séance du mercredi 9 juin 2010) 640
Audition de M. Marc Girard, consultant (Procès-verbal de la séance du mercredi 9 juin 2010) 644
Audition de M. Didier Houssin, directeur général de la santé au ministère de la santé et des sports (Procès-verbal de la séance du jeudi 10 juin 2010) 662
Audition de Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports (Procès-verbal de la séance du mardi 15 juin 2010) 689
Audition de M. Luc Chatel, ministre de l’éducation nationale, porte-parole du Gouvernement (Procès-verbal de la séance du mercredi 16 juin 2010) 716
Audition de M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales (Procès-verbal de la séance du mercredi 16 juin 2010) 727
.
Audition de M. Didier Houssin,
directeur général de la santé au ministère de la santé et des sports
(Procès-verbal de la séance du mardi 6 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures trente.
(M. Didier Houssin prête serment.)
M. Didier Houssin, directeur général de la santé au ministère de la santé et des sports. En préambule, je souhaite situer le cadre de mon action.
J’ai été nommé directeur général de la santé le 31 mars 2005. Le 31 août 2005, en pleine flambée épizootique mondiale liée au virus grippal H5N1, j’ai été nommé délégué interministériel à la lutte contre la grippe aviaire. Outre la menace de pandémie grippale liée à ce virus, j’ai dû affronter, dès 2005, l’épidémie liée au virus chikungunya à La Réunion et l’état d’hyper-endémie lié au méningocoque B14.P1.7-16 dans la zone de Dieppe. J’ai donc été sensibilisé très tôt aux menaces épidémiques.
J’ajoute que je suis médecin et que je n’ai pas de lien d’intérêts avec l’industrie pharmaceutique ou des dispositifs médicaux.
La campagne de vaccination contre le virus H1N1 a été inédite. J’en évoquerai successivement la programmation, l’explication et la gestion. Conformément à votre demande, je centrerai mon propos sur la manière retenue pour préparer et conduire chacune de ces actions.
Le travail de programmation d’une campagne vaccinale contre un virus grippal pandémique avait été partiellement préparé durant la période qui a précédé le 24 avril, dans le cadre de la menace liée au virus grippal aviaire H5N1. Plusieurs avis du Haut conseil de la santé publique (HCSP) et un avis du Comité consultatif national d’éthique (CCNE) avaient été émis ; des contrats de réservation de vaccins pandémiques avaient été mis en œuvre ; un travail interministériel avait été lancé en 2008 sur les priorités d’accès à la vaccination ; des outils d’information à l’intention du public et des professionnels de santé avaient été élaborés.
L’éventualité, en cas de pandémie, de pouvoir proposer une vaccination avant la première vague, était cependant jugée hautement improbable.
Cette éventualité s’est toutefois présentée en 2009, en raison de la réactivité des pays d’émergence du virus et de l’OMS, en raison de la date de cette émergence – fin avril, donc au terme de la période de grippe saisonnière – et du fait que la pandémie épargna largement la métropole durant l’été. Tout cela rendait très probable la survenue d’une première vague pandémique avant la fin 2009, donc dans un délai compatible avec une campagne de vaccination préalable.
À partir de la fin du mois d’avril 2009, le travail de programmation s’est fait en plusieurs étapes. Il s’agissait d’abord d’inscrire cette tâche prioritaire en plus des missions du dispositif de gestion de crise, dès le début du mois de mai ; de définir une stratégie de vaccination et de préparer l’acquisition de vaccins, en mai et juin ; de choisir ensuite une organisation pour la campagne de vaccination, en juin et juillet, en tenant compte de nombreuses contraintes, parmi lesquelles les plus fortes étaient la présentation du vaccin en multi-doses – imposant un mode collectif d’organisation de la vaccination – et sa livraison très progressive. En août et septembre, il s’est agi de définir un ordre de priorité de la vaccination. La campagne de vaccination a été lancée en octobre, puis il a fallu, en octobre, novembre et décembre, assurer le suivi de cette campagne, en se préparant, au besoin, à sa suspension.
Cette programmation a été fondée sur l’expertise de différents organismes nationaux – l’Institut de veille sanitaire (InVS), le Comité de lutte contre la grippe (CLCG), le Haut conseil de la santé publique (HCSP), l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) et le Comité consultatif national d’éthique (CCNE), dont l’avis n° 106 a été formulé en février 2009 –, européens – le European Center for Disease Prevention and Control (ECDC) et l’Agence européenne du médicament (EMEA) –, et internationaux – le Center for Disease Control and Prevention (CDC) d’Atlanta, aux États-Unis, l’Organisation mondiale de la santé (OMS), notamment.
L’expertise était large et approfondie s’agissant du choix d’une stratégie de vaccination, de la décision d’acquisition de vaccins, de la définition d’un ordre de priorité pour la vaccination, du lancement et du suivi de la campagne. Elle était en revanche peu développée concernant les aspects organisationnels de cette dernière. L’organisation mise en place en France, choisie sous forte contrainte, s’est donc surtout inspirée de certains travaux conduits dans le cadre du plan variole – il est très vite apparu que le cadre d’ensemble n’était toutefois pas applicable –, de l’organisation de la vaccination contre la méningite en Seine-Maritime ou contre la grippe saisonnière, et de l’exemple du dispositif prévu au Canada. Cette organisation a été testée avant le lancement de la campagne, dans le cadre d’exercices, afin d’affiner, par exemple, l’organisation interne d’un centre de vaccination. L’organisation a été adaptée au fil du temps, notamment pour tenir compte de l’évolution des connaissances (type de vaccins recommandés pour les femmes enceintes, entre autres), des variations d’affluence, ou afin de rendre la vaccination possible pour certaines catégories de la population (constitution d’équipes mobiles).
Ce travail de programmation a réclamé la mise en place d’importantes articulations entre les ministères de l’intérieur et de la santé, avec les collectivités locales, à propos des centres de vaccination et avec d’autres ministères – éducation nationale pour la vaccination des scolaires, affaires étrangères pour la vaccination des Français à l’étranger, travail et solidarité pour la vaccination en milieu de travail ou en établissement médico-social, justice pour la vaccination en établissement pénitentiaire.
Le travail d’explication touchant la vaccination a été l’un des aspects les plus difficiles de la lutte contre la pandémie grippale liée au virus H1N1. Ce travail d’explication avait été partiellement préparé (outil internet « Mon quotidien en pandémie » destiné au site pandemie-grippale.gouv.fr).
Dès le mois de mai, ce travail d’explication s’est néanmoins révélé complexe du fait de la nécessaire articulation avec l’information sur la vaccination contre la grippe saisonnière, laquelle ne pouvait être abandonnée, de l’évolution rapide des connaissances, mais aussi de nombreuses incertitudes. Parmi ces dernières, les plus importantes ont concerné l’appréciation de la gravité de la pandémie, la possibilité de disposer de vaccins ayant une autorisation d’utilisation, la date des autorisations, le calendrier de livraison des vaccins et le volume des premières quantités livrées – les calendriers ont toujours été indicatifs –, les effets indésirables liés aux vaccins – ce qui a imposé la mise en place d’un vaste plan de gestion des risques et un travail particulier de transparence conduit par l’AFSSAPS autour des questions de pharmacovigilance –, la possibilité d’utiliser une dose plutôt que deux pour la vaccination, qui ne s’est confirmée qu’en novembre 2009, l’ordre de priorité à retenir pour la vaccination et les règles relatives à l’articulation avec la vaccination contre la grippe saisonnière, qui n’ont pu être fixées qu’en septembre 2009.
Ce travail d’explication, appuyé notamment par de nombreux points presse, un site internet dédié, des courriers de la ministre et une campagne de l’Institut national de prévention et d’éducation pour la santé (INPES), a été conduit auprès des professionnels de santé, des établissements de santé et du secteur ambulatoire, auprès du grand public et de nombreux autres acteurs de la campagne – centre interministériel de crise, préfets et leurs équipes opérationnelles départementales, autres ministères, services du ministère de la santé, chefs de centres de vaccination.
Ce travail d’explication a été appuyé d’initiatives à visée d’exemple, comme la vaccination de la ministre, ou la vacation en centre de vaccination que j’ai personnellement assurée le 21 novembre.
Les explications fournies par les autorités sanitaires ont toutefois été contrariées par l’intervention sur la scène médiatique – presse ou internet –, de différents acteurs, y compris des médecins, dont les propos ont semé le doute sur l’opportunité de se faire vacciner et dont les principaux messages étaient que la pandémie grippale, moins importante que d’autres problèmes sanitaires dans le monde, ne méritait pas l’attention, qu’elle n’était pas grave, que la vaccination était inutile, que les vaccins étaient dangereux, que la vaccination était organisée de façon collective, donc mal organisée, que la campagne de vaccination était le résultat d’un complot de l’industrie pharmaceutique, ou d’un complot politique visant à porter atteinte aux libertés individuelles, voire d’un complot visant l’élimination d’une partie de l’espèce humaine.
Dans le contexte d’une crise de longue durée, la gestion de la campagne de vaccination, au sens opérationnel et logistique, a réclamé des efforts importants et soutenus de la part de nombreux acteurs.
La gestion de la campagne a suscité de nombreuses décisions au niveau du Centre interministériel de crise (CIC), pilotée par le ministère de l’intérieur. Outre l’ouverture dès le premier jour du centre de crise sanitaire, la direction générale de la santé a fait évoluer son organisation interne afin de mettre en place une équipe « projet » pour préparer la campagne, puis participer à son pilotage et à son suivi – notamment opérationnel et logistique – en lien avec l’InVS, l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS), la CNAMTS et l’AFSSAPS.
L’ÉPRUS, dont la montée en charge, peu après sa création, avait été retardée par des problèmes de gouvernance, a su jouer un rôle clé dans l’acquisition et la logistique des produits de santé – vaccins, aiguilles, seringues –, notamment grâce à la création en son sein de l’établissement pharmaceutique début 2009, et dans la gestion des ressources humaines, puisqu’il a fourni le contexte d’emploi qui a permis d’offrir un cadre juridique et de rémunération à près de 10 000 personnes.
Le rôle des préfets, mobilisés par les circulaires du 21 août et du 28 octobre 2009, a été central dans la mise en œuvre de la campagne et dans les adaptations de son organisation, notamment lors du passage à une phase de forte affluence à compter du 18 novembre.
Les acteurs territoriaux, pour leur part, ont contribué à la gestion par la mise à disposition de personnels, de locaux adaptés, comme les gymnases, et de matériels ; certains ont mis en place un système dédié d’information de leurs administrés, voire d’organisation des prises de rendez-vous.
Les établissements de santé ont organisé une activité de vaccination en leur sein, indispensable pour certaines populations. Quant aux professionnels de santé, ils ont contribué largement au fonctionnement des centres de vaccination, puis ont pris le relais dans le secteur ambulatoire lorsque cela est devenu possible.
Enfin, le public, dont l’affluence s’est renforcée soudainement avant de faiblir à nouveau en janvier, a imposé de constantes adaptations du dispositif.
Du point de vue sanitaire, la gestion de la campagne s’est attachée particulièrement à fluidifier la logistique de distribution des vaccins afin d’éviter les ruptures importantes d’approvisionnement, à réguler les invitations à la vaccination grâce à l’envoi de bons, assuré par la CNAMTS – indispensable pour la mise en place effective d’un ordre de priorité, la sécurisation du dispositif de traçabilité et la mesure de la couverture vaccinale –, et à informer les professionnels de santé concernés, compte tenu des différents vaccins utilisés et des différentes recommandations d’utilisation. La gestion de la campagne s’est aussi efforcée d’éviter que des personnes prioritaires ne puissent pas accéder à la vaccination (édition de bons dans les centres de vaccination) et à la sécurité sanitaire de la vaccination, par une analyse des dysfonctionnements observés et la diffusion rapide de recommandations aux chefs de centres.
Enfin, grâce au dispositif de la réquisition, la gestion de la campagne a permis d’offrir un cadre d’action juridiquement sécurisé à tous les professionnels concernés.
En conclusion, je dirai que la campagne de vaccination contre le virus A(H1N1) organisée en France entre les mois d’octobre et janvier a été inédite, traduisant un effort collectif sans précédent, qui ne pouvait toutefois manquer d’interroger dans une société parfois saisie par l’individualisme. Des leçons sont à en tirer pour l’avenir de la vaccination, sur la capacité de l’État à informer et à expliquer à l’heure d’internet et sur l’aptitude du système de santé à s’organiser dans des circonstances exceptionnelles.
En mai, en août et jusque tard dans l’année, notre crainte était que la pandémie liée au virus H1N1 ne se traduise par une hécatombe. Nous avons tout fait pour l’éviter et protéger au mieux la santé des Français, la campagne de vaccination étant l’une des importantes mesures de prévention prises à cette occasion. La pandémie n’est pas terminée, mais nous nous sommes efforcés d’adapter les actions à l’évolution des connaissances, dans un contexte longtemps marqué – il l’est encore – par de grandes incertitudes. À ce jour, l’hécatombe n’a pas eu lieu. Chance inespérée ? Erreur d’appréciation ? Action efficace ? Les deux, voire les trois ? Votre commission d’enquête va pouvoir en juger.
Mme Marisol Touraine. Vous avez dit lors de votre audition devant le Sénat que la gestion de la pandémie avait été suivie par le Président de la République et que des arbitrages importants avaient été rendus par le Premier ministre. Pouvez-vous préciser ce qui a été défini à l’Élysée, les choix qui ont été faits au niveau du Gouvernement et les décisions qui ont été prises par la ministre de la santé ?
Dans une interview donnée au journal Libération le 3 mars 2010 et intitulée « On ne referait pas très différemment », vous dites : « J’arrive à la conclusion que notre action a été couronnée de succès. Par rapport à ce que l’on pouvait craindre, il n’y a eu, à ce stade, qu’environ 300 décès en France. » Considérez-vous que ce chiffre soit à mettre au crédit du dispositif mis en place ?
Comment expliquez-vous le décalage entre votre objectif initial – une vaccination massive de la population – et le résultat de la campagne – 6 millions de personnes vaccinées seulement ?
Vous semblez considérer que le choix d’une vaccination dans des centres collectifs a été fait en raison du conditionnement des vaccins. Ne fallait-il pas procéder autrement, en demandant à l’industrie pharmaceutique de conditionner les vaccins en fonction des choix opérés en amont ?
Vous avez dit que des interventions médiatiques sur internet avaient troublé l’opinion et qu’il fallait en tirer les conséquences pour la communication gouvernementale. Est-ce à dire qu’à aucun moment le Gouvernement ne s’est interrogé sur les modalités d’une communication de crise dans une société démocratique où l’information est libre et circule ?
M. Guy Lefrand. Quel rôle ont joué les experts et l’OMS dans l’évolution de la gestion de cette crise ? En d’autres termes, les décisions ont-elles été prises en fonction des risques présentés par l’OMS ?
Le Gouvernement a, semble-t-il, perdu une bataille, celle de la communication. Quelles sont les causes de cet échec, quel rôle a joué internet et quelles leçons en tirez-vous ? Comment expliquez-vous le rejet, tant par le grand public que par une partie des professionnels de santé, de la gestion de cette crise ?
D’après vous, de quelle nature était la relation qui s’est instaurée entre le Gouvernement et l’industrie pharmaceutique ?
Enfin, la décision sur le conditionnement des vaccins en multi-doses a eu des effets en cascade, affectant notamment l’adhésion des professionnels de santé. Aurait-il pu en être autrement ?
M. Jean-Pierre Door, rapporteur. Quand et comment a-t-il été décidé de valider la stratégie de vaccination globale ? De quelle façon le nombre de vaccins à commander a-t-il été calculé? Comment expliquez-vous le refus initial des laboratoires de livrer des vaccins unidose ?
Enfin, il semble que les relations entre le ministère de l’intérieur et celui de la santé n’aient pas été optimales. Pensez-vous qu’elles aient été de nature à gêner l’information du grand public ?
M. le président Jean-Christophe Lagarde. Vous avez dit que le choix du conditionnement en multidoses était lié à un problème de délai. Quelle était la différence de délai annoncée par les laboratoires pour fournir des vaccins unidose ?
Il sera d’autant plus intéressant d’entendre votre réponse à la dernière question du rapporteur que vous êtes le délégué interministériel à la lutte contre la grippe aviaire.
M. Didier Houssin. Madame Touraine, je n’ai pas participé à l’ensemble des réunions qui se sont tenues autour du Président de la République, mais je crois savoir qu’elles étaient destinées à l’information de celui-ci et des ministres concernés. En dehors de la décision concernant l’acquisition de matériels de réanimation et de dispositifs d’oxygénation extracorporelle, les décisions formellement visibles ont été prises principalement au niveau du Premier ministre : acquisition des vaccins – décision prise le 3 juillet –, gratuité de la vaccination, aspect non obligatoire, ordre de priorité, élargissement de la prise en charge des cas du secteur hospitalier au secteur ambulatoire – décision prise le 22 ou 23 juillet. Les décisions relevant du secteur sanitaire, comme le rôle des établissements de santé dans la vaccination, ont été prises par la ministre de la santé. La plupart des décisions étant de nature interministérielle, elles ont été en grande partie validées par le centre interministériel de crise, présidé par les ministres ou par leurs directeurs de cabinet.
Si j’ai dit lors d’une interview – interview que j’avais acceptée parce que la ministre m’en avait donné l’autorisation – que notre action avait été couronnée de succès, je n’ai pas voulu dire que c’était un succès sur toute la ligne : le nombre de décès a été relativement peu élevé si on le compare à celui de pandémies antérieures, alors que ce phénomène naturel, qui dure encore, aurait pu avoir des conséquences extrêmement graves. Est-ce le résultat de la chance ou est-ce lié aux actions menées par les pouvoirs publics et les professionnels concernés ? On ne peut pas écarter l’hypothèse que ce qui a été fait pour retarder le processus – fermetures de classes en septembre et octobre, élargissement des recommandations en matière d’hygiène, traitement précoce de certains malades par antiviraux, vaccination d’un certain nombre de personnes – ait eu un effet bénéfique. Une évolution spontanée de la pandémie aurait-elle eu des conséquences plus graves ? Il est difficile de répondre à cette question.
Lorsque la vaccination peut être conduite, elle constitue une bonne méthode de prévention, si tant est qu’elle survienne largement avant l’apparition du phénomène épidémique. Nous avons tenté de déclencher la campagne le plus rapidement possible afin de ne pas être pris de vitesse ; de ce point de vue, le succès n’est pas total puisque la vaccination a débuté quelques semaines seulement avant le pic épidémique.
Il est certain que nous aurions préféré disposer d’un conditionnement du vaccin en unidose, ce qui aurait permis d’organiser la campagne comme nous le faisons contre la grippe saisonnière. Les industriels nous ont tous répondu de la même manière : organiser le flaconnage de quantités aussi importantes requérait un délai supplémentaire minimum de deux mois. Compte tenu de l’extrême pression temporelle à laquelle nous étions soumis, il n’a pas été jugé raisonnable d’attendre.
Il faudra effectivement tirer toutes les conséquences de la conduite de la communication de crise. Une veille sur internet était assurée par le service d’information du Gouvernement et nous avions, dans le cadre de la préparation à une pandémie grippale, déjà mis en place un site. Mais nous n’étions pas suffisamment armés pour battre en brèche les argumentaires et les rumeurs qui se sont développés sur le réseau. Le CDC d’Atlanta et la Food and Drug Administration (FDA) disposent d’équipes qui ont pour seule tâche de suivre Facebook ou Twitter et de réagir dès l’apparition de signaux inquiétants. Nous avons encore des progrès à faire en ce domaine. Toutefois, l’intervention de l’État sur internet – anonyme ou non – dans un cadre de gestion de crise pose problème pour la démocratie.
Monsieur Lefrand, on peut critiquer le rôle des experts, dire que leurs estimations étaient erronées, mettre en avant la question des déclarations d’intérêts, et pointer les liens que certains entretiendraient avec l’industrie pharmaceutique. Malgré tout, je crois que nous avons eu la chance de disposer d’un dispositif réactif. La mobilisation rapide de l’InVS, du HCSP et de l’AFSSAPS nous a permis de ne jamais nous trouver en situation de perdition. Il convient de saluer le travail des organismes d’épidémiologie, l’évaluation par l’AFSSAPS des vaccins en développement et l’installation des dispositifs de pharmacovigilance, grâce auxquels nous avons pu suivre en sécurité la mise en place des vaccins.
Je ne pense pas que l’on puisse faire grief à l’OMS de sa réactivité. Quelques années plus tôt, nous avions été confrontés au SRAS (syndrome respiratoire aigu sévère), qui s’était propagé en quelques jours sur la surface du globe et le manque de réactivité des Chinois avait été pointé du doigt. Nous ne pouvons que nous féliciter de la rapidité de réaction de l’OMS.
S’agissant de la vaccination, nous avons perdu la bataille du nombre. Sans qu’il s’agisse d’une obligation, l’idée était que chaque personne souhaitant se faire vacciner puisse l’être, selon un ordre de priorité. Nous aurions aimé avoir une couverture vaccinale semblable à celles obtenues en Suède, en Norvège ou au Canada, mais il se trouve que la population française ne s’est pas montrée assez inquiète, craignant peut-être davantage le vaccin. La comparaison doit être faite avec la Suède. Au Canada, en raison d’un climat différent, la crainte de la pandémie était bien plus importante et les résultats obtenus en matière de vaccination bien plus élevés.
Il est difficile d’extraire la gestion d’un tel phénomène de son environnement sociétal, politique et médiatique. De la même manière, la réaction des individus vis-à-vis de la vaccination traduit leur perception des positions politiques ou médiatiques, elles-mêmes fluctuantes. Les professionnels de santé n’échappent pas à ce contexte – ils sont eux aussi connectés à internet – et leur opinion est influencée par les diverses informations en circulation. Pour autant, il convient de s’interroger sur les raisons qui ont conduit un nombre significatif d’entre eux à envisager de dissuader leurs patients de se faire vacciner ou même à affirmer qu’ils ne recommanderaient pas la vaccination. Comment obtenir l’adhésion des professionnels de santé dans une situation critique ? C’est l’une des questions que nous devons nous poser pour l’avenir.
Vous m’avez interrogé sur les liens avec l’industrie pharmaceutique, thème sur lequel enquête plus particulièrement la commission sénatoriale. Trois arguments invalident l’hypothèse selon laquelle le Gouvernement aurait été manipulé.
Premier argument : les industriels ne tiennent pas le premier maillon de la chaîne, qui permet de faire remonter les informations depuis les cabinets ou les hôpitaux et de qualifier la situation. Les organismes d’épidémiologie, par nature, ne sont pas liés aux firmes pharmaceutiques. Celles-ci ne sont pas en mesure de laisser accroire que l’on est confronté à une pandémie lorsque tel n’est pas le cas.
Deuxième argument : si les 35 producteurs mondiaux s’étaient entendus pour monter une affaire de cette ampleur, ils se seraient préparés à la production massive de vaccins et à un conditionnement en unidose.
Troisième argument : si l’industrie avait tenu dans sa main les experts de l’AFSSAPS et de l’EMEA, elle ne leur aurait jamais laissé dire en octobre qu’une seule dose de vaccin suffisait.
La thèse du complot, national ou international, ne tient pas !
M. le président Jean-Christophe Lagarde. L’interrogation porte davantage sur les liens, plus apparents, que les experts entretiennent avec les différents laboratoires.
M. Didier Houssin. M. Jean-Pierre Door m’a interrogé sur le processus de décision. La direction générale de la santé interrogeait les organismes d’expertise compétents pour avoir un avis. L’avis fourni, elle formulait une préconisation à l’attention de la ministre. La décision était alors validée dans le cadre du ministère, en interministériel ou par le Premier ministre. Puis la direction générale de la santé, dans le cadre de la CIC, avec les autres ministères, la mettait en œuvre.
Les exercices de préparation à l’éventualité d’une pandémie avaient montré début 2009 qu’il était important de passer rapidement en posture interministérielle. Le plan pandémie avait désigné le ministère de l’intérieur comme pilote, du fait de son dispositif préfectoral. L’organisation interministérielle s’est révélée un choix heureux car nous nous sommes trouvés confrontés dès le premier jour à des problèmes touchant à l’organisation des aéroports, à la police des frontières, à la douane, aux affaires étrangères et à la santé.
M. Jean-Marie Le Guen. Monsieur le président, je ne pense pas que la logique d’une commission d’enquête soit d’entendre un discours global et théorique – que nous connaissons déjà –, mais d’inviter la personne auditionnée à répondre de façon précise à des questions précises. Faute de quoi, nous aurons tous perdu notre temps et nous resterons sur notre faim.
M. le président Jean-Christophe Lagarde. J’allais justement proposer à nos collègues de formuler les questions les plus concises possible afin que M. Houssin puisse y répondre de manière brève et précise.
Monsieur Houssin, vous avez dit que l’on ne pouvait exclure le fait que la campagne de vaccination ait eu des effets bénéfiques. Quel a été le taux de mortalité en Pologne, pays où il n’y a pas eu de campagne de vaccination ?
M. Didier Houssin. Mme la ministre a répondu à cette question devant la commission d’enquête sénatoriale. Il est difficile de recenser précisément le nombre de décès liés à la grippe H1N1 – il existe toujours une partie invisible – et nous connaissons mal la situation sanitaire polonaise. Du point de vue méthodologique, il ne semble pas rigoureux de comparer la Pologne et la France. J’ajoute que le gouvernement polonais avait clairement l’intention d’organiser une campagne, mais que des contraintes diverses l’en ont empêché.
M. le président Jean-Christophe Lagarde. Cela revient à dire que l’on ne peut jamais évaluer l’efficacité d’une campagne de vaccination.
M. Jean-Marie Le Guen. Quels sont les noms des experts qui se sont prononcés pour une vaccination générale ?
Vous avez dit que les décisions sur la stratégie vaccinale s’étaient appuyées sur des considérations d’ordre sanitaire, psychosocial et politique. Qui a pris quel type de décisions ? Quelles ont été les recommandations d’ordre sanitaire ? Sur quelle base les réflexions psychosociales ont-elle été élaborées ? À quel moment la décision politique a-t-elle été prise ?
M. Dider Houssin. Les avis formulés par le CLCG et par le HCSP ont été, dans la quasi-totalité des cas, votés à l’unanimité, ou à une très grande majorité et une abstention. Je peux vous communiquer les comptes rendus de ces réunions.
M. Jean-Marie Le Guen. Je précise ma question. Si vous interrogez un expert comme Bruno Lina, il vous dira que le HCSP, où siège une majorité de représentants de l’administration, n’a fait que valider une décision qui était déjà prise. En d’autres termes, si les experts se sont ralliés à une décision administrative, car elle ne comportait pas d’inconvénient majeur, aucun ne peut affirmer qu’il a recommandé une vaccination générale. Par ailleurs, est-il sérieux d’affirmer que votre position éthique était de permettre à chacun de se faire vacciner, alors que cette position n’était pas compatible avec un calendrier qui prévoyait dix-huit mois de vaccination ?
M. Dider Houssin. Les comptes rendus vous donneront une idée de la façon dont étaient organisées les délibérations. Je ne pense pas que le CLCG et le HCSP aient suivi une quelconque instruction de l’administration. Je leur adressais un courrier de saisine où étaient posées un certain nombre de questions, auxquelles ils répondaient sur un papier où figuraient également les votes. Ces documents, qui retracent les réunions des mois d’avril, mai, juin et juillet, sont à votre disposition. Cela dit, que les experts se sentent aujourd’hui « sous pression » et critiqués, et que cela puisse influer sur certaines prises de position, je ne dirai pas le contraire !
La campagne n’était pas prévue pour durer dix-huit mois. Le dimensionnement du dispositif, au niveau des centres de vaccination, avait été calculé de manière que l’on puisse effectuer la vaccination en quatre mois, dans le cas d’une appétence particulière de la population. Peut-être était-ce trop long encore, mais il fallait tenir compte de contraintes d’organisation très importantes.
S’agissant de l’acquisition des vaccins, deux stratégies se présentaient à nous : une stratégie « santé publique » consistant à vacciner de façon suffisamment large pour bloquer l’épidémie avant qu’elle ne survienne, ce qui était assez peu probable compte tenu de ce que l’on pouvait craindre de la cinétique de celle-ci ; une stratégie de protection individuelle consistant à encourager les personnes à se faire vacciner. Chacune des options conduisait à dimensionner un stock de vaccins, qu’il fallait acquérir suffisamment tôt. La décision politique la plus importante a été celle du 3 juillet, lorsque le Premier ministre a validé l’acquisition de 94 millions de doses.
M. Bernard Debré. Combien de traitements antiviraux avez-vous achetés et qu’en avez-vous fait ? Les publications montrent que les antiviraux ne sont pas efficaces sur la mortalité : tout au plus réduisent-ils de quelques heures la symptomatologie, lorsqu’ils sont administrés rapidement.
Pouvez-vous confirmer qu’en sus de la commande de 94 millions de doses de vaccin, l’ÉPRUS a reçu l’instruction de poser une option pour 30 millions de doses, ce qui fait un total de 124 millions de doses ?
Je crois savoir que les grippes de type H et N ne nécessitent qu’une injection de vaccin. Pourquoi a-t-il été décidé de vacciner deux fois contre la grippe A(H1N1) ? Mais cette question est sans doute idiote puisque l’on a, par la suite, changé d’avis et décidé de ne vacciner qu’une fois.
Pourquoi les Américains ont-ils disposé avant nous d’un vaccin s’administrant par injection nasale, conditionné de manière différente ?
Combien faut-il vacciner de personnes pour stopper une épidémie ? Je n’ai jamais entendu dire qu’il fallait vacciner deux fois toute une population !
M. Didier Houssin. Effectivement, les antiviraux n’ont pas fait la preuve d’une très grande efficacité contre la grippe saisonnière. En revanche, cinq ou six publications montrent que, parmi les personnes atteintes du virus H1N1 et hospitalisées, celles qui ont reçu des antiviraux dans les premières quarante-huit heures ont développé des formes moins graves et présenté un taux de létalité plus faible.
M. Bernard Debré. Il y a des publications qui affirment le contraire !
M. Didier Houssin. Je n’en ai pas vu beaucoup !
C’est l’avis unanime du CLCG, rendu le 12 novembre, qui nous a conduits à modifier la recommandation, afin d’inciter les médecins à prescrire plus largement les antiviraux.
M. Bernard Debré. Combien de traitements antiviraux avez-vous achetés ?
M. Didier Houssin. Nous avions acquis, dans le cadre de la préparation à une pandémie grippale, notamment liée à un virus H5N1, un stock de 33 millions de traitements. La seule acquisition d’antiviraux en 2009 concerne quelques centaines de milliers de doses de Tamiflu pédiatrique.
Effectivement, nous avons pris une option sur une trentaine de millions de doses dans le cas où il serait nécessaire de vacciner en deux fois l’ensemble de la population. Pourquoi en deux fois ? Nous avions affaire à un virus grippal d’un type nouveau – une recombinaison inhabituelle de composants d’origines aviaire, porcine et humaine. Or, dans le cas du H5N1, également nouveau, l’immunité suffisante ne pouvait s’obtenir qu’avec deux doses de vaccin. Depuis le mois de décembre, il est apparu que le H1N1, bien que très nouveau, aurait des structures conservées du virus de 1918 et que, par conséquent, la population présenterait une immunité bien meilleure que prévu.
M. Bernard Debré. Le H1 avait aussi sévi en 1957, 1958 et 1959.
M. Didier Houssin. Le H1 qui circule aujourd’hui ressemble davantage au virus de 1918.
Pour une efficacité barrière, il faut en effet vacciner entre 30 et 50 % de la population ; mais il faut pouvoir le faire suffisamment en amont de l’épidémie, ce qui n’était pas notre cas. Nous devions donc être en mesure de proposer la vaccination à l’ensemble de la population, notamment si la survenue de formes graves en grand nombre avait incité les Français à se faire vacciner.
M. Jean-Marie Le Guen. Mais les vaccins n’étaient pas disponibles !
Mme Catherine Lemorton. Pourquoi avez-vous ciblé 47 millions de personnes plutôt que 40 ou 50 millions ?
Ne pensez-vous pas que renvoyer nos concitoyens à un site internet, même officiel, du Gouvernement les ait incités à mettre sur un même plan l’information officielle et les inepties qui circulaient sur les autres sites ? N’eût-il pas mieux valu privilégier la diffusion de spots à la télévision ou à la radio ?
Les personnes auditionnées ont expliqué que la généralisation de la vaccination au monde adulte s’appuyait sur l’extrapolation du modèle de la grippe saisonnière. Comment avez-vous pu procéder à une telle extrapolation pour le monde des enfants – je pense notamment aux 3-24 mois, déjà soumis à de multiples vaccinations – puisque ceux-ci ne sont pas vaccinés contre la grippe saisonnière ? Avez-vous effectué des tests cliniques ? Dans l’affirmative, combien ?
M. Jean-Paul Bacquet. Avez-vous pris du recul par rapport à vos choix initiaux ? Pouvez-vous raisonnablement considérer que votre campagne soit un succès lorsque seulement 10 % de la population ont été vaccinés ? Vous pouviez tirer les enseignements des épidémies précédentes et des campagnes de vaccination passées. Je pense notamment à celle qui avait été – très mal – organisée dans le Puy-de-Dôme contre la méningite.
Pourquoi avoir exclu d’office les médecins généralistes d’une stratégie qui, au départ, devait conduire à la vaccination de 50 % de la population seulement ?
Vous entendre vous féliciter de cette campagne et n’en tirer aucune conclusion me rend extrêmement inquiet pour l’avenir : de quelle crédibilité disposerons-nous pour organiser la prochaine campagne ?
M. Didier Houssin. Madame Lemorton, le calcul du nombre de doses nécessaires a été effectué aux mois de mai et juin en tenant compte de la forte probabilité que nous devions disposer de deux doses – selon les informations alors en notre possession – et de l’hypothèse selon laquelle les personnes âgées bénéficiaient d’une certaine immunité, et d’un taux de compliance de 75 %. Celui-ci a été établi à partir du taux de compliance à la vaccination contre la grippe saisonnière – entre 65 et 70 % – et du taux de compliance à la vaccination contre la méningite en Seine-Maritime – de l’ordre de 85 %. Nous avons donc proposé d’acquérir 94 millions de doses, pour un total de 47 millions de personnes.
Votre remarque concernant internet est importante. Il convient de réexaminer l’action des pouvoirs publics sur le réseau en cas de crise, qu’elle soit d’origine sanitaire ou autre. Mettre en place un site n’est pas tout : encore faut-il que celui-ci soit correctement référencé et que l’on soit capable de combattre les arguments délétères.
Nous avons disposé très tôt d’informations concernant le risque de mortalité liée au H1N1 chez les personnes les plus jeunes. Dans la dernière publication de PLoS Medicine, il est d’ailleurs démontré que la pandémie de 2009 se situe à un niveau bien supérieur à celui des grippes saisonnières en termes d’années de vie perdues. Les personnes jeunes étaient les plus touchées, et c’est la raison pour laquelle nous étions enclins à proposer des vaccins aux enfants. Compte tenu de l’absence de données cliniques concernant les vaccins adjuvantés, le Haut conseil a recommandé l’utilisation de vaccins sans adjuvants, que nous avons réussi à obtenir auprès de Sanofi-Pasteur.
Monsieur Bacquet, je n’ai jamais dit que la gestion de la pandémie ait été un succès sur toute la ligne : j’ai dit que, sur le plan de l’impact sanitaire final, elle avait été couronnée de succès. Pour autant, je ne trouve pas satisfaisant le taux de couverture vaccinale.
La campagne de vaccination dans le Puy-de-Dôme était certainement antérieure à ma prise de fonctions à la direction générale de la santé. En revanche, je connais bien la campagne qui a été conduite contre la méningite en Seine-Maritime : grâce à une vaccination collective, l’épidémie a été enrayée.
Pourquoi le choix d’une vaccination collective ? Les contraintes du conditionnement en multidoses, la nécessité d’organiser un ordre de priorité et de faire en sorte que les médecins, le moment venu, se consacrent entièrement aux personnes malades, nous ont fait préférer un mode collectif d’organisation de la vaccination.
Mme Marie-Louise Fort. J’ai reçu beaucoup de protestations de la part des médecins généralistes, qui sont – faut-il le rappeler ? – l’un des piliers de notre système de santé. Quelles ont été les précautions prises pour les informer ou les intéresser à la préparation ainsi qu’à l’explication de la campagne ? Ne croyez-vous pas qu’ils auraient pu être vos meilleurs alliés pour combattre la désinformation ? Envisagez-vous désormais de les associer pleinement à la gestion des crises à venir ?
M. Gérard Bapt. M. Jean-Marie Le Guen vous a demandé quels avaient été les arbitrages rendus par le Premier ministre. Combien de réunions interministérielles se sont-elles tenues à Matignon ? M. le rapporteur peut-il en obtenir les comptes rendus ?
Vous parlez d’une décision d’acquisition des vaccins validée par le Premier ministre le 3 juillet. Mais la décision administrative n’a-t-elle pas été prise en amont, avant même que ne fût connu l’avis des experts ? Le 14 mai, le directeur de cabinet de la ministre de la santé écrivait au président de GlaxoSmithKline (GSK) afin de réserver – pour une somme de 75 millions d’euros hors taxes à régler à la réservation – 50 millions de doses.
Vous avez fait le choix de vacciner 75 % de la population. Comme il ne pouvait plus s’agir d’une vaccination barrière – le vaccin étant arrivé après le virus –, il vous restait encore la possibilité de choisir des populations cibles, conformément aux recommandations de la mission d’information sur la grippe aviaire, présidée par Jean-Marie Le Guen et dont le rapporteur était Jean-Pierre Door, qui préconisait de cibler 30 % de la population, publics prioritaires inclus.
Comment se fait-il que les autorités sanitaires n’aient pas tenu compte du passage somme toute rapide du virus au Mexique ? Pourquoi n’ont-elles pas réagi lorsque l’OMS a changé sa définition de la pandémie, relevant le niveau d’alerte au niveau 6 alors que seulement 144 décès étaient déclarés ? Le passage en phase 6 permettait tout simplement de faire jouer les contrats pré-pandémiques, ce qui revenait à abaisser le bras d’un bandit manchot : 2 milliards de livres sterling de commandes !
M. Jean-Pierre Dufau. Qui a pris la décision politique de lancer la vaccination massive et à quelle date ? Quand les vaccins ont-ils été commandés ? Enfin, qui a pris la décision de mettre fin à la campagne le 31 janvier, et pourquoi ?
Mme Catherine Génisson. A-t-on une idée du nombre de personnes atteintes par la grippe A(H1N1) ? Alors que l’on avait sorti l’arme nucléaire pour faire le diagnostic obligatoire de cette grippe, les médecins se sont vus, du jour au lendemain, quasiment interdire de faire ce diagnostic. Pourquoi ? Le diagnostic différentiel des symptômes d’une grippe A(H1N1) et d’une grippe saisonnière n’étant pas des plus faciles, comment expliquer la prescription du Tamiflu, dont on sait le peu d’efficacité pour les grippes saisonnières ?
Mme Valérie Fourneyron. Je serai, comme l’ensemble de mes collègues, très attentive à vos réponses sur le calendrier des commandes. Qui a commandé les vaccins et quand ?
Vous avez dit que les arbitrages sur les publics cibles avaient été rendus à Matignon. Quels sont les dysfonctionnements qui expliquent notamment la faible couverture vaccinale des personnes souffrant d’affections de longue durée ?
Comment expliquez-vous la défiance dont a fait preuve le ministère de la santé à l’égard des médecins généralistes ? Celle-ci pèsera lourd à l’avenir, et il faudra en tirer toutes les conséquences.
M. Élie Aboud. Il est vrai que le maillon constitué par les médecins généralistes a dysfonctionné.
Mme Marie-Louise Fort. Il a manqué !
M. Élie Aboud. Il était surréaliste de voir, d’un côté, les pouvoirs publics lancer une importante campagne d’information et, de l’autre, les médecins généralistes dénigrer la vaccination. La direction générale de la santé est-elle entrée en contact avec les syndicats de médecins généralistes ? Ces contacts ont-ils, à un certain moment, cessé ?
M. Didier Houssin. Entre les mois de mai et d’octobre, six réunions au moins se sont tenues au ministère de la santé avec les responsables des syndicats, ceux des unions régionales des médecins libéraux et les ordres. Des contacts réguliers et permanents ont donc été établis ; ils ont notamment porté sur l’élargissement de la prise en charge à la médecine ambulatoire et sur la vaccination. Toutefois, le hiatus – ou la perception d’un hiatus – entre médecins et autorités sanitaires demeure incontestablement l’une des leçons à tirer de la pandémie.
Monsieur Bapt, le centre interministériel de crise s’est réuni une quarantaine de fois, ce qui a donné lieu à des comptes rendus, à mon avis accessibles. Par ailleurs, les réunions interministérielles ont fait l’objet d’un « bleu », et leurs comptes rendus sont aussi certainement accessibles.
Nous avons établi des contacts réguliers avec les laboratoires à partir du 30 avril, date à laquelle nous avons reçu un premier mail. Nous cherchions à savoir quel type de vaccin, sous quelle forme et selon quel calendrier, les industriels, que nous ayons un contrat avec eux ou non, pouvaient produire. Leurs réponses nous ont permis de distinguer certains d’entre eux, dont GSK, qui avait de l’avance tandis que Sanofi n’avait pas d’autorisation pour son vaccin Emerflu. En mai et juin, nous avons émis des lettres d’intention en direction des laboratoires capables de livrer rapidement des quantités importantes de vaccin. Mais la décision formelle d’acquisition et la notification des marchés n’ont pas été faites avant la décision du Premier ministre du 3 juillet.
M. Gérard Bapt. Dans la lettre du 14 mai, il est bien spécifié que 1,50 euro par dose de vaccin devait être versé à titre d’arrhes et que cet acompte de réservation serait remboursé si l’OMS ne remettait pas de souche. Cela signifie bien qu’un engagement de réservation a été effectué et que 75 millions d’euros ont été versés !
M. Didier Houssin. C’était une lettre d’intention.
M. Gérard Bapt. Faut-il un jury d’honneur ?
M. Didier Houssin. Pour établir le nombre de doses à commander, nous avons tenu compte de l’avis n° 106 du CCNE, postérieur au rapport de la mission d’information parlementaire, selon lequel il convenait que l’ensemble de la population puisse accéder à la vaccination si elle le souhaitait, étant entendu qu’un ordre de priorité pouvait être établi. Cet avis a constitué un élément de la décision politique, au même titre que les considérations d’ordre sanitaire.
En 2008, l’OMS s’est interrogée dans le cadre de la préparation à une pandémie sur l’éventualité de diriger le phasage en fonction d’éléments de gravité. Cela supposait de pouvoir recenser les décès de façon fiable et identique dans chaque pays, ce qui s’est révélé extrêmement difficile. L’idée a donc été abandonnée. Toutefois, la pandémie de 2009 a montré qu’il s’agissait d’un point crucial. Ainsi, je pense qu’il faudrait réviser le plan et tenter, malgré tout, de construire des indicateurs de gravité.
Nous avons tous été marqués par l’affaire de la grippe porcine de 1976, lorsque les États-Unis ont lancé une campagne de vaccination contre un risque épidémique finalement inexistant. L’Institute of Medicine a depuis démontré que cet échec tenait en partie au fait que le président Ford avait été enfermé dans une seule décision consistant à la fois à acquérir les vaccins, à définir l’ordre de priorités et à lancer la campagne.
J’ai pensé qu’il fallait faire en sorte de distinguer chacune des décisions. L’acquisition des vaccins devait survenir suffisamment tôt pour laisser le temps de la production ; l’ordre de priorité devait être établi indépendamment ; le lancement de la campagne devait être décidé après une nouvelle analyse de la situation épidémiologique, pour pouvoir faire marche arrière si nécessaire.
On ne peut pas dire que l’acquisition et le lancement de la campagne de vaccination aient été simultanés : l’acquisition a été décidée le 3 juillet et le lancement de la campagne de vaccination fin septembre.
Lorsque la campagne a effectivement été lancée, fin septembre, l’InVS faisait toujours état d’un risque de mortalité important, et ce scénario était partagé par les organismes épidémiologiques européens.
M. le président Jean-Christophe Lagarde. Pourtant, en septembre, l’administration avait pu observer le pic épidémique en Nouvelle-Calédonie ou à la Réunion où, en l’absence de vaccin, la mortalité n’avait pas été importante. Pourquoi vous attendiez-vous à une situation plus grave en métropole ?
M. Jean-Pierre Dufau. À quel moment ont eu lieu les séances de travail à l’Élysée, autour du Président de la République ?
M. Didier Houssin. Nous avons évidemment suivi de très près ce qui se passait dans l’hémisphère Sud : les informations qui nous parvenaient n’étaient pas encourageantes et laissaient penser qu’il fallait se méfier, d’autant que l’hiver n’est pas aussi froid que dans l’hémisphère Nord et que les pays sont moins peuplés. En Australie, en Nouvelle-Zélande, au Chili et en Argentine, où se trouvent de grands centres urbains, on a observé de nombreuses hospitalisations, avec une activité importante des services de réanimation.
Les réunions à l’Élysée se sont surtout tenues au début de la pandémie, lorsqu’il s’agissait d’apprécier la situation, de faire le point sur la position de l’OMS et des pays voisins. Nous étions en interaction permanente avec les autorités sanitaires européennes. Elles ont aussi permis de préparer l’acquisition des vaccins ou encore de commander, compte tenu de ce qui se passait dans l’hémisphère Sud, du matériel de réanimation et des dispositifs d’oxygénation extracorporelle. Une réunion s’est également tenue lorsqu’il s’est agi de mobiliser les préfets pour répondre à l’affluence soudaine dans les centres de vaccination.
Madame Génisson, nous étions dans une situation de pandémie très inhabituelle avec des décès parmi les sujets jeunes. Or des publications montraient que le taux de létalité était moindre chez les sujets en réanimation lorsqu’ils avaient reçu précocement un traitement. La responsabilité des autorités sanitaires était de formuler des recommandations allant dans le sens d’une prescription plus large d’antiviraux.
Mme Catherine Génisson. Ma question portait davantage sur le diagnostic. Au début, il fallait faire le diagnostic dès qu’un sujet présentait des symptômes grippaux. Mais cette préconisation a cessé du jour au lendemain. Pourquoi ? Par ailleurs, les généralistes ont été exclus du plan, aussi bien comme opérateurs que comme médiateurs. Êtes-vous malgré tout en mesure de dresser un bilan estimatif du nombre de personnes ayant présenté les symptômes de la grippe A(H1N1)?
M. Didier Houssin. Au début, notre objectif était de bloquer le processus épidémique, grâce à l’identification des personnes « contact » et à la recommandation de traitements pour une prise en charge hospitalière, puis ambulatoire. Au mois de septembre, le seuil épidémique a été franchi et nous n’avons plus été capables de poursuivre cette surveillance des cas groupés. Nous sommes alors passés à une surveillance populationnelle et nous avons modifié les recommandations thérapeutiques. Ce n’est que beaucoup plus tard, au mois de novembre, devant l’accentuation des formes graves, que nous avons recommandé une prescription plus large des antiviraux.
Madame Fourneyron, l’envoi des bons a respecté l’ordre de priorité. Les personnes les plus fragiles ont bien reçu leurs bons ; si elles ne sont pas allées se faire vacciner, c’est qu’elles ne le souhaitaient pas ou que leur médecin généraliste le leur avait déconseillé. Il n’y a pas eu de dysfonctionnements dans l’envoi des bons.
M. le président Jean-Christophe Lagarde. J’en doute très fortement. J’ai moi-même constaté, au sein de ma famille, que l’ordre de priorité n’était pas respecté dans l’envoi des bons. Il sera sans doute intéressant d’interroger les responsables de la CNAMTS sur ce point.
Par ailleurs, dans les centres de vaccination, les responsables, les médecins ou les infirmiers ne savaient plus à quel saint se vouer car les instructions changeaient chaque jour : vacciner seulement les femmes enceintes, même si les vaccins sans adjuvants n’étaient pas disponibles, puis vacciner tout le monde – et je ne parle pas des files d’attente. Cette campagne, gratuite, générale et non obligatoire, était une première. Mais sa gestion a été, disons-le, assez apocalyptique. Sans doute aurons-nous l’occasion d’en parler de nouveau.
La gestion de cette crise est pour vous un succès dans la mesure où le bilan est moins grave que ce que l’on pouvait imaginer. Vous dites que l’on ne peut pas écarter le fait que cela soit à mettre au crédit de l’action des pouvoirs publics. Je ne suis pas de ceux qui critiquent le déploiement préventif de moyens importants, mais je doute de leur efficacité. La direction générale de la santé a-t-elle commencé une analyse introspective de cette action dans la perspective de futures crises ?
Je vous serais reconnaissant de préciser par écrit à notre rapporteur la façon dont s’effectue la veille sur internet et s’il existe une capacité de réponse – anonyme ou non – sur le réseau.
Je vous saurais gré, monsieur le rapporteur, de vous procurer les comptes rendus des réunions de la cellule interministérielle de crise et de les diffuser auprès des membres de la commission d’enquête.
M. le rapporteur. La pandémie a été moins grave que prévu et il faut s’en réjouir. Est-ce grâce à la prudence, à la précaution, à la prévention ? Ce sont des mots que nous nous attacherons à définir dans le rapport.
Pourriez-vous nous communiquer le coût final de la campagne poste par poste – masques, seringues, vaccins, antiviraux, gestion-mobilisation, logistique et stockage – en distinguant les masques et les antiviraux commandés dans le cadre de la campagne H5N1 ?
M. le président Jean-Christophe Lagarde. Certaines questions restent en suspens. Nous ferons en sorte de vous donner l’occasion d’y répondre prochainement.
Monsieur Didier Houssin, nous vous remercions.
La séance est levée à dix-huit heures dix.
Audition de M. Thierry Coudert,
directeur de l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS)
(Procès-verbal de la séance du mardi 6 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures dix.
(M. Thierry Coudert prête serment.)
M. Thierry Coudert, directeur de l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS). La campagne de vaccination contre la grippe H1N1 a été le baptême du feu pour l’établissement que je dirige depuis octobre 2008.
L’Établissement de préparation et de réponse aux urgences sanitaires a été créé par la loi du 5 mars 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur, elle-même précisée par le décret du 27 août 2007.
L’ÉPRUS a pour mission, à la demande du ministre chargé de la santé, d’acquérir, de fabriquer, d’importer, de distribuer et d’exporter des produits et services nécessaires à la protection de la population face aux menaces sanitaires graves.
Par un heureux hasard, l’ÉPRUS a eu le statut d’établissement pharmaceutique un mois avant le déclenchement de la campagne sur laquelle enquête votre commission.
L’ÉPRUS est intervenu, à la demande de la ministre de la santé, dans l’approvisionnement et la distribution de produits et services nécessaires à la protection de la population face à la menace de pandémie grippale.
Plus précisément, l’ÉPRUS a procédé à l’acquisition des vaccins et des articles consommables nécessaires à la campagne de vaccination, a assuré la prise en charge des vaccins mis à disposition ou livrés par les fabricants dans des conditions garantissant leur sécurité et a conçu, en liaison avec sa tutelle, un dispositif logistique permettant de les stocker et de les distribuer dans des conditions garantissant à la fois le respect des conditions réglementaires de conservation et de l’impératif de traçabilité, la réactivité nécessaire à un ravitaillement efficace et adapté à la demande, l’adaptation possible de ce schéma logistique à la situation géographique des sites à ravitailler et aux acteurs susceptibles d’entrer en jeu.
L’ÉPRUS a, enfin, procédé aux modifications unilatérales de contrat demandées par le ministère et motivées par l’intérêt général – épisode que je suis en train de dénouer actuellement.
Les premières discussions avec les fabricants de vaccins ont été menées par le ministère. Elles avaient pour objet de déterminer la capacité de ceux-ci à honorer les besoins de l’État dans des délais et conditions satisfaisants. Des lettres d’intention non contractuelles, précisant les volumes et délais souhaités pour les acquisitions envisagées, ont été adressées aux laboratoires consultés.
La ministre de la santé m’a alors demandé d’initier des négociations en vue de l’acquisition de vaccins dirigés contre le virus H1N1 auprès de quatre fabricants : GlaxoSmithKline (GSK), Baxter, Sanofi et Novartis. À sa demande, j’ai associé à ces négociations le directeur de l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) et le président du Comité économique des produits de santé (CEPS).
Par courrier en date du 6 juillet 2009, la ministre de la santé m’a demandé de mener toutes les actions nécessaires en vue de signer des contrats avec ces quatre laboratoires.
Deux procédures ont été mises en œuvre.
La première a consisté en l’affermissement des tranches conditionnelles prévues dans des marchés publics préexistants conclus avec Sanofi-Pasteur, d’une part, et avec Novartis, d’autre part, dans le cadre du plan pandémie grippale. Ces marchés ont été transférés à l’ÉPRUS en juillet 2009. L’apparition du virus H1N1 et le déclenchement du niveau 5 puis du niveau 6 d’alerte par l’OMS justifiaient la mise en œuvre de ces deux marchés. À cette fin, l’objet des premières tranches conditionnelles prévues par ces marchés a été précisé pour permettre la fourniture d’un vaccin contre le virus H1N1 dans les meilleurs délais. Les commandes passées ont pris la forme d’avenants aux marchés initiaux : un avenant n° 3 au marché public conclu avec Sanofi-Pasteur, concernant 28 millions de doses à 6,25 euros hors taxe, a été transmis le 8 juillet 2009 ; un avenant n° 4 au marché public conclu avec Novartis, concernant 16 millions de doses à 9,34 euros hors taxe, a été notifié le 29 juillet 2009. Ces commandes fermes étaient assorties de tranches conditionnelles permettant de porter, en cas de besoin, le nombre total de doses commandées de 94 millions à 130 millions.
La seconde procédure a consisté en la conclusion de marchés publics, sur le fondement du 7° de l’article 3 du code des marchés publics, avec le laboratoire GSK
– l’accord a été notifié le 15 juillet 2009 pour 50 millions de doses au prix unitaire de 7 euros hors taxe – et avec Baxter pour 50 000 doses au prix de 10 euros hors taxe.
Dans ces deux derniers cas, la ministre m’ayant demandé de recourir aux dispositions du code des marchés publics afin que les approvisionnements de vaccins contre le virus H1N1 s’effectuent dans les conditions élevées de confidentialité, de rapidité et de sécurité qu’exigeait la protection des intérêts essentiels de l’État, j’ai conclu des contrats avec ces laboratoires sur la base des dispositions du 7° de l’article 3 du code des marchés publics, qui instaure une exclusion du champ d’application du code pour les contrats dont l’exécution doit s’accompagner de mesures particulières de sécurité ou pour lesquels la protection des intérêts essentiels de l’État l’exige, et qui autorise à ce titre la conclusion de marché sans publicité ni mise en concurrence.
Les circonstances exceptionnelles dans lesquelles étaient envisagées ces acquisitions m’ont paru justifier pleinement cette forme de marché. En effet, face à l’émergence d’une pandémie grippale dont l’impact prévu sur les populations était redoutable, de très nombreux États ont sollicité dans l’urgence les laboratoires susceptibles de fabriquer un vaccin dirigé contre le virus H1N1. Cette situation conduisait à une mise en concurrence globalisée, chacun des États tentant d’obtenir, dans les meilleures conditions possibles, un stock suffisant de doses de vaccin destiné à sa population.
Par ailleurs, la tension du marché, marqué par une demande supérieure à l’offre, était renforcée par l’imminence de la pandémie grippale en Europe – prévue pour septembre 2009 –, associée aux délais incompressibles de fabrication et de commercialisation des vaccins.
Dans ce contexte, il était impératif pour l’État de garantir une stricte confidentialité des conditions d’exécution des contrats pour préserver la confidentialité des informations relatives aux conditions économiques et aux calendriers de production et assurer la sécurité des approvisionnements, des sites de production, de stockage et de livraison. L’objectif poursuivi était d’éviter que ne surviennent des agissements susceptibles de troubler l’ordre public, ou que des personnes mal intentionnées n’aient accès à des informations sensibles.
La répartition des commandes entre les quatre laboratoires s’est faite selon les capacités de ces derniers, en privilégiant les offres les plus robustes, les prévisions de livraisons de quantités significatives dans les délais les plus courts possibles et les conditions les moins onéreuses pour l’État.
Il fallait également prévoir une vaccination adaptée aux différents types de populations visées : vaccins non adjuvés et adjuvés, culture sur œuf ou culture cellulaire, multi-doses et mono-dose.
À ce stade, il faut souligner que les laboratoires proposaient tous un schéma vaccinal à deux injections. À partir du moment où l’État avait décidé de couvrir l’ensemble de la population, il devait disposer de suffisamment de doses de vaccins pour vacciner potentiellement 65 millions de personnes, soit 130 millions de doses – cible atteinte par l’ajout de tranches conditionnelles. Les laboratoires proposaient une présentation unique des vaccins en multi-doses – GSK et Baxter – ou comportant en proportion très faible des mono-dose : Sanofi, à hauteur de 300 000 doses, et Novartis, dont l’offre était limitée à 10 % de la commande, soit 1,6 million de doses.
Malgré l’insistance de l’ÉPRUS, aucun des laboratoires ne pouvait, au moment de la signature des contrats, s’engager à offrir une alternative plus importante en mono-dose, compte tenu des incertitudes pesant alors sur leur capacité à produire des volumes aussi importants dans des délais aussi contraints. De fait, seul le laboratoire Novartis a pu proposer en octobre, par un avenant notifié le 13 octobre, une augmentation du pourcentage de mono-dose prévu dans la commande initiale. Au total, ce laboratoire a fourni, entre le 12 novembre et le 7 janvier, 5,8 millions de doses réparties sur neuf livraisons, ces mono-dose étant pour la plupart sous présentation collective, c’est-à-dire dans des boîtes de 10 seringues.
Comme cela était exigé par l’État, les contrats visaient expressément l’acquisition de vaccins autorisés à être mis sur le marché, ces AMM garantissant en particulier l’efficacité et l’innocuité des vaccins. Cette exigence rajoutait aux incertitudes de production du vaccin, des aléas pouvant survenir dans le cadre de l’instruction du dossier d’AMM, et renforçait le caractère indicatif des échéanciers de livraison.
Les livraisons de vaccins ont été dans l’ensemble plus tardives que ce qui était prévu à la signature des contrats.
La première mise à disposition a été effectuée par GSK le 9 octobre : 1,072 million de doses. À la fin du mois d’octobre, le stock détenu par l’ÉPRUS n’était alimenté que par ce laboratoire et atteignait 4,205 millions de doses.
Les premières livraisons des autres fabricants sont intervenues dans la semaine 46, c’est-à-dire du 9 au 15 novembre. Elles concernaient le Panenza – vaccin non adjuvé – de Sanofi pour 1,1 million de multi-doses et 300 000 mono-dose, et le Focetria de Novartis pour un peu plus de 1 million de doses, dont 450 000 en présentation mono-dose. Ce vaccin qui, du fait de son conditionnement par 100 doses ou par 10 doses et sa présentation prête à l’emploi, convenait à des collectivités réduites ou dispersées, a été, dans un premier temps, utilisé pour la vaccination des Français à l’étranger et les besoins de Tahiti et de Nouvelle-Calédonie. Les premières livraisons concernaient également le Celvapan de Baxter. Les 12 000 premières doses de ce vaccin n’ont pu être livrées à l’ÉPRUS que le 12 novembre à la suite d’un retard dans l’obtention de l’AMM. Ce vaccin a été réservé à l’usage exclusivement hospitalier pour les personnes allergiques aux protéines de l’œuf.
Entre le 9 octobre 2009 et le 18 février 2010, 35 livraisons ont été effectuées sur les sites des dépositaires. Compte tenu de la dispersion de ces derniers, cela a nécessité l’organisation de 45 transports et chaque livraison a été convoyée par une escorte de police ou de gendarmerie.
Pour assurer la conservation des vaccins et la distribution vers les répartiteurs, l’ÉPRUS a passé avec le dépositaire pharmaceutique DEPOLABO un marché permettant d’obtenir à la fois une capacité de stockage en froid suffisante – environ 1 500 palettes –, au sein de sites sécurisés dont le statut de dépositaire pharmaceutique garantit le respect des conditions de conservation et la traçabilité des mouvements de vaccins, un réseau de distribution permettant de ravitailler dans le respect des bonnes pratiques pharmaceutiques les structures en aval – les répartiteurs pharmaceutiques et les établissements de santé – et une répartition territoriale des cinq sites de stockage permettant de ravitailler sous 24 heures les établissements de santé ou de répartition rattachés à la zone desservie.
Ces sites dépositaires ont approvisionné, d’une part, les répartiteurs chargés à leur tour de ravitailler les centres de vaccination et, plus tard, les pharmacies d’officines, ainsi que, d’autre part, les établissements hospitaliers.
Afin d’assurer l’acheminement des vaccins vers les centres de vaccination et, aujourd’hui, vers les officines pharmaceutiques, l’ÉPRUS s’appuie sur le réseau de distribution pharmaceutique des grossistes-répartiteurs.
Pour l’approvisionnement des centres de vaccination, au sein de ce réseau de distribution, 93 agences locales avaient été sélectionnées sur des critères de desserte géographique et de capacité de stockage en chambres froides.
Aujourd’hui, pour le ravitaillement des médecins libéraux via les officines pharmaceutiques, toutes les agences locales – au nombre de 185 – sont concernées.
Ce réseau offre, outre l’intérêt d’un maillage géographique très fin, la garantie d’un fonctionnement dans le strict respect des bonnes pratiques de distribution pharmaceutique.
Il est à noter que les départements d’outre-mer ont bénéficié des mêmes procédures logistiques, adaptées cependant à la situation locale.
En collaboration avec le Conseil national de l’Ordre des pharmaciens et la Chambre syndicale de la répartition pharmaceutique, l’ÉPRUS a rattaché chaque centre de vaccination à une agence de répartition. Cette liste établie et validée, l’ÉPRUS a communiqué à chaque responsable d’équipe opérationnelle départementale (EOD) les coordonnées des établissements de répartition pharmaceutique chargés du ravitaillement des centres de vaccination du département. Cette procédure a permis le ravitaillement quotidien de près de 1 200 centres de vaccination auxquels étaient rattachées des équipes mobiles, et assure aujourd’hui le ravitaillement de près de 23 000 officines pharmaceutiques.
Jusqu’à fin janvier 2010, les besoins en vaccins exprimés par les pharmacies à usage intérieur des établissements de santé « dédiés grippe » ont été adressés par mail à l’ÉPRUS, qui les faisait satisfaire directement par le site dépositaire compétent dans le délai maximum de 48 heures.
Du 20 octobre à ce jour, l’ÉPRUS a distribué quelque 13 millions de doses de vaccins, dont 1,5 million dans les établissements de santé, 10 millions dans le circuit des grossistes-répartiteurs pour le ravitaillement des centres de vaccination et, aujourd’hui, des officines, et 1,5 million pour l’approvisionnement de la France d’outre-mer, des Français de l’étranger et les deux cessions consenties – au Qatar pour 300 000 doses et à Monaco pour 80 000 doses.
Le stock actuellement disponible est de 30 millions de doses, dont il faut déduire les 9,4 millions de doses réservées pour le don OMS concernant une vingtaine de pays, qui sont en cours d’enlèvement.
Enfin, la vaccination se poursuit dans les cabinets médicaux et les établissements de santé.
Les marchés publics sont des contrats administratifs et demeurent régis, à ce titre, par le corpus juridique applicable à ce type de contrat.
Les marchés publics conclus avec Sanofi-Pasteur et Novartis étaient notamment fondés sur les dispositions du cahier des charges générales, fournitures courantes et services dans sa version de 1977, qui fixe notamment des règles précises en matière de résiliation, dans son article 24. Celles-ci, le cas échéant, étaient pleinement applicables.
Pour ces marchés ainsi que pour ceux concernant les marchés conclus avec GSK et Baxter, l’État a donc utilisé la jurisprudence ancienne et constante du Conseil d’État et les règles générales applicables aux contrats administratifs que nous avions évidemment intégrées dans les négociations.
Ainsi, je rappelle qu’en application des règles générales applicables aux contrats administratifs, l’administration dispose, même sans texte et même si ce n’est pas expressément prévu aux clauses du contrat, d’un pouvoir de modification unilatérale de ses contrats pour des motifs d’intérêt général. La personne publique doit seulement pouvoir justifier d’un intérêt public.
En l’espèce, l’intérêt public se justifiait pleinement par le changement du schéma vaccinal – une dose au lieu de deux doses prévues à l’origine – applicable pour la quasi-totalité de la population et validé par l’Agence européenne des médicaments (EMEA) fin novembre 2009.
C’est sur ce fondement que j’ai pu, à la demande de la ministre de la santé, modifier unilatéralement, le 4 janvier 2010, les marchés publics afin de réduire de 50 millions de doses les commandes initialement conclues. Le montant hors taxe de la commande a été ainsi ramené de 675 millions d’euros à 317 millions d’euros.
Les négociations menées depuis ces notifications avec chaque laboratoire ont abouti à un accord transactionnel avec le laboratoire Novartis pour un montant de 10,5 millions d’euros, correspondant à 16 % du montant des doses annulées.
Vendredi dernier, j’ai procédé à la notification d’un dédit au laboratoire Sanofi à hauteur de 2 millions d’euros, qui correspondait également à 16 % du montant des doses annulées.
Quant au laboratoire GSK, je suis encore en discussion avec lui.
Je conclurai mon propos liminaire sur les moyens d’injection et de consommables de vaccination.
Au titre de la préparation à la pandémie aviaire, l’État avait constitué un stock de 30 millions de seringues et de 150 000 collecteurs pour seringues. Ce stock a été complété par l’achat de 50 millions de seringues et de 200 000 collecteurs. Le différentiel entre le nombre de doses et le nombre de seringues tenait à la fourniture par Novartis des moyens d’injection.
Ont été également acquis à cette occasion les consommables nécessaires aux centres de vaccination : antiseptiques, compresses, gants de soins, blouses à usage unique, entre autres. Le montant total de ces acquisitions s’élève à 8,9 millions d’euros TTC, les achats de seringues et de collecteurs représentant 55 % de ce montant, soit 4,9 millions d’euros.
À l’occasion de ce baptême du feu, l’ÉPRUS a pu éprouver des modalités et des flux logistiques qui, compte tenu de sa courte expérience comme opérateur logistique du ministère de la santé, étaient encore au stade de concept au début de l’alerte pandémique. Le dispositif logistique utilisé à cette occasion a montré sa robustesse et sa flexibilité – de la vaccination collective à la vaccination individuelle –, ses capacités d’adaptation à des besoins variant de quelques centaines à plus de 200 000 vaccinations quotidiennes, dans les premières semaines de décembre 2009, ainsi que sa réactivité puisqu’il a été en mesure de satisfaire les urgences sous 24 heures. Les capacités de traitement des demandes par l’ÉPRUS ont également été confirmées puisqu’il y a eu, en moyenne, entre 30 000 et 50 000 mails par mois entre juin et décembre 2009.
Cette campagne de vaccination aura montré l’utilité de l’instrument créé en 2007 et permis de tester un certain nombre de procédures qui nous ont permis d’être aussi réactifs que nous pouvions l’être dans ce genre de situation.
M. Jean-Pierre Door, rapporteur. Je vous remercie, monsieur le directeur, pour ce propos liminaire.
Vous avez parlé de baptême du feu, mais l’ÉPRUS date maintenant de deux ans et a déjà eu à faire face à la préparation d’un plan contre la grippe H5N1. Je souhaiterais connaître l’état exact des stocks en Tamiflu, Relenza et en masques de cette période ainsi que leurs délais de péremption.
D’autres laboratoires vous ont-ils répondu en dehors des quatre que vous avez cités ?
M. Thierry Coudert. J’ai été chargé par le ministère de négocier avec quatre laboratoires.
M. le rapporteur. D’autres laboratoires se sont-ils manifestés ?
M. Thierry Coudert. À mon niveau, non.
M. le rapporteur. La différence de prix des vaccins s’explique-t-elle par la différence de leur mode de fabrication ?
M. Thierry Coudert. Elle s’explique à la fois par les différents types de procédés utilisés et par le fait que, dans certains cas, il y a un adjuvant ou une seringue. Le vaccin mono-dose était évidemment plus cher que le multi-doses. Les quantités étaient aussi différentes : le prix unitaire des 50 000 doses de Baxter était forcément différent de celui des 50 millions de doses du laboratoire GSK.
M. le rapporteur. Aux États-Unis a été employé un vaccin par voie nasale à partir de virus atténué. S’il n’a pas été utilisé en France, est-ce parce que l’Agence européenne ne l’a pas accepté ?
M. Thierry Coudert. Je ne sais pas. Mon prédécesseur serait peut-être mieux placé pour vous répondre, bien que le rôle de l’ÉPRUS soit purement logistique : il fonctionne à partir des instructions données par le ministère pour négocier des contrats.
M. le président Jean-Christophe Lagarde. Est-ce à dire que le ministère a sélectionné seul les quatre laboratoires sans que l’établissement que vous dirigez ait été sollicité pour l’informer des laboratoires susceptibles de répondre à cette forme particulière d’appel d’offres ? D’autres pays ont eu recours à d’autres laboratoires et à d’autres formes de vaccins, avec des délais et des prix différents.
M. Thierry Coudert. Le rôle de l’ÉPRUS était clairement de négocier avec les quatre laboratoires qui lui avaient été indiqués par le ministère. Dans le contexte de pénurie de vaccins qui régnait alors, notre travail de négociation a été essentiel sur les quantités et sur le calendrier des livraisons.
Je suis incapable de vous répondre sur la phase amont, mais j’imagine que les quatre laboratoires en question étaient les seuls en mesure de faire face à la demande.
M. le président Jean-Christophe Lagarde. À aucun moment votre établissement n’intervient en tant que conseil ou « tête chercheuse » du Gouvernement…
M. Thierry Coudert. Ce n’est pas le rôle qui a été assigné à l’ÉPRUS.
Pour répondre au rapporteur, je préciserai qu’il nous restait, de la campagne précédente, à peu près 1 milliard de masques chirurgicaux et 700 millions de masques FFP2, dont les durées de validité étaient en moyenne de cinq ans, ainsi que 33 millions de doses d’antiviraux. Je vous ferai parvenir le détail de ces stocks.
Par définition, nous n’avions pas de stocks constitués de vaccins. Mais nous avons activé les tranches conditionnelles des contrats négociés dans le cadre du plan contre le H5N1 avec deux laboratoires.
M. Gérard Bapt. Les contrats négociés dans le cadre de la campagne contre la grippe aviaire sont toujours valables et le seront, je crois, jusqu’en 2012. Si, l’an prochain, un autre virus apparaissait pour lequel l’OMS ferait à nouveau passer le niveau d’alerte pandémique en phase 6, ces contrats seraient-ils réactivés et la France serait-elle tenue de recevoir la quantité de vaccins prévue dans les options avec Sanofi et Novartis ?
Vous avez indiqué que la commande à GSK a été conclue en juillet. Mais une réservation avait déjà été faite le 14 mai par la ministre de la santé auprès de ce laboratoire pour 50 millions de doses au prix unitaire de 7 euros, avec un versement d’arrhes de 1,50 euro hors taxe par vaccin commandé, soit 75 millions d’euros, ce versement devant être remboursé à l’État si l’OMS ne fournissait pas la souche virale à GSK. Sur quelle base juridique a été faite cette réservation avec versement d’arrhes ?
Vous avez également indiqué que les premiers vaccins ont été livrés le 9 octobre. Était-ce des mono-dose ?
M. Thierry Coudert. Les premiers vaccins étaient des multi-doses fournies par GSK.
M. Gérard Bapt. Les premiers vaccins mono-dose ont donc été fournis par Novartis entre novembre et décembre. Dès la première semaine de décembre, quelque 500 000 vaccins mono-dose, de présentation identique à celle des vaccins contre la grippe saisonnière, étaient stockés à l’ÉPRUS. Une partie était destinée aux ambassades et à l’outre-mer, mais l’autre partie aurait pu être distribuée par des médecins généralistes ou des centres de vaccination décentralisés, comme cela s’est fait à partir du 4 janvier !
M. Thierry Coudert. Ce n’est pas parce qu’une campagne de lutte contre une menace sanitaire cesse que les contrats expirent. En cas de nouvelle pandémie, ils peuvent être affermis et les options à nouveau validées.
J’ai répondu à votre deuxième question.
Par contre, je suis incapable de répondre à la troisième. L’ÉPRUS n’a pas été associé à la stratégie vaccinale. C’est peut-être le côté un peu frustrant du rôle de cet établissement : il n’intervient que sur des questions de logistique, c’est-à-dire qu’il envoie des mono-dose ou des multi-doses là où on lui dit de les envoyer. Cela s’apparente un peu à une fonction d’épicier ou de pharmacien.
M. Gérard Bapt. Comment avez-vous intégré la réservation du 14 mai dans le contrat conclu avec GSK ?
M. Thierry Coudert. Le contrat a été conclu sur le fondement du 7° de l’article 3 du code des marchés publics, c’est-à-dire en dehors du cadre d’un marché public classique.
Les négociations avec GSK ont porté sur des points importants, tels que la clause de responsabilité qui a, d’ailleurs, été ensuite étendue aux autres contrats. Les calendriers de livraison, même s’ils n’étaient qu’indicatifs, revêtaient également une importance majeure.
Mme Catherine Lemorton. Vous avez indiqué que le stock de vaccins actuellement disponible est de 30 millions de doses, dont il faut déduire 9,4 millions de doses promises par Mme Bachelot-Narquin à l’Organisation mondiale de la santé. Qu’attend-on pour donner ces doses à l’OMS ? Elles pourraient permettre de vacciner en prévention les populations de l’hémisphère Sud. Attend-on que le virus mute ?
M. Thierry Coudert. Comme je l’ai indiqué, les 9,4 millions de doses réservées à l’OMS sont en cours d’enlèvement.
M. le président Jean-Christophe Lagarde. Je doute qu’il y ait beaucoup de personnes voulant se faire vacciner en France depuis le 4 janvier. Garder 20 millions de doses en stock d’un vaccin fabriqué à partir d’un virus qui ne peut que muter et alors que 6 millions de personnes en France ont été vaccinées me paraît quelque peu excessif. Pourquoi n’en donnons-nous pas plus à l’OMS ?
M. Thierry Coudert. Votre question dépasse mes compétences.
M. Yves Bur. Les prix doivent varier en fonction des fabricants, des quantités commandées et des contraintes de livraison. Existe-t-il un benchmark sur les prix payés et les conditions des marchés conclus par les autres grands pays européens et les États-Unis ? À moins de considérer que ces négociations ne relèvent d’un « secret défense sanitaire », il serait intéressant d’avoir ces éléments de comparaison.
Vous avez fait état de difficultés dans les négociations avec GSK pour limiter le montant de l’indemnité à lui verser. Quelle est la nature de ces difficultés, qui font que ce laboratoire soit le dernier avec lequel vous soyez en discussion ?
M. Thierry Coudert. J’ai associé dès le départ à toutes les négociations M. Renaudin, le président du Comité économique des produits de santé, qui est le spécialiste français en matière de fixation des prix des médicaments et qui dispose lui-même d’éléments de benchmark, afin qu’il puisse me donner des indications en la matière.
Il y avait deux types de prix. Le premier concernait les deux contrats qui ont été affermis et qui reprenaient en fait les prix fixés dans les contrats initiaux. La discussion les concernant a été relativement simple. Le second type concernait les prix sur lesquels nous avons topé. Notre expert en la matière a estimé, en fonction de la différence de nature des produits et des quantités commandées, qu’ils se situaient dans une fourchette « raisonnable ».
M. Yves Bur. Est-il possible d’avoir des informations plus précises ? Les États communiquent-ils sur les conditions dans lesquelles ils ont obtenu des vaccins…
M. Thierry Coudert. Non !
M. Yves Bur. … ou considèrent-ils que ces informations relèvent d’un « secret défense santé » ?
J’ai toute confiance en M. Renaudin. En tant que président du CEPS, il connaît parfaitement les prix du marché. Toutefois, ce ne sont pas ces derniers qui m’intéressent, mais les prix réellement négociés.
M. le président Jean-Christophe Lagarde. Puisqu’il ressort de votre attitude, monsieur le directeur, que les informations concernant les prix payés par les autres États relèvent du « secret défense », pourriez-vous nous faire parvenir un document précisant les éléments qui vous ont conduit à penser que, eu égard aux différentes typologies, aux différentes présentations des vaccins et aux différentes quantités commandées, vos choix se sont portés sur des produits aux prix « satisfaisants » ?
M. Thierry Coudert. À l’époque des négociations, il n’y avait aucun échange d’informations entre les différents États – fussent-ils européens – sur les prix. Nous disposons depuis lors d’un certain nombre d’informations, mais elles restent parcellaires. Il n’y a pas eu d’échanges systématiques sur ce sujet.
Nous nous sommes systématiquement appuyés sur la science et les référentiels de M. Renaudin pour déterminer si les prix proposés se situaient dans une fourchette raisonnable.
M. Yves Bur. Je suppose que des commissions s’interrogent également dans les autres pays sur le coût et le déroulement de cette campagne de vaccination. Il devrait être possible de procéder à un véritable benchmarking permettant de nous éclairer sur les conditions du marché et d’éviter, ainsi, des polémiques inutiles.
M. le président Jean-Christophe Lagarde. Cher collègue, votre remarque alourdit la charge de travail de notre rapporteur, puisque nous allons lui demander de rechercher les travaux effectués par les autres pays sur cette question, et oriente sur ce sujet les auditions que nous avons prévues de divers responsables au niveau de l’Union européenne, ce genre d’échanges faisant partie du debriefing nécessaire après une crise.
M. Michel Lejeune. À l’unité vaccinale, existe-t-il une différence de coût entre la présentation mono-dose et la présentation multi-dose ? Si oui, de quel ordre ?
M. Thierry Coudert. Il n’y a aucune différence.
Mme Valérie Fourneyron. J’aimerais que vous reveniez sur les conditions dans lesquelles vous avez négocié les contrats avec les quatre laboratoires. Vous avez indiqué que les premières discussions avaient eu lieu au ministère de la santé et avaient fait l’objet d’éléments non contractuels. Ces éléments liaient-ils l’ÉPRUS avec ces quatre laboratoires ? Auriez-vous pu en écarter certains ?
Pourriez-vous dresser un récapitulatif de tous les coûts supportés par l’ÉPRUS : protocoles transactionnels, vaccins, articles consommables ?
Vous avez indiqué que, au moment des commandes des vaccins, les laboratoires ne proposaient qu’un schéma vaccinal à deux injections. Vous n’avez pas contesté ce schéma. Qu’est-ce qui vous a conduit à accepter une campagne portant sur deux vaccins par personne et les quantités de doses correspondant à une telle campagne ?
M. Thierry Coudert. L’ÉPRUS s’appuie sur les dossiers d’AMM et ces derniers, au moment de la commande, portaient sur deux injections. Je n’avais pas à prendre parti sur ce sujet mais je n’ai pas eu le sentiment qu’il faisait l’objet de discussions. Lorsque, fin novembre, le schéma de traitement ne s’appuyait plus que sur une injection, cela a fourni à l’État le motif d’intérêt général lui permettant de rompre unilatéralement les contrats.
Concernant le premier point, s’il est vrai que des lettres d’intention non contractuelles posaient un certain nombre de principes généraux, c’est par la négociation que nous sommes parvenus à la signature de contrats avec les quatre laboratoires. L’essentiel de la discussion a porté sur les clauses de responsabilité, les calendriers de livraison et les quantités à livrer. Dans un climat de compétition internationale entre États pour l’approvisionnement en vaccins, notre objectif, au cours de ces négociations, était d’obtenir le calendrier de livraison et les quantités les plus favorables compte tenu du développement supposé de la pandémie.
Pour deux contrats, les prix étaient la reprise de ceux des contrats initiaux sous l’empire du H5N1.
Mme Valérie Fourneyron. Auriez-vous pu écarter un laboratoire ?
M. Thierry Coudert. Oui, s’il s’était révélé incapable de produire les quantités que l’on attendait dans des délais raisonnables.
Quand nous avons entamé les négociations, les laboratoires ne disposaient pas encore des souches virales et ne pouvaient donc pas nous donner des informations totalement fiables sur leur calendrier de livraison. Mais, si l’un deux s’était déclaré dans l’incapacité de nous livrer avant les mois de mars ou d’avril de l’année suivante, la négociation se serait arrêtée.
M. le président Jean-Christophe Lagarde. Il n’y avait que les délais qui vous posaient un problème ?
M. Thierry Coudert. C’était un élément important.
Mme Valérie Fourneyron. Les éléments précontractuels ne vous liaient-ils pas aux quatre laboratoires ?
M. Thierry Coudert. Ils fournissaient un cadre de discussion.
M. le président Jean-Christophe Lagarde. Pour résumer, le cadre des négociations était organisé par le ministère, lequel avait également choisi les laboratoires et avancé les prix. La seule initiative qu’il restait à l’ÉPRUS, dont le rôle est de négocier et d’assurer la logistique, était de ne pas commander à tel ou tel laboratoire si celui-ci n’était pas en mesure de livrer la quantité de vaccins dans les délais prévus. L’ÉPRUS ne vous est-il pas apparu dans une situation de grande faiblesse vis-à-vis des laboratoires dans cette discussion ?
M. Thierry Coudert. De « grande faiblesse » ? Sous quel angle ?
Dans un climat de tension internationale sur les capacités de production et, donc, de livraison de vaccins, l’essentiel de la discussion était concentré sur l’approvisionnement en vaccins selon les quantités disponibles et dans des délais compatibles avec l’évolution supposée de la pandémie. La situation internationale dictait ce type de négociation.
Concernant les prix, pour deux contrats, ils étaient la reprise de ceux des contrats initiaux et, pour les deux autres, ils se situaient dans une fourchette raisonnable. Ils n’étaient donc pas un élément majeur de la discussion, sur lequel les laboratoires auraient pu tirer la couverture à eux de manière abusive.
M. le président Jean-Christophe Lagarde. Ce n’est pas ce que je voulais dire en parlant de « situation de faiblesse ».
Quels délais supplémentaires étaient demandés par les laboratoires pour passer aux vaccins mono-dose ?
Vous pourrez nous fournir ces informations par écrit ultérieurement si vous le souhaitez.
Il s’établit toujours un rapport de force entre un client et son fournisseur. Ce rapport était manifestement en votre défaveur puisque, tous les États voulant des vaccins en quantités importantes, les laboratoires choisissaient, au gré des négociations, ceux qu’ils allaient servir. C’est ce que j’appelle une situation de grande faiblesse.
Une telle situation était-elle normale ? Nos préréservations du fait de H5N1 n’auraient-elles pas dû inciter les industries concernées à se mettre à faire du mono-dose avant même que la crise n’intervienne ?
N’est-ce pas, finalement, une des leçons à tirer de cet épisode ? Les contrats ou précontrats devraient être beaucoup plus directifs afin d’éviter que nous ne nous retrouvions dans la même situation de faiblesse à chaque pandémie mondiale.
M. Thierry Coudert. Si nous avions voulu avoir à tout prix du mono-dose, les programmes de livraison auraient été décalés au-delà de la limite supposée de la pandémie, c’est-à-dire au-delà du printemps. Les schémas de vaccination n’auraient alors plus eu grand sens.
Une fois réglée la question de la clause de responsabilité, qui n’a pas été un sujet mineur, toutes les discussions portaient sur les quantités disponibles et les calendriers de livraison.
M. le président Jean-Christophe Lagarde. Il serait intéressant de savoir si un pays a pu être livré en vaccins mono-dose avant le nôtre.
M. Yves Bur. Les délais de livraison étaient effectivement un des éléments majeurs de la discussion. La France s’est-elle trouvée à un moment donné en manque de doses disponibles compte tenu du calendrier de vaccination qu’elle s’était fixée ? Aux environs du 10 novembre, la presse allemande a fait état d’un risque de rupture d’approvisionnement en vaccins en Allemagne. Cela s’est-il produit en France ?
Ma deuxième question concernera le financement de l’ÉPRUS pour cette opération. Nous avons adopté, dans le PLFSS, une disposition prévoyant une contribution, plus ou moins volontaire, des assurances complémentaires santé. Avez-vous une idée de la clé de répartition qui va être choisie : l’assurance maladie sera-t-elle le principal financeur, les complémentaires venant au second rang, ou chacun apportera-t-il sa contribution proportionnellement à ce qui a été prévu dans le PLFSS ? Participez-vous aux discussions relatives au financement ?
M. Thierry Coudert. L’ÉPRUS n’est pas associé à ce type de discussion.
Nous avons enregistré de petits décalages par rapport au planning de livraison, avec, de temps en temps, des sortes de spasmes, en hausse ou en baisse. Fin novembre et début décembre, il y a eu quelques tiraillements dans la livraison des centres de vaccination mais, entre l’irrégularité des livraisons et l’irrégularité de la fréquentation des centres de vaccination, cela n’a pas posé de gros problèmes.
M. le président Jean-Christophe Lagarde. Quelle est l’objection majeure à la mise à disposition des médecins libéraux de vaccins multi-doses ?
M. Thierry Coudert. Le multi-dose se prête assez peu à la vaccination en pratique libérale car celle-ci entraîne une perte de produit très importante. En centre de vaccination, cette perte est déjà de l’ordre de 10 %. Dans un système plus éclaté et avec un rythme de vaccination aléatoire, elle aurait été considérable.
M. Philippe Vitel. Quelles sont les dates de péremption des doses que vous avez actuellement en stock ?
M. Thierry Coudert. Les dates de péremption s’étalent, selon les vaccins, entre fin 2010 et mi 2011. Je pourrai, si vous le souhaitez, vous donner le détail par produit.
M. le rapporteur. Je vous demanderai en effet, monsieur le directeur, de nous fournir l’état exact des dispositifs médicaux et des vaccins ainsi que leurs dates de péremption.
M. le président Jean-Christophe Lagarde. Le jour du début de la campagne de vaccination grand public, il n’y avait pas de vaccin sans adjuvant disponible pour les femmes enceintes, alors qu’elles avaient reçu, de manière prioritaire, des bons de vaccination. Il me semble que ce vaccin n’a été disponible que quinze jours après. Pouvez-vous, monsieur le directeur, nous préciser la date à laquelle ce vaccin a été disponible et nous expliquer pourquoi il ne l’a pas été auparavant ?
M. Thierry Coudert. Je fournirai les dates précises au rapporteur.
M. le président Jean-Christophe Lagarde. Nous vous remercions, monsieur le directeur.
La séance est levée à dix-neuf heures dix.
Audition de Mme Françoise Weber,
directrice générale de l’Institut de veille sanitaire (InVS)
(Procès-verbal de la séance du mardi 6 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-neuf heures dix.
(Mme Françoise Weber prête serment.)
Mme Françoise Weber, directrice générale de l’Institut de veille sanitaire (InVS). Je voudrais en préambule éclairer la commission sur le déroulement et le bilan de la pandémie. Je voudrais rappeler tout d’abord que l’InVS est chargé de la surveillance permanente de l’état de santé de la population, ainsi que de la veille et de l’alerte sur les menaces sanitaires de toute nature, à partir de l’analyse et de la synthèse permanente et réactive de données épidémiologiques, recueillies à travers les activités de veille de l’InVS, ses réseaux de surveillance, la consultation d’études épidémiologiques et d’articles scientifiques. L’expertise de l’InVS est interne : elle est menée par ses agents, épidémiologistes, biostatisticiens ou experts en santé publique.
Dès le 23 avril 2009, l’InVS était très fortement mobilisée par la pandémie. Notre mission était de réévaluer régulièrement les hypothèses, les scénarios possibles et plausibles d’évolution de la pandémie, afin d’aider les pouvoirs publics dans leur prise de décision de mesures préventives et de préparation du système de soins à la prise en charge des malades. Notre objectif n’était pas de faire des prédictions, impossibles par nature, mais d’évaluer la menace.
Il me paraît important de rapporter les décisions qui ont été prises à l’évolution de nos connaissances et de nos estimations au fil du temps, étant donné notamment l’immense potentiel évolutif des virus grippaux, qui rend très difficile, voire impossible, de prévoir l’évolution des pandémies grippales. Ainsi, si les trois pandémies survenues au XXe siècle ont connu un taux d’attaque à peu près identique d’environ 25 %, les niveaux de létalité, soit le nombre de décès rapporté au nombre de malades, ont été très différents : la pandémie la plus grave, celle de 1918, a tué 1,1 % de la population européenne, tandis que la pandémie la moins grave, celle de 1968-1969, a entraîné entre 20 000 et 30 000 décès en France, la mortalité ayant été plus importante en 1969 et au début de 1970 qu’en 1968, année de la première vague de cette pandémie. Les scénarios d’évolution ont donc été extrêmement variables.
L’évolution de la connaissance de la pandémie due au virus H1N1 a connu trois phases.
Dans une première phase, entre avril et septembre 2009, on a très rapidement constaté qu’il s’agissait bien d’une pandémie au sens scientifique et épidémiologique du terme, c’est-à-dire un virus nouveau se répandant très rapidement sur tous les continents. En mai, les données en provenance du Mexique faisaient état d’un taux d’attaque et d’une létalité supérieurs à ceux de la grippe saisonnière. Il était très difficile d’en savoir plus à ce moment-là.
En juin, la pandémie fut qualifiée de « modérément grave » par l’OMS, quand il s’est confirmé que la majorité des cas étaient bénins et la létalité du même ordre de grandeur que celle de la grippe saisonnière. On pouvait alors abandonner les hypothèses les plus pessimistes. Toutefois, certaines populations, notamment les femmes enceintes et les adultes de moins de 65 ans, présentaient des formes beaucoup plus sévères que celles de la grippe saisonnière, si bien qu’à ce stade on ne pouvait pas abandonner l’hypothèse d’un nombre très important de cas graves et de décès parmi des populations jeunes. En France, on enregistra alors les premiers cas sévères, nécessitant un recours prolongé à l’oxygénation extracorporelle. On ne pouvait abandonner à ce stade l’hypothèse d’une létalité identique à la grippe saisonnière associée à un taux d’attaque plus important, soit un nombre absolu de formes sévères et de décès beaucoup plus important. Tous les pays en étaient au même point en ce qui concerne les hypothèses épidémiologiques.
Dans une seconde phase, à partir de septembre, il a été possible de préciser les projections, notamment sur les caractéristiques des cas graves, mais avec la persistance d’inconnues. Les estimations ont été à nouveau revues à la baisse sur la base des observations faites au cours de l’hiver austral et de l’épidémie estivale au Royaume-Uni. Il n’était cependant toujours pas possible d’établir une projection univoque sur la vague à venir dans l’hémisphère Nord, d’autant que le virus pouvait muter entre les deux hémisphères et que les épidémies précédentes s’étaient intensifiées lors de leur passage à l’hémisphère Nord : ainsi, en Nouvelle-Zélande, le taux d’hospitalisation, de 22 pour 100 000, était très supérieur à celui observé aux États-Unis au moment de la vague estivale, qui était de 3 pour 100 000. Les services de réanimation néo-zélandais devaient déjà faire face à un accroissement important de leur charge de travail.
Fin septembre, en France comme dans les autres pays, ce sont les valeurs les plus basses des hypothèses de gravité de la pandémie qui ont été retenues, comme le prouve la note de l’InVS à l’adresse de la direction générale de la santé datée du 28 septembre.
La troisième phase a permis de préciser l’ensemble des paramètres, notamment le taux d’attaque. Les observations faites à partir de la seconde quinzaine de novembre, correspondant au pic observé dans la plupart des pays européens, ont permis de conclure que l’impact de la pandémie resterait, pour cette première vague, en deçà de toutes les projections réalisées. Nous pourrons préciser ultérieurement les facteurs qui ont permis que cette pandémie reste en deçà de tous les scénarios retenus par les pays disposant d’un système de surveillance épidémiologique suffisamment avancé.
On peut aujourd’hui dresser le bilan de la vague hivernale en France.
Par rapport à l’épidémie saisonnière la plus forte de ces dix dernières années, celle de 1999-2000, la vague de l’hiver 2009-2010 a été plus précoce, un peu plus longue et d’intensité légèrement supérieure, et elle a eu un impact particulièrement important chez les enfants. Les formes asymptomatiques ou peu symptomatiques ont probablement été plus nombreuses que pendant la grippe saisonnière. En janvier, le nombre des personnes atteintes par le virus pouvait être estimé entre 8 et 15 millions de personnes, soit entre 12 et 24 % de la population, auxquelles il faut ajouter 5 millions de personnes protégées par la vaccination. De 13 à 20 millions de personnes, soit entre 20 à 30 % de la population française, seraient ainsi immunisées, sans compter une proportion importante des personnes âgées de plus de 50 ans, dont on sait désormais qu’elles étaient d’emblée protégées par une immunité résiduelle.
Le nombre d’hospitalisations dans les services d’urgence a été multiplié par huit par rapport à la saison grippale précédente. La distribution des âges des personnes hospitalisées est très différente de celle observée pour la grippe saisonnière : l’augmentation du nombre de cas a porté essentiellement sur la tranche des 10-19 ans, puis sur les 20-64 ans. Le nombre de patients admis en soins intensifs ou en réanimation atteste d’une sévérité particulière du virus A(H1N1) en 2009 par rapport au virus saisonnier, avec au moins 1 330 patients hospitalisés, et plus probablement 2000, le Programme de médicalisation des systèmes d’information (PMSI) dénombrant déjà 1 700 hospitalisations. On relève en outre une fréquence beaucoup plus importante du syndrome de détresse respiratoire aiguë liée au virus et du recours à une oxygénation extracorporelle. Par ailleurs, 20 % des personnes hospitalisées en unité de soins intensifs ou de réanimation ne présentent pas de facteurs de risque, et l’âge des patients est beaucoup moins élevé que dans le cas de la grippe saisonnière. Enfin, le nombre de décès notifiés à ce jour comme directement liés à la grippe pandémique s’élève à 312, ce qui correspond à une fourchette basse, qui ne prend pas en compte les décès en dehors des établissements de santé, ni ceux des personnes porteuses d’affections chroniques, dont le décès est indirectement lié au virus, et qui ne peuvent être comptabilisés qu’a posteriori.
On peut cependant d’ores et déjà affirmer que la mortalité a donc été inférieure à celle envisagée par tous les scénarios en septembre 2009, en France comme dans tous les autres pays.
Les données rassurantes sur l’impact épidémiologique de la première vague de la pandémie se sont donc accumulées progressivement et, en France comme dans les autres pays, le bilan se révèle en deçà des estimations de septembre 2009. On note cependant une sévérité particulière de certaines formes graves, qui touchent au surplus une population jeune.
Une vague épidémique de grande ampleur apparaît comme peu probable avant l’hiver prochain, compte tenu du taux estimé d’immunisation de la population et des données les plus récentes de la littérature internationale, à condition que le virus reste stable. Toutefois, des foyers localisés dans des groupes de populations peu immunisées ne peuvent être exclus.
Si l’hypothèse la plus probable est que le virus A(H1N1) circule de nouveau, il n’est pas possible de préciser à ce jour l’ampleur de sa circulation et de celle des autres virus, ni les caractéristiques de sa sévérité.
En résumé, c’est un scénario pandémique particulièrement favorable qui s’est déroulé jusqu’à présent. Il est néanmoins nécessaire de rester extrêmement vigilant car le virus peut encore évoluer entre son premier passage et son retour dans l’hémisphère Nord. C’est pourquoi l’InVS maintient un niveau élevé de vigilance sur cette menace, comme il le fait sur les quelque 90 alertes qu’il traite chaque année. Il reste tout aussi mobilisé sur des menaces moins visibles et de plus long terme, que ce soit en matière de maladies infectieuses, de menaces environnementales ou de maladies chroniques.
M. le président Jean-Christophe Lagarde. Peut-on estimer l’impact de la vaccination sur la propagation de l’épidémie ? Pourquoi la pandémie n’a-t-elle pas été plus forte dans les pays qui, comme la Russie ou la Pologne, n’ont pas développé de stratégie vaccinale ?
Les travaux sur la mutation des virus et la gestion des pandémies, que nous devons à notre excellent collègue Jean-Pierre Door et à Mme Marie-Christine Blandin, faisaient état d’une contribution de l’épidémiologiste Antoine Flahault, selon laquelle la grippe saisonnière pourrait constituer un magnifique laboratoire d’essai pour se préparer à lutter contre les épidémies. Est-ce, selon vous, une bonne idée ?
Mme Françoise Weber. En théorie, la vaccination a deux objectifs : arrêter ou modérer la transmission du virus ; protéger individuellement les personnes, d’abord les populations à risque, puis tous les autres.
Les travaux scientifiques utilisent déjà ce que l’on connaît de la grippe saisonnière et des pandémies précédentes pour établir des modélisations de l’impact d’une vaccination sur le taux d’attaque d’un virus grippal. Sur la base de ces travaux de modélisation, notamment sur la pandémie A(H5N1), l’InVS savait que l’impact de la vaccination sur le taux d’attaque et sur le profil de l’épidémie serait relativement faible car il était probable que les vaccins ne seraient pas disponibles en quantité suffisante avant le début de la première vague pandémique, mais qu’en revanche la vaccination gardait de l’intérêt pour protéger les personnes, en particulier celles susceptibles de développer des formes sévères de la maladie : les populations à risque et les jeunes. À cela s’ajoutent les informations collectées depuis vingt ans au travers de nos réseaux de surveillance épidémiologique de la grippe saisonnière, le réseau Sentinelles et celui des groupes régionaux d’observation de la grippe (GROG), qui nourrissent nos comparaisons avec la grippe saisonnière.
Le taux d’efficacité de la vaccination correspond à la réduction du nombre de grippés chez les vaccinés en comparaison des non vaccinés. Selon une étude non encore publiée menée par l’European Center for Disease Prevention and Control (ECDC) à partir de sept pays européens, dont la France, la vaccination A(H1N1) 2009 réduit de 70 % le nombre de cas chez les vaccinés, ce qui est, pour un vaccin grippal une très bonne efficacité. D’autres études devront venir consolider ces premiers résultats.
Vous évoquez la situation des pays qui n’ont pas mis en place de stratégie vaccinale, mais il faut comparer ce qui est comparable, ce qui n’est pas le cas en l’espèce. Il est nécessaire d’en savoir plus sur la qualité des dispositifs de recueil des données relatives à la mortalité mis en place par des pays tels que la Lettonie, la Lituanie ou la Pologne. En outre, les frontières ne constituent pas des barrières étanches face à la circulation des virus ou inversement à l’impact d’une vaccination. En l’absence d’une vision européenne d’ensemble, toute comparaison est prématurée. Il est vrai cependant que ces pays n’ont, comme les autres pays européens, pas été massivement touchés. Je le rappelle, malgré l’efficacité de la vaccination nous n’attendions pas un bénéfice populationnel important de celle-ci compte tenu de la date de disponibilité des vaccins par rapport à la survenue de la première vague.
M. le président Jean-Christophe Lagarde. Si je comprends bien ce que vous venez de dire, il n’aurait, premièrement, jamais été question que la vaccination influe sur le pic pandémique et, deuxièmement, il n’est pas possible de connaître aujourd’hui l’impact de la vaccination…
Mme Françoise Weber. Il est vrai que nous n’attendions pas un effet significatif de la vaccination sur le pic pandémique, compte tenu du moment où les vaccins ont été disponibles.
M. le président Jean-Christophe Lagarde. Est-ce la raison pour laquelle la vaccination n’a pas été obligatoire ?
Mme Françoise Weber. Je pense que beaucoup d’autres facteurs ont joué.
M. Jean-Pierre Door, rapporteur. Pouvez-vous nous décrire les relations que vous entretenez avec les différents organismes étrangers, notamment européens et américains, grâce auxquels vous assurez un suivi épidémiologique journalier ?
Alors que le taux d’efficacité vaccinale est assez important en France en matière de grippe saisonnière, dans le cas du virus A(H1N1) il a été inférieur à ce que nous en attendions. Pour quelle raison ?
Avez-vous eu votre mot à dire à propos de la stratégie vaccinale mise en place à partir du printemps par la direction générale de la santé et le délégué interministériel à la lutte contre la grippe aviaire (DILGA) ?
Mme Françoise Weber. Comme tous nos homologues des pays développés, nous avons nos propres réseaux de surveillance et nous sommes partie prenante de réseaux européens et internationaux. La plupart des pays ont mis en place le même dispositif de surveillance de la grippe que nous : des réseaux de médecine générale permettant de surveiller les profils épidémiques associés à des systèmes de recueil et de notification individuelle des hospitalisations des cas graves.
Nous sommes ainsi en relation avec les autres pays d’Europe à travers l’European Center for Disease Prevention and Control, qui assure la coordination de la veille et de l’alerte sanitaires au niveau européen, et nous sommes un acteur important. Nous échangeons également des données sur la pandémie au travers de l’Early Warning and Response System (EWRS). Par ailleurs, nous échangeons des éléments d’expertise scientifique, notamment avec nos collègues du Royaume-Uni, des États-Unis et de l’hémisphère Sud, qui nous permettent de travailler sur des planning assumptions,
c’est-à-dire des projections sur lesquelles bâtir des hypothèses de prévention et de préparation du système de santé. Ces multiples échanges nous ont permis de produire les mêmes hypothèses pour éclairer la décision publique.
Tel a été notre « mot à dire », monsieur le rapporteur : produire des scénarios d’évolution de la pandémie. Sachant que ce phénomène était très difficile à prévoir, nos hypothèses allaient d’un scénario optimiste à un scénario pessimiste. Dès le mois de septembre cependant et sur la base de l’évolution des connaissances et des expériences des pays déjà touchés nous avons exprimé notre inclination en faveur du scénario le plus optimiste. Voilà quelle a été la contribution de l’InVS à la décision. C’est précisément la raison pour laquelle les agences sanitaires ont été créées : distinguer l’évaluation de la décision, afin que la première ne soit pas parasitée par des considérations de gestion. L’InVS est resté dans son rôle d’évaluation et de production de scénarios d’évolution, avec une grande humilité, compte tenu des incertitudes, tout en travaillant en très étroite collaboration avec les pouvoirs publics dans la gestion de cette pandémie, en répondant à toutes les questions qui nous étaient posées dans notre domaine d’expertise.
Mme Catherine Lemorton. L’InVS n’a-t-il pas, malgré lui, favorisé une situation anxiogène ? En effet, il semble a posteriori que ce virus n’était pas si inconnu : dès septembre, M. Flahault évoquait la proportion de 35 à 40 % de cas asymptomatiques, que vous nous dites ne découvrir qu’aujourd’hui. Vous justifiez votre prudence face aux informations rassurantes venues de l’hémisphère Sud par le nombre d’hospitalisations à l’étranger : comment pouvez-vous comparer, de ce point de vue, des pays dont les systèmes de soins sont extrêmement différents ? Par ailleurs, en octobre, à l’occasion de votre audition par la Commission des affaires sociales, vous approuviez vous-même l’hypothèse d’une chute du pic pandémique à l’occasion des vacances scolaires. Il apparaît donc que, depuis le mois de juin, de nombreux éléments montraient qu’il n’y aurait pas de catastrophe. l’InVS n’a-t-il pas été pris dans la spirale infernale de l’anxiété ?
Mme Françoise Weber. Ne croyez pas que nos estimations résultent d’une intuition ou procèdent d’un caprice personnel : elles sont le fruit de travaux scientifiques et d’échanges entre équipes internationales, basés sur une technique scientifique qui s’appelle l’épidémiologie. Celle-ci a ses limites et ses incertitudes, et ce sont elles que nous percevons aujourd’hui. Mais nous pouvons justifier à chaque étape de notre évaluation des données scientifiques qui ont été prises en compte et de la validité de nos calculs par rapport à l’état de la littérature scientifique internationale. Tous les scientifiques de l’InVS ont cependant l’humilité de reconnaître les limites de ces estimations. Notre objectif n’était pas de prédire ce qui allait se passer, mais de donner la fourchette des hypothèses possibles d’évolution.
La proportion de cas asymptomatiques est en réalité beaucoup plus élevée que les 30 à 40 % de la grippe saisonnière, qui était l’hypothèse initiale, puisqu’elle pourrait aller jusqu’à 70 %, proportion que nous sommes en train d’essayer de préciser, du point de vue notamment de la distribution par tranche d’âge. Cela fait plusieurs mois que nous essayons de déterminer cette proportion, mais nous ne disposions alors d’aucune donnée suffisamment fiable sur le plan scientifique. Certains ont eu assez tôt l’intuition de ce que serait l’évolution de la pandémie mais il s’agissait avant tout d’opinions qui n’étaient pas fondées sur les éléments scientifiques opposables. Tant que nous sommes dans l’incertitude, nous devons avoir l’humilité de dire qu’il est trop tôt pour tirer des conclusions scientifiquement fondées. J’assume le corollaire de cette humilité, à savoir le risque d’être quelquefois les derniers à avoir raison. Notre niveau de responsabilité l’exige : il aurait été hasardeux de fonder des décisions publiques sur des intuitions personnelles.
M. le président Jean-Christophe Lagarde. On peut s’interroger sur le degré de certitude suffisant selon vos critères, puisque vous avez fait état de l’existence d’un risque pour l’avenir. Si votre raisonnement est scientifiquement imparable, il me semble très discutable pour l’organisation de la vie en société, puisqu’il y aura toujours un risque de pandémie du point de vue scientifique. Le sentiment général est qu’on savait dès le mois de juin que c’était bénin. En tant que conseil des responsables publics, quelle balance établissez-vous entre le souci de leur proposer une hypothèse raisonnable et celui de la certitude scientifique ? Le lancement d’une alerte étant conditionné à l’existence d’un élément anormal, ne devez-vous pas être capable de dire à partir de quand on revient à une situation normale ou socialement acceptable ?
Mme Françoise Weber. On commence à comprendre ce qui s’est passé durant la première vague de la pandémie et pourquoi on s’est retrouvé devant un scénario pandémique assez inattendu. Nous avons commencé à être rassurés entre septembre et mi-novembre, au moment du pic épidémique : c’est alors que nous nous sommes progressivement rendu compte que cette pandémie n’allait pas avoir, en termes de nombre de cas symptomatiques, un impact beaucoup plus important que la grippe saisonnière, même si une incertitude demeurait en ce qui concerne le nombre de cas sévères.
Il est important de comprendre que ce virus nous a réservé quelques surprises. S’il s’agissait bien d’un nouveau virus, porteur de toutes les menaces d’un virus pandémique, il était difficile de prévoir le taux d’immunisation d’une partie de la population. Or celui-ci a joué un rôle important dans l’évolution de la pandémie. Par ailleurs, l’efficacité des antiviraux s’est révélée plus importante que prévu. L’absence quasi-totale de cocirculation virale et d’éléments de surinfection explique également a posteriori le caractère très favorable du scénario qui s’est finalement imposé. Or nous ne disposions pas de ces éléments au début de la pandémie, et même au début de la première vague.
Notre évaluation a pris en compte les données relatives aux systèmes de santé les plus proches du nôtre, notamment néo-zélandais et australien, qui présentent des systèmes de surveillance épidémiologique et de prise en charge des patients tout à fait comparables aux nôtres. C’est pourquoi le 19 novembre, nous avons rencontré nos collègues de ces pays dans le cadre d’un séminaire dont le but était de tirer les leçons de ce qui s’était passé dans l’hémisphère Sud pour affronter la vague à venir dans l’hémisphère Nord. Si nous avons été particulièrement attentifs au taux d’hospitalisation et au nombre de cas sévères dans ces pays, c’est précisément parce que nous savions que leur système de soins était tout à fait comparable au nôtre. S’agissant des États-Unis, il est vrai que le critère du taux d’hospitalisation est moins pertinent ; en revanche, nos deux systèmes sont comparables en ce qui concerne la prise en charge des formes les plus graves par les services de réanimation.
M. Gérard Bapt. Avez-vous des informations sur d’éventuels décès post-vaccination ? Sur quelles études cliniques vous fondez-vous pour affirmer l’efficacité des antiviraux ? Vous n’avez pas évoqué en revanche l’efficacité des simples gestes barrières, prônés par les messages de santé publique.
Vous avez rappelé que la déclaration de pandémie est liée à l’apparition d’un virus nouveau. Que pensez-vous de la modification par l’OMS de la définition d’une pandémie qui lui a permis de lancer la phase 6 de l’alerte ? Comment affirmer le caractère entièrement nouveau du virus, alors que dès le 22 mai 2009, le Center for Disease Control and Prevention d’Atlanta indiquait que 10 % des moins de soixante ans et 33 % des plus de soixante ans avaient déjà développé des anticorps contre ce virus prétendument nouveau ? En outre, le directeur du CDC d’Atlanta affirmait le 5 mai, que « le virus n’ [avait] pas l’air plus sévère qu’une souche de grippe saisonnière, qui fait chaque année 36 000 morts aux États-Unis », ce qui est contraire à vos affirmations quant à l’impossibilité de connaître exactement le degré de gravité de la pandémie dans l’hémisphère Nord avant l’automne.
Vous nous dites que vous avez pu tirer le bilan de la pandémie le 19 novembre, lors d’un séminaire auquel participaient des collègues de l’hémisphère Sud. Or le Dr Dupagne, généraliste parisien disposant d’un site internet, affirme qu’il était dès le mois de mai arrivé à la conclusion qu’il ne s’agirait pas d’une épidémie grave en correspondant par voie électronique avec des collègues de l’hémisphère Sud.
Vous nous annoncez maintenant la survenue d’un deuxième pic épidémique. Croyez-vous qu’après ce qui vient de se passer, la population et le corps médical seront sensibles aux messages de santé publique fondés sur vos attendus ? Quelle est exactement cette étude InVS-INSERM sur laquelle s’appuyaient le Comité de lutte contre la grippe et M. Antoine Flahault pour prédire que l’épidémie de grippe risquait de tuer 30 000 personnes en France ?
On nous parle aujourd’hui d’une simple hypothèse : il n’empêche qu’une dépêche AFP du 12 mai, reprise sur le site du Monde, l’a diffusée comme une pure et simple information. Or le bulletin épidémiologique de l’OMS en date du 22 mai fait état de 180 décès liés à la grippe A dans le monde entier. Cette panique, largement entretenue par l’OMS, lui a permis de déclencher le 11 juin 2009 la phase 6 de l’alerte à la pandémie, alors que seulement 144 décès dans le monde étaient alors attribués à la grippe A. Tout cela ne laisse pas d’interroger les responsables publics et tous ceux qui réfléchissent aux questions de santé publique. En effet, le passage en phase 6 mettait automatiquement en jeu les contrats « prépandémiques » ou options de commande liant les États aux producteurs de vaccins à hauteur de 2,26 milliards d’euros. Bingo pour les laboratoires producteurs de vaccins !
Ce contexte, s’il ne met pas en cause la responsabilité de l’InVS, devrait cependant vous inciter à vous demander si vous agiriez de même à la prochaine occasion.
Mme Françoise Weber. Vous me permettrez, monsieur le député, de ne pas commenter l’ensemble des interventions de mes collègues épidémiologistes, qu’ils aient été à certains moments plus optimistes ou, à d’autres, plus pessimistes : cela demanderait beaucoup plus de temps que cette commission n’en dispose.
Quant aux responsabilités de l’InVS, notamment celle de préparer le système de santé à ce qui pouvait arriver, je me suis déjà exprimée sur la question. Je rappellerai à ce propos un principe qui vaut, non seulement dans le champ sanitaire, mais également dans le domaine de la défense nationale comme dans beaucoup d’autres : on doit se préparer à des menaces dont la survenue n’est jamais certaine et dont nous essayons de préciser les contours au fur et à mesure.
En ce qui concerne les décès post-vaccination, je ne suis pas compétente et Jean Marimbert saura vous répondre de façon beaucoup plus précise que moi. Je peux simplement vous dire qu’en termes épidémiologiques nous n’avons pas constaté de phénomène anormal.
L’efficacité des antiviraux, notamment du principal d’entre eux, l’oseltamivir, avait été évaluée sur la grippe saisonnière. À partir de la synthèse des études disponibles, le groupe Cochrane avait conclu à une efficacité limitée sur la grippe saisonnière. En revanche, certains éléments mettaient en évidence l’impact de l’oseltamivir sur la mortalité liée à la grippe aviaire. En outre, l’analyse des premiers cas graves de grippe A(H1N1) indiquait un risque de deux à cinq fois plus élevé pour les personnes, présentant ou non des facteurs de risque, qui n’avaient pas reçu de Tamiflu dans les quarante-huit premières heures, résultats confirmés par la littérature scientifique internationale. Cette confirmation de l’efficacité d’une telle administration du Tamiflu nous a conduits à en recommander la prescription, même pour les personnes ne présentant pas de facteurs de risque.
En termes scientifiques et épidémiologiques, il s’agissait bien d’une pandémie, c’est-à-dire de l’apparition d’un nouveau virus se diffusant très rapidement sur l’ensemble des continents. Mais l’OMS a besoin de critères plus fins pour déterminer des seuils dans la gestion de la pandémie. Elle a considéré à un certain moment la sévérité comme un élément à prendre en compte pour lancer une phase de mobilisation plus importante. Or ce critère s’est révélé insuffisamment pertinent et d’une application trop peu facile pour que l’OMS le conserve. La question n’est donc pas celle de la définition de la pandémie, mais celle des critères à prendre en compte pour activer les différentes phases d’alerte.
La déclaration faite le 5 mai par nos collègues des CDC ne traduit qu’une observation à un moment donné, qui ne permet pas de préjuger ce qui se passera en hiver, comme l’ont montré les pandémies précédentes. Le rapport fait à la présidence des États-Unis au mois d’août par les mêmes auteurs avance des hypothèses tout à fait similaires à celles que nous avons soumises à la DGS et à notre ministère, à savoir de 30 000 à 90 000 décès, de 150 000 à 300 000 hospitalisations en réanimation, et 1,8 million d’hospitalisations. Nos hypothèses ont donc toujours été cohérentes et conformes à celles des CDC et de la Health Protection Agency (HPA). C’est une chose que de constater un état de fait à un instant t, mais c’en est une autre que d’établir des hypothèses et des scénarios pour préparer un système de santé à une menace et tout un pays à affronter une crise. Nous étions dans la préparation à une menace, dont on ne savait, par définition, ni quand ni comment elle allait se réaliser.
La vision du Docteur Dupagne était juste s’agissant du plus grand nombre de malades. Dès le début, nous avions vu que la plupart des patients présentaient des formes tout à fait bénignes de la maladie. Mais ce serait tout à fait faux de caractériser cette pandémie par cette seule observation. Nous avons eu à faire face à de nombreuses formes graves et inhabituelles chez les sujets jeunes. Il faudrait aussi interroger les réanimateurs, dont l’analyse du phénomène est différente de celle des généralistes. Ceux-ci vous diront qu’ils ont observé des cas qui, par leur nombre et leur sévérité, dépassaient tout ce qu’ils ont coutume de voir à l’occasion des grippes saisonnières. Je me permets de vous inviter à entendre à ce sujet les présidents des sociétés savantes d’anesthésie et de réanimation. Leurs observations recouperont certainement celles faites par nos collègues australiens et néo-zélandais à la fin de la vague pandémique de l’hémisphère Sud : si la plupart des cas sont tout à fait bénins, la sévérité tout à fait inhabituelle de certains rend difficile la prédiction de l’ampleur de l’épidémie, notamment au moment de son passage à l’hémisphère Nord.
M. Gérard Bapt. Vous agiriez donc de même dans des circonstances analogues. Pouvez-vous nous confirmer que, depuis le lancement de l’alerte au virus A(H1N1), le paludisme a fait 1 million de morts à travers le monde ?
Mme Françoise Weber. Le paludisme dépassant le champ d’investigation de cette commission, vous me permettrez de vérifier les données dont je dispose en ce domaine avant de vous confirmer cet élément par écrit.
Il est évident que des éléments de choix stratégique interviennent dans les décisions de santé publique, notamment en ce qui concerne le rapport coût-efficacité. Quel que soit le pays, les décideurs tiennent compte des moyens dont celui-ci dispose au regard de l’impact qu’ils souhaitent obtenir sur la santé publique. Je crois que c’est ce qui s’est passé dans le cas d’espèce, sans que je puisse me livrer à une analyse plus approfondie. Mon sentiment personnel est que la campagne de vaccination et les messages de santé publique sur les mesures barrières ont joué un rôle et qu’en termes de santé publique, ces mesures étaient proportionnées à la menace présente au moment où elles ont été décidées. Je ne dispose pas d’éléments pour les considérer comme disproportionnées au regard de la menace à laquelle nous avions à faire face.
M. le président Jean-Christophe Lagarde. Je vous demanderai de bien vouloir nous communiquer vos travaux sur l’impact de ces mesures barrières, non seulement sur la prévention de la grippe A, mais aussi sur celle d’autres virus.
Vous ne devez pas perdre de vue que vous n’êtes pas seulement un conseil de l’État et des décideurs politiques : la reprise de vos travaux dans les médias vous donne également un rôle d’information du public. Quand vos doutes scientifiques, légitimes, deviennent des certitudes médiatiques, voire des contrevérités qui se propagent dans l’opinion, cela décrédibilise aux yeux de celle-ci l’ensemble des autorités sanitaires, et on risque de créer un problème plus grave que celui auquel on était censé remédier.
M. le rapporteur. Pour m’être rendu au Center for Disease Control and Prevention (CDC) d’Atlanta au mois de décembre, monsieur Bapt, je puis vous dire que leurs inquiétudes restaient vives. Je vous rappelle également que le président Obama avait déclaré l’urgence sanitaire en juillet.
La prévention n’est pas la précaution : l’une porte sur un fait avéré, quand la précaution s’applique même lorsque l’on ne sait pas quel peut être le risque. Or je pense que, comme la majorité d’entre nous, vous avez voté en faveur de l’inscription du principe de précaution dans la Constitution.
M. le président Jean-Christophe Lagarde. Ça n’a pas été mon cas.
Madame Françoise Weber, nous vous remercions.
La séance est levée à vingt heures trente.
Audition de M. Bernard Boubé,
préfet et ancien directeur
de l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS)
(Procès-verbal de la séance du mardi 6 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-neuf heures dix.
(M. Bernard Boubé prête serment.)
M. Bernard Boubé, préfet et ancien directeur de l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS). Je serai plus bref que prévu puisque je suis auditionné après M. Didier Houssin et Mme Françoise Weber. C’est en tant qu’ancien spécialiste de la planification de crise que j’ai suivi les événements relatifs à la pandémie, les réactions qu’elle a suscitées et les décisions qui ont été prises.
Je tiens en premier lieu à vous faire part de l’expérience frustrante que j’ai vécue lors de la constitution de l’ÉPRUS, fin août 2007, jusqu’à juin 2008, période très courte mais riche en événements de toutes sortes, du moins en ce qui me concerne.
Cette période, que je considère comme un échec, est d’abord l’histoire du rejet d’une greffe par un organisme – la DGS, voire le ministère de la santé – qui n’en éprouvait pas le besoin.
J’ai eu l’occasion de présenter, devant la commission des finances du Sénat, le déroulement des événements : le rapport provisoire de l’été 2009 fait clairement apparaître les causes de dysfonctionnement et les insuffisances de l’ÉPRUS, structure condamnée par son administration de tutelle à un rôle subordonné interdisant toute perspective de progrès. Du reste, le rapport du Sénat s’interrogeait sur sa pérennité.
Certaines des difficultés les plus graves qui ont justifié mon départ de l’ÉPRUS ont trouvé des solutions, parfois tardives, qui ne sont pas toutes satisfaisantes. Je pense notamment à l’installation pérenne du siège de l’ÉPRUS au début de l’année 2009, à la révision de son statut juridique au regard de son activité pharmaceutique par un décret d’août 2008 et, consécutivement, à l’ouverture, en avril 2009, d’un établissement pharmaceutique.
L’ouverture de cet établissement était particulièrement importante puisqu’elle conditionnait l’exécution des missions que la loi avait confiées à l’ÉPRUS s’agissant notamment de l’acquisition, du stockage et de la distribution de produits relevant des protections édictées par le code de la santé – le monopole pharmaceutique, pour faire bref.
Le rapport du Sénat indique que les relations entre la DGS et l’ÉPRUS ont été formalisées par une convention. N’en ayant pas connaissance, il m’est difficile de l’apprécier. Le fait que la DGS et moi-même, en tant que directeur de l’ÉPRUS, n’ayons pas eu la même conception de nos rapports a été une des raisons principales des difficultés rencontrées. En dépit de mes propositions réitérées, nos rapports n’ont fait l’objet d’aucune tentative d’organisation.
En revanche, l’organisation des rapports de l’ÉPRUS avec le service de santé des armées, selon les modalités que je souhaitais présenter au conseil d’administration de juin 2008 – conseil annulé en raison de mon départ –, constitue une évolution favorable. La sécurité des stocks concernés est désormais mieux prise en compte. Je ne suis pas certain que ce soit le cas de tous les produits.
D’autres difficultés provenaient de mauvaises pratiques, d’erreurs et de routines sur le plan administratif, que je voulais écarter d’un établissement public créé par le législateur en vue de professionnaliser la logistique de crise sanitaire. Elles portaient à la fois sur les modalités de transfert des marchés par la DGS, la gestion des stocks et la constitution d’une réserve de professionnels de santé, laquelle, malheureusement, en était encore à l’état de projet lorsque je suis parti, en dépit des efforts que l’ÉPRUS avait fournis afin de la mettre en place.
De fait, les blocages que j’ai rencontrés lors de la mise en route de l’ÉPRUS, ainsi que pour assurer la sécurité de l’établissement au regard du code de la défense, ne m’ont pas permis de mener à bien la mission qui m’avait été confiée. C’est la raison pour laquelle j’ai quitté mes fonctions. Certains de ces blocages, je l’ai dit, appartiennent au passé, mais ce n’est pas le cas de tous.
Il est vrai que la loi du 5 mars 2007 présentait quelques ambiguïtés, qui en rendaient l’application difficile. C’est ainsi que le texte ne précisait pas la nature juridique et la domanialité des stocks de produits de sécurité. Ces stocks sont conjointement financés par les budgets de l’État et de l’assurance maladie, qui alimentent à parts égales le budget de l’ÉPRUS. Ils sont acquis par l’ÉPRUS sur demande du ministre chargé de la santé, mais sur le budget de l’établissement, qui dispose de l’autonomie financière. S’ils sont conservés sous la responsabilité de l’ÉPRUS, ils sont délivrés aux autorités sanitaires d’emploi sur ordre du ministre. S’agit-il dès lors de stocks d’État ou de l’ÉPRUS ? Doivent-ils être intégrés dans la comptabilité patrimoniale de l’État ou dans celle de l’ÉPRUS ? Faut-il distinguer les régimes juridiques des stocks constitués par l’État avant la création de l’ÉPRUS et des stocks qui sont constitués par l’ÉPRUS à la demande de l’État ?
La DGS et moi-même n’avions pas la même position en la matière. Je tiens à rappeler que c’est la mienne qui a été confirmée par la Cour des comptes. Il n’en reste pas moins que des sujets aussi importants que la présentation des comptes, la préparation de certains appels d’offre ou la prise en charge des stocks, que je souhaitais formaliser par une convention de transfert, puisque l’ÉPRUS risquait d’en devenir le responsable en tant que personne morale, et non pas simplement comme un établissement se livrant à une activité d’État, soulevaient de nombreuses questions, qui devenaient plus sensibles au fil des mois. Il en était de même du contrôle de la conservation de ces stocks chez les prestataires.
Enfin, la conception de la loi relativement au corps de réserve sanitaire me paraît quelque peu restrictive : l’expérience de la lutte menée contre le virus de la grippe A(H1N1) confirme l’intérêt d’un élargissement de cette conception, pour en faire, à l’exemple des réserves militaires, un corps beaucoup plus large, répandu sur le territoire, qui pourrait, tout d’abord, servir à tester nos réactions en termes de mobilisation, ou du moins de sensibilisation, ce qui nécessiterait la prise en charge sur fonds publics de formations et d’échanges techniques, appelés à devenir opératoires le moment venu. Ces canaux permettraient également de prendre le pouls du terrain et de redresser d’éventuelles erreurs de communication.
Telle est l’expérience que j’ai vécue à l’ÉPRUS. Ma tutelle et moi-même ne partageons évidemment pas le même point de vue sur la façon dont les événements se sont déroulés.
En ce qui concerne la pandémie, il est vrai qu’une des questions posées par l’opinion est celle de la qualité du plan de crise et, plus généralement, d’une préparation dont les autorités publiques se prévalaient avec constance avec un haut niveau de satisfaction. Je n’ai pu porter qu’un regard extérieur, puisque je ne suis plus directeur de l’ÉPRUS depuis juin 2008. Comme vous l’a indiqué Mme Françoise Weber, en dépit d’une observation attentive et de la mobilisation de tout le savoir scientifique, nous n’avons pas toujours connu la situation avec exactitude. Or, ces incertitudes n’ont pas été sans conséquences. L’InVS rappelle les différences considérables entre les estimations des réseaux GROG (groupes régionaux d’observation de la grippe) et Sentinelles au 13 décembre 2009, c’est-à-dire au pic de l’infection : elles allaient de 6,7 à 12 millions de cas et, au total pour l’InVS, de 8 à 15 millions. Ce fait est préoccupant puisqu’il indique qu’on ignore ce qui s’est exactement passé. De même, s’agissant du traitement des malades, on a ressenti un flou certain entre, d’une part, les déclarations officielles et, d’autre part, la façon dont les médecins ont pris en charge leurs patients.
La distinction avec la grippe saisonnière a parfois été assez longue à apparaître et des qualifications contrastées ont affecté le phénomène – on a ainsi évoqué une « grippette ». Quant aux cas de surinfection, nous ne les connaissons avec certitude que pour les patients hospitalisés, mais moins bien pour l’ensemble des personnes atteintes par le virus. Nous ignorons de ce fait l’état réel des malades guéris et le nombre de ceux qui conservent des séquelles respiratoires. S’il est vrai que le quart de la population a été affecté, nous obtiendrons bientôt des réponses à toutes ces questions.
Par rapport aux prévisions du plan, il est vrai que de nombreux sujets n’ont pas été défrichés, compte tenu de la situation réelle de la pandémie. En ce qui concerne les mesures barrières, les fermetures d’écoles n’ont eu que peu d’effets puisque, dans de nombreux endroits, aucun dispositif d’isolement des enfants n’était prévu. Les parents n’ont donc pas pu y recourir dans tous les cas. Quant à la surveillance des voyageurs, elle a été très vite réduite après avoir concerné principalement le Mexique – cette réduction n’est du reste pas propre à la France. Par chance, le virus a tardé à se répandre dans notre pays. Le plan recommandait l’usage de masques de protection et des stocks considérables ont été constitués ; or ces stocks n’ont pas été utilisés. Est-ce dû à la péremption des stocks anciens, au retard dans les renouvellements autorisés par la loi de finances au printemps 2009 ou à la crainte que les salariés et la population ne refusent de se soumettre à la contrainte, mal comprise, de l’usage du masque en public ? Je n’ai toujours pas de réponse à ces questions.
Quant aux antiviraux, il est vrai qu’ils ont montré leur efficacité lorsqu’ils ont été administrés, c’est-à-dire dans les hôpitaux. Au dehors, tout dépendait de la pratique des médecins traitants, qui, pour la plupart, ont utilisé d’autres dispositifs, lesquels, il est vrai, leur avaient été recommandés au début de la pandémie. Ils ont pu ainsi se rendre compte que le paracétamol traitait avec efficacité la plus grande partie des patients atteints. Ce n’est que tardivement que l’usage plus systématique des antiviraux leur a été recommandé.
Fallait-il recourir au système centralisé de vaccination ? Les explications en la matière sont toutes pertinentes. Il n’en reste pas moins que la situation a créé dans l’opinion publique un hiatus important avec les autorités sanitaires, d’où la création de votre commission d’enquête. C’est sans doute le point majeur sur lequel des efforts doivent porter afin de rétablir une relation de confiance, fondée sur la transparence et l’écoute, relation sur laquelle, à juste titre, le plan de crise insistait. Il importe de réduire la méfiance, encore vive, de la population à l’encontre des autorités sanitaires et des experts.
Les difficultés rencontrées lors de la crise proviennent moins du plan lui-même, qui reste bon dans son principe, que de l’usage qui en a été fait. Comme celle de 1976, plus encore que celle de 1968 et 1969, la pandémie « avortée » de 2009 a été provoquée par un virus qui a manqué de franchise. Sa virulence s’est atténuée après son apparition spectaculaire au Mexique, prenant à contre-pied un grand nombre d’autorités sanitaires. Nos plans ont été à l’origine conçus pour une pandémie agressive et un virus meurtrier, et cette dangerosité imprégnait sans doute les esprits, ce qui n’a pas manqué d’influer sur les décisions. Il est souhaitable que la prochaine version du plan reflète davantage la réalité nuancée des pandémies, ce qui permettrait de mieux contribuer au traitement de la crise à venir – il en arrivera forcément une. Il convient, à cette fin, que les causes profondes des difficultés rencontrées aient été préalablement reconnues et traitées.
M. Jean-Pierre Door, rapporteur. J’ai été le rapporteur du texte qui a créé l’ÉPRUS. Cet organisme destiné à réagir aux urgences sanitaires représentait à nos yeux un progrès considérable. Or, en tant que premier directeur de cet établissement, vous venez de nous exposer les dysfonctionnements qui ont accompagné sa naissance, notamment les problèmes qui ont très vite surgi entre votre tutelle et vous-même et qui sont à l’origine de votre départ.
Le fonctionnement actuel de l’ÉPRUS continue-t-il, à vos yeux, de mériter vos critiques ? Si tel est le cas, qu’entendez-vous par l’élargissement du rôle de l’ÉPRUS, que vous avez évoqué dans votre propos liminaire ? Souhaiteriez-vous que l’établissement acquière un rôle équivalent à celui de la Biomedical Advanced Research and Development Agency (BARDA) aux États-Unis, qui ne se contente pas de gérer des stocks, mais qui intervient aussi dans les décisions et la recherche ?
M. Bernard Boubé. Je n’ai évoqué que les difficultés auxquelles j’ai été directement confronté. Je ne dispose, pour la suite, que d’informations en provenance de sources ouvertes.
Ces difficultés étaient de plusieurs ordres. Je le répète : je n’ai pas pu installer le siège de l’ÉPRUS durant les neuf mois pendant lesquels j’ai dirigé l’établissement. Le président de l’ÉPRUS et moi-même avons très rapidement fait une proposition visant à installer l’établissement dans une tour parfaitement sécurisée et sécurisable, puisque ne s’y trouvaient que des services de l’État ou proches de l’État. De surcroît, cette tour est très bien connue des services de gestion des ministères chargés des questions sociales – santé et travail – puisqu’un grand nombre d’entre eux y sont installés. Si, comme nous l’avions proposé, nous avions pu, à notre tour, y installer l’ÉPRUS dès la fin du mois de novembre 2007 nous aurions pu, dès mars 2008, disposer d’un établissement pharmaceutique et prendre en charge une grande partie, voire la totalité des nombreuses opérations que la DGS souhaitait nous confier. De plus, la France prenait alors la présidence de l’Union européenne et il n’existait dans aucun autre pays de l’Union une structure de ce type : ainsi aurions-nous pu entraîner nos partenaires dans des coopérations, qui étaient souhaitées par le gouvernement français.
Le président de l’ÉPRUS et moi-même n’avons été informés de l’impossibilité d’installer l’ÉPRUS dans ces locaux que la veille de la réunion du conseil d’administration qui devait entériner le projet. Il a fallu attendre mon départ pour que la situation se décante. J’avais, à plusieurs reprises, fait des propositions – nous avons visité vingt-huit sites –, mais je n’ai jamais pu obtenir les informations me permettant d’établir le bon dimensionnement du site de l’ÉPRUS.
Par ailleurs, si je ne demandais pas l’augmentation des effectifs prévus pour la gestion des stocks, même en cas de modification stratégique importante, du fait que je travaillais en liaison avec le service de santé des armées afin de sécuriser les stocks dans des conditions que les militaires maîtrisent, j’avais en revanche posé la question de la réserve sanitaire. La DGS avait en la matière un projet, certes limité, mais conforme à la loi : il consistait à sécuriser les urgentistes en leur permettant d’obtenir une véritable professionnalisation de leurs missions, notamment extérieures. Or, pas même ce projet n’a pu aboutir, puisque, à mon départ, les règles d’emploi de cette réserve minimale n’avaient pas encore été présentées au conseil d’administration, la DGS ayant souhaité le faire à ma place. Par-delà ce projet, j’avais pour ambition de constituer une réserve de plusieurs dizaines de milliers de professionnels de santé, ce qui aurait permis de couvrir l’ensemble du territoire – ce projet est, à mes yeux, toujours d’actualité. Je n’ai pas réussi à savoir en quel sens trancherait la DGS : or une réserve de quelques dizaines de milliers de professionnels ne peut être gérée comme une réserve minimale de quelques centaines.
Quant à la stratégie de stockage, elle n’a été arrêtée qu’après mon départ, alors que tout était prêt avec le service de santé des armées.
L’addition de toutes ces incertitudes et l’absence de siège de l’établissement ne nous a pas permis d’obtenir de l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) l’agrément pour l’ouverture d’un établissement pharmaceutique, ce qui nous contraignait à ne réaliser certaines opérations, devenues urgentes en raison des dates de péremption, qu’en oubliant des dispositions majeures de la loi, comme le monopole pharmaceutique. Cela n’était possible qu’à la condition d’obtenir l’expression d’une certaine confiance politique, mais tel ne fut pas le cas. Il m’était donc devenu impossible de rester et je suis parti. Le reste est affaire de perception. J’ai présenté ma démission, en en exposant les raisons, ce qui n’est pas habituel. Il est tout à fait normal qu’il ait été mis à fin à mes fonctions, ce que je considérais comme souhaitable.
M. Gérard Bapt. M. le rapporteur vous a demandé ce que vous entendiez par l’« élargissement » des missions de l’ÉPRUS.
Par ailleurs, savez-vous si les doses de tamiflu mises gratuitement à disposition jusqu’à épuisement pour la prévention, y compris de personnes asymptomatiques, arrivaient à péremption courant 2010, ce qui ne laisserait pas de nous interroger sur cette indication larga manu ?
M. Bernard Boubé. Je souhaitais, non seulement élargir la réserve sanitaire, mais tout simplement que l’ÉPRUS assume la totalité de ses missions. Or la DGS et moi-même divergions sur la conception des relations entre un établissement public, qui est à un bout de la chaîne de sécurité sanitaire, et une administration centrale qui exerce sur cet établissement public et sur celui qui le dirige une double mission : d’une part, une mission de tutelle, prévue par la loi, qui porte sur les actes du conseil d’administration ; d’autre part, une mission hiérarchique, puisque la loi prévoit que le directeur général de l’ÉPRUS répond, au nom de l’État, à des demandes expresses du ministre de la santé relatives à l’acquisition ou à la mise à disposition de produits de santé. Il est dès lors agent de l’État et, de ce fait, ne relève plus de la tutelle qui pèse sur l’établissement public. Ces distinctions juridiques ne sont pas sans conséquences sur les relations entre les deux établissements et leur fonctionnement.
Avant mon départ, les relations entre l’ÉPRUS et l’administration de tutelle ont été établies sur des bases réduites par rapport à ce que la loi prévoyait.
Je ne me rappelle plus les dates de péremption des produits, et ne saurai donc répondre précisément à votre question. Je peux en revanche vous confirmer qu’on m’a demandé de réaliser des opérations avec rapidité, alors qu’il m’était quasiment impossible de le faire.
M. le président Jean-Christophe Lagarde. J’ai été surpris d’apprendre par votre successeur à la direction de l’ÉPRUS que l’établissement, après avoir, dans un premier temps, récupéré les contrats précédemment passés par la DGS, se contentait de négocier avec tel ou tel laboratoire, sans avoir à effectuer lui-même des recherches, alors qu’il a un rôle de « logisticien » dans la discussion, la négociation, l’acquisition, la conservation et la distribution des produits de santé qui sont nécessaires pour répondre à une urgence sanitaire. Quel est votre avis en la matière ?
En dehors de la question de la réserve médicale, et par-delà votre désaccord avec la DGS sur le caractère de simple exécutant laissé à l’ÉPRUS, comment serait-il possible, selon vous, d’améliorer l’efficacité de l’établissement en matière de réponse aux urgences sanitaires ?
M. Bernard Boubé. Je suis obligé de me montrer prudent dans l’expression de mes préoccupations. En effet, dans le cadre de mes fonctions antérieures, j’ai eu l’occasion d’évaluer la sécurité des opérateurs d’importance vitale et de proposer de manière détaillée la mise en place de dispositifs visant à améliorer ladite sécurité. Or je n’ai même pas pu le faire dans l’établissement qui m’était confié. Il s’agit là d’un problème culturel majeur.
Il convient de rappeler que les missions de l’ÉPRUS ne concernent pas les seules pandémies mais aussi, et plus largement, la préparation et la réponse aux urgences sanitaires de toutes sortes – calamités naturelles ou hypothèses d’attentats.
M. le rapporteur. Vous pensez au bioterrorisme…
M. Bernard Boubé. Pas seulement : au terrorisme en général.
S’agissant des produits devant être gérés par l’ÉPRUS et des capacités de mobilisation des professionnels concernés – tel était le sens de la réserve sanitaire dans l’esprit du ministre qui avait défendu le texte en 2007 –, le terrorisme était expressément visé, même s’il est vrai que chacun avait dans l’esprit les problèmes liés aux pandémies – nous sortions du SRAS et voyions se profiler la grippe H5N1.
Compte tenu de mes activités antérieures et de mon expérience, j’avais une conception précise de la manière de procéder : lorsque j’ai compris que celle-ci n’était pas partagée par ma hiérarchie et que je n’aurai pas le dernier mot, j’en ai tiré les conséquences.
Que l’ÉPRUS, aujourd’hui, remplisse déjà ses missions ! Toutefois, comme je vous l’ai dit, je ne maîtrise plus le sujet, n’ayant même pas eu connaissance de la convention régissant désormais les relations entre l’administration centrale et l’établissement que je dirigeais.
M. le président Jean-Christophe Lagarde. Pensez-vous avoir été nommé à l’ÉPRUS principalement en raison de vos responsabilités antérieures, à savoir dans la perspective de préparer un établissement public à répondre à des urgences sanitaires qui ne seraient pas d’origine naturelle ?
M. Bernard Boubé. Il faudrait le demander à ceux qui sont à l’origine de ma nomination. Je pense toutefois pouvoir répondre à votre question par l’affirmative.
M. le président Jean-Christophe Lagarde. Avez-vous le sentiment que l’on a progressivement évolué vers une autre conception, laquelle ne nous préparerait pas à répondre de manière satisfaisante à des urgences sanitaires autres que naturelles ?
M. Bernard Boubé. Je n’ai pas dit cela ni ne pourrai le dire, puisque j’ai quitté l’ÉPRUS le 16 juin 2008. Depuis cette date, je n’ai pas cherché à savoir ce qui s’y passait, afin de ne gêner personne. Mon successeur a été nommé après un long délai et de nombreuses tractations. Les seuls échos que j’ai de sa prise de fonctions proviennent de la lecture du rapport de la commission des finances du Sénat.
M. le président Jean-Christophe Lagarde. Est-il légitime, compte tenu de la nature radicalement différente des deux missions confiées à l’ÉPRUS, même si leur finalité commune est d’assurer la sécurité sanitaire des Français, que l’administration de rattachement soit la DGS et, plus largement, le ministère de la santé ?
M. Bernard Boubé. J’ai répondu longuement à cette question devant la commission des finances du Sénat. Si celle-ci m’y autorise, je vous ferai parvenir ma réponse.
La question qui se pose est celle du rattachement de tout ou partie de l’ÉPRUS en fonction des objectifs qui lui sont assignés. L’accent est aujourd’hui mis sur un type de menaces, et il est heureux que les autres menaces ne se soient pas matérialisées. Toutefois, suivant de près les événements internationaux, je sais, comme tout un chacun, que ces menaces ne sont pas derrière nous : elles méritent donc un examen attentif.
M. le président Jean-Christophe Lagarde. Je vous remercie, monsieur le préfet.
La séance est levée à vingt et une heures dix.
Audition de M. Benoît Leclercq,
directeur général de l’Assistance publique – Hôpitaux de Paris (AP-HP)
(Procès-verbal de la séance du mercredi 7 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures dix.
(M. Benoît Leclercq prête serment.)
M. Benoît Leclercq, directeur général de l’Assistance publique – Hôpitaux de Paris. L’AP-HP représente trente-sept hôpitaux, 1,1 million d’admissions en urgence, 1 million d’hospitalisations et 4 millions de consultations. Elle emploie 92 000 personnes, avec un budget de 6,4 milliards d’euros. Elle s’étend principalement sur la région d’Île-de-France, principalement sur la métropole parisienne.
L’AP-HP était préparée à la grippe A, dans la mesure où elle avait déjà mis sur pied un plan assez drastique contre la grippe H5N1, dite « grippe aviaire ». En outre, depuis
2005-2006, elle a remis à jour son Plan blanc, c’est-à-dire son plan d’urgence interne. Enfin, sa qualité d’établissement de référence de la zone de défense l’amène à pratiquer régulièrement des exercices.
Dans la gestion de la grippe A, je distinguerai trois phases.
La première phase s’est déroulée avant l’été, lorsque les premiers cas sont apparus au Mexique, ce qui a déclenché des prises en charge hospitalières et pré-hospitalières, en particulier par les SAMU, les services d’assistance médicale d’urgence.
Durant la deuxième phase, à partir de l’été, les consultations dédiées se sont développées, nous avons pris en charge des cas graves – la médecine de ville traitant l’essentiel des patients –, nous avons adapté nos capacités hospitalières, notamment dans nos services de maladies infectieuses, afin de libérer de la place en vue d’accueillir d’éventuels patients, et nous avons largement mobilisé nos laboratoires de virologie ainsi que nos services de réanimation. Nous avons aussi planifié la déprogrammation de lits en cas d’affluence massive et nous avons préparé les plans de continuité d’activité en cas de pandémie grave, considérant que, si 30 % de la population française avait été touchée, 30 % au moins de notre personnel soignant l’aurait été.
La troisième phase, à partir de la rentrée de septembre, a requis une implication beaucoup plus forte, en matière hospitalière mais aussi dans le cadre des campagnes de vaccination de nos personnels, des patients, des familles de nos personnels et de la population.
L’AP-HP dispose depuis longtemps d’un système de gestion de crise, avec une cellule centrale et des référents dans chaque hôpital et chaque pôle hospitalier. Nous avons créé un comité stratégique H1N1. Nous avons mobilisé le réseau d’épidémiologie et de biologie, placé sous l’autorité du professeur Bricaire. Nous avons organisé des conférences téléphoniques avec l’ensemble de nos hôpitaux afin de coordonner leur activité.
Il a fallu adapter notre dispositif hospitalier, ce que nous sommes parvenus à faire sans tensions excessives, à quelques exceptions près.
Les SAMU et les SMUR – services d’assistance médicale d’urgence et services mobiles d’urgence et de réanimation, structures extra-hospitalières –, ont dû faire face à une augmentation du nombre d’appels. Nous avons donc renforcé leurs capacités de réponse téléphonique, y compris afin d’opérer un recensement statistique en vue de suivre l’évolution de l’épidémie.
Durant la première phase, tous les cas suspects ont été transportés à l’hôpital et isolés. Nous avons également mis en place des consultations dédiées spécifiques, notamment à l’entrée des hôpitaux sièges des SAMU de quatre départements sur huit. Nous avons rencontré davantage de difficultés avec les laboratoires de virologie, dans lesquels les virus de ce type sont détectés, car ils ont été soumis à des tensions plus vives. En effet, ils ne travaillent généralement pas dans l’urgence. De surcroît, le nombre de laboratoires de niveau de confinement L3, c’est-à-dire très protégés, est relativement faible. Enfin, il n’existe pas de définition des situations médicales et biologiques nécessitant un dépistage.
À partir de l’été, nous avons constitué un réseau de consultations hospitalières dédiées dans nos hôpitaux référents et dans nos hôpitaux dits de deuxième ligne. Ce réseau a bien fonctionné, hormis des tensions ponctuelles au cours de certains week-ends, notamment estivaux, durant lesquels le personnel est évidemment moins nombreux.
Au début de l’automne, nous avons porté une attention soutenue à la préparation de la déprogrammation. Il s’agissait, en cas de pandémie massive, d’être capable de déprogrammer de l’activité sur rendez-vous, y compris des opérations chirurgicales, afin de libérer des places hospitalières en tant que de besoin – l’ancienne DHOS, direction de l’hospitalisation et de l’organisation des soins, aujourd’hui DGOS, direction générale de l’offre de soins, avait fixé des seuils à cet effet –, notamment dans les services de médecine et les salles de réanimation ou de réveil de chirurgie. Cela nous a amenés à surveiller de manière encore plus précise que d’habitude – d’ordinaire, nous le faisons déjà quotidiennement – les capacités disponibles en réanimation, à bien suivre le fonctionnement et la continuité de nos services, et à vérifier que les équipements réservés pour ce faire dans les services, en particulier les respirateurs et les matériels de circulation extracorporelle, étaient adaptés. Les seuils de déprogrammation n’ont jamais été atteints, hormis une journée de la semaine 46, en pédiatrie. Les tensions observées à d’autres moments n’étaient pas uniquement liées à la grippe H1N1 mais à une conjonction entre cette grippe, des bronchiolites et des gastro-entérites, ces deux dernières affections provoquant toujours de l’affluence aux urgences durant cette période de l’année. Nous avons battu un record à l’hôpital Robert-Debré, avec 405 patients admis un dimanche, alors que le maximum atteint les années précédentes excédait à peine les 300. Les capacités en lits de réanimation adultes n’ont jamais été dépassées puisque nous avons admis 193 patients, dont 54 enfants. Lorsque le seuil de 15 % de lits occupés a été atteint, durant la semaine 46, il a fallu ouvrir quatre lits supplémentaires, sans que nous fussions contraints de déprogrammer l’activité de manière massive. Nous en avons toutefois déduit que le nombre de lits de réanimation pédiatrique était sans doute trop faible dans la région parisienne, sachant que l’AP-HP y concentre 70 % des lits de réanimation pédiatrique.
Par l’intermédiaire de l’Agence générale des équipements et produits de santé, l’AGEPS, ex-Pharmacie centrale, nous avons approvisionné en antiviraux – Tamiflu et Relenza – les hôpitaux de l’AP-HP mais aussi ceux des quatre autres départements ne dépendant pas des SAMU de l’AP-HP. Nous avons aussi servi d’interface entre l’ÉPRUS, l’Établissement de préparation et de réponse aux urgences sanitaires, et le SAMU d’Île-de-France.
À partir de mi-octobre, nous avons distribué 157 000 doses de vaccins contre la grippe A et les dispositifs médicaux stériles associés, d’abord à nos hôpitaux puis aux hôpitaux sièges de SAMU extérieurs à l’AP-HP, qui servaient de relais avec les hôpitaux de leur département. Nous avons reçu 3,1 millions de masques de protection respiratoire FFP2, que nous conservons, et 7 millions de masques chirurgicaux, stock dans lequel nous puisons et que nous renouvelons afin d’éviter la péremption.
L’AP-HP s’est également mobilisée dans le cadre des campagnes de vaccination.
Nous avons d’abord obtenu de pouvoir vacciner notre personnel contre la grippe saisonnière dès la réception des vaccins, le 10 septembre, alors que, d’habitude, la médecine de ville vaccine avant nous. L’effet H1N1 a d’ailleurs accru le taux de vaccination du personnel, qui est resté néanmoins trop faible. Un délai de trois semaines étant requis entre les deux vaccins, nous avons pu attaquer la campagne H1N1 le 20 octobre. Au final, 30 % des personnels non soignants – administratifs, logistiques et de service – ont été vaccinés contre la grippe H1N1, soit un peu moins de 30 000 personnes, de même que 65 % des médecins ; les personnels infirmiers, en revanche, se sont peu fait vacciner.
M. le président Jean-Christophe Lagarde. Disposez-vous des données pour la grippe saisonnière ?
M. Benoît Leclercq. Cette année, nous sommes arrivés à 28 %, contre 20 % les années précédentes.
Nous avons aussi vacciné dans nos locaux 14 000 malades atteints d’affections chroniques, 4 800 membres des familles de notre personnel, 1 600 libéraux et, accessoirement, 500 personnes allergiques à l’œuf.
Par ailleurs, l’AP-HP a été très fortement sollicitée pour la campagne de vaccination organisée par l’État. Nous avons équipé en logistique les centres de vaccination aménagés dans les communes, notamment en achetant la plupart des réfrigérateurs. Nous avons procédé à des détachements massifs d’internes en médecine et d’étudiants en soins infirmiers mais aussi de personnels seniors volontaires.
L’organisation de la mobilisation a été tributaire, selon nous, des difficultés de planification et de régulation des opérations parfois rencontrées par les DDASS, les directions départementales des affaires sanitaires et sociales, en particulier lors de l’extension de l’amplitude du dispositif. Pour être plus précis, il est arrivé que nous ayons mobilisé des moyens ne pouvant être utilisés, dans la mesure où les centres n’étaient pas ouverts, pour des raisons nous échappant.
Le nombre d’internes mis à disposition a varié de 5 par jour à 220 par jour – durant la période la plus difficile, en gros jusqu’à Noël –, plus 1 600 étudiants en institut de formation en soins infirmiers, 225 cadres de santé et quelques volontaires.
Les dépenses spécifiques engagées par l’AP-HP ont été compensées : nous avons reçu 1 million d’euros, en sus de la tarification à l’activité, au titre des missions d’intérêt général – sachant que l’enveloppe nationale s’élevait à 10 millions d’euros et que nous représentons environ 10 % de l’hospitalisation –, soit approximativement le coût que nous avions engagé. Si vous le souhaitez, je vous communiquerai le détail. Cette somme nous semble couvrir notamment les frais supportés par les laboratoires et le manque à gagner lié au blocage de lits dans les services de maladies infectieuses pour attendre des patients éventuels. Nous avons en outre versé des indemnités au personnel, à hauteur d’1,5 million d’euros, enveloppe qui sera remboursée par l’assurance maladie.
M. Bernard Debré. Ce compte rendu correspond à ce que beaucoup d’entre nous avons vécu à l’AP-HP. Nous avons beaucoup mobilisé les internes pour vacciner à l’extérieur, au point que nous avons parfois été forcés de déprogrammer, même si cela ne nous avait pas été demandé.
Sur quels critères les internes ont-ils été réquisitionnés ? Les avez-vous fixés vous-mêmes ? Sinon, avez-vous été consulté ? Avez-vous reçu une demande chiffrée que vous avez ensuite ventilée ?
Beaucoup de ces internes ont été envoyés très loin, à trente ou quarante kilomètres, alors qu’ils ne possédaient pas nécessairement de voiture. Ont-ils été indemnisés, en particulier de leurs frais kilométriques ?
Les hôpitaux ont aussi beaucoup vacciné, vous avez donné les chiffres. Quand un flacon de dix doses était ouvert, dix médecins ou membres du personnel étaient-ils automatiquement vaccinés ? Il est revenu à mes oreilles – j’ai même cru le voir – qu’une, deux, trois ou quatre doses sur dix pouvaient être utilisées et que le reste était jeté.
M. Benoît Leclercq. Sur instruction ministérielle, nous avons exclu tous les internes des services d’urgence, de réanimation et de pédiatrie, quelle que soit la discipline pédiatrique. Ensuite, nous avons évidemment mobilisé les internes les moins proches des patients, c’est-à-dire ceux exerçant en santé publique ou en biologie médicale, ce qui ne constitue aucunement un jugement de valeur. Ensuite, nous avons pris les listes et sollicité les gens. Du reste, compte tenu du taux d’indemnisation annoncé, il n’y a pas eu de problème de choix. Les premiers critères ont donc été définis par les autorités ministérielles, après quoi la direction générale a procédé à une sélection, par le biais des directeurs des affaires médicales de chaque établissement, qui ont pris contact avec les chefs de service ou, dans un certain nombre de cas, le syndicat des internes, largement autogéré.
M. le président Jean-Christophe Lagarde. Contrairement aux médecins libéraux, l’AP-HP a donc été consultée pour organiser la réquisition et orienter le choix vers tel ou tel interne ou infirmière.
M. Benoît Leclercq. Absolument ! Tout comme nous avons décidé que tous les étudiants de troisième année des instituts de formation en soins infirmiers iraient vacciner. Nous avons demandé à opérer nous-mêmes le tri car il n’aurait pas été forcément adapté qu’il soit fait par les DDASS, les cellules opérationnelles ou les préfets.
Mme Catherine Génisson. La réquisition a-t-elle été arbitraire ou opérée en concertation avec les chefs de pôle et les chefs de service, sur lesquels repose l’activité habituelle de l’hôpital ?
M. Benoît Leclercq. Nous étions sollicités quotidiennement par les préfectures pour envoyer un nombre donné d’internes et il fallait répondre sous vingt-quatre ou quarante-huit heures. Nous n’avons donc pas toujours été consultés.
Mme Catherine Génisson. Seulement vingt-quatre heures !
M. Benoît Leclercq. Parfois quarante-huit heures. Sur la fin, le délai atteignait parfois une semaine, cela dépendait des jours.
M. le président Jean-Christophe Lagarde. Les évolutions ont sans doute été d’autant plus importantes que le volume horaire d’ouverture des centres, dans toutes les villes, était très variable.
M. Benoît Leclercq. Tous les internes ont été indemnisés pour leurs vacations et pour leurs déplacements : nous avons versé 1,133 million d’euros au titre des vacations et près de 10 000 euros de frais de déplacement.
Le Gouvernement nous a fourni des flacons de dix doses de vaccin…
M. Jean Mallot. Ce sont les laboratoires qui vous les ont fournis !
M. Benoît Leclercq. Ma tutelle, c’est le Gouvernement. Je répète que le Gouvernement nous a fourni des flacons de dix doses. Dans les centres de vaccination, on vaccinait par dizaines ; à l’hôpital, en revanche, il est évidemment arrivé que la totalité d’un flacon ne soit pas utilisée.
M. Bernard Debré. Et le reste était jeté ?
M. Benoît Leclercq. Oui.
M. Bernard Debré. N’a-t-on jamais jeté de flacons pleins ?
M. Benoît Leclercq. Bien sûr que non !
M. Guy Lefrand. Votre plan contre la grippe aviaire et votre Plan blanc ont-ils pu être réutilisés tels quels ou a-t-il fallu les adapter ? En d’autres termes, ces plans se sont-ils avérés efficients ?
Quel a été le degré de coordination avec le ministère et quel rôle l’ARH, l’agence régionale d’hospitalisation, a-t-elle joué dans l’organisation et la planification ?
Vous avez évoqué des difficultés de planification du côté des DDASS.
Sous-entendez-vous que celles-ci ont insuffisamment utilisé vos potentialités internes ou ont tardé à les utiliser ?
Une bonne partie du personnel soignant n’a pas été vaccinée. Cela a-t-il tenu à des problèmes de communication ? Sinon, qu’est-ce qui a poussé autant d’infirmiers à ne pas se faire vacciner ?
M. Benoît Leclercq. Les plans précédents se sont avérés très efficients, les adaptations n’ayant été que marginales. Toutes les cellules ont pu être mobilisées et les référents étaient prêts : en moins de quarante-huit heures, le dispositif était opérationnel. Si une épidémie de grippe particulière ne se produit pas tous les deux ans, il importe que nous organisions des exercices d’envergure tous les deux ans afin que les gens restent mobilisés.
La coordination avec le ministère était quotidienne, d’abord parce que le siège de l’AP-HP est situé à Paris. J’étais informé au jour le jour du nombre d’admissions, de consultations, de patients en réanimation pédiatrique et adulte, qui étaient communiqués au ministère via le réseau CORRUSS, et j’échangeais avec les directeurs de cabinet de l’époque, qui souhaitaient être informés « en direct ». La coordination politique, si je puis dire, était assurée à mon niveau et la cellule de crise « grippe » de l’AP-HP correspondait quotidiennement, voire deux fois par jour, avec les référents du ministère.
Je ne me souviens pas que l’ARH participait au dispositif mais je ne suis pas catégorique car j’étais un peu loin du terrain.
Concernant les DDASS, je n’ai pas voulu dire que je disposais de potentialités internes sous-utilisées. Le problème, c’est quand on me demandait deux internes pour les envoyer à Évry, qu’un véhicule de la préfecture les prenait en charge et qu’ils arrivaient dans un bourg où le centre de vaccination n’était pas ouvert. Faire partir ainsi deux jeunes qui auraient pu servir dans un service hospitalier traduisait un relatif manque de coordination et ne contribuait pas à la mobilisation générale. C’est en ce sens que des potentialités internes, mises à disposition, n’ont pas été utilisées. Mais nous ne disposions pas de potentialités supplémentaires ; certes, nous n’avons pas déprogrammé, mais certains services ont admis moins de malades durant cette période.
M. le président Jean-Christophe Lagarde. Quand vous mobilisiez des moyens, c’était en réponse aux préfectures qui vous les avaient demandés.
M. Benoît Leclercq. Oui, systématiquement.
M. le président Jean-Christophe Lagarde. Et pourtant, les centres auxquels ils étaient destinés n’étaient pas toujours ouverts.
M. Benoît Leclercq. Soit le centre n’était pas ouvert, soit il n’y avait pas d’infirmière, soit les vaccins n’étaient pas arrivés.
M. Bernard Debré. Soit il n’y avait pas de candidats à la vaccination ! Il est arrivé que cinq internes soient envoyés dans un centre où il n’y avait aucun patient à vacciner ! Et il leur a été interdit de partir !
M. Benoît Leclercq. J’ai lu les journaux, comme vous, mais, ayant juré de dire la vérité, je ne parlerai que de ce que j’ai vu, fait ou dit.
Quitte à passer pour immodeste, je ne pense pas que le faible taux de personnel infirmier vacciné soit imputable à un problème de communication. Nous avons mené une campagne de communication intense, nous avons distribué à l’ensemble de nos personnels un petit fascicule en trois volets, nous nous sommes appuyés sur différents vecteurs, mais un syndicat d’infirmiers s’est livré à une contre-campagne interne qui a manifestement beaucoup plus porté que nos messages : sur internet, j’ai lu des posts ahurissants, véhiculant des appels à ne pas se faire vacciner.
M. le président Jean-Christophe Lagarde. De quel syndicat s’agit-il ?
M. Benoît Leclercq. Je n’ai pas son nom en tête mais je vous le communiquerai ; son responsable se nomme M. Lamouroux.
M. le président Jean-Christophe Lagarde. Son argumentation était-elle scientifique ou sociale ?
M. Benoît Leclercq. Il s’agissait de messages du type : « rien n’est prouvé », « cela ne sert à rien » ou « cela peut être dangereux ».
M. le président Jean-Christophe Lagarde. Les arguments invoqués étaient donc de nature scientifique, ils ne tenaient pas aux relations sociales internes à l’entreprise.
M. Benoît Leclercq. Non, ils ne visaient pas la direction générale.
M. le président Jean-Christophe Lagarde. Cela a dû vous changer !
M. Benoît Leclercq. Je ne vous le fais pas dire…
Il faudra donc sans doute que nous nous adaptions et que nous diffusions sur internet des conseils en faveur de la vaccination. Nous ne cessions d’expliquer qu’il était plus risqué d’être victime des effets liés au vaccin en attrapant la grippe qu’en se faisant vacciner ; apparemment, cela n’a pas porté.
M. le président Jean-Christophe Lagarde. Cependant, davantage de monde s’est fait vacciner contre la grippe H1N1 que contre la grippe saisonnière : 30 000 agents dans le premier cas, 28 % dans le second cas, soit environ 25 000 agents.
M. Benoît Leclercq. Le bouche à oreille a aussi fonctionné : je me vois encore persuader mes secrétaires de se faire vacciner, alors qu’elles refusaient d’y aller après avoir lu des messages négatifs.
M. Bernard Debré. Le taux de 28 % pour ce qui concerne la grippe saisonnière est déjà faible, il traduit une réticence inhérente au corps médical, que nous avons essayé de contrecarrer. Par contre, 65 % des médecins se sont fait vacciner.
M. Benoît Leclercq. En effet, nous avons été très heureux que deux tiers des médecins se soient protégés ; la proportion est encourageante en vue des pandémies.
M. Jean-Pierre Door, rapporteur de la commission d’enquête. Le nombre de personnels atteints par le virus H1N1 a-t-il été important, au point de désorganiser certains services ?
Des services vous ont-ils signalé une quelconque désorganisation ?
Disposez-vous d’un référent chargé de la grippe H1N1 dans chaque hôpital ? Des réunions d’information sont-elles organisées régulièrement à destination du personnel ?
M. Benoît Leclercq. Dans la mesure où la grippe H1N1 a touché le personnel hospitalier dans les mêmes proportions que la population générale, la désorganisation a été limitée. Un seul cas s’est produit, aux urgences du Kremlin-Bicêtre, où un interne, porteur des symptômes, a contaminé sept personnes du service. Cela nous a posé des difficultés particulières pendant quelques jours mais nous y avons paré en vingt-quatre heures. Ce cas
– auquel l’inconscience de certains personnels n’est vraisemblablement pas étrangère – a toutefois mis en évidence la fragilité du système.
Nous disposons d’un référent grippe par service. Ces référents sont réunis régulièrement pour entendre des exposés des infectiologues de la maison, MM. Bricaire, Vittecoq ou Delfraissy, ainsi que des spécialistes en épidémiologie travaillant à la direction de la politique médicale, les docteurs Fournier ou Brun-Ney. C’est ainsi que nous entretenons un réseau de déploiement rapide très efficace. Quand nous appuyons sur un bouton dans les bureaux de l’avenue Victoria, il faut qu’une sonnerie retentisse tant à l’hôpital Cochin qu’à l’hôpital René-Muret-Bigottini de Sevran.
M. le rapporteur. Le million d’euros a-t-il bien été versé dans l’enveloppe MIG
– missions d’intérêt général –, en supplément ?
M. Benoît Leclercq. Absolument, sur la ligne budgétaire H1N1.
Mme Catherine Génisson. Pouvez-vous confirmer que vous n’avez procédé à aucune déprogrammation d’activité ?
M. Benoît Leclercq. La direction générale n’a demandé aucune déprogrammation.
Mme Catherine Génisson. Que signifie la nuance ?
M. Benoît Leclercq. Comme l’a indiqué le professeur Debré, dans un service où deux internes étaient prélevés pour aller vacciner en ville, il est possible que le chirurgien ou le médecin ait été amené à réduire le nombre d’admissions du jour.
Mme Catherine Génisson. Il y a donc eu des déprogrammations.
M. Bernard Debré. Très peu.
M. Benoît Leclercq. Mobiliser 220 internes sur un total de 2 000, cela ne peut pas provoquer de catastrophe nationale.
M. le président Jean-Christophe Lagarde. D’autant que les 220 n’ont jamais été mobilisés d’un coup.
M. Benoît Leclercq. Si : cet effectif était mobilisé quotidiennement.
M. le rapporteur. Dans quel périmètre vos internes étaient-ils envoyés ?
M. Benoît Leclercq. L’Île-de-France.
M. le rapporteur. Dans tout le bassin parisien ? Jusqu’à l’Essonne, la
Seine-et-Marne ?
M. Benoît Leclercq. Absolument.
M. le rapporteur. Nous sommes maintenant en avril. Avez-vous déjà reçu une évaluation émanant des internes et des élèves infirmiers, faisant état de leur ressenti ? Êtes-vous en mesure de procéder à cette évaluation ? Sera-t-elle effectuée ? Vous l’a-t-on proposé ?
M. Benoît Leclercq. À chaud, nous avons pu évaluer que les internes, les élèves infirmiers ou les monitrices appelés à courir dans les centres de vaccination faisaient montre d’une certaine irritation. Cela dit, tous les personnels sollicités ont répondu présent. Aucun n’a refusé d’y aller. J’ai seulement dû régler quelques petits problèmes de cadrage, au début de l’opération. Le syndicat des internes m’a ainsi demandé de signaler à Mme la préfète Martine Monteil, secrétaire générale de la zone de défense, qu’aller quérir un interne par l’intermédiaire d’un motard de la gendarmerie n’était pas forcément idéal pour mobiliser les personnels médicaux. J’ai appris à connaître l’ensemble des préfets de la région et je leur ai suggéré qu’ils recourent moins aux motards et que nous organisions mieux nos plannings, un peu à l’avance.
Nous aurions préféré que l’on nous indique les besoins et que l’on nous laisse remplir les cases, comme cela a été fait au milieu de la période. Je pense aussi que tout aurait pu être organisé différemment, mais c’est un autre problème…
M. le président Jean-Christophe Lagarde. Dites-nous donc !
M. Benoît Leclercq. La vaccination du public aurait pu être organisée dans les hôpitaux, qui savent gérer des files d’attente et des prises de rendez-vous.
M. le président Jean-Christophe Lagarde. Dans quels locaux ?
M. Benoît Leclercq. Nous avons bien trouvé la place pour organiser neuf ou dix consultations dédiées, qui n’existaient pas auparavant. Les plans blancs ont précisément pour objet de modifier l’affectation de tel ou tel local. Un centre de vaccination n’est pas un équipement aussi complexe qu’un hôpital, ce n’est qu’une pièce propre pourvue d’un lavabo et d’un réfrigérateur acheté par l’AP-HP, avec une salle d’attente, une salle d’interrogatoire pour le médecin et une salle de vaccination.
M. le président Jean-Christophe Lagarde. Avez-vous une idée du nombre de personnes qui ont été vaccinées dans le périmètre géographique couvert par l’AP-HP ?
M. Benoît Leclercq. Non, aucune, je le reconnais.
M. le président Jean-Christophe Lagarde. Le centre de vaccination installé dans ma ville, armé pour partie par l’hôpital Avicenne et qui couvrait trois communes, n’a accueilli que 5 000 personnes en deux mois, dont 3 000 en trois semaines. Avicenne aurait été capable de s’en occuper. Votre proposition me semble donc intéressante.
M. Benoît Leclercq. Nos soignants ont l’habitude de s’organiser pour ce genre de choses : ils savent comment manipuler un flacon, ils savent qu’il faut enfiler des gants. Or, d’après ce qui m’a été rapporté, ce b.a-ba n’a pas toujours été respecté dans les centres de vaccination. J’ajoute que le personnel d’État fourni pour des tâches administratives, en provenance notamment des préfectures, aurait pu venir à l’hôpital ; pour notre part, nous disposions de la force vive médicale puisque c’est nous qui l’avons mise à disposition de la ville.
M. Bernard Debré. Puisqu’il suffisait d’une pièce, d’un réfrigérateur et du matériel de vaccination, le médecin généraliste aurait parfaitement pu s’en occuper. Or, ce ne sont ni les hôpitaux ni les médecins généralistes qui ont été utilisés. Voilà le sujet auquel il convient de réfléchir.
M. le président Jean-Christophe Lagarde. Je partage assez cet avis. J’ai cru comprendre que les gens ne défilaient pas à l’AP-HP pour se faire vacciner et que des flacons y ont été jetés sans que toutes les doses aient été utilisées. Or n’importe quel médecin de ville aurait été capable de regrouper ses patients par sept, huit ou neuf afin d’éviter de gâcher des doses.
M. le rapporteur. Une fois les centres fermés, avez-vous récupéré les réfrigérateurs et autres matériels ?
M. Benoît Leclercq. J’avoue ne pas m’être posé la question.
M. le président Jean-Christophe Lagarde. Pas la peine de venir chercher celui de Drancy car c’est ma commue qui l’a payé !
M. Benoît Leclercq. Rassurez-vous, nous ne récupérerons que ceux que nous avons achetés !
M. le président Jean-Christophe Lagarde. Je me demande bien où l’AP-HP a pu acheter des réfrigérateurs. À Drancy, c’est la commune qui a dû le fournir. Quand la préfecture m’a sollicité, je lui ai proposé de mettre à disposition un centre médico-sportif, équipé notamment de cabinets de consultation, mais elle m’a répondu que nous risquions d’être submergés par l’affluence et qu’elle réquisitionnait un gymnase. Nous avons donc bloqué un gymnase pendant quatre mois, avec trois médecins, quatre infirmières, quatre agents de l’État et quatre agents de la ville, pour ne finalement vacciner que cinquante personnes par jour. Peut-être une simple salle suffisait-elle, en tout cas l’État a demandé beaucoup plus !
Un certain nombre d’infirmières de troisième année, décisive dans leur cursus, semblent avoir été réquisitionnées longtemps, ce qui leur a sans doute posé des problèmes en fin d’année. Comment avez-vous prévu de résoudre ce problème ?
La Réunion et la Nouvelle-Calédonie, par exemple, ont souffert d’un déficit en appareils de respiration externe. Est-il arrivé un moment où les capacités en locaux et en équipements de l’AP-HP ont été dépassées ? Cela aurait-il pu se produire si la pandémie avait été significative ? Quel a été le nombre maximum de patients atteints par la grippe H1N1 que vous avez accueillis en soins intensifs et en réanimation ?
M. Benoît Leclercq. La direction générale de la santé – la DGS – et la ministre de la santé nous ont garanti que l’examen de fin d’année des élèves infirmiers ne serait pas perturbé. Pour être plus précis, s’il devait arriver qu’un élève rate son examen, ce ne serait pas à cause de ça.
M. le président Jean-Christophe Lagarde. Il se trouve qu’une école d’infirmières est implantée dans ma circonscription et que certaines des élèves ont manqué trois semaines à un mois de cours, censés nécessaires pour préparer leur examen. La DGS a-t-elle bien assuré qu’elle en tiendrait compte ?
M. Benoît Leclercq. Le ministère nous a dit que ce n’était pas un sujet, qu’il n’y aurait pas de perturbation aux examens. Le nombre de reçus n’a jamais été aussi élevé…
Mme Catherine Génisson. Tout le monde est reçu !
M. Bernard Debré. CQFD !
M. Benoît Leclercq. Nous n’avons jamais atteint les limites de capacités en lits ni en respirateurs. Nous avons parfois frôlé la limite pour les matériels de circulation extracorporelle, sachant que l’indication se discutait parfois. Bref, globalement, nous n’avons pas rencontré de difficultés de ce point de vue.
Le nombre de patients hospitalisés dans les services de maladies infectieuses a dû monter jusqu’à 400, je vous communiquerai le chiffre exact. En réanimation, nous sommes grimpés à une centaine de patients.
M. le président Jean-Christophe Lagarde. Jusqu’à combien de patients auriez-vous pu tenir ?
M. Benoît Leclercq. Un millier environ.
M. Bernard Debré. Il convient de faire attention aux chiffres : l’ensemble des 400 patients hospitalisés n’étaient pas dans une situation grave ; seuls une centaine d’entre eux ont été admis en réanimation, parmi lesquels un certain nombre ont été surtraités, avec des matériels inappropriés.
M. Jean Mallot. Si j’ai bien compris, les lieux d’implantation des centres de vaccination ont été choisis par les préfets. Je ne partage pas l’argument des flacons multidoses pour justifier la mise à l’écart des généralistes et cet argument, en tout cas, ne vaut pas pour les hôpitaux. À l’époque, avez-vous proposé que l’AP-HP héberge des centres de vaccination ? Si oui, a-t-elle été écartée ? Pour quels motifs ?
M. le président Jean-Christophe Lagarde. Avez-vous, vous, formulé cette proposition ?
M. Benoît Leclercq. Non, même si, en réunion, je grommelais souvent et réclamais que l’on nous laisse faire. Il est plus compliqué d’envoyer des internes à Évry que d’organiser les vaccinations nous-mêmes, quitte à se coordonner avec les collègues d’Evry pour voir comment organiser la vaccination chez eux. Je dois néanmoins reconnaître que je n’ai pas formulé cette proposition et que l’idée s’est imposée au fil du déroulement de l’opération.
M. le président Jean-Christophe Lagarde. Nous ne faisons que nous interroger. Nous ne vous faisons porter aucune responsabilité.
M. Benoît Leclercq. Mais je ne me défile pas !
M. le président Jean-Christophe Lagarde. Les préfets n’ont pas choisi les centres de vaccination – les choses, en tout cas, se sont passées ainsi pour les centres que je connais le mieux – mais ont demandé aux maires si ceux-ci pouvaient l’organiser dans tel ou tel local. Pour la région parisienne, seule la direction générale de l’AP-HP aurait pu se proposer ; en province, en revanche, où les maires président le conseil d’administration des hôpitaux, peut-être auraient-ils pu prendre l’initiative. Nous pourrons interroger la Fédération hospitalière de France à ce propos.
Monsieur le directeur général, je vous remercie.
La séance est levée à dix-huit heures.
Audition de Mme Annie Podeur,
directrice générale de l’offre de soins au ministère de la santé et des sports
(Procès-verbal de la séance du mercredi 7 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures.
(Mme Annie Podeur prête serment.)
Mme Annie Podeur, directrice générale de l’offre de soins. Dans la gestion de la pandémie grippale, la DHOS, direction de l’hospitalisation et de l’organisation des soins, devenue depuis la DGOS, direction générale de l’offre de soins, est intervenue en appui du cabinet, comme il est normal pour une direction d’administration centrale, mais aussi de la DGS, la direction générale de la santé, qui était la direction pilote. Ma direction s’est occupée de tout ce qui concernait d’une part la préparation à la pandémie et l’organisation de la vaccination dans les établissements de santé, d’autre part la mobilisation des professionnels de santé, dont la gestion relève d’elle.
La DHOS, avant la création de la DGOS, était chargée de l’organisation de l’offre de soins, et dans ce cadre, de « définir les mesures d’organisation applicables aux activités de soins des établissements de santé, d’orienter et d’animer les politiques de ressources humaines des établissements publics de santé, médicaux et médico-sociaux ». Elle était enfin, et c’est là toute la différence avec le paysage actuel, consécutif à la mise en place des agences régionales de santé (ARS), chargée « d’animer, de coordonner et de contrôler l’activité des agences régionales de l’hospitalisation (ARH) ».
La DHOS, à laquelle a donc succédé la DGOS, n’était plus depuis 2007 chargée directement de la gestion des crises, alors qu’elle le fut à une époque. De 2002 à 2007, il existait en son sein une cellule de gestion des risques chargée de la gestion opérationnelle des crises et, en amont, des alertes. La DHOS était aussi chargée de l’organisation territoriale et de l’organisation des établissements de santé en situation de crise. C’est la DHOS, dont je n’étais pas alors directrice, qui élaborait les plans blancs, les plans blancs élargis, les plans de préparation à une pandémie grippale – à l’époque n’existait pas l’ÉPRUS, l’Établissement de préparation et de réponse aux urgences sanitaires. La DHOS avait également pour tâche, conjointement avec la DGS qui les organisait, de l’évaluation des retours d’expérience sur la gestion de crise. Enfin, la DHOS avait élaboré différents supports de communication. Un décret du 13 mai 2007 a confié à la DGS l’ensemble des alertes. C’est elle qui, en liaison avec les autres ministères et institutions concernés, assure la gestion des situations d’urgence sanitaires. C’est elle qui prépare les réponses aux risques sanitaires liés à des événements naturels, des épidémies – cela a été le cas pour la pandémie grippale H1N1 –, des accidents technologiques ou des actes de terrorisme. Il faut ici rappeler que dès avant 2007, la DGS a toujours été chargée de la politique de prévention et de gestion des risques infectieux, notamment de la politique vaccinale.
Il me paraissait important de rappeler ce cadre institutionnel et de souligner la clarification des compétences intervenue entre nos deux directions.
Pour autant, comme il est d’usage et de bonne pratique, il était normal que toutes les directions d’administration centrale se mobilisent autour du cabinet et aident la DGS. Pour la gestion de la pandémie grippale, j’ai mis en place au sein de ma direction une organisation ad hoc légère, puisqu’il ne s’agissait que d’apporter un appui. J’ai désigné un référent grippe, Marie-Ange Desailly-Chanson, conseiller médical, aujourd’hui présente à mes côtés, référent bien identifié, et pour le cabinet et pour la DGS. J’ai aussi réuni chaque semaine, et plus souvent si nécessaire, par exemple lorsque nous préparions une instruction, le deuxième conseiller médical, le conseiller technique, le chargé de communication et un correspondant par sous-direction afin de pouvoir répondre rapidement à toutes les questions.
Cette cellule est intervenue en appui du référent grippe et nous avons toujours veillé à la qualité de la communication, ascendante et descendante, de façon à être très opérationnels. Par ailleurs, répondant à une demande à la fois de la DGS et du cabinet, comme étaient alors affectés à ma direction les conseillers généraux des établissements de santé, j’en ai mis cinq à disposition de la DGS, mobilisables en priorité pour la gestion de la pandémie, jusqu’à ce que celle-ci retombe au niveau IV. Disponibles, ces conseillers ont été plus ou moins mobilisés durant la période. Enfin, j’ai veillé à ce que dans les ARH, dont j’avais alors la responsabilité, soit également désigné un référent grippe bien identifié, nous servant de relais d’information. Nous avons toujours répondu très rapidement à leurs questions par l’intermédiaire de notre référent grippe et leur avons toujours adressé très vite les instructions, afin d’éviter tout retard dans leur application.
Nous avons eu deux axes principaux de travail. Le premier a été de préparer les établissements à la prise en charge des victimes de la pandémie : nous avons commencé à y travailler dès le printemps dernier, en juin de façon très opérationnelle. Le deuxième a été de préparer la vaccination des personnels des établissements de santé. De par nos compétences, notre rôle se bornait là.
Pour ce qui est de la préparation des établissements, j’ai signé deux instructions essentielles, le 6 août 2009 et le 24 septembre 2009, en veillant chaque fois à les rédiger de manière concise et précise de façon qu’elles apportent des réponses sans ambiguïté aux établissements. Celle du 24 septembre concerne notamment la déprogrammation des activités pour faire face à un afflux éventuel de victimes de la pandémie.
Nous avons été très vigilants sur plusieurs points. Tout d’abord, nous avons fait en sorte que les centres 15 puissent faire face à un afflux d’appels. Nous savions que, dans leur grande majorité, ils étaient capables d’absorber un doublement des appels. En nous fondant sur ce qui avait été vécu dans l’hémisphère Sud et en tirant les leçons de la saturation survenue en Grande-Bretagne suite à l’afflux d’appels à la fin de l’été 2009, nous avons renforcé leurs équipements techniques et leurs moyens en personnels pour qu’ils puissent répondre à un triplement. Il faut ici préciser que le plan urgences mis en place de 2005 à 2008 avait déjà considérablement augmenté leurs moyens en personnel médical et que le nombre de permanenciers avait également été renforcé en 2007-2008. Nous sommes allés plus loin en demandant que des locaux soient adaptés avec des postes supplémentaires de réception des appels et que des personnels soient formés pour intervenir transitoirement en cas de besoin.
Nous nous sommes ensuite assurés que les plans blancs des établissements de santé étaient parfaitement opérationnels – ce qui suppose qu’ils soient régulièrement actualisés et donnent lieu à des exercices suffisants –, et permettaient d’établir une déprogrammation intelligente d’activité, sans mettre à mal la capacité des établissements à répondre aux besoins sanitaires non liés à la pandémie grippale. Nous avons également vérifié que l’annexe biologique ad hoc « pandémie grippale » qui figure dans chaque plan blanc était bien à jour. Enfin nous avons veillé, comme cela était clairement demandé dans l’instruction du 6 août, à ce qu’il y ait un référent grippe, clairement identifié, assurant le lien à la fois avec l’ARH et avec nous, de façon là encore, à faciliter la circulation de l’information, du bas vers le haut et du haut vers le bas.
Le dernier point auquel nous avons prêté une attention particulière, non des moindres, avait trait aux capacités de réanimation, compte tenu des syndromes de détresse respiratoire observés chez certains patients. Dès juin 2009, nous avions mené une enquête pour recenser l’ensemble des respirateurs, en sus des équipements des salles de réanimation. Nous avons renforcé les possibilités de prise en charge en commandant, de manière exceptionnelle, cent respirateurs de haut niveau et trente-quatre dispositifs ECMO qui, judicieusement répartis par zone de défense, devaient permettre de faire face à une augmentation brutale des besoins qui pouvaient être importants compte tenu du tableau clinique de cette pandémie.
J’en viens à la préparation de la vaccination des personnels hospitaliers. L’instruction essentielle sur le sujet date elle aussi du 24 septembre 2009 – pour lever toute ambiguïté, il y a bien deux instructions datées du 24 septembre, l’une relative à la déprogrammation d’activité, l’autre à la vaccination des personnels. Cette instruction permettait d’identifier, au vu des priorités arrêtées et validées par le Premier ministre, les personnels à vacciner en priorité et les modalités de traçabilité de leur prise en charge. Dès le début, nous avons insisté sur la nécessité d’une information parfaitement transparente. Convaincus que la réfutation de certains arguments qui circulaient alors sur internet et la mobilisation des personnels passaient par la parole du corps médical, nous avons toujours renvoyé les établissements vers des sites où ils pouvaient trouver une information complète et fiable. Nous pensions que c’était les médecins qui pouvaient, dans les établissements, faire prendre conscience aux autres personnels soignants de l’intérêt de la vaccination – laquelle est toujours restée un acte volontaire – et amener à ce qu’un maximum d’entre eux se fasse vacciner.
Nous avons par ailleurs, à titre accessoire, en appui à la DGS, apporté notre expertise de terrain. C’est à ce titre que nous avons participé à la cellule de crise à partir du 27 avril 2009. C’est le plus souvent notre référent grippe, Marie-Ange Desailly-Chanson, qui a assisté à ces réunions. Je me suis astreinte à assister personnellement à la réunion hebdomadaire organisée sous la présidence du directeur de cabinet de juin à octobre 2009. À partir d’octobre, nous avons travaillé de manière plus restreinte au niveau du cabinet avec le directeur général de la santé, en apportant notre expertise sur la manière de mobiliser les personnels des établissements de santé pour qu’ils se fassent vacciner et les internes, les externes et les élèves infirmiers pour qu’ils participent à la vaccination. Ma direction, compte tenu de ses responsabilités en matière de formation des personnels médicaux et paramédicaux, est sans doute celle qui était le mieux à même de le faire. Enfin, j’ai moi-même organisé des conférences téléphoniques avec les établissements, notamment pour nous assurer lors de la préparation des instructions, que nous voulions précises et concises pour qu’elles soient immédiatement opérationnelles, que leurs dispositions étaient parfaitement intelligibles, sans ambiguïté et répondaient aux interrogations des établissements.
J’ai également participé, en appui, aux conférences de presse et à la validation de certains documents. Enfin, nous avons été, comme se doit de l’être une administration centrale, à l’écoute des signaux transmis par nos interlocuteurs hospitaliers habituels mais aussi par des organisations syndicales de médecins libéraux, et les avons répercutés.
M. le président Jean-Christophe Lagarde. Je vous remercie, madame la directrice, et laisse la parole à notre rapporteur.
M. Jean-Pierre Door, rapporteur. Le directeur de l’AP-HP, que nous avons auditionné avant vous, nous a indiqué qu’environ 30 % des personnels non soignants et 60 % des médecins de l’AP-HP s’étaient fait vacciner. Pourriez-vous nous communiquer les chiffres au niveau national ? Il nous a également indiqué le montant des dépenses spécifiques engagées par l’AP-HP et compensées au titre des missions d’intérêt général. Quel est ce montant au niveau national ?
Il semble qu’à l’AP-HP, internes et élèves infirmiers aient été envoyés vacciner un peu partout, parfois très loin de chez eux. Dans ma petite ville, ce sont les élèves de l’Institut de formation en soins infirmiers qu’on a envoyés dans le centre de vaccination qui n’était pas loin. Mais comment cela s’est-il passé dans les autres villes de France ? Avez-vous eu des remontées de terrain négatives ? En effet, ce qui nous intéresse aujourd’hui, ce sont plus les aspects négatifs que les aspects positifs, afin de faire mieux la prochaine fois.
M. le président Jean-Christophe Lagarde. Le positif nous intéresse aussi.
M. le rapporteur. Bien sûr.
Un autre question est de savoir si des centres de vaccination auraient pu être organisés dans les hôpitaux, du moins certains d’entre eux, à Paris ou en province.
Mme Annie Podeur. Pour estimer le nombre et la proportion de personnels hospitaliers vaccinés, nous disposons maintenant des remontées de la CNAMTS par le biais des coupons Ameli, outils de traçabilité.
M. le rapporteur. Les bons de vaccination ont-ils aussi été utilisés dans les hôpitaux ? Les personnels de santé ont en effet été vaccinés avant la population générale.
Mme Annie Podeur. Oui. Ils n’ont pas reçu de bon à domicile, mais celui-ci était tiré dans l’établissement au moment où ils se faisaient vacciner, rempli puis adressé à un centre de traitement.
Le pourcentage de personnels de santé vaccinés, médecins et non médecins, s’établit entre 37 % et 44 %. Pourquoi une fourchette ? On est sûr du chiffre de 37 % jusqu’au 3 décembre 2009, mais ensuite, dans la mesure où à partir de cette date la vaccination dans les établissements de santé a été ouverte à l’entourage des personnels, voire à des personnes extérieures, la borne haute de 44 % inclut aussi ces catégories-là.
Nous disposons par ailleurs de statistiques déclaratives fournies par les établissements eux-mêmes. On était ainsi à 44 % au CHU d’Angers, 43 % au CHU de Clermont-Ferrand, 31 % aux Hospices civils de Lyon, 30 % au CHU de Saint-Étienne, mais à 17 % seulement au CHR d’Orléans et 15 % au CHR de Metz.
M. le président Jean-Christophe Lagarde. Pourquoi a-t-on soudainement à compter du 3 décembre ouvert la vaccination dans les hôpitaux à des personnes extérieures ?
Mme Annie Podeur. C’est le cabinet qui en a fait le choix devant la saturation de certains centres de vaccination les derniers week-ends de novembre.
M. le président Jean-Christophe Lagarde. Les centres n’étaient plus saturés à cette date.
Mme Annie Podeur. Fin novembre, si.
M. Yves Bur. Est-il arrivé que les lieux de vaccination à l’hôpital soient saturés ?
Mme Annie Podeur. Non. C’est d’ailleurs pourquoi il était possible d’envisager leur ouverture à des personnes extérieures.
M. Bernard Debré. On n’a pas vacciné de personnes extérieures à l’hôpital.
Mme Annie Podeur. Si, dans quelques établissements, y compris de l’AP-HP, l’entourage des personnels de santé mais aussi d’autres populations ont pu se faire vacciner. Trois centres, je ne peux pas certifier ici ce nombre, ont été ouverts.
M. le président Jean-Christophe Lagarde. Et comment la population en a-t-elle été informée ?
Mme Podeur. Je pense qu’elle l’a été surtout par son entourage.
M. le président Jean-Christophe Lagarde. Voilà un ordre venu du cabinet du ministre, diffusé dans le monde hospitalier, transmis au reste de la population par le bouche à oreille selon qu’on avait ou non la chance de connaître des personnels hospitaliers, et ce pour éviter de prétendus embouteillages dans les centres de vaccination. Étrange…
Mme Annie Podeur. L’extension s’est faite le 3 décembre sur demande du cabinet, après que des établissements l’avaient informé que, leurs centres internes n’étant pas saturés, il leur était possible de vacciner d’autres personnes que celles de l’entourage des personnels. Dès que la vaccination a été ouverte à l’entourage, ce qui était une demande assez forte des personnels eux-mêmes, inévitablement des personnes qui passaient par là – des témoignages m’ont été rapportés en ce sens, à Lille par exemple – sont venues se faire vacciner sans bon, lequel était alors aussi tiré sur place.
M. le président Jean-Christophe Lagarde. La campagne de vaccination du personnel médical a commencé en octobre. Avez-vous eu connaissance à un moment donné de difficultés à vacciner les personnels des établissements hospitaliers d’octobre à décembre ?
Mme Annie Podeur. Non.
M. le président Jean-Christophe Lagarde. Des difficultés sont apparues, en novembre, une dizaine de jours après le début de la vaccination du public. Or, ce n’est que le 3 décembre que la vaccination a été ouverte plus largement dans les hôpitaux. J’y insiste parce que le directeur de l’AP-HP nous a dit tout à l’heure qu’il n’avait jamais proposé que la vaccination se fasse dans ses établissements, mais qu’il avait le sentiment que cela aurait été possible. Vous nous dites, vous, que cela s’est fait, sans que presque personne n’en soit informé. C’est un élément intéressant. Je rappelle que nous ne cherchons pas ici à épingler des responsables, mais à réfléchir aux moyens d’améliorer les choses une prochaine fois.
Mme Annie Podeur. Nous étions au stade d’une expérimentation, limitée à une quinzaine d’établissements, sur instruction du directeur de cabinet et sur message de ma part d’ailleurs. Le directeur de cabinet a signé lui-même une instruction le 7 janvier 2010 car on ne se trouvait là hors de mon champ de compétences, demandant à tous les établissements sièges de SAMU d’organiser en leur sein un centre de vaccination ouvert à la population.
M. le président Jean-Christophe Lagarde. Le 7 janvier, il n’y avait plus de problème puisque la vaccination a alors été ouverte aussi aux médecins libéraux.
M. Guy Lefrand. On s’est aperçu début décembre qu’il y avait des disponibilités dans les hôpitaux pour vacciner. L’idée d’utiliser les hôpitaux comme centres de vaccination a-t-elle été à un moment évoquée ? Si oui, pourquoi n’a-t-elle pas été retenue, sachant qu’in fine, cela s’est tout de même fait ? A posteriori, pensez-vous qu’on aurait dû exploiter cette possibilité ?
M. le rapporteur. Les centres de vaccination de ville ont été ouverts le 12 novembre. La première semaine, il n’y a pas eu grande affluence. Mais une mutation possible du virus en Norvège ayant été annoncée dans les médias le 24 novembre, dès le lendemain, se formaient des files d’attente…
Mme Annie Podeur. Tout à fait.
M. le rapporteur. … qui ont duré une semaine, jusqu’à ce qu’on apprenne que cette mutation était bénigne, après quoi le nombre des candidats à la vaccination a de nouveau chuté. N’y a-t-il pas une relation entre l’affluence qui a suivi l’annonce de cette mutation et l’ouverture plus large demandée dans les établissements de santé ?
Mme Annie Podeur. Je confirme que cette décision, prise à effet du 3 décembre, était liée à l’engorgement ponctuel constaté lors des derniers week-ends de novembre.
Mme Catherine Génisson. A-t-il été accepté d’emblée que l’entourage des personnels hospitaliers puisse se faire vacciner dans les hôpitaux ?
Le 3 décembre semble avoir été une date clé. Est-ce simplement parce qu’on s’est rendu compte que les hôpitaux pouvaient vacciner en nombre ou y a-t-on été poussé parce que les centres de vaccination de ville étaient surchargés ?
Mme Annie Podeur. La question est : a-t-on songé à un moment que la vaccination puisse être pratiquée dans les établissements hospitaliers, voire exclusivement dans les établissements hospitaliers ?
M. le président Jean-Christophe Lagarde. Pas nécessairement. Entre autres dans les établissements hospitaliers.
Mme Annie Podeur. Certains établissements, en nombre limité, possèdent des centres de vaccination qui fonctionnent de manière pérenne avec une organisation ad hoc.
Notre souci à nous, je l’ai dit, était de préparer les établissements à l’accueil des patients grippés et de préserver leur potentiel de personnels à cet effet. Nous ne souhaitions pas que l’on dérive trop vers l’organisation de vaccinations massives dans les établissements car les personnels n’auraient pas pu tout faire en même temps.
Toutes les instructions indiquaient qu’il fallait d’abord protéger les personnels hospitaliers, de façon qu’ils puissent prendre en charge les cas graves, et que ce n’était qu’en dernier ressort qu’on pouvait les mobiliser pour la vaccination massive – d’une ampleur jamais connue en France. C’est pourquoi nous avons veillé tout d’abord à l’approvisionnement des pharmacies, ensuite à la mise en place de consultations dédiées dans plusieurs hôpitaux – nous avons eu jusqu’à 400 établissements pouvant accueillir en priorité les patients atteints du virus. Le parti avait été pris dès le départ d’organiser des centres de vaccination à l’extérieur des établissements de santé. En revanche, pour des raisons de célérité et de bonne utilisation, notamment de vaccins pluriels, livrés dans des délais que l’on ne maîtrisait pas nécessairement au moment où on a organisé la vaccination, il avait été décidé que la vaccination des professionnels de santé hospitaliers aurait lieu à l’hôpital, ainsi d’ailleurs que celle des médecins libéraux, tant que les centres de ville n’étaient pas encore en place – la vaccination a été ouverte aux libéraux dès novembre. La priorité a été de vacciner les professionnels de santé, médicaux et paramédicaux, selon l’ordre de priorité fixé par le Premier ministre. L’instruction d’élargissement du dispositif de vaccination à l’entourage des personnels date du 2 décembre 2009, d’où la date d’entrée en vigueur que je vous ai indiquée du 3 décembre.
M. Guy Lefrand. Vous nous dites que vous souhaitiez réserver les personnels hospitaliers pour la prise en charge des patients atteints du virus. Dans le même temps, le directeur de l’AP-HP nous l’a dit tout à l’heure, 220 internes par jour étaient mobilisés pour aller vacciner dans des centres, qu’ils trouvaient parfois fermés ou qui n’étaient pas en état de fonctionner. N’aurait-il pas été possible d’organiser au sein de certains hôpitaux, sans que cela soit exclusif de centres extérieurs, des centres de vaccination afin que les personnels hospitaliers n’aient pas à se déplacer ?
M. Bernard Debré. Une logique m’échappe. Vous nous dites qu’on ne pouvait pas vacciner dans les hôpitaux, parce que les personnels devaient rester disponibles en cas de grippe dangereuse, mais dans le même temps, on les envoyait vacciner à l’extérieur – 220 internes par jour pour l’AP-HP seulement ! Les hôpitaux ont été dégarnis au profit de centres de vaccination qui ne marchaient pas. Qu’aurait-on fait s’il y avait eu alors « un coup de feu » à l’hôpital ?
Mme Annie Podeur. Tel qu’initialement conçu, le dispositif devait, dans les centres de vaccination organisés sous la responsabilité de la DGS, faire appel à des volontaires. Force est de constater que ceux-ci n’ont pas été légion, c’est le moins qu’on puisse dire. C’est pourquoi, cela avait été prévu dans l’instruction, il m’a été demandé ex post, fin novembre, de mobiliser des internes, des étudiants en médecine et des élèves infirmiers quand on s’est aperçu que les centres ne pouvaient pas fonctionner sans leur renfort massif.
Pour vous répondre, monsieur le rapporteur, oui, il y a eu des difficultés importantes et massives en région parisienne pour des raisons à la fois d’organisation territoriale au niveau des services déconcentrés et d’effets d’échelle. En revanche, d’après les remontées que nous avons eues, y compris de grandes villes, je pense à Lyon ou Clermont-Ferrand, où le nombre d’internes mobilisés a été remarquable, nous pouvons dire que les choses se sont globalement bien passées, sans difficulté particulière pour les personnels mobilisés. Ils n’étaient certes plus présents à l’hôpital, mais on y avait laissé tous les personnels seniors. Il n’y a donc pas d’incohérence, monsieur Debré. On a simplement donné la possibilité à des médecins et des infirmières, en-dehors de leurs obligations de service et sur la base du volontariat, de se joindre à l’effort collectif national. S’agissant des internes et des externes, nous avons toujours veillé à ce que la tâche ne soit pas trop lourde et contraignante en sus de leurs obligations de service et à ce qu’ils soient correctement indemnisés, ce qui était bien le moins. Ma responsabilité était, au vu de demandes formalisées qui devaient d’ailleurs faire l’objet d’une concertation entre les équipes opérationnelles départementales, la direction des affaires médicales des hôpitaux « fournisseurs » d’internes et d’externes et les IFSI « fournisseurs » d’élèves infirmiers, d’ajuster au mieux les plannings. Y compris à l’AP-HP, la direction des affaires médicales a fait un travail remarquable, salué par les syndicats d’internes. Ceux-ci ont bien perçu l’effort de recherche d’adéquation mais aussi compris que les besoins en amont n’étaient pas toujours évalués de façon assez précise pour que le service rendu corresponde aux moyens mobilisés. Je pense que les services déconcentrés ont rencontré une vraie difficulté pour armer un nombre très important de centres de vaccination, dispersés aux quatre coins de la région parisienne.
Mme Catherine Génisson. En dépit de la qualité des instructions données, je ne pense pas que cela se soit passé aussi bien que vous le dites, vous le reconnaissez d’ailleurs. Si la réquisition des internes s’est effectuée dans d’assez bonnes conditions, en dépit de quelques difficultés ici ou là, c’est à leur arrivée dans les centres de vaccination qu’il y avait des problèmes, leur présence n’étant pas toujours opprtune. N’a-t-on jamais proposé de mobiliser moins de personnels à l’extérieur mais de permettre en revanche de vacciner davantage in situ ?
Mme Annie Podeur. Les arbitrages ont été rendus…
M. le président Jean-Christophe Lagarde. Madame la directrice, vous avez insisté, à juste titre, sur le fait que vous n’étiez pas en charge de la vaccination de la population, mais seulement de celle des personnels de santé. C’est un fait. À partir du moment où l’essentiel des personnels de santé qui le souhaitaient avaient été vaccinés – j’aimerais d’ailleurs savoir en combien de temps et quand ce plafond a été atteint –, comment se fait-il que n’ait jamais été formulée l’idée, qui paraît évidente, d’utiliser les capacités hospitalières pour vacciner la population ? Est-ce dû à l’existence de deux directions centrales chargées, l’une de la vaccination des personnels, l’autre de la vaccination de la population, travaillaient chacune de leur côté ? Vous avez dit que les centres de vaccination avaient été installés dans des « lieux identifiables ». Pouvez-vous nous préciser ce que vous entendez par là car un hôpital est, me semble-t-il, un « lieu identifiable » par la population comme un lieu où on peut se faire vacciner ?
Mme Annie Podeur. On ne peut pas véritablement parler de centres de vaccination dans les établissements de santé. Des équipes y avaient simplement été mises sur pied, qui se sont relayées et ont travaillé avec des moyens ad hoc pour assurer dans les meilleurs délais la couverture vaccinale des personnels de santé qui y exerçaient. Les établissements, auxquels on en avait d’ailleurs laissé la latitude, ont ensuite adapté les ressources déployées aux flux enregistrés. Il est évident que la mobilisation a été plus forte les premières semaines.
Le choix avait été fait d’organiser des centres de vaccination spécifiques hors des établissements de santé pour l’ensemble de la population. Là encore, ma direction n’est intervenue qu’en appui et à la demande.
M. le président Jean-Christophe Lagarde. Nous ne cherchons pas des responsables, mais simplement à mieux comprendre ce qui s’est passé. Vous n’avez pas répondu à ma question : une fois vaccinés 37 % à 40 % des professionnels de santé, votre mission pouvant dès lors être considérée comme remplie, et certains établissements ayant même vacciné des personnes extérieures, comment se fait-il qu’on n’ait pas vu, dans la direction voisine de la vôtre, qu’on disposait de capacités supplémentaires dans les établissements eux-mêmes ?
Je souhaiterais que vous nous transmettiez l’instruction du 2 décembre…
Mme Annie Podeur. … relative à la vaccination de l’entourage des personnels. C’est une instruction du 7 janvier qui a ouvert plus largement les possibilités.
M. le président Jean-Christophe Lagarde. L’instruction de décembre donnait la possibilité aux gens du quartier de se faire vacciner dans les hôpitaux ?
Mme Annie Podeur. Il n’y a jamais eu d’instruction pour les gens du quartier. Ont été vaccinés ceux qui passaient et souhaitaient se faire vacciner.
M. le président Jean-Christophe Lagarde. C’est aussi ce qui s’est passé dans les centres de ville. On avait dit aux personnes de se présenter avec leur bon de vaccination, mais celles qui venaient sans ont pu être vaccinées quand même.
Mme Catherine Génisson. Il est arrivé aussi qu’on fasse repartir des personnes venues sans bon !
M. le président Jean-Christophe Lagarde. Cela a varié selon les périodes.
Mme Annie Podeur. Personne n’a proposé d’ouvrir au reste de la population le dispositif de vaccination mis en place dans les établissements de santé. Mais si on nous l’avait demandé, les personnels n’auraient pas pu à la fois soigner les malades, vacciner à l’extérieur pour les internes et les personnels infirmiers, et assumer une tâche supplémentaire au sein des établissements. Des choix s’imposent à un moment. Il eût fallu qu’il y ait une substitution. Or, telle n’a pas été la décision prise.
M. Yves Bur. On a considéré que les hôpitaux étaient d’abord destinés à accueillir les patients atteints du virus et à les soigner, et on s’est organisé en fonction de cela. Le même raisonnement a prévalu pour les généralistes qu’on a souhaité au début réserver aux soins des malades.
Mme Annie Podeur. Exactement.
M. le président Jean-Christophe Lagarde. Le ministère de la santé avait en effet dit au départ qu’il souhaitait que les généralistes restent disponibles pour faire face à l’afflux des malades et en assurer le premier accueil.
Mme Annie Podeur. En fin d’année, les établissements de santé, notamment publics, sont en général débordés par les épidémies saisonnières. Ce n’est pas à ce moment-là qu’on peut prendre le risque de les dégarnir, notamment dans certains services sensibles, et d’affecter une partie de leurs personnels – seniors j’entends –, médicaux et paramédicaux, à une mission vaccinale de santé publique qu’ils ne sont pas a priori destinés à assumer
– sauf s’il existe un centre de vaccination pérenne dans l’établissement, ce qui est l’exception.
Vous souhaitez connaître le montant de l’enveloppe nationale accordée au titre des missions d’intérêt général pour faire face à la pandémie grippale. Nous avons, à titre provisionnel, prévu dans la circulaire du 2 novembre 2009 un montant de dix millions d’euros, réparti entre les régions au prorata de leur population, en demandant aux ARH de contrôler, avant tout versement, les justificatifs de surcoûts présentés. Durant toute la période, l’activité supplémentaire générée par la pandémie, et cette activité a existé, expliquant d’ailleurs pour partie le dépassement de l’ONDAM enregistré en 2009, était intégralement rémunérée au titre de la tarification à l’activité. Nous allons maintenant examiner à partir des remontées du terrain, mais je n’en ai pas encore le détail, comment ces dix millions ont été effectivement utilisés.
M. le président Jean-Christophe Lagarde. Sachez déjà qu’il y a un million d’euros pour l’AP-HP, son directeur nous l’a dit tout à l’heure.
Mme Annie Podeur. Il devra le justifier. Cela dit, 10 % de l’enveloppe totale pour l’AP-HP, c’est logique.
M. le rapporteur. Allez-vous prochainement évaluer la façon dont ont été gérés les internes, les externes et les élèves infirmiers ?
Mme Annie Podeur. S’agissant des internes et des externes, les frais engagés par les établissements pour couvrir leur rémunération, hors obligations de service ou de stage, sont « traçables », dans la mesure où ils sont présentés à la CPAM pour être remboursés. Pour l’instant, on arrive pour l’ensemble du pays à une dépense de 3,6 millions d’euros. Mais il a un vrai problème de traçabilité. Or, nous ne pouvons, nous, payer que sur un état de services produit par l’équipe opérationnelle départementale.
Mme Catherine Génisson. Connaît-on la proportion de personnels hospitaliers tant médicaux que paramédicaux qui ont permis aux centres de vaccination de fonctionner ?
Mme Annie Podeur. Non. C’est une question qu’il faut poser à la DGS qui avait la charge des centres de vaccination et dispose peut-être, via les équipes opérationnelles départementales, d’un planning global des personnels mobilisés. Pour ma part, je sais simplement quel a été le pourcentage d’internes mobilisés sur tel ou tel site. C’est ainsi que j’ai pu vous dire que dans certains établissements, il y avait eu une forte mobilisation des internes, sans que cela ait créé de difficultés parce que cela avait été organisé en étroite concertation entre l’équipe opérationnelle départementale et la direction des affaires médicales de l’établissement de rattachement.
Mme Catherine Génisson. Je comprends que vous ne puissiez pas répondre mais il sera important pour nous d’avoir cette information.
La mobilisation des personnels médicaux et paramédicaux pour la vaccination a-t-elle entraîné beaucoup de déprogrammations d’activités dans les hôpitaux au niveau national ?
Mme Annie Podeur. Les déprogrammations ont été tout à fait exceptionnelles et très ponctuelles, sur deux ou trois jours. En revanche, l’activité, notamment des unités de réanimation, a été très soutenue. On a enregistré un net surplus d’activité liée à la prise en charge des cas graves.
Mme Catherine Génisson. A-t-on ou non manqué de lits de réanimation ?
M. le président Jean-Christophe Lagarde. Je me souviens avoir lu dans la presse courant octobre ou début novembre – mais tant de choses ont été écrites qui étaient parfois des sottises ! –, que nous avions peut-être atteint notre capacité maximale en matière d’accueil pour détresse respiratoire. L’avez-vous vous-même constaté et quel est le nombre maximal de personnes qui auraient pu être prises en charge au niveau national en cas de forte pandémie ?
Mme Annie Podeur. À ma connaissance, si certaines unités de réanimation ont pu être saturées sur un laps de temps très court, les contraignant à orienter les patients vers d’autres unités, comme cela arrive fréquemment à certaines périodes de l’année, cela est resté exceptionnel. Une enquête que nous avions menée en juin 2009 avait recensé, au-delà des capacités des unités de réanimation qui sont de 4 967 lits et 7 007 respirateurs, 5 311 lits et 1 165 respirateurs dans les unités de surveillance continue, 8 433 lits et 3 867 respirateurs dans les salles de soins post-interventionnelles, enfin quelque 8 000 respirateurs dans les salles d’opération. Auraient donc pu être pris en charge 20 000 patients.
M. Guy Lefrand. Vous nous avez dit, madame la directrice, qu’un référent grippe avait été désigné dans chaque ARH. Le directeur de l’AP-HP ne se souvenait pas que les ARH avaient été associées au dispositif, en tout cas à son niveau. Pouvez-vous nous préciser quel a été leur rôle ?
Le taux moyen de 40 % de personnes vaccinées parmi les personnels soignants vous paraît-il satisfaisant ? Sinon, pourquoi, à votre avis, la campagne n’a-t-elle pas suscité davantage d’adhésion ?
Mme Annie Podeur. S’agissant du rôle des ARH, la loi Hôpital, patients, santé, territoires (HPST) a modifié les modalités de tutelle de l’AP-HP mais les nouvelles n’entreront en vigueur que prochainement. L’AP-HP a bénéficié d’un traitement particulier en étant associée, en tant que telle, à toutes les conférences téléphoniques que j’ai organisées avec les ARH. Je tiens d’ailleurs ici à rendre hommage aux ARH, structures qui, sur le point de cesser leur activité, avec donc des effectifs très diminués, ont été très présentes. Si nous avons pu collecter chaque semaine des données comme la montée en charge du taux de vaccination avant que nous puissions disposer de données parfaitement traçables par le biais des coupons Ameli, c’est grâce à elles.
N’étant pas médecin, il ne m’appartient pas de juger du taux de couverture vaccinale parmi les personnels soignants. Sachez que le taux de vaccination a été très supérieur à celui enregistré habituellement pour la grippe saisonnière, et que celui des médecins a été exceptionnellement élevé. Je pense sincèrement que l’exemple donné par les médecins a participé de la mobilisation des autres personnels qui, comme chacun d’entre nous, confrontés à certaines informations diffusées dans la presse ou sur internet, pouvaient vraiment hésiter à se faire vacciner. Cela a certainement été l’un des facteurs de succès
– relatif certes mais de succès néanmoins – de cette campagne vaccinale.
M. le président Jean-Christophe Lagarde. Monsieur le rapporteur, vous nous avez dit tout à l’heure qu’il y avait eu une soudaine affluence dans les centres fin novembre-début décembre après l’annonce d’une mutation du virus en Norvège. En réalité, entre le 19 novembre et le 3 décembre, on était à environ 1,7 million de personnes vaccinées. C’est entre le 3 décembre et le 17 décembre qu’on est passé de 2 à 4 millions. C’est à ce moment-là qu’il y a eu réel afflux.
Mme Annie Podeur. En effet.
M. le président Jean-Christophe Lagarde. Il semble qu’il y ait eu une pression des personnels de santé pour que leur entourage puisse être vacciné.
Mme Annie Podeur. C’est vrai.
M. le président Jean-Christophe Lagarde. D’où vraisemblablement l’instruction du 2 décembre.
Pourriez-vous ultérieurement nous dire plus précisément par écrit dans quelles périodes les personnels de santé ont été vaccinés ? Débutée en octobre, je pense que leur vaccination devait être terminée depuis un certain temps le 3 décembre, en tout cas pour le plus grand nombre d’entre eux.
Mme Annie Podeur. Non, je crois que le taux augmentait encore. Quoi qu’il en soit, nous vous communiquerons les statistiques dont nous disposons.
M. le président Jean-Christophe Lagarde. Cette pression des personnels de santé pour que leur entourage puisse être vacciné tient sans doute aussi au fait que certains centres n’étaient pas suffisamment ouverts. C’est en effet à peu près au même moment qu’on a décidé de les ouvrir plus largement. Ce qui m’interpelle est qu’on a ouvert plus largement la vaccination dans les établissements de santé, sans aucun caractère officiel.
Enfin, vous avez dit, même si j’ai bien compris que cela ne relevait pas de la responsabilité de votre direction, qu’il y avait eu des difficultés d’organisation « importantes et massives » dans les centres de vaccination de la région parisienne. Pourriez-vous, comme nous ne pouvons pas poursuivre par trop longuement votre audition au-delà de l’horaire prévu, nous préciser ultérieurement par écrit ce que vous entendez par là.
Mme Annie Podeur. Je vous renvoie très clairement, monsieur le président, aux décisions, y compris administratives, qui ont pu être prises concernant l’encadrement des services déconcentrés en région parisienne.
M. le président Jean-Christophe Lagarde. Certains responsables n’auraient pas poursuivi leur mission ?
Mme Annie Podeur. Je ne suis pas en mesure et ce n’est pas de ma compétence, d’apprécier l’adéquation du dispositif dans les centres de vaccination à la prise en charge d’une population nombreuse, avec des services déconcentrés qui étaient ce qu’ils étaient à l’époque et qui ont été très mobilisés.
M. le président Jean-Christophe Lagarde. Qu’entendez-vous par « décisions concernant les services déconcentrés » ?
Mme Annie Podeur. Je pense à la direction des affaires sanitaires et sociales de Paris.
M. le président Jean-Christophe Lagarde. Ce n’était pas pour vous le faire dire mais être sûr de ne pas faire de mauvaise interprétation.
Mme Annie Podeur. Je le redis, je n’ai aucune appréciation à porter. Je peux simplement vous dire, puisque j’étais chargée de capter les signaux, que les signaux ont été, de la part notamment des jeunes internes et des élèves infirmiers, répétés.
Nous vous adresserons un graphique, aussi exploitable que possible, de la montée en charge des vaccinations sur un échantillon de population. Vous n’aurez pas de chiffre en valeur absolue, c’est la courbe qui importera.
M. le président Jean-Christophe Lagarde. Madame la directrice, je vous remercie.
La séance est levée à dix-neuf heures cinq.
Audition de M. Laurent Degos,
président du collège de la Haute Autorité de santé (HAS)
(Procès-verbal de la séance du mercredi 7 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-neuf heures cinq.
(M. Laurent Degos prête serment.)
M. Laurent Degos, président du collège de la Haute Autorité de santé. Je vous rappellerai tout d’abord rapidement les attributions de la Haute Autorité de santé. Elle évalue les médicaments, les dispositifs médicaux et les actes professionnels en vue de leur remboursement et de leur bon usage. C’est la commission de la transparence qui évalue les médicaments, et c’est son président, Gilles Bouvenot, présent à mes côtés, qui répondra, si vous le permettez, à toutes vos questions sur les médicaments. La Haute Autorité de santé formule également des recommandations de bonnes pratiques de sécurité et de santé publique, ainsi que pour la prise en charge à 100 % de certains produits dans le cadre des affections de longue durée. Enfin, elle certifie les établissements de santé, l’information médicale, comme les sites « e-santé », et accrédite les médecins.
Dans le cadre de la campagne de vaccination contre la grippe A, elle n’a été saisie qu’une fois, le 6 janvier 2010, par le directeur de la sécurité sociale et la ministre de la santé qui ont sollicité son avis pour le remboursement de la vaccination par les médecins libéraux, à un tarif précis. Elle a donné sa réponse dans l’heure, qu’elle a fait porter par coursier.
Ayant été averti le week-end précédent de l’éventualité de cette saisine, j’ai immédiatement pris contact avec la direction de la Haute autorité, afin de pouvoir réunir très rapidement et le collège et la commission d’évaluation des actes professionnels. Nous avons ainsi pu répondre que oui, les généralistes pouvaient pratiquer la vaccination – il me paraissait évident que les médecins pouvaient faire une injection sous-cutanée mais il n’en a pas moins fallu l’avis de la haute autorité ! En revanche, nous avons répondu que nous n’avions aucune compétence pour fixer la tarification de l’acte, sur lequel notre avis était également sollicité.
À cette période, le pic de l’épidémie était passé. J’en veux pour preuve l’interview de M. Frédéric Keck le 9 janvier 2010 dans Le Monde et l’article de M. Thierry Saussez, directeur du Service d’information du Gouvernement, en réponse dans le même quotidien le 14 janvier 2010. La Haute Autorité de santé n’a reçu aucune autre demande de la part de quiconque dans cette campagne. Alors qu’elle évalue tous les vaccins, elle n’a pas eu à évaluer ceux contre la grippe A, puisqu’ils n’étaient pas remboursés par l’assurance maladie, mais fournis par les pouvoirs publics. Quant aux antiviraux, elle les a évalués selon son calendrier habituel.
Elle n’a formulé aucune recommandation particulière sur le sujet de la grippe A afin de conforter le ministère comme émetteur unique d’information, ce qui est notre règle en cas de crise.
M. le président Jean-Christophe Lagarde. Pourriez-vous préciser cette dernière idée ?
M. Laurent Degos. Nous n’avons aucun rôle dans la gestion des crises ni de l’urgence. En cas de crise, tout doit être géré par le ministère. Nous lui répondons lorsqu’il le faut mais nous ne nous auto-saisissons jamais, ne formulons pas de recommandations et le laissons seul en charge de l’information.
Nous nous sommes trouvés, durant cette campagne, dans une position privilégiée pour comprendre certains événements, du fait que la population était beaucoup moins sévèrement touchée qu’attendu. En tant que médecin, je suis toujours attristé par une mort, notamment provoquée par la grippe. Toute mort liée à la grippe est une mort de trop, mais force de constater pour la grippe A que la catastrophe prédite n’a, heureusement, pas eu lieu. En fait, il y a eu crise sans crise. Nous connaissons bien à la Haute Autorité de santé ces situations qu’on appelle « le presque accident », auxquelles nous nous intéressons beaucoup avec les professionnels.
Dans ces circonstances, les praticiens peuvent prendre part à la recherche des causes de l’événement sans arrière-pensée, sans chercher à se justifier ni se défendre. On a parfois été très proche de l’accident, sans qu’il arrive jamais, ce qui a permis de privilégier la recherche des causes, plus que des responsabilités, mais aussi d’identifier la barrière qui a précisément permis d’éviter l’accident, afin d’en tirer des leçons pour l’avenir. La crise attendue pour la grippe A n’a pas eu lieu. Tant mieux, il ne s’agit pas maintenant de démontrer que chaque action était justifiée mais d’en profiter pour permettre d’améliorer les campagnes futures. Le virus H1N1, que l’on attendait très virulent, ne l’a pas été autant qu’attendu. Peut-être serait-il utile pour l’avenir de mener une étude scientifique afin de mieux comprendre pourquoi.
M. le président Jean-Christophe Lagarde. Nous avons bien compris que la Haute Autorité de santé était arrivée un peu après la bataille. Je souhaiterais néanmoins vous poser quelques questions. Elle n’a pas évalué les vaccins contre la grippe A, contrairement à tous les autres, uniquement parce qu’ils étaient distribués gratuitement et qu’elle n’évalue que les produits dont est sollicité le remboursement. Il n’existe pas d’autres vaccins gratuits ? Le remboursement donne toujours l’illusion de la gratuité aux patients.
M. Laurent Degos. La Haute Autorité de santé aide à la décision au remboursement et au bon usage ensuite ; dans le cas d’espèce, le vaccin étant gratuit, il n’y avait pas de remboursement. On a sollicité notre avis seulement au moment où la vaccination allait aussi pouvoir être effectuée par les médecins libéraux.
M. le président Jean-Christophe Lagarde. Les antiviraux Tamiflu et Relenza, eux, sont remboursés. Vous nous avez dit avoir procédé à leur évaluation selon votre « calendrier habituel ». Vu le contexte, votre avis sur ces produits n’aurait-il pas été plus urgent que d’habitude ?
La haute autorité a rendu des avis successifs dans lesquels sa commission de la transparence a jugé le service médical rendu (SMR) de ces antiviraux modéré, voire insuffisant. Un large débat a eu lieu sur leur usage. Lors d’un colloque organisé à l’initiative de notre rapporteur, nous avons même appris qu’il existait un débat chez les scientifiques sur le fait de savoir si l’utilisation systématique du Tamiflu faisait ou non courir le risque d’une adaptation du virus, à l’instar de la résistance de certaines bactéries aux antibiotiques. Avez-vous eu aussi des débats et rendu des avis sur le sujet ?
M. Laurent Degos. Permettez-vous que ce soit Gilles Bouvenot qui réponde à cette question qui relève de la commission de la transparence ?
M. le président Jean-Christophe Lagarde. En théorie, ce n’est pas possible puisque vous êtes le seul à avoir prêté serment. En pratique, nous allons demander à M. Bouvenot de dire la vérité, toute la vérité, rien que la vérité, de lever la main droite et de dire « Je le jure ».
(M. Gilles Bouvenot prête serment.)
M. Gilles Bouvenot, président de la commission de la transparence de la Haute Autorité de santé. Voyons d’abord le calendrier. La commission de la transparence est appelée à se prononcer lors de la première demande de remboursement d’un médicament par une firme, c’est ce qu’on appelle la première inscription. Pour le Tamiflu, cette première inscription a eu lieu en 2004 et pour le Relenza, en 1999. La commission a ensuite l’obligation réglementaire de réévaluer cinq ans plus tard les produits dont elle a proposé l’inscription. Mais elle est habilitée, entre temps, à revoir un médicament, à la demande des firmes ou de sa propre initiative, si elle pense que le contexte médical ou scientifique a évolué et surtout si de nouvelles données sur le produit sont disponibles.
Nous avons procédé à la première inscription du Relenza le 21 novembre 1999, alors qu’il avait obtenu son autorisation de mise sur le marché (AMM) le 26 juillet, nous l’avons revu à une date intermédiaire que je n’ai plus en tête, puis pour la dernière fois le 26 septembre 2007.
Pour ce qui est du Tamiflu, nous l’avons évalué de nombreuses fois sans jamais changer d’avis depuis sa première inscription en 2004. Nous l’avons revu en 2006 pour une extension d’indications chez l’enfant ; en 2007, à la demande de la Direction générale de la santé pour la prise en charge en prophylaxie de la grippe chez certaines populations à risques, plus exposées à des complications ; une nouvelle fois encore en 2007, de nouveaux dosages à 30 mg et 45 mg ayant été mis sur le marché alors que le dosage lors de la première inscription était de 12 mg ; le 16 avril 2008, la Direction générale de la santé nous ayant demandé de réexaminer son SMR ; le 13 mai 2009 en raison d’une modification du résumé des caractéristiques du produit qui contraignait la firme à solliciter cette réévaluation – des effets indésirables nouveaux avaient été notés. Enfin, nous l’avons revu le 21 octobre 2009 pour sa réévaluation quinquennale classique, sans précipitation ni saisine particulière, car telle est la procédure normale.
Pour déterminer le SMR du Tamiflu, nous avons distingué les propriétés curatives –raccourcit-il la durée de la grippe et évite-t-il les complications, en particulier les surinfections comme les otites ou les pneumonies ? – des propriétés prophylactiques – évite-t-il que des personnes ayant été au contact de sujets grippés contractent la grippe ? Sur le plan curatif, nous avons toujours dit que son SMR était insuffisant – insuffisant ne signifiant pas inefficace. Nous avons considéré que le raccourcissement de la durée des signes cliniques de la grippe, d’environ un jour, n’était pas suffisant pour que joue la solidarité nationale, d’autant que les essais présentés ne démontraient pas de manière formelle que ce produit réduisait l’occurrence des surinfections.
M. Gérard Bapt. Il s’agissait d’essais effectués par le fabricant.
M. Gilles Bouvenot. Comme toujours, monsieur le député.
La firme ne pouvait pas en octobre 2009 fournir de données nouvelles qui nous auraient conduit à modifier la note attribuée au produit sur le plan curatif.
Sur le plan prophylactique en revanche, nous avons été surpris du pourcentage de sujets qui, prenant du Tamiflu dans les 36 ou 48 heures après le premier contact avec un sujet grippé, pouvaient être protégées. Et nous avons distingué trois cas. Pour le sujet jeune, bien portant, sans risques particuliers de complications, même si le Tamiflu peut éviter un certain nombre de grippes, nous avons considéré, là encore, le SMR insuffisant. Pour les sujets à risques, très jeunes enfants, personnes de plus de soixante-cinq ans ou présentant des comorbidités comme une insuffisance respiratoire, un asthme, une bronchite chronique, nous avons estimé qu’il y avait lieu, pour le bénéfice des patients, d’être plus généreux dans notre note, et lui avons reconnu un SMR faible – un SMR faible différant à l’époque fort peu d’un SMR modéré, l’incidence sur le remboursement étant la même. Je rappelle pour mémoire que le remboursement est de 65 % lorsque le SMR est important, qu’il était de 35 % en cas de SMR modéré ou faible et qu’il a maintenant été ramené à 15 % en cas de SMR faible, ce taux de 15 % n’étant d’ailleurs pas encore entré en vigueur, le texte n’ayant été publié qu’en janvier.
Nous avons reconnu le SMR du Tamiflu modéré chez des patients à risques dont il nous semblait qu’il fallait éviter à tout prix qu’ils contractent la grippe – patients « institutionnalisés », patients immuno-déprimés, patients ayant une protection vaccinale incomplète par rapport à la souche circulante – sur ce plan, nous faisions presque de l’anticipation en nous demandant si la vaccination couvrirait le virus de l’année prochaine car nous avons toujours raisonné en termes de grippe saisonnière – , adolescents ou personnes de plus de soixante ans avec des comorbidités, patients présentant une contre-indication au vaccin. J’insiste sur ce dernier point : le collège de la Haute Autorité de santé a toujours eu le souci que les médicaments contre la grippe ne servent pas d’alibi pour ne pas vacciner. Pour nous, le traitement de la grippe, c’est la vaccination. Ni les professionnels de santé ni les patients ne devaient un seul instant penser que le Tamiflu pouvait remplacer la vaccination.
Vous le voyez, notre position sur le Tamiflu n’a jamais varié, non plus que sur le Relenza qui s’est vu reconnaître le même niveau de SMR.
Notre commission a eu la possibilité le 21 octobre 2009, à l’échéance quinquennale normale de réévaluation, de se prononcer sur le Tamiflu, alors qu’une pandémie avait menacé – ou menaçait encore, nous n’en savions rien à l’époque. Eh bien, vous serez sans doute déçus que la commission ait déclaré ne disposer d’aucune donnée permettant de dire quelle serait l’utilité, même potentielle, du Tamiflu dans un contexte de pandémie. La question nous préoccupait, elle taraudait même les infectiologues de la commission, mais nous étions dans l’incapacité d’y répondre, ne disposant pas notamment des données concernant l’hémisphère Sud, que d’autres peut-être avaient. La question ne nous a d’ailleurs pas été posée, ce que je comprends parfaitement. La commission de la transparence est composée de professionnels de santé pluridisciplinaires, apportant l’expertise de spécialistes de très haut niveau, mais elle n’est pas l’instance publique décidant d’une politique vaccinale.
Pour conclure, le Tamiflu nous a paru utile dans un certain nombre de cas ciblés, mais, je le rappelle, nous avons réalisé son évaluation en raisonnant en termes de grippe saisonnière traditionnelle. Nous ne pouvions pas dire si le Tamiflu aurait un SMR plus important lors d’une pandémie. Nous n’avions pas d’éléments pour nous prononcer, autres que des supputations ou des craintes éventuelles.
M. le président Jean-Christophe Lagarde. Personne dans votre commission ne s’est demandé comment, s’il vous avait été soumis, le vaccin contre la grippe H1N1 aurait été évalué, en fonction des données fournies par les laboratoires ?
Vous avez dit que vous ne vouliez rien dire laissant à penser aux professionnels de santé, voire aux médias, que le Tamiflu pouvait remplacer la vaccination. L’utilité de la vaccination faisait-elle l’objet d’un avis unanime parmi les membres de la haute autorité ?
M. Gilles Bouvenot. Oui. Il est unanimement reconnu que la vaccination est très efficace pour la grippe saisonnière. Depuis sa création, la commission de la transparence a conscience du fait qu’il faut éviter que les Français, qui ont un attrait particulier pour les médicaments, ne recourent au tout-médicament quand ce n’est pas indispensable. Lorsqu’un médicament est moins efficace qu’un vaccin, il faut le dire haut et fort.
J’en viens à la procédure d’évaluation des vaccins. Ceux-ci obtiennent une autorisation de mise sur le marché ou AMM, après quoi ils sont évalués par le comité technique des vaccinations, qui est une structure du Haut conseil de santé publique. La commission de la transparence n’intervient qu’ensuite, pour répondre aux deux questions de savoir s’ils méritent d’être pris en charge par la solidarité nationale et s’ils constituent un progrès thérapeutique par rapport à l’existant, le SMR reconnu par la commission déterminant le prix qui sera accepté.
Lorsque le vaccin contre la grippe H1N1 est arrivé, nous ne disposions d’aucune donnée scientifique à son sujet, sauf à se plonger dans la littérature médicale internationale, ce que seuls nos infectiologues ont fait, les autres membres de la commission n’ayant aucune raison de le faire. Nous n’avons pas eu connaissance du dossier d’AMM, lequel ne nous est communiqué que lorsque nous avons à évaluer le produit pour que soit fixé son taux de remboursement. En l’espèce, il n’y avait donc pas lieu que nous en ayons connaissance. Nous n’avons pas eu non plus communication officielle de l’avis du comité technique, ce qui n’aurait d’ailleurs servi à rien. Dès lors que les pouvoirs publics prennent la main pour des raisons de santé publique et décident de fournir gratuitement un vaccin à la population, il n’y a pas lieu de demander à la Haute Autorité de santé s’il faut le rembourser ou non. Nous n’avons donc pas éprouvé la moindre frustration – si c’est ce terme que vous souhaitiez entendre de notre bouche. Attachés au strict respect de la réglementation, nous avons fait ce que nous devions faire. En l’occurrence, nous n’avions pas d’avis à donner et n’en avons pas donné.
M. Jean-Pierre Door, rapporteur. Ainsi la Haute Autorité de santé n’a pas été saisie durant toute la gestion de la pandémie, hormis la saisine sur le remboursement éventuel de l’acte de vaccination par les praticiens libéraux, mais vous n’en avez pas été « frustrés ».
Mais je vous connais, monsieur le directeur. La Haute Autorité de santé est une autorité indépendante qui renseigne et conseille dans les domaines médical et médico-économique. Vous ne pouvez pas ne pas avoir de sentiment sur la campagne de vaccination telle qu’elle s’est déroulée, et s’il y avait des conseils à donner pour le futur, lesquels donneriez-vous ?
M. Laurent Degos. Monsieur le rapporteur, nous n’avons pas de « sentiment » à avoir en l’espèce. Nous devons regarder objectivement ce qui s’est passé. Il est très difficile de répondre à votre question au nom de l’ensemble de la Haute autorité de santé, dont chacun des membres peut avoir sa propre opinion sur cette campagne de vaccination.
Celle-ci s’est déroulée de façon logique par rapport à ce qui était attendu. C’est plutôt son résultat qui pose problème. Pourquoi y a-t-il eu finalement aussi peu de personnes vaccinées ? Je me plaisais à rappeler récemment à mes collègues ce qui s’était passé au XVIIIème siècle avec ce qu’on appelait alors l’inoculation. Alors qu’on avait clairement fait savoir qu’il était bénéfique d’être inoculé pour éviter la petite vérole, dix ans plus tard, pas plus de mille personnes avaient été inoculées en France, ce qui prouve bien tout l’irrationnel des comportements de la population.
S’agissant de la grippe A, trois conseils principaux ont été donnés pour éviter la contamination par le virus et la propagation de la maladie : se laver régulièrement les mains, porter un masque et se faire vacciner. Chacun s’est lavé plus fréquemment les mains, et il y a eu moins de gastro-entérites cet hiver. Personne en revanche n’a porté de masque, jugé inconfortable. Quant à la vaccination, seule une minorité, peut-être éclairée, y a eu recours.
Pourquoi cette attitude ? Simplement parce que les gens se demandaient s’il n’y avait pas un risque à se faire vacciner. Des rumeurs ont couru comme quoi une complication pourrait être l’apparition d’un syndrome de Guillain-Barré. Des questions ont été soulevées sur l’intérêt ou non des adjuvants. Tout cela a inquiété la population. Et les gens ont préféré courir le risque d’attraper la grippe plutôt que d’avoir l’impression de choisir délibérément un risque en allant se faire vacciner, aussi infime, voire nul qu’ait été ce risque. Cette attitude échappe à la raison.
Mme Catherine Lemorton. Je souhaiterais revenir un instant sur le Tamiflu. La commission de la transparence a jugé le 21 octobre 2009 que son SMR ne s’était pas amélioré et demeurait insuffisant. La communauté médicale dans son ensemble ne s’y était pas trompée qui, hormis la première saison grippale après la sortie du médicament, en a peu prescrit, ayant vite compris que le produit n’était pas très efficace.
Pour rendre son avis du 21 octobre 2009, la commission de la transparence s’est appuyée sur des études présentées par l’industrie pharmaceutique, sur la validité desquelles on peut tout de même s’interroger. La première est celle de J. Gaillat. Elle a été menée en maison de retraite à Annecy où un essai a été réalisé sur 32 patients sur 81 résidents et 6 membres du personnel sur 48. La deuxième est celle de D. Vu et a porté sur 45 patients aux États-Unis. La dernière concerne l’administration en curatif chez des enfants à risques sur six saisons grippales aux États-Unis, n’ayant abouti à tester en six ans que 3 721 enfants.
Dans la mesure où le mode d’action du Tamiflu, qui est un inhibiteur de la neuraminidase, est identique quel que soit le virus, et sachant tout ce que la Haute Autorité de santé a dit, à juste titre, sur ce produit depuis 2004, que pensez-vous de l’injonction faite en décembre aux médecins généralistes – après que la vaccination s’était révélée un échec – de prescrire du Tamiflu à tout-va. Il suffisait d’avoir croisé sa concierge ayant éternué deux fois dans le hall de son immeuble pour s’en voir prescrire, alors que le rapport bénéfices/risques du produit est loin d’être positif, notamment chez les enfants où ont été observés de nombreux effets secondaires – des revues indépendantes des laboratoires l’ont établi. Je peux comprendre que le Tamiflu ait été prescrit chez des sujets à risques, comme les asthmatiques, les insuffisants respiratoires…, mais non à des enfants en bonne santé au simple motif qu’ils auraient pu contracter la grippe H1N1. Cette injonction n’était pas raisonnable. Quel est votre avis sur le sujet ?
M. Gilles Bouvenot. Lorsqu’un laboratoire pharmaceutique demande au ministère le remboursement d’un médicament, lequel passe alors nécessairement devant la commission de la transparence, dont l’avis est consultatif, le dossier ne contient la plupart du temps que des études faites par le laboratoire lui-même. Cela peut paraître choquant mais je ne sache pas que les pouvoirs publics réalisent des essais de médicaments et effectuent des recherches en ce domaine ! Notre travail est d’examiner, avec la plus grande prudence, les dossiers qui nous sont soumis. L’honneur de la Haute Autorité de santé réside précisément dans sa totale indépendance intellectuelle. Nous travaillons à la croisée de desiderata non expressément formulés mais que nous connaissons : celui du décideur, qui n’intervient pas, celui du payeur qui a toujours l’impression qu’il va payer trop et trop cher, et celui de l’industriel qui pense naturellement que son médicament n’a pas été reconnu à sa juste valeur.
Il existe des études indépendantes, mais jamais avant l’AMM ou au moment de l’AMM. Elles ne sont toujours effectuées qu’après, comme cela a été le cas pour les statines. Il ne me choque pas que les dossiers ne contiennent que des études menées par les industriels, notre travail consistant précisément à les examiner avec distance et à faire preuve de l’esprit critique nécessaires. Les notes que nous avons données au Tamiflu l’ont été, pour l’essentiel, sur la base du dossier de première inscription, dont les études étaient beaucoup plus solides que les dernières que vous avez citées. Après que le résumé des caractéristiques du produit avait été modifié, le fabricant a dû nous fournir des études complémentaires. Ce fut celles que vous avez indiquées dont nous avons, comme vous, madame, considéré que, d’une très grande médiocrité et portant sur de trop faibles effectifs, elles ne nous permettaient pas de revaloriser le SMR du Tamiflu. Mais elles ne remettaient pas en cause pour autant les conclusions que nous avions rendues lors de la première inscription.
Pour ce qui est du rapport bénéfices/risques, ne croyez pas, madame, que je veuille me défausser. Mais ce n’est pas la Haute Autorité de santé qui octroie les AMM. C’est l’Agence européenne du médicament, l’EMA, basée à Londres, au niveau européen, et l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) au niveau national. La commission de la transparence n’est pas habilitée à remettre en cause une AMM, laquelle est par définition octroyée sur la base d’un rapport bénéfices/risques globalement favorable, ni à juger de sa pertinence. Lorsque nous considérons qu’un produit n’est pas extraordinaire, nous disons que son SMR est modéré ou faible.
S’agissant de « l’injonction » faite aux généralistes, je ne peux que vous répondre, non en tant que président de la commission de la transparence, mais en tant que professeur des universités-Praticien hospitalier (PU-PH) de thérapeutique à la faculté de médecine de Marseille. Ma conviction est que lorsqu’une pandémie est avérée ou menace, même de « petits moyens » peuvent avoir de l’efficacité, je dirai même une efficacité insoupçonnée, en tout cas insoupçonnable. Si nous avons renoncé à toute idée de nous prononcer sur l’intérêt de Tamiflu dans le contexte d’une pandémie, c’est que nous n’avions aucun élément nous permettant de l’évaluer. Mais cela ne signifie pas qu’en tant que professionnel de santé – je parle là en mon nom personnel – , je n’aurais pas utilisé ce « petit moyen » supplémentaire, surtout dans un contexte de couverture vaccinale insuffisante. Tant que l’on n’a pas atteint un certain seuil de population vaccinée, la protection est mauvaise, du moins insuffisante. À titre personnel, mais cela n’engage que moi, cette « injonction » – j’ignorais qu’il s’agissait d’une « injonction », vous me l’apprenez – ne me choque pas. Et c’est pourtant moi qui vous dis dans le même temps que le Tamiflu n’est pas un médicament extraordinaire. Mais lors d’une pandémie, n’y aurait-il qu’un peu d’efficacité, pardonnez-moi ma trivialité, à « gratter » au profit des patients, je ne le refuserai pas.
M. Gérard Bapt. Il me choque, moi, que l’on ait incité à prescrire très largement et à distribuer gratuitement dans les pharmacies du Tamiflu à l’entourage de patients simplement suspectés d’avoir la grippe A, sans même que leur statut sérologique ait été contrôlé, alors que, de l’avis même de la commission de la transparence, ce produit ne présente pas d’intérêt sur le plan curatif et un intérêt faible sur le plan préventif. Car ce produit a des effets secondaires, psychiatriques notamment. Lors de la réévaluation des produits à l’échéance quinquennale, prenez-vous en compte les données de pharmacovigilance ?
Il est dommage que les gestes-barrières ne soient pas remboursés par la sécurité sociale car nous pourrions en connaître l’évaluation ! Saura-t-on jamais l’efficacité de se laver les mains, de mettre sa main devant sa bouche quand on tousse ou quand on éternue par rapport à la prise de Tamiflu ?
La Haute Autorité de santé a également une mission d’évaluation médico-économique. Avez-vous une idée du bénéfice retiré par rapport à l’investissement engagé lors de cette pandémie qui a été au total peu agressive ?
M. Gilles Bouvenot. Monsieur Bapt, je vais vous redire d’une autre manière ce que j’ai déjà répondu à Mme Lemorton. Nous avons pris en compte les modifications du résumé des caractéristiques du Tamiflu lorsque des effets psychiatriques ont été ajoutés parmi les effets indésirables. Mais nous n’avions pas à remettre en question l’AMM du produit ni à contester le rapport bénéfices/risques indiqué : c’est à l’EMA et à l’AFSSAPS qu’il appartient de dire, si tel est leur avis, que les effets indésirables nouvellement découverts du Tamiflu sont assez préoccupants pour que le rapport bénéfices/risques ne soit plus positif.
Afin de ne pas vous paraître incohérent, je précise bien que pour nous, SMR insuffisant ne signifie pas inefficacité. Un médicament inefficace ne doit tout simplement pas avoir d’AMM. Dès lors qu’un médicament a une AMM, c’est qu’il a un principe actif, donc une certaine efficacité et d’ailleurs par conséquent aussi des effets indésirables. Notre rôle à nous est de dire si cette efficacité est remarquable ou non. Lorsque nous concluons que le SMR d’un médicament est insuffisant, nous ne disons pas qu’il est inefficace. Je rappellerai ici les déremboursements intervenus en 2005 et 2006 des veinotoniques et des vasodilatateurs, que nous avions demandés au ministre de la santé, parce que nous estimions que l’efficacité de ces produits était insuffisante pour qu’ils méritent d’être remboursés. On peut sourire de la modestie de leur efficacité. Pour autant, ils ne sont pas inefficaces, et ont manifesté une supériorité par rapport aux placebos. Je comprends vos questions sur le rapport efficacité/effets indésirables mais c’est aux instances qui ont accordé son AMM à ce produit qu’il appartiendrait de la lui retirer.
M. Laurent Degos. La Haute Autorité de santé mène des études médico-économiques, mais selon un programme prédéfini car il s’agit d’études importantes qui ne peuvent être engagées à chaud. L’évaluation médico-économique du Tamiflu, distribué alors gratuitement, ne nous a pas été demandée. Elle ne nous a pas non plus paru utile alors qu’il était, comme le vaccin, fourni gratuitement.
M. le président Jean-Christophe Lagarde. Il me reste, messieurs, à vous remercier.
La séance est levée à vingt heures.
Audition de M. Claude Hannoun,
professeur honoraire à l’Institut Pasteur
(Procès-verbal de la séance du mardi 13 avril 2010)
(Présidence de M. Guy Lefrand, vice-président de la commission d’enquête,
puis de M. Jean-Christophe Lagarde, président)
La séance est ouverte à neuf heures dix.
(M. Claude Hannoun prête serment.)
M. Claude Hannoun, professeur honoraire à l’Institut Pasteur. Je suis entré à l’Institut Pasteur en 1945, avec une licence de sciences, et j’y ai achevé mon doctorat ès sciences.
Deux années plus tard, en 1947, j’ai été amené à isoler la première souche de virus de la grippe en France. Nous étions une équipe de trois, et à vingt et un ans, j’étais évidemment le plus jeune et c’est moi qui ai fait le travail concret. Puis, il m’a été demandé, dans la continuité de ce travail, de m’intéresser à la production de vaccins et, dans les années 1950-1951, j’ai produit le premier vaccin contre la grippe en France.
Dans la mesure où j’ai été impliqué dans ce domaine dès la troisième année de ma carrière scientifique, il y a de cela un demi-siècle, je ne suis donc pas absolument impartial en matière de vaccins. Vous ne trouverez pas en moi un adversaire de ceux-ci.
(Le président Jean-Christophe Lagarde remplace le vice-président Guy Lefrand au fauteuil de la présidence.)
J’ai produit ce premier vaccin par culture sur embryon de poulet. Le virus utilisé était déjà un virus H1N1.
Si les Français ont isolé le virus de la grippe pour la première fois en 1947, les Anglais l’avaient fait en 1933 : nous avions quatorze ans de retard ! De même, je n’ai pas inventé le vaccin. Il était déjà produit depuis deux ans par les Américains. Ils l’ont élaboré en 1944-1945. La France n’a commencé à le préparer qu’en 1949. Après l’interruption dramatique de la recherche scientifique en France du fait de la guerre, nous commencions à rattraper notre retard.
Après avoir élaboré ce premier vaccin de façon artisanale, nous avons fait du scaling up, c’est-à-dire que nous avons progressivement accru l’échelle de production. Nous sommes passés à un vaccin semi-industriel, puis, quelques années plus tard, à un vaccin industriel. Toutes ces évolutions ont eu lieu à l’Institut Pasteur. Celui-ci, qui est une fondation sans but lucratif, disposait à l’époque de la capacité à produire et à vendre des vaccins, dans la ligne de l’action de Pasteur, qui avait élaboré entre autres le vaccin contre la rage. L’Institut Pasteur fonctionnait donc aussi comme une entreprise commerciale. Ce mode de fonctionnement, possible à l’époque, ne le serait sans doute plus guère aujourd’hui. Du reste, pour résoudre les difficultés engendrées par ce double mode d’action, la fondation Institut Pasteur a créé quelques années plus tard une filiale, Institut Pasteur Production, destinée à produire et à commercialiser les vaccins. Entre 1958 et 1960, le vaccin contre la grippe a donc, comme les autres, été transféré dans le catalogue d’Institut Pasteur Production, compagnie commerciale associée à l’Institut Pasteur et filiale à 100 % de celui-ci. Les bénéfices réalisés étaient entièrement réinvestis dans la recherche.
Par la suite, les conditions financières, industrielles et économiques ont fait que Institut Pasteur Production a fusionné avec l’Institut Mérieux. Les fusions et concentrations successives ont ensuite abouti à la création de Sanofi Pasteur. Désormais, la fondation Institut Pasteur et Sanofi Pasteur sont totalement indépendants l’un de l’autre. Toutefois, l’Institut Pasteur a conservé des intérêts dans Sanofi.
Je voudrais maintenant évoquer la question des conflits d’intérêts. À l’époque, j’étais membre de l’Institut Pasteur et je fabriquais un vaccin. Aujourd’hui, ce travail aboutirait très probablement à des prises de brevets, au versement de royalties et à un intéressement des chercheurs. Tel n’était pas le cas à l’époque. Mes découvertes en matière de vaccin ne m’ont rien rapporté d’autre que mon salaire – modeste – de chercheur. Les bénéfices générés par ces travaux revenaient intégralement à l’Institut Pasteur, dont j’étais membre. Plus tard, j’ai déposé, en tout, quatre ou cinq brevets, mais les bénéfices qui en ont découlé sont entrés dans les caisses de l’Institut Pasteur ; en ce qui me concerne, je n’ai jamais reçu un centime d’intéressement sur des ventes.
Après cinquante ans de bons et loyaux services à l’Institut Pasteur, j’ai pris ma retraite en 1995. Depuis, je suis retraité et indépendant. Ces cinquante années de travail, la plupart du temps sur la grippe, m’ont donné une certaine expérience de la question. Virologue, j’ai travaillé sur le virus mais aussi sur l’épidémiologie. En 1984, avec Jean-Marie Cohen, j’ai créé le réseau de surveillance « GROG » (groupes régionaux d’observation de la grippe). J’ai aussi créé des institutions de réflexion et de recherche comme l’ESWI (European scientific working group on influenza).
Si, ayant pris ma retraite il y a quinze ans, je ne suis plus à la pointe de la recherche, mon expérience acquise et le fait de continuer à me tenir informé me permettent de prétendre encore être une sorte d’expert. Lorsque, en tant que tel, je suis consulté par la direction générale de la santé ou par des institutions officielles, je ne demande aucune compensation. En revanche, lorsque je suis sollicité par une firme industrielle pour un conseil ou en tant que membre d’un advisory board, il n’y a pas de raison que le service ainsi rendu ne soit pas compensé : je reçois alors des honoraires, de montant du reste limité. Un contrat préalable précis, indiquant le service qui m’est demandé – en général, une participation à un conseil consultatif pendant une journée ou deux – est établi. Pour une journée entière de travail, précédée d’une journée de préparation et suivie d’une journée de rédaction de rapport, ils se montent à des sommes de 1 000 ou 1 200 euros. Ces rémunérations ne me causent aucun problème de conscience. Lorsque je sors de la réunion, une fois mon contrat fini, tout lien de subordination avec la compagnie industrielle qui m’avait sollicité cesse ; je ne détiens aucun intérêt dans son fonctionnement. Je ne reçois ni royalties, ni stock options et demeure entièrement libre de mes mouvements et de mes décisions.
Jusqu’en 1995, j’étais expert à l’OMS et auprès du ministère. Lorsque j’ai pris ma retraite, en 1995, j’ai cessé ces fonctions. Depuis, je n’ai participé ni aux comités de crise ni aux différents conseils. J’en garde cependant un peu de regret : j’ai en effet été à l’origine des différentes actions de préparation de la pandémie. J’ai commencé à m’y intéresser à partir de 1980. En particulier, j’ai organisé en 1993 à Berlin une réunion sur la grippe et sa prévention, laquelle comportait un atelier spécifique sur la pandémie : qu’est-ce qu’une pandémie ? En surviendra-t-il une ? Telles étaient les questions évoquées.
Tous les experts s’accordent pour dire qu’il y a toujours eu des pandémies de grippe et qu’il y en aura toujours. Il n’y a aucune raison pour qu’elles cessent. Nous le disions dès 1990. Il faut vivre avec.
Par ailleurs – c’est un élément très important –, le virus de la grippe est un virus facétieux et trompeur. Avec lui, rien ne se passe jamais comme prévu. On pourrait conclure qu’il est un peu contradictoire de vouloir établir des plans pour organiser à l’avance une lutte contre un virus imprévisible. Certains experts disent préférer une absence de plan à un mauvais plan. D’autres en revanche considèrent qu’il vaut malgré tout mieux avoir réfléchi à l’avance pour prendre les mesures nécessaires lors de la survenue du danger. Je suis plutôt partisan de cette deuxième position.
En 1993, les travaux de la réunion que j’avais organisée ont abouti à la rédaction d’un document de recommandations à l’attention des gouvernements, des industriels et de l’OMS. Ce document demandait aux gouvernements de se préoccuper de la question. Deux États seulement l’avaient déjà fait, le Canada et les États-Unis. Nous tirions en quelque sorte la sonnette d’alarme, indiquant qu’une pandémie était un jour possible et qu’en ce cas, il était sans doute préférable que les États aient défini à l’avance une politique. Aux industriels, le document demandait d’être prêts, en cas de nouveau virus, à élaborer un vaccin aussi vite que possible. Enfin, il invitait l’OMS à encourager la mise au point de ces plans. Je vous remettrai ce document.
L’année suivante, en 1994, a été créé en France un groupe de travail pour l’élaboration de stratégies de prévention et de contrôle des épidémies de grippe. Ce groupe est ensuite devenu la « cellule de crise » contre la grippe. En juin 1995 il a publié un premier rapport, élaboré en collaboration avec l’ensemble des ministères. Tous sont en effet impliqués : une épidémie de grippe concernera aussi bien les transports que l’armée, les hôpitaux, les écoles, ou encore le commerce et la distribution. Ce document a été le premier d’une série d’autres qui ont abouti au dernier plan « pandémie grippale ».
Si, ayant pris ma retraite en juin 1995, ma collaboration officielle avec les services de l’État s’est arrêtée, j’ai cependant continué à être consulté par ceux avec lesquels j’avais collaboré. Lorsque la situation a commencé à devenir plus sérieuse, avec l’apparition du virus de la grippe aviaire, le H5N1, puis du virus dit de la grippe A, c’est-à-dire le virus H1N1v — v signifiant variant car en 1918 et en 1977, le virus de la grippe était déjà le virus H1N1 —, j’ai été consulté de façon officieuse par le ministère de la santé, aussi bien à l’époque de M. Xavier Bertrand, qu’à celle de Mme Roselyne Bachelot-Narquin. Le ministère s’est en effet mis à organiser des réunions officieuses d’experts, sortes de réunions de réflexion, de brainstorming, où chacun donnait librement son avis, et donc bien différenciées des réunions officielles ou des cellules de crise. Je n’ai pas participé aux réunions officielles.
Quelles ont été les positions des experts ?
Le 27 avril 2009, l’alerte est déclenchée après que le virus eut frappé un enfant au Mexique. Dix-sept jours plus tard, 14 cas était répertoriés en France. Jamais une telle vitesse de propagation d’une pandémie n’avait été observée. En quatorze jours, le virus était passé du Mexique aux États-Unis, au Canada, en Espagne, en Grande-Bretagne et même en France, pays pourtant moins directement relié au Mexique. Le Mexique comptait alors déjà 60 morts – à ce jour, il y en a eu 1 100.
Extrêmement contagieux, considéré très vite par les centres de référence comme assez largement nouveau, ce virus créait l’une des situation les plus graves que les experts avaient pu envisager.
Dès le début, en dépit de la mise en place d’une politique destinée à limiter l’expansion de la maladie –les mesures d’isolement des premiers malades étaient parfaitement justifiées –, l’épidémie s’est très largement répandue.
Elle présentait deux caractéristiques : elle était extrêmement contagieuse, mais aussi – cette constatation a aussi été faite dès le début – pas aussi mortelle qu’il n’avait été craint.
Les experts ont alors été consultés. Il faut noter qu’il ne forment pas une population homogène : certains sont spécialistes d’une question de longue date ; d’autres ne s’y intéressent qu’une fois qu’elle est sous le feu de l’actualité. Les avis des experts peuvent aussi être divergents.
Dès le 11 mai, quinzième jour de l’épidémie, un expert a déclaré dans une conversation qu’elle pourrait causer peut-être 30 000 morts en France. Ces propos ayant été immédiatement relayés par la presse, une inquiétude s’est développée.
Dans les réunions auxquelles j’ai participé, mon avis sur le développement de l’épidémie à l’avenir m’a été demandé. Je l’ai donné, tout en indiquant mes réserves sur la fiabilité des prévisions possibles. Puis l’Institut de veille sanitaire m’a fait savoir qu’il allait lancer une nouvelle présentation, sur internet, du Bulletin épidémiologique hebdomadaire et qu’il souhaitait que je rédige le premier éditorial de ce BEH web – c’était le nom choisi – sur la question. Cet éditorial a été publié le 29 juin et il reprenait des considérations écrites au début du mois de juin.
Ce texte, intitulé « Que nous apprennent les pandémies du passé ? », qui correspond précisément à mon domaine de compétences – j’ai plus de compétences sur le passé que sur le futur de la virologie –, retrace ce que pensaient la majorité des experts avec qui j’ai travaillé, ou que j’apprécie. Plusieurs de ceux que vous avez entendus, ou que vous entendrez – François Bricaire, Jean-Claude Manuguerra, Jean-Marie Cohen… –, sont en effet des gens avec qui j’ai travaillé, et même, dans certains cas, que j’ai formés.
Dans ce texte, j’exposais, sur la base de considérations élaborées vingt jours après le début de la pandémie, que trois possibilités étaient ouvertes.
La première était celle d’un arrêt de la pandémie : « ça fait pschitt ».
La deuxième était celle d’une épidémie du même type que la grippe saisonnière, accompagnée sans doute d’une récurrence au cours des années suivantes.
Enfin, la troisième était celle d’un scénario catastrophe, une situation du même type que celle de 1918 ; en effet – cela a été confirmé par la suite – le virus était le même, ou en tous cas lui ressemblait beaucoup. Face à lui, il y a très peu d’immunité ; seules quelques personnes âgées sont immunisées – à l’époque, ce point même n’était pas sûr. La situation pouvait donc s’envenimer.
Suite à mon intervention au cours de cette réunion, l’une des personnalités qui m’interrogeaient m’a demandé quel pourcentage comparatif de réalisation je donnais à chacune des trois hypothèses. J’ai répondu que je ne pouvais pas pondérer les probabilités de réalisation de chacune des hypothèses les unes par rapport aux autres. À cette époque, les experts n’étaient pas tous absolument sûrs de la réalisation d’un scénario apocalyptique.
Dans ma conclusion, je tirais l’enseignement de l’historique des différentes pandémies. Il faut savoir que quelques-unes, dont celle de 1947 – dont nous avons isolé le virus, lui aussi un variant H1N1 –, ne sont pas homologuées : pendant le XXème siècle, cinq épidémies ont eu lieu et non trois.
Voici cette conclusion :
« 1 – Toutes les pandémies ne sont pas des catastrophes. Certaines avortent et il est très probable que d’autres à l’avenir auront un impact limité.
« 2 – Certains virus sont capables, après avoir couvé pendant quelques temps, de développer grâce à des mutations spontanées et aléatoires… [ou des réassortiments] … trois caractéristiques qui les rendent dangereux : une forte transmissibilité chez l’homme, … [c’est le cas du virus qui nous concerne]…un pouvoir pathogène exacerbé … [tel n’est pas le cas]… et le fait d’acquérir une résistance aux antiviraux ». Cette caractéristique est un danger supplémentaire puisque dans ce cas, nos armes deviendraient inopérantes, mais ce n’est pas le cas pour ce virus.
« 3 – L’acquisition et les évolutions de ces caractéristiques sont pour l’instant impossibles à prévoir.
« 4 – L’évolution est souvent diphasique, la deuxième vague étant la plus grave. Après la pandémie, ces virus rentrent dans le rang et deviennent des virus saisonniers, parfois cohabitant avec d’autres.
« 5 – la situation en 2009 a évolué. D’un côté, on dispose d’armes nouvelles : capacité de détection, réseaux de surveillance, vaccins, antiviraux, antibiotiques. Mais de l’autre, les liaisons internationales beaucoup plus rapides et le développement de l’urbanisation accélèrent la transmission. »
Je vous fournirai ce document.
En conclusion de cet exposé introductif, je voudrais vous faire part de mon inquiétude, pour plusieurs raisons. La première est que le virus est le même qu’en 1918.
Ensuite, sa contagiosité extrême représente un danger réel : elle rend sa vitesse de diffusion extrêmement rapide.
Le virus s’est aussi manifesté au cours d’une saison inhabituelle : le 27 avril, lorsqu’il est apparu au Mexique, la température était de 30 degrés. Jamais une épidémie, même moindre, n’était survenue par de telles températures. À vrai dire, jamais nous n’avions constaté d’épidémie de grippe en pays tropical. Dans ces régions, la maladie est endémique : le virus ne se conserve pas bien dans l’air et se transmet mal. Celui-là s’est transmis même lorsqu’il faisait très chaud, ce qui est bizarre.
Un autre motif d’inquiétude est que ce virus cause des morts dans des types de populations peu habituelles. On trouve des formes graves de la maladie, et même des décès, chez les enfants, les femmes enceintes et les adultes jeunes. La moitié ou le tiers des cas se produit chez des personnes qui, traditionnellement, étaient considérées comme ne présentant aucun facteur de risque préalable.
En revanche, certains éléments sont rassurants. La létalité est faible. La maladie des personnes touchées est le plus souvent extrêmement bénigne – en revanche, nous ne savons pas jusqu’à quand : des variations sont possibles, surtout avec la deuxième vague. Ensuite, le virus reste encore sensible aux antiviraux ; cela nous donne des armes pour les formes les plus graves.
Pour conclure, je dirai que, jusqu’à aujourd’hui – en avril 2010 –, nous avons eu trois chances.
La première est que ce virus, très contagieux, ne soit pas plus agressif – nous ne savons pas pourquoi. Sous les réserves que nous avons faites, il n’est pas très pathogène. C’est une grande chance : compte tenu du nombre de cas, il aurait pu faire en France non pas 300 morts mais 30 000, comme prévu par un de mes collègues.
La deuxième chance est que le vaccin reste, malgré toutes les bêtises qui ont pu être dites à son sujet, la meilleure arme pour la suite. On peut conclure de son administration à près de six millions de personnes – jusqu’à 300 millions de doses ont sans doute été administrées dans le monde – qu’il a été dans l’ensemble bien supporté. Sans cette chance, si les prévisions catastrophiques qui avaient été faites s’étaient réalisées, la situation aurait été épouvantable.
La troisième et dernière chance est que le nouveau virus a étouffé les anciens. Cet élément était également nouveau. D’habitude, les autres virus, le H3N2, le B, sont aussi facteurs d’épidémies. Or, l’épidémie de grippe n’a été quasiment due qu’au H1N1v. Les autres virus n’ont pas causé de dégâts.
Le bilan global de cette pandémie aura donc été presque équivalent à celui d’une épidémie normale.
La seule réserve finale est que la modification de la marche de l’épidémie et ces trois chances n’ont pas pour cause les actions entreprises.
M. le président Jean-Christophe Lagarde. Merci, monsieur le professeur pour cet exposé.
Selon vous, le vaccin contre le virus H1N1v a-t-il été réalisé dans des conditions de sécurité similaires aux vaccins contre la grippe saisonnière ? Comment expliquez-vous qu’il ait été à ce point contesté et mis en doute par les milieux médicaux eux-mêmes ? Nous avons constaté dans nos auditions que si les médecins se sont largement vaccinés, tel n’a manifestement pas été le cas des autres professions médicales. Enfin, pourquoi les pays sans stratégie vaccinale n’ont-ils pas connu de pandémie ?
M. Claude Hannoun. Contre la grippe saisonnière, la formule de vaccin qui a été élaborée donne satisfaction. Malheureusement, chaque année, il faut changer une ou plusieurs des trois souches. De ce fait, après la fin de chaque saison de grippe, le vaccin est périmé. Il faut alors en élaborer un autre avec des souches différentes.
Il y a vingt ans, un problème réglementaire s’est posé. Remplacer, par exemple, le H3N2 Victoria par le H3N2 Port Chalmers correspond-il à la création d’un nouveau vaccin ? Si on considère que le remplacement constitue une création, c’est l’intégralité d’une nouvelle procédure d’autorisation de mise sur le marché (AMM) qui doit être conduite. En revanche, si le remplacement de la souche est considéré comme une modification mineure – la virulence de la souche n’a aucune importance, puisque la souche est un vaccin inactivé –, il a été décidé tant à l’échelon international qu’en France que ce changement ne donnerait lieu qu’à une révision d’AMM, et non à une nouvelle AMM, cette révision ne nécessitant qu’un essai clinique rapide. En l’occurrence, le délai, très bref – il court de février, quand sont décidées les compositions de vaccins, à septembre, où ils sont mis sur le marché –, n’est pas suffisant pour conduire une procédure d’AMM ; en revanche, il permet de vérifier l’efficacité et l’innocuité du vaccin sur cinquante sujets. Une fois celles-ci constatées, l’autorisation de modification d’AMM est donnée.
H1N1v est un virus comme un autre. Un autre virus H1N1, le H1N1 « normal », est du reste déjà présent dans le vaccin. Quelques contrôles supplémentaires ont néanmoins été ajoutés. Cependant, il est légitime de considérer que la situation est la même que la situation habituelle, et que l’introduction d’une souche différente sur les bases de la technologie industrielle et de la composition générale du vaccin est possible.
Néanmoins, comme la souche a été confiée aux producteurs en juin au lieu de février, qu’il fallait que le vaccin soit produit le plus vite possible, l’industrie – qui était de plus en pleine phase de production du vaccin saisonnier – a été mise dans une situation difficile. Elle a donc légèrement diminué sa production de vaccin pour la grippe saisonnière et transféré les moyens ainsi libérés sur le vaccin contre le virus H1N1v. Elle a ensuite produit le vaccin nouveau avec les procédés et les moyens habituels.
Il s’agissait cependant d’une primo-vaccination. Or, même dans le cas du vaccin contre la grippe saisonnière, la primo-vaccination demande deux injections : les enfants vaccinés pour la première fois reçoivent deux doses de vaccin et non une. Lorsqu’ils ont grandi, et qu’ils ont eu des contacts avec le virus, les vaccinations ultérieures – qui, de plus, sont pour partie des revaccinations – sont effectuées en une seule fois. L’hypothèse formulée a donc été celle d’une vaccination en deux doses.
Le vaccin contre la grippe présente aussi l’inconvénient considérable d’une efficacité bien loin d’être absolue. Elle est au mieux de 80 % chez les adultes, et parfois seulement de 70 %, voire moins, chez les personnes âgées. Par comparaison, l’efficacité des vaccins contre la rougeole, la poliomyélite ou la fièvre jaune est de 99,9 %. La raison de cette moindre efficacité n’est pas connue. Le vaccin reste néanmoins très efficace contre les formes graves de la maladie et pour lutter contre la mortalité.
Pour renforcer son efficacité – et comme pour d’autres vaccins –, des adjuvants de l’immunité ont été introduits. Ceux qui ont été utilisés, notamment le squalène, le sont déjà dans d’autres vaccins et ont déjà été administrés à des millions de personnes. La proposition de les utiliser pour le vaccin antigrippal n’a suscité aucune réaction au sein des milieux scientifiques. L’un des plus grands immunologistes de France, le professeur Jean-François Bach, expose aujourd’hui même dans un rapport à l’Académie des sciences – dont j’ai entendu un extrait hier – qu’il n’existe aucune raison de mettre en doute l’efficacité ou l’innocuité des adjuvants utilisés.
C’est donc un mauvais procès qui a été fait au vaccin. Il repose sur des rumeurs assez anciennes : en 1976 déjà, lors de l’épidémie de grippe porcine aux États-Unis, on avait évoqué l’existence de complications – sous la forme de syndromes de Guillain-Barré – dues au vaccin ; toutefois, cette rumeur a été entièrement démentie par la suite. Nous n’avons aucune raison de penser que la vaccination de 40 millions d’Américains a entraîné une augmentation du nombre de cas du syndrome en question ; un certain nombre de ces 40 millions d’Américains l’auraient de toute façon contracté, cette maladie n’étant absolument pas rarissime. Qui plus est, le vaccin contre la grippe porcine de 1976 ne comportait pas d’adjuvant : j’ai moi-même participé à son élaboration aux États-Unis et j’ai été l’un des cobayes de son expérimentation. Bref, on peut parler de manipulation et de déformation.
M. le président Jean-Christophe Lagarde. L’innocuité d’adjuvants éprouvés peut-elle être modifiée lorsque la souche a été changée ?
M. Claude Hannoun. C’est parce que l’hypothèse ne peut être absolument éliminée a priori que des essais ont été conduits. Cela dit, elle n’a pas de fondement rationnel.
Ce sont les industriels qui ont réalisé les essais, et non la recherche publique – elle le pourrait techniquement, mais des crédits gigantesques seraient nécessaires. Ils effectuent des expérimentations des mélanges d’adjuvants, sur l’animal d’abord puis, après autorisation, sur l’homme.
Pour autant, il est fondamental pour les chercheurs qui n’appartiennent pas au monde de l’industrie de connaître ces expérimentations. Une fois celles-ci achevées, les industriels les soumettent à l’un de ces comités consultatifs, de ces advisory boards, constitués d’experts internationaux indépendants que j’évoquais au début de la présente audition. Ces experts donnent ensuite leur avis. Cette procédure permet de connaître les travaux des industriels, l’évolution de leurs recherches, et d’effectuer des comparaisons – sans, bien sûr, communiquer à l’un les éléments fournis par l’autre, le processus relationnel comportant une clause de confidentialité. Les contacts entre les industriels et les scientifiques ne méritent pas qu’on jette l’opprobre sur ces derniers : ils en ont besoin pour connaître les travaux des industriels et ils n’entachent en rien leur indépendance. Par ailleurs, les chercheurs se contrôlent les uns les autres.
J’ai personnellement été assez déçu par l’attitude du corps médical. Dès le début de la pandémie, il a émis des réserves : un sondage indiquait que 30 % des médecins seulement se feraient vacciner. Les médecins disent aujourd’hui que c’est vers eux que le citoyen va se retourner lorsque la vaccination va lui être proposée ; mais si le médecin lui dit que lui-même ne se fait pas vacciner, l’effet est catastrophique ! Pour moi, l’attitude du corps médical est l’une des raisons importantes de la si mauvaise réception de la vaccination par le public, et je le regrette. Certains propos que j’ai entendus de la part de médecins sont pour moi inacceptables : ils signifient que les médecins se retirent de la dimension scientifique de la vaccination, qu’ils se positionnent sur un autre registre. Un médecin devrait être formé à la prévention, et être dans ce domaine beaucoup mieux informé sur les vaccins et leur utilisation qu’il ne le semble aujourd’hui.
M. Jean-Pierre Door, rapporteur. Merci, monsieur le professeur, pour ce témoignage passionnant.
Hier, l’un de vos élèves, le docteur René Snacken, du Centre européen de prévention et de contrôle des maladies, basé à Stockholm, m’a tenu les mêmes propos que vous : connaissance et incertitude.
Parmi les connaissances figurent le génétype du virus, la sévérité de son action sur certaines catégories de personnes qui n’avaient jamais été touchées de cette façon, et la dominance de ce virus sur le virus saisonnier qu’il a effacé.
Les incertitudes portent sur les conséquences de l’apparition du virus : absence de pandémie – « ça fait pschitt » –, pandémie aux conséquences limitées ou pandémie dramatique.
Le docteur Snacken nous a aussi confirmé que la position du centre était de mettre en application le règlement sanitaire international (RSI), rédigé il y a deux ou trois ans, après l’épisode du virus H5N1. Or, la mise en application du règlement sanitaire international a pour conséquence une stratégie de vaccination de l’ensemble de la population. La Suède a donc acheté 18 millions de doses, avec l’objectif de vacciner les 9 millions de Suédois.
Par ailleurs, pour la vaccination, un ordre de priorité des publics a été établi. Était-il logique ?
M. Claude Hannoun. Tout à fait.
M. le rapporteur. Était-il nécessaire de mettre à la disposition du public, des professions de santé, le Tamiflu ?
Ensuite, comment jugez-vous la décision d’appliquer le RSI ? La réaction n’a-t-elle pas été trop rigide, alors que la virulence du virus n’était pas encore vraiment connue ?
Enfin, quid du futur vaccin ? Le docteur Snacken nous a dit qu’un vaccin trivalent serait proposé.
M. Claude Hannoun. Il est en fabrication. Il sera mis en distribution en septembre.
M. le rapporteur. Ce vaccin associe les virus H1N1, H3N2 et B. Quelle est la probabilité qu’il évite l’an prochain le retour d’une épidémie de grippe due au H1N1v ?
M. Guy Lefrand. Monsieur le professeur, selon vous, les experts de l’OMS ont considéré que le risque de pandémie était constitué, doit le troisième scénario que vous avez évoqué. Dès lors, estimez-vous que la stratégie développée pour la vaccination, le lancement du plan « pandémie grippale », était la bonne ? Aurait-il fallu au contraire prendre plus de recul avant de réagir ?
M. Jean-Paul Bacquet. Selon quels critères le choix du troisième scénario a-t-il été fondé ? L’inscription du principe de précaution dans la Constitution a-t-il pesé sur le choix des experts ?
Pouvons-nous disposer aujourd’hui d’hypothèses plus précises quant à la certitude d’une future pandémie, un peu comme pour la crue centennale de la Seine à Paris ?
Enfin, monsieur le professeur, je ne partage pas votre opinion selon laquelle, en refusant la vaccination, les médecins se sont retirés scientifiquement de l’opération. Pour moi, c’est parce qu’ils se sont senti exclus de cette décision politique et médicale de santé publique, qu’ils ont considéré qu’elle ne les concernait pas. Voilà quelques années, une opération de vaccination de masse contre la méningite a été organisée dans une partie du département du Puy-de-dôme, laquelle a été confiée aux médecins militaires et à ceux de la sécurité sociale. Eh bien, la réaction des médecins libéraux a été identique : ils n’ont pas compris leur exclusion. Cette exclusion avait d’ailleurs pour conséquence que, dans le cas de deux enfants de la même famille fréquentant des écoles différentes, l’un pouvait être vacciné et l’autre non!
L’exclusion des médecins de l’organisation de la vaccination contre le virus H1N1v ne pouvait pas en faire des vecteurs de communication favorables. Ils n’ont même pas eu à se poser la question de la validité scientifique de la vaccination.
M. Michel Lejeune. Quelles précisions pouvez-vous nous apporter sur le caractère diphasique de la pandémie ? Un deuxième pic va-t-il se produire ?
M. le président Jean-Christophe Lagarde. Pensez-vous, monsieur Hannoun, que la vaccination de 6 millions de personnes peut empêcher ce pic ?
M. Jean Mallot. Dès lors que le vaccin n’était pas considéré comme nouveau, nous avez-vous dit, une nouvelle AMM ne s’imposait pas ; des essais cliniques en quelque sorte minimaux, effectués par les industriels en vue d’une modification d’AMM suffisaient. Néanmoins, avez-vous ajouté, des experts indépendants étaient consultés sur ces essais.
Avez-vous la conviction d’avoir connaissance de tous les essais réalisés par les laboratoires ? Les experts ne peuvent donner leur avis que sur ce dont ils sont saisis.
M. Claude Hannoun. Nous n’avons en effet connaissance que des essais qui nous sont présentés.
M. Jean Mallot. Qu’un grand nombre de médecins aient décidé de ne pas se faire vacciner et l’aient fait savoir a eu, à votre avis, des conséquences catastrophique sur l’état d’esprit de la population. Cependant, votre relation de l’évolution de la pandémie dans les pays sans stratégie vaccinale conduit à la tentation de conclure que celle-ci était assez indépendante des politiques nationales de vaccination. Faudrait-il en conclure que la vaccination ne changerait rien ?
M. Claude Hannoun. En fait, c’est le plan pandémique qui a été appliqué. Or, si les plans pandémiques sont proposés par l’OMS, et calés sur les phases qu’elle définit, l’OMS ne décide pas pour les États. Chaque gouvernement prend sa décision. Ainsi, alors que l’OMS avait déclaré la phase 6, la France en est restée à la phase 5B.
Cependant, à mon sens, une erreur de communication a été commise. Le plan n’a pas été assez expliqué. Il aurait été possible d’indiquer très simplement que, loin de constituer un cadre figé, le plan était évolutif. De plus, il a été inspiré de celui élaboré pour le virus H5N1 et modifié au fur et à mesure. Or, alors que les changements étaient chaque fois la preuve d’une gestion, certes à vue – comment faire autrement ? – mais solide du dispositif, chaque modification a été accompagnée de critiques de l’opinion sur l’irrésolution des responsables.
Tous les vaccins antigrippaux saisonniers sont déjà trivalents : trois virus y sont mêlés. La modification opérée sur le prochain vaccin est le remplacement du H1N1 ancien, qui n’est plus très actif depuis quelques années, par le H1N1v. Le vaccin conservera le même nom : H1N1 sera simplement suivi d’un « v ».
Même si, en matière de prévision, des réserves s’imposent toujours , on peut être assuré que le virus H1N1v sera de nouveau actif l’hiver prochain – je réponds ainsi à la question sur la deuxième vague.
Le nombre de 5,8 millions de personnes vaccinées n’est évidemment pas suffisant pour contenir une vague épidémique nouvelle. Cependant, 10 millions de personnes ont été infectées, directement ou indirectement ; or, en les ajoutant aux personnes vaccinées, c’est plus de 15 millions de personnes, près de 25 % de la population française, qui ont été en contact avec le virus. L’hiver prochain, le virus H1N1v ne trouvera donc pas devant lui 100 % de personnes sensibles, ou presque. Et si l’on met à part les personnes âgées, soit encore 20 % de la population, plus d’un quart de la population sensible aura déjà été en contact avec le virus. L’épidémie pourra donc être moins grave.
M. le rapporteur. Ne craignez-vous pas que, eu égard à l’expérience de la population cette année, la prochaine campagne de vaccination soit un « flop »?
M. Claude Hannoun. Si, bien sûr. Le danger est réel.
Comme chaque année, la campagne de vaccination contre la grippe va reprendre en septembre. La CNAM va de nouveau adresser des bons aux personnes à risques.
M. le rapporteur. Cette campagne est un succès depuis longtemps.
M. Claude Hannoun. Certes. Mais les personnes à risque ne sont pas les mêmes que celles à qui la CNAM adresse habituellement ses bons de vaccination contre la grippe saisonnière. Celles-ci sont les personnes atteintes de maladies chroniques – qui restent à risque – et celles de plus de soixante-cinq ans. Or, les personnes de plus de soixante-cinq ans sont les moins exposées ! Que décidera la CNAM ? Je ne le sais pas.
M. le président Jean-Christophe Lagarde. Puisque le vaccin protège aussi de la grippe saisonnière, vous suggérez donc, monsieur le professeur, que soient vaccinés à la fois les destinataires habituels des bons de vaccination mais aussi les personnes identifiées comme à risque au regard du nouveau virus ?
M. Claude Hannoun. La campagne de vaccination doit être maintenue.
M. le président Jean-Christophe Lagarde. En excluant les jeunes ou les asthmatiques ?
M. Claude Hannoun. Si l’on veut ne pas le faire, il faut passer à la vaccination universelle, comme les Canadiens ont commencé à le faire au Québec.
Il y a là une difficulté, mais je ne peux pas vous présenter de solution. La CNAM va sans doute y réfléchir, mais je ne suis pas au courant de l’état de ses réflexions.
En France, nous n’avons pas choisi le scénario catastrophe de préférence aux deux autres. Nous avons appliqué les mesures prévues en fonction des scénarios.
Pourquoi le choix – essentiel – a-t-il été fait d’acheter 94 millions de doses de vaccins et de constituer un stock de Tamiflu ? Le calcul est simple : pour arrêter une épidémie grave, telle que celle que nous craignions, au moins 70 % d’une population– et non pas 30 %, comme je l’ai entendu – doivent être immunisés ; dans ce cas, la proportion de personnes sensibles est insuffisante pour entretenir le feu. Une proportion de 70 % de 60 millions de personnes nécessitant chacune deux doses de vaccin représente 94 millions de doses. Cela dit, ce raisonnement est celui des experts, et je ne peux pas vous dire si, pour arriver à ce même total, les décideurs ont suivi le même raisonnement.
M. le président Jean-Christophe Lagarde. Dans les réunions de brainstorming auxquelles vous avez participé, le principe de la vaccination a-t-il été très discuté ou a-t-il constitué un élément très consensuel ?
M. Claude Hannoun. C’était un élément consensuel : avant les antiviraux – qui sont récents –, il n’existait pas d’arme curative contre la grippe : l’unique arme était préventive. La vaccination est la seule façon de se débarrasser de la grippe.
Avec la vaccination, l’excédent de mortalité, qui était de 5 000 à 10 000 personnes par an, est tombé à 2 000 ou 3 000. C’est ainsi que, avec le début des campagnes de vaccination, dans les années 1984-1985, la mortalité par grippe, qui touchait principalement les personnes âgées, s’est effondrée : le nombre de décès dus directement à la grippe – et c’est à ce nombre qu’il faut comparer les 300 morts d’aujourd’hui –, qui était alors compris entre 1 000 et 2 000, est tombé à quelques unités, entre 10 et 30. La comparaison entre les 300 morts confirmées de la grippe A(H1N1)v et l’excédent de mortalité de 3 000 dû à la grippe saisonnière n’est donc pas pertinente.
J’ai décrit mes cinquante ans de carrière, mon histoire personnelle et l’histoire de la grippe à travers une vie de chercheur, dans un ouvrage intitulé La grippe, ennemi intime ; itinéraire d’un virologue, qui a été publié en septembre dernier – pendant la pandémie, ce qui n’était sans doute pas le meilleur moment.
La question de l’exclusion des médecins est essentielle. Votre analyse, monsieur Bacquet, est juste pour le moment où le plan a été lancé. Il reste que, avant même cet épisode, les médecins n’étaient déjà pas très favorables au vaccin.
Les recommandations générales pour vacciner le corps médical et les personnels soignants contre la grippe saisonnière étaient jusqu’à récemment très mal appliquées par les médecins ; 20 % d’entre eux tout au plus se faisaient vacciner, alors que chaque hiver, ils rencontrent des gens susceptibles de les contaminer et qu’ils sont eux-mêmes susceptibles de contaminer des patients qui n’ont pas la grippe. Ce très faible taux de vaccination est sans doute lié à des raisons personnelles : considérant qu’ils n’ont jamais attrapé la grippe, ils ne se vaccinent pas.
M. Jean-Paul Bacquet. Ne pas se faire vacciner ne signifie pas forcément s’opposer à la vaccination ! Les médecins vaccinent, et très largement : le taux de vaccination en France est le meilleur d’Europe. Dans le cas particulier de la grippe H1N1, non seulement ils ne se sont pas fait vacciner, mais, de plus, ils ont travaillé contre la vaccination. Qu’ils n’aient pas été acteurs, c’est une chose, mais ils n’ont même pas été consultés pour être des vecteurs de communication ! Les cellules mises en place dans chaque préfecture pour organiser et suivre la vaccination ne comportaient pas de médecins. Dans mon département, où je siégeais en tant qu’élu, c’est moi qui ai dû demander que les organisations professionnelles soient représentées – il n’y avait même pas de médecins !
M. Claude Hannoun. J’ai également remarqué que c’était le cas dans un comité national.
M. le président Jean-Christophe Lagarde. Monsieur le professeur, merci d’avoir participé à cette audition.
La séance est levée à dix heures quinze.
Audition de M. le professeur Bernard Bégaud,
pharmacologue
(Procès-verbal de la séance du mardi 13 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête,
puis de Mme Jacqueline Fraysse, vice-présidente)
La séance est ouverte à dix heures quinze.
(M. Bernard Bégaud prête serment.)
M. Bernard Bégaud, pharmacologue. Je suis médecin, professeur de pharmacologie médicale à l’université de Bordeaux. Je dirige une unité de l’INSERM
– l’Institut national de la santé et de la recherche médicale –, sur une matière proche du sujet auquel vous vous intéressez puisqu’elle traite de « Pharmaco-épidémiologie et évaluation de l’impact des produits de santé sur les populations ». Auparavant, j’ai présidé une université et j’ai été impliqué dans de multiples commissions d’organismes comme l’AFSSAPS, l’Agence française de sécurité sanitaire des produits de santé ; j’ai également travaillé, dans les années quatre-vingt, à la Direction générale de la santé.
Je suis intervenu à l’occasion de l’épisode de la vaccination contre l’hépatite B, qui était une tout autre affaire, ainsi qu’à propos des conflits d’intérêts touchant les experts. Même s’il est difficile de trancher, j’ai alors eu l’occasion de témoigner dans la presse, à la lumière de plus de vingt ans d’expérience sur des sujets chauds, du fait que des conflits d’intérêts s’étaient sûrement produits – et je ne vois pas pourquoi l’affaire de la grippe ferait exception. C’est d’autant plus gênant que la France et les autres pays européens ont probablement moins bien réglé le problème que les États-Unis mais cela ne me semble toutefois pas constituer l’objet central de la problématique concernant la campagne française contre la grippe H1N1. S’il y a des remarques à formuler, ce n’est pas tellement à propos de l’achat de millions de doses à la suite de contacts ou de pressions présumés.
Bien qu’ayant été régulièrement sollicité par les médias du fait de ma très forte implication dans l’affaire de la vaccination contre l’hépatite B, j’ai préféré me taire à propos de la vaccination contre la grippe, pour des motifs républicains : quand un pays traverse ou risque de traverser une crise sanitaire, il est d’assez mauvais goût de s’étaler pour critiquer voire dénoncer l’action conduite. Après-coup, il est certes facile, pour le bureaucrate que je suis, d’aboyer avec les loups ou d’émettre des observations livresques ; d’un autre côté, en tant que citoyen spécialiste de santé publique, je me dois de m’interroger car il est très difficile d’y voir clair.
Ayant beaucoup lu sur le sujet et ayant même écouté les débats parlementaires à l’Assemblée nationale et au Sénat, lorsqu’ils étaient retransmis, j’éprouve moi-même du mal à répondre à la question suivante : y a-t-il quelque chose à reprocher ? Il convient de s’en tenir à des évidences.
Premièrement, la différence entre l’objectif annoncé par les organisateurs de la campagne et le résultat atteint est assez surprenante : alors qu’il était prévu de vacciner 75 % de la population française, c’est-à-dire 47 millions de sujets, seuls 9 à 10 % des gens, soit sept à huit fois moins que l’objectif proclamé, étaient vaccinés trois ou quatre mois plus tard. Le spécialiste se demande immédiatement si cet écart a été volontaire ou subi. Telle est la question cruciale : soit les organisateurs de la campagne ont su très tôt que le virus ne serait pas aussi dangereux que prévu et ont alors agi de sorte à ne pas faire monter le dispositif en puissance de manière exagérée, soit ils n’ont tout bonnement pas réussi à obtenir un meilleur taux de vaccination.
Si la première hypothèse est la bonne, cela signifie que les organisateurs ont légitimement dramatisé la situation tout en étant eux-mêmes rassurés ; sinon, c’est très grave, car, au cas où le virus aurait été aussi dangereux que prévu, une hécatombe sanitaire se serait produite. Même s’il reste à modéliser cette théorie, l’on considère que la propagation exponentielle d’une épidémie ou d’une pandémie est enrayée dès lors que 30 % environ de la population est immunisée.
Les spécialistes en santé publique du ministère – Mme la ministre a sans doute repris peu ou prou leur argumentation – en ont conclu que la campagne a été un succès puisque 9 à 10 % des gens ont été vaccinés et 20 % ont été immunisés par contact. J’ignore si ces spécialistes incluent les personnes qui, comme moi, ont pu être au contact d’un virus ressemblant, en 1957. Quoi qu’il en soit, à moins qu’ils aient été rassurés dès le début, leur raisonnement est effrayant : cela signifie que 20 % de la population a été en contact avec le virus, représentant 120 000 décès potentiels, si l’on retient l’hypothèse extrêmement optimiste au regard des annonces initiales, selon laquelle ne meurent que 10 % des patients porteurs de formes cliniques.
La campagne a-t-elle été volontairement menée de façon prudente et n’a-t-elle pas été portée au-delà parce que l’absence de dangerosité était connue ? En tant que citoyen, je l’espère. Sinon, c’est inquiétant, au regard de ce qui aurait pu se passer comme de ce qui pourrait se passer demain si une épidémie ou une pandémie beaucoup plus grave survient. Si les sujets immunisés en 1957 sont inclus dans le calcul, il n’aurait pas dû être nécessaire de les vacciner. Dans ce cas, pourquoi avoir commandé 94 millions de doses ?
Deuxièmement, la communication des risques – sujet sur lequel travaille mon unité de recherche – a semblé un peu bizarre, pas idéale, même si ce ne fût pas aussi délibéré que lors du fléau de l’hépatite B, affaire qui reste comme le grand traumatisme français, une catastrophe de santé publique. Il a été très maladroit d’envoyer des messages contradictoires, en particulier à propos des adjuvants ; cela a contribué à la perte de confiance. S’il y a une chose à revoir dans l’avenir, c’est vraiment la communication. La France est un pays à la fois très centralisateur, voire jacobin, mais qui souffre de la multiplicité des structures – je ne citerai pas les comités, commissions, directions et agences qui sont intervenus. Cela s’explique mais les risques de cacophonie s’en trouvent augmentés. En revanche, s’agissant de la pharmacovigilance, à la différence de ce qui s’était produit lors de l’affaire de l’hépatite B, l’attitude a été assez exemplaire : un dispositif très crédible, bien conçu et efficient a été mis sur pied ; il n’a pas fait remonter de signaux particuliers mais, le cas échéant, il aurait été de nature à alerter les autorités.
M. Jean-Pierre Door, rapporteur. Après avoir expliqué qu’il était difficile de répondre, vous vous êtes fait un peu procureur à propos de la stratégie vaccinale, qui est au cœur de notre réflexion, en expliquant qu’elle était mauvaise et qu’elle a échoué. Nous savons que la communication a été quelque peu déficitaire, notamment sur internet, à travers les vecteurs comme Twitter ou Facebook. Dans le souci d’être constructif, quels conseils pourriez-vous prodiguer pour améliorer les campagnes de communication en matière vaccinale ?
M. Bernard Bégaud. Je ne pense pas m’être fait procureur. J’ai simplement voulu dire que cette campagne a été un échec si elle n’a pas été maîtrisée. En revanche, si elle a été maîtrisée, c’est un succès.
M. le président Jean-Christophe Lagarde. M. Bernard Bégaud s’interroge ; or un procureur ne s’interroge pas.
M. Bernard Bégaud. Et c’est aux autorités de répondre.
J’ignore comment la campagne de communication a été préparée ; au reste, dispenser des conseils serait d’une très grande prétention de ma part. Il n’en demeure pas moins qu’une telle campagne doit être préparée avec des gens dont c’est le métier, en particulier des spécialistes de la communication en risque sanitaire ; il en existe quelques-uns mais je ne suis pas sûr qu’ils aient été sollicités. Il est effectivement crucial de recourir aux moyens modernes, ce qui n’a pas été fait. Les gens sont allés chercher des informations sur internet : de nombreuses données factuelles y étaient disponibles, sur les sites des CDC, les Centers for Disease Control and Prevention, ou de l’InVS, l’Institut de veille sanitaire, concernant notamment le nombre de décès, mais l’outil a été très peu utilisé pour diffuser des messages.
Plusieurs erreurs de communication, lourdes de conséquences, ont été commises.
Premier exemple, l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) explique que les adjuvants, déjà contenus dans d’autres vaccins administrés à la tonne, n’entraînent aucun risque et, juste après, les autorités annoncent que plusieurs millions ou centaines de milliers de doses dépourvues d’adjuvants ont été préparées pour les personnes à risque. Pour la population, un tel message est catastrophique car elle en conclut immédiatement que les adjuvants comportent un risque.
M. le président Jean-Christophe Lagarde. C’est clair ! Tout le monde s’est interrogé !
M. Bernard Bégaud. Des doses non adjuvées auraient pu être préparées sans que cela fasse l’objet de communication ; dans les centres de vaccination, les femmes enceintes et les personnes présentant un lupus ou une maladie auto-immune auraient été discrètement dirigées vers un guichet B.
Deuxième exemple, nous autres médecins avons mis des années à faire comprendre à la population que, pour la grippe saisonnière, le risque létal concernait les personnes âgées. Dans le cas présent, le risque portant surtout sur les sujets jeunes, le message a été compris ainsi : il est inutile de vacciner les vieux. Selon moi, le message aurait dû être présenté différemment.
Troisième exemple, en communiquant quotidiennement le nombre de morts pour motiver les gens, l’on s’expose aux remarques du premier imbécile venu qui constate que la grippe saisonnière tue dix fois plus, ce qui dissuade de se faire vacciner.
Ces erreurs auraient pu être anticipées par des journalistes spécialisés ou, par exemple, par un ancien directeur général de la santé spécialiste de la grippe, mais je ne suis pas sûr qu’ils aient été associés à la réflexion. Il convient à la fois d’utiliser les moyens modernes et de préparer les messages.
M. Jean-Paul Bacquet. Les professionnels de santé ont été au premier rang en matière de communication négative. La principale erreur n’a-t-elle pas été le gros déficit de communication auprès des professionnels de santé pour en faire des vecteurs favorables ? L’enjeu n’était pas forcément de les associer à la vaccination mais au moins de les informer. Le parallèle avec l’hépatite B est très intéressant : ce n’est pas un mouvement des praticiens et des autres professionnels de santé qui a mis fin à la vaccination en milieu scolaire mais une décision politique, prise par qui l’on sait, à la suite d’un effet de mode dans les publications people. Sans doute aurait-il fallu commencer par communiquer en direction des professionnels de santé. Pour les vaccinations à venir, qu’en pensez-vous ?
M. Bernard Bégaud. Didier Tabuteau, qui fut le premier directeur général de l’Agence du médicament, l’a très bien dit : une campagne sanitaire ne peut réussir contre le tissu sanitaire. Le divorce est consommé : les syndicats de médecins généralistes affirment ne pas avoir été associés alors que Mme Bachelot-Narquin a eu l’occasion d’énumérer toutes les dates auxquelles elle a reçu des médecins. En tout cas, sur le terrain, si les médecins n’ont pas fait campagne contre la campagne, nous avons constaté que beaucoup d’entre eux ne l’ont pas relayée, se sont braqués et ont dit à leurs patients que la vaccination n’était pas nécessaire. À cet égard, c’est un échec. Cela dit, si la situation avait été très grave, il aurait certes mieux valu que les médecins soient là pour soigner plutôt que pour vacciner. Quoi qu’il en soit, tout aurait dû être fait pour que les médecins se comportent comme des relais et non comme fossoyeurs du message. À l’avenir, il conviendra de préparer toute action avec le tissu sanitaire – médecins et pharmaciens –, faute de quoi elle sera vouée à l’échec.
M. le président Jean-Christophe Lagarde. Je dois être l’un des rares membres de la commission d’enquête à ne pas exercer la profession de médecin mais je ne vois pas pourquoi il serait incompatible de vacciner et de soigner, car la phase de vaccination intervient avant que le virus se répande.
M. Bernard Bégaud. Là encore, je ne suis pas compétent, mais ce raisonnement semble provenir du plan Houssin, élaboré lors de la pandémie antérieure. Au début, je n’ai pas non plus compris ce choix considérant que les 50 000 médecins mobilisables immédiatement constituaient une force de frappe considérable pour vacciner une grande partie de la population. Néanmoins, ce choix – même bon – a été mal géré, les médecins s’étant transformés en contre-relais de la campagne ou en tout cas, d’après certains experts, n’ayant pas été suffisamment sollicités pour la relayer.
M. Guy Lefrand. J’ai un peu de mal à saisir pourquoi les autorités auraient fait le maximum pour ne pas vacciner la population après avoir commandé les doses de vaccin. Accessoirement, à quelles autorités pensez-vous ?
M. Bernard Bégaud. Imaginons que nous sommes aux commandes. Assez tôt au cours de l’année 2009, nous savons que la pandémie va toucher l’hémisphère Nord, en particulier la France. Nous bénéficions déjà d’une expérience acquise dans l’hémisphère Sud, y compris dans des départements français, mais nous ignorons peut-être encore que le virus n’est pas aussi dangereux que prévu et nous adoptons un objectif maximisé : vacciner toute la population, avec une attrition de 25 %, soit 47 millions de personnes. Nous commandons par conséquent 94 millions de doses – cela peut paraître un peu surcoté, comme si l’on voulait faire savoir que le virus allait trouver en France à qui parler, mais c’est nullement scandaleux – et nous mettons en œuvre ce plan quasi militaire de vaccination. C’est seulement ensuite que des indicateurs, provenant du comité technique du ministère, de l’Institut de veille sanitaire (InVS) ou d’ailleurs, réévaluent à la baisse la dangerosité du virus. Nous maintenons cependant le dispositif en le laissant suivre son mouvement, sans mobiliser au maximum les internes des hôpitaux et les autres moyens. Si les choses se sont effectivement passées ainsi, la vaccination de 10 % de la population en trois ou quatre mois a été volontaire. En revanche, si les autorités voulaient jusqu’au bout vacciner toute la population mais n’ont pas pu faire mieux, c’est que la situation a été subie et qu’elles ont essuyé un échec. Suis-je clair ?
M. Guy Lefrand. Parfaitement clair.
M. Bernard Bégaud. Cela me semble être la question fondamentale mais les organisateurs de la campagne sont sans doute les seuls à pouvoir y répondre.
Mme Marie-Louise Fort. Je ne suis pas médecin mais nombre de praticiens de ma circonscription m’ont expliqué qu’ils ont appris un principe : on ne touche pas au système immunitaire des femmes enceintes, on ne les vaccine pas ou du moins on évite de le faire. Qu’en pensez-vous ?
M. Bernard Bégaud. Vous auditionnerez des experts plus compétents que moi sur le sujet. Compte tenu du risque, le Haut conseil de la santé publique avait même identifié les femmes enceintes comme cible prioritaire. Toutefois, du fait de leur terrain immunitaire particulier transitoire, des vaccins sans adjuvant leur étaient destinés.
M. le rapporteur. En Suède, toute la population, femmes enceintes comprises, a été traitée avec un seul type de vaccin, contenant des adjuvants.
M. le président Jean-Christophe Lagarde. Pourquoi la France a-t-elle effectué le choix contraire pour les femmes enceintes ?
M. le rapporteur. Sous les effets de la campagne des ligues anti-vaccination.
M. le président Jean-Christophe Lagarde. Mais pas à la lumière d’arguments scientifiques valables. Je confirme que cette décision a été dévastatrice : si les personnes présentant un risque potentiel reçoivent un vaccin non adjuvé, les gens en déduisent que les adjuvants sont dangereux.
M. Bernard Bégaud. L’administration d’adjuvants, comme de n’importe quelle substance, comporte des risques ; des cas particuliers de réactions aux adjuvants ont du reste été observés. La perception que les Français ont du vaccin est paradoxale. Bien que, contrairement à une idée reçue, Pasteur n’ait pas inventé le vaccin, la France est le pays de la vaccination. Un certain rejet de la vaccination s’est pourtant développé, parfois rationnel, souvent parfaitement irrationnel, rejet qui s’est concrétisé lors de l’affaire de l’hépatite B. La République n’a jamais soldé le problème et la cicatrice est restée béante. Je ne comprends pas qu’aucun travail n’ait été conduit et qu’aucune décision politique n’ait été prise à la suite de cette affaire. La polémique relative aux adjuvants provient, entre autres, de l’affaire de l’hépatite B, à l’occasion de laquelle l’aluminium et autres produits avaient été incriminés, sans preuve, comme causes de myofasciite à macrophages ou de démyélinisation centrale. Cette sensibilité particulière explique peut-être que la campagne de la grippe H1N1 ait été gérée de la sorte. Tant que la France, aidée par ses spécialistes, n’expiera pas, par une anamnèse ou une analyse publique intégrale, l’histoire de l’hépatite B, la question traînera et resurgira.
M. Guy Lefrand. Je suis médecin mais pas vaccinologue. Pour stopper une épidémie, quel pourcentage de la population faut-il vacciner ?
M. Bernard Bégaud. Je ne suis pas non plus vaccinologue mais simplement pharmacologue et spécialiste en santé publique. Le taux de 30 % procède d’un schéma assez simple mais susceptible d’être modélisé mathématiquement, selon lequel, si la population est brassée de façon aléatoire, la propagation fulgurante de la transmission est cassée dès lors qu’un sujet sur trois est protégé. Ce taux de 30 % ne constitue toutefois pas un objectif en soi. En effet, pour éradiquer complètement une maladie, il faut vacciner presque tout le monde : la variole a disparu quand 100 % de la population a été vaccinée.
M. le président Jean-Christophe Lagarde. Monsieur Bernard Bégaud, je vous remercie.
La séance est levée à dix heures trente.
Audition de M. le professeur Pierre Bégué,
membre de l’Académie nationale de médecine
(Procès-verbal de la séance du mardi 13 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête,
puis de Mme Jacqueline Fraysse, vice-présidente)
La séance est ouverte à dix heures trente.
(M. Pierre Bégué prête serment.)
M. Pierre Bégué, membre de l’Académie nationale de médecine. Je suis membre de l’Académie nationale de médecine, professeur émérite de pédiatrie – je n’exerce plus – et j’ai présidé le Comité technique des vaccinations, où j’ai sévi – ou agi – pendant douze ans. J’ai aussi vécu l’épisode douloureux de l’hépatite B. Ce n’est pas le sujet du jour, les deux maladies et les deux campagnes ne sont nullement superposables ; cependant, du point de vue du sentiment public, la première affaire a eu des conséquences sur la seconde et, si vous m’interrogez à ce propos, je ne manquerai pas de répondre à vos questions.
L’Académie nationale de médecine a publié deux communiqués relatifs à la grippe A, disponibles sur son site, que je vous remettrai.
Le premier communiqué date du 13 octobre 2009. Rédigé après une réunion à laquelle ont participé le directeur général de la santé et des experts impliqués dans la campagne, il émet des recommandations et des remarques en début de campagne. Il approuve la vaccination, alors qu’une polémique sévit, tant dans les médias que sur internet. Cette désinformation ou contre-information a démarré très tôt, dès les grandes vacances, et s’est enflammée début septembre. Les critiques portaient tantôt sur la justification de la vaccination, tantôt sur la fiabilité des vaccins, en particulier des adjuvants. L’Académie insiste sur la vaccination des personnes à risque. Elle souhaite que les généralistes soient impliqués et que les personnels de santé soient vaccinés en premier. Elle recommande qu’une évaluation soit mise en place parallèlement à propos de l’efficacité vaccinale, des effets secondaires et du rapport coût/efficacité.
Le deuxième communiqué date du 9 février 2010 mais a été rédigé en janvier. En fin de campagne, après le quatrième trimestre 2009, il s’agit surtout d’une analyse critique de la situation.
La campagne vaccinale, très relayée par les médias, est jugée trop alarmiste et répétitive, en contraste avec une épidémie quantitativement très proche de la grippe saisonnière. Inversement, le profil particulier des malades admis en réanimation et décédés n’a été que rarement mentionné : la prédominance de la tranche d’âge des quinze à soixante-cinq ans et la mortalité de 20 % de personnes sans facteurs de risque ont été très peu commentées alors que ces éléments auraient mieux soutenu l’objectif. Le caractère très médiatique de l’information, le contraste entre des propos alarmistes et une pathologie relativement bénigne ainsi que les débats anti-vaccinaux risquent d’avoir altéré la confiance du public et d’amoindrir son adhésion si une prochaine alerte sanitaire grave survient. Cette observation, que nous avons été, je crois, les premiers à formuler, a été depuis lors largement reprise.
L’absence de recours initial aux médecins généralistes et aux pédiatres, vaccinateurs habituels en France, a été mal comprise. La profession médicale aurait certainement largement accepté de participer, comme en témoigne une enquête effectuée entre juin et septembre, publiée en janvier 2010 dans Vaccine, la grande revue internationale de vaccinologie, dont je vous ai apporté une copie : plus de 60 % des 1 500 praticiens interrogés y auraient été très favorables ; les autres étaient sans opinion ou plutôt opposés. Même si le recours unique aux centres de vaccination a permis d’obtenir une meilleure traçabilité des vaccinés et des effets indésirables, le bénéfice final en matière de communication avec les personnes et de couverture vaccinale est douteux. Le fait de ne pas disposer, dans un premier temps, de vaccins monodoses a sûrement constitué aussi un facteur très limitant : il est inadapté de proposer des flacons de dix doses d’un produit qui se périme probablement du matin au soir – après, il a été admis qu’il pouvait durer un peu plus longtemps –, pour des raisons de coût et d’organisation des cabinets.
La succession des avis relatifs à l’utilisation des vaccins et des antiviraux – l’Académie énumère les principaux après son communiqué – a aussi gêné la compréhension de la campagne. Il aurait fallu expliquer que les modifications de stratégie vaccinale étaient tout simplement liées aux résultats des essais vaccinaux en cours et à l’arrivée de vaccins sans adjuvant. Là encore, l’implication des médecins de famille aurait facilité la communication.
La vaccination de masse, souvent confondue avec la généralisation à une tranche d’âge, est toujours difficile en France – chacun se souvient des difficultés suscitées par la vaccination en milieu scolaire contre l’hépatite B. Il aurait fallu en tenir compte pour le choix et pour la communication. Pourtant, voici ce qui est publié sur le site du Center for Disease Control and Prevention (CDC) d’Atlanta : « L’État et les gouvernements locaux devraient chercher à minimiser l’anxiété publique » et « la vaccination reste la meilleure protection ».
Enfin, l’Académie demande à nouveau une évaluation et une meilleure concertation entre les acteurs concernés par la mise en œuvre de ce type d’action de prévention.
M. le président Jean-Christophe Lagarde. Pouvez-vous mieux expliquer pourquoi vous distinguez vaccination de masse et généralisation de la vaccination ?
Au vu de la faible virulence du virus – qui, d’après une des personnes auditionnées précédemment, était connue très tôt –, la vaccination de masse était-elle justifiée ?
M. Pierre Bégué. Je suis vaccinologue, pas virologue. Nous nous renvoyons tous la balle !
M. le président Jean-Christophe Lagarde. C’est bien pourquoi nous vous posons cette question.
M. Pierre Bégué. Mais je suis aussi infectiologue. Dans l’absolu, une pandémie grippale était attendue depuis des années. Au début des années quatre-vingt-dix – j’ai été en fonction jusqu’en 1997–, avec M. Hannoun et d’autres, nous nous réunissions déjà pour préparer la pandémie grippale ! C’est peu de temps après – je venais de quitter mes fonctions – que la peur de la grippe aviaire est apparue. Pour faire face à sa gravité, des structures ont été mises sur pied, avec souvent une organisation de style militaire – j’en profite pour rendre hommage à l’armée, qui connaît très bien les pandémies et les épidémies.
Quand un virus absolument nouveau arrive, les chercheurs le traquent. En attendant de connaître sa structure, ils peuvent s’attendre à ce qu’il soit susceptible de se répandre largement ; c’est une des conditions pour parler de pandémie. Mais l’OMS, l’Organisation mondiale de la santé, semble en avoir oublié une autre : la gravité. Quand le virus du chikungunya est apparu, nul ne savait que son avancée en Europe serait contenue, le moustique porteur ne vivant que dans des zones très chaudes. Revenons à la grippe : l’OMS, influencée par l’épidémie du Mexique, a statué sur le fait que la pandémie serait potentiellement grave. J’ignore jusqu’où je puis aller dans votre enceinte…
M. le président Jean-Christophe Lagarde. Jusqu’au bout !
M. Pierre Bégué. Le 12 janvier 2010, jour même où se réunissait ma sous-commission de l’Académie, chargée de la vaccination, afin de travailler sur le communiqué, le prix Nobel Luc Montagnier, nous adressait le courriel suivant : « L’analyse moléculaire du virus disponible dès le début de son irruption mexicaine et américaine montrait que cette nouvelle souche d’origine porcine ne possédait aucun des gènes de virulence possédé par le H1N1 de la grippe espagnole et le virus H5N1 d’origine aviaire. Nos “experts” clairement ont suivi les avis de ceux de l’OMS et non celui d’experts américains. J’ai moi-même eu ces informations en une heure en juillet 2009 de Peter Palese (Mount Sinai Hospital New York) qui participait au Comité américain ad hoc. Mais personne ne m’a consulté du côté ministère français de la santé. »
M. le président Jean-Christophe Lagarde. Pourriez-vous nous confier une copie de ce courriel ?
M. Pierre Bégué. Naturellement, d’autant qu’il est parvenu au secrétariat de l’Académie.
M. Jean-Pierre Door, rapporteur. J’ai eu connaissance de ce courriel de Luc Montagnier à l’Académie nationale de médecine, dans laquelle il faisait état de recherches américaines tendant à contester la virulence du virus. Comment expliquez-vous que le président Obama ait déclaré l’urgence sanitaire à deux reprises, d’abord quelques semaines après ces recherches, devant le Congrès, puis, au mois de décembre, en exigeant la vaccination de toute la population ? S’il a eu connaissance de cette information, lui aussi aurait dû stopper toutes les opérations.
M. le président Jean-Christophe Lagarde. Il ne reçoit pas les courriels destinés à l’Académie nationale de médecine !
M. Pierre Bégué. À l’époque, nul ne savait comment l’épidémie allait s’étendre.
Mais je parlais de gravité, de virulence… Quand un microbe est inconnu, il est certes impossible de deviner sa virulence mais la biologie moléculaire moderne s’appuie sur les gènes graves des virus connus, comme celui de la grippe espagnole, dont un exemplaire a été récupéré et étudié, sans parler de H5N1, que nous connaissons par cœur. Je vous livre simplement cet avis pour que vous sachiez que les avis des virologues eux-mêmes divergent, après quoi chaque pays prend des décisions plus ou moins dictées par le principe de précaution.
Ce qui a fait peur, aux États-Unis comme chez nous, c’est l’impact sur la population vierge. La grande majorité des sujets âgés ont rencontré des éléments du fichu virus de la grippe et en conservent des traces immunitaires ; ils sont par conséquent moins susceptibles, en théorie, de développer des formes graves. Ils sont également peu susceptibles de propager la maladie – je réponds là un peu à l’interrogation concernant le taux de 30 % –, contrairement aux enfants, qu’il est important de protéger parce qu’ils véhiculent beaucoup de maladies respiratoires ; c’est pourquoi les Américains ont décidé, il y a sept ou huit ans, de vacciner les enfants contre la grippe. Avec la grippe H1N1, c’est encore pire puisque les adultes jeunes ne sont pas protégés. Deux gravités se superposent : celle du virus et celle de la population atteinte. D’ailleurs, même si le nombre de cas est faible, la démonstration statistique est faite : personne n’y pense mais, rien qu’en France, une quarantaine de personnes jeunes, ne présentant aucun facteur de risque, sont tout de même décédées.
Le débat n’est donc pas si simple. L’Académie nationale de médecine, le 13 octobre, a soutenu la campagne vaccinale, considérant qu’il convenait de se méfier énormément du tour que pouvait prendre une telle épidémie. En effet, personne n’a jamais pu expliquer pourquoi, mais vous savez tous que les formes les plus sévères apparaissant à la deuxième vague, en fin d’épidémie, même pour la grippe saisonnière.
En outre, seul Jean-Daniel Flaysakier, excellent journaliste médical, s’est aventuré à faire la remarque suivante : il est avéré que les morts décomptés ont été victimes de la grippe A, tandis que les sujets âgés censés être victimes de la grippe saisonnière meurent d’autres maladies, décompensées par la grippe : si 5 000 insuffisants cardiaques et pulmonaires attrapent la grippe, 2 000 vont mourir. Cela aurait dû être dit immédiatement.
M. Jean-Paul Bacquet. Vous avez salué le savoir-faire logistique des militaires mais vous avez laissé entendre que, du point de vue de la communication, nous n’avions pas été très bons. Je déplore pour ma part que les professionnels de santé n’aient pas du tout été associés, non pas au geste vaccinal mais comme vecteurs de communication pour expliquer l’intérêt d’une vaccination de masse. J’ai l’impression qu’il n’a pas été tenu compte des antécédents, soit par déni d’échec, soit par absence de prise de conscience des conséquences possibles. L’arrêt de la vaccination contre l’hépatite B a été dû bien davantage à une médiatisation outrancière et inadaptée qu’à un refus de vaccination de la part des professionnels de santé. J’ai déjà cité l’exemple d’une vaccination de masse contre la méningite, dans une partie du Puy-de-Dôme : la même organisation logistique, assortie d’un manque de communication par le biais des médecins, a produit exactement les mêmes effets négatifs que la campagne contre la grippe A. Pourquoi continuer de ne pas tenir compte des échecs des campagnes de vaccination précédentes ? En matière de logistique, nous sommes bons ; en matière de communication, nous sommes nuls.
Dans les décisions qui ont été prises en matière de vaccination de masse, quel a été, à votre sens, le poids du principe de précaution, inscrit dans la Constitution et que la médiatisation érige en protection presque certaine et systématique ?
M. Pierre Bégué. À propos de la communication, tout a déjà été dit. J’ai connu, au niveau de la Direction générale de la santé, le même défaut de communication à propos de l’hépatite B. L’organisme censé aider à la communication est l’INPES, l’Institut national de prévention et d’éducation pour la santé, mais cela ne suffit pas.
Nous pourrions débattre du fait que les médecins n’ont pas été engagés pour vacciner. J’appartiens à un réseau d’information sur la vaccination émanant de la Société de pédiatrie, lequel a eu l’impression d’être totalement ignoré, tout comme a été ignoré son communiqué assez sévère de décembre que je tiens à votre disposition. Même si les médecins ne sont pas très bons dans le domaine des vaccins, ils pourraient se mettre à la disposition de leurs patients et apporter des réponses médicales à leurs interrogations, quitte à ce que des argumentaires écrits leur soient diffusés afin qu’ils puissent, comme les médecins américains, répondre aux questions délicates.
J’irai plus loin, mais je ne vous apprendrai rien car cela figure dans un rapport de l’Office parlementaire des choix scientifiques technologiques : en France, l’instruction en « vaccinologie » – c’est le nom actuel – des étudiants en médecine est déficitaire depuis au moins quarante ans. Quand j’ai commencé mes études, il n’existait que quatre vaccins ; de nos jours, le calendrier doit en comporter au moins dix-sept ou dix-huit. La discipline a été complètement abandonnée car il était d’usage, à l’instar de grands contemporains aujourd’hui décédés, de penser que les maladies infectieuses étaient terminées : il y avait les antibiotiques d’un côté, les vaccins de l’autre. J’ai beaucoup travaillé sur les antibiotiques – M. Bégaud le sait – mais je suis passé aux vaccins, partant du constat effrayant que l’effet de nouveaux antibiotiques s’amoindrissait à très grande vitesse et jugeant que la vaccination offrait un salut possible. Les Scandinaves et les Américains, à l’inverse de nous, sont très bien formés en matière de vaccination, matière dans laquelle nous conservons beaucoup de retard tant sur le plan scientifique comme que professionnel – nous l’observons dans les congrès. Cela dit, lors des entretiens post-universitaires ou des formations médicales continues – je ne sais plus quel est l’intitulé en vigueur mais c’est la même chose –, si un sujet de vaccinologie est traité avec compétence par les intervenants, je vous assure que les médecins présents apprennent beaucoup et qu’ils en sont ravis.
Le problème de la France n’est pas né avec l’affaire de l’hépatite B : il existait bien avant ! En 1988, avec Jean-François Girard, alors directeur général de la santé, quand il a été question de lancer, l’année suivante, la campagne vaccinale ROR, rougeole-oreillons-rubéole, nous avons procédé à un an d’enquêtes auprès des professionnels pour déterminer ses modalités. En parallèle, par le biais du CFES, le Comité français d’éducation pour la santé, nous avons mis sur pied des réseaux de surveillance, et, dès 1992, c’est-à-dire deux ans avant la campagne de l’hépatite B, nous connaissions le nombre d’opposants à certaines vaccinations, parmi les familles et les médecins ; nous savions même, par exemple, que 90 % des praticiens ne voulaient pas vacciner les nourrissons ou que 70 % ne voulaient vacciner que les adolescents. La défiance vis-à-vis du ROR était déjà très grande, et nous avions classé les familles en quatre catégories : 3 à 5 % d’entre elles s’y opposaient ; 20 % désiraient réfléchir et manifestaient plutôt un désaccord ; 20 à 30 % étaient d’accord sous réserve d’être informées ; à peine 30 à 40 % de familles se disaient confiantes. Ces ordres de grandeur sont connus, ils n’ont pas changé. Je ne suis donc pas du tout étonné de ce qui s’est passé.
Quand il est question de vaccination de masse en France, les cheveux se hérissent sur les têtes, des blocages se produisent immanquablement. J’ai œuvré à l’OMS pendant huit ans, très discrètement, pauvre petit conseiller temporaire au bureau des vaccins, à Copenhague, mais nous y travaillions tout de même pas mal. J’y ai rencontré un certain nombre de vaccinologues émérites et compétents, membres du comité des sages, lequel est un peu attaqué. Certains pays sont preneurs de vaccinations de masse, surtout en Europe de l’Est mais aussi en Angleterre, à condition que les pédiatres et les médecins de famille soient mis à contribution ; en France, c’est beaucoup plus difficile. Je rejoins M. Bégaud : la vaccination de masse aurait dû être discutée avec les acteurs de terrain, c’est-à-dire avec ceux qui se chargent du travail ; or, en France, depuis des années, le travail de vaccination est effectué à 90 % par les médecins de famille et les pédiatres. Pour preuve, il a fallu aménager des centres de vaccination car il n’en existait pas !
M. Guy Lefrand. L’Académie a regretté l’absence de recours aux médecins généralistes mais on nous dit que, pour des raisons de délais et de coût, il était obligatoire de commander des vaccins multidoses. Eu égard aux difficultés d’utilisation et de gestion des flacons, le recours aux médecins généralistes était-il envisageable ou bien, au contraire, ce choix de conditionnement justifie-t-il que les autorités n’aient pas fait appel à eux ?
M. Pierre Bégué. Je ne suis pas industriel mais je peux comprendre que les vaccins multidoses posent moins de problème que les vaccins monodoses et que le coût varie en fonction de l’emballage. Je rappelle tout de même que, dans notre pays, en 1986, la malheureuse épidémie d’infection par le VIH – virus de l’immunodéficience humaine – a conduit le comité technique des vaccinations, que je présidais, le Conseil supérieur d’hygiène publique de France et la direction générale de la santé à décider de ne plus vacciner qu’avec des flacons monodoses. Aux États-Unis, il est habituel d’utiliser des vaccins multidoses, de même que dans les pays du tiers-monde, où tous les patients se présentent simultanément. En France, nous ne travaillons pas dans les mêmes conditions. Et il existe plusieurs sortes de vaccins multidoses : pour un vaccin se périmant rapidement, un conditionnement en dix doses n’est pas comparable à un conditionnement en trois doses – les médecins généralistes auraient peut-être pu écouler des flacons de trois doses, en trente-six heures, à leur cabinet. Vous savez que des vaccins monodoses sont maintenant disponibles : tapez « CDC » et « grippe » sur un moteur de recherche, vous obtiendrez « vaccin monodose », pas « vaccin multidoses ».
Pardonnez-moi de dévier vers un autre sujet : aux États-Unis, le vaccin a été administré uniquement sans adjuvants, alors que la France a retenu les deux options. Un danger existe-t-il ? Convient-il d’ouvrir le débat ?
Aux États-Unis, comme l’adjuvant à base de squalène était nouveau, la FDA, la Food and Drug Administration, n’a pu autoriser la généralisation de son usage et elle n’a pas voulu aller plus loin, tout en sachant que la vaccination sans adjuvants requiert l’injection d’une deuxième dose.
Les adjuvants sont-ils dangereux ? Nous en utilisons un depuis près de cinquante ans, l’aluminium ; il nous en a été administré à tous et rien ne nous est arrivé. Il n’en demeure pas moins que, il y a six ou sept ans, un anatomopathologiste a affirmé avoir découvert une corrélation avec des maladies musculaires ou des maladies de faiblesse généralisée : la myofasciite à macrophages était née. La biopsie fait évidemment apparaître de l’aluminium là où le vaccin a été pratiqué, mais il est destiné à agir sur les cellules immunitaires – en particulier les cellules dendritiques, cellules extrêmement importantes, dont on ne parle que depuis dix ou quinze ans –, pour qu’elles s’organisent mieux, qu’elles captent l’antigène et le véhiculent tout de suite aux cellules fabriquant des anticorps. C’est le seul rôle de l’aluminium – malheureusement, pour certains vaccins viraux pour lesquels un adjuvant est nécessaire, l’aluminium ne fonctionne pas.
Aux États-Unis, le vaccin contre le cancer du col de l’utérus de GSK, le Cervarix, a dû attendre longtemps avant d’être autorisé dans la mesure où il contient un nouvel adjuvant – qui n’est pas le squalène ; pour autant, le Gardasil, un autre vaccin ayant le même objet, est commercialisé dans ce pays alors qu’il contient du bon vieil aluminium.
Le vaccin contre la grippe a toujours requis un adjuvant parce que c’est un mauvais vaccin : si vous vous faites vacciner contre la grippe saisonnière en novembre, vous ne fabriquez plus d’anticorps en mars, surtout si vous avez quatre-vingts ans ! Pardonnez-moi d’être bavard mais je suis animé par la passion, et nous entendons tellement de bêtises…
La pandémie de grippe H1N1 était avérée car des cas étaient apparus en Australie, au Mexique, à New York, en Angleterre et en Pologne. Or une vraie pandémie repart à la saison suivante. Quand le cabinet de la ministre, en mars ou avril, a réfléchi à la commande de millions de doses de vaccin, il s’est tout de même soucié que ses effets durent un peu. Imaginez qu’il ait fallu rouvrir tous les centres de vaccination en septembre pour faire face à une deuxième pandémie ! Pour moins gâcher et faire durer un peu les effets du vaccin, il convient de trouver un bon adjuvant, ce qui n’est pas le cas de l’aluminium. Mais nous disposons du fameux squalène – ce n’est pas de l’huile de requin mais un composé chimique –, et la France, depuis des années, administre aux sujets âgés un vaccin baptisé Safeguard, répertorié dans le Vidal, qui rallonge la durée d’immunité. Nous connaissions parfaitement cet adjuvant ; il n’est pas administré par centaines de millions de doses mais tout de même par centaines de milliers de doses.
En Suède, c’est le vaccin adjuvé qui a été injecté aux femmes enceintes. Leur immunité étant affaiblie, il importe de peser le risque et le bénéfice : le risque est qu’elles fassent une petite réaction ; le bénéfice est qu’elles échappent à une grippe grave. À partir d’une certaine durée de grossesse, il est indiqué de les vacciner. À la deuxième injection de vaccin adjuvé, la réaction peut être locale – une injection unique m’a été administrée et je n’ai eu aucun effet secondaire –, voire générale, mais il ne faut pas exagérer, cela se résume à des petites fièvres et des petites douleurs, sans commune mesure avec le syndrome de Guillain-Barré. Celui-ci, au demeurant, n’a rien à voir avec le vaccin ; il est le plus souvent imputable à la grippe. Mais, quand quelqu’un est touché, allez savoir si c’est dû à la grippe ou au vaccin ! Pour l’hépatite B, c’était pareil : nous avions demandé à vacciner uniquement la tranche d’âge des nourrissons et des enfants, point à la ligne – je le sais, c’est moi qui suis allé à la sécurité sociale pour négocier les milliards nécessaires –, mais le Gouvernement a décidé de vacciner les adultes de vingt à quarante ans, c’est-à-dire les victimes potentielles de la sclérose en plaques (151). Allez donc savoir s’il y a un lien entre le vaccin et la maladie.
M. Guy Lefrand. Vos digressions sont fort intéressantes mais j’attends une réponse précise à ma question : l’usage de vaccins multidoses aurait-il tout de même permis de faire participer les médecins généralistes ou cela aurait-il posé problème ?
M. Pierre Bégué. Oui, cela leur aurait posé problème, je l’ai indiqué en introduction. Comme l’a dit M. Bégaud, si des gens de terrain avaient été sollicités, il en serait ressorti que, dans un pays où c’est le privé qui vaccine, il fallait demander à l’industrie de ne pas produire de vaccins en dix doses. Notre tissu de santé publique n’est pas constitué de centres médicaux, hormis les centres de PMI – protection maternelle et infantile –, destinés non pas aux vaccinations mais aux enfants et aux jeunes adolescents.
M. le président Jean-Christophe Lagarde. Au demeurant, les centres de PMI n’ont pas été sollicités non plus.
M. le rapporteur. Les États-Unis, marqués par l’impact du problème du syndrome de Guillain-Barré dans les années 1975-1976, n’emploient pas d’adjuvants : les 250 millions de doses de vaccins n’en contenaient pas. Mais ils ont acheté des stocks d’adjuvants, qu’ils ont mis de côté au cas où la pandémie aurait été plus importante, de façon à accroître le nombre de doses disponibles. Par ailleurs, les États-Unis se sont fournis en vrac, par cent doses, mais les vaccins y sont administrés par voie nasale. Ils sont élaborés à base de virus atténué et non inactivé, ce qui peut poser un problème car le virus peut se réveiller ; c’était leur angoisse et ils ont maintenant commandé des vaccins injectables.
Toute l’Europe a commandé des flacons de dix doses mais la Suède, pour sa part, s’est approvisionnée dans ce conditionnement auprès d’un seul laboratoire et uniquement en vaccins contenant des adjuvants : les 9 millions de Suédois devaient être vaccinés de la sorte, femmes enceintes comprises, des brochures leur recommandant cette vaccination en attestent. La France a choisi de commander une gamme de quatre produits : avec et sans adjuvants ; sur culture d’œuf ou sur culture cellulaire pour les personnes allergiques. Avons-nous eu raison ou non de nous engager dans ce choix à la carte ?
La France possède un système de soins particulier. Outre-atlantique, les vaccins n’ont pas été administrés par les médecins mais par le personnel infirmier, dans les aéroports et les supermarchés.
M. le président Jean-Christophe Lagarde. C’est d’autant plus facile qu’ils sont administrés par spray nasal.
M. le rapporteur. En Scandinavie et en Grande-Bretagne, les médecins assurent la « capitation », une prise en charge globale du patient, qui inclut le volet santé publique. Le système de soins français est totalement différent : de nature libérale, il fonctionne à l’acte, le médecin généraliste ne se préoccupant pas obligatoirement de santé publique et ne connaissant pas forcément tout de la vaccination – ce qui constitue un défaut. Cette coexistence de systèmes de soins divers pose un problème réel. Comment faire pour mieux s’organiser à l’avenir ?
M. le président Jean-Christophe Lagarde. L’intervention de M. le rapporteur contient davantage d’affirmations que de questions…
Quelle différence faites-vous, en particulier du point de vue de la vaccination, entre une grippe saisonnière et une grippe comme la H1N1v, alors qu’une deuxième vague puis vraisemblablement une troisième et une quatrième sont annoncées ? Pourquoi nous y préparons-nous différemment ? Le professeur Hannoun nous a expliqué précédemment que la pandémie n’a été arrêtée que grâce à trois facteurs de chance et que l’action menée n’a eu aucun effet mais servira peut-être pour la prochaine vague. Pourquoi ne pas traiter la grippe H1N1v comme la grippe saisonnière, dès la prochaine vague ? Ne convient-il pas d’identifier les populations à risque, qui auraient accès aux trois vaccins ? Je trouve un peu inquiétant que personne n’en parle encore.
Je formulerai à mon tour une observation, mais moins longue que celle de notre rapporteur. Vous avez beaucoup parlé de l’hépatite B, qui a manifestement beaucoup traumatisé le monde médical. Toutefois, en tant que patient et en tant que maire, je vous assure que personne ne m’a parlé du problème de l’hépatite B ; les citoyens ont seulement ressenti des doutes à propos de la grippe.
Vous avez indiqué que la peur de la pandémie enflait depuis les années quatre-vingt-dix et a été encore renforcée par la grippe aviaire. La réaction excessive au premier virus venu n’est pas seulement due au principe de précaution ; l’attente de la communauté médicale a aussi joué. Ce n’est pas condamnable en soi mais cela a contribué au phénomène de communication et à l’alerte générale.
Tout le monde – j’imagine que c’est aussi le cas des vaccinologues – s’accorde pour dire que le virus de la grippe est imprévisible. Communiquer quand on ne sait pas, alors que l’on représente le savoir, c’est sacrément compliqué, en premier lieu pour l’autorité politique.
M. Pierre Bégué. Le prochain vaccin saisonnier comportera les vaccins classiques contre la grippe saisonnière plus celui contre le H1N1.
M. le président Jean-Christophe Lagarde. D’habitude, le vaccin s’adresse à des personnes âgées ou dites « à risque ». Cette année, à qui conviendra-t-il de l’élargir ?
M. Pierre Bégué. Seules sont affectées par une grippe saisonnière les personnes dont les anticorps accusent une baisse. L’organisme, normalement, conserve très longtemps les anticorps produits contre les grippes saisonnières successives. Du reste, l’armée ne vaccine pas tous les ans mais tous les trois ans, ce qui s’avère suffisant, les études le prouvent, du moins pour des sujets jeunes, les virus n’étant pas totalement étrangers les uns aux autres.
La question de l’élargissement va en effet se poser. Conviendra-t-il de s’occuper des nourrissons âgés de plus de six mois, qui n’ont pas encore rencontré la grippe ? Outre les sujets âgés, sur lesquels la grippe pandémique fait peser un risque modéré, convient-il de vacciner des malades jeunes et qui ne sont atteints par aucune des indications figurant sur la liste des ALD, les affections de longue durée ? S’il ne l’a pas déjà fait, le comité technique des vaccinations devra se saisir du sujet et en discuter, c’est son rôle. Une information spécifique devra sans doute être encore dispensée, à cause du risque de résurgence, peut-être pas en septembre mais plus sûrement vers novembre. Cette année, si vous n’avez pas eu l’impression que la grippe resurgissait, c’est parce que tout le mois d’octobre a été très chaud ; nous autres pédiatres avons d’ailleurs constaté un recul de trois semaines des épidémies de bronchiolite et de rotavirus.
Oui, nous sommes traumatisés par l’affaire de l’hépatite B.
M. le président Jean-Christophe Lagarde. Mais personne n’a fait l’amalgame.
M. Pierre Bégué. Sauf les détracteurs des vaccins, en particulier un personnage couramment convié à la télévision, notamment à l’émission « C dans l’air ». Ancien conseiller d’une personnalité très importante, il usurpe le titre de professeur et, dès le mois de septembre, il avait mis en ligne environ dix ou quinze pages consacrés à dénigrer la vaccination de la grippe et revenant sur l’hépatite B. De plus, il a débattu dans les médias face à un pauvre vaccinologue ne faisant pas le poids, subjugué par le personnage. L’affaire de l’hépatite B est exploitée par les anti-vaccination, à cause de la vaccination de masse.
M. Jean Mallot. De qui parlez-vous ?
M. Pierre Bégué. Je parle de Marc Girard, l’homonyme d’un très grand vaccinologue, désormais membre de l’Académie nationale de médecine.
M. le président Jean-Christophe Lagarde. Quelle est la différence entre grippe saisonnière et grippe A ?
Par ailleurs, quelle est la probabilité que ce virus mute ? Les personnes vaccinées sont très peu nombreuses, les personnes immunisées le sont davantage mais les données sur les personnes ayant contracté le virus varient de façon assez extravagante. Si une mutation intervient, toutes les recherches en cours, y compris celles portant sur le vaccin contre la grippe saisonnière, serviront-elles ?
M. Pierre Bégué. L’effet du vaccin contre la grippe saisonnière ne serait pas affecté.
M. le président Jean-Christophe Lagarde. En cas de mutation, le vaccin initial ne servira plus à rien.
M. Pierre Bégué. Une mutation brutale est fort peu probable. Une alarme a été lancée en Norvège, je crois, après une toute petite mutation, mais celle-ci n’interfère aucunement sur la virulence du virus.
M. Bernard Bégaud. Je ne suis pas tout à fait d’accord avec vous, monsieur le président. En matière de risque sanitaire, la communication est toujours nimbée d’incertitude. Quels sont les effets des téléphones portables ou des nanotechnologies ? Qui peut répondre à ces questions ? Mais il importe de respecter certains principes de communication, de ne pas se réfugier derrière son ignorance pour communiquer maladroitement. Il est tout à fait possible d’élaborer des schémas de communication gérant l’incertitude.
M. le président Jean-Christophe Lagarde. La population méconnaît complètement ce qu’est la grippe. Depuis la création de notre commission d’enquête, moi qui n’exerce pas de profession médicale, j’ai appris des tas de choses. Comment communiquer en direction d’une cible complètement ignorante du sujet, dépourvue de « culture grippale » ? Quiconque a le nez qui coule raconte qu’il a attrapé la grippe, ce qui en fait une maladie bénigne, banale, sans intérêt ni importance. Toutefois, la grippe aviaire a fait peur à la population, qui ne comprenait pas comment un poulet pouvait tuer à travers la grippe ; d’autant que les mécanismes de mutation du virus ne sont pas connus.
Pas moins de quinze années ont été nécessaires pour faire comprendre ne serait-ce que les voies de transmission du VIH, cependant que des crétins continuaient à raconter n’importe quoi. Pour la grippe, c’est un peu pareil. Il est compliqué de communiquer en direction d’une population peu éduquée ; il convient de combler un peu ce déficit d’éducation de la population au phénomène grippal, notamment pour l’informer qu’il existe un risque certain de pandémie virulente.
(Mme Jacqueline Fraysse, vice-présidente de la commission d’enquête, remplace
M. le président Jean-Christophe Lagarde au fauteuil de la présidence.)
M. Michel Lejeune. Le doute de la population à propos de la vaccination n’est-il pas inversement proportionnel au danger ? Un rush vers les centres de vaccination s’est produit lorsque a été annoncé le décès de quelques personnes qui étaient en parfaite santé avant d’avoir contracté la grippe. Le doute s’est installé dès lors que l’effet grippe a été atténué ; en cas de pandémie vraiment meurtrière, je crois que la population changerait d’avis.
Nous venons de passer un premier pic mais chacun sait que toute pandémie en comporte deux et le second se produira probablement à l’automne. Que préconisez-vous ? Estimez-vous qu’il faut poursuivre les vaccinations ? Procéder à des vaccinations associées ? À l’aune de ce qui s’est passé, ne convient-il pas de modifier la stratégie de communication ?
M. Pierre Bégué. La question est très difficile. L’Académie nationale de médecine n’est rien : nous avons demandé à participer, le cas échéant, à la concertation préalable à une éventuelle deuxième campagne vaccinale mais nous n’avons encore reçu aucune réponse. Il est essentiel de prendre dès aujourd’hui – nous sommes déjà mi-avril – une position à propos de l’opportunité de l’extension des indications classiques de la vaccination contre la grippe. Le vaccin sera disponible. Mais faudra-t-il l’administrer aux personnes n’ayant encore reçu qu’une dose ? Il serait mal venu, monsieur le rapporteur, de critiquer la France en l’incriminant d’avoir choisi une diversité de vaccins – avec adjuvants, sans adjuvants et sur culture cellulaire pour les personnes allergiques à l’œuf.
M. Jean Mallot. Qui optait pour tel ou tel vaccin et à quel moment ?
M. Pierre Bégué. Pour les femmes enceintes et les nourrissons gravement immunodéprimés, le vaccin non adjuvé Panenza était recommandé. Les personnes appartenant à l’une des catégories à vacciner mais sujettes à l’une des quelques rares allergies avérées à l’œuf ont également pu être traitées. Ce choix d’un éventail de vaccins n’est pas critiquable, bien au contraire, mais il complique les indications : les schémas, renouvelés dans les différents avis, étaient tout de même complexes. Pour les praticiens, c’est difficile à gérer mais pas excessivement – la direction générale de la santé et le Haut conseil de la santé publique ont fourni des tableaux pourvus de couleurs –, d’autant qu’ils connaissent leurs patients.
Les sujets ayant reçu le vaccin avec adjuvant, normalement, seront protégés. En revanche, ceux qui ont reçu une seule injection de vaccin sans adjuvant courent un risque, sans oublier tous les petits qui n’étaient pas encore nés où l’étaient à peine lors de la campagne précédente : il convient peut-être de les ajouter à la liste des sujets à risque pour toutes les grippes et plus seulement pour la grippe saisonnière. Peut-être est-ce déjà décidé ; honnêtement, je ne suis pas au courant des délibérations du comité technique des vaccinations. S’ensuivra une concertation puis sans doute une communication spécifique.
Tout le monde a jugé que la communication était mauvaise. Celle-ci doit être conduite, je crois, par des médecins, très calmement, en expliquant les conséquences possibles sans affoler la population, mais seulement une fois prises les décisions ministérielles – il s’agit, c’est évident, de ne pas enfoncer une épée dans les reins du Gouvernement. Si j’étais en position de responsabilité, c’est ce que je ferais. Il faut maintenant travailler avec les virologues avertis et les spécialistes de la communication en santé publique.
Mme Marie-Louise Fort. Une commission d’enquête n’a pas vocation à intenter un procès à charge mais plutôt à présenter une vision pour l’avenir. En vous écoutant, je trouve néanmoins que de nombreux doutes subsistent.
Combien de cas de grippe H1N1 ont été comptabilisés exactement ? Il fut un temps où chaque cas suspect faisait l’objet d’analyses permettant de confirmer l’infection.
Chacun a certes le choix mais, sans avis éclairé, il est difficile de prendre une décision. Lors du deuxième pic de l’épidémie, les médecins généralistes seront-ils véritablement entraînés pour participer à la prévention ou du moins à l’information de leurs patients, afin que l’éventuelle deuxième vague de vaccination soit conduite dans les meilleures conditions ? Compte tenu du peu de temps qui reste d’ici à l’automne, cela vous semble-t-il possible ? Quelles décisions la ministre de la santé doit-elle prendre pour faire en sorte que la France soit opérationnelle à l’automne prochain et empêcher toute polémique sur la question ?
À votre connaissance, Luc Montagnier a-t-il envoyé le même courriel à d’autres destinataires ?
M. Pierre Bégué. Je l’ignore mais je pourrai regarder dès demain sur l’adresse électronique de l’Académie s’il y avait d’autres destinataires. Quoi qu’il en soit, il était adressé à la sous-commission de la vaccination.
Vous avez raison, nous sommes en avril, il est temps de décider s’il convient de mener une nouvelle action contre la grippe H1N1 ou au contraire de se borner à vacciner contre la grippe saisonnière. Dans ce second cas de figure, le système est connu depuis longtemps et nous pourrions faire confiance à l’industrie. Je suis méchant mais, durant toutes mes années de lutte en faveur de la vaccination ROR dans ce pays, j’ai constaté que nous étions toujours doublés par le vaccin contre la grippe : les industriels nous demandaient de programmer le ROR à la rentrée des classes afin de ne pas les gêner. La vaccination contre la grippe est importante mais il est embêtant que l’industrie soit toujours en filigrane, voire plus.
L’appel en faveur de la vaccination émanera-t-il encore de l’industrie ou bien le ministère décidera-t-il de lancer une deuxième vague ? Celui-ci, en tout cas, devra prendre une décision car la question lui sera posée. Or quiconque croit à la pandémie considère forcément qu’il convient de vacciner les personnes qui ne le sont pas encore ou du moins qui ne sont pas protégées, et qu’il convient par conséquent de mener une action positive avec les médecins de famille après les avoir fait asseoir autour de la table. M. Door a raison, cela aura un coût, mais il ne faut pas exagérer, l’aménagement des centres de vaccination n’a pas été gratuit.
Les médecins et les infirmiers seront mis à contribution. Il y a quelques années, il a en effet été décidé – malgré l’avis plutôt défavorable de l’Académie nationale de médecine, rédigé par mes soins – que la deuxième vaccination de la grippe pourrait être effectuée par un infirmier, sur délégation de tâche. Cela peut nettement faciliter les choses, à condition que les infirmiers soient favorables à la vaccination. Je vous communiquerai, pour vos archives, l’article excellent que j’ai déjà évoqué, relatif aux médecins : 30 % n’étaient pas disposés à vacciner ; parmi le personnel soignant, tout le monde n’était pas très chaud non plus mais certains ou certaines auraient vacciné si cela leur avait été demandé. Il faut seulement communiquer calmement. La grippe, comme beaucoup de maladies, fait certes l’objet d’un défaut d’information, mais il faut rester calme. Les gens ne sont pas sots, il faut les informer sans les paniquer. L’éducation et la prévention sont, de toute évidence, très mal faites.
Bref, il est urgent de déterminer si, oui ou non, la démarche sera poursuivie. Si la réponse est positive, il faudra impérativement recourir aux soignants, médecins et infirmières, sans les mettre devant le fait accompli mais en travaillant avec eux. En effet, pour un professionnel de santé, rien n’est pire que de se retrouver avec des textes rigides et contraignants à propos desquels il n’a pas été consulté.
Mme Jacqueline Fraysse, présidente. Il est nécessaire d’expliquer de nouveau à la population le rôle de la vaccination, connu depuis Pasteur mais qui tend à être oublié. La vaccination a constitué un formidable progrès de santé publique. Notre génération a connu, par exemple, la poliomyélite, qui détruisait des vies dès la plus tendre enfance. Répéter ces vérités ferait du bien au corps médical, et, surtout, la population a besoin de les entendre.
Une autre question fondamentale mériterait d’être abordée : celle du risque. Nous autres médecins, nous évaluons constamment le rapport bénéfice/risque de nos actes. Quel acte présente le plus d’avantages et le moins d’inconvénients ? Aucun geste, quel qu’il soit, n’est exempt d’inconvénients, chacun doit le savoir ; le risque est plus ou moins grand mais il existe toujours, il faut arrêter de raconter le contraire aux gens. Les vaccins ont toujours présenté des risques, comme tout traitement. L’objectif est de réduire ces risques autant que possible, de les évaluer au mieux mais nous ne les supprimerons pas. Dire la vérité à la population contribue à la responsabiliser.
Que convient-il de faire dans l’immédiat ? Le Gouvernement se décrédibiliserait encore plus s’il n’adoptait pas des dispositions s’inscrivant dans la lignée de celles mises en œuvre durant la pandémie. S’il se comportait comme s’il n’a pas cru à la pandémie, ce serait embêtant ! Il convient de prendre en compte ce qui s’est passé : une deuxième vague de vaccination s’impose, en élargissant le champ de la vaccination saisonnière habituelle. Reste à déterminer les cibles auxquelles il doit être élargi ; il incombe aux scientifiques compétents en la matière de le déterminer. En tout cas, faire l’économie de poursuivre les actions liées à la pandémie est inenvisageable ; ce serait grave, ce serait du gâchis, notamment financier.
M. Pierre Bégué. Je souhaite revenir sur la notion de gravité. On entend couramment que cette grippe n’est pas grave,…
Mme Jacqueline Fraysse, présidente. Elle peut l’être !
M. Pierre Bégué. … mais les malades présentent tout de même souvent des symptômes comme s’ils avaient un rhume. Par ailleurs, il est assez dur d’évaluer sa prévalence. Le meilleur test, la PCR, est très onéreux. Les tests rapides coûtent moins cher mais sont inopérants : si le résultat est positif, le sujet a la grippe ; en revanche, si le résultat est négatif, le sujet a tout de même 50 % de risque d’être malade. Les enquêtes relatives à la diffusion de la grippe, pour être fiables, doivent mobiliser des fonds importants et être menées par des épidémiologistes de haut niveau.
Nous devons aussi parler du Mexique. On entend tout le temps que des foules de malades y présentaient déjà une insuffisance respiratoire. Des pays ne possédant par le même système de santé ne peuvent être comparés ; il convient notamment de distinguer les dispositifs de réanimation. À cet égard, les situations à New York, au Mexique – surtout dans la zone concernée – et en France sont très différentes. Dans notre pays, vous êtes pris en charge extrêmement rapidement après avoir été conduit dans un service de réanimation par le SAMU, le service d’aide médicale d’urgence. Pour 1 800 ou 1 900 malades admis en réanimation avec le syndrome grippal, 300 décès sont enregistrés ; les choses sont cadrées. À New York, il faut trouver un service pour venir vous chercher, surtout si vous ne disposez pas de la sécurité sociale ; le système n’est donc pas aussi performant, on le constate en examinant les chiffres des décès. L’épidémie de rougeole de 1987, aux États-Unis, a provoqué un nombre élevé de morts. Au Mexique, ce fut encore pire ; et le problème est survenu dans une zone où la pneumopathie sévit toute l’année, compte tenu d’un environnement animal extrêmement préjudiciable. Mon ami Antoine Flahault, qui s’est rendu au Mexique il y a trois jours, est au courant de la situation.
Comment faire pour rechercher les formes bénignes alors que les tests efficaces sont très chers et que les tests bon marché ne sont pas fiables ? Quant aux formes graves, elles ne peuvent être comptabilisées qu’en France car nous savons ce que nous faisons ; aux États-Unis ou plus encore au Mexique, au-delà de certaines limites, cela pourrait conduire à un affolement.
M. Bernard Bégaud. Un gros travail d’information en direction de la population est nécessaire et il convient d’éviter un piège redoutable : en matière vaccinale, si chacun raisonne en fonction de son intérêt individuel, cela pose un problème ; les messages doivent surtout être collectifs. S’agissant de la variole ou de la poliomyélite, par exemple, qui ont déjà été évoquées, le rapport bénéfice/risque, pour un sujet qui se fait vacciner, est très mauvais ; en effet, la population étant presque entièrement immunisée, la probabilité qu’il attrape la maladie est quasi nulle, alors que la probabilité qu’il fasse un petit accident ne l’est pas totalement. Je rappelle que la variole a pu être éradiquée que parce que 100 % de la population a joué le jeu. Il faut donc se méfier de l’égoïsme ambiant et il convient d’adresser des messages collectifs de santé publique affichant des objectifs généraux.
Pour l’éducation de la population, les médecins ne doivent pas être négligés car ils constituent des relais fondamentaux. Comme le disait M. Bégué, il est très dommageable que ces grands enseignements de santé publique ne soient pas relayés au cours des études médicales. Je sais de quoi je parle car j’ai été doyen de faculté de médecine et j’ai participé à la réforme : la France est le pays du monde dit « développé » qui enseigne le moins le médicament.
Les industriels du secteur pharmaceutique sont des collègues et des partenaires, et il est nécessaire de travailler avec eux. Toutefois, nombre de problèmes proviennent du fait que nous leur avons abandonné la conduite des campagnes d’information : le dérapage concernant l’hépatite B ne se serait pas produit si l’industrie ne s’était pas occupée de la campagne.
L’information est une mission cruciale.
M. le rapporteur. Savez-vous si le nombre de grippes saisonnières et, par voie de conséquence, le nombre d’hospitalisations ont diminué ?
M. Pierre Bégué. Oui, nettement.
M. Bernard Bégaud. Il n’y en a presque pas eu.
M. le rapporteur. Une grippe a remplacé l’autre. Nous demanderons aux représentants de la sécurité sociale quels bénéfices financiers elle a retiré de cette décrue.
Je prolongerai le propos de Mme Fraysse. Compte tenu des réactions de l’opinion publique et à la lumière des analyses formulées par les personnes successivement auditionnées, vous inclus, je crains que la campagne de vaccination de septembre soit un « flop » dramatique. Vous aussi ?
M. Bernard Bégaud et M. Pierre Bégué. Oui !
M. le rapporteur. Parmi nos recommandations, nous conseillerons peut-être que le turbo soit immédiatement enclenché en matière d’information et de communication sur la campagne de vaccination à venir.
Nous allons en discuter avec les professionnels de l’industrie pharmaceutique – nous auditionnons les premiers cette après-midi. Cela dit, dès janvier, une fois passé l’épisode d’urgence, ils ont été en mesure de fournir des vaccins unidoses. Des stocks de vaccins unidoses peuvent donc être mis à la disposition des médecins libéraux ; il faudra relayer l’information auprès d’eux afin qu’ils reprennent leur cartable sur l’épaule et s’engagent dans cette campagne de vaccination individuelle.
M. Bernard Bégaud. Au demeurant, cela ouvre une porte de sortie au Gouvernement.
M. le rapporteur. Comment cela ?
M. Bernard Bégaud. Revenir vers les médecins risque de passer pour un aveu d’échec. Mais le Gouvernement pourrait très hypocritement – ce que personne n’imagine –déclarer qu’il peut enfin travailler avec les médecins généralistes, ses amis de toujours, maintenant que les vaccins unidoses sont disponibles.
M. Pierre Bégué. Je voudrais donner du grain à moudre à Mme la présidente. La perception de la vaccination peut changer très vite.
Quand l’URSS s’est transformée en fédération – à l’époque, je collaborais au bureau des vaccins de l’OMS –, les vaccinations ont été abandonnées : résultat, entre 1992 et 1997, 250 000 cas de diphtéries et 4 500 morts ont été comptabilisés. Au service des maladies infectieuses de Saint-Pétersbourg, j’avais constaté que les victimes du croup n’étaient pas des enfants de trois ans, comme il y a un siècle, mais des adultes de vingt ou trente ans en réanimation respiratoire, présentant des fausses membranes diphtériques très étendues et qui étaient en train de mourir. La diphtérie ne sera jamais éradiquée car elle repart dès que de taux de couverture vaccinale tombe à 40 ou 50 %.
De même, en 1992, des cas de poliomyélite ont été observés en Hollande et deux personnes en sont mortes : un gamin et un pauvre homme d’une soixantaine d’années, qui n’avait jamais été en contact avec le virus. L’affaire est connue, elle a fait l’objet de publications et le directeur général de la santé nous l’a racontée. Une petite confrérie chrétienne radicale, qui vit au Nord-Est des Pays-Bas et compte environ 70 000 membres, n’accepte pas les vaccinations. Les enfants de cette confrérie sont scolarisés dans des écoles spéciales ; en effet, aucune loi n’oblige les parents à faire vacciner leurs enfants mais ceux qui s’y refusent doivent trouver une école qui les accepte. Bref, un jeune âgé de treize ans a contracté la poliomyélite en nageant dans une rivière et a transmis la maladie à quelque soixante ou soixante-cinq personnes, soit un cas pour mille, conformément aux prévisions. Pour couvrir un peu la communauté, son chef a accepté qu’une dose de vaccin soit délivrée par voie orale, mais pas par voie injectable. Par la suite, la génétique a démontré que le virus était de souche pakistanaise et le virus circule toujours dans le monde entier, même dans les pays où plus personne ne contracte la poliomyélite, et, contrairement à ce que pensaient naguère les scientifiques, il ne sera probablement jamais possible de l’éradiquer. Il suffirait de tenir ce langage aux gens. Si un tel message passait à la télévision, pensez-vous qu’ils ne comprendraient pas ? Nul besoin de longs discours, cela nous concerne directement ! Dans le cas que je viens de citer, l’intérêt individuel et l’intérêt collectif se rejoignent.
M. Jean-Paul Bacquet. Autrefois, durant leur service militaire, les Cantalous et les Savoyards contractaient la rougeole, la varicelle et d’autres maladies.
M. Pierre Bégué. En 1917, une épidémie de rougeole a empêché d’embarquer des milliers de jeunes soldats américains, âgés de vingt à vingt-cinq ans, et plusieurs centaines d’entre eux sont morts. C’est pourquoi les Américains surveillent les maladies infectieuses.
M. Philippe Vitel. On a successivement expliqué à nos compatriotes qu’il fallait deux injections, puis une seule si le vaccin contenait des adjuvants, puis une seule dans tous les cas. Là aussi, le doute peut nuire à la compréhension de l’information. Alors qu’une deuxième campagne va être lancée, quelle consigne sera donnée à ceux qui sont déjà vaccinés ?
Enfin, pour illustrer la pauvreté de la communication relative à la vaccination, je vais vous livrer une anecdote. Dans une réunion publique, en présence d’une assistance assez bien « cérébrée », j’ai demandé aux personnes à jour pour le vaccin contre le tétanos de se signaler : une personne sur cinq a levé la main. Lors d’une rencontre préparatoire à l’examen du projet de loi HPST – hôpital, patients, santé et territoires –, des conseillers techniques, à qui je faisais part du problème, m’ont rétorqué que la France est un pays « survacciné » et qu’il n’y avait rien à ajouter…
M. Pierre Bégué. Votre première remarque est la plus importante : le doute est semé. Il aurait fallu expliquer à la population – je crois que cela figure dans un de nos communiqués et il me semble en avoir parlé en introduction, en tout cas c’était dans nos intentions – que trois mois au moins étaient nécessaires pour fabriquer le nouveau vaccin et que, par précaution, lorsqu’un vaccin est prêt, il fait l’objet d’essais, d’abord sur des adultes puis sur des enfants. Il faut aussi procéder à des dosages d’anticorps : pour la première dose, les résultats sont obtenus très vite ; pour la deuxième dose, les résultats, fondamentaux, tardent un peu plus. En l’espèce, les délais ont été extrêmement brefs : la première série de résultats a été disponible fin septembre et la seconde fin octobre. D’aucuns ont jugé que c’était très long mais c’est la règle pour des essais. Dès qu’ils ont été connus, les résultats ont été envoyés aux États-Unis et surtout à Londres, à l’EMEA, l’European Medicines Agency, avant de redescendre dans nos différentes agences, qui les ont immédiatement répercutés. L’opinion publique a eu l’impression que nous ne savions pas alors que nous savions, mais au terme d’une procédure tout à fait inhabituelle : non pas une AMM – autorisation de mise sur le marché – tranquille, obtenue au bout de quatre ans de recherches, mais une AMM de vaccin débobinée de semaine en semaine. D’où l’importance de la communication : pour ma part, je n’aime pas la télévision mais nous ne manquons pas de vaccinologues jeunes, compétents, dynamiques et calmes qui auraient su expliquer la situation, M. Bégaud l’a dit.
M. Bernard Bégaud. William Dab, par exemple, n’a jamais été consulté par le cabinet.
M. Pierre Bégué. Les sujets n’ayant reçu qu’une injection de vaccin sans adjuvant méritent d’en recevoir une seconde mais cela sera un peu compliqué. Quant aux sujets ne faisant pas partie d’une population à risque et qui ont reçu une seule injection de vaccin adjuvé, ils sont certainement protégés.
M. Bernard Bégaud. Je suis tout à fait d’accord, une fois de plus, avec M. Bégué, mais je souhaite revenir sur la notion de « survaccination », quitte à me recoiffer de ma casquette de polémiste.
Une autre faute française – je ne veux pas pointer à nouveau du doigt l’industrie pharmaceutique – consiste à mettre sur le même plan les vaccins majeurs, cités ce matin, et les vaccins plus mineurs, en abreuvant la population de messages. Si un vaccin contre la calvitie est découvert un jour, des campagnes publicitaires passeront à la télévision ! Les messages finissent par se diluer et l’on oublie l’essentiel. Nous pourrions polémiquer sans fin sur la nécessité du vaccin contre le cancer du col de l’utérus, administré aux jeunes filles. Ce n’est pas un vaccin majeur mais son lancement a dû être accompagné de messages télévisés car il est cher et, au départ, il n’était pas remboursé. En revanche, les messages en faveur des vaccins majeurs ne sont ni vus ni entendus. C’est problématique car il importe d’expliquer sans relâche ce qu’est un risque sanitaire et de dire la vérité.
Ce qui inquiète la population, c’est l’inconnu : quand les gens ne savent pas, ils ont peur, ce phénomène a été indubitablement démontré à maintes reprises ; quand on leur parle, même en faisant état d’un risque, ils ressentent beaucoup moins la peur. En l’occurrence, ce principe n’a pas été appliqué.
Mme Jacqueline Fraysse, présidente. Convient-il de revacciner les enfants de deux ou trois ans, voire plus jeunes, qui ont déjà été vaccinés ?
M. Pierre Bégué. Ce sera vraisemblablement nécessaire car la plupart d’entre eux ont reçu des vaccins sans adjuvant.
M. Jean-Paul Bacquet. Vos interventions renforcent mon pessimisme à propos des prochaines campagnes de vaccination et de la prise de conscience de la population. Cependant, je vous remercie car vous avez tous deux très bien décrit la situation et mis en évidence nos insuffisances.
Je ne poserai pas une question mais je dresserai un constat. Je suis médecin et je crois que les comportements face à la vaccination contre la grippe A traduisent une évolution sociétale générationnelle vis-à-vis de tout ce qui est médical. Les Français sont des enfants gâtés de la médecine, au point, cela a été dit, qu’ils ont pu croire à la fin des maladies infectieuses et à la persistance des seules maladies dégénératives, cancers et autres. Il est sûr que le cancer faisait moins de victimes quand les gens mouraient d’une maladie infectieuse avant cinquante ans ou d’une maladie traditionnelle d’usure entre cinquante et soixante ans. Notre vision est donc totalement faussée ; le sida nous a d’ailleurs réveillés en nous rappelant que les maladies existent encore et tuent toujours. Quand j’exerçais, j’avais l’habitude de dire qu’un patient de quatre-vingt-dix-neuf ans et demi ne peut mourir que d’une erreur médicale. Ceux qui se passionnent pour les maladies nosocomiales et incriminent les médecins en faisant des amalgames oublient que les personnes qui en meurent, s’ils n’avaient pas été hospitalisés, auraient succombé bien avant d’une affection rénale, hépatique, diabétique ou autre.
À propos de la vaccination, il me semble que nous vivons exactement le même phénomène : après l’affaire de l’hépatite B – personne n’a fait le parallèle entre les deux dossiers –, l’opinion publique a été déstabilisée et, des années plus tard, l’effet se fait toujours sentir. Le drame de Lübeck, en 1959, est encore d’actualité quand il s’agit de dénoncer la nocivité du vaccin BCG. Le manque de courage politique manifesté à l’occasion de l’arrêt de la vaccination en milieu scolaire contre l’hépatite B – je vois les choses ainsi – n’a fait que confirmer le poids de l’opinion publique. Celle-ci, forgée à partir d’informations bonnes ou mauvaises, a intégré que la médecine guérit tout et elle refuse de ne pas comprendre l’incompréhensible. Or exercer la médecine revient souvent à se battre contre l’inacceptable.
Personnellement, je n’ai pas voté en faveur du principe de précaution et je ne le ferai jamais car je considère qu’il constitue une insulte à la recherche médicale – la présidente le sait. Je suis un rescapé de la tuberculose, que j’ai contractée étant enfant ; j’en suis sorti grâce à la streptomycine. Aujourd’hui, à cause du principe de précaution, cet antibiotique ne pourrait pas être mis sur le marché ; en vertu du principe de précaution, tous les rescapés de la tuberculose seraient sous terre.
M. Pierre Bégué. Le 11 mai, l’Académie nationale de médecine organise une session sur le thème « Vaccination et société », avec M. Michel Setbon, sociologue, et trois autres intervenants.
M. Jean-Paul Bacquet. Aujourd’hui, l’intérêt individuel l’emporte sur l’intérêt collectif ; la notion même de santé publique n’est plus comprise.
Mme Jacqueline Fraysse, présidente. Il faut dire que nous ne travaillons guère sur le sujet.
M. Philippe Vitel. Les salons de médecines douces ou parallèles, qui pullulent tous les dimanches, ne rendent pas service non plus.
M. le rapporteur. N’est-ce pas la Cour de cassation qui avait établi un lien de cause à effet entre le vaccin contre l’hépatite B et la sclérose en plaques ? Les responsables politiques ont été coincés par cette décision judiciaire.
M. Jean-Paul Bacquet. Qu’un ministre, médecin lui-même, déclare qu’il s’en remet à la sagesse des médecins, c’est la négation de l’action politique.
Mme Jacqueline Fraysse, présidente. Monsieur Pierre Bégué, je vous remercie d’avoir consacré un peu de votre temps pour alimenter notre réflexion.
La séance est levée à midi quinze.
Audition de M. Didier Tabuteau,
conseiller d’État, directeur général de la Fondation Caisses d’épargne pour la solidarité et
directeur de la chaire Santé de l’Institut d’études politiques de Paris
et de M. Claude Le Pen,
professeur de sciences économiques à l’université de Paris-Dauphine
(Procès-verbal de la séance du mardi 13 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête.)
La séance est ouverte à quinze heures.
(M. Didier Tabuteau et M. Claude Le Pen prêtent successivement serment.)
M. Didier Tabuteau, conseiller d’État, directeur général de la Fondation Caisses d’épargne pour la solidarité et directeur de la chaire Santé de l’Institut d’études politiques de Paris. En revoyant, à la lumière de l’intitulé de la commission d’enquête, le « film » de la campagne de vaccination contre la grippe A(H1N1), je me suis posé six questions – auxquelles je ne sais d’ailleurs pas toujours répondre – sur la manière dont on aurait pu gérer cette situation et dont on pourrait à l’avenir gérer une situation similaire, car je suis persuadé que, depuis une dizaine d’années, nous sommes entrés dans une ère où de tels événements se reproduiront.
La première question, à laquelle j’apporterai le moins de réflexions personnelles, est celle de la légitimité de l’alerte. Bien que n’étant pas en mesure de juger d’un point de vue scientifique des données, notamment épidémiologiques, dont on disposait au départ – je ne suis spécialiste que des politiques publiques de santé –, je considère qu’il est important de se livrer à une analyse rétrospective. Or, ayant suivi l’évolution de l’épidémie par la presse, j’ai constaté qu’ont perduré jusqu’en octobre 2009, bien que de plus en plus contradictoires, des signaux indiquant une épidémie grave. Le débat actuel montre que la diffusion des données par l’Organisation mondiale de la santé, l’OMS, aux instances sanitaires nationales a suscité un questionnement inédit sur la manière d’élaborer une procédure permettant un examen partagé des données épidémiologiques et de santé publique. Je formulerai à la fin de mon exposé une proposition sur ce point.
La deuxième question qui se pose est celle de la proportionnalité de la réaction. En effet, le principe de précaution est d’abord un principe de proportionnalité : la riposte doit être adaptée au risque tel qu’il est apprécié à l’instant où l’on doit se prononcer – ce qui est, bien évidemment, très difficile. Or, nous manquons de moyens permettant d’évaluer le risque. Ainsi, il est toujours difficile d’apprécier le rapport coût/résultats, par exemple, de dispositifs de santé publique visant à prendre en charge des cas de méningite, ou même celui d’une campagne de vaccination saisonnière. Si nous disposons d’un travail assez bien documenté sur le cancer, qui remonte à plusieurs années et auquel il me semble d’ailleurs que M. Claude Le Pen a participé, nous manquons, dans l’affaire qui nous occupe, d’éléments de référence quant aux coûts médicaux directs – les vaccins – et aux coûts évités, comme les arrêts de travail ou les pertes de production.
La troisième question consiste à se demander quels étaient les objectifs de la politique de santé publique définis au début de l’épidémie et à mesure que s’imposait la conviction qu’un vaccin serait disponible. De fait, pour apprécier les résultats d’une politique, il faut d’abord en définir les objectifs. S’agissait-il de vacciner toute la population – et, dans ce cas, pourquoi la vaccination n’a-t-elle pas été rendue obligatoire ? De vacciner une part suffisante de la population pour endiguer l’épidémie, sachant qu’au-delà d’un certain seuil d’immunisation peut jouer un effet de protection collective ? De vacciner tous les volontaires ? Ou s’agissait-il, enfin, de vacciner tous les volontaires des groupes à risques ? Il m’a semblé que l’objectif était de vacciner tous les volontaires, toutes les personnes souhaitant être vaccinées. En effet, la vaccination n’a pas été rendue obligatoire et, même si l’on a défini des ordres de priorité, le dispositif consistait à permettre à chacun de recevoir un bon de vaccination.
La quatrième question est alors de savoir quels ont été les résultats au regard de l’objectif. S’il s’agissait de vacciner toute la population, le taux de réussite serait évidemment très bas mais, même dans l’hypothèse où l’objectif était de vacciner toutes les personnes volontaires, je sais par des retours qualitatifs, à défaut de données quantitatives, que tous ceux qui souhaitaient être vaccinés n’ont pas pu l’être avant le mois de décembre, à un moment où l’épidémie était pleinement présente sur le territoire national. Il s’agit, dans ce cas, d’un échec, alors même que la quantité de doses vaccinales disponibles aurait permis d’atteindre le résultat visé.
Par ailleurs, cette opération de santé publique a ravivé les tensions entre médecins et pouvoirs publics, séparés par un malentendu historique qui remonte à la création des officiers de santé par la Révolution française, voilà plus de deux siècles. Depuis une vingtaine d’années, des initiatives ont été prises pour tenter un rapprochement. La construction du programme de vaccination n’a cependant pas permis de surmonter l’opposition et, de ce point de vue encore, il ne s’agit donc pas d’un succès.
On a enfin pu observer des tensions entre les services de l’État et les services de santé publique. Certaines notes de service ont pu provoquer au sein des premiers des réactions liées à la difficulté de les mettre en œuvre. En vue de la préparation d’une autre échéance, et en particulier au moment où se mettent en place les agences régionales de santé, il importe de remédier à cette situation.
La cinquième question porte sur le mode d’organisation. Dans l’élaboration du programme de vaccination – et quel qu’ait été le bien-fondé de celui-ci –, on a oublié que notre système de santé avait beaucoup évolué depuis la fin du xixe siècle et le début du xxe siècle et que ce système était désormais très dense, très bien structuré et capable de prendre en charge la population. Le choix d’un système administratif face à une épidémie dont le déroulement a suivi, à quelques jours près, la projection qui en avait été faite, s’est révélé dommageable. Les médecins et les pharmaciens, vecteurs naturels de l’information sanitaire, se sont trouvés, à tout le moins, en décalage par rapport aux politiques publiques. Si, dès les mois de juin ou juillet, lorsque le processus de vaccination de masse a été envisagé, on avait associé à l’élaboration du plan les professionnels de santé, par l’intermédiaire de leurs organisations professionnelles, syndicales ou ordinales, l’approche générale et les effets des programmes de vaccination auraient certainement été très différents.
Je conclurai en évoquant quelques éléments de réflexion – ou de doute – quant à la manière dont devrait être construit un système analogue si un nouveau défi du même ordre se présentait.
Le premier point, sur lequel je ne reviendrai pas, porte sur la place à y ménager pour les professionnels de santé et pour les associations de patients.
J’observe, en deuxième lieu, que la parole des institutions de santé publique s’est très peu fait entendre. Nous disposons en France, depuis les événements terribles des années 1980, d’un système de santé publique et de sécurité sanitaire très développé, qui rassemble une grande expertise et d’importantes capacités de réaction. Si, depuis le mois d’avril, des instances telles que l’Institut de veille sanitaire, le Haut conseil de la santé publique ou l’Agence française de sécurité sanitaire des produits de santé avaient été officiellement saisies et si leurs avis avaient été rendus publics et discutés par l’ensemble des parties prenantes, au moyen par exemple d’auditions publiques – ou « hearings » – telles que les permet le code de la santé publique, le dispositif aurait certainement été beaucoup plus efficace et aurait bénéficié d’une plus grande crédibilité.
Ma troisième réflexion porte sur les modes de communication. Sur les risques liés à la grippe et au vaccin, cette communication a été d’une ampleur impressionnante : pour la première fois, on a assisté à une pharmacovigilance en temps réel. Il faut cependant que cette communication intervienne dans un cadre général permettant de mettre en perspective tous les éléments. C’est là un point sur lequel nous avons peu d’expérience et sans doute beaucoup de progrès à faire.
Enfin, une timidité excessive a prévalu en matière de déontologie de l’action publique, s’agissant notamment des conflits d’intérêts et de la publication de certaines données. Or, dans ce domaine qui prête aux réactions émotionnelles, le moindre élément de suspicion peut être très lourd de conséquences. C’est ainsi que des polémiques se sont fait jour à propos de liens d’intérêt que pouvaient avoir les experts, en France ou à l’étranger, avec des laboratoires pharmaceutiques. Dès le départ, la suspicion a pesé sur un programme de vaccination qui, par ailleurs, n’était pas porté par les professionnels de santé. De ce fait, la gestion de la vaccination a été un rendez-vous véritablement manqué avec la santé publique, alors même qu’un rapprochement s’était ébauché, notamment avec la création de la médecine générale de premier recours par la loi du 21 juillet 2009. À l’issue de cette épidémie, heureusement beaucoup moins grave que ce qui avait pu être annoncé au départ, la confiance a plutôt régressé sur ces sujets.
M. Claude Le Pen, professeur de sciences économiques à l’université de Paris-Dauphine. Je pourrais souscrire à la quasi-totalité des propos de M. Didier Tabuteau, à l’exception d’un point sur lequel je reviendrai. J’insisterai pour ma part sur cinq éléments.
Le premier est le paradoxe d’une surpréparation aboutissant à un échec. À la différence en effet de crises sanitaires antérieures, comme celle de la canicule qui a surpris les pouvoirs publics, il y avait ici un excès de préparation. Mais être très préparé ne prémunit pas contre les effets d’une politique inadaptée. La France, qui l’était fortement à un risque de virus du type H5N1, a transposé ce plan à une attaque du virus H1N1, pensant que le scénario qui s’était déroulé au Mexique était le scénario catastrophe annoncé, dans lequel s’associaient la létalité d’un virus aviaire classique et la transmissibilité du virus H1N1 traditionnel. D’où une réponse massive qui s’est soldée, de façon inédite, par au moins un demi-échec.
En deuxième lieu, dès avant l’été jusqu’en novembre, l’action des pouvoirs publics a été commandée par la peur d’une pénurie de vaccins, du fait de l’incertitude quant aux doses à administrer et aux process de fabrication, ainsi que des difficultés que rencontraient les laboratoires pour obtenir les autorisations de mise sur le marché. Lors du pic épidémique, au début de décembre 2009, il y a eu une véritable angoisse de ne pouvoir satisfaire la demande en cas de ruée de la population. La négociation avec les laboratoires était, au début du moins, très centrée sur les délais de livraison et sur les capacités de production – question qui avait d’ailleurs été soulevée déjà dans le cadre de la préparation à une grippe H5N1. À cela s’ajoutait le fait que la France est l’un des très rares États à s’être engagés à fournir des vaccins à d’autres pays… Cette peur de la pénurie a été très réelle jusqu’au retournement brutal de situation intervenu vers le 20 ou 25 décembre 2009, moment où l’on a constaté la pléthore.
Le troisième point, sur lequel je suis en léger désaccord avec Didier Tabuteau, porte sur le principe de précaution. La réponse a été excessive par crainte d’une réponse insuffisante. L’application du principe de précaution, inscrit dans la Constitution, pose un énorme problème. En effet, si la loi du 2 février 1995 relative au renforcement de la protection de l’environnement dite « loi Barnier » dispose que « l’absence de certitudes, compte tenu des connaissances scientifiques et techniques du moment, ne doit pas retarder l’adoption de mesures effectives et proportionnées visant à prévenir un risque de dommages graves », comment proportionner une réponse à un risque inconnu ? C’est précisément ce qui conduit à la disproportion, par crainte de ne pas faire assez. La même question se pose pour le « coût acceptable ». Le texte est certes pédagogique, mais il est inapplicable.
Le quatrième point, que me suggère l’étude de l’histoire des épidémies, est qu’il est constant que l’épidémie, maladie du peuple, est une maladie plus politique que sanitaire. Les opinions publiques y ont toujours réagi d’une manière politique. Permettez-moi de vous lire à ce propos un texte cité dans un ouvrage de François Delaporte sur le choléra à Paris en 1832 : « Beaucoup de personnes en France n’avaient vu dans cette maladie qu’une direction donnée aux esprits par le gouvernement afin de détourner l’attention des affaires publiques ». Lorsque le choléra a commencé à tuer, on a dit que « le prétendu fléau n’était que l’exécution d’un projet d’extermination conçu par le gouvernement » après les Trois Glorieuses de 1830, dans un climat social tendu. Ce phénomène n’est pas propre à la France : « À l’apparition de cette maladie, le peuple de Revel, semblable à celui de toutes les cités russes, reste persuadé qu’il est empoisonné. Sa défiance devient extrême. Il refuse les secours de l’art, refuse jusqu’aux aliments qu’on lui distribue, éprouve une aversion insurmontable pour les hôpitaux et commence à méconnaître les voix puissantes de l’autorité. » L’épidémie suscite le doute. Dans un contexte politique tendu, on recourt à des métaphores militaires : la maladie est assimilée à une invasion et le virus à un ennemi, auxquels l’individu oppose des « défenses » immunitaires.
Je crois pouvoir faire l’hypothèse que ces épisodes de santé publique sont d’autant plus mal vécus que la société est clivée politiquement. C’est peut-être la raison pour laquelle la réaction a été très différente dans les pays nordiques, notamment en Suède, où 80 % de la population a été vaccinée. Faute d’une confiance suffisante entre les pouvoirs publics et l’opinion publique, une suspicion malsaine a joué. Je ne crois pas, bien sûr, qu’il y ait eu de complot de la part des opposants aux vaccins ou de sombres capitalistes, mais je pense que des messages inquiétants ont réveillé un fonds de représentations populaires qui remonte à 150 ans. A ainsi joué une coupure entre les élites et la masse, entre la parole des experts et le vécu des gens. Ce vécu s’exprime dans les réponses à une enquête d’opinion citées par l’un des experts auditionnés par l’Office parlementaire d’évaluation des choix scientifiques et techniques : lorsqu’on demandait aux personnes interrogées si elles pensaient qu’elles contracteraient la grippe, puis, au cas où elles la contracteraient, si elles pensaient que ce serait grave, elles répondaient deux fois « non ». Le discours alarmiste est apparu en contradiction avec cet état de l’opinion publique et a semblé procéder d’une volonté sournoise d’exercer un inacceptable « contrôle des corps », selon l’expression de Michel Foucault. La résistance n’est pas liée à une mauvaise appréhension des risques ou à l’ignorance, mais elle est une sorte de sursaut face aux tentatives d’imposer une solution que l’on ne comprend pas. Cette réaction négative ne doit pas nécessairement être appréciée en termes négatifs.
Mon cinquième point a trait à la place des professionnels de santé. Si l’on rejouait aujourd’hui la pièce, je pense qu’on le ferait pratiquement dans les mêmes termes – on passerait les mêmes commandes et formulerait les mêmes hypothèses sur la couverture de la population. En revanche, on n’écarterait sans doute pas du dispositif l’extraordinaire potentiel que constituent les 55 000 médecins libéraux, les 60 000 infirmières, les 3 000 hôpitaux et les 22 000 officines de ce pays. Ces professionnels ont très mal ressenti leur exclusion et émis des anticorps davantage du fait de cette exclusion que de la politique sanitaire proprement dite, et c’est dans cette absence d’implication que réside, selon moi, la faiblesse de l’organisation choisie.
Cette défiance vis-à-vis des médecins tient à plusieurs raisons. Sans doute la crainte d’une pénurie a-t-elle joué, incitant à concentrer plutôt les vaccinations en certains lieux. On a également trouvé des arguments techniques, liés à l’impossibilité de fractionner les flacons de dix doses – mais, au point où on en était, on aurait fort bien pu le faire, quitte à en perdre quelques-unes. Sans doute considérait-on que la santé publique est, au fond, une politique régalienne, relevant de la responsabilité de l’État – des préfets plutôt que des professionnels de santé. D’où une organisation très militaire, hiérarchique – « top-down », dans le vocabulaire des consultants –, où l’autorité est une autorité d’ordre avant d’être une autorité de santé. L’ordre l’a emporté sur la santé, et il est à craindre que ce doive être encore le cas. On redoute l’anarchie et la prise d’assaut des pharmacies – le plan H5N1 prévoit d’ailleurs une protection policière des pharmacies en cas de pandémie.
Le dernier point, que l’on pourrait numéroter 5 bis, porte sur la crise de légitimité. L’État s’est dépouillé de sa légitimité au profit d’agences, de telle sorte que l’on ne sait pas où réside aujourd’hui la légitimité en matière de santé publique : appartient-elle à la Haute Autorité de santé, à l’Agence française de sécurité sanitaire des produits de santé, à l’Institut national du cancer, à l’Institut de veille sanitaire ou au ministère ? Qui a le droit de parler ? Est-ce la ministre, qui a créé toutes ces agences spécialisées ? Les Français voient mal où est le pouvoir réel et d’où vient l’analyse des questions de santé qui les concernent.
M. Jean-Pierre Door, rapporteur. Les deux exposés que nous venons d’entendre sont remarquables. Les gens ayant tendance à croire que ce qu’ils lisent dans la presse ou sur internet est la vérité, ils ont pris pour argent comptant les campagnes menées sur ces supports, où les termes mêmes de « virus » et de « pandémie » ont été galvaudés.
Il me semblerait utile d’essayer d’identifier, à partir des interventions de M. Tabuteau et de M. Le Pen, des pistes pour l’élaboration d’un nouveau plan, plus adapté à une nouvelle pandémie et exempt des dysfonctionnements que nous avons connus.
M. Didier Tabuteau. Il existe entre M. Claude Le Pen et moi-même, en dehors de l’interprétation du principe de précaution, un deuxième point de divergence. En effet, la présence de l’épidémie n’est pas constante depuis le xixe siècle : ce que nous vivons à cet égard depuis la fin des années 1990 et le début des années 2000, c’est une résurgence. Dans la deuxième moitié du xxe siècle, des épidémies dramatiques ont frappé le monde et la France, notamment en 1957-1958 et 1967-1968, en étant ignorées du grand public. Nous ne sommes donc pas confrontés à une réitération des épidémies qui, comme le choléra de 1832, scandaient le temps politique, mais à leur réapparition au terme de près d’un demi-siècle pendant lequel les pays riches, notamment européens, ont pu croire que le progrès médical avait permis de les surmonter. La conjonction du syndrome respiratoire aigu sévère (SRAS), qui a donné lieu à la première intervention de l’OMS dans les politiques publiques des pays développés, de la menace du virus H5N1, qui présentait un taux de létalité très élevé, et du bioterrorisme qui a suivi le 11 septembre 2001, a ressuscité cette peur des épidémies dans des pays qui s’en croyaient protégés. C’est là que se situe le point de rupture et c’est alors qu’a été défini un plan de lutte contre la pandémie. Et ce phénomène ne peut que s’accentuer compte tenu des moyens dont nous disposons pour assurer la surveillance des virus. De fait, nous avons pu suivre en direct le franchissement des frontières par le SRAS et par les virus H5N1 et H1N1.
J’en reviens à ma proposition. Il faut réfléchir sur la manière dont est proférée la parole de santé publique dans un monde où l’information sur la santé est multiple et où la santé elle-même est un sujet majeur de préoccupation pour la population. À l’exception du cas catastrophique d’une épidémie imprévue qui se développerait en quelques jours, appelant une organisation administrative et militaire, les pouvoirs publics doivent avoir la capacité de produire du débat susceptible d’être repris par la société. Ainsi, des auditions publiques menées par les instances de santé existantes – des « hearings » à la française, qu’avait d’ailleurs prévues la loi de 2002 –, permettraient au public de s’approprier ce débat par tous les moyens de communication et le structureraient. Faute de débat contradictoire avec les partenaires socio-professionnels et associatifs sur ces questions, il sera impossible de gérer une pandémie ou une épidémie de ce type dans un système de santé organisée comme il l’est actuellement.
M. Claude Le Pen. Je partage l’opinion de M. Tabuteau sur ce dernier point. Pour ce qui est en revanche de la controverse académique consistant à savoir si l’on avait oublié les épidémies ou si elles réapparaissent en faisant ressortir un vieux fonds culturel, j’observe que la question se posait déjà en 1830 : on professait alors que la France était réfractaire aux agents pathogènes et que notre pays moderne ne pouvait pas souffrir d’une maladie du Moyen Âge. L’idée que la pathologie est toujours du passé et que la modernité nous en protège est un thème récurrent, du moins dans la période moderne. Les grandes maladies infectieuses relèvent d’un monde sous-développé, qui se caractérise par l’ignorance, l’insalubrité et la misère – association mise en lumière notamment par Louis Chevalier. La situation que nous évoquons aujourd’hui n’est certes pas la réplique d’une situation antérieure, mais il existe une constante : on oublie toujours la pathologie, qui revient toujours – comme la crise économique.
L’élaboration des politiques publiques devrait tenir compte de la dimension sociale et des représentations de la population, sans se limiter à une vision médicale et technocratique. S’il n’est pas plus foisonnant que par le passé, ce fonds s’exprime davantage : on ne pense pas plus qu’autrefois, mais on publie ses pensées sur Twitter ou sur internet – y compris les plus inavouables, car la parole y est libre. Chacun de nous est un journal et la publication de la pensée privée change les termes d’une communication maîtrisée par des professionnels ou par des agences de communication. On ne peut plus commander la population comme on la commandait lorsque la parole légitime était unique et passait par un canal lui aussi unique.
Mme Marisol Touraine. Je tiens à remercier les deux intervenants pour leurs exposés très intéressants.
À vous écouter, il semble qu’une grande partie de l’échec viendrait de l’incapacité d’assigner des objectifs précis à la campagne de vaccination. Si les pouvoirs publics avaient mieux précisé l’objectif recherché, peut-être la suite aurait-elle été moins chaotique. Vous avez bien montré qu’il y avait maldonne dès le départ, quand on s’est arrêté au scénario d’une épidémie combinant la létalité du H5N1 et la contagiosité du H1N1. Cependant, ce scénario était disqualifié dès avant l’été. Pensez-vous que les pouvoirs publics ont eu le sentiment de ne pas pouvoir changer de discours politique ? Comment doit-on gérer l’évolution d’une crise ? N’aurait-il pas été possible d’expliquer que l’appréciation de la situation avait changé et que la politique devait changer en conséquence ?
Ma deuxième question porte sur la capacité à tenir un discours légitime dans une démocratie d’information. M. Houssin nous a expliqué la semaine dernière qu’internet était la cause de la crise, du fait de la diffusion d’informations erronées, mais son existence n’en est pas moins une donnée de fait. Pensez-vous que, dans une telle crise, la mise en réseau des acteurs « traditionnels » – instances ordinales, associations de médecins et associations de patients – suffit ? Est-ce la légitimité de la parole publique qui est en cause, ou celle de la parole des experts ? Si les instances ordinales avaient été impliquées, la communication et la conviction auraient-elles été meilleures ?
Enfin, je m’interroge sur l’idée selon laquelle une société clivée politiquement accorderait une moindre autorité à la parole publique. En France, une forte tradition étatique a peut-être nui à la démocratie au quotidien cependant que les pays du Nord, très démocratiques, connaissent d’importants débats. Notre pays ne paie-t-il pas aujourd’hui le fait de se vouloir de moins en moins étatiste sans s’être doté d’instances de débat public dignes d’une démocratie de l’âge de l’information ?
M. Claude Le Pen. Je ne suis pas loin de le penser.
Les commandes de vaccin révèlent une stratégie réfléchie – même si l’on ne s’est pas donné les moyens de la mettre en œuvre. La commande de 94 millions de doses de vaccin s’explique en effet par le calcul suivant : sur 60 millions de personnes, on a considéré que 20 % ne se feraient pas vacciner ; il restait alors environ 45 millions de personnes à vacciner, à raison de deux doses par personne. Pour être cohérent et écouler toutes ces doses, il aurait néanmoins fallu s’y prendre autrement : on ne vaccine pas 45 millions de personnes en les convoquant dans des gymnases le samedi après-midi.
Il y a eu, en fait, deux stratégies : l’une de vaccination de masse, pour les commandes, et l’autre de vaccination élitiste, centrée sur les groupes à risque et non cohérente avec la première – je n’ai, pour ma part, reçu mon bon de vaccination qu’en février, comme certains d’entre vous sans doute. Soit on a commandé trop de doses pour le modèle de vaccination retenu, soit on n’a pas retenu le bon modèle de vaccination pour le nombre de doses commandées.
Par ailleurs, je tiens à insister sur le fait qu’il faudra impliquer à l’avenir les professionnels, par l’intermédiaire de leurs institutions, de leurs organisations, de l’ordre des médecins et des organisations syndicales. Lors de la préparation du plan H5N1, j’ai été frappé par les excellents commentaires des syndicats de pharmaciens et de médecins au sortir de la petite cellule de crise réunie pour l’occasion. Malgré quelques divergences, les travaux avançaient bien. Or, lors du passage à l’exécution, les professionnels ont été éliminés. C’est là encore une forme de contradiction.
Quant à changer de politique en cours de route, c’est très difficile. La tentation d’un gouvernement est de rester droit dans ses bottes, de peur de troubler davantage l’opinion publique en changeant de politique.
M. Didier Tabuteau. Pour ce qui est de la légitimité de l’État, il ne faut pas oublier que, si la France est un pays colbertiste, doté d’un État fort, ce n’est pas vrai dans le domaine de la santé, où la compétence a été communale et l’intervention de l’État très modeste aux xviiie et xixe siècles, à l’exception de certains cas d’épidémie. L’État n’a commencé à acquérir une légitimité en ce domaine que dans les années 1990, après le drame du sang contaminé et la crise de la vache folle.
Par ailleurs, il me semble que la sécurité sanitaire et les crises de la fin du xxe siècle nous ont appris que la réévaluation permanente des décisions était une nécessité et que cette capacité de se remettre en cause à mesure qu’évoluent les connaissances était la meilleure manière d’appliquer l’obligation de précaution que j’évoquais tout à l’heure.
M. Jean Mallot. Je reviendrai sur le cinquième point évoqué par M. Claude Le Pen. Au printemps 2009, la question de la pandémie était essentiellement abordée par le Gouvernement et par la presse sous l’angle de ses conséquences économiques : sans trains ni métros, et avec des entreprises paralysées, le pays allait s’arrêter. Vous avez par ailleurs relevé que l’État s’était dépouillé de sa légitimité au profit des agences – et nous travaillons par ailleurs, dans le cadre d’autres missions d’information, sur les autorités administratives indépendantes. Pensez-vous qu’il faille remettre en cause cette situation pour rendre à l’État du pouvoir – et, si c’est le cas, comment ? À défaut, ne pourrait-on faire en sorte que l’État conserve une légitimité réelle ?
M. Claude Le Pen. Les agences ont été créées parce qu’on pensait que l’État n’avait pas les capacités d’expertise nécessaires ou manquait de moyens matériels. On a donc créé des zones d’expertise indépendante, pour préserver la décision publique de toute suspicion, notamment du soupçon d’être inspirée par des experts choisis. Il s’agissait là d’un modèle de « démembrement » démocratique, destiné à bien séparer ce qui relève de la science et ce qui relève du choix public. Mais, dans cette logique, il faut laisser les agences aller jusqu’au bout, et créer par exemple une agence chargée de la sécurité face aux pandémies, qui donne les directives. La ministre ne doit pas interférer dans l’élaboration par ces agences de leurs recommandations, ni même peut-être dans leur financement, se contentant de contrôler leur bon fonctionnement, de veiller à leur coordination et à être garante de leur sérieux et de leur scientificité. La situation actuelle est un entre-deux. Cela étant, le mouvement engagé ne paraît pas réversible et je ne pense pas qu’il soit question de reconstituer avenue de Ségur le ministère d’antan.
Pour la plupart d’entre elles, ces agences ne fonctionnent pas trop mal. On a cependant pu déplorer parfois l’absence d’une agence spécifiquement consacrée au traitement des catastrophes sanitaires, qui aurait permis un meilleur fonctionnement. Aujourd’hui, il y a à la fois trop d’agences et pas assez. On ne sait plus si la légitimité politique réside dans la technique – établir un plan et décider – ou dans la communication en direction des Français, dans le choix principiel entre une vaccination générale et une vaccination élitiste.
M. Philippe Vitel. J’interpréterai sous un autre angle les questions de M. Mallot. L’une des conclusions de la commission d’enquête sur la canicule a été que les structures, qui étaient alors moins nombreuses qu’aujourd’hui, n’avaient pas su travailler d’une manière transversale. La transversalité a-t-elle gagné à leur multiplication ? Certaines structures ont-elles failli ? La remontée d’informations vers le sommet de la pyramide – le bureau du ministre – s’est-elle faite correctement ?
M. Claude Le Pen. Ces agences communiquent peu entre elles, sauf lorsqu’on invite leurs directeurs à un colloque !
M. Didier Tabuteau. Je vois les choses un peu différemment. Avant la création des agences, on ne pouvait pas prononcer les mots de « santé publique » au ministère de la santé, qui ne possédait aucune expertise permettant de faire face à quelque problème que ce soit. En cas de difficulté, un conseiller constituait un groupe de travail informel en réunissant quelques médecins de sa connaissance. Les agences ont apporté à ceux qui doivent prendre des décisions sur des sujets difficiles une expertise et une capacité sans aucune mesure avec ce dont on disposait auparavant. De quelques centaines de cadres administratifs, on est passé à plus de 10 000 personnes travaillant exclusivement pour la santé publique et produisant de l’expertise et des connaissances. C’est un autre monde.
Les agences ont été créées comme des « bras armés » permettant à l’État de connaître la situation et de réagir au mieux. C’est la raison pour laquelle elles ont été conçues, non comme de grandes structures administratives employant un personnel nombreux, mais comme des unités ne comptant jamais plus de 1 000 personnes, disposant d’une forte réactivité et en relation étroite avec les réseaux scientifiques nationaux et mondiaux de manière à faire remonter rapidement l’information pour donner au ministre tous les éléments nécessaires à la prise de décision. En effet, en dehors de très rares délégations de compétences, ces agences, parce que créées par réaction à une période où l’État n’exerçait pas assez de responsabilités, ont pour mission de permettre au ministre d’assumer sa responsabilité incessible en matière de santé publique.
C’est d’ailleurs ainsi que les choses fonctionnent aux États-Unis, pays pourtant peu suspect de colbertisme : le secrétaire d’État à la santé détermine sa politique en s’appuyant sur l’expertise fournie par le Center for Disease Control and Prevention (CDC), par la Food and Drug Administration (FDA), par les National Institutes for Health (NIH) et par d’autres agences encore.
Sous réserve d’éventuels dysfonctionnements dont je ne suis pas informé, je suis persuadé que, constitué surtout depuis les années 1998-2002 où l’on a commencé à avoir une perception plus aiguë des risques de santé publique, ce dispositif d’agences assistant le ministre et fortement intégrées dans les circuits administratifs comme dans les réseaux d’expertise est nécessaire pour faire face aux urgences.
M. Patrice Debray. Médecin généraliste, j’ai eu, dès le début, le sentiment que l’on réagissait à l’épidémie comme si l’on était en face du virus H5N1, alors qu’il s’agissait du H1N1, de sorte que la réponse a été inadaptée et surdimensionnée. Ensuite, il était en effet très difficile de revenir en arrière. Disposait-on ou non des éléments qui auraient permis de gérer le risque de façon plus adéquate ?
Je continue d’exercer, dans le cadre d’une maison médicale pluridisciplinaire regroupant six généralistes. Nous avons été associés aux discussions initiales sur la façon de gérer cette crise sanitaire mais je dois humblement reconnaître que nous avons manifesté des réticences en ce qui concerne notre participation à la campagne de vaccination : nous ne disposions pas de vaccins unidoses, ce qui nous aurait obligés à regrouper les rendez-vous, et, surtout, nous ne savions pas grand-chose des éventuelles réactions post-vaccinales ; or nous avions le souvenir d’avoir dû interrompre la vaccination contre l’hépatite B parce qu’on redoutait qu’elle ne contribue à l’apparition de scléroses en plaques. Prétendre que l’on a écarté les médecins libéraux de cette campagne n’est donc que la moitié de la vérité : nous n’étions pas très enthousiastes !
M. Claude Le Pen. Je n’ai pas d’éléments en ce qui concerne votre premier point. Ce que je puis dire, c’est qu’à l’époque, on a rappelé que le virus responsable de l’épidémie de grippe espagnole de 1919 était un virus H1N1. Le souvenir de ce précédent, les nouvelles venant du Mexique et le fait que l’agent de transmission était l’oiseau, tout cela a joué en faveur d’un scénario pessimiste. D’autre part, on était mal informé de ce qui se passait dans l’hémisphère Sud – les informations venant d’Australie étaient très contradictoires – alors que cela aurait dû constituer un test en vraie grandeur.
M. le président Jean-Christophe Lagarde. Mais on savait ce qu’il en était dans nos territoires d’outre-mer…
M. Claude Le Pen. Certes, et les premiers doutes sur la létalité de l’épidémie ont surgi quand on a constaté qu’il n’y avait pas eu autant de décès qu’on le redoutait dans l’hémisphère Sud. On n’en est pas moins resté au scénario catastrophiste pour un certain temps encore.
Point qui n’a pas été souvent signalé : on a produit en France, dans le même temps, le vaccin contre la grippe H1N1 et le vaccin interpandémique classique, la CNAM envoyant pour ce dernier des bons aux patients de plus de soixante-cinq ans et à certains patients en affections de longue durée. D’où une certaine confusion dans l’esprit de nos compatriotes. À un moment, on a même dit et écrit que le vaccin interpandémique, qui bénéficie d’une certaine confiance, pouvait peut-être protéger « un peu » de la grippe H1N1.
M. Jean-Paul Bacquet. Un « on-dit », précisément !
M. Claude Le Pen. Tout a été dit, et le contraire de tout, ce qui explique le trouble de l’opinion.
Quant aux accidents postvaccinaux, ils ont fait l’objet d’un suivi exemplaire. L’apparition de la moindre rougeur était rapportée au journal télévisé ! Mais on n’a pas constaté d’accident grave, y compris du fait des adjuvants, chez les centaines de milliers de personnes vaccinées.
M. le président Jean-Christophe Lagarde. Sur ce point, tout le monde est d’accord.
M. Didier Tabuteau. C’est bien parce que les médecins et autres professionnels de santé ont eu des réticences à s’engager dans la campagne de vaccination que je parle d’une occasion manquée. On avait là une chance de les mobiliser pour une importante action de santé publique, mais cela supposait de ne pas attendre septembre ou octobre pour les solliciter : il fallait les associer à la préparation de la circulaire du 21 août et, plus largement, à l’élaboration de la stratégie. Leurs réticences auraient alors été moindres.
M. Jean-Marie Le Guen. Je suis un peu étonné d’entendre mettre en cause les agences. Si je ne m’abuse, de toutes les crises sanitaires de ces vingt dernières années, celle-ci est sans doute celle où elles sont le moins intervenues. Sa gestion a en effet été intégralement prise en charge par l’administration : pour partie par le ministère de la santé, avec un directeur général de la santé cumulant cette fonction avec celle de délégué interministériel à la lutte contre la grippe aviaire (DILGA), et pour partie par le SGDN et par le ministre de l’intérieur, omniprésents ! Certes, l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS) est une agence – mais une agence de moyens, et encore… Quant à l’InVS, son rôle a été relativement modeste et, au demeurant, il n’est pas compétent pour tous les risques, ce qu’on peut regretter.
Que cette crise de santé publique ait été gérée par le cœur du cœur de l’appareil d’État, voilà déjà qui fait question.
Au surplus, cette intervention a été celle d’un État puissant comme jamais, échappant à tout contrôle du Parlement. Il a en effet décidé d’engager des centaines de millions d’euros sans en référer au Parlement et il a fait de même pour la définition de la stratégie de vaccination. Il a en outre réquisitionné des internes, désorganisant notre appareil de soins, et a révoqué ad nutum des responsables d’administrations sanitaires et sociales. Chaque jour, des conférences de presse se tenaient au ministère de la santé, animées par la ministre elle-même, entourée de tous les responsables de l’administration. Dans ces conditions, je m’étonne qu’on s’interroge sur le point de savoir si l’État avait les moyens d’agir.
Je m’étonne également que vous prétendiez, monsieur Le Pen, que cet État pouvait difficilement faire marche arrière. Pourquoi alors avoir écrit tant d’excellents articles dans les journaux, tout au long de la crise ? Vous exposiez dans Le Figaro tout ce que l’État aurait dû faire : quelle conception avez-vous donc des politiques pour penser qu’ils ne pouvaient comprendre vos arguments et modifier leur approche ?
Nous discutons beaucoup de la stratégie de vaccination et des achats de vaccin, mais il y a un élément qui est peu pris en considération : c’est qu’il était impossible aux laboratoires de livrer les vaccins en temps et en heure. Si le désir de se faire vacciner s’était maintenu au niveau où il était les premiers jours, on se serait heurté à une pénurie massive. Les 90 millions de doses ne seraient jamais arrivées à temps pour satisfaire la demande ! Quelles tensions n’aurions-nous pas eu à affronter si l’épidémie n’avait pas été bénigne ! Dès lors, à supposer que les Français aient été tous volontaires pour se faire vacciner, convenait-il de leur laisser croire qu’il y aurait un vaccin pour chacun ? De leur répéter que le vaccin était le principal rempart contre l’épidémie ?
M. Didier Tabuteau. La question du rôle des agences de santé publique me paraît à moi aussi importante – il faudrait d’ailleurs y ajouter celle du rôle du Haut Comité pour la santé publique, qui aurait dû être majeur dans la définition de la stratégie vaccinale et thérapeutique. J’ai essayé, sans y réussir, de dresser un historique des saisines officielles de ces instances. Mon sentiment est qu’elles ont été beaucoup moins présentes que pendant la crise de la vache folle, par exemple. Or leur intervention aurait eu le mérite de faire pièce à la constitution, ici et là, de groupes de travail informels. La saisine officielle permet de s’appuyer sur des agences préétablies, ayant une compétence précise et reconnue et des règles de fonctionnement claires, rodées pour répondre dans de bonnes conditions aux questions posées mais aussi rassemblant, à côté des experts du sujet, des spécialistes de méthodologie ou d’épidémiologie, des sociologues ou des représentants d’associations de patients. Il me semble donc qu’une des leçons à tirer de cette crise devrait être la nécessité d’élaborer une procédure de gestion de crise de façon à utiliser toutes ces institutions de façon optimale et « audible » : loin d’affaiblir le rôle de l’État, cela ne peut que le conforter.
M. Claude Le Pen. Nous n’attaquons pas les agences ni ne mettons en cause leur existence. Simplement nous observons qu’elles ont été créées en fonction des circonstances, d’où le besoin de les coordonner et de combler certaines lacunes, et nous posons la question de la répartition de la légitimité entre l’État et ses « bras armés » : qui commande ? Pourquoi l’État a-t-il agi sans elles – le cerveau sans ses bras – ? Il en est résulté un trouble auquel, pensons-nous, on peut parer en organisant mieux leur action commune, ce qui peut aller jusqu’à changer le modèle d’État dans ce domaine de la santé qui a, en France, une spécificité pour des raisons historiques : si l’État doit agir à travers ses agences, il doit leur conférer une certaine légitimité, leur permettant d’émettre des recommandations sans aucune interférence de sa part – et nous n’en sommes pas tout à fait là.
Quant à la possibilité ou non de changer de politique… Je ne suis qu’un modeste publiciste qui écrit dans les journaux qui veulent bien l’accueillir, et je suis persuadé que les politiques font ce qu’ils peuvent. La sociologie des organisations – ou, plus largement, de la décision car le problème n’est pas propre à la politique – montre que, plus une organisation est grande, moins les politiques sont flexibles. On peut les ajuster, mais il est très difficile d’en changer en cours de route : c’est considéré comme un aveu d’échec. Les décideurs tendent à aller au bout de leurs convictions, considérant qu’ils ont charge d’âmes et que leur trouble se communiquerait à leurs troupes. Ils doivent faire semblant d’avoir raison et, s’ils ont des doutes, les cacher. Que ce soit regrettable, j’en conviens, et de même je vous accorde volontiers qu’en l’espèce, il eût fallu changer la politique suivie. Quant à savoir ce qu’il en sera à l’avenir…
M. le président Jean-Christophe Lagarde. Quelle est votre réponse, s’agissant de la légitimité de l’alerte, au niveau national et au niveau international ? Par ailleurs, M. Debray a rappelé qu’on avait opposé au virus H1N1 une réponse conçue pour le H5N1, ce qui pose non seulement la question de l’adaptation des politiques, mais aussi celle des conceptions du profane en matière médicale. Nous avons grandi dans la certitude que les antibiotiques, la cortisone, etc. soigneraient tous nos maux et nous nous comportons comme si la grippe était une maladie bénigne. Cette mauvaise perception des risques et des incertitudes médicales n’a-t-elle pas joué un rôle négatif ?
Par ailleurs, puisque vous avez insisté sur le caractère proportionné que doit avoir la réaction, comment évaluer cette proportionnalité ?
L’administration de la santé a invoqué un argument de responsabilité médicale, en cas d’accidents postvaccinaux : n’y avait-il pas d’autre moyen de couvrir ce risque d’assurance que de regrouper les médecins en les réquisitionnant ?
Enfin, vous avez relevé qu’on a produit en même temps le vaccin contre la grippe classique et le vaccin contre le virus H1N1. Dans la mesure où, au moment où on a passé commande de ce dernier, on redoutait une pandémie fortement létale, ne pouvait-on établir un ordre de priorité ? Comment expliquez-vous qu’on ne l’ait pas fait ?
M. Claude Le Pen. Je ne l’explique pas. Je sais seulement que cela a posé problème à la firme produisant le vaccin contre le H1N1, et entraîné un certain retard dans les livraisons. Mais le virus de la grippe classique étant présent, même si c’était « à bas bruit », on n’a sans doute pas jugé opportun d’interrompre la procédure de vaccination habituelle. En outre, il en est comme de ces gros pétroliers qu’on ne peut pas arrêter en se contenant de mettre au point mort…
M. Didier Tabuteau. L’alerte était-elle légitime ou non ? J’avoue ne pas savoir répondre à cette question indéniablement majeure, faute de connaître les données dont disposaient l’OMS et les institutions de santé nationales. Mais j’attends avec beaucoup d’intérêt les travaux qui seront produits sur le sujet.
Quant à la proportionnalité de la décision, je ne suis pas choqué qu’on se soit fixé pour objectif de vacciner toutes les personnes qui le souhaitaient. C’est d’ailleurs ainsi qu’on agit pour la grippe saisonnière et cela répondait à l’attente de la population, telle qu’on pouvait la percevoir en septembre-octobre. Cette demande de protection était légitime et je rappelle qu’on y a répondu par d’autres moyens : ainsi je n’aurais garde d’oublier la campagne en faveur des mesures d’hygiène, qui a certainement servi contre d’autres maladies que la grippe H1N1.
Cela étant, même s’il faut prendre en compte une certaine proportion de refus de vaccination – que je suis incapable d’évaluer mais qui commandait peut-être de ne pas aller jusqu’à 94 millions de doses –, je le répète, la décision prise en juin-juillet ne me choque pas au regard du critère de proportionnalité, mes réserves portant plutôt sur le fait qu’on n’a pas mené la politique que cela impliquait.
Sur le problème de la responsabilité, je dois avouer mon incompréhension. J’avais cru comprendre que le vaccin ferait l’objet d’une autorisation de mise sur le marché (AMM) normale. Dès lors, nous devions être dans le champ d’une responsabilité de droit commun, tant pour le producteur que pour le prescripteur. Si le produit avait été utilisé sans AMM ou hors AMM, c’est l’article L. 3131-3 du code de la santé publique qui se serait appliqué : en cas de menace sanitaire grave, « les professionnels de santé ne peuvent être tenus pour responsables des dommages résultant de la prescription ou de l’administration d’un médicament », et c’est l’État qui assume cette responsabilité. Mais, si le vaccin, comme on l’a dit, avait été évalué normalement et avait obtenu une AMM, je ne vois pas en quoi un régime dérogatoire aurait été justifié ! Certes, depuis 1976 et les cas de syndrome Guillain-Barré enregistrés aux États-Unis après une campagne de vaccination contre la grippe porcine, les entreprises pharmaceutiques entretiennent quelques inquiétudes, et on aurait à la rigueur pu prendre une mesure législative. Mais je ne suis pas sûr que cela aurait rassuré – au contraire même, on aurait sans doute accru les doutes de la population.
Mme Dominique Orliac. Vous pensez qu’à l’avenir, le seul grand changement à apporter à la gestion d’un risque pandémique consisterait à y associer les professionnels de santé. Mais, parmi les raisons pour lesquelles on ne l’a pas fait en 2009, il en est une que vous n’avez pas mentionnée et qui a pourtant été avancée : c’est le coût. Peut-on évaluer le surcoût qu’aurait eu la vaccination par ces professionnels, par rapport au dispositif choisi par le Gouvernement ?
D’autre part, monsieur Tabuteau, au moment où l’on s’attendait à une grippe fortement létale, on avait prévu de faire prendre en charge par le SAMU les patients présentant un syndrome grippal ou ayant été en contact avec un malade ; le SAMU les aurait conduits à l’hôpital où on leur aurait administré du Tamiflu. Cette mesure vous semblait-elle appropriée à un risque épidémique comme celui-là ? Cependant, par la suite, le Tamiflu a été donné sans formalité. Cette attitude fluctuante, qu’on retrouve dans l’information dispensée aux Français, ne vous semble-t-elle pas avoir eu un rôle négatif ?
M. Claude Le Pen. Les généralistes ont dit qu’on ne les avait pas mobilisés pour éviter d’avoir à les payer, mais je ne crois pas que ce soit la raison décisive, qui se trouve plutôt à mon avis dans l’organisation « militaire » de la vaccination et dans la peur d’une pénurie. Je pense d’ailleurs qu’on aurait pu négocier un tarif avec les médecins pour faire autrement qu’on a fait…
M. Jean-Paul Bacquet. L’argument de la traçabilité a également été avancé.
M. Claude Le Pen. En fait, on a multiplié les arguments, mais plus pour justifier la décision a posteriori que pour la peser a priori : conditionnement en dix doses, traçabilité, coût… La raison profonde est qu’on voulait une organisation strictement encadrée, reposant sur des gens qu’on contrôlait.
M. Didier Tabuteau. Je ne suis pas compétent pour juger des conditions de prescription du Tamiflu, mais cela ne me choque pas qu’on ait opté pour une prise en charge des premiers cas à l’hôpital, puis qu’on soit revenu sur ce choix : la gestion de l’épidémie doit être évolutive. En revanche, il me semble essentiel d’indiquer clairement au départ que les décisions sont prises pour un temps limité et qu’elles seront révisées à la lumière des nouvelles informations disponibles. À la différence de Claude Le Pen, je pense que le politique a la capacité de réviser ses décisions, d’autant que vingt ans de gestion des problèmes de sécurité sanitaire lui en ont appris la nécessité : toute décision est appelée à être revue, au bout de vingt-quatre heures ou d’un mois. Et si on lui explique clairement cela, la population est parfaitement en mesure d’admettre ces ajustements.
M. le président Jean-Christophe Lagarde. Merci à tous deux.
La séance est levée à seize heures trente-cinq.
Audition de M. Christian Lajoux,
président du LEEM (Les entreprises du médicament)
(Procès-verbal de la séance du mardi 13 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures quarante.
(M. Christian Lajoux prête serment.)
M. Christian Lajoux, président du LEEM (« Les entreprises de médicaments »). Je représente donc le LEEM, qui est un collectif d’entreprises.
Pour la première fois de l’histoire, après l’épidémie de grippe aviaire H5N1 de 2004, le monde s’est préparé à la possibilité d’une pandémie grippale et cette préparation s’est intensifiée dès la détection, en avril 2009, au Mexique, d’un virus humain H1N1 jusque là inconnu.
Sa gravité s’est révélée, en définitive, comparable à celle d’un virus grippal saisonnier affectant chaque année plusieurs millions de personnes et provoquant plusieurs milliers de décès en France, mais on ne pouvait alors le prévoir, compte tenu de ses mutations, de ses migrations et de ses combinaisons possibles avec un autre virus.
La vaccination reste en tout état de cause le meilleur outil de prévention contre le virus circulant et contre ses mutations. Sur les recommandations de l’OMS et des experts nationaux comme internationaux, les pouvoirs publics ont donc décidé d’organiser des programmes de vaccination à vaste échelle et les entreprises du médicament ont, collectivement, participé à cette lutte contre la pandémie : dès l’identification du virus en avril et la mise à disposition de sa souche, par l’OMS, en juin, elles ont tout mis en œuvre pour réaliser un vaccin dans un délai de cinq à six mois – délai dont nous avons toujours dit aux autorités qu’il était nécessaire.
Grâce à leur stratégie d’anticipation et d’optimisation de la prise en charge d’une menace sanitaire, nos entreprises s’étaient préparées bien en amont à mettre à la disposition des populations et des gouvernements, le moment venu, des moyens de diagnostic et de lutte contre les virus émergents – ce qui n’empêche qu’elles ont été surprises.
Notre action a d’abord porté sur la production même du vaccin : nous avons consenti des investissements importants en recherche-développement et développé nos outils de production, appelés parfois à fonctionner sept jours sur sept et vingt-quatre heures sur vingt-quatre pour répondre à la demande aux dates convenues avec les autorités de santé. Par ailleurs, nous avons également renforcé nos capacités d’approvisionnement, de distribution et de stockage des vaccins ainsi que des antiviraux, des antipyrétiques et des antibiotiques.
Parallèlement, a été mis en place un « plan de continuité » afin de poursuivre, en sus de la production des vaccins, la fourniture des médicaments destinés à d’autres pathologies, dans l’hypothèse où une partie de nos personnels serait en arrêt de travail du fait de la grippe. Nous avons ainsi effectué des achats massifs de moyens de protection individuelle, tels que masques, gants et désinfectants. Nous avons réfléchi à des formes alternatives de travail, telles que le télétravail, ainsi qu’à l’accompagnement social que requérait cette mobilisation de tous nos moyens humains. Des exercices ont été organisés pour tester ce plan de continuité avant son entrée en application.
Nous avions à assurer en même temps la production de vaccins, la production et le stockage des antiviraux et la continuité de fourniture des autres médicaments, ce qui n’était pas sans poser des problèmes complexes, en raison notamment de notre dépendance à l’égard d’approvisionnements internationaux.
Comment le LEEM s’était-il préparé, concrètement, à faire face à la pandémie proprement dite ? Depuis des années, les entreprises regroupées en son sein – Wyeth, GSK, Baxter, SANOFI Pasteur, SANOFI Aventis, MSD, Novartis… – ont constitué un « groupe vaccins », en charge de la recherche-développement et de l’économie du vaccin. Un groupe plus restreint, concerné plus directement par les vaccins antigrippaux, a collaboré étroitement avec le ministère de la santé, avec le délégué interministériel à la lutte contre la grippe aviaire et avec la cellule de crise de la direction générale de la santé. Des orientations régulièrement actualisées ont été adressées à nos adhérents et nous nous sommes tenus en relation avec les autres acteurs de la santé, notamment avec le secteur de la distribution et avec les pharmaciens. Un guide pratique a été publié en 2006 pour aider les entreprises à élaborer leur plan de continuité, et il a été complété le 8 septembre dernier par des indicateurs leur permettant d’adapter leur activité à l’évolution de la pandémie.
En 2008, nous avons prêté notre concours à l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) pour identifier les médicaments dont la fourniture devait impérativement être maintenue en période de pandémie.
Le LEEM a sensibilisé les entreprises à l’organisation d’exercices et a lui-même participé aux exercices nationaux « pandémie 08 » et « pandémie 09 », en janvier 2008 et janvier 2009.
En septembre 2009, à la demande des autorités de santé, nous avons procédé au recensement des stocks et des capacités de production de médicaments antipyrétiques et d’antibiotiques.
Le LEEM se coordonne régulièrement avec les acteurs de la chaîne du médicament : la chambre syndicale des grossistes répartiteurs et des dépositaires, l’Ordre national des pharmaciens, le syndicat des pharmaciens d’officine.
Ainsi, le rôle du LEEM a principalement consisté, d’abord, en une anticipation des mesures concrètes de lutte contre la pandémie et de leur impact sur les entreprises ; ensuite, en une sensibilisation à la façon d’appliquer ces mesures ; enfin, en des recommandations pour la période transitoire précédant le déclenchement des plans de continuité. Tout cela en intégrant les incidences sur les collaborateurs de nos entreprises, soit environ 100 000 personnes en France.
M. Jean Mallot. Vous nous avez dit que les entreprises du médicament s’étaient préparées à la pandémie et qu’elles avaient pourtant été surprises par celle-ci. Par quoi précisément ont-elles été surprises ? Et de quelle façon ?
Il vous arrive de présenter le LEEM comme un organisme de lobbying au service de l’industrie du médicament. Quelle forme cette action de lobbying a-t-elle prise dans le cas de la grippe A ?
M. Christian Lajoux. Le LEEM ne fait pas de lobbying. Il agit en faveur de l’intérêt général, en œuvrant à une coordination entre les entreprises adhérentes et au développement de leur responsabilité sociale. Dans cet esprit, il a conclu en 2009 un accord avec le ministère de l’environnement et du développement durable. Le lobbying participe certes de la démocratie, comme la concevait déjà Tocqueville, mais ce n’est pas une fonction du LEEM et nous n’utilisons pas le mot. Notre collectif se considère plutôt comme un acteur citoyen engagé, comme un acteur responsable de la société et c’est à ce titre que nous nous sommes employés à réagir au mieux, en liaison avec les autorités, à une crise sanitaire comme celle de l’an passé. En l’occurrence, il n’appartenait pas au LEEM de négocier des contrats : son rôle a été celui d’un facilitateur.
Quant à la surprise que nous avons éprouvée, elle a été le lot de tous. Après l’émotion provoquée par la grippe aviaire de 2005, les industriels du médicament se demandaient comment ils réagiraient à une nouvelle pandémie. La démarche du LEEM consistait donc à servir l’intérêt général en les aidant à se préparer à une nouvelle menace, toujours susceptible de se concrétiser un jour. Mais nous avons été surpris comme tous par la rapide montée en puissance des alertes décrétées par les organisations internationales.
M. Jean-Pierre Door, rapporteur. Vous êtes aussi le vice-président d’un grand laboratoire qui a fourni des vaccins. Comment les contrats d’acquisition de ceux-ci ont-ils été négociés ? Comment en est-on venu à imposer la clause de décharge de responsabilité signée avec l’Établissement de préparation et de réponses aux urgences sanitaires (ÉPRUS) alors que rien de tel ne s’est fait aux États-Unis ?
Comment s’est organisée la chaîne de distribution, et avez-vous rencontré des difficultés pour produire en même temps que le vaccin contre le virus H1N1 le vaccin contre la grippe saisonnière ?
Participez-vous aux négociations sur l’arrêt des stocks de vaccins et sur l’indemnisation des industriels ? Se déroulent-elles comme, par exemple, en Suède avec GlaxoSmithKline (GSK) ?
Les médias ont évoqué des conflits d’intérêts entre experts et industriels. Qu’en pensez-vous ? Comment renforcer, ainsi que vous avez dit le souhaiter, l’indépendance des experts ?
M. Christian Lajoux. Le LEEM n’est intervenu ni dans la négociation des contrats d’approvisionnement, ni dans les négociations sur leur arrêt. Et je n’y ai pas non plus participé personnellement comme responsable de SANOFI Aventis : ces discussions sont conduites par le directeur général de SANOFI Pasteur, que vous entendrez prochainement.
Je n’ai non plus joué aucun rôle dans l’adoption de la clause de décharge de responsabilité.
M. le président Jean-Christophe Lagarde. L’autorisation de mise sur le marché (AMM) n’aurait-elle pas dû en dispenser ?
M. le rapporteur. Cette clause était-elle utile ?
M. Christian Lajoux. Elle concernait les quatre laboratoires qui ont passé contrat avec l’État pour fournir les vaccins. Mais ces contrats ne pouvaient être discutés au sein du LEEM sans s’exposer à une action pour entente.
M. le président Jean-Christophe Lagarde. Il n’y a pas de problème d’entente s’agissant de la clause de décharge de responsabilité.
M. Christian Lajoux. Le LEEM n’avait pas à connaître de contrats concernant chacune de ces quatre sociétés individuellement. Cela étant, il me semble que la clause de décharge de responsabilité avait été spécifiée en amont, en 2005.
M. le rapporteur. Non : elle a été demandée par les laboratoires au moment où ils ont signé avec l’ÉPRUS.
M. Christian Lajoux. Cette question ne regardait pas le LEEM.
SANOFI Pasteur a dû développer et produire le vaccin contre le virus H1N1 tout en continuant de fabriquer des vaccins contre la grippe saisonnière pour l’hémisphère Sud, ce qui comportait un risque de désorganisation de la production. Mais l’entreprise a su s’adapter.
La loi de 2002 sur la transparence des activités des experts permet d’éviter les conflits d’intérêts. Les scientifiques sont en effet soumis à l’obligation de déclarer leurs liens avec des industriels – liens de travail inévitables dans un domaine où les experts sont peu nombreux et liens indispensables pour réaliser des progrès thérapeutiques. Ces déclarations sont adressées aux autorités de santé qui en assurent la publicité par l’intermédiaire de la Haute Autorité de santé (HAS) et de l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS). Les industries du médicament ne sont pas directement concernées car on ne les interroge pas. L’obligation de déclaration et de publicité ne pèse que sur les médecins et les agences d’évaluation.
Cela étant, compte tenu de l’émotion qu’a suscitée dans l’opinion cette question des conflits d’intérêts, le LEEM est ouvert à toute réflexion visant à améliorer encore la transparence, pour éviter que sa collaboration avec les industriels ne nuise à l’objectivité et à la loyauté des évaluations faites par les experts.
M. le président Jean-Christophe Lagarde. Avez-vous des propositions ?
M. Christian Lajoux. Les industries ne jouent aujourd’hui aucun rôle dans le processus d’information. Aucune obligation ne pèse sur elles, comme je l’ai dit. On pourrait envisager d’en instituer, dans les limites posées par la loi Informatique et libertés. Une telle réflexion a été menée aux États-Unis, débouchant sur le Physician Payment Sunshine Act de 2009.
M. Guy Lefrand. La question des liens d’intérêt entre experts et industriels pharmaceutiques a suscité de nombreuses discussions, jusque dans l’hémicycle de l’Assemblée nationale. Ces liens n’ont-ils pas été trop favorisés au niveau international ?
Quels furent vos interlocuteurs au niveau de l’État ? Et vos relations avec les experts ? Êtes-vous intervenu dans les décisions concernant la chaîne de fabrication et de commande des vaccins ?
En quoi la production des multidoses diffère-t-elle de celle des unidoses de vaccin ? Quels auraient été les coûts et les délais pour passer, ne serait-ce que partiellement, de l’une à l’autre ?
Quel bilan l’industrie du médicament tire-t-elle aujourd’hui de la pandémie, notamment sur les plans organisationnel et financier ? Quels sont les points à améliorer dans le dispositif ? A-t-il fallu construire de nouvelles usines, installer de nouvelles chaînes de production ?
M. Christian Lajoux. Je vais répondre en commençant par la dernière question.
Non, nous n’avons pas eu à nous doter de nouvelles unités car nous avons pu adapter les chaînes existantes à une production de vingt-quatre heures sur vingt-quatre et sept jours sur sept. Une nouvelle organisation du travail a permis d’exploiter au mieux les structures existantes. Et c’est tant mieux : il faut quatre à cinq ans pour construire un nouveau site de fabrication.
M. le rapporteur. Vous auriez pu anticiper après la pandémie du virus H5N1 ?
M. Christian Lajoux. Nous avons prouvé que nous pouvions répondre à la demande en adaptant nos méthodes de travail, quitte à exiger beaucoup de nos personnels.
Tirant le bilan de la pandémie, chacun doit bien constater, outre une surévaluation des risques, la méconnaissance totale, de mai jusqu’à octobre, d’un certain nombre de données scientifiques qui auraient dû être prises en compte dans le plan de lutte contre le risque sanitaire. Mais il est facile de réécrire l’histoire. Il faut se rappeler dans quel état d’esprit on s’est organisé pour mettre en œuvre le principe de précaution. On s’interrogeait sur la gravité de la pandémie, sur le dosage du vaccin, et, jusqu’en novembre sauf erreur, on ne savait pas s’il fallait une ou deux injections. Le souci de protection des citoyens a donc provoqué une mobilisation forte, mais non complaisante, des acteurs autour des autorités de santé.
Encore aujourd’hui, il faut rester prudent. Nous ne sommes pas à l’abri d’un retour du risque.
Il ne faudrait surtout pas que la vaccination sorte de cette affaire déconsidérée, alors qu’elle est déjà combattue depuis des années par des groupes de pression hostiles. Mais, sur d’autres sujets, d’autres groupes jouent sur l’émotion, peut-être parfois à des fins politiques. Il faut intégrer cela dans l’analyse de la situation.
En second lieu, on a beau se préparer et élaborer des plans d’action, les événements ne se déroulent jamais comme on l’a imaginé. Malgré tout, se cantonnant dans son rôle, l’industrie du médicament s’est plutôt révélée bonne citoyenne, fournissant aux dates prévues des vaccins efficaces et sûrs. Cela n’a pas empêché qu’à la recherche de boucs émissaires, on stigmatise les laboratoires, les accusant de forfaits qu’ils n’auraient même pas eu les moyens de commettre !
M. le président Jean-Christophe Lagarde. Comment pourrait-on améliorer encore les délais de production ? Devrait-on disposer, dans la perspective d’une pandémie toujours possible, de surcapacités de production dans de grandes firmes qui, je le rappelle, sont liées à l’État, ne serait-ce que parce que les prix des médicaments sont administrés ? Une partie du drame a, en effet, résulté de l’incapacité de fournir aux médecins et aux infirmiers libéraux des vaccins unidoses dans un bref délai.
On réputait au départ le nouveau virus pour très dangereux mais on a continué à fabriquer des vaccins contre la grippe saisonnière dans les conditions habituelles, sans donner la priorité au vaccin contre la grippe H1N1. Pourquoi ?
Les multidoses ont été fixées à dix unités. Pourquoi n’avoir pas prévu d’autres formats, par exemple de trois à cinq unités, ce qui les aurait rendu utilisables par les médecins ? Ce n’est qu’une question de taille de flacon, me semble-t-il.
M. Christian Lajoux. Les multidoses étaient conçues pour répondre à une pandémie grave exigeant une vaccination massive et très rapide.
M. le président Jean-Christophe Lagarde. Le choix des multidoses découlait donc du mode choisi pour l’organisation de la vaccination, et non l’inverse ?
M. Christian Lajoux. Nous nous attendions à une pandémie énorme. Nous nous mettions donc en situation, après les cinq à six mois requis pour la mise au point et la production du vaccin, de vacciner le plus grand nombre possible de personnes en quelques semaines. Le choix de la formule multidoses répondait à une démarche de vaccination massive, rapide et organisée collectivement.
M. Guy Lefrand. Qui a fait ce choix ?
M. Yves Bur. Était-ce une décision nationale ?
M. Christian Lajoux. Je ne sais pas répondre. Les industriels se sont conformés à une orientation générale, avant qu’une firme ne décide de produire des unidoses.
M. Jean Mallot. Les délais de fabrication sont-ils différents pour les unidoses et pour les multidoses ?
M. le président Jean-Christophe Lagarde. N’est-ce pas qu’une question de taille de flacon, entre cinq et dix doses ? Je ne vois pas pourquoi on nous a parlé d’une différence de plusieurs mois...
M. Christian Lajoux. C’est aussi une question de réglage des chaînes de production. Si l’on commence à produire des multidoses, on ne passe pas facilement à la production d’unidoses. Cela requiert des modifications autrement plus importantes que pour descendre de dix à cinq doses, par exemple. En outre, d’un point de vue réglementaire, nous étions obligés de nous en tenir au format défini dans le dossier de demande d’AMM. Pour effectuer une modification en cours de route, il aurait fallu solliciter une nouvelle autorisation et donc allonger encore les délais.
Le délai de production résulte du mode de production : les antigènes sont cultivés sur des œufs, ce qui exige un temps incompressible – nous ne sommes pas ici dans le domaine de la haute technologie ! Mais l’industrie du médicament étudie d’autres process, de culture cellulaire, qui seraient sensiblement plus rapides.
M. Yves Bur. L’image de l’industrie du médicament a-t-elle souffert des campagnes d’opinion dénonçant son manque de transparence ? Comment comptez-vous réagir ?
Les obligations de déclaration concernant le financement des associations de patients par l’industrie pharmaceutique, instituées par la loi de 2002, ne sont toujours pas appliquées. Néanmoins, ne faudrait-il pas étendre ce système à l’ensemble du secteur de la santé ? L’industrie y est-elle prête ?
Quand on a commencé à lutter contre la pandémie, quel délai séparait la commande de la livraison des vaccins ? Aurait-on pu livrer la totalité des commandes avant la fin du cycle grippal ?
M. Christian Lajoux. Des livraisons étaient déjà possibles au début de novembre 2009. L’ensemble des doses pour 47 millions de patients aurait été disponible en janvier-février 2010.
M. le président Jean-Christophe Lagarde. Soit des livraisons de multidoses étalées sur trois mois, et des unidoses pendant le temps restant ?
M. Christian Lajoux. Quand un train de production est lancé, on ne l’arrête pas pour adapter l’appareil industriel à un autre type de fabrication – par exemple pour passer des multidoses aux unidoses.
M. le président Jean-Christophe Lagarde. En janvier 2010, on disposait de cinq millions d’unidoses, ce qui permit à la ministre d’envisager une vaccination par les médecins généralistes. Je suppose qu’alors, on ne produisait plus de multidoses…
M. Christian Lajoux. Les délais de fabrication sont le fruit d’un type de production très lourd, imposant des contraintes comparables à celle de la conduite d’un énorme paquebot.
Au 16 mars 2010, les stocks de vaccins, selon les statistiques, publiques, de l’ÉPRUS, se montaient à 25, 8 millions de doses – à la fois en multidoses et en monodoses.
M. Yves Bur. Pour 5 à 6 millions de personnes déjà vaccinées… Cela ne fait que 31 millions. Aurait-on pu atteindre l’objectif de 47 millions de personnes vaccinées ?
M. Christian Lajoux. Les laboratoires ont arrêté la production. Mais le calendrier que j’ai indiqué pouvait être respecté.
M. le président Jean-Christophe Lagarde. A priori, la production n’a pu être arrêtée que le 4 janvier, quand la ministre a arrêté les commandes.
M. Christian Lajoux. Il restait encore deux mois avant le terme que j’ai indiqué – fin février.
L’effort pour une plus grande transparence est déjà engagé. La loi de 1994 portant diverses mesures d’ordre social (DMOS) oblige déjà les industriels à faire part au Conseil de l’ordre de leurs relations avec les médecins. Le LEEM est prêt à travailler à une amélioration du dispositif, à l’instar de ce qui se pratique depuis longtemps aux États-Unis.
L’image de l’industrie du médicament a été incontestablement dégradée par les campagnes d’opinion : on a prétendu que nous avions inventé le virus, fait pression sur l’OMS et imposé un prix élevé des vaccins, alors qu’il s’établissait entre 6 et 7 euros. Mais je suis surtout préoccupé, dans un souci de l’intérêt général, par le risque de dégradation de l’image de la vaccination. C’est pourquoi je me réjouis de cette commission d’enquête et de celle du Sénat : elles nous permettront de passer d’une réaction purement émotive à une attitude rationnelle et à une analyse objective des événements.
M. le président Jean-Christophe Lagarde. Est-il légitime que le LEEM soit membre de la commission d’autorisation de mise sur le marché de l’AFSSAPS ?
M. Christian Lajoux. Il n’y siège qu’en qualité d’observateur, sans droit de vote.
M. le président Jean-Christophe Lagarde. Nous vous remercions.
La séance est levée à dix-sept heures quarante-cinq.
Audition de M. Michel Setbon,
sociologue au Centre national de la recherche scientifique
et à l’École des hautes études en santé publique
(Procès-verbal de la séance du mardi 13 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures quarante-cinq.
(M. Michel Setbon prête serment.)
M. Michel Setbon, sociologue au Centre national de la recherche scientifique et à l’École des hautes études en santé publique. Mon parcours de chercheur, orienté vers la sociologie de la santé publique et des crises sanitaires, privilégie une approche interdisciplinaire. Il a été scandé par plusieurs crises sanitaires, dont trois essentielles : l’émergence du VIH et les contaminations post-transfusionnelles qui ont suivi ; la crise de la « vache folle » ; les maladies infectieuses émergentes présentant des risques épidémiques, dont la grippe A est le dernier avatar après le chikungunya, la dengue, etc.
De cette longue expérience en matière de recherche, j’ai retenu que l’on ne peut traiter correctement un problème émergent de santé publique sans un effort massif et soutenu pour améliorer nos connaissances sur trois sujets : sur l’agent infectieux lui-même ; sur la façon dont il se propage – données épidémiologiques recueillies au fur et à mesure, cibles atteintes, facteurs de risque que l’on découvre petit à petit, intensité de la propagation... – ; enfin, sur la perception, les comportements et les réactions du public exposé.
De ces éléments susceptibles d’éclairer et d’orienter la réponse publique, le troisième a toujours été négligé, voire ignoré. C’est pour moi la cause principale de nos échecs et des désastres qui en ont résulté : désastre sanitaire pour ce qui est de la contamination post-transfusionnelle par le VIH ; désastre socio-économique pour ce qui est de la vache folle ; désastre stratégique et économique dans le cas de la grippe A.
Le modèle suivi invariablement dans toutes ces crises est de type « top-down » : quelques experts énoncent certaines connaissances ou certaines prédictions à un moment donné ; les politiques et les administratifs déterminent « la » bonne solution pour y faire face ; et le public n’a qu’à s’y conformer !
Le problème est que ce modèle ne marche pas, comme on l’a vu dans les trois grandes crises que j’ai évoquées.
En 1983, on avait demandé aux centres de transfusion sanguine d’écarter les donneurs présentant un facteur de risque et susceptibles de transmettre le nouvel agent, et à ces personnes de ne pas se rendre dans les centres. Cela n’a pas été suivi d’effet.
En 1998-1999, en dépit de nombreuses et coûteuses décisions en matière de sécurisation de la viande bovine, des farines animales, etc., le public s’est détourné massivement de la consommation de viande bovine et le coût de l’opération a été prohibitif.
En 2009, on a demandé aux Français de se faire vacciner. Or seuls 10 % l’ont fait à ce jour.
Ces crises sont certes différentes, mais toutes montrent que les individus, exposés à un risque en même temps qu’à une consigne visant à les protéger et à protéger autrui, ne sont pas des sujets passifs mais bien les décideurs finaux, ceux qui ont la latitude de mettre ou non en œuvre les décisions énoncées. Ces décisions sont souvent fondées, bonnes, mais on ne se préoccupe pas de savoir comment le public les comprendra, les interprétera et les appliquera. Or c’est lui qui détient la clé.
C’est un point crucial pour toutes les actions de santé publique dans les pays démocratiques développés : si les comportements des citoyens-acteurs décident de la réussite ou de l’échec d’un programme, il est impératif d’en découvrir les mécanismes et les déterminants. Or, en France, on ne s’y intéresse pas. On ne voit pas ces données-là alors qu’il existe quantité de travaux scientifiques publiés sur lesquels s’appuyer pour mener des recherches fécondes et produire des connaissances utilisables.
Dans le cas de la grippe A, nous disposions d’un avantage inédit par rapport aux crises précédentes, celui d’avoir anticipé l’arrivée d’une pandémie. C’était une première en matière de santé publique. Cela dit, anticiper ne signifie en rien prédire ce qui se passera. La nature, l’intensité et les caractéristiques de la pandémie à venir dépendent de nombreux paramètres qui sont totalement ignorés au moment de l’anticipation : gravité, prévalence, facteurs de risque, cibles les plus vulnérables, etc. On ignore également quels seront les comportements adoptés par la population. Il faut donc passer par des recherches.
Les facteurs qui déterminent le choix de se faire ou non vacciner sont bien connus. Ils sont en lien direct avec les perceptions que les individus ont du risque auquel ils sont exposés. De nombreux travaux empiriques puis théoriques ont montré pourquoi une personne décide volontairement de se faire vacciner, par type de population par exemple, en fonction de l’agent contre lequel il s’agit de s’immuniser. On sait également comment la profession médicale perçoit la vaccination et se comporte, etc.
Les individus se posent les mêmes questions que les scientifiques mais ils y apportent des réponses différentes.
En premier lieu, croient-ils ou non à l’imminence annoncée d’une pandémie ? L’exemple de la grippe aviaire H5N1 a montré que les Français pouvaient douter de la réalité d’un tel phénomène.
Ensuite, s’ils pensent que la pandémie va arriver, la perçoivent-ils comme grave ? Se perçoivent-ils eux-mêmes comme susceptibles de contracter la maladie ? Sur quelle expérience fondent-ils ce jugement ? Quel rapport bénéfice/risque chacun établit-il à la mesure de ses compétences, de son expérience et de ses connaissances ? Faut-il faire confiance aux autorités sanitaires et au discours qu’elles tiennent ? Quelle est l’influence du médecin ?... Toutes ces questions sont fondamentales pour comprendre et prédire comment les gens se comporteront en fonction de la nature de l’épidémie.
Après certaines difficultés, nous avons pu réaliser une première enquête financée par le service d’information du Gouvernement, le SIG, en juin 2009, soit un mois et demi après l’annonce de la pandémie. Nous avons posé quelques questions sur la vaccination puisque nous savions que, dès qu’un vaccin serait disponible, il serait proposé à la population mais selon des modalités encore inconnues. Il est apparu que 61 % de notre échantillon représentatif se déclaraient favorables à leur propre vaccination – mais l’on sait que, de l’intention à l’action, il y a une déperdition importante. Cependant, deux facteurs principaux soutiennent l’intention de vaccination : être soi-même inquiet face au risque de contracter le virus de la grippe A ; avoir eu une expérience antérieure de vaccination contre la grippe saisonnière.
Ces données nous permettaient de conclure de façon pessimiste quant à la proportion de Français qui se feraient vacciner. En effet, le niveau d’inquiétude de l’ensemble de l’échantillon s’est révélé extrêmement bas et le deuxième facteur favorisant l’intention de vaccination, à savoir le fait de s’être fait vacciner contre la grippe saisonnière, était l’apanage des personnes de plus de 60 ans – de fait, alors qu’en France, 26 % de la population se fait vacciner contre la grippe saisonnière, ce taux s’élève à 70 % pour la tranche d’âge au-dessus de 60 ans, mais tombe à 8 % au-dessous de 34 ans. Or on n’avait pas l’intention de vacciner en priorité les personnes âgées, mais au contraire les enfants et les personnes entre 20 et 40 ans. Tout laissait donc à penser que cette cible serait difficilement atteignable.
Les mois suivants ont confirmé cette perception de la grippe A – le niveau d’inquiétude est resté bas – ainsi que nos prévisions concernant la vaccination.
Nous avons réalisé la deuxième enquête entre le 10 et le 20 décembre 2009, c’est-à-dire au plus fort de l’épidémie. Cette période correspond à la fois au pic d’intensité de la propagation de la contamination et au pic d’intensité de la vaccination. Le vaccin était alors proposé depuis près de deux mois. Alors que nous étions alors en situation réelle et non plus dans une perspective d’intention pure, la perception de la grippe et l’intention de se faire vacciner n’ont pas connu de changement notable
Nous avons toutefois observé que d’autres facteurs liés au débat public qui s’est tenu autour de la vaccination ont fait basculer dans le refus ceux dont l’intention était indécise. Les trois variables que nous avons identifiées étaient : l’opinion des proches et des amis ; l’opinion du médecin généraliste ; la croyance de la personne dans les vertus de la vaccination en général. Au moment de cette enquête, 7,5 % de notre échantillon étaient vaccinés, soit exactement la même proportion que dans l’ensemble de la population, 20 % disaient en avoir l’intention et 70 % affirmaient qu’ils ne le feraient pas même si la vaccination leur était proposée par leur médecin généraliste.
En conclusion, l’échec de la campagne de vaccination pouvait être prévu. On ne s’est pas donné les moyens de l’anticiper et d’en tirer les conséquences opérationnelles. Enfin, si la réponse vaccinale était au départ tout à fait justifiée, les incertitudes pesant sur les paramètres de l’épidémie et sur leur impact sur les comportements en matière de vaccination auraient dû conduire à adapter le programme. Or on a fait le choix inverse, celui de l’irréversibilité. Déterminer une stratégie avant l’émergence de l’épidémie, c’est bien ; la maintenir alors que les faits poussent à sa révision, c’est courir à l’échec – un échec qui, à mes yeux, n’est pas seulement celui de la campagne de vaccination mais qui atteint la crédibilité à venir de l’action en matière de santé publique.
M. Yves Bur. Toutes les études vont-elles dans le sens de celles que vous avez menées ?
M. Michel Setbon. Il n’y en a pas eu beaucoup. Quelques sondages d’opinion tout au plus.
M. le président Jean-Christophe Lagarde. A-t-on réalisé des études à l’étranger, aux États-Unis par exemple, où un grave problème de vaccination s’est posé dans les années 1970 ?
M. Michel Setbon. Il existe beaucoup d’études là. En novembre 2009, un article publié dans une grande revue américaine, Vaccine, montre exactement la même corrélation entre l’intention vaccinale et le fait de s’être déjà fait vacciner.
M. Jean-Pierre Door, rapporteur. L’« irréversibilité » dont vous parlez est-elle celle du plan retenu, l’attitude consistant à rester « droit dans ses bottes » ?
M. Michel Setbon. Oui : une fois que l’on s’est dit que l’on allait vacciner tout le monde, on a persisté alors que les faits démontraient que ce n’était ni nécessaire ni faisable. En d’autres termes, on n’a pas changé d’avis devant les faits. Ce qui, d’un point de vue scientifique, est renversant !
J’en reviens aux deux enquêtes quantitatives de juin et de décembre 2009. Celles-ci ont été réalisées par questionnaire auprès d’un échantillon représentatif de 1 001 personnes. Elles utilisent des échelles et des outils normalisés et portent sur les attitudes et les représentations du risque et de la maladie. Les catégories de variables explorées sont : la connaissance de la maladie ; les changements de comportement déclarés ; les changements de comportement anticipés ; la perception de l’efficacité des mesures de protection ; l’intention – ou l’action – vaccinale ; la perception de la maladie ; la perception du risque infectieux ; le soutien social ; l’expérience de la grippe saisonnière ; les attitudes et les valeurs sociopolitiques.
Les deux paramètres clés pour connaître l’intention vaccinale d’un individu sont sa perception de la gravité de la maladie et sa perception de la probabilité de contracter la maladie. Les études font apparaître que la majorité de la population a perçu la grippe A au même niveau que la grippe saisonnière. Si l’on considère que celle-ci n’est pas grave et qu’on ne l’attrape pas souvent, on pense de même, par analogie, de la grippe A. Le poids de l’expérience est donc important.
La gravité perçue, de 5 sur une échelle de 10, peut être qualifiée de faible. Il en va de même de l’inquiétude ressentie, un peu supérieure à 4 en moyenne.
Par ailleurs, sur une échelle de perception du risque où l’on a demandé de noter de 0 à 10 différents risques, la grippe A figurait en juin 2009 en dernière place, au même niveau que la grippe saisonnière et bien au dessous du tabagisme et des OGM. En décembre, on a constaté très peu de variation. Le risque perçu concernant la grippe A restait au bas de l’échelle, à peine plus haut que celui de la grippe saisonnière.
M. Yves Bur. Combien de morts faut-il pour que cette perception se modifie ?
M. Michel Setbon. Ce n’est pas qu’une question de morts. Le nouveau variant de la maladie de Creutzfeldt-Jacob a provoqué 50 morts mais le niveau d’inquiétude du public était, au moment de la crise de la vache folle, largement supérieur. On ne peut dire que la perception du risque soit fonction du nombre des décès ou de la prévalence de la pathologie. Les variables sont de nature qualitative. Le problème de la grippe A est qu’elle a été très vite perçue comme n’étant pas nouvelle, mais comme une simple grippe. Dès lors le facteur majeur de perception haute du risque disparaît.
M. le président Jean-Christophe Lagarde. Dispose-t-on d’études comparables pour la grippe aviaire ?
M. Michel Setbon. Nous les avons faites.
M. le président Jean-Christophe Lagarde. Avait-on alors le sentiment d’un risque plus important ? La grippe aviaire ou la « grippe porcine » sont transmises par les animaux, ce qui peut susciter des réactions relevant de l’ordre du fantasme. L’appellation « grippe A » ne renvoie qu’à une grippe habituelle...
M. Michel Setbon. Dans le cas de la grippe aviaire, la mortalité observée était extrêmement importante, de l’ordre de 50 % des personnes ayant contracté le virus.
D’un autre côté, je pense que le non-événement qu’a constitué la grippe aviaire en France a été un facteur aggravant pour ce qui est de la capacité de produire des messages audibles.
M. le rapporteur. « On nous refait le coup ! »
M. le président Jean-Christophe Lagarde. De manière plus générale, ne pensez-vous pas que les autorités sanitaires, à force de crier au loup et d’annoncer des catastrophes qui vont balayer le monde, finissent par désensibiliser le public, le « vacciner » contre tout cela, si j’ose dire ?
M. le rapporteur. Une fois que des idées, erronées ou non, circulent sur internet ou sur d’autres supports, il est difficile de les corriger : elles sont passées dans l’opinion publique et dans les réseaux sociaux. Cela semble avoir été le cas de cette impression de méfiance, voire de déni, qui a circulé.
M. Michel Setbon. Il est encore plus difficile de corriger ces idées lorsqu’on les connaît mal. Je ne dis pas qu’il est facile d’agir sur les perceptions, croyances ou rumeurs, mais la première condition pour cela serait de les connaître, de les mesurer.
M. Yves Bur. La cellule de crise et les autorités sanitaires vous ont-elles contacté pour que vous leur parliez de ces questions ?
M. Michel Setbon. C’est une de mes grandes déceptions. Le SIG, en lien avec la direction générale de la santé, a financé la plupart de ces travaux. J’ai transmis les résultats au directeur général de la santé, au cabinet, etc., en juillet...
M. le rapporteur. … et ils sont restés autistes !
Mme Jacqueline Fraysse. Certes, les personnes véhiculent différentes choses dans leur inconscient. Je crois néanmoins que le décalage net entre ce que les citoyens vivaient et observaient autour d’eux et le discours alarmiste qu’on leur tenait a conforté l’idée d’un mensonge. Pourquoi ce décalage entre l’expérience vécue et le discours tenu ?
M. le président Jean-Christophe Lagarde. Le fait que la population ait entendu parler du sujet en plein été, à une période où les journaux n’ont rien à se mettre sous la dent et où il est inhabituel de contracter la grippe, n’a-t-il pas eu un rôle ? Le temps de latence entre l’annonce d’un danger et le moment où ce danger survient amplifie-t-il l’impression, pour les individus, qu’il ne se passe rien en réalité ?
M. Michel Setbon. C’est toute la difficulté de rendre crédible une anticipation sans être en mesure de prédire ce qui va se passer. Anticiper n’est pas prédire : c’est se préparer à un événement qui va arriver. Le problème est le même avec le changement climatique.
M. le président Jean-Christophe Lagarde. C’est bien le sentiment de Claude Allègre !
M. Yves Bur. Il nous reste beaucoup de choses à connaître dans ce domaine. Ce qui est déroutant, c’est qu’on ne vous ait pas consulté pour comprendre ce qui se passait après les études que vous aviez remises.
M. Michel Setbon. En décembre, les pouvoirs publics avaient compris que ce qui se passait était différent de ce qu’ils attendaient.
M. Yves Bur. Ils attendaient notamment un taux d’acceptation du vaccin de l’ordre de 75 %...
M. Michel Setbon. C’est impossible ! Je l’ai dit !
M. Yves Bur. On s’est fondé sur des campagnes menées sur de petits territoires après l’apparition d’un cas de méningite fulgurante, en supposant que le schéma serait le même. Vous considérez que le raisonnement est faux ?
M. Michel Setbon. Faux, c’est-à-dire non fondé par les connaissances scientifiques sur le sujet. Aucun membre du comité d’experts ne représentait ce domaine de la connaissance. En outre, sur quels arguments le comité a-t-il arrêté sa position ? Personne n’a étayé l’argument selon lequel il fallait vacciner 85 % de la population.
M. le président Jean-Christophe Lagarde. Il faut bien distinguer deux choses.
Vouloir vacciner 85 % de la population est une décision politique et médicale visant à arrêter une pandémie.
En revanche, différentes modélisations permettaient de prévoir dès juin que la plupart des gens n’iraient pas se faire vacciner. Or on prévoyait d’en vacciner 75 %. C’était donc l’échec assuré ?
M. Michel Setbon. Là où réside, à mes yeux, la grande difficulté : c’est de savoir que faire lorsque l’on sait que l’on n’arrivera pas à convaincre 80 % de la population de se faire vacciner et que l’on veut programmer des moyens pour vacciner tout le monde. Même si, au bout du compte, 20 % seulement de la population se fait vacciner, rendre le vaccin accessible à tout le monde est une exigence politique et éthique. Ce n’est pas la même chose.
M. le président Jean-Christophe Lagarde. Lorsqu’Yves Bur évoquait une acceptation de 75 %, votre réaction a été que c’était impossible. Vous semblez donc avoir une certitude scientifique. Pourquoi le taux de 75 % vous fait-il réagir à ce point ?
M. Michel Setbon. On ne peut exclure que l’épidémie atteigne une gravité et une intensité telles qu’elles en viendraient à convaincre la majorité de la population. C’est pourquoi je défends les idées de flexibilité et d’adaptabilité : il est possible de programmer un accès généralisé au vaccin et ajuster au fur et à mesure le dispositif à la réalité des données de l’épidémie et des comportements humains – sachant que, pour une épidémie moyenne, l’on ne dépasse pas 30 % de personnes vaccinées.
M. le président Jean-Christophe Lagarde. Peut-on prévoir le pourcentage de personnes qui se feront vacciner en fonction de la perception de la gravité et de la vulnérabilité ?
M. Michel Setbon. À partir du moment où l’on a identifié ces deux facteurs clés, on peut commencer à préciser la prédiction. Globalement, les 60 % d’intentions de vaccination ont été divisés par deux, 10 % de la population ayant été réellement vaccinés. C’est avec ces données qu’il faut travailler.
M. le président Jean-Christophe Lagarde. Vous indiquez que ce travail a été réalisé à l’étranger et que les résultats sont à peu près les mêmes…
M. Yves Bur. A-t-on adapté les stratégies vaccinales à ces connaissances et à ces modèles ?
M. Michel Setbon. En l’occurrence, je ne dispose pas de données suffisantes.
M. le rapporteur. À la fin de juillet et au début d’août 2009, plusieurs décès de personnes jeunes ont fait la une des journaux. Pour vous, ces messages sont-ils restés lettre morte, de même que l’annonce de 300 morts aux États-Unis ?
Par ailleurs, après qu’il eut été annoncé en Norvège, à la fin de novembre, l’éventualité d’une mutation virale, j’ai constaté un pic de demandes dans le centre de vaccination de ma commune. Au Canada, c’est l’annonce par le Gouvernement d’un risque de pénurie de vaccins qui a poussé la population à se précipiter.
M. Yves Bur. Sans doute les autorités canadiennes voulaient-elles se débarrasser de leurs vaccins !
M. le rapporteur. En France, il semble que l’information n’ait pas été reçue par la population.
M. Michel Setbon. Il ne suffit pas de se fier à des impressions. L’impact de ces nouvelles sur la perception de la population peut se mesurer et se vérifier. Le 15 décembre, au moment du pic de l’épidémie et au moment où les médias montraient des centres de vaccination très encombrés, la perception du risque restait à 4,1 sur une échelle de 10.
M. le président Jean-Christophe Lagarde. Ce qui semble signifier que, si l’on avait été à 7, les centres de vaccination auraient été complètement submergés.
M. Michel Setbon. Il ne faut jamais accuser le thermomètre...
M. le président Jean-Christophe Lagarde. Il me semble que le SIG vous a posé des questions parce qu’il cherchait comment communiquer. Mais personne ne se demande comment décider et adapter l’action par rapport à la communication du SIG. On voit bien que l’on a là affaire à une science humaine étrangère à la « culture maison ».
M. Jean Mallot. Notre commission essaie d’étayer ses analyses sur des données scientifiques. Le Gouvernement, pour sa part, ne s’est jamais situé dans le registre de l’information scientifique des populations : il s’est situé dans celui de la communication d’une part, dans celui de l’ordre d’autre part.
Vous avez affirmé que les pouvoirs publics, en décembre, avaient compris qu’ils avaient perdu. De mon point de vue, le Gouvernement pensait au contraire qu’il avait gagné et que la situation allait se calmer.
M. le président Jean-Christophe Lagarde. Il avait tout de même bien compris qu’il y avait un problème et que, si la pandémie n’avait pas eu lieu, il avait raté la campagne de vaccination.
M. Jean Mallot. C’est égal : il avait gagné la bataille de la communication. Sa hantise, c’était que se reproduise le schéma de la canicule de 2003. Je suis persuadé que le Premier ministre, Brice Hortefeux et Roselyne Bachelot-Narquin considèrent qu’ils ont gagné.
M. le président Jean-Christophe Lagarde. Des médecins ont souligné devant notre commission le rôle des « gestes barrières ». Des études comme les vôtres pourraient-elles fournir des informations fiables en la matière ? Alors que les Français ne sont pas réputés avoir une excellente hygiène, l’insistance sur le lavage des mains, par exemple,
a-t-elle produit des effets mesurables ? Peut-on corréler des changements de comportement à la perception du danger ? Ou au contraire les décorréler – « ce n’est pas assez grave pour se vacciner mais suffisamment pour se laver les mains... » – ?
M. Michel Setbon. Les enquêtes ont évalué la croyance dans l’efficacité des différentes mesures préconisées et l’adoption effective de ces mesures. La seule qui ait été plébiscitée est le lavage des mains – c’est-à-dire la plus aisée, la moins coûteuse et celle qui répond à un risque considéré comme banal.
Mme Jacqueline Fraysse. En d’autres termes, c’est une mesure frappée au coin du bon sens.
M. le président Jean-Christophe Lagarde. Donc certains messages ont été entendus.
M. Michel Setbon. Oui. Dès lors qu’on arrive à le mesurer et que l’on établit que le vaccin arrive en dernière ligne, que cela va coûter une fortune et que les gens n’y auront pas recours, il faut modifier sa ligne de conduite !
M. le rapporteur. Alors qu’il y a eu irréversibilité ?
M. Michel Setbon. Une irréversibilité qui était dans les têtes – peut-être aussi provoquée par certaines signatures.
Une autre dimension de l’épidémie, esquissée dans les travaux de Xavier de Lamballerie et Antoine Flahault, est que, parmi les personnes qui étaient porteuses des anticorps du virus, trois sur quatre n’ont pas présenté de symptômes. On peut parler de chance. Si l’on avait eu une autre proportion de cas symptomatiques, la visibilité de l’épidémie aurait été totalement différente.
M. le président Jean-Christophe Lagarde. Lors du pic pandémique, j’étais à La Réunion où les personnes estimaient que la grippe A n’était rien du tout par rapport au chikungunya. Celles qui l’avaient contractée affirmaient que cela s’était traduit simplement par un petit accès de faiblesse pendant 24 heures. Même pour les cas symptomatiques, c’était moins grave qu’un rhume !
M. Jean Mallot. Une « grippette », disait Bernard Debré.
M. Michel Setbon. Ce sont des paramètres qu’il faut prendre en considération lorsque l’on passe de la prédiction à l’observation. À quoi cela peut-il servir de se trouver en situation réelle si l’on ne tient pas compte des faits ?
M. le rapporteur. Après l’étude de séroprévalence que M. Antoine Flahault a menée chez les femmes enceintes à Marseille, estimez-vous indispensables, à l’avenir, les études portant sur des cohortes – femmes enceintes, jeunes, personnes à risque, personnes obèses... – ?
M. Michel Setbon. Une étude baptisée « CoPanFlu », à laquelle je suis associé au titre des sciences humaines, devrait être lancée, mais elle ne démarre que très péniblement, et trop tard.
M. le rapporteur. Pensons à demain.
M. Michel Setbon. Comme on l’a vu pour le chikungunya, le problème est d’être en mesure de réaliser des recherches en temps réel. Or notre dispositif de recherche n’est pas adapté à cette démarche. J’ai eu toutes les peines du monde pour rassembler des financements et j’ai dû travailler avec des bouts de ficelle !
M. le rapporteur. On a pourtant l’impression que ces études démarrent.
M. le président Jean-Christophe Lagarde. Il y a une différence entre la science médicale et les sciences humaines. Pour les secondes, une enquête menée six mois après ne sert plus à grand-chose.
M. Michel Setbon. C’est ce qui s’est passé pour le chikungunya : je n’ai pu mener mes enquêtes qu’à la fin de l’épidémie.
M. le président Jean-Christophe Lagarde. Je vous remercie pour votre contribution, qui nous sera très utile. La commission vous serait reconnaissante de lui faire parvenir les données qui vous paraîtraient significatives, ainsi qu’une bibliographie.
M. Michel Setbon. Je vous transmettrai également un article consacré à l’enquête du mois de juin, qui sera publié prochainement dans une grande revue internationale.
La séance est levée à dix-huit heures trente-cinq.
Audition de M. Antoine Flahault,
directeur de l’École des hautes études en santé publique
(Procès-verbal de la séance du mardi 27 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt.
(M. Antoine Flahault prête serment.)
M. Antoine Flahault, directeur de l’École des hautes études en santé publique. Je souhaite au préalable signaler que je n’ai aucun conflit d’intérêt direct, mais un conflit indirect : un membre de ma famille est salarié du LEEM – Les Entreprises du médicament –, qui représente les entreprises du secteur de l’industrie pharmaceutique en France.
L’alerte concernant la pandémie grippale a été donnée en avril 2009 depuis le Mexique. Les États-Unis et le Canada ayant très rapidement pu identifier et isoler le virus, la première question qui s’est posée a été celle de sa contagiosité. Avait-on affaire à un virus de la grippe se comportant de façon inhabituelle ? Alors que pour le SRAS, en 2003, les premiers articles scientifiques étaient parus après la fin de l’épidémie, dans le cas de la pandémie de grippe A(H1N1), les premières séries d’articles ont été publiées depuis le Mexique dans le mois qui a suivi l’alerte donnée par l’Organisation mondiale de la santé. Ils nous ont rapidement permis de calculer ce que l’on appelle le taux de reproduction de base, mesure épidémiologique du nombre de cas secondaires générés par un cas index. L’ajustement de la courbe exponentielle sur la première série venant du Mexique a montré que ce taux de reproduction était de 1,4, avec un temps de génération de trois jours entre deux cas. C’était le signe d’un virus de la grippe au comportement normal. Ainsi, dès le début du mois de mai, on était capable d’affirmer que cette maladie avait un potentiel pandémique et que son comportement était classique.
En effet, le taux de reproduction signe la souche virale. Par exemple, la rougeole a un taux de reproduction de 20, le plus élevé. Si un enfant atteint de cette maladie est mis en contact avec une classe de maternelle ou une crèche dans laquelle aucun enfant n’est vacciné – ce qui ne serait plus possible aujourd’hui –, il pourra provoquer à lui seul vingt cas secondaires. Pour la grippe, ce taux de reproduction était donc de 1,4. Cela peut sembler faible, mais c’est suffisant pour que le virus fasse assez rapidement le tour de la planète.
M. le président Jean-Christophe Lagarde. De quand date cette information ?
M. Antoine Flahault. Du tout début du mois de mai 2009. Dès le 18 mai, nous avons pu envoyer les résultats de nos premiers travaux, réalisés avec une équipe comprenant des chercheurs de l’INSERM et de l’INRA. L’étude, parue le 12 août 2009 dans une revue en libre accès publiée en ligne, BMC infectious diseases, élaborait différents scénarios pour les dix-huit mois à venir.
Je rappelle que la modélisation mathématique n’est pas en soi prédictive : elle sert seulement de « planche à dessin » pour les politiques de santé publique, notamment lorsqu’il s’agit d’envisager des interventions telles que la vaccination d’une part donnée de la population. Toutefois, le scénario que nous avions jugé le plus probable s’est finalement à peu près réalisé. Écartant l’hypothèse d’une très forte couverture vaccinale à partir de septembre – il était en effet assez facile de prévoir qu’aucun vaccin ne serait disponible à cette date –, nous avions suggéré qu’une demi-vague épidémique se produirait dans l’hémisphère Sud à partir de la fin du mois de juillet et s’arrêterait assez brutalement au tout début du mois d’octobre. C’est ce qui s’est produit, à ceci près que l’on ne sait pas encore s’il s’agissait vraiment d’une demi-vague. Si c’est le cas, nous pensons que l’autre moitié surviendra entre mai et septembre 2010.
L’article paru dans BMC prévoyait également qu’une vague unique se produirait dans l’hémisphère Nord, démarrant à partir de septembre-octobre 2009 et se terminant au début de l’année 2010, sans résurgence au printemps et en été. Nous n’avions pas poussé plus loin nos simulations, en ébauchant par exemple un scénario pour l’hiver prochain.
Répondant à la presse, notamment dans des articles du Monde et de Libération, nous avions évoqué au tout début du mois de mai 2009 trois modèles possibles pour l’épidémie. Le premier était celui d’une pandémie de type SRAS, qui disparaîtrait spontanément sans réapparaître au cours de l’hiver 2009-2010. Nous n’y croyions pas vraiment, car le SRAS est une maladie très bruyante. Cette pneumopathie atypique conduit très souvent à l’hospitalisation, parfois en réanimation, et aucun cas asymptomatique n’a été identifié à ce jour. Il fut donc relativement facile à l’époque de stopper les malades sur le tarmac des aéroports et d’empêcher l’éclosion de foyers secondaires – avec quelques exceptions, comme à Toronto. Il n’y a donc pas eu de pandémie avec le SRAS, au contraire du scénario qui s’est produit avec la grippe H1N1.
Le deuxième modèle, celui d’une pandémie incontrôlée, a été très souvent évoqué. C’est celui d’une pandémie prenant une allure catastrophique, comparable à celle de 1918 – le virus H1N1 a en effet une parenté avec celui de la grippe espagnole. Nous n’y croyions pas vraiment non plus, car nous ne sommes plus en 1918 : nous disposons aujourd’hui de traitements antiviraux, mais aussi d’antibiotiques contre les complications de la grippe, de systèmes de réanimation, etc. En outre, en 1918, la notion de virologie était absente des connaissances scientifiques. Nous ne pensions donc pas que le monde développé pourrait connaître ce type de scénario.
Nous évoquions finalement un troisième modèle, celui d’une « pandémie des temps modernes », qui s’apparenterait davantage à celles de 1957 et 1968, les deux dernières pandémies de l’époque moderne.
À la fin du mois d’août 2009, une question demeurait pendante dans la communauté scientifique, probablement la plus difficile à résoudre quand une épidémie survient, celle de la virulence : quelle mortalité attribuer à cette maladie ? Une telle question est très complexe s’agissant de la grippe. Ainsi, en ce qui concerne la grippe saisonnière, on évoque 6 000 décès en France chaque année, et 36 000 aux États-Unis. Or, cette mortalité en excès n’est pas vue par les médecins, dont les certificats de mortalité ne font connaître que 600 décès par an pour cette maladie, soit le dixième du chiffre estimé par les épidémiologistes. On observe le même phénomène en Grande-Bretagne, en Australie, aux États-Unis : une mortalité en excès très importante – de l’ordre de 1 cas pour 1 000 affections dues à la grippe saisonnière –, mais que les médecins ne voient pas.
Par ailleurs, la mortalité peut prendre trois aspects. Elle peut d’abord être directe, ce qui est rarissime dans le cas de la grippe saisonnière. En France, les bases de données du PMSI – Programme de médicalisation des systèmes d’information – montrent que dans les cinq dernières années, on n’a observé que cinq à six cas par an de syndrome de détresse respiratoire aiguë dû à la grippe saisonnière, et entre un et trois décès par an. Mais à la fin du mois d’août 2009, l’expérience de l’hémisphère Sud n’était pas du tout celle-ci : la mortalité directe y était de l’ordre de 1 pour 10 000, c’est-à-dire cent fois supérieure à celle qui est observée d’habitude avec la grippe saisonnière. C’est ce qui nous a fait écrire dans PLoS Currents : Influenza que la virulence vraiment attribuable à la mortalité directe semblait élevée avec cette grippe pandémique. Quant à la mortalité indirecte, il est trop tôt pour se prononcer. En France, au lieu d’avoir un à trois décès par le syndrome de détresse respiratoire aiguë, on a connu environ 300 décès – soit cent fois ce à quoi on se serait attendu avec une grippe saisonnière –, et environ 1 200 hospitalisations pour syndrome de détresse respiratoire aiguë, à comparer aux 5 hospitalisations causées chaque année par la grippe saisonnière. Le visage pris par cette grippe H1N1 pandémique était donc particulier.
Cette différence entre mortalité directe et indirecte nous a semblé particulièrement difficile à faire passer dans les médias. Nous avons donc publié un livre chez Plon, avec Jean-Yves Nau, et ouvert un blog – qui est d’ailleurs toujours en activité –, afin de tenter d’expliquer au public ces concepts compliqués.
Autre concept important à comprendre, celui de létalité, qui désigne la proportion des malades qui décèdent à l’hôpital. Une étude importante parue le 4 novembre 2009 dans le Journal of the american medical association nous apprend que les enfants, s’ils sont souvent atteints par le virus H1N1, en meurent beaucoup moins que les jeunes adultes et les adultes âgés. Les adultes ont le même taux de létalité dans une tranche d’âge allant de 18 à plus de 70 ans, alors que ce taux est dix à cent fois inférieur chez les enfants et les tout petits enfants.
À partir de l’automne 2009, les résultats de recherche commencent à affluer, nous donnant d’autres éléments de connaissance. On se rend ainsi compte que la distribution d’âges des cas de H1N1 pandémique est superposable à celle des cas saisonniers de H1N1, mais assez différente de la distribution d’âges des cas saisonniers de grippe H3N2 – c’est-à-dire la grippe de Hongkong, alors que la grippe saisonnière H1N1 est une résurgence de la grippe de 1918. La grippe pandémique se comporte donc comme une grippe H1N1 normale. Mais on observe aussi que très peu de gens âgés de plus de 60 ans contractent le virus H1N1 saisonnier : c’est ce qui relève de l’expérience vécue dans l’hémisphère Sud, confirmée depuis dans l’hémisphère Nord. Ce fait est important parce qu’il signifie que la mortalité indirecte sera probablement beaucoup moins importante que celle de la grippe saisonnière, laquelle est, depuis 1968, essentiellement due au virus H3N2.
À ma connaissance, les seuls à avoir mis en évidence cette mortalité indirecte sont les CDC, Centers for disease control and prevention, qui assurent la surveillance en temps réel de 122 villes nord-américaines et publient chaque semaine un bulletin à ce sujet. Dès le mois de septembre, la mortalité indirecte y avait atteint la valeur attendue pour la saison. L’excès de mortalité est assez aisé à calculer : il suffit, à un moment donné, de comparer le taux de mortalité à celui que l’on observait les années précédentes, en l’absence d’un virus H1N1 pandémique. Cette comparaison est d’autant plus facile qu’aux États-Unis il n’y a pas eu de grippe au mois de septembre depuis plus de vingt ans.
Je terminerai par un article important paru le 22 avril dans la revue Nature, et qui dresse le portrait de cette pandémie un an après son apparition. Il met en lumière des travaux effectués par Mme Viboud au National institute of health – équivalent américain de l’INSERM – et parus dans PLoS Currents : Influenza. Ils montrent qu’au États-Unis, le nombre de certificats de décès confirmés a été faible par rapport à la mortalité habituellement enregistrée au cours des saisons et des pandémies passées – même si une enquête des CDC montre une sous-estimation de la mortalité rapportée à l’Organisation mondiale de la santé. Les estimations de Mme Viboud conduisent à attribuer 44 000 décès à la grippe H1N1, un chiffre proche des 36 000 décès enregistrés en moyenne lors des épidémies de grippe saisonnière aux États-Unis. Mais plus intéressante est la tentative de Mme Viboud de chiffrer le nombre d’années de vie perdues, car ce sont plutôt des jeunes qui décèdent de la pandémie H1N1, contrairement à ce qui se passe pour la grippe saisonnière. Cet indicateur permet de prendre en compte la différence entre le décès prématuré d’une personne de quatre-vingt-quinze ans, dont l’espérance de vie n’est que de quelques mois, et celui d’une personne plus jeune. Or ce nombre d’années de vie perdues en raison de la pandémie H1N1 aux États-Unis est comparable à celui que l’on a pu calculer lors des deux dernières pandémies : plus important qu’en 1968, mais moins qu’en 1957. C’est ce qui laisse penser que nous avons connu une forme de « pandémie des temps modernes ».
Nous avons ainsi assisté, sur toute la planète, au remplacement de toutes les souches virales en circulation par la souche H1N1 pandémique. Désormais, il n’existe presque plus de virus H3N2 et H1N1 saisonniers, ce qui est une signature pandémique très claire : à chaque pandémie, la nouvelle souche remplace totalement les souches précédentes.
Comme tout le monde le prévoyait, le vaccin est arrivé trop tard pour l’hémisphère Sud. Il a été produit à temps pour l’hémisphère Nord, mais s’est révélé peu attractif, puisque dans pratiquement aucun des pays développés où il était disponible – à l’exception du Canada, de la Hongrie et de la Suède – la couverture vaccinale a été de nature à pouvoir enrayer le phénomène pandémique. Par l’immunisation acquise, les populations de ces trois pays se sont vu appliquer une forme de mesure barrière, et il sera intéressant d’observer si la même souche y circulera à nouveau l’hiver prochain.
M. Bernard Debré. Pour stopper une épidémie, quel pourcentage de la population faut-il vacciner ? Je n’ai jamais entendu, en effet, qu’il était nécessaire de vacciner tout le monde.
Par ailleurs, est-il vrai que lorsqu’un patient est atteint cliniquement par la grippe H1N1, trois à quatre autres personnes sont atteintes de façon infraclinique ? Autrement dit, si l’on calcule le nombre de patients cliniquement révélés, peut-on estimer que ceux qui ont été atteints sans qu’on le sache sont trois ou quatre fois plus nombreux, comme cela a été montré à Marseille ?
Qui a décidé qu’il fallait deux injections pour être protégé contre ce virus ? En dehors du cas H5N1, qui n’a pas donné lieu à une épidémie, il n’a jamais été nécessaire de se faire vacciner deux fois pour se protéger contre une grippe, quelle qu’elle soit.
Enfin, vous avez parlé de 300 décès dus au syndrome de détresse respiratoire aiguë, ce qui me paraît beaucoup. Il me semble que de nombreux décès concernaient des malades atteints de maladies associées très graves. Je songe, par exemple, au cas d’une jeune fille de quinze ans atteinte d’une leucémie en phase terminale : elle est morte avec le virus, et non pas du virus.
M. Antoine Flahault. La question de savoir comment stopper une épidémie est particulièrement intéressante, et il est pour le moins étonnant que nous ne puissions pas y apporter de réponse autre que théorique. La modélisation mathématique montre en effet que l’immunisation de 30 % de la population peut constituer une mesure barrière. Mais alors que les vaccins pour la grippe saisonnière existent depuis des années, on n’a jamais demandé aux firmes pharmaceutiques qui commercialisent ces produits, ni à l’État ou aux caisses d’assurance maladie, qui les remboursent, de tenter d’apporter la confirmation expérimentale de cette hypothèse, par exemple en appliquant une mesure barrière dans quelques régions de France. Grâce au réseau Sentinelles, qui permet de mesurer chaque année un pic épidémique, on pourrait voir si cette épidémiologie théorique se confirme dans la réalité. Or, à ma connaissance, elle n’a jamais été appliquée ni en France ni dans le monde. Seule exception, en vaccinant les enfants au Japon pendant des années, on a pu montrer une diminution de la mortalité chez les personnes âgées. Mais ces données sont relativement pauvres, et en outre elles ont plus de trente ans.
Quoi qu’il en soit, aucun modèle mathématique n’évoque la nécessité de vacciner la totalité de la population – du moins s’agissant de la grippe : je ne dirais pas cela pour la rougeole.
Pour répondre à votre deuxième question, il est exact que l’équipe de Xavier de Lamballerie, en collaboration avec l’École des hautes études en santé publique (EHSP), a démontré qu’il existait un grand nombre de cas asymptomatiques, peut-être trois à quatre, pour chaque cas symptomatique. C’est souvent le cas avec la grippe, et ça l’est particulièrement pour ce virus, ce qui explique la difficulté à estimer correctement la proportion de la population qui a été atteinte. On ne peut pas simplement se fier à une veille sanitaire basée sur la notification de cas : on est obligé d’effectuer des enquêtes de séroprévalence, dans la mesure du possible en temps réel, pour permettre le pilotage de la pandémie. Or, à ma connaissance, aucun pays au monde n’a mis au point un plan de ce type.
C’est l’EMEA, l’Agence européenne du médicament, au vu des « prédossiers » présentés par les laboratoires, qui a pris la décision de délivrer une autorisation de mise sur le marché prévoyant deux injections de vaccin. Les industriels ayant déjà déposé des dossiers pour le vaccin contre le virus H5N1, les dossiers relatifs au vaccin contre la souche H1N1 ont en effet été préenregistrés afin d’éviter que des problèmes de type administratif ne conduisent à ralentir le processus d’autorisation. Mais ces dossiers ont été conçus à partir d’une souche de la grippe différente de la souche H1N1 pandémique.
M. Jean-Marie Le Guen. Contrairement à ce qui s’est passé aux États-Unis, où le vaccin était unique et sans adjuvant.
M. Jean-Pierre Door, rapporteur. Mais ce n’était pas le même !
M. Antoine Flahault. La Food and Drug Administration (FDA) a en effet choisi d’autres procédures, qui ont par ailleurs été contestées, car l’ajout d’un adjuvant a permis de proposer plus rapidement un plus grand nombre de doses. Il y a donc eu des controverses de part et d’autre de l’Atlantique. En Europe, les agences nationales du médicament ont suivi, comme elles en avaient l’obligation, les procédures européennes.
En ce qui concerne les 300 décès, à ma connaissance, nous ne sommes pas en mesure de distinguer la part de ceux qui sont dus directement au virus de la grippe. Ce que l’on peut dire, c’est que la plupart peuvent lui être imputés. Quant au syndrome de détresse respiratoire aiguë, il répond à une définition très stricte, et il est vrai qu’un certain nombre de détresses respiratoires aiguës n’étaient que des DRA et non des syndromes de détresse respiratoire aiguë. Les premières séries publiées sur le syndrome de détresse respiratoire aiguë grippal concernent d’ailleurs justement le virus H1N1 pandémique. Ce qu’elles nous apprennent est particulièrement intéressant : les facteurs de risque de syndrome de détresse respiratoire aiguë sont justement certaines maladies préexistantes que vous avez évoquées, qui n’étaient pas des facteurs attendus. Le diabète, l’obésité, l’asthme ne sont pas d’habitude des maladies entraînant le décès par grippe, mais elles augmentent désormais le risque de mortalité. Bien entendu, un certain nombre de patients jeunes mais extrêmement malades, débilités par d’autres pathologies préexistantes, sont décédés du virus H1N1. Mais ce qui est vraiment nouveau, c’est que des gens en pleine santé – 30 % du total – et des gens avec de faibles facteurs de risque aient pu également mourir.
M. le président Jean-Christophe Lagarde. Vous avez parlé d’un à trois morts par an de grippe saisonnière pour cinq hospitalisations, que vous avez voulu comparer aux 1 200 hospitalisations et 300 morts de grippe pandémique. Mais on retient généralement l’idée que la grippe saisonnière cause, directement ou indirectement, le décès de 3 000 personnes par an. Vous comparez donc des chiffres qui ne sont pas comparables, à moins d’en conclure que la grippe pandémique a fait beaucoup moins de victimes que la grippe saisonnière.
M. Antoine Flahault. J’ai seulement dit qu’il y avait eu entre un et trois morts par syndrome de détresse respiratoire aiguë, et cinq personnes par an placées en réanimation pour syndrome de détresse respiratoire aiguë lié à une grippe saisonnière dans les cinq dernières années. Il est donc totalement exceptionnel de mourir de la grippe dans un service de réanimation. Lorsque nous parlons de 300, 3 000 ou 6 000 décès en excès, il ne s’agit pas de personnes qui meurent de la grippe, mais dont la mort est attribuable à la grippe. Celle-ci est la goutte d’eau qui fait déborder le vase d’une maladie préexistante. Ainsi, deux mois avant son décès, le pape Jean-Paul II a été hospitalisé à Rome en pleine épidémie de grippe, et a subi une trachéotomie pour cause d’insuffisance respiratoire aiguë. Mais il est mort chez lui, quinze jours après sa sortie de l’hôpital, d’une fausse route liée à sa maladie de Parkinson. Il avait complètement guéri de la grippe, et n’est donc pas mort du virus. J’affirme donc que dans les dernières années, entre une et trois personnes, en moyenne annuelle, sont décédées du virus de la grippe saisonnière. C’est ce que démontrent les bases du PMSI, qui souffrent peut-être d’une légère sous-estimation.
M. le président Jean-Christophe Lagarde. Et ce sont ces un à trois morts de syndrome de détresse respiratoire aiguë que vous comparez aux 300 morts dont vous avez parlé ?
M. Antoine Flahault. Oui, comme on peut comparer les 1 200 cas d’hospitalisation en soins intensifs survenus en France pendant la pandémie aux cinq cas d’hospitalisation dus chaque année à la grippe saisonnière.
Mme Valérie Fourneyron. Lors d’une autre audition, en septembre dernier, vous aviez déjà affirmé que l’on n’avait jamais eu recours à la stratégie barrière. Ne serait-il pas temps d’envisager l’étude d’une telle stratégie contre la grippe saisonnière H1N1 ? Il semble que nous y sommes prêts.
Par ailleurs, lors de la même réunion, vous n’aviez pas jugé pertinent de lancer une campagne de vaccination de masse, estimant au contraire qu’il valait mieux cibler certaines populations à risques, qu’il s’agisse des personnels soignants ou de personnes souffrant de certaines maladies. Or ce n’est pas ce qui s’est passé. Comment analysez-vous cette divergence ?
M. Antoine Flahault. J’apprécie beaucoup cette question, car tout l’intérêt de cet exercice est probablement d’essayer de mieux faire la prochaine fois. Or, et vous avez tout à fait raison sur ce point, la prochaine fois ne signifie pas la prochaine pandémie, mais bien les prochaines grippes saisonnières.
Il existe en effet deux stratégies de vaccination contre la grippe : la stratégie de barrière, qui n’a jamais été employée nulle part, et le ciblage des populations à risques. Mais bien que systématiquement utilisée, cette dernière stratégie n’a jamais été évaluée correctement. L’équipe de Mme Viboud et de Lone Simonsen a d’ailleurs publié des travaux très controversés sur son efficacité, jugeant que l’hypothèse selon laquelle elle entraînait une diminution de la mortalité n’avait jamais été véritablement démontrée aux États-Unis. Les études épidémiologiques qui vantent les bénéfices de la vaccination chez les personnes âgées évoquent une réduction de 50 % de la mortalité chez ces personnes pendant les épidémies de grippe. Mais si c’était vrai, répond Lone Simonsen, cela devrait se voir, y compris dans les courbes de mortalité. Or ce n’est pas le cas.
L’efficacité de la stratégie de protection des personnes à risques n’est donc pas très bien démontrée. De plus, si la prochaine grippe saisonnière est due au virus H1N1, ces personnes à risques ne seront pas les mêmes que celles que l’on avait identifiées avec le virus H3N2 : ce seront des personnes beaucoup plus jeunes, situées dans des bassins de population particuliers. Cependant nous ne disposons d’aucune évaluation en ce domaine.
Pour autant, ne faudrait-il rien faire ? Mon propos n’est pas de reprocher le choix de telle ou telle stratégie : dans une situation d’incertitude, il a bien fallu prendre des décisions. Celle qui a été prise a donc consisté à proposer un vaccin à toute la population française – et non de l’imposer ; on ne peut donc pas vraiment parler de vaccination massive – et d’inciter très fortement des populations reconnues comme à risques, comme les femmes enceintes, à se faire vacciner. Mais je souscris totalement à votre proposition : il convient désormais d’évaluer cette méthode de façon rigoureuse. Donnons-nous les moyens de réaliser de véritables expérimentations afin de déterminer les stratégies les plus efficaces.
M. le rapporteur. Le Centre européen de prévention et de contrôle des maladies (ECDC) a procédé à l’évaluation des risques en fonction d’incertitudes documentées – le type antigénique du virus, sa sévérité, la prédominance du virus pandémique sur le virus saisonnier – et de certaines inconnues parfaites : ainsi, rien n’indiquait que le virus ne muterait pas et n’aurait pas une virulence plus importante. Quel est votre avis sur ces observations, que les représentants de l’ECDC maintenaient encore récemment ? Doit-on craindre de nouvelles vagues épidémiques ? Quelles recommandations pourriez-vous formuler pour améliorer la prévention et la gestion de ces éventuelles futures crises ?
Une étude de Jean-Paul Moatti, de l’INSERM, publiée dans PLoS One le 16 avril, a tenté d’expliquer pourquoi le taux de vaccination a été si faible en France. Les deux raisons principales évoquées étaient les doutes sur la sécurité du vaccin et la crainte d’effets secondaires.
M. Jean-Marie Le Guen. Sans parler de l’absence d’adhésion du corps médical !
M. le rapporteur. Ce facteur a joué après : au départ, les médecins n’étaient pas concernés.
M. le président Jean-Christophe Lagarde. Comme nous l’a expliqué un sociologue, la première des raisons était le doute sur la sévérité du virus.
M. le rapporteur. Je parle, moi, de la sécurité du vaccin. Quoi qu’il en soit, cette étude de l’INSERM a pointé les inconvénients de la stratégie employée. La question se pose désormais de savoir comment on pourrait obtenir un meilleur taux de vaccination.
Par ailleurs, vous avez affirmé que les virus H3N2 et H1N1 saisonnier allaient disparaître. Or nous sommes sur le point de fabriquer un vaccin trivalent, permettant de lutter contre ces deux souches et contre le virus H1N1 pandémique. Est-ce vraiment utile ?
Enfin, nous avons évoqué la part de la population qu’il était nécessaire de vacciner. Or une disposition du règlement sanitaire international, ajoutée au moment de l’épidémie de grippe H5N1, prévoit que lorsque le stade 6 est atteint, il faut être en mesure de vacciner la totalité de la population.
M. Jean-Marie Le Guen. C’est pour cela que la France n’y est pas passée !
M. le rapporteur. En effet : nous sommes restés au stade 5A, qui laissait la possibilité d’une vaccination volontaire. Mais les vaccins ont été commandés à un moment où l’on ne connaissait pas encore la virulence du virus, et alors que l’on avait encore à l’esprit le plan de lutte contre la grippe A(H5N1). En tout état de cause, il serait peut-être nécessaire de revoir le règlement sanitaire international.
M. Antoine Flahault. En ce qui concerne l’incertitude sur les mutations du virus et la crainte des futures vagues, on peut citer un article publié dans l’American journal of public health qui montre que depuis la pandémie de 1918, la mortalité par grippe n’a cessé de décroître. Des mutations peuvent se produire lors de chaque saison, et c’est d’ailleurs pour cette raison que l’on modifie régulièrement la composition des vaccins. Parfois, la mutation est plus importante : c’est ce qui a entraîné les pandémies de 1957, 1968 et de 1977. Mais la mortalité de la grippe tend à diminuer, comme d’ailleurs celle de toutes les maladies infectieuses. Il n’est certes pas totalement impossible qu’une mutation terrifiante se produise, mais cette hypothèse me semble plutôt relever du fantasme. Faut-il craindre de futures vagues ? Oui : des vagues de grippe. Même si elle a des particularités, la pandémie que nous venons de connaître ressemble à la grippe que l’on a l’habitude de voir.
J’en viens à la question de la vaccination. J’ai le sentiment que les gens, qui ont plutôt du bon sens, n’ont pas été très convaincus par la sévérité de cette souche grippale. C’est ce qui ressort des travaux de Michel Setbon et de ceux de Jean-Paul Moatti. Face à une menace qui n’apparaissait pas extrêmement grave, les Français ne se sont pas beaucoup mobilisés. Mais je crois surtout que nous payons des années d’incurie scientifique en matière d’évaluation de la vaccination. On a beaucoup reproché au personnel médical de ne pas montrer l’exemple, mais on n’a jamais fait la preuve que la vaccination du personnel médical apportait le moindre bénéfice pour les patients, ou même pour le fonctionnement des hôpitaux ! Dans ce domaine, les seules études existantes ne concernent que les maisons de retraite, et elles sont controversées. Elles montrent que la vaccination du personnel de ces établissements a un impact plutôt positif, mais pas exceptionnel, sur la santé des pensionnaires. Avec un tel niveau de preuve, un membre du corps médical peut difficilement être convaincu de la nécessité de se vacciner.
Par ailleurs, si les vaccins se sont montrés finalement très sûrs, au début de la campagne vaccinale, l’expérience manquait à ce sujet. Ainsi, la plupart des gens, ne se sentant pas très menacés par une grippe pas très tueuse, constatant la faible conviction des personnels médicaux, et estimant que la sécurité des vaccins n’était pas totalement établie, a préféré s’abstenir.
En ce qui concerne le vaccin trivalent, c’est faire un pari que de prévoir la substitution du H1N1 à toutes les autres souches. Nous l’observons actuellement, mais rien ne permet d’affirmer que le virus H3N2 ne va pas resurgir. Il y a sans doute trop de doutes et pas assez d’expérience pour faire de ce pari une affirmation définitive. Les industriels et les experts de l’Organisation mondiale de la santé n’ont sans doute pas voulu prendre un tel risque sur le dos des populations, et ont préféré un vaccin efficace contre les trois souches H3N2, H1N1 et H1N1 pandémique.
M. Gérard Bapt. Lorsqu’une personne vaccinée rencontre le virus, peut-elle être contagieuse, ou son immunité protège-t-elle également son entourage de la contagion ? Telle est, au fond la question qui se pose à propos de la vaccination des personnels médicaux.
Je souhaite par ailleurs évoquer la communication autour de la pandémie, car il y a eu une tendance systématique à inquiéter les populations. Je ne reviens pas sur l’épisode de La Gloria : alors que certains avaient décrit des habitants ce village suffocant des suites de la grippe, il n’y a pas eu une seule mort liée à la grippe H1N1 à La Gloria. En revanche, de nombreuses personnes y sont mortes de syndrome de détresse respiratoire aiguë, à cause de la présence, dans cette province, de porcheries détenues par des sociétés américaines et laissées dans un état innommable. Mais on se rappelle de ce bateau dont on avait refusé l’accostage en raison d’un cas de grippe signalé à bord, et dans lequel on a même envoyé des scaphandriers. Dans Le Monde du 12 mai, vous avez vous-même rapproché la pandémie en cours de la grippe de Hongkong, et déclaré que « l’épidémie de grippe A pourrait tuer 30 000 personnes en France » – l’AFP en a fait un titre. Je pourrais citer de nombreuses déclarations similaires, y compris venant de responsables de l’Organisation mondiale de la santé.
Au même moment, un médecin généraliste installé près d’ici, le docteur Dupagne, correspondait avec des confrères de l’hémisphère Sud. Et il concluait dès le mois de mai qu’il ne s’agissait pas d’une grippe grave et qu’il n’y avait pas lieu de s’inquiéter. Or, de telles informations finissent par se diffuser chez les généralistes.
Par ailleurs, le professeur Dab a déploré l’absence de débat et d’ouverture sur la société. Ne pensez-vous pas que le monde de la virologie reste refermé sur lui-même et que, pris dans des concepts intellectuels, il finit par développer une forme de pensée unique ? Ne faudrait-il pas tenir compte davantage de la réalité du terrain ?
M. Jean-Marie Le Guen. Avez-vous des contacts avec vos collègues du Mexique ? Il me semble en effet qu’il y a eu une forme d’incompréhension de ce qui s’y est passé. L’information a été complètement déformée, sans que je sache s’il faut l’attribuer au pays lui-même ou à des interférences d’une autre origine.
Quant à la vaccination, était-elle possible ? Était-elle souhaitable ? Je rappelle que le calendrier de livraison des vaccins rendait de toute façon impossible l’application d’une vaccination barrière. La stratégie affichée était donc dès le départ impossible, et ce modèle théorique n’aurait jamais pu être validé. Vous-même avez publié un livre à la fin du mois d’août, et avez tenu dans un article paru dans Le Monde des propos très clairs sur le sujet. Or lorsque l’on cosigne un livre, on est généralement amené à le promouvoir. Pourtant on ne vous entend plus beaucoup à partir du mois de septembre. Est-ce parce que vous n’avez pas eu l’occasion d’intervenir dans les médias, parce que vous n’avez pas voulu interférer avec une politique de santé publique gouvernementale, ou parce que l’on vous a demandé de moins vous exprimer ?
Mme Marie-Louise Fort. N’étant absolument pas médecin, je fais partie de la population « normale »…
M. Jean-Marie Le Guen. Merci pour les autres ! (Sourires).
M. le président Jean-Christophe Lagarde. L’anormalité n’est pas nécessairement une tare, cher docteur Jean-Marie Le Guen.
Mme Marie-Louise Fort. Je veux dire par là que jusqu’à présent, seuls des médecins se sont exprimés. Peut-être est-ce pure jalousie de ma part. Mais plus sérieusement, vous avez fait état, monsieur le professeur, de la difficulté de faire passer certains messages dans les médias, notamment en ce qui concerne la mortalité directe ou indirecte. Que pensez-vous de la communication institutionnelle nationale sur la vaccination ? Que préconisez-vous pour l’avenir, puisque, si j’ai bien compris, en matière de grippe, nous ne sommes pas au bout de nos peines ?
M. Antoine Flahault. M. Gérard Bapt a posé la question de l’efficacité individuelle du vaccin. C’est sans doute le domaine dans lequel existe le plus d’études. Lorsque j’évoquais un manque d’évaluations, en effet, il s’agissait de son efficacité collective. Du point de vue individuel, le vaccin contre la grippe est connu pour ne pas être très efficace, et il l’est d’autant moins que l’on est âgé. Il n’est donc pas possible d’affirmer qu’une personne vaccinée sera protégée à 100 %, ni qu’elle ne risque pas d’héberger le virus ou de contaminer d’autres personnes. Mais, à titre individuel, la vaccination réduit significativement ces risques, ainsi que le risque de développer des complications.
Je ne partage pas l’idée selon laquelle le débat n’a pas eu lieu autour des questions liées à la grippe. Il est exact que dans certaines sphères scientifiques, les opinions contredisant l’idée dominante peuvent avoir du mal à s’exprimer, mais cela n’a pas été le cas en l’espèce. J’ai trouvé au contraire remarquable que tout le monde ait eu la possibilité de s’exprimer sur ce sujet de société : les politiques sont intervenus, le débat n’a pas été capturé par les experts, et même parmi ces derniers, des opinions antagonistes ont pu être émises. C’était sain, car la culture du débat et de la contradiction, naturelle pour des députés, est parfois insuffisante dans le domaine scientifique. C’est pourquoi on a eu tort, selon moi, de vilipender à ce point la cacophonie régnant autour de la question de la grippe, car le débat a eu lieu de façon démocratique.
Vous me reprochez d’avoir annoncé 30 000 décès dès le mois de mai, mais j’ai seulement dit que cela pourrait arriver. C’était l’un des scénarios possibles, celui de 1968. Mais j’ai surtout dit cela par rapport au rapprochement fait à cette époque avec la grippe de 1918, qui a fait 20 millions de morts. Des ouvrages sont ainsi parus en France qui annonçaient 500 000 décès dans le pays. J’ai justement dit que de telles affirmations n’étaient pas raisonnables, que cela n’arriverait pas.
Je reconnais volontiers que je me suis trompé : il n’y a pas eu 30 000 morts. Mais je le répète, le décompte effectué aux États-Unis du nombre d’années de vie perdues en raison de la grippe – nous ne disposons pas encore de telles données pour la France – montre que nous avons connu un scénario peu éloigné de celui de 1968. L’affirmation selon laquelle on pourrait connaître une pandémie des temps modernes n’était donc ni catastrophiste, ni absurde. Dès lors, pourquoi ne pas le dire ? Un tel exercice n’a-t-il aucun intérêt ? Vous êtes libre d’en juger ainsi. Mais nous nous devons d’essayer d’envisager les scénarios possibles. L’Institut de veille sanitaire (InVS) a déclaré qu’il pourrait y avoir entre 6 000 et 96 000 décès : ne fallait-il retenir que l’estimation haute ? C’est une tendance générale, et pas seulement chez les journalistes. On peut d’ailleurs comprendre que les politiques en charge de la gestion du risque aient tendance à ne retenir que le haut de la fourchette. Cela ne me choque pas particulièrement.
J’en viens à cette forme de communication faisant alterner « douches chaudes » et « douches froides », et qui a été très étudiée par les spécialistes de la gestion du risque. On l’appelle en anglais reassurance arousal paradox, que l’on pourrait traduire par : « je rassure et je mobilise ». Cela revient, par exemple, à affirmer que le nuage de Tchernobyl ne passera pas au-dessus de la France – « je rassure » –, mais qu’il convient de se munir d’iode pour le cas où cela apparaîtrait nécessaire – « je mobilise ». Ce paradoxe est consubstantiel à la gestion d’une crise. Quel que soit le bord politique où vous vous situez, lorsque vous êtes aux manettes, vous devez tenir un discours destiné à éviter toute panique tout en maintenant l’attention et la vigilance. Cette dualité se retrouve à tous les stades de la communication.
Jean-Marie Le Guen juge que l’on m’a peu entendu. En tant que directeur d’une École de santé publique, j’ai le sens de mes propres responsabilités. Lorsque le débat était posé, c’est-à-dire avant que le ministère prenne la décision de vacciner telle ou telle catégorie de la population, je me suis senti autorisé à présenter mes arguments et à diffuser le plus possible les résultats de nos travaux. Une fois les décisions prises, il n’était pas dans mon tempérament de m’y opposer. Une telle attitude « militante » aurait ajouté à la confusion, ce que je ne souhaitais pas.
M. le président Jean-Christophe Lagarde. Vous avez indiqué que l’on pouvait prévoir un redémarrage de la pandémie cette année, entre mai et septembre, dans l’hémisphère Sud. Pourrait-elle également survenir au Nord ? Dans ce cas, et comme, à l’heure actuelle, aucune décision n’a été prise concernant l’avenir, il vous est possible de formuler quelques suggestions.
M. Antoine Flahault. La question est complexe. C’est à partir de l’expérience passée que l’on peut envisager les scénarios possibles pour l’hiver prochain. Or celle-ci montre que depuis vingt-cinq ans, nous n’avons pas connu une seule saison sans épidémie de grippe. En effet, lorsqu’un virus de la grippe rencontre une population suffisamment immunisée pour qu’une épidémie ne puisse s’y développer, il mute – pardonnez-moi cet anthropomorphisme. Cela n’implique pas nécessairement une évolution de type pandémique, mais une petite mutation se produit, qui donne à nouveau au virus un espace pour progresser. Ces virus ne pouvant se multiplier qu’à travers les cellules humaines, ils doivent en effet être la cause d’épidémies pour pouvoir survivre. Un tel principe évolutionniste signifie que nous vivrons toujours avec la grippe. En France, en particulier, la part de la population immunisée est probablement trop faible pour pouvoir faire barrière à une épidémie. En revanche, dans certains pays comme le Canada ou la Suède, où près de 60 % de la population sont vaccinés, l’immunisation sera peut-être suffisante pour empêcher la progression d’une épidémie, à moins que des mutations n’y éclosent. Toutefois, de telles mutations n’auraient rien de terrifiant. Elles sont attendues, et ce sont ces mutations qui permettent aux épidémies saisonnières de se développer dans nos différents pays.
M. le président Jean-Christophe Lagarde. Dans la mesure où la situation en France est différente de celle de la Suède, de la Hongrie ou du Canada, est-ce que vous recommanderiez la vaccination pour la saison prochaine, en particulier avec un vaccin trivalent ?
M. Antoine Flahault. Je le répète, nous manquons d’études suffisamment claires pour que l’on puisse recommander une politique publique de vaccination de certains groupes de population. En raison du faible niveau de preuve, les décideurs devront donc agir en situation d’incertitude. Selon moi, la logique médicale ne doit pas inciter à proposer une stratégie barrière, car nous manquons de retours d’expérience en ce domaine. Sur ce point, mon discours est le même qu’avant la pandémie. En revanche, nous disposons d’une plus grande connaissance sur la nature des groupes à risques. Par exemple, les femmes enceintes ayant atteint le deuxième trimestre de grossesse me paraissent à nouveau mériter d’être vaccinées cette année. De même, on a pu observer que les jeunes présentant des pathologies sous-jacentes comme l’asthme, le diabète, les maladies cardiaques et l’obésité morbide étaient plus exposés. Feront-ils partie des groupes à risques dont la vaccination sera recommandée lors de la prochaine campagne ? Je n’en sais rien, mais une certaine logique médicale pourrait le prévoir.
M. le président Jean-Christophe Lagarde. C’est le conseil que vous donneriez pour l’utilisation, l’année prochaine, des nouveaux vaccins trivalents ?
M. Antoine Flahault. Tout à fait.
M. le rapporteur. Ce faisant, vous vous éloignez de l’option américaine consistant à lancer une stratégie nationale de vaccination contre le virus H1N1.
M. Antoine Flahault. La composition du vaccin trivalent comprend de toute façon la souche H1N1. Mais compte tenu du niveau de preuve de son efficacité, la vaccination pour tous ne me semble pas, en effet, devoir être recommandée. De toute façon, la précédente pandémie a bien montré qu’elle n’était pas applicable. Je ne vois pas pour quelle raison l’ensemble de la population deviendrait favorable à la vaccination lors d’une deuxième vague. En revanche, concentrer nos efforts sur les groupes à risques me paraît la meilleure solution.
M. le président Jean-Christophe Lagarde. Monsieur le professeur, je vous remercie.
La séance est levée à dix-sept heures vingt.
Table ronde réunissant des représentants d’ordres et de syndicats professionnels :
M. Thierry Amouroux,
secrétaire général du Syndicat des personnels infirmiers,
M. Michel Chassang,
président de la Confédération des syndicats médicaux français,
M. Philippe Gaertner,
président de la Fédération des syndicats pharmaceutiques de France,
M. Claude Leicher,
président de MG France,
Mme Chloé Loyez,
étudiante en troisième année du deuxième cycle d’études de médecine à l’Université Paris VI, présidente de l’Association nationale des étudiants en médecine de France,
M. Grégory Murcier,
président de l’Intersyndicat national des internes des hôpitaux,
représentant les internes de spécialité hors médecine générale,
M. Martial Olivier-Koehret,
médecin généraliste, ancien président de MG France,
M. Matthieu Piccoli,
étudiant en troisième année de deuxième cycle d’études de médecine à l’Université
Paris-Descartes, représentant les étudiants en médecine d’Île-de-France,
M. Patrick Romestaing,
ORL libéral, président de la section Santé publique du Conseil national de l’Ordre des médecins et
M. Philippe Tisserand,
président de la Fédération nationale des infirmiers libéraux
(Procès-verbal de la séance du mardi 27 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures vingt.
M. le président Jean-Christophe Lagarde. Jusqu’à présent, nous avons surtout procédé à des auditions individuelles. Pour des questions de délais, mais aussi afin de mieux confronter les points de vue, nous avons décidé d’organiser un certain nombre de tables rondes. Nous accueillons ainsi aujourd’hui plusieurs représentants d’ordre et de syndicats professionnels du monde médical.
Prêtent successivement serment :
– M. Thierry Amouroux, secrétaire général du Syndicat des personnels infirmiers ;
– M. Michel Chassang, président de la Confédération des syndicats médicaux français ;
– M. Philippe Gaertner, président de la Fédération des syndicats pharmaceutiques de France ;
– M. Claude Leicher, président de MG France ;
– Mme Chloé Loyez, étudiante en troisième année du deuxième cycle d’études de médecine à l’Université Paris VI, présidente de l’Association nationale des étudiants en médecine de France ;
– M. Grégory Murcier, président de l’Intersyndicat national des internes des hôpitaux, qui représente les internes de spécialité hors médecine générale ;
– M. Martial Olivier-Koehret, médecin généraliste, ancien président de MG France ;
– M. Matthieu Piccoli, étudiant en troisième année du deuxième cycle d’études de médecine à la faculté de médecine de l’Université Paris-Descartes, représentant des étudiants en médecine d’Île-de-France ;
– M. Patrick Romestaing, ORL libéral, président de la section Santé publique du Conseil national de l’Ordre des médecins ;
– M. Philippe Tisserand, président de la Fédération nationale des infirmiers libéraux.
M. le président Jean-Christophe Lagarde. Le Gouvernement a pris la décision de proposer à tous les Français un vaccin contre la grippe A(H1N1), son souhait étant de vacciner, sur la base du volontariat, la part de la population la plus importante possible. Or, le taux de vaccination n’a été finalement que d’environ 10 %. Ma première question sera donc de vous demander ce qui, selon vous, explique ce résultat.
M. Jean-Pierre Door, rapporteur. Pour ma part, j’aimerais savoir d’emblée si des rencontres ont eu lieu au printemps dernier entre les organismes que vous représentez et le ministère.
M. Martial Olivier-Koehret, ancien président de MG France. Vous nous interrogez sur l’adhésion de la population à la vaccination. Il convient tout d’abord de se remettre dans le contexte. À l’époque, tous les patients, à toutes les consultations, nous posaient des questions sur la grippe, la prise en charge, les risques, la vaccination. Dans un tel contexte, nous, médecins généralistes, avons connu à plusieurs reprises des difficultés à nous positionner par rapport au discours public, qui suivait la progression des connaissances au sujet de la pandémie grippale. Pendant toute une période, au fil des annonces, il a été difficile de suivre la politique mise en place – possibilité ou non de produire un vaccin, date de disponibilité des produits, nombre d’injections préconisé, etc.
Nous avons pourtant insisté à plusieurs reprises sur la nécessité d’une contribution des médecins généralistes à la prise en charge des patients atteints de la grippe et au processus de vaccination. Le choix de vacciner l’ensemble de la population donnait une dimension altruiste à cette campagne : plus que la protection de chaque individu, en effet, elle visait à empêcher la propagation de la maladie. Mais il manquait une complémentarité avec notre propre approche, selon laquelle les patients souffrant de maladies du cœur ou des poumons, ou ceux pouvant développer certaines complications, devaient être vaccinés tôt. Tout cela a entraîné une certaine confusion dans le fonctionnement du dispositif.
Il convient de rappeler que lors de toute grande campagne de santé publique, les patients interrogent leur médecin généraliste. C’est le message qui est transmis à cette occasion qui entraîne ou non l’adhésion du processus de vaccination. La nécessité d’une complémentarité entre notre intervention et celle des pouvoirs publics est, selon moi, un des enseignements majeurs à tirer de cette crise.
Bien entendu, au cours cette pandémie, nous avons vu s’agiter l’ensemble des acteurs du lobby anti-vaccin, qui ont profité de nos difficultés à tenir un discours carré et cohérent sur la vaccination pour remuer toutes les peurs imaginables. Pour ma part, j’ai été mis en cause à plusieurs reprises au cours de réunions ou de colloques pour avoir pris position en faveur de la vaccination, dont certains – même des médecins – contestait le principe même.
Si nous avons eu des difficultés à définir la politique publique engagée, c’est parce que pour la première fois, une crise sanitaire a été retransmise en direct sur tous les écrans. La totalité des informations était disponible, mais il n’existait aucun recul pour les appréhender, ce qui rendait la situation particulièrement complexe.
M. Michel Chassang, président de la Confédération des syndicats médicaux français. Vous n’avez pas prononcé le mot, mais au fond, vous vous demandez ce qui explique l’échec du schéma vaccinal retenu. En effet, alors que l’objectif initial était de vacciner la plus grande part de la population, on n’est pas parvenu à vacciner un plus grand nombre de personnes que lors d’une campagne de vaccination contre la grippe saisonnière. Selon moi, il existe au moins quatre raisons à cet échec.
La première est l’absence de message clair, qui a entraîné des doutes et des interrogations chez les Français, au point de voir remis en question, comme l’a dit mon confrère, le principe même de la vaccination. Nous avons connu une communication pour le moins intempestive au sujet de la dangerosité potentielle du virus, d’une part, et des éventuels effets secondaires du vaccin, d’autre part. J’en veux pour preuve les messages contradictoires concernant la détection d’un éventuel cas de syndrome de Guillain-Barré, d’ailleurs infirmée par la suite. Toutes les campagnes de vaccination peuvent faire apparaître des effets secondaires, mais c’était vraiment une erreur de mettre l’accent sur de tels effets lors d’une campagne de vaccination de masse.
La deuxième raison, que je n’ai d’ailleurs jamais entendu citer jusqu’à présent, est l’absence de formation préalable des professionnels, contrairement à ce qui avait été décidé d’un commun accord lors de la campagne de vaccination contre la grippe aviaire. À l’époque, en effet, nous étions en concertation permanente, ce qui n’a pas été le cas lors de la campagne de vaccination contre la grippe A(H1N1). Cette formation aurait non seulement eu pour but de préparer les professionnels à ce type de pandémie, mais surtout de leur permettre de délivrer un message unique. Or contrairement à ce que nous avions proposé dès le printemps, une telle formation n’a pas eu lieu en 2009, ce qui a été une grosse erreur.
La troisième raison est que les modalités retenues, que je qualifie volontiers de « militaro-soviétiques », ont complètement révolté les médecins – et plus largement les Français. Le choix a été effectué de donner l’exclusivité à des centres de vaccination et de court-circuiter tout le réseau de proximité. Songez pourtant que ce pays compte 55 000 médecins généralistes, 3 000 pédiatres, 60 000 infirmières libérales !
Les raisons invoquées pour justifier cette mise à l’écart systématique du tissu de proximité ont profondément heurté les professionnels, qu’il s’agisse de l’absence de réfrigérateurs, des problèmes liés au conditionnement ou du prétendu risque d’encombrement des cabinets. En fait, comme lors de toute épidémie, on n’a observé qu’une augmentation de 10 % de l’activité en médecine de ville – un afflux facile à absorber. En outre, alors que les autres pays étaient donnés en exemple, on s’est aperçu que presque tous pratiquaient la vaccination dans des cabinets médicaux, individuels ou de groupe.
Écartés du dispositif, non formés, incapables de délivrer un message unique, les médecins ont pourtant été amenés à produire des certificats de non-contre-indication pour des enfants vaccinés dans des centres spéciaux ou des établissements scolaires ! Cela les a irrités profondément.
Par ailleurs, il est curieux, lorsque l’on veut toucher toute une population, de réserver la vaccination aux seuls détenteurs de bons. La raison invoquée, à savoir la nécessité d’une traçabilité, ne tenait pas : comme la prose pour M. Jourdain, la traçabilité est, Dieu merci, quelque chose que nous pratiquons tous les jours. Lors de toute vaccination – et celle-ci était à nos yeux une vaccination ordinaire –, nous remplissons des dossiers médicaux.
Notons que toute cette stratégie était en contradiction avec une loi qui vient d’être adoptée, la loi portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires, laquelle était censée remettre le médecin généraliste au centre du dispositif dit de « médecine de proximité ».
Enfin, passant rapidement sur les longues files d’attente que l’on a vu se former à l’entrée des centres de vaccination – lesquelles ont provoqué l’hilarité dans les cabinets –, je rappellerai qu’il n’a pas été permis aux médecins d’obtenir auprès de ces centres les doses nécessaires pour vacciner leurs propres patients.
La quatrième raison est que le choix de ce schéma vaccinal a désorganisé profondément l’ensemble du système de santé, en raison notamment des réquisitions intervenues. Certains médecins étaient ainsi contraints de quitter leur cabinet, dont la salle d’attente était pleine, pour rejoindre leur poste dans des centres de vaccination vides ! De même, la réquisition des stagiaires a déséquilibré le fonctionnement de la médecine de ville. Les hôpitaux et les services de santé au travail ont connu le même sort. Enfin, à la fin de l’année dernière, les médecins généralistes ont dû doubler le nombre de gardes sous prétexte de mobilisation autour de la vaccination.
Reste à tirer les leçons de tout cela, car ce qui nous importe, c’est l’avenir. Je suppose que vous aurez des questions à nous poser à ce sujet. Mais je crois avoir donné les raisons ayant conduit à l’échec du schéma vaccinal retenu.
M. Grégory Murcier, président de l’Intersyndicat des internes des hôpitaux. Avec l’accès illimité et irraisonné à toutes les sources d’information comme le permet la société actuelle, chacun ou presque changeait d’avis plusieurs fois par jour. Tout le monde
– jusqu’à des urologues ! – donnait son avis sur telle antenne ou dans tel journal. Comme si moi, interne en chirurgie maxillo-faciale, j’avais donné mon avis sur la qualité du vaccin et l’opportunité de se faire vacciner… Comment le Français moyen aurait-il pu s’y retrouver ? Je rejoins donc les deux intervenants précédents quant au manque de cohérence de l’information fournie aux citoyens.
Ajoutez à cela le fait que l’épidémie s’est révélée un peu moins grave que prévu et la propension, très française, à toujours trouver une raison pour ne pas faire ceci ou cela.
Telles sont selon moi les seules raisons importantes du manque de succès de la campagne de vaccination, même si les éléments qui ont été cités ont forcément eu un impact.
M. le rapporteur. Avez-vous participé aux campagnes de vaccination ?
M. Grégory Murcier. J’ai été réquisitionné de façon légale – ce qui permettait d’être rémunéré. Dans la pratique, l’association locale des internes de Saint-Étienne s’est mise en rapport avec la direction régionale des affaires sanitaires et sociales (DRASS) et la direction des affaires médicales de son CHU.
L’ensemble des associations des internes de France a largement contribué à la qualité de l’organisation, dans la mesure où les DRASS ont été relativement inefficaces, voire parfois totalement incompétentes.
M. le président Jean-Christophe Lagarde. Ce qui signifie ?
M. Grégory Murcier. Nombre de DRASS n’ont pas été capables de faire un planning, alors que c’est à la portée de tout un chacun avec le tableur Excel, voire avec un papier et un crayon. Manquaient-elles de personnel ? Étaient-elles submergées ? Quoi qu’il en soit, les associations d’internes ont souvent remplacé les DRASS en ce domaine.
Les plannings ont été organisés plus facilement à certains endroits qu’à d’autres. Nous recevions une convocation. Nous remplissions un papier attestant de notre présence. Il était renvoyé à la DRASS, ce qui nous permettait d’être payés lorsque nous étions intervenus dans les heures permettant une rémunération.
M. le rapporteur. Avez-vous été rémunéré ?
M. Grégory Murcier. Pas moi, dans la mesure où j’ai travaillé de midi à seize heures, un lundi, sur mes heures de travail. En revanche, tous mes collègues qui ont été réquisitionnés à des moments où ils pouvaient être payés, l’ont été. L’un d’eux a même touché 1 700 euros en un mois !
M. le président Jean-Christophe Lagarde. Étiez-vous défrayés de vos frais de transport ?
M. Grégory Murcier. Oui, sur pièces justificatives.
M. le rapporteur. Le service hospitalier où vous travaillez a-t-il été désorganisé ?
M. Grégory Murcier. Non, les quatre internes se sont organisés pour ne pas quitter le service le même jour. Je pense que cela s’est passé de la même façon dans tous les CHU de France. Certes, à Paris, suite à l’intervention présidentielle, on est allé jusqu’à faire réquisitionner des internes par la force publique, et cette effervescence a duré quelques semaines, ce qui nous a obligés à taper régulièrement du poing sur la table. Mais le problème tenait plutôt à un manque d’organisation du ministère de la santé.
M. Philippe Tisserand, président de la Fédération nationale des infirmiers libéraux. Je répondrai d’abord à M. le rapporteur que nous avons effectivement eu, au cours de l’été, trois réunions au cours desquelles on nous a répondu la même chose, à savoir que l’on n’avait pas besoin de nous.
Depuis le départ, le choix avait été fait d’une vaccination collective. Nous n’étions pas là pour revendiquer quoi que ce soit. La seule chose que nous demandions, c’est que les réquisitions ne désorganisent pas la chaîne des soins de ville que les infirmiers libéraux avaient en charge, concernant notamment les patients lourds.
La ministre était présente lors de l’une de ces réunions – qui réunissait les quatre syndicats d’infirmiers libéraux et la présidente de l’Ordre national des infirmiers, dont l’approche est d’ailleurs différente de celle des syndicats. Nous lui avons indiqué que nous n’entretiendrions pas la polémique qui était née autour de cette vaccination, notamment à propos des adjuvants. Nous ne sommes pas des sociétés savantes et nous n’avions aucune légitimité à intervenir sur de tels sujets.
En revanche, nous avions à dire que se poserait un jour, en raison du choix qui avait été fait, la question de la vaccination des personnes âgées dépendantes, handicapées, et des personnes fragiles, immunodéprimées, qui sont à leur domicile mais intransportables. On nous a répondu encore une fois que l’on n’aurait aucun besoin de nous et que nous n’avions aucun souci à nous faire. En somme : de quoi nous mêlions-nous ? Nous avons rétorqué que si l’on n’avait pas besoin de nous pour le moment, il pourrait en aller différemment plus tard : le dispositif prévoyait en effet que des équipes mobiles pourraient se rendre au domicile des malades. Or, comment de telles équipes auraient-elles pu se constituer et être rapidement opérationnelles sans nous alors que nous savons, pour le vivre au quotidien, qu’une telle organisation n’est pas facile à mettre en place ? De même, nous avons mis en avant le fait que 62 000 infirmières libérales visitaient en moyenne 35 foyers par jour, ce qui correspond déjà à plus de 2 millions de personnes dépendantes. Certes, la priorité n’était pas de vacciner les personnes âgées ni les personnes dépendantes. Mais à un certain moment, elles devaient bien faire partie des gens à vacciner.
Les vaccinations se font sur prescription médicale, sauf la revaccination de la grippe saisonnière, mais il faut se rappeler qu’à l’époque, on projetait une vaccination en deux injections. Il nous paraissait donc cohérent de proposer nos services, même si l’on nous avait fait comprendre que l’on n’avait pas besoin de nous.
M. le président Jean-Christophe Lagarde. Au cours de ces discussions, a-t-il été question du coût de la vaccination ?
M. Philippe Tisserand. Il n’était pas question de coût, puisque l’on n’avait pas besoin de nous.
M. le président Jean-Christophe Lagarde. Avez-vous évoqué la question ?
M. Philippe Tisserand. Non. De toute façon, le coût est déterminé dans la convention. Nous avions également dit aux services de la ministre qu’il s’agissait d’une crise sanitaire, que nous ferions preuve de civisme et que notre vocation n’était pas d’être des « travailleurs saisonniers » : les infirmiers libéraux n’avaient pas l’intention de se faire de l’argent sur la vaccination antigrippale.
Que l’on nous ait dit que l’on n’avait pas besoin de nous, tant mieux après tout : nous avons assez de travail. Mais que l’on nous réquisitionne ensuite dans les conditions que nous craignions et que nous avions anticipées, à savoir l’après-midi pour le lendemain, imaginez un peu les conséquences : les infirmières libérales, associées à deux, ont quotidiennement voire biquotidiennement à visiter 80 malades, sous perfusion, sous chimiothérapie, dépendants, alités, avec des escarres, avec des nutritions parentérales, des dialyses péritonéales, etc. Une telle réquisition est inacceptable, surtout quand les représentants syndicaux se sont déplacés trois fois au cours de l’été, quitte à écourter leurs vacances, pour écouter les conseillers de la ministre fanfaronner et leur dire que l’on se passerait de nous.
M. le rapporteur. Ces trois réunions n’ont donc abouti à aucun résultat ?
M. Philippe Tisserand. Sinon que le même message a été passé, de la première à la dernière réunion – une en juillet, une en août et une en septembre, à laquelle je me suis d’ailleurs abstenu d’aller.
M. le président Jean-Christophe Lagarde. Est-ce qu’à votre connaissance un nombre significatif d’infirmiers libéraux a refusé d’être réquisitionné ?
M. Philippe Tisserand. Il y a eu des refus, même si je ne les ai pas quantifiés. En tant que président de la fédération nationale, je suis intervenu auprès de M. Guy Boudet, de la direction de l’hospitalisation et de l’organisation des soins : dans des cas précis, il n’était pas possible de réquisitionner – parfois sous la menace – des personnes ayant une obligation légale de continuité des soins, sauf à obliger des professionnels à n’avoir d’autre choix que de contrevenir à la loi.
M. Thierry Amouroux, secrétaire général du syndicat des personnels infirmiers. Nous avons, nous aussi, assisté à des réunions, qui n’ont débouché sur rien. On nous a réunis pour pouvoir dire qu’on nous avait réunis, mais on n’a absolument pas tenu compte de notre avis.
M. le rapporteur. Où avaient lieu ces réunions ?
M. Thierry Amouroux. Au cabinet de la ministre.
Nous avons immédiatement alerté les autorités sur le fait que la circulaire Hortefeux du 21 août allait à l’encontre de nos pratiques professionnelles. Celle-ci organisait en effet un fractionnement des tâches. Or, qu’une équipe soignante prépare les injections, puis qu’une deuxième injecte et enfin qu’une troisième équipe, administrative, assure la traçabilité à l’hôpital, constitue une faute professionnelle : la même personne doit préparer, injecter et noter ce qu’elle a fait.
Cette circulaire nous imposant des conditions d’exercice incompatibles avec notre déontologie, des infirmières salariées ont freiné des quatre fers, alors qu’elles étaient prêtes à aller vacciner pour répondre aux besoins de santé de la population.
Nous avons soulevé le problème au cours de plusieurs réunions. Chaque fois qu’il nous était signalé par une infirmière ou une étudiante en soins infirmiers, nous alertions la direction des affaires sanitaires et sociales pour qu’elle rappelle les bonnes pratiques professionnelles. Au mois d’octobre, le Haut conseil de la santé publique avait lui-même précisé que l’on ne pouvait pas fractionner les tâches. Mais, comme vous avez pu le constater vous-même, ces dysfonctionnements ont perduré dans les centres de vaccination.
La circulaire Hortefeux prévoyait par ailleurs que les personnes entreraient en file indienne dans les gymnases pour remplir un questionnaire proposé par un agent administratif et qu’en fonction des croix cochées, elles pourraient passer directement dans la file de vaccination, au rythme d’une personne toutes les deux minutes, sans avoir vu un médecin. Nous avons indiqué qu’en tant qu’infirmiers, nous ne vaccinerions pas quelqu’un qui n’aurait pas rencontré préalablement un médecin.
M. le président Jean-Christophe Lagarde. Vous êtes donc responsables de la réquisition des médecins ?
M. Thierry Amouroux. Nous nous sommes positionnés très clairement, par écrit, dès le mois de septembre.
M. le président Jean-Christophe Lagarde. Cela veut dire que, fin août, la présence des médecins n’était pas prévue ?
M. Thierry Amouroux. Cette présence était prévue. Mais seulement pour les personnes qui avaient coché certaines contre-indications.
Dans un pays évolué, au XXIe siècle, on ne peut pas piquer, comme en médecine vétérinaire, un « troupeau humain » au rythme d’une personne toutes les deux minutes. C’est incompatible avec les attentes de la population et explique qu’il était difficile de trouver des infirmiers qui acceptent de travailler dans de telles conditions.
Les réquisitions ont été faites n’importe comment et ont donné lieu à de nombreux dysfonctionnements, que nous avons signalés à l’époque. Par exemple, en raison des réquisitions des étudiants en soins infirmiers, des centres de formation ont été fermés pendant plusieurs semaines, ce qui a eu forcément une incidence sur la formation de ces professionnels.
M. le président Jean-Christophe Lagarde. Ce point a déjà été abordé. J’habite près d’une école d’infirmières et il m’a semblé que l’enseignement avait été considérablement désorganisé. Pourtant, le directeur de l’Assistance publique-Hôpitaux de Paris nous a dit que les réquisitions n’avaient pas eu de conséquences fâcheuses, les étudiants ayant finalement obtenu leurs examens, en plus grand nombre même que les autres années.
M. Thierry Amouroux. Certains ont bien eu leur bac en 1968…
Si l’on fixe un temps de formation précis, c’est qu’on estime que ce laps de temps est nécessaire pour former un professionnel. Remplacer des semaines de formation par une présence dans un gymnase, où l’on se livre à des pratiques contraires aux pratiques professionnelles, aura forcément un impact.
M. Martial Olivier-Koehret. Je tiens à répondre à la question de M. le rapporteur, qui est fondamentale. Dès avril-mai, le syndicat a mis en place, à titre individuel, une cellule de veille, alimentée par les médecins généralistes, pour fournir aux collègues les informations que le cabinet ministériel nous dispensait au cours de contacts réguliers. Puis, très rapidement, des réunions ont été organisées tous les quinze jours ou toutes les trois semaines entre les médecins libéraux et le cabinet. On ne peut donc pas prétendre qu’il n’y avait pas de transparence. Mais, comme on nous disait tout, on nous disait aussi des choses contradictoires d’une réunion à l’autre, ce qui ne facilitait pas l’organisation des choses. La communication n’était pas suffisamment rigoureuse pour qu’elle puisse produire ses effets.
Une autre question portait sur les 10 % de personnes qui ont accepté d’être vaccinées. Je remarque que s’il y avait eu 1 000 morts de la grippe – et 10 000 encore plus –, il y aurait eu beaucoup plus de candidats à la vaccination. Il faut se rappeler le contexte.
Dans le cadre de ces réunions régulières, auxquelles tous les services du ministère participaient, nous avons demandé qu’il y ait des réunions départementales. Certaines ont eu lieu entre avril-mai et juillet. Un certain nombre de comités départementaux de l’aide médicale d’urgence, de la permanence des soins et des transports sanitaires ont travaillé sur la mise à disposition des masques ou encore sur l’organisation des relations entre les professionnels et l’administration. Là où il y a eu anticipation et organisation, il n’y a pas eu de réquisitions. Mais là où il n’y a pas eu suffisamment de réunions locales, il y a eu des réquisitions, comme en Seine-saint-Denis et dans une dizaine de départements. De fait, lorsque nous sommes intervenus, nous avons pu mettre en place des dispositifs qui permettaient à l’administration de trouver des volontaires pour les centres de vaccination et de ne plus avoir besoin de réquisitionner.
M. le rapporteur. Tout le monde était-il convié à ces réunions ?
M. Martial Olivier-Koehret. Il s’agissait de réunions de médecins libéraux –regroupant unions régionales, syndicats et ordres – avec les différents services de l’État. MG France a demandé par deux fois que les médecins libéraux se réunissent avec les médecins hospitaliers ; nous nous étions d’ailleurs exprimés en ce sens avec ces derniers, avec François Aubart et les sociétés de pneumologie et d’anesthésie. Mais cela n’a pu se faire. De même n’a-t-il pas été possible de pousser la logique d’organisation qui avait prévalu jusqu’en juillet et qui aurait dû aboutir à ce que la ministre bascule, au moins pour partie, la vaccination sur les médecins généralistes, qui seraient intervenus en complémentarité des centres.
À l’époque, nous nous demandions en effet si nous serions capables, soit avec les infirmiers, soit en direct, d’assurer la totalité des vaccinations. Nous étions sûrement capables de vacciner nos patients, ceux que nous voyons régulièrement pour des pathologies ; sans doute aussi les personnes isolées en s’organisant en équipes de soins de ville avec les infirmiers. Mais le reste de la population ?...
Une logique d’organisation progressive a donc prévalu jusqu’en juillet dans les réunions successives où l’on nous a tout dit, y compris ce qu’on ne savait pas. La transparence peut rendre les choses difficiles et brouiller le discours public qui a besoin d’être cohérent, stable et répété pour être entendu de la population.
M. Guy Lefrand. Monsieur Michel Chassang, existe-t-il un compte rendu des réunions auxquelles vous participiez ?
M. le président Jean-Christophe Lagarde. Si vous le permettez, M. Chassang répondra lorsque nous aurons entendu M. Leicher, l’actuel président de MG France.
M. Claude Leicher, président de MG France. Pour l’honnêteté et la transparence des débats, il nous faut, les uns et les autres, nous replacer dans la situation dans laquelle nous étions le 26 avril, quand l’épidémie a été annoncée.
Pour ma part, j’ai pu analyser la situation à partir de quatre points de vue différents : en tant que l’un des vice-présidents nationaux de MG France à l’époque ; en tant que participant à l’organisation départementale dans la mesure où j’ai aidé la DASS de mon département à trouver les médecins ; en tant que médecin exerçant en maison de santé – nous sommes quatre médecins généralistes, et nous avons décidé que la moitié d’entre nous participerait à l’effort de vaccination collective en centres de vaccination ; et en tant que citoyen, avec deux petits-enfants de moins de six mois et une personne asthmatique dans la famille.
Je remarque d’abord qu’il n’y avait pas de consensus sur la réalité de cette épidémie au moment où elle a démarré. En avril, en mai et en juin, tout le monde s’est demandé ce qui se passait. On était à peu près sûrs qu’il y aurait une pandémie, mais on n’en connaissait pas le degré de gravité.
Au mois de juin, nous avons commencé à organiser des réunions départementales. Personnellement, j’ai organisé une réunion de mon secteur de garde. Le 15 juin, j’ai présenté le dispositif tel qu’il était, à savoir une déclinaison du dispositif aviaire. Les médecins, très dubitatifs, se demandaient pourquoi les consultations pour patients grippés ne seraient pas faites dans les cabinets de médecine générale, mais dans des centres dédiés. Heureusement, à partir du 20 juillet, on a admis qu’il s’agissait d’une grippe de gravité normale qui devait donc être prise en charge en ambulatoire.
L’incertitude régnait sur ce qui se passait. Nous nous interrogions : fallait-il vacciner toute la population, ou fallait-il ne vacciner que les personnes à risque ? Le sentiment des médecins généralistes, dans leur ensemble, était plutôt de vacciner essentiellement et d’abord les personnes à risque puis, éventuellement, s’il restait du temps et des vaccins, les autres.
S’il n’y avait pas de consensus sur la réalité, il n’y en avait pas non plus sur les procédures choisies. On a compris assez rapidement que les procédures n’étaient pas des procédures issues du ministère de la santé, mais du ministère de l’intérieur, ce qui était une erreur en termes de stratégie d’organisation. D’où cette dualité entre le discours qui nous était fait – on ne vous réquisitionnera pas parce que l’on n’a pas besoin de vous – et la réalité : un tiers des médecins qui ont été dans les centres de vaccination étaient des médecins libéraux.
Par ailleurs, il n’y avait pas de connaissance et pas de confiance dans le dispositif ambulatoire de la part de l’administration de la santé, qui ne possédait pas son sujet : elle ne savait pas qui elle pouvait réquisitionner, à quel moment, quelles étaient les personnes à protéger, etc.
Au niveau départemental, nous avions demandé que les secteurs de garde se rencontrent pour s’organiser. S’il fallait recommencer une opération comme celle-là, je suggérerais que ce soit au niveau des secteurs de garde de médecine de ville que l’organisation se fasse – quitte à les mutualiser dans certains endroits s’ils sont trop petits numériquement –, et que les médecins du secteur de garde s’organisent pour proposer une réponse à la fois en termes de prise en charge des patients malades et, éventuellement, de prise en charge de la vaccination.
J’exerce dans une maison de santé pluridisciplinaire, avec trois autres médecins, sept infirmiers et d’autres professionnels de santé. Nous aurions pu très facilement nous transformer en centre de vaccination rapproché avec une organisation, comme nous le faisons d’ailleurs tous les ans pour la vaccination de la grippe saisonnière, et avec un échange d’informations, ce qui n’est pas prévu dans le dispositif de vaccination de grippe classique. Nous avons demandé, mais nous ne l’avons pas obtenu, d’avoir un retour d’informations systématique pour mettre nos dossiers à jour. Quoi qu’il en soit, il existe ainsi des points d’accès libéraux, soit individuels soit de groupe, comme le sont les maisons de santé, qui sont susceptibles de répondre à un afflux même très important de demandes de soins ou de vaccination.
On peut expliquer le manque d’adhésion de la population par la perte de crédibilité de la parole publique comme de la parole médiatique : cette épidémie, d’abord annoncée comme potentiellement très grave, a ensuite été considérée comme n’étant pas grave, avant d’être jugée comme pouvant être grave et nécessitant une vaccination, sachant que, dans un second temps, il a été demandé de se faire vacciner par précaution parce qu’il pourrait y avoir un deuxième pic !
Ce manque de constance du discours public a traduit en fait un phénomène dont on ne parle pas beaucoup, à savoir la faillite de l’expertise. Les experts ont fait d’emblée une hypothèse maximaliste, qu’ils n’ont jamais remise en cause, et les politiques n’ont jamais pu adapter leurs mesures à la réalité du développement de l’épidémie. Marc Gentilini le dit très clairement : l’expertise scientifique doit conduire à examiner au moins deux ou trois hypothèses différentes concernant une pandémie afin que l’on puisse moduler le dispositif suivant le degré de gravité de cette dernière.
La grande qualité de notre système libéral est son adaptabilité. Nous pouvons voir dans une même journée vingt patients ou soixante. Nous pouvons coopérer avec les infirmiers et les pharmaciens. Une des premières mesures que nous avons demandées quand on nous a annoncé que les vaccinations seraient possibles en ville, c’était que le circuit de vaccination passe aussi par les pharmaciens et que le vaccin puisse être distribué à la population par les 26 000 pharmacies existant en France. C’était évidemment indispensable pour nous ; commencer à vacciner la population sans avoir accès au vaccin n’était pas cohérent.
M. le président Jean-Christophe Lagarde. Monsieur Chassang, comment se passaient les réunions en question ? Avez-vous des comptes rendus ? Pourquoi cette désorganisation, alors que vous aviez multiplié, tout au long de l’été, les réunions dans un certain nombre de départements : des médecins absents, des infirmiers remplacés par des pompiers, des horaires d’ouverture changeant du jour au lendemain, etc. ?
Notre objectif est de savoir comment faire la prochaine fois. Nous sommes conscients que si 50 millions de Français avaient voulu se faire vacciner, on en aurait été incapable, en tout cas selon cette procédure.
M. Michel Chassang. Il n’y a pas eu de comptes rendus officiels de ces réunions. Simplement, nous avions nous-mêmes – je parle de mon syndicat CSMF – élaboré en interne des comptes rendus officieux que nous avons publiés sur notre site. Ils sont naturellement à votre disposition.
Dans ces réunions, on ne discutait pas de l’essentiel, à savoir, comme nous l’avons dit et redit depuis l’origine, que l’exclusion des centres de proximité, en particulier les cabinets, constituait une erreur fondamentale qui conduirait à l’échec.
Il s’agissait de pures séances d’information sur la propagation du virus, sur la nécessité ou non du port de masques, sur la disponibilité du vaccin, sur son conditionnement, etc. Nous avons eu la désagréable surprise, à plusieurs reprises, d’apprendre que la ministre faisait des conférences de presse avant même l’organisation et la tenue de ces réunions, quand ce n’était pas de façon concomitante, à quelques minutes près. Cela laisse entrevoir combien la concertation était peu importante.
M. Thierry Amouroux. En effet.
M. le président Jean-Christophe Lagarde. J’ai quatre questions récurrentes depuis le début des auditions.
Premièrement, un médecin libéral est-il capable de regrouper par dix des patients pour les vacciner, dès lors qu’on lui donne la dose ou qu’il va la chercher quelque part ? On nous a déjà répondu par la négative, en avançant notamment des problèmes de conservation, ce qui me paraît assez surprenant.
Deuxièmement, pouvait-on envisager la vaccination dans un centre médical, de quatre médecins, par exemple ? Pourquoi une telle hypothèse a-t-elle été refusée ?
Troisièmement, j’ai lu dans la presse qu’il y aurait eu un problème lié au montant facturé au médecin par acte de vaccination : n’y aurait-il pas eu, tout simplement, derrière tout cela, un problème de gros sous ?
Depuis janvier, existent des doses individuelles qui, j’imagine, passent par le réseau pharmaceutique. On peut donc se faire vacciner dans le secteur libéral. Peut-on savoir combien d’actes auraient été facturés à 6 euros, au lieu des 22 euros habituels ?
M. Michel Chassang. L’impossibilité supposée, pour les praticiens, d’utiliser des flacons multidoses de dix doses, ne tient pas. Les praticiens ont, en moyenne, entre 20 et 30 patients par jour et il leur aurait été tout à fait facile d’organiser des séances de vaccination collective.
Cela dit, il existe deux types de vaccins : l’un dont la validité, une fois le flacon ouvert, n’est que de 24 heures, et un autre où elle est de huit jours.
M. le président Jean-Christophe Lagarde. Et s’agissant de ceux qui ont été livrés ?
M. Michel Chassang. Ils ne l’ont été qu’a posteriori, en tout cas à partir du mois de janvier.
M. le président Jean-Christophe Lagarde. Mais pas avant ?
M. Michel Chassang. Je ne peux pas répondre à la question.
M. le président Jean-Christophe Lagarde. Mais entre octobre-novembre et janvier ? Je vise les vaccins que vous utilisiez dans les centres. J’imagine que si ce n’était pas vous qui vacciniez, vous avez eu la curiosité d’aller regarder à quoi ils ressemblaient.
M. Michel Chassang. Il ne s’agissait pas d’obliger tous les cabinets à vacciner. Il s’agissait de laisser la possibilité à ceux qui s’en sentaient capables de le faire, en particulier aux cabinets de groupe où le problème se pose avec beaucoup moins d’acuité.
M. le président Jean-Christophe Lagarde. Vous voulez donc dire qu’à côté des centres de vaccination, les médecins du secteur libéral qui le souhaitaient seraient venus chercher des vaccins qu’ils auraient utilisés au gré des rendez-vous qu’ils fixaient ?
M. Michel Chassang. Nous avions proposé que les centres de vaccination interviennent en complément. Nous ne demandions pas l’exclusivité.
M. le rapporteur. Comment aller chercher ces flacons, alors que les centres avaient déjà du mal à les obtenir ? Un problème de logistique se posait.
M. le président Jean-Christophe Lagarde. Est-ce que les centres pouvaient servir justement de lieux de ressources ?
M. Michel Chassang. Au lieu de renforcer les centres, il aurait mieux valu diminuer leur activité.
M. le président Jean-Christophe Lagarde. Ce n’est pas ce que je veux dire. Est-ce que les médecins de ville auraient pu, concrètement, aller chercher leurs dix vaccins pour la journée, tout en conservant la traçabilité ?
M. Michel Chassang. Oui, nous l’avions proposé également. Nous aurions pu travailler avec les municipalités, s’agissant notamment de l’acheminement des vaccins et de l’approvisionnement des cabinets volontaires.
Quel était le prétexte du refus gouvernemental ? Une supposée suractivité des cabinets médicaux en période d’épidémie et la règle selon laquelle les patients grippés ne devaient pas fréquenter des patients non grippés : c’est ce qui se passe tous les jours !
M. le président Jean-Christophe Lagarde. On s’est sans doute conformé aux dispositions relatives à la grippe H5N1.
M. Michel Chassang. Une seconde raison invoquée était que les médecins amenés à soigner des patients extrêmement nombreux seraient incapables d’assumer les vaccinations.
Votre troisième question portait sur la facturation.
M. le rapporteur. Il y a eu une polémique à ce propos.
M. Michel Chassang. Certes. Mais je suis prêt à étudier le coût global du dispositif, pour qu’on puisse le comparer à ce qu’il aurait coûté, même à 22 ou 23 euros de l’époque.
La rémunération de 6,60 euros était réservée à un contexte bien précis, une modification de la nomenclature limitant cette cotation aux vaccinations de groupe. En clair, elle s’appliquait à une vaccination organisée dans le cabinet du médecin, et non pas à une vaccination qui se faisait à l’occasion d’une consultation.
Y a-t-il eu des facturations à 6,60 euros ? À ma connaissance, non.
M. le rapporteur. Les médecins auraient-ils tous été volontaires pour entrer dans le système ? À votre avis, quel pourcentage de cabinets aurait refusé de participer ?
M. Michel Chassang. Le conditionnement multidose était incontestablement un frein pour un certain nombre de cabinets, notamment ceux qui ont une faible activité. Mais j’estime que la moitié au moins d’entre eux était capable de vacciner ; ils auraient été volontaires si la possibilité leur en avait été donnée.
M. Martial Olivier-Koehret. Vous parlez des conditionnements de dix doses. Mais, jusqu’en septembre, il s’agissait de 50 doses. Ce n’est que progressivement que l’on a su qu’il y aurait des flacons à 10 doses, puis des flacons unidose.
M. le président Jean-Christophe Lagarde. Ce n’est pas ce qu’on nous a expliqué jusqu’à présent.
M. Martial Olivier-Koehret. Il faut se rappeler du contexte de l’époque où, au fur et à mesure, la donne changeait.
La vaccination n’est pas un acte anodin, il faut disposer d’un réfrigérateur, assurer la sécurité du circuit, sachant que, lorsque vous reconditionnez le vaccin, vous pouvez, sur un flacon de dix doses, en perdre une à chaque fois. Des calculs ont été faits et cet aspect précis constituait un frein.
On a dit dès le départ que ceux qui étaient volontaires devaient pouvoir participer. On a ainsi assisté à une polémique au sein de la profession, la moitié de celle-ci estimant qu’il ne fallait pas vacciner.
M. le président Jean-Christophe Lagarde. Je pense que c’est extérieur au problème de la Commission.
M. Martial Olivier-Koehret. De la Commission, mais pas de la grippe…
Enfin, il fallait un circuit pour mettre les vaccins à notre disposition. On aurait pu s’appuyer éventuellement sur les pharmaciens, car ceux qui sont allés les chercher dans les centres n’ont pu, pour la plupart, en avoir parce que ces derniers préféraient les garder.
M. le président Jean-Christophe Lagarde. Ce n’était pas une réticence : c’était une interdiction qu’on leur avait faite.
M. Martial Olivier-Koehret. Mais sans le dire publiquement.
M. le président Jean-Christophe Lagarde. De la même façon qu’on a toujours vacciné sans bons à certains endroits.
M. Martial Olivier-Koehret. C’est un autre point.
Les autorités européennes avaient demandé une pharmacovigilance extrêmement précise, puisque l’on s’attendait à des complications. Il fallait pouvoir suivre les vaccins, surtout avec les deux injections. Il fallait utiliser exactement le même vaccin, suivre les numéros de lots. La traçabilité était organisée par la Caisse nationale d’assurance maladie. Mais à partir du moment où vous demandez à cette dernière d’organiser un dispositif administratif, vous pouvez être sûr qu’il ne marchera pas ! Des cabinets recevaient ainsi des patients qui se plaignaient de ne pas avoir reçu leur bon, alors qu’ils en avaient besoin.
M. le président Jean-Christophe Lagarde. Nous entendrons les représentants de la Caisse nationale d’assurance maladie avec plaisir !
M. Martial Olivier-Koehret. Je n’ai pas entendu parler de facturation à 6 euros. C’était une question de communication. Il y avait une espèce de crainte à dire à la population qu’il y aurait un coût lié à la vaccination. Si, en tant que médecins libéraux, nous avons plus d’activité, il est normal que nous ayons plus de facturation. Cela ne pose pas de problème. Ce qui pose problème, c’est lorsque l’on reçoit des patients dans des conditions inhabituelles par rapport à notre pratique, si l’on ne fait pas d’examen, d’interrogatoire, s’il ne s’agit que de piquer à la chaîne. Cela nécessite alors de mettre en place un système complémentaire, en distinguant nos patients que l’on suit régulièrement, pour lesquels on a un dossier et dont on connaît les facteurs de risques, du reste de la population qui n’est pas malade, mais qui a juste besoin, à un moment donné, d’une vaccination, parce que tel est le choix du pays.
Enfin, en janvier, plus personne quasiment n’a été vacciné. L’épidémie était passée et n’intéressait plus personne. Elle ne faisait plus la une des magazines. La peur avait disparu.
M. le rapporteur. Conseilliez-vous aux patients de se faire vacciner ?
M. Martial Olivier-Koehret. On conseille toujours aux patients d’entrer dans les dispositifs de vaccination lorsque ces vaccinations sont disponibles. Lorsqu’ils posent la question de savoir s’il leur faudra recommencer l’année suivante, nous leur répondons toujours par l’affirmative car, sinon, on assisterait à une chute des vaccinations.
Mme Marie-Louise Fort. Vous avez procédé, dans le cadre de la médecine générale, à la vaccination habituelle de la grippe, qui a lieu tous les ans. Pensez-vous qu’il aurait été possible de procéder aux deux vaccinations en cas de besoin ? Cela n’aurait pas provoqué de dépenses supplémentaires pour la sécurité sociale.
M. le président Jean-Christophe Lagarde. Sauf que le vaccin n’était pas disponible.
M. Martial Olivier-Koehret. Non seulement il n’était pas disponible, mais il y avait une contre-indication à les faire en même temps.
M. le président Jean-Christophe Lagarde. Je me souviens qu’on indiquait, à l’époque, qu’il fallait trois semaines ou un mois de décalage entre les deux injections.
M. Philippe Tisserand. Si la campagne de vaccination de grippe saisonnière a été avancée c’est parce qu’une recommandation tendait à privilégier la vaccination pour la grippe saisonnière.
M. le président Jean-Christophe Lagarde. La campagne de publicité autour de la vaccination contre la grippe saisonnière a en effet été avancée début septembre, étant indiqué qu’il fallait un délai trois semaines entre les deux vaccinations.
Monsieur Philippe Gaertner, votre réseau de pharmacies aurait-il pu servir de relais ? Comment le dispositif aurait-il pu fonctionner ?
M. Philippe Gaertner, président de la Fédération des syndicats pharmaceutiques de France. Je voudrais revenir sur la première question que vous avez posée et sur la perception, par les pharmaciens, de cette réticence à se faire vacciner. Pourquoi n’a-t-on vacciné que 6 millions de personnes, vu du côté du comptoir ?
On a constaté, au mois de septembre, une certaine incompréhension chez nos clients, entre la vaccination saisonnière et la vaccination pandémique. La campagne de vaccination saisonnière a démarré plus tôt que l’année précédente, vers le 22 ou le 23 septembre – ce qui est la date habituelle de la campagne saisonnière. Pour nous, il ne fallait pas attendre, parce qu’on savait qu’on devrait revacciner avec le vaccin pandémique trois semaines après. Cela s’est fait un peu plus rapidement qu’habituellement pour que l’on puisse faire le deuxième vaccin derrière.
Je ne reviens pas sur la confusion des patients, qui se demandaient s’il fallait ou non se faire vacciner avec des vaccins adjuvantés. Ce fut très largement médiatisé et la question a suscité une forte inquiétude.
Au cours des réunions qui se sont tenues au ministère, ce dernier a mis en avant le fait que le risque de suractivité empêcherait une prise en charge de la vaccination pandémique, sans oublier les difficultés liées au flacon multidose. Telles sont les deux raisons officielles qui nous ont été fournies pour nous expliquer que les pharmaciens ne participeraient pas. Une troisième raison a été fournie au moins deux fois dans les réunions, mais j’ose espérer qu’elle n’a été prise au sérieux par les services de l’État : il n’y avait pas de réfrigérateurs dans les pharmacies !
M. le rapporteur. Qui gérait ces réunions ?
M. Philippe Gaertner. À la fois les services de l’État et le cabinet.
M. le président Jean-Christophe Lagarde. Vous avez eu le souvenir que quelqu’un vous ait dit cela ?
M. Philippe Gaertner. Bien sûr.
M. le président Jean-Christophe Lagarde. Mais qui ? Un représentant du ministère de la santé, du ministère de l’intérieur ?
M. Philippe Gaertner. Toutes nos réunions se sont tenues au ministère de la santé.
M. le président Jean-Christophe Lagarde. Après tout, si les représentants de l’État qui étaient présents appartenaient bien au ministère de la santé et pas à celui de l’intérieur, un sous-préfet aurait pu poser la question !
M. Philippe Gaertner. Nous les avons en tout cas rassurés sur ce point, en leur faisant remarquer qu’en tout état de cause, ce n’était pas une raison valable.
Le vaccin a été disponible à partir du début novembre, moment où la campagne de vaccination grand public a commencé. Pendant une semaine, les gens sont venus dans les officines, parfois deux fois par jour, pour obtenir ce vaccin pandémique. Voyant qu’ils ne l’obtiendraient pas chez nous et qu’ils devaient aller non pas chez leur médecin mais dans un centre, ils ont dit qu’ils n’iraient pas. Un centre de vaccination n’est pas l’endroit ou les Français que j’ai rencontrés dans mon officine ou qu’ont reçu mes confrères ont l’habitude d’aller pour se faire vacciner.
À mon sens, ce changement de système a été l’une des raisons majeures de la réticence de nos concitoyens. Je l’ai d’ailleurs signalé le 12 novembre, dans un communiqué de presse rédigé conjointement avec la CSMF, communiqué que je vous remettrai.
Notre syndicat a par ailleurs envoyé 28 circulaires à nos adhérents entre le mois de mai et aujourd’hui. On ne peut donc pas parler d’un manque de mobilisation des structures syndicales.
Mon point de vue de pharmacien est qu’à partir du moment où la chaîne pharmaceutique fonctionnait, les officines étant livrées entre deux et quatre fois par jour, on aurait pu s’adresser à ces dernières pour approvisionner les médecins généralistes.
J’ai moi-même essayé de me faire vacciner, ce qui était un peu compliqué compte tenu de mes fonctions nationales. Il me fallait aller dans le centre dédié, à huit kilomètres de mon officine, lequel n’était malheureusement ouvert que le mardi, de 9 heures à 12 heures 15 et de 14 heures 30 à 17 heures. De surcroît, les réunions au ministère, justement au sujet de la grippe, étaient nombreuses.
M. le rapporteur. Aujourd’hui, vous avez dans vos officines des doses vaccins.
M. Philippe Gaertner. De mémoire, nous en avons obtenu à partir du 28 janvier. Dans mon officine, il me semble que nous n’avons eu qu’une seule demande de flacon multiple, qui a été fournie à un médecin sur demande insistante d’un patient. Je peux vous dire que les neuf autres doses du flacon multidose n’ont pas été utilisées.
Enfin, de mon point de vue, la durée de validité des flacons aurait certainement permis, dans un cabinet libéral, d’assurer la vaccination dans le cadre classique.
M. Patrick Romestaing, président de la section Santé publique du Conseil national de l’Ordre des médecins. Ce pays, comme d’autres, a traversé des mois d’instabilité et d’informations contradictoires. Les choix de santé publique faits par les gouvernements en place ont été essentiels, même s’ils ont été difficiles à faire. On ne saurait les discuter.
Dans le contexte d’une annonce de pandémie qui s’annonçait très grave, quelle autre décision les politiques pouvaient prendre que de lancer une vaccination de l’ensemble de la population ? Mais il faut distinguer les choix de santé publique des choix politiques concernant l’organisation de la vaccination.
S’agissant des choix de santé publique, de par ma fonction au Conseil national, j’ai siégé dans toutes les réunions du Comité technique des vaccinations et j’ai entendu, comme témoin, les échanges entre toutes les personnes qui s’occupent de vaccination dans ce pays et, entre autres, de la vaccination contre la grippe A(H1N1). J’ai trouvé que ces débats étaient extrêmement sérieux, très documentés, et les interventions tout à fait pertinentes.
J’ai relayé ces débats au niveau du Conseil national en disant que, selon les experts, les vaccins étaient nécessaires et qu’ils ne présentaient aucune dangerosité, même avec des adjuvants.
C’est pour cette raison que le Conseil national, le 22 septembre – à l’époque peu de gens s’exprimaient en ce sens –, a diffusé un communiqué rappelant aux médecins qu’ils devaient être en situation de soigner dans le cadre d’une situation épidémique qui s’annonçait lourde, et qu’ils devaient être eux-mêmes vaccinés afin de ne pas contaminer leurs patients. On peut regretter que des voix, qui font parfois autorité dans le pays, se soient élevées pour dire que ce vaccin n’avait pas de raison d’être et que cette épidémie n’était pas dangereuse. On le sait maintenant. À l’époque, on ne le savait pas.
L’organisation constitue un autre aspect de la question, évidemment essentiel. L’ensemble des interventions a montré indiscutablement des dysfonctionnements. Ces dysfonctionnements ont été très variables. Il convient de signaler que, dans certains endroits, tout s’est bien passé. J’exerce dans le Rhône, qui n’est pas le département le moins peuplé de ce pays. Or il n’y a eu aucune réquisition de médecins généralistes ou spécialistes. Les centres ont parfaitement fonctionné avec des médecins volontaires du secteur libéral, du secteur salarié et hospitalier ; les internes, les assistants chefs de clinique se sont mobilisés.
M. le président Jean-Christophe Lagarde. Pourquoi cela a-t-il mieux fonctionné dans le Rhône qu’à d’autres endroits ? Et si le Rhône a été un exemple, autant en tirer profit.
M. Patrick Romestaing. Je ne sais pas si le Rhône est un exemple. Mais je crois qu’il est très important, dans ce type de situation, que les structures qui ont l’habitude de travailler ensemble partagent leurs informations. Ce fut le cas dans notre département, mais aussi dans beaucoup d’autres, entre le préfet, le directeur de la direction des affaires sanitaires et sociales, le représentant des organisations représentatives au sein des Unions régionales des médecins libéraux ou des conseils de l’Ordre. Ainsi, quand on a eu vent de réquisitions préfectorales, il m’a été facile, en tant que président d’Ordre, d’appeler le directeur de la direction des affaires sanitaires et sociales pour lui dire que la situation était suffisamment difficile pour les médecins en exercice libéral pour ne pas risquer de jeter de l’huile sur le feu et pour lui suggérer d’agir autrement. Le message a été entendu et il n’y a pas eu de réquisitions.
Les médecins en activité sur le terrain nous disaient qu’ils étaient débordés, qu’il leur était difficile de se déplacer pour aller chercher des vaccins quelque part et qu’ils ne pouvaient pas faire venir au cabinet des patients avec, dans la salle d’attente, d’autres patients atteints de grippe peut-être très contagieuse.
Par ailleurs, le conditionnement multidose n’était pas aussi simple que cela à gérer. Certains médecins ayant utilisé une dose du flacon multidose sur une journée, ils se sont demandés s’ils pouvaient continuer à utiliser ce dernier le lendemain, même en disposant d’un réfrigérateur.
Les médecins ont éprouvé également des difficultés pour se faire vacciner eux-mêmes dans les centres de vaccination – même si, à Lyon, les hôpitaux ont organisé en permanence des lieux dédiés de vaccination pour les personnels de santé, où l’on pouvait se rendre sans difficulté.
Tout cela explique qu’au-delà du message brouillé que l’on entendait dans les médias, les médecins eux-mêmes et l’ensemble des professionnels de santé se sont beaucoup interrogés sur la façon de procéder et même, pour certains, sur l’utilité d’une vaccination et sa dangerosité. D’où une certaine réticence de la part des professionnels de santé et, en fin de compte, un taux de vaccinés sur l’ensemble du pays qui n’est pas du tout en adéquation avec l’ensemble des moyens mis en place par le ministère.
M. le rapporteur. Avez-vous été convié aux réunions ministérielles de juillet, août et septembre ?
M. Patrick Romestaing. J’ai participé à toutes les réunions, sauf une, où Michel Legmann est allé en personne. Effectivement, c’était surtout des réunions d’information, mais on pouvait tout de même y prendre la parole et donner son avis. Pour ma part, j’ai appelé l’attention sur le peu d’investissement des personnels salariés non hospitaliers dans le fonctionnement des centres de vaccination. Mon propos a d’ailleurs été entendu et relayé sur le terrain.
M. le président Jean-Christophe Lagarde. De ce que j’entends aujourd’hui, l’Ordre et les syndicats ont une position très différente sur la question de savoir si l’on aurait dû pouvoir se faire vacciner chez les médecins libéraux.
M. Matthieu Piccoli, représentant des étudiants en médecine d’Île-de-France. Je suis étudiant hospitalier en cinquième année de médecine et j’ai été réquisitionné à plusieurs reprises.
S’agissant de l’échec de la campagne, j’ajouterai une raison qui n’a pas été mentionnée depuis le début de cette réunion, à savoir que c’était les patients qui prenaient la responsabilité finale de la vaccination. Ils devaient signer le bon de vaccination, ce qui ne se fait pas a priori pour toutes les vaccinations habituelles. À côté des laboratoires qui ne prenaient pas de risque en cas d’effets indésirables, les professionnels qui prescrivaient ou qui injectaient le vaccin étaient couverts par la réquisition. Le patient était un peu laissé seul dans sa décision de se faire vacciner.
À ceux que j’ai vaccinés, je demandais s’ils étaient allés voir auparavant leur médecin généraliste : dans quatre cas sur dix, ils y étaient allés pour lui demander si cette vaccination ne présentait pas de risques.
M. Grégory Murcier. Je précise que les internes officiaient sous l’autorité d’un médecin senior et qu’ils faisaient le contrôle des contre-indications. Les externes, comme M. Matthieu Piccoli, vaccinaient. Il faut dire que la quatrième année d’externat, une fois validée, donne une équivalence « infirmier », mais uniquement en cas de réquisition.
M. Matthieu Piccoli. L’organisation était tout de même beaucoup plus anarchique pour nous que pour les internes : ces derniers avaient la chance d’être gérés par le centre hospitalier régional universitaire. Nous, nous étions gérés directement par la direction régionale de l’action sanitaire et sociale. Or, en fait, ce sont les associations locales qui ont fait le travail des directions régionales des affaires sanitaires et sociales : à aucun moment nous n’avons reçu une seule circulaire d’information officielle, signée par la direction régionale des affaires sanitaires et sociales ou la préfecture, sur la réquisition, sur nos droits, sur nos devoirs, sur notre rôle d’ « agents vaccinateurs » ou sur les différences de protocoles avec ceux utilisés au quotidien à l’hôpital – partage des tâches ou utilisation des aiguilles. En effet, les seringues utilisées à l’hôpital ont des aiguilles que l’on peut enlever ; on prélève le produit dans le flacon avec une aiguille, qui perce l’opercule de sécurité, puis on change d’aiguille pour l’injecter dans le patient ; ce n’était pas possible sur les seringues qui ont été utilisées pendant toute la campagne de vaccination, malgré toutes les remarques qui ont été faites dès le début ; je ne dis pas que c’était dangereux, je ne dis pas qu’il aurait fallu faire autrement, je dis juste que l’on n’a eu aucune information à ce propos, alors que tous les comités locaux d’hygiène précisaient qu’il fallait faire autrement.
Sur place, nous avons rencontré des problèmes de gestion des stocks et de fourniture, les chefs de centre et les personnels administratifs n’étant pas formés à toutes les problématiques et n’ayant pas non plus connaissance des différents documents officiels – dispositions vaccinales, remboursement des frais de transports, rémunération des vaccinations... Nous sommes d’ailleurs très déçus de la prise en charge des frais de transport et de la rémunération.
M. le rapporteur. À combien se montait votre rémunération ?
M. Matthieu Piccoli. Théoriquement, elle aurait dû être 16,18 euros bruts par heure, à savoir 4,5 actes infirmiers.
M. le rapporteur. Avez-vous été indemnisé ?
M. Matthieu Piccoli. À l’heure actuelle, j’attends encore 80 % de ma rémunération. Mais je ne vais pas pleurer.
Mme Marie-Louise Fort. Toute peine mérite salaire !
M. Matthieu Piccoli. Croire que, parce que l’on va rémunérer les étudiants, ils vont être plus dociles, c’est un peu mépriser nos études, qui sont extrêmement difficiles. Penser que, sous prétexte que l’on va nous donner un peu d’argent, cela va nous calmer et que nous accepterons une formation un peu moins bonne que celle que l’on aurait dû avoir, c’est problématique.
M. le rapporteur. C’était sur la base du volontariat ?
M. Matthieu Piccoli. Non, nous avons reçu des coups de téléphone avec des menaces : on vous envoie la police, on sait où vous habitez ; vous vous exposez à des contraventions de catégorie IV si vous ne vous présentez pas. Parfois, ce n’était même pas la direction régionale des affaires sanitaires et sociales qui appelait, mais des sociétés privées qui étaient chargées de contacter les étudiants.
M. le président Jean-Christophe Lagarde. Des étudiants en médecine sont-ils disposés à témoigner par écrit du fait qu’ils auraient été contactés par des sociétés privées pour être réquisitionnés par l’État ?
M. Matthieu Piccoli. Oui.
M. le président Jean-Christophe Lagarde. Je vous demande de faire parvenir à l’Assemblée, à la présidence de la Commission d’enquête, des témoignages d’étudiants en médecine qui auraient été réquisitionnés, pour le compte de l’État, par des sociétés privées.
M. Matthieu Piccoli. Je dis qu’ils ont été contactés par téléphone, pas qu’ils ont été réquisitionnés…
M. le président Jean-Christophe Lagarde. Pour moi, c’est la même chose. Mais de quelles sociétés privées s’agissait-il ?
M. Matthieu Piccoli. C’est une très bonne question. En tout cas, ce n’étaient pas des gens de la direction régionale des affaires sanitaires et sociales.
M. le président Jean-Christophe Lagarde. À quel endroit ? Dans quels départements ? Quelles sociétés ?
M. Matthieu Piccoli. Nous allons essayer de trouver des étudiants qui accepteront de formuler un témoignage par écrit.
M. le président Jean-Christophe Lagarde. Et éventuellement d’indiquer de quelles sociétés privées il s’agissait, s’ils s’en souviennent.
M. Matthieu Piccoli. Le problème est qu’il n’y avait aucune trace écrite.
M. le président Jean-Christophe Lagarde. Si dix étudiants témoignent qu’ils ont été appelés par des sociétés privées, on peut se dire qu’il y a eu un problème.
M. Matthieu Piccoli. Une fois sur place, on n’a pas adapté les ressources humaines aux besoins réels des centres. Il faut savoir qu’il y avait 156 centres en Île-de-France et qu’environ 3 400 étudiants ont été mobilisés. Sur l’ensemble de la région, 300 étudiants ont été mobilisés par jour, alors qu’à certains moments, les centres étaient relativement vides.
M. le président Jean-Christophe Lagarde. A-t-on tenu compte de votre domicile ?
M. Matthieu Piccoli. Non. Les facultés de médecine parisiennes étaient affectées à un département : par exemple, la faculté de médecine de Paris V, Paris-Descartes, était affectée au département de Paris pour les étudiants en cinquième année, et au département de l’Essonne pour les départements en sixième année ; les étudiants de la faculté de médecine de Paris VI étaient affectés soit au département de la Seine-et-Marne, soit à la Seine-Saint-Denis, soit aux Hauts-de-Seine.
M. le président Jean-Christophe Lagarde. C’est assez logique, mais cela ne tient pas compte du domicile.
M. Matthieu Piccoli. Ni du domicile, ni du lieu de stage, ni de la proximité entre la faculté et les départements.
M. le président Jean-Christophe Lagarde. C’était assez logique, si ce n’est que cela ne tenait pas compte du domicile des étudiants.
M. Matthieu Piccoli. Ni de leur lieu de stage, non plus d’ailleurs que de la proximité des facultés avec les différents départements de la région.
M. le président Jean-Christophe Lagarde. Cela signifie qu’on n’a jamais établi une liste des étudiants en médecine des différentes facultés pour s’en servir comme fichier. Le problème a été traité université par université.
M. Grégory Murcier. Les directions régionales des affaires sanitaires et sociales manquaient totalement, je l’ai dit, d’organisation. Si on leur avait demandé en plus de connaître l’adresse personnelle des étudiants…
M. le président Jean-Christophe Lagarde. Lorsqu’on menace quelqu’un d’une contravention de quatrième classe, mieux vaut connaître son adresse !
M. Matthieu Piccoli. Au final, nous avons été heureux quand tout cela a été terminé. Il aurait été possible de beaucoup mieux anticiper, puisque la campagne de vaccination se préparait depuis longtemps, mais les responsables régionaux n’ont été contactés qu’à la mi-décembre. Et heureusement que l’épidémie n’a pas été grave ! Quasiment aucun étudiant réquisitionné n’a refusé d’aller vacciner, preuve de leur bonne volonté.
M. le président Jean-Christophe Lagarde. Ces réquisitions ont-elles eu des conséquences sur vos études ?
M. Matthieu Piccoli. À Paris, nous avons été mobilisés durant les semaines, parfois même les jours, qui précédaient nos examens. Et lorsqu’on faisait valoir qu’on était réquisitionné la veille ou le jour d’un examen, on nous répondait qu’aller vacciner était prioritaire sur tout autre élément.
M. le rapporteur. Pourriez-vous nous transmettre les dates de vos examens ?
M. Matthieu Piccoli. Tout à fait.
M. le président Jean-Christophe Lagarde. Les examens n’ont pas lieu partout à la même date ?
M. Matthieu Piccoli. Non. On aurait parfaitement pu adapter le dispositif en tenant compte des dates des examens dans chaque faculté.
M. le président Jean-Christophe Lagarde. Les examens auraient peut-être aussi pu être décalés…
Mme Chloé Loyez, présidente de l’Association nationale des étudiants en médecine de France. Il n’y avait aucune concertation avec nos responsables pédagogiques.
M. le président Jean-Christophe Lagarde. Les vaccins, eux, peuvent n’être pas livrés à la date prévue, mais la date des examens, elle, est intangible !
Mme Chloé Loyez. La situation a été particulièrement difficile en Île-de-France, mais je voudrais me placer d’un point de vue plus général, concernant l’ensemble du territoire.
Encore étudiants en médecine, loin d’être diplômés, nous étions plutôt comme des citoyens lambda face à cette grippe, n’ayant pas la connaissance du virus, de sa transmission ni des vaccins que peuvent avoir les médecins seniors. En tant que futurs professionnels de santé, les étudiants de cinquième et sixième années ont néanmoins été réquisitionnés pour vacciner, la validation de la quatrième année des études de médecine donnant équivalence pour assurer des soins infirmiers. Mais aucune information ni aucune formation sur cette grippe ni la gestion de la pandémie ne leur ont été données dans leurs CHU – non de la faute de ces derniers, mais par absence totale d’organisation. La seule information qui leur a été délivrée, tant sur cette grippe que sur les modalités de leur réquisition, a été celle que nous leur avons nous-mêmes transmise par le biais de nos représentants locaux, et c’est bien cette information-là qui a été la plus efficace.
Au niveau national, nous avons eu dès fin juillet des réunions avec le cabinet de la ministre de la santé mais ce ne sont pas les quelques réunions en conférence de presse avec la ministre qui ont été les plus efficientes. Nous avions un interlocuteur au sein du cabinet que nous rencontrions et avec qui nous avions des contacts réguliers. Les choses se passaient d’ailleurs plutôt bien avec lui. Nous étions informés, nous recevions les documents du Haut conseil de la santé publique. En revanche, du côté de l’administration de la santé, c’était la désorganisation totale. Les directions des affaires médicales, les directions régionales des affaires sanitaires et sociales, les préfectures, censées être en relation avec le ministère de la santé ou le ministère de l’intérieur, en savaient dix fois moins que nous, et même que les étudiants de deuxième ou troisième année, sur ce qui devait se faire.
Les étudiants recevaient des informations contradictoires, ce qui ne pouvait que nuire à la bonne marche du dispositif. Je veux pour exemple emblématique de la cacophonie qui régnait alors, la déclaration – qui nous est restée en travers de la gorge – de la ministre de l’enseignement supérieur et de la recherche, Mme Valérie Pécresse, annonçant triomphalement dans la presse fin novembre que les étudiants en médecine seraient mobilisés dans les centres de vaccination, sur la base du volontariat, sans percevoir aucune rémunération, et que cette expérience serait très bénéfique pour leur formation… alors que depuis le mois d’août, nous négociions avec le ministère de la santé la question de la rémunération et avions insisté auprès de nos interlocuteurs pour que notre formation initiale ne pâtisse pas des réquisitions. Mais il n’y avait aucune coordination des acteurs au niveau local – les directions régionales des affaires sanitaires et sociales et les préfectures agissaient chacune dans leur coin, sans prendre contact avec les représentants des étudiants, ni même les responsables pédagogiques ou les doyens. Il n’est pas étonnant dès lors que les choses se soient très mal passées dans certaines villes.
En fait, le même manque de communication constaté au sujet de la pandémie, a prévalu auprès des étudiants. Ceux-ci ne savaient pas quel serait leur rôle exact ni comment ils allaient être réquisitionnés. Nous, leurs représentants, le savions, et essayions de les tenir informés, mais nous ne disposions que de moyens « amateurs » pour ainsi dire. Les étudiants ignoraient s’ils seraient rémunérés mais, plus grave, car la rémunération passait vraiment au second plan pour eux, s’ils seraient couverts en cas de problème chez un patient qu’ils auraient vacciné.
M. le président Jean-Christophe Lagarde. Jusqu’à quand ne l’ont-ils pas su ?
Mme Chloé Loyez. Jusqu’au bout.
M. le président Jean-Christophe Lagarde. Il a été dit partout à l’ouverture des centres que la réquisition permettait précisément que vous soyez couverts.
Mme Chloé Loyez. Nous le savions, nous. Nous avons diffusé l’information auprès des étudiants – j’ai moi-même rédigé un livret d’explications à ce sujet. Le problème est que lorsqu’ils consultaient leur doyen, leur direction des affaires médicales ou leur chef de centre, on ne savait pas leur répondre. Et il est arrivé que la personne de la directions régionales des affaires sanitaires et sociales qui les appelait ne soit pas elle-même capable de leur répondre, et ce jusqu’au bout, hélas.
Les villes où les choses se sont bien passées, comme Reims, sont celles où il y a eu une concertation entre tous les acteurs, où les représentants des étudiants et les responsables pédagogiques ont vraiment été associés au dispositif et où il y a eu un réel effort de cohérence dans la communication.
M. le rapporteur. Dans quelle faculté étudiez-vous ?
Mme Chloé Loyez. Paris VI, mais j’ai suivi pendant des semaines ce qui se passait dans les 35 facultés de médecine.
Mme Marie-Louise Fort. Vous nous avez dit, monsieur, qu’on a fait endosser la responsabilité aux personnes qui se faisaient vacciner en leur faisant signer un document. Vous nous dites, madame, qu’en tant qu’étudiants en médecine de cinquième et sixième années ayant simplement une équivalence pour assurer des soins infirmiers, vous ne saviez pas trop sur quel pied danser mais, à ma connaissance, il y avait dans chaque centre des médecins diplômés, internes ou généralistes réquisitionnés. Vous vacciniez sous la responsabilité de l’État et de ces médecins. En fait, vous avez rempli le rôle d’infirmier vaccinateur sans avoir de responsabilité. Les centres se trouvaient placés sous la gestion médicale stricto sensu de deux médecins.
M. Matthieu Piccoli et Mme Valérie Loyez. Théoriquement.
M. le président Jean-Christophe Lagarde. J’ai vu des étudiants en médecine devoir continuer à vacciner en l’absence de deux des trois médecins et des deux infirmiers diplômés d’État censés être présents.
Mme Chloé Loyez. Le problème n’était pas que les étudiants n’étaient pas couverts, mais qu’ils n’arrivaient pas à obtenir de message clair. Le statut des externes stipule qu’ils exercent leurs fonctions d’étudiants hospitaliers dans un service hospitalier, sous la responsabilité d’un chef de service. Dès lors qu’ils sortaient de ce cadre, les étudiants se demandaient légitimement s’ils demeuraient sous la responsabilité de leur chef de service ou passaient sous celle du chef de centre. Et comme ni les directions des affaires médicales de leurs centres hospitaliers universitaires ni les directions régionales des affaires sanitaires et sociales ne savaient leur répondre, même si nos représentants locaux pouvaient, eux, les informer correctement, cela n’avait pas le même poids et ne suffisait pas à les rassurer, notamment sur leur couverture.
M. le président Jean-Christophe Lagarde. Qui exerçait l’autorité hiérarchique sur les étudiants dans les centres de vaccination ?
Mme Chloé Loyez. Le chef de centre.
M. le président Jean-Christophe Lagarde. Dans ma ville, le chef de centre, c’était le trésorier-comptable.
Mme Marie-Louise Fort. Pour avoir visité différents centres dans ma circonscription, j’ai constaté que les chefs de centre n’étaient souvent pas des médecins et qu’ils devaient toutefois veiller à ce que soient présents en permanence les médecins capables d’assurer la bonne marche des choses.
M. le président Jean-Christophe Lagarde. Mais si les étudiants qui vaccinaient rencontraient un problème médical, ce n’est pas au chef de centre qu’ils pouvaient en référer.
Mme Marie-Louise Fort. Il appartenait aux médecins d’intervenir.
M. Matthieu Piccoli. À la réserve près qu’au tout début de la campagne, quand l’organisation était encore très chaotique, des internes ont dû exercer la responsabilité de médecin référent de centre et des externes la fonction d’interne, en ayant par exemple à prescrire des vaccins, des doses et des voies d’injection.
M. Grégory Murcier. Il faut distinguer entre l’Île-de-France, où la situation a vraiment été extrêmement tendue à certains moments, et le reste du pays, où il y a eu aussi des difficultés, mais de manière beaucoup plus disparate. L’Île-de-France a été un point noir, où les difficultés n’avaient pas été du tout anticipées. Et en effet, dans certains endroits, les étudiants en médecine de cinquième et sixième années ont été amenés à faire des choses qu’ils n’avaient pas à faire, de même d’ailleurs que les internes.
M. le président Jean-Christophe Lagarde. Avez-vous une idée de la raison pour laquelle la situation a été si difficile en Île-de-France ?
M. le rapporteur. Dans ma ville, où il n’y a pas de faculté de médecine, nous n’avions pas d’internes seulement des stagiaires de l’hôpital local et des élèves de l’institut de formation en soins infirmiers, qui étaient d’ailleurs ravis de venir vacciner. Des médecins retraités, des médecins militaires, des médecins du travail venaient le soir remplir le rôle de surveillant médical. Il est vrai que les candidats à la vaccination signaient sous leur seule responsabilité, un formulaire dans lequel ils indiquaient s’ils étaient ou non sous anticoagulants, diabétiques ou non, asthmatiques ou non, allergiques à l’œuf ou non, et s’ils prenaient un traitement particulier.
M. Matthieu Piccoli. Ils confirmaient également par leur signature qu’ils souhaitaient se faire vacciner.
M. le président Jean-Christophe Lagarde. Cela, c’est normal. Mais on leur demandait par exemple non pas s’ils étaient allergiques à l’œuf, ce que chacun aurait pu comprendre, mais à l’ovo-albumine, dont le citoyen lambda, moi le premier, ne sait pas ce que c’est.
L’expérience vécue a été très différente selon les centres. J’ai néanmoins eu l’impression d’une souffrance générale des intervenants, même là où les choses ne se sont pas particulièrement mal passées.
On pourrait débattre longuement de la réquisition. Je ne dis pas qu’elle n’était pas nécessaire, je ne dis pas non plus que la vaccination aurait dû pouvoir se pratiquer aussi dans les cabinets libéraux, bien que ce soit là plutôt mon sentiment. Il ne me choque pas qu’on réquisitionne les médecins en cas de situation grave, dans la mesure où le pays les a formés et payés pour cela. La désorganisation qui a entouré ces réquisitions et entraîné une souffrance des acteurs est un autre sujet. Pour le reste, j’ai vu dans le centre de vaccination de ma ville une infirmière scolaire réquisitionnée tout faire pour éviter d’avoir à vacciner car elle ne savait plus le faire !
Pensez-vous que les étudiants en médecine sont assez sensibilisés, informés, formés en matière d’épidémiologie et de risques pandémiques pendant leur cursus ? La grippe semble une maladie familière mais on s’aperçoit en réalité qu’elle demeure une grande inconnue, y compris pour ceux chargés de gérer une épidémie.
Mme Chloé Loyez. Les facultés de médecine ont une large autonomie dans l’enseignement qu’elles dispensent. Elles ont des objectifs à remplir, mais elles s’organisent comme elles le souhaitent pour les atteindre. Certaines assurent peut-être un enseignement spécifique, mais dans l’ensemble ce n’est pas le cas. Cela ne fait l’objet que d’un cours de santé publique et d’infectiologie, parmi d’autres.
M. Grégory Murcier. Je me souviens très vaguement de quelques cours sur le sujet, ayant d’ailleurs obtenu ledit certificat en session de rattrapage seulement.
Puisque l’un des objectifs de cette commission d’enquête est de voir comment faire mieux la prochaine fois, je dirai qu’il faudrait mettre en place des centres de vaccination dans des lieux fixes, ouverts à horaires fixes, ne changeant pas tous les jours, et adaptés aux besoins de la population, ce qui n’est clairement pas le cas quand ils sont ouverts de 9 heures 30 à 11 heures et de 14 heures à 17 heures 30.
M. le président Jean-Christophe Lagarde. À la fin, les centres étaient ouverts quasiment jusqu’à minuit. Je me souviens qu’on voulait dans ma commune ouvrir le centre les 24 et 31 décembre de 8 heures à 22 heures, ce à quoi je me suis opposé. J’ai fait savoir au préfet que je fermais le gymnase car je trouvais cela ridicule.
M. Grégory Murcier. De 18 heures à 24 heures, nous étions rémunérés, ce qui était toujours mieux. Un autre intérêt est qu’on pouvait, avec ces horaires plus amples, toucher davantage de population.
L’une des leçons à tirer de cet épisode est que nous n’avons pas une administration capable de gérer une crise de santé publique. S’il y a des endroits où les choses se sont bien passées, dans beaucoup d’autres, les directions des affaires médicales ou encore les directions régionales des affaires sanitaires et sociales n’ont même pas été capables de réunir tous les intéressés en un même lieu pour établir un planning ! Il a fallu que j’explique au responsable des affaires médicales de mon centre hospitalier universitaire que le mieux était de convoquer l’ensemble des internes dans un amphi avec des représentants de la directions régionales des affaires sanitaires et sociales et de la direction des affaires médicales pour confectionner le planning du mois à venir. Personne n’y avait pensé avant !
M. le président Jean-Christophe Lagarde. Dans quel département ?
M. Grégory Murcier. La Loire. C’était à Saint-Étienne. Pour que les choses se passent bien, comme cela a été le cas à Lyon ou Clermont-Ferrand, il suffisait que le directions régionales des affaires sanitaires et sociales ou le directeur des affaires médicales ait un peu de jugeote. Mais certains étaient totalement débordés. Les situations étaient très disparates, alors qu’il suffirait de créer un modèle tout simple, prêt à être utilisé en cas de crise.
Mme Chloé Loyez. La désorganisation a été à son comble lorsque les étudiants ont commencé à être envoyés dans les centres. Les choses ne se sont bien passées que là où ce sont les étudiants qui ont établi eux-mêmes les plannings. Sinon, il est arrivé que des étudiants soient appelés à 22 heures pour aller vacciner le lendemain à 8 heures à l’autre bout du département, sans qu’on tienne compte ni de leur lieu de stage ni de leur lieu de résidence. Ils ne savaient pas si leurs frais de transport seraient pris en charge, ni parfois même comment se rendre dans ces lieux… Je ne parle même pas de la rémunération. Il est arrivé aussi qu’ils soient réquisitionnés des jours où ils devaient passer des examens ou leur évaluation de stage. Comme il n’y avait aucune communication avec nos centres hospitaliers universitaires et nos chefs de service, ceux-ci nous disaient de ne pas aller vacciner mais de venir passer nos examens ou notre évaluation !
M. le président Jean-Christophe Lagarde. M. Matthieu Piccoli nous a déjà expliqué tout cela, et nous l’avons bien compris. Y a-t-il des éléments nouveaux que vous souhaiteriez apporter ?
Mme Chloé Loyez. Je voudrais en venir à nos propositions, toutes simples, pour faire mieux si une nouvelle urgence sanitaire se présentait.
Il faudrait :
1° Mettre tous les acteurs de terrain autour d’une même table au même moment pour faire face ensemble aux difficultés et organiser la réponse ;
2° Mieux impliquer qu’aujourd’hui les étudiants dans l’information et la formation à la réponse aux urgences sanitaires ;
3° Les réquisitionner dans le respect des dispositions législatives et réglementaires régissant la réquisition : on leur avait dit qu’ils recevraient un ordre de réquisition signé du préfet, garantissant qu’ils étaient couverts et seraient rémunérés, mais dans la plupart des villes, ils ne l’ont pas reçu, tout s’étant fait dans la précipitation ;
4° Privilégier le volontariat et tenir compte des lieux de stage ou de résidence des étudiants dans leur affectation ;
5° Se donner les moyens d’évaluer efficacement les besoins sur le terrain et d’adapter en conséquence les moyens humains déployés : il y a en effet eu surréquisition, des étudiants ne comprenant pas pourquoi ils avaient dû quitter leur stage pour aller dans des centres de vaccination totalement vides ;
6° Prévoir une rémunération en fonction des compétences des étudiants, et cela en amont de leur réquisition, et non pas ultérieurement, dans la plus totale anarchie comme cela s’est fait ;
7° Assurer une prise en charge logistique, incluant frais de transports et frais éventuels de logement – il a fallu que certains étudiants logent sur place. Je pense notamment à ceux de la faculté de médecine de Caen qui ont été envoyés dans des centres très éloignés où ils sont parfois restés une semaine entière et ont dû trouver eux-mêmes à se loger sur place, en faisant appel aux communes ou autres collectivités.
Les étudiants en médecine étaient volontaires pour aller vacciner. Pleinement conscients de leur rôle en tant que futurs professionnels de santé, ils savaient pertinemment qu’ils pouvaient être appelés à la rescousse en cas de crise sanitaire. Déjà en responsabilité auprès de patients au cours de leurs stages, ils n’ignoraient ni leur rôle ni leurs devoirs. Ils n’étaient absolument pas de mauvaise volonté.
M. le président Jean-Christophe Lagarde. Mais ils n’ont eu ni l’information ni la formation qui auraient été nécessaires.
M. Matthieu Piccoli. Juste un mot pour expliquer pourquoi cela s’est particulièrement mal passé en Île-de-France. Tout d’abord, la région regroupe un sixième de la population française. Ensuite, c’était la préfecture qui décidait, la direction régionale des affaires sanitaires et sociales n’étant chargée que d’appliquer les décisions prises, sans aucune marge de manœuvre, alors qu’elle n’en avait pas vraiment les moyens. La direction régionale des affaires sanitaires et sociales, en dépit de sa bonne volonté, a été complètement dépassée.
M. le président Jean-Christophe Lagarde. Partout en France, les préfectures décidaient et les directions régionales des affaires sanitaires et sociales appliquaient les décisions. Ce n’est pas propre à l’Île-de-France.
M. Philippe Tisserand. Les élèves infirmiers ont manifesté le 17 décembre 2009 devant le ministère de la santé, à l’appel de leur président, M. Grégoire Cristofini. L’entretien que celui-ci a accordé à la revue dont je suis directeur de la publication, corrobore totalement ce que viennent de nous dire les représentants des étudiants en médecine. « Nous avons subi, nous déclarait-il, des pressions et des menaces inacceptables de la part des centres de vaccination et des DRASS. Nous devions vacciner sans respect des protocoles habituels de soins, avec notamment des aiguilles qu’il fallait « recapuchonner », alors que ce geste exposant les professionnels à des risques de piqûre accidentelle est strictement interdit », poursuivait-il.
Dès le premier jour de la campagne, des infirmières retraitées, notamment de l’Oise – je pourrais retrouver leur nom si cela vous intéresse – m’ont appelé pour me dire que, volontaires, elles s’étaient rendues dans les centres, mais qu’au vu de ce qui s’y passait, elles étaient reparties, refusant de vacciner dans de telles conditions. Elles exigeaient d’avoir à leur disposition des seringues avec des trocarts permettant de pomper le vaccin dans les flacons multidoses, dont les bouchons étaient d’ailleurs très durs. « Nous ne vaccinons pas des veaux », me disaient-elles, « il n’est pas dans notre culture professionnelle de piquer le patient avec la même aiguille que celle qui a transpercé un bouchon qui le sera dix fois. » Et les médecins généralistes présents étaient d’accord avec elles.
Par ailleurs, environ la moitié des élèves infirmiers en Île-de-France travaillent à l’extérieur pour financer leurs études. Vu les conditions et l’ampleur des réquisitions
– jusqu’à 40 heures –, certains ont perdu leur emploi. Les élèves infirmiers ont, au total, le sentiment d’avoir été utilisés pour accomplir une tâche dans des conditions ne correspondant pas à ce qu’on leur enseigne.
Nous, infirmiers libéraux, savions parfaitement que nous ne pourrions pas vacciner tout le monde mais avions proposé au ministère de la santé de vacciner les patients que nous visitons tous les jours. Il y avait certes au début le problème des flacons multidoses, mais des flacons unidose ont bien été disponibles par la suite ! Les arguments sur les conditions de conservation et d’acheminement des vaccins ou l’impératif de traçabilité, qu’on nous a opposés pour nous interdire de vacciner ces patients, ne m’ont pas convaincu. On pouvait penser que des personnels qui pratiquent quotidiennement des chimiothérapies à domicile dans le cadre de protocoles très lourds auraient été capables de faire un vaccin !
S’agissant du coût de l’opération, j’ai l’impression que les conseillers de la ministre de la santé ne savent pas bien compter. En effet, si les infirmiers libéraux avaient pu vacciner les patients chroniques ou dépendants qu’ils visitent à domicile, il n’y aurait pas eu de surcoût. Une vaccination sur prescription médicale est en effet facturée 3,20 euros et le déplacement 2 euros. C’est par ailleurs méconnaître totalement la nomenclature des actes infirmiers, dont la facturation est dégressive. Le premier acte chez un patient est facturé à taux plein, le deuxième à demi-tarif, et au-delà, ils ne le sont plus. Les infirmiers libéraux réalisent 400 millions de séances de soins par an auprès de personnes âgées dépendantes, facturées à la demi-heure et dont la facturation intègre tous les actes infirmiers, hormis les perfusions et les grands pansements. C’est dire qu’une vaccination pratiquée dans ce cadre n’aurait rien coûté de plus.
M. Thierry Amouroux. Nous n’étions pas inquiets quant à la gestion d’une crise sanitaire réelle. La canicule de 2003 a montré que les professionnels savent s’auto-organiser pour faire face à un pic d’activité. Cet été-là, ils ont travaillé bien au-delà de leurs horaires normaux, sans avoir besoin d’être réquisitionnés ni que la technostructure s’en mêle.
Dans le cas de cette pandémie, il y a eu deux phases. De fin avril à l’été, nul ne pouvait exclure que les conséquences de cette grippe soient très graves, et il était logique de commander autant de vaccins. Puis dès le début septembre, avec le recul par rapport à ce qui s’était passé dans l’hémisphère Sud, on savait qu’il fallait vacciner les personnes à risque, les femmes enceintes, les malades chroniques, les enfants qui, d’une manière générale, en raison de la proximité de leur vie sociale, sont plus exposés à la transmission des virus, mais il n’était plus évident qu’il faille vacciner l’ensemble de la population. C’est alors qu’est apparu un problème de sens. En France, les experts se fondaient sur une hypothèse maximaliste. Mais dans chaque pays, les ordres de priorité étaient différents et il n’y avait nulle part de certitude scientifique avérée. Lorsque seule une minorité de médecins et d’infirmiers se fait vacciner, cela ne peut guère avoir d’effet d’entraînement sur le reste de la population...
M. le président Jean-Christophe Lagarde. Qui, parmi vous, a été vacciné ?
(Plusieurs personnes auditionnées lèvent la main.)
M. Thierry Amouroux. Je ne le suis pas.
Mme Chloé Loyez. J’ai essayé de me faire vacciner, mais n’ai pas réussi.
M. Philippe Gaertner. Moi non plus.
M. Michel Chassang. Moi je l’ai été, avec un vaccin de contrebande, si j’ose dire.
M. le président Jean-Christophe Lagarde. Avez-vous fait vacciner vos enfants ?
M. Thierry Amouroux. Oui, c’étaient des personnes à risque.
M. le rapporteur. Pourquoi ne vous êtes-vous pas fait vacciner vous-même, si je puis me permettre de vous poser cette question ?
M. Thierry Amouroux. Je n’ai aucun facteur de risque particulier.
M. le rapporteur. Vous étiez entouré de personnes pouvant avoir cette grippe…
M. Thierry Amouroux. La grippe A(H1N1) est plus contagieuse que la grippe saisonnière, mais nettement moins grave. D’après les chiffres communiqués le 20 avril 2010 par l’Institut national de veille sanitaire, il y a eu 312 décès et 1 334 cas graves constatés depuis le début de l’épidémie, alors que la grippe saisonnière fait chaque année entre 2 000 et 4 000 morts.
M. Grégory Murcier. Il faut tout de même souligner que les personnes décédées de la grippe A(H1N1) étaient souvent des personnes en bonne santé, sans facteur de risque particulier.
M. Thierry Amouroux. J’ai d’ailleurs trouvé choquante la communication à ce sujet. L’administration disait que cette grippe était plus grave parce la moyenne d’âge des victimes n’était que de 39 ans, alors que d’ordinaire les victimes de la grippe saisonnière sont âgées de plus de 65 ans. Toute vie n’a-t-elle pas le même prix ?
M. le président Jean-Christophe Lagarde. Ce n’est pas ce qu’a dit M. Grégory Murcier.
M. Thierry Amouroux. Mais c’est ce qu’a dit l’Administration.
M. le président Jean-Christophe Lagarde. Tous les experts les plus éminents, quels qu’ils soient, nous ont dit que ce qui était surprenant c’était que des personnes en bonne santé n’ayant aucune raison de décéder d’une grippe saisonnière pouvaient décéder de la grippe A(H1N1). On dit souvent que la grippe saisonnière ne fait qu’accélérer la fin de vie de personnes âgées déjà fragilisées. On ne dispose pas d’assez de recul pour savoir qui parmi les quelque 300 personnes mortes de la grippe A(H1N1) en est décédé directement. En revanche, cette grippe aurait provoqué quelque 1 300 syndromes de détresse respiratoire aiguë contre une dizaine seulement pour la grippe saisonnière. Je ne sais pas si elle est plus grave ou moins grave que la saisonnière, elle l’est en tout cas assez pour qu’il ait paru nécessaire de se mobiliser…
M. Martial Olivier-Koehret. Il faut compter aussi avec le fait que sans avoir de signes cliniques, on pouvait transmettre le virus.
M. le président Jean-Christophe Lagarde. Il ne s’agit pas de porter de jugement de valeur sur qui s’est fait ou non vacciner. Mais vous paraît-il inconcevable que l’on puisse, en cas de crise sanitaire, imposer une vaccination à des professions spécifiques comme les professionnels de santé, les policiers, les gendarmes, les pompiers, particulièrement indispensables à ce moment-là au fonctionnement de la société, sans qu’elle le soit au reste de la population ?
M. Thierry Amouroux. À l’Assistance publique-Hôpitaux de Paris, le taux de vaccination a été de 18 % chez les infirmières et de 32 % chez les médecins.
M. le président Jean-Christophe Lagarde. Le directeur de l’Assistance publique-Hôpitaux de Paris, que nous avons déjà auditionné, nous l’a dit.
M. Grégory Murcier. Mais à Saint-Etienne, où il y a eu le premier mort de la grippe A(H1N1), le taux est monté à 90 % !
M. le président Jean-Christophe Lagarde. Le jour même où on a ouvert les centres de vaccination à la population générale, on a parlé de deux cas de syndrome de Guillain-Barré. Je le sais car c’est en allant me faire vacciner que j’ai entendu sur France Info parler pour la première fois de cette sinistre maladie…
M. Claude Leicher. Ce que je retiens, c’est qu’on a fait courir un risque à la population de par l’organisation des centres et les pratiques qui y ont eu lieu, que les procédures habituelles n’ont pas été respectées ou que certains personnels appelés, pour ne plus pratiquer de soins depuis longtemps, avaient perdu certaines habitudes. Nous avons été frappés du nombre d’appels que nous avons reçus de la part de médecins vaccinateurs incapables de répondre à des candidats à la vaccination ayant apporté leurs ordonnances. Lorsqu’un médecin a cessé d’exercer la médecine depuis quelques années, beaucoup de noms de médicaments ne lui disent plus rien ! Dans le cas de polypathologies complexes, certains avaient également des difficultés à discerner des contre-indications.
M. le président Jean-Christophe Lagarde. Je pense, pour ma part, qu’il était ridicule de réquisitionner, par exemple, des médecins du travail, extrêmement spécialisés dans un domaine très particulier.
M. Claude Leicher. On s’est aperçu que l’acte de vaccination que l’on croyait si simple ne l’était pas. Je n’hésite pas à dire qu’il a été, en l’espèce, galvaudé. Certains se sont étonné que les médecins généralistes demandent une consultation pour faire une vaccination, mais pour les vaccins, il y avait plus de trente indications différentes selon l’âge, les pathologies éventuelles, un état de grossesse ou non… C’est bien d’ailleurs pourquoi l’avis d’un médecin était obligatoire dans les centres et que la vaccination, d’une manière générale, comporte nécessairement une consultation, conformément aux procédures et à la loi. La vaccination contre la grippe saisonnière est comptée comme une consultation. Deux tiers des vaccinations habituelles contre la grippe saisonnière sont dites d’opportunité. L’assurance maladie ne prend en charge le vaccin que pour six millions de personnes à risques, alors que dix à onze millions de doses de vaccin sont délivrés chaque année dans les officines. Au-delà des strictes populations cibles, nous vaccinons aussi des mères avec de jeunes enfants, beaucoup d’enseignants et de professionnels de santé, non pas parce qu’ils présentent un facteur de risque mais parce qu’ils ne veulent pas transmettre la maladie ou ne peuvent pas se permettre d’être malades.
Cette campagne de vaccination a, hélas, été dominée par la peur : peur de ne pas faire assez, peur que les gens ne soient pas vaccinés assez tôt, peur de ne pas cibler les bonnes personnes… La canicule de 2003 a, à l’évidence, laissé des traces indélébiles. Or, les véritables leçons de cette canicule n’ont toujours pas été tirées. Personne ne sait par exemple que nous avons perfusé plusieurs dizaines de milliers de patients à domicile dès juin 2003 et que les ventes de solutés de perfusion en officine ont explosé dès ce mois-là…
Que proposer donc ? Tout comme en médecine de catastrophe, on n’expérimente jamais un dispositif nouveau, il faudrait, dans un cas comme celui de la grippe A(H1N1), s’appuyer sur des dispositifs éprouvés, dont les professionnels ont l’habitude. Le médecin traitant tel que défini dans la loi de 2004 doit être le pivot autour duquel articuler les campagnes de santé publique et les dispositifs nécessaires, susceptibles de monter en puissance en fonction de la gravité avérée. L’administration de la santé commence à le comprendre en matière de dépistage et de prévention, pas assez hélas puisque chaque fois qu’on organise un dépistage, on invente en même temps une administration pour cette campagne, ce qui coûte cher à l’État tout en étant bien souvent redondant sans toucher davantage de population.
Dès le mois de juin, en tout cas dans mon secteur de garde, les généralistes avaient compris que la grippe A(H1N1) était à la fois très contagieuse et atypique – les lésions pulmonaires observées n’étaient pas habituelles. D’où la nécessité de prendre des précautions particulières.
Une autre proposition est que des vaccinations dites d’opportunité puissent aussi avoir lieu, comme c’est souvent le cas pour la grippe saisonnière.
Ce qui caractérise l’organisation de la médecine libérale, c’est sa souplesse, son adaptabilité. Il est tout à fait possible d’envisager, dans un contexte particulier, de passer un contrat particulier avec les praticiens.
Et surtout, il faudrait être attentif à l’organisation territoriale pour garantir un égal accès de tous à la vaccination. Les secteurs de garde, lesquels, même s’ils demeurent perfectibles, présentent l’avantage d’exister déjà et de fonctionner, peuvent être la base territoriale de l’organisation de la médecine virale. Parlant de secteur de garde, je ne pense pas seulement aux généralistes, mais aussi aux pharmaciens, aux infirmiers, aux kinésithérapeutes… Il y a là un socle sur lequel se fonder si besoin. Notre souci était de protéger l’hôpital. Nous ne voulions pas que les services d’urgence, les SAMU et le 15 soient encombrés par des cas n’ayant rien à y faire. J’appelle d’ailleurs votre attention sur le fait que nous réclamons depuis des années un numéro de téléphone distinct pour la permanence des soins et l’aide médicale d’urgence, que nous n’obtenons pas du fait de la pression exercée par les hospitaliers, ce qui est, à mon avis, un mauvais calcul de leur part.
L’organisation et le rodage préalables de notre système de santé sont une condition indispensable de succès de tout dispositif mis en place en cas de pandémie. Chacun doit savoir d’avance ce qu’il doit faire et ne pas faire, notamment ne pas se précipiter aux urgences hospitalières. Si le système n’est pas ainsi préalablement « huilé », tout dispositif, aussi parfait soit-il en théorie, échouera en pratique.
M. Martial Olivier-Koehret. La connaissance de l’épidémie était fonction des données recueillies. On a constaté dans l’hémisphère Sud que l’épidémie avait avorté très vite par rapport à ce qui était annoncé. L’Institut national de veille sanitaire ou les groupes régionaux d’observation de la grippe annonçaient ici une explosion de cas, qui n’a pas eu lieu, comme l’a confirmé le dispositif de recueil hebdomadaire volontaire que nous avions mis en place chez les généralistes à partir de juillet. Cette distorsion entre ce qui était annoncé et ce qui a été constaté a aussi contribué à affaiblir la valeur du discours public. Il y a besoin d’un recueil professionnel organisé à partir des observations des professionnels.
M. le rapporteur. Par « recueil professionnel », vous entendez le réseau Sentinelles ?
M. Martial Olivier-Koehret. Une explosion de cas avait été annoncée, que nous ne constations pas d’après notre propre dispositif de recueil de données.
M. le rapporteur. Vous mettez en cause le réseau Sentinelles ?
M. Martial Olivier-Koehret. Je mets en cause la gestion de la situation par l’Institut national de veille sanitaire et les groupes régionaux d’observation de la grippe. Reportez-vous aux déclarations de l’époque, ils avaient annoncé une explosion de l’épidémie, qui ne s’est pas produite. Cela a contribué à vider les centres de vaccination.
M. le rapporteur. Vous mettez également en doute le nombre de consultations hebdomadaires pour syndrome grippal ?
M. Martial Olivier-Koehret. Plus exactement, les extrapolations qui en ont été faites. Les prévisions ne se sont pas avérées, même si nous avons constaté une augmentation d’activité.
M. Michel Chassang. De 10 %.
M. Martial Olivier-Koehret. Cela n’a rien d’exceptionnel.
J’en viens à la réquisition, sans même parler de ce qui s’est passé dans un département comme la Seine-Saint-Denis où elle palliait une désorganisation et une absence totale d’anticipation des moyens locaux, mais comme mode d’assurance de la responsabilité des professionnels et vecteur de leur rémunération, puisque c’est ainsi que les choses nous ont été présentées.
Les dispositifs d’exception sont sujets à dysfonctionnement. D’une manière générale, mieux vaut s’appuyer sur le réseau existant – médecins généralistes, pharmaciens, infirmiers libéraux… –, qui, en l’espèce, a bien fonctionné. Le problème tenait sans doute au mode d’exercice libéral. Il faut donc définir dans le cadre de notre activité libérale un mandat de santé publique par lequel nous puissions passer des soins dispensés à nos seuls patients à des soins à l’ensemble de la population, avec un autre mode d’exercice, une autre organisation et une autre répartition des responsabilités. Ce mandat explicite de santé publique, pour être accepté par les professionnels, devrait avoir fait l’objet d’une négociation. Cette proposition rejoint celles de l’Office parlementaire d’évaluation des choix scientifiques et technologiques.
M. le président Jean-Christophe Lagarde. L’État qui a formé plusieurs dizaines de milliers d’infirmiers et de médecins doit pouvoir leur imposer des obligations en cas de problème majeur de santé publique. Vous auriez souhaité que les médecins généralistes volontaires soient associés à la campagne de vaccination. Mais on pourrait imaginer aussi que cela ne se fasse pas seulement sur la base du volontariat….
M. Michel Chassang. Oui, mais dans les cabinets.
M. le président Jean-Christophe Lagarde. Je ne voudrais pas qu’on me dise un jour que les médecins ne veulent pas d’une telle option. Je profite donc du fait que nous vous auditionnions pour mettre les choses parfaitement au clair.
M. Martial Olivier-Koehret. Il faudrait que cela ait été clairement expliqué et négocié.
M. le président Jean-Christophe Lagarde. Que vous receviez à un moment mission de service public pour faire face à une urgence sanitaire ne me choque pas.
M. Martial Olivier-Koehret. Nous avons déjà, de fait, un mandat de santé publique dans notre activité.
M. le président Jean-Christophe Lagarde. La structure existante doit demeurer libérale dans les conditions d’activité normale mais aussi pouvoir être organisée différemment, selon un protocole précis, en matière de santé publique.
M. Claude Leicher. Il faudrait un contrat.
M. le président Jean-Christophe Lagarde. Lequel n’existe pas aujourd’hui.
M. Martial Olivier-Koehret. Pour nous occuper de l’ensemble de la population, et non plus de nos seuls patients, il faut que des règles soient clairement définies. Dans les transports, il arrive fréquemment qu’en cas de problème de santé d’un voyageur, on demande s’il y a un médecin à bord. S’il y en a un, il doit intervenir et il intervient.
M. le président Jean-Christophe Lagarde. C’est là un problème individuel de déontologie. Aux termes du serment d’Hippocrate que vous avez prêté, vous devez assister tout malade. En cas de crise sanitaire, la logique est un peu différente. Une obligation vous serait faite, comme il en existe déjà pour les gardes.
M. Martial Olivier-Koehret. Il faut ici dire que l’ÉPRUS n’a pas fonctionné lors de cette pandémie.
M. Michel Chassang. Il faut, d’une manière générale, que notre système de santé mette beaucoup plus l’accent sur la prévention. Aujourd’hui, en matière de prévention et de santé publique, au lieu d’utiliser les réseaux de proximité, comme les médecins de famille, les pédiatres… on a tendance à utiliser des circuits parallèles. Ce qui s’est passé pour la grippe A est l’exemple même de ce qu’il ne faut pas faire. Il faudrait au contraire faire appel aux réseaux de proximité, en prévoyant une diversification des modes de rémunération mais aussi des lignes budgétaires spécifiques au sein de l’ONDAM, avec des crédits alloués à la prévention plus importants qu’aujourd’hui.
M. le rapporteur. J’en suis tout à fait d’accord. Des pays comme la Suède ou l’Allemagne sont en avance sur nous et ont une véritable culture en matière de prévention.
M. Michel Chassang. Il n’y a d’ailleurs pas eu de problème autour de la grippe A dans ces pays.
M. Patrick Romestaing. Une remarque, si vous le permettez, monsieur le président. Les médecins du travail sont des médecins comme les autres et je ne suis pas d’accord avec vous. Un centre de vaccination n’est pas un centre de chirurgie cardiaque ou de neuro-chirurgie. Assurer une présence, repérer des contre-indications et répondre aux questions éventuelles des candidats à la vaccination, tout médecin, muni d’un minimum de documentation, peut le faire.
Je voudrais revenir sur un point abordé par Claude Leicher, même si cela déborde un peu du sujet, car c’est une question récurrente. Nous nous battons depuis longtemps afin d’obtenir un numéro unique pour les urgences. Le 15 est en effet toujours encombré. Nous avons à Lyon un numéro spécial médecine libérale/professionnels de santé à dix chiffres, qui bien entendu soutient difficilement la concurrence face à un numéro à deux chiffres ! Et quand une personne compose ce numéro, situé au même endroit que le 15, pour des raisons de sécurité, au bout de vingt secondes, l’appel est rerouté vers le 15, à la grande surprise d’ailleurs de celui qui appelle. J’insiste sur cette demande d’un numéro spécifique.
Pour le reste, chacun l’aura compris, mieux vaut, en cas de crise, partir de l’existant que d’ajouter un nouvel élément à un ensemble déjà complexe. Ainsi pourrait-on peut-être s’appuyer sur les CODAMU, les comités départementaux d’aide médicale urgente, qui gèrent la permanence des soins pour l’ensemble des professionnels de santé sur le territoire et où tous les acteurs sont représentés – médecins libéraux et hospitaliers, infirmiers, transports sanitaires… – pour coordonner l’action en cas de nouvelle pandémie du type grippe A. Il faudrait simplement veiller à y associer les chefs de clinique, les internes et les étudiants en médecine.
Mme Chloé Loyez. L’ÉPRUS n’a pas fonctionné, nous en sommes d’accord. Vous semblez, monsieur, lui en faire le reproche. Or, pour travailler régulièrement avec l’établissement depuis sa création et l’aider à recruter étudiants en médecine, en soins infirmiers, en pharmacie, en kinésithérapie, en écoles de sages-femmes, pour la réserve sanitaire de renfort, je dois dire que l’ÉPRUS, s’il semble avoir des moyens financiers suffisants, ne dispose pas des moyens humains nécessaires. Personne n’y est délégué pour communiquer auprès des étudiants, des responsables pédagogiques ni des doyens. Rien n’est prévu pour que l’engagement d’un étudiant à l’ÉPRUS constitue un plus dans son cursus, et pas seulement une contrainte pour lui. Les étudiants qui faisaient partie de la réserve sanitaire de renfort de l’établissement étaient les derniers à être envoyés dans les centres de vaccination, au motif qu’ils devaient rester mobilisables au cas où les services d’urgence auraient été débordés.
M. le président Jean-Christophe Lagarde. Je vous invite à poursuivre à l’issue de l’audition cette discussion avec notre rapporteur, qui a rapporté la loi ayant créé l’ÉPRUS.
M. le rapporteur. L’ÉPRUS, tout nouveau, est encore en rodage. Le hasard a voulu qu’il ait à faire face à une première expérience grandeur nature avec la grippe H1N1.
Mme Chloé Loyez. Je ne fais aucun reproche à l’ÉPRUS. Je dis au contraire que cet établissement devrait avoir beaucoup plus de moyens humains.
M. Philippe Gaertner. Un mot sur deux aspects qui ont concerné plus particulièrement les pharmaciens. Tout d’abord, le Tamiflu avec l’arrivée le 21 décembre – on peut d’ailleurs se demander pourquoi seulement à cette date-là – du stock d’État, alors que la diminution du nombre de cas était alors déjà avérée. L’arrêté « pandémie » sur le Tamiflu n’a d’ailleurs toujours pas été levé, ce qui laisse perplexe sur le suivi. Les officines fonctionnent toujours avec les stocks d’État, qui arrivent à péremption en mai 2010.
Enfin, j’ai déjà interpellé deux fois la Direction générale de la santé (DGS) en réunion sur l’organisation des gardes pour les pharmacies d’officine, puis de nouveau par écrit en proposant des astreintes. J’attends encore à ce jour sa réponse.
M. le président Jean-Christophe Lagarde. En Seine-Saint-Denis, les gardes de pharmacie ne sont tout simplement plus assurées. J’ai interpellé à plusieurs reprises le préfet, l’Ordre des pharmaciens…
M. Philippe Gaertner. Ce sont les syndicats qui ont l’obligation de s’occuper des gardes. Et rassurez-vous, dans nombre de départements, le système fonctionne parfaitement.
M. le président Jean-Christophe Lagarde. Ce qui se passe dans le mien est un vrai scandale de santé publique. Les pharmacies n’assurent plus les gardes, au prétexte qu’il y en a une ouverte 24 heures sur 24, Porte de Montreuil. Mais comment fait une mère seule qui a besoin d’un médicament pour son enfant à 2 heures du matin si elle n’a pas de véhicule ? Mais je m’arrête là, car cela n’a rien à voir avec le sujet de cette commission d’enquête.
Il me reste, madame, messieurs, à vous remercier.
La séance est levée à vingt heures cinq.
Audition de M. Jacques Berger,
directeur général délégué de Sanofi Pasteur
(Procès-verbal de la séance du mercredi 28 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt.
(M. Jacques Berger prête serment.)
M. Jacques Berger. Je vous remercie de me donner l’opportunité de présenter, comme j’ai eu l’occasion de le faire il y a quelques jours devant la commission du Sénat, ce que Sanofi Pasteur a réalisé dans le cadre de cette pandémie, et l’esprit dans lequel il l’a fait.
Nous sommes des industriels, des producteurs de vaccins dont le métier est d’être prêt à répondre à des besoins de santé publique. Dans le cas d’une éventuelle pandémie, cela signifie être capable de fournir le plus rapidement possible le plus de doses possible d’un vaccin satisfaisant aux exigences réglementaires, efficace et bien toléré – un tel vaccin étant considéré par l’ensemble de la communauté scientifique comme la solution la plus efficiente pour enrayer la progression d’une pandémie.
Le groupe Sanofi Aventis est l’un des leaders mondiaux dans le secteur de la santé. Il emploie 100 000 personnes dans le monde, dont 26 000 en France. Sanofi Pasteur, sa division vaccins, qui est lui-même l’un des leaders mondiaux dans ce domaine, développe, produit et distribue chaque année 1,6 milliard de doses dans plus de 150 pays. Il emploie 12 000 personnes dans le monde, dont près de 6 000 en France.
À partir de deux de ses sites, l’un en France à Val-de-Reuil, l’autre aux États-Unis, Sanofi Pasteur couvre environ 40 % des besoins mondiaux en vaccins contre la grippe saisonnière, ce qui le place au premier rang des producteurs mondiaux.
Sensibilisé par la situation que le monde a connue avec le SRAS (syndrome respiratoire aigu sévère), puis avec le H5N1 en 2004, Sanofi Pasteur, comme quelques autres producteurs, s’est mobilisé pour se préparer à une éventuelle pandémie de grippe. Tous les efforts que nous avons déployés depuis cette période ont été orientés dans ce sens.
Sur le plan industriel, nous avons adapté et augmenté nos unités de production, fabriqué des lots pilotes puis des lots à grande échelle, optimisé nos processus de production. S’agissant du développement, nous avons fait porter nos efforts sur l’amélioration de la productivité des souches, la diminution de la quantité d’antigène nécessaire, la réalisation de lots cliniques et les études cliniques correspondantes.
Parallèlement, nous avons eu des discussions avec les autorités réglementaires pour réfléchir avec elles aux voies d’obtention des autorisations de mise sur le marché les plus adaptées à cette situation potentielle.
Enfin, nous avons mis en place, dans l’ensemble de Sanofi Pasteur, un « plan de continuité » afin d’assurer au mieux, même en situation de pandémie, la poursuite de notre activité – non seulement la production du vaccin contre la grippe pandémique, mais aussi celle de tous les autres vaccins.
Ce processus de préparation s’est bien entendu déroulé en étroite collaboration avec la communauté scientifique et avec les autorités de santé publique – OMS, autorités réglementaires telles que la Food and Drug Administration (FDA) et l’Agence européenne du médicament (EMEA), autorités de santé de pays très impliqués dans la préparation à une éventuelle pandémie.
À partir de la fin d’avril 2009, c’est-à-dire après l’apparition des premiers cas au Mexique et la décision de l’OMS, le 25 avril, de déclarer « une urgence de santé publique de portée internationale », Sanofi Pasteur a décidé de mettre en place un mode de fonctionnement spécifique pour mieux répondre à cette situation de risque pandémique.
Trois équipes de crise ont alors été constituées : une équipe aux États-Unis, pour coordonner les efforts déployés à partir de nos unités en Amérique du Nord ; une équipe en France, pour coordonner les actions entreprises à partir du site de Val-de-Reuil ; une équipe globale pour assurer la cohérence de nos actions et optimiser le partage d’expériences entre les équipes française et américaine.
Dès le mois de mai 2009, sur la base des informations disponibles, nous avons décidé d’appliquer trois grands principes, qui ont ensuite servi de schéma directeur à l’ensemble de notre action : un principe de santé publique ; un principe de responsabilité ; un principe de transparence et de dialogue.
Une pandémie est avant tout un énorme défi de santé publique. Lorsque la pandémie est apparue au Mexique, le défi était pour nous de poursuivre la production du vaccin contre la grippe saisonnière, puisque nous assurions 40 % des besoins mondiaux, tout en développant et produisant deux formes de vaccin contre la grippe A(H1N1), l’un avec adjuvant et l’autre sans, de façon à répondre aux besoins exprimés par certaines autorités de santé.
L’application du principe de responsabilité nous a amenés à refuser de « sur-promettre », en termes de quantité comme en termes de délais, à avoir une attitude raisonnable et cohérente en matière de prix, et à porter une attention particulière aux pays les plus pauvres, laquelle s’est traduite en particulier par une donation de 100 millions de doses via l’OMS.
Enfin, nous avons décidé d’appliquer le principe de transparence et de dialogue dans toutes nos interactions avec les autorités de santé, en veillant à rester strictement dans notre rôle et dans notre compétence de producteur de vaccins.
C’est sur la base de ces principes que nos processus de production, nos démarches réglementaires et nos programmes d’études cliniques ont été lancés. Ces actions ont été entreprises conformément aux bonnes règles pharmaceutiques, en utilisant l’expérience acquise depuis de nombreuses années dans la production de vaccins contre la grippe et les enseignements apportés depuis 2004 par notre plan de préparation à une éventuelle pandémie.
Durant toute cette période, nos contacts avec les différentes autorités de santé publique ont été renforcés afin d’assurer la cohérence des actions menées.
Le processus de production lui-même n’a pu démarrer que début juin 2009, une fois la souche reçue de l’OMS et après son adaptation à l’environnement industriel.
En France, nous avons alors décidé d’interrompre brièvement notre production de vaccin saisonnier destiné aux pays de l’hémisphère Nord, pour produire les premiers lots de vaccin H1N1 nécessaires à nos études cliniques, afin de ne pas retarder leur démarrage. Une fois ces lots cliniques terminés, la production de vaccin saisonnier a repris jusqu’au terme initialement prévu. Nous avons ensuite démarré immédiatement la production industrielle de vaccin H1N1.
C’est à cette même période, c’est-à-dire début juillet 2009, que les contacts avec les autorités françaises ont abouti à la signature d’un avenant au contrat initial que nous avions signé en 2005 dans le cadre de la préparation à une éventuelle pandémie. Par cet avenant, 28 millions de doses ont été commandées à Sanofi Pasteur le 13 juillet.
Nos études cliniques effectuées en Europe ont démarré le 18 août. Il y en a eu en France et en Finlande, ainsi qu’en Inde. D’autres études ont été lancées simultanément aux États-Unis avec le vaccin produit sur notre site américain.
Fin août, des réunions avec l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) et d’autres agences européennes ont montré que, puisque nous ne disposions pas de dossier prototype dit « mock up », il serait possible d’utiliser pour le vaccin non adjuvanté Panenza la voie réglementaire appelée DCP (procédure décentralisée). L’intérêt de celle-ci était de nous permettre d’espérer une autorisation de mise sur le marché à la mi-novembre, c’est-à-dire plus tôt que ce que permettait l’autre voie réglementaire européenne (dite centralisée), que nous avions initialement choisie pour nos deux vaccins.
C’est ainsi que l’autorisation a été obtenue le 13 novembre, et la vaccination avec Panenza a pu commencer en France quelques jours plus tard, avec les premières quantités que nous avions livrées. Nos livraisons se sont poursuivies, principalement en décembre. Au 1er janvier, nous étions, sauf erreur, le laboratoire qui avait livré le plus de doses à la France, soit 14 380 000 doses.
Le métier de Sanofi Pasteur, développer et produire des vaccins, est difficile. Être le mieux préparé possible et répondre de façon efficace à l’apparition d’une pandémie représentait, pour Sanofi Pasteur et pour tous ceux qui ont le même métier, un défi considérable. Il nous fallait répondre non seulement aux besoins en vaccin contre la grippe A(HlNl) mais aussi en vaccin saisonnier, pour l’hémisphère Nord et pour l’hémisphère Sud. Nous avons pu relever ce défi grâce à une mobilisation sans précédent de nos collaborateurs. Je suis fier de dire que notre société, dans laquelle je travaille depuis quarante ans, a mis toutes ses forces dans la bataille, en toute transparence et de manière parfaitement responsable.
M. Jean-Pierre Door, rapporteur. À quelle date le Panenza a-t-il été livré en France ?
M. Jacques Berger. Les vaccins ont été livrés la semaine du 12 novembre, mais ils ont été retenus puisque la DCP n’était pas à son terme.
M. le rapporteur. Le Panenza non adjuvanté est donc arrivé après le début de la campagne.
M. le président Jean-Christophe Lagarde. En effet, les femmes enceintes, convoquées en priorité, n’ont pas pu bénéficier du vaccin non adjuvanté les premiers jours. Confirmez-vous que ce retard n’était pas dû à un délai de production, mais à la délivrance de l’autorisation ?
M. Jacques Berger. Oui. L’enregistrement a été effectif le 16 novembre, très exactement.
M. Gérard Bapt. Le contrat prépandémique de 2005 portait-il bien sur 14 millions de traitements, donc 28 millions de doses ?
M. Jacques Berger. C’est cela. C’était une tranche optionnelle, portant sur 14 millions de traitements. On avait alors la conviction que deux injections étaient nécessaires.
M. Gérard Bapt. Au moment de la livraison, en novembre, ne saviez-vous pas qu’une seule dose était suffisante ?
M. Jacques Berger. Non. Cela n’a été confirmé par l’EMEA autour du 20 novembre.
M. Gérard Bapt. Vous avez développé un vaccin non adjuvanté aux États-Unis, sous une dénomination différente, qui était disponible dès le mois de septembre. L’obtention de l’AMM aux États-Unis a, semble-t-il, été beaucoup plus rapide qu’en Europe. Comment expliquez-vous ce retard de deux mois, retard d’autant plus regrettable que la population cible du Panenza était celle des enfants ?
M. Jacques Berger. Le vaccin produit aux États-Unis a été disponible cinq semaines avant le Panenza. Il y a une explication très simple à ce délai : en France, nous ne disposons que d’un seul bâtiment. Nous avons donc interrompu la production du vaccin saisonnier, que nous avions pris l’engagement de réaliser dans les quantités requises tant pour l’hémisphère Nord que pour l’hémisphère Sud, pour fabriquer quelques lots de vaccin H1N1 destinés aux études cliniques ; ce n’est qu’ensuite que nous avons pu débuter la production de Panenza. Aux États-Unis, l’un des deux bâtiments du site a pu être consacré immédiatement à la production du vaccin H1N1.
M. Gérard Bapt. Le délai n’est donc pas dû à l’obtention tardive de l’AMM.
M. Jacques Berger. Il y a une autre différence : aux États-Unis, le système de variation applicable pour passer d’une souche à l’autre ne nécessite pas de disposer au préalable des résultats des études cliniques. C’est la combinaison de ces deux facteurs qui explique que le vaccin américain ait été disponible plus tôt.
M. le président Jean-Christophe Lagarde. Pourriez-vous évaluer le retard dû aux différences de procédure en matière d’études cliniques ?
M. Jacques Berger. Techniquement, les études cliniques n’ont pas pu commencer en France avant le 18 août. La souche a été disponible dans les premiers jours de juin ; il a fallu ensuite réaliser le travail d’amplification, qui nécessite trois ou quatre semaines ; puis nous avons pu fabriquer des lots cliniques, naturellement soumis à divers contrôles. C’est alors que les études cliniques ont pu être lancées. Il a fallu attendre les résultats de l’administration de la première dose, puis ceux de la seconde injection. Ces derniers étaient nécessaires pour la finalisation du dossier DCP, qui est intervenue au tout début du mois de novembre. Nous avons ainsi reçu un avis favorable pour l’enregistrement le 13 novembre, et la licence a été confirmée le 16 novembre.
M. le président Jean-Christophe Lagarde. Combien de temps les études cliniques ont-elles duré ?
M. Jacques Berger. Elles ont débuté le 18 août. Nous avons reçu les derniers résultats dans les premiers jours de novembre.
M. le président Jean-Christophe Lagarde. Ce n’est donc pas la phase de production qui a posé problème.
M. Jacques Berger. Les lots cliniques ont été fabriqués durant la deuxième quinzaine du mois de juin. Le processus pharmaceutique et réglementaire nécessaire pour que ces lots puissent être utilisables en études cliniques s’est achevé le 18 août.
M. Gérard Bapt. Alors qu’il s’avérait qu’une seule dose était suffisante, on a attendu les résultats des études cliniques sur la deuxième injection pour accorder l’AMM…
Votre capacité de production en France était insuffisante, étant entendu que l’on recommandait que les enfants et les femmes enceintes, publics prioritaires, reçoivent un vaccin non adjuvanté. Lors de votre audition par la mission d’information sur la grippe aviaire, présidée par M. Jean-Marie Le Guen et dont le rapporteur était M. Jean-Pierre Door, vous disiez déjà que votre capacité de production serait insuffisante dans le cadre d’une pandémie de type H5N1. Nous avions alors souligné la nécessité d’investissements supplémentaires et d’une aide de l’État. Ces investissements ont-ils été réalisés ? L’État français ou un autre État européen vous ont-ils aidé à accroître votre capacité de production ?
M. Jacques Berger. La réponse est non. Nous n’avons pas reçu d’assistance particulière des autorités pour accroître nos capacités. En revanche nous avons décidé nous-mêmes de les augmenter. Des usines sont en construction, depuis plusieurs années déjà, au Mexique et en Chine.
M. le président Jean-Christophe Lagarde. Les vaccins qui y seront produits seront-ils en partie destinés à l’Europe ?
M. Jacques Berger. Le but est plutôt de produire là où il y a des besoins.
M. le président Jean-Christophe Lagarde. La production ne serait-elle pas mutualisée dans le cadre d’une pandémie ?
M. Jacques Berger. L’existence de ces unités libérera automatiquement des capacités dans les unités de production européennes pour répondre à nos propres besoins.
M. le rapporteur. Actuellement, quelle est votre capacité de production ?
M. Jacques Berger. En ce qui concerne le vaccin saisonnier, elle est d’environ 200 millions de doses par an.
M. le président Jean-Christophe Lagarde. Et qu’en est-il pour le vaccin H1N1 ?
M. Jacques Berger. Il est très difficile de le dire car le rendement est très différent selon la souche et selon la période pendant laquelle on procède à la fabrication. En 2009, nous disposions d’une « fenêtre de tir » entre la fin de la production du vaccin saisonnier destiné à l’hémisphère Nord et le début de la production du vaccin saisonnier destiné à l’hémisphère Sud. La situation aurait été différente si l’OMS nous avait demandé d’arrêter la production de vaccin saisonnier – que nous assurons à hauteur de 40 % des besoins mondiaux.
M. Gérard Bapt. Dès le contrat prépandémique, vous aviez expliqué aux membres de la mission d’information sur la grippe aviaire que, dans le cadre d’une pandémie, vous exigeriez d’être déchargés par les États de toute responsabilité relative au vaccin, hors défaut de fabrication et de transport. Tel fut bien le cas dans le cadre des avenants. Pensez-vous à l’avenir maintenir cette exigence ?
Aux États-Unis, les laboratoires publient systématiquement les conflits d’intérêts concernant les médecins en rapport avec les firmes. Il semble que les sociétés françaises, ainsi que l’Ordre des médecins, refusent cette pratique. Celle-ci a pourtant le mérite de couper court aux doutes qui peuvent se faire jour et nuire au succès d’une démarche de santé publique. Pensez-vous que Sanofi Aventis, au vu de ce qui s’est passé au cours des derniers mois, pourrait changer d’attitude et publier systématiquement les contrats de recherche ou d’essais qu’il passe avec des médecins français ?
M. Jacques Berger. Il n’a jamais été question de nous décharger de notre responsabilité. En revanche, nous avons considéré qu’un partage devait se faire entre les laboratoires et les autorités publiques : les laboratoires assument la responsabilité pharmaceutique, et les États doivent endosser celle qui est liée à l’organisation d’une vaccination de masse, laquelle peut déclencher l’association d’effets secondaires sans lien avec la vaccination. Cela n’est pas nouveau et apparaissait déjà dans le contrat signé en 2005.
Nous sommes sensibles à la question du lien d’intérêt, qu’il convient de distinguer du conflit d’intérêt. Le monde du vaccin est, en nombre de personnes impliquées, très réduit. Il y a de grandes chances que, souhaitant développer les meilleurs produits et donc faire appel aux meilleurs experts, nous consultions les mêmes que ceux dont les structures de santé vont demander l’avis avant de prendre une décision difficile. Ce n’est pas un problème si la transparence est assurée. Dans cette perspective, et bien avant la pandémie, Sanofi Aventis a fait en sorte que l’expert informe les structures avec lesquelles il travaille de sa collaboration avec notre société.
M. Gérard Bapt. Merck et Lilly publient eux-mêmes les contrats qu’ils passent avec les experts.
M. Jacques Berger. Nous serons favorables à tout ce qui permettra de garantir la transparence maximale, ne serait-ce que pour éviter des débats sans fondement.
M. le président Jean-Christophe Lagarde. Pensez-vous qu’il faille légiférer ou modifier la réglementation, ou les laboratoires peuvent-ils faire eux-mêmes le nécessaire ?
M. Denis Jacquat. Ils se heurteront au refus de l’Ordre des médecins.
M. Yves Bur. La transparence est en effet une question qu’il faudra trancher rapidement. Le débat existe au sein du LEEM (Les entreprises du médicament) sur le sujet. L’adoption des mêmes règles qu’aux États-Unis permettrait de mettre fin aux suspicions. J’avais obtenu l’adoption d’un amendement visant à assurer la transparence des financements des associations, mais il apparaît que l’industrie du médicament accepte difficilement de publier la liste des bénéficiaires.
Le contrat de commande des vaccins faisait-il mention de délais ou de dates de livraison ? Avez-vous pu les respecter ou en avez-vous été empêchés par la durée de la procédure de certification ?
Vous avez eu des négociations sur le prix avec l’État français, mais aussi avec d’autres acheteurs dans le monde. Pourriez-vous nous faire parvenir un tableau comparatif de vos conditions commerciales ?
M. Jacques Berger. Les délais de livraison inscrits dans les contrats étaient indicatifs, pour une raison simple : beaucoup de paramètres étaient inconnus à ce stade – date de disponibilité des réactifs en provenance de l’organisation mondiale de la santé et des centres de référence et productivité de la souche, laquelle peut varier de 30 à 100 %.
Nous avons cependant fait des estimations et, comme on peut le lire dans les dispositions contractuelles publiées par la presse, nous avons dit que nous pensions effectuer la livraison en décembre. En fait, nous l’avons commencée en novembre et poursuivie, pour l’essentiel, en décembre. À la fin de l’année, il ne restait qu’un petit solde, qui a été livré dans la première semaine de février. A ma connaissance, je le répète, Sanofi Pasteur était au 1er janvier le laboratoire qui avait livré le plus de doses à la France.
Notre système de prix a été très simple. Comme je l’ai indiqué tout à l’heure, nous avons souhaité dès le départ qu’il soit raisonnable, et tel a bien été le cas puisque notre prix a été le plus bas de ceux qui ont été pratiqués. Le prix – 6,25 euros la dose, prix fait à la France – a été le même pour tous les acheteurs, la seule différence concernant le coût du transport, et exception faite de trois pays dans lesquels nous effectuons une dernière étape de production, qui ont bénéficié d’un prix un peu inférieur.
M. Yves Bur. Vous n’avez donc pas tenu compte du volume de la commande.
M. Jacques Berger. Non. Dès l’établissement de notre politique de prix, nous avons été fermes sur ce point. Enfin, pour les pays les plus pauvres, il y a eu application des règles du tier pricing et gestion par l’OMS de la donation que nous avons effectuée.
M. le rapporteur. Combien avez-vous produit de doses au total ?
M. Jacques Berger. Environ 200 millions, issues de nos sites américain et français.
M. le rapporteur. Comment la renégociation avec les autorités françaises s’est-elle passée ?
M. Jean-Paul Bacquet. Pourriez-vous également nous préciser combien vous avez vendu de doses, et éventuellement, combien vous en avez repris ?
M. Jacques Berger. Officiellement, la résiliation a été formulée le 4 janvier ; la chronologie est la suivante.
Lors d’une réunion en novembre avec le directeur de cabinet de la ministre de la santé, celui-ci m’a très clairement fait entendre que si nous avions l’opportunité de trouver de nouveaux acheteurs, le contrat que nous avions passé avec les autorités françaises serait revu à la baisse. Je n’avais pas pris d’engagement, mais c’était pour moi un engagement moral.
Le 23 décembre, ayant acquis – à tort – la conviction que nous allions pouvoir vendre ailleurs 9 des 28 millions de doses commandées, j’ai proposé aux autorités françaises de réduire la commande d’autant. Le 24 décembre après-midi, j’ai reçu la confirmation écrite que cette diminution était la bienvenue. Il était prévu qu’après les fêtes, le 4 janvier, nous finalisions cette décision dans un avenant au contrat. Mais avant de recevoir cet avenant, j’ai été informé par un coup de fil qu’il s’agirait d’une résiliation, qui allait être annoncée quelques heures après et qui porterait non pas sur 9, mais sur 11 millions de doses : le ministère nous imposait une réduction supplémentaire de 2 millions de doses par rapport à ce que j’avais proposé.
Nous étions prêts à une réduction volontaire de 9 millions de doses, pensant pouvoir les vendre ailleurs ; mais la décision des autorités françaises a eu un impact important : des pays avec lesquels nous avions des discussions les ont interrompues ou ont réduit leurs commandes, et un pays a annulé la sienne.
M. le président Jean-Christophe Lagarde. Lequel ?
M. Jacques Berger. La Grèce.
Une toute petite partie seulement des 11 millions de doses a pu être vendue. Les doses formulées ont été perdues. Un certain volume en vrac pourra être réutilisé pour la fabrication du vaccin saisonnier, l’OMS ayant pris la décision d’inclure la souche H1N1 dans les vaccins saisonniers destinés à l’hémisphère Sud et à l’hémisphère Nord.
M. le président Jean-Christophe Lagarde. Il nous a été souvent expliqué que la décision de créer des centres de vaccination était liée à l’exigence des laboratoires de produire des vaccins en flacons multidoses. Il semblerait qu’aucun n’ait souhaité produire de monodoses, arguant de délais trop importants. Combien de temps supplémentaire fallait-il à votre entreprise pour le faire, sachant que le conditionnement en doses unitaires est d’usage pour les autres vaccins ?
M. Jacques Berger. Les monodoses sont destinées aux pays comme la France, mais les campagnes internationales de vaccination, assurées notamment par l’Unicef, utilisent des flacons multidoses, d’emploi et de conservation plus aisés.
Un laboratoire pharmaceutique n’a aucune raison de refuser de produire des doses unitaires s’il le peut, d’autant qu’elles seraient vendues plus cher. Mais le problème était celui de la capacité de production. La responsabilité d’un laboratoire comme le nôtre étant de mettre à disposition le plus rapidement possible la plus grande quantité possible d’un vaccin, le conditionnement en flacons multidoses s’imposait. Si nous avions dû produire des doses unitaires, nous aurions pris un très grand retard dans la livraison des quantités souhaitées. Je suis prêt à chiffrer ce délai. Il ne s’agir en rien de mauvaise volonté ; un conditionnement en doses unitaires n’aurait pas permis de répondre à l’enjeu de santé publique, et ses conséquences auraient été majeures si la pandémie s’était révélée sévère.
M. le président Jean-Christophe Lagarde. Il serait souhaitable que vous puissiez nous transmettre votre estimation chiffrée.
Par ailleurs j’observe que le vaccin saisonnier, dont vous avez dû interrompre la chaîne de production, est conditionné en monodoses.
M. Jacques Berger. À ce stade, il s’agissait de vrac.
M. le président Jean-Christophe Lagarde. Néanmoins je ne comprends pas en quoi il était plus compliqué de produire le vaccin H1N1 en doses unitaires.
M. Jacques Berger. Nous n’avions pas une capacité de répartition en seringues unitaires suffisante, dès lors qu’il s’agissait d’aller le plus vite possible. Et il n’est pas pensable de se doter, pour répondre à un besoin ponctuel, d’unités de répartition qui resteraient ensuite inutilisées pendant des années. Par ailleurs, le coût du vaccin serait plus élevé.
M. le président Jean-Christophe Lagarde. Merci de bien vouloir également nous communiquer par écrit une estimation de ce coût supplémentaire.
M. Jacques Berger. Les autorités françaises nous ayant fait savoir qu’il pourrait être utile de disposer d’un certain nombre de doses en seringue, nous en avons fourni 300 000 au début du mois de novembre, au même prix unitaire que les autres. Mais s’il avait fallu conditionner toutes les doses sous cette forme, le prix en aurait été affecté.
M. le président Jean-Christophe Lagarde. Avez-vous livré d’autres doses unitaires ensuite ?
M. Jacques Berger. Non. Nous en avons produit 380 000 en tout, dont 80 000 à destination d’un autre pays.
M. le président Jean-Christophe Lagarde. Vos unités de production vous auraient-elles permis de produire sous les deux conditionnements en même temps ?
M. Jacques Berger. Nous commençons par produire le vrac. Nous disposons ensuite de deux machines, l’une permettant la répartition en seringues unitaires, l’autre en flacons multidoses. Il s’agit de deux chaînes différentes. Mais nous avons indiqué très clairement aux autorités que le seul moyen de livrer rapidement les quantités demandées était le conditionnement en flacons multidoses.
M. le président Jean-Christophe Lagarde. La machine permettant la répartition en seringues unitaires ne pouvait-elle pas continuer à produire après la fabrication des 300 000 doses ?
M. Jacques Berger. Cela n’aurait pas suffi, compte tenu du temps réduit dont nous disposions.
M. le président Jean-Christophe Lagarde. Combien de vaccins monodoses contre la grippe saisonnière produisez-vous annuellement ?
M. Jacques Berger. Environ 140 ou 150 millions, mais la production est répartie sur l’ensemble de l’année.
M. le président Jean-Christophe Lagarde. Ce qui fait à peu près 12 millions en un mois…
M. Jacques Berger. Je comprends que ces estimations soient un élément important, et plutôt que de risquer de faire aujourd’hui une erreur, je préfère vous faire parvenir par écrit des éléments chiffrés.
M. le président Jean-Christophe Lagarde. Notre seul objectif, comprenez-le bien, est de rechercher les moyens d’améliorer la gestion du risque pandémique.
M. Jacques Berger. Nous sommes tout à fait prêts à participer à cette analyse, disposant aussi d’une expertise dans ce domaine.
M. le rapporteur. Avez-vous commencé la production du vaccin trivalent ?
M. Jacques Berger. Dès le mois de décembre dernier.
Chaque année, pour la campagne de vaccin contre la grippe dans l’hémisphère Nord, qui a lieu dans les derniers mois de l’année, les souches sont annoncées par l’OMS vers le 15 février, et la production de vrac et la mise sous forme pharmaceutique se déroulent jusqu’au mois d’août. Pour la campagne de l’hémisphère Sud, nous sommes informés des souches dans le courant de la première quinzaine de septembre, nous débutons alors la production et les vaccins sont commercialisés durant les premier et deuxième trimestres de l’année.
Aussitôt la production du vaccin H1N1 terminée, nous avons, dès le mois de décembre 2009, repris la production du vaccin saisonnier à destination de l’hémisphère Sud, dont la campagne est en train de se dérouler. Nous avons déjà commencé la production destinée à la campagne 2010 de l’hémisphère Nord. Dans les deux cas, nous produisons à la fois des vaccins saisonniers et des vaccins trivalents, ces derniers incluant pour la première fois la souche A(H1N1).
M. Gérard Bapt. Sachant que vous avez fourni à la mi-novembre 300 000 doses unitaires et que Novartis en a livré 500 000 fin novembre-début décembre, une campagne de vaccination décentralisée aurait été possible beaucoup plus tôt.
M. le président Jean-Christophe Lagarde. Cela paraît évident.
Monsieur Berger, que pensez-vous du nombre relativement faible de personnes qui ont fini par se faire vacciner ?
M. Jacques Berger. Comme tout le monde, j’ai été très frappé par la méfiance dont ont fait preuve les Français, en s’appuyant sur tout ce qui a pu être dit sur les adjuvants ou sur les vaccins en général. Je le regrette beaucoup, étant bien placé pour connaître les bénéfices de la vaccination.
M. le président Jean-Christophe Lagarde. Beaucoup de rumeurs ont été répandues, notamment sur la façon dont étaient produits les vaccins. Ne serait-ce qu’au regard de vos intérêts commerciaux, votre communication sur le sujet n’a-t-elle pas été défaillante ?
M. Jacques Berger. Sur le plan de la santé publique, mais aussi parce que c’est notre métier, nous serions bien sût très heureux que la couverture vaccinale, de manière générale, soit meilleure. Nous sommes prêts, là encore, à réfléchir avec les autorités aux moyens d’y parvenir.
M. le président Jean-Christophe Lagarde. À l’occasion de cette pandémie, j’ai découvert, comme beaucoup de Français, que les vaccins comportaient généralement des adjuvants. Peut-être serait-il utile, pour couper court aux soupçons, que les laboratoires informent les citoyens sur la façon dont ils produisent les vaccins.
M. Jean-Paul Bacquet. J’ai un avis totalement opposé au vôtre, monsieur le président. Incontestablement, les nouveaux moyens de communication amplifient les arguments des opposants à la vaccination, qui ont toujours existé : que serait-il advenu du BCG si le drame de Lübeck était survenu à l’ère d’internet ? Mais je pense que la mission d’éducation sanitaire revient entièrement aux pouvoirs publics et qu’il n’appartient pas aux laboratoires de communiquer en la matière. Cela ne ferait qu’aggraver la situation car cette initiative serait perçue comme une tentative de justification à visée commerciale.
Je regrette que les pouvoirs publics n’assument pas leur responsabilité en matière de vaccinations, qu’elles soient facultatives ou obligatoires. Il est anormal, par exemple, que des enfants puissent aller à l’école sans avoir reçu les vaccins obligatoires.
La non-adhésion des professionnels est responsable, en grande partie, de l’échec de cette campagne. Comment avez-vous perçu la médiatisation de leurs arguments ?
M. Jacques Berger. Nous avons tous constaté un problème majeur de communication, lié à l’utilisation par les opposants à la vaccination des nouveaux moyens que, nous-mêmes, nous n’avons pas la possibilité d’utiliser de la même façon. Les laboratoires sont-ils les mieux placés pour parler favorablement des vaccins ? J’en doute et je pense que cette démarche serait mal perçue. Je serais très favorable, en revanche, au lancement d’une réflexion sur le sujet, associant les acteurs concernés aux pouvoirs publics, car on voit circuler sur internet des affirmations effarantes, notamment contre les laboratoires – qui, s’ils sont loin d’être parfaits, s’efforcent de bien faire leur travail.
M. Gérard Bapt. Puis-je vous suggérer, d’une part, de publier systématiquement les conflits d’intérêts et, d’autre part, d’assurer la transparence des contrats, que vous aviez dit couverts par le secret commercial avant de finalement tout révéler ?
M. Jacques Berger. Nous n’avions rien demandé en matière de confidentialité. Je me suis aperçu que le contrat que j’avais signé s’est retrouvé très vite dans la presse. Nous n’avons jamais communiqué sur ces aspects et nous ne nous le serions jamais permis, estimant que c’était aux autorités françaises de le faire si elles le décidaient.
M. le président Jean-Christophe Lagarde. Les laboratoires ont demandé le huis clos à la commission sénatoriale, sous prétexte de confidentialité des contrats. J’ai, pour ma part, refusé le huis clos.
M. Jacques Berger. Pourtant, les contrats ont été publiés par la presse dès le mois de novembre et leur contenu peut être consulté sur l’internet.
M. Gérard Bapt. C’est au sujet des clauses de la renégociation que les laboratoires ont demandé le secret.
M. Jean-Paul Bacquet. J’aimerais avoir une réponse à ma question sur la non-adhésion des médecins de vaccination. Les propos de certains d’entre eux n’ont fait que justifier les absurdités que l’on pouvait lire sur l’internet.
Les médecins généralistes ont été totalement exclus de la campagne. J’avais, dès le départ, fait part au préfet de ma surprise de ne pas voir siéger un seul d’entre eux à la cellule de crise de mon département. L’enseignement post-universitaire est très déficient en France et n’est souvent assuré que dans des visées commerciales. Or une campagne de ce type exigeait une formation massive et immédiate des professionnels de santé. Il y a quelques années, une vaccination de masse contre la méningite a été organisée dans le Puy-de-Dôme ; elle s’est très mal passée parce que, là aussi, on a mis à l’écart les médecins, qui n’ont reçu ni information ni formation.
M. Jacques Berger. Les commentaires négatifs sur la vaccination formulés par des médecins jouissant d’une certaine autorité sont évidemment très dommageables car ils créent la cacophonie et offrent un appui aux groupes anti-vaccinaux.
Les professionnels de la santé sont, avec internet et les médias, une source d’information des citoyens. Il me paraît important d’associer les médecins afin qu’ils soient les ambassadeurs de la vaccination. Dans le cas qui nous occupe, le fait que celle-ci ne soit pas passée par eux constituait une difficulté supplémentaire pour les mobiliser ; mais il faudra tirer de cette expérience les conclusions qui s’imposent.
M. Jean-Paul Bacquet. Si les médecins avaient été associés à la campagne, je suppose que vous auriez fait fonctionner votre réseau de visiteurs médicaux.
M. le président Jean-Christophe Lagarde. Je ne suis pas certain qu’il s’agisse le maillon le plus vertueux de la chaîne médicale !
M. le rapporteur. Quel est le montant de l’indemnisation que vous avez reçue de l’État dans le cadre de la renégociation du contrat ?
M. Jacques Berger. La résiliation concernait, selon l’ÉPRUS, 2 millions de doses. Son impact financier est aisément chiffrable – il suffit de multiplier le nombre de doses par leur coût unitaire. Les propositions successives que nous avons faites n’ont pas été acceptées. Nous avons reçu il y a dix jours une notification de l’ÉPRUS indiquant que la compensation s’établira à 16 % de la valeur de la commande, soit 2 millions d’euros pour une commande qui représentait 12,5 millions d’euros.
M. le président Jean-Christophe Lagarde. Pourriez-vous nous indiquer le prix de revient d’une dose ?
M. Jacques Berger. Je ne suis pas en mesure de vous le dire. Tous les coûts de ne sont pas encore identifiés.
M. le président Jean-Christophe Lagarde. Vous deviez avoir une estimation du coût de revient lorsque vous avez fixé le prix unitaire.
M. Jacques Berger. C’était effectivement une estimation. Je rappelle que le prix que nous avons pratiqué – 6,25 euros – est inférieur à celui qui figurait dans le contrat de 2005 – 6,50 euros.
M. le rapporteur. Quel est le prix de la dose du vaccin saisonnier ?
M. Jacques Berger. En Europe, il se situe autour de 6 euros. Il est un petit peu plus bas en France.
M. Gérard Bapt. L’indemnisation porte-t-elle sur les 2 millions ou sur les 11 millions de doses que vous n’avez pas livrées ?
M. Jacques Berger. L’ÉPRUS considère qu’elle concerne les 2 millions dans la mesure où, quatre heures avant l’annonce officielle de la résiliation, j’avais moi-même proposé une réduction de 9 millions de doses, acceptée par les autorités.
M. Gérard Bapt. Votre coopération n’a pas été récompensée !
M. le président Jean-Christophe Lagarde. Monsieur Jacques Berger, je vous remercie.
La séance est levée à dix-sept heures vingt-cinq.
Audition de M. Philippe Chêne,
président de Baxter France
(Procès-verbal de la séance du mercredi 28 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures vingt-cinq.
(M. Philippe Chêne prête serment.)
M. Philippe Chêne, président de Baxter France. C’est un plaisir et un honneur pour moi, en tant que président de Baxter France, d’être devant vous aujourd’hui, accompagné de M. Denis Cavert, responsable de notre division « biosciences », qui abrite les vaccins. Je m’efforcerai d’apporter des réponses à toutes vos questions. Je vais commencer par présenter très rapidement notre entreprise et le contexte dans lequel nous avons apporté notre contribution au plan de gestion de la pandémie H1N1.
Baxter est une entreprise globale d’origine américaine créée dans les années trente, qui emploie environ 47 000 personnes dans le monde, dont 340 en France sur notre site de Maurepas, dans les Yvelines. Nous sommes un laboratoire un peu atypique, dans la mesure où nous sommes spécialisés dans la fabrication de médicaments, mais aussi de dispositifs médicaux, dans les domaines de la nutrition, de la thérapie rénale et des biosciences, avec la production de médicaments dérivés du plasma. La plupart de nos produits sont de prescription hospitalière et s’adressent à des malades atteints de maladies graves et chroniques ou à des patients qui se trouvent en situation critique à l’hôpital.
Depuis quelques années, Baxter a investi aussi dans la prévention en mettant au point des vaccins, domaine dans lequel nous sommes désormais un acteur à part entière compte tenu des innovations que nous avons apportées.
M. le président Jean-Christophe Lagarde. Depuis combien de temps ?
M. Philippe Chêne. Depuis le début des années quatre-vingt-dix pour l’activité de recherche et depuis 2006, sur notre site européen de Bohumil en République tchèque, pour la production de vaccins à partir de la technologie de culture cellulaire.
Nous avons développé un vaccin pandémique, appelé Celvapan, qui a obtenu une autorisation de mise sur le marché de la Commission européenne le 7 octobre 2009. Ce vaccin a la particularité d’être produit sur culture cellulaire et non sur œuf – et il ne contient pas d’adjuvant. On a toujours considéré que cette technologie était complémentaire de la culture sur œuf. Elle offre un double avantage : elle permet la mise à disposition de vaccins commerciaux dans des délais plus rapides (en général douze semaines) ; elle permet aux autorités de diversifier leurs approvisionnements et, éventuellement, de s’affranchir de produits cultivés sur œuf, ce qui constitue un avantage non seulement en cas de virus aviaire, mais aussi pour les patients allergiques aux protéines d’œuf. Celvapan a été le premier vaccin sans adjuvant élaboré à partir de la technologie de production sur cellules Vero à obtenir une autorisation de mise sur le marché dans l’Union européenne.
Concernant notre contribution au plan Pandémie mis en place par les autorités françaises, on nous a expressément demandé l’été dernier de livrer le plus grand nombre de vaccins possible. Nous avons été sollicités en raison des avantages que représente notre technologie – disponibilité plus rapide, absence de protéines d’œuf et absence d’adjuvant.
Nous avons pris toutes les dispositions nécessaires pour répondre à la demande de la France, bien qu’il n’y ait pas eu de contrat de préréservation : nous avions travaillé entre 2005 et 2009 avec les autorités sanitaires pour faire connaître notre technologie, mais cela n’avait pas débouché sur la signature d’un tel contrat.
M. le président Jean-Christophe Lagarde. Est-ce parce que l’État ne le souhaitait pas ?
M. Philippe Chêne. Je pense qu’une évaluation avait été faite du potentiel des différentes sociétés, ainsi que de l’état d’avancement de la culture cellulaire. C’est une technologie récente, qui ne permet pas pour l’instant, eu égard à nos capacités, de produire des volumes très importants. C’est d’ailleurs pourquoi nous avons toujours présenté notre offre comme complémentaire et non pas concurrente des autres en termes de volumes disponibles ; mais un tel avantage n’a sans doute pas été pris en compte.
Le 10 août dernier, nous avons signé un contrat avec l’ÉPRUS, l’Établissement de préparation et de réponse aux urgences sanitaires, sur le fondement de l’article 3-7 du code des marchés publics, contrat aux termes duquel nous mettions à disposition de l’État 50 000 doses de notre vaccin Celvapan en multidoses. C’est évidemment un contrat d’appoint par rapport à la quantité commandée par le Gouvernement : il représentait 0,05 % du total.
Les 12 000 premières doses sont arrivées sur le territoire national le 29 août, sur notre site de Maurepas, lequel avait été sécurisé à la demande des autorités. L’ÉPRUS en a pris possession le 27 octobre. L’enregistrement de ce vaccin était intervenu le 7 octobre. Nous avons livré le solde, soit 38 000 doses, le 10 décembre. À cette date, notre contrat était ainsi honoré, les 50 000 doses ayant été livrées et payées par l’ÉPRUS. Nous n’avons donc pas été concernés par les résiliations de commandes.
M. le président Jean-Christophe Lagarde. Pourquoi ne pouviez-vous pas produire ces 50 000 doses en monodoses ?
M. Philippe Chêne. Celvapan est un vaccin pandémique, dont la production a été organisée pour répondre à cette caractéristique. Nous avions des contrats de réservation avec d’autres États, prévoyant une livraison en multidoses. Les 50 000 doses livrées aux autorités françaises ont été prélevées sur ces contrats de réservation ; elles n’ont pas été produites spécifiquement pour la France.
M. le président Jean-Christophe Lagarde. Au total, combien avez-vous produit de doses de vaccin ?
M. Philippe Chêne. Nous en avons livré en Europe, sur l’ensemble de la période, environ 11 ou 12 millions.
M. Jean-Pierre Door, rapporteur. Et aux États-Unis ?
M. Philippe Chêne. Nous n’en avons pas livré, du fait que l’enregistrement est européen. En revanche, nous avions des contrats de réservation avec la Nouvelle-Zélande et d’autres pays hors Europe qui reconnaissent les enregistrements européens.
M. Gérard Bapt. Y a-t-il eu des résiliations de la part d’autres pays ?
M. Philippe Chêne. Je ne crois pas que l’on puisse parler de résiliations au sens de celles qui ont eu lieu en France. Tous les pays avec lesquels nous avons travaillé, hormis la France, avaient conclu un contrat de réservation, lequel comportait des clauses d’ajustement à différents stades de la pandémie. C’est ainsi que la Grande-Bretagne, à laquelle était destinée la plus grande partie de notre production, avait la possibilité, par contrat, de moduler les volumes en fonction des besoins.
M. Gérard Bapt. Le principe de responsabilité, qui a été transféré à l’État pour cause de circonstances exceptionnelles, sauf problèmes de production ou de logistique, est-il à vos yeux intangible pour l’avenir ?
M. Philippe Chêne. Oui, mais les vaccins, notamment pandémiques, sont des produits de santé un peu particuliers. Notre responsabilité pharmaceutique est totale, au sens où nous nous engageons à produire des vaccins et des médicaments de qualité conforme au dossier d’enregistrement. En revanche nous n’avons aucune influence sur les stratégies, l’organisation des campagnes, les conditions de vaccination ; il est donc très difficile pour les laboratoires d’assumer ce type de responsabilité.
M. Gérard Bapt. Pour des raisons de transparence sur les éventuels conflits d’intérêts, deux firmes américaines, Merck et Lilly, ont décidé de publier systématiquement les contrats passés – quelle qu’en soit la nature – avec des médecins. Est-ce que votre société, qui est américaine, applique les mêmes règles aux États-Unis ? Qu’en est-il en Europe ?
M. Philippe Chêne. C’est un sujet sensible, sur lequel nous devons travailler tous ensemble. En tant que société américaine, nous avons un code de conduite et des procédures très strictes, visant à déconnecter les relations avec les experts, dans leur domaine d’expertise, de tout intérêt commercial.
La législation française existante, si elle est appliquée, peut être assez efficace ; tous ces contrats doivent être déclarés au Conseil de l’Ordre.
M. Gérard Bapt. Qui ne les publie pas…
M. Philippe Chêne. Même si je ne suis que président de la filiale française de Baxter, je pense pouvoir dire que notre entreprise est très ouverte à ce type de publication.
M. Gérard Bapt. Concernant la transparence, se pose aussi le problème du secret commercial et industriel. J’avais correspondu avec vous lorsque j’étais allé étudier les contrats à l’ÉPRUS ; votre société était celle qui occultait le plus largement son contrat. Vous étiez mis en accusation de tous côtés et je vous avais demandé quel était l’intérêt pour vous de maintenir cette opacité. Vous aviez interrogé votre maison mère et, trois jours après, vous aviez libéré toutes les clauses de confidentialité – et je vous en rends hommage. Ne croyez-vous pas que ce devrait être systématique ? Quel avantage commercial ou industriel une firme pourrait-elle retirer du fait d’avoir accès à un contrat dans lequel les processus de production ne sont pas indiqués ?
M. Philippe Chêne. Je vous remercie d’avoir rappelé que, notamment à la suite de nos échanges, j’avais décidé de lever la confidentialité sur l’ensemble du contrat, en obtenant pour cela l’accord de la maison mère et une décision symétrique de l’ÉPRUS.
Par principe, en général, nous ne dévoilons pas nos contrats commerciaux. Mais compte tenu de la sensibilité de ce type de contrat et de la suspicion que la non-transparence provoque – alors qu’il n’y a pas grand-chose dans ces contrats –, à titre personnel, je n’aurais aucun problème à lever le voile.
M. le rapporteur. Je reviens à votre vaccin sur culture cellulaire. Quel était le prix de la dose ?
M. Philippe Chêne. 10 euros. C’est le prix que nous avions évoqué dès 2005 lorsque nous avions commencé à travailler avec les autorités de santé sur des contrats de réservation.
M. le président Jean-Christophe Lagarde. Le prix a-t-il été identique pour tous les pays ?
M. Philippe Chêne. Grosso modo, oui, mais l’économie des contrats n’est pas tout à fait la même partout. Dans certains pays, nous avons des contrats de pré-réservation. Cela signifie que, dès le départ, nous nous engageons à mettre à disposition un pourcentage de notre capacité, les personnels et les matériels qui seront nécessaires à une production de masse rapide ; des fees sont payés très régulièrement, en amont des crises, ce qui nous permet d’entretenir l’outil de production. De ce fait, le prix unitaire de la dose vendue lorsque la pandémie est déclarée peut varier un peu en fonction des montants déjà réglés dans le cadre des contrats de pré-réservation.
M. Yves Bur. Il ne s’agit donc pas de remises en fonction du volume.
M. Philippe Chêne. Je n’ai pas en tête les prix exacts retenus dans chaque cas mais les contrats étaient à peu près identiques en termes de valeur.
M. le rapporteur. Baxter est un nouveau venu dans le domaine du vaccin. Allez-vous développer des vaccins saisonniers, en particulier le fameux vaccin trivalent ?
Pourra-t-on le faire sur culture cellulaire ?
M. Philippe Chêne. L’objectif est effectivement d’entrer sur le marché des vaccins saisonniers dès l’automne 2010 en Europe. La commission des affaires sociales du Sénat s’étant étonnée qu’une société américaine teste ses vaccins en Europe et pas aux États-Unis, je souligne que le centre de recherches qui a mis au point la culture cellulaire est en Autriche, à Vienne ; nous avons construit en République tchèque l’usine qui produit le vrac, et la formulation finale et le conditionnement du vaccin se font à Vienne. C’est donc tout naturellement que nous avons d’abord postulé pour les enregistrements européens.
Nous allons lancer un vaccin saisonnier produit par culture cellulaire. Nous avons un programme de développement en Asie et en Amérique du Nord, et nous envisageons de renforcer nos capacités en Europe.
M. le président Jean-Christophe Lagarde. Avez-vous prévu de développer le vaccin trivalent ?
M. Philippe Chêne. Oui, sur culture cellulaire.
M. le président Jean-Christophe Lagarde. Votre réponse concernant les prix me paraît trop floue. Nous serions intéressés de savoir si l’État français vous a sollicités pour d’éventuelles pré-réservations d’autres pandémies. Mais surtout, puisque vous dites qu’en cas de pré-réservation, on vous verse régulièrement une certaine somme pour entretenir l’outil de production – ce qui n’avait pas été évoqué par le représentant de Sanofi que nous venons d’entendre –, pourriez-vous nous préciser quelle proportion de la dépense il faudrait consacrer à cette réservation pour pouvoir, ensuite, obtenir rapidement et à un prix moindre les doses nécessaires ?
Nous risquons en effet d’être un jour confrontés à une pandémie plus grave. Pour faciliter les campagnes de vaccination, il faudrait améliorer nos capacités de production. J’aimerais donc savoir à quel coût il serait possible d’adapter par avance l’outil industriel.
J’imagine que lorsque vous produirez des vaccins saisonniers, ce coût de pré-réservation sera moindre.
M. Philippe Chêne. Si d’autres n’ont pas évoqué ces coûts, c’est bien, en effet, parce que leur outil de production était solvabilisé par l’existence d’une activité saisonnière, ce qui n’était pas notre cas. Nous allons entrer sur le marché des vaccins saisonniers à l’automne prochain, mais cela ne mobilisera d’ailleurs pas l’ensemble de notre capacité.
Je ne saurais cependant pas vous dire aujourd’hui la part exacte que représentent ces coûts.
M. le président Jean-Christophe Lagarde. C’est pourquoi nous souhaiterions une réponse par écrit.
M. Philippe Chêne. Vous m’avez également demandé si nous avions été sollicités par les autorités pour un contrat de pré-réservation : pas encore, mais nous avons initié un contact en ce sens la semaine dernière.
M. Gérard Bapt. J’ai lu que, dans le vaccin, le plus cher était l’adjuvant, et le moins cher l’antigène. Est-ce exact ? Vous produisez sans adjuvant. Or il n’y a pas de grosse différence de prix.
Vous produisez également des vaccins contre le méningocoque. S’agit-il de culture cellulaire ?
M. Philippe Chêne. Non.
M. Gérard Bapt. Sur œuf ?
M. Philippe Chêne. Non plus.
M. Gérard Bapt. Concernant le vaccin qui nous occupe aujourd’hui, vous dites avoir livré 11 à 12 millions de doses en Europe. Quelles ont été les données de la pharmacovigilance ? Des doutes avaient été émis, notamment en Allemagne, sur le caractère risqué de la production par culture cellulaire.
M. Philippe Chêne. L’utilisation de la culture cellulaire dans la production de vaccins pandémiques et/ou saisonniers est nouvelle, mais la technologie de la culture cellulaire a été développée dans les années quatre-vingt-dix et a été utilisée, par exemple, pour produire des vaccins antivarioliques de deuxième génération – que l’on avait d’ailleurs proposés à la France à l’époque, dans le cadre du plan Biotox. Ces vaccins antivarioliques ont été achetés par certains pays européens, dans le cadre de la lutte contre le bioterrorisme, à la suite des attentats du 11 septembre, et nous en avons livré entre 200 et 220 millions de doses au gouvernement américain. De nombreuses études cliniques ont été réalisées sur cette technologie.
Sur l’ensemble des 11 millions de doses que nous avons livrées, il est très difficile pour nous de savoir combien ont été réellement utilisées. On peut néanmoins penser que quelques millions de doses l’ont été. À ma connaissance, aujourd’hui, les rapports de pharmacovigilance ne font état que d’effets secondaires connus de la vaccination grippale ou de la vaccination en général, tels que fièvre, fatigue, douleur au niveau du site d’injection ou maux de tête. La semaine dernière, nous avons d’ailleurs eu confirmation de l’avis favorable – non encore publié – de l’EMEA pour une autorisation de mise sur le marché définitive, et non plus uniquement dans le cadre de la crise pandémique. On peut donc être rassuré sur la culture cellulaire.
S’agissant du détail des coûts de production, l’adjuvant coûte probablement cher parce qu’il est conditionné séparément ; mais je peux difficilement, dans ma position, comparer les coûts des modes de fabrication par culture cellulaire et par culture sur œuf.
M. Jean-Paul Bacquet. Les médecins ont peu adhéré à la campagne de vaccination. Y voyez-vous une réaction d’humeur liée à la décision de ne pas les y associer, ou la manifestation du fait qu’ils ne considèrent plus la vaccination comme indispensable ?
M. Philippe Chêne. J’espère que c’est une réaction d’humeur. Dans le pays de Pasteur, on doit se souvenir que la vaccination a pu éradiquer des maladies graves. Quant aux effets indésirables des vaccins, nous disposons dans nos pays développés de systèmes de pharmacovigilance qui permettent de les suivre de façon très précise. On insiste beaucoup sur la nécessité de développer les actions de prévention, ne serait-ce que pour des questions de coût ; or les vaccins font aussi partie de la prévention, aussi bien que les campagnes anti-tabac ou anti-alcool. Ils doivent retrouver leur place, y compris en France. Un sondage montre que 70 % des Français en ont peur : je trouve cela dramatique, non seulement en tant qu’industriel, mais aussi en tant que citoyen.
M. le président Jean-Christophe Lagarde. Je vous remercie.
La séance est levée à dix-huit heures.
Audition de M. Hervé Gisserot,
président de GlaxoSmithKline
(Procès-verbal de la séance du mercredi 28 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures.
(M. Hervé Gisserot prête serment.)
M. Hervé Gisserot, président de GlaxoSmithKline. GlaxoSmithKline dispose en France de quatre sites industriels et d’un site de recherche et de développement ; il emploie près de 5 000 employés sur toute la chaîne de valeur ajoutée du médicament, de la recherche à la commercialisation. Il est également le premier laboratoire international en termes d’investissements sur le territoire français, avec 850 millions d’euros investis au cours de ces trois dernières années.
Permettez-moi de vous présenter rapidement la contribution de GSK dans le contexte de la pandémie de grippe A(H1N1).
Les pandémies peuvent être dévastatrices, en termes de santé publique et sur le plan économique. C’est pourquoi, depuis près de dix ans, deux des priorités de l’Organisation mondiale de la santé (OMS) ont été d’inciter les gouvernements à se préparer au risque de pandémie et d’encourager l’industrie pharmaceutique à élaborer des solutions adaptées.
Dans ce contexte, GSK France a réalisé de très importants investissements, à hauteur de 2,5 milliards d’euros ces dernières années, dans le domaine de la recherche et afin d’augmenter ses capacités de production.
Depuis 2005, des contacts réguliers ont été établis avec la direction générale de la santé (DGS), de manière à tenir les autorités informées de nos données cliniques et de nos démarches réglementaires sur le vaccin contre la grippe A(H5N1). Mon prédécesseur, Christophe Weber, avait d’ailleurs été auditionné en novembre 2005 par la mission d’information sur la grippe aviaire sur le développement par GSK d’un vaccin adjuvanté.
Depuis le mois d’avril 2009, l’ensemble de nos équipes – recherche et développement, industrie, réglementation, pharmacovigilance – se sont mobilisées, sans relâche, pour faire face aux demandes des États confrontés à la crise sanitaire. Nous avons révisé nos priorités de production en fonction des recommandations de l’OMS, décalant dans le temps la production de certains vaccins moins prioritaires en termes de santé publique.
Dans le cadre de la préparation à la pandémie de grippe A(H1N1), GSK s’est appuyé sur sa présence industrielle en France. Le groupe a accéléré ses investissements dans le site de GSK Biologicals à Saint-Amand-les-Eaux pour produire l’adjuvant ASO3. Il a signé pour le remplissage, principal goulet d’étranglement de la production du vaccin, de nombreux accords de sous-traitance, en interne – le site de Notre-Dame-de-Bondeville a contribué au remplissage de l’antigène –, et en externe, avec notamment Pierre Fabre. Il a également exporté à partir d’Evreux, l’un de nos plus importants sites industriels dans le monde, la moitié de la production mondiale de l’antiviral Relenza.
Par ailleurs, le contexte évoluant très rapidement, Jean Stéphenne, président de GSK Biologicals, a adressé des courriers réguliers à l’ensemble des gouvernements européens, afin de les tenir informés, en temps réel et en toute transparence, des progrès réalisés sur les plans industriel, réglementaire et clinique, ainsi que des éventuelles difficultés à anticiper.
À la demande expresse de la direction générale de la santé (DGS), les discussions se sont accélérées au début du mois de mai 2009, à la suite des premiers cas de grippe porcine survenus au Mexique et de la déclaration de pandémie de niveau 5 faite par l’OMS le 29 avril. Les autorités nationales ont rapidement identifié l’intérêt du vaccin développé par GSK sur trois points essentiels : un dossier de vaccin prototype A(H5N1) avait déjà été approuvé par l’Agence européenne du médicament (EMEA) ; la présence d’un adjuvant permettait de réduire significativement la quantité d’antigène associé et garantissant une meilleure protection croisée ; enfin, le stockage séparé de l’adjuvant et de l’antigène permettait d’utiliser le vaccin au-delà de la pandémie en cours. En conséquence, une lettre d’intention, portant sur la commande de 50 millions de doses de vaccins, a été signée le 14 mai par le directeur de cabinet de la ministre de la santé. La production du vaccin a démarré le 22 juin, en amont de la signature, le 10 juillet 2009, du contrat avec l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS).
Le processus de décision a donc été rapide et géré avec beaucoup d’efficacité, d’exigence sur le plan scientifique et médical, et un grand sens mutuel des responsabilités.
Il fallait tenir des délais courts car, la capacité de production mondiale étant limitée, la France devait se positionner très vite afin d’obtenir les quantités souhaitées, et ce bien qu’elle n’ait pas signé de contrat de pré réservation avec GSK, qui n’avait pas répondu à l’appel d’offres des autorités françaises en 2005 ; en outre, dans cette période de préparation de la production, GSK devait impérativement évaluer ses besoins d’investissements.
Notre vaccin a reçu l’avis positif de la Commission européenne le 29 septembre 2009. GSK ayant souhaité que tous les pays européens ayant commandé le vaccin reçoivent la première livraison en même temps, la France a reçu 1,1 million de doses le 9 octobre. Au 4 janvier 2010, date de la notification unilatérale par le Gouvernement de la modification du contrat, 12,3 millions de doses avaient été mises à disposition, soit 25 % de la commande totale, suivant le planning de livraison indicatif. Les 18 millions de doses souhaitées par la France par suite de la révision unilatérale du marché ont fini d’être livrées le 16 février 2010.
Pour les 32 millions de doses restantes, la grande majorité des étapes industrielles avait déjà été réalisée à la date de la notification du 4 janvier 2010. Toute la production en vrac était ainsi finalisée, et la moitié des quantités était déjà conditionnée en flacons.
À ce jour, les discussions se poursuivent avec l’ÉPRUS dans le but d’aboutir à un accord transactionnel, souhaité par GSK et par les autorités françaises. Des accords ont déjà été signés par GSK dans une vingtaine de pays européens, dont l’Allemagne, le Royaume-Uni, les Pays-Bas, la Belgique, ainsi qu’au Japon, à hauteur des deux tiers de la valeur initiale du contrat. Sur ces mêmes bases, GSK a fait une proposition étayée à l’ÉPRUS ; nous n’identifions pas de spécificité du contexte français justifiant une différence d’approche.
Je tiens à souligner que GSK a fait preuve d’esprit de responsabilité à tous les niveaux : scientifique, contractuel et sociétal.
En termes de responsabilité scientifique et réglementaire, les décisions appartiennent aux autorités mondiales, européennes et nationales compétentes, et la responsabilité du laboratoire est de fournir les données nécessaires pour les éclairer. Tout au long du développement et de la fabrication du vaccin, les données ont été soumises en intégralité et en toute transparence à l’Agence européenne du médicament (EMEA) et à l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS), dès qu’elles étaient disponibles.
En termes de responsabilité contractuelle, dans le cas d’une vaccination de masse et dans un contexte pandémique, il est non seulement logique, mais indispensable pour l’industriel que l’État prenne à sa charge la responsabilité de l’utilisation du produit – c’est d’ailleurs ce qui se fait dans tous les pays européens. En revanche, GSK assume pleinement et entièrement sa responsabilité pharmaceutique en termes de qualité des produits délivrés.
En termes de responsabilité sociétale, enfin, depuis l’émergence du risque pandémique au printemps 2009, GSK s’est constamment tenu à une position de réserve en matière de communication, notamment à destination du grand public. Nous n’avons jamais, en France ou ailleurs, participé à des communications susceptibles de majorer la perception du risque pandémique ou de surestimer le bénéfice vaccinal. Nous avons considéré qu’il appartenait aux pouvoirs publics de communiquer auprès du grand public sur la stratégie de gestion de la pandémie, sans aucune interférence de notre part.
En conclusion, face aux critiques rétrospectives, je veux souligner que, dans un contexte de grande incertitude scientifique et épidémiologique, pas un jour n’a été perdu : moins de cinq mois se sont écoulés entre la lettre d’intention et la livraison des premières doses de vaccin, qui ont permis de démarrer la campagne de vaccination auprès des professionnels de santé.
GSK se veut acteur de santé publique et partenaire dans la durée des autorités françaises, quelles que soient les circonstances. Nous sommes tout à fait ouverts aux réflexions en cours afin de tirer les leçons de cet exercice pandémique grandeur nature et apprendre à mieux nous préparer, tous ensemble, aux inévitables pandémies du futur. Gageons que cette commission d’enquête y contribuera.
M. Jean-Pierre Door, rapporteur. Quel était le prix d’une dose ? N’était-il pas possible de faire un vaccin monodose, ce qui aurait limité les stocks ?
Par ailleurs, bien que la résiliation du contrat remonte au 4 janvier, les négociations avec les autorités françaises ne sont toujours pas achevées. Confirmez-vous que vous exigez une indemnisation à hauteur des deux tiers de la valeur du contrat initial, et non de 16 %, comme d’autres laboratoires l’ont accepté ?
Enfin, sera-t-il possible d’utiliser ultérieurement ou de reconditionner sous forme de vaccins trivalents les 32 millions de doses de vaccin restantes ?
M. le président Jean-Christophe Lagarde. Combien avez-vous produit de vaccins à travers le monde ? Les avez-vous facturés partout au même prix ?
M. Hervé Gisserot. La dose de vaccin a été facturée 7 euros à l’ensemble des pays européens ayant signé un contrat avec GSK.
M. Yves Bur. Sans clause de volume ?
M. Hervé Gisserot. Non.
Je souligne que nous n’avons en aucun cas cherché à tirer profit de la situation, puisque ce prix de 7 euros se situe dans la moyenne des tarifs européens du vaccin saisonnier – alors que les entreprises qui ont négocié dans une situation non pandémique, en 2005, ont obtenu un prix de 10 euros par dose. Nous n’avons donc pas exploité une quelconque « position de force ».
Notre dossier réglementaire de vaccin prototype A(H5N1) portait sur un vaccin multidoses ; il paraît évident que, face à une pandémie de grippe A(H5N1), cette option aurait été privilégiée. En outre, le principal goulet d’étranglement de la fabrication du vaccin n’est pas la production de l’antigène, mais le remplissage des flacons. Pour l’heure, l’industrie pharmaceutique n’a pas, à l’échelle mondiale, les capacités de remplissage suffisantes pour que, en cas de pandémie, le vaccin soit mis à la disposition des populations sous la forme d’un produit fini dans des délais suffisamment rapides pour assurer leur protection. Même si l’expérience a montré qu’il était pertinent de prévoir une part de vaccins monodoses, je ne pense pas – à moins que nos capacités de remplissage n’augmentent considérablement – qu’il faille suivre exclusivement cette piste.
À plusieurs reprises, les autorités françaises nous ont interrogés sur la possibilité de constituer un dossier de vaccin monodose. Nous leur avons à chaque fois répondu que, ce faisant, nous risquerions de perdre l’avantage procuré par un dossier réglementaire déjà déposé et approuvé.
M. le président Jean-Christophe Lagarde. Tous les laboratoires concernés étaient dans ce cas !
M. Hervé Gisserot. Non : Sanofi Pasteur n’avait pas déposé de dossier.
M. le président Jean-Christophe Lagarde. Il aurait fallu déposer également un dossier de vaccin monodose.
M. Hervé Gisserot. On ne change pas un dossier multidoses en dossier monodose aussi facilement !
M. le président Jean-Christophe Lagarde. Là n’est pas la question ; dans la mesure où vous étiez en discussion avec l’État depuis 2005, pourquoi ne pas avoir déposé également un dossier de vaccin monodose, sachant que l’essentiel des vaccins que vous produisez sont de ce type ? Il aurait suffi d’activer le dossier adéquat, au lieu de se priver, pour des raisons purement administratives, d’un vaccin monodose !
D’ailleurs, pourquoi les autorités françaises n’avaient-elles pas signé de contrat de pré réservation avec vous, alors que vous êtes leur principal fournisseur ?
Du point de vue industriel enfin, comment expliquez-vous le goulet d’étranglement du remplissage ?
M. Hervé Gisserot. Je conviens que l’expérience de la pandémie de grippe A(H1N1) montre qu’il sera pertinent, à l’avenir, de constituer également des dossiers de vaccins monodoses, de manière à apporter davantage de flexibilité. Il n’en reste pas moins qu’à mon sens, aucun industriel du médicament ne sera capable, dans les délais requis en cas de pandémie, de fournir des vaccins monodoses en nombre suffisant pour couvrir les besoins des populations. Il faut donc prévoir une combinaison des deux.
Cela dit, en mai dernier, il n’était plus possible pour GSK, dans les délais impartis et avec la contrainte – légitime – d’une approbation du dossier réglementaire avant toute utilisation du vaccin, de passer d’un vaccin multidose à un vaccin monodose.
M. Yves Bur. Cela est-il arrivé dans d’autres pays ?
M. Hervé Gisserot. Nous ne l’avons fait ni en France ni ailleurs en Europe.
M. le rapporteur. Quels sont les autres vaccins produits par votre entreprise ?
M. Hervé Gisserot. Nous produisons de très nombreux vaccins : nous sommes, avec Sanofi Pasteur, les leaders mondiaux dans ce domaine.
M. le président Jean-Christophe Lagarde. Combien produisez-vous par an de vaccins monodoses contre la grippe saisonnière ?
M. Hervé Gisserot. Rien que pour l’Europe, nous avons lancé la production de 400 millions de doses de vaccins A(H1N1), ce qui est bien supérieur à notre volume de production habituel. Pour vous donner un ordre de grandeur, nous produisons 45 millions de doses de vaccin diphtérie-tétanos-coqueluche (DTPa) et livrons 250 000 doses de vaccin saisonnier par an – mais nous ne sommes pas un acteur très important de ce marché en France.
Par ailleurs, nous ne pouvions pas allouer la totalité de nos capacités de remplissage au vaccin A(H1N1) : même en période de pandémie, nous devons continuer à fournir des vaccins essentiels pour la santé publique, comme les vaccins pédiatriques. C’est pourquoi nous avons fait appel à la sous-traitance, ce qui a soulevé des difficultés supplémentaires sur le plan réglementaire, puisque, pour toute intervention d’un sous-traitant, le dossier doit être amendé et approuvé au niveau européen.
M. le rapporteur. À quels sous-traitants avez-vous fait appel ?
M. Hervé Gisserot. Sur le territoire français, notre site de Notre-Dame-de-Bondeville, spécialisé dans les anti-thrombotiques et qui produit la Fraxiparine ou l’Arixtra, a été mobilisé, en raison de son savoir-faire en matière de remplissage stérile ; pour le remplissage de l’antigène du vaccin contre la grippe A(H1N1), notre site de Saint-Amand-les-Eaux a réalisé le remplissage de l’adjuvant ASO3 ; et nous avons également fait appel à Pierre Fabre.
M. le rapporteur. Les 400 millions de doses ont-elles toutes été fabriquées ?
M. Hervé Gisserot. La totalité a été produite en vrac ; pour la moitié, le remplissage en flacons avait déjà été réalisé.
M. le rapporteur. Les autorités des autres pays qui vous ont commandé des vaccins contre la grippe A(H1N1) sont-elles également en négociation pour la résiliation du contrat ?
M. Hervé Gisserot. La plupart des États ont finalisé leur négociation, sur la base, identique, des deux tiers de la valeur initiale du contrat passé – y compris de grands pays, comme l’Allemagne ou le Royaume-Uni, qui avaient commandé des doses en quantités comparables à la France.
Nous n’avons pas obtenu de contrat de pré réservation parce que nous n’avons pas participé à l’appel d’offres. Permettez-moi de citer la déclaration faite par mon prédécesseur lors de son audition devant la mission d’information sur la grippe aviaire : « Lorsque le Gouvernement a lancé l’appel d’offres, nous avons estimé qu’il était trop tôt pour s’engager sur quoi que ce soit. Rien ne dit que les fabricants parviennent à mettre au point un vaccin suffisamment immunogène pour que la réaction soit suffisante après deux doses. Il est possible qu’un fabricant ne parvienne qu’à produire un vaccin efficace seulement après trois ou quatre doses. »
Nous avions considéré, à l’époque, que notre dossier n’était pas suffisamment solide pour pouvoir nous engager vis-à-vis de l’État – bien qu’au moment de la pandémie, notre vaccin s’est révélé probablement le mieux préparé. D’autres ont répondu à l’appel d’offres, mais, comme l’histoire l’a montré, ils n’ont pas pour autant été prêts avant nous.
M. Gérard Bapt. Vous avez dit que 12 millions de doses avaient été livrées au 4 janvier 2010 ; or, la commande initiale prévoyait la livraison de 30 millions de doses à cette date. Pourquoi ce retard ?
Par ailleurs, lorsque, en novembre, alors que vous n’aviez pas encore fabriqué les doses, on a commencé à réaliser qu’un trop grand nombre de vaccins avait été commandé, les conditions de négociation de la résiliation auraient-elles été différentes si l’État avait réduit sa commande ?
M. Hervé Gisserot. Il est difficile de le dire ! Ce qui est probable, c’est que nous aurions recherché la cohérence à l’échelle européenne. La France n’aurait pas été traitée différemment du Royaume-Uni ou de l’Allemagne.
M. Gérard Bapt. On nous a pourtant dit que le Royaume-Uni avait pu adapter sa commande aux besoins, ce qui n’a pas été le cas de la France.
M. Hervé Gisserot. À ma connaissance, le Royaume-Uni avait pris une option sur une tranche additionnelle, mais la commande initiale était fixe.
M. Gérard Bapt. À combien de doses s’élevait-elle ?
M. Hervé Gisserot. La commande portait sur 60 millions de doses, plus une tranche additionnelle de 30 millions.
M. Gérard Bapt. La négociation sur la résiliation portait donc sur 60 millions de doses ?
M. Hervé Gisserot. Je ne connais pas les détails de la négociation britannique. Tout ce que je peux vous dire, c’est que le gouvernement anglais a économisé un tiers de la valeur du contrat initial.
Quant au planning de livraison, il n’était qu’indicatif. Nous avons maintes fois souligné aux autorités qu’il ne pouvait en être autrement, dans la mesure où de nombreux paramètres, comme le rendement de l’antigène, ne pouvaient être connus avant d’avoir manipulé la souche. Nous avons tenu à peu près les délais pour la première livraison, mais le besoin d’optimisation du processus industriel, ainsi que certaines variations réglementaires, n’ont pas permis une montée en puissance aussi rapide que nous le souhaitions, ni d’atteindre le rythme de 2 millions de doses par semaine.
M. Gérard Bapt. La première livraison a été faite très tôt ; j’imagine que ces vaccins ont été utilisés dans les milieux hospitaliers.
Dans la lettre d’intention signée le 14 mai par le directeur de cabinet de la ministre, le prix par dose est de 7 euros hors taxes, à raison de 6 euros pour l’adjuvant et de 1 euro pour l’antigène. Dans la mesure où l’adjuvant peut être conservé durant quatre ans, les produits ne peuvent-ils pas être réutilisés ? L’économie réalisée serait bien supérieure à la somme que vous réclamez à l’État !
Par ailleurs, la commande prévoyait le versement d’arrhes à hauteur de 1,50 euro hors taxes par dose, soit 675 millions d’euros au total. Quand et par qui cette somme a-t-elle été versée ?
M. Hervé Gisserot. Pour les autorités françaises, notre vaccin présentait l’avantage – indépendamment de sa qualité intrinsèque – de proposer un conditionnement séparé de l’adjuvant et de l’antigène. Or, le coût financier reposait essentiellement sur l’adjuvant, qui était utilisable plus longtemps et qui pouvait être combiné avec d’autres antigènes, moyennant des démarches réglementaires complémentaires. Comme on ne mesurait pas bien la vigueur de la pandémie, cela représentait probablement un investissement en vue de constituer un éventuel stock stratégique.
Je retournerai donc votre argument : la France dispose aujourd’hui d’un stock stratégique d’adjuvants qu’elle peut conserver et utiliser dans d’autres circonstances.
M. Gérard Bapt. Mais vous n’avez pas livré les doses qui ont été résiliées. Or vous affirmez que vous avez tout produit. Il vous reste donc un stock important de doses de vaccins ?
M. Hervé Gisserot. Nous avons toujours exprimé aux autorités françaises notre souhait que, comme dans la plupart des autres pays, la résolution de la négociation passe par la commande des deux tiers des doses initiales. Si le Gouvernement français avait souhaité acquérir, non 18 millions de doses, mais les deux tiers des 50 millions commandés, le problème aurait été réglé depuis longtemps !
M. le rapporteur. Combien de doses vous reste-t-il ?
M. Hervé Gisserot. La totalité des 32 millions de doses qui n’ont pas été livrées suite à la révision unilatérale du marché ont été produites en vrac ; pour la moitié d’entre elles, les flacons ont été remplis.
M. le président Jean-Christophe Lagarde. Vous souhaitez être indemnisés à hauteur des deux tiers de ces 32 millions de doses ?
M. Hervé Gisserot. Non, à hauteur des deux tiers de la valeur initiale du contrat.
M. Gérard Bapt. Vous avez cependant reçu des arrhes. Ont-elles été retranchées de la somme que vous réclamez à l’État ?
M. Hervé Gisserot. La lettre d’intention signée le 14 mai prévoyait en effet que ces arrhes, qui devaient correspondre aux honoraires de pré réservation payés par les autres pays, soient incluses dans le prix, c’est-à-dire que le coût final d’une dose soit de 7 euros, et non de 8,50 euros.
M. le président Jean-Christophe Lagarde. Dans le cas contraire, cela n’aurait plus été des arrhes !
M. Hervé Gisserot. Je souligne que la France a bénéficié d’une situation favorable, car, alors que nous avions déjà des engagements contractuels vis-à-vis d’autres pays, non seulement nous avons intégré la France au groupe des pays ayant pré réservé notre vaccin, mais nous ne lui en avons pas fait supporter le coût. Les premières doses de vaccin ont été livrées le 9 octobre, comme à l’Angleterre, à l’Allemagne et à d’autres États qui avaient payé des frais de réservation, alors que la France ne l’avait pas fait.
M. Gérard Bapt. Elle avait quand même versé des arrhes…
M. Hervé Gisserot. Qui étaient incluses dans le coût total de 7 euros et qui, de surcroît, n’ont jamais été versées : elles ont été intégrées dans la facturation finale.
M. Gérard Bapt. Quelles sont les données de pharmacovigilance dont vous disposez sur votre vaccin ?
M. Hervé Gisserot. Le Pandemrix a été administré à quelque 80 millions de personnes dans le monde. Selon nos données de pharmacovigilance, le rapport bénéfice/risques n’a pas été différent de celui prévu par les autorités réglementaires.
M. Gérard Bapt. Les laboratoires Merck et Lilly ont décidé de publier systématiquement les contrats qu’ils passent avec des médecins aux États-Unis. Une telle pratique serait-elle envisageable en France ?
M. Hervé Gisserot. Nous le faisons nous aussi aux États-Unis, et nous allons dans cette voie en Europe, car nous considérons qu’il s’agit d’un besoin sociétal. Si nous voulons que soit définitivement réglé le débat récurrent sur les conflits d’intérêts entre experts, industriels et autorités, nous devons pratiquer la plus grande transparence.
Lors de mon audition par la commission d’enquête du Sénat, le président Autain m’avait demandé, sans grand espoir, de lui communiquer les liens que nous avions avec les experts du secteur du vaccin ; je lui ai répondu par courrier pour chacun d’entre eux, à l’exception d’un seul qui ne m’a pas autorisé à le faire – contractuellement, l’accord de l’expert est nécessaire. C’est dire si nous sommes favorables à une plus grande transparence ! GSK est l’un des laboratoires moteurs en la matière.
M. le président Jean-Christophe Lagarde. Quel est le délai de péremption du Pandemrix après ouverture ?
M. Hervé Gisserot. Le délai de péremption est de 18 mois pour l’antigène et de 36 mois pour l’adjuvant. Après ouverture, le produit doit être utilisé dans les 24 heures.
M. le président Jean-Christophe Lagarde. Le vaccin de l’un de vos concurrents peut être utilisé durant une semaine. Pourquoi cette différence ?
M. Hervé Gisserot. Je ne vois pas à quoi vous faites référence. À ma connaissance, lorsque le vaccin est mélangé, l’autorisation de mise sur le marché (AMM) recommande une utilisation dans les 24 heures.
M. le président Jean-Christophe Lagarde. C’est pourtant ce que les représentants des syndicats et de l’Ordre des médecins nous ont dit hier.
M. Hervé Gisserot. On peut malheureusement utiliser des produits sans respecter les autorisations de mise sur le marché (AMM). Tout ce que je peux dire, c’est que l’AMM recommande d’utiliser notre produit dans les 24 heures après sa reconstitution.
M. le président Jean-Christophe Lagarde. Et le produit de la concurrence ?
M. Hervé Gisserot. A priori, je ne connais pas de vaccin possédant une telle propriété. Toutefois, s’agissant de la concurrence, je ne serai pas formel.
M. le président Jean-Christophe Lagarde. Nous vérifierons.
Vous avez dit que le contrat français ne présentait pas de spécificités suffisantes pour faire l’objet d’une négociation particulière. Eu égard aux difficultés rencontrées, comment, à l’avenir, élaborer un contrat plus équilibré et moins pénalisant pour l’entreprise et pour l’État ? En effet, la moitié des doses dont vous réclamez le paiement à l’État sont en votre possession, en vrac, et sont potentiellement réutilisables dans un vaccin trivalent.
M. Hervé Gisserot. Pour ma part, je ne suis pas assez compétent en matière industrielle pour l’affirmer !
M. le président Jean-Christophe Lagarde. Un industriel que nous avons précédemment auditionné nous a expliqué qu’il intégrerait une partie de l’antigène produit dans un vaccin trivalent ; par ailleurs, l’adjuvant peut également être réutilisé.
M. Hervé Gisserot. Mes compétences en matière industrielle et réglementaire sont insuffisantes pour que je puisse vous répondre. Il se peut que l’antigène soit réutilisable, mais notre vaccin contre la grippe saisonnière étant sans adjuvant, la seconde hypothèse ne nous concerne pas. Nous développons un tel vaccin, mais nous ne l’avons pas encore commercialisé.
Quant au contrat, j’espère que vos commissions d’enquête permettront de concevoir des solutions plus judicieuses pour chacune des parties. Selon moi, face à un risque aléatoire, l’approche assurantielle serait la plus pertinente : on tâcherait de clarifier les choses en période non pandémique, en espérant que le risque couvert ne se présentera pas ; c’est d’ailleurs dans cet esprit que les autorités françaises ont passé l’appel d’offres en 2005.
M. Yves Bur. Si les négociations avec le Gouvernement aboutissent dans le sens que vous souhaitez, celui-ci vous réglera les deux tiers des 50 millions de doses commandées, soit 33 millions de doses.
M. Hervé Gisserot. Non, car, à mon grand regret, la négociation ne porte pas sur des doses, mais sur une somme d’argent. À ma connaissance, le Gouvernement n’envisage pas de constituer un stock de 33 millions de doses. GSK demande que le Gouvernement lui verse une somme correspondant à la valeur de ces 33 millions de doses.
M. Yves Bur. Le Gouvernement aura donc payé l’équivalent de 33 millions de doses. Sur les 18 millions de doses qui lui ont été déjà livrées, moins de 6 millions ont été utilisées. Il existe donc déjà un stock de 12 millions. Les 11 millions de doses restantes seront-elles livrées aux autorités françaises ou les conserverez-vous ?
M. Hervé Gisserot. Si le Gouvernement le souhaite, nous les lui livrerons. Cette possibilité a été évoquée, et elle a été mentionnée dans la presse sous l’expression de « droit de tirage ». Ce sont les autorités françaises qui ont décidé d’abandonner cette piste.
M. le président Jean-Christophe Lagarde. Il faut dire qu’aux 12 millions de doses de Pandemrix s’ajoute le stock de Panenza : nous avons de quoi faire !
M. Gérard Bapt. Soulignons l’embarras des autorités françaises qui, non seulement se retrouvent avec un stock de vaccins sur les bras, mais doivent, de surcroît, conduire une négociation difficile.
Combien de doses de vaccin avez-vous produit dans le monde ?
M. Hervé Gisserot. Nos principaux contrats ont été européens – même si le Japon a été également un marché important. Comparativement, notre présence en Amérique fut beaucoup moins forte.
M. Gérard Bapt. Au total, vous avez donc produit quelque 800 millions de doses ?
M. Hervé Gisserot. Je dirais plutôt entre 600 et 700 millions – mais je vous communiquerai le chiffre précis.
M. Gérard Bapt. J’ai lu qu’il aurait été produit un milliard de doses de vaccins dans le monde – mais ce chiffre a été probablement sous-évalué. Sachant que l’on évalue à 300 millions le nombre de doses injectées, il existerait donc un stock de 700 millions de doses, au minimum. C’est énorme !
M. Hervé Gisserot. Le chiffre d’un milliard me semble plausible, dans la mesure où GSK a obtenu une part très significative des marchés passés par les autorités à travers le monde.
M. Gérard Bapt. Quoi qu’il en soit, cela reste sur l’estomac !
Un texte relatif à un partage d’avantages sur les fabrications de vaccins entre l’Organisation mondiale de la santé (OMS) et les firmes pharmaceutiques est actuellement en préparation. Personnellement, je m’interroge beaucoup ce qui s’est passé au sein de l’OMS durant cette pandémie. En dehors de contrats de recherche et des dons de vaccins à destination des pays pauvres, existe-t-il aujourd’hui des contrats de financement de structures de l’OMS par des laboratoires ?
M. Hervé Gisserot. Qu’est-ce à dire ?
M. Gérard Bapt. Le texte qui est présenté au conseil exécutif de l’OMS, et qui devrait venir en discussion à l’assemblée générale au mois de mai, évoque un partage d’avantages en fonction du niveau de production des vaccins. Pour l’heure, les États financent les structures de l’OMS, mais ces financements deviennent à l’évidence insuffisants. Le projet vise à ce que les laboratoires financent les structures de l’OMS en fonction du niveau de production des vaccins – comme si les laboratoires « renvoyaient l’ascenseur » à l’OMS, qui leur a fourni gratuitement les souches. Je voudrais donc savoir s’il existe déjà, actuellement, des contrats de financement de structures de l’OMS par les laboratoires.
M. Hervé Gisserot. N’étant pas suffisamment compétent en la matière, il m’est difficile de vous répondre sous serment.
M. le président Jean-Christophe Lagarde. Il me semble que nous nous éloignons de notre sujet…
Monsieur Hervé Gisserot, nous vous remercions.
La séance est levée à dix-huit heures cinquante.
Audition de M. Alexandre Sudarskis,
directeur général de Novartis vaccins et diagnostics
(Procès-verbal de la séance du mercredi 28 avril 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-neuf heures.
(M. Alexandre Sudarskis prête serment.)
M. Alexandre Sudarskis, directeur général de Novartis vaccins et diagnostics. Plutôt que de vous imposer un exposé liminaire, je vous propose de nous livrer sans plus tarder au jeu des questions-réponses.
M. Jean-Pierre Door, rapporteur. Pouvez-vous nous indiquer comment s’est déroulée la phase de négociations entre votre entreprise et les autorités françaises pour la commande de 16 millions de doses de vaccin contre la grippe H1N1 ? A-t-elle présenté des similitudes avec ce qui s’est passé dans d’autres pays, en particulier quant au nombre de doses et à l’organisation de votre production et de votre distribution ? Sur quels sites les vaccins ont-ils été produits ?
M. Alexandre Sudarskis. Nous avons répondu, en février 2005, à un appel d’offres, dans le cadre d’un marché public, portant sur deux lots de vaccins, l’un contre le virus de la grippe aviaire H5N1, l’autre contre un virus pandémique mutant. Nous nous sommes prononcés sur le second lot, qui comportait une première tranche ferme portant sur 600 000 traitements et trois tranches conditionnelles pour un total de 12 millions de traitements.
L’appel d’offres nous a été notifié pour valoir engagement en avril 2005 et l’acceptation est intervenue en juillet 2005, de même que le visa du contrôleur financier.
En mai 2007, nous avons obtenu un avis favorable de l’Agence européenne du médicament sur notre dossier prototype dit « mock-up » du vaccin contre la grippe aviaire H5N1, adjuvanté au MF59 à base de squalène.
Nous avons exécuté en juin 2009 la première tranche ferme de 1,2 million de doses, sur la base de deux doses pour 600 000 traitements.
À compter de mai 2009, nous avons été contactés pour les tranches conditionnelles portant sur le virus H1N1 et nous avons eu des échanges en mai et juin avec la direction générale de la santé, la DGS, et avec l’Établissement de préparation et de réponse aux urgences sanitaires, l’ÉPRUS. Nous avons ainsi signé, le 29 juillet 2009, un avenant au contrat, portant sur l’affermissement de la première tranche conditionnelle pour 16 millions de doses. Mais une autre tranche conditionnelle de 8 millions de doses était également prévue, ce qui explique le chiffre de 24 millions de doses paru dans la presse.
Sur ce contrat de 16 millions de doses, nous en avions livré 9 millions, lorsque, le 4 janvier 2010, l’ÉPRUS nous a notifié la résiliation de la commande de 7 millions de doses.
M. le rapporteur. Quel était le prix d’une dose de votre vaccin Focetria ?
M. Alexandre Sudarskis. Ce prix était de 9,34 euros hors taxes.
Le contrat portait sur la fourniture de vaccins multidoses et sur la possibilité de fournir des monodoses. En fait, 65 % des 9 millions de doses que nous avions livrées en janvier 2010 se présentaient sous la forme de seringues préremplies, donc de monodoses.
M. le rapporteur. Sous quel délai avez-vous pu fournir ces monodoses ?
M. Alexandre Sudarskis. Les délais de fabrication étaient plus longs que pour des multidoses, en raison de l’état de nos équipements de mise sous forme à la date à laquelle a été passée la commande, du fait que la commande ne portait pas uniquement sur le marché français, mais aussi de la nécessité de continuer à fournir nos autres vaccins, en particulier pédiatriques et contre la grippe saisonnière.
Les livraisons ont débuté le 12 novembre, par des lots de 250 000 doses de vaccin adjuvanté, puis elles se sont échelonnées. Nous avons livré à la fois des seringues préremplies et des flacons multidoses jusqu’à la première semaine de janvier. À la fin décembre, nous avions livré 1,9 million de doses en seringues préremplies.
Pour le vaccin contre la grippe, Novartis dispose de trois centres de production dotés de plates-formes technologiques différentes. C’est en Italie qu’a été produit le vaccin Focetria, adjuvanté au MF59, que nous avons fourni à la France, à partir d’une culture sur œuf, donc du mode de production traditionnel de notre vaccin contre la grippe saisonnière, distribué en France sous le nom de Gripguard.
Nous disposons d’une autre unité de production en Allemagne, avec un vaccin également fabriqué sur œuf et un vaccin fabriqué sur culture cellulaire, Optaflu. Cette dernière technologie étant de développement récent, les volumes produits ont été relativement faibles en 2009.
Enfin, notre unité de production implantée à Liverpool fournit les États-Unis et, dans une moindre mesure, le Royaume-Uni, en vaccins non adjuvantés produits à partir d’une culture sur œuf.
M. le rapporteur. Comment la négociation de l’indemnisation de l’annulation de 7 millions de doses en janvier 2010 s’est-elle déroulée ?
Je m’étonne par ailleurs que le prix de la dose de votre vaccin soit supérieur d’environ deux euros à celui de vos concurrents, s’agissant, comme eux, d’un produit adjuvanté et sous forme multidoses. Quel est le prix de votre vaccin contre la grippe saisonnière ?
M. Alexandre Sudarskis. Il varie de 4,50 euros en France pour le vaccin adjuvanté à plus de 15 euros sur les marchés allemands notamment.
S’agissant de Focetria, c’est un prix moyen que je vous ai donné. Je rappelle que les prix ont été établis en 2005, dans le cadre d’un contrat global de services qui ne portaient pas initialement sur la fourniture de vaccins contre la pandémie H1N1, mais sur le développement d’un vaccin contre la grippe aviaire. L’engagement que nous prenions de mobiliser nos équipes et nos équipements et de développer un nouveau produit était donc répercuté dans le prix fixé à l’époque. On ne peut pas comparer la réponse à l’appel d’offres de 2005 à un prix négocié ultérieurement et pour des volumes différents, par d’autres laboratoires.
La négociation sur la résiliation de la commande de 7 millions de doses a débouché sur une indemnisation à hauteur de 16 % du montant de la commande annulée, soit un montant total de 10,5 millions d’euros hors taxes.
La majeure partie des doses de la commande annulée avait déjà été fabriquée puisque l’annulation est intervenue le 4 janvier et que notre planning de livraisons courait jusqu’à début février.
M. le rapporteur. Que faire des doses qui vous restent en stock ?
M. Alexandre Sudarskis. Une partie des doses avait déjà été conditionnée sous la forme spécifique qui nous avait été imposée par la France. Elles ne peuvent donc pas être réutilisées et elles demeurent en stock chez nous où elles seront détruites à la fin de la validité du produit. Seuls des produits en vrac pourraient être réutilisés dans le cadre d’un vaccin saisonnier qui contiendrait la souche H1N1.
M. le rapporteur. Même les vaccins sous forme multidoses ne peuvent pas être reconditionnés et réutilisés ? Certains de vos concurrents disent que ce serait possible.
M. le président Jean-Christophe Lagarde. Il me semble que les concurrents parlaient uniquement du vrac. Une partie des 7 millions de doses annulées est-elle demeurée sous cette forme ?
M. Alexandre Sudarskis. Plus de 5 millions de doses étaient déjà mises sous forme, que ce soit en monodoses ou en multidoses, et il était donc absolument impossible de les réutiliser. Pour le reste, soit 2 millions de doses, le vrac en était à diverses étapes de production.
M. Gérard Bapt. Ne pourrait-on, au lieu de se contenter d’attendre la date de destruction, offrir ces vaccins à des pays qui n’ont pas eu les moyens de les commander et où des foyers sont encore signalés ?
M. Alexandre Sudarskis. Nous avions un accord avec la direction générale de la santé (DGS) pour qu’une partie des 9 millions de doses que nous avions déjà livrées soit allouée à l’Organisation mondiale de la santé (OMS) et des livraisons ont été effectuées vers quatre ou cinq pays qui en avaient fait la demande auprès des autorités françaises.
Quelques livraisons ont également été faites pour la partie qui nous reste en stock, mais le conditionnement spécifique des vaccins pour la France rend leur réutilisation difficile, d’autant que nous n’avons pas eu de demande de pays francophones.
M. le président Jean-Christophe Lagarde. Je reviens sur le fait que vous êtes l’un des rares laboratoires avoir produit des monodoses. Pourquoi ? Qui vous l’a demandé ?
M. Alexandre Sudarskis. Le contrat signé en 2005 prévoyait la possibilité de livrer en monodoses et cela correspondait alors à nos capacités de mise sous forme. En fait, ce choix était lié aux volumes et aux types d’utilisation : si le produit qui devait être livré était réservé à des populations spécifiques, il semblait logique de le produire en monodoses ; en revanche, pour une vaccination de masse, la production multidoses paraissait plus indiquée. Il s’agissait en fait d’un service supplémentaire que nous offrions dans le cadre de ce contrat.
M. le président Jean-Christophe Lagarde. Vous nous avez indiqué un prix moyen du vaccin, mais j’aimerais vraiment que vous parveniez à distinguer le prix en mono et en multidoses, car cela nous donnerait une idée de la différence de coût selon deux modes d’organisation de la vaccination.
Par ailleurs, certains de vos concurrents nous ont dit qu’ils avaient déposé auprès des autorités européennes, dans le cadre de la vaccination contre le virus H5N1, des dossiers relatifs aux multidoses. Est-ce parce que c’était cette forme qui leur avait été demandée ou parce qu’ils avaient eux-mêmes fait ce choix ?
Enfin, qui a fixé à 5 millions sur un total de 9 millions le nombre de doses que vous avez livrées sous forme individuelle ?
M. Alexandre Sudarskis. Dès le dossier maquette pour la demande d’autorisation préalable portant sur le vaccin contre le virus H5N1, nous avions prévu la fourniture en mono et en multidoses, sans toutefois prendre d’engagement sur les volumes.
M. le président Jean-Christophe Lagarde. Mais vous avez bien considéré que vous seriez ainsi apte à répondre aux deux types de demande et vous avez dès lors simultanément présenté les deux dossiers, alors que nous avions cru comprendre que cela présentait des difficultés.
M. Alexandre Sudarskis. Il n’y avait pas de difficulté particulière dans la mesure où le vaccin contre la grippe saisonnière était déjà fabriqué en monodoses et où les chaînes de production étaient donc adaptées pour cela.
M. le président Jean-Christophe Lagarde. La ministre a annoncé en janvier qu’elle disposait de 5 millions de monodoses alors que, si j’ai bien compris, vous en aviez livré 1,9 million fin décembre. L’accélération a donc été rapide. Pouvez-vous préciser les délais de fabrication, ou, plus exactement, nous dire à quel moment des monodoses sont sorties de vos chaînes de production et ont été disponibles ?
M. Alexandre Sudarskis. La première livraison de 249 000 monodoses a eu lieu le 12 novembre et, fin novembre – et non fin décembre comme je l’ai indiqué tout à l’heure par erreur –, nous en avions livré un total de 1 980 000. Fin décembre, le nombre total de monodoses livrées était de 4,3 millions.
C’est également le 12 novembre que nous avons effectué la première livraison de 600 000 vaccins en multidoses. D’autres livraisons sont intervenues le 17 et le 19 novembre, pour atteindre à cette date un total de 1 784 000.
M. le président Jean-Christophe Lagarde. Si vous avez été capables de livrer 1 784 000 multidoses le 19 novembre et 1 980 000 monodoses à la fin du même mois, cela signifie que les délais de fabrication sont peu ou prou les mêmes. Cette information n’est pas dénuée d’intérêt dans notre réflexion sur l’organisation des campagnes de vaccination.
M. Alexandre Sudarskis. Ces chiffres correspondent à la demande qui nous était faite mais pas à nos capacités de production : n’oubliez pas que nous avons livré des vaccins dans plusieurs dizaines de pays pour atteindre, fin janvier, un total de 154 millions de doses, au sein duquel la proportion de monodoses est bien plus faible que ce que vous venez d’indiquer.
M. le président Jean-Christophe Lagarde. Si vous avez livré autant de monodoses en France à ce moment, c’est donc bien parce que c’est ce qui vous était demandé.
M. Alexandre Sudarskis. Nous avons fourni alors le plus de monodoses possible car je crois me souvenir que l’on nous avait demandé un effort particulier en ce sens. Mais cela ne signifie pas que nous sommes capables de produire la moitié de nos vaccins sous cette forme.
M. le président Jean-Christophe Lagarde. Le fait que l’on vous demande d’accroître cette production vous a-t-il conduit à modifier celle d’autres vaccins ?
M. Alexandre Sudarskis. Bien évidemment, mais cela n’est pas lié à la demande spécifique des autorités françaises. L’entreprise a été réorganisée en profondeur afin de faire face à la demande globale et cela a eu un impact sur les autres productions de vaccins, qui ont été repoussées ou mises sous forme différemment. Nous avons également mobilisé des unités de remplissage et de conditionnement dans d’autres usines du groupe et chez des fournisseurs tiers. Là où des capacités de mise sous forme étaient disponibles, près de 1 000 salariés de Novartis sont venus renforcer les équipes dédiées aux vaccins.
M. le président Jean-Christophe Lagarde. Je vous ai entraîné sur d’autres terrains, mais j’aimerais que vous répondiez à ma question sur le prix des différentes formes du vaccin.
Pouvez-vous par ailleurs nous dire si la France est le seul pays qui vous a demandé de livrer des monodoses ?
Enfin, combien de temps après son ouverture un flacon de multidoses est-il périmé ?
M. Alexandre Sudarskis. Il est recommandé d’utiliser dans les 24 heures un flacon ouvert.
Je ne dispose pas de l’information sur le nombre de monodoses commandées par d’autres pays, mais je vous la fournirai par courrier.
Quant au prix, je rappelle qu’il a été établi il y a cinq ans, sur la base non pas d’une dose mais d’un service. Il n’y a donc pas eu de négociation sur le prix, mais une réponse de notre part à un appel d’offres portant sur le développement d’un vaccin prépandémique contre le virus de la grippe aviaire et non sur la fourniture d’un vaccin contre le virus H1N1. Il s’agissait de tranches conditionnelles qui, pour la plupart, n’ont pas été affermies. C’est pour ces raisons que le prix diffère de celui d’autres laboratoires.
M. le président Jean-Christophe Lagarde. Lorsque vous répondez à l’appel d’offres en 2005, il n’y a donc pas de prix différent pour le vaccin mono ou multidoses : vous fixez un prix global et vous livrez en fonction de vos capacités.
M. Alexandre Sudarskis. On ignorait en outre à ce moment combien il faudrait de doses pour chaque traitement. Ce n’est qu’en développant le dossier maquette du vaccin contre le virus H5N1 qu’il est apparu que deux doses étaient nécessaires.
M. le rapporteur. Le chiffre de 154 millions de vaccins vendus au total correspond-il aux marchés définis en 2005 ?
M. Alexandre Sudarskis. Non, il s’agit du nombre de vaccins contre la grippe H1N1 livrés en 2009 et 2010.
M. le rapporteur. D’autres pays avaient-ils, comme la France, signé un contrat dès 2005 ?
M. Alexandre Sudarskis. L’Italie a également signé un contrat prépandémique en 2005 ; d’autres pays ne se sont prononcés qu’ultérieurement.
M. le rapporteur. Votre potentiel de livraisons était de 154 millions de vaccins.
M. Alexandre Sudarskis. Il était en fait supérieur : nous avons livré un peu moins de vaccins que ce qui nous avait été commandé, mais je ne dispose pas ici du détail.
M. le rapporteur. L’indemnisation, dont vous nous avez dit qu’elle avait été en France de l’ordre de 16 %, a-t-elle été identique dans les autres pays où il y a eu rupture de contrat ?
M. Alexandre Sudarskis. Nous étions contractants aux Pays-Bas, où il n’y a pas eu de rupture de contrat et où nous avons fourni l’intégralité de la commande. Je ne dispose pas de l’information en ce qui concerne l’Italie.
Mais chaque contrat répondant bien évidemment aux prescriptions de la législation nationale, la négociation des indemnités a varié selon les pays. En France, nous nous sommes appuyés sur la jurisprudence en matière de marchés publics.
M. Gérard Bapt. Dans votre contrat, il était indiqué qu’« une partie de la production pourra être conditionnée en monodoses, sur demande de l’ÉPRUS, dans la limite de 10 % de la commande considérée ». Si vous êtes allés bien au-delà, est-ce de votre propre chef ou parce qu’il y a eu une demande expresse en ce sens de l’ÉPRUS, ce qui pourrait donner à penser qu’il s’agissait de préparer la vaccination par les généralistes ?
M. Alexandre Sudarskis. Les 10 % correspondaient à une évaluation, au moment où nous avons passé les contrats, de nos capacités à fournir des seringues monodoses, soit 2,5 à 3 millions de doses, à partir de l’hypothèse de 16 millions de doses plus 8 millions de tranches conditionnelles. En fait, nous en avons livré un peu plus, à la demande des autorités.
M. Gérard Bapt. En juillet 2009, on est parti d’un contrat prépandémique portant sur 12 millions de doses pour 6 millions de traitements. Est-ce, là aussi, le Gouvernement qui vous a demandé de passer à 16 millions ?
M. Alexandre Sudarskis. Nous étions alors tous sous le choc de la déclaration de la pandémie et l’on nous demandait de façon pressante de fournir un maximum de doses dans les délais les plus rapides. Nous avons donc effectivement répondu à la demande des autorités, le calendrier étant toutefois optionnel.
M. Gérard Bapt. Pour Sanofi, le contrat prépandémique a simplement été affermi en juillet, sans commande supplémentaire.
M. Alexandre Sudarskis. Je crois savoir que Sanofi ne pouvait pas livrer avant le mois de décembre et les autorités souhaitaient qu’un maximum de doses soit livré entre septembre et décembre, avant que Sanofi soit en capacité de prendre la suite.
M. Gérard Bapt. S’agissant des responsabilités, votre contrat indique que « considérant les circonstances exceptionnelles qui caractérisent l’objet, l’État s’engage à garantir le titulaire contre les conséquences de toute réclamation ou action judiciaire pour les effets secondaires éventuels d’un vaccin ». Cette clause est dérogatoire par rapport au contrat relatif à la vaccination saisonnière. Or, maintenant que vous avez une certaine expérience et des retours de pharmacovigilance, il apparaît que les industriels n’ont pas été confrontés à des effets indésirables majeurs, c’est en tout cas ce que nous a indiqué le représentant du laboratoire GSK. Pensez-vous que les contrats à venir continueront néanmoins à comporter une telle décharge de responsabilité ?
M. Alexandre Sudarskis. Notre responsabilité peut toujours être engagée pour faute. Par ailleurs, nous parlons de produits utilisés dans le cadre de leur autorisation de mise sur le marché. Mais ce n’était pas le cas au moment où cette clause a été négociée. Elle figure dans l’avenant et a été rediscutée au mois de juillet, mais elle existait pratiquement en l’état dans le contrat de 2005. Nous n’avons donc pas cherché à la modifier au moment de la pandémie.
Dans l’éventualité d’une autre pandémie et dans le cas d’une vaccination d’urgence et de masse, il me paraîtrait difficile de demander à un laboratoire de supporter la responsabilité, dans la mesure où il ne communique pas lui-même sur son produit et où il n’est maître ni de sa distribution ni de ses conditions d’utilisation. Les choses sont très différentes pour le vaccin saisonnier, pour lequel nous sommes maîtres de notre communication auprès du corps médical et dont l’utilisation est strictement conforme aux indications.
M. Gérard Bapt. Votre contrat court jusqu’en 2011. Si un virus mutant apparaissait en novembre 2010, comme le prédisent les virologues, un peu comme on annonçait jadis systématiquement le retour du loup, et si l’Organisation mondiale de la santé (OMS) déclarait une nouvelle fois l’urgence, ce contrat serait donc à nouveau en vigueur.
M. Alexandre Sudarskis. Certes, mais, si le contrat indique clairement qu’il est nécessaire que le niveau pandémique soit déclaré par l’OMS pour permettre aux autorités de passer éventuellement commande, cela n’a rien d’automatique. D’ailleurs, lors de la crise précédente, l’OMS a déclaré le niveau 6, ce que la France n’a jamais fait.
Pour autant, en cas de nouvelle pandémie, les autorités pourraient effectivement bénéficier des engagements que nous avons pris de développer un vaccin sur la base d’un virus pandémique et de le fournir dans des délais raisonnables.
M. Gérard Bapt. Sur un milliard de vaccins commandés, 300 millions seulement ont été injectés. Vous conservez donc en stock un grand nombre de vaccins appelés à se périmer et l’indemnisation que vous avez obtenue à ce titre paraît faible par rapport à celle d’autres laboratoires. Quel type de contrat pourrait-on prévoir à l’avenir afin d’éviter ce qui apparaît à l’opinion publique comme un véritable gâchis ? Faut-il envisager des options successives, au fur et à mesure que l’on apprécie le risque réel mais aussi la propension de la population à se vacciner ?
M. Alexandre Sudarskis. Il faut mettre en face de la demande les capacités globales de l’industrie pharmaceutique, que l’on peut estimer entre 700 et 900 millions de doses.
M. Gérard Bapt. Le problème est en fait d’adapter la demande aux besoins, sans provoquer à chaque fois de telles turbulences.
M. Alexandre Sudarskis. Outre les besoins, les délais constituent également une contrainte : on nous demande un certain nombre de doses, tout de suite et en tout cas avant ses voisins...
Dans une perspective strictement nationale, l’important est d’assurer l’autosuffisance, soit par une augmentation des capacités de production sur le sol national, soit par des engagements contractuels comme ceux qui avaient été souscrits en 2005. On peut aussi augmenter le taux de couverture par la vaccination saisonnière, ce qui présenterait l’avantage de mieux protéger les populations à risque, mais aussi de développer les capacités de faire face à une éventuelle pandémie. Qui plus est, des études montrent que l’adjuvantation favorise une immunité croisée protégeant la population contre d’éventuelles faibles mutations des virus qui circulent.
M. le président Jean-Christophe Lagarde. Une coordination européenne des commandes et des décisions, notamment pour les préréservations, présenterait-elle selon-vous une utilité pour augmenter les capacités industrielles ou vaut-il mieux se concentrer sur le vaccin saisonnier ? Pour dire les choses autrement, le fait que les États se soient livrés une certaine concurrence a-t-il posé des problèmes au regard de la production industrielle ?
M. Alexandre Sudarskis. Nous avons tenu les engagements qui avaient été souscrits, mais il est certain que cette concurrence a exercé une pression sur les négociations.
Pour sa part, l’industrie essaie de développer au niveau européen une politique vaccinale qui permettrait à la fois d’augmenter le taux de couverture et de garantir un certain niveau de production de haute technologie sur le continent. Le regroupement des industriels au sein d’une association européenne des fabricants de vaccins va dans ce sens.
Les États-Unis ont réalisé de très importants investissements pour développer des cultures cellulaires sur leur territoire dans le cadre du programme de lutte contre le bioterrorisme. Cela a permis d’aller plus vite et d’engager des investissements en faveur de technologies innovantes.
M. le rapporteur. Dans le cadre du dernier plan de recherche européen, un budget est également prévu pour développer les vaccins et l’antibiothérapie contre les nouveaux risques.
M. le président Jean-Christophe Lagarde. Vous évoquez les États-Unis. La vaccination s’y est faite de façon totalement différente, sous la forme de sprays, dont la production est plus rapide. Quel jugement portez-vous sur ce mode de protection, qui a permis de couvrir un plus grand nombre de personnes que nous n’avons été capables de le faire ?
M. Alexandre Sudarskis. Les États-Unis ont utilisé les sprays dans une proportion relativement faible par rapport aux injections et nous leur avons d’ailleurs fourni une très importante quantité de vaccins multidoses à partir de notre plate-forme britannique.
Faute de disposer d’études sur l’efficacité et sur la tolérance de ce mode de vaccination, je n’ai pas de commentaire particulier à faire à propos. Mais c’est une voie que d’autres laboratoires explorent.
M. Gérard Bapt. L’assemblée générale de l’Organisation mondiale de la santé (OMS) sera prochainement appelée à se prononcer sur un texte relatif au partage d’avantage avec les fabricants de vaccin antigrippal. Savez-vous si, en dehors de programmes de recherche ou de la mise à disposition de vaccins pour les pays pauvres, des laboratoires financent déjà directement certaines structures de l’OMS ?
M. Alexandre Sudarskis. Novartis pratique en direction des pays en développement une politique de remises qui consiste en fait à leur fournir des produits à des prix subventionnés par les pays développés. S’agissant plus particulièrement de la grippe, l’OMS nous a demandé de faire des dons.
Il est par ailleurs souhaitable que les laboratoires, publics et privés, aient un libre accès aux virus circulants, afin de pouvoir les identifier et fabriquer des vaccins.
M. le président Jean-Christophe Lagarde. Vous avez suivi comme nous la polémique sur les experts. J’imagine que vous êtes, comme vos concurrents, disposés à publier l’intégralité des contrats que vous avez passés avec eux.
M. Alexandre Sudarskis. La question nous a été posée par la commission d’enquête du Sénat et nous avons répondu que Novartis mène une politique de transparence de ses activités comme de ses relations avec les experts. Il faudra étudier les modalités concrètes de cette publicité, mais nous y sommes bien entendu ouverts.
M. le président Jean-Christophe Lagarde. Qu’est-ce qui empêche de le faire dès aujourd’hui, comme les laboratoires américains ?
M. Alexandre Sudarskis. Nous-mêmes le faisons aux États-Unis, dont nous respectons la législation.
En France, tous nos contrats respectent, outre le droit français, une procédure interne extrêmement rigoureuse. Qui plus est, les experts en font la déclaration et ces contrats sont donc disponibles.
M. le président Jean-Christophe Lagarde. Pourquoi faudrait-il instituer en France une obligation légale pour que vous y fassiez ce que vous faites déjà aux Etats-Unis ?
M. Alexandre Sudarskis. Parce qu’il est souhaitable que tout le monde soit appelé à respecter les mêmes procédures. Bien évidemment, dès lors qu’il existerait une obligation de publier l’ensemble de nos contrats, nous le ferions comme nous le faisons aux Etats-Unis, cela ne nous pose aucun problème en termes d’éthique.
M. le président Jean-Christophe Lagarde. Si je comprends bien, vous préféreriez qu’une obligation légale impose les mêmes règles à tous, cette publication pouvant avoir un effet dans un cadre concurrentiel.
M. Alexandre Sudarskis. Cela peut arriver, en fonction des travaux menés par les experts.
M. le rapporteur. Où se situent vos centres de recherche ?
M. Alexandre Sudarskis. En matière de vaccins, nous avons peu d’activité de recherche en France : celle-ci se concentre essentiellement aux États-Unis, en Italie et en Allemagne.
Mais la question relative aux experts concerne l’ensemble de la recherche et nous menons effectivement en France des travaux de recherche pharmaceutique.
M. le président Jean-Christophe Lagarde. Qui plus est, il n’y a pas de raison pour que la communication se limite aux activités de recherche exercées en France.
M. Alexandre Sudarskis. Je pense d’ailleurs que les informations sont disponibles sur les sites internet des institutions de recherche américaines.
M. le président Jean-Christophe Lagarde. Il me reste à vous remercier d’avoir participé à cette audition.
La séance est levée à vingt heures.
Audition de M. Jean Marimbert,
directeur général de l’Agence française de sécurité sanitaire des produits de santé
(Procès-verbal de la séance du mercredi 5 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt.
(M. Jean Marimbert prête serment.)
M. le président Jean-Christophe Lagarde. Nous souhaitons examiner avec vous, monsieur le directeur général, la question des vaccins, de leurs dates de mise sur le marché, de leur conditionnement, ainsi que la participation de l’Agence française de sécurité sanitaire des produits de santé aux décisions internationales sur les vaccins à diffuser. Je vous propose de faire un exposé introductif d’une dizaine de minutes, qui sera suivi d’un échange de questions-réponses avec les commissaires.
M. Jean Marimbert, directeur général de l’Agence française de sécurité sanitaire des produits de santé. Je rappellerai tout d’abord brièvement les principales activités de l’Agence française de sécurité sanitaire des produits de santé dans le chantier de la pandémie grippale avant d’évoquer l’organisation de ses processus d’intervention. Je terminerai par quelques commentaires de portée plus générale.
Nous avions commencé de travailler bien avant le début de la pandémie de grippe A(H1N1), nous préparant plutôt à une pandémie H5N1. Dans cette perspective, nous avions notamment contrôlé les stocks stratégiques de produits de santé détenus par l’État, établi, à la demande du ministère de la santé, une liste de médicaments et de dispositifs médicaux indispensables en cas de pandémie, et autorisé l’Établissement de préparation et de réponse aux urgences sanitaires en tant qu’établissement pharmaceutique.
L’apparition du virus A(H1N1) et le passage à une pandémie ont démultiplié les activités de l’agence que l’on peut classer en deux catégories.
La première englobe celles liées à l’exercice des missions propres de l’agence, débouchant sur des décisions prises par son directeur général au nom de l’État en vertu de la loi. Pour les vaccins, il s’est agi notamment des autorisations accordées durant l’été 2009 pour des essais cliniques ou des études de suivi concernant le virus A(H1N1), d’autorisations d’importations et de certificats de libération de lots, sachant que tout lot de vaccins doit faire l’objet avant sa mise sur le marché d’un certificat émanant d’un organisme public de contrôle habilité – en France, ce sont les laboratoires de l’agence qui libèrent environ 40 % des lots commercialisés en Europe et environ la moitié de ceux commercialisés en France. L’agence a par ailleurs évalué le vaccin non adjuvanté Panenza ainsi que l’oseltamivir PG, développé par la pharmacie centrale des armées sous forme de comprimés sécables et que nous avons autorisé dans le courant de l’automne. Elle s’est occupée également du suivi des effets de la vaccination mis en place pour la circonstance, combinant un dispositif renforcé de pharmacovigilance, ouvert pour la première fois à grande échelle à la déclaration par les patients eux-mêmes, et une série d’études de suivi centrées sur certaines populations comme les femmes enceintes ou certains risques comme le syndrome de Guillain-Barré. En dehors des vaccins, l’agence a également procédé à des évaluations d’antiviraux et de solutions hydro-alcooliques.
L’agence a également fourni au ministère de la santé des éléments d’expertise et des avis pour l’éclairer dans les décisions qui lui incombaient – je pourrai revenir plus en détail sur ce point si vous le souhaitez. Enfin, l’agence a participé à la production et à la diffusion d’informations concernant les produits de santé utilisés en période pandémique. Elle a ainsi ouvert une rubrique sur son site internet, organisé deux conférences de presse dans ses locaux et participé à de très nombreux points de presse organisés au ministère de la santé à partir du début de la campagne de vaccination.
Quelques mots maintenant de l’organisation des processus d’intervention de l’agence. La plupart d’entre eux sont assurés intégralement en régie, par des agents de l’agence, en particulier pour tout ce qui concerne le contrôle en laboratoire et l’inspection des sites.
Pour ce qui concerne la pharmacovigilance, le travail a reposé essentiellement sur la collaboration entre les équipes internes du service concerné de l’agence et le réseau des centres régionaux de pharmacovigilance qui recevaient les signalements des professionnels de santé et des patients, avec le concours, comme c’est la règle, des services de pharmacovigilance des laboratoires, destinataires eux aussi de signalements.
La mise au point des études de suivi a donné lieu à des échanges entre les équipes de l’agence et certains centres académiques, notamment des services de neurologie pour assurer un suivi spécifique du syndrome de Guillain-Barré.
S’agissant de l’évaluation des vaccins, il faut distinguer, d’une part, la participation de l’agence aux processus d’évaluation par le Comité des spécialités pharmaceutiques à usage humain (CHMP, Committee for medicinal products for human use), comité scientifique européen où elle est représentée et, d’autre part, les travaux menés en dehors de ce cadre centralisé. L’agence a été amenée, la France étant le pays rapporteur, à évaluer le vaccin non adjuvanté Panenza avec les agences des quatre autres pays parties à la procédure de reconnaissance mutuelle qui a débouché sur une décision d’autorisation juridiquement nationale. Cela s’est fait essentiellement avec des évaluateurs internes, dont le travail a servi de base à une consultation du groupe de travail de la commission d’autorisation de mise sur le marché chargée des médicaments anti-infectieux, puis de la commission d’autorisation de mise sur le marché en formation plénière. Il en a été de même pour l’évaluation de l’oseltamivir PG, dont il fallait vérifier la bioéquivalence avant de pouvoir lui accorder une autorisation de mise sur le marché.
Les évaluations ont été conduites dans le respect des principes de collégialité et de pluridisciplinarité, auxquels j’attache personnellement la plus grande importance ; de déclaration des intérêts pris en compte pour écarter les experts se trouvant dans une situation de conflit d’intérêts avérée pour le produit concerné ; de transparence du processus, laquelle s’est traduite par la mise en ligne non seulement des documents de synthèse et des rapports publics d’évaluation mais aussi des comptes rendus des séances des commissions, depuis 2006 pour la commission nationale de pharmacovigilance et depuis 2007 pour la commission de contrôle de la publicité et la commission d’autorisation de mise sur le marché. La loi de 2007 a d’ailleurs rendu cela obligatoire pour toutes les commissions liées aux médicaments.
Je terminerai par les quelques brefs commentaires généraux que m’ont inspirés ma participation et celle des équipes de l’agence à ce vaste chantier de lutte contre la pandémie.
Premier constat : au bout du compte, le bilan humain en termes de souffrances et de décès a été beaucoup plus limité qu’on pouvait le redouter il y a un an à la même époque, et même encore à la fin de l’été ou au début de l’automne, dans un contexte d’incertitude majeure et persistante sur plusieurs paramètres essentiels de la pandémie. On ne peut que s’en réjouir, mais cela n’enlève rien à la nécessité de procéder à une évaluation approfondie de la gestion de la pandémie et de justifier les décisions prises. La sévérité moyenne, finalement très modérée de cette grippe, est évidemment le facteur explicatif essentiel, mais il n’est pas interdit de penser que l’action préventive et curative qui a été menée a pu contribuer de manière réelle et significative à cette issue positive. Je pense ainsi à la promotion des mesures barrières, à la vaccination des sujets à risque ou encore à la mobilisation des services d’urgence et de réanimation, dont les moyens avaient été renforcés pour accueillir les patients présentant des formes graves.
Le deuxième constat positif concerne la mobilisation très forte, tel est en tout cas mon sentiment, qui a eu lieu pour ce chantier de santé publique de grande ampleur, voire sans précédent. La réponse à la pandémie a fait appel à de nombreuses personnes qui, au sein des ministères et des agences, comme l’Agence française de sécurité sanitaire des produits de santé ou l’Institut de veille sanitaire, mais aussi parmi les experts, dans les établissements de santé, dans les centres de vaccination, dans les collectivités locales ou dans les industries de santé, ont su faire preuve de disponibilité et de réactivité autant que de compétence et n’ont mesuré ni leur temps ni leurs efforts. C’est un constat encourageant à prendre en compte dans l’évaluation globale.
Pour autant, et ce sera ma conclusion, certains aspects du bilan ne sont sans doute pas à la hauteur des efforts déployés et laissent un goût d’insatisfaction, en particulier quant à la proportion de personnes vaccinées, certes proche de celle constatée dans d’autres pays européens comparables, mais globalement modeste. Sans me livrer à une analyse exhaustive des causes de ce résultat mitigé, j’insisterai simplement sur deux points qui me sont apparus comme des difficultés sérieuses dans la gestion de la pandémie.
Le premier est le poids, beaucoup plus lourd que pour d’autres phénomènes épidémiques, notamment pour la grippe saisonnière, de l’incertitude sur la portée de la pandémie, qui a pesé très largement jusqu’à l’été. Moment de l’attaque par le virus, taux d’attaque, maintien ou non du même niveau de sévérité moyenne que dans l’hémisphère Sud, mutation rapide ou non du virus, coexistence ou non avec le virus de la grippe saisonnière, rendements de production vaccinale, calendrier des livraisons, date d’autorisation des vaccins : autant de paramètres encore très incertains au début de l’été 2009. Le champ de ces incertitudes s’est certes réduit au fil des mois, à mesure que la pandémie révélait sa nature réelle, mais nombre de celles-ci subsistaient encore fin novembre, alors que la campagne de vaccination était engagée et que l’on approchait du pic : rappelons-nous l’annonce le 20 novembre 2009 en Norvège d’une mutation du virus présentant des signes de résistance au traitement, les interrogations persistantes à l’époque sur la durée de la pandémie au-delà de l’hiver et la possibilité d’une nouvelle vague. Or, un message de santé publique est, toutes choses égales par ailleurs, plus difficile à formuler et à faire passer quand les contours précis de la menace ne sont pas identifiables d’emblée, les autorités sanitaires étant alors conduites à tenir un discours nuancé, faisant la part de ce qui demeure incertain et s’ajustant au fil des mois en fonction de l’évaluation des données disponibles. Cette évolution propre à une pandémie grippale complique l’équation globale de l’information qui est certainement à mes yeux l’un des points essentiels d’interrogation, avec le recul que nous avons maintenant. Les autorités sanitaires ont le devoir de délivrer à nos concitoyens l’information que ceux-ci sont en droit d’attendre afin d’être éclairés dans leur choix, en l’espèce de se faire vacciner ou non ou de faire vacciner ou non leur entourage. Cette information doit être aussi compréhensible que possible, sans être par trop simplificatrice au point de taire les zones d’incertitude ou de déformer la vérité scientifique. On peut souligner l’existence de formes graves touchant parfois des sujets sans antécédents médicaux sans pour autant prétendre en prévoir exactement la proportion ; on peut affirmer sa confiance, et nous l’avons fait, dans le profil général de sécurité des vaccins et défendre l’intérêt de santé publique de la vaccination sans pour autant prétendre, car ce serait affirmer une contre-vérité, que les vaccins ne provoqueront aucun effet indésirable grave et seraient donc totalement dénués de risque.
Dans une société démocratique où les formes et les canaux d’expression sur les enjeux de santé sont multiples, la parole des autorités sanitaires en croise beaucoup d’autres. Elle se télescope même parfois dans l’esprit de nos concitoyens avec des expressions contraires, parfois contradictoires, qui, notamment à la télévision ou sur internet, peuvent être beaucoup plus tranchées. Les autorités sanitaires ont une tout autre responsabilité que des individus, scientifiques ou non, qui expriment leur seule opinion sans contraintes. Si les Français ont pu être inquiets à certains moments, la majorité d’entre eux n’a pas dans l’ensemble perçu de menace grave, et la tonalité des conseils qu’ils recevaient durant l’automne 2009 de la part de leurs médecins n’était pas de nature à lever les appréhensions qu’ils pouvaient avoir face à des vaccins perçus comme nouveaux.
Comment mieux gérer l’information – et la contre-information – sur une menace évolutive, quand foisonnent les messages sur le sujet ? C’est là certainement un champ de réflexion important pour l’avenir.
M. le président Jean-Christophe Lagarde. La procédure exceptionnelle accélérée dite de mock up, adoptée dans la perspective de la pandémie, présente-t-elle les mêmes garanties qu’une procédure classique d’autorisation de mise sur le marché ? Si oui, pourquoi n’est-elle pas systématiquement suivie ?
M. Jean Marimbert. La procédure de mock up – ou prototype – a été conçue quelque trois ans avant l’arrivée effective de la pandémie. On se demandait alors, en Europe et ailleurs dans le monde, dans le cadre de la préparation à une pandémie, comment faire pour raccourcir le plus possible, à partir du moment où l’on connaîtrait la souche virale pandémique, c’est-à-dire quelques mois seulement avant le début de la pandémie, la dernière ligne droite à franchir pour la production de vaccins. En Europe, il a été décidé de préparer le plus en amont possible le maximum d’éléments d’évaluation. L’idée était de constituer un dossier pharmaceutique complet avec des données cliniques sur plusieurs milliers de personnes vaccinées contre la souche H5N1, dont on avait peur qu’elle ne devienne facilement transmissible à l’homme, ce qu’elle n’est, semble-t-il, heureusement toujours pas. Le raisonnement était que si l’on obtenait, d’une part, un certain niveau d’immunogénicité et, d’autre part, un certain profil de tolérance pour un vaccin contre la grippe H5N1, au moment où il faudrait produire le vaccin contre une souche pandémique quelle qu’elle soit, on pourrait extrapoler les résultats et recourir aux mêmes techniques de fabrication et de contrôle, en ne changeant que l’antigène.
Le mérite de cette approche, notamment par rapport à celle des États-Unis, est qu’elle comporte des données cliniques. On a en fait accordé une sorte de pré-autorisation de mise sur le marché pour le prototype sur la base d’un dossier complet concernant le virus H5N1, particulièrement virulent, et décidé, en fonction de la vitesse de démarrage de la pandémie, de faire fabriquer le vaccin contre le virus A(H1N1) en amassant en cours de route le plus de données cliniques possible sur le nouveau vaccin.
En Europe, à partir du milieu de l’automne, on disposait pour les vaccins utilisés d’une masse significative de données cliniques sur H5N1 et un nombre croissant au fil des mois de données cliniques sur le virus A(H1N1). L’option américaine, que je respecte, a été tout à fait différente, consistant à mettre en circulation des vaccins pandémiques sans la moindre donnée clinique, par simple extrapolation par rapport aux actualisations régulières du virus de la grippe saisonnière. Par chance, la cinétique du virus a été telle que ce choix de tout centrer sur des vaccins sans adjuvant liés aux dérivés du vaccin contre la grippe saisonnière n’a pas posé de problème, et c’est tant mieux. Mais ce choix comportait une part de pari. Si chaque approche est respectable, l’approche européenne n’en était pas moins solide.
Mme Catherine Lemorton. Je vous remercie tout d’abord, monsieur le directeur général, d’avoir accepté de nous rencontrer régulièrement, jusqu’en décembre, avec Mme Bachelot-Narquin.
Je m’étais déjà interrogée fin 2009 sur le sujet en commission des affaires sociales : pour ce qui est des adultes, on a extrapolé à partir du modèle connu de la vaccination contre la grippe saisonnière et donné comme consigne de vacciner un maximum de personnes pour faire barrage à la pandémie. Cela, je veux bien l’entendre, mais j’ai plus de mal à comprendre l’extrapolation concernant les enfants, en particulier ceux âgés de six à vingt-quatre mois, déjà très sollicités sur le plan immunitaire par tous les vaccins qui leur sont administrés à cette période de leur vie, notamment l’hexavalent, qui donne lieu à une injection à l’âge de trois mois, une autre un mois plus tard et un rappel à l’âge d’un an, le vaccin rougeole-oreillons-rubéole venant s’intercaler. Même si ces vaccins sont éprouvés et utilisés depuis longtemps, la vaccination constitue toujours un choc immunitaire pour les enfants et voilà qu’on y ajoutait le vaccin contre la grippe A(H1N1) !
Combien de pools d’enfants ont-ils fait l’objet de tests cliniques avant que ne soit élargie l’indication du vaccin à toute la population infantile ? Les parents n’ont pas adhéré massivement à la campagne et le taux d’enfants vaccinés est très faible, mais nul ne savait au départ ce qu’il en serait. Avec quel recul pouviez-vous faire cette extrapolation puisque les enfants ne sont pas d’ordinaire vaccinés contre la grippe saisonnière, si ce n’est de manière marginale quelques enfants gravement malades, sans que cela puisse avoir valeur d’essai clinique ?
La recommandation est-elle toujours aujourd’hui de deux injections pour les moins de douze ans ? Je ne connais pas d’autre vaccin où la stratégie vaccinale diffère pour les adultes et pour les enfants. Pourquoi cette différence ?
J’en viens au Tamiflu, distribué à compter de décembre en provenance des stocks d’État, dont vous avez vérifié la bioéquivalence. Je vous avais demandé en septembre si cette vérification serait opérée ; elle l’a été, et je m’en félicite. Les professionnels de santé savent, depuis dix ans qu’il est sur le marché, que le Tamiflu n’est pas spécialement efficace contre la grippe, encore moins pour la prévenir. Il y a un an et demi, pas un seul médecin n’en aurait prescrit dans un but préventif. Or, début décembre, les médecins ont reçu un courrier les enjoignant de prescrire du Tamiflu à toute personne présentant un début de symptômes grippaux ou même ayant été susceptible d’avoir côtoyé une personne grippée. Je m’étonne vraiment qu’on ait pu élargir à ce point la prescription de ce produit, sur le fondement de tests présentés par l’industrie pharmaceutique. J’ai interrogé sur ce sujet M. Laurent Degos, président du collège de la Haute Autorité de santé, que nous avons auditionné il y a quelques semaines. Pourquoi cette soudaine stratégie début décembre ? Était-ce – vous savez que je suis un peu provocatrice – pour écouler les stocks de l’État qui allaient être périmés ? Je plaisante, mais on a tout de même demandé aux pharmaciens de mettre de côté le stock de Tamiflu en gélules qu’ils avaient commandé depuis septembre-octobre et qu’ils avaient l’habitude de dispenser depuis dix ans, au profit du stock d’État sous forme de comprimés. Début décembre, les décideurs politiques auraient-ils soudain perçu que la stratégie de vaccination était en train d’échouer et n’auraient-ils pas cherché à montrer par tous les moyens qu’ils agissaient quand même au profit de nos concitoyens en leur faisant prescrire du Tamiflu à tour de bras ?
Ma dernière remarque concernera le recueil des effets secondaires par les centres régionaux de pharmacovigilance.
Quand on réduit la période précédant l’autorisation de mise sur le marché, même si l’on se trouve dans un cas très particulier, il est normal de mettre en alerte tous les centres régionaux. Certains de vos propos au début de la pandémie n’étaient pas de nature à rassurer nos concitoyens, déjà en proie à des doutes après le vaccin contre l’hépatite B. En effet, ceux-ci ne craignent pas les effets secondaires à court terme, comme une sensation de chaleur au point d’injection, ou bien l’état fébrile qui peut faire suite à la vaccination, mais bien davantage de potentiels effets indésirables à long terme, comme le développement de maladies neurologiques ou auto-immunes. Je partage sur ce point l’avis de M. Bégaud, pharmacologue, qui nous a dit, lors de son audition, que tant qu’on n’aurait pas totalement éclairci ce qui s’est passé autour du vaccin contre l’hépatite B et que persisteront, à tort ou à raison, des craintes, les Français seront toujours réticents vis-à-vis des campagnes de vaccination massives. Or, à nos interrogations à ce moment-là, vous répondiez que vous gériez la situation à court terme et que, pour le long terme, resterait à prouver que les possibles effets constatés avaient bien un lien avec le vaccin.
Est-il judicieux que chaque Français puisse lui-même signaler d’éventuels effets indésirables sur les sites de pharmacovigilance ou celui de l’Agence française de sécurité sanitaire des produits de santé ? Le filtre d’un professionnel de santé, quel qu’il soit, me paraît important pour analyser l’effet secondaire dont peut se sentir victime un patient. On risque sinon que soit signalé un nombre considérable d’effets secondaires n’ayant rien à voir avec la vaccination, mais instillant le doute et suscitant des peurs infondées.
M. Jean Marimbert. Un amendement d’origine parlementaire à la loi portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires, adoptée l’an passé, fait dorénavant obligation de permettre aux patients de signaler directement les effets secondaires dont ils peuvent être victimes. La pandémie grippale a donné l’occasion d’une première expérience à grande échelle de cette nouvelle faculté. J’ai entendu beaucoup de personnes, à l’Agence française de sécurité sanitaire des produits de santé et ailleurs, exprimer les mêmes craintes que vous à ce sujet, madame Lemorton, certaines pointant même des risques d’instrumentalisation de cette notification par les patients. Or, nous n’avons rien constaté de tel. La synthèse globale, qui sera publiée dans quelques semaines, montre que 20 % environ des signalements proviennent de patients qui les ont fait remonter par internet. Les effets indésirables signalés étaient, pour l’essentiel, bénins et assez prévisibles. Le système n’a pas, comme nous le craignions, je vous le concède, été submergé, et nous n’avons pas reçu de signalements fantaisistes. L’essentiel des notifications spontanées en pharmacovigilance, nous le savons, provient de patients en établissements de santé ; il y en a beaucoup moins en ville. Je trouve, pour ma part, intéressante cette possibilité nouvelle offerte aux patients, complémentaire de celle des professionnels de santé, à condition bien entendu de ne pas jouer l’une contre l’autre : le dispositif doit reposer d’abord sur la déclaration des professionnels de santé.
Le débat de fond sur l’efficacité du Tamiflu n’est pas encore tranché. Rien n’est évident. Hors pandémie, on sait que ce médicament peut abréger la durée de la grippe, à la condition expresse d’avoir été pris dans les quarante-huit heures de l’apparition des premiers symptômes. C’est ce qu’a toujours dit la Haute Autorité de santé, laquelle ne l’a pas évalué en période de pandémie. Mais, à la lecture de quantité de publications de ces derniers mois, des conclusions convergentes apparaissent concernant des cohortes de patients hospitalisés à New York, au Mexique, au Chili et dans d’autres pays, sur le fait que l’usage massif des antiviraux dans ces endroits aurait réduit non seulement la durée des hospitalisations, mais également le nombre de victimes de la pandémie. Selon ces articles, la proportion des personnes ayant développé une forme grave débouchant sur un décès aurait été moindre là où les antiviraux avaient été massivement utilisés de manière précoce.
Vous avez, à juste titre, distingué l’usage curatif et l’usage préventif du Tamiflu. Fin novembre-début décembre, le comité de lutte contre la grippe, qui siégeait au ministère de la santé, a envisagé une extension d’indication à titre préventif, à dose pleine, pour des personnes exposées au contact de personnes grippées ou suspectées de l’être – en priorité pour les personnes présentant des facteurs de risque. La question était de savoir si l’on devait recommander, hors autorisation de mise sur le marché, le passage à dose curative. Il y a eu débat, et je m’en suis entretenu avec le directeur général de la santé, lequel a convenu qu’il était important que l’agence puisse donner son avis rapidement. C’est ce que nous avons fait, dans les délais imposés par le calendrier. Il faut se souvenir qu’on était alors au point d’inflexion de l’épidémie, peu avant le pic, mais on ne le savait pas encore. Notre avis n’a pas été inconditionnellement favorable : soulignant qu’il n’existait pas de références internationales, nous avons dit qu’on pouvait envisager de prescrire du Tamiflu à dose pleine, mais pendant cinq jours seulement et non dix. S’il y avait un risque de toxicité, celui-ci serait davantage lié à la durée du traitement qu’au doublement de la dose pendant cinq jours.
L’idée que cet avis, comme la décision des pouvoirs publics, auraient été dictés par un souci d’accroître les ventes de Tamiflu et d’écouler les stocks n’est absolument pas fondée. Il y a eu un vrai débat scientifique, avec confrontation d’arguments, repris dans une note de l’agence. Notre réponse a été oui, à condition de limiter le traitement à cinq jours : cinq jours à dose pleine équivalant à dix jours à demi-dose, traitement préventif standard. Cette évolution de prescription, chacun le comprendra, n’était pas de nature à induire une consommation supplémentaire considérable.
Vous vous interrogez sur les extrapolations chez les enfants. Il faut distinguer les vaccins pandémiques centralisés et le Panenza. Il est vrai que, lorsque le Comité des spécialistes pharmaceutiques à usage humain (CHMP) a donné un avis favorable fin septembre sur les trois premiers vaccins pandémiques centralisés, il n’existait pas de données pour les nourrissons, mais seulement pour les enfants et les pré-adolescents. L’extrapolation, dont les fondements figurent dans les documents du comité que nous avons mis en ligne à l’époque, repose à la fois sur le constat d’un profil général de sécurité et de tolérance pour les tranches d’âge supérieures tout à fait acceptable, et sur la crainte de formes très graves de cette grippe chez les très jeunes enfants, à partir des données recueillies dans l’hémisphère Sud et dans certains pays de l’hémisphère Nord déjà touchés, en particulier les États-Unis. Le rapport bénéfices/risques a clairement pesé dans l’extrapolation. Pour le Panenza en revanche, des essais cliniques avait été menés à partir de l’été et nous disposions de données sur l’immunogénicité et la tolérance dans toutes les tranches d’âge, à partir de six mois. C’est d’ailleurs ce qui a conduit à préconiser dans l’autorisation de mise sur le marché du Panenza un schéma vaccinal différent selon l’âge des enfants. Pour les vaccins pandémiques centralisés, sur lesquels on travaillait au début à partir d’extrapolations, on a pu, dans le courant de l’automne, s’appuyer sur quelques données d’essais cliniques chez les enfants.
M. Jean-Pierre Door, rapporteur. Pourriez-vous nous préciser les procédures classiques d’autorisation de mise sur le marché et les délais d’obtention de cette autorisation pour les vaccins contre la grippe, afin que nous puissions les comparer aux procédures mock up ? Quelles modalités l’agence préconise-t-elle pour les essais cliniques ? Les vaccins ont été autorisés aux États-Unis le 15 septembre, alors qu’ils ne l’ont été en Europe que le 29. Pourquoi ce décalage ? Cela tient sans doute à la réalisation d’essais cliniques en Europe, alors qu’il n’y en a pas eu aux États-Unis. Pourriez-vous nous en dire davantage ?
Dans votre propos introductif, vous avez cité, parmi les missions de l’Agence française de sécurité sanitaire des produits de santé, l’information de la population. Or, j’ai le sentiment que, sur ce point, des améliorations sont possibles. Souvenons-nous qu’au moment même où les autorités recommandaient de se faire vacciner, beaucoup critiquaient la qualité des vaccins et disaient même qu’ils présentaient des risques. On entendait alors tout et son contraire, ce qui a brouillé le message. N’aurait-il pas fallu que l’agence délivre une meilleure information, comme vous l’avez d’ailleurs dit vous-même ? Quelles leçons en tirer pour l’avenir ?
M. Jean Marimbert. La Food and drug administration (FDA) américaine a délivré l’autorisation de mise sur le marché des vaccins contre la grippe A(H1N1) plus tôt qu’en Europe tout simplement parce qu’elle a autorisé les vaccins non adjuvantés sur le seul fondement d’extrapolations par rapport aux vaccins contre la grippe saisonnière. Elle a en l’occurrence appliqué le même raisonnement que celui tenu tous les ans face aux variations du virus de la grippe saisonnière par rapport à des souches antérieures.
M. le rapporteur. La déclaration du Congrès invoquant une « urgence sanitaire » a-t-elle joué ?
M. Jean Marimbert. Je ne saurais le dire. Pour en avoir discuté avec les autorités sanitaires américaines, je pense que la population américaine avait une très grande confiance dans les vaccins contre la grippe en général. Nous devons avoir à l’esprit que la vaccination contre la grippe saisonnière est beaucoup plus répandue aux États-Unis qu’en France et dans le reste de l’Europe : elle n’y est pas réservée aux plus de soixante-cinq ans ou aux personnes immuno-déprimées, et beaucoup de jeunes adultes s’y font chaque année vacciner.
La Food and drug administration, quant à elle, avait confiance, d’une part, dans les fabricants de vaccins grippaux et, d’autre part, dans la validité de son raisonnement d’extrapolation, fondé sur l’hypothèse que le virus A(H1N1) se comporterait de manière assez semblable à une souche variante du virus saisonnier habituel. N’oublions pas toutefois que ce choix a failli provoquer une crise dans la mesure où ces vaccins sans adjuvant – c’est la contrepartie – ne peuvent être fabriqués qu’à un rythme plus lent. Il faut en effet de deux à quatre fois plus d’antigènes pour obtenir le même nombre de doses. Quand, à la mi-octobre, le Centre de prévention et de contrôle des maladies d’Atlanta a annoncé qu’en l’espace d’un mois il y avait eu autant d’enfants morts pour des raisons pouvant être attribuées en première intention au virus A(H1N1) qu’en un an en temps normal, les Américains se sont alors rués vers les centres de vaccination et, à cette date, les États-Unis manquaient de vaccins.
M. le président Jean-Christophe Lagarde. Pour la fabrication annuelle du vaccin contre la grippe saisonnière, procède-t-on en Europe par extrapolation ou sur la base d’essais cliniques ?
M. Jean Marimbert. Sur la base d’essais cliniques.
M. le président Jean-Christophe Lagarde. Cette différence de méthode entre les États-Unis et l’Europe se retrouve donc tous les ans.
M. Jean Marimbert. Oui, au moins pour la France. Les vaccins contre la grippe saisonnière ne sont pas tous autorisés dans le cadre d’une procédure centralisée, et beaucoup le sont en dehors. En France et dans quelques autres pays d’Europe, on procède toujours à des essais cliniques à la fin du printemps et au début de l’été. On accorde l’autorisation de mise sur le marché au vaccin contre la grippe saisonnière de l’année n sur la base des acquis antérieurs et de quelques essais cliniques, alors qu’aux États-Unis, on ne raisonne que par extrapolation par rapport à l’année n−1, sans aucune donnée clinique.
M. le président Jean-Christophe Lagarde. Paradoxalement, c’est pourtant en France qu’on a eu peur des vaccins, et pas aux États-Unis !
M. Jean Marimbert. Pour répondre à votre question, monsieur Door, en ce qui concerne les autorisations de mise sur le marché centralisées, le délai peut varier selon les suppléments d’information apportés ou demandés. Une évaluation prend en moyenne entre 100 et 150 jours, certaines évaluations pouvant demander de manière exceptionnelle jusqu’à 200 ou 210 jours. Il est très difficile de procéder à des comparaisons avec les procédures mock up. En effet, l’évaluation sur les dossiers prépandémiques a duré plusieurs mois. Les dossiers mock up ont été évalués essentiellement au second semestre 2008 et cela n’a débouché sur des avis favorables pour certains des vaccins pandémiques que fin 2008-début 2009. Il y a donc eu au moins quatre ou six mois d’évaluation, auxquels s’est rajoutée l’évaluation effectuée à partir de fin août-début septembre, quand le Comité des spécialités pharmaceutiques à usage humain a disposé de données complémentaires sur les dossiers pandémiques, y compris de premières données cliniques concernant le virus A(H1N1). Il y a alors eu une rolling review, revue permanente de semaine en semaine, des nouvelles données disponibles. Cumulés, les mois d’évaluation des procédures mock up et ceux de la rolling review représentent un temps substantiel.
Pour ce qui est de l’information, monsieur le rapporteur, j’ai voulu dire tout à l’heure à la fois que ce que nous avions fait était perfectible et qu’une autorité sanitaire, dans un domaine comme celui des vaccins, ne peut pas simplifier par trop la réalité à seule fin de rassurer le plus possible la population, à laquelle nous devons une information exacte.
J’ai distingué pour la pharmacovigilance les effets de court terme et de long terme car telle est la réalité. Il y a des effets secondaires immédiats, la plupart bénins comme une rougeur au point d’injection ou un épisode fébrile, et d’autres qui ne sont pas mineurs. Ainsi observe-t-on parfois des poussées de sclérose en plaques dans les jours ou les semaines qui suivent une vaccination, et dont il faut savoir si elle lui est imputable ou non. Au-delà, il est des effets à long terme et l’honnêteté exige de dire à nos concitoyens que des cohortes font l’objet d’un suivi dans le temps afin de les repérer.
On crédibilise la parole publique en tenant à la population un langage de vérité, sans mystification, ne laissant pas faussement penser que, parce que le rapport bénéfices/risques est positif et que l’intérêt de la vaccination sur le plan de la santé publique n’est pas à démontrer, il n’y aurait strictement aucun risque.
En septembre, nous n’avons sans doute pas fait assez en matière d’information, mais il faut se souvenir que c’est alors que sont apparues les polémiques sur le syndrome de Guillain-Barré, les adjuvants, le thiomersal, avec des déclarations indéfendables sur certains sites internet. Nous avons immédiatement édité toute une batterie de fiches que j’ai moi-même présentées lors d’une conférence de presse, à laquelle les journalistes assistaient en nombre et où tous ces points ont été abordés. La reprise qui en a été faite quelques jours plus tard dans la presse a été bonne. Mais nos concitoyens ont alors été soumis à un véritable kaléidoscope de déclarations, publiques ou non, sur le sujet de la vaccination, sensible par nature, puisqu’il s’agit d’administrer à des personnes en bonne santé un médicament visant à les prémunir contre un risque ultérieur. L’information délivrée par l’Agence française de sécurité sanitaire des produits de santé et par le ministère s’est heurtée à d’autres. J’ai vu dans mon entourage, y compris parmi mes amis, des personnes qui, sceptiques face à tous ces discours contradictoires, se tournaient naturellement vers leur médecin. Or, en octobre-novembre, la parole médicale était plutôt dissuasive. Il est difficile pour une agence sanitaire d’être convaincante sans convergence ni synergie entre la parole publique et celle des soignants.
M. le président Jean-Christophe Lagarde. L’agence a-t-elle eu une communication spécifique à destination du monde médical ?
M. Jean Mallot. Pourquoi a-t-on maintenu le principe de deux injections chez les enfants ? Pourquoi une stratégie vaccinale différente pour cette population ? N’aurait-on pas pu savoir plus tôt s’il fallait une ou deux injections ?
Mme Valérie Fourneyron. L’agence a-t-elle joué un rôle dans la négociation des contrats avec les laboratoires fabricants ? A-t-elle joué un rôle dans la prolongation des dates de péremption du Tamiflu ? Avez-vous aujourd’hui l’impression qu’elle porte une part de responsabilité dans le fait qu’on ait obtenu en France un aussi mauvais résultat en matière de vaccination collective, par rapport aux autres pays européens en particulier ?
M. Jean Marimbert. Monsieur Mallot, on a continué de préconiser deux injections pour certaines tranches d’âge car les données cliniques ont montré qu’une seule n’était pas assez immunogène. C’est encore le cas aujourd’hui pour les vaccins Focetria et Pandemrix : pour l’un, on ne passe à une seule injection qu’à partir de l’âge de neuf ans et, pour l’autre, à partir de l’âge de dix ans. Il faut également deux injections de Panenza chez les enfants pour obtenir une immunisation suffisante.
Pour ce qui est des contrats avec les laboratoires, je suis intervenu avec Noël Renaudin lors de la dernière phase des négociations fin juin-début juillet. Dans au moins l’un des contrats que j’ai alors eu entre les mains, la version proposée courant juin à l’Établissement de préparation et de réponse aux urgences sanitaires exonérait très largement le laboratoire de responsabilité, y compris pour les défauts de fabrication. Nous avons cherché à y remédier autant que faire se pouvait. Je suis également intervenu, avec un certain succès, pour que les laboratoires fournissent davantage de documents d’information – il ne s’agissait pas de notices classiques –, lesquels étaient chichement mesurés dans leurs propositions initiales.
Oui, l’Agence française de sécurité sanitaire des produits de santé est intervenue concernant la date de péremption du Tamiflu. Avant même le déclenchement de la pandémie, après que j’ai adressé en septembre ou octobre 2008 une note au directeur général de la santé, nous avons contrôlé les stocks de Tamiflu et constaté que leur durée limite d’utilisation pouvait être prolongée jusqu’à sept ans. Notre analyse a ensuite été validée au niveau communautaire et l’autorisation de mise sur le marché du Tamiflu a été modifiée en conséquence en juin 2009.
L’agence se sent-elle responsable des résultats obtenus, me demandez-vous ? Quand on a été l’un des acteurs de l’élaboration de la réponse à la pandémie, qui a comporté des aspects positifs, mais aussi, je l’ai dit, qui n’a pas toujours été à la hauteur des attentes, on porte nécessairement une part de responsabilité, même si nous avons eu avec nos équipes le sentiment de faire le maximum. J’ai évoqué dans mon propos liminaire la production et la diffusion de l’information, soulignant la difficulté née de son caractère évolutif. Il y a là incontestablement un champ de réflexion pour améliorer nos pratiques.
M. Gérard Bapt. Savez-vous combien de boîtes de Tamiflu des stocks d’État livrées chez les pharmaciens pour être remises gratuitement à la population sur prescription médicale ont été effectivement retirées ?
M. Jean Marimbert. Je ne peux vous répondre.
M. Gérard Bapt. Il serait intéressant d’interroger les autorités sanitaires sur la façon dont l’indication de ce médicament a été modifiée, hors autorisation de mise sur le marché, sur injonction de la direction générale de la santé, sans que la commission d’autorisation de mise sur le marché ait même été réunie. Comment s’étonner ensuite que les médecins et les patients n’aient pas suivi la parole officielle ?
Vous avez dit dans votre propos liminaire que toutes les mesures prises ont apporté une « contribution réelle et significative » au traitement de la pandémie. Sur quels éléments vous fondez-vous pour l’affirmer ? Combien de morts ou de formes graves ont été évitées grâce au vaccin ? Sait-on dire ce qui, des mesures barrières ou du vaccin, a été le plus efficace, d’autant que les vaccins sont arrivés après le pic de la pandémie ? Peut-être pourrait-on attendre les résultats en provenance de pays qui n’ont pas vacciné, comme la Pologne, pour affirmer que la « contribution réelle et significative » dont vous vous targuez est bien réelle.
Enfin, quand, afin de garantir toute transparence, les autorités françaises exigeront-elles de l’Agence européenne du médicament qu’elle publie les conflits d’intérêts de ses propres experts ? Je ne parle pas de l’Organisation mondiale de la santé qui, elle, ne publie même pas la liste de ses conseillers !
M. Jean Marimbert. Je ne me suis « targué » de rien ! J’ai dit que la sévérité finalement très modérée de cette grippe expliquait pour l’essentiel le nombre de morts et de cas graves plus faible qu’on ne le craignait, mais qu’on ne pouvait pas exclure que certaines des mesures prises y aient également contribué. Mon propos, très nuancé, n’était nullement triomphaliste.
Le législateur a confié à l’Agence française de sécurité sanitaire des produits de santé le devoir d’évaluer et de prendre des décisions par délégation de l’État. Je n’ai jamais reçu d’injonction de prendre une décision scientifique, fondée sur une matière scientifique et une évaluation. Si j’en avais reçu, je n’en aurais pas tenu compte. Si votre critique porte sur la décision, elle m’atteint et, derrière moi, l’institution tout entière. Nous n’avions pas, sur le plan juridique, à réunir la commission d’autorisation de mise sur le marché. Nous nous trouvions entre deux réunions de cette commission en formation plénière et l’agence n’avait que quelques jours pour rendre son avis. Nous avons réuni un groupe de travail spécialisé et réfléchi en interne.
Pour ce qui est de la transparence, nous avons cherché, ces dernières années, à faire des progrès, en tout cas à l’échelon national. Les débats actuels ne peuvent que nous inciter à les renforcer encore, au niveau européen comme au niveau national. Je participe actuellement à des discussions avec des responsables de l’Agence européenne du médicament, laquelle est aussi convaincue de la nécessité de franchir un pas supplémentaire en ce domaine car il y va de la crédibilité de l’ensemble du dispositif.
M. le rapporteur. L’Agence française de sécurité sanitaire des produits de santé peut-elle éditer des documents à destination de l’ensemble de la population sur l’intérêt de la vaccination ou la qualité des vaccins ? En Suède, beaucoup d’information de cette nature a été distribuée, qui était éditée par l’autorité sanitaire. Avez-vous cosigné ce type de documents ? En un mot, est-ce faisable chez nous ?
M. Jean Marimbert. Bien sûr. Il est vrai que l’agence a produit beaucoup d’information à l’intention des journalistes et des professionnels de santé, mais beaucoup moins à l’intention du grand public. Pour réaliser de bons documents d’explication sur la vaccination, il faut conjuguer plusieurs types de compétences, les nôtres, mais aussi celles du Haut conseil de la santé publique et du ministère sur les aspects de stratégie vaccinatoire et celles de l’Institut national de prévention et d’éducation pour la santé qui a une grande expérience de l’édition et de la diffusion de documents à destination du grand public.
M. le rapporteur. C’est une piste à creuser.
M. le président Jean-Christophe Lagarde. Et vis-à-vis des médecins ?
M. Jean Marimbert. Les médecins ont reçu beaucoup de messages…
M. le président Jean-Christophe Lagarde. De votre part ?
M. Jean Marimbert. C’est plutôt le ministère, qui avait une stratégie globale de communication à leur égard, qui leur a adressé des courriers. Nous avons pour notre part davantage communiqué en direction des journalistes grand public qu’envoyé des documents aux médecins, ce que nous faisons d’ordinaire souvent concernant des médicaments, des autorisations de mise sur le marché ou des modifications de ces autorisations.
M. le président Jean-Christophe Lagarde. Il me reste, monsieur le directeur général, à vous remercier.
La séance est levée à dix-sept heures vingt-cinq.
Audition de M. Claude Michellet,
directeur de l’académie de Paris
(Procès-verbal de la séance du mercredi 5 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures vingt-cinq.
(M. Claude Michellet prête serment.)
M. le président Jean-Christophe Lagarde. Traditionnellement, nous proposons à nos invités de faire d’abord un exposé liminaire. Cependant, afin de permettre un débat plus nourri, nous commencerons directement par les questions.
Nous avons constaté à quel point l’incertitude des parents d’élèves était forte sur la façon dont la vaccination allait être organisée dans les écoles et les collèges. Nombre de leurs messages, surprenants, me semblent avoir pour cause une information très tardive, si ce n’est parcimonieuse, de la part de l’éducation nationale. Pourriez-vous, monsieur le directeur, préciser à notre attention les modalités d’information des parents prévues par l’académie de Paris sur les conditions de vaccination de leurs enfants ? J’imagine que des circulaires interministérielles ont également été publiées.
M. Claude Michellet, directeur de l’académie de Paris. S’est d’abord posée pour nous la question de connaître la part des actions qui, dans la campagne de vaccination – je ne parle pas ici des règles de fermeture de classes ou d’établissements –, relevait du niveau académique et du niveau national.
Nous avons dû attendre des informations précises sur la date de démarrage de la campagne et les conditions de sa conduite. Nous avons toujours été soumis à un dilemme : devions-nous prendre l’initiative de lancer des informations, ou au contraire attendre les documents d’information nationaux ? J’ai apporté à la commission d’enquête la totalité des documents d’information qui devaient être communiqués à chaque famille par les établissements – elles le leur ont été en deux jours. Ce sont des documents, des formulaires de vaccination, nationaux. Je dois préciser qu’ils ne concernent que les élèves de collège et de lycée : à Paris – comme sans doute dans l’ensemble du territoire – les élèves des écoles étaient vaccinés dans les centres de vaccination.
M. le président Jean-Christophe Lagarde. Ces documents nous seront utiles.
M. Claude Michellet. Pour vacciner collégiens et lycéens, nous avons constitué vingt-six équipes mobiles, constituées de médecins et d’infirmières scolaires. Ces équipes ont tourné dans l’ensemble des établissements de la capitale ; c’est là qu’elles vaccinaient.
Pour pouvoir nous organiser, il nous fallait connaître le nombre d’élèves à vacciner. Après avoir communiqué les documents d’information aux familles, nous attendions leurs réponses d’acceptation ou de refus de la vaccination. En fonction de celles-ci, nous déterminions le temps que les équipes allaient passer dans les établissements. Nous pouvions alors organiser la succession de leurs visites au sein de ceux-ci.
L’urgence nous a conduits à prendre l’initiative d’élaborer nous-mêmes des documents et à les communiquer aux parents. Trente-six heures après cette opération, nous avons reçu les documents nationaux. Cette situation a entraîné à la fois un brouillage de la communication et, pour les chefs d’établissement, qui devaient faire photocopier la totalité de ces documents en autant d’exemplaires que de familles, un double travail. Nous considérons avoir été insuffisamment informés sur les actions préparées au niveau national.
M. le président Jean-Christophe Lagarde. Par quel moyen ces photocopies étaient adressées aux parents ?
M. Claude Michellet. Elles étaient remises aux élèves.
Mme Marie-Louise Fort. Vous avez donc envoyé aux parents une première série de documents, émanant du rectorat, leur exposant qu’une campagne de vaccination contre la grippe allait être lancée dans les établissements et que leurs enfants ne seraient vaccinés qu’avec leur accord. Ce n’est qu’ensuite que vous avez reçu du ministère les documents nationaux. Les chefs d’établissement ont alors également fait parvenir ceux-ci aux familles.
M. Claude Michellet. Oui.
Mme Marie-Louise Fort. En cas d’hésitation de la famille, les documents que vous aviez élaborés comportaient-ils un numéro de téléphone ? Les établissements étaient-ils tous dotés d’un référent, leur infirmière par exemple ?
M. Claude Michellet. Depuis un certain temps une information indiquant aux parents pour quelles raisons il fallait se faire vacciner, assortie de toutes les informations sur les différents vaccins, figurait sur le site de l’académie.
Cette information a été redoublée par écrit. Les parents devaient répondre à nos envois. Ils pouvaient revenir jusqu’au dernier moment sur leur acceptation ou leur refus de faire vacciner leur enfant.
Chaque établissement affectait un référent aux parents. Celui-ci, qui était souvent l’infirmière, pouvait être aussi le secrétariat du proviseur.
La responsabilité des équipes mobiles de vaccination, composées de médecins et d’infirmiers, relevait du rectorat. Il revenait en revanche aux établissements de fournir le support administratif et l’organisation concrète.
Ces modalités d’organisation étaient valables aussi bien pour les établissements publics que pour les établissements privés.
M. Jean-Pierre Door, rapporteur. Par qui étaient formées ces équipes mobiles ? D’où venaient-elles ? Quel était votre rôle ? De quels moyens disposiez-vous ? Assuriez-vous vous-mêmes la tenue des calendriers ? Pouvez-vous aussi nous rappeler les dates de la campagne conduite dans les collèges et lycées de la région parisienne ? Enfin, connaissez vous le taux de pénétration de la vaccination auprès des élèves ? Les courbes dont j’ai pu disposer indiquent que les meilleurs taux de vaccination en France concernent les classes d’âge jeunes.
M. Claude Michellet. À Paris, deux campagnes de vaccination ont été organisées dans les établissements scolaires. La première s’est déroulée du 25 novembre au 18 décembre 2009, c’est-à-dire jusqu’aux vacances de Noël. Elle a été réalisée par les vingt-six équipes mobiles. Seul le second degré était concerné, soit 400 collèges et lycées, 300 dans le secteur public et 100 dans le secteur privé. L’académie de Paris comprend aussi 660 écoles primaires, mais celles-ci n’étaient pas concernées par ce processus.
Lorsque, au mois de janvier, il a fallu relancer la campagne, nous avons choisi d’ouvrir vingt centres permanents où les élèves volontaires se présentaient.
La première campagne a permis quelque 32 000 vaccinations (31 997 exactement). La deuxième n’en a suscité qu’un peu moins de 2 000. Autrement dit, au mois de janvier, nous n’avons reçu quasiment aucune demande.
Les 32 000 vaccinations de la campagne de novembre et décembre font apparaître un taux de vaccination de 17,2 % de la population visée, soit 2 000 élèves par jour ouvrable – je rappelle que le taux national est de 10 %.
Nous avons repéré une réelle différence entre les taux de vaccination selon que les établissements étaient publics ou privés : 15 % environ dans le secteur public, mais plus de 21 % dans le secteur privé.
Nous avons aussi pu constater que nous vaccinions beaucoup plus dans les lycées généraux que dans les lycées technologiques, mais je ne peux malheureusement pas fournir de chiffres précis, la grille de classification des vaccinations effectuées ne permettant pas de faire la part des uns et des autres. Nous avons aussi beaucoup plus vacciné dans l’ouest et le sud que dans le nord et l’est de Paris.
M. le président Jean-Christophe Lagarde. Diriez-vous que le critère de cette différence de taux est celui des catégories socio-professionnelles ?
M. Claude Michellet. Oui. Cette situation n’est pas spécifique à la grippe A(H1N1). Les campagnes de prévention et d’éducation à la santé organisées à l’attention des lycées rencontrent toutes beaucoup plus de succès auprès des catégories socio-professionnelles favorisées qu’auprès de celles qui ne le sont pas. L’information y est-elle mieux reçue ? Ne faut-il pas au contraire constater un déficit de réception de l’information au sein d’autres catégories ? Dans certaines populations du nord de Paris, le taux de vaccination était de l’ordre de 5 %.
M. le président Jean-Christophe Lagarde. Les lycées sont donc à l’unisson de la population : voilà un élément rassurant !
M. Claude Michellet. Je rappelle que nous ne vaccinions qu’après avoir reçu l’aval des parents.
M. le président Jean-Christophe Lagarde. Receviez-vous des réponses négatives ?
M. Claude Michellet. Très peu.
M. le président Jean-Christophe Lagarde. Autrement dit, l’indifférence primait sur le refus.
M. Claude Michellet. Les refus n’étaient en effet pas forcément des refus actifs.
Mme Valérie Fourneyron. Comment le ministère de l’éducation nationale a-t-il été associé à la stratégie vaccinale d’ensemble du Gouvernement et à son évolution ? Quels ont été l’organisation et le mode de fonctionnement du dispositif interministériel ? Comment y avez-vous été associé ? À partir de quand ? Quel était votre interlocuteur au ministère de l’éducation nationale ?
M. Claude Michellet. Nous avons été chargés d’organiser la vaccination des élèves par les médecins et les infirmières scolaires.
M. le rapporteur. Vos équipes étaient donc des équipes internes à l’éducation nationale…
M. Claude Michellet. Tout à fait. Nous avons mobilisé les médecins et les infirmières scolaires. Le volet administratif du dispositif – organisation, rotations, passages des équipes, inscriptions des élèves – était assuré par les personnels administratifs des établissements.
M. le président Jean-Christophe Lagarde. Cette organisation vaut-elle pour l’ensemble de la France ? Paris dispose peut-être de plus de médecins et d’infirmières scolaires que les départements du nord-est de sa petite couronne, par exemple.
M. Claude Michellet. Dans le premier degré, c’est la ville de Paris et non le rectorat qui assure la médecine scolaire. De ce fait, l’académie de Paris dispose de moins de médecins scolaires que d’autres. Ces médecins sont en revanche beaucoup plus faciles à mobiliser. Il est aussi beaucoup plus simple d’organiser les tournées d’une équipe de vaccination entre des établissements relativement importants et très proches les uns des autres.
Si nous avons pu organiser la vaccination avec nos seules forces, nous avons dû en revanche travailler dans le cadre d’un dispositif interministériel pour deux actions.
Il s’est agi, d’abord, avant la période de vaccination, des fermetures de classes et d’établissements. La décision était prise par le préfet sur la base des informations que nous lui communiquions. Après quelques tâtonnements, nous avons mis en place un circuit : organisation de la remontée de l’information, validation de celle-ci par les services médicaux et la direction des affaires sanitaires et sociales, décision du préfet, puis communication de celle-ci au rectorat. Le fonctionnement a été plutôt satisfaisant.
Ensuite, alors que nous avions déjà mis en place notre dispositif de vaccination dans les établissements, nous avons été mobilisés par la préfecture pour fournir des équipes et du personnel aux centres de vaccination du public. À Paris, ces centres ont été installés dans les gymnases. Nous avons été associés aux réunions bi-hebdomadaires, voire quotidiennes, tenues en préfecture, et sollicités pour fournir du personnel aux gymnases transformés en centres de vaccination.
Mme Valérie Fourneyron. Les décisions de tous les préfets n’ont pas été identiques, y compris en matière de fermetures de classes. Comment le pilotage interministériel était-il organisé ?
M. Claude Michellet. Les consignes ministérielles et interministérielles que nous avons reçues correspondaient aux consignes nationales diffusées par les médias : la fermeture à partir d’un certain nombre de cas groupés.
Cela dit, il est vrai que les interprétations ont été différentes en fonction du terrain. Ainsi, à Paris, milieu urbain très dense, nous avons très rapidement – dès le mois de novembre – mis fin aux fermetures de classes.
M. le président Jean-Christophe Lagarde. Une rumeur selon laquelle la vaccination des enfants en milieu scolaire serait devenue obligatoire, avec ou sans l’accord des parents, a circulé sur internet. Interrogé par la principale fédération de parents d’élèves de ma commune, je me suis tourné vers l’inspectrice de l’éducation nationale, puis l’inspecteur d’académie. Il m’a été clairement répondu que tel n’était pas le cas et qu’une demande préalable serait adressée aux parents, et même, en cas de partage de l’autorité parentale, à chacun des deux parents séparés. Comment avez-vous traité ces cas ? Dans l’un des documents que vous m’avez remis, la signature d’un seul des parents partageant l’autorité parentale est demandée. N’est-ce pas cette politique qui a été à l’origine de la rumeur ? J’en suis pour ma part convaincu.
M. Claude Michellet. La consigne nationale n’était pas précise. Nous avons décidé de ne prendre en compte les deux réponses que si l’une d’entre elles était négative. Avec un avis positif et sans avis contraire, nous avons vacciné. Telle a été la consigne diffusée auprès des chefs d’établissement.
M. le président Jean-Christophe Lagarde. Vous avez disposé exclusivement de vaccins multidoses ?
M. Claude Michellet. Oui.
M. le président Jean-Christophe Lagarde. Vos équipes mobiles se déplaçaient d’établissement en établissement sans savoir à l’avance qui souhaitait se faire vacciner ?
M. Claude Michellet. Non. Au vu des réponses, le chef d’établissement établissait la liste des enfants à vacciner et organisait le tour de passage. Les équipes mobiles savaient combien d’enfants devaient être vaccinés dans l’établissement. Il était prévu qu’elles aillent chercher chaque jour dans les centres de vaccination le matériel qui leur était nécessaire. Cette mesure a été source de difficultés : en fait, ce sont les établissements – le plus souvent leurs chefs – qui ont dû effectuer cette tâche. Ils ont dû beaucoup payer de leur personne. Il leur fallait se rendre dans les centres de vaccination, à l’époque très chargés, et patienter parfois une demi-heure, le temps qu’un membre du personnel du centre puisse se dégager pour collecter les doses de vaccin et le matériel nécessaire pour les administrer. Nous avions pourtant longuement plaidé pour la mise en place d’un système de distribution au quotidien des vaccins dans les établissements où des vaccinations devaient avoir lieu.
Une autre difficulté est venue du retour des déchets aux centres. Là encore, ce sont les établissement qui en ont été chargés.
Enfin, au début, le nombre de glacières était insuffisant et les trousses médicales manquaient. Nous ne pouvions que constater une anticipation insuffisante des achats nécessaires.
M. le rapporteur. Votre stratégie a été bonne et votre travail efficace. Que, dans une ville aussi peuplée que Paris, vous ayez pu agir par vous-mêmes donne à réfléchir.
Avez-vous une idée du taux de vaccination des enseignants ? Comment ont-ils réagi ?
M. Claude Michellet. C’est un point négatif. Au moment où les équipes mobiles passaient, certains enseignants étaient tout à fait prêts à se faire vacciner. Malheureusement, ils ne faisaient pas partie des catégories prioritaires. Après plusieurs hésitations, nous nous sommes, un peu à contrecœur, ralliés à cette règle et nous ne les avons pas vaccinés. En tout état de cause, n’étant pas prioritaires, ils n’étaient évidemment pas en possession de bons.
Alors même que nous assurions nous-mêmes la vaccination dans les établissements, nous avons aussi prêté des infirmières scolaires et des personnels administratifs aux douze premiers gymnases ouverts à Paris pour la vaccination de l’ensemble du public. L’État s’étant rapidement rendu compte que ce nombre n’était pas suffisant, il l’a fait passer à vingt-deux. Enfin, le 5 décembre, le rectorat de Paris s’est vu confier par décision du préfet – en application des règles de la solidarité d’État – la gestion de deux de ces gymnases.
Ceux-ci étaient ouverts de huit heures à vingt-deux heures. Si nous avons fourni le personnel administratif de ces deux centres, nous n’avons pas eu à en gérer le personnel médical et infirmier. Nous avons travaillé toutes les vacances scolaires, sauf le jour de Noël. Pour garantir les horaires d’ouverture, le fonctionnement de chaque centre requérait une équipe de trois fois sept personnes, soit vingt et une personnes à mobiliser sept jours sur sept, à l’exception du lundi matin, où les équipes étaient réorganisées. Cette situation a duré jusqu’au moins de janvier.
M. Jean Mallot. À mon sens, la lecture des documents permet de comprendre pourquoi le taux de vaccination est supérieur dans les catégories socio-professionnelles les plus élevées.
Voilà ce qui est offert à la lecture des parents dans une fiche d’information : « Qu’est-ce que le thiomersal ? Le thiomersal est un composé qui est utilisé de longue date comme conservateur. […] Le lien entre le thiomersal et l’hypothétique trouble neurologique n’a pas été confirmé par les nombreuses études réalisées. »
La fiche médicale individuelle de l’enfant, à remplir par les parents, est également instructive : « A-t-il eu une réaction grave lors d’une vaccination ? » Les parents peuvent en effet se souvenir d’une telle réaction. « A-t-il une allergie aux protéines de l’œuf ou du poulet, à l’ovalbumine ou à certains médicaments ? »
M. le président Jean-Christophe Lagarde. La question de l’allergie à l’ovalbumine était posée dans tous les centres. J’ai moi-même demandé de quoi il s’agissait.
M. Jean Mallot. Mais de nombreuses familles ont dû ne rien comprendre. Il y a là sans doute une leçon à tirer pour l’avenir.
M. le président Jean-Christophe Lagarde. Ce n’est pas M. Michellet qui est l’auteur de ce questionnaire !
M. Claude Michellet. Lorsque nous vaccinions, le médecin était systématiquement présent et les parents pouvaient accompagner leurs enfants. Comme à l’accoutumée dans ce type de situation, nous avons organisé une aide.
M. Jean Mallot. Par ailleurs, si de nombreux élèves avaient été atteints par la grippe, beaucoup d’établissements auraient dû être fermés. Mais si le lycée est fermé, comment y vacciner les élèves ? De quelle façon l’hypothèse de fermetures en nombre avait-elle été envisagée par le plan ?
M. Claude Michellet. La décision de fermer des classes ou des écoles avait été prise avant le lancement de la campagne de vaccination. De plus, les fermetures ne duraient pas plus d’une semaine. Elles ont été présentées au public comme des barrières contre la propagation de l’épidémie.
Mme Marie-Louise Fort. Disposez-vous de réactions de parents sur le contenu des courriers qui leur ont été envoyés ? Ceux qui ne les auraient pas compris se sont-ils contentés des explications et préconisations diffusées par les médias ?
M. Claude Michellet. À mon sens, les débats et messages diffusés par les médias ont eu beaucoup plus d’impact que ces courriers, qui ont été envoyés pour des raisons d’information mais aussi de précaution : l’éducation nationale se souvient d’épisodes de vaccination dans les écoles plutôt cuisants, et causes de difficultés juridiques, y compris avec les infirmières et les médecins scolaires. Des phénomènes secondaires étant apparus à la suite de campagnes de vaccination contre l’hépatite, des familles étaient allées jusqu’à porter plainte.
Cette constatation mène à la problématique de la réquisition. Les consignes que nous avons reçues étaient contradictoires, notamment pour les infirmières scolaires : celles-ci étaient réquisitionnées, nous a-t-on expliqué, mais seulement si elles étaient volontaires ; la consigne nationale était de passer malgré tout par le volontariat. Or, sur cent cinquante-cinq infirmières, cinq seulement se sont déclarées volontaires pour vacciner. Toutes les autres attendaient la réquisition. Certains syndicats d’infirmiers avaient donné comme mot d’ordre à leurs membres de ne pas ouvrir leur messagerie électronique et de ne pas répondre au téléphone, pour éviter qu’ils ne soient contactés et réquisitionnés.
Ce manque de clarté de la consigne ne permettait pas de déterminer si la vaccination constituait une mission prioritaire emportant réquisition de l’infirmière contactée ou si celle-ci conservait la liberté de déterminer elle-même le degré de priorité relative de ses missions.
Il importe de repenser tous ces éléments pour l’avenir.
M. le président Jean-Christophe Lagarde. Nous transmettrons ce message.
Je constate moi aussi la difficulté de compréhension des documents. Ils comportent en outre un réel déficit graphique : mis à part le document tiré en couleurs, ils sont assez peu lisibles, même dans leur présentation. Une plaquette assez simple, compréhensible, lisible, un peu plus graphique, distribuée à tous et permettant aux parents de comprendre le sujet aurait pu être élaborée.
La vaccination s’est effectuée du 25 novembre au 18 décembre. À quelle date précise avez vous pu disposer de l’information vous permettant de l’organiser ? Par quel canal cette information est-elle passée : circulaire ministérielle, bulletin officiel de l’éducation nationale, par exemple ?
Tout en étant restés très longtemps dans le flou, nous avez-vous dit, vous étiez prêts lorsque l’information vous a été transmise. Si j’ai bien compris, il y a eu télescopage des dates de mise en œuvre des actions décidées par vous-mêmes – sans doute du fait d’inquiétudes du monde enseignant ou des parents d’élèves – et de réception des instructions nationales.
M. Claude Michellet. Je n’ai pas le souvenir d’une consigne écrite. Le 25 novembre était un mercredi. Le « feu vert » nous a été donné lors d’une conférence téléphonique à la fin de la semaine précédente, le jeudi ou le vendredi. Il faisait suite à la consigne de distribution des bons de vaccination donnée aux caisses primaires d’assurance maladie. Il découlait de l’estimation de la date de réception des bons par les parents. Il avait été prévu que la campagne commencerait à Paris et en région parisienne.
M. le président Jean-Christophe Lagarde. La campagne publique a été lancée le 12 novembre. Le 25 novembre, l’ensemble des éléments nécessaires à l’organisation de la vaccination était donc disponible depuis suffisamment longtemps. J’ai l’impression qu’il y a eu un manque d’anticipation.
Vous souffriez du flou des instructions données par le ministère de l’éducation nationale, nous avez-vous dit. Mais toutes les informations nécessaires étaient alors disponibles au ministère de la santé. Dès le début du mois d’octobre, il était possible d’établir une communication vers les parents sur la façon dont la vaccination serait proposée à leurs enfants. Ne pas le faire a aggravé le flou et donné des armes aux opposants à la vaccination, qui se sont exprimés sur internet.
M. Claude Michellet. Selon mes souvenirs, la reproduction des documents nationaux a été effectuée le vendredi et le samedi de la semaine précédant celle du 25 novembre.
M. le président Jean-Christophe Lagarde. Aucun point de ces documents ne me semble conditionné par un élément de dernière minute.
Si, pendant l’été, la communication du ministère de l’éducation nationale à l’attention du grand public sur la façon dont seraient prolongés les cours si des établissements devaient fermer en nombre a été abondante et précise, ce ministère n’a pas été en mesure de préciser de façon simple, générale et compréhensible la manière dont la vaccination se déroulerait. Or, si les éléments nécessaires n’étaient pas disponibles en juin, ils l’étaient en septembre.
M. Claude Michellet. De ce fait, nous avons été amenés à envoyer aux chefs d’établissement des documents légèrement différents de ceux qui, finalement, nous ont été transmis. Non seulement cette action a abouti à une multiplication bien inutile des photocopies, mais elle a en plus été source de brouillage.
M. le président Jean-Christophe Lagarde. Monsieur le directeur, souhaitez-vous ajouter d’autres éléments ?
M. Claude Michellet. Il est toujours désagréable d’être dans l’attente de quelque chose d’imprécis. Nous étions hantés par la crainte, au cas où nous prendrions une initiative, de provoquer un brouillage supplémentaire, cette initiative pouvant être démentie le lendemain.
Dans ce type de situation, la répartition des tâches entre niveaux opérationnels doit être clairement établie et chacun des niveaux doit être autonome dans la gestion des tâches qui lui sont confiées. La répartition des tâches entre niveaux ne doit pas souffrir d’incertitudes ou de doublons. Nous ne savions même pas que des formulaires d’information et des questionnaires étaient en préparation au niveau national !
M. le président Jean-Christophe Lagarde. Étiez-vous clairement informés sur les conditions de la poursuite de l’enseignement en cas de fermeture d’établissements ? J’ai l’impression que vous étiez dans la même situation que le grand public : alors que votre information sur la gestion de la fermeture des établissements était très solide, vous n’en disposiez d’aucune sur les conditions de vaccination.
M. Claude Michellet. Sans doute. Cela dit, autant, depuis l’épisode de la grippe aviaire, nous avons réfléchi à la gestion de situations fortement dégradées, comportant de nombreuses fermetures d’établissements, autant la réflexion mérite encore d’être développée sur les situations de perturbations ponctuelles, concernant une classe ou une école ici où là.
Enfin, pour le personnel du rectorat, l’expérience de la gestion d’un gymnase a été positive et relativement bien perçue. Ce gymnase vaccinait entre 600 et 700 personnes. Nombre de personnels mobilisés en ont tiré un sentiment de fierté d’accomplir un service public, ce que nous n’imaginions pas au début. Pour chaque journée, y compris pendant les vacances, nous avons trouvé l’effectif nécessaire. De vraies équipes se sont formées.
M. le président Jean-Christophe Lagarde. Monsieur Claude Michellet, nous vous remercions.
La séance est levée à dix-huit heures quinze.
Audition de M. Thierry Saussez,
directeur du service d’information du Gouvernement
(Procès-verbal de la séance du mercredi 5 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures quinze.
(M. Thierry Saussez prête serment.)
M. le président Jean-Christophe Lagarde. Monsieur le directeur, ma première question sera simple : pensez-vous que la communication – tant celle du Gouvernement que, plus généralement, celle de l’État, notamment par l’intermédiaire des agence sanitaires – a été efficace, utile et réactive avant et durant la campagne de vaccination ?
M. Thierry Saussez, directeur du service d’information du Gouvernement. Dès lors que l’on prend, comme vous le faites, quelque distance par rapport aux événements, il me semble que l’on peut répondre « oui ». L’étude-bilan que nous avons faite après la crise montre que les Français partagent largement cette analyse pour la manière dont ils ont été informés à propos de la grippe A(H1N1) en général et du plan de vaccination en particulier.
Il est difficile de se replacer dans le climat de l’époque. Je vous remettrai à ce propos les notes d’alerte que nous avons rédigées au fil de la crise. La première, en date du 27 avril 2009, montre que les critiques vis-à-vis du Gouvernement consistaient plutôt à reprocher à celui-ci de sous-estimer la menace. Pour avoir participé à la cellule interministérielle de crise – la cellule décision –, je sais que la communication gouvernementale était centrée, à cette période comme pendant toute la durée de la crise, sur les deux points suivants : dans la gestion d’une crise, il faut éviter l’affolement et la panique, et le rôle de l’État consiste à envisager toutes les situations possibles, y compris la pire.
Les attentes de l’opinion, relayées par les médias – et même par une hypermédiatisation – étaient que l’on ferme les frontières, que l’on interdise de se rendre au Mexique et que l’on impose le port d’un masque dans les aéroports. D’une manière générale, lorsque l’opinion est inquiète, elle juge que le Gouvernement n’en fait pas assez et, au fur et à mesure qu’elle est moins inquiète, elle considère qu’il en fait trop. À chacun de choisir s’il vaut mieux, au bout du compte, être accusé d’en faire trop ou de n’en faire pas assez.
Ainsi, en avril 2009, la première note d’analyse montre que l’opinion considérait que le Gouvernement n’en faisait pas assez – souvenons-nous de l’alarmisme qui régnait alors dans les médias. En septembre, au milieu de la crise, l’inquiétude avait diminué, le public envisageait moins de se faire vacciner et commençait à penser, selon un mouvement permanent et compréhensible, que le Gouvernement en faisait peut-être trop.
Il est donc bon de prendre de la distance. Pour ce qui est de la réaction des Français face à la communication mise en œuvre à propos de la grippe, je rappellerai les résultats d’un sondage de l’Institut français d’opinion publique (IFOP) réalisé en mars 2010 auprès d’un échantillon représentatif de la population.
À la question : « Avez-vous le sentiment d’avoir été bien informé ou non sur les comportements adoptés pour vous protéger et protéger vos proches ? », 85 % des personnes interrogées répondaient par l’affirmative. Elles étaient 84 % à faire de même à propos des comportements adoptés dans leur entreprise ou leur administration, 73 % pour ce qui concerne la mise en place d’un plan de vaccination par les pouvoirs publics, 70 % pour ce qui concerne les actions mises en œuvre par les pouvoirs publics pour gérer l’épidémie, 69 % pour ce qui concerne les symptômes de la maladie et 64 % pour ce qui touche à l’évolution de l’épidémie.
En revanche, quand on demandait aux personnes interrogées si elles avaient utilisé certains moyens d’information et si ces moyens étaient fiables, 91 % avaient utilisé les journaux télévisés et 65 % les jugeaient fiables, 60 % avaient écouté les déclarations officielles du Gouvernement et 55 % les jugeaient fiables, 27 % avaient consulté les sites internet d’information et 81 % les jugeaient fiables, 13 % avaient consulté les sites internet gouvernementaux et 85 % les jugeaient fiables – ainsi, le site consacré à la pandémie grippale par le Gouvernement a reçu 6 millions de visites en 2009. À la question de savoir ce qu’ils souhaitent dans le cas d’une autre épidémie ou pandémie, les Français répondent qu’ils souhaitent d’abord des spots télévisés d’information, puis une information de la part des médecins traitants.
La communication du Gouvernement suscite des critiques fortes, mais est décrite comme présentant de vrais atouts. Cette communication est jugée disproportionnée – après la crise, on considère que le Gouvernement en a fait trop –, mais, pour 80 % des personnes interrogées, elle a été bien diffusée. Pour 61 %, elle a manqué de crédibilité et, pour 54 %, elle a été pédagogique – l’opinion gère ses propres paradoxes : la pédagogie n’est-elle pas un élément de la crédibilité ? Pour 66 %, elle a manqué de transparence et, pour 54 %, elle a été responsabilisante. Ces chiffres, je le répète, ont été mesurés après la crise.
Enfin, cette communication a eu un réel impact sur les comportements des Français.
La première conclusion que l’on peut tirer de ces données porte sur le rôle de la communication publique, qui consiste à délivrer une information au plus grand nombre possible de citoyens, en toute transparence, afin qu’ils soient libres et responsables de leurs comportements. À en juger par ce qui s’est produit et par le jugement porté après la crise par les Français, le pari a été gagné.
Par ailleurs, 43 % des personnes interrogées ont déclaré avoir modifié leurs comportements d’hygiène au moment de l’épidémie, contre 36 % en décembre. C’est particulièrement le cas des femmes, des moins de trente-cinq ans et des habitants de l’Île-de-France. Il s’agit d’un progrès considérable, qu’il faudra entretenir.
Comme les campagnes menées depuis trente ans dans les domaines de la sécurité routière, de la santé ou de l’environnement, cette crise a permis aux Français d’acquérir des règles de base d’hygiène personnelle et collective, des « gestes barrières » qui sont un frein au développement des épidémies. Cette action devra être poursuivie.
En outre, 58 % des personnes interrogées pensent que la France est désormais mieux préparée à faire face à une nouvelle épidémie. De fait, c’est la première fois que notre pays gère en situation réelle une crise pandémique, en termes tant de décision politique que de logistique – avec la gestion, dans toute la France, des masques et des vaccins – ou de communication, malgré les erreurs liées à la gestion des informations diffusées sur internet, que nous devons assumer et qui doivent être une source de réflexion pour l’avenir. Cette expérience représente certainement un gain considérable pour le jour – qui viendra nécessairement, dans cinq ans, dix ans ou cinquante ans – où, devant une pandémie de type H5N1, on ne reprochera pas à l’État d’en faire trop, compte tenu de la gravité de la situation.
M. Guy Lefrand. Je m’interroge sur l’impact d’une communication destinée à encourager une vaccination de masse et qui a été suivie de la vaccination de moins de 10 % de la population. Pouvez-vous préciser quelle a été la communication destinée aux professionnels de santé, qui, pour une bonne partie, n’ont nullement adhéré à la vaccination ? Avez-vous analysé les problèmes de communication intervenus avec ces professionnels ?
M. Thierry Saussez. Non, cela n’a pas été analysé en détail au niveau interministériel – c’est-à-dire au niveau du service d’information du Gouvernement. Sans doute le ministère de la santé vous en a-t-il parlé ou vous en parlera-t-il plus directement.
Pour nous, la communication de crise comporte deux étapes.
La première consiste par nécessité à maximiser la crise : l’État est dans son rôle lorsqu’il envisage le pire. Durant toute cette première phase, nous n’avons d’ailleurs guère rencontré de difficultés auprès des médias et de l’opinion publique.
La deuxième étape consiste – puisque nous gérons des incertitudes, ce qui conduit d’ailleurs les acteurs à adopter une certaine humilité et devrait inciter à la même humilité les commentateurs ou ceux qui réécrivent l’histoire – à nous donner le plus possible de marges de manœuvre dans la mise en œuvre. C’est précisément à ce stade que les polémiques ont commencé à prendre de l’ampleur. Dès lors que l’on rencontre une contrainte, liée ici aux délais de livraison de vaccins et à leur conditionnement, et que l’on ne peut pas associer à l’opération les médecins libéraux, on alimente la polémique, qui nuit incontestablement à la prise en compte des impératifs sanitaires ou à la vaccination. Si l’on avait pu éviter ces contraintes et commencer la vaccination en se donnant des marges de manœuvre, en recourant notamment aux médecins libéraux, c’est-à-dire à la proximité et à la confiance, les choses auraient été, de ce point de vue, différentes.
M. le président Jean-Christophe Lagarde. Ne vous est-il pas venu à l’esprit, durant la période de préparation, que toutes les personnes qui se demandaient si elles devaient se faire vacciner iraient d’abord demander conseil à leur médecin traitant et qu’une communication spécifique, exemplaire et efficace, en direction des médecins pourrait permettre une meilleure adhésion à la vaccination ?
Le directeur général de l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) nous a déclaré que, dans l’hésitation, le public s’est tourné vers les médecins, lesquels étaient souvent plus que dubitatifs, car ils n’étaient pas acteurs. La communication consiste aussi à faire en sorte que les gens soient acteurs, afin de s’assurer de leur participation.
M. Thierry Saussez. C’est absolument évident. Si vous me demandez aujourd’hui quel serait, compte tenu de l’expérience, un schéma idéal pour faire face à la gestion des incertitudes et dégager des marges de manœuvre pour la mise en œuvre, je répondrais qu’il faudrait s’assurer du délai de livraison des vaccins et de leur conditionnement, travailler au niveau de la proximité en passant par le réseau médical, commencer la vaccination au plus près du terrain et en douceur et n’ouvrir les centres de vaccination que lorsque la pandémie ne laisserait plus aucun autre choix.
M. Jean-Pierre Door, rapporteur. Il convient de réfléchir à l’organisation de la gestion de crise. L’articulation est-elle suffisante entre le service de communication du Gouvernement, l’Institut de veille sanitaire et la Délégation interministérielle à la lutte contre la grippe aviaire ? Une cellule de gestion de crise ne serait-elle pas utile à l’avenir pour mieux préparer la communication en direction de tous les secteurs, afin d’éviter des messages quelque peu brouillés ? Aux États-Unis, la gestion est parfaitement organisée et tous les acteurs sont réunis au sein d’une telle cellule.
Par ailleurs, de nombreuses rumeurs, parfois terribles, ont dû vous parvenir par l’intermédiaire de sites internet ou d’un certain nombre de réseaux sociaux. Une surveillance était-elle prévue et quelqu’un était-il en mesure de répondre à ces rumeurs afin de ne pas aggraver le déni du risque ou de la réalité ? Un rapport de l’Office parlementaire d’évaluation des choix scientifiques et technologiques a rappelé à ce propos qu’il existe aux États-Unis une cellule chargée de surveiller les rumeurs circulant sur les sites internet et de leur répondre immédiatement. Une telle tâche relève, me semble-t-il, des services de communication. Que pourrait-on faire à l’avenir en ce sens ?
M. Thierry Saussez. Le rôle du service d’information du Gouvernement, fixé par circulaire du Premier ministre, consiste entre autres à participer à l’ensemble des exercices majeurs régulièrement organisés en France – il en est prévu environ un par mois, le prochain étant Piratair. La France possède une culture de préparation de crise et d’exercices majeurs. Ce service s’était d’ailleurs préparé depuis plusieurs années à une pandémie, même s’il s’agissait d’une pandémie de type H5N1.
Le rôle du service est donc de participer à l’élaboration de la stratégie de communication de crise, de coordonner la communication interministérielle, de veiller à l’unicité de la parole de l’État et de partager ses outils de communication. J’ai donc siégé en permanence à la cellule « décision » de la cellule interministérielle de crise, qui a fonctionné dès la première semaine de déclenchement de la pandémie, et s’est ensuite réunie de façon hebdomadaire au niveau des ministres ou des directeurs de cabinet. Mon collaborateur André Chevallier, ici présent, chef du département « communication de crise » au service d’information du Gouvernement, a participé simultanément à la cellule « communication ».
Sur une période aussi longue et compte tenu des contraintes d’expression personnelle ou politique naturelles dans une démocratie, la parole de l’État me semble donc avoir été globalement assez bien coordonnée. Les éléments de langage ont été unifiés pour les membres du Gouvernement et les préfets et diffusés sur le terrain pour l’ensemble des acteurs. À mon niveau, je n’ai pas senti de problème considérable en la matière.
M. le président Jean-Christophe Lagarde. Quel le coût de toutes ces campagnes de communication ?
M. Thierry Saussez. Je vous les indiquerai dans un instant.
La gestion de l’internet a été un échec, que j’assume. Cette tâche est très difficile pour l’État, car celui-ci ne vit pas dans le temps de l’immédiateté d’une information qui circule à la vitesse de la lumière. L’État est transparent, parle officiellement et valide ses réponses : il dit qui parle. Face à un univers en grande partie masqué où interviennent de nombreuses voix, qui vont des cadres licenciés de l’industrie pharmaceutique, aux sectes, en passant par les fous, les théoriciens du complot mondial et sioniste et ceux qui déclarent que les vaccins ont été inventés par les laboratoires pour gagner de l’argent, c’est un défi considérable. Il n’en reste pas moins que nous avons réagi trop tard pour équilibrer les rumeurs folles qui nuisent aux enjeux de santé publique.
Nous cherchons à dépasser les systèmes de veille pour être plus proactifs. Peut-être cela supposera-t-il la mise en place de porte-parole du web ou de structures interministérielles, au-delà du service d’information du Gouvernement, que je viens de développer considérablement – en partie à l’issue de cette crise – pour disposer de plus de moyens, non seulement de veille – car nous les possédons déjà –, mais aussi d’intervention directe. Peut-être faut-il plus d’idées et de créativité. Ainsi, nous avons eu trop tard l’idée de créer un réseau de vaccinés qui auraient pu témoigner, contre les loufoques affirmant que le vaccin allait provoquer des décès en masse, que la vaccination était inoffensive.
Si donc la gestion de l’internet est difficile pour l’État, qui ne combat pas à armes égales avec ses contradicteurs, celui-ci ne peut rester sur son quant-à-soi et doit développer ses moyens propres, avec plus d’imagination et plus d’idées. Structurellement, peut-être le réseau des veilleurs interministériels n’est-il plus suffisant aujourd’hui et peut-être des porte-parole web pourraient-ils parler en validant leur propre réponse. Dans le temps d’internet, il n’est pas question de mettre trois jours à répondre à une attaque.
Monsieur le président, nous avons coordonné la campagne de l’Institut national de prévention et d’éducation pour la santé (INPES), qui a connu cinq vagues – de mai 2009, où la campagne portait sur les gestes barrières, à février 2010, où la cinquième action, beaucoup plus modeste, était consacrée à la possibilité de se faire vacciner par son médecin. En dehors des honoraires d’agences – chiffres dont je ne dispose pas, mais que l’INPES possède –, les achats d’espace dans la presse se sont élevés à 1,691 million d’euros. La totalité des achats d’espace audiovisuel s’est faite gratuitement par procédure de réquisition gratuite du Conseil supérieur de l’audiovisuel (CSA). Un tel achat est estimé par les chaînes de radio et de télévision entre 20 et 30 millions d’euros bruts sur l’ensemble de la période.
Dans cette affaire, l’État a été très économe dans ses dépenses de communication, comme il s’efforce ordinairement de l’être sous mon autorité, malgré parfois quelques polémiques. Du reste, le montant de 20 ou 30 millions d’euros bruts serait singulièrement diminué si l’on tenait compte des prix négociés par l’État pour ses campagnes d’intérêt général.
Du côté du service d’information du Gouvernement, l’animation et l’éditorialisation du site dédié à la pandémie grippale – lequel a fait l’objet, je le répète, de 6 616 427 visites en 2009 – et les investissements réalisés en matière de veille médias, d’internet, d’études et de sondages, de référencement du site et de création des messages rouges que nous avions prévus en cas de limitation des transports ou d’autres mesures plus dures qui auraient pu être mises en œuvre dans une situation pandémique – mais que nous n’avons heureusement pas eu besoin de publier – représentent un montant de 612 000 euros.
M. Jean Mallot. L’objectif d’un service comme le vôtre est, somme toute, de conditionner l’opinion au service de la politique du Gouvernement. Il est aussi d’assurer la promotion de celui-ci en prouvant à l’opinion qu’il a bien agi dans cette crise. Au risque d’une certaine naïveté, il me semble qu’il devrait surtout s’agir d’assurer la construction et le pilotage d’une campagne conduisant la population française à faire face convenablement à cette crise – ce qui n’est pas tout à fait la même chose. Comment avez-vous résolu le problème de cette pluralité d’objectifs possibles pour un service comme le vôtre ?
Les sondages analysant la campagne sont-ils inclus dans les chiffres que vous venez d’indiquer ?
M. Thierry Saussez. Bien sûr. Le service d’information du Gouvernement, qui existe depuis trente ans, sous une forme ou sous une autre et sous tous les gouvernements, a fait l’objet des mêmes critiques, formulées à tour de rôle par les uns et les autres. C’est un jeu très français.
On peut dire à son honneur que, quelle que soit sa couleur, il a toujours consacré la grande majorité de ses investissements publicitaires à la santé, à la sécurité routière et à l’environnement. L’exemple que nous étudions aujourd’hui doit précisément nous inspirer en matière de communication sur les règles et les comportements d’hygiène, ou nous inciter à ne pas affaiblir la préparation de la France à la gestion d’une crise pandémique de type H5N1.
Les campagnes de communication du Gouvernement ont changé les comportements. On n’aurait jamais fait évoluer en trente ans le rapport à l’automobile sans conjuguer à la loi et à la réglementation la motivation des Français via la communication. Il en va très probablement de même pour tous les grands enjeux de santé ou d’environnement, en matière notamment de réduction des déchets ou d’adoption de nouveaux comportements. L’une des grandes lignes de l’action de communication du Gouvernement est donc comportementale.
Dans un deuxième temps, cette action consiste aussi à informer les Français sur des réformes ou des mesures mises à leur disposition. On a tendance à parler dans ce cas de campagnes plus « politiques », mais il s’agit toujours là, selon moi, de valoriser et de mettre à la portée des Français des politiques publiques légitimes, déterminées par l’exécutif et votées par le Parlement.
Enfin, en période de crise, le premier objectif est de délivrer une information aux Français de la manière la plus transparente et la plus objective possible. C’est ce qu’a fait la campagne de l’Institut national de prévention et d’éducation pour la santé (INPES). Il n’est pas contestable que, sans aucun objectif de nature politicienne, cette campagne a apporté aux Français, notamment sur les gestes barrières, une information qui a eu des effets. Les résultats rapportés par les sondages nous ont été confirmés par les médecins et les spécialistes, qui considèrent que ces évolutions de comportements ont également fait reculer d’autres problèmes de santé.
Un mot encore sur les sondages. Les trois notes d’analyse que je vous remets montrent, je le rappelle, que l’opinion reproche tout d’abord au Gouvernement de ne pas en faire assez, que l’inquiétude diminue au milieu de la crise et qu’à la fin l’opinion, qui n’est plus inquiète du tout, reproche au Gouvernement d’en faire trop. Enfin, l’étude finale fait apparaître que l’information globale des Français sur ces questions a été assurée. Tout cela permet de voir ce qui a – ou n’a pas – fonctionné.
La gestion démagogique d’une crise consisterait à faire bouger l’État au prorata de l’inquiétude, au mépris des enjeux de santé publique. Or, tel n’est pas le rôle de l’État. Les virus, les bestioles, les mutations et les pandémies qui se déclarent en trois semaines se moquent bien de nos préoccupations démagogiques, de la politique politicienne, des médias et de notre gestion du temps. Nous sommes donc contraints de mettre en place un système qui, par définition puisqu’il anticipe la crise, nous conduira probablement soit plus loin, soit moins loin qu’il ne serait souhaitable. J’en reviens à ce que j’ai dit tout à l’heure : il s’agit de choisir d’en faire trop ou de n’en faire pas assez !
M. Gérard Bapt. Où se réunissait la cellule interministérielle de décision ?
M. Thierry Saussez. Systématiquement au ministère de l’intérieur.
M. Gérard Bapt. Pas à Matignon ?
M. Thierry Saussez. Matignon organisait des réunions interministérielles.
M. Gérard Bapt. Qui en assurait le secrétariat et les comptes rendus ?
M. Thierry Saussez. La direction de la planification de sécurité nationale.
M. le président Jean-Christophe Lagarde. Nous avons demandé ces comptes rendus et nous devrions les recevoir prochainement.
M. Gérard Bapt. Un anthropologue a publié dans Le Monde un article intitulé « Un échec du catastrophisme » – auquel vous avez d’ailleurs répondu. Si, comme vous l’avez répété, il faut, pour engager la gestion d’une crise, maximiser le risque, la réussite a été totale. Ce reproche a été formulé par des parlementaires, des scientifiques et des médecins. Récemment, M. Antoine Flahault, directeur de l’École des hautes études en santé publique, nous déclarait que le chiffre de 30 000 à 60 000 morts qu’il avait indiqué à l’AFP représentait une fourchette basse des estimations qui avaient alors cours, lesquelles pouvaient atteindre le chiffre de 300 000 morts. Il y en a eu en fait 312, dont la majorité étaient porteurs d’autres pathologies, bien qu’on ait observé aussi le décès de jeunes.
M. Thierry Saussez. Parfaitement sains.
M. Gérard Bapt. A posteriori, la théorie de la maximisation du risque n’entraînera-t-elle pas une sorte d’inertie et ne risque-t-on pas de voir un nombre plus important encore de citoyens s’éloigner de la vaccination recommandée par l’autorité publique ?
M. Thierry Saussez. C’est possible. On peut cependant espérer que les vaccins de la grippe saisonnière intègrent progressivement des évolutions comparables à celles qui ont déjà eu lieu.
Par ailleurs, toute gestion de crise continuera d’être régie par les deux points que j’ai déjà évoqués : maximiser la crise pour y faire face et, devant l’impératif de gérer des incertitudes, se donner des marges de manœuvre dans la mise en œuvre. La question sera donc de savoir à quoi s’appliquera la gestion de crise – à quel moment et pourquoi l’État interviendra à ce niveau. À le faire trop ou trop souvent, on « perd » la prévention et on s’expose au « syndrome de Pierre et le loup » – l’opinion dirait : « Ils m’ont déjà fait le coup ! » –, sauf bien sûr dans le cas de la grippe H5N1, face à laquelle personne ne reprochera au Gouvernement d’en faire trop, car elle fera d’emblée 50 000 morts. Pour éviter cette situation, l’État doit se mobiliser à bon escient à partir des informations scientifiques et médicales dont il dispose.
M. le rapporteur. Beaucoup de gens ont été touchés par le « syndrome de Pierre et le loup » que vient d’évoquer M. Thierry Saussez.
Pour ce qui est de la gestion des incertitudes, le communicant doit trouver un équilibre difficile entre prévention et précaution – la première s’appliquant à un risque reconnu et l’autre à toutes les incertitudes. Que faut-il faire, selon vous, pour éviter les excès tout en assurant une prévention efficace des risques ?
M. Thierry Saussez. Si le communicant avait toutes les réponses, il serait comme vous : un dieu. Or, il n’est qu’un humble serviteur de l’État.
En matière de prévention, l’un des bénéfices de la crise que nous venons de connaître a été de favoriser l’adoption de gestes barrières. L’État doit organiser à ce propos des campagnes de communication régulières, car ces comportements valent aussi pour les gastro-entérites et bien d’autres problèmes de santé qui peuvent toucher notre pays.
Par ailleurs, l’une des conclusions que l’on peut tirer de cette crise est qu’il importe de pouvoir se donner des marges de manœuvre dans la mise en œuvre. C’est là que réside la différence entre précaution et prévention. C’est le métier de l’État que de se préparer à affronter le pire avec des cellules de décision, de logistique et de communication. Dès lors que l’opinion publique est fortement mobilisée à propos d’un risque, la question de la marge de manœuvre devient centrale. Dans le cas du nuage de cendres émis par le volcan islandais Eyjafjöll, il allait de soi d’interdire le passage des avions à travers ce nuage – n’importe quel responsable politique aurait pris la même décision –, mais, trois jours plus tard, les vols étaient de nouveau autorisés. C’est là un cas typique où, après avoir maximisé la crise au titre de la précaution, on a pu se donner des marges de manœuvre et on ne s’est pas enfermé dans la crise.
M. Guy Lefrand. Revenons à l’objet même de cette commission d’enquête : la vaccination proprement dite. Il ne suffit pas, en effet, de dire que les Français ont appris à bien se moucher. Le Gouvernement a mis en place une campagne pour pousser les gens à se faire vacciner, mais ils ne l’ont pas fait. Il y a là un certain hiatus, car cet aspect de la communication n’a manifestement pas abouti. Quelles conclusions en tirez-vous ?
Par ailleurs, vous avez indiqué tout à l’heure que la communication s’élaborait au jour le jour et dépendait notamment de la disponibilité des vaccins. Cela signifie-t-il qu’elle ait pu être modulée en fonction de la quantité de vaccins disponibles ?
M. Thierry Saussez. On ne peut pas couper une crise en tranches, et pas davantage la communication. La gestion de la crise a été globale et la vaccination n’en a été qu’un élément. Du reste, les limites qu’a connues la vaccination ne doivent pas faire oublier les gains réalisés notamment en matière de gestes barrières ou de gestion de crise en situation réelle au niveau de l’État.
Pour ce qui concerne la vaccination, qui a été l’une des cinq étapes des campagnes de communication de l’INPES, je répète que, bien évidemment, le schéma idéal aurait consisté à commencer par l’échelle individuelle et par le médecin de proximité, et à n’ouvrir les centres de vaccination de masse qu’au cœur de la plus grande affluence. Cependant, malgré la spécialité française consistant à battre sa coulpe, les chiffres affichés par notre pays ne sont guère plus mauvais que ceux de bon nombre de ses voisins européens.
La communication publique a pour enjeu de donner l’information aux citoyens et de les responsabiliser au maximum dans leurs comportements collectifs, à charge pour eux de décider, notamment face à une question aussi personnelle que la vaccination, de faire ou de ne pas faire ce qui est recommandé.
M. le président Jean-Christophe Lagarde. Je suis en désaccord avec votre hypothèse. Vous déclariez tout à l’heure que la communication relative aux politiques publiques ne vise pas seulement à permettre aux citoyens de comprendre, mais aussi à modifier leurs comportements – c’est tout aussi vrai pour cette crise qu’en matière de sécurité routière. La question n’est pas de savoir si les gens sont satisfaits et s’ils ont le sentiment d’avoir été bien informés : elle est de savoir si la campagne d’information a été utile et si elle a permis qu’ils soient vaccinés. Force est de reconnaître que cela n’a pas été le cas.
Si l’un des travers français consiste à battre sa coulpe, un autre est de se croire toujours meilleur que les autres. Or, en l’espèce, notre pays ne se classe pas parmi les meilleurs et le fait de se situer dans une mauvaise moyenne ne saurait satisfaire le Gouvernement, et encore moins un organisme gouvernemental.
M. Thierry Saussez. J’espère ne pas vous avoir donné le sentiment d’une aussi grande satisfaction !
M. le président Jean-Christophe Lagarde. Certes non, mais je préfère préciser les choses.
Par ailleurs, je ne suis pas certain que l’État soit dans son rôle quand il avance l’hypothèse du pire, ou, plus précisément, quand il communique à partir de cette hypothèse.
M. Thierry Saussez. Je n’ai pas dit que l’État devait communiquer sur cette hypothèse, mais qu’il devait l’envisager. J’ai même rappelé que toute la communication du Gouvernement avait consisté à recommander d’éviter l’affolement et la panique tout en faisant savoir qu’il se préparait.
M. le président Jean-Christophe Lagarde. Manifestement, cela n’a pas été perçu, et c’est sans doute la raison pour laquelle on lui reproche aujourd’hui légitimement d’en avoir trop fait. Le plus grave, et c’est ce qui a motivé mon souhait et celui de mon groupe de créer cette commission d’enquête, est que, le jour où surviendra, par exemple, une pandémie du type H5N1, il est à craindre que nos concitoyens ne croient pas ce que dira l’État. C’est ce que vous avez appelé le « syndrome de Pierre et le loup ».
Permettez-moi d’avancer quelques hypothèses sous forme de questions.
Tout d’abord, vous êtes-vous appuyés sur des études de sociologues ? La Commission d’enquête a, quant à elle, auditionné un sociologue, M. Michel Setbon, qui a travaillé sur ces sujets et a l’expérience des questions liées à la grippe.
M. Thierry Saussez. Il a d’ailleurs travaillé aussi pour nous.
M. le président Jean-Christophe Lagarde. Son étude montre clairement qu’en juillet et en décembre 2009, la perception des risques et les intentions vaccinales de l’opinion n’avaient pratiquement pas changé. Si donc le jugement politique avait évolué, les lignes n’avaient pas bougé quant à l’appréciation de la crise.
Avez-vous sollicité M. Michel Setbon avant et après la crise ?
M. Thierry Saussez. Avant la crise et pendant la première partie de celle-ci.
M. le président Jean-Christophe Lagarde. Sans doute serait-il encore utile de faire appel à lui.
Jusqu’à présent, je me suis peu exprimé au sein de cette commission d’enquête. N’étant pas médecin, je voulais d’abord comprendre la situation. Comme vous l’avez souvent répété, le Gouvernement s’attendait à une pandémie de type H5N1 et a déclenché en conséquence un mécanisme correspondant à ce genre de menace, lançant une communication dans un contexte marqué par de nombreuses incertitudes liées à ce type de risque, de telle sorte qu’il était ensuite très difficile de revenir en arrière et de faire comprendre au public que son affolement, auquel il avait été légitimement répondu, ne se justifiait plus et que l’on était, finalement, confronté à une « grippette ».
M. Thierry Saussez. On retombe sur les marges de manœuvre !
M. le président Jean-Christophe Lagarde. L’expérience doit être utile.
M. Thierry Saussez. Je vous ai déjà dit que je partage ce sentiment.
M. le président Jean-Christophe Lagarde. Puisque nous sommes ici pour essayer de mieux nous préparer à répondre à une pandémie de type H5N1, mais aussi pour comprendre qu’il existe des niveaux intermédiaires auxquels, à force de nous préparer au pire, nous n’étions pas prêts, quelle conclusion peut-on tirer de l’expérience ?
Sans doute peut-on aussi améliorer certains types d’informations. Si, comme vous le dites, il est difficile de communiquer dans l’incertitude, l’incertitude même ne devrait-elle pas faire partie de la communication gouvernementale permanente ? De fait, je suis effaré de ma propre méconnaissance de la grippe – méconnaissance que partage sans doute une bonne part de la population. Si le public savait que les virus évoluent et mutent, sans doute accepterait-il mieux que nous ne soyons pas certains de ce que nous affirmons et internet vous poserait sans doute moins de problèmes. Nous manquons de culture sur ces questions et il faudrait que les Français puissent prendre conscience du fait que la science ne peut pas tout.
Par ailleurs, l’audition du directeur de l’Académie de Paris, à laquelle nous venons de procéder, nous a révélé que la communication du ministère de l’éducation nationale sur un sujet effectivement sensible pour les parents et plusieurs millions de nos concitoyens était dramatiquement administrative et indigente. L’indigence des documents diffusés par le ministère aux parents, par l’intermédiaire des établissements scolaires, pour les inciter à faire vacciner leurs enfants confine à l’indécence.
Enfin, j’ai découvert aujourd’hui que mes enfants, qui sont âgés de moins de neuf ans et qui ont été vaccinés avec une injection – sans doute de Panenza –, en auraient eu besoin d’une deuxième. Or, puisqu’il a été annoncé partout qu’une seule injection suffisait, je croyais qu’ils étaient protégés. Au-delà du cas individuel, on voit là un défaut de communication car, malgré la traçabilité, ceux qui devaient recevoir l’information n’ont pas été invités à venir recevoir la deuxième dose d’un vaccin dont nous avons en stock des millions d’unités et dont nous ne savons plus quoi faire. Un travail d’audit, que la commission d’enquête ne pourra pas faire, serait utile en la matière.
Il serait bon que nous sachions, pour une fois, procéder à un retour sur notre expérience pour savoir comment gérer les marges de manœuvre. Il ne suffit pas de savoir comment les Français ressentent l’information qu’ils ont reçue. Sans doute aurais-je répondu à votre sondage comme l’ensemble de nos concitoyens si j’avais été interrogé il y a trois semaines, mais, ayant appris que mes enfants n’ont pas reçu les doses de vaccin qu’ils auraient dû recevoir, j’aurais aujourd’hui un jugement très différent.
M. le rapporteur. N’avez-vous reçu aucun message ?
M. le président Jean-Christophe Lagarde. Aucun. À partir du 4 janvier, la communication du Gouvernement sur le besoin de vaccination a beaucoup diminué. Lorsqu’on a fait vacciner ses enfants début novembre, c’est-à-dire au début du processus, et que, devant l’affluence dans les centres de vaccination au moment de la deuxième injection prévue, trois semaines plus tard, on a laissé passer Noël, rien n’était fait pour inciter les parents à faire procéder à la deuxième injection. Il serait d’ailleurs intéressant de demander à la Direction générale de la santé, qui dispose des éléments de traçabilité, combien d’enfants ont reçu deux injections dans notre pays.
M. Gérard Bapt. Que de difficultés !
M. Thierry Saussez. La crise, c’est difficile !
M. le président Jean-Christophe Lagarde. Loin de moi l’idée d’instruire un procès. La question est de savoir comment bien nous préparer à la pandémie grave que nous redoutons sans réagir démesurément aux alertes modérées qui surviendront dans l’intervalle, afin d’éviter le « syndrome de Pierre et le loup ».
M. Thierry Saussez. Vous évoquez là l’hypothèse d’une pandémie potentielle de type H1N1, c’est-à-dire un virus à transmission très rapide, mais de faible létalité – sans oublier cependant l’hypothèse d’une éventuelle mutation. En cas de H5N1, je le répète, la question ne se poserait pas, car la gravité de la pandémie exclurait que quiconque vienne reprocher à l’État d’en faire trop.
Par ailleurs, dans le cas d’une crise courte, se pose la question de la jonction entre la maximisation de la crise et les marges de manœuvre. Il est du devoir de l’État d’appliquer rigoureusement le principe de précaution, qu’il s’agisse d’empêcher les avions de traverser un nuage de cendres volcaniques ou d’assurer la prévention de la grippe. La question centrale est de savoir à quoi appliquer ce principe et comment travailler les marges de manœuvre. L’une des conclusions que nous tirons de la gestion de cette crise est que, tant pour la communication que dans tous les secteurs concernés, nous inscrirons désormais dans chaque plan de gestion de crise une interrogation sur la possibilité de dégager des marges de manœuvre.
En troisième lieu, il est certain qu’en matière de communication, tout n’a pas été parfait. Nous avons ainsi eu connaissance, dans le cadre de la cellule communication, des documents que vous évoquiez. De toute évidence, il sera possible d’améliorer ces éléments ciblés. C’est, au fond, la première fois que l’État gère une telle crise sur une aussi longue durée et il convient d’en tirer tous les éléments d’amélioration possible.
Quant à la fin de la campagne – il faut bien que la crise se termine un jour –, j’ai moi-même mis un terme à la campagne télévisée car, s’il est inévitable que les Français trouvent que le Gouvernement en fait trop lorsque l’inquiétude est faible, celui-ci ne doit pas exagérer pour autant. Cependant, il aurait sans doute été nécessaire de continuer à livrer des informations ciblées au grand public. La jonction entre la situation et les moyens employés pourrait certainement être améliorée.
M. le président Jean-Christophe Lagarde. Je suggérais tout à l’heure que le phénomène grippal, très méconnu de la population, qui appelle souvent « grippe » un simple rhume, devrait, comme les incertitudes des scientifiques quant à l’évolution du virus et de l’épidémie, faire partie de notre culture. On accepte en effet beaucoup mieux un risque reconnu comme aléatoire qu’une grippe assimilée à une affection qui ne menacerait que les personnes âgées ou fragiles.
M. Thierry Saussez. Ce n’est pas le cas du virus H5N1.
M. le président Jean-Christophe Lagarde. Bien entendu. Toujours est-il qu’aux États-Unis, où le vaccin contre la grippe saisonnière fait partie de la culture, la vaccination contre la grippe H1N1, même pratiquée avec un vaccin non testé, a été beaucoup mieux acceptée qu’en France. En termes de communication, il vaudrait mieux que la population possède un niveau minimal d’information. Au-delà de la promotion de gestes barrières, c’est une question sur laquelle le Gouvernement devrait travailler.
M. Thierry Saussez. Je suis tout à fait d’accord. La communication est nécessaire pour promouvoir les comportements d’hygiène, mais il faut aller plus loin. Dès le début de juillet, nous prendrons notre modeste part à la promotion des comportements de prévention en ouvrant un site web à l’adresse www.risques.gouv.fr, auquel sera relié le site pandémie-grippale. Ce site aura une vocation pédagogique et permettra aux Français de mieux comprendre la vingtaine de risques présentés, qui ne se limitent pas aux plus importants que sont les incendies de forêt ou les inondations.
M. Gérard Bapt. Pour la relance et la sortie de crise, il faut redonner le moral aux Français, que le Médiateur de la République décrit comme « stressés ».
M. Thierry Saussez. Je vous rassure : dans les enquêtes d’opinion, le « nous » est très dépressif, mais le « je » est plus volontaire.
M. Gérard Bapt. En matière de communication, il existe des médiateurs importants. Ainsi, il est dommage d’avoir manqué la médiation parlementaire qui aurait consisté à inciter le Gouvernement à revenir sur l’expérience réussie de la mission d’information consacrée à la grippe aviaire, pour laquelle les députés ont fait durant des mois des allers et retours entre le terrain et les autorités – mission dont M. Jean-Pierre Door était déjà rapporteur.
La médiation par les généralistes a elle aussi été manquée. Il est regrettable de n’avoir pas pu – ou pas voulu – s’appuyer sur ces médiateurs extraordinaires. Le docteur Dupagne, médecin généraliste installé près d’ici, nous a déclaré que, dès le mois de mai, les communications qu’il avait par internet avec ses confrères généralistes d’outre-mer et de l’hémisphère Sud lui avaient révélé que cette grippe n’était pas grave. De même, le Sénat recevra prochainement un médecin que je connais, installé à La Réunion, qui tient le même discours. Les généralistes, qui communiquent entre eux, n’ont donc pas particulièrement incité à la vaccination, et cela d’autant moins qu’ils ont été mis à l’écart.
La communication doit s’appuyer sur un débat avec la société, lequel n’a pas eu lieu, sinon dans les pires conditions, et sur la médiation.
Quant à l’adaptation à la crise, elle évoque le Titanic. Dès le 14 mai 2009, on commandait 50 millions de doses de vaccin à GSK. En septembre-octobre, on excluait les généralistes au motif que le vaccin était conditionné en flacon de dix doses – ou, selon l’une des personnes que nous avons auditionnées, par souci d’économie. Fin novembre, on apprenait qu’un million de doses de vaccins en seringues unitaires étaient stockées à l’Établissement public de réponse aux urgences sanitaires (ÉPRUS). On aurait pu ouvrir les vannes vers les médecins généralistes, mais cela n’a pas été fait.
M. Thierry Saussez. Cela a été fait assez vite après !
M. Gérard Bapt. Le 4 janvier 2010, la ministre s’est adressé à la Nation, indiquant qu’elle résiliait les contrats et déclarant aux généralistes qu’on les aimait et qu’on avait besoin d’eux. Cependant, les conditions n’avaient été négociées ni avec les distributeurs, ni avec les pharmaciens, ni avec les généralistes.
M. le président Jean-Christophe Lagarde. Cette décision n’a peut-être pas été celle de M. Thierry Saussez…
M. Thierry Saussez. On en revient aux marges de manœuvre !
M. Gérard Bapt. En l’espèce, on n’en a eu aucune. Lorsque l’on a su que la létalité était très faible, la stratégie de vaccination n’a pas été adaptée, car cela serait revenu à reconnaître que l’on avait commandé trop de doses de vaccin.
En termes de contenu de la communication comme en termes d’adaptation, de nombreuses leçons peuvent être tirées de cette crise. Mais lorsque j’entends le délégué interministériel à la lutte contre la grippe aviaire déclarer que, la prochaine fois, il ne procédera pas très différemment, je suis très inquiet.
M. Thierry Saussez. Dans le domaine de la communication, nous nous sommes efforcés de travailler le mieux possible en réseau, en mobilisant par exemple l’association « Voisins solidaires » ou en sollicitant des experts et des relais. Probablement aurions-nous pu en faire davantage ; nous le ferons la prochaine fois – indépendamment de la question d’internet, à propos de laquelle j’ai déjà reconnu que nous avons des progrès considérables à faire.
Quant à la logistique, on ne saurait la séparer des autres aspects de la gestion de la crise. Un vrai débat s’impose certes, mais on ne peut reprocher à l’État de maximiser la crise, parce que c’est son rôle de le faire. Il importe de savoir quand déclencher les opérations et quelle marge de manœuvre on se donne dans la mise en œuvre. De toute évidence, il faut tirer des enseignements de cette crise.
M. le président Jean-Christophe Lagarde. Monsieur Thierry Saussez, nous vous remercions.
La séance est levée à dix-neuf heures quinze.
Audition de M. Yves Kerouédan,
président de la Chambre syndicale de la répartition pharmaceutique,
et de M. Emmanuel Déchin, secrétaire général
(Procès-verbal de la séance du mercredi 5 mai 2010)
(Présidence de M. Guy Lefrand, vice- président de la commission d’enquête
puis de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-neuf heures vingt.
(M. Yves Kerouédan et M. Emmanuel Déchin prêtent successivement serment.)
M. Yves Kerouédan. Les grossistes-répartiteurs sont des entreprises qui distribuent des médicaments : 85 % des médicaments distribués en pharmacie passent par leur circuit qui ravitaille, à partir de cent quatre-vingt dépôts, les 22 500 pharmacies françaises dans un délai moyen de deux heures. Il s’agit d’un métier très réglementé dont les obligations sont définies par les articles R. 5124-2 à R. 5124-59 du code de la santé publique, avec pour contrepartie la possibilité pour les grossistes-répartiteurs de dégager une marge.
M. Jean-Pierre Door, rapporteur. Combien existe-t-il d’organismes répartiteurs ?
M. Yves Kérouédan. On dénombre six grossistes-répartiteurs principaux et quinze « short liners » – à opposer aux « full liners ». Officiellement, ces deux dernières catégories n’existent pas en France, mais il faut savoir que certains grossistes-répartiteurs ne détiennent aujourd’hui qu’une partie de la collection des médicaments au lieu d’en détenir la totalité.
M. Emmanuel Déchin. Parmi les obligations des grossistes-répartiteurs, celle de détenir la totalité de la collection des médicaments commercialisés en France, pour une consommation de quinze jours, est relativement contraignante. Les grossistes-répartiteurs adhérant à la chambre syndicale respectent cette obligation. D’autres ont obtenu le statut de grossistes-répartiteurs auprès de l’Agence française de sécurité sanitaire des produits de santé mais, pour autant, il est de notoriété publique qu’ils ne détiennent pas la totalité de la gamme, loin s’en faut : ce sont ceux-là que nous appelons les « short liners ».
M. Yves Kérouédan. Nous avons joué un tout petit rôle dans la gestion de la campagne de vaccination contre la grippe A(H1N1). Au mois d’avril 2009, nous avons été convoqués au ministère de la santé par Mme Roselyne Bachelot-Narquin. Le dossier était d’une actualité récente et relativement compliqué – reportez-vous aux reportages télévisés, notamment sur le Mexique –, et l’inquiétude gagnait. Il nous a été demandé si nous étions prêts, en tant que grossistes, à distribuer masques et Tamiflu dans le cadre du « kit de distribution » contre une éventuelle pandémie. Nous avons bien sûr répondu favorablement et commencé à livrer, à partir du 20 juillet 2009, des masques chirurgicaux – 1 300 000 boîtes de 50 unités – à l’ensemble des pharmaciens qui en faisaient la demande.
La base juridique de ces livraisons était double : d’une part, une convention conclue avec l’Établissement de préparation et de réponse aux urgences sanitaires et d’autre part, un arrêté du 3 décembre 2009, qui fixait notre rémunération.
Un peu plus tard, il nous a été demandé de distribuer des antiviraux. Nous avons donc livré aux pharmacies 1 075 000 boîtes de dosettes de Tamivir, de Tamiflu et de Relenza, à partir du mois de décembre.
Nous avons été rémunérés pour ces deux opérations.
M. Emmanuel Déchin. Nous avons été effectivement rémunérés sur la base d’une convention signée avec l’Établissement de préparation et de réponse aux urgences sanitaires, laquelle renvoyait à un arrêté. Cette convention a été conclue assez tôt, dès le mois de septembre, tandis que l’arrêté fixant définitivement le montant de notre rémunération n’a été publié qu’au début du mois de décembre. Nous avons donc connu une petite difficulté s’agissant de notre rémunération pour les livraisons assurées entre les mois de juillet et décembre.
M. Yves Kerouédan. L’administration nous a en effet annoncé qu’il n’était pas sûr que nous soyons rémunérés pour les livraisons effectuées depuis le mois de juillet. Nous avons réagi assez violemment, mais finalement tout cela s’est très bien terminé.
M. Gérard Bapt. Combien cette opération a-t-elle coûté ?
M. Yves Kerouédan. Je crois que cette distribution a coûté 1,2 million d’euros, soit 50 centimes d’euro par unité d’œuvre – le prix d’un timbre-poste.
M. Jean Mallot. J’ai du mal à comprendre pourquoi une telle prestation a donné lieu à une rémunération particulière. En quoi est-elle différente des prestations que vous assurez tous les jours en répartissant les médicaments ?
M. Yves Kérouédan. Habituellement, nous achetons les médicaments et nous réalisons une marge à cette occasion.
M. Emmanuel Déchin. Nous avons en effet oublié de vous préciser qu’il s’agissait en l’occurrence du stock de produits de l’Établissement de préparation et de réponse aux urgences sanitaires, donc de l’État.
M. Yves Kerouédan. D’où un mode de rémunération particulier : au lieu de dégager une marge, nous avons négocié un forfait.
S’agissant des vaccins, de premières hypothèses de travail ont été émises par l’Établissement de préparation et de réponse aux urgences sanitaires au mois d’août 2009, et l’opération a été lancée au mois de novembre de la même année. Celle-ci consistait à livrer, à partir de 93 centres de distribution, 1 100 centres départementaux de vaccination, puis 430 centres hospitaliers et centres hospitaliers universitaires et, enfin, les 22 300 officines de France.
Cette opération se révéla un peu difficile, en raison d’une certaine versatilité des directives. Notre logistique, qui est importante, suppose de mettre en place des dispositifs fiables et pérennes. Or, selon les jours et les semaines, les informations qui nous étaient données pouvaient diverger.
Nous avons distribué ces vaccins sans problème particulier et avons été rémunérés pour cela. Au total, nous avons distribué 5 millions de doses.
M. Guy Lefrand, président. Dont combien dans les officines ?
M. Yves Kerouédan. Nous ne disposons pas de chiffres spécifiques, mais il s’agissait de la plus petite partie – la plus grande a été livrée dans les centres de vaccination.
M. le rapporteur. S’agissait-il d’un million de doses environ ?
M. Yves Kerouédan. Je ne suis pas sûr que le nombre de doses ainsi livrées soit aussi important.
Cette distribution de médicaments a été régie par une convention conclue avec l’Établissement de préparation et de réponse aux urgences sanitaires, en application de l’article 3 du code des marchés publics qui établit une procédure dérogatoire au droit commun. Dans ce cadre, nous avons été rémunérés 850 000 euros. Ainsi, l’ensemble de l’opération, pour les grossistes-répartiteurs, a coûté un peu plus de deux millions d’euros.
Quelles conclusions en tirer ?
Mon grand âge – j’ai soixante-quatre ans – fait que j’ai connu la dernière pandémie de grippe de 1968-1969. Les deux épisodes ont été selon moi différents : en 1968-1969, il s’agissait d’une vraie pandémie, tandis que, cette fois-ci, il ne s’agissait que d’une épidémie « standard ».
M. Gérard Bapt. Permettez-moi de ne pas être d’accord.
M. Yves Kérouédan. Une pandémie, selon moi, atteint plus de 8 à 10 millions de personnes. Or, en 1968-1969, 12 millions de Français avaient été atteints.
M. Gérard Bapt. Je me réfère pour ma part à une définition de la pandémie qui est précise : même si elle peut être évolutive, elle ne correspond pas à la vôtre.
M. Yves Kérouédan. Nous pouvons ne pas être d’accord.
En premier lieu, l’Établissement de préparation et de réponse aux urgences sanitaires a accompli un excellent travail. On peut d’ailleurs se féliciter qu’il ait été présent au cours de l’opération ! C’est une structure bien gérée, par un « général » efficace, qui a su faire preuve d’un grand professionnalisme. De même, au sein du ministère de la santé, nous avons bénéficié d’une bonne écoute de la part de la chargée de mission avec laquelle nous sommes en contact régulier.
En deuxième lieu, l’opération a servi pour nous de test en grandeur réelle – même s’il ne s’agissait pas d’une pandémie... Elle a montré que l’on pouvait intervenir avec efficacité et a mis en lumière le fonctionnement de la chaîne de solidarité du médicament qui repose sur les industriels, les grossistes et les pharmaciens.
Quels points pourrait-on améliorer ?
On peut déplorer la difficulté des relations et de l’articulation entre l’échelon national et l’échelon local ou régional. Certaines directions régionales des affaires sanitaires et sociales ont considéré que les directives de l’Établissement de préparation et de réponse aux urgences sanitaires étaient secondaires et que la « mainmise » régionale était plus importante que l’avis de cet établissement. D’où des différences de points de vue parfois délicates à arbitrer. Le recours aux centres de vaccination nous a conduits à mettre en place des process spécifiques, notamment non informatiques, qui n’étaient pas simples à gérer. Les intermédiaires qui nous ont livrés, en particulier pour les masques, ont sans doute été mal choisis. Enfin, on peut regretter certaines opérations marquées par l’urgence et des changements logistiques trop nombreux.
Si l’on avait constaté des pathologies associées – par exemple des troubles broncho-pulmonaires aigus – comme en 1968-1969, aurions-nous connu, comme à cette époque, une pénurie de médicaments ? La question mérite d’être posée.
M. le rapporteur. Quand avez-vous débuté vos premières négociations avec l’Établissement de préparation et de réponse aux urgences sanitaires ?
M. Yves Kerouédan. Aux mois d’avril et mai.
M. le rapporteur. Aviez-vous eu des contacts avec cet établissement ou avec le ministère de la santé lors de la préparation du plan de lutte contre une pandémie grippale de type H5N1 ?
M. Emmanuel Déchin. Nous y avions travaillé très en amont avec la direction générale de la santé, puis avec la direction de la sécurité sociale, en concertation avec nos amis pharmaciens. Mais un désaccord apparut entre les pharmaciens et la direction de la sécurité sociale concernant le niveau de rémunération demandé, et ces discussions furent mises entre parenthèses. Quoi qu’il en soit, depuis le mois de mai 2008, nous n’avions pas, en tant que grossistes-répartiteurs, abordé la question avec les pouvoirs publics.
M. le rapporteur. Mais vous étiez prêts sur un plan technique ?
M. Emmanuel Déchin. Oui, parce que nous avions travaillé à partir de l’hypothèse d’une pandémie grippale de type H5N1.
M. le rapporteur. … qui a été transposée au virus A(H1N1).
M. Emmanuel Déchin. Nous savions en tout cas comment les opérations devaient se dérouler : les officines, que nous approvisionnerions, distribueraient les kits destinés aux patients ; des plates-formes régionales seraient mises en place par l’Établissement de préparation et de réponse aux urgences sanitaires et approvisionnées par un dépositaire ; nous serions, pour notre part, ravitaillés par un dépositaire.
M. le rapporteur. Combien de temps vous faut-il pour distribuer, à partir des centres, les produits dans l’ensemble de l’hexagone, dès l’instant où vous les réceptionnez ?
M. Yves Kerouédan. Vingt-quatre heures au maximum.
M. Emmanuel Déchin. Tout dépend des conditions dans lesquelles nous recevons le produit. Au début, on nous avait parlé d’un kit destiné aux patients. Nous devions le constituer nous-mêmes, à partir de boîtes de masques et de Tamiflu, avant de le livrer dans chaque officine. Il nous aurait alors fallu un peu plus d’une journée pour accomplir cette opération. Mais en cas de réception d’un produit déjà prêt, vingt-quatre heures auraient suffi pour le livrer dans les 22 600 officines.
M. Yves Kerouédan. Dans le cadre d’un fonctionnement normal, nous livrons une pharmacie dans un délai compris entre deux heures et deux heures et quart à compter de la passation de sa commande.
M. le rapporteur. Combien de temps faut-il aux industriels pour livrer les cent quatre-vingt centres ?
M. Yves Kerouédan. Généralement, nous sommes livrés sous trois ou quatre jours, via les dépositaires. En période difficile, ce délai peut dépasser la semaine.
M. le rapporteur. Qui sont les dépositaires ?
M. Yves Kerouédan. L’industrie pharmaceutique est chargée de la fabrication des produits. Les dépositaires assurent la logistique pour le compte des laboratoires. Les grossistes-répartiteurs livrent les pharmaciens d’officines.
Il existe quelques dépositaires importants, qui stockent et livrent pour le compte des laboratoires. En l’occurrence, les dépositaires assuraient la logistique via les plates-formes des grossistes répartiteurs.
M. le rapporteur. Ainsi, en trois jours, les produits étaient livrés dans les cent quatre-vingt centres. Puis, dans un délai compris entre vingt-quatre et quarante-huit heures, ils étaient livrés dans les 22 600 pharmacies.
M. Emmanuel Déchin. En l’espèce, les masques et le Tamiflu provenaient du stock de l’Établissement de préparation et de réponse aux urgences sanitaires, déposé dans cinq plates-formes régionales.
M. Yves Kerouédan. Les deux dépositaires qui ont livré les masques étaient Geodis et Aexxdis, et celui qui a livré le Tamiflu était Depolabo.
M. Gérard Bapt. Vous avez déclaré que vous aviez distribué 5 millions de doses de vaccins. Or, on parle de 6 millions de personnes vaccinées !
M. Emmanuel Déchin. À notre connaissance, 5 millions de doses ont été distribués (152). Nous pourrons vous donner de plus amples détails, dans la mesure où nous avons mis au point avec l’Établissement de préparation et de réponse aux urgences sanitaires un système de reporting quotidien.
M. Gérard Bapt. Peut-être ne prenez-vous pas en compte, dans vos calculs, les officines et les dernières livraisons qui y ont été effectuées ?
M. Yves Kerouédan. Si et, de toute façon, la quantité livrée aux officines a été très marginale.
M. Gérard Bapt. Je tiens malgré tout à appeler l’attention de mes collègues : si ce sont bien 5 millions de doses qui ont été distribuées, il y a donc eu des « pertes en ligne », que la ministre de la santé a d’ailleurs évaluées à 10 % – soit une dose perdue pour une boîte de dix.
M. Yves Kerouédan. C’est-à-dire 500 000 doses.
M. Gérard Bapt. Dans le centre de vaccination de ma circonscription, par exemple, le réfrigérateur est un jour tombé en panne. Par recoupement, on peut penser que le taux de vaccination a été en fait inférieur à celui espéré.
Que pensez-vous par ailleurs de la solution qui aurait consisté à distribuer des vaccins non seulement dans les centres, mais aussi dans les officines à destination des médecins généralistes ou des centres médicaux ?
M. Yves Kerouédan. Notre filière de soins – constituée des industriels, grossistes, pharmaciens et médecins – est remarquablement performante. Il eût sans doute été plus efficace de l’utiliser. La difficulté, en l’occurrence, résultait du conditionnement des vaccins en multidoses : un médecin ne dispose pas toujours d’un réfrigérateur adapté ni d’un volume de clientèle suffisant. Mais si l’on devait demain administrer un vaccin monodose, mieux vaudrait passer par cette filière composée des industriels, des grossistes, des pharmaciens et des médecins.
M. Guy Lefrand, président. Selon vous, si l’on avait fait appel aux médecins libéraux, cela aurait-il compliqué votre tâche et coûté plus cher ?
M. Yves Kerouédan. Si l’on avait suivi la chaîne traditionnelle, nous aurions approvisionné les pharmaciens, chez qui les médecins se seraient eux-mêmes approvisionnés. Mais, je le répète, c’est sans compter avec le conditionnement des vaccins en multidose.
M. Emmanuel Déchin. Notre métier consiste à livrer les officines. Il est donc inutile, dans un tel cas, de mettre en place des moyens dédiés.
M. Guy Lefrand, président. Si ce n’est entre la pharmacie d’officine et le cabinet du médecin.
M. Emmanuel Déchin. Tant que l’on nous demande de livrer l’officine, nous restons dans un schéma classique qui fonctionne très bien, avec des systèmes d’information extrêmement performants. En revanche, s’il nous fallait livrer des médecins généralistes, ce serait une tout autre affaire.
M. Yves Kerouédan. Rien n’empêche de se voir délivrer une prescription, d’aller chez le pharmacien, puis de se faire vacciner après, même si c’est un peu plus compliqué.
M. le président Jean-Christophe Lagarde. Vous dites que vous avez distribué 5 millions de doses de vaccins. Pouvez-vous nous communiquer un chiffre plus précis afin que nous sachions ce qu’il recouvre ? Dans le centre de vaccination de ma circonscription, toutes les doses de vaccins n’ont pas été utilisées. Cela signifie qu’un certain nombre d’entre elles a dû être récupéré par l’Établissement de préparation et de réponse aux urgences sanitaires en fin d’opération. Ce nombre de 5 millions de doses correspond-il à celui qui a été consommé ?
M. Emmanuel Déchin. Non, ce sont les doses que nous avons distribuées et livrées.
M. le président Jean-Christophe Lagarde. Comment peut-on avoir vacciné 6 millions de personnes, avec 5 millions de doses ?
M. Yves Kerouédan. Tout ce que je peux répondre, c’est que nous avons facturé 5 millions de doses.
M. le rapporteur. Y compris livraisons aux centres hospitaliers ?
M. Yves Kerouédan. Oui, y compris les quatre cent quarante centres hospitaliers et centres hospitaliers universitaires et les 22 300 pharmacies.
M. le président Jean-Christophe Lagarde. L’Établissement de préparation et de réponse aux urgences sanitaires a-t-il, à votre connaissance, utilisé un autre circuit de distribution ?
M. Emmanuel Déchin. Oui, concernant le personnel hospitalier en début de campagne de vaccination.
M. le président Jean-Christophe Lagarde. L’établissement a-t-il livré directement les hôpitaux ?
M. Emmanuel Déchin. La vaccination du personnel hospitalier n’est pas passée par nous.
M. le président Jean-Christophe Lagarde. On connaît le nombre de personnels hospitaliers qui se sont fait vacciner, mais cela n’atteint pas un million.
M. le rapporteur. Il faut peut-être prendre en compte les personnels des ambassades, les Français de l’étranger…
M. Gérard Bapt. 80 000 doses avaient été prévues à cet égard.
M. Yves Kerouédan. Ce sont tout de même 800 000 personnes qui travaillent dans les hôpitaux.
M. le président Jean-Christophe Lagarde. Oui, mais qui ne se sont pas toutes fait vacciner. Dans les hôpitaux, le taux de vaccination variait entre 60 % dans le meilleur des cas, et 20 %.
Nous auditionnerons les caisses primaires d’assurance maladie qui étaient chargées d’envoyer les bons et qui sont donc les seules institutions, à ma connaissance, détenant des éléments d’information concernant la traçabilité de la vaccination, personne par personne.
Reste que nous sommes en train d’essayer d’évaluer l’efficacité d’une campagne de vaccination sans être d’accord sur le nombre de personnes que l’on a vaccinées ! C’est un vrai problème.
M. Jean Mallot. Nous sommes en effet à la recherche de circuits de vaccination parallèles. L’écart entre le nombre de personnes vaccinées et celui des doses livrées est de plus d’un million. Et si l’on tient compte d’un pourcentage de pertes de 10 %, cet écart est d’1,5 million !
M. Yves Kerouédan. Nous ne pouvons que vous communiquer le nombre de doses que nous avons livrées, soit 5 millions.
M. Jean Mallot. C’est un problème, si personne ne peut identifier un autre circuit qui aurait permis d’écouler 1,5 million de doses.
M. Yves Kerouédan. Ce n’est pas parce que les caisses primaires d’assurance maladie ont envoyé des bons qu’il y a eu vaccination…
M. le rapporteur. Dans la chaîne des cent quatre-vingt répartiteurs, tout le monde était-il prêt à se mobiliser en cas de problème ? Avez-vous rencontré des difficultés ?
M. Yves Kerouédan. Au contraire. Dès le mois de mai 2009, nous avons instauré un système d’astreinte le week-end pour pouvoir faire face à toute urgence.
M. Gérard Bapt. Les kits distribués en officine comprenaient-ils des masques, avec le Tamiflu ?
M. Yves Kerouédan. Non, il n’y a pas eu de kits. La distribution a tout d’abord concerné les masques, puis le Tamiflu. Au début, des kits étaient prévus, mais ensuite, on y a renoncé.
M. Emmanuel Déchin. Il était craint que les laboratoires Roche ne soient pas en mesure de répondre aux besoins du marché. En fait, on s’est rendu compte, au début du mois de juillet et jusqu’au mois de décembre, que Roche arrivait à suivre la demande.
M. Gérard Bapt. Des doses de Tamiflu ont donc été livrées aux pharmacies. Il semble que très peu d’entre elles aient été retirées. Que sont-elles devenues ? Les avez-vous retournées à l’Établissement de préparation et de réponse aux urgences sanitaires ?
M. Emmanuel Déchin. Non.
M. Gérard Bapt. Sont-elles donc toujours chez les pharmaciens ?
M. Emmanuel Déchin. Nous n’avons repris aucune dose de Tamiflu depuis que nous les avons livrées.
M. le président Jean-Christophe Lagarde. Vous avez expliqué que vous perdriez du temps à regrouper les produits s’ils ne vous étaient pas livrés en kit.
M. Emmanuel Déchin. Nous ne « perdrions » pas de temps. Cela en demanderait simplement un peu plus.
M. le président Jean-Christophe Lagarde. N’importe quel citoyen français est capable de se rendre dans sa pharmacie pour retirer masques, gants et Tamiflu. Les regrouper dans vos centres et perdre ainsi vingt-quatre ou quarante-huit heures ne me paraît pas présenter d’intérêt.
M. le rapporteur. Les kits ont été imaginés dans le cadre du plan de lutte contre la pandémie grippale H5N1, en cas de confinement à domicile. Des personnes réquisitionnées, qui auraient cependant pu exercer un droit de retrait, auraient livré ces kits à chaque famille. Un système équivalent existe dans les plans canadien, chinois ou britannique.
M. le président Jean-Christophe Lagarde. Nous parlions tout à l’heure avec votre prédécesseur de « marges de manœuvre ». En fonction de la virulence du virus, il doit être possible de moduler les mesures.
M. Guy Lefrand, président. Avez-vous repris les doses de vaccin non utilisées ?
M. Emmanuel Déchin. Nous avons récupéré dans les centres de vaccination, à la demande de l’Établissement de préparation et de réponse aux urgences sanitaires, les doses qui n’avaient pas été utilisées. Un tri devait être effectué selon que la chaîne du froid avait été ou non respectée.
M. Jean Mallot. Avez-vous une idée précise de la quantité de doses que vous avez ainsi récupérée ?
M. Emmanuel Déchin. Une partie de ces doses a été détruite et l’autre est revenue à l’Établissement de préparation et de réponse aux urgences sanitaires.
M. le président Jean-Christophe Lagarde. Vous n’avez livré que 5 millions de doses. Pouvez-vous nous faire parvenir le nombre de doses que vous avez récupérées ? S’il faut encore soustraire à ces 5 millions celles qui n’ont pas été utilisées…
M. Gérard Bapt. Qui prenait la décision de détruire les vaccins ?
M. Yves Keroudéan. L’Établissement de préparation et de réponse aux urgences sanitaires.
M. Emmanuel Déchin. Quand les centres avaient trié les doses, l’établissement se chargeait d’y récupérer les produits thermosensibles qui n’avaient pas été conservés au froid. Nous récupérions dans les centres ceux qui avaient été conservés au froid, parce que nous disposons de caisses isothermiques.
M. Gérard Bapt. Je suis étonné. Si je me souviens bien, c’est le centre de vaccination de ma circonscription qui avait rapatrié les produits non utilisés à la direction régionale des affaires sanitaires et sociales.
M. Guy Lefrand, président. Avez-vous été rémunérés pour cette opération de récupération ?
M. Emmanuel Déchin. Nous avons facturé cette prestation 100 000 euros.
Nous communiquerons à votre commission les quantités précises que nous avons récupérées.
M. le président Jean-Christophe Lagarde. Nous aimerions en effet avoir par écrit les quantités précises de doses de vaccin qui ont été livrées, récupérées et, éventuellement, détruites, si vous en avez connaissance. Nous pourrions aussi nous adresser à l’Établissement de préparation et de réponse aux urgences sanitaires, pour connaître la proportion des pertes.
M. Guy Lefrand, président. Que nous proposeriez-vous pour améliorer le système, pour la prochaine fois ?
M. Yves Kerouédan. En cas de survenance d’une épidémie telle que celle-ci, le mieux est de passer par le circuit classique : industriels, grossistes, pharmaciens et médecins. En cas de réelle pandémie, des difficultés sont à prévoir : désorganisation importante et dégradation des services proposés, quelles que soient les mesures de sécurité prises en amont. Le meilleur système consisterait à se fier au système de santé français tel qu’il existe.
M. le président Jean-Christophe Lagarde. En cas de réelle pandémie, pensez-vous que le système traditionnel pourrait « cohabiter » avec un système de crise passant par des centres hiérarchisés et quelque peu « militarisés » ? Cela vous poserait-il des problèmes ?
M. Yves Kerouédan. Non, mais une telle organisation ne serait pas la plus efficace. Le meilleur système est celui qui existe et qui fonctionne bien.
M. Emmanuel Déchin. Le système actuel fonctionne, en outre, sur la base de systèmes d’information qui font moins appel aux ressources humaines que ne le suppose la livraison de 1 100 centres dans toute la France. Quand on passe par l’officine, il suffit que le pharmacien effectue sa commande sur sa console ; elle nous arrive directement, nous la préparons et nous l’envoyons. Avec des centres, le processus est beaucoup plus artisanal. Cela explique peut-être les écarts de nombres que vous avez constatés. Dans l’urgence, il n’y a pas eu de décompte à l’unité près. Par rapport à nos procédures habituelles, nous sommes revenus quelques années en arrière avec des commandes par fax ou par papier.
M. le président Jean-Christophe Lagarde. Dites-vous qu’il serait possible que vous ayez livré six millions de doses et n’en ayez facturé que cinq millions ?
M. Emmanuel Déchin. J’ai parlé de l’unité près et vous me parlez d’un million ! C’est un peu différent. En revanche, ce que j’ai voulu dire, c’est que nous n’avons peut-être pas livré exactement cinq millions de doses, mais un peu plus.
M. Guy Lefrand, président. Je vous remercie.
La séance est levée à dix-neuf heures cinquante-cinq.
Audition de M. Thierry Gentilhomme,
chef du département des urgences sanitaires de la direction générale de la santé
au ministère de la santé et des sports
(Procès-verbal de la séance du mercredi 5 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance débute à dix-neuf heures cinquante-cinq.
(M. Thierry Gentilhomme prête serment.)
M. le président Jean-Christophe Lagarde. Monsieur le directeur, nous souhaitons examiner avec vous les questions de la mise en place de la campagne de vaccination, des principes qui l’ont orientée et de l’application du principe de précaution.
M. Thierry Gentilhomme, chef du département des urgences sanitaires de la direction générale de la santé au ministère de la santé et des sports. Administrateur civil – je ne suis pas en effet médecin – j’ai été nommé sous-directeur de ce qui était alors le département des situations d’urgence sanitaire, le DéSUS, à la direction générale de la santé en février 2008. Ce département a vocation à gérer les situations d’urgence et, globalement, à assurer la mise en place des moyens permettant de répondre aux menaces sanitaires graves.
M. le président Jean-Christophe Lagarde. Au niveau national ou également local ?
M. Thierry Gentilhomme. Au sein du département des urgences sanitaires, le centre opérationnel de réception et de régulation des urgences sanitaires et sociales, le CORRUSS, est chargé de recevoir toutes les alertes sanitaires qui nous sont rapportées depuis le niveau local par les agences régionales de santé – hier par les directions départementales des affaires sanitaires et sociales et les établissements de santé. Depuis mon arrivée, mon département a ainsi été mobilisé à la suite notamment d’alertes à la rage, à la méningite, au méningocoque B – en Seine-Maritime et dans la Somme –, et, sur le plan alimentaire, à la présence de datura dans des boîtes de haricots – nos domaines d’intervention sont très variés... Nous intervenons donc en appui des services déconcentrés. Nous disposons à cet effet d’une unité pour planifier les procédures et les outils permettant de répondre aux menaces de manière organisée. De même, une unité logistique réalisait, avant la création de l’établissement de préparation et de réponse aux urgences sanitaires, les acquisitions et gérait les stocks, création qui a donc changé notre organisation.
Le département des urgences sanitaires a été créé par l’arrêté du 11 mai 2007. Mon premier chantier a été de donner au CORRUSS une vocation opérationnelle car ce dernier avait davantage été bâti sur le modèle d’un service d’aide médicale d’urgence (SAMU) que sur celui d’un centre de crise potentielle. J’ai donc recruté les profils adaptés.
Mon deuxième chantier a été d’accompagner la montée en puissance de l’Établissement de préparation et de réponse aux urgences médicales – qui connaissait quelques difficultés – et de l’aider à devenir pleinement opérationnel. Ainsi, la délivrance du statut d’établissement pharmaceutique à l’ÉPRUS est intervenue le 27 mars 2009.
Nous avons donc abordé la crise le 24 avril avec une capacité opérationnelle relativement nouvelle. Nous avions cependant pu constater, lors d’un exercice intitulé Pandémie 09, que tout fonctionnait bien, ce qui nous a permis d’avoir dès le départ une bonne capacité de réaction. Totalement mobilisées, enterrées trois semaines dans les sous-sols du ministère de la santé, mes équipes ont géré le début de l’alerte, en établissant les conduites à tenir autour des premiers cas et en préparant les premières mesures, notamment de contrôle aux frontières.
Dans une deuxième phase d’appui, il nous a fallu faire face à la gestion, que nous avions peut-être sous-estimée, des cas groupés : écoles, colonies, paquebots, etc. Le département a donc continué à jouer son rôle d’appui – quelles mesures, par exemple, doit prendre tel ou tel préfet qui nous appelle, etc. – pendant la gestion de la crise tout l’été.
Parallèlement, nous avons finalisé, le 16 juin, un circuit de distribution pour les masques et les antiviraux, pour permettre le passage au secteur ambulatoire le 23 juillet.
Dans le même temps, il nous a fallu, début mai, nous préoccuper de l’organisation de la vaccination en prenant en compte, au fur et à mesure que l’on nous les notifiait, les différentes contraintes.
M. le président Jean-Christophe Lagarde. De quelle nature étaient ces contraintes et par qui ont-elles été fixées ?
M. Thierry Gentilhomme. La première contrainte a été le conditionnement, car nous n’étions pas assurés de disposer de vaccins en monodose.
D’autres contraintes ont découlé des négociations avec les laboratoires, de problèmes spécifiques liés aux vaccins – respect de la chaîne du froid – et de la nécessité d’éviter la sortie des vaccins du circuit pharmaceutique. Nous voulions jouer la carte de la sécurité sanitaire : d’où l’organisation que nous avons mise en place avec les répartiteurs.
M. Jean-Pierre Door, rapporteur. Combien de personnes travaillent dans votre service ? Quels sont vos liens avec l’Institut de veille sanitaire, Matignon, le ministère de l’intérieur ?
M. Thierry Gentilhomme. Mon plafond d’emplois est de 35, mais nous tournons à 32 : entre quinze et vingt conseillers techniques – médecins, pharmaciens, ingénieurs –, le reste étant du personnel administratif.
Au quotidien, nous sommes en relation permanente avec l’Institut de veille sanitaire, qui évalue la plupart des alertes.
M. le rapporteur. Les alertes de l’Organisation mondiale de la santé passent-elles par l’Institut de veille sanitaire avant d’arriver au département des urgences sanitaires ?
M. Thierry Gentilhomme. Non, une fonction importante du centre opérationnel de réception et de régulation des urgences sanitaires et sociales (CORRUSS) est d’être le point focal français pour les instances européennes et l’Organisation mondiale de la santé. Ainsi, le signal du 24 avril est arrivé au CORRUSS sous la forme d’une alerte.
Je ne suis pas en liaison avec Matignon, mais avec le Centre opérationnel de gestion interministériel des crises (COGIC) et la direction de la planification de sécurité nationale (DPSN) du ministère de l’intérieur.
M. le président Jean-Christophe Lagarde. Quelle est l’articulation entre votre service et le ministère de l’intérieur ?
M. Thierry Gentilhomme. La cellule interministérielle de crise (CIC) a été présidée par le ministre de l’intérieur, le plus souvent par son directeur de cabinet, et, la crise étant sanitaire, coprésidée par le directeur de cabinet de la ministre de la santé.
M. le président Jean-Christophe Lagarde. Avez-vous eu un contact particulier au ministère de l’intérieur avec un homologue ?
M. Thierry Gentilhomme. J’ai travaillé au quotidien avec mes collègues de la DPSN et de la direction de la sécurité civile du ministère de l’intérieur.
M. le rapporteur. Étiez-vous géographiquement séparés ?
M. Thierry Gentilhomme. La collégialité règne au sein de la cellule interministérielle de crise. Et toutes les semaines, j’ai participé à une conférence téléphonique organisée par la direction de la planification de sécurité nationale avec les préfets délégués. L’interaction était permanente. Issu du ministère de l’intérieur, les choses en étaient d’autant plus facilitées.
M. le rapporteur. Une organisation centralisée, dans un lieu unique, ne serait-elle pas préférable ?
M. Thierry Gentilhomme. Nous en avons ressenti le besoin dès le départ, ayant eu à gérer seuls la crise du 24 avril au 1er mai. Dès le 24, j’ai demandé à disposer d’un officier de liaison de la sécurité civile ; autrement dit, nous nous étions mis en réseau avec le ministère de l’intérieur, sachant que nous passerions la main à un moment donné. Un commandant de pompier a ainsi été nommé pour faire la liaison avec la sécurité civile.
M. le président Jean-Christophe Lagarde. Dans toutes les administrations d’État, des procédures d’échanges sont prévues. Il semble que cela n’ait pas été le cas pour cette crise, pourtant prévisible. Vous êtes issu du ministère de l’intérieur : les choses ont donc bien fonctionné… Mais avec une autre personne que vous, les choses auraient-elles fonctionné de la même manière ?
M. Thierry Gentilhomme. Nous connaissions notre correspondant, la DPSN. En outre, les procédures figuraient dans le plan pandémie : une réunion interministérielle et une réunion de la cellule interministérielle de crise (CIC). Au début, des « pré-CIC » préparaient la réunion de la CIC, avant celle de la réunion interministérielle du soir. La contrainte était très forte en termes d’organisation.
Finalement, les choses se sont déroulées de manière plus souple, et c’est heureux car les réunions prennent beaucoup de temps et ne doivent pas prendre le pas sur l’action.
M. Gérard Bapt. Vous avez « passé la main », avez-vous dit, au ministère de l’intérieur. Où s’est alors situé le centre de décision ?
M. le rapporteur. Auprès du délégué interministériel ?
M. Thierry Gentilhomme. Le délégué interministériel à la lutte contre la grippe aviaire n’a pas joué de rôle dans la gestion opérationnelle.
Quand je parle de « passer la main » à la suite de la décision du Premier ministre le 1er mai 2009, cela signifie aussi qu’il y a eu une phase d’apprentissage au cours de laquelle il a fallu expliquer, être en appui : ce n’est pas parce que le ministère de l’intérieur s’est mis à piloter la crise qu’il a acquis toutes les compétences en matière sanitaire. En termes de gestion, il n’y a pas eu l’épaisseur d’une feuille de cigarette entre nous, tant nous avons été en contact.
S’il a été pénalisant au début d’être séparés géographiquement, rester ensemble tout au long d’une crise qui dure un an n’est guère possible. En outre, au début, la cinétique de la crise n’a pas été celle d’un plan rouge, mais plutôt, pour prendre une image, d’un simple accident de bus.
M. le président Jean-Christophe Lagarde. Votre service a-t-il participé aux discussions portant sur la nécessité de lancer une campagne générale de vaccination – obligatoire ou non – puisque vous êtes chargé de concevoir la mise en œuvre de cette dernière ?
M. Thierry Gentilhomme. Non. Quand le sujet de la vaccination a émergé, nous étions en plein dans l’opérationnel : nous gérions des cas groupés, avec une équipe qui avait déjà derrière elle un mois de crise. Les équipes de la délégation interministérielle à la lutte contre la grippe aviaire ont en revanche joué un rôle car c’est par celle-ci que l’Organisation mondiale de la santé passait.
M. le président Jean-Christophe Lagarde. Autrement dit, vous n’avez pas été consulté lors du lancement de la campagne alors que vous êtes en charge de la logistique avec l’établissement de préparation et de réponse aux urgences sanitaires ?
M. Thierry Gentilhomme. Non. Le nombre de vaccins et la couverture de la population sont simplement pour moi des données à intégrer.
M. le président Jean-Christophe Lagarde. La faisabilité serait aussi une donnée ?
M. Thierry Gentilhomme. Elle doit plutôt, en effet, être définie après.
M. le rapporteur. Comme l’ont souligné les rapports sur le virus H5N1, il conviendrait de réfléchir à un lieu de décision unique car les risques sont non seulement viraux, mais également liés au climat, au bioterrorisme, etc.
Aux États-Unis et au Royaume-Uni, des centres de décision regroupant, sous l’autorité du chef du gouvernement, les ministères de l’intérieur, de la santé et de la défense nationale, se réunissent tous les matins dans un lieu unique. Un tel centre opérationnel en France ne faciliterait-il pas les choses ?
M. Thierry Gentilhomme. Le fait d’avoir un lieu unique est forcément une valeur ajoutée. Nous avons peiné au départ, car nous avons dû, tout en nous retrouvant seuls, donner dans le même temps des instructions aux préfets en matière par exemple de contrôle aux frontières, voire de marcher sur les plates-bandes du ministère des transports. Si le ministre de la santé a le pouvoir de donner des instructions aux préfets, l’interministériel est un métier : celui du ministère de l’intérieur.
La collégialité – le lieu unique – doit exister dès le départ, mais il ne faudrait pas que l’on assiste ensuite à une gestion de crise qui s’enferme. Comme chez les militaires, on refait le plan en même temps que l’on avance : on a besoin d’une différenciation entre, d’une part, le lieu où s’opère l’échange d’informations – la cellule de situation – et, d’autre part, les cellules d’aide à la décision qui doivent agir sur leur cœur de métier.
M. le président Jean-Christophe Lagarde. Ce lieu de rencontre existe, de fait, au ministère de l’intérieur.
M. Thierry Gentilhomme. Avec la chaîne préfectorale.
M. le président Jean-Christophe Lagarde. Pourquoi vous êtes-vous sentis seuls pendant la semaine du 24 avril au 1er mai ? Est-ce simplement le laps de temps pendant lequel on ne savait pas ce qui se passait ?
M. Thierry Gentilhomme. On peut dire cela.
M. le président Jean-Christophe Lagarde. Comment s’est imposé le principe de la mise en place de centres de vaccination ? Quelle a été la contrainte qui a été déterminante pour ne pas associer les médecins libéraux dès le départ ?
M. Thierry Gentilhomme. Il s’est agi moins d’une décision que du résultat d’un processus. À force d’accumuler les contraintes, il est apparu que la seule voie possible était celle d’une vaccination collective dans des centres dédiés. La contrainte déterminante, ce fut le conditionnement.
M. le président Jean-Christophe Lagarde. L’argument du conditionnement n’est pas convaincant – comme ne l’ont pas été ceux, entendus également ici, sur l’absence de réfrigérateur dans nombre de cabinets de médecins généralistes, sur leur impossibilité à regrouper leurs patients par dix,…
M. Thierry Gentilhomme. Le flux de livraison des vaccins a d’abord concerné le Pandemrix, avec des boîtes de 500 doses. Pour démarrer la vaccination dans les 1 000 centres, 5 millions de doses environ étaient nécessaires.
Le conditionnement est le gage de la traçabilité. Pour faire le parallèle avec la chaîne pharmaceutique des 22 600 officines, le pharmacien aurait dû dépaqueter la boîte de 500 doses et le besoin aurait été de 11 millions de doses. Autrement dit, plus vous augmentez la capillarité du système, plus il faut de doses.
Nous avons eu les 5 millions de doses vers le 12 novembre – en semaine 46. Or, l’idée n’était pas de lancer la vaccination coûte que coûte dès la livraison de la première dose de vaccin, mais d’assurer un approvisionnement régulier pour éviter une rupture de stock.
M. le président Jean-Christophe Lagarde. Pourquoi n’a-t-on pas permis aux médecins volontaires de faire partie du système, en leur proposant d’aller chercher les vaccins dans les centres, au lieu de procéder à des réquisitions ?
M. Thierry Gentilhomme. Début 2010, nous avons demandé aux médecins d’aller chercher des vaccins dans les centres.
M. le président Jean-Christophe Lagarde. Cela aurait donc pu être fait beaucoup plus tôt.
M. Thierry Gentilhomme. Le conditionnement en multidoses et en boîtes de 500 doses, sans compter l’exigence de traçabilité – numéros de lot, stickers – et d’une notice par patient ont compliqué les choses et engendré une perte de temps.
Par ailleurs, le plan Pandémie nous invitait à préserver l’offre de soins.
M. le président Jean-Christophe Lagarde. Retirer 3 000 médecins du circuit ne préserve pas l’offre de soins.
M. Thierry Gentilhomme. C’est pourquoi nous avons agi pour mobiliser au maximum les internes. La réquisition des médecins libéraux ne faisait pas partie du schéma.
M. le président Jean-Christophe Lagarde. Comment y est-on arrivé ?
M. Thierry Gentilhomme. La réquisition se fait au niveau local et d’un département à l’autre, les situations ont été très différentes – je parlerais d’ailleurs plutôt pour ma part de mobilisation, car il ne s’agissait pas d’envoyer les gendarmes.
M. le président Jean-Christophe Lagarde. C’est pourtant ce qui est arrivé ! En outre, la réquisition était nécessaire, ne serait-ce que pour les problèmes de responsabilité.
M. Thierry Gentilhomme. Nous sommes d’accord : il s’agissait d’un cadre juridique. Mais, je le répète, les situations ont été très disparates d’un département à l’autre.
M. le président Jean-Christophe Lagarde. Un tel manque de coordination, lié à un pur dysfonctionnement de l’État, est un vrai sujet d’interrogation pour le ministère de l’intérieur.
M. Gérard Bapt. L’exclusion des médecins est un problème très important, y compris en termes de communication et de réussite de la vaccination. Or, l’argument de la traçabilité a été ressenti comme une injure par les médecins, car ils assurent déjà la traçabilité de la vaccination saisonnière. C’est pour eux les mépriser que de considérer qu’ils sont incapables d’assurer la traçabilité.
En outre, l’argument de l’exigence de protection de l’offre de soins ne tient pas, car les médecins ont eu malgré tout beaucoup de travail en plus, ne serait-ce qu’en devant répondre aux appels de leurs patients leur demandant conseil.
Quant à la présentation en multidoses, si 5 millions de doses ont permis de commencer la vaccination en semaine 46, avez-vous dit, 500 000 doses en seringues unitaires ont été livrées dans les semaines 49 et 50 à l’établissement de préparation et de réponse aux urgences sanitaires...
M. Thierry Gentilhomme. Je n’ai pas dit que les médecins n’étaient pas capables d’assurer la traçabilité. Mais, d’une part, nous avons rencontré des difficultés avec les boîtes de 500, car les laboratoires refusaient de nous fournir des stickers ; nous avons alors dû imaginer des codes barres pour le suivi des lots. D’autre part, deux injections étant prévues à l’époque, il fallait assurer la traçabilité du produit utilisé pour la première injection, d’où la fonction attribuée aux bons.
Certes, 500 000 doses ont été livrées à l’établissement de préparation et de réponse aux urgences sanitaires, mais une boîte de dix seringues par médecin n’alimente pas tout le circuit.
M. Gérard Bapt. Écartée, la médecine générale s’est sentie méprisée.
La stratégie mise en œuvre, sans réactivité, du 14 mai jusqu’au 4 janvier 2010, dans votre bunker, me fait penser au Titanic !
En commission, j’ai interrogé la ministre à plusieurs reprises. Selon M. Didier Houssin, directeur général de la santé, s’exprimant dans le cadre de l’Office parlementaire d’évaluation des choix scientifiques et technologiques sur la grippe, des propositions ont été faites aux médecins, mais ils n’y ont pas répondu. Or, les syndicalistes n’ont pas entendu parler de ces propositions ! Il y a eu une véritable incompréhension.
M. Thierry Gentilhomme. Je retiens l’image du Titanic, mais pour une autre raison : il n’est pas facile de changer de cap une fois la machine lancée...
Nous avions en tête plusieurs facteurs : le pic épidémique annoncé, le schéma britannique avec beaucoup de malades, les fortes tensions dans les hôpitaux en janvier, le plan Pandémie prévoyant la protection de l’offre de soins.
Si nous avions pu anticiper la situation – à savoir le nombre de malades et de personnes vaccinées –, nous aurions fait autrement.
M. le président Jean-Christophe Lagarde. Les choses ont-elles fonctionné de manière satisfaisante selon vous ?
M. Thierry Gentilhomme. Le travail réalisé par les services et l’engagement humain ont été très importants. Nous avons été au rendez-vous. Je ne peux pas dire que je ne suis pas satisfait.
Néanmoins, nous avons appris des choses et devons en tirer les enseignements.
M. le président Jean-Christophe Lagarde. Quelles modifications doivent être apportées au plan pandémie grippale, au plan de vaccination ? La vaccination de seulement 5 à 6 millions de personnes est un demi-échec. Comment mieux se préparer ?
M. Thierry Gentilhomme. La mobilisation de l’État a été succès.
M. le président Jean-Christophe Lagarde. Un tel investissement sans atteindre le résultat souhaité vous fait sans doute réfléchir.
M. Thierry Gentilhomme. Pour ma part, je réfléchis en termes de gestion.
La réponse sanitaire en France est organisée autour des établissements de santé de référence au niveau des zones de défense, et des stocks dans les hôpitaux. Avant la crise, nous avions demandé à l’établissement de préparation et de réponse aux urgences sanitaires de travailler sur un schéma directeur de stockage. Nous avons eu à mettre en œuvre une logistique : cela a bien fonctionné, et il nous faut maintenant en tirer toutes les conséquences.
Une orientation s’impose : le renforcement de la zone de défense.
En outre, il est nécessaire de donner un statut aux stocks, en distinguant le stock stratégique détenu par l’Établissement public de réponse aux urgences sanitaires et qui peut éventuellement faire l’objet de programmes de contrôle de stabilité, et les stocks tactiques dans les hôpitaux, comme la mallette d’antidotes dans l’ambulance du service mobile d’urgence et de réanimation, le SMUR, ou chez les pompiers, et qui sont la réponse immédiate à l’urgence.
Le chantier est énorme : il faut rénover profondément la réponse.
Pour utiliser les répartiteurs, diffuser le Tamiflu sur le territoire et organiser la vaccination, nous avons utilisé la même chaîne. Nous devons consolider cet acquis pour restructurer l’ensemble.
Nous avons également un autre chantier, la variole versus grippe, pour laquelle le plan prévoit des unités de vaccinations, des engagements très forts comme la vaccination de la population en quatorze jours. Grâce à notre acquis en termes d’organisation, nous pourrons moderniser le schéma.
M. le président Jean-Christophe Lagarde. Nous nous sommes préparés au naufrage du Titanic, mais avons connu une petite voie d’eau ! Dans le cas d’une grippe, on doit être capable de décélérer beaucoup plus vite, faute de quoi plus personne ne croira l’État le jour où un réel problème surviendra. La direction générale de la santé réfléchit-elle aux moyens permettant de s’adapter à des situations moins graves que prévues ?
La variole versus grippe correspond à une situation plus grave nécessitant une vaccination plus lourde.
M. Thierry Gentilhomme. Cette crise m’a appris beaucoup de choses, en particulier sur mon département dont je dois reconsidérer l’organisation et la logique même de préparation et de planification. Le plan Pandémie doit évoluer dans le sens que vous évoquez : face à un risque qui n’est pas maximal, il faut être pragmatique.
Quant au plan variole, je sais que l’on me demandera à la rentrée d’y avoir réfléchi.
M. le président Jean-Christophe Lagarde. La vaccination reprendra à partir de la rentrée, mais ne vous concernera plus car ce ne sera plus de l’urgence sanitaire.
M. Thierry Gentilhomme. Effectivement.
M. le rapporteur. Après l’ouragan Katrina et la variole, les États-Unis ont créé une structure d’urgence et de réponse sanitaire. C’est ce que vous avez fait depuis quelques mois, et vous avez raison de plaider pour une meilleure organisation, car nous ne sommes pas à l’abri de risques majeurs de toute nature.
Je prône une organisation autour des préfets des sept zones de défense, car ils pourront réagir plus rapidement que quatre-vingts préfets et vingt-deux agences régionales de santé. Il faudra un responsable décentralisé de votre service dans chaque zone de défense.
M. Thierry Gentilhomme. Effectivement, notre système est trop centralisé : la réponse est la territorialisation. Il faut une réponse de proximité, avec une harmonisation pour éviter les disparités sur le territoire.
Nous avons échangé 30 000 courriels avec les services déconcentrés. La mobilisation a été exemplaire.
Nous devons travailler différemment avec les agences régionales de santé, qui sont des établissements publics, qu’avec les directions départementales des affaires sanitaires et sociales. Le 12 mai prochain, je réunirai tous les responsables de veille sanitaire en vue de les mettre en réseau : nous allons les accompagner progressivement en termes de gestion de crise. Si les acteurs sont performants, les préfets seront bien conseillés.
Ensuite, il faudra une organisation territoriale de la réponse dont la zone de défense est l’alpha et l’oméga, et articuler l’ÉPRUS avec les zones de défense, car cet établissement public gère des stocks d’État, eux-mêmes mis en œuvre par d’autres établissements publics, les agences régionales de santé.
À l’avenir, le chantier d’actualisation prioritaire est la variole.
Il faut apporter aux agences régionales de santé – acteurs majeurs car autonomes – non pas des instructions, mais des outils : c’est le sens de la restructuration que j’ai commencé à entreprendre. Nous devons mettre en place le règlement sanitaire international, assurer des mises en réseau de responsables. Nous avons imaginé dans les agences régionales de santé des plateformes de réponse aux urgences sanitaires pour les mettre en réseau autour du centre opérationnel de réception et de régulation des urgences sanitaires.
Voilà comment nous espérons pouvoir avancer.
M. le président Jean-Christophe Lagarde. Merci beaucoup, monsieur Thierry Gentilhomme.
La séance est levée à vingt heures cinquante.
Audition de M. Francis Delon,
secrétaire général de la défense et de la sécurité nationale
et de M. Yann Jounot,
directeur de la planification de sécurité nationale au ministère de l’intérieur,
de l’outre-mer et des collectivités territoriales
(Procès-verbal de la séance du mardi 11 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt-cinq.
(M. Francis Delon et M. Yann Jounot prêtent successivement serment.)
M. Francis Delon, secrétaire général de la défense et de la sécurité nationale. Le secrétariat général de la défense nationale, devenu aujourd’hui le secrétariat général de la défense et de la sécurité nationale et que je désignerai comme tel, a été fortement impliqué dans la préparation de la lutte contre la pandémie grippale.
En février 2004, le Premier ministre a demandé que l’on prépare un plan gouvernemental de prévention et de lutte contre une pandémie grippale. Sur proposition du ministre de la santé et du ministre de l’intérieur, cette préparation a été confiée au secrétariat général en raison de son rôle de coordination interministérielle de l’action du Gouvernement.
Les problématiques abordées dépassaient le seul domaine sanitaire et renvoyaient à des sujets très variés, qui touchaient au fonctionnement de diverses activités d’importance vitale, au droit du travail, à l’ordre public ou encore à la communication. C’est en raison de ses compétences de planification de la réponse interministérielle à des situations éminemment perturbées que le secrétariat général a été sollicité. L’une de ses missions consiste en effet à analyser les risques et les menaces, élaborer des politiques de prévention et de protection et préparer l’État, au niveau central, à la gestion de crises sur le territoire national ou hors des frontières.
Nous n’avons évidemment pas travaillé seuls : nous avons eu pour rôle de faciliter la synthèse des contributions fournies par les ministères et de veiller à la cohérence des mesures proposées par rapport à une stratégie générale définie en commun. Nous avons beaucoup été aidés, à partir du mois d’août 2005, par le délégué interministériel à la lutte contre la grippe aviaire, M. Didier Houssin, qui a traité de nouvelles thématiques indispensables à la construction du plan et s’est occupé de plusieurs aspects, notamment du recueil des fiches techniques. Nous n’avons pas du tout cherché à calquer le plan de lutte contre la pandémie grippale sur le modèle des plans de défense et de sécurité, tels que les plans de lutte contre le terrorisme, car chaque thème a ses particularités.
La première édition du plan de lutte contre la pandémie grippale date d’octobre 2004. Elle a été révisée à quatre reprises, la dernière édition en date ayant été approuvée au mois de février 2009. Ce plan a donc évolué, notamment au fil d’exercices qui ont été menés à plusieurs reprises et ont permis de tester ses différentes versions.
Il présente surtout la stratégie nationale de préparation et de réponse et fixe des objectifs communs à l’ensemble des parties appelées à intervenir, parties publiques comme opérateurs privés. Il est avant tout une « boîte à outils » d’environ trois cents mesures, parmi lesquelles les décideurs peuvent choisir celles qui correspondent le mieux à un contexte donné. Contrairement à ce que l’on entend parfois, il ne s’agit pas d’une mécanique implacable mais d’un instrument très flexible.
Ce plan est novateur à plus d’un titre. D’abord, dans une finalité de transparence de l’action publique, il n’a pas été classifié mais rendu accessible à tous sur le site internet « pandemie-grippale.gouv.fr ». Ensuite, ce fut l’un des deux premiers plans, avec celui du Canada, à donner une grande place à la dimension éthique dans la stratégie générale de préparation et de réponse à la crise.
À partir de 2005, il a fait l’objet de quatre exercices, soit quasiment un par an. Des ministres, comme Xavier Bertrand et Roselyne Bachelot-Narquin, et des parlementaires y ont participé. Des situations un peu différentes ont été simulées pour tester les différents aspects de ce que pourrait être une stratégie de lutte contre la pandémie grippale.
En accompagnement du plan, le secrétariat général a défini la méthode d’élaboration de plans de continuité d’activité des administrations et des entreprises. Si l’épisode de grippe de 2009 n’a pas été accompagné de fortes perturbations, le travail qui a été effectué dans presque toutes les administrations de l’État et dans un grand nombre de collectivités et d’entreprises vaudra pour l’avenir, non seulement en cas d’épidémie, mais aussi de perturbations majeures provoquées par d’autres événements.
J’en viens à notre action spécifique en 2009.
En situation de crise, le principal rôle du secrétariat général consiste à assister les plus hautes autorités de l’État en deux domaines. Le premier est celui de l’organisation gouvernementale et interministérielle de gestion de la crise. Dans le cas qui nous occupe, l’organisation a été calquée sur celle du plan : nous en avons fait la pédagogie et explicité le mode d’emploi. La pièce centrale du dispositif de gestion de crise a été la cellule interministérielle de crise, chargée de la conduite opérationnelle de l’action gouvernementale. Nous étions représentés à chacune de ses réunions, y apportant une expertise proprement interministérielle lors de l’examen de l’ensemble des textes réglementaires et des circulaires qui ont été élaborés dans ce cadre.
Le second domaine d’intervention du secrétariat général est celui de l’anticipation des risques qui peuvent affecter la sécurité nationale et des réponses à leur apporter. Fort heureusement, en 2009, nous n’avons atteint un tel seuil ni sur le territoire national ni à l’extérieur de nos frontières. Nous nous sommes néanmoins préoccupés de quelques thèmes d’anticipation. Le premier était celui d’un débordement de la crise au-delà de ses aspects sanitaires, qui aurait pu conduire à la désorganisation d’activités essentielles. Nous avons par exemple contribué à l’évaluation de quelques plans de continuité d’activité, suivi la situation de quelques grands opérateurs, pour apprécier les risques de rupture de leur activité et évalué le nombre de personnes qu’il était opportun de vacciner pour assurer la continuité des activités économiques, sociales et administratives vitales pour la Nation. Le Gouvernement n’a donné finalement la priorité qu’au personnel médical mais cette évaluation était néanmoins nécessaire pour éclairer la décision politique.
Un autre thème d’anticipation a concerné la situation à l’étranger et les dispositions que prenaient les autorités dans quelques pays clés, notamment les États-Unis ou le Royaume-Uni : nous avons procédé à plusieurs niveaux à des échanges avec nos partenaires dans ces deux pays, en particulier sur la mise en œuvre des plans de lutte contre la pandémie et sur leur adaptation à la situation rencontrée.
M. Yann Jounot, directeur de la planification de sécurité nationale au ministère de l’intérieur, de l’outre-mer et des collectivités territoriale. Outre que je représente la direction qui a assuré le support et le fonctionnement de la cellule interministérielle de crise, je suis également haut fonctionnaire de défense adjoint.
Le schéma dans lequel nous nous sommes inscrits pour la gestion de cette grippe constitue une première. Nous avons fait pour la première fois application des dispositions du Livre blanc sur la défense et la sécurité nationale, qui distingue bien deux fonctions : la direction de la politique stratégique, confiée aux autorités gouvernementales – Premier ministre et Président de la République –, et la conduite opérationnelle de la crise ainsi que la coordination interministérielle, confiées au ministère de l’intérieur. Cette orientation, validée par le législateur, figure à l’article 5 de la loi de programmation militaire.
Cette organisation a été appliquée dans le cadre du plan de lutte contre la pandémie grippale, dès lors que le Gouvernement a considéré que l’on était dans une situation de crise majeure qui pouvait avoir des impacts multisectoriels sur l’ensemble des composantes du gouvernement et de la société.
Le Premier ministre a donc confié la responsabilité du pilotage lors de la crise au ministère de l’intérieur, ce qui a conduit à l’activation, le 30 avril 2009, de la cellule interministérielle de crise, laquelle s’est réunie et a travaillé dans le cadre des orientations générales fixées par le Gouvernement.
Le dispositif de gestion de crise s’est traduit par pas moins de quarante-trois réunions – journalières en début de crise, puis hebdomadaires –, auxquelles participait une grande partie des membres du Gouvernement. Elles étaient présidées par le directeur de cabinet du ministre de l’intérieur, en présence du directeur de cabinet du ministre de la santé, sauf, au début, où elles l’étaient par le ministre de l’intérieur lui-même. Étaient présents à la fois les représentants du secrétariat général de la défense et de la sécurité nationale, du cabinet du Premier ministre et du Président de la République à compter de la fin du mois de juillet.
Le fonctionnement de cette cellule s’est inscrit dans un cadre interministériel avec, sous l’autorité du ministère de l’intérieur, un lien très fort entre ce dernier et le ministère de la santé car, même si les impacts de cette crise étaient par nature intersectoriels, elle était évidemment sanitaire et la réponse gouvernementale s’est largement inspirée des expertises rendues par le ministère de la santé.
L’ensemble des instructions qui ont été débattues et décidées dans le cadre de cette cellule s’est traduit généralement par la production de circulaires conjointes des deux ministres chargés de l’intérieur et de la santé. L’ensemble des réunions a fait l’objet de comptes rendus, qui sont évidemment à la disposition de votre commission, qui éclairent les conditions dans lesquelles le travail gouvernemental a été conduit, sous le pilotage opérationnel du ministère de l’intérieur.
On peut distinguer trois grands moments dans ce pilotage.
Lors de la première période, de la fin du mois d’avril au mois d’octobre 2009, nous avons tenté de freiner l’arrivée et l’impact du virus sur le territoire national par un certain nombre d’éléments de réponse, y compris par anticipation, en particulier par les plans de continuité d’activité, qui n’ont pas été activés, non plus, sauf à la marge dans certains aéroports où des contrôles sanitaires aux frontières ont été mis en place, que les mesures liées aux dispositifs de protection individuelle. La cellule interministérielle de crise a ainsi défini le cadre dans lequel les différentes administrations, les opérateurs ou les collectivités auraient pu être en mesure d’activer ces différentes mesures.
Dans la mesure où une crise de cette nature a un impact en dehors des frontières nationales, nous avons fait l’effort de nous intéresser le plus possible aux enjeux internationaux. Les débats de la cellule ont traduit la volonté de mieux connaître les réponses des autres États et de faire en sorte que l’Europe se saisisse davantage de ce thème, dans sa dimension non seulement sanitaire mais aussi sectorielle.
Mais le rôle de la cellule interministérielle de crise a surtout été de décliner une « boîte à outils » nationale, c’est-à-dire de choisir les mesures nécessaires et parfois de les construire. C’est particulièrement évident pour la vaccination : même si elle figurait dans les options du plan de lutte contre la pandémie grippale, nous avons dû collectivement inventer la manière dont elle devrait être organisée.
La deuxième période, d’octobre 2009 à la fin du mois de janvier 2010, a été celle de la vaccination, les circulaires du 21 août et du 28 octobre 2009 ayant défini les modalités de sa mise en œuvre. La vaccination a débuté le 20 octobre pour les professionnels de santé et à partir du 12 novembre pour l’ensemble de la population. Elle s’est traduite par la mise en place, sur l’ensemble du territoire national, de plus d’un millier de centres de vaccination, avec une montée en puissance progressive : après un démarrage relativement lent, la demande a très sensiblement augmenté après le 20 novembre, avant de diminuer, notamment durant les fêtes de fin d’année, ce qui a conduit à ajuster le fonctionnement des centres. Nous avions pris rendez-vous pour le début du mois de janvier, afin de vérifier si la fréquentation reprendrait. La reprise ayant été relativement lente, le ministère de l’intérieur, en sa qualité de président de la cellule de crise, a poussé à une fermeture anticipée des centres de vaccination qui avaient été conçus pour fonctionner plus longtemps. Il a ainsi été décidé qu’ils fermeraient à la fin du mois de janvier, parallèlement à la fin du calendrier d’envoi des bons. Nous avons dans le même temps essayé de « desserrer » le dispositif et d’ouvrir des centres de vaccination dans les grandes administrations ou dans les entreprises. Quoi qu’il en soit, les centres ont été fermés le 30 janvier 2010.
Nous sommes aujourd’hui dans la troisième période, celle du repli. Il a fallu reprendre l’ensemble des équipements, dans des conditions de sécurité suffisante, et surtout procéder aux opérations de clôture administrative et financière pour solder les comptes, le ministère de l’intérieur étant en charge du volet administratif de l’organisation de la campagne.
J’en viens à quelques éléments d’appréciation.
Nous pouvons noter la bonne résilience de la chaîne de gestion de la crise. L’appareil administratif d’État – et au-delà, puisque les collectivités territoriales ont été étroitement associées au dispositif – a tenu dans la durée, malgré des tensions très fortes.
Pour assurer la réponse opérationnelle, nous nous sommes appuyés sur l’échelon départemental qui doit impérativement rester – y compris dans le cadre de la réforme territoriale en cours – un maillon important de la réponse territoriale en termes de sécurité, mais aussi, c’était une innovation, sur les préfets de zone qui ont été un relais efficace des instructions nationales et un soutien pour les préfets de département.
S’agissant du fonctionnement de la cellule interministérielle de crise, la responsabilité du ministère de l’intérieur s’est insérée dans les options stratégiques décidées par le Gouvernement. Cela a nécessité un important travail de coordination de l’ensemble des ministères. Nous avons pu ainsi homogénéiser au maximum les positions des différentes administrations et produire, dans des délais courts, les textes et les instructions qui ont permis aux chaînes territoriales de répondre aux instructions du Gouvernement. Nous avons dû construire un certain nombre d’instruments dont le mode d’emploi ne figurait pas dans le plan de lutte contre la pandémie grippale et nous avons testé la capacité à animer un réseau territorial sur une longue durée. Nous avons bien sûr travaillé dans un cadre interministériel extrêmement large.
Je terminerai par quelques réflexions sur la planification.
Nous devons tenir compte des acquis de la crise, pour apporter des compléments, en termes de mode d’emploi ou de cadrage, au plan de lutte contre la pandémie grippale. Nous avons dû, même si des éléments de doctrine étaient disponibles dans ce plan, inventer collectivement des dispositifs pour permettre aux uns et aux autres de mettre en place si nécessaire les plans de continuité d’activité. Nous avons dû également préciser ensemble les conditions d’utilisation des équipements de protection individuelle et donner un cadre précis à l’organisation territoriale de la vaccination.
Nous nous sommes aperçus qu’un certain nombre d’éléments de soutien, en particulier juridiques et financiers, étaient nécessaires à la conduite de la crise. La planification doit les intégrer afin que certaines questions n’aient pas à être traitées « à chaud ». Tel n’a pas été pleinement le cas.
Le ministère de l’intérieur étant par ailleurs en charge de la transposition territoriale des plans et de leur mise en œuvre, il peut réfléchir à des axes d’amélioration. Il doit d’ailleurs renouveler son effort de transposition territoriale cohérente des plans gouvernementaux. Ainsi, il se penchera sans doute sur la question des seuils de déclenchement des diverses phases du plan, au niveau national comme à celui de l’Organisation mondiale de la santé.
M. Jean-Pierre Door, rapporteur. Pouvez-vous nous préciser quelle était l’articulation entre le secrétariat général de la défense et de la sécurité nationale, la cellule interministérielle de crise, la direction générale de la santé et le département des situations d’urgence sanitaire ? Comment ce dispositif était-il décliné dans les préfectures, qui n’ont pas toutes réagi de la même façon, ce qui a pu donner l’impression d’un manque d’unité entre les territoires ?
Vous avez par ailleurs évoqué la possibilité de définir vous-même quels publics vacciner, la direction générale de la santé ayant pris ensuite une orientation différente. À quels publics pensiez-vous alors ?
J’ai cru vous entendre dire que vous aviez vous-même « inventé » les modalités de la vaccination. Portez-vous de la sorte la responsabilité de la déclinaison territoriale de la campagne de vaccination ? Peut-on être satisfait des résultats ?
Enfin, vous avez envisagé de confier parfois certaines responsabilités aux préfets de zone de défense plutôt qu’aux préfets de département. S’agit-il d’une orientation pour l’avenir ?
M. Francis Delon. S’agissant du secrétariat général de la défense et de la sécurité nationale, la préparation du plan depuis 2004 s’est faite sous l’autorité du Premier ministre, en relation étroite avec le ministère de la santé, le ministère de l’intérieur, mais aussi d’autres ministères – économie, transports, etc. – puisque ce plan à une vocation large.
M. le rapporteur. Cette préparation a-t-elle eu lieu au sein du ministère de la défense ou de celui de l’intérieur ?
M. Francis Delon. La préparation du plan relève de la responsabilité du Premier ministre, c’est-à-dire du secrétariat général de la défense et de la sécurité nationale, avec le concours des différents ministères. Le ministère de la défense n’a pas été impliqué à titre principal. Les deux premiers ministères concernés étaient ceux chargés de la santé et de l’intérieur.
Comme le prévoit le Livre blanc sur la défense et la sécurité nationale de 2008, lorsqu’une crise importante survient, le Premier ministre est responsable de sa gestion ; en général, il en délègue la gestion opérationnelle, en principe au ministre de l’intérieur pour une crise sur le territoire national. C’est ce qui a été fait en l’occurrence. Le ministre de l’intérieur a eu la responsabilité de piloter la cellule interministérielle de crise. Compte tenu de la particularité de la crise, il a décidé que le ministre de la santé devrait être étroitement associé et il a été demandé à Mme Bachelot-Narquin de copiloter la cellule avec M. Hortefeux.
Chacun a exercé ses responsabilités. Le ministère de l’intérieur a animé le réseau territorial des préfectures. Le ministère de la santé a utilisé tous ses réseaux d’information et de mise en œuvre à travers le réseau sanitaire. D’une certaine façon, le secrétariat général s’est plutôt effacé au moment de la gestion de la crise parce que son rôle n’est pas opérationnel : il a un rôle d’anticipation, de planification et de préparation à l’anticipation sous l’autorité du Premier ministre.
Le secrétariat général suivait les travaux de la cellule, mais il n’en était pas l’acteur principal. Il était là pour être informé de ce qui se passait, pour pouvoir informer le Premier ministre et, le cas échéant, lui conseiller d’anticiper un certain nombre de mesures.
J’ai en effet parlé des publics à vacciner. Au début de l’automne, le public manifestant un très fort engouement pour la vaccination et les vaccins arrivant « au compte-goutte », on avait craint une pénurie de vaccins. Nous avons donc envisagé une liste de publics prioritaires, comprenant bien sûr les personnels de santé, ceux qui sont directement confrontés à la maladie et qui doivent être protégés le plus tôt possible, les personnes vulnérables, mais aussi, au sein de la population qui n’entrait dans aucune de ces catégories, les forces de police, les pompiers et certains personnels essentiels pour assurer la continuité de la vie du pays. Cela n’a jamais été finalisé et, vous le savez, le nombre des vaccins s’est révélé amplement suffisant.
M. Yann Jounot reviendra sur les modalités de la vaccination.
Quelles pistes définir pour l’avenir ? Il me semble que le plan devra s’orienter vers plus de souplesse, qu’il faudra améliorer la « boîte à outils » et prendre plus de distance vis-à-vis des décisions de l’Organisation mondiale de la santé, en particulier en renonçant à caler le plan sur les phases qu’elle définit.
Un important effort en faveur de la gestion territoriale devra bien entendu être consenti, mais en n’oubliant jamais que la réaction à une crise d’une telle dimension doit évidemment être pilotée au niveau national.
M. Yann Jounot. Le système est assez nouveau. Le ministre de l’intérieur reçoit délégation du Premier ministre et il coordonne l’action gouvernementale au plan opérationnel, dans le cadre des grandes orientations stratégiques fixées par le Gouvernement.
La vaccination a été l’orientation de départ de la gestion de la crise. Elle a été évoquée dès les premières réunions de la cellule de crise, place Beauvau. Ensuite, conformément à la décision du Gouvernement et sur la base de l’expertise du ministère chargé de la santé, nous avons, au sein de la cellule, élaboré une réponse opérationnelle en termes de vaccination.
La cellule s’est appuyée par ailleurs sur l’ensemble des centres de la crise dont peuvent disposer les ministères – et pas uniquement le ministère de la santé : le centre de planification et de conduite des opérations au ministère de la défense, les centres de crise territoriaux– centres opérationnels de zone ou centres opérationnels de défense – ou encore les centres de crise existant au ministère de l’intérieur, comme le centre opérationnel de gestion interministérielle des crises.
La cellule a exercé en fait une coordination politique pour mettre en œuvre une réponse territoriale dans le cadre stratégique fixé par le Gouvernement. En effet, si certains sujets étaient d’ordre strictement sanitaire, la façon de traiter l’endiguement, donc les mesures en matière de transports, la façon dont on appliquait les plans de continuité d’activité et les mesures de protection individuelle relevaient de l’ensemble des ministères. Il fallait donc harmoniser au mieux la façon dont chacun appliquait les instructions conçues, transmises et déclinées sous l’autorité du ministre de l’intérieur en tant que président de la cellule, organe de pilotage opérationnel interministériel.
Dire que l’on a « inventé » la vaccination est sans doute un peu excessif. La vaccination est une réponse qui figure dans le plan de lutte contre la pandémie grippale. Mais il est exact que nous avons construit l’offre de vaccination destinée à l’ensemble de la population, dès lors que le Gouvernement avait décidé que l’on procéderait de la sorte.
Le ministère de la santé avait fait état de difficultés liées au type de vaccin, au calendrier et aux craintes que ce virus faisait naître pour la santé publique. La décision mise en œuvre par le ministère de l’intérieur dans le cadre de la cellule interministérielle de crise était fondée sur sa préconisation de construire un système de vaccination différent du système de droit commun. Les centres de vaccination ont donc été déployés sur le territoire national. Il s’est agi d’un travail conjoint du ministère de la santé et du ministère de l’intérieur, en liaison avec les autres ministères mais prioritairement bien sûr avec le ministère de l’intérieur et le ministère de la santé, qui a fixé le cadre général de l’organisation de la vaccination.
En l’occurrence, « inventer », c’était créer les centres et déterminer leur mode de fonctionnement compte tenu des contraintes qui vous ont été rappelées, notamment par le professeur Houssin.
J’en viens à l’organisation territoriale. Au ministère de l’intérieur, nous pensons que la crise se gère dans la proximité. Tout ce que nous faisons aujourd’hui, y compris au niveau des zones de défense, vise à renforcer le rôle de l’échelon départemental.
Nous avons besoin d’une instance intermédiaire entre Paris et les départements afin de vérifier que la planification dans les départements obéit partout aux mêmes conditions d’homogénéité et de cohérence. L’échelon zonal, pour nous, ne se substitue donc pas à l’échelon départemental, il l’appuie. Dans certaines grandes crises – pollutions marines, grands aléas climatiques – où les préfets de département sont à la manœuvre, il est nécessaire qu’une autorité supradépartementale coordonne l’action des départements. Voilà pourquoi les nouveaux textes renforcent le pouvoir de coordination de l’échelon zonal, d’autant qu’il est beaucoup plus facile d’animer un niveau territorial comptant sept ou douze zones de défense plutôt que cent départements. En outre, les zones de défense assurent elles-mêmes les tâches d’animation infrazonale. Voilà le schéma dans lequel le ministère de l’intérieur s’inscrit.
M. Gérard Bapt. Nous avons auditionné la semaine dernière le sous-préfet responsable du département des situations d’urgence sanitaire. Ses propos concordent tout à fait avec la description que vous avez faite de la gestion de la crise, à partir de la fin du mois d’avril.
Pourriez-vous faire en sorte que notre commission ait accès aux comptes rendus des réunions interministérielles, dont on nous a dit, monsieur Yann Jounot, que vous aviez eu la charge ?
M. le président Jean-Christophe Lagarde. J’insiste à mon tour pour qu’ils nous parviennent dans les meilleurs délais.
M. Yann Jounot. Il faut distinguer le travail gouvernemental, qui se traduit par un certain nombre de vraies réunions interministérielles, du fonctionnement de la cellule interministérielle de crise. C’est le Gouvernement qui fixe les grandes orientations, par exemple en matière de stratégie de vaccination.
M. Gérard Bapt. Il y avait deux types de réunions et deux types de comptes rendus ?
M. Yann Jounot. Le compte rendu des vraies réunions interministérielles est assuré par le cabinet du Premier ministre. La cellule interministérielle de crise met en œuvre des grandes orientations décidées par le Gouvernement, et cela fait l’objet de relevés de décision, qui ont d’ailleurs été communiqués à l’ensemble des préfets de département et de zone. Bien sûr, l’ensemble de ces documents est à la disposition de votre commission.
M. le président Jean-Christophe Lagarde. S’agit-il des documents qui ont été adressés aux préfectures de zone et de département ?
M. Yann Jounot. Ce sont les documents qui relatent l’ensemble des débats qui ont eu lieu en cellule interministérielle de crise pour la mise en œuvre des orientations stratégiques définies par le Gouvernement.
M. le président Jean-Christophe Lagarde. Existe-t-il des comptes rendus relatifs à l’établissement de ces orientations stratégiques ? À qui faut-il les demander ?
M. Francis Delon. Les réunions que préside le Premier ministre donnent lieu à compte rendu, le « bleu » étant établi par le secrétaire général du Gouvernement.
M. Gérard Bapt. Mais pourrions-nous avoir accès à vos propres comptes rendus ?
M. Francis Delon. Je n’ai pas de compte rendu en tant que tel, puisque je ne présidais pas de réunions. Mais si vous souhaitez avoir des documents particuliers, nous vous les communiquerons.
M. le président Jean-Christophe Lagarde. Nous souhaitons obtenir les comptes rendus de mise en œuvre, dont parlait M. Yann Jounot. Puis nous verrons, pour les orientations stratégiques, avec le secrétariat général du Gouvernement.
M. Gérard Bapt. Une des idées du plan de lutte contre la pandémie grippale élaboré au début de l’année 2009 était que, face à un risque notamment sanitaire, il fallait alerter et non pas paniquer, ce qui paraît logique et raisonnable. Nous avons entendu récemment M. Thierry Saussez, chargé de la communication du Gouvernement, pour qui il faut maximiser le risque quand on doit gérer une crise sanitaire. N’y a-t-il pas contradiction ?
Par ailleurs, vous avez dit que le plan était évolutif et qu’il devra l’être plus encore. Mais très franchement, on ne s’en est pas aperçu jusqu’au 4 janvier 2010, lorsque la ministre de la santé a annoncé un changement de cap sur plusieurs points. Auriez-vous pu faire des propositions pour adapter la gestion de la crise à l’évolution de la situation, notamment de la connaissance que l’on avait du risque ?
Enfin, vous avez parlé de la nécessité de rechercher un meilleur découplage de la gestion sanitaire entre le niveau national et celui de l’Organisation mondiale de la santé. C’est une donnée importante. Quand je m’en étais pris à cette dernière dans Le Monde, je m’étais attiré de vertes remontrances. Il semblerait que maintenant, on pense qu’il faille prendre une certaine distance vis-à-vis d’elle, notamment pour ce qui a trait aux phases et aux alertes en cas de risque sanitaire.
M. le président Jean-Christophe Lagarde. Monsieur Francis Delon, vous avez évoqué l’aspect évolutif de la « boîte à outils », qui a échappé à de nombreux membres de la commission d’enquête et à la majorité de la population. Pouvez-vous nous en dire plus ?
M. Francis Delon. J’ai plutôt parlé de souplesse. Ce plan est en effet une boîte à outils. Il n’a pas vocation à être appliqué de A à Z. Il présente des solutions possibles pour telle ou telle situation. Dans tous les plans gouvernementaux, on applique des solutions qui semblent adaptées à une situation donnée, puisque l’on ne peut pas tout prévoir à l’avance dans le détail. Nous faisons toujours l’effort de laisser un certain nombre d’options ouvertes. Ce fut le cas du plan de lutte contre la pandémie grippale depuis sa première élaboration en 2004.
Ce que vous évoquez depuis tout à l’heure, ce n’est pas le plan lui-même : c’est sa mise en œuvre.
M. le président Jean-Christophe Lagarde. Quelle est la différence ?
M. Francis Delon. Elle est fondamentale : le plan est un guide. La mise en œuvre se traduit par des choix par rapport à ce guide. Cela n’a strictement rien à voir.
Ce plan est flexible. Il pourrait l’être, peut-être, encore plus. En tout cas, dans les exercices qui ont été menés, cet élément a toujours été mis en avant. Il n’y a pas d’automaticité : il y a des choix à faire, en fonction des circonstances.
Vous avez justement relevé l’importance du lien avec les phases d’alerte définies par l’Organisation mondiale de la santé. Avec l’expérience, on procède à des ajustements. D’ailleurs, ce plan a déjà été modifié à quatre reprises. Il devra probablement être encore moins lié qu’on ne le prévoyait aux décisions de l’Organisation mondiale de la santé. Cela dit, pour cette dernière le monde est toujours en phase d’alerte 6, alors que nous n’avons, en France, jamais dépassé la phase 5A, ce qui prouve que nos décisions n’ont n’a pas toujours été complètement calquées sur les siennes.
Je ne sais pas très bien ce qu’a voulu dire M. Thierry Saussez. Quoi qu’il en soit, la communication est un élément central de la gestion de crise. Il faut en effet alerter sans créer la panique. Il faut donner confiance au public tout en lui disant la vérité. Reste à trouver le bon équilibre. Il m’a semblé que la politique du Gouvernement, telle qu’elle était décidée par le Premier ministre, répondait bien à cette nécessité et je n’ai pas du tout eu le sentiment d’un décalage.
M. Jean Mallot. Le plan, que vous distinguez de l’application qui en a été faite, prévoit effectivement une partie relative à la communication. Que pouvez-vous nous en dire ? Quelle était la place du service d’information du Gouvernement dans ce schéma ?
Ensuite, la stratégie de vaccination fait partie du plan. Sa mise en œuvre suppose une articulation avec le ministère de la santé. Pouvez-vous illustrer cette articulation à trois moments précis : lorsque l’on a décidé de ne pas avoir recours aux médecins de proximité pour la vaccination ; lorsqu’il s’est agi de commander les vaccins ; lorsque l’on a appris qu’une seule injection suffirait ?
Comment le plan se transforme-t-il en décision ? Qui prend la décision ? Peut-on mieux comprendre ce qui s’est passé ?
M. le président Jean-Christophe Lagarde. Je veux bien que le plan soit une succession de « boîtes à outils », mais une fois mis en œuvre, on a l’impression que rien n’arrête le paquebot : la vaccination avec deux doses qui deviennent une seule dose, la morbidité qui est bien moindre que ce que l’on craignait au départ, etc. Comment cela se passait-il lors des réunions de la cellule interministérielle de crise ?
M. Yann Jounot. Le plus simple est de reprendre les débats de la cellule.
La question de la vaccination a été un moment important. Dès le 5 mai 2009, la cellule a envisagé l’hypothèse d’une vaccination. Le ministère de la santé a rappelé les délais dans lesquels cette décision devait être prise, pour tenir compte de l’arrivée des vagues de virus à l’automne. Lors de la réunion du 12 mai 2009, le ministère de la santé a rendu compte des négociations qu’il avait entamées en vue de l’acquisition de vaccins. Ainsi, dès les premières réunions, il a alimenté le travail interministériel au sein de la cellule opérationnelle pilotée par le ministère de l’intérieur sur la préparation à la mise en œuvre de la vaccination.
Concernant les modalités de celle-ci, il faut reprendre les comptes rendus du 15 juillet et du 22 juillet 2009. Le ministère de la santé, sur la base de son expertise, confortée par un certain nombre d’expertises internationales, a précisé que la vaccination devrait être réalisée dans des centres séparés, à la fois pour protéger la population et pour tenir compte des caractéristiques particulières du vaccin conditionné en multidoses.
Il ne faut pas oublier que, pendant une grande partie de cette phase de préparation, nous étions dans l’incertitude : le ministère de l’intérieur n’a pas de compétences sanitaires éprouvées et les experts n’étaient pas tous d’accord sur l’évolution de la maladie. Un débat était né autour de l’éventualité de la mutation du virus et de l’arrivée d’une seconde vague pandémique au début de l’année 2010. L’hypothèse, qui s’est révélée fausse a posteriori, était que ce virus pouvait tuer.
Voilà ce qui a conduit le Gouvernement à organiser un système spécifique de vaccination collective à destination de l’ensemble de la population.
Quasiment jusqu’à la fin du mois de novembre et au début du mois de décembre, on pouvait douter de la dangerosité du virus. Ensuite, dans le cadre des orientations stratégiques du Gouvernement, nous avons mis en œuvre cette offre spécifique de vaccination, qui a été ajustée pour tenir compte des pics de fréquentation – avec notamment un pic important aux alentours du 20 novembre, avant que la fréquentation ne se tasse. Enfin, dès le début du mois de janvier, le ministère de l’intérieur a insisté pour que l’on tienne compte de cette baisse d’affluence dans les centres de vaccination, pour que l’on développe d’autres capacités de vaccination, en entreprise, puis dans les hôpitaux, et pour que l’on ferme les centres de vaccination à la fin du mois de janvier, ce qui n’était pas alors l’hypothèse retenue par le ministère de la santé.
Compte tenu de l’ensemble des contraintes sanitaires et de l’état des connaissances transmises par le ministère de la santé et les autorités sanitaires, nous avons essayé malgré tout d’organiser cette réponse en termes de vaccination et d’ajuster les conditions de son fonctionnement à la réalité de la dangerosité du virus et à la fréquentation des centres par la population.
M. Francis Delon. Le point 2-7 du plan précise les objectifs de la communication : « Le dispositif est conçu pour assurer le maintien d’un lien de confiance fort entre les autorités gouvernementales et la population et vise donc à atténuer les craintes et l’anxiété. Les objectifs de la communication sont : informer en permanence la population sur la situation et les mesures prises, entretenir la confiance de la population et la crédibilité des pouvoirs publics, inciter chaque citoyen à devenir acteur et responsable face au risque et favoriser la solidarité nationale, informer sur la façon dont on peut retarder l’arrivée de l’épidémie sur le territoire français, informer les cibles prioritaires sur les mesures spécifiques les concernant, préparer le pays à gérer le risque en coordination avec les partenaires européens et internationaux, aider à gérer la crise et à maintenir l’organisation de la société pendant la pandémie, préparer la sortie de crise et la reprise de la vie normale. » Suivent un certain nombre de considérations sur la mise en œuvre de ces objectifs.
Concernant l’organisation même de la communication, on lit que « les axes stratégiques de communication seront définis par le Premier ministre » et que, « en phase prépandémique, la communication est pilotée par le Premier ministre et coordonnée par le service d’information du Gouvernement, qui agit en liaison étroite avec la délégation interministérielle à la lutte contre la grippe aviaire et avec le secrétariat général de la défense nationale. Dès que la cellule interministérielle de crise est activée, c’est le ministère de l’intérieur, chargé de la conduite opérationnelle de l’action gouvernementale, qui anime et qui coordonne la communication des divers ministères avec l’appui du service d’information du Gouvernement ». Ce dernier n’est ainsi plus en première ligne : il vient en appui de la cellule.
M. le président Jean-Christophe Lagarde. Avez-vous l’impression que c’est ce qui s’est passé ?
M. Francis Delon. Le service d’information du Gouvernement a joué son rôle, puis des adaptations ont été faites. Le Gouvernement a décidé d’abord d’une politique d’information active, dans laquelle ce service a été beaucoup utilisé. Mais une cellule d’information existait auprès de la cellule interministérielle de crise, M. Yann Jounot peut vous en parler.
M. le président Jean-Christophe Lagarde. Vous dites que le Gouvernement avait choisi d’utiliser le service d’information du Gouvernement, bien au-delà de ce que prévoit votre plan puisqu’il n’a plus à assumer cette communication à partir du moment où la cellule interministérielle de crise intervient. Or M. Thierry Saussez a assumé devant nous la semaine dernière le fait que le service avait conduit et piloté de bout en bout la politique de communication. Vous avez dit que la communication était très importante dans une crise. Or, dès lors que ce qui s’est passé est exactement contraire à ce que prévoit le plan, ce denier ne doit-il pas être corrigé ?
M. Francis Delon. Le plan n’a pas à être corrigé : il prévoit que la cellule interministérielle de crise est chargée de la communication, c’est ce qu’elle a fait. M. Yann Jounot va vous expliquer comment.
M. Yann Jounot. La cellule comporte une cellule « décision », une cellule « situation », et une cellule « communication ». Étaient présents, au titre de la communication, l’ensemble des ministères impliqués dans la gestion de la crise, celui de la santé comme d’autres. Le service d’information du Gouvernement participait à l’ensemble des réunions.
Comment la communication a-t-elle été organisée par le Gouvernement à cette occasion ? Un certain nombre de communications conjointes ont été faites par le ministère de la santé et le ministère de l’intérieur, notamment sur tout ce qui ressortait de la responsabilité de pilotage de ce dernier, pour expliquer les mesures qui étaient prises dans le cadre de la cellule. Des éléments pourront vous être transmis pour attester de la réalité de ces conférences de presse ou communiqués de presse conjoints des ministres ou de leurs porte-parole.
Comme il s’agissait d’une crise sanitaire, le Gouvernement a considéré qu’il était plus légitime que la communication sur le volet sanitaire soit conduite par le ministère de la santé plutôt que par le ministère de l’intérieur. Il convient de distinguer cette communication d’ordre sanitaire des communications conjointes des deux ministères sur la mise en œuvre du dispositif.
Enfin, il faut prendre en compte les grandes campagnes d’information gouvernementales auxquelles faisait sans doute allusion M. Thierry Saussez. Je pense à la campagne de l’Institut national de prévention et d’éducation pour la santé qui, au début, a porté plutôt sur les gestes de prévention et qui a été orientée ensuite, au début du mois de novembre, sur la nécessité de se faire vacciner.
Une vingtaine de conférences de presse conjointes des ministères de l’intérieur
– sous l’autorité de Mme Michèle Alliot-Marie puis de M. Brice Hortefeux – et de la santé ont été organisées, notamment après les réunions de la cellule, avant et après la mise en place de la vaccination.
M. le président Jean-Christophe Lagarde. J’imagine qu’à la fin de la conférence de presse, les journalistes se tournaient vers le ministre qu’ils avaient envie d’interroger. On connaît cela…
M. Yann Jounot. Le principe d’une communication conjointe a été acté dès le début. D’ailleurs, les comptes rendus de la cellule signés par le ministère de l’intérieur ont tous été validés, antérieurement, par le ministère de la santé. Même dans ce cadre interministériel collectif, le dialogue était très étroit avec le ministère de la santé, la crise étant tout de même de nature sanitaire.
Ensuite, même si quelques exceptions sont possibles, nous avons veillé à faire en sorte que les éléments de langage ou les instruments d’information diffusés par les différents ministères soient validés par la cellule. Notre responsabilité était de faire en sorte que la communication soit la plus homogène possible.
M. le président Jean-Christophe Lagarde. Avez-vous le souvenir que la cellule interministérielle ait traité du document qu’on envoyait aux parents d’élèves pour les informer de la campagne de vaccination qui allait avoir lieu dans les établissements et les inciter à faire vacciner leur enfant et à répondre par un formulaire ?
Par ailleurs, est-ce votre direction qui a décidé de l’organisation des centres ou du système des bons ?
M. Yann Jounot. La cellule de communication a vu ces éléments.
M. le président Jean-Christophe Lagarde. N’y voyez pas de mise en cause personnelle. Avez-vous lu ce document ? Pensez-vous qu’il soit compréhensible par les parents ?
M. Yann Jounot. Monsieur le président, je ne peux pas vous répondre précisément aujourd’hui. Mais sur le principe, effectivement, ce document a été vu et validé en cellule de communication.
M. le président Jean-Christophe Lagarde. Les représentants du service d’information du Gouvernement y siégeaient-ils ?
M. Yann Jounot. Oui.
M. le président Jean-Christophe Lagarde. Donc ils l’ont vu et l’ont jugé intelligible par les parents…
M. Yann Jounot. Il a été validé…
Par ailleurs, le choix de la vaccination en centres n’a pas été opéré par le ministère de l’intérieur. C’est le ministère de la santé qui a rappelé les contraintes et a demandé que la vaccination soit organisée dans des centres de vaccination spécifiques.
M. le président Jean-Christophe Lagarde. Avez-vous « construit » cette réponse ?
M. Yann Jounot. Le ministère de l’intérieur, avec le ministère de la santé, a produit les deux grandes circulaires relatives à l’organisation de la vaccination que j’évoquais tout à l’heure : celle de la fin du mois d’août et celle de la fin du mois d’octobre, qui comportent une partie « intérieur » et une partie « santé ». La deuxième circulaire, notamment, fixe les conditions de sécurité médicale dans lesquelles les centres devaient fonctionner. Il s’agit donc d’une production conjointe des deux ministères.
M. le président Jean-Christophe Lagarde. Vous avez ainsi construit l’outil, à partir de la décision politique de ne pas avoir recours aux médecins de ville. Pensez-vous que cet outil a correctement fonctionné, qu’il a été bien organisé, que les préfets de département et les personnes qui y ont été envoyées ont su ce qu’ils avaient à faire ? Vous êtes-vous rendu dans ces centres pour vous rendre compte de leur état d’organisation ou plutôt de désorganisation ?
Le centre de vaccination de ma ville a été, dans un premier temps, ouvert deux fois deux heures par semaine ; on n’y acceptait que les personnes qui avaient des bons de vaccination. Dans l’après-midi ou la soirée qui a suivi le premier jour de vaccination, nous avons appris qu’il ouvrirait deux fois trois heures, et que les bons de vaccination n’étaient plus nécessaires. Le surlendemain, les personnes qui n’avaient pas de bon de vaccination n’étaient plus admises et le centre n’ouvrait plus que deux heures…
Avez-vous eu des échos de telles situations ? Vous êtes d’ailleurs quasiment les premiers à nous parler d’évaluation de votre action, ce qui est plutôt positif. Je ne dis pas que cela était simple à organiser, mais on a eu l’impression d’une vaste pagaille. Je ne parle même pas du fait que les bons de vaccination n’étaient toujours pas arrivés chez les gens alors que l’on était en train de fermer les centres, ni même des réquisitions de médecins que l’on n’avait pas envisagées au départ, alors qu’elles étaient indispensables.
Vous avez dit qu’il était essentiel que la population ait confiance dans les autorités sanitaires. Je ne suis pas persuadé que le résultat ait été atteint. Cette organisation qui a semblé « cafouiller » a-t-elle été évaluée ? Considère-t-on aujourd’hui qu’elle a été satisfaisante ? Sait-on comment on pourrait la corriger ?
Il semble que l’on se soit adapté à ce qui se passait, au fur et à mesure, après l’ouverture des centres, alors que l’on avait disposé de cinq ou six mois, voire de quelques années, depuis 2004, pour se préparer et envisager qu’en cas de grippe aviaire, il serait nécessaire de vacciner rapidement la population de façon efficace. On ne peut pas dire que ce soit ce qui s’est passé.
M. Yann Jounot. Concrètement, nous avons construit l’outil entre le mois de juillet et la fin du mois d’octobre, dans un dialogue conjoint entre les ministères de la santé et de l’intérieur. Il est vrai que nous avons constaté, à l’ouverture des centres, un certain nombre de problèmes d’ajustement. Nous avons effectivement observé et mesuré les difficultés que vous avez évoquées, ce qui a amené le ministère de l’intérieur à mieux diffuser les instructions nationales et à intervenir davantage dans la problématique d’ouverture des centres.
M. le président Jean-Christophe Lagarde. Tout cela ne pouvait-il pas être anticipé ? On m’a demandé d’ouvrir mon centre de vaccination le 24 décembre ou le 31 décembre jusqu’à 22 heures ! Au départ, il était ouvert le mardi et le jeudi, aux heures où la population qui travaille ne peut pas venir se faire vacciner. À la fin de la campagne, il a été prévu de vacciner dans les grandes entreprises, ce qu’on n’a même pas fait dans les grandes administrations, ou dans chaque préfecture, alors que c’était parfaitement envisageable. Il y a de quoi être étonné.
M. Yann Jounot. S’agissant du pilotage du fonctionnement des centres territoriaux, nous avons donné des instructions dans un délai relativement court par rapport à leur mise en œuvre. Or elles étaient d’une élaboration compliquée, parce que le sujet était lui-même complexe.
Nous avions d’abord laissé beaucoup de liberté aux préfets de département pour apprécier les conditions d’ouverture des centres, notamment en ce qui concerne les jours et les amplitudes horaires. En raison des difficultés rencontrées, des instructions très précises ont été données par le directeur de cabinet du ministre de l’intérieur, semaine après semaine, jusqu’à la fin des fêtes de Noël.
La vaccination en entreprise n’avait pas été envisagée à l’origine – on pensait alors que le virus pouvait avoir des conséquences graves et notre souci était d’isoler les populations dans des lieux particuliers. C’est le ministère de l’intérieur qui a proposé cette solution peu avant les vacances de Noël. Il avait été constaté que le virus était d’un caractère moins pathogène que prévu et l’on a souhaité desserrer la contrainte qui pesait sur les centres et élargir l’offre de vaccination.
M. le président Jean-Christophe Lagarde. Est-ce le ministère de la santé qui souhaitait que la vaccination ait lieu dans un lieu isolé ?
M. Yann Jounot. C’était l’équation de départ : des centres spécifiques, distincts des réseaux habituels de vaccination ou de soins…
M. le président Jean-Christophe Lagarde. Je comprends que l’on soigne dans des lieux séparés. Mais pourquoi vacciner une personne saine dans un gymnase et non dans son entreprise ou dans son administration ? Elle ne risque pas de propager le virus.
M. Francis Jounot. C’est une question qu’il faudra sans doute poser au ministère de la santé et au professeur Houssin. Mais encore une fois, le cahier des charges de la vaccination que le ministère de l’intérieur a mis en œuvre répondait à la nécessité d’isoler les flux et aux contraintes logistiques liées au conditionnement du vaccin en multidoses. Si l’on n’a pas envisagé à l’origine de pratiquer la vaccination en entreprise, c’est parce qu’on était dans cette configuration.
Quand nous avons constaté que les choses se passaient plus normalement, nous avons souhaité desserrer au maximum la contrainte pesant sur les centres de vaccination et offrir davantage de capacités de vaccination à la population générale. A donc été mise en œuvre, à partir du début du mois de janvier, cette nouvelle offre de vaccination en entreprise pour aboutir finalement à la proposition faite par le ministère de l’intérieur dès le début du mois de janvier, à savoir une décision de fermeture des centres au 30 janvier. C’est le ministère de l’intérieur qui y a poussé parce qu’il devenait manifeste que leur maintien n’était plus nécessaire.
M. le président Jean-Christophe Lagarde. Là encore, c’est assez surprenant. Tout le monde s’était préparé à une pandémie beaucoup plus grave, au point qu’on craignait de manquer de vaccins. On pensait qu’il fallait vacciner la population le plus vite possible. Mais les centres n’ont pas été ouverts le week-end. Pourquoi ? Pour vacciner le maximum de population, il faut le faire au moment où celle-ci est disponible.
M. Yann Jounot. Il y a eu effectivement, au début, des problèmes de fonctionnement. Et le directeur de cabinet a demandé que les préfets ouvrent les centres le week-end…
M. le président Jean-Christophe Lagarde. Dès l’ouverture de la campagne de vaccination ? Combien de temps après ?
M. Yann Jounot. Pas dès l’ouverture : une quinzaine de jours après.
M. Philippe Vitel. Chez moi, dès l’ouverture, et sept jours sur sept.
M. le président Jean-Christophe Lagarde. Avez-vous un « retour d’expérience » de la part des préfectures ?
M. Philippe Vitel. Selon les endroits, la méthodologie employée a été totalement différente.
M. Yann Junot. Dans les instructions sur lesquelles nous avons travaillé avec le ministère de la santé et qui étaient extrêmement lourdes, le descriptif du fonctionnement des centres était très détaillé. C’est ce mode d’emploi que les préfets de département devaient mettre en œuvre.
Au début de la campagne de vaccination, nous avions laissé aux préfets toute latitude pour décider des jours d’ouverture des centres. Nous avons eu connaissance, vers le 20 novembre, de difficultés, principalement dans les grandes agglomérations. Cela nous a amenés, une quinzaine de jours après le début de la campagne, à préciser beaucoup plus strictement les conditions dans lesquelles les centres de vaccination devraient être ouverts, notamment en prévoyant des plages d’ouverture le samedi, voire le dimanche dans les grandes agglomérations.
M. le président Jean-Christophe Lagarde. Monsieur le secrétaire général, savez-vous comment les campagnes de vaccination se sont déroulées dans les pays voisins, du moins ceux qui avaient fait un tel choix ?
M. Francis Delon. Tous les grands pays responsables ont fait le choix de la vaccination. À l’époque, il était difficile d’en faire un autre sans faire prendre un risque considérable à la population. On peut discuter des modalités et de la façon dont le dispositif a été mis en œuvre mais, personnellement, je pense qu’un tel choix n’était pas une erreur.
J’ai discuté avec les Anglais, les Américains et les Canadiens à l’automne dernier. Ils ont observé les mêmes phases que nous. En raison d’un engorgement extrême, au Canada et aux États-Unis, des gens faisaient la queue la nuit précédente pour se faire vacciner le lendemain matin ! Et cela provoquait des protestations.
Ces pays se sont posé les mêmes questions que nous : a-t-on raison d’inciter autant à la vaccination ? Quelle est la létalité précise du virus ? Encore au début du mois de décembre, les Canadiens et les Américains pensaient, comme nous, que le risque était élevé et qu’il fallait vacciner.
Les interrogations et les débats que nous avons observés chez nous ont largement eu lieu ailleurs. Simplement, nous avons peut-être voulu mieux nous préparer que les autres. Nous étions assez en avance, alors que certains pays avaient été moins diligents. Or il se trouve que ceux qui avaient moins diligents que nous s’en sont mieux tirés, la pandémie ayant été ce qu’elle a été. C’est très bien ainsi mais il me semble que, pour un pays comme la France, il était difficile, compte tenu des informations dont on disposait, de ne pas faire le choix de la vaccination.
M. le président Jean-Christophe Lagarde. Dans les autres pays, a-t-on également constaté des polémiques sur les vaccins et leur éventuelle dangerosité ?
M. Francis Delon. J’ai l’impression qu’elles ont été moins importantes qu’en France, même si je ne sais pas pourquoi.
M. le président Jean-Christophe Lagarde. Merci, messieurs, d’avoir participé à nos travaux.
La séance est levée à dix-sept heures cinquante.
Audition de M. Roger Salamon,
président du collège du Haut conseil de la santé publique
(Procès-verbal de la séance du mardi 11 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures cinquante.
(M. Roger Salamon prête serment.)
M. Roger Salamon, président du collège du Haut conseil de la santé publique. Créé par la loi relative à la politique de santé publique de 2004, le Haut conseil de la santé publique a pour mission d’évaluer la centaine d’objectifs fixés en annexe de cette loi et de répondre à des saisines dans les champs de l’environnement et des maladies infectieuses. Il résulte de l’association du Haut comité de la santé publique et du Conseil supérieur d’hygiène publique de France, lequel existe depuis le XIXe siècle.
Le haut conseil a été mis en place par le biais d’un appel à candidatures lancé auprès des professionnels de la santé publique travaillant dans les universités, à l’Institut national de la santé et de la recherche médicale, dans les hôpitaux et dans les directions régionales et départementales des affaires sanitaires et sociales. Les candidats ont ensuite été sélectionnés par des responsables scientifiques de grandes structures ou agences. C’est ce qui vaut au haut conseil d’être considéré comme une structure totalement indépendante car composée exclusivement d’experts – cent cinq au moment de sa création, cent quarante aujourd’hui –, qui élisent d’ailleurs leur président.
Les activités du haut conseil sont de deux ordres. D’une part, il évalue les objectifs fixés dans la loi relative à la politique de santé publique – j’ai remis dernièrement un rapport à la ministre de la santé à ce sujet – et il participe à la définition des objectifs de la prochaine loi de santé publique – qui semble repoussée à 2011. D’autre part, il répond, toujours dans l’urgence, à des saisines multiples, dont celles relatives à la grippe. Celles-ci ont été soumises à la commission des maladies transmissibles, présidée par le professeur Perronne, laquelle comprend un comité technique des vaccinations, présidé par le professeur Floret.
Je précise d’emblée que le haut conseil n’a pas participé à la décision de procéder à une vaccination de masse et d’acheter des vaccins à cet effet. Il ne lui appartient pas de prendre des décisions de cet ordre. Mais je n’hésiterai pas à vous donner mon avis à ce sujet si vous me le demandez.
Le haut conseil est intervenu en « seconde main ». Une fois les vaccins commandés, le Gouvernement l’a consulté sur la manière de distribuer ceux-ci. Quelles priorités devait-on arrêter ? Fallait-il des vaccins monovalents, des vaccins avec adjuvant ? Pouvait-on vacciner les femmes enceintes comme les autres adultes ? Fallait-il vacciner les personnes âgées, que l’on disait plus ou moins immunisées, ou bien les plus jeunes ?
La première saisine que nous avons reçue date du 11 juin 2009 et posait la question de la pertinence de l’utilisation d’un vaccin pandémique dirigé contre le virus grippal A(H1N1). Dans notre réponse, nous distinguions deux cas. Si des vaccins étaient disponibles en assez grand nombre avant le début de l’épidémie, l’objectif majeur était d’éviter celle-ci et le public à vacciner en priorité était alors constitué de jeunes enfants, qui sont les plus aptes à diffuser la grippe, et de toutes les personnes pouvant être sources d’épidémie.
En revanche, si les vaccins n’étaient disponibles qu’au moment où l’épidémie était déjà déclarée, il aurait été moins important d’essayer d’enrayer celle-ci que de protéger d’une part tous ceux qui « tenaient les rênes » de l’État et les services de secours – pompiers, gendarmes, personnels de santé, etc. –, et d’autre part tous ceux qui risquaient d’être gravement affectés par le virus. Un certain nombre d’inconnues empêchaient de préciser les contours de cette dernière catégorie car les personnes à risque n’étaient pas les mêmes que pour la grippe saisonnière : on les disait plus jeunes et ne présentant pas de pathologies particulières.
Nous avons été beaucoup sollicités sur cette question, qui a fait l’objet de plusieurs saisines entre les mois de juin et septembre : les vaccins ne pouvant être livrés d’un coup, il nous était demandé quelles devaient être les priorités.
Nos réponses ont été assez proches de celles du Centre de prévention et de contrôle des maladies américain : nous recommandions de vacciner en priorité les personnels de santé, médico-sociaux et de secours, les femmes enceintes et les bébés.
M. le président Jean-Christophe Lagarde. Estimez-vous que le haut conseil aurait dû être consulté plus tôt ?
M. Roger Salamon. Si vous me demandez mon avis sur la décision prise par la ministre de la santé, je vous le donnerai : j’estime qu’elle a fait ce qu’il fallait faire et que n’importe qui aurait fait à sa place. Le pire aurait été qu’elle ne fasse rien. Il est toujours facile de critiquer a posteriori.
Je sais que la personne que vous allez auditionner après moi, et qui est un grand monsieur de la médecine française, vous dira l’inverse mais je pense qu’il a tort. Des députés, pourtant médecins, voire des anciens ministres, ont également dit des bêtises.
Cela étant, si j’avais pu prévoir, si la ministre de la santé avait pu prévoir, si vous-mêmes, mesdames et messieurs les députés, aviez pu prévoir ce qui allait se passer, on aurait impliqué plus tôt le Haut conseil de la santé publique.
M. le président Jean-Christophe Lagarde. C’était le sens de ma question. Le comité technique des vaccinations aurait-il dû être saisi plus tôt ? Au mois de juin, il était un peu tard…
M. Roger Salamon. Je suis d’accord. Mais il y avait une décision à prendre et on peut comprendre, compte tenu du fait que l’Organisation mondiale de la santé avait déclaré une alerte de niveau 6, qu’un ministre ne perde pas de temps.
Si on avait pu prévoir que la grippe serait beaucoup moins létale qu’on le craignait et que tant de reproches seraient faits, il aurait été, effectivement, intelligent de consulter un comité d’experts indépendant pour se garantir de tous ces mauvais procès.
M. Gérard Bapt. Le secrétaire général de la défense et de la sécurité nationale vient de nous dire qu’il faudrait, à l’avenir, découpler notre plan de celui de l’Organisation mondiale de la santé. Cela prouve que quelque chose n’a pas fonctionné.
M. Roger Salamon. Je suis d’accord.
M. Gérard Bapt. Nous savons que le choix de la vaccination barrière est politique et a été pris très tôt. Le haut conseil n’a été consulté qu’ensuite, par l’intermédiaire du comité de lutte contre la grippe, sur les modalités de la vaccination.
Cela étant, l’intervenant précédent nous a dit qu’en décembre, on s’interrogeait encore sur la pathogénicité du virus. Le 22 mai, le bulletin officiel de l’Organisation mondiale de la santé avait attiré l’attention sur le fait que, dans la plupart des cas, les sujets semblaient présenter un syndrome de type grippal classique bénin et guérissaient spontanément, et le directeur du Centre de prévention et de contrôle des maladies américain faisait remarquer à la même époque qu’on mourait moins de cette grippe pandémique que de la grippe saisonnière. Vous n’en faites pas état dans votre rapport.
À partir des chiffres de l’Institut de veille sanitaire, qui évalue à 312 le nombre de décès dus à la grippe A(H1N1), j’ai construit une courbe qui montre que si beaucoup de jeunes ont été touchés, très peu en sont morts, tandis que peu de personnes âgées ont attrapé la grippe mais que la grande majorité en sont mortes.
Le docteur Dupagne m’avait signalé en mai qu’il avait correspondu avec des confrères du Sud qui lui avaient indiqué que la grippe A(H1N1) n’était pas plus grave qu’une grippe banale. C’est également ce que disait le docteur de Chazournes de la Réunion, qui sera entendu demain par le Sénat.
Je ne comprends pas que l’on puisse continuer d’affirmer que l’on ignorait la faible létalité de cette grippe, qu’une vaccination barrière était nécessaire et, comme le directeur général de la santé et la ministre de la santé que, si l’on se retrouvait dans une situation identique demain, on referait la même chose. C’est méconnaître l’état de l’opinion et le discrédit des autorités sanitaires auprès des praticiens.
Ne croyez-vous pas que le risque a été maximisé par des experts obnubilés par leur spécialité et que cela a débouché sur beaucoup de gaspillage et un grand discrédit des autorités sanitaires auprès des médecins généralistes ?
M. Roger Salamon. Le nombre de morts susceptibles d’être causées par une maladie est calculé en multipliant le risque de mortalité individuel par le nombre de personnes susceptibles de contracter la maladie. Je rappelle quand même qu’au Mexique, la grippe A(H1N1) a fait beaucoup de morts. Mais imaginons qu’on ait les idées plus claires et qu’on se rende compte qu’elle est, par exemple, deux fois moins meurtrière que la grippe saisonnière. Comme l’Organisation mondiale de la santé avait annoncé qu’elle se diffuserait sur toute la planète, ce qui n’a été contesté par personne et qui s’est même avéré, si elle touchait cinquante fois plus de personnes, un rapide calcul montrait qu’elle tuerait vingt-cinq fois plus que la grippe saisonnière. C’est ainsi que l’on doit raisonner et non simplement à partir du risque de mortalité individuel.
Deuxièmement, quand on regarde votre courbe, monsieur Bapt, on voit que plus de personnes âgées que de jeunes sont mortes. Mais, même si les premières étaient « protégées » par rapport à la grippe A(H1N1), beaucoup d’autres facteurs ont pu provoquer leur décès. Ce qui doit nous interpeller, dans le cas d’une pandémie de grippe, c’est que des jeunes meurent alors qu’ils ne présentent aucun facteur de risque et qu’ils ne font pas partie de la population à risque de la grippe saisonnière. Les chiffres que vous citez sont exacts mais il faut les rapporter à la population touchée.
Quant à l’état de l’opinion, il est le résultat de la communication qui a été faite sur la grippe A(H1N1). Or deux erreurs ont été commises en la matière. La première est le fait des politiques et des journalistes. Les premiers, parce qu’ils pensaient que la situation était possiblement grave et voulaient convaincre la population de se faire vacciner, après avoir commandé, en pleine période de crise, une grande quantité de vaccins coûteux pour protéger leur santé – ils ne l’ont pas fait pour le plaisir de dépenser –, nous ont « infligé » des conférences de presse quotidiennes au cours desquelles le ministre de l’intérieur est venu systématiquement appuyer la ministre de la santé. En tant que citoyen et médecin, j’en ai personnellement été choqué car il s’agissait bien d’un problème de santé. Un état des lieux présenté de temps à autres par Mme Bachelot-Narquin, Mme Weber, la directrice de l’Institut de veille sanitaire, et, surtout, M. Houssin, le directeur général de la santé, aurait amplement suffi. J’ai également été choqué de voir les journalistes affoler la population en faisant, chaque jour, le décompte des morts.
La seconde erreur de communication, beaucoup plus grave, est le fait de tous ceux, politiques, gens des médias, humoristes, auxquels se sont joints des médecins généralistes et d’autres professionnels de santé, qui ont annoncé, sans aucun fondement, que la grippe A(H1N1) n’était pas grave, qu’il ne fallait pas se faire vacciner et – ce qui est absolument faux – que la vaccination faisait courir des risques, par exemple celui du syndrome de Guillain-Barré dont on sait pourtant qu’il n’est pas lié à la vaccination mais à la grippe elle-même. Si la grippe A(H1N1) s’était révélée aussi grave qu’on le craignait au départ, cet « empêchement » médiatique de la vaccination aurait été dramatique.
L’attitude de certains médecins a été scandaleuse car, après avoir appelé à ne pas se faire vacciner, ils ont dit le contraire lorsqu’il leur a été permis de le faire… J’ai également été très choqué que, dans l’hôpital où je travaille à Bordeaux, les personnels de santé, jusqu’à des puéricultrices en réanimation infantile, refusent de se faire vacciner. Le directeur du centre hospitalier universitaire a menacé d’interdire aux personnels non vaccinés d’intervenir en réanimation. Il avait raison mais sa démarche était illégale et il n’a pas pu l’imposer.
On peut également reprocher à l’Organisation mondiale de la santé de s’être « excitée » un peu trop rapidement et à certains de n’avoir pas pris en compte le fait qu’une alerte de niveau 6 porte sur le nombre des gens susceptibles d’être atteints par une maladie et non sur la gravité ou la létalité de celle-ci. On peut encore dénoncer les conflits d’intérêt qui peuvent exister au sein de l’Organisation mondiale de la santé ou ailleurs. Mais n’oublions pas le nombre de morts causées par la grippe espagnole : la grippe A(H1N1) aurait pu être tout aussi dévastatrice. Personne ne pouvait évaluer sa létalité ni affirmer qu’il n’y aurait pas de deuxième vague de la pandémie.
Quand la maladie s’est déclarée au Mexique, elle a énormément tué et il était annoncé qu’elle s’étendrait au monde entier. Cela dit, la létalité annoncée était tellement forte qu’elle en était invraisemblable.
M. Gérard Bapt. Elle était fausse.
M. Roger Salamon. Elle était complètement fausse, mais il était alors impossible de s’en rendre compte. Pour établir le taux de létalité d’une grippe, on fait le rapport entre le nombre de personnes mortes de cette grippe et le nombre de grippes diagnostiquées et déclarées. Or, au début de l’épidémie, on ne comptait qu’un petit nombre de grippes diagnostiquées et déclarées.
Cela étant dit, quand on dispose de toutes ces informations et qu’on dirige un pays développé, on commande des vaccins le plus rapidement possible. C’est d’ailleurs ce qu’ont fait tous les pays.
Pourquoi commander des vaccins nécessitant une double dose ? Parce qu’au moment de la commande, ils étaient les seuls à disposer d’une autorisation de mise sur le marché. Nous avons, nous-mêmes, très vite proposé d’administrer des doses uniques, après que des études ont été réalisées sur leur efficacité et leur innocuité.
Aucune crise sanitaire grave n’échappe aux erreurs de communication. Il y en a eu également au sujet de l’amiante et du syndrome de la guerre du Golfe. Il est, d’ailleurs, impossible qu’il n’y en ait pas en France, tellement la population est individualiste et veut montrer qu’elle est téméraire.
Cela étant, il n’est pas simple de bien communiquer. Il est très difficile d’alerter sans alarmer ; de faire comprendre aux gens qu’il convient de se faire vacciner sans leur dire que la situation est grave. Mais la communication devient encore plus difficile quand les puissants lobbies anti-vaccination font courir des rumeurs, comme celles concernant le risque de contracter le syndrome de Guillain-Barré.
M. le président Jean-Christophe Lagarde. Vous venez de défendre avec enthousiasme la décision d’une vaccination générale. Mais le premier avis rendu par le haut conseil le 26 juin 2009 est très réservé sur la pertinence de la vaccination dans le contexte d’une épidémie déclarée. Il déclare ne pas être à même, « compte tenu des nombreuses incertitudes concernant aussi bien la maladie que les vaccins ainsi que des potentiels aléas des études de modélisation », de proposer à ce jour des recommandations concernant la stratégie d’utilisation des futurs vaccins pandémiques A(H1N1). Il souligne, en outre, que « la mise en place d’une vaccination au-delà de trente jours suivant le début de la circulation active du nouveau virus A(H1N1) en France aurait un impact très limité sur l’évolution de la vague pandémique en cours en France, quelle que soit la population ciblée. » Vous avez publié un avis quasiment identique en juillet 2009. Je ne comprends pas bien…
M. Roger Salamon. Nous aurions aimé pouvoir vacciner de manière préventive pour éviter l’épidémie. Mais cela n’a pas été possible puisque l’épidémie était déjà présente quand nous avons disposé des premiers vaccins. C’est le sens de la seconde phrase que vous avez citée. Il n’était plus question d’enrayer l’épidémie. Il fallait essayer de vacciner ceux qui risquaient des complications s’ils contractaient la maladie, à savoir les femmes enceintes et les jeunes.
Mais, comme nous avions des doutes sur l’efficacité des vaccins, nous avons poussé à ce que soient conduites de nombreuses études sur leur immunogénicité et leur tolérance. Nous ne pouvions pas émettre de recommandations à ce sujet puisque nous attendions les résultats de ces études.
M. le président Jean-Christophe Lagarde. Pourquoi, en septembre, le haut conseil a-t-il envisagé un schéma vaccinal visant la population entière alors qu’il l’excluait jusque-là et que d’autres instances, comme le Centre européen de prévention et de contrôle des maladies, l’advisory commitee on immunition practices américain et le département de la santé britannique continuent à l’exclure ? Que s’est-il passé pour que vous changiez d’avis ?
M. Roger Salamon. Les vaccins étaient disponibles.
En septembre, personne n’aurait pris la décision d’acheter en masse des vaccins pour vacciner la totalité de la population. Mais d’une part, les vaccins étaient achetés, livrés et ne présentaient aucun effet secondaire, d’autre part, même si la grippe était moins grave que prévu, elle avait quand même causé des morts et une deuxième vague n’était pas totalement exclue. Nous étions d’avis de vacciner tout le monde, conformément à la décision prise par le Gouvernement.
M. le président Jean-Christophe Lagarde. En fait, vous n’étiez pas vraiment favorables à la vaccination quand on annonçait une maladie grave et vous l’êtes devenus en septembre, quand on savait que la grippe A(H1N1) n’était finalement pas si grave, au motif que les vaccins avaient déjà été commandés et, semble-t-il, qu’il fallait les écouler et lancer la campagne même si l’on savait que la vaccination n’était pas indispensable.
M. Roger Salamon. S’ils n’avaient pas été achetés à cette date, on aurait pu considérer que le jeu n’en valait pas la chandelle.
Mais, dans l’évaluation du bénéfice d’une vaccination, on prend en compte le coût des vaccins, leur efficacité et les risques encourus. En septembre, le coût des vaccins était nul puisqu’ils avaient été achetés et qu’ils venaient d’être livrés, et les risques étaient également nuls. Donc rien ne s’opposait à ce que tout le monde soit vacciné.
Je vous signale que la décision de vacciner tout le monde avait été prise très tôt par la ministre de la santé.
M. Gérard Bapt. Pour revenir à ma courbe, que j’ai calquée sur celle établie pour l’Australie, je note que, sur les cent trente-deux morts dénombrées par l’Institut de veille sanitaire, cinquante personnes seulement ne présentaient pas de facteurs aggravants. En Australie, on dénombre à peu près le même nombre de morts – cent quatre-vingt trois – pour une population comparable à celle de la France et, là aussi, il s’agit surtout de personnes âgées.
J’observe, par ailleurs, qu’il y a un « avant » et un « après » le 4 mai 2009 pour ce qui concerne la définition d’une pandémie : à cette date, les critères de morbidité et de mortalité ont disparu.
En revanche, les contrats conclus avant la pandémie continueront à être mis en œuvre dès que l’Organisation mondiale de la santé décrètera un niveau d’alerte 6, puisqu’ils courent jusqu’en 2011 ou 2012.
La décision de procéder à une vaccination barrière est présentée comme éthique. Le Gouvernement s’est fondé sur la déclaration du professeur Flahault, le 12 mai 2009, selon laquelle l’épidémie de grippe pourrait tuer 30 000 personnes en France. Or une étude réalisée aux États-Unis sur la mortalité due à la grippe depuis 1900 montre que la létalité de la grippe saisonnière ne cesse de diminuer. Par ailleurs, on ne peut comparer la grippe A(H1N1) et la grippe espagnole, survenue en 1918, au lendemain de la Grande Guerre, quand on ne disposait ni d’antibiotiques ni de structures hospitalières. Enfin, était-il « éthique » de la part de M. Flahault de déclarer, le 12 mai 2009, que « chaque nation va décider de sa politique et cela ne va pas être triste car il n’y aura pas de vaccins pour tout le monde » ?
M. Roger Salamon. Je ne nie pas que certains éléments du dossier méritent d’être mieux compris afin d’en tirer des leçons pour l’avenir, mais le haut conseil n’est compétent sur aucun des points que vous avez soulevés, monsieur Bapt.
M. Jean-Pierre Door, rapporteur. Aux trois cent douze décès causés par la grippe A(H1N1) qu’a cités Gérard Bapt, il faut ajouter un grand nombre – que l’on estimait à 1 300 au 20 avril dernier – de malades sévères qui ont dû être hospitalisés et dont certains sont encore en réanimation.
Monsieur Roger Salamon, avez-vous la possibilité de répondre aux nombreuses questions qui sont posées sur internet et aux multiples positions que d’aucuns y prennent à propos de la grippe A(H1N1) ?
M. Roger Salamon. Non.
M. le rapporteur. La Haute Autorité de santé, que préside M. Degos, peut émettre un avis ; pourquoi le haut conseil ne le peut-il pas ?
M. Roger Salamon. Tous nos avis peuvent être consultés sur notre site mais nous ne sommes pas en relation avec le grand public. Nous recevons des courriels mais, généralement, nous n’y répondons pas parce qu’ils ne contiennent pas de questions. Nous aurions peut-être le droit de donner notre avis mais nous n’avons ni l’envie, ni la possibilité technique de le faire.
M. le président Jean-Christophe Lagarde. C’est selon moi une erreur : quand surviennent des polémiques, comme sur le syndrome de Guillain-Barré, si vous ne répliquez pas et n’expliquez pas, dans le monde d’internet, vous êtes comme mort et il ne sert plus à rien de publier vos avis.
M. Michel Lejeune. Vous avez parlé de la puissance des lobbies anti-vaccins. Pouvez-vous nous en dire plus ?
M. Roger Salamon. Ces lobbies anti-vaccins sont très puissants : comme tous les extrémistes, même s’ils ne sont pas nombreux, ils savent très vite faire parler d’eux.
J’avais déjà pu mesurer leur pouvoir lorsque j’ai été désigné comme expert sur la vaccination anti-hépatite B et le risque de sclérose en plaques. J’ai travaillé pendant un an avec Mme Bertella-Geffroy.
L’exemple le plus frappant de l’intervention des lobbies anti-vaccins dans le cas de la grippe A(H1N1) est la publication dans tous les médias, le jour même où la ministre de la santé s’est fait vacciner devant les caméras, d’informations sur le prétendu risque d’être victime du syndrome de Guillain-Barré du fait de la vaccination.
Cela m’a d’ailleurs empêché de vacciner l’équipe de France de rugby de passage à Paris avant une rencontre contre les Samoans : dans l’avion qui amenait l’équipe de Toulouse à Paris, David Marty a téléphoné à sa femme, qui est infirmière, et celle-ci lui a fortement déconseillé de se faire vacciner en raison du risque de syndrome de Guillain-Barré associé à la vaccination. Résultat : à l’exception de deux joueurs, tous ont refusé de se faire vacciner…
Mme Catherine Génisson. Ne pensez-vous pas que si les médecins généralistes avaient été associés, non seulement à la vaccination, mais également à l’information et à la communication, le poids des lobbies aurait été moins important ?
M. Roger Salamon. Permettez-moi, là encore, de vous répondre très franchement. Mon père était médecin généraliste. J’ai toujours rêvé de l’être. Ma fille et mon neveu le sont. Or je considère que les médecins généralistes, d’une manière générale, se sont comportés de façon indigne.
On se plaint déjà du coût élevé de la vaccination ; si les généralistes y avaient été associés dès le début, elle aurait coûté trois fois plus cher, aurait été impossible à gérer et il n’aurait pas été possible d’en assurer la traçabilité. Mais je ne suis pas économiste, mieux vaudra que vous posiez votre question à une personne plus compétente.
Quant à la communication, il n’était pas nécessaire que les généralistes soient habilités à vacciner pour s’en charger. Or non seulement ils n’ont pas relayé la position du Gouvernement auprès de leurs patients, mais encore ils l’ont combattue, ce qui est assez ahurissant et décevant. Le fait qu’après avoir dissuadé les gens de recourir à la vaccination, ils l’aient prônée quand il leur a été permis de s’en charger confirme mon jugement...
Enfin, je considère que les professionnels de santé dans les hôpitaux se sont comportés de manière anormale, voire inadmissible.
Mme Catherine Génisson. Ma qualité de médecin me pousse à réagir à vos propos. Même si les médecins ont été exclus du dispositif parce qu’on estimait que, dans une pandémie planétaire, ils avaient mieux à faire que de s’occuper de médiation, d’information et de communication sur la vaccination, comment pouvez-vous leur demander d’être vertueux quand ils étaient mis de côté et considérés comme quantités négligeables alors qu’ils sont un maillon très important de la chaîne des soins, que ceux-ci soient préventif ou curatifs ?
M. Philippe Vitel. Alors qu’on avait décidé une vaccination barrière pour laquelle on avait commandé 94 millions de doses pour vacciner 70 % de la population avec deux doses, on a mis en place un système de vaccination bancal d’où étaient exclus à la fois le maillage de la médecine classique et le secteur hospitalier. Ne voyez-vous pas là une incohérence ?
M. Roger Salamon. Il me paraît difficile de confier à des médecins généralistes une vaccination de masse avec des vaccins multidoses qui ne se gardent qu’une journée, une liste prioritaire à respecter et une traçabilité à assurer. Un généraliste pourra difficilement vacciner plusieurs personnes dans la journée et, en tant que praticien libéral, je le vois mal se plier à des règles. C’est la conclusion à laquelle avait abouti la réflexion menée au sein du ministère de la santé, à laquelle avaient participé de nombreux médecins. Cela aurait été beaucoup trop coûteux.
M. Gérard Bapt. Savez-vous combien a coûté l’injection au bout du compte ?
M. Roger Salamon. Je dis que cela aurait été trop coûteux parce qu’il aurait fallu disposer de vaccins monodoses ou jeter la moitié ou les deux tiers des flacons qui n’auraient pas été utilisés par les généralistes.
Mme Catherine Génisson. C’est ce qui s’est passé dans les centres de vaccination !
M. Roger Salamon. Quoi qu’il en soit, depuis quand les médecins ont-ils besoin que le ministre de la santé leur dise ce qui est bon pour leurs patients ?
M. le président Jean-Christophe Lagarde. Autant je suis d’accord avec vous, monsieur Salamon, pour dire que, quelles que soient les frustrations ressenties par les médecins généralistes d’avoir été écartés de la vaccination, leur rôle était de conseiller leurs patients,…
M. Roger Salamon. … et de faciliter l’action du Gouvernement !
M. le président Jean-Christophe Lagarde. … autant je trouve votre affirmation quant à l’incapacité des généralistes à gérer une vaccination et à regrouper des patients un peu catégorique.
M. Philippe Vitel. En tout cas, votre raisonnement ne s’applique pas au milieu hospitalier, qui réunit toutes les conditions que vous avez citées. Pourquoi a-t-il été exclu du dispositif ?
M. Roger Salamon. Vouliez-vous que l’on vaccine dans les hôpitaux ?
M. Philippe Vitel. C’est mieux que dans un gymnase ou une salle de spectacle !
M. le président Jean-Christophe Lagarde. Avec des fonctionnaires des impôts pour assurer la traçabilité !
Mme Catherine Génisson. Quant au gaspillage lié à l’utilisation de vaccins multidoses, on pourrait en parler longtemps…
M. le président Jean-Christophe Lagarde. Nous avons découvert, la semaine dernière, que les répartiteurs pharmaceutiques ont distribué 5 millions de doses alors qu’on nous explique que 6 millions de personnes ont été vaccinées.
M. Roger Salamon. Premièrement, contrairement aux médecins généralistes, les personnels hospitaliers n’ont jamais demandé à être associés à la vaccination. Au contraire. Ils étaient déjà suffisamment impliqués à leur goût puisqu’au début de l’épidémie, toute personne atteinte de la grippe était systématique hospitalisée en réanimation ou orientée vers le service d’aide médicale urgente.
Deuxièmement, compte tenu des difficultés que connaissent déjà les hôpitaux et des listes d’attente qui existent dans tous les services, sans parler des urgences, demander aux hôpitaux de vacciner aurait eu pour conséquence de les déstabiliser gravement.
M. le président Jean-Christophe Lagarde. Nous vous remercions, monsieur Roger Salamon.
La séance est levée à dix-huit heures quarante-cinq.
Audition de M. le Professeur Marc Gentilini,
professeur émérite des maladies infectieuses et tropicales
à l’hôpital de La Pitié-Salpêtrière, président honoraire et membre de l’Académie nationale de médecine et membre du Conseil économique, social et environnemental,
et de M. le Professeur François Bricaire,
chef du service maladies infectieuses et tropicales à l’hôpital de La Pitié-Salpêtrière
(Procès-verbal de la séance du mardi 11 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures quarante-cinq.
(M. Marc Gentilini et M. François Bricaire prêtent successivement serment.)
M. le président Jean-Christophe Lagarde. Je vous propose, messieurs, que nous en venions directement aux questions que les membres de la commission souhaitent vous poser.
M. Jean-Pierre Door, rapporteur. Messieurs, vous nous direz tous deux ce que vous avez pensé de la gestion de l’épidémie de grippe H1N1. Mais, pour commencer, professeur Gentilini, vous avez écrit que le problème majeur en cette affaire vous a paru être le bon usage du principe de précaution. Quel pourrait être selon vous un bon usage de ce principe ?
M. Marc Gentilini, professeur de médecine, spécialiste des maladies infectieuses. Vous ne commencez pas par la question la plus simple. Nous savons tous d’où est né le principe de précaution et comment il a progressivement dérivé. Il est grand temps à la fois que les instances scientifiques prennent position publiquement et que le Parlement s’intéresse de près à cette question. Le principe de précaution, initialement conçu pour protéger de risques mal définis ou inconnus, est aujourd’hui invoqué à tout bout de champ afin de prendre les précautions maximales sans savoir ni où l’on va ni quel sera le prix à payer, ce qui me paraît une dérive grave. Les membres de l’Académie de médecine et de l’Académie des sciences désapprouvent d’ailleurs ce que l’on a fait de ce principe, devenu un « machin » qui entrave la science et la recherche, et partant bloque le progrès. Tel n’était pas du tout l’esprit de ceux qui l’ont fait inscrire dans la Constitution – place qui, soit dit au passage, est discutable. Je souhaite, pour ma part, que s’engage une réflexion sur le bon usage de ce principe.
M. le président Jean-Christophe Lagarde. Ce qui s’est passé dans le cadre de l’épidémie de grippe H1N1 vous paraît-il une dérive ?
M. Marc Gentilini. Je suis mal à l’aise pour vous répondre car j’ai conscience que le poste de ministre de la santé est particulièrement exposé dans une société comme la nôtre et que je ne veux pas critiquer ceux qui sont chargés de prendre les décisions. Toujours est-il qu’on a pris des précautions extrêmes…
M. le président Jean-Christophe Lagarde. Vous avez parlé de « pandémie de l’indécence ».
M. le rapporteur. Et « de la démesure »…
M. Marc Gentilini. Déjà en juin, je trouvais que l’on en faisait beaucoup trop autour de cette grippe, notamment par rapport à la multitude des problèmes sanitaires qui se posent dans le monde. C’est l’Organisation mondiale de la santé qui a lancé l’alerte. Peut-être faudrait-il redéfinir le rôle de cette organisation. Quoi qu’il en soit, il ne serait pas mauvais de lui rappeler de temps à autre que son rôle est de s’occuper des problèmes de santé dans l’ensemble du monde, pas seulement dans l’Europe privilégiée. Déjà alors, je trouvais les mesures prises indécentes face aux milliards de personnes qui souffrent encore de la faim et aux millions de celles qui meurent encore chaque année du paludisme, dans l’indifférence la plus totale. Pour quelque 370 morts imputables à la grippe H1N1 dans notre pays, on aura dépensé un milliard et demi d’euros, si l’on additionne le coût de toutes les mesures. Pour un nombre sensiblement équivalent de sans-abri morts dans la rue, pas un sou en revanche ! C’est disproportionné, indécent et insupportable.
Je mesure combien il est difficile pour un responsable politique de prendre la bonne décision. Je ne pense d’ailleurs pas que les coupables en cette affaire soient avant tout les politiques, mais les experts. Tout cela a été une arnaque sanitaire et économique…
Mme Catherine Génisson. Une arnaque tout court !
M. Marc Gentilini. Une arnaque médiatique aussi. Les politiques ont été victimes des pressions qu’ils ont subies. Vu le nombre de morts alors annoncé – de 30 000 à 60 000 dans l’année –, je comprends que la ministre de la santé ait pu être effrayée et céder aux pressions d’un entourage peu critique pour appliquer le principe de précaution. Je désapprouve totalement ces positions car pour moi, le rôle des responsables n’est absolument pas celui-là.
M. François Bricaire, professeur de médecine, spécialiste des maladies infectieuses à l’hôpital de La Pitié-Salpêtrière. Le principe de précaution était au départ un bon principe, tout à fait justifié dans une société moderne comme la nôtre qui a les moyens de prévoir certaines risques, de s’organiser pour y parer au mieux et de protéger la population. Mais dès lors que la menace est inconnue, il existe incontestablement un risque de dérive. Dans des sociétés exigeantes, à juste titre, les décideurs peuvent être obligés de prendre des mesures pouvant paraître disproportionnées. Dès lors que le virus de la grippe H1N1 s’est révélé moins virulent qu’on ne l’attendait, cette démesure est devenue évidente. Mais c’est là tout le problème d’un risque inconnu. Si celui-ci se révèle finalement faible, le dispositif mis en place peut apparaître surdimensionné. S’il se révèle, hélas, fort, et que le dispositif a été par chance bien dimensionné, chacun s’en félicitera, mais s’il a été sous-dimensionné, chacun déplorera que l’on n’ait pas fait davantage.
M. le président Jean-Christophe Lagarde. La grippe nous paraissait une maladie assez bien connue et maîtrisée. Or, au fil de nos auditions, nous nous apercevons qu’elle ne l’est pas autant que nous le croyons. Toute pandémie grippale risquant de s’inscrire dans le même contexte d’incertitude, ne serait-il pas utile que la population sache mieux de quoi il est question ? L’ensemble du corps médical a-t-il d’ailleurs la même position à ce sujet ? Il est surprenant par exemple que les médecins se soient assez largement fait vacciner, les infirmières beaucoup moins. Pensez-vous que dans le cadre de la préparation à d’autres pandémies, de gravité variable, il soit possible de réduire l’incertitude ?
M. François Bricaire. Contrairement à ce que l’on pense, la grippe est assez mal connue, du corps médical comme des citoyens. Elle est mal connue car trop banale, ou plutôt parce qu’elle a été banalisée, le terme même de grippe étant souvent utilisé à tort. En dépit d’un très grand nombre de travaux scientifiques sur le sujet, il demeure énormément d’inconnues sur les virus de la grippe, multiples et dont la plasticité est telle qu’il est impossible de prévoir quoi que ce soit de fiable en matière d’évolution de l’infection. On sait que des épidémies se succèdent, que de temps à autre se déclenchent des pandémies après la mutation substantielle d’un virus, que la population n’a donc pas rencontré antérieurement et contre lequel elle n’est donc pas protégée. Mais on ne sait jamais quel type de virus sera responsable de l’épidémie ou de la pandémie ni quand celles-ci se déclencheront. Ce qui s’est passé l’année dernière est emblématique. On s’attendait plutôt à l’attaque d’un virus aviaire, l’Organisation mondiale de la santé ayant alerté, à juste titre, sur une épizootie, devenant panzootie, de grippe aviaire H5N1, dont le virus pouvait s’adapter à l’homme. Or, c’est finalement un virus H1N1 qui a frappé. Il nous faut donc faire preuve de la plus grande modestie. Pour ma part, j’en reste à ce que m’a enseigné l’un de mes anciens maîtres, le virologue Claude Hannoun : « en matière de grippe, on se trompe tout le temps. » Ne pensez pas que ce soit là une dérobade. Je veux seulement dire que nous devons continuer à travailler et affiner nos connaissances épidémiologiques afin de mieux appréhender le phénomène lorsqu’il apparaît, mieux évaluer son extension potentielle et déterminer les meilleurs moyens de le contrôler.
Il est un point sur lequel je diverge quelque peu d’un autre de mes maîtres, le professeur Gentilini : je ne pense pas, moi, que l’on en ait fait trop de fin avril à juin dernier. Il fallait faire ce qui a été fait.
M. le président Jean-Christophe Lagarde. Pourquoi ?
M. François Bricaire. Fin avril, des cas de décès avaient été recensés au Mexique, et attribués, à tort ou à raison, à la grippe. Face à la gravité apparente de ces cas et une extension très rapide de la maladie, il fallait réagir vite et faire dans notre pays ce qui était prévu dans le plan « pandémie grippale », à savoir activer les plans de surveillance, alerter les centres référents ainsi que les hôpitaux chargés, avec l’aide du service d’aide médicale urgente, le SAMU, d’accueillir les premiers malades. Ce plan avait déjà fait ses preuves. Les Canadiens, qui ne disposaient de rien d’analogue, l’avaient regretté lors de l’épidémie de syndrome respiratoire aigu sévère, le SRAS, à Toronto.
M. le président Jean-Christophe Lagarde. Quand le dispositif avait-il fait ses preuves en France ?
M. François Bricaire. En 2003, lors de l’épidémie de SRAS, mais aussi dans le cas d’autres pathologies infectieuses moins contagieuses et lors de l’épisode de l’envoi de lettres contaminées au bacille du charbon, qui avait fait craindre des attaques bioterroristes.
M. le président Jean-Christophe Lagarde. Il paraît normal lorsqu’on ne connaît pas bien un risque de faire le maximum pour y parer. Tout le problème est de parvenir à décélérer lorsqu’on se rend compte qu’il n’était pas aussi grave qu’on le craignait. Or, les plans ne prévoient pas de décélération. Toute pandémie annoncée risque donc d’enclencher la même mécanique. Dans l’incertitude, on sort l’artillerie lourde sans possibilité de revenir en arrière, semble-t-il.
M. François Bricaire. Je suis tout à fait d’accord. Je suis certain qu’une prochaine pandémie conduirait à la même stratégie, avec la mise en place, à mon avis nécessaire, d’un dispositif aussi lourd au début. On pourrait imaginer de partir doucement et de monter en puissance selon la virulence de l’agresseur. L’inverse me paraît néanmoins plus raisonnable. Face à un agresseur annoncé comme dangereux, on a frappé fort et il fallait frapper fort. Tout le problème en effet a été de ne pas pouvoir décélérer rapidement. Il faut non seulement adapter en permanence nos connaissances, mais aussi pouvoir faire preuve de souplesse, ce qui a précisément fait défaut. Il était ahurissant à un moment que des personnes soient hospitalisées pour des symptômes ne justifiant nullement une hospitalisation en milieu confiné. Lorsque nous l’avons fait remarquer, on nous a fait valoir qu’il n’était pas sûr que ces patients auraient pu avoir accès de manière satisfaisante à du Tamiflu dans le cadre d’une prise en charge en ville ni que les médecins de ville auraient été prêts à les recevoir, alors qu’on ignorait la virulence du virus. Il y a nécessairement un temps de latence entre la perception d’un phénomène, sa connaissance et une réaction adaptée de la part des décideurs.
M. le rapporteur. Si l’incertitude prévalait au début de l’épisode viral, on a ensuite mieux connu le virus. Vous aviez dit, professeur Gentilini, devant l’Office parlementaire d’évaluation des choix scientifiques et technologiques, qu’il faudrait renoncer à utiliser le mot « pandémie » – sans nous dire d’ailleurs par lequel le remplacer. Ce terme est-il encore justifié ?
M. Marc Gentilini. Il ne s’agit pas de le remplacer, mais de lui redonner son sens véritable. J’appartiens à une génération qui savait ce qu’était une pandémie. Le mot, à juste titre, faisait peur, désignant une maladie meurtrière frappant l’ensemble du monde. Mais il n’y a pas si longtemps, avant toutefois cette épidémie de grippe H1N1, l’Organisation mondiale de la santé a modifié sa définition d’une pandémie, estimant que seule la rapidité de la dissémination devait être prise en compte. Je ne partage pas cet avis. Une maladie infectieuse non ou peu meurtrière, qui ne fait que se répandre vite, n’est pas selon moi une pandémie mais seulement une épidémie mondiale. Vaccinant naturellement ceux qui la contractent, elle les dispense d’ailleurs de se faire vacciner ultérieurement.
Il semble que dans la prise en charge de la grippe H1N1, on se soit trompé de guerre. On a utilisé les plans élaborés pour lutter contre la grippe H5N1.
M. le rapporteur. La France n’est pas la seule à s’être trompée.
M. Marc Gentilini. Certes, mais étant Français, je connais mieux ce qui s’est passé en France.
Mme Catherine Génisson. Le professeur Gentilini a raison, on a utilisé contre cette possible pandémie de grippe H1N1, les plans prévus contre la grippe H5N1, sur lesquels le Gouvernement avait beaucoup travaillé. Or, on a très rapidement su que le virus H1N1 n’avait pas, en tout cas a priori, la même virulence que le H5N1.
L’Organisation mondiale de la santé doit-elle, selon vous, messieurs, demeurer l’organisation sanitaire de référence sur le plan mondial, tant en matière d’information que de plans d’action ? Comment fonctionne-t-elle et quel rôle a-t-elle joué exactement ? Vous semblez dénoncer son armada d’experts…
Vous avez tous deux regretté le manque de souplesse des plans mis en œuvre. C’est certain mais dans le même temps, il y a eu, à plusieurs reprises, d’étranges ruptures. De mai à juin, la mobilisation, notamment des centres 15, a été extrême et des hospitalisations sans doute indues ont eu lieu avant que, du jour au lendemain, ces mesures ne soient stoppées, sans que soit donnée à l’appui de ce changement total de cap la moindre explication scientifique ou épidémiologique. Il en a été de même lors de la fermeture des centres de vaccination, décidée elle aussi du jour au lendemain, davantage, semble-t-il, devant leur manque de fréquentation que sur la base de données scientifiques. Le message adressé à nos concitoyens s’en est trouvé brouillé, au point de devenir illisible, et ne les a finalement pas « éduqués » à la gestion d’une épidémie. Or, le principe de précaution ne concerne pas que les experts mais aussi chacun de nos concitoyens.
M. Marc Gentilini. La création de l’Organisation mondiale de la santé honore l’ensemble du monde politique international. Je défends cette organisation, mais pas telle qu’elle fonctionne actuellement. Les États y sont représentés, sur un plan politique, mais c’est la direction générale qui agit, entourée d’une armada d’experts monopolisant l’information et prenant seuls les décisions, ce qui est profondément regrettable. Songez que dans certains pays, on est toujours à ce jour au stade 6 d’alerte. Heureusement qu’en France, Mme Roselyne Bachelot-Narquin n’a pas cédé à Mme Margaret Chan et n’a pas décrété le passage au stade 6. C’eût été aberrant, alors l’on frôlait déjà la démesure ! En fait, cette bonne institution est actuellement mal dirigée : Mme Margaret Chan, excellente spécialiste de santé publique, qui connaît plus particulièrement les grippes et virus associés, et a été formée à Hong-Kong, a complètement pollué l’Organisation mondiale de la santé. Pour ma part, je souhaiterais qu’après le coût faramineux de cette opération internationale qui s’est soldée par un lourd échec, elle quitte la tête de l’organisation. D’ailleurs, si Mme Margaret Chan avait le respect d’elle-même, elle soumettrait sa démission à la prochaine assemblée générale. Alors que l’Organisation devrait être le phare sanitaire de l’humanité, elle s’est trompée et elle a trompé. Il faut faire preuve d’une extrême sévérité, afin que cela ne se reproduise pas.
Pour le reste, oui, on a manqué dans notre pays de souplesse, se contentant d’appliquer les plans prévus pour la grippe H5N1, sans analyser plus avant ce qui s’était passé dans l’hémisphère Sud. Or, plusieurs publications en attestaient dès juin, on était loin de l’apocalypse annoncée ! Hélas, jamais ceux qui défendaient un scénario moins pessimiste n’ont été entendus. En dépit de mes prises de position publiques qui auraient pu appeler l’attention des décideurs politiques, jamais le ministère de la santé n’a pris contact avec moi, pas plus qu’il n’a consulté l’Académie nationale de médecine. Il existe quantité d’organismes comme le Haut conseil de santé publique, la Haute Autorité de santé, l’Institut national de veille sanitaire, et bien d’autres. Mais cet excès d’instances, toutes très onéreuses, ne finit-il pas par entraver une bonne diffusion de l’information jusqu’au tissu sanitaire du de proximité ? Ne constituent-elles pas un mauvais filtre ?
Certains dispositifs ont en effet été arrêtés du jour au lendemain sans aucune explication. Se souvient-on qu’à un moment, l’Organisation mondiale de la santé avait établi une liste de onze opérations nécessaires pour bien se laver les mains – ce qui, soit dit au passage, n’avait aucun sens pour les un à deux milliards de personnes qui, de par le monde, n’ont pas accès à l’eau potable ! La vaccination telle qu’organisée, qu’on l’admette ou non, a été un échec. Si on avait procédé à une vaccination ciblée, en mobilisant tout le réseau sanitaire, elle aurait probablement été une réussite. Je n’ai pas de leçons à donner à quiconque mais je réagis en tant que citoyen, un peu plus au fait que d’autres de ces questions. Je n’aimerais pas que si c’était à refaire, on refasse la même chose, comme l’ont dit certains décideurs, notamment le directeur général de la santé. Je pense, pour ma part, qu’une réflexion est nécessaire et j’espère que votre commission d’enquête invitera à définir une nouvelle expertise mobilisant aussi la société civile. Toute décision sanitaire intéressant l’ensemble de la communauté ne peut rencontrer de succès que si on l’y a préalablement intéressée et associée, notamment par le biais du réseau des médecins généralistes. Une aussi mauvaise information et une aussi mauvaise communication ne doivent pas se reproduire.
M. le président Jean-Christophe Lagarde. Même si, face à l’incertitude qui existait au départ, on avait déclenché l’artillerie lourde et commandé 94 millions de doses de vaccins, pensez-vous qu’il aurait été possible en cours de route de décider de ne procéder qu’à une vaccination ciblée, au vu de ce qui s’était passé dans l’hémisphère Sud, en expliquant en toute honnêteté à la population que l’épidémie serait moins grave qu’on le craignait bien qu’elle puisse, comme la grippe saisonnière, être dangereuse pour certaines populations qui devaient, elles, se faire vacciner ?
M. Marc Gentilini. Pour avoir connu en Afrique des campagnes de vaccination massive imposées, j’en sais toute la difficulté. La quasi totalité des vaccinations généralisées à l’ensemble de la population se sont soldées par des échecs. Ce qui réussit, ce sont les vaccinations ciblées. Si on avait fait ce choix-là, la vaccination aurait été mieux comprise, mieux dispensée et mieux acceptée par la population. Il aurait suffi de commander douze à quinze millions de doses, ce qui aurait permis de vacciner largement toute la population scolaire et tous les groupes à risques comme les femmes enceintes. On a au contraire sorti la Grosse Bertha contre une grippe que d’aucuns ont qualifiée comme on le sait…
M. le président Jean-Christophe Lagarde. Ne pensez-vous pas qu’en prenant position, avec d’autres, en faveur d’une vaccination ciblée, vous avez contribué aux réticences de nos concitoyens à se faire vacciner ?
M. Marc Gentilini. On ne m’a pas demandé mon avis.
M. le président Jean-Christophe Lagarde. Vous l’avez exprimé publiquement.
M. Marc Gentilini. J’ai dénoncé l’achat d’emblée de 94 millions de doses de vaccins, et je maintiens ma position. La commission d’enquête du Sénat m’a demandé ce que j’aurais fait si j’avais été à la place de la ministre de la santé. En aucun cas, je n’aurais commandé autant de vaccins. Le 30 août 2005, Dominique de Villepin, alors Premier ministre, avait annoncé l’achat de 200 millions de masques et confirmé celui de 130 millions de comprimés de Tamiflu. Par ailleurs, avaient été commandés deux millions de doses de vaccins contre le virus non muté de la grippe H5N1 et réservés quarante millions de doses contre le virus muté. Les décisions prises à l’époque, alors même que le danger était beaucoup plus important, étaient beaucoup plus sages que celles prises à l’emporte-pièce face à la grippe H1N1. Je ne sais pas qui est responsable des choix faits l’année dernière mais c’étaient à l’évidence de mauvais choix.
M. François Bricaire. Je voudrais revenir un instant sur la définition de la pandémie. Une pandémie, c’est la dissémination d’un agent infectieux dans l’ensemble du monde, en tout cas sur une zone géographique très large, deux continents au moins, sans nécessairement de gravité potentielle. Toute l’ambiguïté réside dans le fait que nos concitoyens sont persuadés qu’une pandémie est mortelle.
M. Marc Gentilini. Cet aspect fait partie des caractéristiques d’une pandémie.
M. François Bricaire. Non, il peut y avoir des pandémies bénignes. Mais cela, personne ne veut l’entendre ! Une pandémie de grippe, c’est la diffusion d’un nouveau variant viral qu’on ne connaît pas et qui se répand très largement.
M. le rapporteur. Vous n’êtes pas d’accord sur la définition du terme de pandémie.
M. Marc Gentilini. L’Organisation mondiale de la santé en a modifié la définition.
M. Gérard Bapt. Permettez-moi de lire les définitions qu’elle en donnait avant et après le 1er mai 2009. La mention « with enormous numbers of deaths and illnesses » a disparu après cette date. Pourquoi ? Des documents de l’organisation évoquaient aussi alors les centaines de milliers de morts que ferait la pandémie. « Même dans l’hypothèse la plus modérée, on dénombrera au bas mot jusqu’à 233 millions de consultations, cinq millions d’hospitalisations et sept millions de décès. » Pourquoi la notion de morbidité/mortalité
a-t-elle disparu à un moment donné ?
M. François Bricaire. Je maintiens ma définition, tout en reconnaissant qu’il y a eu un sérieux problème de communication, ayant conduit à de mauvaises interprétations, qui n’ont pas été sans incidence sur les décisions prises.
Il est tout à fait vrai qu’on a extrapolé ce qui était préparé contre la grippe H5N1 à la grippe H1N1. Pour travailler depuis longtemps sur la question des infections émergentes, j’ai toujours trouvé regrettable qu’on se focalise sur un agent infectieux particulier pour élaborer un plan de prévention. À partir de structures générales de base, on pourrait adapter dans chaque cas la réponse aux caractéristiques de l’agent viral en cause, qu’il s’agisse de sa virulence, de ses capacités d’extension géographique, de sa létalité potentielle et des moyens thérapeutiques disponibles.
Le virus H5N1 était en effet potentiellement très dangereux mais les cas de décès constatés chez l’homme, imputables au H5N1, résultaient tous d’un virus aviaire. La virulence d’un virus mutant, capable de transmission interhumaine, n’était absolument pas connue.
Mme Catherine Génisson. Toutes les contaminations de l’animal à l’homme avaient toujours donné lieu, semble-t-il, à au moins un décès.
M. François Bricaire. Il s’agissait du virus aviaire. Mais ce n’est pas celui-là qui était redouté pour provoquer une pandémie chez l’homme. Ce qu’on craignait et dont on ignorait les conséquences potentielles, c’était la mutation du virus aviaire.
M. le président Jean-Christophe Lagarde. On ne savait d’ailleurs pas si la mutation augmenterait ou diminuerait la létalité.
M. François Bricaire. Je ne m’exprimerai pas, pour ma part, sur l’Organisation mondiale de la santé. Le professeur Marc Gentilini a fort bien dit tout le bien qu’il fallait penser d’une manière générale de l’existence d’une telle organisation, même si sa gestion peur prêter à critique. Elle a certes géré de manière très vite alarmiste la grippe H1N1. Je ne dis pas cela pour la défendre, mais je rappelle néanmoins que lorsqu’est déclenché le seuil 6 d’alerte, des mesures, notamment administratives, sont prises qui facilitent la tâche des laboratoires pharmaceutiques et leur permettent d’accélérer la fabrication des vaccins.
M. Marc Gentilini. Tout à fait. L’un n’est peut-être pas indépendant de l’autre…
M. François Bricaire. Chaque pays peut faire ce qu’il souhaite en fonction de ses moyens. Il faut se féliciter que la France ne soit pas passée au stade 6. Mais que l’Organisation mondiale de la santé l’ait décidé, elle, pour des raisons qui la regardent, on peut à la rigueur le comprendre.
Mme Catherine Génisson. L’organisation aurait dysfonctionné par excès dans l’application du principe de précaution, avez-vous dit. Peut-on éliminer toute arrière-pensée dans sa position comme dans les discours des différents experts ?
M. François Bricaire. Je ne sais pas répondre à cette question.
M. le président Jean-Christophe Lagarde. Le déclenchement d’une alerte de niveau 6 facilite la fabrication accélérée des vaccins par les laboratoires. Puisque nous réfléchissons aux moyens d’améliorer les choses dans le futur, plutôt que de « contraindre » l’organisation à déclencher une telle alerte pour obtenir la livraison de vaccins dans des délais raisonnables, peut-être pourrions-nous, nous, trouver les moyens de faciliter les procédures sans que l’on ait à aller jusque là. Serait-ce utile ?
M. François Bricaire. Oui, surtout au niveau international, car il est franchement déraisonnable de devoir déclencher une alerte de niveau 6 pour mettre en place des plans de prévention, qui devraient pouvoir être déployés même en cas de maladie infectieuse bénigne.
M. le rapporteur. C’est l’application stricte du règlement sanitaire international, validé par tous les États, dont la France.
M. le président Jean-Christophe Lagarde. À la lumière de cette expérience, peut-être ce règlement pourrait-il être modifié. Notre pays pourrait précisément porter un message en ce sens.
M. Gérard Bapt. Le représentant de l’État français, M. Didier Houssin, directeur général de la santé, votera-t-il en faveur du renouvellement du mandat de Mme Margaret Chan ?
M. le rapporteur. Nous avons d’autres représentants, en la personne notamment du secrétaire exécutif du groupe stratégique consultatif d’experts sur la vaccination, M. Philippe Duclos.
M. Gérard Bapt. Vous nous avez dit, Monsieur François Bricaire, que la dangerosité potentielle du virus H1N1 est demeurée longtemps mal connue. Mais il faut reprendre les choses à l’origine. L’épidémie serait partie de La Gloria au Mexique, dans un élevage porcin – d’où le nom initial de grippe mexicaine ou porcine. La première souche a toutefois été isolée en Californie. Il y a eu beaucoup de morts parmi les animaux du fait notamment de leurs conditions d’élevage. On devrait d’ailleurs peut-être aider le Mexique à construire des stations d’épuration et les éleveurs mexicains à se débarrasser de leurs animaux morts sans polluer la nappe phréatique.
Dans le bulletin épidémiologique hebdomadaire de l’Organisation mondiale de la santé du 22 mai 2009, il est fait état de 45 cas mortels au Mexique, mais à cette date, l’épidémie est pratiquement terminée dans ce pays. À La Gloria, le pic a eu lieu fin avril. Sur la base de ces seuls 45 morts au Mexique, pays aux conditions sanitaires précaires, avec toutes les fragilités qui peuvent s’ensuivre pour la population, on déclenche une alerte sanitaire mondiale. Voilà ce que je ne peux pas comprendre, pas plus que le fait qu’on se soit interrogé encore en décembre en France sur la létalité de ce virus. Sur quelles bases a-t-on décidé d’une telle stratégie vaccinale et d’une telle mobilisation des États ? Au moment même où l’organisation mondiale de la santé s’alarmait, le responsable du Center for Disease Control and Prevention aux États-Unis déclarait, lui, que cette grippe tuait moins qu’une grippe saisonnière. Voilà la question à laquelle nous aimerions que soit apportée une réponse afin qu’une prochaine fois, notre ministre de la santé, quel qu’il soit, ne soit pas placé dans la même situation que celle dans laquelle s’est retrouvée Mme Roselyne Bachelot-Narquin, avec notamment le professeur Antoine Flahault qui, trois jours avant la commande des vaccins à GlaxoSmithKline, le 12 mai 2009, déclarait qu’il y aurait « au bas mot, 30 000 morts en France. » Je comprends que, devant de telles affirmations, la ministre ait décidé de faire le maximum. Soit dit au passage, je suis choqué qu’un professeur exerçant des responsabilités de si haut niveau nous ait dit, lorsque nous l’avons auditionné, que son seul conflit d’intérêts potentiel était l’emploi de sa femme au groupement « Les Entreprises du médicament », le LEEM, alors que la commission d’enquête sénatoriale lui a fait avouer qu’il siégeait au conseil scientifique de cet organisme. Il ne nous l’a pas dit, semble-t-il, parce que ce conseil a été dissous en février dernier. Il n’empêche que durant toute l’épidémie, il en était membre, et qu’il va en tout état de cause l’être de l’organe appelé à lui succéder.
La stratégie adoptée en France repose-t-elle sur le moindre élément scientifique ? Y a-t-il eu beaucoup plus de morts en Pologne, pays qui n’a pas vacciné ? Il y en a eu 132 en France, selon l’Institut national de veille sanitaire, dont 50 qui n’avait aucune pathologie associée. C’est, hélas, toujours trop, mais c’est moins que le nombre de tués sur la route en un mois ou de suicides chez les jeunes. Ce que je déplore, c’est ce consensus intellectuel, cette « pensée unique » des experts qui travaillent en circuit fermé sans entendre ce que dit la société. Dès le mois de mai 2009, les généralistes avaient compris, aux dires de leurs homologues de l’hémisphère Sud, que cette grippe ne serait pas grave. Et on nous dit qu’on n’en savait rien encore en juillet-août, ou plus tard même ! C’est cela qui interpelle, encore davantage que les ratés de la gestion de la pandémie sur le plan national, qui pourraient toujours être corrigés une autre fois. C’est à la source qu’il faut éviter que puissent se reproduire de tels errements.
M. François Bricaire. Je ne voudrais pas avoir l’air de défendre qui que ce soit. Je vous réponds sur la base d’éléments que j’espère les plus scientifiques possible. Il est vrai que le Mexique a initialement déclaré des décès imputés finalement à tort à la grippe. La surveillance épidémiologique dans ce pays n’est pas aussi facile et donc fiable que dans d’autres. Quoi qu’il en soit, à ce stade, on craignait une pandémie qu’on voyait, j’allais dire enfin, arriver…
M. Gérard Bapt. « Enfin », c’est exactement cela !
M. le président Jean-Christophe Lagarde. J’ai moi aussi le sentiment qu’on attendait tellement une pandémie que lorsque celle-ci est arrivée, on s’est dit que c’était la bonne !
M. François Bricaire. Tout à fait. Et il y a bel et bien eu pandémie.
M. le président Jean-Christophe Lagarde. Mais pas la pandémie mortelle, attendue, redoutée – ou espérée – par les spécialistes !
M. François Bricaire. Chacun devrait s’en réjouir.
M. Marc Gentilini. Il faut voir comment l’information était traitée au journal télévisé de 20 heures et dans la presse – il est un grand quotidien du matin que je ne peux plus lire tant m’a choqué la manière proprement scandaleuse dont y a été relatée l’épidémie de grippe A. Pendant des mois, la désinformation a succédé à la désinformation. On annonçait presque avec délectation les morts, surtout quand, « enfin », il y en avait un sans pathologie ni facteur de risque associés. Il ne faut pas que cela puisse se reproduire.
M. François Bricaire. Nous en sommes d’accord. Les médias ont exprimé des regrets, les scientifiques j’en suis moins sûr. Il n’y a pas eu le nombre de morts attendus – pour ne pas dire souhaités. On a en effet pu se demander à un moment si certains ne souhaitaient pas des morts pour justifier le dispositif mis en place.
Cela étant, dans l’incertitude, il était normal de se mobiliser. Il est difficile de savoir si un virus, toujours potentiellement mutant, ne mutera pas. Souvenons-nous qu’en 1918, la première vague de grippe espagnole au printemps avait été bénigne et que ce n’est qu’après la mutation du virus, que la seconde vague à l’automne fut aussi meurtrière.
M. Gérard Bapt. Est-on sûr que c’était le même virus ?
M. François Bricaire. A priori, oui.
M. Gérard Bapt. Avait-on clairement identifié la souche virale en 1918 ?
M. François Bricaire. Non, on ne savait pas le faire. Mais nous avons aussi l’expérience des épisodes de 1957 et 1968.
M. Marc Gentilini. Les antibiotiques n’existaient pas encore en 1918 et sans doute la majorité des victimes de la grippe espagnole sont mortes non pas du virus lui-même, mais de complications pulmonaires bactériennes, liées aux pneumocoques.
M. le rapporteur. En outre, du fait de la guerre, la population souffrait également de dénutrition, ce qui la fragilisait.
M. François Bricaire. C’est toutefois en Amérique du Nord que la grippe espagnole a fait le plus de victimes alors que c’est en Europe que la population avait le plus souffert. Mais en effet, ce sont bien des surinfections pulmonaires qui tuaient l’essentiel des grippés, en particulier âgés, alors que les plus jeunes étaient plus atteints par le virus.
M. Gérard Bapt. Ne vaudrait-il donc pas mieux vacciner à large échelle contre les pneumocoques ?
M. François Bricaire. Je suis un farouche partisan de la vaccination contre le pneumocoque, notamment pour les sujets fragiles ou à risques.
M. le président Jean-Christophe Lagarde. Messieurs, nous vous avons beaucoup interrogé sur les virus, beaucoup moins sur ce que vous avez constaté de cette grippe dans le cadre de vos fonctions. Vous avez certainement reçu à l’hôpital des patients infectés par ce virus. Quelles atteintes avez-vous directement observées ? Quelles propositions auriez-vous à faire ?
Par ailleurs, la multiplicité des autorités sanitaires amenées à se prononcer, chacune sur le seul aspect du problème pour lequel elle est sollicitée, ne finit-elle pas par être dommageable, notamment en matière de communication ? Ne serait-il pas utile de regrouper certaines de ces autorités ?
M. François Bricaire. Dans le service de maladies infectieuses que je dirige à La Pitié-Salpêtrière, j’ai en effet reçu un certain nombre de cas, initialement des cas suspects qui se sont ou non confirmés, mais qui, en tout cas, étaient tous bénins.
M. le président Jean-Christophe Lagarde. Vous n’avez pas eu à traiter de syndrome de détresse respiratoire aigu ?
M. François Bricaire. Non, mon service n’étant pas équipé pour ce faire. Plus tard, lorsque les patients étaient traités en ville, nous en avons reçu quelques-uns plus sévèrement atteints qui nécessitaient une hospitalisation pour gêne respiratoire ou troubles neurologiques. Mais pas plus d’une centaine de patients n’ont été hospitalisés dans mon service pour cause de grippe. En revanche, en tant que « responsable grippe » à La Pitié-Salpêtrière, j’ai été amené à travailler avec mes collègues réanimateurs. Et il y a eu des malades hospitalisés en réanimation pour syndrome de détresse respiratoire aigu, avec parfois nécessité de mise en place d’une assistance respiratoire extracorporelle. Seuls les cardiologues peuvent le faire et c’est donc le service de réanimation cardio-vasculaire qui a été très sollicité, et non le service de réanimation pneumologique comme attendu. Au total, ont été hospitalisés un nombre limité de malades présentant une grippe bénigne et un nombre faible de malades beaucoup plus sévèrement atteints, dont certains sont décédés.
M. le président Jean-Christophe Lagarde. Les antiviraux étaient-ils efficaces ?
M. François Bricaire. Oui, s’ils avaient pu être pris très tôt, dès l’apparition des premiers symptômes. Dans les formes sévères, il était trop tard pour en donner aux patients lorsqu’ils arrivaient à l’hôpital.
M. Marc Gentilini. L’Académie de médecine, dont l’approche est transversale, devrait permettre de dépasser les difficultés que pose l’approche, toujours sectorielle, des autres autorités sanitaires, structures plutôt verticales. Toutefois, la Haute Autorité de santé ou le Haut conseil de santé publique, de par le nom même qui leur a été donné, devraient eux aussi avoir une vue globale. Il serait bon de dresser l’inventaire de toutes ces instances, de savoir à quoi elles servent exactement, combien elles coûtent et s’il n’y a pas des redondances, ce qui me paraît à évident.
Lorsque j’ai remis au Gouvernement en avril 2009 le Plan national Santé Environnement 2 – PNSE 2 – que j’avais élaboré, j’ai incidemment demandé comment il s’articulait avec tous les autres. Je vous remets la liste de tous les plans mis en œuvre par le ministère de la santé, qu’il serait intéressant que vous examiniez de plus près. Je suis sidéré par les dysfonctionnements d’un ministère aussi important !
Le milliard et demi d’euros dépensés en France pour cette grippe est à mettre en regard par exemple des 145 000 euros dont dispose l’attaché sanitaire auprès de l’Ambassadeur de France au Viêt-Nam pour toute l’année 2010 contre les 91 millions de dollars de son homologue aux États-Unis. Un milliard et demi d’euros, c’est aussi deux fois le montant des crédits du plan Cancer, lequel n’est doté que de 750 millions d’euros pour la période 2009-2013. Faut-il rappeler aussi, dans un autre ordre d’idées, que l’ensemble des ambassades françaises dans le monde n’ont pour conduire l’ensemble de leurs activités, que 82 millions d’euros ? On ne peut qu’être effaré lorsqu’on porte le regard au-delà de l’Hexagone, comme nous devrions tous le faire. Plus d’esprit critique serait nécessaire et si je suis heureux de payer des impôts, je le serais encore davantage si cet argent était bien utilisé !
Je suis très inquiet de tous ces dysfonctionnements. Je vous supplie donc, messieurs les parlementaires, de faire en sorte que pareil épisode ne se reproduise pas à l’automne prochain. Il est, hélas, à craindre que les mêmes équipes n’aient les mêmes réflexes et que l’on retombe donc dans les mêmes travers.
Mme Catherine Génisson. À quelles conditions le Tamiflu est-il efficace contre la grippe et, bien prescrit, peut-il empêcher l’évolution vers les formes plus sévères, rares mais très graves ?
M. François Bricaire. Comme la plupart des antiviraux, les anti-grippaux comme le Tamiflu et le Relenza d’ailleurs, ne sont efficaces que lors de la phase d’intense multiplication du virus qui suit immédiatement l’infection. Dans l’absolu, le Tamiflu est efficace contre la grippe, certes pas à 100 %, mais, prescrit dans les premières heures, son efficacité est de 70 à 80 %. Prescrit dans les quarante-huit heures, elle tombe à moins de 50 % et au-delà, elle devient quasi-nulle. Peut-il éviter les formes graves de la grippe ? Oui, en théorie, s’il a été administré assez tôt. De nombreuses discussions ont d’ailleurs eu lieu pour savoir s’il fallait en donner systématiquement ou non à titre préventif. Pour des patients dont la situation risquait de s’aggraver, attendre pour en prescrire représentait potentiellement une perte de chance.
M. le président Jean-Christophe Lagarde. Je vous remercie, messieurs les professeurs, de votre participation à nos travaux.
La séance est levée à vingt heures.
Audition de M. Paul Castel,
directeur général des hospices civils de Lyon,
président de la conférence des directeurs généraux
de centres hospitaliers régionaux et universitaires
(Procès-verbal de la séance du mardi 11 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à vingt heures.
(M. Paul Castel prête serment.)
M. le président Jean-Christophe Lagarde. On nous a précédemment indiqué que la vaccination s’était remarquablement bien déroulée à Lyon et, plus généralement, dans le département du Rhône, et que les relations entre l’administration préfectorale, les administrations locales, les représentants du monde médical et les milieux hospitaliers avaient été très bonnes. Même si vous n’avez pas été directement impliqué, pouvez-vous nous dire, à partir de cette expérience, quelles sont les clés d’une vaccination réussie ?
M. Paul Castel, directeur général des hospices civils de Lyon, président de la conférence des directeurs généraux de centres hospitaliers régionaux et universitaires. Je ne sais pas si les choses se sont remarquablement bien passées, mais j’ai le sentiment qu’il y a eu un gros investissement et un engagement civique de tous les acteurs ainsi que, au sein des quinze établissements des hospices civils de Lyon, une forte mobilisation du corps médical, des personnels soignants et de tous nos partenaires internes et externes afin de faire face à une charge de travail importante. Le préfet délégué à la sécurité avait organisé un système de pilotage hebdomadaire avec un responsable médical et un responsable soignant et à aucun moment, lors de ces réunions, je n’ai senti, en dépit de certaines périodes de saturation, le moindre sentiment de « ras-le-bol ».
Je crois aussi que le message est bien passé au sein des hospices civils grâce à l’engagement personnel d’éminents médecins qui nous ont aidés à mobiliser la communauté médicale et soignante. Le taux de vaccination des médecins a ainsi dépassé 60 %, tandis qu’il était de 26 % chez les infirmières et les aides soignants, chez qui nous nous sommes heurtés à un certain scepticisme, d’ailleurs relayé par les syndicats, au motif que le mot d’ordre venait de la direction et que la vaccination aurait en fait été destinée à éviter de trop nombreux arrêts de travail…
Au cours de cette période, les internes, les étudiants et les élèves infirmiers ont eu une attitude formidable.
Nous avons par ailleurs accompli un important travail d’organisation, en coopération avec les autorités départementales – si ce n’est à leur place – pour ce qui avait trait au planning.
M. le président Jean-Christophe Lagarde. Il nous a déjà été rapporté que des internes et les étudiants en médecine avaient parfois été contraints de suppléer le personnel des directions régionales des affaires sanitaires et sociales.
M. Paul Castel. Certains ajustements techniques ont été nécessaires. Nous avons eu des discussions et le préfet nous a écoutés, mais il est vrai que nous disposions d’une certaine expérience et que notre implication a sans doute permis d’améliorer la réactivité. Nous voulions aussi éviter une certaine désorganisation qui aurait pu conduire à ce qu’un interne volontaire trouve le centre de vaccination fermé au moment où il s’y présentait.
M. le président Jean-Christophe Lagarde. Vos services n’ont donc pas été désorganisés, en particulier parce que vous vous êtes impliqués dans l’organisation du dispositif, allant parfois jusqu’à vous substituer aux autorités.
M. Paul Castel. Nous ne nous sommes pas substitués aux autorités, avec lesquelles nous avons travaillé en parfaite complémentarité. Nous avons apporté notre expérience et nos capacités aux exécutants parce que nous sentions qu’il était parfois nécessaire, sur le plan technique, que nous intervenions à leur place, par exemple dans l’établissement des plannings, tout simplement parce qu’il s’agissait davantage de nos métiers que des leurs.
La situation a parfois été tendue dans les centres, notamment au début quand les files d’attente étaient importantes et il nous a alors fallu mobiliser davantage de personnel, sans que cela ne désorganise à aucun moment le fonctionnement de l’hôpital.
Avec le recul, je me réjouis que l’hôpital n’ait pas été appelé à intervenir immédiatement dans la vaccination car cela aurait davantage provoqué des dysfonctionnements majeurs, avec l’annulation d’une partie de notre activité et des conséquences pour les consultations et les urgences. Je craignais beaucoup de telles situations qui, fort heureusement, ne se sont pas produites.
M. Jean-Pierre Door, rapporteur. Les centres de vaccination étaient donc en dehors de l’hôpital. Vous y avez envoyé régulièrement des internes et des étudiants. Ces derniers n’ont-ils jamais rechigné à s’y rendre ?
Par ailleurs, à quelle date avez-vous commencé à pratiquer des vaccinations au sein des hôpitaux ?
M. Paul Castel. Les vaccinations hospitalières ont été ouvertes au public dès le 9 décembre 2009. Mais auparavant, nous avions déjà ouvert la vaccination aux familles et aux proches des personnels soignants, même lorsqu’ils se présentaient sans bon de vaccination. Il nous semblait en effet essentiel de vacciner ces personnes dont le nombre n’a pas été négligeable.
M. le président Jean-Christophe Lagarde. Le directeur général de l’Assistance Publique - Hôpitaux de Paris nous a dit sensiblement la même chose : au-delà des personnels soignants, avant ou juste après le lancement de la campagne de vaccination générale, on a vacciné à l’hôpital des personnes qui n’avaient pas reçu de bon puisqu’elles n’étaient pas prioritaires et qui venaient de leur propre initiative.
Certes, cela s’est aussi produit dans les centres de vaccination, mais on ne comprend du coup pas bien ce que vous nous dites quant au risque de perturbation de votre activité : cette dernière aurait-elle été davantage affectée quand vous envoyiez vos internes dans des centres de vaccination extérieurs ou si vous leur aviez demandé d’y consacrer un peu de leur temps, au sein de votre établissement ?
M. Paul Castel. C’est pour l’essentiel sur la base du volontariat que médecins et internes se sont rendus dans les centres de vaccination. Nous nous organisions afin que leurs plages horaires de travail au sein de l’hôpital soient assurées par eux-mêmes ou par des personnes qui se substituaient à eux.
M. le président Jean-Christophe Lagarde. Cela aurait donc pu être fait au sein de l’hôpital où ils exerçaient.
M. Paul Castel. Non, car à l’hôpital il fallait continuer à accueillir les urgences, qui sont, chaque année, au nombre de 315 000 au sein des hospices civils de Lyon, auxquelles s’ajoutent 70 000 urgences pédiatriques. Nous avons pu maintenir notre organisation du travail tout en consacrant des moyens humains à la vaccination. Tout n’a pas été idyllique, mais les choses se sont globalement bien passées alors que, quand le cabinet de la ministre et le préfet nous ont demandé de prévoir la vaccination dans nos établissements, nous avons véritablement craint de ne pas pouvoir maintenir simultanément nos activités, ne serait-ce que parce que la vaccination exigeait des locaux.
M. le président Jean-Christophe Lagarde. Il s’agissait donc d’un problème immobilier.
M. Paul Castel. Non, cela aurait exigé aussi du personnel administratif…
M. le président Jean-Christophe Lagarde. Il aurait suffi que le personnel qui s’est rendu dans les gymnases se rendît à l’hôpital. Et, pour la population, il paraît plus normal de se faire vacciner à l’hôpital que dans un gymnase…
M. Paul Castel. Peut-être, mais cela aurait fait peser un risque sur le fonctionnement de l’hôpital. Là, les choses se sont faites de façon pragmatique et étalée, et je porte un jugement positif sur cet étalement.
M. le rapporteur. À la fin du mois de décembre et au début du mois de janvier, lorsque l’on a organisé les vaccinations intra-hospitalières, vous avez bien dû mettre des locaux à disposition. Il aurait suffi de le faire plus tôt…
M. Paul Castel. Bien que les hospices civils et la préfecture l’aient annoncée dans la presse, la vaccination intra-hospitalière n’a pas drainé vers l’hôpital le même flux que lors du pic de la demande dans les gymnases. Ainsi, à l’hôpital Édouard Herriot, il nous a suffi d’aménager rapidement un bâtiment. Mais même cela n’a pas été sans difficulté : à l’arrivée des premiers patients, le préfet délégué à la sécurité et moi-même avons constaté que l’accès des personnes handicapées n’était pas possible.
Je ne dis pas qu’il est impossible de vacciner à l’hôpital, mais cela nécessite une organisation particulière et risque, notamment en début de période hivernale, de se conjuguer avec nos difficultés habituelles liées aux affluences aux urgences, à l’insuffisance de lits et au manque de fluidité faute de place en soins de suite.
M. le président Jean-Christophe Lagarde. Votre appréciation diffère radicalement de celle du directeur de l’Assistance Publique-Hôpitaux de Paris et cela alimentera notre réflexion.
M. le rapporteur. Avez-vous été amenés à envoyer des internes et des externes en dehors de l’agglomération lyonnaise ? Pouvez-vous par ailleurs nous indiquer comment s’est passée l’indemnisation de ces personnels ?
M. Paul Castel. Nous nous sommes rapidement mis d’accord avec l’autorité préfectorale pour limiter la mobilité de notre personnel au Grand Lyon et à la proche périphérie. En dehors de quelques dépannages très ponctuels, nous ne sommes ainsi pas allés jusque dans l’Ain, département pour lequel nous nous sommes tournés vers l’hôpital de Bourg-en-Bresse. Nous nous sommes également mis d’accord avec les hôpitaux de Villefranche-sur-Saône et de Valence. De la sorte, il n’y a pas eu de problèmes de déplacement.
M. le président Jean-Christophe Lagarde. Tout cela a donc été négocié au sein de votre comité de pilotage hebdomadaire. Tel n’a manifestement pas été le cas à Paris, ce qui a conduit à envoyer des personnels assez loin.
M. Paul Castel. En effet, nous nous sommes mis d’accord avec la direction départementale des affaires sanitaires et sociales.
Cette dernière ayant parfois été un peu lente à valider les certificats de service fait, qui seuls permettent aux comptables publics d’effectuer des paiements, il y a eu quelques retards dans l’indemnisation. Mais cela n’a pas suscité de récriminations.
Nous avons d’ailleurs beaucoup insisté auprès des autorités sur la nécessité de ne pas décourager les jeunes médecins volontaires.
M. Gérard Bapt. Les répartiteurs pharmaceutiques nous ont dit qu’ils vous avaient livré les doses de vaccin, mais qu’ils n’avaient pas récupéré celles qui n’avaient pas été utilisées. Les détenez-vous toujours en stock où les avez-vous rapatriées vers l’Établissement de préparation et de réponse aux urgences sanitaires ? Pouvez-vous nous indiquer le nombre de vaccins qui vous ont été livrés et de ceux que vous conservez en stock ?
M. Paul Castel. Je ne dispose pas ici des chiffres, mais je pourrai vous les communiquer ultérieurement et vous indiquer plus précisément ce que sont devenus les vaccins non utilisés.
M. le président Jean-Christophe Lagarde. Préalablement à la vaccination, les hôpitaux ont été approvisionnés en masques et en antiviraux. Comment les choses se sont-elles passées ? Avez-vous été informés préalablement ? Vous a-t-on fait payer tout cela ?
Au-delà, la grippe A(H1N1) a-t-elle eu pour les établissements de santé un coût qu’il leur faut désormais assumer ?
M. Paul Castel. On nous a livré de grandes quantités de ces matériels, sans véritable évaluation préalable de nos besoins, mais en concertation avec les équipes de nos pharmacies pour la localisation des livraisons. Cette préparation en amont a évité des difficultés.
S’agissant du coût de l’opération, nous avons perçu une première dotation de 400 000 euros, mais nous avons demandé un complément car nous estimons que le coût global, incluant celui des examens biologiques, a atteint 2,9 millions d’euros.
M. le président Jean-Christophe Lagarde. S’agit-il uniquement des prélèvements biologiques qui ont été pendant un temps systématiquement réalisés pour vérifier que les patients étaient effectivement atteints de la grippe A(H1N1), ou aussi des examens auxquels on a procédé ultérieurement, lorsque l’épidémie s’est développée et que l’on a renoncé à cette détection systématique ?
M. Paul Castel. Nous avons communiqué à l’agence régionale de santé le coût de l’ensemble des examens biologiques liés à la grippe A(H1N1) ; je suis dans l’incapacité de dire s’ils ont été plus importants lors de la période à laquelle vous avez fait référence.
M. le rapporteur. A-t-on procédé à un dosage biologique pour tous les patients ?
M. Paul Castel. Je l’ignore. Mais je vous communiquerai le détail, en distinguant les deux périodes.
M. le président Jean-Christophe Lagarde. Avez-vous aujourd’hui la possibilité d’utiliser les masques et les produits hydro-alcooliques stockés à l’occasion de l’épidémie ?
M. Paul Castel. Je vérifierai le nombre de masques toujours en stock. Nous en avions d’ailleurs déjà auparavant et il y a donc un problème de péremption. Sans doute pourrons-nous en écouler un peu, mais je ne puis vous dire dans quelle proportion.
M. le président Jean-Christophe Lagarde. Au total, pensez-vous que les modalités retenues par les pouvoirs publics pour la campagne de vaccination ont été satisfaisantes et efficaces ?
M. Paul Castel. Globalement, oui. Il est facile de dire a posteriori que les choses auraient pu être mieux faites, mais on ignorait comment la situation allait évoluer et on a logiquement agi dans un souci de précaution. Vues depuis l’hôpital public, je trouve que les choses se sont bien passées. En tant que président de la conférence des directeurs généraux de centres hospitaliers régionaux et universitaires, j’ai d’ailleurs interrogé mes collègues à ce propos et la quinzaine d’entre eux qui m’a répondu partage mon évaluation positive.
Les réunions hebdomadaires, voire bihebdomadaires, ont facilité la coordination et évité, du moins à Lyon, toute opposition entre les services de santé et la préfecture.
M. le président Jean-Christophe Lagarde. Aujourd’hui, la campagne de vaccination semble avoir été un échec parce que l’on a vacciné bien moins de personnes qu’on ne le prévoyait. Pensez-vous qu’il serait possible d’améliorer certaines choses si nous devions affronter à nouveau une pandémie conduisant à vacciner une part importante de la population ?
M. Paul Castel. On a pu constater des lourdeurs, en particulier dans les procédures mises en œuvre par l’Assurance maladie, dont on peut comprendre qu’elles visaient à garantir la sécurité mais qui ont été trop administratives, ont pris beaucoup de temps et ont entraîné des erreurs. Ainsi, l’idée que les choses étaient compliquées s’est répandue de bouche à oreille et cela a eu un effet dissuasif. Il y aurait sans doute là des choses à changer.
Peut-être pourrait-on aussi envisager d’impliquer les établissements de soins privés, même si l’hôpital public a tiré une certaine fierté d’être appelé à exercer ces missions de service public.
Nos craintes d’être submergés se sont révélées assez largement injustifiées : nous n’avons pratiquement pas été amenés à déprogrammer nos activités.
M. le président Jean-Christophe Lagarde. Peut-être parce qu’il y a eu peu de cas graves…
M. Paul Castel. En effet : il y a eu dix décès à Lyon.
Nous étions parfois à la limite de nos capacités en réanimation, mais nous avons reçu des dotations satisfaisantes en équipements de respiration et nous n’avons jamais été en situation de rupture.
M. le président Jean-Christophe Lagarde. Globalement, assez peu de personnes ont été hospitalisées par rapport à ce que l’on pouvait craindre. Or, vous nous dites que vous étiez à la limite de la rupture : que se serait-il passé si vous aviez dû accueillir des milliers de personnes en détresse respiratoire comme on l’annonçait ?
M. Paul Castel. Il aurait fallu déprogrammer et décaler une série d’activités qui ont quand même été réalisées au cours de cette période. Nous y avions été préparés à l’occasion de simulations, qui se sont déroulées au cours de la première phase du plan de lutte contre la pandémie grippale, d’avril à la fin du mois de juillet, à partir des informations en provenance de l’hémisphère Sud, mais nous n’y avons pas été acculés. C’est aussi au cours de cette première phase que nous avons, à la demande du ministère de la santé, organisé le pilotage des opérations et mobilisé nos équipes.
Nous sommes ensuite passés à une phase plus active et plus opérationnelle, en particulier avec l’acheminement des médicaments. La phase suivante a été celle de la vaccination des personnels et des populations à risque, avant que nous en venions à la vaccination externe.
M. le rapporteur. Je suppose qu’en tant que président de la conférence des directeurs généraux de centres hospitaliers régionaux et universitaires, vous avez eu des contacts avec vos collègues. Ces derniers partagent-ils l’impression que vous venez de nous livrer ?
M. Paul Castel. En effet, nous avons eu des échanges, dont je pourrai vous transmettre la teneur. On y retrouve peu ou prou ce que je viens de vous dire, la situation n’ayant pas paru particulièrement compliquée dans les grandes métropoles, à l’exception de Paris.
M. le président Jean-Christophe Lagarde. Merci beaucoup, professeur, d’avoir participé à cette audition.
La séance est levée à vingt heures quarante-cinq.
Audition de M. John Ryan,
chef de l’unité « Menaces sur la santé » au sein de la direction générale de la santé de la Commission européenne,
de M. Patrick Le Courtois,
membre de l’Agence européenne du médicament,
et de M. Denis Coulombier,
membre du Centre européen pour la prévention et le contrôle des maladies
(Procès-verbal de la séance du mercredi 12 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures quinze.
M. le président Jean-Christophe Lagarde. Je remercie tous les participants d’avoir répondu à l’invitation de la commission d’enquête parlementaire sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1) en France.
Je signale aux membres de la commission que, bien entendu, il a été demandé à un représentant de l’Organisation mondiale de la santé de bien vouloir exposer la stratégie de celle-ci devant la commission, au besoin par visioconférence. Mais, après réflexion, l’Organisation mondiale de la santé a décliné l’invitation. Je le regrette profondément : un acteur essentiel des campagnes de vaccination, leur « déclencheur », ne s’exprimera pas devant nous et n’aura donc pas l’occasion d’expliquer sa stratégie, ce qui risque d’alimenter certaines suspicions.
Il nous a été indiqué qu’il était de tradition, pour cette organisation, de ne jamais répondre aux commissions parlementaires nationales et qu’elle menait ses propres enquêtes. Cette réponse n’est guère satisfaisante !
M. Gérard Bapt. Le Parlement européen, lui, a pu mener une enquête.
M. le président Jean-Christophe Lagarde. En revanche, d’autres ont bien voulu se déplacer et c’est avec eux que nous allons aborder la question des recommandations internationales en matière de lutte contre les pandémies, notamment contre la grippe A(H1N1).
Messieurs, je vous propose de décrire votre rôle, notre commission attendant aussi de vous un avis, nourri des différentes expériences nationales, sur l’organisation de la campagne de vaccination en France et sur son bilan, que nous avons estimé suffisamment décevant pour nous pencher sur la question.
M. John Ryan, chef de l’unité « Menaces sur la santé » au sein de la direction générale de la santé de la Commission européenne. Je remercie votre commission de m’offrir la possibilité de présenter la position de la Commission européenne concernant de la gestion de la pandémie au niveau de l’Union européenne.
Permettez-moi de rappeler tout d’abord les compétences de la Commission européenne en matière de santé publique et de gestion des crises sanitaires. Depuis 1999, l’Union européenne dispose d’une législation qui a instauré un système d’information mutuelle. Les États membres sont ainsi tenus de s’informer réciproquement et de coordonner leurs dispositifs pour quarante-neuf maladies transmissibles identifiées.
Toutefois, le traité sur l’Union européenne ne prévoit pas d’harmonisation en matière de santé publique. Les seules exceptions concernent le sang et les organes, qui sont considérés comme des marchandises pouvant circuler d’un pays à l’autre et pour lesquels le traité prévoit la possibilité d’une législation imposant certains niveaux de sécurité. Dès lors, la responsabilité de la gestion des crises sanitaires incombe principalement aux États membres.
Par ailleurs, le règlement sanitaire international de l’Organisation mondiale de la santé a valeur de traité international et tous les États membres y sont parties contractantes. En matière de maladies transmissibles, nous avons établi un lien entre les déclarations faites au niveau communautaire et celles faites au niveau de l’Organisation mondiale de la santé : si un État déclare une infection à cette dernière, le système communautaire en est informé en même temps, et vice versa.
Après les attaques terroristes perpétrées aux États-Unis en 2001, le Conseil des ministres de l’Union européenne a mis en place un comité de sécurité sanitaire pour répondre au risque d’utilisation d’agents pathogènes. Ce comité a également compétence pour la préparation des pandémies grippales.
Il faut enfin mentionner deux agences pouvant jouer un rôle important dans la gestion des crises sanitaires. Il s’agit, d’une part, du Centre européen pour la prévention et le contrôle des maladies dont le siège se trouve à Stockholm. Représenté ici par le docteur Coulombier, il a la responsabilité de l’analyse des risques et suggère les stratégies à prendre en cas d’infection. Il s’agit, d’autre part, de l’Agence européenne du médicament dont le siège est à Londres et qui représentée ici par le docteur Le Courtois. Ces deux agences appuient l’action des États membres et de la Commission européenne sur les plans législatif et de l’action communautaire.
J’en viens à la présentation des différentes étapes de la gestion de la crise de la grippe au niveau communautaire.
Nous avons été informés des premiers cas d’apparition du nouveau virus de la grippe par des contacts bilatéraux avec les États-Unis et le Mexique. Ces cas ont été confirmés quelques jours après par l’Organisation mondiale de la santé. La Commission européenne a immédiatement convoqué le comité de sécurité sanitaire afin de discuter de la situation, laquelle était encore assez vague puisqu’aucun cas n’était décelé en Europe. Il était absolument nécessaire de partager nos informations avec nos partenaires internationaux et avec l’Organisation mondiale de la santé.
M. le président Jean-Christophe Lagarde. Pourriez-vous préciser les dates ?
M. John Ryan. Les réunions du comité de sécurité sanitaire ont eu lieu immédiatement après que la Commission européenne eut reçu les informations. Elles sont devenues quotidiennes par la suite. Dans un souci de transparence, la Commission européenne a publié leur compte rendu sur son site internet.
Nous avons par ailleurs innové en convoquant, dans le même cadre, le comité réglementaire qui avait été créé par une décision communautaire relative aux maladies transmissibles. Nous avons pu ainsi adopter une définition des cas de grippe A(H1N1), ce qui a permis aux États membres de collecter des informations sur des bases identiques. Il s’agissait là plus d’une mesure de surveillance que d’une démarche d’harmonisation.
Ces réunions, auxquelles l’Organisation mondiale de la santé était systématiquement associée, ont permis aux États membres d’apprécier l’évolution de la transmission de l’infection par le virus et de considérer les mesures qui s’imposaient, par exemple pour les voyageurs en provenance des zones à risque ou qui souhaitaient s’y rendre, pour le traitement des personnes infectées dans l’Union européenne ou encore pour les mesures d’hygiène (lavage des mains, isolement des personnes infectées, port du masque...).
Dans un deuxième temps, nous avons mis en place un dispositif de surveillance communautaire qui nous a permis d’avoir une vision harmonisée de la transmission du virus au niveau de l’Union européenne.
Le comité de sécurité sanitaire a permis aux États membres de se mettre d’accord sur trois aspects importants de la gestion de la crise : la fermeture des écoles, qui faisait polémique à l’époque car on n’était pas certain de son efficacité, la prise en charge des ressortissants qui tombaient malades à l’étranger (fallait-il les traiter sur place ou les rapatrier) et la définition des groupes à risque qui devaient être vaccinés en priorité.
Pour ce qui est des stocks d’antiviraux, le plan pandémique de l’Union européenne, qui date de 2005, avait encouragé les États membres à en constituer en prévision d’une pandémie. Certains l’avaient fait, d’autres pas et ces derniers se trouvaient en situation de pénurie. De plus, certains avaient commandé des vaccins, d’autres ne l’avaient pas fait. La première démarche de la Commission européenne a consisté à aider les États membres à organiser leur approvisionnement lorsque leurs stocks étaient insuffisants. Nous nous sommes inspirés des appels d’offres existants et avons repris les exemples suédois, néerlandais et allemand.
La Commission européenne a pu ainsi répondre à l’appel à l’aide de la Bulgarie pour constituer un stock suffisant d’antiviraux. L’Union européenne a également mobilisé des stocks pour aider l’Ukraine, pays qui n’était absolument pas préparé.
Alors que le comité de sécurité sanitaire assurait la coordination de ces actions, le Conseil des ministres s’est réuni à quatre reprises et a adopté des conclusions publiques quant aux démarches à suivre. En septembre 2009, la Commission européenne a adopté une communication assortie de cinq documents de travail – eux aussi dans le domaine public – analysant, entre autres, les problèmes de communication avec le public ou de stratégie vaccinale.
La Commission européenne a également convoqué, au niveau ministériel, une réunion du G7 et du Mexique, qui s’est tenue en décembre.
Pour ce qui est de l’évaluation de la gestion de la crise, la Commission européenne a demandé dès le mois d’avril 2009 à une agence extérieure d’analyser l’action communautaire. Le premier rapport de cette agence est disponible. Le second, qui analyse plus particulièrement l’aspect vaccinal, est en préparation. Ils alimenteront tous deux les débats d’une conférence qui se déroulera les 1er et 2 juillet 2010, au début de la présidence belge de l’Union. Cette conférence sera suivie d’un Conseil des ministres informel les 5 et 6 juillet. Nous espérons que cette démarche d’évaluation, lancée dès l’année dernière « en temps réel », nous permettra de tirer quelques leçons et d’améliorer notre performance à l’avenir.
Le plan pandémique de l’Union européenne, qui date de 2005, doit être révisé à la lumière de ce que nous a appris cette crise. La Commission européenne a l’intention d’en proposer une mise à jour avant la fin de l’année.
Vous le voyez, nous essayons de tirer des conclusions le plus rapidement possible. Nous aimerions en outre intégrer les résultats des enquêtes menées aux différents niveaux (national, Conseil de l’Europe, etc.).
L’Organisation mondiale de la santé suit une démarche similaire visant à une révision de ses plans pandémiques, très critiqués pour ce concerne la déclaration de la pandémie. La Commission européenne souhaite pour sa part une approche concordante de cette organisation et de l’Union européenne concernant cette déclaration de pandémie. Nous voulons éviter que les annonces de Mme Margaret Chan à Genève ne soient pas suivies par l’Union européenne.
Nous nous employons donc à évaluer l’action menée dans les premiers mois de la pandémie, à en tirer les leçons, à travailler avec les instances nationales, telle votre commission d’enquête, et à examiner les mesures que l’on peut proposer au plan communautaire pour faire mieux la prochaine fois.
M. Denis Coulombier, membre du Centre européen pour la prévention et le contrôle des maladies. La création, en 2005, du Centre européen pour la prévention et le contrôle des maladies à Stockholm s’est faite sur proposition de la Commission européenne au Parlement européen à la suite de l’épidémie de SRAS (syndrome respiratoire aigu sévère) en 2003. Cette épidémie a fait apparaître un besoin de coordination technique et scientifique au niveau européen, à la fois pour soutenir les États membres et pour conseiller la Commission européenne face à des problèmes qui dépassent le cadre national.
Dès le départ, la préparation à la pandémie grippale a été l’une de nos priorités. La Commission européenne et l’Organisation mondiale de la santé procédaient déjà à des réunions annuelles consacrées à la coordination dans ce domaine. Nous avons engagé une revue des plans de préparation des pays de l’Union européenne ainsi que de la Norvège, du Lichtenstein et de l’Islande, mis au point un protocole d’évaluation, organisé le suivi de réunions régulières entre tous les partenaires et publié plusieurs rapports qui faisaient l’état des lieux de la préparation en Europe.
Ces rapports ont établi que l’Europe est une des régions du monde les mieux préparées à la survenue d’une pandémie grippale. Ils ont cependant mis en évidence que du travail restait à faire quant à la mise en œuvre opérationnelle de ces plans jusqu’au niveau le plus périphérique ou leur interopérabilité au sein de l’Union européenne.
Le centre, qui a pour mandat de détecter les maladies émergentes, dispose d’un système de contact et de suivi avec différents partenaires (le « renseignement épidémiologique », ou epidemic intelligence) qui fonctionne vingt-quatre heures sur vingt-quatre. Nous avons donc reçu très tôt – dès le 21 avril – les informations en provenance des États-Unis concernant l’occurrence de deux premiers cas véritablement documentés sur cette nouvelle souche de grippe que l’on ne pouvait identifier précisément. Nous avons rempli notre fonction de conseil en publiant une première évaluation le 23 avril – soit vingt-quatre heures après, compte tenu du décalage horaire –, laquelle a été remise à jour le lendemain. Le 24 avril, nous avons activé notre plan de crise. Bref, nous avons reconnu très tôt le potentiel pandémique de cette nouvelle souche et nous avons communiqué ces informations aux États membres et à différents partenaires à travers des mécanismes de coordination tels que le comité de sécurité sanitaire.
Dès le 25 avril, nous avons diffusé un rapport quotidien. Sans entrer dans le détail de notre action durant la pandémie, je précise que nous avons fourni des documents et présenté des options au fur et à mesure que les informations devenaient disponibles, en particulier au début de la pandémie, moment où l’on s’interrogeait sur sa sévérité au vu des données initiales en provenance du Mexique. Les connaissances ont évolué au cours des premières semaines.
M. Patrick Le Courtois, membre de l’Agence européenne du médicament. L’Agence européenne du médicament est une agence de l’Union européenne créée en 1995, après trente années d’harmonisation communautaire. En matière d’autorisations de mise sur le marché, elle prépare les avis scientifiques concernant l’évaluation des produits de santé, dans le cadre d’une procédure d’enregistrement appelée « procédure centralisée ». Ces avis donnent lieu à une décision de la Commission européenne après consultation des États membres. Depuis l’année dernière, le Parlement européen exerce un droit de regard sur les décisions de la Commission européenne en la matière.
Cette procédure européenne est obligatoire pour les produits issus des biotechnologies. C’est pourquoi elle s’est appliquée aux vaccins mock-up, ou vaccins maquettes, qui comportent, pour les vaccins initiaux, un procédé biotechnologique.
Certains produits destinés à différentes indications thérapeutiques ou certains types de médicaments peuvent également être soumis à la procédure centralisée.
L’agence ne dispose pas de ressources d’évaluation propres : elle s’appuie entièrement sur les ressources d’évaluation et d’expertise des autorités nationales d’enregistrement des médicaments. Elle fonctionne en réseau, avec plusieurs comités scientifiques.
L’un d’entre eux, le comité pour les médicaments à usage humain (Committee for medicinal products for human use, ou CHMP), a autorité pour émettre des avis scientifiques concernant l’autorisation de mise sur le marché des médicaments. Il est composé de délégués et de remplaçants nommés par les États membres, l’agence assurant son secrétariat administratif et scientifique.
D’un point de vue pratique, pour chaque dossier de demande d’autorisation de mise sur le marché, le comité désigne deux rapporteurs qui travaillent indépendamment. Les équipes d’évaluation et d’experts proviennent des agences nationales. Le comité prend ses décisions de façon collégiale et le plus souvent consensuelle, parfois en votant. Il s’appuie sur des groupes de travail, dont un qui est consacré aux vaccins et un autre qui évalue la qualité pharmaceutique des produits biologiques – ce qui inclut les vaccins. Le président du comité est un Français qui travaille à l’Agence française de sécurité sanitaire des produits de santé. Celui du groupe de travail sur les produits biologiques est également un Français travaillant pour l’Assistance publique-Hôpitaux de Paris. Celui du groupe de travail « vaccins » est allemand et travaille au Paul-Ehrlich Institut, l’autorité allemande en charge de l’enregistrement des produits biologiques.
L’évaluation des produits de santé au niveau européen est donc totalement ancrée dans l’expertise et l’évaluation nationales.
D’une manière générale, l’agence et le comité évaluent le rapport bénéfice/risque des médicaments, sans considération de leur rapport coût/efficacité, qui n’est pas de sa compétence. Ils ne font pas de recommandations sur les stratégies de vaccination, lesquelles restent du ressort des États membres. C’est pourquoi tous les résumés de caractéristiques des produits indiquent que l’on doit suivre les recommandations nationales en la matière.
L’agence a commencé à se préparer à la pandémie de grippe en 2003, en coordination avec la Commission européenne – en particulier la direction générale de la santé et de la protection des consommateurs –, l’Organisation mondiale de la santé et les autorités réglementaires. Elle a consulté l’association européenne des producteurs de vaccins tout au long du processus.
L’agence a participé aux travaux du comité de sécurité sanitaire et a commencé à publier dès 2004 des lignes directrices concernant les vaccins maquettes. Un plan d’action a été rendu public. Nous avons formé les évaluateurs des agences nationales à la procédure à mettre en œuvre et à l’évaluation des dossiers. Dès 2007, des recommandations en matière de pharmacovigilance et de gestion des risques étaient diffusées. Le premier vaccin maquette, le Focetria du laboratoire Novartis, a été autorisé en 2007. En 2008, nous avons mis en place un plan de continuité d’activité pandémique. Le deuxième vaccin maquette, le Pandemrix de GlaxoSmithKline, a été autorisé cette même année, de même que, au début de 2009 – juste avant le début de la pandémie –, le Celvapan du laboratoire Baxter.
Par ailleurs, en 2005, une modification de la législation pharmaceutique a introduit de nouvelles procédures réglementaires permettant une évaluation rapide des vaccins, en particulier les vaccins maquettes, en cas de pandémie.
Les recommandations du comité pour les médicaments à usage humain ont suivi trois principes.
Premièrement, en cas de pandémie, le vaccin devait être disponible le plus rapidement possible après l’identification du virus, mais nous devions disposer de suffisamment d’informations sur sa sécurité et sur son efficacité. C’est le cas des vaccins saisonniers, dont on connaît le mode de fabrication et pour lesquels la souche est modifiée de façon relativement simple chaque année. Le concept du vaccin maquette a consisté à autoriser un vaccin avant qu’une pandémie ne débute, en se plaçant dans l’hypothèse la plus contraignante, c’est-à-dire celle d’un virus pour lequel la population est naïve, d’où le choix de développer et de valider les vaccins à partir du virus de la grippe aviaire H5N1. Cette hypothèse a conduit à établir des critères biologiques d’efficacité plus sévères que pour les vaccins saisonniers.
Deuxièmement, il était nécessaire de disposer de suffisamment de vaccins dans une situation d’incertitude quant au rendement des souches virales pandémiques, donc de diminuer la quantité d’antigène nécessaire à leur production tout en maintenant une efficacité suffisante. Pour répondre à ces deux contraintes, il a été proposé que les vaccins soient adjuvantés : on diminuait ainsi par deux voire par quatre la quantité d’antigène par rapport à un vaccin saisonnier habituel.
Troisièmement, on devait disposer d’alternatives aux vaccins traditionnels cultivés sur œufs. D’où la proposition de développer des vaccins pandémiques sur des cellules, comme c’est le cas pour d’autres types de vaccins. C’est ce que le laboratoire Baxter a fait.
Les vaccins développés à partir du virus H5N1 ont été testés sur des populations naïves, c’est-à-dire des populations qui n’ont jamais été en contact avec le virus et qui n’ont donc aucune protection immunitaire. Les études ont montré que deux doses de vaccin étaient nécessaires pour atteindre une réponse immunologique suffisante.
Dès l’annonce de la survenue du nouveau virus, en avril 2009, l’agence a tenu des réunions téléphoniques quotidiennes avec la Commission européenne et le comité de sécurité sanitaire, ainsi que des téléconférences, plusieurs fois par semaine, avec l’Organisation mondiale de la santé et de nombreuses autorités réglementaires dans le monde, en particulier celles des États-Unis, du Canada et du Japon, avec lesquelles elle a passé des accords de confidentialité. Elle a également rencontré l’association européenne des producteurs de vaccins et chacune des firmes, de façon à déterminer ce que serait leur stratégie.
Après l’émission de recommandations en faveur d’un vaccin monovalent, formulées au début du mois de mai 2009, les firmes nous ont informés qu’elles demanderaient, pour ce qui concerne la procédure centralisée, l’autorisation d’utiliser trois vaccins maquettes et qu’elles déposeraient par ailleurs trois nouveaux dossiers devant être évalués selon une procédure d’urgence. L’agence ne disposait pas de dossier de vaccin saisonnier autorisé que l’on pût modifier, si jamais cette stratégie avait été proposée. On ne comptait que deux vaccins saisonniers, l’un qui n’était autorisé que pour les personnes âgées et un autre que la firme n’était pas en mesure de mettre en production. La question ne s’est donc pas posée.
Comme vous le savez, quatre autres vaccins ont été autorisés au niveau national, au-delà des vaccins maquettes.
Un vaccin nouveau non adjuvanté de Sanofi, initialement destiné à faire l’objet d’une autorisation selon la procédure centralisée, a finalement été autorisé selon la procédure décentralisée par la France qui a été le pays de référence, en novembre dernier.
L’agence a en outre émis un avis scientifique concernant deux nouveaux vaccins adjuvantés au début de l’année 2010.
En ce qui concerne les vaccins maquettes, elle a demandé aux firmes dès le mois de mai 2009 de réaliser des essais cliniques supplémentaires avec le virus A(H1N1) afin de valider le nombre de doses nécessaire, y compris dans les populations ou dans les tranches d’âge pour lesquelles on ne disposait pas encore de données pour le virus H5N1 – puisque les essais le concernant étaient en cours. L’agence leur a également demandé de mettre en place un suivi intensif de pharmacovigilance, un suivi de cohorte de 9 000 personnes vaccinées pour chaque produit, des registres de femmes enceintes et des études d’efficacité clinique – études auxquelles nous avons travaillé avec le Centre européen pour la prévention et le contrôle des maladies, qui a par ailleurs réalisé de telles études indépendamment des firmes.
Sur cette base, l’agence a rendu un avis positif, le 24 septembre 2009, pour les vaccins Focetria et Pandemrix incorporant le virus A(H1N1). Ces produits ont fait l’objet d’une décision de la Commission européenne cinq jours plus tard, selon une procédure exceptionnelle. Pour le vaccin Celvapan, l’avis a été rendu le 1er octobre, l’évaluation du dossier ayant pris plus de temps.
Pour ce qui est de la réduction de deux à un du nombre de doses de vaccin nécessaire pour les adultes, le comité a évalué les données au fur et à mesure que les firmes les fournissaient. Celles-ci ont déposé une demande en vue de cette réduction à la mi-octobre 2009, en se fondant sur des données très préliminaires. Le comité a, dès le mois d’octobre 2009, envisagé la possibilité de n’administrer qu’une seule dose, tout en continuant à recommander plus formellement deux doses. Ce n’est qu’en novembre, après avoir reçu des données scientifiques consolidées qui l’ont rassuré, qu’il a émis un avis favorable à l’administration d’une dose unique.
M. le président Jean-Christophe Lagarde. Pourriez-vous préciser la date de cet avis ? Cette information pourrait être utile, voire déterminante.
M. Patrick Le Courtois. Je vous la fournirai.
Pour le vaccin Celvapan, le comité a maintenu sa recommandation selon laquelle deux doses étaient nécessaires. Un comité d’experts indépendants des équipes d’évaluation nationales, que nous avons convoqué en février, a confirmé l’efficacité du produit et cette posologie.
L’agence a communiqué régulièrement et rapidement les informations relatives aux différentes étapes de la procédure, aux résultats de l’évaluation et aux recommandations du comité. Elle a créé une page internet dédiée aux vaccins et à la pandémie et a commencé à publier des informations dès le 29 avril 2009. Les autorités réglementaires nationales et le comité de sécurité sanitaire ont toujours été informés par avance de toute communication importante de l’agence.
Nous avons recueilli des informations en matière de pharmacovigilance dès que l’on a commencé à utiliser les vaccins et avons produit des rapports hebdomadaires à partir du début du mois de décembre 2009. Ces données ont, jusqu’à présent, montré une bonne tolérance aux vaccins contre la grippe A(H1N1). Leur efficacité biologique et immunologique a déjà été démontrée. Les données préliminaires des études d’efficacité clinique, produites au niveau national ou par le Centre européen pour la prévention et le contrôle des maladies, font apparaître une efficacité de l’ordre de 70 %. Une étude allemande publiée la semaine dernière conclut même à une efficacité de 98 %. Les résultats d’études de l’agence de protection sanitaire britannique, pour l’instant non publiés, sont eux aussi très prometteurs, y compris en ce qui concerne les enfants alors que les vaccins saisonniers ont une efficacité relative dans cette catégorie.
L’Agence européenne du médicament a engagé, elle aussi, une démarche interne d’évaluation de façon à se préparer à la conférence organisée par la présidence belge. Nous y avons associé le groupe des directeurs des agences réglementaires nationales. Nous nous concentrons sur les questions de procédure, opérationnelles et scientifiques. Cette pandémie a en effet soulevé un grand nombre de questions sur le plan scientifique. Nous pensons être en mesure de présenter nos propositions au début du mois de juillet.
L’agence travaillera avec ses partenaires institutionnels sur les modifications nécessaires de la procédure réglementaire et sur les recherches à effectuer, en concertation avec les producteurs de vaccins.
M. le président Jean-Christophe Lagarde. Je voudrais d’abord interroger Monsieur Ryan sur les pistes de révision du plan communautaire, lesquelles sont en cours de préparation pour la fin de l’année. Faut-il renforcer la coopération européenne pour acquérir des vaccins en commun ? L’absence de collaboration entre États n’a-t-elle pas, dans un climat de « foire d’empoigne » – chacun voulant disposer du vaccin le premier –, permis aux laboratoires de profiter de la concurrence entre les pays et n’a-t-elle pas empêché d’anticiper les capacités de production nécessaires pour faire face à une nouvelle pandémie ?
Nous avons entendu hier des praticiens et des responsables du secrétariat général de la défense et de la sécurité nationale nous expliquer que, en raison du règlement sanitaire international, il avait fallu attendre que soit atteint le niveau 6 de l’alerte à la pandémie pour déclencher le processus permettant de disposer de vaccins. Ne faudrait-il donc pas, à l’initiative de la France ou de l’Union européenne, amender ce règlement ?
Monsieur Coulombier, à partir de quel moment la sévérité de la grippe A(H1N1) est-t-elle apparue plus faible qu’on ne le craignait aux mois d’avril et mai 2009 ? Comment appréciez-vous la stratégie vaccinale de la France par rapport à celles d’autres pays : doit-elle être généralisée ou bien plus ciblée en fonction des populations à risque ?
Par ailleurs, Monsieur Ryan, pourquoi l’Europe devrait-elle intervenir dans le domaine de la définition des populations à risque à la place des États membres, lesquels semblent a priori les mieux placés pour agir ?
Enfin, Monsieur Le Courtois, l’Agence européenne du médicament a-t-elle été déjà saisie de demandes d’autorisation de mise sur le marché de vaccins trivalents en vue de la saison prochaine, notamment pour la vaccination contre la grippe saisonnière ?
M. John Ryan. Nous nous sommes engagés à réviser le plan pandémique communautaire, nécessairement lié au plan de l’Organisation mondiale de la santé. Le plan communautaire date de 2005, les travaux d’élaboration de celui-ci ayant commencé en 2002. En décembre 2008, la présidence française a fortement appuyé notre démarche en adoptant les conclusions du Conseil des ministres qui demandaient une telle révision à la Commission européenne, et ce antérieurement à la pandémie de grippe A(H1N1). En effet, les États membres avaient relevé un point faible dans le dispositif : l’insuffisance des mesures d’accompagnement et de préparation des secteurs autres que celui de la santé publique. Il ne sert à rien de disposer de stocks de vaccins et d’avoir formé des professionnels de santé si, par ailleurs, l’électricité est coupée et les magasins sont vides… Un plan doit intégrer tous les secteurs vitaux de la société dans une démarche de préparation à la survenance d’une pandémie. La mise à jour de notre plan visera essentiellement à intégrer ces éléments et elle interviendra avant la fin de cette année. Nous intégrerons aussi les leçons tirées de l’expérience récente, notamment concernant la définition de la pandémie. Celle-ci a fait l’objet de controverses au sein de l’Organisation mondiale de la santé tenant aux modalités de prise en compte de la gravité de la pandémie en fonction des zones géographiques. Nous devons nous mettre d’accord avec l’Organisation mondiale de la santé pour réviser le règlement sanitaire international, en cohérence avec l’approche communautaire.
M. le président Jean-Christophe Lagarde. Qu’en sera-t-il si des divergences persistent ?
M. John Ryan. Nous sommes trop liés les uns aux autres pour cela. Un accord devrait intervenir rapidement.
La pandémie a été déclarée à la suite d’infections observées aux États-Unis et au Mexique. Mais imaginons que l’infection ait commencé dans une autre partie du monde et que les informations n’aient pas été communiquées à temps à l’Organisation mondiale de la santé. Il est donc essentiel de mettre en place un partenariat assez fort au niveau international et que les mêmes règles soient appliquées partout. Il faut, avant tout, une cohérence internationale.
II y a quelques années, la Commission européenne avait proposé de constituer un stock de vaccins et d’antiviraux mobilisable en cas de besoin. Le Conseil des ministres en a discuté à plusieurs reprises et a finalement rejeté cette idée. On envisageait alors une situation que nous avons vécue depuis, certains États ayant procédé à l’achat de vaccins, d’autres non. Toutefois, nous allons maintenant étudier la possibilité d’une approche commune d’acquisition de vaccins et d’antiviraux.
M. le président Jean-Christophe Lagarde. Sans forcément constituer de stocks.
M. John Ryan. Nous pouvons, en effet, imaginer un système plus léger. Car l’origine du problème est financière : les États qui ont investi dans les vaccins ne sont pas disposés à les fournir aux autres États membres qui n’ont pas suivi la même démarche, d’autant qu’ils pourraient en avoir besoin plus tard. D’où l’idée d’un partage virtuel des stocks entre ceux qui en avaient trop et ceux qui n’en avaient pas assez, et ce en utilisant des systèmes communautaires pour faciliter les échanges. Cela a bien fonctionné dans le cas de la Bulgarie, comme pour la vente de surplus de vaccins entre États membres à la suite du passage de deux doses à une seule. Des solutions sont donc possibles sans investir trop d’argent.
Peut-on définir une stratégie vaccinale commune ? Cela ne me paraît pas possible au niveau des vingt-sept États européens car les infections se déplacent géographiquement. On ne peut donc avoir en permanence la même approche dans tous les États membres. Toutefois, on peut chercher à éviter des approches trop différentes concernant les groupes « cibles » à vacciner. C’est pourquoi le comité de sécurité sanitaire a pris l’excellente décision d’essayer de définir quels étaient ces groupes cibles et d’obtenir, sur cette base, un minimum d’accord entre les États membres. Le reste des décisions appartenait librement à ces derniers : ainsi, certains pays ont choisi de vacciner d’abord les responsables politiques, les parlementaires, les hauts fonctionnaires ou encore les pompiers…
M. le président Jean-Christophe Lagarde. En France, les parlementaires ont été sacrifiés !
M. John Ryan. La décision était nationale et dépendait, pour partie, de l’état des stocks.
M. Denis Coulombier. Dès le départ, nous avons eu l’impression, en raison des informations en provenance du Mexique, que la sévérité de la pandémie pouvait être relativement importante : beaucoup de personnes étaient hospitalisées.
M. le président Jean-Christophe Lagarde. Ces informations vous paraissaient-elles alors fiables et vous semblent-elles toujours l’avoir été ? De nombreuses personnalités que nous avons auditionnées ont prétendu que la gravité du mal avait été surévaluée au Mexique où des décès non liés à la grippe avaient été imputés à celle-ci.
M. Denis Coulombier. À la fin du mois d’avril 2009, nous avons envoyé un agent de liaison du centre de crise de Stockholm à celui d’Atlanta afin d’avoir accès à des informations fiables. Le centre américain avait déjà dépêché des équipes au Mexique pour faire le tri des informations exploitables. Nous avons alors réalisé que la sévérité annoncée résultait d’un biais très connu dans les données de surveillance : quand celles-ci ne dépendent pas d’un système très performant, on ne voit apparaître que le sommet de l’iceberg, c’est à dire les cas les plus graves repérés dans les hôpitaux.
La question du degré de sévérité est, bien sûr, la première que l’on se pose lors de l’émergence d’une souche pandémique. Les expériences tirées du passé montrent que l’on ne peut rien déterminer à l’avance : en 1919, la pandémie de la grippe espagnole s’est avérée particulièrement sévère, tandis que les pandémies suivantes ont été d’une sévérité beaucoup plus modérée.
Notre évaluation en date du 30 avril 2009 montrait que le virus présentait un potentiel pandémique. Toutefois, ce terme décrivait seulement la propagation géographique de l’infection et pas nécessairement la sévérité de la maladie elle-même. Toute la difficulté d’évaluer la sévérité d’une pandémie provient de ce que celle-ci possède toujours deux dimensions : la sévérité de la maladie pour chaque individu et sa sévérité collective – en cas de population naïve, la maladie se diffuse plus largement que pour une grippe saisonnière dans la mesure où, dans ce dernier cas, une grande partie de la population est déjà protégée. Nous avons rapidement compris que les symptômes de la maladie n’étaient pas spécialement sévères et que sa gravité ne pouvait pas être mesurée par les statistiques de mortalité, ce qu’on appelle la létalité.
Le propre d’une pandémie réside également dans ses conséquences sur les groupes à risque, d’où l’importance de déterminer ceux-ci au niveau de l’Union européenne. Chaque pays ne peut, pour le faire, attendre d’observer les cas qui vont émerger sur son territoire : on l’a bien vu aux États-Unis, qui ont bénéficié des informations fournies par des pays déjà touchés par la pandémie. De telles informations ont permis d’identifier les groupes à risque. On a, par exemple, noté une surmortalité des enfants – les éléments de cette étude ont été publiés il y a quelques semaines dans Eurosurveillance. Toutefois, le suivi des statistiques de mortalité, lequel est assuré pour la grippe saisonnière, n’est pas encore réalisé pour la grippe pandémique car l’analyse des données prend un certain temps. Nous savons cependant que, si la mortalité n’a pas été modifiée sur le plan quantitatif, elle a été qualitativement différente.
M. Gérard Bapt. La mortalité a été plus élevée chez les enfants. Mais par rapport à quoi ?
M. le président Jean-Christophe Lagarde. Quand vous êtes-vous rendu compte de cette sévérité effective de la pandémie et quand avez-vous émis un avis sur celle-ci? Quel a été l’impact de cette sévérité sur la mortalité ?
M. Denis Coulombier. La sévérité de la pandémie a été caractérisée à la fin du mois de mai 2009 au Mexique. Quand des cas de grippe A(H1N1) sont apparus en Europe, nous avons compris rapidement que nous n’étions pas en face d’une pandémie particulièrement sévère.
M. le président Jean-Christophe Lagarde. La sévérité de la pandémie était-elle plus ou moins grande que celle d’une grippe saisonnière ? Vous avez dit qu’elle ne l’était « pas plus », ce qui est une litote. Quand on regarde les chiffres, il semble qu’elle ait été moindre.
M. Denis Coulombier. La comparaison est difficile à établir. En effet, la sévérité ne s’exprime pas seulement par des statistiques quantitatives de mortalité. Il faut aussi prendre en compte l’aspect qualitatif : la grippe pandémique est plus sévère que la grippe saisonnière pour les femmes enceintes, mais elle l’est moins pour les personnes âgées.
M. le président Jean-Christophe Lagarde. Autrement dit, la grippe A(H1N1) tuerait moins que la grippe saisonnière mais pas les mêmes catégories de personnes.
M. Denis Coulombier. Nous ne le savons pas encore. Les données de mortalité associées à la grippe saisonnière, dont nous disposons, sont relativement complexes et doivent être mises en corrélation avec la circulation du virus. II est souvent difficile pour un médecin d’attribuer un décès exclusivement à la grippe plutôt qu’à une autre affection car le facteur grippal peut intervenir parmi d’autres. Les statistiques sont utilisées afin d’essayer de faire la part des choses. S’agissant de la pandémie grippale, les statistiques ne seront pleinement exploitables que dans les années qui viennent.
La mesure de la mortalité provoquée par la pandémie provient des statistiques fournies à notre demande par les États membres. Le chiffre ainsi obtenu, qui est de 3 000 selon le dernier état, est très sous-estimé. On ne peut encore le rapporter aux statistiques générales.
M. le président Jean-Christophe Lagarde. Qu’en est-il de la vaccination ?
M. Denis Coulombier. Le vaccin demeure un excellent outil de prévention et de lutte contre la pandémie. Je confirme les données relatives à son efficacité telles qu’elles ont été publiées récemment par une revue allemande.
S’est posée la question de la disponibilité de vaccins en quantité suffisante lors de la survenance de la vague pandémique en Europe. Cette disponibilité variait beaucoup d’un pays à l’autre. D’où le choix de se concentrer sur les populations à risque, ce qui ne réduit pas sensiblement la pandémie mais permet de prévenir les cas les plus sévères. Nous avons formulé des recommandations en ce sens.
M. Patrick Le Courtois. La plupart des vaccins saisonniers – environ 99 % – sont autorisés au niveau national. L’Agence européenne du médicament ne connaît que deux vaccins autorisés qui n’ont jamais été utilisés : celui de Sanofi qui, finalement, n’a pas été commercialisé, et celui de Novartis qui n’a jamais été mis en production. Ces vaccins étaient plus spécialement destinés aux personnes âgées.
Mme Marie-Louise Fort. Je suis très choquée par le refus de l’Organisation mondiale de la santé de se présenter devant notre commission d’enquête alors que cette institution est financée à hauteur de 60 % par des organismes privés et de 40 % par les États membres. Monsieur Ryan et de nombreuses personnes auditionnées, dont notre ministre de la santé, ont fait référence aux travaux de l’Organisation mondiale de la santé. Des informations importantes pourraient donc nous manquer. Au minimum, cet organisme devrait accepter de fournir une contribution écrite, comme cela s’est pratiqué dans le cadre d’autres commissions d’enquête. Il faut donc insister encore auprès de l’Organisation mondiale de la santé, et peut-être nous rendre sur place.
M. le président Jean-Christophe Lagarde. Je partage votre indignation s’agissant d’un organisme international financé par des États. Ses représentants ont refusé de venir devant nous et nous ne pouvons les y obliger en raison de leur statut international. J’avais proposé une audition par visioconférence ; il m’a été répondu que, traditionnellement et par principe, l’Organisation mondiale de la santé ne répondait pas aux commissions d’enquête parlementaire nationales. Je pense donc que lorsque nous remettrons notre rapport à l’Assemblée nationale, celui-ci pourra insister sur l’absence de transparence de cette organisation et sur son manque de volonté de coopération avec les organes représentatifs des nations ! Je pourrai, bien sûr, refaire une demande mais je dispose déjà d’un refus officiel par écrit.
Mme Marie-Louise Fort. Comment s’appuyer sur un organisme dont les études et les décisions servent souvent de références alors qu’il échappe à tout contrôle ?
M. le président Jean-Christophe Lagarde. Je propose que nous mentionnions notre indignation dans le rapport.
M. Denis Coulombier. Je me permets de rappeler que l’Organisation mondiale de la santé est contrôlée par les États membres qui en font partie, lesquels délèguent des experts en son sein…
M. le président Jean-Christophe Lagarde. Ne vous faites pas l’avocat de cette organisation contre laquelle nous sommes très irrités ! Nous représentons nous-mêmes un État qui en est membre. Quand un organisme gère une crise de façon aussi discutable, quand il s’auto-évalue, quand autant de questions se posent sur son rôle et sur l’indépendance de ses experts, la moindre des choses de sa part serait d’être transparent. L’auto-évaluation rencontre des limites, surtout lorsque l’organisme en question dépend d’États souverains qui essaient de comprendre ce qui s’est produit et qui, en plus, payent la facture des conséquences des décisions de celui-ci.
M. Jean-Pierre Door, rapporteur. Pour l’élaboration d’un autre rapport parlementaire, je me suis rendu auprès de l’Organisation mondiale de la santé il y a environ trois mois et j’ai rencontré ses principaux dirigeants. Nous avons évoqué la politique d’évaluation alors en cours et qui faisait appel à des audits externes. Peut-être cette organisation se sentait-elle bridée par ces audits…
Dans le cadre de la préparation de notre rapport sur le virus de la grippe aviaire H5N1, l’organisation avait accepté de tenir une visioconférence avec nous et Mme Chan, alors vice-présidente, y avait participé. Nous devrions donc adresser une nouvelle demande à l’Organisation mondiale de la santé.
M. le président Jean-Christophe Lagarde. Voilà une précision utile mais qui constitue une preuve supplémentaire des mensonges de cette organisation concernant son refus de répondre aux commissions d’enquête. Son évaluation interne ne peut en constituer un motif. Dans une situation similaire, et alors qu’elle n’en avait pas l’obligation, la Cour des comptes a accepté de venir s’exprimer devant nous à huis clos.
M. le rapporteur. J’ai pu examiner sur place le fonctionnement du Centre européen pour la prévention et le contrôle des maladies et rencontré à ce titre votre collègue M. René Snacken. J’ai pu observer comment étaient évalués les risques en fonction d’incertitudes documentées et ai compris qu’il existait des liens très étroits entre ce centre et celui d’Atlanta. Le renseignement, la préparation à la crise et le conseil scientifique ont bien fonctionné. Quant à la communication, ne fait-elle pas partie des fonctions qui doivent être revues pour l’avenir, ainsi que me l’a laissé entendre le directeur du centre ? Et si oui, de quelle façon ?
Un rapport sur la lutte contre la grippe aviaire H5N1 avait révélé un défaut de coordination et de coopération entre les États européens. C’est d’ailleurs pour cette raison que fut mis en place le comité de sécurité sanitaire et qu’on a renforcé le règlement sanitaire international, non sans douleur je crois. Quels sont les liens entre le comité, les centres pour la prévention et le contrôle des maladies et l’Organisation mondiale de la santé ? Peuvent-ils être renforcés ?
Monsieur Ryan a déclaré que le traité sur l’Union européenne ne prévoyait pas d’harmonisation des politiques, sauf en ce qui concerne le sang et les organes humains. Pour autant, à l’occasion de la préparation contre une pandémie de grippe de type H5N1, nous avions réfléchi à ce que pourrait être une « ingérence sanitaire », termes employés à Pékin lors de la conférence internationale sur le sujet. Lorsque nous avons reçu ici la commissaire européenne à la santé, nous avons évoqué avec elle la nécessité d’un renforcement de la coopération et de la coordination dans le domaine sanitaire, les virus n’ayant pas de passeport et ignorant les frontières. J’estime donc que la stratégie vaccinale, qu’elle soit massive ou ciblée, doit viser l’ensemble des pays. Quels que soient les moyens, financiers ou médicaux, des uns et des autres, la solidarité des vingt-sept États membres doit prédominer ; la commissaire européenne nous a du reste indiqué qu’elle travaillait en ce sens. Comment peut-on donc renforcer cette coopération afin de parvenir à des stratégies communes ou harmonisées ? La pandémie de grippe A(H1N1) doit nous y aider.
On a enfin observé un décalage entre la validation des vaccins par la Commission européenne et celle opérée par la Food and drug administration américaine, qui est intervenue plus tôt, de même que pour les organismes similaires chinois ou australien. Ce retard européen était-il dû au fait que les procédures que nous appliquons sont plus « sécurisées » ?
M. Denis Coulombier. En ce qui concerne la communication du Centre européen pour la prévention et le contrôle des maladies, les responsabilités sont clairement partagées : l’évaluation des risques est assurée par les agences et la gestion des risques par la Commission européenne. Durant la pandémie, la communication s’est déployée à trois niveaux : le niveau scientifique, celui médias et celui du public.
Au premier niveau, celui de la communication scientifique, nous avons été très actifs : plus d’une centaine d’articles a été publiée sur les différents aspects de la pandémie. Aux deuxième et troisième niveaux, nous avons été moins performants : il faut sans doute y voir un « péché » de jeunesse.
M. le rapporteur. La cellule de surveillance d’Atlanta comprend quatre cents personnes qui étudient les messages reçus en temps réel, alors qu’il n’y en a que dix ou douze à Stockholm.
M. Denis Coulombier. Nous connaissons un vrai problème d’échelle : nous comptons trois cents personnes en Europe contre dix à douze mille aux États-Unis. Pour autant, nous ne sommes pas vraiment isolés : l’agence s’appuie sur les ressources fournies par les États membres et a de nombreux contacts opérationnels avec les autres centres dans le monde. Les Américains et les Chinois nous ont ainsi envoyé des officiers de liaison.
M. John Ryan. La communication a été identifiée comme un problème clé, et ce avant même la propagation de la pandémie. C’est pourquoi, au sein du comité de sécurité sanitaire, nous avons créé un réseau de communicants qui a été activé lors la survenance de la pandémie. Il tenait des réunions journalières et a permis d’adresser des messages identiques au public et à la presse de chaque État membre.
Il a été procédé, au sein de ce réseau, à une analyse de nos points faibles en matière de communication. Celle-ci est disponible. Toutefois, nous n’avons pas utilisé les nouveaux réseaux que sont facebook et twitter ; nous devons donc nous moderniser sur ce terrain. Les groupes antivaccination se sont avérés beaucoup plus actifs que nous dans l’utilisation des nouveaux supports de communication.
Comment mesurer rapidement l’état d’esprit de l’opinion publique dans un contexte de pandémie ? Un baromètre mis en place par la Commission européenne a montré que 98 % des personnes interrogées étaient conscientes de l’existence de la pandémie, 80 % se considéraient comme bien informées et 57 % estimaient ne pas devoir être touchées par elle, ce qui traduit des contradictions dans la perception des risques.
M. le président Jean-Christophe Lagarde. Il y a peut-être moins de populations naïves que vous ne le croyez…
M. John Ryan. Les sources d’information sanitaire provenaient pour 65 % de la télévision et pour 33 % des journaux. Enfin, 55 % des personnes n’étaient pas disposées à se faire vacciner, ce qui montre que nous n’avions pas réussi à faire passer notre message.
Il est donc important, pour la prochaine fois, de mettre en place des méthodes de communication plus efficaces en direction des populations, qui ne perçoivent pas toujours les choses comme les perçoivent leurs gouvernements. Nous allons donc étudier, lors de la présidence belge, comment activer des réseaux de communication plus performants et mettre en place de bonnes pratiques en la matière.
Il faut savoir que nous possédons davantage de pouvoir en matière de santé des animaux : nous pouvons prendre à leur encontre des mesures contraignantes que nous ne pouvons pas prendre à l’égard des êtres humains – mis à part le cas du sang ou celui des organes. Toutefois, compte tenu de l’expérience fournie par cette crise, nous proposerons des améliorations en ce domaine
M. le président Jean-Christophe Lagarde. Si je comprends bien, pour se trouver, en tant qu’individu, sous la coupe de l’Union européenne, il faut se mettre en pièces détachées…
M. John Ryan. Il n’existe pas de règles européennes concernant la vaccination des enfants qui voyagent d’un pays à l’autre alors qu’il en existe pour les chiens… Des exemples comme celui-ci nous aident à formuler des propositions d’amélioration.
M. Patrick Le Courtois. Je voudrais donner quelques précisions sur les délais de réaction à la pandémie : aux États-Unis, la Food and drug administration a approuvé le 15 septembre 2009 quatre vaccins élaborés sur la base de vaccins saisonniers ; l’Agence européenne du médicament a émis un avis favorable pour les deux vaccins maquettes le 24 septembre 2009, avis qu’elle a transformé en décision le 29 septembre, ce qui représente donc deux semaines d’écart entre les décisions américaine et européenne.
La Food and drug administration espérait pouvoir délivrer les autorisations de mise sur le marché à la fin du moins d’août mais prévoyant, en raison des données fournies par le Centre pour la prévention et le contrôle des maladies d’Atlanta, qu’elle allait recommander deux doses pour les personnes de moins de cinquante ans et une seule dose pour les autres, elle a attendu de disposer des résultats de petits essais cliniques réalisés chez des adultes avant de prendre sa décision – c’était inhabituel car, en général, cette administration autorise la mise sur le marché des vaccins saisonniers sans essai, fondant seulement sa décision sur des données relatives à la qualité pharmaceutique des produits.
Le décalage de deux semaines pour l’Europe s’explique, s’agissant des vaccins maquettes, par les difficultés qu’ont rencontrées les fabricants avec le rendement des souches, de 30 % inférieur à celui que l’on obtient habituellement. Ceux-ci ont donc dû changer de souches, d’où une évaluation réglementaire plus longue et plus complexe. Notre objectif initial visait la mi-septembre.
Le vaccin Celvapan a également rencontré des difficultés de fabrication, ce qui nous a conduit à diligenter une inspection de bonnes pratiques de production en Autriche, provoquant, là encore, un retard de deux semaines.
L’harmonisation des schémas de vaccination en Europe est une question très importante car de plus en plus de vaccins sont autorisés selon la procédure centralisée au niveau européen. Il existe en effet un lien direct entre le développement des médicaments, les populations sur lesquelles il faut faire des études afin de disposer de données cliniques, et les schémas de vaccination. Plus la normalisation sera importante au niveau européen, plus il sera aisé de développer les vaccins et de les mettre rapidement à la disposition du public.
M. Gérard Bapt. Monsieur Le Courtois, comment l’Agence européenne du médicament est-elle financée ? Pourriez-vous nous indiquer qui est le président français du groupe « vaccins » ? Les conflits d’intérêts des experts de vos différents groupes apparaissent-ils sur votre site internet – ce qui n’était pas le cas récemment ? Les débats en commission sont-ils publics ? Vous avez indiqué que le vaccin de Sanofi avait été « finalement » autorisé selon la procédure décentralisée : pourquoi ce mot ?
J’ai constaté que Messieurs Ryan et Coulombier, parlant d’harmonisation, ont manifesté une certaine distance à l’égard de l’Organisation mondiale de la santé.
Par ailleurs, on parle beaucoup de communication, mais si le message de base n’est pas crédible, celle-ci ne sera pas reçue, sauf à réinstaurer un régime de type soviétique.
Le prochain sondage d’opinion, à l’occasion de la prochaine alerte, ne risque-t-il pas de donner des résultats encore plus mauvais que les précédents, compte tenu de l’expérience que nous venons de vivre ?
Vous avez dit être très attentifs à la notion de sévérité de la pandémie. Or, depuis le 1er mai 2009, les critères de morbidité et de mortalité ont disparu de la définition de la pandémie par l’Organisation mondiale de la santé, ainsi que pour apprécier l’opportunité de passer d’une phase d’alerte à la suivante. Au vu de l’expérience vécue – je pense notamment à la commande par la Grèce de vingt-deux millions de doses de vaccin pour une population de douze millions d’habitants –, exigerez-vous une meilleure concordance entre les approches de l’Organisation mondiale de la santé et de l’Europe à cet égard ?
Vous avez évoqué un taux de mortalité supérieur chez les enfants. Mais par rapport à quoi ? Toutes les statistiques montrent que, davantage touchés par la grippe, il en mouraient moins que les personnes âgées, qui, elles, sont moins touchées. Pourriez-vous donc préciser si ce taux s’applique à la pandémie ou bien à la grippe saisonnière ?
Nous savons qu’en France, les structures de surveillance sanitaire sont particulièrement élaborées ; il suffit de consulter à cet égard le site internet de l’Institut de veille sanitaire. Généralement, on ne meurt pas à la maison d’un syndrome respiratoire aigu, on en meurt à l’hôpital. Toutes les informations statistiques sont donc disponibles. Ne peut-on dès lors s’interroger sur une stratégie vaccinale qui repose sur une vaccination « barrière » destinée à toute la population mais arrivant trop tard ? On a recensé en France 1 330 cas graves d’hospitalisation, dont plus de 90 % identifiés comme atteints du virus de la grippe A(H1N1). On a constaté que seuls dix-sept d’entre eux avaient été vaccinés, et moins d’une semaine seulement avant leur hospitalisation, ce qui rendait celle-ci inopérante. Dans tous ces cas, qu’il y eut ou non un vaccin ne changeait donc rien.
Enfin, vous avez cité une étude allemande datant de deux semaines et prouvant l’efficacité de la vaccination. Peut-on en connaître les références et savoir quel laboratoire l’a financée ?
M. John Ryan. La Commission européenne n’a pas cherché à établir une distance entre elle et l’Organisation mondiale de la santé. La création de cette dernière remonte à 1948, le règlement sanitaire international est applicable et nous avons en général de bons contacts avec cette instance. De plus, il existe un lien entre le système pharmaceutique communautaire et les décisions de l’organisation. Nous travaillons donc en étroite liaison, non seulement pour les pandémies mais aussi sur des thèmes de santé publique tels que le tabac, l’alcool ou la nutrition.
Cela dit, il existe certainement des leçons à tirer de cet événement. Le système comporte des faiblesses et il faut y apporter des améliorations.
Un exemple : les cas de mélamine contenue dans le lait chinois n’ont jamais fait l’objet d’une information en application du règlement sanitaire international. J’estime donc important de renforcer les systèmes d’alerte et la confiance entre les États membres de l’Organisation mondiale de la santé.
Il faut également améliorer la définition de la pandémie. D’après l’organisation, la modification de certains documents en avril 2009, qui soulève aujourd’hui une controverse, ne concerne pas cette définition : il s’agit plutôt de documents annexes. Telle est l’explication qui a été donnée au public et au Conseil de l’Europe.
Notre dispositif communautaire étant mis en œuvre après que soit intervenue la déclaration d’une pandémie par l’Organisation mondiale de la santé, il est stratégiquement important de procéder à une clarification.
Pour ce qui d’un futur « eurobaromètre », j’espère qu’il sera meilleur que l’ancien. Les améliorations que nous envisageons concernent de nouveaux outils et la création de messages en commun. Nous sommes beaucoup plus actifs qu’auparavant dans ce domaine.
M. Denis Coulombier. L’étude qui montre une surmortalité statistique chez les enfants pendant la période pandémique se fonde sur les données des années passées.
M. Gérard Bapt. Donc on ne peut affirmer qu’elle est le fait de la pandémie.
M. Denis Coulombier. L’observation de la mortalité est indépendante. Le programme EuroMoMo (European monitoring of excess mortality for public health action), mis en place il y a quelques années et financé sur des fonds européens, enregistre la mortalité en continu. Toute analyse statistique vise à établir des corrélations temporelles entre différentes situations (comme la pollution, par exemple) et la mortalité de certains groupes. Or les experts ont remarqué un petit accroissement statistique de la mortalité des enfants durant la période correspondant à la vague de pandémie en Europe. Leur hypothèse est qu’il existe un lien de causalité entre l’une et l’autre. Mais cela reste une hypothèse et l’analyse doit se poursuivre. Aujourd’hui, on ne connaît aucun autre phénomène pouvant expliquer cette petite variation.
M. Gérard Bapt. Dans tous les pays, les chiffres montrent qu’il y a eu beaucoup moins de morts chez les enfants que chez les personnes âgées.
M. Denis Coulombier. C’est une autre comparaison. Dans l’étude que je cite, la comparaison porte sur la mortalité des enfants par rapport aux années passées. Il n’est nullement affirmé qu’il y aurait eu plus de morts que dans les autres groupes d’âge.
La variation de mortalité n’est pas considérable mais elle a justifié une publication dans une revue scientifique.
M. le président Jean-Christophe Lagarde. En d’autres termes, la grippe A(H1N1) tue plus les enfants que la grippe saisonnière mais, pour autant, elle ne tue pas plus les enfants que les personnes âgées.
M. Denis Coulombier. Pour compléter cette analyse, il semble que la grippe A(H1N1) a touché davantage d’enfants que ne le fait la grippe saisonnière. Sans doute, pour un enfant malade, le risque de décès n’est-il pas plus important, mais davantage d’enfants ont été malades. Pour un même niveau de létalité, il en résulte plus de morts.
Par ailleurs, s’il est exact que les infections respiratoires aiguës sévères sont enregistrées, l’attribution d’un décès à la grippe peut se révéler difficile. Par exemple, le démarrage de la grippe – avant même qu’elle soit symptomatique – peut être le facteur qui entraînera une décompensation de l’équilibre précaire d’un patient diabétique âgé et provoquera le décès. Il n’est pas évident, pour un clinicien, de déterminer ce qui est à l’origine de cette décompensation. D’où le recours aux études statistiques, qui permettent d’éviter ces biais.
Je vous remets une copie de l’étude allemande dont il a été question. Elle n’a pas été financée par les laboratoires. C’est l’équivalent allemand de l’Institut de veille sanitaire qui l’a réalisée, sur la base d’études rétrospectives de cas. La revue où l’article est publié possède un comité de lecture composé d’experts.
M. Patrick Le Courtois. La formule « finalement autorisé » est sans doute un abus de langage de ma part. N’y voyez aucune intention ! La firme Sanofi a comparé les procédures centralisée et décentralisée pour son vaccin non adjuvanté, sachant qu’elle avait décidé de recourir à la procédure centralisée pour un vaccin quasi identique avec adjuvant – ce dossier a reçu un avis favorable du comité au premier trimestre de cette année. Elle a estimé que l’évaluation serait plus rapide dans le cadre de la procédure décentralisée, le maniement de la procédure centralisée étant un peu plus complexe. Elle nous l’a fait savoir au début de l’été. Le recours à l’Agence européenne du médicament n’était, en l’occurrence, pas obligatoire.
En moyenne, le financement de l’agence provient à 75 % des redevances des firmes – c’est le cas de nombreuses agences réglementaires en Europe – et à 25 % de la Commission européenne.
Le groupe de travail « vaccins », dont le président est allemand, et qui ne comprend pas de Français, n’est pas constitué de représentants des États. Le comité choisit dans une liste les experts qui lui semblent les mieux à même de réaliser ce travail. Le professeur Jean-Hugues Trouvin, qui travaille à l’Assistance publique-Hôpitaux de Paris, préside le groupe « qualité biologique ».
La commission d’enquête du Sénat nous a longuement interrogés, il y a une semaine, sur la question complexe des conflits d’intérêts. La gestion de ces conflits fait partie du règlement qui a mis en place l’Agence européenne du médicament. Sur cette base, nous avons établi une procédure consistant à évaluer le risque de conflits d’intérêts en fonction de l’importance du travail et des avis des experts dans le processus décisionnel. Par exemple, les présidents de comité ne doivent avoir aucun conflit d’intérêts. Il en va de même des experts qui rapportent sur un dossier. Par contre, un niveau défini de conflit d’intérêts peut être toléré dans certains comités, ce qui limite leur engagement dans certains travaux.
M. Gérard Bapt. Ces conflits d’intérêts font-ils l’objet d’une publication ?
M. Patrick Le Courtois. La procédure est publiée sur le site de l’agence, de même que les conflits d’intérêts des membres du conseil d’administration et des comités. Pour l’instant, seul le nom des experts participant aux groupes de travail apparaît. Les conflits d’intérêts de tous les experts travaillant pour l’agence sont néanmoins disponibles sur place et font l’objet de très nombreuses consultations. Notre intention est de mettre rapidement en ligne ces informations.
M. Gérard Bapt. Au vu des résultats de l’étude allemande que l’on vient de nous distribuer, il semblerait que le nombre de décès soit équivalent que l’on ait pas, peu ou beaucoup vacciné. Cela mérite réflexion.
M. Jean Mallot. En utilisant la procédure des vaccins maquettes, on a glissé de quelque chose que l’on connaît à quelque chose que l’on ne connaît pas. Cela étant, contrairement à ce qui se passe aux États-Unis, il a été demandé des examens cliniques complémentaires, notamment sur les populations considérées comme moins bien « testées » pour le vaccin. De ce point de vue, combien d’essais cliniques a-t-on réalisés sur les enfants, en particulier sur la tranche d’âge de six à vingt-quatre mois ?
Par ailleurs, vous avez indiqué que les firmes avaient demandé à la mi-octobre 2009 la validation du passage de deux à une injection et que cette possibilité avait été reconnue, avant que l’on ne donne un avis favorable en novembre. Pourriez-vous être plus précis au sujet des dates, qui ont leur importance.
M. le président Jean-Christophe Lagarde. Vous remarquez que les groupes antivaccination ont été plus actifs que vous sur internet. Avez-vous réalisé une cartographie de l’importance de leurs campagnes ? On entend dire que la France est le premier pays touché. Est-ce exact ? Plus généralement, pourquoi les groupes antivaccination remportent-ils à certains endroits plus de succès qu’ailleurs ?
M. Patrick Le Courtois. La stratégie des États-Unis a consisté à n’utiliser que des produits déjà utilisés comme vaccins saisonniers et à y incorporer la nouvelle souche pandémique de la même manière que l’on procède avec les souches saisonnières. Comme certains doutes subsistaient, l’administration a demandé, par exception, quelques données cliniques chez l’adulte pour vérifier la validité de cette stratégie. Les Américains ont donc fait un pari, et ils nous l’ont dit. On notera que la vaccination saisonnière de la femme enceinte et de l’enfant est beaucoup plus fréquente aux États-Unis qu’en Europe.
Par ailleurs, les États-Unis sont très réticents quant à l’utilisation des adjuvants. On n’y propose aucun vaccin saisonnier adjuvanté, ce qui n’est pas le cas en Europe où, notamment, plus de 40 millions de personnes – surtout dans les pays septentrionaux – ont été vaccinées avec un de ces produits. Cette réticence est liée au traumatisme de la crise sanitaire et politique de 1976, lorsqu’un vaccin adjuvanté a provoqué des cas de maladie de Guillain-Barré. De plus, les groupes antivaccination sont plus influents aux États-Unis qu’ils ne le sont en Europe.
Pour en revenir aux vaccins maquettes, qui ont pour la première fois fait l’objet d’une autorisation, le comité a été extrêmement prudent. C’est pourquoi, au mois d’octobre, en dépit d’éléments montrant leur efficacité avec injection d’une seule dose, il a préféré disposer de données définitives issues d’essais « propres » et d’éléments concernant la deuxième dose, afin d’être pleinement assuré de l’efficacité de ces vaccins sur les populations naïves – cet aspect étant, si je puis dire, son obsession.
De plus, le développement des vaccins maquettes s’est fait par étapes, si bien que l’on ne disposait pas de données concernant le nombre de doses nécessaire pour certaines tranches d’âge. Ce n’est pas sans lien avec les recommandations faites en direction des populations à risque : à un certain moment, nous nous sommes trouvés dans la situation où les données disponibles pour les vaccins maquettes contre la grippe A(H1N1) ne concernaient pas les populations recommandées. Des extrapolations étaient possibles, voire acceptables dans une situation de pandémie très sévère, mais, comme on a su assez tôt que la pandémie était modérée, on a demandé des essais supplémentaires.
Outre le comité qui se prononce sur les autorisations de mise sur le marché, l’Agence européenne du médicament comporte un comité pédiatrique, lequel a fortement recommandé que l’on réalise des essais chez les enfants, y compris les plus jeunes, en parallèle avec les essais pratiqués sur les adultes.
Il se trouve que les firmes ont réalisé ces essais de façon séquentielle, en raison des difficultés auxquelles elles se sont heurtées au niveau des comités d’éthique pour faire de telles études chez les enfants alors que l’on ne disposait pas de résultats concernant les adultes. En général, dans le développement des médicaments, on attend ces résultats avant de passer aux essais chez les enfants. Mais, en la matière, les deux catégories étaient très différentes d’un point de vue immunologique et il a semblé préférable de mener les études en parallèle.
Bref, nous avons reçu les résultats des essais cliniques chez les enfants quelques semaines après les résultats concernant les adultes.
En septembre, des données très préliminaires collectées sur un tout petit nombre de sujets vaccinés avec des lots expérimentaux de Pandemrix contenant plus de vaccin que la version commercialisée montraient déjà qu’une seule dose pourrait être suffisante. Vers la mi-octobre, les firmes nous ont demandé de pouvoir modifier leurs demandes d’autorisation de mise sur le marché en passant de deux à une dose de vaccin, sur la base de données qui, je le répète, n’étaient pas complètement finalisées et qui montraient qu’une dose pourrait être suffisante. Invité au Conseil des ministres de la santé au mois d’octobre, j’ai communiqué cette information au commissaire qui a indiqué aux ministres que l’agence, suite à cette demande des firmes, allait évaluer les données et se prononcer une semaine plus tard. Le 22 octobre 2009, l’agence a émis un avis selon lequel elle continuait à recommander deux doses bien que beaucoup d’éléments montrent qu’une dose pourrait être suffisante. Sur la base de ces informations, certains pays ont décidé d’attendre la confirmation formelle du comité, d’autres ont décidé de passer immédiatement à une seule dose. Ce n’est qu’en novembre 2009, au vu de données supplémentaires, que le comité a été complètement convaincu qu’une dose suffisait et qu’il a modifié l’autorisation de mise sur le marché en ce sens.
M. Jean Mallot. À quelle date précisément ?
M. Patrick Le Courtois. Je vous ferai parvenir cette information.
Pour ce qui est des essais cliniques avec les vaccins contre la grippe A(H1N1) – qui ont commencé en août 2009 –, quatre cents à cinq cents personnes, dont deux cents enfants et adolescents, ont été enrôlées pour chacun des vaccins. Les chiffres sont moindres pour les enfants plus jeunes : dix-sept enfants de six à onze mois pour un des vaccins, quatre-vingt pour un autre et soixante-cinq pour le troisième.
M. le président Jean-Christophe Lagarde. Les mouvements antivaccination qui existent aux États-Unis sont-ils, d’après vous, d’origine sectaire ?
M. John Ryan. Nous ne disposons pas d’une cartographie d’ensemble de tous ces mouvements. Selon l’expérience dont nous disposons, des groupes tels que ceux s’opposant à la vaccination contre l’hépatite B, le papillome humain ou la rougeole, les oreillons et la rubéole, s’organisent par groupes de langue. À titre d’exemple, en Suisse, des mouvements s’adressent aux populations parlant allemand, ce qui leur procure un impact dans les cantons alémaniques de la Suisse mais non dans les cantons francophones. Aux Pays-Bas – mais il ne s’agit pas véritablement d’un phénomène sectaire –, nous avons observé, dans une zone déterminée, des croyances religieuses régionales hostiles à la vaccination des enfants. Il ne faut pas, pour autant, stigmatiser des populations identifiées en fonction de leur langue ou de leur religion. Mais, si nous voulons définir une stratégie communautaire, il nous faut intégrer tous les facteurs d’acceptation, et donc tenir compte de ces groupes minoritaires, même si nous ne rencontrons pas de problème avec la majorité. Dans une pandémie, on ne peut tenir à l’écart une partie de la population.
M. le président Jean-Christophe Lagarde. Avez-vous pu identifier l’origine des campagnes sur internet incitant à ne pas se faire vacciner ?
M. John Ryan. Non. Pour nous, le plus important à l’avenir est que, en cas de pandémie, les pays se fassent confiance et définissent une stratégie commune : on n’arrête pas les virus aux frontières des États, comme l’Ukraine a cru pouvoir le faire en fermant les siennes. C’est pourquoi nous travaillons aussi avec l’Organisation mondiale de la santé, même si on ne peut espérer placer tous les pays du monde au même niveau. Notre but est que, sur le plan communautaire, les êtres humains bénéficient d’une protection au moins équivalente à celle des animaux.
M. le président Jean-Christophe Lagarde. Je vous remercie. Si vous rencontrez des représentants de l’Organisation mondiale de la santé, vous pouvez leur rappeler qu’ils nous ont menti par courrier et qu’il va nous falloir en tenir compte.
La séance est levée à dix-huit heures trente-cinq.
Audition de Mme Sophie Kornowski-Bonnet,
présidente du laboratoire Roche
(Procès-verbal de la séance du mercredi 12 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures quarante.
(Mme Sophie Kornowski-Bonnet prête serment.)
M. Jean Mallot. Des stocks d’antiviraux avaient été réalisés en 2005 dans la perspective de la grippe H5N1. La question de l’approvisionnement en antiviraux s’est reposée lorsque la direction générale de la santé a demandé l’automne dernier aux médecins de prescrire systématiquement le Tamiflu en mode préventif. Sur quelles bases scientifiques cet effet préventif avait-il été démontré ? Ensuite, la date de péremption initiale de ces médicaments a été prorogée par l’Agence française de sécurité sanitaire des produits de santé. Comment cela a-t-il été rendu possible ? Enfin, pouvez-vous nous donner quelques chiffres sur les livraisons complémentaires que vous avez effectuées et sur la consommation effective des produits ?
Mme Sophie Kornowski-Bonnet, présidente du laboratoire Roche. Une première indication se trouve déjà dans l’autorisation de mise sur le marché de Tamiflu, qui fait état à la fois d’un traitement préventif et d’un traitement prophylactique post contact : l’effet protecteur de Tamiflu a été démontré dans plus de 90 % des cas. Puis, son utilisation a été conseillée pour ce que l’on appelle un « traitement préemptif ». Le comité de lutte contre la grippe a recommandé une posologie plus élevée que le traitement de prophylaxie de l’autorisation de mise sur le marché, soit deux doses par jour pendant cinq jours. Cette posologie était justifiée par le profil du virus, qui se multiplie plus vite que le virus saisonnier sur lequel l’autorisation de mise sur le marché était fondée et dont la charge virale est beaucoup plus élevée. Cela permettait de mieux prendre en charge les patients, en particulier les sujets à risques : ne pas augmenter la dose faisait courir le risque de ne traiter que quelques virus, pas tous. L’on a d’ailleurs constaté chez les patients décédés, notamment celui de Saint-Étienne, une charge virale phénoménale.
Assez peu de données étaient alors disponibles sur le Tamiflu. L’autorisation de mise sur le marché avait été basée sur plusieurs études et l’avis de la commission de transparence de la Haute Autorité de santé indiquait clairement que son intérêt devenait majeur en cas de pandémie. Depuis, une dizaine de publications ont mis en évidence une baisse de la contagiosité et de la mortalité et une amélioration significative de l’état des patients, adultes, enfants ou femmes enceintes, traités par Tamiflu – pas tellement en France, où les barrières sanitaires ont bien fonctionné, mais au Mexique, au Chili et en Argentine par exemple. Les attaques très violentes qu’ils ont connues ont montré l’intérêt du médicament.
M. Jean-Pierre Door, rapporteur. Est-il vrai qu’une étude comparative entre le Chili, qui avait utilisé le Tamiflu, et l’Argentine, qui n’a pas recommandé sa prescription, donne un très net avantage au Chili ?
Mme Sophie Kornowski-Bonnet. Oui. Je vous la communiquerai.
M. le rapporteur. La Haute Autorité de santé a fait état d’études contradictoires concernant le service médical rendu du Tamiflu.
Mme Sophie Kornowski-Bonnet. Il n’y en a pas eu en France à ma connaissance. En revanche, une polémique a eu lieu il y a quelques mois sur une méta-analyse du British medical journal.
M. le rapporteur. Un des experts de la Haute Autorité de santé que nous avons auditionné a fait état de résultats contradictoires concernant le service médical rendu du Tamiflu.
Enfin, la liste des experts qui collaborent avec votre laboratoire et leur déclaration de conflits d’intérêts sont-elles publiées ?
Mme Sophie Kornowski-Bonnet. Pour en revenir au Chili, c’est un des rares pays qui n’a connu aucun décès parmi les patients traités par un antiviral.
La seule publication contradictoire sur le Tamiflu a été la méta-analyse menée par le British medical journal. En l’occurrence, c’est la presse anglaise qui nous a demandé des données. Or, Roche fournit volontiers ses données à des scientifiques, mais pas à la télévision. Nous avons donc contacté nous-mêmes la personne chargée de l’étude, qui a refusé de signer un contrat de confidentialité alors qu’elle nous demandait la database complète, qui contenait des données sur des patients. Nous ne l’avons donc pas communiquée, en tout cas pas dans un premier temps. L’étude contradictoire n’a d’ailleurs jamais conclu au non-intérêt du Tamiflu : elle a conclu qu’elle ne pouvait pas conclure. Depuis, nous leur avons transmis toutes les données, mais les auteurs de l’analyse ne se sont curieusement pas précipités pour l’achever. Elle le sera certainement un jour. En attendant, le British medical journal a publié le 6 mai un article montrant tout l’intérêt du Tamiflu dans la pandémie. J’en ai apporté un exemplaire.
Par ailleurs, nous déclarons toujours nos contrats avec les experts, même si nous en avons très peu dans le domaine de la grippe. En revanche, nous ne publions pas les listes de ces experts, suivant ainsi la ligne du LEEM – Les entreprises du médicament – mais nous pouvons bien sûr vous les communiquer. Nous nous assurons que nos relations sont éthiques. Nous avons une grille tarifaire qui suit la loi du 27 janvier 1993 portant diverses mesures d’ordre social et que nous déclarons au conseil de l’Ordre des médecins, ce qui n’est pas obligatoire. Pour ce qui est de la grippe, nous avons de nombreuses réunions de travail mais seulement quelques de contrats de partenariat, officiels et déclarés, que je vous communiquerai.
M. le président Jean-Christophe Lagarde. Les autres laboratoires que nous avons auditionnés sont tous favorables à une publication régulière de la liste des experts qui collaborent avec eux, mais sous réserve d’une réglementation, comme aux États-Unis. Êtes-vous d’accord ? Est-ce une question d’enjeu concurrentiel ?
Mme Sophie Kornowski-Bonnet. Je suis d’accord, et ce n’est pas une question concurrentielle. Le problème est d’essayer d’être créatif, et de choisir les bonnes personnes pour cela. On n’a pas les mêmes idées en travaillant avec un expert ou avec un autre. Si chacun sait qui travaille avec qui, nous allons tous essayer d’avoir les mêmes idées, ce qui n’est pas positif. Mais l’enjeu réel n’est pas là : nous avons besoin de relations transparentes et respectables. Nous ne pouvons pas mettre notre réputation en jeu. Publier les listes ou non n’a pas grande conséquence, du moment que tout le monde les publie ou personne. L’enjeu est d’entretenir des relations parfaitement éthiques avec les professionnels de santé.
Pour ce qui est des chiffres, l’approvisionnement de l’État en Tamiflu datait des contrats signés entre 2003 et 2005. Pendant la pandémie, nous avons travaillé avec les autorités de santé afin de rendre le médicament disponible au plus près des patients, puisqu’il doit être pris dans les quarante-huit heures suivant les premiers symptômes et que la situation n’était pas facile à gérer pour les pharmacies. Nous avons eu aussi assez vite des demandes d’hôpitaux. Nous avons donné aux autorités de santé tous les moyens pour fabriquer des comprimés le plus vite possible. Au final, nous avons vendu pour 12 millions d’euros supplémentaires de Tamiflu au Gouvernement, essentiellement sous des formes pédiatriques qui n’étaient pas disponibles dans le stock initial, le reste consistant en quelques centaines de milliers de boîtes pour adultes destinées à une aide d’urgence au Mexique et à nos ambassades.
M. le rapporteur. Je viens de rencontrer le responsable de la pharmacie centrale des armées qui m’a déclaré disposer encore aujourd’hui de neuf tonnes de Tamiflu en poudre. L’armée serait capable de fabriquer rapidement des gélules à partir de la poudre, grâce à un procédé spécial.
Mme Sophie Kornowski-Bonnet. L’État a en effet acheté du Tamiflu sous forme de poudre, qui a l’avantage d’une durée de vie très longue, voire illimitée, contrairement aux gélules que nous fabriquons – car c’est la capsule qui vieillit. Nous avons travaillé ensemble pour développer un procédé spécifique, assez complexe, de fabrication de comprimés – il ne s’agit pas de gélules – à partir de cette poudre. La pharmacie centrale des armées est dorénavant capable de fabriquer des comprimés en cas de pandémie.
L’État a aussi, ainsi que vous l’avez dit, prorogé la date de péremption de ses stocks. Nos données de stabilité nous avaient convaincus que leur durée de vie pouvait être augmentée, et nous avions communiqué nos conclusions à l’Agence française de sécurité sanitaire des produits de santé.
M. Jean Mallot. Combien de doses représentent les 12 millions d’euros ?
Mme Sophie Kornowski-Bonnet. Cette somme correspond à 436 000 boîtes de 75 mg, 132 000 boîtes de 45 mg et 499 000 boîtes de 30 mg.
En France, pour se préparer à une pandémie, on se fonde sur un nombre de 28 millions de personnes à risques : 4 millions d’asthmatiques, 19 millions d’adultes âgés de plus de 65 ans ou souffrant d’une affection de longue durée et 5 millions d’enfants. On considère aussi le taux d’attaque de la maladie, qui, en l’occurrence, était très élevé : d’après les derniers chiffres, de 9 à 14 millions de personnes ont été contaminées durant la pandémie.
M. le président Jean-Christophe Lagarde. Confirmez-vous que la prescription préemptive du Tamiflu décidée en décembre 2009 aurait dû passer par une extension de son autorisation de mise sur le marché et que cela n’a pas été le cas ?
Mme Sophie Kornowski-Bonnet. C’est le comité de lutte contre la grippe, qui observe le comportement du virus sans relâche, qui a recommandé cette utilisation. Il l’a fait dans une situation pandémique, c’est-à-dire anormale – je rappelle que les personnes décédées ne correspondent pas aux victimes habituelles – et cette décision était pleinement cohérente avec nos propres réflexions. C’était une décision logique, fondée sur la connaissance scientifique. Il n’y a pas eu de demande d’extension d’autorisation de mise sur le marché, car cela prend trop de temps : s’il avait fallu en passer par là, le Tamiflu serait arrivé après le pic pandémique.
M. le président Jean-Christophe Lagarde. Mais la demande n’a toujours pas été faite depuis ?
Mme Sophie Kornowski-Bonnet. Non.
M. le président Jean-Christophe Lagarde. Pourtant, vous nous avez expliqué toute l’efficacité préemptive du Tamiflu. La crise est passée, mais une autre peut venir !
Mme Sophie Kornowski-Bonnet. Roche se posera peut-être la question à l’avenir, mais il n’y a pas de demande d’extension à ce jour.
M. le président Jean-Christophe Lagarde. Je comprends parfaitement que la décision ait dû être prise au plus vite, d’autant que le médicament avait déjà été autorisé. Ce que je trouve étonnant c’est qu’ayant découvert l’efficacité de votre médicament dans cette situation, vous n’ayez pas encore, depuis décembre 2009, déposé de demande d’extension. Le laboratoire y a pourtant tout intérêt !
Mme Sophie Kornowski-Bonnet. L’efficacité en doses préemptives constatée pour ce virus ne sera pas forcément la même pour un autre. En outre, les demandes d’autorisation de mise sur le marché font l’objet d’une longue réflexion dans l’entreprise. Le fait que je n’aie pas encore été impliquée ne veut pas dire qu’il n’y aura pas de demande, ni d’ailleurs que la réflexion n’ait pas commencé. Enfin, une demande d’autorisation de mise sur le marché ne se dépose pas en trois mois. Même si nous avions pris la décision en février ou mars, après la pandémie, le dossier ne serait pas encore constitué.
M. le rapporteur. Il y a environ un an, nous avions prévu, dans le projet de loi de financement de la sécurité sociale, une possibilité d’autorisation de mise sur le marché transitoire en cas d’urgence sanitaire, destinée à éviter les procédures administratives. C’est sans doute ainsi que le comité de lutte contre la grippe a pu prendre sa décision.
M. le président Jean-Christophe Lagarde. Je ne conteste en rien la légalité de cette décision, d’autant qu’il ressort de l’une de nos auditions que l’autorisation de mise sur le marché n’était pas nécessaire puisque la dose est restée inchangée – deux par jour pendant cinq jours au lieu d’une pendant dix jours. L’absence d’autorisation de mise sur le marché n’est donc pas scandaleuse. Reste qu’être le plus transparent possible, dans ces domaines, évite la prolifération de sottises sur internet.
Nous en avons terminé. Merci encore une fois de vous être rendue à notre invitation.
La séance est levée à dix-neuf heures dix.
Audition de M. Thierry Blanchon,
responsable adjoint du réseau Sentinelles
à l’Institut national de la santé et de la recherche médicale (INSERM)
et de M. Jean-Marie Cohen,
coordinateur national des groupes régionaux d’observation de la grippe (GROG)
(Procès-verbal de la séance du mercredi 26 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt.
(M. Thierry Blanchon et M Jean-Marie Cohen prêtent successivement serment.)
M. le président Jean-Christophe Lagarde. Nous souhaitons aborder avec vous, messieurs, la question de la collecte d’informations relatives à la pandémie grippale. De nombreuses questions se posent, d’autant que certains ont émis des doutes sur la réalité même de la pandémie, des confusions ayant eu lieu entre grippe et état grippal. Vous pourrez également nous donner votre sentiment sur l’organisation de la campagne de vaccination elle-même.
Je vous propose de nous exposer brièvement comment vos structures respectives ont travaillé dans le cadre de cette pandémie – ou de cette épidémie.
M. Jean-Marie Cohen, coordinateur national des groupes régionaux d’observation de la grippe. Je vous ai apporté quelques documents dont j’ai pensé qu’ils pourraient vous être utiles. Tout d’abord, trois exemplaires de tous les « bulletins GROG » que nous avons édités depuis le début de l’alerte relative à la « grippe mexicaine ». Ensuite, tous les bulletins hebdomadaires produits par Chorum, structure très proche des groupes régionaux d’observation de la grippe, à l’intention des mutualistes et diffusés chacun à environ un million d’exemplaires. Enfin, une fiche provisoire, car nous ne disposons pas encore de sa version définitive, détaillant comment nous gérons les liens d’intérêts. Sachez que nous disposons de quantité de documents, informations et données chiffrées sur le nombre d’arrêts de travail prescrits, le nombre de consultations pour grippe, le volume de médicaments vendus, notamment de Tamiflu… Nous pouvons, si vous le souhaitez et en fonction de vos besoins, vous les faire parvenir sous quarante-huit heures.
Je le dis d’emblée, ma position est intenable. En effet, je suis proche de l’Institut de veille sanitaire qui finance 75 % d’une moitié de mon salaire. J’ai été et je suis toujours un conseiller direct de madame Roselyne Bachelot-Narquin qui m’a convié à quasiment tous les dîners d’experts qu’elle a organisés – je venais à sa demande, sans toutefois aucun mandat officiel. Je suis par ailleurs l’un des fondateurs de la revue Prescrire, revue indépendante à l’intention des médecins et pharmaciens, qui présente la particularité de ne comporter aucune publicité pharmaceutique. Au cours de la pandémie, cette revue a tenu un discours qui n’était pas le mien. Si sur certains sujets, son attitude est remarquable, sur d’autres, sa posture est, je n’hésite pas à le dire, stupide.
M. le président Jean-Christophe Lagarde. En l’espèce, quel était votre point de désaccord ?
M. Jean-Marie Cohen. Pour les responsables de la revue, tout médicament nouveau est a priori mauvais.
M. le président Jean-Christophe Lagarde. Même un vaccin ?
M. Jean-Marie Cohen. Oui, il arrive que Prescrire critique vivement un vaccin. Dans le cas de la grippe, son discours a été plutôt « soft » car très vite, elle n’a plus eu d’arguments majeurs à opposer. Mais elle est, d’une manière générale, très critique vis-à-vis de l’industrie pharmaceutique.
Vous devez savoir que dans les groupes régionaux d’observation de la grippe, nous dialoguons avec tous les acteurs de la santé qui le souhaitent et donnons des avis à tous ceux qui nous sollicitent, aussi bien à des associations de militants anti-vaccination qu’à des laboratoires pharmaceutiques ou des caisses d’assurance maladie, mais ne sommes jamais rémunérés à titre personnel. C’est une règle très stricte de notre fonctionnement.
M. Thierry Blanchon, responsable adjoint du réseau Sentinelles à l’Institut national de la santé et de la recherche médicale. Le réseau Sentinelles est une unité mixte de recherche en santé publique, placée sous tutelle conjointe de l’Institut national de la santé et de la recherche médicale et de l’université Paris VI Pierre et Marie Curie. Nous assurons une veille sanitaire notamment autour de la grippe, avec 1 300 médecins généralistes qui, de manière continue depuis 1984, surveillent les syndromes grippaux : cela permet de connaître parmi ces syndromes, la part de ceux imputables à la grippe véritable ainsi que le nombre de consultations pour grippe chez les généralistes. Nous travaillons en étroite liaison avec les groupes régionaux d’observation de la grippe bien entendu, l’Institut de veille sanitaire et les deux centres nationaux de référence de Paris et de Lyon. Pendant toute la pandémie l’année dernière, nous avons organisé des conférences téléphoniques hebdomadaires au cours desquelles nous décidions ensemble du message à délivrer. Le début de l’épidémie a ainsi été annoncé le 7 septembre et sa fin le 29 décembre 2009, en accord avec les groupes régionaux d’observation de la grippe, l’Institut de veille sanitaire et les centres de référence.
Nous sommes en train de mettre en place avec les groupes régionaux d’observation de la grippe et l’Institut de veille sanitaire un réseau unifié dans le but d’être plus efficace et d’aider les décideurs. Les médecins de Sentinelles et des groupes régionaux d’observation de la grippe surveillent désormais la grippe sur la base d’une même définition des syndromes grippaux, ce qui permet de disposer de données plus fines, qui ont d’ailleurs été utilisées pendant la pandémie.
Au-delà de ces aspects de surveillance sanitaire, notre réseau mène également une activité de recherche sur les vaccins contre la grippe et sur l’efficacité vaccinale. Des tests d’immunogénicité sont réalisés avant que les vaccins ne soient mis sur le marché mais comme par définition, le vaccin est préparé avant que la souche ne circule, des études sont nécessaires, notamment au niveau européen.
M. le président Jean-Christophe Lagarde. Les méthodes de collecte des informations par les groupes régionaux d’observation de la grippe et le réseau Sentinelles, assez différentes au départ, se sont donc rapprochées ?
M. Thierry Blanchon. Les deux réseaux travaillent en lien étroit avec l’Institut de veille sanitaire. La surveillance qu’ils exerçaient était complémentaire, mais assez différente, ce qui compliquait les messages à diffuser. Depuis janvier 2008, nous avons commencé de travailler à leur rapprochement en recherchant comment opérer ensemble une surveillance efficace des différentes épidémies à partir de définitions identiques. Il faut savoir que la définition du syndrome grippal n’est pas la même partout en Europe. L’important est de se fonder sur les mêmes indicateurs d’une année sur l’autre afin de pouvoir établir des comparaisons valides. Depuis début septembre 2009, le réseau Sentinelles et les groupes régionaux d’observation de la grippe retiennent les symptômes suivants : fièvre d’apparition brutale, supérieure à 39°C, accompagnée de myalgies et de signes respiratoires. Nous avions jusque là des données nationales très fiables et pertinentes. Des données régionales de même qualité étaient nécessaires, que l’unification des deux réseaux a permis d’obtenir, notamment durant la pandémie, tout simplement parce que nous pouvions nous appuyer sur un plus grand nombre de médecins. Ces données ont été publiées dans le bulletin Grippe hebdomadaire de l’Institut de veille sanitaire.
M. Jean-Marie Cohen. Dans les bulletins que je vous ai remis, figurent deux indicateurs : l’occurrence de grippes cliniques, forme très particulière de grippe ou d’infections ressemblant à la grippe et donnant une fièvre très élevée, et l’occurrence d’infections respiratoires aiguës donnant de la fièvre, mais pas nécessairement supérieure à 39°C. Les grippes cliniques représentent environ la moitié des infections respiratoires aiguës.
L’atout supplémentaire des groupes régionaux d’observation de la grippe par rapport au réseau Sentinelles est qu’ils ne sont pas constitués exclusivement de généralistes : ils associent également des médecins du travail, des pharmaciens, des infirmières, des entreprises vigies, l’armée… Pour établir les données, les médecins effectuent des prélèvements rhinopharyngés chez les sujets supposés grippés. Ces confirmations virologiques sont essentielles dans la surveillance d’une grippe pandémique car elles permettent de distinguer entre les vraies et les fausses grippes et de suivre très précisément les différents virus de la grippe. C’est grâce à cette analyse virologique fine pratiquée par les deux centres nationaux de référence, l’Institut Pasteur à Paris et les Hospices civils de Lyon, qu’on a pu suivre littéralement à la trace le virus A(H1N1) et le différencier d’autres virus, grippaux et non-grippaux. En septembre-octobre, il circulait encore peu, représentant moins de 10 % des cas de syndromes grippaux, alors que les rhinovirus, virus respiratoires saisonniers sans danger, étaient très nombreux. C’est la combinaison d’une surveillance clinique élargie, grâce à notre collaboration avec le réseau Sentinelles, et de ces analyses virologiques qui a permis à tout instant de savoir à peu près où on en était.
Les analyses ne sont pas simples pour la période 2009-2010 car il semble que le virus A(H1N1) ait donné chez certains sujets des formes de grippe avec très peu de fièvre, voire pas de fièvre du tout. Nous n’en sommes pas encore sûrs, les données étant encore en cours d’analyse. En novembre-décembre, beaucoup de gens ont eu mal à la tête et ont été très fatigués sans pour autant être fébriles ni tousser : nous nous demandons toujours s’ils ont eu ou non une forme inhabituelle de grippe, qui n’a pas rendu nécessaire de consultation médicale ni d’arrêt maladie. Ils se sont souvent contentés de demander un conseil à leur pharmacien, quand ils ne sont pas soignés eux-mêmes avec les médicaments de leur armoire à pharmacie. Bien qu’anormalement fatigués, ils ne se sont pas inquiétés, n’imputant pas leurs symptômes à la grippe. Et comme il s’agissait d’une forme clinique de grippe qui n’entrait dans le cadre ni des définitions traditionnelles ni des nouvelles alors élaborées, il est possible que certains cas de grippe véritable n’aient pas été recensés – ce qui n’est pas grave en soi, dans la mesure où la maladie est restée bénigne chez ces sujets. Mais lorsqu’on débat du nombre de cas, il importe de savoir qu’un certain nombre a pu passer inaperçu.
M. le président Jean-Christophe Lagarde. Ce sont là de pures supputations, dans un sens comme dans l’autre d’ailleurs, sur lesquelles on ne peut donc fonder un quelconque raisonnement. L’une des questions clés est de savoir combien de personnes seraient aujourd’hui immunisées contre la grippe A(H1N1) parce qu’elles l’auraient déjà contractée.
M. Jean-Marie Cohen. Il est possible qu’une partie de la population ait été ainsi immunisée, sans qu’on puisse le savoir. Les enquêtes sérologiques, dont je ne sais pas encore quand les résultats seront connus, apporteront peut-être une réponse.
M. le président Jean-Christophe Lagarde. Combien de temps faut-il pour connaître les résultats d’une enquête sérologique ?
M. Jean-Marie Cohen. Un certain temps (Sourires). Mais il est sûr qu’ils seront disponibles avant septembre prochain.
M. Jean-Pierre Door, rapporteur. Avez-vous une idée du pourcentage de prélèvements rhinopharyngés effectués sur des sujets grippés, à fins de diagnostic, notamment au cours des semaines 48-49 ?
M. le président Jean-Christophe Lagarde. On faisait effectuer des prélèvements par les médecins sur quasiment tous les patients suspectés de grippe durant l’été, puis du jour au lendemain, on a expliqué à l’automne que ce n’était plus possible car il y avait trop de cas. Votre réseau de surveillance a certainement, lui, continué de faire des prélèvements. Mais à partir de quand, selon vous, ne se justifiaient-ils plus ?
M. Jean-Marie Cohen. Au moment du pic de l’épidémie, en décembre, plus de 60 % étaient positifs. Plus de dix mille ont été réalisés la saison dernière contre cinq mille environ d’habitude au sein des groupes régionaux d’observation de la grippe. Il était bien évidemment impossible aux médecins du réseau d’effectuer un prélèvement chez tous leurs patients, pour des raisons à la fois de coût et de charge de travail induite en aval dans les laboratoires de virologie. Nous avons mis au point en 1984 une méthode statistique de surveillance, devenue depuis un standard mondial, consistant à demander à diverses vigies de dénombrer le nombre de sujets apparemment grippés et d’effectuer des prélèvements sur un échantillon de patients. Cette méthode, à la fois très sensible et fiable, permettant de détecter les cas de grippe même lorsqu’ils sont peu nombreux, facilite le suivi au plus près de toutes les épidémies, fortes ou faibles.
Mais il se trouve qu’en raison de la médiatisation de la pandémie entre avril et juin dernier, nous avons dû stopper les prélèvements afin de ne pas déclencher une grève à La Poste ! En effet, les postiers avaient peur que ces prélèvements, qu’ils auraient dû acheminer, ne contiennent du virus A(H1N1), qu’ils percevaient comme redoutable, mortel… Nous avons discuté avec La Poste ainsi qu’avec la direction générale de l’aviation civile, nombre de prélèvements étant acheminés par voie aérienne, afin de mettre au point un protocole d’envoi avec des emballages étanches, parfaitement sûrs pour les personnels amenés à les manipuler. Cela a pris deux mois et demi et il a fallu plusieurs interventions ministérielles pour aboutir. Nous n’avons pu recommencer à effectuer des prélèvements qu’à la mi-juillet.
Pourquoi les pouvoirs publics ont-ils décidé du jour au lendemain que ces prélèvements n’avaient plus lieu d’être, alors qu’ils avaient été jusque là systématiques chez tous les sujets grippés, et à partir de quand ce virage à 180 ° était-il pertinent ? C’est une tout autre question que celle de la surveillance épidémiologique, liée à une stratégie de confinement des patients contaminés. Le socle du plan de lutte français contre la pandémie, comme dans beaucoup d’autres pays, était qu’il fallait gagner du temps. Pour ce faire, dans une première phase où les cas sont rares, il faut isoler les malades le plus vite possible, effectuer le prélèvement nécessaire pour confirmer qu’ils sont bien atteints de la grippe pandémique, et les maintenir confinés tant qu’ils sont contagieux. Cela a été fait dans une perspective très hospitalo-centrée. Nous avions dit à l’Office parlementaire d’évaluation des choix scientifiques et technologiques il y a deux ans que dans la gestion d’une pandémie, le problème principal serait celui de la communication. Nous avions souligné qu’il serait difficile de faire comprendre à nos concitoyens, ainsi d’ailleurs qu’au corps médical, que pendant quelques semaines, tout malade présumé grippé devrait être isolé à l’hôpital, soigné par des personnels équipés de masques, gants et combinaisons, puis que du jour au lendemain, les malades pourraient être traités en ville. Et en effet, ce message a eu du mal à passer, d’autant que les médecins hospitaliers, au départ heureux de faire la preuve de leur rôle clé en situation de crise sanitaire – quelques-uns d’entre eux se sont abondamment exprimés sur les ondes et ont même fait de la surenchère – ont très vite été ennuyés, avec leurs lits d’isolement et de réanimation encombrés de patients atteints simplement d’une grippe et n’allant pas si mal que cela. Dès juin, lors d’une réunion avec la ministre, certains médecins hospitaliers – je pense notamment aux professeurs Pierre Carli et François Bricaire – ont fait valoir qu’il n’était pas justifié de bloquer des lits dans leur service pour des malades dont la vie n’était pas en danger et qui avaient seulement besoin d’être isolés, au risque que des malades très graves ne puissent plus être hospitalisés faute de place. C’est alors qu’ils ont préconisé un basculement du dispositif vers la médecine de ville et demandé qu’on n’hospitalise plus systématiquement les patients suspectés de grippe. Ce basculement ne s’est toutefois opéré que fin juillet.
Pourquoi ce décalage, que l’on a retrouvé de manière récurrente durant toute la pandémie ? Entre le moment où, sur le terrain, on sentait que des adaptations étaient nécessaires et celui où les décisions prises étaient effectivement mises en œuvre, il s’est à chaque fois écoulé un délai de trois semaines. Je ne pense pas que ce soit la faute des responsables politiques mais plutôt de l’organisation alors en place. Le circuit court qui permettait que des décisions soient prises très rapidement entre le ministre de l’intérieur, le cabinet du Président de la République et le ministre de la santé, garantissait efficacité et réactivité, mais présentait l’inconvénient suivant : l’administration, au travers notamment des agences sanitaires gouvernementales, se sentait quelque peu exclue, si bien que lorsqu’elle était sollicitée pour entrer de nouveau en jeu, le délai nécessaire était d’environ trois semaines, ce qui a eu des conséquences extrêmement dommageables, notamment auprès des médecins de ville.
M. le rapporteur. Quels services administratifs visez-vous en particulier ?
M. Jean-Marie Cohen. Les directions départementales et régionales de l’action sanitaire et sociale, l’Agence française de sécurité sanitaire des produits de santé, les préfectures…
M. le président Jean-Christophe Lagarde. Si les décisions avaient été prises, non pas directement par les ministres en cellule de crise, mais par les administrations centrales, n’auraient-elles pas mis autant de temps à redescendre vers les échelons territoriaux ?
M. Jean-Marie Cohen. Peut-être, je n’en sais rien.
M. le président Jean-Christophe Lagarde. Chacun des ministres était responsable d’une administration centrale.
M. Jean-Marie Cohen. Ce qui s’est passé durant les trois premières semaines de juillet, avec cet écart entre la décision prise en haut et la réalité vécue sur le terrain, a amené les médecins de ville à penser qu’on se moquait d’eux. Pendant ces trois semaines, alors qu’ils estimaient qu’ils devaient avoir la main, ils ont pensé qu’on la leur avait refusée au moment même où on leur promettait qu’ils l’auraient un jour !
Mme Catherine Lemorton. Un mot, monsieur Jean-Marie Cohen, concernant la revue Prescrire. Ses responsables ne sont pas hostiles a priori à tout nouveau médicament, ils ne font que dénoncer le fait que beaucoup de prétendues nouveautés pharmaceutiques n’en sont pas.
Pour ce qui est de l’isolement des malades pratiqué au tout début de la pandémie, j’ai vécu le problème de près, habitant à quatre kilomètres seulement du collège où le professeur Marchou du centre hospitalier universitaire de Toulouse-Purpan s’est mis en colère pour demander qu’il soit mis fin à l’hospitalisation systématique des enfants atteints de grippe A, qui se portaient très bien et avaient tendance à prendre l’hôpital pour une joyeuse colonie de vacances.
Quand avez-vous considéré, dans le réseau Sentinelles et dans les groupes régionaux d’observation de la grippe, que la grippe A(H1N1) était assez contagieuse – je ne dirais pas très contagieuse, car le cas du collège évoqué ci-dessus est emblématique avec six enfants touchés seulement – mais pas dangereuse ? Quand, de par les retours de terrain, en avez-vous eu, en conscience, la certitude ?
Pour ce qui est des personnes finalement immunisées contre cette grippe, pour l’avoir contractée sans le savoir, des experts ont très tôt abordé le sujet. Le professeur Antoine Flahault notamment nous avait dit dès octobre, lors d’une audition organisée par mon groupe politique, que l’on pouvait estimer entre 35 % et 40 % le nombre de personnes qui n’auraient pas de symptômes assez nets pour consulter mais seraient néanmoins immunisées. Les résultats des études sérologiques seront très intéressants.
Quand avez-vous senti, si tel a été le cas, qu’il était nécessaire d’associer les médecins libéraux ? Et à votre avis quand aurait-il fallu le faire pour que la campagne de vaccination ne soit pas un échec ? Heureusement que cette grippe n’était pas grave. Sinon, les dégâts auraient pu être considérables. Je vous pose ces questions dans le seul objectif de tirer les leçons de cet épisode, afin de faire mieux lors d’une prochaine pandémie plus grave.
M. Thierry Blanchon. Dans le réseau Sentinelles, dès le début août, nous avons noté un nombre de consultations pour syndrome grippal inhabituel pour la saison, sans que l’on ait encore dépassé le seuil épidémique. Celui-ci l’a été en septembre – ce seuil, cyclique, haut en hiver, est assez bas en fin d’été – alors même que le pourcentage de prélèvements positifs n’oscillait qu’entre 5 % et 10 %.
M. le président Jean-Christophe Lagarde. Que signifie exactement que « le seuil épidémique est dépassé » ? Cela veut-il dire que l’épidémie débute ou qu’on se situe déjà au-delà ? J’ai du mal à comprendre cette notion de seuil.
M. Thierry Blanchon. Nous utilisons en France depuis 1984 la méthode mathématique dite de Serfling permettant de déterminer par modélisation, parmi tous les syndromes grippaux, ceux dus au virus de la grippe et ceux dus à d’autres virus donnant des symptômes cliniques assez proches. Seul le virus de la grippe peut entraîner un très grand nombre simultané de cas de syndromes grippaux à un moment donné. Le seuil épidémique est fonction, je le disais, de la période de l’année, haut en hiver, plus bas en été. Dès lors qu’il est dépassé, l’épidémie a débuté ; dès lors que le nombre de cas repasse en-dessous, elle est terminée. En 2009, alors même qu’on était encore sous ledit seuil épidémique, le nombre de consultations pour syndrome grippal était plus élevé que d’habitude, preuve d’une circulation déjà importante du virus.
S’agissant des études sérologiques, je comprends bien ce qu’a pu vous dire le professeur Antoine Flahault, qui dirigeait le réseau Sentinelles il y a encore quelques années. Nous n’aurons que dans quelques mois les résultats de l’étude, copilotée par l’Institut de veille sanitaire, qui permettra de quantifier précisément le nombre de personnes qui ont vraiment eu la grippe A(H1N1) l’année dernière. Le professeur Antoine Flahault ne vous donnait que des estimations.
Pour ce qui est de l’implication des médecins, je ne pourrais parler que de ceux du réseau Sentinelles, soit 2 % seulement des praticiens libéraux. Nous avons eu le sentiment, et ce tout au long de la pandémie, qu’ils ne recevaient pas l’information adéquate et ne pouvaient donc pas la relayer auprès de leurs patients. Pour susciter l’adhésion à la campagne de vaccination, ce sont eux les premiers qu’il aurait fallu convaincre de son utilité. Or, en septembre-octobre, ils étaient tout sauf convaincus, ayant même pour certains d’entre eux alimenté la polémique qui s’est alors fait jour.
M. le président Jean-Christophe Lagarde. Comment sont-ils informés habituellement dans ce genre de circonstances ?
M. Thierry Blanchon. La messagerie « DGS Urgent » leur permet de recevoir automatiquement un courriel en cas de problèmes sanitaires urgents, à la condition qu’ils soient abonnés, mais les informations de « DGS Urgent » ne sont pas assez fréquemment actualisées : la dernière concernant la grippe y remonte aujourd’hui à la mi-avril ! De fait, les médecins sont informés par les médias généralistes, des médias spécialisés, les différents réseaux dont ils peuvent être membres ou dans le cadre de leur formation continue. En l’espèce, nous avons vraiment eu le sentiment dans le réseau Sentinelles de jouer le rôle d’interface pour les tenir informés.
Mme Catherine Lemorton. Les instances ordinales, de médecins comme de pharmaciens, ont multiplié leurs bulletins.
M. le président Jean-Christophe Lagarde. Quel est le canal traditionnel d’information des médecins sur la grippe, notamment saisonnière, ou d’ailleurs sur toute autre question sanitaire ?
M. Thierry Blanchon. Aujourd’hui, il n’en existe pas qui soit vraiment fiable et efficace. À chaque praticien de se débrouiller comme il le peut pour s’informer des dernières recommandations ! Les informations données par le biais de la messagerie « DGS Urgent », en laquelle les médecins ont confiance même si tout n’y est pas parfaitement actualisé, sont insuffisamment expliquées. Or, pour convaincre le corps médical, il ne suffit pas de l’informer que telle recommandation en remplace une autre, encore faut-il lui dire pourquoi. Il aurait été bon d’expliquer aux médecins pourquoi on était passé du jour au lendemain de l’hospitalisation systématique de tout malade suspecté de grippe à une gestion des malades en ville. La difficulté d’accès à l’information, conjuguée à ce manque d’explications, a largement contribué à l’échec de la campagne de vaccination.
M. le président Jean-Christophe Lagarde. Le Quotidien du médecin est-il un bon vecteur d’information, couramment utilisé par les médecins ?
M. Thierry Blanchon. Oui et non. C’est une bonne publication, assez lue, pas nécessairement d’ailleurs par les médecins libéraux, mais qui demeure journalistique. Les médecins auraient besoin de recevoir en temps réel une information officielle expliquant les tenants et les aboutissants de telle ou telle nouvelle recommandation.
M. le président Jean-Christophe Lagarde. Cela ne devrait théoriquement pas poser de difficulté, dans la mesure où tous les cabinets sont désormais informatisés.
M. Thierry Blanchon. Presque tous.
M. Jean-Marie Cohen. Lors du colloque organisé en novembre dernier par l’Office parlementaire d’évaluation des choix scientifiques et technologiques, la sénatrice Marie-Christine Blandin avait souligné à juste titre que des informations, prétendument livrées par les experts en avant-première et de manière confidentielle, se retrouvaient le lendemain même dans tous les médias ! C’est dire que chacun a en fait disposé des informations en même temps. Toute la différence a résidé dans leur interprétation. La grippe, comme d’ordinaire, a joué un rôle de révélateur et mis en évidence le fossé culturel considérable qui existe entre les soignants, les chercheurs et les autorités. C’est là un vrai problème de société, que les politiques doivent prendre à bras-le-corps, car il est de nature à obérer l’équilibre des comptes de la sécurité sociale et compromettre notre système de soins. Par effet de billard, il n’est pas neutre non plus sur nos problèmes économiques, ni sur le niveau d’endettement de notre pays.
Tout au long de la pandémie, les médecins ont dit qu’ils « n’étaient pas au courant », alors même que le ministère ne cessait de mettre en ligne des informations dédiées aux professionnels, sans compter qu’il avait organisé de 2006 à 2008 le plus important programme national de formation jamais conçu à l’intention du corps médical. Ce programme, qui a fait l’objet d’une évaluation, avait donné des résultats encourageants mais il aurait fallu « en repasser une couche ». Or d’une part, l’État n’avait plus d’argent, d’autre part, il n’en a pas eu le temps avant l’arrivée de la pandémie.
Je confirme que dans les groupes régionaux d’observation de la grippe, où les médecins sont pourtant spécifiquement sensibilisés au sujet de la grippe, comme leurs confrères du réseau Sentinelles, ils déploraient de n’être pas informés et que tout leur soit caché, alors même que les autorités avaient fait un effort colossal d’information et de transparence, dans tous les médias. Le tri dans cet afflux d’informations, auquel il fallait déjà avoir accès, était, hélas, long à faire.
Quand avons-nous compris que la grippe A était « assez contagieuse mais pas très grave », me demandez-vous ? Personnellement, je n’ai pas vécu les choses ainsi. La transmission massive et très rapide du virus A(H1N1), observée en avril-mai au Mexique, en Californie et au Texas, dans des régions où la température extérieure était très élevée alors que la grippe traditionnelle se propage plutôt en saison froide, n’était pas rassurante du tout. En juin, nous étions très inquiets.
M. le président Jean-Christophe Lagarde. À partir de quand ne l’avez-vous plus été ?
M. Jean-Marie Cohen. Au moment même où constatant que l’épidémie n’était pas très grave dans les établissements scolaires ou les colonies de vacances, on aurait pu commencer d’être rassuré, sont apparus les premiers cas de « poumons grippaux » chez des personnes bien portantes qui, atteintes d’une grippe en apparence banale, développaient quelques jours plus tard un syndrome de détresse respiratoire aiguë, exigeant leur hospitalisation en réanimation pour des semaines. Les médecins n’étaient pas débordés, l’épidémie n’explosait pas, mais des personnes sans facteur de risque particulier présentaient des formes graves, ce qui n’était pas rassurant. Personnellement, jusqu’à Noël, je n’ai pas dormi. Ce n’est qu’ensuite que j’ai été quelque peu rassuré, en espérant néanmoins que ne sévisse pas une deuxième vague, comme lors de la grippe espagnole de 1918. Tout au long de l’épisode, ont alterné informations rassurantes et inquiétantes. Je n’ai, pour ma part, jamais été tranquille.
M. le rapporteur. Il y avait, à mon sens, deux canaux d’information pour les médecins. Tout d’abord, le site www.pandemie.gouv.fr, mis en place par le ministère à leur intention et qu’ils pouvaient consulter quotidiennement, si leur cabinet était informatisé. Ensuite, je le sais pour avoir été vice-président d’une union régionale de médecins libéraux, c’est le rôle de ces instances que de transmettre à l’ensemble des médecins, syndiqués ou non, toutes les informations de sécurité sanitaire. Or, j’ai l’impression que ce canal n’a pas bien fonctionné. Qu’en pensez-vous ? C’est un point important dans la mesure où la loi relative à l’hôpital, aux patients, à la santé et aux territoires a transformé les unions régionales de médecins libéraux en unions régionales de professions de santé, élargies à l’ensemble des professions de santé, médicales et paramédicales.
Par ailleurs, quel est votre sentiment sur l’utilisation du terme de pandémie, et non d’épidémie, alors qu’à compter d’avril 2009, le critère de sévérité qui figurait jusqu’alors dans le règlement sanitaire international a été revu au profit du critère d’extension géographique ? Ne faudrait-il pas revoir la terminologie, de même que les divers stades de pandémie ?
M. Jean-Marie Cohen. Dans les groupes régionaux d’observation de la grippe, nous avions préparé depuis plusieurs années, un plan de communication en direction des unions régionales de médecins libéraux. Nous avons demandé à l’Institut national de prévention et d’éducation pour la santé de financer d’urgence la mise en place d’une plate-forme informatique, Pegasus Bridge, afin que nous puissions transmettre en temps réel aux unions régionales toutes les informations nous parvenant. L’information n’a très bien circulé qu’au moment où la rumeur a enflé autour de syndromes de Guillain-Barré potentiellement induits par la vaccination. Nous avons alors envoyé à toutes les unions via cette plate-forme, deux pages résumant la littérature sur le sujet et cela a été parfaitement relayé. Mais pour le reste, j’en conviens avec vous, le relais que devaient être les unions régionales n’a pas fonctionné et celles-ci, à l’exception d’une ou deux, n’ont pas fait leur travail, alors même qu’elles disposent d’un budget important, financé par une contribution obligatoire des praticiens.
M. le rapporteur. Pensez-vous que les unions régionales de médecins libéraux pourraient à l’avenir, dans le cas d’autres pandémies, être un bon canal d’information, maintenant qu’elles ont été transformées en URPS, élargies à l’ensemble des professions de santé ?
M. Jean-Marie Cohen. Créer des unions régionales de professions de santé est une bonne idée, les médecins étant moins maladroits lorsqu’ils sont associés à d’autres professionnels de santé, comme pharmaciens et infirmières, que lorsqu’ils sont seuls.
Cela étant, demeure un problème particulier à la grippe. C’est une maladie extrêmement compliquée et lorsqu’on n’en est pas spécialiste, on a tendance à répercuter les informations reçues en les simplifiant et donc en les déformant. On l’a constaté même avec les grands experts hospitaliers qui ont simplifié à l’excès une information très pointue, contribuant à propager des vues tronquées qui ont poussé à la faute. Pour qu’à l’avenir les unions régionales de professions de santé puissent jouer efficacement leur rôle de relais d’information s’agissant de la grippe, il faudra y associer des personnes spécifiquement compétentes sur le sujet. On avait déjà noté de tels dysfonctionnements lors de l’épisode du SRAS, le syndrome respiratoire aigu sévère.
M. le président Jean-Christophe Lagarde. Plutôt que de s’appuyer sur des instances qui, bien que censées être financées pour cela, n’effectuent visiblement pas correctement leur travail, pourquoi le ministère de la santé ou la direction régionale de la santé ne pourraient-ils pas adresser directement à tous les médecins, un courriel, ou un courrier aux quelques-uns qui seraient demeurés absolument rétifs à l’informatique, contenant une information neutre et fiable, sans risque qu’elle ait été déformée ? Qu’est-ce qui l’empêcherait sur le plan technique ou sur le plan financier ?
M. Jean-Marie Cohen. Il faut tenir compte de ce que j’appelle le « syndrome de Tchernobyl ». Dans n’importe quel contexte de crise fortement médiatisée, on ne croit plus les autorités en France, réputées mentir. Pour que la communication officielle soit crue, elle doit être cautionnée par des instances extérieures. Cette analyse est peut-être un peu excessive, mais elle n’est pas loin de la réalité.
M. le président Jean-Christophe Lagarde. Si les médecins ne consultent même plus les informations officielles car ils n’ont pas confiance, que peut-on faire ?
M. Thierry Blanchon. Les unions régionales de médecins libéraux ont-elles joué leur rôle ? Je suis incapable de répondre. Je suis sûr en revanche que si nous en réunissions les responsables, ils nous diraient qu’ils ont organisé quantité de réunions d’informations, et c’est vrai. Mon sentiment est que les unions régionales n’avaient pas la compétence pour faire la synthèse des informations glanées sur les sites officiels et la diffuser en temps réel, comme il le faudrait en cas de pandémie. Le Comité de lutte contre la grippe réunit les meilleurs experts de France sur le sujet : c’est à eux qu’il revient de valider un message court, diffusé à chaque nouvelle recommandation – sur laquelle ils sont de toute façon consultés. Quitte à ce que nous, dans nos réseaux, renforcions cette information, issue du ministère et validée par le Comité, afin d’éviter le « syndrome de Tchernobyl ». Je trouve moi aussi invraisemblable que l’on ne dispose pas d’une liste des adresses électroniques de l’ensemble des médecins et des pharmaciens afin d’adresser à tous très rapidement une information sanitaire, quand c’est nécessaire.
Mme Catherine Lemorton. On pourrait parfaitement trouver un moyen d’informer quasiment en temps réel l’ensemble des médecins. Lorsqu’un lot de médicaments doit être retiré du marché, l’information est immédiatement transmise par l’Agence française de sécurité sanitaire des produits de santé aux 23 000 pharmacies de France et le lot récupéré en moins de trente-six heures.
M. Thierry Blanchon. Tout à fait. Sans oublier d’expliquer pourquoi on est conduit à donner telle nouvelle recommandation ni de préciser qu’elle a été validée par le Comité de lutte contre la grippe.
M. le président Jean-Christophe Lagarde. Peut-on dire que si le maximum a été fait pour informer le public de façon transparente, il n’y a pas eu d’explications complémentaires particulières à l’intention des médecins ? Il y a eu en tout cas un sérieux problème de communication. A-t-on estimé que puisque le grand public disposait des informations dans Le Figaro, Le Monde, Libération et tous autres médias, les médecins n’avaient qu’à s’y informer eux aussi ? C’est en tout cas le sentiment que j’ai eu lorsqu’un pédiatre m’a interrogé parce que j’étais maire, pour en savoir plus sur cette grippe !
M. Thierry Blanchon. Des patients demandaient à leur médecin ce qu’il pensait de la nouvelle recommandation annoncée au journal télévisé de la veille ou du jour, dont l’intéressé n’était même pas informé ! Ce n’est pas la même chose que de s’adresser au grand public ou à des professionnels de santé. Les unions régionales de médecins libéraux peuvent éventuellement relayer l’information, comme tout médecin le fait vis-à-vis de ses patients, mais ce n’est pas à elles de la créer.
M. Jean-Marie Cohen. Les médecins et les pharmaciens des groupes régionaux d’observation de la grippe nous ont dit qu’à partir de juillet, tous leurs clients les interrogeaient sur la grippe et qu’ils étaient dans l’incapacité de leur répondre, ne disposant pas d’autres informations que celles des médias, n’étant pas allés en chercher ailleurs et n’ayant de toute façon pas le recul nécessaire pour mieux analyser le phénomène.
M. le président Jean-Christophe Lagarde. S’ils ne sont pas allés chercher davantage d’informations, est-ce parce qu’ils se sont sentis exclus ?
M. Jean-Marie Cohen. Il faut être conscient qu’au centre national de coordination des groupes régionaux d’observation de la grippe, où nous sommes pourtant très proches des sources, quatre personnes travaillaient à plein temps pour faire la synthèse de toutes les informations disponibles, l’une de ces personnes employant tout son temps à rechercher ces informations.
Mme Catherine Lemorton. N’avez-vous pas le sentiment, avec un peu de recul, que le dispositif a été rigide et a eu du mal à s’adapter ? Vous nous avez dit, monsieur, ne pas avoir dormi jusqu’à Noël, je comprends ce que vous avez voulu dire, mais beaucoup de vos confrères ont parfaitement dormi durant tout l’épisode – j’en ai côtoyés beaucoup. On disposait quand même des retours d’expérience de l’hémisphère Sud, notamment des départements et territoires d’outre-mer, où l’on avait bien perçu que l’épidémie n’était pas aussi grave que prévu.
Estimez-vous que les vaccins, avec ou sans adjuvant, ont été livrés avec retard ?
Ne croyez-vous pas que l’on a commis une erreur au départ en voulant vacciner un maximum de personnes ? N’aurait-il pas été plus judicieux de se demander d’abord quel pourcentage de personnes vaccinées il fallait atteindre pour protéger la majeure partie de la population ? De l’objectif initial, démesuré, a découlé toute l’organisation ultérieure. Il était irréaliste de penser pouvoir vacciner deux fois 47 millions de personnes à trois semaines d’intervalle, car on partait au départ de l’hypothèse de deux injections, et ce, tout en écartant de l’opération les médecins et les infirmiers libéraux. Cela, je l’ai dit dès juillet 2009. Les experts peuvent-ils dire quel pourcentage de la population doit être vacciné pour protéger l’ensemble ?
M. le président Jean-Christophe Lagarde. Avez-vous observé, messieurs, que la vaccination ait, à un moment quelconque, influé sur le pic de la pandémie ?
M. Thierry Blanchon. Pour ce qui est du retour d’expérience de l’hémisphère Sud, beaucoup d’articles ont été publiés, un colloque a été organisé dès septembre par l’Institut de veille sanitaire. Le problème est que l’on n’a jamais pu écarter totalement l’hypothèse de la dangerosité de cette pandémie avec des cas particulièrement graves, difficiles à pronostiquer. Nous avons très vite compris dans les groupes régionaux d’observation de la grippe et le réseau Sentinelles que l’épidémie était modérée, ce qui ne signifie pas que cette grippe n’était pas grave. Le nombre de patients hospitalisés, en réanimation ou en service de maladies infectieuses, et dont les prélèvements étaient positifs, était important, sans que l’on puisse toutefois faire de comparaisons avec les années précédentes puisqu’il n’existait pas antérieurement de dispositif hospitalier pérenne de surveillance du nombre de patients hospitalisés pour grippe, ni d’organisation systématique de prélèvements. Cela n’a été mis en place qu’à l’occasion de cette pandémie, pour laquelle il y avait obligation de déclaration. Le nombre de prélèvements effectués a été bien supérieur à ce qu’il est d’habitude, ce qui rend hasardeuse toute comparaison. Nous sommes incapables, encore aujourd’hui, de dire s’il y a eu ou non davantage de cas graves de grippe ayant exigé une hospitalisation que les autres années. Il nous est également très difficile de dire à partir de quel moment on a su que cela n’était pas si grave que cela – si cela a jamais été le cas. Le même biais vaut pour la mortalité. On entend encore dire dans les médias que la grippe A(H1N1) a été beaucoup moins meurtrière que la grippe saisonnière, ce qui n’a aucun sens car on ne dispose d’aucun élément de comparaison. Cette grippe a été à l’origine directe de la mort de quelque 400 personnes, ce qui est très supérieur à la mortalité directe observée d’habitude. De ce seul fait, personne ne pouvait assurer que nous n’avions pas affaire à une grippe grave. Cela étant, le virus de la grippe était aussi plus systématiquement recherché, ce qui a pu biaiser les données.
Pour ce qui est des vaccins, nous n’avons pas le sentiment qu’ils ont été livrés avec retard par rapport à ce qui avait été annoncé par les pouvoirs publics, même s’ils l’ont été trop tard par rapport à la vague épidémique qui avait démarré en septembre et avait déjà fortement grossi fin octobre, quand la vaccination a commencé.
Celle-ci a-t-elle cassé le pic épidémique ? Très sincèrement, non, car on n’a pas réussi à obtenir assez tôt une couverture vaccinale suffisante.
Enfin, quel pourcentage et quelles catégories de la population faut-il vacciner pour escompter une protection de l’ensemble ? La réponse à cette question relève du Comité de lutte contre la grippe qui compte parmi ses membres des épidémiologistes, des statisticiens, des mathématiciens, capables de modéliser les épidémies. Ces experts, notamment monsieur Fabrice Carrat, membre du comité et qui fait partie de la même unité de l’Institut national de la santé et de la recherche médicale que nous, s’apprêtent à adapter les paramètres des modèles en fonction des connaissances acquises sur la pandémie. C’est en améliorant encore les modèles disponibles qu’on parviendra à déterminer qui il faut vacciner et à quel moment pour « casser » l’épidémie. Pour le reste, je partage votre avis qu’il était aberrant de penser vacciner 47 millions de personnes par deux injections à trois semaines d’intervalle, alors que la pandémie était déjà bien installée quand les vaccins ont été livrés et que les médecins et infirmiers libéraux avaient été exclus de l’opération.
M. Jean-Marie Cohen. Le groupe régional d’observation de la grippe de La Réunion nous avait informés que le système de soins de l’île n’avait pas été débordé par la grippe H1N1 et que le virus était « comme celui du chikungunya, mais en moins fort », ce qui était rassurant.
Nous étions également en contact quotidien avec le centre de Melbourne en Australie, d’où les informations qui nous parvenaient étaient mitigées. Nos homologues nous avaient fait savoir que le pays était confronté, avec le virus H1N1, à la plus forte épidémie de grippe depuis dix ans, laquelle se conjuguait avec la grippe saisonnière, sachant qu’au début, celle-ci l’emportait, avant que la tendance ne s’inverse. Ils nous avaient également indiqué que l’épidémie avait causé des morts chez des enfants et des adultes jeunes en bonne santé. Il est difficile de dire si notre dispositif a été trop rigide, car nous recevions des informations, les unes rassurantes, les autres inquiétantes.
Les vaccins sont-ils arrivés avec retard ? Le fait même que vous posiez cette question est la preuve qu’un travail remarquable a été réalisé cette fois-ci, car lors de toutes les pandémies précédentes, le vaccin n’a jamais été au point qu’un an après la première vague. C’est la première fois que l’on dispose d’un vaccin plus tôt. Certes, on en a peut-être fait un peu trop et le dispositif a-t-il été surdimensionné. Il n’empêche que cela a permis de se poser les bonnes questions et d’obtenir des vaccins beaucoup plus vite que d’habitude. Disposer d’un vaccin aussi tôt, au décours de la première vague pandémique, est un privilège dont tous ne pouvaient bénéficier. Le Gouvernement était dès lors confronté à un double écueil dans sa communication : soit il disait qu’il n’y aurait pas de vaccin pour tous, au risque de provoquer une panique, voire des attaques de pharmacies et de centres de vaccination, soit il taisait que c’était un privilège et personne ne s’alarmait. Il n’a pas réussi à surmonter cette contradiction.
Pouvait-on raisonnablement espérer réussir à vacciner 47 millions de personnes d’un coup ? Entendant évoquer ce projet à la radio, ma première réaction a été de dire que c’était fou. Lorsque j’ai demandé à l’équipe de Mme Roselyne Bachelot-Narquin pourquoi les praticiens libéraux, qui tous les ans vaccinent en un mois dix à douze millions de nos concitoyens contre la grippe saisonnière, avaient été exclus de l’opération, on m’a expliqué que l’obstacle majeur résidait dans la gestion des groupes prioritaires. Les femmes enceintes constituaient un groupe prioritaire, mais un médecin de ville n’en voit pas plus de dix par semaine en consultation. Comment dès lors assurer la vaccination de tout ce groupe ? Cette épidémie a mis en évidence que la médecine de ville n’est pas organisée dans notre pays pour mener une campagne de vaccination de masse en urgence. L’un des objectifs que je fixe aux groupes régionaux d’observation de la grippe est de pousser les représentants des professionnels de santé libéraux à mettre en place sous deux ans un dispositif leur permettant d’y pourvoir.
La vaccination a-t-elle eu une incidence sur la vague pandémique ? Clairement non.
Était-il absurde de nourrir le dessein de vacciner tout le monde ? Sur un plan médical, ce n’était pas cohérent mais sur un plan politique, c’était la seule solution possible. Les pouvoirs publics ne pouvaient pas dire que le vaccin serait réservé à certaines catégories de population.
M. le président Jean-Christophe Lagarde. On a bien dit qu’il y aurait des publics prioritaires. Cela étant, vous êtes le premier, parmi toutes les personnes que nous avons auditionnées jusqu’à présent, à nous dire que la ministre vous a expliqué que les médecins libéraux n’avaient pas été associés en raison des difficultés qu’aurait posées la gestion des groupes prioritaires, ce qui est tout de même une explication plus satisfaisante que celles entendues jusqu’à présent, comme le fait que les médecins n’avaient pas de frigidaire ou autres arguments tout aussi fantaisistes !
M. Jean-Marie Cohen. Ce n’est pas la ministre qui me l’a dit, mais son directeur de cabinet.
Mme Catherine Lemorton. Lorsque la ministre a résilié les contrats de commande de vaccins le 12 janvier dernier, le ministère n’avait aucune idée de l’état d’avancement de la vaccination chez les publics prioritaires.
M. Jean-Louis Touraine. Première question, à laquelle j’associe notre collègue Gérard Bapt : comment expliquez-vous le retard, non pas dans la fabrication des vaccins par les laboratoires, mais dans leur dispensation à la population ? La définition des groupes à risques a pris du temps, sans que ces groupes soient d’ailleurs au final davantage vaccinés, et a été très diversement perçue. Les personnels de santé, notamment hospitaliers, faisaient partie des publics prioritaires alors qu’ils ont été assez réticents à se faire vacciner, pour des raisons diverses, l’une étant que ne se sentant associés en rien, ils ne voyaient pas la raison d’être vaccinés en urgence. Cela a abouti pendant un temps à un stockage de vaccins non utilisés qui a contribué à retarder la vaccination du reste de la population, et partant sa protection, sachant qu’il faut au moins deux semaines pour obtenir une réponse immunitaire.
Seconde question : pouvez-vous évaluer l’incidence qu’aura la gestion, pour le moins imparfaite, de cette campagne de vaccination sur les campagnes ultérieures, contre la grippe saisonnière par exemple ? Les professionnels de santé seront-ils aussi enthousiastes que d’habitude pour y participer ? La population ne sera-t-elle pas plus réticente ? Si tel devait être le cas, il faudrait engager de nouvelles dépenses de communication pour restaurer l’image de la vaccination, acte de santé publique, à la fois parmi les professionnels de santé et dans la population générale. Il me semble – ce n’est toutefois là que mon sentiment – que cette image a été altérée. Si l’an prochain le taux de vaccination contre la grippe saisonnière diminue de 20 %, que fera-t-on pour redonner confiance à la population ?
M. Guy Lefrand. Si les médecins libéraux n’ont pas été initialement associés à la campagne de vaccination, c’est qu’ils n’auraient pas compté assez de membres de groupes prioritaires dans leur patientèle, vous aurait-on dit. Cela ne me paraît pas un argument suffisant. La décision n’était-elle pas liée également au conditionnement multi-doses des vaccins ?
Il est agréable, tant l’industrie pharmaceutique a été critiquée, de vous entendre souligner que pour la première fois, un vaccin a été disponible durant la première vague d’une pandémie. Peut-on espérer encore des progrès et avoir dans le futur des vaccins encore plus rapidement ?
M. Jean-Marie Cohen. Les réticences des médecins et des infirmières à se faire vacciner tiennent largement au fait que le vaccin contre la grippe A(H1N1) a été présenté comme très différent des vaccins contre la grippe saisonnière. Toutes les femmes susceptibles d’être enceintes se sont par exemple dit qu’elles devaient absolument éviter un vaccin adjuvanté. Le flou de l’information, autour notamment des adjuvants, a freiné considérablement la campagne. J’éprouve pour ma part une certaine rancune à l’égard de confrères qui ont, peut-être en toute bonne foi, raconté n’importe quoi sur les adjuvants. Il n’empêche que cela a singulièrement compliqué la tâche de ceux qui voulaient faire bien, en toute honnêteté.
M. Guy Lefrand. Est-ce la complexité même des protocoles qui a empêché que les libéraux soient associés ?
M. Jean-Marie Cohen. Si les libéraux ont été écartés, c’est qu’il fallait à la fois gérer des vaccins conditionnés en boîtes de dix, jongler entre vaccins adjuvantés et non adjuvantés selon les publics, et suivre des directives concernant les publics prioritaires, qui changeaient quasiment d’une semaine sur l’autre en fonction de l’évolution des connaissances et de la livraison, plus ou moins rapide, des vaccins.
M. le président Jean-Christophe Lagarde. Les médecins de ville n’auraient pas été capables de gérer cela dans leur cabinet quand des infirmières, et même des élèves infirmières, le faisaient dans les centres de vaccination ?
M. Jean-Marie Cohen. Le problème n’était pas de procéder à l’injection, mais de gérer l’ensemble des vaccins disponibles, les uns sans adjuvant, les autres avec, chacun s’adressant à un public prioritaire précis.
M. le président Jean-Christophe Lagarde. Si les médecins et les infirmières de notre pays n’en sont pas capables, il y a de quoi s’inquiéter pour notre système de santé !
M. Jean-Marie Cohen. Devant toutes les directives qu’ils ont reçues, les centres de vaccination eux-mêmes parfois ne comprenaient plus ce qu’ils devaient faire.
M. le président Jean-Christophe Lagarde. C’est encore un autre sujet. Nous regarderons avec les préfets, lorsque nous les auditionnerons, s’il y a eu des dysfonctionnements.
M. Thierry Blanchon. Alors que le vaccin contre la grippe pandémique et celui contre la grippe saisonnière sont très proches, le public les a perçus comme très différents. Je ne pense pas qu’il y aura d’incidence sur la vaccination contre la grippe saisonnière à l’automne prochain, même s’il faudra sans doute apporter des précisions. Le problème dans cette campagne de vaccination a vraiment été le manque d’explications. On se dit maintenant, avec le recul, que la bombe aurait pu être désamorcée assez facilement en donnant aux professionnels de santé toutes les explications nécessaires dès le 21 octobre, lorsqu’on leur a ouvert la vaccination, en les assurant notamment que les vaccins avaient fait l’objet d’une procédure rigoureuse de validation avant leur mise sur le marché, de façon qu’ils soient convaincus à la fois de leur non-dangerosité et de leur utilité, et puissent convaincre leurs patients. Je suis sûr que dans ces conditions ils se seraient fait vacciner et que cela aurait enclenché une tout autre dynamique. En effet, en novembre, lorsque la population a vu que les professionnels ne s’étaient pas fait vacciner en nombre – le phénomène ayant été largement relayé par les médias – elle a été peu encline à le faire elle-même.
M. Jean-Louis Touraine. Il y a eu une perte de confiance dans la vaccination, y compris les vaccinations infantiles, qu’on constate tous les jours sur le terrain et contre laquelle il va falloir se battre. Il existait dans notre pays un courant de pensée réfractaire à la vaccination, jusqu’alors assez marginal. On lui a, hélas, offert une opportunité de se faire entendre. Beaucoup de gens n’avaient aucune opinion particulière sur la vaccination en général. Ils y recouraient parce qu’on leur disait qu’il le fallait. Maintenant qu’ils ont entendu l’inverse, je ne suis pas sûr qu’ils ne deviendront pas hostiles à la vaccination.
M. le rapporteur. On a constaté cette même réaction de l’opinion publique dans tous les pays.
M. Thierry Blanchon. L’Agence française de sécurité sanitaire des produits de santé, qui a assuré un suivi rigoureux des effets secondaires du vaccin pandémique, a pu apporter la preuve qu’il n’en avait pas induit davantage que le vaccin saisonnier. Je ne dis pas qu’un effort particulier de communication ne sera pas nécessaire, mais peut-être pas aussi important que vous le dites.
M. le président Jean-Christophe Lagarde. Lorsqu’on livre une information massive à la population – et on ne peut pas s’en dispenser si on veut éviter le « syndrome de Tchernobyl » –, il faut s’attendre à ce genre de réactions car elle ne possède pas les compétences pour analyser cette information dans le détail et la moduler comme il serait nécessaire. Elle ne s’y intéresse d’ailleurs souvent pas. Et sa réaction ne peut qu’être exacerbée lorsque l’information est inquiétante et que les médecins, qui seraient les seuls à même de la rassurer, ne savent eux-mêmes pas répondre.
Dans la perspective d’une prochaine pandémie, il faut réfléchir aux moyens, sans rien lui cacher, de ne pas effrayer la population et permettre que des relais fonctionnent, notamment auprès des professionnels de santé, afin que la sérénité l’emporte et qu’on évite les dérapages qui ont eu lieu dans cette campagne. Que les personnels de La Poste aient à un moment refusé de transporter les prélèvements effectués par les médecins, comme vous nous l’avez appris, montre bien que l’on était dans le fantasme le plus total ! C’est la preuve que l’on n’a pas su communiquer efficacement.
M. Jean-Marie Cohen. Un ouvrage est sorti il y a deux ans, intitulé La grande menace, sur la couverture duquel l’éditeur avait apposé un bandeau « 500 000 morts ». Dans la seconde édition, le bandeau a disparu. Ce chiffre était totalement fantaisiste.
M. le président Jean-Christophe Lagarde. Un éditeur, pour gagner de l’argent, cherche à accrocher les lecteurs. Lors de cette pandémie, ce sont des médecins eux-mêmes qui ont parlé de dizaines de milliers de morts…
M. Jean-Louis Touraine. L’affaire qui a entouré le vaccin contre l’hépatite B a eu un effet catastrophique sur l’opinion au sujet des vaccins.
M. le président Jean-Christophe Lagarde. Nous faisons confiance au rapporteur de cette commission d’enquête pour formuler des propositions qui permettent de faire mieux les fois prochaines.
Il me reste, messieurs, à vous remercier.
La séance est levée à dix-huit heures.
Audition de M. Jean Leonetti,
président de la Fédération hospitalière de France
(Procès-verbal de la séance du mercredi 26 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête,
puis de M. Guy Lefrand, vice-président)
La séance est ouverte à dix-huit heures.
(M. Jean Leonetti prête serment.)
M. Jean-Pierre Door, rapporteur. Je vous propose d’engager immédiatement notre échange.
Pouvez-vous nous dire comment se sont organisés les hôpitaux publics pour faire face à la pandémie dans les domaines de l’information, de la formation des personnels, des services dédiés et des plans blancs ?
Quelles ont été leurs relations avec les agences régionales de l’hospitalisation, qui avaient communiqué des directives à tous les hôpitaux publics pour faire face à cette pandémie ?
Comment se sont déroulées les opérations de ravitaillement en matériels, masques, antiviraux puis vaccins ?
Dans quel cadre s’est déroulée la vaccination, dans un premier temps, des personnels hospitaliers – et de leurs proches qui l’ont demandé – puis, dans un second temps, du grand public ?
Avez-vous connaissance du coût financier de la grippe pour les établissements publics en France ?
M. Jean Leonetti, président de la Fédération hospitalière de France. En tant qu’organisme d’appui, d’information et de relais, la Fédération hospitalière de France recevait non seulement des informations de la direction générale de la santé et des services du ministère, mais également du terrain et des hôpitaux, en particulier de l’Assistance publique-Hôpitaux de Paris. J’ai ainsi l’impression que l’on a déclenché une énorme machine de guerre face à une épidémie pressentie comme redoutable, au motif que l’on pensait que la médecine générale allait être submergée de malades, que les hôpitaux, en particulier les services de réanimation recevraient un afflux de cas graves et qu’il convenait donc de vacciner de manière décentralisée, avec les collectivités territoriales comme support. On s’est par la suite aperçu que la situation était bien moins grave. De la sorte, le processus s’est déroulé par phases successives et de façon évolutive.
Première des vaccinations organisées, la vaccination à l’hôpital n’a pas été à la hauteur de ce qu’on aurait pu souhaiter en temps de pandémie : seulement 37 % des personnels hospitaliers ont été vaccinés, un peu plus chez les médecins que parmi le personnel infirmier. Il est vrai que les avis médicaux à son sujet étaient contradictoires et tranchés : certains affirmaient que ce n’était pas la peine de se faire vacciner tandis que d’autres incitaient l’ensemble des services à le faire pour des raisons à la fois médicales et médico-légales.
Une première ouverture a eu lieu à la demande des proches des personnels hospitaliers vaccinés. Comme ils ne recevaient pas leur bon de vaccination alors que la maladie était annoncée comme grave et que des doses de vaccin étaient disponibles à l’hôpital puisque tout le monde ne se faisait pas vacciner, ils ont réclamé une vaccination, et le corps médical a fini par accéder à leur demande. Le même phénomène s’est produit dans les centres de vaccination en ville. Au début, on n’acceptait que les gens qui avaient reçu leur bon, selon le niveau de risque établi par le plan – enfants, femmes enceintes, personnes à risque – puis, comme les gens faisaient la queue – tout au moins au début –, on les a admis en consultation et on les a vaccinés. L’élargissement s’est fait au fur et à mesure, avec un petit décalage parfois entre les instructions données et les prises de décision sur le terrain, qui relevaient du bon sens.
Je ne décrirai pas en détail l’organisation des hôpitaux publics. Vous la connaissez : elle avait pour but d’assurer la continuité de l’activité et comportait un plan blanc, des exercices programmés et des simulations de déprogrammation. Les hôpitaux étaient prêts car il avait été annoncé, bien en amont, l’arrivée d’une grippe très contagieuse, qui devait toucher 30 % de la population et tuer massivement, notamment les enfants et les femmes enceintes. Si les jeunes et les femmes enceintes ont hélas payé un certain tribut à cette grippe, leur nombre n’a heureusement pas été aussi important qu’il avait été craint.
M. le rapporteur. L’envoi d’internes et d’étudiants à l’extérieur a-t-il entraîné une désorganisation des services ? L’Assistance publique-Hôpitaux de Paris et les Hospices civils de Lyon nous ont fait part de dysfonctionnements.
M. Jean Leonetti. Deux situations auraient été possibles. À notre connaissance, elles n’ont pas eu lieu.
Premièrement, il aurait pu y avoir une saturation des services de réanimation car les malades graves de la grippe avaient besoin d’un matériel d’oxygénation extracorporelle et de longues durées d’hospitalisation, notamment en réanimation, dans une période où la population était touchée par la grippe saisonnière, les gastro-entérites et les bronchiolites. Or, si certains services ont été pleins, on n’a pas connu de saturation.
M. le président Jean-Christophe Lagarde. Cette addition de phénomènes a-t-elle permis à la fédération de déterminer dans les hôpitaux un seuil d’accueil maximal qu’il faudrait prendre en compte si on avait affaire à un virus plus virulent ? L’expérience a-t-elle permis de mieux évaluer nos capacités de traitement ?
M. Jean Leonetti. Une mission d’expertise menée avec le ministère avant l’épidémie avait permis d’évaluer la capacité d’accueil des services de réanimation et de soins intensifs en cas de pandémie. Si celle-ci avait vraiment touché 30 % de la population, avec un taux de mortalité de 5 %, je ne suis pas sûr, en vérité, qu’on n’aurait pas été, à un moment, débordé puisque, avec l’épidémie qu’on a connue, même si les services n’ont pas été saturés, ils étaient, dans de nombreux cas, pleins. Cela nous a donné une idée de ce que peut être une pandémie virale, et des mesures à prendre dans ce cas.
Pour compléter ma réponse à M. Jean-Pierre Door, je précise que les internes, les externes et les élèves infirmiers ne devaient pas sortir des hôpitaux. Les secteurs avaient bien été catégorisés : l’hôpital recevait les malades avérés, la vaccination avait lieu à l’extérieur. L’idée, qui est assez logique, était de ne pas modifier les flux : on ne devrait pas faire entrer des populations à l’intérieur de l’hôpital pour les vacciner où étaient soignés des malades graves atteints d’une pandémie caractérisée par une grande contagiosité.
Mais, devant la pénurie de personnels médicaux – puisqu’on ne pouvait pas recourir aux médecins généralistes – on s’est trouvé dans l’obligation de faire appel aux internes. En dehors de Paris où cela a entraîné des problèmes, essentiellement parce que les centres de vaccination étaient excentrés, cela s’est plutôt bien déroulé. Il n’y a pas eu, à notre connaissance, de déprogrammation.
Nous nous sommes alors tous demandé pourquoi, au lieu de faire sortir les internes, on ne vaccinait pas à l’intérieur de l’hôpital. C’est parce qu’on s’attendait à ce qu’il y ait un deuxième pic. Le premier n’avait pas été virulent mais le virus pouvait muter, entraînant une recrudescence de vaccinations. L’hôpital restait donc sur le pied de guerre. Il ne voulait pas se démunir localement pour la vaccination afin d’être prêt à traiter éventuellement les cas graves causés par la mutation du virus.
M. le président Jean-Christophe Lagarde. En septembre-octobre, les informations concernant l’hémisphère Sud et le fait que les services des hôpitaux n’étaient pas débordés montraient que l’épidémie était moins forte que prévu. N’avez-vous pas eu le sentiment que la rigidité du système empêchait de s’adapter. Trouvez-vous logique qu’on n’ait pas demandé aux hôpitaux de s’organiser pour participer à la vaccination en réservant un espace pour cela ? Après tout, les hôpitaux sont des endroits où les gens se rendent pour subir des actes médicaux. Ne pensez-vous pas que cela aurait été jouable ? Ne faudrait-il pas prendre en compte cet élément lors d’une future épidémie ?
M. Jean Leonetti. La vaccination à l’hôpital n’est possible que sous certaines conditions : l’hôpital doit avoir des locaux vides suffisamment grands et il faut prévoir un apport supplémentaire de personnels extérieurs afin de ne pas déprogrammer les activités quotidiennes de l’hôpital, surtout en période hivernale où se développent d’autres pathologies, ce qui nécessite d’anticiper les différents phénomènes.
M. le président Jean-Christophe Lagarde. Les internes ont bien été envoyés à l’extérieur…
M. Jean Leonetti. Ils ne sont pas très nombreux à l’avoir été. De plus, le fonctionnement d’un service hospitalier repose non pas sur les internes, mais sur des seniors. Les blocs opératoires et les salles d’accouchement n’ont pas été déprogrammés.
Ce qui a été choquant, mais qui était difficilement prévisible, c’est que, lorsque les internes ont été appelés en renfort, ils sont arrivés après le pic de vaccinations et ils ont quelquefois eu le sentiment qu’ils auraient été plus utiles à l’hôpital qu’à attendre le « client » dans un centre...
L’impression que j’ai eue, c’est qu’on recherchait l’organisation la plus rationnelle possible mais qu’on courrait toujours après l’événement qui venait contredire la prévision, le mot d’ordre constant étant d’assurer la sécurité des malades les plus graves, en cohérence avec la mission essentielle de l’hôpital.
Cela étant, il s’est posé la question, en fin de vaccination, de la fermeture de tel ou tel centre de vaccination. Lorsque dix personnes seulement venaient se faire vacciner, on aurait pu leur demander d’aller à l’hôpital et ainsi éviter aux internes de se déplacer.
En cas de nouvelle épidémie, une certaine souplesse serait probablement utile dans la gestion des actions menées localement.
M. le président Jean-Christophe Lagarde. Sans doute serait-il intéressant, s’agissant de la nécessaire souplesse, que vous rencontriez le secrétaire général de la défense nationale…
M. Jean Leonetti. Une dotation de 10 millions d’euros avait été prévue dans le cadre des missions d’intérêt général et de l’aide à la contractualisation, mais le coût a atteint entre 110 et 130 millions d’euros pour l’ensemble des hôpitaux français, en incluant les pathologies, financées dans le cadre de la tarification à l’activité.
Mme Catherine Lemorton. Les publics prioritaires – femmes enceintes, personnes atteintes d’affections de longue durée – sont connus du milieu hospitalier où ils doivent se rendre régulièrement. Les hôpitaux disposant des doses de vaccin non utilisées, leur a-t-on proposé de se faire vacciner lors de leurs consultations habituelles ?
M. Jean Leonetti. Les personnes vulnérables ont été assez rapidement et efficacement vaccinées dans les centres de vaccination. S’il n’y a eu presque personne le premier jour, la diffusion d’une information a ensuite provoqué un pic de vaccinations, si bien qu’il y a eu des queues à l’extérieur des centres dans les collectivités qui n’avaient pas prévu de gymnases ou de grandes salles à cet effet. Puis, on a assisté à une chute des vaccinations lorsque sont arrivées des nouvelles rassurantes.
On a recensé 1 334 cas graves et 312 décès. Les cas graves se sont caractérisés par la nécessité d’une oxygénation par membrane extracorporelle et des réanimations beaucoup plus longues que celles pratiquées normalement pour une détresse respiratoire aiguë.
M. le rapporteur. Avez-vous été dotés de matériels respiratoires supplémentaires ? Cette dotation était-elle suffisante ?
M. Jean Leonetti. Oui. Cette dotation était antérieure à l’épidémie de grippe A(H1N1). Elle remontait à l’alerte précédente de pandémie H5N1.
Les moyens des hôpitaux ont été suffisants pour recevoir et soigner les malades graves dans le cadre de l’épidémie que nous avons connue. Il n’y a pas eu de déprogrammation au-delà de quarante-huit heures.
La vraie question est celle de l’évolution du système en fonction de l’évolution de l’épidémie.
Les premiers cas de grippe ont été acheminés à l’hôpital par les services d’aide médicale d’urgence (SAMU) ou les services mobiles d’urgence et de réanimation (SMUR) et placés en isolement dans les services de réanimation, les personnels soignants étant soumis à de contraintes d’hygiène et de sécurité drastiques. Il n’en a pas été de même pour les cas suivants. On a élargi le processus et abaissé le seuil de réponse.
D’ailleurs, un enseignement est à tirer de l’application des mesures d’hygiène et de sécurité dans les hôpitaux où il y a eu un lavage des mains quasi obsessionnel : on a observé une diminution de la transmission des maladies infectieuses durant la période. Cela nous a réappris des gestes élémentaires d’hygiène.
M. le président Jean-Christophe Lagarde. Cela a-t-il également réduit le nombre des maladies nosocomiales ?
M. Jean Leonetti. Je ne suis pas sûr que le lavage des mains soit suffisant pour cela en raison de la virulence des virus et de leur adaptation aux antibiothérapies, qui font de l’hôpital un milieu particulièrement propice à leur diffusion.
M. Jean-Louis Touraine. Dans certains secteurs, il y a eu, pendant quelques semaines, une relative désorganisation des services du fait de la réquisition des internes.
J’ai également relevé deux aspects quelque peu surréalistes.
Premièrement, alors que médecins des hôpitaux et malades chroniques suivis régulièrement à l’hôpital – dialysés, greffés, porteurs du sida – allaient à contrecœur dans les centres de vaccination situés dans des endroits excentrés – ce qui a provoqué une sous-vaccination de ces populations à risque –, il aurait été plus simple de vacciner ces malades en même temps que leur étaient prodigués les autres soins qu’ils viennent recevoir régulièrement à l’hôpital.
Deuxièmement, lorsqu’il a été possible de vacciner certaines populations de malades dans les hôpitaux, …
M. Jean Leonetti. En phase 2 !
M. Jean-Louis Touraine. … comme les médecins libéraux qui les suivaient n’avaient pas le droit de les vacciner dans leur cabinet, ils les faisaient venir dans l’hôpital où ils travaillaient une partie de la semaine pour les faire bénéficier du vaccin…
En résumé, des patients qui se rendent régulièrement à l’hôpital ont dû aller dans des centres de vaccination extérieurs alors que des personnes suivies en ville ont dû se rendre à l’hôpital pour se faire vacciner. Au lieu de distribuer les vaccins dans tous les lieux de santé, on a déplacé les gens, ce qui a entraîné des pertes en ligne pour la vaccination.
La leçon qui me semble devoir être tirée de ces dysfonctionnements est qu’il faut se calquer le plus possible sur l’existant et procéder à la vaccination là où elle est naturelle, sans demander à la médecine de ville ou à la médecine hospitalière de modifier leurs pratiques.
M. Jean Leonetti. Si l’on ne garde pas à l’esprit le fait qu’on s’est toujours placé – même lorsque les faits démentaient les hypothèses – dans l’éventualité du pire, on ne peut pas comprendre l’organisation mise en place ni la relative lenteur de l’adaptation du dispositif.
Pourquoi les médecins généralistes ne pouvaient-ils pas vacciner ? Parce que les vaccins étaient distribués en multidoses. Quand une dose était utilisée sur les dix, les neufs autres étaient perdues si elles n’étaient pas utilisées dans les vingt-quatre heures. Comme on n’était pas sûr d’avoir suffisamment de doses, on n’a pas voulu gaspiller les stocks dont on disposait, ce qui, quand on y réfléchit, n’est pas complètement illogique.
Pourquoi n’a-t-on pas vacciné dans les hôpitaux ? Parce que les queues qu’il y avait dans les centres de vaccination, même quand il s’agissait de gymnases, dissuadaient de mettre des salles de consultation à la disposition de cette vaccination. L’hôpital aurait été envahi. De plus, les règles d’hygiène et de sécurité interdisaient de faire vacciner des personnes fragiles au même endroit ou à proximité de malades gravement atteints par le virus.
Le nombre de malades graves n’ayant pas été très important, on se dit, après coup, qu’on aurait pu organiser différemment les flux et les espaces. La vraie question à se poser est de savoir si on referait la même chose si c’était à refaire. Mais cette question impose de considérer tous les cas possibles. Un virus ne ressemble pas à un autre. Il peut être plus virulent. Il peut muter. Si l’on connaît une pandémie de la gravité de la grippe espagnole, vaccinera-t-on dans les hôpitaux en détachant des personnels de tels ou tels services à cet effet, en mélangeant les populations fragiles et les malades gravement atteints et en disséminant les doses de vaccin sur l’ensemble des médecins, sans aucune traçabilité ?
Compte tenu de l’épidémie qu’on a connue, on peut en effet dire, a posteriori, qu’il aurait été plus rationnel d’organiser la vaccination à partir du centre hospitalier du fait de ses compétences et du réseau qu’il développe avec la population. Mais on ne peut tirer aucune conclusion pour l’avenir car on ne sait pas si on sera face au même type de pandémie.
L’épidémie a touché l’Australie et la Nouvelle-Calédonie avant d’atteindre l’hexagone, si bien qu’on savait qu’elle se caractérisait par une mortalité importante dans des populations qui n’étaient d’ordinaire pas considérées à risque – jeunes de vingt-cinq ans, femmes enceintes, enfants en bas âge –, ce qui était inquiétant. Mais il y avait aussi une information rassurante, à savoir que la population n’avait été touchée qu’à 15 % et que le taux de mortalité n’atteignait pas les 5 % que on l’avait craints, bien qu’il s’agisse d’un territoire où il n’y avait pas eu de vaccination et où l’on n’avait développé que des règles d’hygiène, de sécurité et d’isolement.
De toutes ces informations, nous avons retenu qu’il y allait y avoir des cas graves, que les hôpitaux devaient être en situation d’accueillir, mais nous n’avions aucune idée de leur nombre. Il n’y avait eu là-bas qu’un pic d’épidémie mais rien ne permettait d’assurer qu’il n’y en aurait pas un second, ou qu’il n’y en aurait pas un second chez nous. Rien ne permettait non plus d’assurer que le virus de l’hémisphère Sud n’allait pas muter et accroître sa virulence.
En même temps, nous avons dû nous livrer à une course à la vaccination puisque nous avons dû l’organiser trois semaines avant la période normale, en distinguant, de surcroît, les personnes âgées, pour qui la grippe saisonnière présentait plus de dangers, et les enfants, les femmes enceintes, les jeunes, les personnes en contact avec les malades et les personnes immunodéficientes, qui constituaient une population à risque pour la grippe A(H1N1).
La vaccination a, d’abord, été réservée aux personnels hospitaliers, puis elle s’est ouverte à l’ambulatoire. Elle a ensuite été assurée à l’extérieur où ont été envoyés, à un certain moment, des internes, pour enfin, être organisée également l’hôpital. On a d’abord vacciné les porteurs de bons, puis toutes les personnes qui se présentaient. Au fur et à mesure de l’évolution de la situation, on a cherché à assouplir le système, tout en restant dans l’hypothèse du pire, que l’on n’a jamais pu totalement exclure : en effet, après le premier pic, un certain nombre d’épidémiologistes et de virologues avaient expliqué qu’il y en aurait un second. Par ailleurs, il y avait eu quatre cas de mutations en Norvège.
M. le président Jean-Christophe Lagarde. Le raisonnement que vous venez de rapporter, et qui sous-tend la philosophie globale du plan tel qu’il a été monté, ne constitue-t-il pas, en se fondant sur le scénario le plus catastrophique, une application excessive du principe de précaution ? À force de préparer la guerre atomique pour ce qui se révèle en définitive n’être qu’un accident de la route, ne risque-t-on pas de décrédibiliser notre capacité de réaction aux yeux de la population ? La stratégie du secrétaire général de la défense nationale me paraît avoir consisté à ne pas bouger son armée en attendant que les renforts de l’autre arrivent…
Il a certes été procédé à des ajustements mais ne faut-il pas accroître notre capacité à décélérer ou à accélérer à nouveau, c’est-à-dire développer notre souplesse de réaction ? Les hôpitaux pourraient y contribuer, même si de nombreux paramètres doivent être pris en compte. Entre ceux qui alarment la population et ceux qui la dissuadent de se faire vacciner, on risque de ne plus être efficace en cas de coup dur.
Il y a quelques semaines, le directeur général de la santé a dit qu’il ne changerait pas grand-chose au plan, s’il était à refaire. Or le caractère incertain de la grippe nécessite qu’on ait un système souple, prêt à parer à la catastrophe comme à accompagner un événement de moindre importance.
M. Jean Leonetti. Quel est le bilan du plan de lutte contre la grippe A(H1N1) ? Il y a eu très peu de morts. Tous les malades ont été pris en charge de façon parfaite par l’ensemble des hôpitaux et personne n’a pâti d’un manque de préparation de ces derniers. C’est un bilan extrêmement positif. Imaginez qu’à l’inverse, on ait manqué, par exemple, de respirateurs…
Cela montre que la vraie question que vous posez est de savoir si la mobilisation des moyens n’était pas trop haute pour la situation telle qu’on l’a trouvée et comment la réajuster en fonction de l’évolution.
Il me semble indispensable, en cas de pandémie du même type, qu’il y ait une organisation nationale, c’est-à-dire que des consignes globales soient données. On ne peut, en effet, imaginer que chaque région mette en place une organisation différente.
Cela étant, une fois ces consignes globales données, il devrait être possible de trouver des adaptations locales en fonction de la situation dans les centres de vaccination
– cas de sur-effectif ou de sous-effectif – sans créer de distorsions entre les territoires. Mais ce n’est pas facile à organiser.
Personnellement, je pense qu’il faudrait suivre le même chemin en cas de nouvelle épidémie. Mais nous pourrions améliorer notre réactivité à chaque nouvelle information sans céder à la panique ou à la banalisation.
Bien que le médico-social ait opposé une résistance farouche à la vaccination, il n’y a eu aucun malade hospitalisé dans ses rangs. Le virus frappait durement les personnes mais de manière aléatoire. Pourquoi tel jeune homme de vingt ans ou telle femme enceinte sont-ils morts alors qu’un vieillard de quatre-vingts ans en contact avec le même virus n’a développé qu’une fébricule simple qui a disparu au bout de vingt-quatre heures ? Nous n’avons pas à ce jour de réponse à cette question.
Lorsque nous serons confrontés à une nouvelle pandémie, il faudra faire attention à ne pas jouer à « Pierre et le loup », sous peine de ne plus être crus par les Français. Nous devrons trouver un système qui soit aussi sécurisant que celui mis en place pour lutter contre la grippe A(H1N1) et suffisamment souple sur le plan local. Je n’ai pas de solution à proposer mais votre commission est là pour en trouver une.
M. le président Jean-Christophe Lagarde. Tout au moins pour en chercher une…
Mme Catherine Lemorton. Le problème est beaucoup plus profond. J’ai l’impression que les gens ne raisonnent plus en termes de balance bénéfice/risque collective mais en termes de balance bénéfice/risque individuelle. Je me suis rendu compte, en tant que pharmacienne, que les gens ne voient pas, dans la vaccination, un moyen de protéger l’ensemble de la population. Ils calculent les risques entraînés par la maladie et les effets secondaires de la vaccination pour eux-mêmes : comme ils ne voyaient pas d’hécatombe due à la grippe et qu’on leur disait qu’il pouvait y avoir des effets secondaires à une vaccination, ils préféraient prendre le risque d’attraper la maladie, considérant qu’ils avaient plus de chances d’en guérir que d’en mourir.
Je ne vois pas ce qu’on peut faire pour inverser la tendance. Si, demain, on trouvait un vaccin contre le sida, je ne suis pas sûre que les Français courraient se faire vacciner…
M. Jean Leonetti. Je dois avouer que, personnellement, je ne courrais pas me faire vacciner contre le sida parce que, compte tenu de mon mode de vie et des contrôles qui entourent les transfusions, je ne me considère pas comme faisant partie des populations à risque.
Mme Catherine Lemorton. Cela n’engage que vous.
M. Jean Leonetti. Ce n’est pas le même cas de figure quand un virus que tout le monde peut attraper se ballade dans l’air.
Cela étant, je rejoins votre préoccupation. Je me demande, moi aussi, comment inciter les Français à avoir une démarche collective de prévention et à sortir d’une démarche individuelle et égoïste ? Celle-ci a des répercussions sur le politique puisqu’elle a été responsable de la mort d’un jeune de quatorze ans dans les Alpes-Maritimes. On doit demander aux personnes concernées si elles ont vraiment fait tout ce qui était possible pour que cet adolescent ait toutes les chances d’être sauvé. C’est la vraie question à se poser dans un contexte médiatique qui, soit crée la panique, soit pousse à la banalisation, en oscillant entre « Vous n’en avez pas fait assez » et « Vous en avez fait trop ».
Comme je l’ai déjà indiqué, le bilan est positif. Les gens ont été vaccinés. Ceux qui ont été gravement atteints par la maladie ont été bien soignés. Il n’y a pas eu beaucoup de morts et celles qui sont intervenues ne sont pas « illégitimes », c’est-à-dire ne sont pas dues à une mauvaise prise en charge, une mauvaise détection ou à un retard dans la vaccination.
Certains vont mettre en balance le coût. Fallait-il dépenser autant ? C’est une question à poser aux Français. Sont-ils prêts à payer pour avoir une sécurité maximale ou abandonne-t-on toute idée de vaccination contre la grippe saisonnière au motif qu’elle ne tue, chaque année, que 5 000 personnes, dont une majorité de personnes âgées qui, de toute façon, seraient mortes un jour ou l’autre ?
Comme vous l’avez souligné, nous vivons dans une société où le risque individuel est évalué. Dans les centres de vaccination, nous avons assisté à de véritables batailles pour obtenir le vaccin sans adjuvant. La même demande a certainement été faite, madame Lemorton, dans votre pharmacie.
M. Guy Lefrand, président. Nous vous remercions, monsieur Jean Leonetti.
La séance est levée à dix-huit heures cinquante.
Audition de M. Pierre Brodard,
secrétaire général de la Fédération nationale des centres de santé
(Procès-verbal de la séance du mercredi 26 mai 2010)
(Présidence de M. Guy Lefrand, vice-président de la commission d’enquête)
La séance est ouverte à dix-huit heures cinquante.
(M. Pierre Brodard prête serment.)
M. Pierre Brodard, secrétaire général de la Fédération nationale des centres de santé. M. David Houri, président de la Fédération nationale des centres de santé
– anciennement Comité national de liaison des centres de santé, lequel existait depuis 1954 –, confronté à de graves problèmes familiaux, m’a demandé de le remplacer.
Je suis également médecin directeur des centres municipaux de santé de la ville de Pantin.
La fédération est l’une des neuf organisations reconnues officiellement comme représentatives des organismes gestionnaires des centres de santé, qu’ils soient municipaux, associatifs ou mutualistes et, à ce titre, elle siège au sein de la commission paritaire nationale des centres de santé. Elle regroupe actuellement à peu près cent cinquante centres de santé, surtout médicaux et polyvalents, situés en majorité dans la région parisienne.
M. Jean-Pierre Door, rapporteur. Comment les centres de santé ont-ils été mobilisés dans le cadre de la campagne de vaccination contre la grippe A(H1N1) ? Tous les centres ont-ils été mobilisés ? L’ont-ils été sur la base du volontariat ? Avez-vous organisé des vaccinations sur l’ensemble du territoire national ?
Comment les centres de santé qui ont participé à la vaccination ont-ils été approvisionnés en vaccins ? Quels sont les personnels qui ont vacciné dans les centres de santé : les médecins, les infirmières, les personnels de santé ?
Enfin, combien de personnes ont-elles été vaccinées dans ces centres ?
M. Pierre Brodard. Dès le mois de juillet 2009, nous avons été sollicités par les directions départementales des affaires sanitaires et sociales et les préfectures pour étudier la faisabilité de l’organisation de séances de vaccination dans les centres de santé. Comme ces derniers sont également des lieux de soins, qui devaient pouvoir accueillir les malades en cas de pandémie, il a paru difficile de leur demander de jouer également un rôle de centre de vaccination. Il a donc été décidé d’organiser la vaccination dans des gymnases ou des salles de spectacle.
Quand les personnels médicaux des centres de santé ont commencé à vacciner, le 16 novembre 2009, ils l’ont fait dans des gymnases.
Cela étant, nous étions conscients que les centres de santé ne pourraient répondre à l’objectif de vaccination de 50 % de la population. Il fallait pour cela que tout le monde s’attelle à la tâche : médecins généralistes, infirmiers libéraux, personnels des centres de santé et hôpitaux.
Les premières personnes à être vaccinées faisaient partie des populations à risque. Or celles-ci sont très fidèles à leur médecin traitant. En conséquence, l’éloignement des centres de vaccination a été pour elles un problème.
Certains centres de santé auraient pu et voulu être centres de vaccination, mais leur demande n’a pas été retenue.
M. Guy Lefrand, président. Du fait de l’éloignement des centres de vaccination dédiés, pensez-vous que vous auriez pu être partie prenante de la chaîne de vaccination ? Autrement dit, alors que les médecins libéraux n’étaient pas autorisés à vacciner en ville, une vaccination par les centres de santé aurait-elle pu être envisagée ?
M. Pierre Brodard. Les centres de santé auraient pu contribuer à la vaccination mais ils n’auraient pas suffi. Au nombre de quatre cents, ils couvrent certaines zones urbaines sensibles, mais pas l’ensemble du territoire national.
Par ailleurs, compte tenu de la pandémie qui s’annonçait, ils n’auraient pu assumer à la fois un rôle de vaccination et un rôle de consultation.
M. le rapporteur. La patientèle des centres de santé est-elle fidèle, ou bien ceux-ci accueillent-ils également d’autres types de patients ?
M. Pierre Brodard. La patientèle est fidèle : les gens viennent y voir leur médecin traitant. Mais cela n’empêche pas d’autres patients de venir utiliser le plateau technique et de profiter de la multidisciplinarité existant dans les centres de santé.
M. Guy Lefrand, président. Les centres de santé qui auraient pu être utilisés comme centres de vaccination auraient-ils dû, pour cela, être réorganisés ? Dans l’affirmative, auriez-vous été à même de procéder à cette réorganisation ?
M. Pierre Brodard. Les centres de santé sont de différentes tailles. Il existe, par exemple, de très grosses structures installées sur 4 000 mètres carrés.
Quand la pandémie s’est annoncée, le centre d’Argenteuil a ainsi affecté un étage à la médecine spécialisée et un autre à la médecine générale, de manière à pouvoir répondre à la demande de la population sans gêner le suivi par les spécialistes.
Certains centres de santé avaient pour leur part prévu de dédier une partie de leurs locaux à la vaccination.
Souvent, les centres de santé sont déjà utilisés pour des vaccinations publiques et gratuites, en lien avec les services communaux d’hygiène et de santé ou les départements.
Les directeurs de centres de santé sont souvent des référents des services communaux d’hygiène et de santé et ils sont également souvent des directeurs de la santé. Un certain nombre d’entre eux ont d’ailleurs organisé des centres de vaccination dans des gymnases et autres lieux collectifs.
Par ailleurs, le travail en équipe, qui implique infirmières et médecins dans les centres de santé, rend possible l’accueil de populations assez importantes. Certains centres de santé sont ainsi habitués à recevoir quatre cents, six cents, voire six cents personnes par jour et disposent à cet effet d’un accueil et d’infirmeries adéquats.
M. Guy Lefrand, président. En résumé, certains centres de santé auraient pu fonctionner comme centres de vaccination sans surcoût, que ce soit en termes d’organisation ou de personnel, tandis que pour d’autres, un tel fonctionnement aurait exigé un réaménagement et, éventuellement, du personnel supplémentaire…
M. Pierre Brodard. Tout à fait.
M. Guy Lefrand, président. Comment expliquez-vous le faible taux de vaccination de la population contre la grippe A(H1N1) ?
M. Pierre Brodard. La population a été mal informée par les médias. Par ailleurs, la pandémie était relativement faible. Même si, en tant que professionnels, nous savions que les services de réanimation pédiatrique commençaient à être débordés, la population n’estimait pas que la situation était grave. Nombreux étaient ceux dont l’entourage comprenait manifestement des personnes qui, bien qu’ayant contracté la grippe, n’avaient pas été très malades.
Les patients à risque sont venus se faire vacciner : il s’agissait de personnes atteintes du sida, de femmes enceintes ou ayant des enfants en bas âge. Mais ce flux s’est vite tari. L’éloignement des centres de vaccination a contribué à ce tarissement.
On peut penser que si la létalité de la maladie avait été plus grande, la tendance aurait été complètement inversée et il aurait été davantage recouru à la vaccination.
Trois phases ont pu être observées : au cours de la première, les séances de vaccination prévues étaient rares car on craignait de manquer de vaccins ; on a ensuite assisté à une généralisation « délirante » des vaccinations – jusqu’à dix dans une matinée – ; au cours de la troisième phase, lorsque la vaccination a été ouverte à la médecine ambulatoire, les centres de santé se sont inscrits pour vacciner, mais le nombre de vaccinations a été très faible.
M. le rapporteur. Tous les centres ont-ils participé à la vaccination ?
M. Pierre Brodard. Je pense que oui. Mais nous avons dû nous battre pour que les centres de santé puissent vacciner.
M. le rapporteur. Disposez-vous de chiffres ?
M. Pierre Brodard. Non, mais je puis vous dire que le nombre de vaccinations a été très faible. Dans les centres de santé de Pantin, par exemple, où nous avions assuré une importante information, j’ai dû vacciner dix personnes en tout et pour tout.
Dans les jours qui ont suivi l’annonce de l’ouverture de la vaccination à la médecine ambulatoire, il n’y a plus eu une seule information concernant la grippe dans les médias. D’ailleurs, la fin de la campagne n’a pas été clairement annoncée : le soufflé était complètement retombé.
Les centres de santé ont dû faire appel au ministère de la santé pour pouvoir être considérés comme des centres de vaccination et être conviés aux réunions d’information sur le sujet.
Par ailleurs, par le biais de la revue Flash-info de la fédération, nous avons pu communiquer des informations à tous les centres de santé et relayer les courriels d’un inspecteur de la direction départementale des affaires sanitaires et sociales de la Seine-Saint-Denis, qui a fait un travail extraordinaire.
M. le rapporteur. Combien compte-t-on de professionnels de santé dans les centres de santé sur l’ensemble du territoire national ?
M. Pierre Brodard. À peu près cinq mille.
M. Guy Lefrand, président. Se sont-ils fait davantage vacciner que les personnels hospitaliers ?
M. Pierre Brodard. Non. Leur taux de vaccination doit avoisiner les 10 ou 15 %. Le personnel des centres de santé se fait également relativement peu vacciner lors des campagnes de vaccination contre la grippe saisonnière. C’est d’ailleurs surprenant de la part de professionnels qui s’occupent de personnes âgées dans les centres communaux d’aide sociale et autres. Il est vrai que le débat sur la vaccination contre l’hépatite B avait jeté le doute sur les vaccinations en général.
Je voudrais, pour terminer, vous faire part de deux constats également surprenants.
Premièrement, au niveau des directions départementales des affaires sanitaires et sociales comme des préfectures et des conseils de l’ordre, on s’est aperçu que les répertoires recensant les professionnels de santé sont très mal connus et que les fichiers ne sont pas à jour. Nous n’avons pas réussi à diffuser les informations à l’ensemble des professionnels.
Deuxièmement, les réquisitions n’ont pas donné lieu à l’établissement de plannings en bonne et due forme. Un inspecteur de la direction départementale des affaires sanitaires et sociales me téléphonait pour me dire que, le lendemain, à telle heure, il aurait besoin de quelqu’un. Si je lui répondais que je n’étais pas libre pour ce créneau horaire mais que je pouvais venir à un autre moment, je n’étais pas rappelé.
Un certain nombre de médecins se sont par ailleurs déclarés volontaires pour faire des vaccinations mais n’ont jamais été rappelés.
En outre, les fichiers de la direction régionale des affaires sanitaires et sociales comportant nos noms et les plages horaires de vaccination ne correspondaient pas aux horaires proposés dans les préfectures, si bien qu’à certaines séances de vaccination, trois ou quatre médecins ou internes étaient présents, tandis qu’à d’autres on pouvait se retrouver tout seul à vacciner, sans même l’aide d’une infirmière.
Faute d’une organisation adéquate, la mobilisation n’a pas été à la hauteur de ce qu’elle aurait pu être.
M. Guy Lefrand, président. Nous vous remercions, monsieur Pierre Brodard.
La séance est levée à dix-neuf heures dix.
Audition de M. Frédéric van Roekeghem,
directeur général
de la Caisse nationale d’assurance maladie des travailleurs salariés (CNAMTS)
(Procès-verbal de la séance du mercredi 26 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-neuf heures quinze.
(M. Frédéric van Roekeghem prête serment.)
M. le président Jean-Christophe Lagarde. Monsieur le directeur général, nous souhaitons examiner avec vous des sujets que nous n’avons guère abordés jusqu’à présent : la diffusion des bons de vaccination, le coût pour les organismes de sécurité sociale de la campagne telle qu’elle a été organisée, le coût qu’aurait eu une campagne de vaccination par les médecins libéraux. Je vous laisse présenter comment la caisse a participé à cette campagne de vaccination.
M. Frédéric van Roekeghem, directeur général de la Caisse nationale d’assurance maladie des travailleurs salariés. La Caisse nationale d’assurance maladie des travailleurs salariés (CNAMTS) a été sollicitée par le ministère de la santé le 9 juin 2009, au cours d’une réunion qui s’est tenue sous la responsabilité du cabinet de la ministre. Nous nous sommes mobilisés en premier lieu sur des questions d’organisation : pas seulement l’envoi des bons, mais toute la préparation de l’identification des personnes, sur la base de priorités établies par le ministère.
Le calendrier a été assez serré. Dès le 15 juin, j’ai organisé en interne une réunion de crise pour esquisser des solutions. Le 17 juin au soir, un premier planning établissait les premières propositions sur la base des informations disponibles. Le 19 juin, nous étions sollicités pour examiner les conditions éventuelles de la facturation des vaccins, dans le cadre d’une réflexion sur le financement de l’opération. Pendant le mois de juillet, nous avons élaboré la formule des coupons, qui permettait – à l’instar de ce qui existe pour la grippe saisonnière – de gérer la convocation des personnes en fonction des priorités décidées par le Gouvernement. Dix-huit versions différentes du coupon de vaccination ont été établies ; le 11 août, j’ai demandé à Mme Bachelot-Narquin son arbitrage final, afin que l’opération puisse être lancée.
Nous avons dû prendre certaines décisions relativement tôt. En raison de l’importance de la campagne de vaccination envisagée – potentiellement, un peu plus de 90 millions de coupons, exploitables dans un délai extrêmement court –, nous avons choisi de garder en interne l’extraction des bases de données, pour préserver certains éléments de confidentialité, et d’externaliser l’exploitation et la remontée de l’information, ainsi que l’élaboration d’une base internet permettant d’assurer le suivi et la traçabilité de toutes les opérations.
Nous avons eu besoin que la ministre de la santé nous donne, en raison de l’urgence, l’autorisation formelle de déroger aux règles de mise en concurrence du code des marchés publics. C’est ainsi qu’une lettre du 31 juillet 2009 nous a autorisés à sonder le marché informatique pour obtenir une proposition dans les meilleurs délais. Toutefois, en dépit de l’autorisation qui nous était donnée, nous n’avons pas souhaité rédiger un simple bon de commande ; nous avons passé un marché complet en bonne et due forme, comportant une somme ferme pour l’élaboration de la solution et une part variable, fonction du nombre de coupons réellement exploités.
M. le président Jean-Christophe Lagarde. À combien ces deux parts se sont-elles élevées ?
M. Frédéric van Roekeghem. La part ferme était de 14,4 millions d’euros toutes taxes comprises. Mais elle comprenait, pour 6,2 millions d’euros, la fourniture de matériels dont la propriété échoit à la caisse et qui seront donc réutilisés dans le cadre de nos opérations courantes. Ainsi, le coût réel lié à la conception, au développement et à l’intégration de la solution, était de 8,2 millions.
La part conditionnelle comportait des unités d’œuvre : unité d’œuvre d’hébergement, d’exploitation, de stockage et d’accès aux données, pour un coût mensuel de 750 000 euros ; unité d’œuvre de numérisation, vidéocodage et stockage des coupons préremplis, dont le prix était dégressif au million de coupons, par tranche de 20 millions –148 000 euros pour la première tranche, 62 000 euros pour la deuxième. De cette façon, nous nous protégions de l’incertitude sur le nombre de coupons exploités.
M. le président Jean-Christophe Lagarde. Je récapitule. Tout d’abord, donc, vous avez réalisé en interne l’extraction des fichiers, pour identifier les publics prioritaires par catégorie.
M. Frédéric van Roekeghem. Oui. Nous avons même obtenu du directeur de cabinet de la ministre l’autorisation de coordonner l’opération pour l’ensemble des régimes d’assurance maladie, qui nous ont transmis leurs listes.
Nous avons également conservé en interne l’édition des coupons. Nous avons mis en tension nos centres d’édition de manière à pouvoir, en les passant en « deux fois huit et demi », imprimer plus de deux millions de coupons par jour.
M. le président Jean-Christophe Lagarde. Ensuite, nous dites-vous, vous avez émis un marché, alors que l’on vous avait autorisé à déroger à cette procédure.
M. Frédéric van Roekeghem. On nous a autorisés à déroger à la mise en concurrence prévue par le code des marchés publics, et nous y avons dérogé. Mais nous avons conclu un marché en bonne et due forme, ce qui facilite la réponse à vos questions !
M. le président Jean-Christophe Lagarde. C’est, j’imagine, pour l’envoi des coupons que vous aviez besoin de la solution informatique.
M. Frédéric van Roekeghem. Nous étions capables de procéder à l’envoi, mais non à la récupération des coupons, à leur scannérisation et à l’intégration dans une base de données.
M. le président Jean-Christophe Lagarde. Toutes les tranches de 20 millions étaient-elles conditionnelles ?
M. Frédéric van Roekeghem. Oui.
M. Jean-Pierre Door, rapporteur. Finalement, combien y en a-t-il eu ?
M. Frédéric van Roekeghem. Une seule. Le paiement se faisait au million de coupons, selon un tarif dégressif par tranche de 20 millions. Finalement, nous avons payé pour 6 millions de coupons puisqu’il y a eu 5,7 millions de coupons « remontés ».
M. le rapporteur. Il s’agit là, donc, du nombre total de personnes vaccinées.
M. Frédéric van Roekeghem. Tel qu’il ressort de nos bases, oui.
M. le rapporteur. N’y a-t-il pas eu des bons imprimés qui n’ont servi à rien ?
M. Frédéric van Roekeghem. Nous n’avons pas compté le nombre d’impressions, mais le nombre de retours.
Nous avons choisi cette solution pour des raisons de traçabilité des opérations, souhaitée par le ministère, et de pharmacovigilance. À l’époque, on envisageait une vaccination en deux injections, avec la contrainte que la deuxième injection soit identique à la première. Le système retenu permettait d’interroger la base pour connaître la nature de la première injection. Tout cela s’est décidé en juin et juillet. La précaution que nous avons prise a été de prévoir une part variable dans le paiement.
Dans le même temps, le 8 juillet 2009, les ministres nous ont demandé de faire une avance de 879 millions d’euros à l’Établissement public de réponse aux urgences sanitaires.
M. le président Jean-Christophe Lagarde. Vous avez dit ne pas avoir compté le nombre de bons édités. Cela signifie-t-il qu’aujourd’hui, la caisse ne sait pas combien elle a envoyé de bons ?
M. Frédéric van Roekeghem. Nous avons envoyé très exactement 65 126 387 bons – et nous pouvons vous communiquer les envois journaliers. Mais, sachant que certains pouvaient se perdre et que certaines personnes – une femme enceinte, par exemple –, pouvaient devenir prioritaires, nous avions donné aux centres de vaccination et aux caisses primaires la possibilité d’en émettre.
Nos bons ont été édités selon les priorités ministérielles, puis stockés. Nous avons réservé avec La Poste des lieux de stockage très précis, afin de pouvoir les envoyer, au jour près, au moment où le ministère le déciderait. L’envoi journalier a donc été rythmé par le cabinet du ministre.
Le premier envoi a porté sur 3,4 millions de bons, pour les publics prioritaires. Puis nous avons égrené des envois de l’ordre de 2 millions de bons jusqu’au 15 décembre. À deux reprises, j’ai demandé confirmation du rythme à retenir, pour m’assurer qu’il n’était pas trop important. Le 15 décembre, le ministère nous a demandé de le ralentir. Nous avons alors stoppé la production pendant trois jours, puis nous nous sommes repositionnés sur un rythme de production de 500 000 bons. Il s’agissait de réduire la pression sur les centres de vaccination, notamment à Paris – alors que nous aurions été techniquement capables d’envoyer la totalité des coupons avant Noël.
M. le rapporteur. Parfois, les bons n’arrivaient pas, et nous les imprimions à l’intérieur des centres. Mais de ce fait, lorsqu’ils arrivaient, ils étaient mis à la poubelle. Parfois au contraire, certaines personnes en recevaient deux ou trois. Comment l’expliquez-vous ?
M. Frédéric van Roekeghem. Le choix d’ouvrir aux centres la possibilité d’émettre des bons a été politiquement assumé et relevait du bon sens.
M. le rapporteur. N’aurait-il pas fallu ne faire que cela ?
M. Frédéric van Roekeghem. Les centres n’étaient pas capables d’imprimer 65 millions de bons…
M. le rapporteur. Ils auraient pu les imprimer au fur et à mesure, lorsque les gens venaient.
M. Frédéric van Roekeghem. Le schéma d’organisation de la vaccination, qui avait été élaboré dès le mois de mai, n’était pas celui-là. À l’époque, on considérait que le vaccin serait rare, qu’il faudrait établir un ordre de priorité et convoquer la population dans cet ordre. Ce n’est que dans un deuxième temps que l’on s’est aperçu qu’il fallait un peu plus de souplesse. Mais c’est une autre affaire…
Il reste que, même si nos bases étaient assez précises, il était inévitable que certains cas ne soient pas connus de nous, par exemple celui de la femme enceinte qui n’a pas encore fait sa déclaration de grossesse ; il était donc indispensable de laisser aux centres la possibilité d’agir à la marge.
S’agissant de l’arrivée des bons, le ministère était en relation avec La Poste. Il est clair que si celle-ci semble bien maîtriser l’acheminement des courriers jusqu’au dernier kilomètre, ce dernier kilomètre peut poser problème.
M. le président Jean-Christophe Lagarde. Considérez-vous que La Poste ne sait pas distribuer le courrier jusqu’aux boîtes aux lettres ?
M. Frédéric van Roekeghem. Je n’ai pas dit cela. Je dis en revanche, premièrement, que nous maîtrisions l’envoi de nos bons ; deuxièmement, que nous avons un compteur sur tous les affranchissements ; troisièmement, qu’il n’est pas très simple de « pister » 65 millions d’envois. À la demande du ministère, nous avons fait des enquêtes auprès de centaines d’assurés, pour savoir s’ils avaient reçu ou non les bons qui leur avaient été envoyés. N’oubliez pas qu’à ce moment-là, le climat social à La Poste était un peu difficile dans certains départements ; il faut aussi intégrer ce paramètre. Normalement, le pli arrivait ; mais le temps de délivrance pouvait varier un peu.
M. le président Jean-Christophe Lagarde. Depuis, avez-vous procédé à un audit du suivi des familles ? Selon vous, est-ce que les ordres de priorité fixés par le Gouvernement ont été respectés ?
Dans les bons qui ont été recueillis dans les centres de santé, savez-vous combien avaient été imprimés sur place et combien avaient été envoyés par la Caisse nationale d’assurance maladie des travailleurs salariés ? Dans mon centre de santé, j’ai vu bien plus de bons émis sur place que de bons reçus.
S’agissant enfin de l’acheminement des bons, je peux vous donner l’exemple concret d’une famille de trois enfants, de sept ans, quatre ans et six mois, laquelle avait au moins deux raisons de recevoir des bons pour tout le monde : l’enfant de six mois est allaité par sa mère et le père est asthmatique. Or, les bons ne sont pas arrivés en même temps et c’est la mère et l’enfant allaité qui les ont reçus en dernier. Est-ce que cela vous paraît respecter les ordres de priorité fixés par le Gouvernement ?
M. Frédéric van Roekeghem. Je vous fais une proposition : donnez-nous les numéros d’identification – les NIR – et nous vous dirons à quelle date le courrier était parti.
M. le président Jean-Christophe Lagarde. L’exemple que je viens de vous donner concerne ma famille, mais j’aimerais savoir si ce genre de difficultés s’est produit souvent.
M. Frédéric van Roekeghem. Nous pensons, en ce qui nous concerne, avoir à peu près maîtrisé les opérations, mais cela peut se vérifier.
Cette question de l’arrivée des bons a été examinée, y compris par le cabinet de la ministre, au moment même de l’opération ; nous avons donc réalisé des sondages. Après une semaine, à Paris 81 % des bons étaient arrivés, dans l’Essonne 100 %, dans les Yvelines 83 % et dans les Hauts-de-Seine 80 %. La situation était assez variable selon les départements.
M. le rapporteur. Avez-vous fait des sondages sur d’autres départements ?
M. Frédéric van Roekeghem. Oui, « à la volée », sur une vingtaine de départements.
Pour évoquer moi aussi mon cas personnel, je peux vous dire que les bons concernant les membres de ma famille sont bien arrivés…
Je souligne que si nous sommes gestionnaires de nos fichiers, nous avons également exploité les fichiers transmis par d’autres régimes, dont nous avons donc été tributaires.
Encore une fois, si vous nous donnez le numéro d’identification d’une personne, nous sommes capables de vous dire et si ce numéro figurait dans les fichiers qui nous ont été transmis et si le courrier est parti de nos centres. La traçabilité est totale.
M. le président Jean-Christophe Lagarde. Nous retenons votre proposition – car il s’agit aussi de vous aider.
Avez-vous fait des tests, par ailleurs, sur les regroupements familiaux ?
M. Frédéric van Roekeghem. Les regroupements familiaux ont été faits sur la base de la notion d’« ouvreur de droits » ; nous ne pouvons pas connaître, dans nos bases de données, la situation de famille : la seule chose que nous savons, c’est à quel ouvreur de droits l’enfant est rattaché. Nous n’avons pas opéré de rattachement familial sur l’adresse car cela peut poser d’autres problèmes.
M. Michel Lejeune. Je peux témoigner des difficultés rencontrées sur le terrain. Certaines personnes ont reçu plusieurs bons, à un moment où l’on ne parlait pratiquement plus de vaccination. Pour ma part, j’en ai reçu trois.
Ma question porte sur la rémunération des personnels qui vaccinaient. Y avait-il des différences au sein d’une même catégorie professionnelle ? Une infirmière retraitée qui était venue prêter main forte dans un centre m’a dit avoir été payée moitié moins que les infirmières en activité.
M. Frédéric van Roekeghem. C’est le ministère qui a défini les barèmes de rémunération ; nous les avons appliqués. Je peux vous les transmettre.
Si vous avez reçu plusieurs coupons, cela peut être parce que vous n’avez pas été radié d’un régime antérieur.
Quant aux familles, nous ne savions pas les reconstituer ; c’est pourquoi le courrier qui a été envoyé aux parents d’enfants prioritaires incitait la totalité de la famille à se faire vacciner avec lui.
Je ne dis pas que, sur 65 millions d’envois, il n’y ait pas eu des difficultés ponctuelles ; mais je considère que l’incertitude a plutôt concerné le délai de route.
M. le président Jean-Christophe Lagarde. Pourquoi M. Michel Lejeune a-t-il pu recevoir trois bons ? Au-delà de la question de la traçabilité, un audit de ce qui s’est passé serait nécessaire… Il serait utile, par exemple, que vous nous expliquiez comment vous avez identifié les personnes prioritaires.
M. le rapporteur. Grâce aux bons, vous connaissez les 5,7 millions de personnes qui ont été vaccinées. De mon côté, j’ai vu les tableaux établis par département. Pourrait-on avoir une ventilation par type de population – enfants, personnes enceintes, personnes en affection de longue durée,… – ?
M. Frédéric van Roekeghem. Le suivi de la vaccination est un compromis – qui a donné lieu à un décret ministériel, après avis de la Commission nationale de l’informatique et des libertés (CNIL) – entre la nécessité de faire remonter des informations et les contraintes imposées par la CNIL au titre de la confidentialité des données de santé. La CNIL n’a pas souhaité que les motifs d’envoi des bons soient inscrits dans notre base de données. Dès lors, l’Agence française de sécurité sanitaire des produits de santé et l’Institut de veille sanitaire nous ont demandé de reconstituer les tableaux qui vous intéressent, mais ces reconstitutions ne peuvent se faire que par croisement de nos fichiers, en interne, avec les bases vaccinales.
M. le rapporteur. Ce sont des données très importantes quant à l’immunisation de ces populations pour l’avenir.
M. Frédéric van Roekeghem. En effet. Le travail est donc en cours, en liaison avec l’Agence française de sécurité sanitaire des produits de santé et l’Institut de veille sanitaire. Nous retraitons de façon anonymisée nos bases d’information et les bases vaccinales, pour faire les croisements nécessaires.
Nous sommes intervenus, en deuxième lieu, dans le financement de l’opération. Le ministère nous a demandé, le 8 juillet 2009, de faire des avances à l’Établissement public de réponse aux urgences sanitaires pour assurer, dans l’attente de l’inscription des crédits d’État nécessaires, la couverture de l’acquisition des vaccins. J’en ai bien sûr informé notre conseil et j’ai répondu à cette demande par une lettre du 10 juillet, constatant que le ministère avait pris plusieurs engagements : principe du financement à parité entre l’État et l’assurance maladie – qui a été respecté ; versement d’intérêts financiers jusqu’à l’ouverture des crédits d’État ; enfin, dans l’attente d’une autorisation de mise sur le marché déclenchant des conditions de taxe sur la valeur ajoutée plus intéressantes, hypothèse de taxe sur la valeur ajoutée à 19,6 %. Les versements réels à l’Établissement public de réponse aux urgences sanitaires, qui a restreint sa demande, ont finalement été inférieurs à ce qui avait été prévu.
Le 15 décembre 2009, à l’occasion d’une discussion avec le directeur de cabinet de la ministre, j’ai appuyé la demande de renégociation des contrats des laboratoires pharmaceutiques, laquelle a été suivie d’une décision gouvernementale. J’ai mentionné cette demande en réunion des directeurs du ministère de la santé.
Le 29 janvier 2010, j’ai proposé au Gouvernement de suspendre les versements à l’Établissement public de réponse aux urgences sanitaires et demandé certaines instructions comptables pour le bouclage de nos comptes. Le 5 mars 2010, Mme Roselyne Bachelot-Narquin et M. Éric Woerth nous ont répondu que le principe d’un reversement de l’Établissement public de réponse aux urgences sanitaires à l’assurance maladie, d’au moins une centaine de millions d’euros, et dont le montant serait défini après renégociation des contrats, serait acté dans la loi de financement de la sécurité sociale pour 2011, au titre de l’année 2010.
L’assurance maladie est par ailleurs intervenue par la mise à disposition des personnels, tant administratifs que médicaux, en appui de l’organisation préfectorale. À la fin du mois de décembre, nous avions près de 800 personnes – dont, bien sûr, des médecins conseil – réquisitionnées dans les centres. De plus, l’assurance maladie a participé aux comités de pilotage départementaux mis en place par les préfets, notamment pour relayer l’information auprès de la population.
Bien sûr, nous avons participé à l’édition des bons de vaccination. Environ 250 000 bons ont été édités par les caisses primaires. Au total, 2 693 000 bons ont été édités par le biais du web service que nous avions mis en place. Outre les caisses primaires, les centres de vaccination et les hôpitaux étaient autorisés à en éditer. Cette édition s’est faite de façon sécurisée : dans le cadre d’un avenant au premier marché, nous avons respecté la préconisation de la Commission nationale de l’informatique et des libertés d’utiliser un système de codage.
M. le président Jean-Christophe Lagarde. Autrement dit, le nombre de bons utilisés – c’est-à-dire de personnes vaccinées – se partage quasiment par moitiés entre bons reçus à domicile et bons édités sur place.
M. Gérard Bapt. Ma première question concerne la grippe saisonnière. Sur les 10 millions d’assurés à qui vous envoyez un bon de vaccination, combien se font vacciner ?
M. Frédéric van Roekeghem. Environ 6 millions, soit 60 %.
M. Gérard Bapt. S’agissant des bons de vaccination contre la grippe A(H1N1), vous serait-il possible de nous communiquer la courbe des envois, par exemple semaine par semaine ?
M. Frédéric van Roekeghem. Bien sûr.
M. Gérard Bapt. Des personnes pouvaient être en situation de risque sans être en affection de longue durée. A-t-on demandé aux médecins généralistes de les signaler, afin qu’elles soient classées dans les publics prioritaires ?
M. Frédéric van Roekeghem. C’est une question qu’il faut poser au ministère de la santé. À la mi-août, on s’est demandé s’il fallait ouvrir la base vaccinale et permettre aux professionnels libéraux d’émettre des bons de vaccination. Je crois que cette éventualité a été écartée pour des raisons pratiques.
M. Gérard Bapt. Certes, mais on aurait pu néanmoins faire appel aux médecins généralistes pour classer dans les publics prioritaires les adolescents, les femmes enceintes, les personnes atteintes d’une maladie respiratoire ou d’obésité.
M. Frédéric van Roekeghem. Cela ne relevait pas de notre compétence.
Les envois ont visé, par ordre de priorité, d’abord l’entourage des enfants de moins de six mois, les personnes en affection de longue durée et celles atteintes de bronchopneumopathie chronique obstructive (BPCO) ; ensuite, les femmes enceintes et les enfants de six à vingt-quatre mois sans facteur de risque ; puis les collégiens et lycéens. Les départements d’outre-mer ont fait l’objet d’un traitement particulier. Et pour des raisons d’organisation, ce sont les régions qui, à la demande du ministère, ont géré le rythme d’envoi vers les lycéens.
M. le président Jean-Christophe Lagarde. Le ministère de l’éducation nationale ?
M. Frédéric van Roekeghem. Notre interlocuteur était le ministère de la santé.
M. Gérard Bapt. À l’avenir, il me semble qu’il serait bon de faire appel aux généralistes pour identifier les personnes à risques.
Ma dernière question concerne les laboratoires pharmaceutiques auxquels on avait commandé des vaccins. Lorsqu’on a su que l’on allait passer à une seule injection, n’a-t-on pas pensé à négocier avec eux ? Il aurait été plus facile de le faire à ce moment-là, quand ils n’avaient pas encore produit tous les vaccins !
M. Frédéric van Roekeghem. J’ai évoqué ce sujet avec le directeur de cabinet de la ministre le 15 décembre. Mais il faut se souvenir que la question du passage à une seule injection a entraîné bien des débats, notamment au niveau européen.
M. Gérard Bapt. Aux États-Unis, cela s’est fait beaucoup plus tôt.
M. Frédéric van Roekeghem. Oui, mais les droits américains n’étaient pas applicables à l’Europe ; l’élément déclencheur a été l’autorisation de mise sur le marché européenne. Je ne sais plus exactement à quelle date la décision a été prise.
M. le président Jean-Christophe Lagarde. De mémoire, elle a été prise courant octobre.
M. Gérard Bapt. Vous avez évoqué la question le 15 décembre, dites-vous, mais les laboratoires ont néanmoins été mis au pied du mur le 4 janvier…
M. Frédéric van Roekeghem. La période comprise entre ces deux dates est relativement courte. Elle a pu être mise à profit pour vérifier si le Gouvernement ne risquait pas d’engager inconsidérément les finances publiques.
M. Gérard Bapt. Une proposition de négociation n’engage pas les finances publiques… Il s’agissait d’explorer les moyens de diminuer la commande. Pour sa part, Sanofi-Pasteur a proposé de lui-même de diminuer de neuf millions de doses la commande qui lui avait été faite…
M. Frédéric van Roekeghem. Même si la décision était acquise dans son principe, il n’en fallait pas moins prendre certaines précautions. Il aurait pu être dangereux pour les finances publiques de négocier sans avoir évalué les risques juridiques et sans s’être assuré, notamment, de la protection apportée par le code des marchés publics en cas de résiliation unilatérale.
M. Gérard Bapt. La vérification juridique était simple : il fallait consulter la jurisprudence, comme je l’ai fait...
M. Frédéric van Roekeghem. Prendre le temps d’une bonne analyse juridique me paraît nécessaire pour engager ce type de négociation.
M. Gérard Bapt. Avec Sanofi, le compromis a été trouvé très facilement en décembre. Mais on ne l’a pas dit ; cela a été découvert après le 4 janvier.
M. Frédéric van Roekeghem. Il me semble que l’annonce de Sanofi est postérieure à la date que je vous donne. Il faudrait le vérifier.
M. Jean-Louis Touraine. Vous avez dit qu’il y avait eu 5,7 millions de doses de vaccin appliquées, pour 94 millions de doses prévues. Il y a bien sûr de multiples raisons à cet immense écart : le passage au vaccin monodose, les problèmes d’organisation, le manque d’adhésion de la population, le fait que la pandémie ait été moins grave que prévu. À quel moment avez-vous perçu qu’il allait falloir réviser très drastiquement à la baisse les prévisions initiales ?
M. Frédéric van Roekeghem. Il ne s’agissait pas d’une opération courante, comme la vaccination contre la grippe saisonnière, pour laquelle la perception du risque par la population est stable et l’organisation – avec un vaccin monodose – rodée. L’opération, de grande ampleur, n’était pas simple à mener, et le nombre de personnes qui seraient à vacciner dépendait largement de la perception du risque : comme le montrent bien les sondages, les Français sont peu réceptifs à la demande de vaccination si le risque leur semble faible, mais ils peuvent changer d’attitude très rapidement si ce risque leur paraît augmenter.
En ce qui nous concerne, nous avons considéré dès le mois de juillet qu’il y avait une incertitude. À la différence du Gouvernement, nous n’étions pas responsables de la politique vaccinale, mais d’une partie de sa mise en œuvre ; la question n’était pas pour nous de savoir si la totalité de la population devait être vaccinée et dans quel ordre, mais d’être capables de tenir nos engagements vis-à-vis du ministère, au coût le plus raisonnable possible pour la collectivité. Si nous avons négocié les achats de coupons au million, c’est bien parce que nous ne savions pas combien de personnes seraient finalement vaccinées. À l’époque, j’estimais qu’il y en aurait entre 10 et 40 millions.
M. Jean-Louis Touraine. Même vacciner 40 millions de personnes ne justifiait pas l’achat de 94 millions de doses.
M. Frédéric van Roekeghem. On pensait à ce moment-là que deux injections seraient nécessaires. Cela fait 80 millions de doses, auxquelles il n’était pas déraisonnable d’ajouter une marge.
Si le virus avait muté et si l’on avait constaté une létalité beaucoup plus importante, la population aurait totalement changé d’attitude.
Il apparaît donc clairement que, selon que le risque est perçu comme grave ou non et selon que le vaccin est rare ou disponible, l’organisation vaccinale peut beaucoup varier. Dans le cas d’un virus létal et d’un vaccin rare, une organisation sécurisée permettant de maîtriser l’offre vaccinale est incontournable. Lorsque le virus est assez courant et le vaccin disponible, une vaccination déconcentrée est sans doute la plus efficace et la moins coûteuse.
M. le président Jean-Christophe Lagarde. Le problème est que l’on ne peut pas connaître à temps le degré de létalité du virus. Dès lors, il paraît hautement souhaitable que tous ceux qui interviennent dans la chaîne puissent tenir compte de l’incertitude, et donc soient capables de souplesse.
M. le rapporteur. Je voudrais rappeler que chaque pays devait donner 10 % des vaccins qu’il avait commandés à l’Organisation mondiale de la santé pour d’autres pays. Sur 94 millions de doses, il en restait donc un peu plus de 84 millions, soit de quoi vacciner 40 millions de Français. Les Anglais en ont commandé 135 millions, les Américains 350 millions. Par ailleurs, ce n’est que le 30 novembre qu’on a décidé de n’injecter qu’une seule dose, alors que les commandes avaient été passées en avril-mai.
M. le président Jean-Christophe Lagarde. Le 4 janvier, la ministre a annoncé que l’on pourrait aller se faire vacciner chez les médecins libéraux. Dans les jours suivants, nous avons appris que la tarification de cette vaccination avoisinerait 6 euros. Pourriez-vous nous dire combien de vaccinations ont été réalisées au tarif de 6 euros, et combien à 22 euros, soit au prix d’une consultation normale ? Bien entendu, je ne vous demande pas de répondre immédiatement, mais je souhaiterais une réponse écrite. Si je vous pose la question, c’est que je doute que beaucoup de médecins et de patients aient contribué à cet effort d’économie au bénéfice de votre caisse.
M. Gérard Bapt. Des virus circulent sans arrêt, les grippes saisonnières peuvent faire des milliers de morts, mais il n’est jamais arrivé qu’un virus mute pendant une pandémie. Quant à la population, son sentiment sur la dangerosité d’un virus dépend de l’information qu’elle reçoit : si on lui fait peur, elle a peur. À La Gloria, personne n’est mort de la grippe porcine ; et le premier cas de personne infectée au Mexique par le virus A(HlN1) est un enfant non seulement qui va très bien, mais qui a sa statue sur la place du village, auquel il a donné une renommée mondiale !
Alors qu’on explique depuis des années aux personnes de plus de 65 ans et à celles qui sont en affection de longue durée qu’elles doivent se faire vacciner contre la grippe saisonnière, leur taux de vaccination, nous avez-vous dit, ne dépasse pas 60 %. Dès lors, était-il plausible d’arriver, pour la grippe A(H1N1), à un taux de vaccination de la population générale de 75 % ?
M. Frédéric van Roekeghem. Ce taux de 60 % est une moyenne, pour les 10 millions de personnes que nous invitons à se faire vacciner contre la grippe ; mais il y a des variations selon les catégories. Pour les personnes de plus de 65 ans, le taux est de 69 %.
M. le président Jean-Christophe Lagarde. Mais vous ne savez pas recouper la population qui se fait habituellement vacciner contre la grippe saisonnière et celle qui s’est fait vacciner contre la grippe A(H1N1).
M. Frédéric van Roekeghem. Nous allons le faire.
M. Gérard Bapt. On sait que la vaccination contre la grippe saisonnière est d’autant moins efficace que le patient est plus âgé. Ne faudrait-il pas vacciner plus systématiquement contre le pneumocoque ?
M. Frédéric van Roekeghem. La direction générale de la santé a donné des instructions pour accroître, notamment dans le cadre de la prévention grippale, la vaccination des personnes à risque contre le pneumocoque. Nous avons envoyé un message en ce sens à l’ensemble des médecins généralistes. La direction générale de la santé nous a également demandé d’accélérer la vaccination contre la grippe saisonnière, ce que nous avons fait, afin de pouvoir organiser la deuxième vaccination.
M. le président Jean-Christophe Lagarde. Par quel moyen avez-vous envoyé ce message aux médecins ?
M. Frédéric van Roekeghem. Par la Lettre d’information aux médecins, me semble-t-il.
M. le président Jean-Christophe Lagarde. Considérez-vous que votre fichier est fiable ?
M. Frédéric van Roekeghem. A priori, oui.
M. le président Jean-Christophe Lagarde. Fiable aussi sur les centres de santé ?
M. Frédéric van Roekeghem. Avant de vous répondre, je préfère vérifier.
En ce qui concerne l’identification des médecins salariés, le RPPS – répertoire partagé des professionnels de santé – est en cours d’élaboration au ministère.
Quant aux professionnels libéraux, nous les connaissons assez bien, et nous pouvons les contacter soit par voie postale, soit par courriel lorsqu’ils ont choisi de nous communiquer leur adresse, notamment pour recevoir sous forme dématérialisée la Lettre aux médecins.
Si ma mémoire est bonne, non seulement nous avons traité dans la Lettre la question de la vaccination contre le méningocoque, mais nous y avons joint la lettre de la direction générale de la santé qui enjoignait les professionnels de monter en puissance sur cette vaccination. Il me semble que cela a été suivi d’effet.
M. le rapporteur. Comme vous le savez, on parle d’un vaccin trivalent. La caisse nationale le prendra-t-elle en charge, et pour quelles populations ?
M. Frédéric van Roekeghem. C’est une décision ministérielle.
Les questions portent non seulement sur le remboursement par l’assurance maladie, mais aussi sur le prix. Le prix du vaccin le plus vendu contre la grippe saisonnière, en intégrant la marge des pharmaciens, est de 4,11 euros. Il serait souhaitable de s’approcher de cette norme.
Dès lors que le virus est connu, que les laboratoires peuvent anticiper leur production, il est possible de revenir à un dispositif traditionnel, dont l’efficacité peut être accrue par le fait que les infirmières ont maintenant l’autorisation vacciner.
M. le président Jean-Christophe Lagarde. Quelle traçabilité peut-on assurer ? Les personnes à risque qui recevront un bon feront sans doute partie des 5,7 millions de personnes qui se sont déjà fait vacciner contre la grippe A(H1N1).
M. Frédéric van Roekeghem. Pour la grippe saisonnière, nous suivons la délivrance individuelle du vaccin par les pharmaciens : nous envoyons les bons et, dans nos systèmes d’information, nous suivons la remontée de la facturation du pharmacien. Nous sommes donc capables de dire que nous avons envoyé 10 millions de bons et que 6 millions de personnes se sont fait délivrer le vaccin – monodose – par le pharmacien. Si, pour la grippe A(H1N1), nous avons été amenés à externaliser une partie du traitement des données, c’est que, en deux mois, nous n’étions pas capables de l’assurer pour 94 millions de coupons, faute de disposer des scanners haute performance nécessaires. Dans le cas d’une vaccination courante, nous pouvons suivre directement la vaccination, non pas en scannant les coupons papier, mais grâce à la facturation dématérialisée.
M. le président Jean-Christophe Lagarde. Nous vous remercions.
La séance est levée à vingt heures quarante.
Table ronde réunissant des représentants de médias :
M. Gérard Amsellem (Pratis TV),
M. Paul Benkimoun (Le Monde),
M. Alain Ducardonnet (LCI),
M. Éric Favereau (Libération),
M. Jean-Daniel Flaysakier (France 2),
Mme Viviane Jungfer (TF1),
M. Gérard Kouchner (Le Quotidien du médecin),
M. Marc Payet (Le Parisien-Aujourd’hui en France),
Mme Martine Perez (Le Figaro),
M. Benoît Thévenet (France 5) et
M. Jérôme Vincent (Le Point)
(Procès-verbal de la séance du jeudi 27 mai 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à neuf heures trente.
(MM. Gérard Amsellem, Paul Benkimoun, Alain Ducardonnet, Éric Favereau, Jean-Daniel Flaysakier, Mme Viviane Jungfer, MM. Gérard Kouchner, Marc Payet, Mme Martine Perez, MM. Benoît Thévenet et Jérôme Vincent prêtent successivement serment.)
M. le président Jean-Christophe Lagarde. Nous souhaitons aborder avec vous une question centrale, en relation avec l’échec ou la réussite de la campagne de vaccination selon le point de vue que l’on a et avec l’état de l’opinion après celle-ci : comment les informations sur le virus, le vaccin et les décisions politiques prises à ce sujet ont-elles circulé et ont-elles été diffusées ?
Comment appréciez-vous les rumeurs ayant circulé sur internet – parfois reprises par les médias – provenant souvent du lobby anti-vaccinal ?
Les pouvoirs publics ont-ils été efficaces ? M. Thierry Saussez a déjà évoqué auprès de nous la communication du Gouvernement. Comment celle-ci a-t-elle été perçue ?
Les médias sont aussi bien des observateurs que des transmetteurs d’information. Quel a été votre rôle, à la fois comme modérateur et comme interprète des retours d’information provenant du public ?
Quel bilan, en tant que spécialistes, tirez-vous de la campagne de vaccination ?
Comment avez-vous jugé la communication du Gouvernement durant les trois périodes successives : celle des mois d’avril et mai 2009 lors de l’apparition du virus à l’étranger, de son analyse par les experts sanitaires, de l’alerte de la population et de la mobilisation des services de l’État, notamment avec la création d’un comité interministériel de crise ; celle, de mai à juillet, pendant laquelle l’Organisation mondiale de la santé a élaboré une stratégie et des recommandations pour l’ensemble des États ; enfin, celle au cours de laquelle furent arrêtées les décisions politiques relatives à la commande de vaccins et à la campagne de vaccination généralisée ? Les informations provenaient-elles d’abord du Gouvernement ? Étaient-elles, dès le départ, claires et bien hiérarchisées à destination du public ?
M. Gérard Amsellem (Pratis TV). Pour ma part – je représente un média qui s’adresse exclusivement aux professionnels –, je suis d’accord avec votre chronologie. Du mois d’avril au mois de juin 2009, au cours d’une période de flottement, on a progressivement découvert l’identité du virus. Son origine était apparemment porcine et mexicaine. On ne savait pas s’il allait muter ou non. Il a fallu beaucoup de temps pour l’identifier et pour le positionner sur les échelles de graduation de la pandémie reconnues par l’Organisation mondiale de la santé.
S’agissant de la forme, l’information a été considérablement dramatisée.
M. Paul Benkimoun (Le Monde). J’éprouve un sentiment légèrement différent. Au début, l’alerte a été moins véhiculée par les gouvernements que par l’Organisation mondiale de la santé et les organismes de surveillance épidémiologique, notamment aux États-Unis : en dépit de sa dominante mexicaine, le virus était déjà présent en Amérique du Nord.
On ne peut faire abstraction de ce qui s’était produit dans le passé et qui justifiait que les États et l’Organisation mondiale de la santé attendent « l’arme au pied » la survenance d’une pandémie que l’on savait inéluctable. La surprise a été d’ordre géographique, car on prévoyait plutôt son déclenchement en Chine. L’effet de surprise a entraîné une certaine dramatisation, mais qu’il faut relativiser, car le caractère modéré de l’épidémie a été assez vite établi. Les institutions, sur le plan tant national qu’international, étaient préparées et les dispositifs appropriés, depuis longtemps mis au point, étaient prêts.
Cependant, j’ai été frappé par le décalage entre la qualité des mécanismes de surveillance internationale et la quantité d’incertitudes qui demeurait immense. Alors que, dans d’autres crises sanitaires, on avait pu accuser les gouvernements d’imprévoyance, dans celle-ci au contraire, notamment en France, on leur a adressé le reproche inverse : les pouvoirs publics se prévalaient de leurs capacités d’anticipation comme de réaction ; ils disposaient d’un des meilleurs plans d’action, couvrant toute la population et se traduisant par la commande de 94 millions de doses de vaccin ; un droit à la vaccination était reconnu.
M. le président Jean-Christophe Lagarde. En d’autres termes, on attendait une pandémie à laquelle on s’était soigneusement préparé, mais les incertitudes qui sont apparues ont empêché les dispositifs prévus de fonctionner correctement. Notre commission d’enquête tend précisément à en tirer les leçons pour l’avenir.
Mme Martine Perez (Le Figaro). Le plan de lutte contre la pandémie grippale est à rapprocher des crises sanitaires que nous avons connues au cours des vingt dernières années : le sang contaminé, la « vache folle », la canicule… Chacune de ces crises a provoqué, en France, la création de commissions d’enquête ou de missions d’information parlementaires, mettant en cause des hauts fonctionnaires et des responsables politiques. Notre pays se caractérise en effet par des préoccupations de santé publique et par une exigence de sécurité sanitaire particulièrement élevées. Dans les autres pays, les mêmes crises se sont produites, notamment celles du sang contaminé et de la canicule – qui a provoqué 70 000 morts en Europe dont 20 000 en Italie. Mais c’est seulement en France que les pouvoirs publics ont été vivement interpellés. C’est pourquoi ceux-ci entendaient disposer du meilleur plan de lutte possible contre la pandémie.
Nous avons utilisé de multiples sources d’information. Celles provenant du Gouvernement traduisaient de la part de ce dernier une volonté de défense très ferme débouchant sur des mesures de précaution particulièrement importantes, telles que le recours prioritaire à l’hospitalisation, l’injection de deux doses de vaccin – alors que plusieurs revues internationales spécialisées expliquaient qu’une seule dose suffisait – ou encore la campagne de vaccination massive. Le Gouvernement n’est revenu sur certaines d’entre elles qu’après que la presse en avait signalé les excès.
Une meilleure information aurait pu nous parvenir plus tôt par le canal de l’Organisation mondiale de la santé si l’on avait tenu compte de ce qui se passait dans l’hémisphère Sud – comme en Australie, où il n’y a pas eu de campagne de vaccination. Les études épidémiologiques locales, qui auraient pu nous fournir de précieuses indications, n’ont pas été utilisées. Grâce à elles, nous aurions mieux mesuré la gravité du virus et évité de surévaluer les dispositifs de lutte.
M. le président Jean-Christophe Lagarde. L’Organisation mondiale de la santé a par ailleurs inventé une nouvelle règle pour ne pas être entendue par les commissions parlementaires...
M. Jean-Pierre Door, rapporteur. Quelles étaient vos sources d’information autres que gouvernementales ? Vous êtes-vous heurtés à certaines difficultés d’accès ?
Les préoccupations des médias semblent ne pas avoir été identiques de part et d’autre de l’Atlantique : avons-nous particulièrement dramatisé la situation alors qu’on demeurait plus raisonné sur l’autre rive ?
Au-delà de l’information diffusée par les médias, des réseaux sociaux d’un type nouveau, tels que Facebook et Twitter, ont été utilisés. Les campagnes médiatiques qu’on y a mené ont-elles été raisonnables ou, au contraire, contribué à alimenter des rumeurs et à inquiéter les populations vis-à-vis de la vaccination ?
Mme Martine Perez (Le Figaro). Les sources d’information autres que gouvernementales provenaient des agences sanitaires, des chercheurs, notamment ceux de l’Institut Pasteur, de l’Organisation mondiale de la santé – qui communiquait peu de façon spontanée et pertinente, mais qui répondait volontiers aux questions –, des revues scientifiques, d’internet, mais aussi des contacts personnels que nous entretenons avec des virologues, français et étrangers…
Mme Viviane Jungfer (TF1). C’est le propre des journalistes spécialisés de fonctionner ainsi.
M. Gérard Amsellem (Pratis TV). Tout dépend en la matière du public auquel on s’adresse, selon qu’il s’agit de l’ensemble de la population ou des professionnels de la santé. Nous avons aussi eu recours, au tout début, à l’École nationale vétérinaire d’Alfort pour connaître l’origine véritable du virus.
M. Gérard Kouchner (Le Quotidien du médecin). À l’exception de M. Marc Gentilini, qui l’a signalé dès le mois de juillet 2009, les virologues français ont indiqué unanimement, à partir des mois d’août et de septembre, que l’épidémie s’étendait plus lentement que prévu et qu’elle était moins pathogène qu’on ne l’avait cru, à deux exceptions notables : les enfants et les femmes enceintes. Du reste, selon l’avis des experts, connu dès le mois de septembre par les pouvoirs publics, son niveau pathogénique pouvait être comparé à celui d’une grippe saisonnière.
Nous avons cherché, par le biais des articles de la presse spécialisée, à savoir si les informations fournies et les décisions prises par les pouvoirs publics avaient pu réduire les chances de traitement de la grippe A(H1N1) ou de protection contre elle. On ne peut le dire du traitement : la mise à disposition du Tamiflu s’est effectuée dans de bonnes conditions.
Il en va différemment de la stratégie de protection vaccinale. Dès les mois de juin et juillet 2009, les associations et les syndicats de médecins libéraux, en particulier MG France et, dans une moindre mesure, la Confédération des syndicats médicaux français (CSMF), ont déploré que leur profession ait été dépossédée de la prise en charge de l’épidémie. Afin d’apprécier le caractère pathogène de la maladie, il était légitime que, dans un premier temps, l’hôpital fut privilégié. Mais les médecins libéraux étant plus adaptables et plus proches des patients à risques, ils auraient dû ensuite se voir confier davantage de missions. Il était donc regrettable de les cantonner dans une fonction de diagnostic sans les faire participer aux réseaux de protection individuelle alors qu’il suffisait, dans le cas de cette grippe particulièrement contagieuse, de protéger une personne sur deux, contre une sur trois en règle générale, mais non toute la population.
Toute la question est donc de savoir si l’on a confié la stratégie de protection par la vaccination aux bons ou aux mauvais responsables.
M. Marc Payet (Le Parisien-Aujourd’hui en France). La communication du Gouvernement a été complexe et fondée sur des données fluctuantes.
En tant qu’observateurs, nous avons estimé au début qu’il en faisait beaucoup. Mais comment le lui reprocher après la crise mexicaine et une probable propagation du virus A(H5N1) ? À partir des mois de juillet et d’août, il en faisait encore plus, tenant des conférences de presse quotidiennes au ministère de la santé et fréquentes au ministère de l’intérieur. Il faut cependant rappeler que l’Organisation mondiale de la santé ne changeait pas de position et que des risques de mutation du virus ne pouvaient être exclus. Un aspect plus problématique de la communication gouvernementale est apparu en septembre, notamment quand Mme Françoise Weber, directrice générale de l’Institut de veille sanitaire, a fait savoir aux pouvoirs publics que le risque était bien moindre que prévu. Les hypothèses pessimistes étant ainsi remises en cause par un organisme de conseil du Gouvernement, pourquoi n’a-t-on alors pas organisé une conférence de presse plus rassurante que les précédentes ? Nous nous sommes étonnés que le choix ait été fait de ne pas modifier le discours officiel.
En qualité de journaliste chargé de ce dossier au Parisien, je me suis rendu, fin août, dans l’hémisphère Sud, notamment en Nouvelle-Calédonie. J’ai été surpris de constater que la population ne portait pas de masques et que les personnels des hôpitaux, bien qu’ayant mis en place des cellules de crise et déploré le décès de quelques enfants, ne se montraient pas aussi inquiets qu’on le prétendait dans l’hémisphère Nord. Des médecins de brousse, confrontés au virus depuis trois mois, nous faisaient même des déclarations rassurantes, considérant, pour schématiser, que l’épidémie n’allait pas décimer les populations. Un décalage important se manifestait donc entre la réalité de l’épidémie au sud et l’image que l’on s’en faisait au nord.
M. Benoît Thévenet (France 5). Je suis entièrement d’accord avec M. Marc Payet. Dans notre rédaction, nous avons constaté un certain verrouillage de la communication publique sur le sujet : notre accès aux hôpitaux, avec qui nous avons l’habitude de travailler d’ordinaire, était devenu plus difficile, ainsi qu’auprès des médecins et des chercheurs exerçant une fonction d’expert dans les ministères ; on ne nous parlait plus que « off ». Il nous fallait sinon obtenir un accord préalable du cabinet du ministre, tandis que le Gouvernement communiquait beaucoup de son côté, mais de façon unilatérale.
M. Éric Favereau (Libération). La communication officielle a en effet été très importante, mais nous nous sommes aperçus, après coup, d’un manque de transparence quant aux événements clés : quand et comment avait-on décidé de vacciner toute la population ? Comment s’étaient déroulées les négociations avec les laboratoires pharmaceutiques – le cabinet de la ministre de la santé prétendait que les relations avec eux étaient excellentes alors que nous avons appris huit mois plus tard qu’elles avaient été très difficiles ? En somme, l’abondance de la communication a camouflé l’absence de transparence et, par voie de conséquence, de débat public alors que, lors de la crise de la « vache folle », les avis de l’Agence française de sécurité sanitaire des aliments avaient fait l’objet de discussions ouvertes.
M. Gérard Kouchner (Le Quotidien du médecin). M. Didier Houssin, délégué interministériel à la lutte contre la grippe aviaire et directeur général de la santé, a cependant indiqué, le 1er septembre 2009, qu’il avait décidé, en juin, l’acquisition des stocks nécessaires de vaccins.
M. Éric Favereau (Libération). Il n’est peut-être pas utile de vous faire son porte-parole ! D’autant que nous ne savons pas comment les décisions ont été prises…
M. Jérôme Vincent (Le Point). Ma perception est plus tranchée. La première phase d’excitation générale m’a choqué dès le premier jour. En mai et juin, j’ai été frappé par le caractère de propagande que revêtait la communication du Gouvernement. On diffusait de fausses informations, notamment en établissant une comparaison avec l’épidémie de grippe espagnole de 1918, pourtant survenue dans un contexte historique et sanitaire totalement différent. Dans le courant de l’été, un professeur de médecine à Brest a dû, visiblement gêné de le faire, expliquer publiquement qu’un enfant venait de mourir de la grippe A(H1N1), alors que son décès était dû à une maladie génétique, aggravée par une complication grippale. De même, alors que l’expérience tirée de l’hémisphère Sud permettait de savoir, aux mois de juillet et août, que la mortalité imputable au virus était faible, on continuait de la prétendre élevée. Il en a été de même pour le caractère contagieux de l’affection. Nous ne pouvons donc que parler de propagande, voire de communication mensongère.
Le 28 août 2009, Le Point a demandé au Gouvernement de lui communiquer les contrats conclus entre l’Établissement de préparation et de réponse aux urgences sanitaires et les laboratoires pharmaceutiques. Cela nous a été refusé pour des motifs fallacieux fondés notamment sur des raisons de sécurité intérieure et d’intérêts commerciaux. Nous avons alors saisi la Commission d’accès aux documents administratifs qui nous a donné raison. C’est ainsi que l’article publié dans notre hebdomadaire a servi à M. Gérard Bapt pour interpeller le Gouvernement et l’Établissement de préparation et de réponse aux urgences sanitaires à ce sujet.
Il y a donc eu à la fois propagande et obstruction.
M. Paul Benkimoun (Le Monde). Les médias américains gardaient en mémoire l’épidémie de grippe porcine vécue en 1976. On avait alors procédé à des vaccinations massives, le président Gerald Ford montrant publiquement l’exemple. Mais la campagne fut interrompue en raison d’une suspicion de syndrome de Guillain-Barré qu’elle aurait pu provoquer. On sait aujourd’hui que ce n’était pas le cas. Le vaccin utilisé à l’époque était sans adjuvant.
L’intérêt des médias américains s’est encore accru lorsqu’au mois d’août, les services de santé de la ville de New York estimèrent à 500 000 le nombre de cas de grippe A(H1N1), nombre sans rapport avec ceux donnés par l’Organisation mondiale de la santé.
Une multitude d’informations, accessibles au grand public, portant sur le démarrage et le développement de la maladie a été diffusée par les revues scientifiques telles que Science, qui abritait un blog spécialisé tenu par Jon Cohen, encore aujourd’hui en ligne, et qui suivait, au jour le jour, l’évolution de l’épidémie ou du moins ce que l’on en savait. On ne peut donc parler de différence d’empressement entre les médias américains et européens pour couvrir l’information sur la grippe A(H1N1). En outre, les États-Unis aussi connaissent les ligues anti-vaccins.
L’action des réseaux sociaux et la propagation de rumeurs illustrent l’échec majeur de la politique de communication officielle sur le sujet : on n’a pas accordé une place suffisante à l’opinion publique. Le problème des ligues anti-vaccins, dont les allégations sont faciles à disqualifier, me paraît moins important que les interrogations légitimes des populations auxquelles on a mal répondu en dépit du site internet ouvert par le Gouvernement sur la pandémie grippale.
Le pouvoir politique s’est affiché au premier plan, devant les instances sanitaires : le Premier ministre intervenait ainsi à la place du directeur de la santé.
L’Espace éthique de l’Assistance publique – Hôpitaux de Paris, entre autres, a soulevé le problème du débat public, notamment dans le cadre de la conférence nationale de santé. Aux questions qu’on lui posait, le Gouvernement répondait en mettant en avant la complexité du dossier et assurait qu’il gérait parfaitement le problème – de la même façon que l’on criait autrefois : « Bonnes gens, dormez en paix. » Il a ainsi sous-estimé l’importance de l’adhésion des citoyens, comme celle de la mobilisation des médecins généralistes et des pharmaciens, en l’occurrence les premiers interlocuteurs de la population.
L’attitude des pouvoirs publics a cependant changé après qu’on a observé en juillet, dans un hôpital de Toulouse, des lits occupés par des personnes atteintes de la grippe A(H1N1) et qui, visiblement, ne nécessitaient pas une prise en charge aussi lourde.
Dans la perspective d’une éventuelle future crise, il faudra donc davantage tenir compte de l’opinion publique.
M. le rapporteur. Le débat public a donc fait défaut.
M. Alain Ducardonnet (LCI). Au commencement, eu égard aux doutes que l’on avait sur le virus et à l’existence d’un plan d’action contre une pandémie, les opérations ont été correctement menées. Cependant, si le plan a permis une mise en œuvre rapide des mesures prévues, il avait été conçu pour contrer le virus A(H5N1), c’est-à-dire une maladie grave qui justifiait presque un plan de guerre. Or, au fil du temps, les avis d’experts et l’observation de la réalité ont montré que la gravité du virus était moindre qu’on ne l’avait cru, qu’elle n’entraînait pas les complications prévues et qu’elle n’engendrait pas de surmortalité. L’observation médicale laissait penser que l’on s’orientait vers une grippe traditionnelle.
Pourtant, le Gouvernement a continué sur sa lancée, maintenant les mesures initialement prévues, sous la prédominance du ministère de l’intérieur et non de celui de la santé, avec en particulier la mise à disposition de gymnases pour les vaccinations, stratégie acceptable en cas de virus A(H5N1), mais disproportionnée eu égard aux risques encourus avec le virus A(H1N1). L’écart ne cessait de se creuser entre la réalité observée et une communication axée sur le plan de lutte contre la grippe A(H5N1), ne laissant, de plus, aucune place au dialogue. La prise en compte de l’opinion publique a fait défaut.
M. Guy Lefrand. La communication avec les experts a-t-elle été aisée ? Leurs avis paraissaient-ils homogènes et cohérents ou, comme ceux de M. Antoine Flahault et de M. Marc Gentilini, divergents ? Compte tenu de ce que l’on observait dans l’hémisphère Sud, les informations n’étaient-elles pas contradictoires, sachant que certains arguaient, à chaque annonce d’une gravité moindre du virus, que ce dernier pouvait muter ?
Comment les médias jugent-ils leur rôle par rapport à celui qu’ont tenu internet, les réseaux sociaux et certaines sectes anti-vaccinales – je fais notamment allusion à cette jeune femme enceinte que la presse a déclarée paralysée par le syndrome de Guillain-Barré à la suite de sa vaccination contre la grippe A(H1N1), information qui s’est finalement révélée inexacte ?
Comment l’information a-t-elle été appréciée et gérée ? Quelles ont été vos relations avec les professionnels de santé et comment ces derniers vous informaient-ils ?
Les médias ont-ils, en la matière, exercé une fonction de contre-pouvoir, infléchissant en partie les décisions du Gouvernement ?
M. Gérard Amsellem (Pratis TV). L’information diffusée par les pouvoirs publics a souffert d’un déséquilibre entre celle qui s’adressait au grand public et celle qui était transmise aux professionnels de santé, soit 100 000 médecins et 20 000 pharmaciens, lesquels ont été nombreux sur notre site à se plaindre d’être mal informés, et seulement par les médias. Par exemple, certains pharmaciens ont reçu des clients leur indiquant que, d’après ce qu’ils avaient entendu au journal de France 2, des masques de protection étaient disponibles dans les officines. Quant aux médecins, ils étaient assaillis d’appels pour savoir s’il fallait ou non se faire vacciner et ne disposaient pas d’éléments de réponse. Ils se sont sentis mis à l’écart.
M. Gérard Kouchner (Le Quotidien du médecin). L’information du public passe le plus souvent par les professionnels de santé. Or, ceux-ci n’ont pas été suffisamment informés. Le choix avait été fait de ne pas confier la stratégie de vaccination aux médecins et aux pharmaciens : on les en a dessaisis. Les lobbies anti-vaccination ont largement utilisé les réseaux sociaux pour diffuser des informations négatives, notamment sur le rôle des adjuvants. Aux patients qui les interrogeaient, les médecins déclaraient leur ignorance. Eux-mêmes se sont personnellement montrés réticents à la vaccination : 52 % ont déclaré leur intention de se faire vacciner contre 46 % qui ne l’envisageaient pas.
En mai 2009, les experts étaient unanimes pour considérer l’épidémie comme potentiellement très grave, ce qui explique la commande de 94 millions de doses de vaccin et l’adoption d’un véritable plan de guerre. Personne ne s’y opposait à ce moment-là. La stratégie était inadaptée, mais on ne le savait pas encore.
M. le président Jean-Christophe Lagarde. Le savait-on lorsqu’a été prise la décision d’une vaccination massive ?
M. Gérard Kouchner (Le Quotidien du médecin). M. Didier Houssin déclare que cette décision a été prise au mois de juin 2009. Il était alors difficile d’affirmer qu’il ne faudrait pas deux injections de doses de vaccin et protéger toute la population. En avril 2010, le professeur Jean-François Delfraissy, directeur de l’Institut des maladies infectieuses au Kremlin-Bicêtre, a reconnu qu’il s’était trompé, avec les autres experts, sur la sévérité de l’épidémie.
M. le président Jean-Christophe Lagarde. Les experts pouvaient se tromper en raison du caractère évolutif du virus. Il n’existait pas de certitude absolue. Dans ces conditions, les pouvoirs publics, entourés d’experts presque unanimes, ont adopté les mesures de précaution maximales. L’autorité politique est toujours conduite à décider ainsi.
La perception de la gravité du virus s’est ensuite modifiée, mais il n’est pas facile de communiquer sur quelque chose d’incertain, surtout s’agissant d’une maladie considérée comme peu grave par l’opinion publique.
M. Jean-Daniel Flaysakier (France 2). Je tiens d’abord à préciser que le journal télévisé de vingt heures de France 2 n’a jamais conseillé le port de masques. Mais le téléspectateur entend ce qu’il veut : j’avais présenté un jour un reportage sur l’inflation du nombre de césariennes et on m’a félicité pour mon sujet sur l’avortement… La télévision est une école de modestie !
La difficulté que soulève le recours aux experts vient de ce que les adverbes « jamais » et « toujours » s’emploient en politique et en amour, mais pas en science ou en médecine. Un expert sert à réduire le degré d’incertitude et à aider ainsi ceux qui prennent les décisions. Au contraire, l’expert médiatique produit de la certitude et cela d’autant plus qu’il s’éloigne de son champ de compétence. Le mot « expert » est donc un peu trompeur. Il faudrait d’ailleurs mieux le définir. Un expert doit-il le demeurer ad vitam æternam ? Quoiqu’il en soit, l’existence d’opinions divergentes est saine.
Nous venons de connaître la première pandémie dans des pays démocratiques, le Mexique et les États-Unis, sous le règne d’internet. Alors qu’en Chine, la situation avait été différente lors de l’épidémie de syndrome respiratoire aigu sévère en 2003 puisque le pouvoir politique avait pu cacher la réalité pendant des mois, cette fois, le contexte était autre, même s’il faut rappeler que la présidente de l’Organisation mondiale de la santé, Mme Margaret Chan, avait connu ce syndrome et la pandémie de grippe A(H5N1) quand elle était en poste à Hong-Kong.
En juin 2009, la revue New England Journal of Medicine a établi, à partir des statistiques de l’Association internationale de transport aérien, qu’entre les mois de février et avril, 2,3 millions de personnes avaient quitté le Mexique vers cent-soixante pays et plus de mille destinations, et que les premiers cas de grippe A(H1N1) pouvaient apparaître dès lors que mille quatre cents d’entre elles étaient entrées dans un même pays.
Nombre de raisons concouraient donc à ce que l’information fuse, et de façon plus importante que lors des précédentes épidémies.
En France, il est frappant de constater que le dossier a été géré par plusieurs ministères et pas seulement celui de la santé, notamment ceux de l’éducation, de la justice, de l’intérieur ainsi que par le Premier ministre lui-même. M. Luc Chatel a ainsi annoncé la fermeture d’une école à partir de trois cas constatés. La multitude d’intervenants était surprenante. Ainsi, alors que dès les mois de juin et juillet 2009, les services de M. Thierry Saussez avaient repéré, sur internet, les campagnes anti-vaccination qui se préparaient, les notes envoyées aux ministères concernés pour le leur signaler sont restées sans suite.
J’ai été d’ailleurs sidéré par les commentaires émis sur le blog Santé de France 2 : on pouvait, par exemple, lire sur le site d’un médecin que, lors de l’épidémie de grippe espagnole de 1918, c’est le vaccin qui avait tué plutôt que la maladie, alors que le vaccin anti-grippal n’a été inventé qu’en 1944 !
Les pouvoirs publics, qui consacraient d’importants moyens à la communication publique, auraient pu se rendre compte de ce qui était ainsi colporté. Tout s’est déroulé comme si le train fou du virus H5N1 ne pouvait être arrêté.
M. le président Jean-Christophe Lagarde. J’ai été moi-même frappé par le nombre d’informations que j’ai reçues. Concernant, par exemple, le nom de la maladie, initialement appelée grippe porcine durant les dix premiers jours, pourquoi est-elle devenue, du jour au lendemain, grippe A(H1N1) ? Autre exemple, négatif celui-là : la mention du syndrome de Guillain-Barré qui aurait touché deux personnes vaccinées. Les spécialistes que vous êtes ne pouvaient pas ignorer que le vaccin n’était pas plus dangereux que la maladie grippale et que le syndrome était plus souvent imputable à la grippe qu’au vaccin. Or, on n’a pas entendu de démenti à ce sujet. Comment donc mieux gérer l’information en temps de crise ?
M. Benoît Thévenet (France 5). Le Magazine de la santé diffusé sur France 5 a des reproches à se faire, mais davantage sur le ton et sur la forme que sur le fond.
La qualification de virus porcin faisait penser au syndrome respiratoire aigu sévère et aux épidémies précédentes. Mais nous avons vite su que son origine était sans relation avec le cochon. C’est pourquoi le nom de la maladie a changé. De plus, on ne voulait pas pointer le Mexique du doigt.
M. le président Jean-Christophe Lagarde. Le nom de grippe aviaire, lui, n’a pas changé. Pourquoi ?
M. Benoît Thévenet (France 5). Parce que le virus en cause est, lui, effectivement lié aux oiseaux.
Dans le cas du syndrome de Guillain-Barré, une bulle médiatique s’est formée. Tout le monde s’est exprimé avant nous. Nous avons ensuite dû expliquer de quoi il s’agissait et qu’il était trop tôt pour imputer à ce syndrome la paralysie touchant la patiente dont on parlait. Pour autant, l’information à la télévision n’intervient qu’une fois, alors qu’on peut lire et relire un article de journal.
Au Magazine de la santé, nous avons tenu un discours en faveur de la vaccination afin de lutter contre les lobbies anti-vaccination qui utilisaient les réseaux sociaux. Nous avons expliqué comment, depuis l’invention de la vaccination en 1796, la science et la santé avaient progressé.
Les médecins connaissaient l’intérêt de la vaccination indépendamment du contexte de crise sanitaire. Mais leurs relations étaient alors tendues avec le Gouvernement, notamment sur la question de la revalorisation de leurs actes. Un certain état d’esprit général a ainsi favorisé une relative opposition du corps médical. Des représentants syndicaux l’ont officieusement reconnu.
M. le président Jean-Christophe Lagarde. N’avez-vous pas le sentiment que le ministère de la santé était dans un état d’esprit comparable ? Le dialogue avec les médecins était alors difficile.
Mme Viviane Jungfer (TF1). Chaque automne, la rédaction de TF1 traite de la question de la grippe. Nous avons donc été très attentifs aux caractéristiques de la grippe A(H1N1) et nous avons tenu un discours favorable à la vaccination.
Concernant le syndrome de Guillain-Barré, nous avons immédiatement traité du sujet afin d’expliquer que, dans le cas en question, il était trop tôt pour se prononcer. Mais il est bien connu que l’on n’entend que ce que l’on veut entendre. À la télévision, il existe un décalage entre l’annonce et le titre d’un sujet, son lancement et le développement du sujet lui-même. En novembre, la communication échappait à tout contrôle. Il était difficile de mettre en garde contre cet emballement.
M. le président Jean-Christophe Lagarde. Un lien potentiel a été envisagé entre le syndrome de Guillain-Barré et la vaccination, alors qu’on ne savait rien. C’est ainsi qu’on déclenche un mouvement de suspicion…
Mme Viviane Jungfer (TF1). L’appellation du virus a fait l’objet d’hésitations, jusqu’à la décision de l’Organisation mondiale de la santé de le nommer grippe A(H1N1).
M. le président Jean-Christophe Lagarde. Ce qui ne pouvait que susciter des confusions avec le virus A(H5N1) dont le public entendait parler depuis cinq ans.
Mme Viviane Jungfer (TF1). Il y a eu en effet quelques confusions.
M. Jean-Daniel Flaysakier (France 2). Lorsque le virus a été isolé au Mexique, les prélèvements n’ont pas été envoyés aux États-Unis pour analyse, en raison de l’animosité mexicaine à leur égard, mais au Canada, à Calgary dans l’Alberta. Il a alors été caractérisé comme virus de type A, puis on lui a donné son « immatriculation » définitive, en déterminant le H – pour hémagglutinine – et le N – pour neuraminidase – qui sont des glycoprotéines. Cela a pris du temps, autant que pour le changement d’une plaque de voiture en préfecture…
Mme Martine Perez (Le Figaro). L’exemple du syndrome de Guillain-Barré permet de comprendre les interactions, nombreuses, entre le monde politique et les journalistes. Les politiques lisent beaucoup les journalistes, et ces lectures influent sur leur comportement.
L’affaire relative à ce syndrome a pour origine la juste exigence de transparence de la presse et de la population. Si un journaliste avait eu vent d’une suspicion d’un syndrome de Guillain-Barré sans que le ministère l’ait anticipé et communiqué, nous aurions pensé que celui-ci nous cachait quelque chose et nous y aurions consacré nos unes. Les dégâts médiatiques auraient été pires. La communication du ministère a eu pour objet non pas d’apeurer la population mais d’éviter des fuites à l’impact encore plus tragique.
Cela dit, dès lors qu’il y a communication, nous nous emparons du sujet. Ce cas de syndrome de Guillain-Barré, qui en fait n’en était pas un, a fait la une de la presse. Qui en est responsable ? Du fait des interactions extrêmement subtiles entre la presse et les politiques, les deux !
Qui a décidé l’achat de 94 millions de doses ? J’ai été très surprise de ce chiffre lors de son annonce au cours d’une conférence de presse ; en ma qualité de médecin, je sais que la vaccination de 20 % à 30 % de la population suffit à en protéger la totalité. J’ai su assez vite que la décision avait été prise par le directeur général de la santé. On peut regretter l’absence de débat : il y a eu application « militaire », en quelque sorte, du plan pandémie. Cette décision avait-elle aussi pour objet de répondre aux angoisses que la presse avait contribué à répandre dans la population ? Nous n’avons pas le droit d’ignorer l’impact de nos écrits. À mon sens, la décision d’offrir des vaccins à tous n’avait pas pour origine une manipulation organisée en concertation avec l’industrie pharmaceutique mais une volonté des politiques de se protéger de tous les reproches qui leur sont régulièrement faits ne pas prendre telle ou telle situation suffisamment au sérieux.
M. le président Jean-Christophe Lagarde. J’observe cependant, madame, que dans certains cas, le dialogue entre politiques et journalistes permet d’éviter ce type de dérapage. Lorsque des Français – des journalistes par exemple – sont pris en otages et qu’il est souhaité que leur identité ne soit pas dévoilée, ce résultat est obtenu. En cas d’incertitude, peut-être une discussion pourrait-elle remplacer avantageusement la conférence de presse que vous avez évoquée.
M. Paul Benkimoun (Le Monde). Jusqu’au bout, l’Agence France Presse a continué à intituler ses dépêches consacrées à la grippe A(H1N1) « grippe porcine ».
M. le président Jean-Christophe Lagarde. N’étant pas auditionnée, elle ne peut pas répondre.
M. Paul Benkimoun (Le Monde). Il n’y a pas là d’accusation.
Je suis toujours gêné par l’expression : « les médias ». Les positions des uns et des autres ont été assez différenciées. Si chacun est comptable de son travail, il ne l’est pas de celui de l’ensemble de la corporation. De plus, le visionnage d’une émission ou la lecture d’un article de presse peuvent être extrêmement sélectifs.
Les journalistes ont-ils donné trop d’importance à l’épidémie ? La question m’a été posée dès le mois de juillet, lors d’une réunion à Toulouse. Selon moi – avec des nuances en fonction des journaux –, la presse a été prise dans une attente. Les rédactions savaient que la grippe A(H1N1) serait un événement médiatique important : elles la suivaient dès son origine. Les médias s’y sont donc consacrés très vite. Et même en évitant autant que possible le sensationnalisme, il y a eu un effet de saturation et de cacophonie.
Le comportement des médias a été indissociable de la demande constatée de transparence. Parallèlement à la campagne de vaccination, un dispositif sans précédent de pharmacovigilance a ainsi été mis en place : alors que les notifications sont habituellement effectuées par les professionnels de santé, elles ont été ouvertes aux particuliers sur le site internet de l’Agence française de sécurité sanitaire des produits de santé. Parmi les éléments communiqués lors d’une conférence de presse figurait un dossier réalisé par cette agence sur les vaccins et le syndrome de Guillain-Barré. Nous l’attendions donc tous : statistiquement, de tels syndromes se produisent indépendamment des opérations de vaccination et certains cas sont liés à des infections, comme la grippe. Il ne faisait donc pas l’ombre d’un doute que, au moment où se présenterait un cas pouvant ressembler à un syndrome de Guillain-Barré, une forte attention médiatique forte lui serait portée.
Alors que la campagne allait être lancée, j’ai suggéré au directeur de cabinet de la ministre de la santé d’informer par avance le public sur le syndrome de Guillain-Barré. Ainsi, celui-ci aurait pu avoir connaissance de l’ensemble des données relatives à ce syndrome : fréquence de survenue en France, causes possibles. Mon interlocuteur a répondu par la négative, par crainte d’effrayer la population et de donner une assise à des réticences ou des refus de vaccination.
Si demain, face à un nouveau risque de pandémie ou de crise sanitaire, le comportement des autorités à l’égard de la population diffère à nouveau de celui d’un médecin traitant envers son patient, qui l’informe des risques encourus, nous irons au-devant de nouvelles déconvenues.
Le discrédit de cette vaccination s’est aussi ajouté à celui jeté par les Français sur le vaccin contre l’hépatite B, pour lequel, alors que les études épidémiologiques n’ont pas démontré de lien entre ce vaccin et la sclérose en plaques, doutes et incriminations persistent.
M. Gérard Kouchner (Le Quotidien du médecin). La presse spécialisée, comme le Quotidien du médecin, n’a sans doute pas suffisamment joué le rôle essentiel de presse d’opinion. Certes, nous avons donné successivement la parole à ceux qui la prenaient, pouvoirs publics ou syndicats. Mais ce n’est qu’en novembre que les syndicats de médecins généralistes ont commencé à contester le fait que la vaccination ne leur soit pas confiée en ville. Seules les unions régionales des médecins libéraux ont protesté dès le mois de juillet contre cette dépossession. Comme l’a dit M. Alain Ducardonnet, nous n’avons pas assez montré qu’il n’y a pas eu de basculement de l’excellente adaptation du plan de guerre, très bien conçu deux ans plus tôt, par M. Xavier Bertrand pour lutter contre le virus A(H5N1), vers un dispositif convenant mieux à la situation dès lors qu’elle évoluait.
Entre les mois de septembre et novembre – je ne connais pas la date précise et je suis d’accord avec M. Éric Favereau pour parler d’obscurité –, le Gouvernement a décidé d’appliquer le plan de lutte contre le virus A(H5N1), avec intervention des préfets et vaccination dans des gymnases. Rétrospectivement, il apparaît clairement qu’il aurait fallu « passer la main » aux généralistes. Un vrai débat aurait dû avoir lieu. La presse aurait sans doute dû s’en saisir, écrire que des experts commençaient à reconnaître que l’épidémie n’était pas aussi grave que prévu, se procurer des chiffres et demander pourquoi le Gouvernement continuait à s’en tenir au dispositif envisagé alors que personne n’allait se faire vacciner dans les gymnases.
Dès la formulation, en novembre, de la demande des syndicats de médecins généralistes, le professeur Didier Houssin, directeur général de la santé, a refusé d’y donner satisfaction. Au début du mois de décembre, le débat a été porté sur la place publique par les politiques – MM. Jean-Marie Le Guen, Frédéric Lefebvre, des élus communistes par exemple. Dans l’ensemble, tous se sont interrogés sur l’absence de transfert de la vaccination aux médecins généralistes. Nous aurions alors dû dénoncer la poursuite de l’application du dispositif conçu pour la lutte contre le virus A(H5N1).
Ce n’est qu’un mois plus tard, au début du mois de janvier, que Mme Roselyne Bachelot-Narquin a annoncé – sur TF1 je crois, ce qui est un peu étrange pour une information d’abord destinée aux professionnels de santé – que le vaccin allait être mis à la disposition des généralistes. Les conditions étaient ubuesques : ils devaient se procurer les doses de vaccins dans des centres très éloignés de leurs cabinets. Il a ensuite fallu attendre une quinzaine de jours pour que les pharmacies soient approvisionnées. Les raisons alléguées au cours des mois précédents pour ne pas transférer la vaccination aux médecins – à savoir le conditionnement en flacons de dix ou cent doses, ou le respect de la chaîne du froid – étaient irrecevables : un généraliste annonçant qu’il procéderait à la vaccination un jour donné dans la semaine aurait parfaitement écoulé les doses reçues. Et comment penser que la chaîne du froid aurait pu ne pas être respectée pour la vaccination contre le virus A(H1N1) par les généralistes alors qu’elle l’est pour la vaccination contre la grippe saisonnière ? Nous n’avons pas assez dénoncé le caractère fallacieux de ces arguments. Nous n’avons pas réclamé de basculement du dispositif vers les généralistes.
M. Marc Payet (Le Parisien-Aujourd’hui en France). Si, dans cette crise, les experts ont été assez accessibles et faciles à rencontrer, nous devons en revanche évoquer les liens d’intérêt de certains d’entre eux avec les firmes pharmaceutiques. Le sujet est polémique : s’il est difficile de prouver que des liens d’intérêt influencent une décision, ne pas les mentionner est également délicat. Aussi bien au sein du Comité de lutte contre la grippe que des comités de l’Organisation mondiale de la santé, des liens d’intérêt un peu troublants entre les experts et certaines firmes existaient.
Les médias doivent aussi accepter une part d’autocritique. La grippe A(H1N1) était un si « bon sujet » que s’y sont consacrés les journalistes des services de santé, politiques, économiques, voire diplomatiques, lui accordant alors une énorme ampleur médiatique. Agir de façon sensée aurait consisté à conduire des enquêtes, et, patiemment, avec un peu de recul, construire des articles solides. Au lieu de quoi nous avons peut-être consacré à la grippe trop de unes et d’ouvertures des journaux télévisés. En juillet et en août notamment, le traitement a été exagéré : les unes de nos journaux étaient consacrées à une épidémie qui n’était pas encore là ! Pendant l’automne, alors même que nous disposions d’informations, nous n’avons pas non plus conduit beaucoup de reportages critiques.
M. le président Jean-Christophe Lagarde. Les politiques que nous sommes savent bien que, eu égard à la rareté de l’actualité en juillet et en août, il est très facile d’y faire traiter un sujet donné. En revanche, cette situation peut gonfler l’importance d’une question…
M. Marc Payet (Le Parisien-Aujourd’hui en France). Cela dit, pourquoi, depuis cinq ou six ans, la suspicion d’une épidémie prochaine due au virus A(H5N1) était-elle si prégnante ? Était-il nécessaire de conclure autant de contrats prépandémiques ? Ne devons-nous pas nous interroger sur l’influence des laboratoires ?
M. Gérard Bapt. Lorsque le cas de syndrome de Guillain-Barré a été évoqué par la presse – dans un journal dont un représentant est ici présent –, j’ai contacté l’Agence française de sécurité sanitaire des produits de santé. Elle n’était pas au courant. Monsieur le rapporteur, voilà un cas où la transmission de l’information en matière de pharmacovigilance ne passe pas par les agences chargées d’y veiller !
De même, après qu’une infirmière venant d’être vaccinée a avorté, il a été avéré qu’elle était déjà atteinte de la grippe A(H1N1). C’est donc celle-ci, et non le vaccin, qui était responsable.
Il est du devoir de la presse de s’informer où elle peut si elle ne bénéficie pas d’information officielle. Je me félicite aussi, monsieur Jérôme Vincent, qu’elle ait travaillé sur les contrats.
Enfin, alors que la mission d’information parlementaire sur la grippe aviaire avait été tout à fait utile, je regrette que la constitution d’une telle mission pour la grippe A(H1N1) ait été longtemps et systématiquement refusée. La médiation envers l’opinion ne passe pas seulement par les médecins ou les pharmaciens : les élus de terrain peuvent aussi tenir ce rôle.
Par ailleurs, faire basculer le dispositif de vaccination vers les médecins aurait-il suffi à sa réussite ? Les médecins eux-mêmes n’étaient pas convaincus ! Comme le docteur Dupagne l’a dit hier devant la commission d’enquête créée par le Sénat – mais il n’est pas le seul médecin de cet avis –, dès le mois de mai certains étaient convaincus que cette grippe ne serait pas plus grave qu’une autre. J’ai en ma possession un courriel adressé le 2 septembre par le docteur de Chazournes, médecin à La Réunion, à MM. Jean Marimbert, directeur général de l’Agence française de sécurité sanitaire des produits de santé, et Philippe Lechat, directeur de l’évaluation des médicaments de cette agence dans lequel il écrit : « S’il vous plaît, et dans l’intérêt de la population, prenez votre temps pour tester ces vaccins A(H1N1) et résistez à la pression politico-médiatique les concernant. Êtes-vous au courant du plan ministériel ? (…) À La Réunion, c’est l’affolement depuis le début de cette grippe qui est pourtant d’une banalité déconcertante (…). Cette peur et cette panique sont relayées par une presse régionale et nationale omniprésente sur l’île depuis quelques jours, en affirmant que l’île est quasiment devenue infréquentable ! Intervenez auprès de notre ministre au plus vite pour cesser cette course effrénée à la vaccination. »
Le professeur Marc Gentilini s’est plaint devant nous qu’il n’avait pas été entendu et que, en quelque sorte, les experts avaient été sélectionnés, la parole étant refusée à ceux dont les propos étaient divergents de ceux des experts officiels, du Comité de lutte contre la grippe ou encore du Haut conseil de la santé publique.
De façon générale et plus encore lorsqu’ils sont dans l’opposition, les parlementaires, qui ne disposent pas de moyens d’investigation, ont grand besoin de la presse pour travailler. C’est tout particulièrement vrai sur des questions aussi scientifiques. Selon la directrice générale de l’Institut de veille sanitaire, le docteur Françoise Weber, le virus peut encore muter. Dans l’esprit commun, une mutation de virus est un facteur de risque ; or, selon le professeur Antoine Flahault, la mutation du virus serait le signe de la fin de la pandémie, un virus ne mutant que lorsqu’il ne peut plus se développer ! Le docteur Françoise Weber, je crois, a également évoqué le caractère modéré de la pandémie. Mais le scénario optimiste de l’avis officiel, publié le 28 septembre sur le site de l’Institut de veille sanitaire, prévoyait 3 500 morts dont 640 décès d’enfants de zéro à six ans, et le scénario pessimiste 36 000 morts. En mai, le professeur Antoine Flahault avait quant à lui annoncé 30 000 décès.
Ne croyez-vous pas aussi que le parti pris catastrophiste de la communication gouvernementale a été déterminant pour placer la presse dans une situation aussi difficile ? Le directeur du service d’information du Gouvernement, M. Thierry Saussez, a écrit dans un article et répété devant nous que « gérer une crise, c’est faire face à une menace en la maximisant ». C’est bien ce qui a été fait, du début à la fin, et sans adaptation. Or selon un article paru en août 2009 dans le journal suisse Le Temps, rapportant comment un Suisse, installé en Australie, avait vécu – avant le vaccin – la grippe, l’épisode était décrit comme étant d’une banalité déconcertante.
Quelles grandes voix se sont-elles élevées pour dénoncer un tel fourvoiement ? Pour moi, le Titanic a touché l’iceberg le 4 janvier 2010. Comment faire pour que des signaux d’alerte annonçant un fourvoiement, émis par d’autres voix que des voix officielles – tenues par des positions officielles, des conflits d’intérêt, des déroulements de carrières hospitalo-universitaires ; le professeur Gentilini lui-même l’a reconnu devant nous – soient répercutés par la presse afin de permettre au Titanic de manœuvrer avant de toucher l’iceberg ?
M. Jérôme Vincent (Le Point). J’ai été frappé de la convergence disciplinée, ainsi que du manque d’indépendance et d’esprit critique des experts que j’ai rencontrés de juillet à octobre. Tous, sauf cas exceptionnels, sont en attente d’un budget, de matériels, de postes, d’une nomination, d’une récompense ; il n’est pas possible d’être nommé ni de se maintenir dans les structures officielles ou les agences dont ils font éventuellement partie sans être obéissant.
Dans une situation marquée par des incertitudes, les avis devraient être divergents. Au contraire, ces liens d’intérêt, internes au secteur public et donc différents des liens d’intérêt entre les secteurs public et privé, nuisent à l’esprit d’indépendance indispensables à la bonne expertise.
M. le président Jean-Christophe Lagarde. D’autres personnes auditionnées partagent-elles ce sentiment, exprimé pour la première fois devant la commission d’enquête ? Il m’a semblé que pour d’autres maladies, le cancer par exemple, l’unanimisme dans un monde incertain finit par être suspect et que sont présents des intérêts qui ne correspondent pas forcément à l’intérêt public.
M. Gérard Amsellem (Pratis TV). Les médecins savaient-ils tous dès le mois de mai que la grippe n’était pas dangereuse et que la vaccination serait inutile ? Nous avons réalisé auprès d’environ 300 d’entre eux, entre les mois d’avril 2009 et de mars 2010, vingt-quatre sondages pour connaître le pourcentage de ceux qui avaient l’intention de se faire vacciner : en mai, 90 % d’entre eux se sont déclarés volontaires pour bénéficier de la priorité de vaccination ; en septembre, ils n’étaient plus qu’à peine 40 % ; aux mois de novembre et décembre, ce pourcentage était descendu à 15 % ou 20 %, soit la proportion de médecins qui se sont fait vacciner.
Le responsable de cette évolution est le virus lui-même. En ne tenant pas – et heureusement – ses promesses de virulence, il a démobilisé les médecins. Dans ces conditions, il ne me paraît pas possible d’affirmer qu’en mai les médecins savaient, et qu’ils ne voyaient pas l’intérêt de la vaccination.
M. Éric Favereau (Libération). Les liens des journalistes avec les experts me paraissent plus compliqués que ce qu’en a dit M. Jérôme Vincent. Les experts que nous avons consultés m’ont paru plutôt indépendants dans leurs raisonnements. En revanche – je le sais pour suivre depuis longtemps ces questions –, notre forte proximité intellectuelle avec eux créait de notre part une réceptivité à leurs propos. Nous évoluions selon un même paradigme.
Par ailleurs, les experts les plus catégoriques, comme le professeur Marc Gentilini, sont sur la grippe des incompétents notoires. Lors de l’apparition du sida, M. Gentilini avait décidé de ne pas s’occuper d’une maladie qui, selon lui, ne concernait que les gays. Malgré son action dans d’autres domaines, j’avais une certaine réticence à prendre au sérieux ses propos, de même que ceux du professeur Bernard Debré, urologue qui est assez peu présent dans ses services et qui a de multiples activités…
M. le président Jean-Christophe Lagarde. Il s’est sans doute exprimé comme parlementaire ! Ce qui dès lors excuse son « incompétence »…
M. Éric Favereau (Libération). Il faut aussi évoquer le lien de la presse avec l’industrie pharmaceutique. Généraliste ou spécialisée, la presse est en grande difficulté. Aujourd’hui, très peu de journalistes partent en reportage s’ils ne sont pas financés par un laboratoire. Moi-même, travaillant dans un journal aussi indépendant que Libération, je ne peux partir en reportage que si j’en trouve le financement. Chaque année, l’industrie du vaccin organise pour la grippe saisonnière un voyage de presse où la quasi-totalité des journalistes médicaux, spécialisés ou non, sont présents. Ce contexte difficile, qui pose problème, rend un peu cocasse la montée en puissance dans la presse de l’argumentation d’experts vendus à l’industrie pharmaceutique…
M. le président Jean-Christophe Lagarde. Les experts et l’industrie pharmaceutique nous l’ont dit, ils sont prêts à publier leurs liens réciproques. Si nous légiférons, il ne sera pas inutile de faire la même demande pour la presse.
Mme Martine Perez (Le Figaro). Monsieur Gérard Bapt, quelle que soit la précision de l’information de la lettre d’un Suisse qui vit en Australie, pour nous, journalistes, un témoignage ne vaut pas démonstration.
J’ai entendu ici même, à l’Assemblée nationale, lors d’une audition, l’anecdote suivante. Voulant lancer un journal boursier, un entrepreneur cible une clientèle d’un million de personnes. À 500 000 d’entre elles, il expose que la bourse va monter, et aux 500 000 autres qu’elle va descendre. À la moitié de ceux à qui il a dit qu’elle allait descendre, il explique qu’elle va remonter, et aux autres qu’elle va continuer à descendre. Au bout du compte, 50 000 ou 100 000 des destinataires de ses lettres s’abonneront en considérant que ce journaliste ne se trompe jamais.
Rétrospectivement, si l’épidémie avait été catastrophique, des dizaines d’experts auraient pu dire qu’ils avaient eu raison. Mais avoir eu rétrospectivement raison avant les autres ne signifie pas forcément que l’analyse était la meilleure. C’est pour cette raison que, loin de nous contenter de l’avis d’un seul expert, nous autres journalistes essayons d’être rigoureux et choisissons nos interlocuteurs en fonction de leurs compétences. Certains des experts que nous avons consultés étaient inquiets sans être dans une situation de conflit d’intérêt ou connaître des soucis de carrière. Le débat sur cette épidémie comportait un jeu intellectuel : serait-elle grave ou non ? Finalement, elle ne l’a pas été.
Nos articles n’ont jamais parlé de tragédie, mais simplement d’une incertitude ; avec bien du mal, nous essayions d’en démêler l’écheveau. Nous cherchions aussi à savoir comment les pouvoirs publics effectuaient des choix dans cette situation. Si celle-ci s’est progressivement clarifiée, on ne saurait considérer qu’en mai chacun connaissait la faible gravité de la grippe A(H1N1).
M. Gérard Amsellem (Pratis TV). Il nous faut aussi savoir décrypter. Lorsque le professeur Antoine Flahault expose que la grippe pandémique est cent fois plus mortelle que la grippe saisonnière, il fait référence à la mortalité directe, faible, de celle-ci.
Dès lors que les chiffres cités pour la mortalité due à la grippe saisonnière sont de 4 000 morts par an, une extrapolation conduit à des chiffres astronomiques. Un minimum de retenue est indispensable. Il y a eu exagération.
M. le président Jean-Christophe Lagarde. Cette information n’a pas été confirmée par nos auditions. Le nombre de morts directes causées par la grippe A(H1N1) n’est que très légèrement supérieur à celui des morts causées par la grippe saisonnière ; le petit nombre des unes et des autres empêche toute quantification statistique, par qui que ce soit. Le doublement que constitue un passage de trois morts directes à six n’est pas statistiquement fiable.
M. Jean-Daniel Flaysakier (France 2). Mais – malheureusement – la mortalité directe de la grippe saisonnière est inconnue !
M. le président Jean-Christophe Lagarde. Alors que j’ai toujours entendu parler de 3 000 morts par an…
M. Jean-Daniel Flaysakier (France 2). Ce sont des morts indirectes !
M. le président Jean-Christophe Lagarde. … les auditions m’ont appris que les décès directs dus chaque année à la grippe saisonnière étaient inférieurs à la dizaine.
M. Jean-Daniel Flaysakier (France 2). On l’a vu avec le virus A(H5N1), en cas d’épidémie de grippe dans une mégalopole d’un pays d’Afrique, où d’autres maladies comme la tuberculose ou le sida sont très répandues, il n’est pas possible d’imputer précisément chaque mort à une maladie particulière. Si les systèmes de santé australien ou néo-calédonien permettent d’établir des recueils, on ne saurait extrapoler aux 90 % restants de l’hémisphère Sud les résultats qu’on y observe. Contrairement aux idées généralement admises, la grippe est présente sous les tropiques, même si ce n’est pas sous les mêmes formes qu’en Europe. Tant que des modèles de recueil ne seront pas généralisés dans l’hémisphère Sud, notamment dans les pays africains, nous ne pourrons pas dire qu’il ne s’y est rien passé.
M. Gérard Bapt. Je ne prétends pas que tous les médecins savaient en mai 2009 que l’épidémie ne serait pas grave – j’ai seulement cité les docteurs Dupagne et de Chazournes. Cela dit, les médecins correspondant les uns avec les autres, l’évolution des résultats des sondages sur leur propension à se faire vacciner ne me surprend aucunement.
Un dossier, que je tiens à votre disposition, m’indique que, le 26 août 2009, le département de la santé publique des États-Unis communiquait à l’administration américaine des données chiffrées non seulement sur l’Australie, mais aussi sur l’Argentine, le Chili, la Nouvelle-Zélande et l’Uruguay – la situation au Mexique était déjà connue. Ces chiffres étaient très inférieurs à ceux précédemment avancés, qui figurent toujours dans la check-list de l’Organisation mondiale de la santé pour les recommandations des plans nationaux de lutte contre une pandémie grippale, organisation qui envisage 7,4 millions de décès prévisibles.
Vous êtes-vous aussi intéressés à la modification de la définition de la pandémie ? Le 11 juin 2009, le docteur Margaret Chan a décrété la pandémie alors que le nombre de morts dans le monde était de 144. Or, avant le changement de définition de la pandémie, le 4 mai 2009, y compris pour la définition des niveaux d’alerte – le 11 juin est aussi la date de proclamation de la phase 6 –, celle-ci supposait un nombre considérable de morts. Les conflits d’intérêt au sein de l’Organisation mondiale de la santé ont-ils été bien « décortiqués » ? Je n’en suis pas sûr.
Lors d’une réunion qui s’est tenue à Bruxelles en 2009, l’association ESWI (European scientific working group on influenza), présidée par « Mister Flu », le professeur Albert Osterhaus, a exposé que, pour faire réagir les institutions, il fallait rechercher des cas dramatiques, à l’exemple des deux enfants turcs dont la mort a ému l’opinion publique lors de la grippe aviaire. Le même raisonnement était à l’œuvre lors de la réunion tenue en 2005 à Genève entre l’Organisation mondiale de la santé, les agences et les laboratoires. C’est une longue préparation. La responsabilité de l’Organisation mondiale de la santé et de ses experts, du fait de leur convergence avec les structures de surveillance de la grippe et de préparation des plans, est très lourdement engagée.
Si je n’ai personnellement aucun doute sur l’honnêteté personnelle des experts français et des membres du Comité de lutte contre la grippe en France, leur difficulté est qu’ils ne peuvent pas travailler sans les laboratoires. Les chercheurs membres du comité évoluent dans une sorte de consensus intellectuel collectif, sans discussion et sans débat. Ils ont besoin de financer les publications nécessaires à leur carrière, qui leur permettront ensuite de faire partie d’agences ou d’organismes officiels. Les sceptiques, les critiques sont à l’extérieur : ils ne sont pas « sélectionnés » par les laboratoires. Les investigations devraient se concentrer davantage sur l’Organisation mondiale de la santé et la façon dont les plans ont été préparés avec les experts.
Quant à l’hémisphère Sud, je vous renvoie au bulletin de l’Organisation mondiale de la santé du 22 mai qui fait le point sur le Mexique.
M. le président Jean-Christophe Lagarde. Nous sommes en train d’auditionner M. Gérard Bapt !
M. Gérard Bapt. Je veux bien l’être !
M. le président Jean-Christophe Lagarde. Nonobstant la qualité de nos invités, je ne suis pas sûr que la vocation de la présente réunion soit celle d’être un point de presse !
En revanche, nos invités pourraient se prononcer sur la thèse de M. Gérard Bapt selon laquelle nous aurions affaire à une sorte de complot généralisé.
M. le rapporteur. Je regrette également que l’un de nos collègues de l’opposition détourne l’audition de la presse nationale pour la transformer en conférence de presse et distribue des documents de propagande. C’est choquant.
La question qui se pose est celle de la stratégie déployée, celle d’une campagne de vaccination destinée à faire face à une éventuelle pandémie.
Je ne cautionne pas l’ensemble des remarques formulées ici par les représentants de la presse ; notamment, je n’adhère pas au procès intenté contre les experts. Mon opinion se fonde sur les nombreux experts que j’ai rencontrés, y compris à l’Organisation mondiale de la santé et dans les centres de l’Institut Pasteur de l’Asie du Sud-Est lorsque j’étais rapporteur de la mission d’information sur la grippe A(H5N1) – à l’époque, avec un collègue de l’opposition, nous avions essayé de contester le déni du risque, lequel était bien présent.
Quel est votre avis sur les principes de précaution et de prévention ? Le principe de précaution a-t-il été maximalisé ? Devons-nous revoir sa mise en œuvre ? Avons-nous dépassé l’équilibre entre précaution et prévention ? Grâce à vous, nous pourrons peut-être savoir comment demain une meilleure réponse pourrait être apportée à un éventuel nouveau risque.
Le Centre de contrôle et de prévention des maladies d’Atlanta a pour fonction d’analyser tous les médias, sites internet et réseaux sociaux, et de formuler en conséquence des réponses immédiates et en ligne aux rumeurs et échanges qu’ils véhiculent. Ne faudrait-il pas, dans le cadre de la gestion des risques futurs – sanitaires, climatiques, technologiques ou autres –, mettre en place en France une telle « task force », qui permettrait la diffusion de réponses en ligne, élaborées par le Gouvernement, les experts, les autorités publiques ? Devons-nous copier ce modèle ? Notre commission d’enquête est là pour tirer les leçons de la gestion de l’épidémie et aider les autorités à envisager d’autres réponses.
M. Gérard Amsellem (Pratis TV). Monsieur le rapporteur, le principe de précaution inscrit dans la Constitution prévoit la prise de mesures proportionnées à un risque majeur concernant l’environnement. En matière de santé publique, sommes-nous dans ce cadre ?
Par ailleurs, si la prédiction relève de la voyance, la prévision est l’affaire des experts. L’ensemble des experts épidémiologistes que nous avons rencontrés utilisent des modèles mathématiques pour prévoir, sur trente ans, des schémas possibles, et envisager des stratégies en conséquence. Nous ne pouvons donc échapper à leur rôle central.
Quelle que soit l’éminence du rôle de l’Organisation mondiale de la santé, émanation de cent quatre-vingt-treize pays membres, il y a eu une grande absente, l’Europe, dont le silence a été assourdissant. Nous ne pouvons retenir qu’une intervention mineure de la Commissaire européenne Androulla Vassiliou et une réunion des ministres européens, qui n’a abouti à aucune mesure. En matière de « task force » et de centralisation de réponses à des événements majeurs, il faudrait d’abord penser européen.
M. Gérard Kouchner (Le Quotidien du médecin). Comme nous tous, les experts sont soumis bien plus au principe de précaution qu’à l’influence des laboratoires pharmaceutiques. Comme M. Éric Favereau, je connais leur honnêteté ; leurs conflits d’intérêt sont publiés. Mais peu d’entre eux prédiront qu’une épidémie potentiellement grave ne le sera pas : le principe de précaution impose de considérer que l’épidémie peut être grave et que ce n’est pas parce qu’elle ne l’a pas été qu’elle n’aurait pas pu l’être.
Créer une cellule de communication de crise serait reconstituer l’Agence Tass et instaurer une ligne officielle ! C’est la presse qui doit sans doute mieux exercer son rôle de contre-pouvoir ou d’éclairage. Je l’ai reconnu, nous n’avons pas effectué de contre-enquête ni pris position. Nous n’avons pas chargé un journaliste d’enquêter pour savoir pourquoi la France n’était pas passée du plan de lutte contre le virus A(H5N1) à un autre, plus pratique et moins lourd. La première stratégie était acceptable dans la perspective d’une situation comportant des conséquences sociétales potentiellement gravissimes, évoquées par tous les experts – en avril 2010, le professeur Jean-François Delfraissy a reconnu avoir imaginé que quinze à vingt millions de personnes pourraient être immobilisées en même temps. Cependant, à partir du mois de septembre, alors que nous savions que cette gravité n’était plus d’actualité, nous n’avons pas éclairé les lecteurs sur l’absence de changement de stratégie des pouvoirs publics ; ceux-ci auraient alors dû considérer que, après qu’ils avaient prévu le pire, et constatant qu’il ne se réalisait pas, la vaccination devrait désormais être organisée non plus par M. Brice Hortefeux mais par les médecins libéraux.
M. Gérard Kouchner (Le Quotidien du médecin). M. Marc Gentilini a été attaqué publiquement. J’ai été son élève et assistant dans son service. Il ne s’est pas sans cesse trompé. Si, à son début – dans les années 1980 – il n’a pas immédiatement reconnu la gravité de l’épidémie de sida, c’est dans son service, ainsi que dans les hôpitaux Claude-Bernard et Saint-Louis qu’ont été menées les première grandes luttes. C’est là que travaillait Willy Rozenbaum, qui a isolé le premier le virus.
M. le président Jean-Christophe Lagarde. Le professeur Gentilini est un professeur reconnu. Il saura se défendre.
Avez-vous observé, ailleurs qu’en France, des stratégies de communication gouvernementale qui auraient permis une plus grande efficience ?
M. Éric Favereau (Libération). Je tire deux enseignements majeurs de cette affaire.
Voilà vingt ans que je traite de santé publique. Jusqu’ici, l’idée était qu’agir plus était toujours mieux. Pour la première fois – c’est un événement majeur –, ce schéma est mis en question : il est possible d’en faire trop, avec des effets très négatifs.
M. le président Jean-Christophe Lagarde. M. Thierry Saussez nous a pourtant dit le contraire.
M. Éric Favereau (Libération). Ensuite, la situation est cocasse. Alors que les journalistes ici présents représentent tous, ou presque, des journaux favorables à la vaccination, le public n’en a pas voulu.
M. le président Jean-Christophe Lagarde. Qui s’est fait vacciner ?
(Une partie des personnes auditionnées lève la main.)
M. Éric Favereau (Libération). Dans un entretien publié dans Le Monde, un ancien directeur général de la santé a exposé qu’en matière de santé publique, il ne suffisait plus d’avoir raison. Dès lors, on peut se demander pourquoi le ministère de la santé ne s’est pas ouvertement interrogé sur cet échec.
M. le rapporteur. M. Didier Tabuteau a formulé très tôt la même opinion.
M. Benoît Thévenet (France 5). Comment contrecarrer un principe de précaution maximisé ? Nous considérons désormais que toute mort est inacceptable. Pourtant, la vie comporte les risques d’être malade et de mourir. Les autorités sanitaires doivent faire un effort de communication en ce sens. En France, la santé publique se résume trop souvent à l’épidémiologie et aux statistiques.
M. le président Jean-Christophe Lagarde. Une telle communication ne devrait-elle pas être quasi-permanente et effectuée très largement en amont ?
M. Benoît Thévenet (France 5). Bien sûr. La crise nous montre la nécessité d’une réflexion pour expliquer ces notions au public.
M. Jean-Daniel Flaysakier (France 2). Depuis l’affaire du sang contaminé, et par peur d’être traduit devant la Cour de justice de la République, aucun décideur en France n’accepte de conduire une pédagogie du risque.
M. Benoît Thévenet (France 5). Cette action pédagogique est menée dans d’autres pays européens, me semble-t-il. La France est très en retard.
M. le président Jean-Christophe Lagarde. Une telle action au long cours est sans doute impérative, en particulier pour la grippe, que le public prend faussement pour une maladie banale et parfaitement maîtrisée par les scientifiques. Une communication à l’attention d’une population ignorante de la réalité est très difficile en période de crise.
Mme Martine Perez (Le Figaro). En France, le principe de précaution, clairement développé dans le domaine de l’environnement, est très mal défini en matière de santé publique. Jusqu’où aller pour protéger la population ? Lors de l’arrivée de la pandémie, les règles n’étaient pas posées. La création de la commission d’enquête montre l’existence de limites.
Le déroulement de l’affaire a montré aussi l’existence d’un principe de précaution politique. Le nœud de la crise est que, pour se protéger d’un risque peut-être judiciaire, mais au moins tout simplement politique, les responsables ont choisi un dispositif maximal.
Et même si l’industrie pharmaceutique a été très satisfaite de vendre des millions de doses de vaccins à la France, je ne crois pas à un complot des experts.
Si le principe de précaution médicale n’avait pas été contaminé par le principe de précaution politique, l’évaluation des risques, des stratégies et des besoins aurait été beaucoup plus sereine. C’est en France que le stock de Tamiflu est le plus élevé, alors qu’il n’a quasiment pas servi.
Enfin, j’ai longtemps déploré que le Comité de lutte contre la grippe ne comporte pas d’experts de santé publique, mais seulement des virologues et des bactériologistes.
M. Marc Payet (Le Parisien-Aujourd’hui en France). La question qui se pose est de savoir si le Gouvernement a eu raison de souscrire, en quelque sorte, une assurance tous risques hors de prix – un milliard d’euros –, alors qu’avec trois cent douze morts, le risque s’est révélé faible. En effet, compte tenu du contexte budgétaire contraint, ce milliard d’euros n’a pas pu être affecté à d’autres actions, en faveur des hôpitaux ou du handicap par exemple.
M. Jérôme Vincent (Le Point). Monsieur le rapporteur, je ne sais vous répondre ni sur le principe de précaution, ni sur les réponses en ligne.
Ce qu’il faut avant tout inventer aujourd’hui, c’est une « task force » du bon sens.
Alors que le principe de précaution inclut une réponse proportionnée à la menace, la réponse a été hors de proportion et les vraies questions médicales n’ont pas été posées. Comment, en quelques semaines, procéder à une vaccination générale ? C’est impossible ! Jamais dans l’histoire de France une telle opération n’a été conduite ! Mieux encore, comment y procéder avec des vaccins parvenus trop tardivement ? De plus, comment effectuer une telle vaccination sans les médecins généralistes ? Pour eux, l’acte est on ne peut plus simple : après avoir procédé à un interrogatoire, il faut accomplir un geste technique plus qu’élémentaire, au moyen d’instruments et de produits conservés proprement, puis consigner l’acte sur une feuille.
Les politiques – y compris ceux de l’opposition – et les experts ont dû perdre la tête pour imaginer un plan où les vaccins arriveraient trop tard, en quantité hors de proportion et jamais vue dans ce pays, et où les professionnels de la médecine seraient tenus à l’écart ! Ils doivent faire leur mea culpa.
M. le président Jean-Christophe Lagarde. Vous nous donnez l’impression qu’il y a eu une hystérie collective !
Avez-vous observé à l’étranger des stratégies mieux adaptées et mieux comprises par la population ?
Mme Martine Perez (Le Figaro). Pendant l’automne, nous avions demandé à nos correspondants à l’étranger de courts papiers – vingt lignes – sur le déroulement de la vaccination. Une page du Figaro y a été consacrée. Le ton général était, d’une part, que les gens ne se faisaient que peu ou pas vacciner, et, d’autre part, que la presse ne s’intéressait plus du tout à la grippe – au contraire de la France, celle-ci a été un non-événement pour beaucoup de pays européens. Je persiste à penser que ce sont notre tradition et notre vision du traitement des crises sanitaires qui expliquent ce contraste.
M. Paul Benkimoun (Le Monde). Au contraire de la France, beaucoup de pays ont retenu des solutions très simples. Ainsi, en Allemagne, les médecins généralistes demandaient aux patients qui venaient consulter s’ils voulaient être vaccinés ; en cas de réponse positive, ils regroupaient les vaccinations à une même date.
En revanche, quels que soient la stratégie adoptée et l’objectif fixé – enrayement de l’épidémie ou, comme en France, reconnaissance d’un droit à la vaccination pour chacun – peu de pays ont réussi à obtenir un taux élevé de vaccination.
M. Gérard Kouchner (Le Quotidien du médecin). La culture de santé publique de la Grande-Bretagne a fait facilement accepter une vaccination partielle de la population – sur la base d’une personne sur trois – avec des moyens simples. Le nombre de doses achetées a été de ce fait bien moins élevé qu’en France.
Monsieur le rapporteur, la décision d’achat de 94 millions de vaccins – prise en juin, nous dit-on – et de mise à l’écart des médecins généralistes de la vaccination n’auraient-elles pas pu faire l’objet d’un débat au Parlement ?
Mme Martine Perez (Le Figaro). Lors d’une mission à Chicago, j’ai vu à l’aéroport un petit stand où étaient proposées des vaccinations sur place par une infirmière : 25 dollars pour la grippe A(H1N1), 35 dollars pour la grippe saisonnière... D’où ce billet que j’ai écrit pour Le Figaro et que j’ai intitulé « Pour vous faire vacciner simplement, partez à Chicago ». En cas d’épidémie, de telles solutions pragmatiques pourraient être proposées.
M. Gérard Amsellem (Pratis TV). Monsieur le rapporteur, la « task force », c’est le corps sanitaire français ! Or nos 100 000 médecins et 20 000 pharmaciens, pourtant aux avant-postes du bouclier sanitaire, ont été laissés à l’écart.
M. Paul Benkimoun (Le Monde). Je n’imagine pas que la « task force » puisse être constituée uniquement par le corps médical. En effet, les conséquences d’une pandémie ne sont pas seulement sanitaires ; il n’est pas anormal que d’autres ministères que celui de la santé aient été mobilisés.
Ensuite, je partage les propos de M. Jérôme Vincent sur la nécessité d’une « force de réflexion rapide ». Si, pour le Gouvernement, la « boîte à outils » constituée par le plan suffisait à fournir les éléments de réponse, les événements ont rappelé qu’il faut plier non pas les réalités aux plans, mais les dispositifs à la réalité. Nous devons pouvoir disposer de structures, composées de ce que les épidémiologistes anglo-saxons appellent des « zèbres » – des « moutons à cinq pattes » – capables de mener des réflexions « hors des clous ».
Pour fonctionner convenablement, une telle « task force » devrait être indépendante des instances décisionnelles et gestionnaires. Sinon nous verrons resurgir le débat sur les experts et les conflits d’intérêt.
M. Gérard Amsellem (Pratis TV). Il faut distinguer « think tank », c’est-à-dire structure de réflexion, et « task force », cette dernière étant une force opérationnelle d’intervention logistique. La France disposait de moyens pour obtenir de meilleurs résultats en termes d’adhésion et de vaccination.
M. Guy Lefrand. Au regard de l’expérience, traiteriez-vous aujourd’hui l’information de façon identique ? Sinon, comment procéderiez-vous ?
M. Gérard Amsellem (Pratis TV). Je crois avoir déjà répondu. Nous n’avons probablement pas suffisamment mis l’accent sur l’absence de transparence dans la prise des décisions, en particulier de celles portant sur le nombre de personnes à vacciner, en juin, et sur l’organisation de la logistique.
M. Éric Favereau (Libération). Mon travail n’est pas celui d’un agent de santé publique. Le rôle de la presse, c’est la description, la critique, mais pas la palliation d’un quelconque manque d’information.
Cela dit, je suis tout à fait surpris par le manque d’indépendance des structures sanitaires. Nous savons par expérience que les directeurs d’agence ne communiquent qu’après acceptation du directeur du cabinet du ministre. De même, le directeur général de la santé n’accorde pas d’entretien sans l’aval de ce cabinet, lequel relit également ses propos. Nous sommes bien loin de l’indépendance mise en avant pour la création des agences, et ce alors même que la société est prête à débattre de santé publique, notamment à travers la presse.
Enfin, la centralisation de la communication, prévue par le plan de lutte contre la pandémie, me paraît d’une efficacité douteuse. Personne n’avait souhaité le résultat auquel sa mise en œuvre a abouti.
M. Jean-Daniel Flaysakier (France 2). Monsieur le rapporteur, le patron du Centre de prévention et de contrôle des maladies n’a pas de comptes à rendre aux autorités américaines. Inversement, parce qu’elles sont à peu près toutes sous tutelle, les agences françaises ne méritent pas pleinement leur nom.
Monsieur le président, pourquoi aucun représentant de la presse quotidienne régionale n’a-t-il été convié ? L’information de proximité que fournit celle-ci est pourtant essentielle dans ce type de situation.
M. le président Jean-Christophe Lagarde. Pour une commission d’enquête, c’est déjà une initiative originale que d’auditionner la presse. Comme vous pouvez le constater, malgré l’absence également des radios et de l’Agence France-Presse, le débat a duré près de trois heures et, grâce à la diversité des journaux que vous représentez, des éléments très utiles sont apparus.
Ainsi, alors que l’information fournie au grand public aurait demandé à être validée par les professionnels, ceux-ci ne disposaient pas forcément eux-mêmes de l’information nécessaire à leur mission de conseil.
De même, nous poserons au directeur général de la santé, que nous allons entendre de nouveau, plusieurs des questions que vous avez soulevées.
Il a également été intéressant de comprendre comment l’information émise par le service d’information du Gouvernement, dirigée par M. Thierry Saussez, a été reçue et traitée par ses destinataires.
M. Jean-Daniel Flaysakier, vous avez fait remarquer aussi que l’information délivrée n’était pas forcément celle qui serait entendue.
M. Jean-Daniel Flaysakier (France 2). Ce n’est pas précisément ce que j’ai dit. Ma remarque valait pour la télévision. En effet, alors que la presse écrite est lue à tête reposée, à la télévision le message n’est pas forcément reçu si les téléspectateurs n’écoutent que d’une oreille distraite.
M. le président Jean-Christophe Lagarde. Enfin, monsieur Éric Favereau, même si la presse n’est pas un acteur de santé publique, et ne saurait jouer un rôle d’agence de communication gouvernementale, elle reste un maillon de l’information que le Gouvernement ne doit pas négliger.
Je vous remercie de votre participation. Bien des éléments dont vous nous avez fait part seront utiles à nos travaux.
La séance est levée à douze heures trente.
Audition de Mme Viviane Defrance,
secrétaire générale adjointe
du Syndicat des infirmières conseillères de santé (SNICS-FSU)
(Procès-verbal de la séance du mardi 1er juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt.
(Mme Viviane Defrance prête serment.)
M. le président Jean-Christophe Lagarde. Madame, le syndicat que vous représentez a souhaité être entendu par notre commission d’enquête. Nous comprenons votre demande et l’avons donc acceptée. Elle nous donne l’occasion d’aborder la question de l’organisation de la vaccination dans les établissements scolaires.
Mme Viviane Defrance, secrétaire générale adjointe du Syndicat des infirmières conseillères de santé SNICS-FSU. Les infirmières de l’éducation nationale, que le SNICS représente à 62 %, ont été fortement mises à contribution pour cette campagne de vaccination, aussi bien dans les centres de vaccination que dans les établissements scolaires.
Par leurs missions spécifiques – accueil, soins, écoute, aide, réponse à l’urgence, orientation – les infirmières scolaires participent à la réussite scolaire des élèves. Elles sont identifiées par la communauté éducative comme des référents santé de premier recours. Tout au long de cette campagne, leur souci permanent a donc été de concilier les responsabilités inhérentes à leur profession avec cette mission supplémentaire de vaccination.
La menace de pandémie de grippe A(H1N1) a eu des effets positifs sur le respect des règles et les équipements d’hygiène dans les établissements scolaires. Nous déplorons cependant un certain nombre de dysfonctionnements.
Tout d’abord, les infirmières scolaires n’ont pas été associées, notamment par leur ministère de tutelle, à la réflexion sur la mise en œuvre de cette campagne, alors qu’elles étaient particulièrement concernées.
S’agissant de leurs missions spécifiques, nous déplorons que la priorité à donner au maintien de l’offre de soins n’ait pas été respectée. L’utilisation abusive par les préfets du temps de travail des infirmières de l’éducation nationale a eu pour conséquence la fermeture de ces lieux d’accueil et de confidentialité que sont les infirmeries scolaires, où l’on enregistre chaque année 14 millions de consultations. Mme Marie Choquet, de l’Institut national de la santé et de la recherche médicale, note dans son rapport que les infirmières scolaires sont, après les médecins traitants, le personnel de santé le plus consulté par les adolescents.
En outre, toutes les actions de prévention programmées en fonction des besoins recensés ont dû être annulées, alors qu’elles contribuent à aider les élèves à adopter un comportement autonome et responsable.
D’une manière générale, nous avons déploré l’absence d’anticipation, faute de constitution d’un corps de réserve sanitaire, pourtant rendu obligatoire par la loi du 5 mars 2007 relative à la préparation du système de santé à des menaces sanitaires de grande ampleur.
L’éducation nationale a confié la gestion de cette campagne aux infirmières et aux médecins conseillers techniques des inspecteurs d’académie. Cette organisation a été mise en place sans concertation avec les chefs d’établissement, qui sont pourtant les supérieurs hiérarchiques directs des infirmières et qui ont dû pallier leur absence au pied levé.
Au cours de cette période, notre syndicat a été assailli d’appels téléphoniques de collègues totalement désemparées d’apprendre leur réquisition. Le principe initial de volontariat, pourtant inscrit dans les circulaires interministérielles, n’a pas été respecté : dans de nombreux départements, l’infirmier conseiller technique de l’inspecteur d’académie a fourni au préfet la liste complète des infirmiers de l’éducation nationale du département à la place de la liste de volontaires.
Par ailleurs, alors qu’elles n’étaient qu’en sixième position dans l’ordre des réquisitions, les infirmières de l’éducation nationale ont souvent été réquisitionnées prioritairement pour vacciner dans les centres de vaccination, alors que des infirmières retraitées qui s’étaient portées volontaires nous ont dit ne jamais avoir été sollicitées.
Les arrêtés de réquisition n’étaient pas réguliers. En effet, la plupart ne mentionnaient pas précisément le lieu, ni les horaires, ni les jours de réquisition, pas plus que les tâches à accomplir. Dans certains centres de vaccination, la liste des infirmières réquisitionnées était affichée avec leur adresse personnelle. Des infirmières et médecins conseillers techniques des inspecteurs d’académie annonçaient par téléphone ou par courriel que telle infirmière devait quitter son lieu de travail pour se rendre le lendemain dans tel centre de vaccination.
Les circulaires précisaient que dans les établissements du second degré, les infirmières étaient appelées à participer à la vaccination des élèves dans leur établissement d’affectation. Quant aux élèves du premier degré, ils devaient, accompagnés de leurs parents, se rendre dans les centres de vaccination. Cela nous a paru logique et cohérent, mais des disparités et des dysfonctionnements ont été constatés. Ainsi dans certains départements, des infirmières scolaires ont dû fermer leur infirmerie pour aller vacciner des élèves d’établissements privés dont l’infirmière était présente et continuait à remplir ses missions. Dans d’autres départements, des infirmières scolaires se sont insurgées contre la demande de l’inspection académique d’établir pour la direction départementale des affaires sanitaires et sociales un tableau de signalement nominatif des élèves atteints de symptômes grippaux, au mépris des règles de secret professionnel inscrites à l’article R. 4312-5 du code de la santé publique.
L’équipe de vaccination était souvent composée d’un médecin scolaire, de deux infirmières scolaires, de deux agents administratifs, quelquefois d’un pompier, le chef d’établissement devenant « chef de centre ».
Cette campagne a eu un coût très élevé pour les établissements scolaires
– information par courrier de tous les parents, mise à disposition et préparation des locaux, mobilisation de personnels – au regard du peu d’élèves volontaires pour la vaccination. Un exemple : dans un lycée, elle a représenté 5 000 photocopies, 850 enveloppes, 500 timbres et la mobilisation de deux infirmières, d’un médecin et de deux agents administratifs pendant deux jours, tout cela pour sept vaccinations.
Enfin, les personnels de l’éducation nationale n’ont pas pu se faire vacciner en même temps que les élèves. Ils ont été invités à le faire dans certains établissements scolaires de leur département à partir du mois de janvier.
En tant que professionnels de santé, nous avons signalé plusieurs problèmes : celui des aiguilles serties, le risque de non-respect de la chaîne du froid – certains vaccins ont été transportés dans une glacière de camping, dans une voiture particulière – et celui du lieu d’installation de certains centres de vaccination, parfois dépourvus de point d’eau. Des infirmières nous ont dit avoir été choquées de voir dans les centres de vaccination des personnes présentant des pathologies lourdes, par exemple des malades qui venaient de subir une chimiothérapie et qui n’avaient pu se faire vacciner à l’hôpital.
Pour éviter que ces dysfonctionnements ne se reproduisent, le SNICS souhaite la constitution d’un réel corps de réserve sanitaire ; il souhaite également une réflexion en amont sur la mise en œuvre d’une telle campagne, associant l’ensemble des professionnels par l’intermédiaire de leurs représentants ; il demande enfin que l’offre de soins et les missions des infirmières de l’éducation nationale et de l’enseignement supérieur soient respectées. Si des réquisitions complémentaires sont nécessaires après l’affectation des volontaires du corps de réserve, il préconise une « proratisation » en fonction du nombre de professionnels de santé dans les différents lieux d’exercice de la profession infirmière. Je rappelle que les 8 000 infirmières scolaires que compte notre pays représentent 5 % des infirmières fonctionnaires et 3 % du total des infirmières en activité.
Mme Catherine Lemorton. Le fait que des infirmières des collèges et des lycées aient été réquisitionnées veut-il bien dire que des élèves souhaitant se présenter à l’infirmerie pour une demande importante, par exemple une contraception d’urgence, ne trouvaient personne pour y répondre ?
Mme Viviane Defrance. Je le confirme.
M. le président Jean-Christophe Lagarde. Les infirmeries étaient-elles fermées plusieurs jours d’affilée ?
Mme Viviane Defrance. La situation était différente selon les départements, mais c’est arrivé, et parfois pendant plusieurs semaines.
Mme Catherine Lemorton. Connaissez-vous le pourcentage des élèves qui ont été vaccinés au sein des collèges et dans les lycées ? Quelle a été votre attitude face aux élèves de plus de seize ans qui, bien que leurs parents aient souhaité leur vaccination, ont refusé de s’y soumettre ?
Mme Viviane Defrance. Le pourcentage des élèves vaccinés avoisine 10 %, collèges et lycées confondus.
Quant aux élèves qui refusaient de se faire vacciner en dépit de la volonté de leurs parents – qui d’ailleurs parfois n’étaient pas d’accord entre eux –, nous avons toujours respecté leur choix, tout en parlant avec eux.
M. le président Jean-Christophe Lagarde. Les infirmières qui ont poursuivi leur activité au sein de leur établissement ont-elles été interrogées par les élèves sur la vaccination ?
Mme Viviane Defrance. Bien sûr.
M. le président Jean-Christophe Lagarde. Étaient-elles bien informées ?
Mme Viviane Defrance. Là encore, cela dépend des départements. Il y a eu une formation et des circulaires, mais comme les informations commençaient par transiter par l’administration, les infirmières ont dû souvent se documenter par elles-mêmes. Il fallait qu’elles puissent savoir si tel élève souffrant présentait ou non des symptômes grippaux – en particulier en zone rurale, où elles sont les premières sollicitées du fait du faible nombre de médecins.
M. Jean-Pierre Door, rapporteur. Si certaines de vos critiques sont justifiées, d’autres me paraissent l’être moins. J’aimerais donc savoir à quel moment vous les avez formulées. Je veux parler tout d’abord de vos interrogations sur les effets secondaires du vaccin – car sur ce sujet, nous avons eu très vite les réponses.
Par ailleurs, dans un communiqué de presse de votre syndicat, j’ai lu que de nombreux personnels infirmiers, considérant que cette vaccination était injustifiée, ne se sont pas fait vacciner. Savez-vous combien d’infirmières ont été dans ce cas ? Enfin, toujours dans le même document, vous dites que les élèves « ne font pas partie de la population à risque » : En êtes-vous sûre ?
Sur vos critiques qui semblent justifiées, j’aimerais avoir quelques précisions.
Ainsi, vous regrettez de ne pas avoir été suffisamment associées par le ministère de tutelle. Mais qui a contacté les infirmières scolaires et leur a donné des directives, et à quelle date ? Des indemnisations ont-elles été prévues pour celles qui sont sorties du cadre scolaire pour travailler dans un centre de vaccination ou qui ont augmenté leur temps de travail ?
Quant au corps de réserve sanitaire, les décrets d’application de la loi du 5 mars 2007 – qui a institué l’Établissement de préparation et de réponse aux urgences sanitaires – en précisent la composition : les infirmières scolaires en font partie.
Mme Viviane Defrance. Le SNICS ne s’est jamais prononcé contre la vaccination, bien au contraire.
M. le rapporteur. Votre communiqué de presse dit pourtant ceci : « De très nombreux infirmiers partagent les réserves émises par une grande partie des autres professionnels de santé concernant l’intérêt de cette vaccination et refusent de se faire vacciner ».
Mme Viviane Defrance. Je ne sais pas de quel document il s’agit. Peut-être avons-nous mal communiqué, mais nous n’avons jamais émis la moindre objection à la vaccination, et de toute façon nous n’étions pas habilitées, en tant de fonctionnaires, à nous opposer à des décisions prises au niveau national. Nous avons eu quelques interrogations au début de la campagne, dues au manque d’information, mais nous n’avons jamais incité les élèves à ne pas se faire vacciner.
M. le rapporteur. Certes. Néanmoins je lis aussi dans ce communiqué de presse : « La campagne de vaccination contre la grippe A ne doit pas être organisée au détriment de l’offre de soins en faveur des élèves ».
Mme Viviane Defrance. Nous le pensions en effet.
M. le rapporteur. Vous ajoutiez : « Les effets secondaires du vaccin ne sont pas connus à ce jour ». Et ensuite, comme je le disais : « De très nombreux infirmiers partagent les réserves émises par une grande partie des autres professionnels de santé concernant l’intérêt de cette vaccination et refusent de se faire vacciner ». Enfin, vous évoquiez les élèves « qui ne font pas partie de la population à risque ».
Mme Viviane Defrance. Ce document, dont je n’ai pas souvenir, doit dater du tout début de la campagne. La position du SNICS a beaucoup évolué depuis.
M. le rapporteur. Mais dire cela au début, c’est un déni du risque car à l’époque, nous ne savions pas précisément à quel virus nous avions affaire. La stratégie de vaccination de masse a été définie à la fin du printemps, et ce n’est qu’au mois d’août que nous avons su qu’il était bénin…
Mme Catherine Lemorton. Nous l’avons su très rapidement.
M. le rapporteur. Personne ne savait si le virus n’allait pas muter.
M. le président Jean-Christophe Lagarde. Il est paradoxal d’émettre un doute sur l’intérêt d’une vaccination alors que nous ne connaissions pas la virulence du virus. Remettre en question l’utilité du vaccin aurait été plus compréhensible en décembre qu’en septembre, avant le lancement de la campagne de vaccination. Ce qui me choque le plus, à titre personnel, c’est qu’un syndicat écrive ceci : « Comment envisager de vacciner des élèves qui ne font pas partie de la population à risque quand on a choisi de ne pas se faire vacciner soi-même ? ». Une personne qui choisit de ne pas utiliser pour elle-même de pilule abortive devrait-elle donc refuser d’en délivrer à une élève ? Cela me paraît très choquant.
M. Jean-Pierre Dufau. Monsieur le président, notre commission d’enquête a-t-elle pour sujet la mise en œuvre de la vaccination ou l’attitude des infirmières ?
M. le président Jean-Christophe Lagarde. Il est très intéressant de connaître, d’une part, la position des infirmières scolaires sur la manière dont l’État a géré la campagne de vaccination et, d’autre part, la façon dont elles-mêmes ont reçu et répercuté les informations.
M. Jean-Pierre Dufau. Dans notre pays, chacun est libre d’avoir une opinion. Ce n’est pas parce qu’une personne a fait un choix personnel qu’elle n’est pas disposée à appliquer des directives. Vos assimilations sont excessives, monsieur le président. Ce raisonnement par analogie ne me convient pas, et je tiens à ce que cela figure au procès-verbal.
M. le président Jean-Christophe Lagarde. Oui, bien entendu, chacun est libre de son opinion ; mais celle que formule un syndicat ne doit pas être une opinion personnelle. Qu’une personne représentant un syndicat décide de ne pas vacciner quelqu’un sous prétexte qu’elle a choisi pour elle-même de ne pas se faire vacciner me pose problème. Je sais votre sensibilité, monsieur Jean-Pierre Dufau, car vous aviez suggéré cette audition, mais nous avons posé le même type de questions aux syndicats du corps médical.
M. Jean-Pierre Dufau. Disposons-nous d’éléments permettant de dire que certains professionnels ont refusé de vacciner ?
M. le président Jean-Christophe Lagarde. Non, mais le document que nous avons cité montre qu’un syndicat s’est interrogé sur l’opportunité, pour un professionnel de santé qui aurait choisi de ne pas se faire vacciner, de vacciner des élèves.
Mme Viviane Defrance. Les infirmières que nous sommes exécutent les ordres qu’elles reçoivent, mais elles le font en se posant des questions. Nous n’avons jamais influencé les élèves en leur faisant part de notre opinion ; néanmoins nous nous sentions responsables – même si nous savions qu’en cas de problème, l’État serait seul responsable dès lors que nous n’aurions commis aucune faute professionnelle.
M. le président Jean-Christophe Lagarde. Je ne conteste aucunement cette attitude. Ce qui me pose problème, c’est le mélange entre le choix personnel et l’exercice professionnel.
M. le rapporteur. Monsieur Jean-Pierre Dufau, nous avons posé les mêmes questions aux représentants de toutes les professions médicales…
S’agissant de la position de votre syndicat, madame, j’ai parlé d’observations peu justifiées à mes yeux, notamment sur le risque d’effets secondaires du vaccin – je vous demandais d’ailleurs à quelle date cette crainte avait été formulée –, sur l’intérêt de la vaccination – je souhaiterais savoir maintenant quel est le pourcentage d’infirmiers qui ont refusé de se faire vacciner –, enfin sur le fait que des élèves ne feraient pas partie de la population à risque, alors que l’on a toujours dit que les jeunes en faisaient partie.
Je découvre que la date du communiqué de presse que j’ai sous les yeux est le 23 octobre 2009 : nous étions donc au début de la campagne de vaccination, même si nous savions que la virulence du virus était moindre que prévu initialement. J’aimerais cependant savoir si ce texte exprime un point de vue personnel ou collectif.
Quant à celles de vos observations qui me paraissent justifiées, elles concernent tout d’abord l’organisation. Par qui avez-vous été prévenues ? Comment les choses ont-elles été organisées ? Des indemnisations ont-elles été prévues ?
Mme Viviane Defrance. Nous avons d’abord été informées par la presse. Puis nous avons demandé à être reçues dans les ministères, qui nous ont apporté un commencement de réponse. Ensuite, les informations sont arrivées chez les chefs d’établissement, soit directement du ministère, soit en provenance des rectorats et des inspections académiques, ou encore des préfectures et de l’Institut national de prévention et d’éducation pour la santé (INPES). En tant que conseillères techniques, nous avons aidé les chefs d’établissement à clarifier cette masse d’informations reçues, afin de pouvoir les répercuter sur les élèves.
M. le président Jean-Christophe Lagarde. Cela signifie-t-il qu’il n’y a pas eu, de la part de l’Éducation nationale, d’information ciblée en direction des infirmières scolaires ?
Mme Viviane Defrance. Il y a eu des circulaires générales sur le rôle des professionnels de santé. Un certain nombre de rectorats ont réuni des comités d’hygiène et de sécurité, mais très tardivement. Au départ, nous étions dans le flou.
M. le président Jean-Christophe Lagarde. Vous avez dit tout à l’heure que vous étiez bien informées, mais en réalité on ne vous a pas informées…
Mme Viviane Defrance. Pas au départ. Nous sommes allées à la pêche aux informations. Nous avons demandé des audiences et écrit à plusieurs reprises aux ministres, pour demander des renseignements ainsi que le matériel de protection.
M. le président Jean-Christophe Lagarde. Ce matériel vous a-t-il manqué ?
Mme Viviane Defrance. Au départ, les masques étaient stockés dans les rectorats. Ensuite ils devaient transiter par les inspections académiques. Rien n’était simple.
M. Jean-Pierre Dufau. Je voudrais insister sur un point. Des médecins et des infirmiers, comme beaucoup de Français, ont pu être contre la vaccination à titre personnel ; pour autant, il ne faut pas en tirer des conclusions sur le comportement du corps médical. Le choix que l’on fait pour soi et pour sa famille et les doutes que l’on peut avoir sur l’efficacité de la vaccination n’empêchent pas d’obéir aux consignes.
Madame, pourriez-vous préciser ce que vous disiez tout à l’heure sur le problème de la réquisition et du volontariat, ainsi que sur la diversité de situation entre les départements ?
M. le président Jean-Christophe Lagarde. Monsieur Jean-Pierre Dufau, il est évident qu’un professionnel de santé peut faire un choix personnel tout en respectant sa mission de santé publique, mais ce n’est pas ce qui est écrit dans le communiqué de presse que nous évoquons. Je m’étonne qu’un syndicat écrive : « Comment envisager de vacciner des élèves qui ne font pas partie de la population à risque quand on a choisi de ne pas se faire vacciner soi-même ? Il est incontestable que la mise à disposition autoritaire des professionnels de santé de l’éducation nationale pour vacciner soulève des problèmes d’éthique inédits ». Mais tel n’est pas l’objet principal de cette audition…
Mme Viviane Defrance. Les premières circulaires étaient claires : dans un premier temps, la participation aux opérations de vaccination devait se faire sur la base du volontariat. Il nous a paru très logique de demander aux infirmières des établissements secondaires d’être disponibles pour vacciner les élèves de leur établissement d’affectation. En ce qui concerne les élèves du primaire, il nous a également paru très logique que les parents puissent accompagner leur jeune enfant dans un centre de vaccination.
Mais – je ne sais si c’est par souci de simplification – dans certains départements, la liste des infirmières scolaires ayant été communiquée, des collègues ont été réquisitionnées pour aller vacciner dans les centres.
M. le président Jean-Christophe Lagarde. Leur a-t-on demandé si elles étaient volontaires ?
Mme Viviane Defrance. Dans les départements dont je parle, elles ont été réquisitionnées de façon arbitraire par le préfet.
M. le président Jean-Christophe Lagarde. Est-ce à dire que l’administration de l’Éducation nationale, à aucun de ses échelons jusqu’au chef d’établissement, n’avait interrogé les 8 000 infirmières scolaires pour savoir si elles étaient volontaires ?
Mme Viviane Defrance. Pas dans ces départements. La situation était très hétérogène.
M. le président Jean-Christophe Lagarde. Vraisemblablement, donc, le ministère n’a pas adressé de circulaire aux rectorats pour leur demander d’interroger toutes les infirmières scolaires.
Mme Viviane Defrance. Les circulaires ministérielles étaient claires, mais leur application par les inspections académiques a laissé à désirer.
M. le président Jean-Christophe Lagarde. Avez-vous une idée du nombre d’infirmières scolaires qui ont été réquisitionnées ?
Mme Viviane Defrance. La situation est très variable selon les départements. Rares sont ceux où elles n’ont pas été sollicitées hors de leur établissement d’affectation. Il en est un certain nombre où elles l’ont toutes été. On leur demandait de se tenir à la disposition du préfet pendant une période donnée, qui s’étalait sur plusieurs mois.
M. le président Jean-Christophe Lagarde. Dans les départements où on leur a demandé si elles étaient volontaires, a-t-on tenu compte de leur réponse ? Autrement dit, a-t-on réquisitionné des infirmières qui n’étaient pas volontaires ?
Mme Viviane Defrance. Oui, bien sûr, des non-volontaires on été réquisitionnées. Dans certains départements, cela n’a fait aucune différence d’être volontaire ou de ne pas l’être.
Mme Marie-Louise Fort. Quelles sont les informations que vous avez été obligées d’aller chercher dans la presse ?
Mme Viviane Defrance. Nous n’avons pas reçu d’information spécifique en tant que professionnelles de santé, et cela nous a manqué.
Mme Marie-Louise Fort. Généralement, le chef d’établissement reçoit la documentation et la communique aux personnels concernés.
Mme Viviane Defrance. Là encore, la situation a été inégale. Les circulaires parlaient de formation spécifique, et dans de nombreux départements les urgentistes sont venus nous expliquer, notamment, que la population jeune était à risque ; mais cela ne s’est pas fait partout.
Mme Marie-Louise Fort. Je suis quand même rassurée de savoir que vous avez eu d’autres moyens d’information que la presse…
Mme Viviane Defrance. Oui, mais encore une fois, l’information a été trop tardive, et très inégale sur l’ensemble du territoire.
Mme Marie-Louise Fort. La documentation fournie à l’ensemble des établissements scolaires était néanmoins copieuse.
M. le rapporteur. Les médecins scolaires ont-ils contribué à votre information ?
Mme Viviane Defrance. Ils ont eu la même formation que nous auprès des médecins urgentistes.
M. Jean-Pierre Dufau. À l’avenir, ne serait-il pas de bon sens qu’au moins dans un premier temps – en tout cas dans le second degré et dans l’enseignement supérieur, la vaccination des enfants du premier degré se faisant logiquement avec leur famille –, on demande aux infirmières de l’Éducation nationale d’œuvrer dans leur établissement d’affectation, où se trouvent les élèves – population considérée comme à risque – plutôt qu’ailleurs ? Cela leur permettrait en outre de ne pas déserter les infirmeries.
Mme Viviane Defrance. Tel est bien notre souhait, afin de maintenir l’offre de soins. Il est paradoxal de fermer des infirmeries susceptibles d’accueillir des élèves présentant les symptômes de la grippe…
M. le président Jean-Christophe Lagarde. Les infirmières scolaires sont très peu présentes dans les écoles primaires et maternelles, où leur intervention relève de la prévention, et non des soins d’urgence. Celles qui y travaillent peuvent donc être disponibles pour des opérations de vaccination. Quant aux infirmières des collèges et lycées, j’aimerais savoir si leur travail se répartit entre plusieurs établissements.
Mme Viviane Defrance. Une infirmière est affectée à temps plein au lycée ; au collège, normalement, elle est sur un poste mixte, couvrant également le secteur primaire de recrutement – ce qui est cohérent, la même infirmière restant ainsi le référent santé de l’élève pendant toute cette partie de sa scolarité. Mais dans la réalité, même si nous avons bénéficié de créations de poste, il n’y a pas une infirmière dans chaque collège.
M. le président Jean-Christophe Lagarde. Combien d’heures par semaine une infirmière passe-t-elle dans son collège ?
Mme Viviane Defrance. Normalement, elle devrait y passer entre 50 et 70 % de son temps.
M. le président Jean-Christophe Lagarde. Il nous faut essayer de tirer les leçons de ce qui s’est passé.
D’une part, avec un corps de 8 000 infirmières scolaires, la vaccination des élèves et des enseignants in situ ne devrait pas poser de problème. Cela n’a pas été le cas cette fois-ci ; on se demande pourquoi, alors que les professionnels de santé, et même leurs familles, ont pu se faire vacciner dans les hôpitaux, les enseignants n’ont pas pu être vaccinés avant le mois de janvier…
Mme Viviane Defrance. Le problème était le même pour les infirmières scolaires !
M. le président Jean-Christophe Lagarde. D’autre part, il faudrait que, si l’on constate que le nombre des vaccinations au sein de l’établissement scolaire est très limité, il soit possible d’envoyer l’infirmière certains jours dans un centre de vaccination. Cela me paraît être la meilleure utilisation possible des ressources humaines.
Mme Viviane Defrance. Le fait d’utiliser les infirmières de l’Éducation nationale plutôt que les réservistes volontaires est un déni de leurs missions.
M. le président Jean-Christophe Lagarde. C’est un autre sujet. Il reste que je ne conçois pas de laisser les infirmières dans leur établissement pour vacciner sept élèves et exercer leur rôle de conseil habituel – et utile – s’il faut faire face à une urgence sanitaire. Je suis favorable à une gradation dans l’urgence : si cela s’avère nécessaire, les infirmières doivent sortir des établissements scolaires.
Mme Viviane Defrance. Cela signifie qu’à vos yeux, nos missions sont secondaires…
M. le président Jean-Christophe Lagarde. Pas du tout, mais elles le deviennent face à une pandémie mortelle. De la même façon, on a sorti des centaines d’internes des services hospitaliers, où on sait à quel point ils sont indispensables.
Mme Catherine Lemorton. Je ne partage pas votre raisonnement, monsieur le président. Dans un collège de 1 600 élèves, c’est tous les jours que l’infirmière est confrontée à des urgences – demande de contraception d’urgence, actes de violence, tentative de viol… Moi qui suis parent d’élève, je ne pense pas que beaucoup d’infirmières puissent se permettre de sortir de leur établissement.
Par ailleurs, si les infirmières ont exprimé des craintes au sujet des effets indésirables du vaccin, c’est peut-être en raison du traumatisme causé par les vaccinations massives contre l’hépatite B, dans les années 1994 à 1997, qui avaient entraîné beaucoup de troubles neuromusculaires.
Mme Viviane Defrance. En effet, et nous y avons fait allusion lorsque nous avons été reçues au ministère de la santé. Nous n’avons pas été les seules à nous poser des questions. Mais nous ne nous sommes jamais permis de peser sur le libre arbitre de chacun.
M. le rapporteur. Les infirmières scolaires, volontaires ou non, qui ont rejoint les centres de vaccination ont-elles été indemnisées ?
Mme Viviane Defrance. Les indemnisations transitent par les rectorats et commencent seulement à être versées. C’est assez long à venir.
M. le président Jean-Christophe Lagarde. Malheureusement, c’est un problème habituel dans l’Éducation nationale. Les surveillants recrutés en septembre ne sont généralement pas payés avant le mois de janvier…
Madame Catherine Lemorton, je n’ai pas dit que les infirmières n’avaient rien à faire. Mais pour avoir eu la chance de travailler au sein de l’Éducation nationale, je peux vous assurer que dans un établissement de 1 600 élèves, il n’y a pas une urgence par jour.
Merci, madame la secrétaire générale adjointe, d’avoir répondu à notre convocation.
La séance est levée à dix-sept heures vingt.
Audition de M. Jacques Fontan,
responsable du centre de vaccination de Capbreton
(Procès-verbal de la séance du mercredi 2 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
(La séance est ouverte à seize heures vingt.)
M. le président Jean-Christophe Lagarde. Nous accueillons, sur la suggestion de M. Jean-Pierre Dufau, membre de la commission, le docteur Jacques Fontan, responsable du centre de vaccination de la ville de Capbreton, dont notre collègue est le maire.
(Le docteur Jacques Fontan prête serment.)
M. Jacques Fontan, responsable du centre de vaccination de Capbreton. Médecin retraité, spécialiste de santé publique et de médecine tropicale, j’ai commencé ma carrière dans le service de santé de la marine. En tant que directeur du centre d’incorporation nationale de la Marine de Hourtin, j’y ai acquis une expérience de vaccination massive, puisque nous pratiquions 3 000 vaccinations par mois. J’ai ensuite rejoint l’équipe de l’Institut de médecine tropicale de Bordeaux 2 où j’ai piloté le diplôme de gestion de soins en milieu tropical.
En juin 2009, quand la direction départementale des affaires sanitaires et sociales des Landes a fait appel à des médecins retraités volontaires pour participer à la campagne de vaccination, je me suis inscrit et j’ai été désigné comme responsable du centre de vaccination de Capbreton. N’ayant aucune compétence technique ou scientifique particulière, c’est un témoignage de terrain que je vous livrerai.
Dans la nomenclature officielle du ministère, le centre de Capbreton apparaissait comme un centre standard à fonctionnement renforcé : ouvert au public sur trois périodes de quatre heures, il fonctionnait sans interruption de huit heures à vingt heures.
Le centre desservait 24 communes pour un bassin de population d’à peu près 60 000 habitants, parmi lesquels on compte 85 médecins généralistes. Le nombre de personnes vaccinées pendant cette période a été de 9 260, ce qui correspond à environ 15 % de la population desservie.
Le local sélectionné par la préfecture se révélant trop petit, nous avons dû déménager en cours de campagne vaccinale dans un nouveau local beaucoup plus grand trouvé par la mairie. Ce déménagement nous a un peu gênés.
Pour chaque vacation, le médecin responsable du centre et l’infirmière coordonnatrice étaient présents en permanence. Deux médecins, cinq infirmières et quatre personnes faisaient partie de l’administration.
Les médecins étaient au nombre de quinze, dont treize retraités, et les infirmiers, au nombre de trente et un, dont cinq retraités, trois infirmiers en disponibilité et vingt-trois infirmiers actifs.
Le personnel administratif comptait douze personnes, dont quatre demandeurs d’emploi.
Je tiens d’emblée à souligner le rôle fondamental joué par la mairie de Capbreton. Elle nous a apporté un appui logistique de tout instant. Sans elle, nous n’aurions pas pu mener à bien notre mission car nous étions très éloignés du chef-lieu du département, Mont-de-Marsan.
Les difficultés que nous avons rencontrées ont été de deux ordres : les unes étaient liées au comportement des patients, les autres aux tâches administratives du centre.
Les premières étaient dues à trois sentiments éprouvés par la population : la suspicion, le désarroi et l’incompréhension.
La lenteur du démarrage de la campagne est à mettre au compte de la suspicion : pendant les trois premiers jours, seules quatre-vingts personnes sont venues se faire vacciner, contre cinq cent vingt la deuxième semaine. La suspicion éprouvée par la population me paraît due à deux facteurs : d’une part, le faible engagement des médecins généralistes locaux au début de la campagne – quand ceux-ci sont venus se faire vacciner, la deuxième semaine, la campagne a vraiment démarré, puisque la courbe de fréquentation est passée de 1 400 à 2 000 personnes par semaine – ; d’autre part, le matraquage médiatique qui véhiculait des messages contradictoires ou paradoxaux : chaque jour, le nombre de morts dus à la grippe A(H1N1) était répété du matin au soir alors qu’il était inférieur à celui de la grippe saisonnière et on n’arrêtait pas d’insister sur le fait que les sujets jeunes couraient plus de risques que les sujets âgés.
Le second sentiment éprouvé par la population était le désarroi. Les débats télévisés où s’affrontaient les experts, aux avis contradictoires, et les informations diffusées sur internet sur la dangerosité des adjuvants – squalène, thiomersal – y ont fortement contribué mais la communication du ministère, annonçant la distribution de deux types de vaccins, un sans adjuvant réservé aux populations fragiles, et l’autre avec adjuvant pour le reste de la population, est venue encore renforcer les craintes. La majorité des patients nous réclamaient un vaccin non adjuvé, si bien que les médecins du centre ont dû passer beaucoup de temps et faire preuve de beaucoup de pédagogie pour les convaincre de se laisser vacciner selon le protocole prescrit. Ce travail d’explication long et fastidieux a souvent eu des conséquences négatives sur le fonctionnement de la chaîne vaccinale.
Le troisième sentiment éprouvé par la population était l’incompréhension face à certaines incohérences. La réception des bons émis par la Caisse nationale d’assurance maladie des travailleurs salariés (CNAMTS) en fonction des catégories prioritaires a semblé souvent aléatoire : des malades chroniques les avaient reçus tandis que d’autres non ; dans une même famille, certains membres les avaient reçus, mais d’autres les attendaient encore.
Les changements successifs de protocole vaccinal ont également été difficiles à expliquer aux familles. Au début de la campagne, nous avons vacciné les enfants avec deux doses de Pandemrix. Dix ou quinze jours après, nous avons reçu le Panenza et l’avons donc utilisé pour vacciner les enfants. Mais, comme on ne pouvait pas croiser les vaccins, les premiers enfants qui avaient reçu le Pandemrix ont dû recevoir une deuxième injection de ce vaccin, si bien que, dans une même famille, des enfants ont été vaccinés avec du Panenza et d’autres avec du Pandemrix. À partir du 14 décembre, de nouvelles dispositions vaccinales préconisaient l’injection de deux doses de Panenza jusqu’à huit ans et d’une seule dose de Pandemrix à partir de neuf ans. Tout cela était difficile à comprendre par les familles.
Autre difficulté rencontrée, le poids des tâches administratives, à commencer par l’édition des indispensables bons de vaccination. Le déficit de fréquentation du centre dans les premiers jours de la campagne nous a conduits à proposer une vaccination pour tous, avec ou sans bon. Cette option, posée dès le début, a été appliquée pendant toute la campagne bien qu’elle ne correspondît pas aux annonces des spots télévisés et aux instructions ministérielles qui recommandaient l’ajournement de la vaccination des personnes non prioritaires. Notre choix a rapidement produit ses effets mais nous a contraints à un travail long et pénible : la saisie informatique des bons sur le site ameli.fr (assurance maladie en ligne) de la CNAMTS était complexe. L’édition de ces bons de vaccination a demandé un travail de vérification très rigoureux de la part du secrétariat, et a été une source d’engorgement dans le centre.
Une autre tâche qui nous a incombé, alors qu’elle n’était pas prévue au départ, a été la délivrance de vaccins à des structures extérieures. Nous avons fourni des vaccins aux équipes de l’Éducation nationale et aux établissements d’hébergement de personnes âgées dépendantes. Comme nous nous sommes rapidement rendu compte que ces dernières structures étaient inaptes à assurer des vaccinations fiables, nous avons envoyé des équipes pour procéder à celles-ci. Ces vaccinations nous ont également demandé un gros travail sur le plan administratif puisqu’il fallait vérifier la comptabilité des vaccins et assurer la traçabilité.
Les formalités administratives demandées par l’échelon départemental étaient également contraignantes : compte rendu journalier d’activité, compte rendu de gestion des flacons, statistiques de fréquentation, planning prévisionnel hebdomadaire, fiche de présence quotidienne.
La quantité de documents à fournir pour la rémunération du personnel a été particulièrement lourde. Or, malgré nos efforts pour les envoyer régulièrement, les délais de paiement ont été longs. Le personnel n’a été payé que quatre mois, en moyenne, après le début de la campagne, ce qui a conduit à certaines situations critiques, notamment pour les demandeurs d’emploi.
Je vous ferai part en conclusion du sentiment général de l’équipe vaccinale, que j’ai réunie avant de venir devant vous. Malgré les difficultés dont je viens de parler, malgré le regret de ne pas avoir été associés à la phase de préparation de la vaccination et malgré la déception qu’il n’y ait pas eu de réunion de synthèse, cette expérience a été jugée très positive par l’ensemble de l’équipe : elle a montré qu’un groupe de professionnels inconnus les uns des autres mais motivés pouvait rapidement se structurer et assurer, dans un contexte de crise sanitaire, la mise en place d’une action préventive d’envergure.
M. Jean-Pierre Door, rapporteur. Je vous remercie de cette synthèse remarquable, alliant clarté et précision. Pour avoir, moi aussi, participé à un centre de vaccination, je m’y suis tout à fait retrouvé.
Vous avez un résultat impressionnant. Tous les centres aimeraient pouvoir se targuer d’un taux de vaccination de 15 % de la population qu’ils desservaient.
Voici quelques questions. Quels ont été les locaux prêtés par la mairie ? Comment avez-vous procédé pour l’élimination de vos déchets ? Comment a été vécue par le personnel la fin brutale de la campagne de vaccination ? Qu’avez-vous fait des stocks de vaccins et de matériel qu’il vous restait ? Avez-vous pu établir un tableau comptabilisant le nombre d’enfants, de femmes enceintes et de personnes souffrant d’une affection de longue durée, que vous avez vaccinés ?
M. Jacques Fontan. La question du local est un bon exemple de ce qui aurait pu être réglé si nous avions été associés à la phase de préparation. Je me suis porté volontaire au mois de juin mais n’ai été convoqué à la préfecture des Landes que le 8 novembre, alors que la campagne commençait le 12. Le 8 novembre, je ne connaissais rien. J’ai pris contact avec la mairie de Capbreton, et le directeur général des services municipaux m’a montré le local retenu par le personnel de la préfecture. Ayant un peu l’habitude des vaccinations de masse, j’ai tout de suite vu qu’il ne convenait pas. Comprenant trois petites pièces desservies par un couloir, il était même dangereux en cas d’afflux de personnes. J’ai immédiatement demandé au maire de pouvoir changer de local. Je voulais le faire avant le début de la campagne. Le préfet s’y est opposé. Comme les convocations avaient été envoyées, il m’a demandé de démarrer la vaccination dans le local prévu à cet effet et de changer en cours de campagne si j’avais des difficultés. J’avoue que le déménagement nous a passablement perturbés.
M. le rapporteur. Quels locaux avez-vous obtenus alors ?
M. Jacques Fontan. Nous étions au début dans un centre de camping. Deux pièces, chauffées, servaient de salles d’attente : dans la première, les gens patientaient, dans la seconde, ils remplissaient les documents administratifs. Nous avons eu ensuite une salle immense, que la mairie de Capbreton a structurée de manière remarquable en une journée à l’aide de cloisons en bois. Tout le monde a été agréablement surpris du résultat : une grande salle d’attente avait été aménagée au centre de l’immense salle, autour de laquelle se répartissaient deux bureaux de médecin, un bureau pour le responsable du centre, la salle de vaccination et une salle de repos en cas de besoin. C’était parfaitement fonctionnel.
Notre bon résultat vient de ce que nous n’avons jamais tenu compte des bons de vaccination. Comme je l’ai indiqué, nous les éditions, ce qui nous a demandé un travail énorme. Cela s’est su très vite, si bien que, dès la troisième semaine, nous avons vu arriver des gens du Pays basque. Le centre de vaccination de Bayonne ne proposait que trois après-midi de vaccination par semaine, ce qui créait un engorgement monstre. Capbreton n’est qu’à vingt kilomètres de Bayonne mais la ville est située dans le département des Landes tandis que Bayonne est dans le département des Pyrénées-Atlantiques, ce qui posait des problèmes d’approvisionnement en vaccins.
Lorsque la campagne a pris fin, notre centre recevait toujours beaucoup de monde. L’annonce a été brutale puisque nous avons appris le lundi que le centre devait fermer à la fin de la semaine. Et j’ai personnellement reçu mon bon de vaccination le mardi suivant – et de nombreuses personnes ont été dans le même cas –, c’est-à-dire après la fermeture du centre de vaccination.
En fin de campagne, il nous avait encore été demandé une tâche supplémentaire : distribuer du Focetria aux médecins généralistes. Sur les quatre-vingt-cinq médecins généralistes exerçant dans le bassin de population que nous desservions, quatre se sont déplacés pour venir chercher les vaccins. J’en ai profité pour leur demander leur avis sur la vaccination : ils n’étaient pas ravis car les tâches administratives qui accompagnaient celle-ci représentaient pour eux une charge supplémentaire qu’ils ne se sentaient pas capables d’assumer dans une telle période.
La fin soudaine de la campagne a surpris tout le monde. Au cours de la dernière semaine, il y avait eu quatre vacations au cours desquelles deux cents personnes étaient venues se faire vacciner.
La récupération des vaccins n’a pas posé de problème. Des équipes de la direction départementale des affaires sanitaires et sociales étaient chargées de cette mission. En revanche, il y a eu un gaspillage énorme de matériel médical. Comme cela coûtait trop cher de le reprendre, il nous a été demandé de le distribuer. Nous avons donc pris contact avec des maisons de retraite des environs pour écouler nos stocks de seringues, d’alcool et de coton. Il nous restait énormément de seringues. En cours de campagne, nous avions reçu, sans rien demander, plusieurs cartons de seringues supplémentaires : il nous en restait six, soit 24 000 seringues.
M. le président Jean-Christophe Lagarde. Le matériel n’était pas fourni proportionnellement au nombre de vaccins ?
M. Jacques Fontan. Pas du tout. Les vaccins étaient livrés séparément. Je suppose qu’un prestataire était spécialement chargé de cette livraison pour veiller à la continuité de la chaîne du froid.
Le matériel, quant à lui, arrivait de Mont-de-Marsan, vraisemblablement de l’Établissement de préparation et de réponse aux urgences sanitaires. Nous avons connu avec ce dernier des problèmes d’approvisionnement au début de la campagne. Alors qu’il nous était livré des seringues en quantité, nous manquions d’alcool et de pansements adhésifs, si bien que nous avons été obligés, la troisième semaine, d’acheter des pansements dans une pharmacie de Capbreton. Quant aux seringues, il n’y a pas que leur nombre qui nous posait des problèmes. D’une part, il s’agissait de seringues serties dont les infirmières n’aimaient pas se servir – elles disaient même que leur utilisation était contraire à leur déontologie –, d’autre part, elles présentaient un défaut : le bout de l’aiguille s’émoussait quand on l’enfonçait dans la capsule en caoutchouc du flacon de vaccin, ce qui pouvait rendre la vaccination douloureuse chez les enfants.
M. le président Jean-Christophe Lagarde. Comment la population a-t-elle été informée de l’existence et de l’emplacement de votre centre ?
M. Jacques Fontan. Grâce à des panneaux d’information lumineux implantés par la mairie sur la ville de Capbreton.
M. Jean-Pierre Dufau. Et sur l’ensemble de la communauté de communes.
Vous comprenez, chers collègues, pourquoi j’ai souhaité que la commission entende le témoignage du docteur Jacques Fontan. Son expérience de terrain permet de tirer des enseignements utiles en matière d’organisation et de couverture du territoire.
Son témoignage montre – et je souhaite que cela figure dans le rapport – l’importance du rôle joué par les collectivités territoriales de base que sont les communes et les communautés de communes dans la mise en place d’un plan de vaccination de grande ampleur. On aura beau faire tous les plans qu’on voudra, si les communes et les communautés ne sont pas considérées comme des partenaires à part entière et associées dès le début à la mise en œuvre du plan, on connaîtra beaucoup d’échecs. En revanche, si l’on se sert de cette formidable masse de compétences qu’elles représentent, il sera possible de mener une action efficace.
Voilà une démonstration supplémentaire de l’importance qu’il y a à maintenir des services publics sur l’ensemble du territoire, y compris en milieu rural. Les marées noires et autres catastrophes le montrent aussi.
La réactivité et la capacité d’adaptation des communes et des communautés de communes sont un gage de réussite. Quand, après s’être rendu compte, au début de la campagne, que tout avait été prévu sauf le sparadrap que l’on met après la piqûre, le docteur Jacques Fontan est venu nous en faire part, nous nous sommes tout de suite mobilisés pour acheter le sparadrap manquant.
L’autre point important à souligner est la nécessité, pour les collectivités territoriales, d’avoir des consignes claires, et de les avoir suffisamment tôt. Les indications données pour la recherche d’un local pouvant servir de centre de vaccination faisaient référence, au début, à des bureaux : la place disponible devait correspondre à la surface occupée par trois bureaux. Le flou le plus total régnait. Personnellement, j’ai refusé de réquisitionner des gymnases car je n’admettais pas qu’on prive des enfants de gymnastique et de sport à cause d’une pandémie.
Quand les demandes sont formulées correctement et suffisamment tôt, les collectivités territoriales sont capables de trouver des réponses. Mais l’absence de concertation avant la mise en place de la campagne comme celle de réunion de bilan à la fin de celle-ci ont été mal vécues par les collectivités territoriales et par les personnes qui ont travaillé dans les centres de vaccination.
Enfin, le fait que les demandeurs d’emploi réquisitionnés n’aient pas été indemnisés en temps voulu confine au mépris. La moindre des choses aurait été de leur donner une provision au moment de leur réquisition et de régulariser les comptes en fin de parcours. Les laisser quatre mois sans argent était inadmissible.
M. le rapporteur. La commune a-t-elle été indemnisée pour la mise à disposition de locaux municipaux ?
M. Jean-Pierre Dufau. J’ai envoyé une note de frais mais je ne pense pas qu’elle ait été déjà honorée.
M. le président Jean-Christophe Lagarde. Soyez assuré, monsieur Jean-Pierre Dufau, que votre témoignage figurera dans le rapport. Il prouve au passage la vertu du cumul des mandats…
J’ai une autre suggestion à faire en matière de rémunération. L’État, que l’on sait incapable de payer dans des délais raisonnables, pourrait demander aux communes de rémunérer à sa place les personnels vacataires et rembourser ensuite celles-ci, comme il le fait déjà dans d’autres cas afin de ne pas laisser des demandeurs d’emploi dans des situations difficiles.
Docteur Jacques Fontan, les horaires d’ouverture de votre centre ont-ils été modifiés au cours de la campagne ? Dans ma commune, j’ai constaté des variations ubuesques à la suite d’instructions de la préfecture.
Par ailleurs, la nourriture des personnels présents dans le centre a-t-elle été prévue ou a-t-elle été oubliée comme le sparadrap ?
M. Jacques Fontan. Avant de répondre à vos questions, je souhaite donner un exemple supplémentaire de la réactivité dont a fait preuve la mairie de Capbreton et de l’aide qu’elle nous a apportée.
Lors de la réunion préparatoire à laquelle j’ai participé à la préfecture, on m’a remis la circulaire ministérielle accompagnée de trois pavés détaillant le volet technique, le volet administratif et le volet opérationnel de la campagne, dans lesquels devaient se trouver des documents à remettre aux gens : le bon de vaccination, le certificat de vaccination et la fiche de consultation médicale. Or, je n’ai reçu aucun document officiel. Quand je m’en suis étonné auprès de la préfecture, il m’a été répondu de faire des photocopies. Pendant toute la campagne, la mairie de Capbreton a assuré 1 000 photocopies par jour, que nous allions chercher au fur et à mesure : cela a été un travail considérable.
Nous avons rapidement modifié les horaires du centre car nous nous sommes rendus compte qu’il n’y avait personne de 8 à 9 heures et de 19 heures à 20 heures. À partir de la troisième semaine, le centre a été ouvert de 9 heures à 19 heures, soit dix heures au lieu de douze, et ce pendant toute la durée de la campagne.
M. le président Jean-Christophe Lagarde. Sept jours sur sept ?
M. Jacques Fontan. Non, le centre n’était pas ouvert le dimanche et, le samedi, nous arrêtions de vacciner à partir de 16 heures.
Aucune nourriture n’a été prévue. Comme il y avait trois vacations réparties de 9 heures à midi, de midi à 16 heures et de 16 heures à 19 heures, les gens mangeaient soit avant, soit après.
M. le président Jean-Christophe Lagarde. Même le personnel administratif ?
M. Jacques Fontan. Oui. Mais chacun apportait de quoi manger et des infirmières préparaient des gâteaux. Il y avait une très bonne ambiance et, dans la salle de repos, il y avait une cafetière.
M. le président Jean-Christophe Lagarde. Comment a été recruté le personnel administratif ?
M. Jacques Fontan. Cela a été un gros problème. Au début, on nous a affecté des volontaires de la protection civile, des secouristes, qui nous ont plus encombrés qu’autre chose. Ils étaient incapables de faire le travail de secrétariat dont nous avions besoin : saisies informatiques, éditions de bons ameli, vérification de la traçabilité.
Nous avons donc formé du personnel : parmi les demandeurs d’emploi, il y avait deux secrétaires qui ont alterné les vacations.
Mme Marie-Louise Fort. Notre mission ayant pour but de faire le point sur le déroulement de la campagne pour en tirer des résolutions en cas de nouvelle épidémie, j’aimerais avoir votre avis sur le rôle que pourraient jouer les réseaux de santé qui ont été écartés de la vaccination, à savoir les médecins et les pharmacies.
M. Jacques Fontan. Il m’est difficile de répondre à votre question parce que je ne suis pas un spécialiste. Je ne peux que me faire l’écho de ce que nous disaient les médecins de Hossegor et de Capbreton avec lesquels nous avons rapidement tissé des liens.
Les médecins avaient énormément de consultations et ils se disaient contents qu’une structure soit capable de les soulager de la vaccination. Ce n’était pas tant cette dernière qui était en cause que les démarches administratives qui l’accompagnaient.
S’il y avait eu une information plus raisonnée et mieux contrôlée, il y aurait eu moins de problèmes et les gens seraient venus se faire vacciner sans se poser de question. Les médecins auraient pu y contribuer s’ils avaient été associés à la phase préparatoire de la campagne qui a eu lieu entre mai et septembre et à laquelle n’ont participé que les préfets et les services départementaux.
Cela étant, je reste persuadé qu’en cas d’épidémie grave, une structure du type de celle dont j’ai été responsable a toute sa place. Elle fait du préventif pendant que les médecins font du curatif. Les deux actions sont complémentaires.
M. Gérard Bapt. J’ai, moi aussi, reçu mon bon de vaccination le jour de la fermeture du centre de ma circonscription.
Vous avez dit qu’après la fermeture de votre centre, des gens continuaient à venir. Je ne comprends pas bien.
M. Jacques Fontan. Lorsque je suis passé au centre, deux ou trois jours après sa fermeture, pour prendre le matériel à distribuer dans les maisons de retraite, une personne du camping m’a dit qu’il y avait encore des gens qui venaient, malgré l’annonce faite par voie de presse de la fin de la campagne.
M. Gérard Bapt. Dans ma circonscription, le centre de vaccination ne recevait presque plus personne à la fin de la campagne tandis que le vôtre continuait à vacciner. Ces disparités entre un centre et un autre sont assez curieuses.
M. Jean-Louis Touraine. Combien votre centre recevait-il de personnes par jour ?
M. Jacques Fontan. Au maximum de la campagne, il en recevait entre 700 et 800. Lors des trois dernières vacations, la dernière semaine, 200 personnes sont venues se faire vacciner.
Je m’étais amusé à faire une courbe de la fréquentation du centre tout au long de la campagne. Elle montre clairement un déclin de la vaccination pendant la période de Noël. D’ailleurs, la fin de la pandémie a été annoncée au début de janvier.
M. Gérard Bapt. Le matraquage médiatique n’était pas à sens unique. D’un côté, on diffusait des prévisions catastrophistes tandis que, de l’autre, on parlait de grippette. Comment l’analysez-vous ?
M. Jacques Fontan. Du point de vue de la population. J’analyse les effets du matraquage médiatique sur les gens et sur leur comportement. Les querelles d’experts et les interventions de la ministre de la santé les ont complètement désarçonnés. Ils ne comprenaient plus rien.
M. le président Jean-Christophe Lagarde. Combien d’habitants la ville de Capbreton compte-t-elle ?
M. Jean-Pierre Dufau. Elle en compte 9 000 permanents et 50 000 en été. Le bassin de population desservi par le centre de vaccination compte 60 000 personnes.
M. le rapporteur. Y a-t-il un référent sanitaire au sein de la municipalité ?
M. Jean-Pierre Dufau. Oui.
M. le rapporteur. Est-il allé chercher des informations auprès de la préfecture et de la direction départementale des affaires sanitaires et sociales et les a-t-il relayées ?
M. Jean-Pierre Dufau. L’information – et c’est ce que nous déplorons – était verticale et maîtrisée. Il n’était fait aucune place au partenariat. Si nous avions été associés à la préparation de la campagne, son organisation aurait été plus simple, plus efficace et il y aurait eu moins de stress. Nous aurions même pu nous charger de l’information.
M. le président Jean-Christophe Lagarde. Le centre de vaccination de ma ville a reçu des instructions différentes de la préfecture au cours de la campagne. Il lui a été demandé d’être ouvert jusqu’à 22 heures à peu près tous les jours, y compris le dimanche et les 24 et 31 décembre, alors qu’à partir de la mi-décembre, il n’y avait plus qu’une cinquantaine de personnes à venir se faire vacciner. Par ailleurs, après avoir eu l’aval de la préfecture pour vacciner toutes les personnes qui se présentaient, il lui a été officiellement enjoint de ne vacciner que les porteurs de bons… Avez-vous également reçu des instructions différentes de la préfecture ?
M. Jacques Fontan. Tout à fait. L’impression que j’ai eue est que deux acteurs dirigeaient la campagne de vaccination : d’une part, le ministère de l’intérieur et les préfectures, d’autre part, le ministère de la santé par le biais des directions départementales des affaires sanitaires et sociales (DDASS).
J’avais un excellent contact avec le médecin de la DDASS de Mont-de-Marsan, qui était, elle aussi, partisane de vacciner le maximum de monde. Quand je lui ai dit que je ne tenais pas compte des bons, elle m’a approuvé mais m’a conseillé de ne pas m’en vanter auprès de la préfecture. Cette dernière recevait les instructions officielles et avait sans doute peur d’une rupture de stock si l’on vaccinait sur une trop grande échelle.
M. le président Jean-Christophe Lagarde. Le fait que vous vacciniez même sans bon a-t-il été indiqué dans la presse locale ou sur les panneaux d’information lumineux ?
M. Jean-Pierre Dufau. Non.
M. le président Jean-Christophe Lagarde. C’est par le bouche à oreille que les gens l’ont su ?
M. Jacques Fontan. J’ai été interviewé, à la demande de la mairie, par un journaliste de Sud-Ouest qui a mentionné dans son article que nous vaccinions sans bon. Je l’ai regretté car c’est à la suite de cet article que nous avons vu arriver des habitants de Bayonne.
M. Jean-Pierre Dufau. Nous estimions qu’une interview du docteur Jacques Fontan dans la presse constituerait un relais de communication important auprès de la population.
Sur le terrain, il était très difficile de demander aux personnes qui n’avaient pas de bons de retourner chez elles alors que les médias annonçaient que 90 millions de vaccins étaient disponibles, soit bien plus que la population française.
M. le président Jean-Christophe Lagarde. Nous vous remercions, docteur Jacques Fontan, pour votre témoignage et vos réponses à nos questions.
La séance est levée à dix-sept heures dix.
Audition de M. Philippe Coste,
ancien directeur départemental des affaires sanitaires et sociales de Paris
(Procès-verbal de la séance du mercredi 2 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures onze.
(M. Philippe Coste prête serment.)
M. le président Jean-Christophe Lagarde. Je vous propose de nous faire part de votre expérience et de votre sentiment sur l’organisation de la campagne de vaccination. Vous nous expliquerez aussi sans doute aussi les raisons de votre départ de la direction départementale des affaires sanitaires et sociales de Paris.
M. Philippe Coste, ancien directeur départemental des affaires sanitaires et sociales. La direction départementale des affaires sanitaires et sociales (DDASS) de Paris est une DDASS très exposée, qui connaît souvent des situations tendues, qu’il s’agisse de l’afflux de familles de réfugiés, de problèmes d’évacuation d’immeubles détruits par un incendie ou d’autres crises sanitaires, comme la légionellose ou le saturnisme. Dans le cas de la pandémie de grippe A(H1N1), le défi était cependant encore plus important à relever.
Du point de vue de notre organisation, le plan variole s’est avéré d’emblée inopérant. Il a donc fallu inventer un nouveau dispositif pour assurer une vaccination de masse dans le cadre d’exigences de sécurité sanitaire fortes : celui-ci a exigé une logistique lourde.
Cette mobilisation a commencé dès la première hospitalisation, le 28 avril 2009. La première réunion spécifique sur la grippe a eu lieu le 20 mai, pour la mise en œuvre du plan blanc élargi. Cette réunion a été suivie de réunions successives avec le secrétaire général de la ville de Paris, avec la question de la mise en place, d’une part, de centres de coordination sanitaire et sociale dans chaque arrondissement pour répondre aux besoins de la population et, d’autre part, de centres de vaccination dédiés. C’est à ce moment-là qu’ont été évoquées l’utilisation possible de gymnases et la mobilisation des médecins de ville et des médecins de dispensaires et de centres de santé pour assurer la vaccination.
Ces réunions se sont poursuivies au mois de juillet, tant avec le comité départemental de l’aide médicale urgente, le CODAMU, qu’avec les caisses primaires d’assurance maladie, l’ordre des médecins ou l’Assistance publique – Hôpitaux de Paris.
Une première circulaire sur l’organisation des centres est intervenue le 21 août ; elle a d’ailleurs été modifiée le 23 octobre. Le 2 septembre, j’ai été désigné responsable de l’équipe opérationnelle départementale : nous avons poursuivi les réunions auprès du préfet de police, avec les différents acteurs jusqu’à l’organisation du test national qui a eu lieu dans le gymnase Renoir le 15 septembre 2009. Lors de cet exercice, ont été identifiés les principaux besoins, tant informatiques que logistiques : il est ainsi apparu nécessaire de nommer un responsable du centre de vaccination et de disposer d’un logisticien pour organiser le fonctionnement du centre, notamment pour la gestion des files d’attente.
Le 10 octobre, un plan départemental prévoyant l’ouverture de vingt-deux centres de vaccination a été transmis, plan qui a été revu le 15 octobre, pour tenir compte de l’ouverture de centres pédiatriques, ce qui a paru plus adapté en termes de productivité à Paris.
Nous avons ensuite été confrontés à la réalité de la mise en œuvre de ce plan départemental, au lancement de la vaccination proprement dite.
Les problèmes que nous avons alors rencontrés ont été essentiellement liés à la gestion des ressources humaines. En effet, il est tout d’abord apparu que nous ne disposions pas d’un logiciel adapté pour organiser les plannings et les horaires. Nous avons ensuite eu des difficultés à mobiliser les fonctionnaires des autres administrations, certains personnels ayant fait part de leurs doutes sur l’intérêt de l’opération. S’agissant des internes et des élèves infirmiers, les personnels qui les encadrent se sont montrés parfois peu coopératifs : je rappelle que les infirmières ont notamment manifesté devant le siège de l’Assistance publique – Hôpitaux de Paris et que certains élèves infirmiers craignaient que leur mobilisation ne nuise à leur scolarité.
L’absence de visibilité a également constitué un problème, notamment sur les moyens financiers, puisque nous ne disposions d’aucune enveloppe dédiée pour financer l’opération.
Enfin, le dernier problème a été constitué par l’afflux dans les centres de vaccination : d’abord vides, ils se sont trouvés dès la troisième semaine confrontés à une affluence plus massive, au moment même où nous avions des difficultés à mobiliser les professionnels pour assurer la vaccination et où nous étions donc naturellement tentés de réduire le rythme des vacations. Pour faire face à un certain absentéisme, nous avons donc fait appel à des groupes plus volontaires, en particulier à des médecins généralistes retraités qui s’étaient dits prêts à être mobilisés.
Cette campagne de vaccination a été néanmoins, au-delà de son effet direct, l’occasion de tirer des leçons utiles pour l’avenir : nul doute que si une expérience de ce type devait être renouvelée, les instructions nationales seraient données plus rapidement, puisque l’on pourrait s’appuyer sur ce qui a déjà été fait. Des difficultés qui ont été rencontrées ne le seraient plus à l’avenir : par exemple, pour la mobilisation des médecins du travail, les gestionnaires, installés à Paris, ont fait parvenir des listes sur lesquelles figuraient de nombreux médecins exerçant en banlieue parisienne, et qui auraient donc été plus utiles s’ils avaient été mobilisés dans les départements limitrophes de Paris. En tout état de cause, le retour d’expérience est toujours utile et profitable.
Un constat qui a été dressé est celui d’un inégal accès de fait à la vaccination et d’une forte corrélation entre le gradient social et l’appétence pour la vaccination : c’est un point sur lequel il faudra continuer de travailler.
M. Jean-Pierre Door, rapporteur. Quel est le nombre final de personnes vaccinées à Paris ?
M. Philippe Coste. Au moment où j’ai quitté mes fonctions, Paris était le premier département en pourcentage de la population vaccinée, ce qui est d’ailleurs assez logique, au regard de la forte densité de la population à Paris. Pour la ville de Paris, vingt-deux gymnases étaient prévus, mais douze seulement ont été utilisés au départ. Nous avions sélectionné les meilleurs d’entre eux au regard de nombreux critères tels que l’accessibilité générale ou l’accessibilité aux personnes handicapées, et dans onze d’entre eux, il était possible de mettre en place une seconde chaîne de vaccination, permettant ainsi de fluidifier l’activité, en particulier dans l’hypothèse où se présente un cas clinique qui demande plus de temps.
Ce n’est qu’ensuite, après mon départ, que la totalité des vingt-deux centres de vaccination ont été ouverts.
S’agissant des résultats de la vaccination, le démarrage a été assez lent : le premier jour, le 12 novembre, 1 000 personnes ont été vaccinées. Le jeudi suivant, c’étaient 2 000 personnes qui se soumettaient à la vaccination. Le rythme s’est encore accru de semaine en semaine, puisque l’on est passé de 2 900 vaccinations le jeudi d’après à 3 600 le jeudi suivant, puis à 4 500 vaccinations le jeudi 10 décembre. Le jeudi 24 décembre, en revanche, on ne comptabilisait plus que 866 vaccinations. La date officielle de fermeture des centres de vaccination fût le 8 février 2010. Je ne dispose pas du taux de vaccination final de la population parisienne, donnée qu’il faudrait demander au directeur de l’agence régionale de la santé de Paris. À mon départ, 2,9 % de la population parisienne était vaccinée, ce qui était important, mais tenait aussi au mode de fonctionnement qui avait été retenu pour les centres de vaccination, qui avaient été orientés vers la productivité.
M. le président Jean-Christophe Lagarde. Comment a été opéré le choix des centres de vaccination ? La ville a-t-elle proposé des lieux ? La préfecture de police est-elle intervenue aux côtés de la direction départementale des affaires sanitaires et sociales ? Quand vous sont parvenues les instructions nationales, puisque vous indiquez qu’elles ont été tardives ? Quelles ont été les difficultés logistiques spécifiques à Paris, au regard de la fréquentation des centres ? Lorsque nous avons auditionné les syndicats de médecins et d’infirmiers, ils nous ont fait part du caractère désordonné des réquisitions à Paris : comment les choses se sont-elles déroulées ? Enfin, pouvez-vous revenir sur les raisons de votre départ ?
M. Philippe Coste. S’agissant des réquisitions, elles ont parfois été mal vécues, mais elles étaient nécessaires d’un point de vue juridique pour assurer la couverture assurantielle des professionnels concernés.
M. le président Jean-Christophe Lagarde. Comment s’est opéré le choix des personnes réquisitionnées ?
M. Philippe Coste. Les médecins généralistes n’ont pas été réquisitionnés à Paris, car il était convenu qu’il fallait maintenir le système de soins pour les personnes malades, qu’elles soient touchées par la grippe ou par une autre pathologie d’ailleurs.
S’agissant des instructions nationales, lorsque j’ai dit qu’à l’avenir, elles seraient diffusées plus tôt, ce n’était pas un reproche : il s’agissait d’expliquer que de nombreuses décisions avaient été prises avant l’été, car il était nécessaire de les prendre, mais la première circulaire ministérielle a été diffusée à la fin du mois d’août.
S’agissant de mon départ, je dirai qu’il n’était pas programmé : le directeur de cabinet de la ministre m’a expliqué qu’on me reprochait de ne pas avoir su mobiliser les internes de l’Assistance publique – Hôpitaux de Paris. Pourtant, sur ce point, les pouvoirs de la direction départementale des affaires sanitaires et sociales sont limités.
M. Gérard Bapt. C’est plutôt le rôle de l’agence régionale de l’hospitalisation !
M. Philippe Coste. Il n’y a pas eu spécialement de difficultés avec l’Assistance publique – Hôpitaux de Paris. Paris a la densité médicale la plus importante en France : il n’y a donc pas eu de difficulté majeure pour mobiliser des médecins. Il s’est agi peut-être davantage d’un problème relationnel : l’organisation parisienne est spécifique, puisqu’elle implique des relations étroites avec le secrétaire général de la ville de Paris, le préfet de police, le préfet de Paris et le préfet délégué à la zone de défense, et le contexte peut donc parfois être difficile… Mon poste avait en tout état de cause vocation à disparaître quelques semaines plus tard, à la faveur de la naissance des agences régionales de la santé, qui signait la disparition des directions départementales et régionales des affaires sanitaires et sociales.
Mme Catherine Génisson. Vous avez dit que la principale difficulté concernait les ressources humaines : y a-t-il d’ailleurs eu sur ce point une cohérence dans la logique des consignes qui ont été données ? On a en effet eu l’impression qu’au départ, la participation des médecins généralistes était bien prévue, et qu’ils n’ont été écartés que dans un second temps. S’agissant de la mobilisation du monde hospitalier et de l’Assistance publique – Hôpitaux de Paris, ne pensez-vous pas que dans ce type de contexte, il vaudrait mieux se tourner d’emblée vers la médecine générale ou administrative plutôt que de solliciter l’hôpital, qui n’est pas a priori le plus apte à répondre à ce type de sollicitation ? Enfin, le plan départemental initial était composé de douze centres : le passage à vingt-deux centres a-t-il conduit à une amélioration en termes de fonctionnement et d’accueil de la population ?
M. Philippe Coste. Le passage à vingt-deux centres a pu améliorer la fluidité des centres, mais en termes d’effectifs vaccinés, il n’y a pas eu d’amélioration avec le passage à vingt-deux centres malgré l’augmentation de moyens qui a été nécessaire pour faire fonctionner dix centres supplémentaires.
Mme Catherine Génisson. Ce passage à vingt-deux centres n’a-t-il pas justement compliqué la situation ?
M. Philippe Coste. Il est évident que plus le dispositif est dispersé, moins on peut mutualiser les moyens : c’est ce que j’expliquais tout à l’heure en évoquant la seconde chaîne de vaccination.
S’agissant du recours aux médecins, la situation n’est pas la même en fonction des zones : des professionnels disponibles peuvent exister dans toutes les catégories. Il faut en tout état de cause faire d’abord appel à des volontaires et le cas échéant, procéder à la mobilisation des professionnels à moindres frais en termes de santé publique. Je pense par exemple à la médecine du travail, dont certaines activités peuvent être plus facilement différées que celles d’un interne par exemple. L’association de médecins retraités présidée par le Docteur Xavier Emmanuelli effectue d’ailleurs un travail très utile dans ce genre de situations.
M. le rapporteur. Combien de personnes au sein de la direction départementale des affaires sanitaires et sociales ont été mises à contribution pour l’élaboration et la mise en œuvre du plan départemental parisien ?
M. Philippe Coste. La direction départementale des affaires sanitaires et sociales compte environ deux cents personnes, dont cent dix personnes dans le secteur de la santé : l’ensemble des services a été sollicité, et je leur rends hommage devant vous. Les personnels ont également travaillé le week-end et le 11 novembre, la veille de l’ouverture des centres de vaccination, lorsque j’ai lancé un appel à la mobilisation des personnels, vingt-cinq personnes se sont portées candidates. L’opération a suscité une très forte adhésion de la part de l’ensemble des personnels.
Mme Catherine Lemorton. Je reviens à ce qui a été présenté comme votre mutation : elle est intervenue à un moment où l’opposition dénonçait déjà les modalités de la mise en œuvre de la campagne de vaccination. Que vous a-t-on reproché exactement de plus que le fait de ne pas avoir pu mobiliser les internes de l’Assistance publique – Hôpitaux de Paris ? Que faites-vous désormais ?
M. Philippe Coste. Je vous ai dit la vérité et je ne peux rien dire de plus. Les semaines qui ont suivi mon départ de la direction départementale des affaires sanitaires et sociales ont été difficiles. J’ai été ensuite nommé conseiller général pour les établissements de santé, et j’effectue actuellement une mission sur les relations entre l’État et la Caisse nationale de solidarité pour l’autonomie.
M. Jean-Paul Bacquet. Ne pensez-vous pas avoir fait les frais d’une décision prise en raison d’une certaine intolérance des médias dans cette affaire ?
M. Philippe Coste. Chacun peut avoir son sentiment sur ce sujet, et mon avis n’importe pas davantage qu’un autre.
La séance est levée à dix-sept heures cinquante-huit.
Audition de Mme Valérie Lévy-Jurin,
maire-adjointe de Nancy,
présidente du réseau français des villes santé de l’Organisation mondiale de la santé, membre de l’Association des maires de France
(Procès-verbal de la séance du mercredi 2 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures.
(Mme Valérie Lévy-Jurin prête serment.)
M. le président Jean-Christophe Lagarde. Je vous propose de nous exposer le rôle du réseau français des villes santé de l’Organisation mondiale de la santé ainsi que la position de l’Association des maires de France sur l’organisation de la campagne de vaccination.
Mme Valérie Lévy-Jurin, maire-adjointe de Nancy, présidente du réseau français des villes santé de l’Organisation mondiale de la santé, membre de l’Association des maires de France. Le réseau des villes santé de l’Organisation mondiale de la santé existe depuis vingt ans. Il a pour objet de défendre le rôle des villes et des politiques urbaines dans les politiques de santé publique, que ce soit en matière de transports, d’urbanisme ou d’éducation. Il regroupe soixante-dix villes de taille relativement importante et a conclu des conventions avec le ministère de la santé, par exemple pour réduire les inégalités sociales dans le domaine de la santé.
S’agissant de l’avis des collectivités locales sur l’organisation de la campagne de vaccination, il est difficile de dégager une analyse globale du fait des disparités qui peuvent exister entre départements, liées à l’histoire locale, mais aussi aux liens qui ont pu être noués avec l’administration par certains, aux relations interpersonnelles, ou à l’expérience de crises que certains territoires ont déjà vécues.
On peut néanmoins observer deux éléments de contexte qui peuvent expliquer l’insatisfaction qui s’est fait jour. En premier lieu, la réforme générale des collectivités territoriales : les personnels des directions départementales des affaires sanitaires et sociales étaient inquiets quant à leur avenir, et à la crise sanitaire s’ajoutait ainsi une insécurité psychologique. En second lieu, il existait un climat de tension entre les services de l’État et les collectivités locales, dans un contexte budgétaire difficile. Le regard que l’État porte sur nous n’est jamais désintéressé, alors que le domaine de la santé a toujours été affirmé comme relevant de sa compétence exclusive…
Des points positifs sont à souligner. Les collectivités locales ont fait généralement preuve de bonne volonté, car elles tiennent à protéger la santé de leurs populations, et leurs personnels se sont bien mobilisés. En outre, on a pu observer que la culture des situations de crise s’est progressivement installée en France au fil des crises sanitaires. Les plans de continuité de services se sont imposés comme des outils importants, ils ont été étoffés, travaillés, et les personnels y ont porté une grande attention. Plus généralement, nous avons eu l’occasion de redécouvrir les messages d’hygiène et de retrouver une culture de l’hygiène, ce qui constitue également un point positif.
Cela étant, il existe une grande disparité entre collectivités locales, et notamment entre, d’une part, les petites communes et, d’autre part, les moyennes et grandes villes. Les élus ruraux nous ont fait part de leur sentiment de solitude et ont regretté de n’être pas informés, alors que sévissait une véritable cacophonie médiatique et qu’ils sont eux-mêmes le premier relais de l’information vers leurs administrés. Ils auraient voulu bénéficier de la même information que les maires des grandes villes.
Les services d’hygiène des grandes villes ont pour leur part joué un rôle très important et ont contribué à assurer des solidarités entre territoires limitrophes. Ces services font parfois sourire l’État, mais ils ont une capacité de réaction efficace. Les médecins directeurs ont été très fiables et se sont intensément mobilisés, souvent aux dépens de leurs missions de base.
L’information des élus a été perçue comme étant très verticale. Dans les messages que nous avons recueillis, nombreux sont ceux qui déplorent les « ordres », « instructions », ou « injonctions » faits aux collectivités. Il en a été de même pour l’organisation, ressentie comme stéréotypée, standardisée et ne prenant pas en compte les spécificités locales, comme par exemple l’existence, dans certains cas, de services de santé scolaire, sur lesquels l’État n’a donc pas pu s’appuyer. La ville de Grenoble a ainsi dû interpeller la préfecture pour signaler l’existence d’un service qui aurait pu contribuer à désengorger les centres de vaccination. Le recours à une organisation trop standardisée a donc fait fi des atouts que présentaient les collectivités.
On peut également regretter la méconnaissance des habitudes et des populations concernant les choix des lieux où ont été établis les centres de vaccination, choix parfois surprenants qui n’ont pas pris en compte les contraintes budgétaires pour les collectivités qui devaient gérer les annulations de spectacles ou de manifestations sportives, ni la desserte de ces lieux par les transports en commun. Des lieux ont été imposés et il a fallu un bras de fer pour que soient adoptées des solutions plus acceptables sur le plan budgétaire. Certaines villes ont même eu des mouvements d’humeur et ont réclamé une réquisition des locaux où ont été installés les centres.
Les relations, nouées sur le mode du commandement, ont ainsi été mal vécues car les nombreux ajustements en cours de campagne ont été interprétés comme des contradictions. Ainsi, la commune de Champeix a travaillé durant tout l’été sur l’établissement d’un centre et au mois d’octobre cette solution a été abandonnée au bénéfice du recours à des centres de vaccination situés dans des communes voisines. Tous ces ajustements ont été faits par fax, même pas par téléphone ! Il aurait fallu, dès le départ, un véritable dialogue et de la modestie pour qu’il y ait compréhension.
Autre incompréhension : l’exclusion des médecins généralistes du dispositif de vaccination. Ils sont pourtant des acteurs importants des territoires, et contribuent pour une part à l’attractivité de ces derniers.
La question des indemnisations constitue évidemment une demande forte des communes. De nombreux frais n’ont pas été pris en compte pour leur calcul. Les sommes atteintes sont parfois importantes – 63 000 euros pour Metz, 90 000 euros pour Villeurbanne – et les remboursements prévus sont parfois inférieurs au dixième des frais engagés. La mise à disposition de locaux n’a parfois pas été prise en compte. Tout cela appelle une révision des modalités de calcul des indemnisations.
Pour conclure, je dirai qu’après une fin de crise brutale, les territoires attendent aujourd’hui des bilans établis au niveau des départements et regrettent que l’État, souvent demandeur d’évaluations, n’en ait pas conduit pour l’instant.
M. Jean-Pierre Door, rapporteur. Je vous poserai trois questions : l’Association des maires de France, qui mène de nombreuses campagnes d’information auprès des communes, a-t-elle agi de même pour la campagne de vaccination ? Ne pensez-vous pas qu’il faudrait renforcer le rôle des référents sanitaires dans les communes ? Le réseau que vous présidez a-t-il eu des contacts avec l’Organisation mondiale de la santé lors de la gestion de la crise ?
Mme Valérie Lévy-Jurin. Les associations d’élus ont transmis des informations, mais celles-ci étaient très générales ; l’organisation a pour sa part été spécifique à chaque département. L’Association des maires de France a pu fournir des informations régulières, car elle était en contact avec la cellule de crise interministérielle.
Le réseau des villes santé de l’Organisation mondiale de la santé a également transmis des informations, concernant par exemple les achats de masques et leur stockage, et a répondu aux questions récurrentes qui lui étaient posées. En revanche, aucun contact particulier n’a été établi avec l’organisation, car celle-ci considère que le système français est exemplaire et que la tradition vaccinale dans notre pays est forte. Elle se préoccupe donc davantage des pays en voie de développement. Nous sommes néanmoins en contact avec son bureau de Copenhague qui est chargé des villes santé.
Les médecins directeurs et les responsables de services d’hygiène existent surtout dans les grandes villes, qui appartiennent à des agglomérations ou d’autres établissements publics de coopération intercommunale. Il faudrait d’ailleurs sans doute rattacher ces services à ces établissements publics, car ils ont joué un rôle important en termes de solidarité entre territoires de santé et les établissements publics de coopération intercommunale sont désormais dotés de compétences dans le domaine de la santé, dans lequel ils pourraient être des « fers de lance ».
Mme Catherine Lemorton. On peut regretter que les relations avec l’Organisation mondiale de la santé soient si limitées, car de nombreuses leçons auraient pu être tirées des conséquences de la fermeture de centres de vacances dans l’hémisphère Sud sur l’évolution de la pandémie… Comment pourrait-on optimiser ces retours d’expérience ? Un jour surviendra une nouvelle pandémie, et les informations émanant de l’Organisation mondiale de la santé seront précieuses.
Mme Valérie Lévy-Jurin. Notre réseau tient des réunions régulières à un niveau européen élargi, où sont présentes Jérusalem ou des villes turques. La prochaine réunion, qui se tiendra en Norvège, aura lieu en présence de représentants de l’Organisation mondiale de la santé. Nous les interpellerons, en tant que « pouvoirs locaux », sur ce sujet pour améliorer notre efficacité la prochaine fois.
En conclusion, je tiens à souligner que si les collectivités locales sont des partenaires des pouvoirs publics lors des crises sanitaires, elles ne souhaitent évidemment pas devenir gestionnaires de ces crises. Elles souhaitent en revanche que leur savoir-faire soit reconnu, et qu’on les respecte.
M. le président Jean-Christophe Lagarde. Je vous remercie.
La séance est levée à dix-huit heures trente.
Audition de M. Jean-Claude Manuguerra,
président du Comité de lutte contre la grippe
(Procès-verbal de la séance du mercredi 2 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures trente-trois.
(M. Jean-Claude Manuguerra prête serment.)
M. Jean-Claude Manuguerra, président du Comité de lutte contre la grippe. Monsieur le président, je vais commencer, si vous le voulez bien, par planter le décor en présentant le rôle du comité, qui ne concerne pas les aspects logistiques de la stratégie de vaccination.
La grippe est une maladie imprévisible extrêmement contagieuse, contre laquelle on peut malgré tout lutter par des moyens comme le vaccin, et plus récemment des médicaments antiviraux. Pour tous les membres de notre comité, il n’est pas inéluctable que nous subissions des épidémies ; nous anticipons ces épidémies pour diminuer leur impact sur la santé des populations, notamment la population qui vit sur le territoire français. Les plans de lutte sont des « boîtes à outils » disponibles, à utiliser en fonction de la situation. L’expertise scientifique est là pour aider les décideurs à prendre des décisions. Le Comité de lutte contre la grippe fait partie de cette expertise. Il résulte des recommandations de l’Organisation mondiale de la santé (OMS) depuis très longtemps, depuis que celle-ci a préparé son premier plan en 1999. Mais la France a commencé à se doter d’une instance d’expertise dès 1995 à travers l’ancêtre de l’Institut national de veille sanitaire qu’était le réseau national de santé publique.
Notre cellule est coordonnée depuis 1995 par la direction générale de la santé : elle a pour mission de conseiller le directeur général de la santé sur les moyens à mettre en œuvre face à une épidémie de grippe en France, que ce soit la grippe H3N2 en 1997-1998 ou le virus H3N2, saisonnier, en 2000. Mais nous avons joué bien sûr en 2003 un rôle technique relativement substantiel dans la lutte contre le syndrome respiratoire aigu sévère, le SRAS. Depuis, la cellule de lutte a continué de jouer son rôle d’expertise sur les mesures à mettre en œuvre, et à partir de janvier 2003, la cellule est devenue un groupe de travail non permanent du Conseil supérieur d’hygiène publique de France. C’est à partir du 1er janvier 2003 que M. Lucien Bénaïm, à l’époque directeur général de la santé, m’a demandé d’en assurer la présidence. Entre la disparition du Conseil supérieur d’hygiène public de France et son remplacement par le Haut conseil de la santé publique, la cellule était « dans l’air », il n’y avait plus de groupe de travail. Nous avons néanmoins continué à nous réunir au minimum une fois par mois, et même beaucoup plus. Afin de stabiliser les choses, le Comité de lutte contre la grippe a finalement été créé et officialisé par un décret du Premier ministre, suivi ensuite par des arrêtés de nomination. La mission du Comité de lutte contre la grippe est donc aujourd’hui d’apporter au ministre chargé de la santé une expertise collective, médicale et scientifique sur l’ensemble des mesures à mettre en œuvre pour contrôler et réduire l’impact d’une épidémie ou d’une pandémie. Jusqu’à présent, les avis du comité ont été fournis à partir d’un consensus de ses membres. C’est une discussion collégiale et franche qui permet de dégager la meilleure solution et d’asseoir l’expertise. Lorsque les avis portent sur les vaccins et la vaccination – c’est assez important pour comprendre son fonctionnement – , le Comité de lutte contre la grippe a travaillé comme groupe de travail du Haut comité de la santé publique ou du Comité technique des vaccinations, et tous les avis que nous avons émis sur les vaccins ont été présentés au Comité technique des vaccinations, qui l’a approuvé après en avoir amendé ou non les termes, puis au Haut comité de la santé publique. Tous nos avis sur les vaccins sont donc publics, pas directement, mais par l’intermédiaire de l’avis abouti du Haut conseil.
Sur le fonctionnement du Comité de lutte contre la grippe, je rappellerai qu’il est composé de dix-sept personnes. Nous nous sommes réunis à de nombreuses reprises puisque nous avons, depuis le début de la pandémie, émis quarante-trois avis du 25 avril 2009 au 31 janvier 2010. Nous nous sommes ainsi réunis le lendemain de l’alerte mondiale le 24 avril 2009 et nous avons, dans les cent cinquante premiers jours, émis des avis tous les cinq jours, week-ends et jours fériés compris, en mai et juin. C’était donc un groupe extrêmement mobilisé, extrêmement attentif à pouvoir répondre aux questions qui lui étaient posées. S’agissant de l’organisation du groupe, je vous ai dit que pendant un certain temps, jusqu’à août 2008, nous n’avions plus d’existence légale mais que nous continuions à travailler. À partir du moment où le comité a été officiellement créé, un certain nombre d’outils ont dû être mis en place, notamment l’adoption d’un règlement intérieur que nous avons mis un certain temps à élaborer, puis à adopter. Il y avait sans doute aussi, comme me l’a fait remarquer le sénateur François Autain, à appliquer la loi qui régit les déclarations publiques d’intérêts. Celles-ci avaient d’ores et déjà été faite en grande partie par les membres du comité, du fait de leur appartenance à des structures qui l’exigeaient. La question de ces déclarations publiques d’intérêts est une affaire administrative qui ne concerne pas le président du comité. Pour ce qui me concerne, les liens que j’ai déclarés étaient, au cours de ces cinq dernières années, une participation à un congrès payée par le laboratoire Roche au Portugal – rencontre européenne qui a lieu tous les deux ans et qui s’intitule Options pour le contrôle sur la grippe – et une participation rémunérée à un séminaire organisé par les services de santé publique du Canada, également soutenu financièrement par le laboratoire Roche. Je précise que je n’ai ni actions, ni contrat de travail, ni contrat de consultant avec une des sociétés pharmaceutiques impliquées dans la fabrication ou la vente d’antiviraux, de vaccins ou de masques. J’ajoute enfin que je suis totalement solidaire des membres du comité et de toutes les décisions de celui-ci.
M. Jean-Pierre Door, rapporteur. Merci, Monsieur Jean-Claude Manuguerra. Je voudrais savoir quelle a été l’articulation du Comité de lutte contre la grippe avec les autres instances d’expertise, que ce soit au niveau national ou au niveau européen. Quel est en outre votre sentiment sur le fait que le consensus entre les experts n’a pas été un consensus tout à fait général ? Ce point est important puisqu’il a conduit à de nombreuses réactions médiatiques. Quel est votre avis sur la stratégie vaccinale ? Votre comité a fourni un certain nombre d’avis : a-t-il prôné une vaccination massive ou plutôt orientée vers les populations à risque ? Enfin, la communication des experts a-t-elle été suffisamment claire ? Cette communication est-elle à l’origine de l’inquiétude, voire de la suspicion des Français ?
M. Jean-Claude Manuguerra. Sur l’articulation avec les autres instances, nous avons souffert indéniablement d’un manque de clarté au moment de la transformation du Conseil supérieur d’hygiène publique de France en Haut conseil de la santé publique. Mais par la suite, notre comité a intégré des personnes qui appartenaient à un groupe qui avait été tripartite, qui réunissait non seulement des agences, mais également des représentants du comité technique des vaccinations qui auditionnait à peu près tous les six mois les firmes pharmaceutiques pour connaître l’état d’avancement des vaccins contre la grippe H5N1 avant l’obtention de leur autorisation de mise sur le marché et la présentation des dossiers. Quand le Comité de lutte contre la grippe a été créé, j’ai souhaité que l’on puisse capitaliser l’expérience passée. Il fallait donc que puissent y siéger le président de la commission des maladies transmissibles du Haut conseil de la santé publique, M. Christian Perronne, et le président du comité technique des vaccinations, M. Daniel Floret. Parmi les dix-sept membres du comité, la moitié représentent des agences, comme l’Institut de veille sanitaire par exemple, l’Agence française de sécurité sanitaire des produits de santé ou des représentants des centres nationaux de référence. Nous avons essayé de garder, au moins par la composition, un lien avec les agences et les comités ou les conseils qui existaient par ailleurs. Pour ce qui concerne notre articulation, nous sommes rattachés directement au directeur général de la santé. C’est lui qui nous saisit, même si nous pouvons nous saisir nous-même, ce que nous faisons. Il n’y a pas de relations avec d’autres organismes européens, même si chacun de ses membres peut naturellement faire part de son expérience.
M. le rapporteur. Avec le Centre de prévention et de contrôle des maladies de Stockholm par exemple ?
M. Jean-Claude Manuguerra. Nous n’avons pas de lien particulier avec le centre de Stockholm. Au niveau mondial non plus. L’Organisation mondiale de la santé peut émettre des recommandations, mais chaque pays organise son système de santé comme il l’entend et le comité n’a pas de lien particulier avec elle. Des experts du comité peuvent participer à d’autres comités. À ma connaissance, trois membres du Comité de lutte contre la grippe, dont deux membres de droit, participent au groupe d’expertise d’urgence de l’Agence française de sécurité sanitaire des aliments ; certains d’entre nous peuvent participer aux travaux de l’Agence européenne du médicament, je participe par exemple à titre individuel au comité stratégique et technique sur la lutte contre la grippe de l’organisation mondiale de la santé.
M. le rapporteur. À titre personnel donc.
M. Jean-Claude Manuguerra. Tout à fait. Nos avis ne sont pas publics, puisque nous ne disposons pas d’une interface publique comme le Haut conseil de la santé publique par exemple. Nos avis sont destinés à aider à la décision, de la direction générale de la santé, et au-delà, du ministre chargé de la santé et de ses collaborateurs. C’est d’ailleurs une question qui a été évoquée à plusieurs reprises entre nous. On a pu regretter que les positions du comité ne puissent pas être individualisées par rapport aux décisions prises parfois très en aval ou de manière un peu décalée.
Le consensus a toujours été total, qu’il s’agisse des membres de droit ou des personnalités qualifiées. Nous n’avons jamais eu besoin de procéder à un vote et je pense que s’il y avait eu des voix discordantes, elles se seraient fait connaître, et cela n’a pas été le cas. Nous avons toujours réussi à dégager le consensus.
S’agissant de l’expertise en général, il faudrait déterminer ce qu’est un expert. Est-ce quelqu’un qui travaille sur un sujet spécifique, qui est reconnu au niveau national et international depuis un temps minimal, avec le risque d’être un peu déconnecté de la réalité, voire un peu monomaniaque ? Si oui, au comité, nous sommes des experts. S’agit-il d’un expert qui se penche sur un sujet particulier parce qu’il est devenu intéressant ou suscite des débats ? Il s’agit alors de personnes qui n’ont pas forcément de connaissance particulière du sujet et qui parfois interviennent en dehors de leur discipline… Ce peut être aussi des experts qui sont mûs par certaines convictions anti-vaccinales par exemple ou des intérêts particuliers.
Je n’ai jamais eu de formation juridique, et je crois que cela m’a manqué parce que j’ai fini par comprendre que la forme était importante, en particulier s’agissant des déclarations publiques d’intérêts, pour lesquelles nous avons été beaucoup interrogés. J’ai appris, à titre personnel, qu’il fallait être beaucoup plus formaliste.
Mais il est toutefois très curieux que l’on ne demande jamais aux autres « experts » autoproclamés ou dissidents leur déclaration publique d’intérêts lorsqu’ils font des déclarations dans les médias, ou éventuellement dans certains cercles. Or, il est tout à fait possible d’avoir des intérêts qui ne soient pas des intérêts financiers : des convictions qu’il convient de servir par exemple. Derrière une opération antivaccinale, il peut y avoir des motifs religieux. On sait que dans certains pays, certains groupes religieux financent des « ligues antiscientifiques ». Des experts sont payés par d’autres lobbies que l’industrie pharmaceutique. Certains ont un intérêt beaucoup plus « basique » : ils ont par exemple écrit un livre qui se vend d’autant mieux si l’on parle d’eux. Il faut certainement revoir la définition de l’expert ; c’est une question très importante. L’expertise ne se proclame pas par le fait de passer à la télévision. J’ai participé à un débat avec l’un de ces « experts » qui était opposé au vaccin antigrippal pandémique 2009 avec adjuvant. Manifestement, il ne connaissait pas les rouages de l’autorisation de mise sur le marché depuis la fin des années 1990, depuis l’apparition du virus H5N1, avec la procédure d’enregistrement des dossiers dite mock up par exemple. Ses informations étaient fausses, et j’ai demandé d’ailleurs à l’Agence française de sécurité sanitaire des produits de santé pourquoi les informations sur la pharmaco-vigilance par exemple, qui avaient été remises en cause, n’avaient pas fait l’objet de réponses formelles et juridiques. Il semblerait que cela compliqué et que cela prendrait beaucoup de temps… Beaucoup de choses ont toutefois été dites qui sont totalement inexactes : il faudrait pouvoir les contrer. Parmi les leçons à tirer, je pense qu’il faudra à l’avenir lutter pied à pied contre tous les arguments inexacts, les épouvantails destinés à effrayer la population. En effet – on le voit très bien dans les crises – plus le danger paraît lointain et moins l’adhésion est forte sur les moyens de lutter contre les maladies infectieuses. Effectivement, lorsque la grippe est apparue bénigne à la population, celle-ci s’est détournée de la vaccination.
Sur la stratégie vaccinale, il est clair que le comité de lutte contre la grippe, comme la plupart des comités équivalents, reconnaît que le meilleur moyen de lutter contre les maladies infectieuses, et notamment la grippe, est la vaccination. Lorsque l’on peut disposer d’un vaccin. Pendant très longtemps, nous n’avons pas disposé de vaccin contre la grippe aviaire. Au début de la pandémie de grippe A(H1N1), on ne savait pas quand et si l’on aurait un vaccin, alors que la vaccination est la stratégie la plus payante en termes de santé comme en termes économiques. La position générale du comité de lutte contre la grippe est que le vaccin est l’arme la plus efficace. Dès lors, pour protéger la population, quelle que soit la gravité de la maladie, la vaccination devait, selon le comité, être proposée à tous les résidents sur le territoire français qui le souhaitaient.
M. le rapporteur. À quelle époque avez-vous dit cela ?
M. Jean-Claude Manuguerra. Nous l’avons écrit à peu près dans tous les rapports et comptes rendus, à chaque fois que cela a été possible. Cela a d’ailleurs été repris par le Comité technique des vaccinations puis par le Haut conseil de la santé publique.
M. le président Jean-Christophe Lagarde. Vous avez évoqué tout à l’heure les quarante-trois avis émis, et non rendus publics. Nous souhaiterions avoir connaissance de ces avis.
M. Jean-Claude Manuguerra. Vous les aurez dès demain.
M. le président Jean-Christophe Lagarde. Je vous en remercie.
M. Jean-Claude Manuguerra. Vous verrez au fil de ces comptes rendus que telle était notre position. Nous avions beaucoup donné d’avis auparavant sur le vaccin contre la grippe H5N1 en rejoignant l’avis du Comité consultatif national d’éthique selon lequel la vaccination devait pouvoir être proposée à tous ceux qui le souhaitaient. La question était ensuite : quelle population protéger ? Dans nos avis, nous avons toujours été prudents, car les questions nous étaient souvent posées avec des délais très courts pour y répondre, et nos réponses devaient être élaborées avec des informations extrêmement fluctuantes. Nous avons donc identifié des populations prioritaires en cas de pénurie de vaccin, comme les personnels de premier secours, les personnes dont le rôle est essentiel au bon fonctionnement de la société et, en présence du virus H1N1, les enfants de six mois à dix-huit ans. Nous avons ensuite évoqué l’acquisition progressive de vaccins, à revoir en fonction des données épidémiologiques. Mais le temps imparti pour répondre était extrêmement court, et les premières réponses ont été données en fonction de modèles et d’analyses établis lors de la menace de la grippe H5N1 hautement pathogène. Voilà pour la stratégie vaccinale, même si – je le répète – le comité n’avait pas vocation à se prononcer sur les aspects logistiques de la vaccination.
Sur la communication des experts, il faut convenir qu’elle a été brouillée, mais qu’il est hors de question qu’un comité quelconque s’arroge un monopole, une exclusivité de la parole sur une question comme celle-là. La parole est libre et chacun doit pouvoir s’exprimer. Il est essentiel que les médias, dont le rôle est de répercuter les opinions des uns et des autres fassent la part des choses, et sachent qui, éventuellement, a vocation à donner des avis sur un domaine qu’il ne connaît pas trop mal, enfin un peu moins mal que les autres. Faire parler un expert n’est pas forcément une question démocratique. Il ne s’agit pas d’accorder 50 % de temps à ceux qui sont pour et 50 % de temps à ceux qui sont contre : cela reviendrait à dévoyer les données scientifiques qui existent, qui ne sont pas aussi paritaires. Cela dit, le comité en lui-même n’avait pas de stratégie de communication.
M. le président Jean-Christophe Lagarde. Est-ce que vous pensez pertinent que les avis du comité ne soient pas rendus publics ? Vous avez dit que le vaccin était évidemment la meilleure protection contre une pandémie grippale ou contre les maladies infectieuses. Mais le comité a-t-il émis un avis sur le fait que le vaccin arrivant en pleine pandémie ou après la pandémie, la stratégie vaccinale ne pouvait rester la même ? Dernière question : n’avez-vous jamais été consulté sur le choix du recours à des centres de vaccination ?
M. Jean-Claude Manuguerra. Les avis du comité n’étaient pas publics conformément à son règlement intérieur : c’est sa ligne de conduite et notre conception du devoir de réserve. Nos avis concernaient les vaccins : ces avis, strictement médicaux et scientifiques, étaient relayés par des instances qui les rendaient in fine publics. Il ne s’agissait donc pas in fine de l’avis du comité, mais ils reflétaient néanmoins largement l’avis du comité. L’absence de publicité nous a effectivement un peu gênés. Nous pouvions comprendre que les décisions ne soient finalement pas conformes à ce que nous recommandions, mais une publicité des avis nous aurait permis effectivement d’être un peu plus lisibles. Nous avions en réalité un peu « le nez dans le guidon » et avons peut-être évacué rapidement ces états d’âme. Ce n’était en tout cas pas le moment de faire évoluer les choses.
M. le rapporteur. Le retour d’expérience ne va-t-il pas vous entraîner, en tant que président de ce comité, à revoir votre règlement intérieur, vos statuts ?
M. Jean-Claude Manuguerra. Nous sommes rattachés à la direction générale de la santé et c’est à elle que nous rendons in fine nos avis. Je ne me fais pas beaucoup d’illusions sur l’avenir du Comité de lutte contre la grippe en son état actuel. Il est question de l’intégrer au Haut conseil de la santé publique. Il est clair qu’il faudra le revoir.
Sur le fond, quand arrive une pandémie, le vaccin est-il toujours utile ? En fait, il y a deux façons d’envisager l’apport du vaccin : un aspect collectif et un aspect individuel. Sur le premier, ces modèles montrent – et pas uniquement le modèle français – que si l’on vaccine notamment les populations jeunes et les enfants avant l’arrivée de la pandémie, on peut diminuer l’impact de cette pandémie en termes de circulation de son intensité et en termes de mortalité si celle-ci est élevée, avec un effet sur la santé mais aussi un effet socio-économique. Il est clair que si le premier objectif, la première approche, qui est d’éviter la pandémie, de diminuer son impact en termes de circulation de son intensité et en termes de circulation, n’est plus réalisable parce que la pandémie est là, il ne reste que l’intérêt purement personnel. Même après le pic de l’épidémie, des personnes continueront de rencontrer le virus, même si cela est de moins en moins probable, et il y aura toujours des gens qui auront un intérêt individuel à la vaccination. C’est la raison pour laquelle après le pic et la décroissance qui a véritablement eu lieu au début de l’année 2010, en janvier, nous étions toujours favorables à une vaccination pour ceux qui le souhaitaient. Nous faisons des recommandations, et sur la base d’une balance entre bénéfices et risques, le comité juge que tant que le virus circule, il peut y avoir un bénéfice individuel à la vaccination.
M. le président Jean-Christophe Lagarde. Ce que vous êtes en train de dire pourrait signifier qu’avant la pandémie, il y a un intérêt collectif à être vacciné et une fois que la pandémie est déclarée, il n’y a plus qu’un intérêt individuel, ce qui signifie qu’une fois la pandémie déclarée la vaccination de masse n’a plus d’intérêt…
M. Jean-Claude Manuguerra. Oui, mais l’intérêt individuel est tout de même important. La mise en œuvre de la vaccination prépandémique doit avoir lieu avant la pandémie, soit trente jours avant son arrivée. C’est un point sur lequel nous avons beaucoup travaillé pour le virus H5N1. Le comité a toujours été opposé à la vaccination obligatoire. En revanche, il a toujours été favorable au fait de proposer la vaccination à chaque individu. Pour nous, l’intérêt individuel est très important et est un élément à prendre en compte pour la santé de la population qui s’établit à 63 millions d’habitants en France, il faut en tenir compte. Je raisonne ici en termes de vaccinations à opérer et non pas en doses vaccinales, puisque le nombre de doses vaccinales dépend de la préparation vaccinale.
M. le président Jean-Christophe Lagarde. Combien de doses de vaccins auraient-elles été nécessaires pour vacciner toute la population ? Nous avons reçu à ce sujet de nombreux avis différents, et le comité a émis un avis sur le sujet. Quelle proportion de la population faut-il vacciner pour avoir un effet sur une pandémie ?
M. Jean-Claude Manuguerra. Il est sûr que vous avez entendu différentes choses, parce que tout dépend de la façon dont on pose la question, des paramètres et de l’objectif recherché. Nous voulions que la vaccination soit proposée à tout le monde, mais mises à part les deux populations cibles dont je vous ai parlé, – les personnes de premiers secours, les personnes utiles à la société d’une part, les enfants âgés de six mois à dix-huit ans d’autre part – , nous n’avions au départ, et notamment lorsque se sont posées les questions de stratégie vaccinale, pas d’idées claires de ce que devrait être la population « cible » entre six mois et soixante-cinq ans, c’est-à-dire pratiquement l’essentiel de la population. La situation était très différente de la grippe saisonnière, pour laquelle nous avons bien établi quelles étaient les populations à risque, et sur lesquelles il faut faire porter l’effort, soit 20 % de la population. Nous n’avions pas déterminé de population à risque identifiée aux mois de mai et de juin 2009.
Pour répondre en un mot à la question portant sur les centres de vaccinations : non, nous n’avons pas été consultés sur leur mise en place. Je voudrais ici insister sur le fait que certaines orientations globales de la cellule puis du comité n’ont pas été reprises. Dans le plan recommandé par les experts que nous avons remis le 27 juin, – qui était notre dernier plan avant sa ré-écriture pour sa mise en œuvre administrative – le recours aux médecins généralistes en médecine ambulatoire était la pierre angulaire. Le passage par les centres 15 est une décision qui n’a rien à voir, et qui va même à l’encontre de ce que le comité ou la cellule souhaitait. Je dois aussi dire qu’autant – jusqu’à l’avant dernière version de notre plan – nous avions un système assez proche de ce qui existe aux États-Unis, avec un ministère de la santé leader sauf pour les aspects liés à la sécurité pour lesquels le ministère de l’intérieur prenait le relais, autant avec le nouveau plan grippal, tel qu’il a été mis en œuvre depuis le début, le pilotage du plan était dévolu au ministère de l’intérieur et à certaines agences. Nous n’avions donc plus notre mot à dire. Le comité n’a d’ailleurs pas posé de question sur cet aspect logistique.
M. Gérard Bapt. Monsieur Jean-Claude Manuguerra, je vous connais, puisque nous nous sommes rencontrés lors d’une réunion sur l’expertise il y a quelques années et vous êtes un professionnel reconnu pour sa compétence, son travail et son dévouement, notamment à l’Institut Pasteur. Je souhaiterais poursuivre les questions du rapporteur et du président. J’ai été un peu choqué que le Gouvernement ait fixé la composition du comité sans demander systématiquement leurs intérêts. Il semble qu’il ait évolué maintenant, mais cela devrait être, me semble-t-il, systématique ; cela éviterait notamment que ces intérêts paraissent en première page de journaux de grande presse, dans des conditions très désagréables.
Je n’accuse pas la presse. Simplement, quand un soupçon existe, la presse se pose des questions. Je crois qu’il vaut mieux clarifier les choses et qu’il y a là matière à recommandation, si le rapporteur en est d’accord. Par ailleurs, je ne vois pas pourquoi les avis du haut conseil sont accessibles sur son site, et pourquoi les avis du comité ne sont quant à eux pas publiés. Néanmoins, en les demandant, on finit, au cas par cas, par les obtenir. Je suis étonné que le président et le rapporteur n’aient pas tous ces documents-là. Les comptes rendus des réunions interministérielles ont-ils été obtenus ?
M. le rapporteur. Oui. Ils seront mentionnés dans le rapport.
M. Gérard Bapt. Dans un grand quotidien, un ancien directeur de la santé a estimé que ce qui avait pêché au fond, c’était le débat. Il n’était pas ouvert sur la société, notamment sur des disciplines différentes. Je suis ainsi frappé que, dans votre comité qui agit par consensus, qui constitue une sorte de collectif d’intellectuels homogène, il n’y ait pas de sociologues, d’anthropologues… Or le consensus, à un certain moment, empêche toute remise en question. Ne pensez-vous pas aussi que la composition du comité pourrait être élargie ? En matière de stratégie vaccinale, vous avez dit tout à l’heure que, dans l’urgence, vous aviez en quelque sorte fait du « copier-coller » à partir des recommandations qui avaient été faites précédemment pour faire face à une éventuelle pandémie H5N1. On trouve cela dans le compte rendu de la réunion du 18 décembre 2008 où effectivement sont proposées l’acquisition mais aussi la constitution de stocks, ce qui m’a beaucoup étonné. Il était recommandé la constitution de stocks pour faire face à une pandémie aviaire, mais qui n’est jamais devenue humaine. J’avoue que j’ai été un peu surpris par cette stratégie barrière se traduisant par le stockage de quelques centaines de milliers de doses de vaccins pré-pandémique à l’Établissement de préparation et de réponse aux urgences sanitaires à l’heure actuelle. Cela me paraît peu soucieux des réalités budgétaires et logistiques. L’ÉPRUS doit-il, en effet, constituer ainsi des stocks pour chacun des virus susceptibles de déboucher sur une pandémie ? Lors de la réunion du 10 mai 2009, – vous n’êtes pas présent parce que vous êtes au Mexique, mais vous avez dit que vous étiez tout à fait d’accord – , le comité fait une recommandation – à la suite d’une saisine du directeur général de la santé en date du 8 mai. Dès le 11 mai, le directeur général de la santé écrit à la ministre pour proposer les acquisitions de vaccins. On monte ainsi dans le train d’une stratégie vaccinale, qui va se fracasser le 4 janvier 2010. Ne peut-on aujourd’hui se poser la question de l’efficacité, que vous avez jugée la plus payante, de la vaccination « stratégie barrière », puisqu’il y des pays du Sud où il n’y avait pas de vaccins et où la pandémie est passée, et des pays du Nord, où l’on n’a pas vacciné, comme la Pologne qui a refusé, où l’on a peu vacciné comme ici, ou encore où l’on a beaucoup vacciné comme la Suède.
M. le président Jean-Christophe Lagarde. Je crains que M. Jean-Claude Manuguerra soit quelqu’un qui sache faire des réponses développées… Mais il va essayer de ne pas les développer à l’excès.
M. Jean-Claude Manuguerra. En ce qui concerne les déclarations d’intérêts, je suis tout à fait d’accord mais c’est une question à gérer par l’administration. Je suis incompétent pour le faire et ce n’est pas mon rôle. C’est une question administrative qui est certainement très importante, mais qui excède mes missions. Je suis toutefois d’accord, et vous pourrez éventuellement vous reporter sur ces questions aux réponses que j’ai faites à la commission d’enquête du Sénat.
S’agissant du caractère public des avis, j’en ai déjà parlé. Il y a certainement une partie du travail qu’il peut être difficile de rendre publique. Ce sont notamment les éléments retraçant l’état d’avancement des travaux des firmes pharmaceutiques, puisque nous disposons des informations confidentielles avant que les dossiers ne soient déposés et rendus publics par l’Agence européenne du médicament. Le comité ne saurait divulguer des informations relevant du secret industriel ou des avis extrêmement négatifs sur telle ou telle préparation. Il faut éviter que la transparence ne conduise à une non-présentation de résultats par les firmes.
En ce qui concerne la composition du comité, effectivement, je pense qu’il y a une place pour la discussion des avis médicaux et scientifiques de lutte contre la grippe par d’autres experts, d’autres instances. On peut imaginer par exemple que les avis soient revus par des des sociologues, des anthropologues. Mais je pense que cela doit se faire en dehors du comité. Il ne faut pas être trop nombreux et tout mélanger. On pourrait imaginer une réunion du comité avec la « société civile », comme on aime dire, des citoyens, et d’autres experts qui seraient là éventuellement pour discuter nos avis scientifiques et médicaux.
Monsieur Gérard Bapt, vous avez employé l’expression « copier-coller ». C’est un peu sévère, mais, bien sûr, nous étions sous pression lors de la réunion du 10 mai. Nous nous étions réunis déjà le week-end précédent et, à mon départ pour le Mexique, j’avais souhaité qu’une réunion soit organisée la semaine même de manière à ce que l’on puisse laisser trois jours de repos à notre comité, sachant que, par ailleurs, les membres étaient largement occupés, notamment en laboratoire comme moi. Effectivement, il y a eu une saisine le vendredi 8 mai, suivi d’une réunion le 10 mai pour en discuter. C’est un peu regrettable. Je pense que nous aurions pu attendre un peu, mais les pressions, extérieures au comité, étaient fortes… J’attire toutefois même votre attention sur le fait que dans le compte rendu de la réunion suivante, qui s’est tenue deux jours après, le 12 mai, le comité rappelle qu’au total, parce qu’il était assez inconfortable d’avoir discuté de cela d’une manière aussi rapide, il est proposé d’attendre le retour interministériel de la note du ministère de la santé pour effectuer une nouvelle reformulation des recommandations émises le 10 mai par le comité en fonction des informations disponibles. Mais nous n’avons jamais eu à procéder à cette reformulation sur la stratégie vaccinale et l’acquisition de doses. Je vous propose donc de vous reporter au compte rendu de la réunion du 12 mai. Vous y verrez qu’effectivement nous revenons sur le premier avis temporaire et pris sous pression. J’ai ainsi appris que nous devons probablement résister aux demandes de réponse dans des temps déraisonnables. Nous avons été mis dans une situation extrêmement inconfortable. La leçon doit être méditée.
Vous avez fait allusion, monsieur Gérard Bapt, aux stocks proposés dans le rapport de décembre 2008 destinés à faire face à la grippe aviaire H5N1. Je vous signale que, aujourd’hui, on critique beaucoup, mais que pendant très longtemps, la France a été présentée dans des journaux prestigieux comme The Lancet comme l’un des pays les mieux préparés au monde, celui qui faisait le plus d’efforts dans la préparation et la lutte contre la grippe, et une grippe ayant un taux de létalité de 60 %, taux proche du taux de létalité lié au virus d’Ébola, un Ébola qui peut débarquer sur notre territoire et ravager la population. Il faut se souvenir du traumatisme historique qu’a été la grippe espagnole, et notre comité a peut-être été trop sensible à cela.
M. Guy Lefrand. Nous ne l’avons pas tous vécu !
M. Jean-Claude Manuguerra. C’est pour cela que je dis « historique ». Moi non plus je ne l’ai pas vécu… Ceci dit, une affection avec une létalité de 60 %, c’est considérable, Cela serait catastrophique si nous n’étions pas bien préparés. Je préfère que l’on dépense de l’argent pour constituer des stocks qui peuvent être d’ailleurs des achats virtuels de stocks non livrés, bien qu’il s’agisse là de techniques qui ne concernent pas notre comité, pour épargner des vies. Je préfère être dans les chaussures de quelqu’un qui en fait trop pour essayer d’épargner des vies que dans celles de quelqu’un qui n’en fait pas assez. La santé est un atout fondamental pour un pays qui est une grande puissance mondiale et qui peut se l’offrir, ce qui n’est pas le cas de tous les pays. Dans aucun pays, le vaccin n’est arrivé assez tôt pour mener à bien une stratégie pré-pandémique, c’est-à-dire une stratégie de couverture suffisante de la population dans un temps suffisamment avancé pour éviter le développement de la pandémie. Effectivement, la différence en termes de passage de l’épidémie n’a pas été flagrante entre les pays qui ont une bonne couverte vaccinale, comme certains pays scandinaves, et d’autres qui ont eu, malgré leurs efforts, comme la France, une couverture vaccinale plutôt médiocre. Je pense en outre que pour les comparaisons, on ne peut retenir des pays ne disposant pas de système de surveillance aussi pointu et n’ayant pas vacciné ou pris des mesures contre les pandémies grippales. Ce ne sont pas forcément des modèles à suivre. Ils ont agi par défaut plutôt que par choix.
Un député. Ce n’est pas le cas de l’Australie…
M. Jean-Claude Manuguerra. Non, mais l’Australie n’a pas une population énorme et nous étions en début de circulation du virus.
Mme Catherine Lemorton. Quelle est la différence entre un virologue et un virologiste ?
M. Jean-Claude Manuguerra. Aucune ! On peut utiliser les deux termes ; je préfère « virologiste » pour ce qui me concerne, car n’étant pas médecin, mais vétérinaire, je ne voudrais pas passer pour un spécialiste de virologie humaine. Mais les deux termes figurent dans le dictionnaire.
Mme Catherine Lemorton. Merci. S’agissant du comité, la moitié de ses dix-sept membres est composée de membres de droit, issus notamment des agences sanitaires. Que celles-ci participent au consensus que vous décrivez ne nous étonne pas, puisqu’elles travaillaient avec la cellule interministérielle de crise, et donc suivaient tout ce qui disait le Gouvernement. Ces membres de droit ne pouvaient donc pas avoir un avis divergent au sein de votre comité. Ceci est ma première remarque. Deuxième remarque, l’autre moitié est composée de « membres qualifiés » : qui sont-ils ? Vous avez parlé spontanément de conflits d’intérêts, mais vous n’avez pas réglé les questions que l’on se pose. Avez-vous émis un seul avis, à un moment donné – puisque vous fournissiez un avis tous les cinq jours – qui n’allait pas dans le sens du plan gouvernemental et que certains d’entre nous, dans cette commission, jugent un peu parfois « rigide » ; dans ce cas, avez-vous été entendus ou écoutés ? Ensuite, puisque vous êtes virologiste, qu’avez-vous pensé de l’injonction faite aux médecins au début du mois de décembre de prescrire du Tamiflu à titre préventif ? Autant je peux comprendre que, dans l’hémisphère Sud, le Tamiflu avait pu éviter des complications pour des gens atteints par le virus, autant son intérêt « préventif » m’échappe en tant que professionnelle de la santé.
La dernière question sera très claire et vous pourrez me répondre par oui ou non. Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports, ayant décidé de commander 94 millions d’unités vaccinales en juillet – sur la base de deux injections par personne –, pensez-vous que compte tenu de l’organisation décidée, reposant sur des centres de vaccination qui ont écarté les professionnels de santé libéraux, pourtant capables de vacciner, il était possible de vacciner deux fois 47 millions de personnes en quelques mois ?
M. Jean-Claude Manuguerra. Vous dites que la moitié des membres du Comité de lutte contre la grippe sont des membres de droit, et que certains sont des employés d’agences dont les directeurs généraux sont nommés par le pouvoir politique… Dont acte. Ceci dit, connaissant personnellement les membres de mon comité depuis longtemps, je peux vous dire que ce sont des personnes qui ont fait valoir leur opinion de manière complètement indépendante de la direction générale de la santé, et je garantis l’intégrité de mes camarades du comité. La question est légitime mais en ce qui me concerne, je m’estime indépendant du pouvoir politique. J’ai fait remarquer d’ailleurs à d’autres moments, lorsque j’étais président de la cellule avant qu’elle ne soit officialisée, que si un jour je ne convenais pas à cause de mes décisions, on pouvait nommer quelqu’un d’autre…
M. Jean Mallot. Si on peut vous congédier parce que les décisions que vous prenez ne conviennent pas, c’est donc que vous n’êtes pas indépendant… Si l’on est indépendant, on « taille sa route »…
M. Jean-Claude Manuguerra. Oui, mais cela n’influence absolument pas la conduite que l’on tient. Je ne connais pas du tout l’appartenance politique des différents membres du comité ; la composition du comité n’est pas la marque d’une inféodation au pouvoir politique actuel.
M. le président Jean-Christophe Lagarde. Là n’est pas la question. La nomination de membres de droit rend par nature les personnes dépendantes du pouvoir et du Gouvernement en place. Vous disiez vous-même que les déclarations d’intérêts étaient peut-être à envisager, même si l’on peut noter qu’en l’espèce – vous l’avez laissé entendre – des responsables d’agences membres du comité, qui dépendent totalement du Gouvernement, ont pu émettre des avis qui ne correspondaient pas forcement à ceux de ce dernier.
M. Jean-Claude Manuguerra. Des avis ont-ils été émis contre le plan gouvernemental ? J’ai dit tout à l’heure en préambule que le plan était une « boîte à outils ». Nous avons participé à un certain nombre d’exercices de déroulement du plan en fonction de scénarios, et nous avons relevé, notamment dans un des exercices, – ce qui a d’ailleurs été pris en compte par les autorités sanitaires –, son aspect un peu « mécanique ». Nous avions dit qu’il faudrait certainement faire preuve, dans l’application du plan, d’un peu de souplesse afin d’éviter des situations caricaturales. Avons-nous alors émis des avis contre la stratégie du Gouvernement ? Cela me gêne un peu quand on me parle du « Gouvernement »…
Mme Catherine Lemorton. Contre la décision politique prise, si vous préférez.
M. Jean-Claude Manuguerra. Je suis dans la cellule depuis 1995. Nous avons travaillé avec une administration constamment attentive, quel que soit par ailleurs le pouvoir politique en place. Je préfère donc que l’on parle « d’autorités sanitaires », ou de « décideurs sanitaires ».
Mme Catherine Lemorton. Ce n’est pas pareil.
M. Jean-Claude Manuguerra. En fait, nous n’avons pas à prendre de décisions « pour » ou « contre ». Nous avons effectivement quelquefois émis des avis qui n’ont pas été suivis dans les faits, du moins immédiatement. C’est notamment le cas à propos du rôle de la médecine ambulatoire, par exemple. Mais cela s’explique par des raisons logistiques sur lesquelles nous n’avions pas du tout de prise et de moyens d’action, ni même de compétences.
Concernant la prise par les patients de Tamiflu pour prévenir les effets graves et imprévisibles de la grippe, nous avons indiqué au mois d’octobre que ces effets graves apparaissaient dans 20 % des cas chez des personnes qui n’avaient pas de facteurs de risque, et qu’une fois la maladie déclarée, on avait du mal à l’enrayer et que cela se terminait souvent très mal. Nous avons donc recommandé, sur la base des données disponibles, notamment françaises, mais pas seulement, d’appliquer un traitement précoce à toutes les personnes atteintes pour éviter les cas graves. Plus l’on frappe fort et tôt, plus l’on a de chances de succès. Je rappelle que le virus est resté sensible au Tamiflu et au Zanamivir et que l’utilisation préventive du Tamiflu figure dans son autorisation de mise sur le marché, qui doit dater de 2001 pour l’Europe. Le Tamiflu fait partie d’une « prophylaxie saisonnière » qui dure six semaines.
Mme Catherine Lemorton. Je vous renvoie à l’avis de la Haute Autorité de santé d’octobre 2009.
M. Jean-Claude Manuguerra. Les avis de la Haute Autorité de santé sont une chose, l’autorisation de mise sur le marché en est une autre. Il y a eu une autorisation de mise sur le marché. L’application, le remboursement et la prise en charge sont une autre affaire. Nous avons, pour ce qui nous concerne, toujours été réticents à la prophylaxie saisonnière sur six semaines, parce que c’est lors de la prophylaxie sur dix jours, au lieu de cinq jours, à demi-doses, que l’on voit apparaître des résistances…
M. Gérard Bapt. Et qu’en est-il des effets secondaires ?
M. Jean-Claude Manuguerra. Ils existent, mais sont extrêmement très faibles.
Mme Catherine Lemorton. Des effets psychiatriques, ce n’est quand même pas secondaire.
M. Jean-Claude Manuguerra. Les effets psychiatriques ne sont pas imputés et pas démontrés. Vous pensez sans doute au Japon, mais il n’est pas démontré que le Tamiflu est en cause et j’observe que malgré le nombre de doses injectées dans le monde, nous n’avons pas relevé d’effets secondaires graves. Quand une personne n’a pas de facteurs de risques et, à six ou vingt-quatre ans, meurt d’une grippe fulgurante parce qu’elle n’a pas bénéficié du Tamiflu, il y a problème. Ne peut-on alors accepter des nausées ou des vomissements ? Cela étant, le comité était réticent à l’utilisation du Tamiflu ou du Zanamivir en prophylaxie saisonnière sur six semaines, car elle favorise l’apparition de résistances. Ce que nous avons dit, c’est qu’en présence d’un patient à risque, qui ne pouvait pas bénéficier de la vaccination, ou qui n’avait pas encore été vacciné, ou qui ne pouvait pas bénéficier d’un traitement, notamment les enfants de moins de six mois, un traitement ultra-précoce avant l’apparition des symptômes était envisageable. Il s’agit d’une prophylaxie extrêmement ciblée.
En ce qui concerne le nombre d’injections, lorsque celui-ci a été décidé par l’Agence européenne du médicament, – sur laquelle le comité n’a aucun moyen de pression –, j’avais souhaité que l’on discute beaucoup plus de l’option retenue, sachant que le virus A(H1N1) n’est pas aussi différent des virus saisonniers que ne l’est le virus A(H5N1). D’emblée, et a priori, c’est un schéma vaccinal à deux doses qui a été choisi. Sur ce sujet, nous pouvions discuter, mais il y avait là une certaine cohérence. Comme on le fait pour le vaccin saisonnier en Europe – et ce n’est pas le cas aux États-Unis – toutes les données d’efficacité, de tolérance et de sécurité ont été étudiées dans le dossier maquette. Le vaccin ne différait des vaccins maquettes que par l’antigène. Il s’agissait là de montrer spécifiquement l’efficacité biologique – évidemment, pas sur le terrain –, du vaccin par la séroconversion et la montée des anticorps.
Après, il y a eu le temps de la décision de la fabrication du vaccin, du développement des lots industriels et de la conduite des essais. Les premiers essais qui ont été mis sur place par les différents laboratoires pharmaceutiques pour vérifier l’efficacité du vaccin du point de vue biologique datent de fin août, mi-septembre. Les premiers résultats sont tombés début octobre. Dès que les résultats ont été connus, le schéma à deux doses a été rediscuté, parce qu’après une dose, notamment avec le vaccin adjuvanté, la réponse était en général excellente. Nous avons donc proposé, et cela a été l’objet de discussions, de passer de deux doses à une dose pour l’ensemble de la population au lieu de réserver cette stratégie aux plus de soixante ans par exemple. Nous n’avons donc pas changé d’avis comme de chemise, mais nous avons adapté nos avis aux données scientifiques et techniques qui sont apparues au cours du temps.
Mme Catherine Lemorton. Ce n’est pas la question que je vous ai posée ! Pensez-vous aujourd’hui qu’en excluant la médecine ambulatoire, il était raisonnable – parce que nous, dès juillet 2009, nous nous sommes posés la question lorsque nous avons appris le nombre de vaccins commandés – de vouloir vacciner 47 millions de Français ? D’ailleurs pourquoi pas 45, pourquoi pas 43 millions ? On ne sait pas pourquoi cela a été décidé et comment. Pensez-vous qu’avec le plan qui a été mis en place, il était envisageable de vacciner 47 millions de personnes en quelques mois, uniquement dans des centres de vaccination ?
M. Gérard Bapt. Vous aviez fait des recommandations pour des achats de doses… Quand on a prôné une seule injection, avez-vous émis des recommandations pour dire qu’il fallait renégocier tout de suite les contrats ?
M. Jean-Claude Manuguerra. Nous n’avons pas recommandé un nombre de doses particulier ! Nous avons discuté – reportez-vous au compte-rendu du 10 mai – et nous avons insisté sur les personnes à vacciner en priorité : les professionnels de premiers secours et les enfants de six mois à dix-huit ans. Pour les autres, nous proposions une acquisition progressive des stocks en fonction des données épidémiologiques, et nous disions dans la réunion, deux jours plus tard, du 12 mai, que nous souhaitions y revenir. Mais nous n’avons jamais eu de retour, nous n’en avons jamais rediscuté. Nous n’avons pas non plus suggéré de commandes.
Était-il possible de vacciner en quelques mois ? Nous avions de gros doutes sur les livraisons de vaccins. C’était un peu la « course à l’échalote ». Nous avons appris très tôt, pendant l’été, en juillet-août, que les fabricants de vaccins avaient des difficultés, puisque les souches sont faites, à chaque fois, au « coup par coup ». Ce n’est pas comme pour la fièvre jaune. Certaines souches sont parfois d’un rendement très mauvais. Nous avions donc des inquiétudes sur le respect des délais par les fabricants, puisqu’ils étaient dépendants de la productivité de la souche, et nous savions que la vaccination démarrerait tard par rapport à la pandémie. J’ajoute que la circulation virale a été précoce, comme nous nous y attendions. Le pic d’épidémie a été atteint en novembre, ce qui n’est jamais le cas habituellement : il est atteint fin décembre pour les épidémies saisonnières. Effectivement, à ce moment-là, nous savions que nous n’arriverions pas à vacciner toute la population et qu’il fallait donc « prioriser » certains groupes, ceux que nous avions identifiés pendant tout l’été, comme les femmes enceintes par exemple. Vous me demandez si je pensais que l’on pouvait vacciner 47 millions de personnes en quelques mois ; je suis incompétent pour répondre à votre question. Mais en tant que citoyen, je dois vous dire que je pensais qu’à la suite des vaccinations antivarioliques, de la préparation contre le biotox, on avait acquis une certaine « gymnastique ». Cela n’a pas été le cas. C’était une gageure. C’était un défi difficile à relever.
M. le président Jean-Christophe Lagarde. La parole est à M. Jean Mallot, qui a attendu son tour…
M. Jean Mallot. Comme d’habitude ! J’ai une question plutôt de fin d’audition, c’est pour cela que j’avais souhaité intervenir le dernier.
Vous nous donnez un certain nombre d’éléments sur la manière dont les choses se sont passées pour nous aider à mieux comprendre l’articulation des différentes « parties prenantes » aux prises de décision. Notre commission a évidemment pour but de comprendre ce qui s’est passé, mais aussi de formuler des préconisations pour l’avenir. Vous disposez désormais de recul par rapport à tout ce qui s’est passé et de beaucoup d’informations. Si vous deviez dire en trois ou quatre points, pour l’avenir, ce que l’on n’a pas bien fait et ce qu’il faudrait faire autrement, quels seraient-ils ?
M. Jean-Claude Manuguerra. Vous savez, je pense que l’on en fera de toute façon soit trop, soit pas assez… Nous sommes soumis à des événements qui sont imprévisibles. On attendait une épidémie d’épizootie provenant d’Asie, d’Indonésie, et la pandémie a éclaté en Amérique du Nord. Ce qu’il faut garder en mémoire, c’est qu’au début d’une crise, on ne sait pas ce que cela va donner. Lorsque l’on néglige ces crises, on peut s’en mordre les doigts pendant longtemps. Certes il faut dépasser le côté « émotionnel » et angoissant – il y a peut-être eu des discours alarmistes, à la fois de l’Organisation mondiale de la santé et de certains responsables sanitaires – mais j’ai apporté là des journaux du Mexique, où l’on comptait le nombre de morts tous les jours… J’avais vécu la même chose pour le syndrome respiratoire aigu sévère à Hanoï. Il sera toujours difficile en début de crise de faire une évaluation du risque. Lorsqu’on pose la question : « Quel est le pourcentage de la population qu’il faut vacciner pour éviter le développement de la pandémie ? », la réponse dépend du taux de reproduction de la maladie, qui peut grandement évoluer au cours du temps. Nous serons toujours dans des situations où l’expertise sera instable, parce que les informations et les données évoluent constamment. C’est une grande difficulté. Nous essayons simplement d’être une structure de conseil et d’appui pour que la prévention soit la meilleure possible.
M. le président Jean-Christophe Lagarde. Vous venez de dire que tous les débuts de crise seront difficiles parce que remplis d’incertitude. Dans celle-ci, avez-vous eu des doutes, dans votre comité, ou des discussions sur la nature ou la qualité des informations qui provenaient du Mexique, puisqu’il semble quand même que les événements sanitaires aient été moins bien recensés que dans un territoire médicalement très structuré, comme chez nous… Au moment où l’on vous demandait de rendre des avis tous les trois ou quatre jours, l’épidémie là-bas était très amplifiée par rapport à sa réalité.
M. Jean-Claude Manuguerra. Nous connaissons le cas de la Chine qui a ignoré le syndrome respiratoire aigu sévère pendant un certain temps et qui s’en est mordu les doigts. Cela a quand même coûté le poste de ministre de la santé au maire de Pékin, qui n’est tout de même pas n’importe qui dans le système chinois. À Mexico, il existait une vraie inquiétude liée à ce virus et à une mortalité atypique – d’ailleurs aux États-Unis, la mortalité pédiatrique a été quatre fois supérieure à celle de la grippe saisonnière. La physionomie de la pandémie a d’abord fait penser à la grippe espagnole à cause de la mortalité en « W » et non en « U ». Mais il est vrai qu’il était difficile de savoir ce qui se passait vraiment au Mexique. Pendant le week-end du 1er mai, il y eut même une décroissance du nombre de décès signalés dans la ville de Mexico. Lors du debriefing du bureau de l’Organisation mondiale de la santé, qui a eu lieu le mardi ou le mercredi qui ont suivi, on se demandait si l’on avait vraiment passé le pic dans la ville de Mexico, dans le district fédéral, ou si l’on était en la présence d’un défaut de report de données à cause des jours fériés. Nous avions vraiment, face aux données qui arrivaient quotidiennement, des difficultés d’interprétation. Il est clair que nous ne comprenions pas certaines choses, mais la confirmation des cas en laboratoire était extrêmement difficile. Même dans un pays qui évolue très vite comme la Chine, il a fallu que le syndrome respiratoire aigu sévère évolue et se répande vers d’autres territoires et que l’Organisation mondiale de la santé soit saisie pour disposer d’une étiologie véritable. Je crois que le problème du début des épidémies, c’est que l’on ne sait pas très bien ce qu’elles vont devenir. Je ne suis pas sûr qu’en France nous aurions fait beaucoup mieux qu’au Mexique. En France aussi nous avons eu des difficultés méthodologiques pour compter le nombre de cas. Certains les ont découvertes à cette occasion, mais elles étaient connues depuis très longtemps.
M. le rapporteur. M. Jean-Claude Manuguerra, merci pour ce tour d’horizon complet de la situation.
Nous avons reçu l’avis du Haut conseil de la santé publique sur les vaccins à venir pour la campagne de vaccination de 2010-2011 qui comprendra deux vaccins : un vaccin trivalent, qui va inclure la souche de la grippe saisonnière, la souche A(H1N1) et la souche B, et un vaccin monovalent, uniquement pour la grippe A(H1N1). Ces deux vaccins seront disponibles en France pour la saison qui va venir, et le haut conseil recommande de vacciner les femmes enceintes, les personnes à risque, les obèses, les personnes de plus de soixante-cinq ans, les enfants, les adultes à risque et les personnels de santé. Avez-vous été consulté ? Quel est votre avis sur la vaccination grippale à venir ? Ne peut-on craindre que la population tourne le dos à la vaccination ? Le haut conseil recommande aux personnes à risque devant voyager dans l’hémisphère Sud de se faire vacciner. Avez-vous été consulté ?
M. Jean-Claude Manuguerra. J’ai présidé le groupe de travail au sein du haut conseil qui a élaboré le texte à la base de l’avis que vous mentionnez. Bien évidemment, nous avons été consultés. Mais il va falloir que l’on prenne soin de ne pas écarter le Comité de lutte contre la grippe de ces questions, puisqu’encore une fois, c’est là où nous avons les experts qui connaissent le mieux le sujet. En ce qui concerne l’avis du haut conseil, je me bornerai à noter que c’est un avis qui s’inspire largement du nôtre.
Sur le fond, il y a deux vaccins parce que nous savons que le virus de la grippe saisonnière peut être mortel pour certaines personnes. À peu près 20 % de la population sont habituellement couverts par le vaccin contre la grippe saisonnière en France. Il est essentiel pour nous que ce vaccin puisse d’abord, et en priorité, être administré à ceux qui courent les risques les plus graves. Notre crainte, c’est une vague épidémique en provenance de l’hémisphère Sud ou de grippe A(H1N1) en Europe, et une pénurie de vaccins saisonniers comme cela est arrivé certaines saisons – notamment aux États-Unis par exemple. Il s’agit d’assurer la prévention contre la grippe saisonnière par un deuxième vaccin, et non d’écouler les stocks.
M. le rapporteur. Nous allons donc être en possession de deux vaccins, l’un trivalent, l’autre monovalent. Appartiendra-t-il aux professionnels de santé et aux médecins de choisir ?
M. Jean-Claude Manuguerra. Pour les médecins, ce sera simple : ceux qui sont d’habitude protégés contre la grippe saisonnière devront être vaccinés avec le vaccin trivalent. Pour ceux qui ne le sont pas, il faudra se demander s’ils appartiennent à une catégorie à risque face au virus A(H1N1). Dans l’affirmative, s’il s’agit de femmes enceintes par exemple, le vaccin monovalent pourra être administré. Cela sera donc assez simple si l’on présente correctement cet avis du haut conseil.
M. le président Jean-Christophe Lagarde. Cela signifie-t-il que je n’aurai pas la possibilité de me faire vacciner contre la seule grippe saisonnière tout en refusant d’être vacciné contre le virus A(H1N1) ?
M. Jean-Claude Manuguerra. Encore une fois, nous avons toujours été opposés à l’obligation vaccinale. Il y a une marge entre les recommandations, qui sont souvent assorties d’éléments de prise en charge financière, et le fait de pouvoir bénéficier d’un vaccin. Le vaccin saisonnier trivalent bénéficie d’une autorisation de mise sur le marché. Le médecin peut le prescrire, mais comme il n’est pas recommandé, il ne sera pas pris en charge et il vous appartiendra de débourser les quelques neuf euros pour ce vaccin.
M. le président Jean-Christophe Lagarde. Je connais moins bien les choses que vous, mais vous semblez connaître suffisamment la politique pour parfois éluder et éviter une question. Ma question précise est : y aura-t-il un vaccin monovalent saisonnier ?
M. Jean-Claude Manuguerra. La question s’est posée : fallait-il un vaccin monovalent contre le virus A(H1N1) et un vaccin divalent contre les virus H3N2 et B ? Mais l’autorisation de mise sur le marché concerne le vaccin trivalent pour ce qui est du saisonnier. Le vaccin pandémique, avec ou sans adjuvant, a bénéficié d’une autorisation de mise sur le marché. Pour la modifier, il faudrait déposer un dossier de demande à cet effet. Donc, en attendant, il n’y aura pas de vaccin monovalent contre le virus H3N2.
M. le président Jean-Christophe Lagarde. Habituellement, le vaccin contre le virus H3N2 n’est-il pas monovalent ?
M. Jean-Claude Manuguerra. Non. Il est toujours trivalent. L’autorisation de mise sur le marché concerne un trivalent.
M. le président Jean-Chistophe Lagarde. Les laboratoires se sont-ils abstenus de produire des vaccins contre le virus de la grippe monovalents, bivalents, ou trivalents ne concernant pas le virus A(H1N1) ? Ont-ils décidé d’inclure dans la protection contre le virus H3N2 le vaccin contre la grippe A(H1N1) qu’on leur avait fait produire ?
M. Jean-Claude Manuguerra. Je ne peux pas vous répondre à la place des laboratoires.
M. le président Jean-Christophe Lagarde. … C’est une façon d’écouler les stocks…
M. Jean-Claude Manuguerra. Qu’il y ait adjuvant ou pas, l’antigène est préparé de manière indépendante. Je ne crois pas que l’on veuille écouler les stocks. Ce que l’on veut éviter, c’est une déplétion de la quantité de vaccins destinée aux personnes qui en ont besoin.
M. le président Jean-Christophe Lagarde. J’ai plutôt le sentiment qu’en fonction de la stratégie des laboratoires, vous avez préféré disposez d’un stock réservé aux gens à protéger contre la grippe saisonnière et valider une intégration automatique du vaccin contre le virus A(H1N1) dans celui contre le virus H3N2. Je ne pourrai l’an prochain me faire vacciner contre la grippe saisonnière sans être vacciné contre le virus A(H1N1). Cela me semble légèrement attentatoire à ma liberté de choix.
M. Jean-Claude Manuguerra. Il n’y a pas d’autre possibilité. Le vaccin saisonnier est un vaccin trivalent. La réponse de l’Organisation mondiale de la santé au mois de février ne porte pas sur la bivalence ou la trivalence et ce n’est pas au comité de se prononcer sur la composition du vaccin. L’Organisation mondiale de la santé a simplement dit que si l’on voulait vacciner contre le virus H1N1, il fallait que ce soit contre le virus A(H1N1) pandémique.
M. le président Jean-Christophe Lagarde. Je vous remercie.
La séance est levée à vingt heures neuf.
Audition de M. Atanase Périfan,
président de l’association Voisins solidaires
(Procès-verbal de la séance du mercredi 2 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à vingt heures neuf.
(M. Atanase Périfan prête serment.)
M. Atanase Périfan, président de l’association Voisins solidaires. Permettez-moi de me présenter : je suis maire-adjoint du 17ème arrondissement de Paris, je préside la Fédération européenne des solidarités de proximité et j’ai créé la Fête des voisins qui existe dans trente-trois pays et concerne dix millions de participants, dont six millions en France avec mille trois cents mairies partenaires. C’est dans le cadre de la Fête des voisins que nous avons créé, il y a un an, le projet Voisins solidaires. Notre but est de développer des services de proximité en complément de la solidarité institutionnelle et de la solidarité familiale.
La grippe A(H1N1) a constitué pour nous une formidable opportunité pour démontrer tout l’intérêt qu’il y a à entretenir de bonnes relations de voisinage. Nous avons donc proposé, au mois de juillet dernier, à Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports, la mise en place d’un « pack pandémie », validé par le service d’information du Gouvernement dans le cadre de la cellule interministérielle de crise et agréé par le Gouvernement. Deux cent soixante-quatorze mairies et bailleurs sociaux se sont inscrits pour bénéficier de ce pack, qui a par ailleurs été exporté dans cinq pays de l’Union européenne et au Canada.
Le « pack pandémie » consiste en une affiche à apposer dans les halls d’immeuble, un tract incitant à s’organiser entre voisins, pour mettre en œuvre un plan de continuité de la vie sociale et quotidienne à l’instar des plans de continuité de services ou d’activité, un panneau des voisins pour recenser les besoins nouveaux liés à la grippe A(H1N1) et voir comment s’entraider, un miniguide et un annuaire des voisins, qui aurait pu s’intituler « Gardons le contact en évitant les contacts ».
J’en termine en rappelant les autres actions proposées par notre association, L’été des voisins et Le Noël des voisins. Toutes ces actions suivent la même philosophie : nous sommes « formatés » pour être consommateurs et spectateurs ; il ne font donc pas s’étonner que les administrés soient relativement passifs. Nous visons à réinscrire les citoyens dans une logique positive d’action. Nous vivons dans une société assez individualiste, de repli sur soi alors qu’existent des gisements de générosité. La grippe A(H1N1) a été moins grave que prévu, mais a constitué un excellent moyen de tester les dispositifs que nous avons mis en œuvre. Nous avons pu constater que les citoyens étaient prêts à agir et que les mairies étaient intéressées, ce qui nous a incités à aller plus loin en créant un réseau de veille et de mobilisation solidaire. Il s’agit de mettre un plan de mobilisation de la société civile en cas de crise, qu’elle soit sanitaire, naturelle ou autre, en s’appuyant sur les acteurs institutionnels, les mairies, les bailleurs, les entreprises pour financer les projets car nous ne recourons pas aux subventions, et les médias.
Je suis convaincu que les gens sont prêts à se mettre en mouvement et heureux de se rendre utiles, ce qui a été un peu oublié dans la gestion de la crise de la grippe A(H1N1). Les médias s’inscrivent d’ailleurs dans une logique positive : on a compté ainsi près de deux cent cinquante reportages télévisés et diffusés à la radio sur la Fête des voisins.
M. le président Jean-Christophe Lagarde. Pouvez-vous nous dire comment a été financé le « pack pandémie » ?
M. Atanase Périfan. L’association Voisins solidaires recourt à un certain nombre de partenaires, comme Carrefour ou la Caisse des dépôts et consignations. Je consacre beaucoup de temps à solliciter des chefs d’entreprise, pour le financement bien sûr mais aussi pour relayer nos actions. Ainsi, cet hiver, près de cinq mille personnes sont décédées en raison du froid, car elles ne sortaient pas de chez elles et arrivaient en état de dénutrition dans les services d’urgence. Nous avons souhaité une mobilisation des entreprises : Carrefour nous a ouvert ses magasins pour que nous y apposions nos affiches. La fondation Novartis, avec qui nous sommes partenaires depuis plus de deux ans, a été exclue de l’opération « pack pandémie », pour des raisons qui sont faciles à imaginer.
M. le président Jean-Christophe Lagarde. Cette opération n’avait de toute façon pas de lien avec la vaccination. Je m’adresse maintenant au maire-adjoint que vous êtes : avez-vous prévu une opération similaire pour d’éventuelles crues de la Seine qui pourraient avoir des impacts importants sur les activités dans la capitale ?
M. Atanase Périfan. Non, mais c’est une excellente suggestion dont je prends note.
M. Jean-Pierre Door, rapporteur. Je tiens à saluer l’action de votre association, qui présente des similarités avec des dispositifs à l’étranger, comme à Hong Kong où existent des réseaux solidaires qui ont été très efficaces lorsque le trafic aérien a été interrompu, pour héberger des personnes en attente.
Êtes-vous intervenus lors de l’épisode de canicule de l’année 2003, au cours duquel il avait été regretté que n’existent pas de tels réseaux de solidarité ? S’agissant de la pandémie de grippe, en avez-vous ressenti l’impact et avez-vous mené une évaluation ?
M. Atanase Périfan. Concernant la canicule, la Fête des voisins a été créé en 2000, suite à la découverte tardive du décès d’une dame âgée dans son appartement qui m’a laissé penser que bien des détresses se cachaient derrière l’épaisseur des murs de nos immeubles. Le problème aujourd’hui est celui de la relation à l’autre, difficile et qu’il nous faut encourager. En 2003, le réseau n’existait pas puisque Voisins solidaires a été créé en 2009. Mais désormais, dans le cadre du plan « L’été des voisins », nous menons une action complémentaire de celle menée par les communes avec les plans « canicule », et d’une manière générale, nous préparons la mobilisation en cas de survenue d’une crise. Nous menons une pédagogie de la solidarité, qui nécessite de débuter par des démarches très simples, comme le simple fait de se dire bonjour entre voisins ou de se rendre de petits services.
Pour ce qui concerne l’évaluation, nous avons constaté 14 000 téléchargements depuis notre site internet ; nous avons travaillé avec deux cent soixante-quatorze mairies et bailleurs sociaux en France et une centaine de villes étrangères. Cette crise a constitué un test qui nous a permis de constater que les réactions étaient positives et que les personnes impliquées, ces « héros du civisme ordinaire », étaient en quête de sens et de reconnaissance. Je le répète : il existe des gisements de générosité qu’il est de l’intérêt de la société d’exploiter. C’est pour cela que j’ai souhaité être auditionné par votre commission d’enquête ; je consacre un temps important à frapper ainsi aux portes des institutions.
M. le rapporteur. Avez-vous mis en place une cellule de veille sur internet pour répondre aux inquiétudes qui ont pu être manifestées ?
M. Atanase Périfan. Nous avons testé, sur notre site internet, un outil d’information des particuliers, renvoyant à des sites officiels des autorités sanitaires pour ce qui concerne les questions purement médicales. Nous avons reçu environ trois mille demandes ou questions, telle celle-ci : « Est-ce que je risque d’attraper la grippe si j’apporte à manger à la vieille dame qui refuse de sortir de chez elle ? ». On a constaté à cette occasion que près de 80 % des questions portaient sur les freins supposés aux actions : avaient-on le droit d’aller voir des personnes malades ? Pouvaient-on, étant malade, faire état de ses besoins sans être stigmatisé ? Il est difficile de commencer une relation de voisinage en affichant ses besoins ; en revanche, une offre de service permet de nouer des liens qui permettent, plus tard, de détecter les personnes en difficulté qui ont besoin d’aide.
Mme Catherine Lemorton. Je souhaiterais que l’on en revienne au champ d’investigation de notre commission d’enquête, à savoir la campagne de vaccination dont nous nous sommes un peu éloignés. Avez-vous été sollicités pour accompagner des personnes dans les centres de vaccination ?
M. Atanase Périfan. Oui, cela a représenté environ la moitié des services mis en place dans le cadre de cette opération, l’autre moitié ayant été consacrée à la garde d’enfants dont les écoles avaient été fermées.
M. le président Jean-Christophe Lagarde. Je vous remercie.
La séance est levée à vingt heures trente.
Audition de M. Pierre Boissier,
chef de l’Inspection générale des affaires sociales (IGAS)
(Procès-verbal de la séance du mercredi 9 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt-cinq.
(M. Pierre Boissier prête serment.)
M. le président Jean-Christophe Lagarde. Pourriez-vous nous exposer le rôle joué par l’Inspection générale des affaires sociales tout au long de la campagne de vaccination ?
M. Pierre Boissier. Nous avons été relativement peu impliqués dans le dispositif, qui était essentiellement opérationnel alors que notre rôle est avant tout un rôle de contrôle ex post. Cependant, nous avons mis deux personnes à la disposition de la direction générale de la santé pour renforcer les équipes en début de campagne, et un de nos inspecteurs généraux a assuré l’intérim du directeur départemental de l’action sanitaire et sociale de Paris dans la deuxième partie de la campagne, mais sous la responsabilité du ministère et non de l’IGAS.
Nous avons rédigé des rapports ponctuels, à différentes étapes de la gestion de la pandémie. Nous sommes intervenus d’abord en début de campagne, au début de décembre, sur la gestion des stocks, sur saisine du ministère de la santé. On avait en effet constaté un écart entre le nombre de vaccinations et les quantités de vaccins livrées. Nous avons procédé par sondage. L’écart entre le nombre de bons de vaccination décomptés à la CNAM et celui des vaccinations effectuées s’expliquait par un retard dans le traitement des premiers bons, qui s’accumulaient dans les centres de vaccination, et par la constitution de stocks importants. Nous avons donc conclu qu’il n’y avait pas de détournement de vaccins, comme les chiffres pouvaient le laisser craindre. Sur les stocks physiques, nous n’avons rien remarqué d’essentiel, sinon quelques pertes liées à des accidents ou à des difficultés de manipulation des vaccins.
Nous avons également effectué trois audits ponctuels dans des zones où le ministère avait détecté des tensions. Chaque fois, ce fut sur saisine conjointe du ministre de l’intérieur et du ministre de la santé, et de concert avec l’Inspection générale de l’administration.
Notre première intervention, au début de décembre 2009, concernait l’Île-de-France. Nous n’avons pas constaté de dysfonctionnement majeur dans les huit centres de vaccination que nous avons visités à Paris, dans le Val-de-Marne et en Seine-Saint-Denis. Les schémas d’organisation étaient connus et globalement respectés. Toutefois, nous avons souligné deux facteurs de risque par rapport à la conduite de la campagne.
Premièrement, l’efficacité des centres de vaccination était fonction de celle du maillon le plus faible de la chaîne des intervenants administratifs, médicaux et infirmiers, et il était difficile de maintenir un équilibre entre ces trois composantes, compte tenu d’un turn-over extrêmement important. Un certain nombre d’engorgements s’expliquaient par le fait qu’une des catégories n’était plus, ou pas, au niveau des autres.
Deuxièmement, dans un certain nombre de centres, en ce début de campagne, l’archivage et l’envoi des documents visant à assurer la traçabilité de la vaccination n’étaient pas traités avec suffisamment de rigueur ; nous avons donc fait des observations pour que ce problème soit corrigé.
Nous avons pu constater quelques dysfonctionnements affectant la montée en charge, principalement une certaine faiblesse de pilotage due à ce que la responsabilité des équipes opérationnelles départementales (EOD) avait été confiée, officiellement ou non, aux seules directions départementales des affaires sanitaires et sociales. Or, alors que les EOD manquaient un peu d’autorité pour mobiliser l’ensemble des services de l’État, les directions départementales, elles, se trouvaient parfois sous-dimensionnées du fait du bouleversement administratif entraîné par la mise en place des ARS (agences régionales de santé) et par les différentes réorganisations liées à la révision générale des politiques publiques.
Nous avons également demandé que ces équipes opérationnelles ne se contentent pas de transmettre aux centres de vaccination les circulaires et instructions ministérielles, mais qu’elles jouent un rôle d’accompagnement et élaborent des procédures simplifiées au bénéfice des centres.
Je m’arrêterai sur le cas de Paris. À ce stade, les résultats nous sont apparus à peu près convenables : le 30 novembre, la proportion de personnes vaccinées y était de 2,08 %, contre 1,58 % en moyenne nationale. Nous avons cependant constaté certaines difficultés liées au fait que les choix de pilotage entre autorités préfectorales – préfecture de police et préfecture de Paris – et directions départementales des affaires sanitaires et sociales (DDASS) ont varié dans le temps, le partage des rôles et des responsabilités n’ayant pas été clairement défini dès le début de la campagne de vaccination. De ce fait, la DDASS de Paris s’est trouvée relativement isolée pour gérer la crise. Nous avons préconisé, là encore, un renforcement du pilotage. Une telle situation peut sans doute expliquer que la DDASS de Paris ait un peu résisté, en début de campagne de vaccination, à ouvrir de nouveaux centres, pour en porter le nombre à 22 comme initialement prévu.
Deuxièmement, à la fin de décembre 2009, nous sommes intervenus dans le département du Pas-de-Calais, toujours donc sur saisine conjointe des deux ministères, en raison de l’attente qui était nécessaire pour accéder aux centres de vaccination.
Nous avons constaté qu’il n’y avait pas de problème particulier d’approvisionnement, que les plannings étaient bien organisés et que, dans l’ensemble, le stockage des vaccins se faisait dans de bonnes conditions – sauf dans un des centres d’Arras, en raison de pannes de réfrigérateurs. Nous avons observé cependant que les approvisionnements des équipes mobiles de vaccination en kits d’urgence n’étaient pas très satisfaisants, notamment pour ce qui est des établissements scolaires. Nous avons donc recommandé de revoir cette organisation. En conclusion, nous n’avons rien signalé de dramatique.
Troisième et dernière intervention : en janvier 2010, dans les Hauts-de-Seine, nous avons été saisis à propos de l’adéquation quantitative de l’offre de vaccination, ainsi que des modalités d’accès à la vaccination pour les populations les plus démunies.
Nous avons constaté une chute très forte du nombre de vaccinations à partir de Noël, liée, selon nos interlocuteurs, au reflux de l’épidémie et aux annonces d’annulation des commandes de vaccin. Cela se traduisait par la sous-occupation des personnels réquisitionnés. Nous avons préconisé d’alléger et d’assouplir le dispositif.
Nous pouvons sans doute tirer de notre enquête sur l’accès à la vaccination des populations des quartiers défavorisés quelques enseignements pour l’avenir. Nous avons constaté une corrélation significative entre les taux de vaccination et le profil sociologique des communes des Hauts-de-Seine. Cette corrélation a été corroborée par l’ensemble des entretiens que nous avons eus avec les acteurs de terrain : ceux-ci nous ont indiqué que les doutes sur l’innocuité du vaccin et sur l’utilité de la vaccination étaient très profondément enracinés dans les milieux défavorisés. Notre mission a estimé que ce ne serait sans doute pas par des approches administratives classiques que la situation pourrait être corrigée, mais plutôt par un message médical de proximité, en impliquant notamment la médecine de ville.
Voilà les quelques interventions qui ont été les nôtres pendant la conduite de cette campagne.
M. Jean Mallot. D’après mes informations, l’IGAS aurait produit sur la grippe saisonnière un rapport qui n’aurait pas été rendu public. Est-ce que, dans les mois passés, l’IGAS a travaillé sur ce sujet ? Est-ce qu’un tel rapport existe ? Si oui, sera-t-il rendu public un jour ? À qui devons-nous le demander ?
M. Pierre Boissier. Je n’ai pris mes fonctions qu’en octobre 2009. Depuis, nous n’avons pas fait de rapport sur la grippe saisonnière. Je vais évidemment faire des recherches pour voir si, antérieurement, on en avait fait. Si c’est le cas, j’en informerai la commission d’enquête.
Nos rapports étant généralement de nature confidentielle, la commission d’enquête devra adresser une demande formelle au cabinet de la ministre si elle en souhaite la transmission.
M. Jean-Pierre Door, rapporteur. Que pensez-vous de la façon dont ont été réparties les responsabilités entre les deux ministères de la santé et de l’intérieur ? Pensez-vous qu’il faudrait, à l’avenir, revoir le pilotage ?
M. Pierre Boissier. Nous n’avons pas contrôlé l’organisation du dispositif au niveau national. Comme je l’ai dit, nous ne sommes intervenus que trois fois, examinant le fonctionnement de tout au plus une dizaine de centres de vaccination. Je ne pourrai donc pas en tirer des conclusions générales. Nous avons pu néanmoins observer que la diversité des personnels à mobiliser, dans ce type de situation, impliquait que l’autorité la plus établie dans le département ait la main sur le pilotage. En l’occurrence, les rapports que nous avons rendus, notamment sur l’Île-de-France, soulignaient la nécessité d’y impliquer fortement l’autorité préfectorale, et de l’amener à soutenir l’action des équipes opérationnelles.
M. le rapporteur. Plutôt donc le ministère de l’intérieur que les autorités sanitaires – directeur de l’agence régionale de santé et ministère de la santé ?
M. Pierre Boissier. Il m’est difficile de dire comment il faudrait procéder maintenant que les agences régionales de santé sont en place. Mais en l’espèce, sur la période que nous avons examinée et sachant que les directions départementales des affaires sanitaires et sociales étaient « en fin de vie », je visais effectivement les préfets, donc le ministère de l’intérieur.
M. le président Jean-Christophe Lagarde. Si l’IGAS a fait un audit sur la grippe saisonnière, je vous demande de nous en informer. Nous saisirons alors officiellement la ministre pour en avoir connaissance.
Vous avez parlé des difficultés propres à Paris. Vous n’ignorez pas que c’est le seul endroit où un directeur départemental des affaires sanitaires et sociales a été « remercié », puisque c’est un membre de l’IGAS qui a assuré son intérim en attendant la mise en place des agences régionales de santé. Son audition et votre propos me laissent à penser que, dans ce cas spécifique, l’intervention de trois préfets a rendu extraordinairement compliquée la gestion du système et a abouti à marginaliser l’action du directeur départemental des affaires sanitaires et sociales, qui s’est trouvé isolé. Avez-vous réfléchi à une meilleure organisation pour Paris, qui permettrait de désigner clairement un chef de file ?
M. Pierre Boissier. Nous avons effectivement constaté que la complexité de l’architecture institutionnelle de Paris ne permettait pas un partage clair des rôles entre la préfecture de police et la préfecture de Paris. Il n’était pas dans notre mandat de faire un choix ou un arbitrage, d’autant que la décision dépend beaucoup plus du ministère de l’intérieur que du ministère qui nous avait saisis.
Au début du mois de décembre, conjointement d’ailleurs avec l’Inspection générale de l’administration, nous avons demandé que, pour la suite des opérations, on clarifie les rôles entre ces deux préfectures. Après, nous ne sommes pas réintervenus.
M. le président Jean-Christophe Lagarde. Vous n’avez pas fait de suggestions ?
M. Pierre Boissier. Non.
Mme Marie-Louise Fort. Vous avez indiqué que les populations les plus défavorisées avaient été très réticentes vis-à-vis de la vaccination. Quels seraient, d’après vous, les meilleurs réseaux à utiliser pour leur permettre, dans l’avenir, de mieux apprécier la pertinence d’une vaccination éventuelle ? Pensez-vous que le recours aux réseaux habituels de santé – médecins généralistes, etc. – aurait permis d’améliorer la situation ?
M. Pierre Boissier. Nous avons effectivement fait ce constat concernant les départements de l’Île-de-France. L’une de nos préconisations était d’avoir recours à la médecine de ville et à la médecine de proximité – probablement à toutes les formes d’intervention médicale ou sanitaire de proximité. Manifestement, le processus administratif classique – envoi de courrier au domicile – touche moins ce type de public. Qui plus est, comme nous l’ont indiqué les acteurs de l’opération que nous avons auditionnés, celui-ci s’est montré beaucoup plus sensible que d’autres aux informations plus ou moins objectives qui ont été publiées ici ou là sur l’utilité de la vaccination.
M. Patrice Debray. Que pense l’IGAS du fait que la médecine de ville n’ait pas été impliquée dans cette opération de vaccination ? Considérez-vous, en tant que contrôleur des actions sanitaires, qu’il y avait un risque à confier la vaccination aux médecins libéraux ? Si oui, pourquoi ?
M. Pierre Boissier. Nous avons, depuis relativement peu, une compétence sur la médecine de ville. Toutefois, nous n’avons pas été saisis sur ce sujet et il m’est donc difficile de répondre à cette question.
Encore une fois, nous ne sommes intervenus que ponctuellement, sur la manière dont le dispositif fonctionnait. Nous n’avons pas eu à analyser la pertinence de son organisation, ni dans le cadre de notre programme de travail, ni sur saisine complémentaire des ministres.
M. le président Jean-Christophe Lagarde. Vous paraît-il logique qu’on ne vous l’ait pas demandé ? Il me semble que cela fait partie du travail habituel de l’IGAS.
M. Pierre Boissier. Nous avons l’habitude de travailler très étroitement avec la Cour des comptes et de partager nos investigations. Nous pouvons intervenir à deux titres : soit parce que les ministres nous saisissent et, sur ce sujet, cela n’a pas été le cas jusqu’à présent ; soit dans le cadre de notre programme de travail, que nous élaborons en nous concertant avec la Cour.
M. le président Jean-Christophe Lagarde. Et la Cour des comptes, saisie, ne vous a pas sollicités ?
M. Pierre Boissier. Non. Et comme nous savions qu’elle se penchait sur la question, nous n’avons pas jugé opportun de réinscrire ce sujet à notre programme de travail.
M. le président Jean-Christophe Lagarde. Et vous nous confirmez que l’on ne vous a jamais demandé d’évaluer la pertinence du dispositif à ce jour ?
M. Pierre Boissier. À ce jour, nous n’avons pas été saisis d’une demande d’évaluation ex post du dispositif.
M. le rapporteur. À propos des personnes défavorisées des Hauts-de-Seine, vous avez précisé que le niveau du taux de vaccination de cette population pouvait s’expliquer par l’absence d’implication de la médecine de ville. Est-ce un avis personnel de votre part ?
M. Pierre Boissier. Ce n’est pas tout à fait comme cela que je me suis exprimé. J’ai indiqué effectivement que nous avions remarqué une corrélation, sur la base de l’analyse des chiffres, entre les taux de vaccination et le profil social des communes.
M. le président Jean-Christophe Lagarde. Vous n’avez pas dit dans quel sens !
M. Pierre Boissier. En effet, pardonnez-moi : les quartiers les plus défavorisés sont les quartiers où le taux de vaccination a été le plus faible.
Plus précisément, nous avons étudié la corrélation entre taux de vaccination et profil social et nous en avons tiré certaines conclusions. À partir de là, nous avons fait un certain nombre d’interviews auprès de ceux qui mettaient localement en œuvre le dispositif. Les acteurs de terrain nous ont indiqué que dans ces milieux plus défavorisés, les doutes sur l’innocuité et l’utilité du vaccin étaient manifestement enracinés. Par ailleurs la mission qui est intervenue, constatant que les procédures administratives classiques – courriers, etc. – touchaient relativement mal ces populations, a suggéré qu’il serait peut-être préférable de privilégier des messages médicaux de proximité.
Mme Marie-Louise Fort. Est-ce à dire que, pour ces populations, trop de communication tue la communication, ou brouille le message ? Ou qu’elles sont particulièrement influencées par les débats télévisés, notamment, plus que par la presse écrite et les messages sanitaires ?
M. Pierre Boissier. Je vais vous livrer ma vision personnelle. On n’a pas fait d’étude à proprement parler sur la question, mais la communication sur la vaccination a été variée, parfois divergente, et de sources diverses. Il est assez probable que cette multiplicité aura eu des effets déstabilisants.
M. le président Jean-Christophe Lagarde. Au cours de nos auditions, il nous est apparu assez souvent que les directives nationales avaient donné lieu à des interprétations très variées de la part des préfectures, et que cela avait pu influer sur l’efficacité ou sur la compréhension de la campagne de vaccination. L’avez-vous constaté dans les trois départements où vous avez mené des inspections ? En avez-vous entendu parler s’agissant d’autres départements ?
M. Pierre Boissier. Non, nous ne l’avons constaté dans aucun des trois cas examinés. À chaque fois, l’une des tâches des missions était de vérifier que les instructions ministérielles avaient été correctement comprises et appliquées. Les rapports n’ont pas fait état d’interprétations divergentes.
M. le président Jean-Christophe Lagarde. Avez-vous eu l’impression que des informations contradictoires avaient été délivrées en début de campagne, s’agissant notamment des publics qui devaient être accueillis dans les centres ?
M. Pierre Boissier. Non, nous n’avons pas fait de constat sur ce point particulier.
M. le président Jean-Christophe Lagarde. Cela me paraît très surprenant. Chacun a pu constater que, dans tous les centres, y compris en province, on avait commencé par dire qu’on accueillerait telle catégorie de population, puis tout le monde ; puis on avait restreint l’accueil des centres, qu’on avait fini par ouvrir à tous. C’étaient des instructions « à géométrie variable ». L’inspection ne l’a-t-elle pas remarqué ?
M. Pierre Boissier. Nous sommes intervenus uniquement sur l’organisation de la chaîne de fonctionnement. Et sur la chaîne de fonctionnement, nous avons constaté une homogénéité.
M. le président Jean-Christophe Lagarde. La chaîne de fonctionnement, cela n’incluait pas les gens susceptibles d’être admis à être vaccinés ?
M. Pierre Boissier. Notre mandat ne portait pas sur les conditions d’envoi, par la Caisse nationale d’assurance maladie des travailleurs salariés (CNAM), des bons de vaccination aux différentes populations. Nous sommes intervenus sur la manière dont la chaîne de vaccination fonctionnait, à l’intérieur des centres.
M. le président Jean-Christophe Lagarde. Je ne parle pas de l’envoi des bons par la CNAM, mais de l’accueil ciblé des différents publics dans les centres. Ces derniers, qui avaient été ouverts pour accueillir les publics prioritaires munis de bons de vaccination, ont ensuite accueilli tout le monde, puis certaines personnes qui avaient ou non des bons de vaccination, lesquels étaient pour moitié édités sur place, etc. Un tel dysfonctionnement n’est-il pas apparu lors de l’une ou l’autre de vos inspections ?
M. Pierre Boissier. Non, dans aucune des trois.
M. le président Jean-Christophe Lagarde. Le fait que l’on accueille des gens avec ou sans bon ne posait pas de problèmes ?
M. Pierre Boissier. Nous ne l’avons pas constaté, dans aucune de nos trois inspections.
M. Patrice Debray. Les personnes à risque hospitalisées, pensionnaires dans des établissements d’hébergement pour personnes âgées dépendantes ou dans des maisons de retraite et les personnes âgées qui ne pouvaient pas se déplacer ont-elles été concernées par la vaccination ? À ma connaissance, ni les établissements ni les médecins ou infirmières intervenant à domicile ne disposaient du vaccin. J’ai contribué bénévolement à la campagne de vaccination. De temps en temps, mon centre a organisé officieusement le transport de vaccins dans des glacières pour permettre aux équipes mobiles d’aller vacciner ces personnes qui étaient considérées comme des personnes à risque. Avez-vous eu vent de ce problème ?
M. Pierre Boissier. Non, nous n’en avons pas été saisis.
M. le rapporteur. Si j’ai bien compris, on vous a demandé de contrôler le pilotage des centres, la relation entre la direction départementale des affaires sanitaires et sociales et les centres, mais pas ce qui s’est passé à l’intérieur de ces derniers.
M. Pierre Boissier. Sauf pour la première mission qui portait sur la question spécifique des stocks, on nous a demandé d’intervenir sur des sites où l’on constatait des files d’attente ou des difficultés d’accès – et de déterminer si ces problèmes provenaient du pilotage ou du fonctionnement des centres. Nos missions, que ce soit dans le Pas-de-Calais ou en Île-de-France, ont porté sur ce point particulier, et nous avons été saisis de manière limitative.
M. le rapporteur. Les bons ont été une source de dysfonctionnement dans les centres. Lorsque les gens n’en avaient pas, il fallait en éditer, ou les renvoyer. Cela ne faisait-il pas partie des difficultés constatées par vos services ?
M. Pierre Boissier. Comme je vous le disais tout à l’heure, nous n’avons pas fait d’audit sur ce point. Je ne peux qu’avoir une opinion personnelle, que je ne livrerai pas à la commission.
Mme Marie-Louise Fort. Vous n’avez pas été sollicités pour inspecter l’ensemble du processus de vaccination, depuis l’arrivée des produits, en passant par l’attribution des bons, par le choix des populations à vacciner et par l’organisation des centres ?
M. Pierre Boissier. Très clairement, non. C’est ce que je disais au début de mon audition : nous avons été peu impliqués et de manière extrêmement ponctuelle.
M. le président Jean-Christophe Lagarde. Exceptionnellement, et bien que vous ayez juré de dire la vérité, toute la vérité, je vais vous poser une question à laquelle j’accepte que vous ne répondiez pas. À titre personnel, jugez-vous logique que l’IGAS, qui est un rouage essentiel de l’administration sanitaire, n’ait pas été réellement associée à une opération d’une telle ampleur et ait dû se contenter de mener des inspections que je qualifierai de « très marginales » ?
M. Pierre Boissier. Je partage votre avis sur le fait que notre intervention a été marginale. Quant à savoir qui devait faire l’évaluation, je reprendrai ce que je vous disais tout à l’heure : ce pouvait être nous ou la Cour des comptes. À partir du moment où la Cour des comptes était impliquée, il ne me paraissait pas nécessaire de nous impliquer aussi. Mais c’est une opinion personnelle et il est tout à fait possible que, demain, la ministre nous demande une évaluation ex post du dispositif.
M. le président Jean-Christophe Lagarde. Avez-vous connaissance d’un autre cas où, sous prétexte que la Cour des comptes viendrait s’intéresser à ce qui se passe dans le domaine de la santé, on n’aurait pas saisi l’IGAS ?
M. Pierre Boissier. Oui, cela arrive régulièrement.
M. le président Jean-Christophe Lagarde. Le dysfonctionnement d’un hôpital peut être de nature financière ou de nature sanitaire. Ce n’est pas parce que la Cour des comptes s’intéresserait au fonctionnement de l’hôpital que vous vous interdiriez d’intervenir ?
M. Pierre Boissier. Je vous l’ai dit, l’Inspection intervient soit sur saisine ministérielle, soit dans le cadre de son programme de travail. Dans ce dernier cas, nous nous coordonnons avec la Cour des comptes.
M. Patrice Debray. Éclairez-moi : la Cour des comptes s’occupe plutôt du versant financier, et l’IGAS du versant sanitaire ?
On conçoit très bien que la Cour des comptes soit saisie en cas de dérive financière d’un établissement hospitalier. On a plus de mal à concevoir qu’elle juge du fonctionnement sanitaire d’un centre hospitalier ou d’une campagne de vaccination. Si une autre épidémie survenait, il serait utile de connaître le rôle que l’IGAS pourrait éventuellement jouer dans la surveillance de la mise en place de cette campagne. Je pense que c’est le sens de la question du président Jean-Christophe Lagarde.
M. le président Jean-Christophe Lagarde. Il me paraîtrait en effet assez incohérent de ne pas utiliser votre compétence et votre connaissance de l’administration. À l’avenir, il serait logique que vous soyez totalement impliqués dans le contrôle du dispositif, non pas parce qu’il y a des files d’attente, mais parce que l’on a besoin d’évaluer en permanence les politiques publiques. Cela me paraît logique. Cela vous paraît peut-être logique à vous aussi. En tout cas, je le souhaite, monsieur l’inspecteur.
Aller plus loin ne nous édifierait pas davantage. Je vous remercie.
La séance est levée à dix-sept heures dix.
Audition de M. Nacer Meddah,
préfet de Franche-Comté, ancien préfet de Seine-Saint-Denis
(Procès-verbal de la séance du mercredi 9 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-sept heures dix.
M. le président Jean-Christophe Lagarde. Je vous remercie, monsieur le préfet, d’avoir répondu à l’invitation de la commission d’enquête parlementaire sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination de la grippe A(H1N1). Nous n’ignorons pas que vous n’êtes plus préfet du département de la Seine-Saint-Denis depuis quelques semaines. Néanmoins, vous n’avez pas pu oublier les principales caractéristiques du déroulement de la campagne de vaccination dans ce département et ce sont vos impressions de l’époque qui nous intéressent. La commission d’enquête est en effet très attachée à recueillir des bilans d’expériences locales en contrepoint des descriptions de la stratégie vaccinale nationale qui nous ont été présentées.
(M. Nacer Meddah prête serment.)
M. Nacer Meddah, préfet de Franche-Comté, ancien préfet de Seine-Saint-Denis. Avant de vous exposer le déroulement de la campagne de vaccination de la grippe A(H1N1) en Seine-Saint-Denis, je voudrais souligner deux éléments propres au département, qui peuvent expliquer la préparation des acteurs de cette campagne à la gestion d’une crise sanitaire.
Premièrement, le département avait déjà dû faire face, quelques mois avant cette campagne, à des alertes sanitaires, notamment à la tuberculose, qui avait sévi à la maison d’arrêt de Villepinte et dans plusieurs établissements scolaires. Le département avait une expérience de gestion des crises sanitaires.
Deuxièmement, les services de l’État, préfecture et direction départementale des affaires sanitaires et sociales au premier chef, étaient sur le pont avant le lancement officiel de la campagne de vaccination, puisqu’ils avaient déjà dû parer au risque d’épidémie de grippe porcine lié au trafic de l’aéroport de Roissy. Dans ce département, la solidarité entre l’État et les collectivités locales et tous les « missionnaires de service public » a permis des prouesses.
La phase de préparation de la campagne s’est déroulée du 21 août au 11 novembre, dans un cadre fixé pour l’essentiel par deux circulaires : une circulaire du 21 août 2009 relative à sa planification logistique, et une circulaire du 28 octobre 2009 qui a fixé les grandes lignes de travail.
La circulaire du 21 août 2009, la plus importante, prévoyait notamment l’installation d’instances spécifiques.
Le comité de pilotage de la campagne, le COPIL, mis en place très rapidement dans le département, réunissait des membres du comité de l’aide médicale urgente et de la permanence des soins et des transports sanitaires, le CODAMUPS, des représentants des professions paramédicales, des associations intervenant auprès des publics visés, des associations de sécurité civile et les représentants de huit communes représentatives du département. Le COPIL s’est réuni toutes les semaines jusqu’au mois de novembre, la fréquence de ses réunions décroissant à compter de cette date du fait de l’intensification de la campagne.
L’équipe opérationnelle départementale, EOD, formation beaucoup plus restreinte, était chargée de faire des propositions de mise en œuvre des demandes gouvernementales au niveau local. Pilotée par le préfet ou par son directeur de cabinet, elle était composée d’agents de la préfecture, de la direction départementale des affaires sanitaires et sociales, du conseil de l’ordre des médecins, de la Caisse primaire d’assurance maladie, de l’inspection académique, de la direction départementale de la sécurité publique et du conseil général. L’EOD se réunissait toutes les semaines, le plus souvent après que la cellule interministérielle de crise s’était réunie, afin de mettre en musique au plus vite les décisions prises au niveau national.
L’intensification de la campagne a entraîné la création dès la mi-octobre d’une instance encore plus restreinte au sein de l’EOD, un binôme composé du cabinet du préfet et de la direction départementale des affaires sanitaires et sociales, véritable cheville ouvrière de la campagne.
Enfin la cellule de suivi a joué un rôle essentiel dans le règlement des problèmes matériels.
La circulaire d’août prévoyait également l’ouverture de centres de vaccination, et ceux du conseil général se sont très vite avérés inadaptés à une campagne de vaccination de grande ampleur et leur utilisation aurait été contraire à la circulaire. Sur la base de critères de proximité et d’accessibilité fixés par celle-ci, nous avons finalement retenu vingt et un centres de vaccination afin d’assurer le maillage d’un département comptant 1,5 million d’habitants et 40 communes. Ce sont les communes qui mettaient les locaux
– essentiellement des gymnases – à notre disposition. Le matériel médical, en particulier les vaccins, était fourni par l’Établissement de préparation et de réponse aux urgences sanitaires, l’ÉPRUS. En ce qui concerne les autres matériels, ils ont été mis à disposition dans le cadre de quinze conventions établies avec les communes, ou achetés par les collectivités grâce à des avances d’un montant de 8 000 euros consenties par la préfecture, celle-ci ayant toujours veillé à ce que ne soit acheté que ce qui était strictement nécessaire et susceptible d’être recyclé.
Les personnels de ces centres provenaient de la direction départementale des affaires sanitaires et sociales pour le personnel médical et de la préfecture pour les administratifs. Bien que la circulaire prévoyait l’emploi majoritaire de personnels communaux, nous avons choisi, en parfaite concertation avec les collectivités locales, de mobiliser massivement les services déconcentrés de l’État. Tous les chefs de centre venaient des services déconcentrés, et les équipes étaient constituées majoritairement d’agents de l’État, à côté des personnels communaux. C’est ainsi que les centres ont été rapidement équipés et opérationnels.
La circulaire du 28 octobre constituait en quelque sorte une « fiche technique » très utile pour la gestion quotidienne de ces centres.
Durant toute cette phase de préparation, nous avons travaillé en étroite collaboration avec les collectivités locales et toutes les professions médicales.
La campagne de vaccination proprement dite s’est déroulée du 12 novembre au 31 janvier. Huit centres étaient ouverts dès le 12 novembre, et tous étaient opérationnels le 16 novembre. Leur amplitude d’ouverture a varié. D’abord ouverts le lundi après-midi et le mardi matin, puis le mercredi après-midi, pour la vaccination des enfants, à partir du 5 décembre, tous les centres sont restés ouverts tous les jours, de huit heures à vingt-deux heures, week-ends compris, pour satisfaire la demande formulée en novembre par le M. Président de la République et exigeant d’intensifier la campagne de vaccination à Paris et dans la petite couronne. Cette intensification a contraint la préfecture à déléguer à chacun des services déconcentrés qui avaient la responsabilité d’un centre la charge d’organiser le planning des personnels de ce centre, en liaison étroite avec la cellule de suivi. Cette cellule de crise créée au sein de la préfecture, composée de personnels de la préfecture, de la direction départementale des affaires sanitaires et sociales et d’un médecin, était chargée, en relation avec chacun des centres, de régler tous les problèmes quotidiens, et faisait chaque soir un point de la situation, ce qui nous permettait de faire remonter jusqu’au ministère toutes nos statistiques et de le tenir informé de tous les incidents. Il a fallu une mobilisation d’une très grande intensité de ces personnels pour faire face aux problèmes récurrents liés à leur nombre insuffisant ou aux difficultés de transport.
En outre, des équipes mobiles de vaccination ont été envoyées dans les établissements scolaires ; elles étaient également chargées dans le département d’organiser des maraudes dans les camps de roms, afin de les diriger vers le centre dédié de Rosny. En dépit d’une mobilisation déjà intense des personnels, l’intensification de la campagne nous a contraints à recourir à des personnels embauchés par la Croix-Rouge dans le cadre de contrats aidés de six mois et mis à la disposition des centres. Tous les personnels, qu’ils soient administratifs ou médicaux, ont fait l’objet de réquisitions collectives, procédure qui permettait une gestion souple et réactive des ressources humaines.
Je tiens à souligner le rôle déterminant de la cellule de suivi. J’ai moi-même visité les vingt et un centres à plusieurs reprises, parfois pendant le week-end, et tous les chefs des services déconcentrés se sont rendus sur le terrain.
À partir de janvier, la campagne s’est ralentie, beaucoup moins de personnes venant se faire vacciner. Il est vrai que la vaccination sur site avait été autorisée : administrations, entreprises publiques, grandes entreprises, puis hôpitaux et cabinets des médecins libéraux pouvaient vacciner. La fermeture des centres a alors été décidée par circulaire interministérielle du 21 janvier 2010, et ceux-ci ont été rendus aux communes le 31 janvier 2010.
Au total, cette campagne de vaccination a permis de vacciner un peu moins de 77 000 habitants de la Seine-Saint-Denis. Les vacations ou les indemnités exceptionnelles de réquisition sont en cours de règlement. Les communes ont déjà bénéficié d’un remboursement forfaitaire de 4 000 euros au titre de la mise à disposition de locaux, et les modalités de remboursement des matériels achetés par elles font l’objet d’un examen au cas par cas. Tout devrait être définitivement liquidé d’ici à la mi-juillet. Le coût de l’équipement et du fonctionnement des centres devrait s’élever finalement à deux millions d’euros, conformément aux prévisions.
Je voudrais en conclusion insister sur trois points.
Je tiens tout d’abord à saluer la mobilisation exceptionnelle des personnels engagés, véritables missionnaires du service public dans le département. Ils ont fait preuve d’une capacité remarquable à se mobiliser en situation de crise, assurant, en dépit de conditions particulièrement difficiles, un fonctionnement optimal des centres de vaccination. J’adresse mes sincères remerciements à tous ceux, nombreux, qui se sont ainsi mobilisés. Agents des services de l’État, agents territoriaux, professionnels de santé se réunissaient quasi quotidiennement. Pendant six mois, une bonne partie des moyens de mon cabinet et de la direction départementale des affaires sanitaires et sociales s’est consacrée à cette campagne extrêmement lourde, mais conduite de manière remarquable dans ce département.
Deuxièmement, cette campagne de vaccination a présenté à mes yeux le rare mérite de constituer un premier test grandeur nature en matière de gestion de crise sanitaire. Dans notre département, elle nous a permis de démontrer notre capacité d’organiser une telle campagne, avec des partenaires publics, des associations, des entreprises et des professionnels de différents secteurs. Cette expérience exceptionnelle est riche d’enseignements, et il faudra en tirer toutes les leçons.
Je terminerai sur une interrogation. Pourquoi ne sommes-nous pas parvenus à sensibiliser les populations défavorisées des quartiers populaires à la nécessité de la vaccination, en dépit d’une intense campagne de communication par voie d’affichage, d’encarts dans la presse et par l’intermédiaire des associations, campagne encore intensifiée à chaque « changement de braquet » ? En effet, les habitants des quartiers défavorisés du département se sont peu rendus dans les centres de vaccination.
M. Jean-Pierre Door, rapporteur. Même si la campagne a bien fonctionné dans votre département, vous avez quand même dû rencontrer quelques difficultés. Vous avez évoqué des problèmes de communication : n’avez-vous pas ressenti des réticences chez les professionnels de santé vis-à-vis de cette campagne ? La coopération avec les autorités de tutelle, ministères de la santé et de l’intérieur, s’est-elle parfaitement bien passée ou le système peut-il être amélioré ? La décision de fermer les centres n’a-t-elle pas été trop rapide ?
M. Nacer Meddah. La mobilisation des professionnels de santé a été exemplaire, surtout au regard du contexte national. Le président du conseil de l’ordre s’est immédiatement impliqué et a participé à toutes les opérations de communication. Est-ce dû à l’habitude de travailler ensemble au sein du CODAMUPS ? Toujours est-il qu’il n’y a pas eu d’opposition de principe des professionnels de santé : même si les débats n’ont pas été absents de nos réunions, ils n’ont pas brouillé le message. Les difficultés, même les plus graves, ont toujours été surmontées parce que tout le monde a joué le jeu.
Je n’ai pas à signaler de difficultés particulières dans nos rapports avec les autorités de tutelle. Nous ne les avons pas rencontrées très souvent, et si les instructions et les circulaires ont été très nombreuses, beaucoup était délégué au niveau départemental, afin qu’il organise au mieux la campagne de vaccination, à charge pour lui d’en rendre compte quotidiennement aux autorités de tutelle. Ainsi, nous avons eu une certaine latitude pour fixer des horaires d’ouverture qui tiennent compte des particularités du département, notamment en matière de sécurité ou de mobilité. Il s’agissait de garantir aux personnels des centres qu’ils pourraient remplir leur mission dans les meilleures conditions.
La fermeture des centres a suscité d’autant moins de difficultés dans le département que le ralentissement de la campagne s’est fait sentir dès la fin de l’année et que les grandes entreprises et les hôpitaux avaient pris le relais pour vacciner une grande partie de ceux qui souhaitaient encore le faire.
M. le président Jean-Christophe Lagarde. Pourquoi la campagne a-t-elle été particulièrement difficile à mener ? Est-ce sur instruction ministérielle que les gymnases ont été mis à disposition ? Les autres locaux étaient-ils inadaptés à une vaccination de masse ? En ce qui concerne l’amplitude des horaires d’ouverture des centres, la demande, faite au plus haut niveau de l’État, d’une ouverture sept jours sur sept de huit heures à vingt-deux heures, n’était-elle pas totalement excessive ? Combien de personnes ont-elles finalement été réquisitionnées ? Le ministère de l’intérieur était-il votre seul interlocuteur au niveau national ou receviez-vous des instructions d’autres ministères ?
M. Nacer Meddah. Il était particulièrement difficile de conduire, pendant six mois et à effectifs constants, une campagne aussi intense dans un département où la mobilisation des personnels est déjà très élevée en temps normal. Il y a eu des réquisitions mais sur la base du volontariat : la quasi-totalité des personnels se sont impliqués volontairement.
La mise à disposition de gymnases n’était pas un choix des communes : elle répondait au choix fait au niveau national d’une campagne de vaccination massive, pour laquelle les centres départementaux étaient insuffisants. Ces gymnases n’ont parfois été que partiellement utilisés afin de limiter la gêne des communes qui souhaitaient y poursuivre des activités sportives ou festives. Tout cela n’était pas toujours facile à gérer.
En ce qui concerne les horaires d’ouverture des centres, il y a sans doute une réflexion à conduire : on n’aurait pas perdu en efficacité en tenant un plus grand compte des spécificités du territoire. L’ouverture des centres le soir ou le week-end ne se justifiait par exemple pas par une affluence particulière, l’amplitude horaire initiale s’avérant finalement bien suffisante pour accueillir toutes les personnes qui souhaitaient se faire vacciner. Il est vrai que les centres de vaccination n’ont jamais été débordés en Seine-Saint-Denis. Cela soulevait une question récurrente : comment atteindre des populations qui ne vont pas facilement se faire vacciner ?
M. le président Jean-Christophe Lagarde. Est-ce la préfecture qui a fait ainsi varier les horaires d’ouverture, au grand dam des acteurs de terrain, ou cela a-t-il été décidé au niveau de la zone ou à un niveau plus élevé ?
M. Nacer Meddah. Il nous a fallu adapter en temps réel notre communication à des variations d’horaires décidées au plus haut niveau et coordonnées au niveau de la zone par le préfet de police.
M. le président Jean-Christophe Lagarde. Y compris en ce qui concerne l’ouverture des centres le 24 et le 31 décembre ?
M. Nacer Meddah. Je m’en suis tenu aux instructions.
M. le président Jean-Christophe Lagarde. Avez-vous rencontré des problèmes de logistique pour assurer l’accueil des personnes munies d’un bon de vaccination ? La définition du public qui devait être accueilli, qui n’a cessé de varier – se limitant d’abord à ceux qui étaient munis d’un bon de vaccination pour englober finalement tous ceux qui se présentaient – était-elle le fruit de décisions prises au niveau préfectoral, à celui de la zone, ou d’instructions gouvernementales ?
M. Nacer Meddah. La zone nous a laissé une certaine latitude dans l’établissement des bons, le pragmatisme s’étant imposé d’emblée dans cette affaire. Le suivi, en revanche, devait être sans faille. Nous n’avons jamais rencontré de véritables difficultés d’approvisionnement, et les incidents que nous avons pu connaître n’ont jamais remis en cause notre capacité à vacciner. La forte décrue en fin de campagne nous a permis d’accueillir tous ceux qui souhaitaient se faire vacciner. Dans les périodes d’affluence, en revanche, priorité était donnée aux porteurs de bons, mais cela ne nous a jamais empêchés d’accueillir les autres.
Mme Marie-Louise Fort. Savez-vous pourquoi la campagne n’a pas convaincu les populations les plus défavorisées ? Est-ce à mettre sur le compte d’un excès de communication et de messages télévisuels contradictoires ? Les réseaux médicaux de proximité n’ont-ils pas été insuffisamment sollicités, en Seine-Saint-Denis comme sur l’ensemble du territoire ?
M. Nacer Meddah. Sur ce sujet délicat, ma réflexion n’est pas achevée et je ne suis pas encore capable de vous apporter de réponse définitive. Je ne pense pas qu’elle soit à rechercher dans une intensification de la communication classique dans un domaine qui ne constitue pas une préoccupation essentielle pour ces populations, sauf lorsqu’elles sont gravement malades. Il aurait peut-être fallu chercher à les atteindre au travers des mamans, des écoles, du tissu associatif. Mais nous étions dans l’urgence, mobilisés en priorité par la mise en place et le fonctionnement des centres de vaccination. C’est là un des enseignements de cette campagne : il faudra chercher à l’avenir les voies d’une communication différente, passant par la proximité et la confiance.
M. le président Jean-Christophe Lagarde. Il est vrai que trente-cinq à quarante pour cent de la population de ce département ne consultent qu’aux urgences.
M. Patrice Debray. J’ai été surpris par la façon dont le COPIL, le CODAMUPS et l’EOD se sont effacés au profit d’un binôme cabinet du préfet-direction départementale des affaires sanitaires et sociales, qui a écarté la médecine de ville du processus de vaccination, au détriment de l’efficacité de la campagne. Pour quelle raison ce binôme a-t-il été créé ? Comment les professionnels de santé, l’ordre des médecins notamment, ont-ils réagi face à cette mise à l’écart, souhaitée, il est vrai, par le ministère ?
M. Nacer Meddah. Le binôme ne s’est pas substitué aux instances dont la mise en place était prescrite par la circulaire. La création de cette structure a répondu à une nécessité opérationnelle d’efficacité, mais les autres instances ont continué à se réunir, même si ce n’était plus avec la même fréquence, et ces réunions étaient nourries par les informations recueillies par le binôme.
Mme Catherine Lemorton. La traçabilité du patient a-t-elle été suffisamment assurée vis-à-vis des caisses de sécurité sociale ? Quelle a été votre réaction face à la préconisation, dans la circulaire du 21 août, d’un rythme de vaccination de trente injections par heure par agent vaccinateur ? Pouvez-vous nous dire combien de temps a demandé une prise en charge individuelle, comportant toutes les étapes que la ministre a détaillées devant la commission des affaires sociales ?
M. Nacer Meddah. Je puis vous assurer que nous faisions chaque jour parvenir aux caisses les bons que nous avions été amenés à imprimer. La question de la traçabilité restait néanmoins entière pour certaines populations telles que les roms, qui ne se fixent pas sur un territoire. Le problème se posait surtout dans le cas, initialement envisagé, des doubles vaccinations.
Mme Catherine Lemorton. Et si l’affiliation à une caisse n’était pas prouvée ?
M. Nacer Meddah. La personne était quand même vaccinée et un bon de vaccination était établi.
M. le président Jean-Christophe Lagarde. Les bons étaient envoyés à la caisse primaire d’assurance maladie, à charge pour elle de les répartir entre les différentes caisses compétentes.
Mme Catherine Lemorton. Je pose cette question dans la perspective d’une autre campagne de vaccination : il s’agit de savoir comment identifier les populations effectivement vaccinées. La caisse primaire a-t-elle vraiment été en mesure de vérifier l’affiliation des personnes vaccinées ?
M. Nacer Meddah. Je ne suis pas en mesure de vous le certifier.
M. Patrice Debray. Ayant participé au fonctionnement d’un centre de vaccination, je peux vous dire, madame Catherine Lemorton, que dans le cas que vous évoquez, le personnel recherchait l’affiliation des personnes par voie informatique et la trouvait dans la plupart des cas.
M. Nacer Meddah. Je laisse au directeur départemental des affaires sanitaires et sociales et aux professionnels de la santé le soin de commenter la pertinence de la prescription de trente injections par heure. Je peux simplement dire que la Seine-Saint-Denis n’a pas connu de cadences infernales en matière d’injection ; au contraire, les personnels étant plutôt désœuvrés à certains moments !
Mme Catherine Lemorton. Qu’un tel rythme de vaccination, unanimement jugé impossible à tenir, soit prescrit par circulaire gouvernementale n’en reste pas moins choquant. Il est vrai que c’était le seul moyen d’atteindre l’objectif de la ministre de la santé d’une double vaccination de 47 millions de personnes.
M. le président Jean-Christophe Lagarde. Je vous remercie, monsieur le préfet, d’avoir participé à cette audition.
La séance est levée à dix-huit heures quinze.
Audition de M. Bernard Fragneau,
ancien préfet du Loiret
(Procès-verbal de la séance du mercredi 9 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures quinze.
M. le président Jean-Christophe Lagarde. Monsieur, vous n’êtes plus préfet du Loiret. Mais vous l’étiez lors de la campagne de vaccination et c’est bien votre expérience de l’époque qui nous intéresse. Les détails sont, pour nous, moins importants que les impressions du terrain ; nous sommes en effet très attachés à recueillir des bilans d’expériences locales, en contrepoint des descriptions de la stratégie vaccinale nationale qui nous ont été présentées.
(M. Bernard Fragneau prête serment.)
M. Bernard Fragneau. Cette affaire nous a tenus occupés bien en amont du 12 novembre. Avant que la campagne de vaccination ne débute, nous avons dû remettre à plat nos plans de continuité d’activité, conduire la distribution des masques, animer la campagne d’information sur les mesures-barrières et gérer le fameux épisode de la fermeture de classes.
Notre mission était de mettre en place un dispositif lourd et inédit. Nous avons relevé ce défi en faisant preuve de réactivité. Dans le Loiret, nous avons réussi à ouvrir six centres de vaccination à la date prévue. Ils ont fonctionné six jours sur sept, sans problème particulier. Des modifications, notamment sur les horaires d’ouverture, ont été apportées par la suite, selon les demandes du Gouvernement.
Celles-ci étaient claires, même si l’accumulation frénétique de textes administratifs – une trentaine de circulaires dites « importantes » et une trentaine d’instructions en trois mois, parfois contradictoires – a pu rendre les choses un peu difficiles.
La chaîne territoriale a correctement fonctionné, d’autant que l’échelon zonal y a été inséré. Celui-ci, dont le rôle est parfois contesté, a beaucoup facilité notre action en anticipant les informations et les instructions venues de Paris.
Nous n’avons pas éprouvé de difficultés à trouver des locaux auprès des collectivités locales, notamment à Montargis… En revanche, nous avons eu du mal à rassembler les personnels médicaux nécessaires et j’ai dû me fâcher pour que les services de l’administration déconcentrée fournissent leur quota de personnels administratifs. Sans doute faut-il y voir le signe d’un esprit civique français insuffisamment développé en France, qui s’aiguise pourtant lorsqu’il est question de rémunération !
Dans la région Centre, les différences entre les départements ont tenu aux viviers de personnes potentiellement vaccinables. Six centres ont été ouverts dans chacun des départements de l’Eure-et-Loir, de l’Indre-et-Loire, du Cher et du Loiret, sept centres ont été ouverts dans l’Indre, quatre dans le Loir-et-Cher. Sur les 650 000 habitants que compte le Loiret, 55 269 ont été vaccinées, 186 731 l’ont été en région Centre, soit un taux moyen de 8 % ; dans la zone Ouest, ce taux a atteint 11 %.
Nous avons rempli notre mission même si les centres auraient pu accueillir davantage de personnes. Je ne pense pas au demeurant que le faible taux de couverture vaccinale puisse nous être imputé.
M. Jean-Pierre Door, rapporteur. Nous avons souhaité vous auditionner pour mieux connaître le fonctionnement de la campagne de vaccination dans un département dit « rural ». Les services de la préfecture ont-ils assuré la communication ?
M. Bernard Fragneau. En effet, nous avons dû relayer la campagne nationale. J’ai assuré plusieurs conférences de presse pour expliquer le dispositif de fermeture des classes, détailler les mesures préventives et annoncer l’ouverture des centres.
Par ailleurs, nous avons rédigé beaucoup de communiqués de presse pour accompagner les changements d’horaires d’ouverture ou l’assouplissement des conditions d’accès aux centres. Nous nous sommes bornés à transmettre des informations pratiques, de la manière la plus précise qui soit. Mais tout le monde ne lit pas la presse et donner les horaires, les adresses et les numéros de téléphone des centres ne suffit pas toujours.
M. le rapporteur. Avez-vous dû procéder à des réquisitions forcées de personnels ?
M. Bernard Fragneau. Sur un plan juridique, il s’agissait effectivement de réquisitions individuelles, mais elles n’étaient pas « forcées » comme à l’encontre des médecins qui faisaient grève en 2002. J’ai dû user également de mon pouvoir hiérarchique auprès d’un certain nombre de personnels relevant des services déconcentrés qui ne voulaient pas apporter leur quote-part à l’effort collectif.
M. le président Jean-Christophe Lagarde. Vous avez évoqué certaines contradictions dans le contenu des circulaires et instructions. De quel ordre étaient-elles ?
M. Bernard Fragneau. Il s’agissait surtout de contradictions entre ce que l’on nous disait et les textes. La date de début de la campagne a ainsi changé à plusieurs reprises. Nous avons appris par la presse ce que nous étions censés faire alors que nous n’avions pas reçu d’instructions. M. Luc Chatel a annoncé que la vaccination allait débuter dans les établissements scolaires alors que nous n’en avions pas été informés et que le dispositif n’était pas prêt. D’ailleurs, cet aspect de la campagne a été un échec total puisque les élèves ne se sont pas fait vacciner.
M. le président Jean-Christophe Lagarde. Avez-vous dû procéder à la fermeture de classes ? Aviez-vous une liberté d’appréciation ?
M. Bernard Fragneau. La règle était qu’à partir de trois élèves touchés dans une même classe, celle-ci devait fermer pour une durée n’excédant pas six jours. Lors du pic épidémique, entre 20 et 30 classes ont été fermées dans le Loiret.
L’Éducation nationale informait la direction départementale des affaires sanitaires et sociales (DDASS), qui évaluait la dangerosité de la situation. Le préfet demeurait libre de son appréciation, mais si une quinzaine d’élèves de la même classe présentaient les symptômes de la grippe A(H1N1), la question ne se posait pas. J’avoue avoir été étonné de la réaction des parents d’élèves, qui étaient plutôt favorables à la fermeture de classes.
M. le président Jean-Christophe Lagarde. Avez-vous été confronté en tant que préfet à d’autres épidémies ?
M. Bernard Fragneau. J’ai connu une épidémie de méningite dans le Jura, qui nous a conduits à vacciner l’entourage des malades en une matinée.
M. le président Jean-Christophe Lagarde. En général, les parents d’élèves demandent à ce que la classe ou l’établissement soient temporairement fermés.
Mme Marie-Louise Fort. Vous avez évoqué la multitude de circulaires et l’existence de consignes contradictoires. Pensez-vous qu’il faudra à l’avenir désigner des chefs de secteur ? Estimez-vous que la campagne d’information organisée par les pouvoirs publics sur la vaccination a été bien faite ? Avez-vous ressenti l’impact des appels à la non- vaccination, appels relayés notamment par la presse audiovisuelle ?
M. Bernard Fragneau. Le fait que des sommités médicales aient parlé d’une « grippette » sans danger n’a certainement pas incité les personnes à se faire vacciner. En outre, la presse quotidienne régionale – notamment La République du Centre – a fait paraître des articles très alarmistes sur les effets secondaires du vaccin. Enfin, certains médecins ont tout bonnement dissuadé leurs patients de se faire vacciner.
La presse a aussi servi de relais à des critiques parfois virulentes exprimées sur l’organisation du dispositif, dont certaines étaient même formulées par des responsables politiques nationaux. Celles-ci ont été très mal ressenties par les agents impliqués dans le fonctionnement des centres de vaccination, notamment par les personnels des directions départementales des affaires sanitaires et sociales, investis plus de douze heures par jour dans cette mission.
La France fait figure de modèle dans l’élaboration de plans de toute nature, mais elle les applique rarement. En la matière, le plan indiquait que le ministre de l’intérieur était aux commandes ; cela n’a pas empêché les autres ministères de prendre certaines initiatives, comme ce fut le cas pour le passage à l’an 2000, un épisode mémorable. Cependant, la chaîne de décision a bien fonctionné : la cellule interministérielle de crise (CIC), qui s’est réuni de façon régulière, a permis de donner une certaine unicité aux instructions.
La remontée des informations s’est avérée en revanche très compliquée, avec deux canaux, celui des directions départementales des affaires sanitaires et sociales et celui des préfets, qui transmettaient aux préfets de zone. Il faut savoir que Paris a exigé jusqu’à trois remontées d’information par jour, ainsi que de connaître chaque matin à 6 heures le nombre de personnes vaccinées la veille. Ces exigences se sont renforcées avec les critiques formulées à l’encontre du dispositif, mais elles n’avaient bien évidemment rien à voir avec son efficacité.
M. le rapporteur. La décision de fermeture définitive des centres de vaccination a été brutale et mal ressentie par les personnels médicaux et administratifs, les élus locaux et la population.
M. Bernard Fragneau. Il s’est bien sûr trouvé des personnes pour s’en plaindre, qui n’avaient pas eu l’idée de venir plus tôt. Mais il faut rappeler qu’au moment où la décision a été prise, il n’y avait plus aucune activité dans les centres. Il est toujours difficile de mettre fin à un dispositif. Ainsi, le niveau rouge du plan Vigipirate demeure activé parce que personne ne prend la responsabilité de le faire passer à l’orange ! Les autorités ont ainsi donné l’impression de ne pas oser arrêter la campagne, même si, localement, nous en attendions tous la fin avec impatience. Cela étant, celle-ci est survenue de manière effectivement brutale.
Mme Catherine Lemorton. Le préfet de la région Midi-Pyrénées, instruit par la première fermeture de collège à Quint-Foncegrives, qui avait donné lieu à l’hospitalisation controversée de plusieurs élèves, a pris la décision de ne plus fermer les établissements scolaires quand bien même 10 % de leurs effectifs étaient touchés. Cette décision a recueilli l’adhésion des enseignants et des parents d’élèves. Il faut dire que la fermeture semblait peu efficace, dans la mesure où les enfants continuaient de se fréquenter hors les murs. Savez-vous si les taux de contamination ont été moins élevés dans les régions où la règle de trois enfants par classe a été appliquée de manière plus systématique ?
M. Bernard Fragneau. Il n’y a pas eu de fermeture d’établissements dans le Loiret, même si deux collèges à Orléans ont été davantage touchés. Chaque jour, nous faisions remonter le nombre de classes fermées, mais je ne sais pas si elles apparaissent dans des statistiques nationales. Aucune de ces classes n’a été fermée une seconde fois, ce qui est un élément en faveur de la mesure. A-t-elle permis d’endiguer la propagation du virus ? Il est difficile de l’affirmer avec certitude.
M. le président Jean-Christophe Lagarde. Cette campagne a mobilisé les services de l’État, les services déconcentrés, les collectivités locales et nécessité des efforts considérables pour armer les centres et les faire fonctionner. N’aurait-il pas été plus facile et tout aussi efficace de s’appuyer sur les personnels de santé des réseaux de proximité ?
M. Bernard Fragneau. Dans le Loiret, nombreux étaient les médecins qui refusaient de vacciner, que ce soit par principe ou parce qu’ils considéraient la grippe A(H1N1) comme bénigne. J’ai donc été surpris par la campagne de protestation des médecins généralistes, organisée par la suite au niveau national.
Il faut bien dire que les cabinets médicaux qui permettent de recevoir les malades dans une salle d’attente et les personnes à vacciner dans une autre sont rares. Les médecins auraient pu scinder leur agenda en deux, mais cela aurait supposé qu’ils procèdent au nettoyage de leur salle d’attente avant de recevoir la population à vacciner. Il était donc difficile, si l’on s’appuyait sur ce réseau, de respecter à la fois l’exigence d’efficacité et le principe de précaution.
Le dispositif départemental, qui exigeait la présence d’un médecin, de six infirmiers et de cinq personnels administratifs par centre a été mis en place tant bien que mal. Il a permis de vacciner 55 000 personnes dans le Loiret. Que se serait-il passé s’il avait fallu en vacciner 650 000 ? Si une nouvelle pandémie devait se déclarer, je ne suis pas persuadé qu’une campagne de vaccination touchant plusieurs millions de Français pourrait être organisée.
M. le président Jean-Christophe Lagarde. Je vous remercie.
La séance est levée à dix-neuf heures.
Audition de M. Marc Girard,
consultant
(Procès-verbal de la séance du mercredi 9 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à vingt heures.
M. le président Jean-Christophe Lagarde. Docteur Marc Girard, je vous remercie d’avoir répondu à l’invitation de la commission d’enquête parlementaire sur la manière dont a été programmée, expliquée et gérée la campagne de vaccination contre la grippe A(H1N1).
J’indique à nos collègues que cette invitation a été demandée par M. Gérard Bapt et acceptée par le rapporteur, M. Jean-Pierre Door, et par moi-même.
(M. Marc Girard prête serment.)
M. Marc Girard. Monsieur le président, monsieur le rapporteur, mesdames et messieurs les députés, à quel titre vais-je me présenter devant vous ? Simplement comme celui qui peut justifier avoir introduit dans le débat public la quasi-totalité des éléments qui ont alimenté la légitime défiance de nos concitoyens à l’égard de la gestion de la grippe porcine. Dès le 28 avril 2009, lors d’une intervention sur la chaîne France 24, j’ai avancé les arguments que vous trouverez dans le script de l’émission, – pièce n° 1 du dossier que je vous ai remis. J’y posais notamment la question des conflits d’intérêts, demandant pour finir : à qui cela profite-t-il ?
Fondées chaque fois sur les données de l’expérience, mes interventions ultérieures sont revenues, notamment, sur l’art de créer des alertes en santé publique et sur la régularité du processus d’autorisation de mise sur le marché (AMM). En octobre, j’ai publié le livre dont je me suis permis de vous remettre un exemplaire et qui vise à replacer la question de la grippe A(H1N1) dans un contexte très large – historique, sociologique, épistémologique et politique.
À l’évidence, les frontières ont bougé, avec cette affaire : c’est la première fois qu’un débat de fond sur les vaccinations a pu sortir de l’éternelle guerre des religions entre pro- et anti-vaccins. Tous mes correspondants, qu’ils viennent des académies, des instances ordinales ou de la médecine militaire, ou qu’ils soient même pastoriens – lesquels ne sont pas des anti-vaccinistes – m’en attribuent le mérite : je le dis sans forfanterie, mais avec gravité.
Pour comprendre, il est utile de rappeler brièvement au terme de quel processus je suis tombé dans la marmite des vaccins. Consultant pour l’industrie pharmaceutique, estimé et confortablement rémunéré par les leaders du marché, n’ayant aucun intérêt personnel à me brouiller avec mes meilleurs clients, qui s’appelaient à l’époque Pfizer, GSK, Aventis, Novartis, Roche, j’ai été chargé par la justice française, au tout début des années 2000, d’expertiser dans le cadre de grandes affaires de santé publique impliquant des médicaments, notamment celle concernant la vaccination contre l’hépatite B. Par rapport à une profession alors fortement contrainte par une réglementation pointilleuse, j’ai alors découvert le secteur vaccinal comme une sorte de sédiment de pratiques pharmaceutiques dont je n’envisageais même pas qu’elles pussent encore exister – comme l’illustre la pièce n° 2 du dossier : une récente offre d’emploi d’un leader du secteur qui ne craint pas d’assumer le fait que, pour diriger le développement d’un projet vaccinal, « une compréhension » – et non, notez-le, « une expertise » – « des aspects cliniques de l’infectiologie serait très utile, mais pas essentielle ». Je ne commente pas.
Ce précédent me permet aussi de revenir sur les allégations de mes collègues experts qui justifient leur discrétion sur leurs liens d’intérêt par le fait que ceux-ci n’altéreraient en rien leur indépendance. La pièce 3, qui présente l’évolution de mon chiffre d’affaire réalisé avec l’industrie pharmaceutique, illustre clairement, je crois, qu’il faut bien du courage – ou de la témérité – quand on veut garder son indépendance en dépit de ces liens.
La question qui vous est posée aujourd’hui n’est pas de savoir comment les Français réagiront lors de la prochaine pandémie, en validant implicitement du même coup la mystification, désormais confirmée par la toute récente enquête du British Medical Journal, qui a consisté à faire accroire que nous venions d’en traverser une. Car cette pseudo-pandémie s’est fondée sur une triple exagération.
Exagération, d’abord, du nombre de personnes touchées, quand il est parfaitement établi aujourd’hui que, lorsque la pandémie a été déclarée, moins de 5 % des personnes répertoriées comme atteintes étaient effectivement positives pour le virus et que, par la suite, le délire des chiffres a été alimenté par des critères sémiologiques dont l’indigence saute aux yeux du moins professionnel : fièvre à 38 ° C, toux… Tous les Français ont vu des gamines la goutte au nez sortir de chez leur médecin paniquées avec une pile de masques et du Tamiflu ; il y a même eu des diagnostics par téléphone.
Exagération, ensuite, de la virulence du virus, avec des critères d’imputabilité des décès extraordinairement lâches et, en contradiction avec la réglementation en vigueur sur la pharmacovigilance, un refus systématique de considérer que les décès après prescription de Tamiflu aient pu correspondre à une toxicité du médicament.
Exagération médiatique, enfin, évidemment.
L’autre fausse question serait d’examiner comment protéger nos concitoyens des sectes. L’argumentaire antivaccinaliste, qui n’avait quasiment intéressé personne jusqu’à présent, a effectivement été examiné par des millions de Français indûment alertés : tout le monde s’est rendu compte de son indigence – je dispose à ce propos de remontées extrêmement convergentes –, de telle sorte qu’il n’est pas excessif de soutenir que, même s’ils surfent naïvement sur la vague, jamais les anti-vaccinalistes n’ont été aussi décrédibilisés qu’aujourd’hui. Dans une démocratie, quand 80 % des citoyens se sont prononcés sans ambiguïté, ils méritent mieux qu’une inquiétude condescendante quant à leur capacité à faire de bons choix.
La question n’est pas non plus de pointer les incompétences avec une sélectivité partisane. Certes, il y a des « Diafoirus d’internet », mais les experts consultés par le ministère ont été répétitivement démentis par les faits et les virologues, par exemple, n’ont jamais craint de se prononcer avec assertivité sur des questions de santé publique qui dépassaient clairement leur compétence. Sans qu’il s’agisse d’attaquer les personnes, c’est aussi l’occasion, parce que la question est importante, de se demander s’il est encore acceptable que, dans un grand pays comme la France, la direction de l’Institut de veille sanitaire soit confiée à une personne avec qui j’entretiens des liens professionnels fort paisibles depuis vingt-cinq ans, mais dont il est facile de montrer qu’elle n’a à son actif ni les titres, ni les travaux justifiant une telle responsabilité.
Permettez-moi donc de vous proposer un critère de crédibilité expertale dont je vous garantis qu’il ne vous laissera jamais dans la peine : le bon expert, c’est celui dont on peut se passer, celui qui saura exprimer les problèmes technico-réglementaires d’une façon qui vous permettra de vous réapproprier les éléments du débat dans l’ordre de votre propre compétence. Vous êtes des politiques : laissez-moi illustrer par trois exemples la façon dont vous pourriez reprendre en mains la situation.
Tout d’abord, vous avez voté l’article L. 4113-13 du code de la santé publique, qui fait obligation à tout professionnel de santé s’exprimant dans la presse de faire préalablement état de ses liens d’intérêt : jugez-vous normal que, de tous les experts concernés que vous avez auditionnés jusqu’à présent, aucun ne se soit spontanément plié à cette disposition que vous avez pourtant voulue ?
Ensuite, jugez-vous décent que la politique préventive du Gouvernement ait été justifiée par le principe de précaution, quand la loi Barnier que vous avez votée en 1995 dispose sans ambiguïté que les mesures prises en son nom doivent l’être « à un coût économiquement acceptable » ?
Enfin, vous avez inclus le code de déontologie médicale dans le code de la santé. Jugez-vous normal que les Français aient reçu de leur ministre une circulaire leur certifiant que le vaccin était sûr malgré les allégations contraires de l’Agence européenne du médicament (EMEA) – en contradiction, par conséquent, avec le principe déontologique sacré du consentement informé ?
Pour conclure brièvement, je proposerai une double lecture de la situation : l’une concernant le médicament et la santé publique, l’autre la politique.
Dans la vie d’un médicament, la phase de développement est incontournable. C’est le seul moment où l’on peut soumettre le nouveau produit à des évaluations contraintes par un minimum de rigueur : contrôle du processus de fabrication, tests chez l’animal, essais cliniques. Même si ces exigences peuvent être contournées, elles ne sauraient en aucun cas être remplacées par la promesse d’une pharmacovigilance qui serait assurée une fois le produit sur le marché. En l’espèce, alors que l’Agence européenne du médicament reconnaissait sans fard que le rapport risque/bénéfice du produit n’avait pu être évalué au cours du développement, l’administration sanitaire ne rougit pas de clamer, une fois le produit sur le marché, que les données de la pharmacovigilance « ne modifient en rien » le rapport risque/bénéfice du produit, lequel n’avait justement pas été évalué. C’est dire, avec un certain cynisme, que ce rapport bénéfice/risque n’a été et ne sera jamais évalué et que ces produits, pour lesquels on a un temps envisagé une obligation vaccinale, sont proprement défectueux au sens légal du terme. Or, cette séquence – développement bâclé sur la fallacieuse promesse d’une pharmacovigilance qui ne viendra jamais – est exactement celle qui sous-tend la proposition de directive modifiant la directive 2001/83/CE, actuellement en discussion à Bruxelles : ce projet est proprement effrayant et la récente histoire des vaccins contre la grippe porcine est l’éloquent prélude de la caricature technico-réglementaire que les lobbies pharmaceutiques cherchent désormais à mettre en place.
Si j’ai maintenant l’audace de vous proposer une lecture politique, au sens étymologique du terme, je me tourne vers la préface à l’édition française, datée de février 2009, de l’ouvrage L’État prédateur, où l’économiste américain James Galbraith, digne fils de son père, admettait que sa réflexion portait d’abord sur les États-Unis tout en postulant qu’elle touchait à une dynamique bien plus universelle. Il n’aura pas fallu plus de deux mois pour le confirmer, car ce qui frappe le plus, dans cette histoire grippale dont les enjeux financiers ne sont même pas niés par ceux qui en profitent, c’est qu’à aucun moment on n’a entendu la voix promotionnelle des fabricants : la publicité de ces produits a été assurée par la voix du ministre et de ses conseillers, au moyen d’arguments qui, dans n’importe quelle autre situation, eussent été sanctionnés par la commission chargée du contrôle de la publicité et de la diffusion des recommandations sur le bon usage des médicaments. Bien pis : le Gouvernement n’a pas craint de recourir – et c’est là le plus important à mes yeux – à la réquisition, authentifiant ainsi de la façon la plus extrême une mystification sanitaire dont les déterminants lucratifs sautaient pourtant aux yeux. Se trouve dès lors illustrée de la façon la plus éloquente la thèse de l’Américain selon laquelle la déréglementation n’est pas la loi de la jungle au profit de lobbies, mais l’appropriation par les lobbies de l’autorité et de la puissance de l’État au bénéfice de leur prédation. En l’espèce, on les a donc vus capables de détourner à leur profit la plus extrême des prérogatives de l’État dans un pays qui a banni la peine de mort : son pouvoir de contrainte sur les corps – mais au seul bénéfice de la liquidation des stocks.
Mesdames et messieurs les députés, j’espère vous avoir convaincus que les Français n’ont nul besoin des sectes anti-vaccinalistes pour être légitimement inquiets.
M. Gérard Bapt. Pouvez-vous nous donner des informations supplémentaires sur le projet de directive que vous jugez très dangereux et qui serait en préparation à l’échelon européen ?
Par ailleurs, la pharmacovigilance existe bel et bien. On trouve notamment sur les sites de l’Agence française de sécurité sanitaire des produits de santé et de l’Agence européenne du médicament, le nombre des décès mis en relation avec la vaccination – de 15 à 25 en France et 121 à l’échelle de l’Union. La question est de savoir si on peut en tirer des conclusions en termes de rapport bénéfice/risque.
M. Marc Girard. Il y a quelque chose que j’ai du mal à comprendre. Pour un chef d’entreprise, la faillite peut emporter interdiction de diriger une entreprise. Quand un médecin fait une faute médicale, il peut être interdit d’exercice. Vous, hommes politiques, pouvez être déclarés inéligibles. Or, depuis le début de cette histoire, je suis frappé par la remarquable impunité qui entoure les opinions des autorités sanitaires et des experts qui leur sont associés, alors qu’il est patent, et démontrable, que, sur bien des points, ces autorités n’ont pas été crédibles. Dès lors que Mme Bachelot-Narquin déclare devant tout le monde que le vaccin est sûr, comment l’administration sanitaire pourrait-elle dire que, finalement, il n’était pas si sûr que cela ? Voilà un premier point.
Deuxièmement, voilà trente ans que je fais de la pharmacovigilance et, n’en déplaise à certains qui voudraient oublier que j’en suis quand même l’un des pères fondateurs, j’ai précisément obtenu un prix de thèse en 1983 pour avoir démontré que les méthodes d’évaluation de causalité de l’agence étaient inopérantes. Et je n’ai pas changé d’avis depuis.
Comment les choses se passent-elles : un effet grave fait l’objet d’examens et d’analyses, puis on n’en entend plus parler, au motif qu’il n’y aurait pas plus de cas signalés que de cas attendus. Mais c’est négliger la sous-notification, qui est de l’ordre de 99 %. À cela s’ajoute le mécanisme scandaleux observé notamment dans le dossier Gardasil, vaccin pour lequel on affirme aujourd’hui qu’il n’y a pas lieu de modifier le rapport risque/bénéfice. Mais par rapport à quoi le modifierait-on puisque, en délivrant l’autorisation de mise sur le marché (AMM), l’Agence européenne du médicament déclarait textuellement – je l’ai déjà souvent cité – que cela se faisait dans des conditions exceptionnelles : en l’absence de données d’efficacité et de tolérance adéquates ?
En un mot, ce que je dénonce, c’est le mauvais fonctionnement de la pharmacovigilance.
Le propos de la directive scélérate en préparation à Bruxelles est de libérer les fabricants du carcan du développement et des essais cliniques – qui du reste peut être contourné, comme on l’a vu avec l’affaire du Vioxx – tout en rassurant par la promesse que les produits seront étudiés, dans le cadre de la pharmacovigilance, lorsqu’ils seront sur le marché. Or, comme c’est le cas pour le vaccin contre l’hépatite B, les études qui font apparaître des effets indésirables sont réfutées comme n’étant pas scientifiques et sont mises en balance avec celles qui ont été faites, d’une façon plus ou moins transparente, par les fabricants.
Le véritable enjeu est aujourd’hui le déport de l’essentiel de l’évaluation du médicament, telle qu’elle est exigée par les textes depuis très longtemps, de la phase de développement – c’est-à-dire du « pré-AMM » – au « post-AMM », permettant une accélération du processus de mise sur le marché et, par conséquent, de la commercialisation, contre la promesse d’une pharmacovigilance qui ne viendra jamais. Les analyses de pharmacovigilance du vaccin contre l’hépatite B, du Gardasil et du vaccin contre le H1N1
– on les trouve sur mon site – avancent toujours les mêmes arguments, à savoir que les effets observés ne sont pas liés au vaccin. On ne constate aucun progrès. C’est très dangereux.
M. Gérard Bapt. L’Agence européenne du médicament fait pourtant bien état de 176 décès du fait du Celvapan, du Focetria et du Pandemrix – dont 151 attribuables au seul Pandemrix. Dès lors que nous disposerons des études épidémiologiques, par pays et en fonction des taux de vaccination, j’imagine que nous pourrons déterminer le rapport bénéfice-risque, prenant en compte les effets indésirables, les hospitalisations, les décès…
M. Marc Girard. Monsieur le député, si 176 décès ont été rapportés, quel est, selon vous, le taux de sous-notification ? Lors du développement du vaccin, la puissance statistique de la détection des effets indésirables, telle qu’elle figure dans le dossier de l’Agence européenne du médicament, était de 1 % – c’est-à-dire que l’agence ne se déclarait en mesure de détecter un effet indésirable que si sa fréquence atteignait 1 %. En envisageant une vaccination obligatoire – portant donc en France sur 65 millions de sujets –, le potentiel d’effets indésirables était de 650 000. Il est effarant que l’agence européenne et les autorités aient assumé ce risque sans ciller. Le problème est là.
Quand bien même il n’y aurait eu, comme vous le dites, que 176 décès, il est un fait qui interpellerait n’importe quel spécialiste de recherche clinique connaissant un tant soit peu la méthodologie : pourquoi, lorsque vous avez vacciné des millions de gens, n’y a-t-il eu que 176 décès, alors que, comme j’ai du reste été seul à le souligner, il y en a eu 7 sur 2 000 patients traités durant le développement du vaccin de Glaxo ? C’est là une proportion que je n’ai jamais rencontrée en trente ans de recherche clinique – et particulièrement frappante pour un vaccin à visée préventive.
Il est donc impossible de pousser plus loin l’analyse, faute d’éléments. Exigez donc qu’on vous communique les données de pharmacovigilance et nous les analyserons – je l’ai déjà fait dans le dossier du vaccin contre l’hépatite B. Les comptes rendus de pharmacovigilance actuellement publiés sur le site de l’Agence française de sécurité sanitaire des produits de santé n’ont véritablement aucune crédibilité.
À cela s’ajoutent les témoignages convergents qui me parviennent de la « base » : effets indésirables graves, comme cela a d’ailleurs été le cas avec le vaccin contre l’hépatite B ; refus forcené – on oserait presque dire : « hystérique » –, de la part de praticiens, de considérer qu’un décès survenu chez un quadragénaire dans la demi-journée qui suit la vaccination pourrait être une complication de celle-ci ; cas de chocs allergiques chez des femmes enceintes, suivis quelques heures après d’un avortement, et que l’on refuse d’imputer au vaccin.
Mme Catherine Lemorton. Monsieur Marc Girard, merci de votre témoignage. Je tiens à m’étonner, avec colère, que notre assemblée n’ait pas débattu de la directive sur la pharmacovigilance.
J’ai été alertée très tôt par le collectif Europe et Médicament qu’une circulaire délétère était en préparation à Bruxelles. La commission des affaires européennes de notre assemblée a été jugée seule habilitée à statuer sur cette circulaire, sur le rapport de Mme Valérie Rosso-Debord. Cependant, cette commission ne comporte, à gauche comme à droite, aucun spécialiste de pharmacovigilance. Je m’en suis émue très vite au sein de la commission des affaires sociales, demandant que celle-ci soit au moins saisie pour avis.
Je tiens à alerter mes collègues : ce qui se prépare à Bruxelles est très grave. Les laboratoires pharmaceutiques ont fait auprès des instances européennes un important lobbying en vue de réduire la phase de développement et d’essais cliniques, puis d’assurer les plans de gestion de risques et le suivi des effets secondaires, pour s’approprier le recueil et la libération des effets secondaires – ce qui peut éventuellement se traduire par le retrait du marché. On ne saurait imaginer conflit d’intérêts plus flagrant.
Aujourd’hui, tous les centres de pharmacovigilance sont alertés et reprochent vigoureusement à notre assemblée la manière dont elle a traité cette question. Je ne reproche pas, quant à moi, à mes collègues de la commission des affaires européennes d’avoir rendu un avis, car on ne peut pas tout connaître, mais je sais que, pour ma part, ne connaissant pas bien les affaires étrangères, je ne manquerais pas de demander, si j’en avais besoin, l’avis de spécialistes. Nous avons fait une très grave erreur et sommes en train de livrer la pharmacovigilance européenne aux industries pharmaceutiques. Il serait fort étonnant que ces entreprises fassent retirer l’un de leurs produits du marché après quelques mois d’utilisation, quels que soient les effets secondaires. Elles ne libéreront ceux-ci que lorsqu’elles auront rentabilisé ces produits.
Cette affaire me reste d’autant plus en travers de la gorge que le débat était soumis à une date butoir et que, bizarrement, au mois de novembre, la commission des affaires sociales n’a pas pu se réunir le dernier mercredi où elle aurait pu se saisir du dossier.
J’en viens à mon deuxième point, qui est une question. Face à une telle pandémie et à l’urgence de la mise sur le marché des vaccins, je me suis d’emblée beaucoup préoccupée des modèles. On nous a expliqué que, puisqu’il existait un vaccin contre la grippe saisonnière, on pouvait en extrapoler le modèle à destination des adultes. Il ne me semble en revanche guère justifié d’avoir extrapolé à destination des enfants ce modèle qui n’existait pas pour leur âge. À l’exception peut-être de quelques centaines d’enfants très gravement malades ou cardiaques que l’on vaccine du reste par demi-doses, comment expliquer que l’on puisse envisager avec autant de légèreté de vacciner les enfants de six à vingt-quatre mois, qui sont déjà abondamment vaccinés ? Par ailleurs, face à la baisse de la demande de vaccination contre l’hépatite B, la stratégie de l’industrie pharmaceutique consiste désormais à proposer un vaccin hexavalent comportant ce vaccin et permettant ainsi de vacciner contre l’hépatite B les enfants sans que leurs parents le sachent. Les enfants sont ensuite vaccinés contre la rougeole, les oreillons et la rubéole, avec le ROR, puis reçoivent des rappels de l’hexavalent. En outre, on vaccine à nouveau contre la tuberculose, qui fait résurgence à la faveur de la précarité qui s’installe chez certaines populations de notre pays.
Les enfants sont donc énormément vaccinés. Or, un vaccin n’a rien d’anodin. Quoi qu’on dise dans la presse, je ne fais pas partie des sectes antivaccinales et je peux d’ailleurs montrer le carnet de vaccination de mes enfants : ils sont vaccinés contre tout ! Cependant, une vaccination s’accompagne toujours d’un choc immunitaire. Quand on injecte un agent pathogène, le corps réagit : que dire quand on en injecte six à un bébé de trois mois, et qu’on en ajoute éventuellement un autre, celui contre la grippe A(H1N1), sans avoir jamais fait de tests cliniques ?
Monsieur Marc Girard, sur combien d’enfants de cette tranche d’âge, sollicitée immunitairement, a-t-on fait de tests cliniques ? A-t-on lancé la vaccination de cette génération sans avoir réalisé ces tests, en se disant qu’on verrait bien ce qui se passerait ?
M. Marc Girard. Avant de répondre à cette question, je reviendrai sur la directive scélérate. Comment se fait-il – et je vous pose la question naïvement – que la seule commission d’enquête qui ait été refusée soit celle du Parlement européen, alors que toutes les conditions nécessaires étaient remplies ? Vous pourriez penser que les députés européens sont moins habiles que vous, mais j’ai une autre idée. Il ne faut pas non plus imputer ce refus au manque de spécialistes de pharmacovigilance au sein d’une commission, car il est toujours possible d’en trouver. En revanche, ce projet de commission d’enquête est le seul qui ait été inspiré par un spécialiste de pharmacovigilance – suivez mon regard ! Il était donc clair que cette commission se serait intéressée non seulement à l’Organisation mondiale de la santé mais aussi à l’Agence européenne du médicament, et aurait ouvert – ce qui n’aurait pas manqué pas d’être « saignant » – le dossier d’enregistrement des vaccins, en s’intéressant notamment aux sept morts dont on nous dit aujourd’hui qu’elles n’ont pas été causées par le vaccin – sans nous dire pour autant à quoi elles sont dues. À l’évidence, l’Agence européenne du médicament a senti venir le coup. Vous êtes des politiques, pas moi. Je trouve effrayants les mécanismes souterrains par lesquels cette demande d’enquête a pu être sabordée.
Pour ce qui est du nombre, bien que je n’aie pas le dossier sous la main, je crois me souvenir que quatre cents enfants ont reçu le vaccin Pandemrix et que deux hépatites auto-immunes se sont déclarées : c’est quand même beaucoup. Vous avez rappelé avec beaucoup de pertinence que ce n’est pas être antivaccinaliste que de dire, comme nous l’avons appris voilà trente ans à la faculté, que tout vaccin comporte un risque minime de réaction auto-immune. Ce risque peut être acceptable si le vaccin protège contre une maladie très grave comme la poliomyélite ou le tétanos, et s’il n’y a pas trop de vaccins. Mais au fur et à mesure que vous augmentez indûment le nombre de ceux-ci, vous augmentez mécaniquement, statistiquement, le risque de pathologies auto-immunes.
Pourquoi une telle excitation à propos du vaccin contre la grippe ? La grippe est peut-être une maladie très grave, mais il ne faut pas exagérer : voilà encore trois ou quatre ans, on la soignait en prenant un grog et en se mettant au lit ! Cependant, de tous les vaccins disponibles, le vaccin contre la grippe est le seul qu’on peut prescrire à nouveau tous les ans. L’espérance de vie étant aujourd’hui en France de l’ordre de quatre-vingt ans, s’il faut vacciner tout le monde chaque année, chacun recevra 80 immunisations au cours de son existence – mais avec trois antigènes, ce qui signifie que, pour une maladie strictement bénigne, vous recevrez, pour le seul vaccin antigrippe, 240 immunisations au cours de votre vie. Ce n’est pas compatible avec la prudence hippocratique. En outre, je mets au défi quelque autorité sanitaire que ce soit de me montrer les études permettant d’évaluer le risque d’une telle surimmunisation.
Pour qui a un peu l’habitude de la pharmacovigilance se pose un autre problème, totalement sous-estimé : celui des morts subites du nourrisson. Songez au nombre de gamins qu’on vaccine… Or, voici comment fonctionne la pharmacovigilance : un gamin meurt. Il a été vacciné deux ou trois jours avant. On parle alors de mort subite. Parfois, on n’enquête même pas. J’ai même vu un article dans lequel, au lieu de se demander s’il y avait un lien avec le vaccin, les auteurs indiquaient fièrement que l’enfant était à jour de ses vaccinations. Or, c’est peut-être bien parce qu’il était à jour de ses vaccinations…
On parle de « sectes antivaccinalistes » et de guerre de religions. Pour ma part, je me suis efforcé d’intervenir en professionnel pour rappeler que les vaccins sont des médicaments comme les autres, avec leur potentiel d’effets indésirables. Ainsi, je ne comprends pas M. Bernard Debré – et s’il était là, je le dirais de la même manière –, qui a été l’un des premiers à employer la jolie formule de « grippette » : s’il s’agissait d’une grippette, pourquoi fallait-il vacciner les enfants ? Il entre là de l’inconscient, qui fait dire que les vaccins ne sont pas dangereux. Je cite souvent l’exemple du dossier de l’Engerix, le vaccin contre l’hépatite B. Savez-vous combien de temps ont duré les études de tolérance pour ce vaccin – sachant qu’il s’agit d’un dossier américain, beaucoup plus lourd que s’il s’était agi de l’Institut Pasteur ? Quatre jours ! Il n’est pas besoin d’être un professionnel de santé pour comprendre…
Un vaccin est un médicament fait pour induire en vous des effets immunitaires, présumés bénéfiques, pendant des années, voire des décennies. Par quelle inconscience, par quelle inconséquence peut-on considérer que, si un médicament est apte à générer chez vous des effets immunologiques bénéfiques pendant des dizaines d’années, il ne serait pas apte, du même coup, à générer des effets immunologiques néfastes ? Or, avec le vaccin contre l’hépatite B, il est question de sclérose en plaques et de maladies auto-immunes : on est au cœur du problème, mais cela n’a pas été étudié.
M. Jean-Pierre Door, rapporteur. Vous êtes un procureur implacable. À titre personnel, je tiens à dire que je ne cautionne aucun de vos propos sur les vaccins, et que je les trouve même très inquiétants. Qu’on pense seulement aux résultats des vaccins contre la polio, le tétanos ou la variole !
Je m’exprime maintenant en ma qualité de rapporteur. La commission d’enquête a accepté votre audition, à la demande de M. Gérard Bapt, et il sera pris note de vos propos. Puisque vous avez critiqué sévèrement la sécurité des vaccins et avez même déclaré en septembre sur une chaîne de télévision qu’il pourrait y avoir 60 000 décès liés au vaccin, à raison d’un décès par 1 000 personnes vaccinées, comment interpréter le fait que près de 6 millions de personnes ont été vaccinées et que l’on n’ait pas constaté cette hécatombe ? De tels propos tenus sur une chaîne de télévision m’inquiètent et vous me permettrez d’en être choqué.
M. Marc Girard. Monsieur le rapporteur, je vous renvoie à la pièce n° 3 du dossier que je vous ai remis. Si j’étais aussi imprudent que vous le sous-entendez, j’aurais eu beaucoup plus d’ennuis encore. Je pense d’ailleurs avoir répondu à la question. En outre, j’ai dit que je ne voulais pas parler des vaccins en général. Je crois avoir une certaine originalité dans ce débat. Les vaccins sont des médicaments parmi d’autres. Certains sont bons et d’autres mauvais. Par exemple, pour un spécialiste de pharmacovigilance, il sautait aux yeux, à la lecture des rapports périodiques de tolérance du vaccin contre l’hépatite B, que ce vaccin était toxique.
Par ailleurs, bien que je n’aie pas fait la transcription de toutes les émissions de télévision auxquelles j’ai participé, je me souviens assez bien de celle que vous citez. Je n’ai jamais affirmé : « Il va y avoir 60 000 morts ». Comme je l’ai dit tout à l’heure à M. Gérard Bapt, j’ai expliqué une question de puissance statistique : risque contre risque. J’ai associé au risque qui nous était indiqué le risque théorique de mourir de la grippe. Avec un seuil de détection de 1 sur 1 000 ou, ce qui est compatible, de 1 sur 10 000, on obtient, par une simple règle de trois, un risque de 600 000 effets indésirables graves – car je n’ai pas parlé de « décès ». Je ne comprends pas... C’est un peu comme quand on nous parle de principe de précaution en faisant abstraction du débat sur sa pertinence : c’est un principe de précaution à sens unique. Quand bien même il y aurait un risque lié à la grippe, pourquoi ne tient-on jamais compte du risque propre aux vaccins ? Je le maintiens et le répète devant vous, sans avoir le moins du monde l’impression de me décrédibiliser : je ne peux pas vous garantir que personne de votre famille, un enfant par exemple, ne va mourir de la grippe, mais, sur la base d’une expérience de trente ans de recherche clinique très axée sur la pharmacovigilance, toutes choses égales par ailleurs, je dis que les risques que vous encourez à assumer une grippe normale et ceux que vous encourez à vous faire vacciner avec des vaccins bâclés en deux mois sont sans commune mesure. Voilà ce que j’affirme.
M. le président Jean-Christophe Lagarde. Pour ne pas être comme vous un spécialiste de ces questions, mais simplement quelqu’un qui essaie de se documenter, j’avoue que je suis, comme le rapporteur et comme d’autres sans doute ici, assez impressionné par le caractère très affirmatif des propos que vous tenez tant sur les laboratoires que sur les vaccins. J’aurai tout à l’heure quelques questions à vous poser.
Je me contenterai, à ce stade, d’une observation. Vous avez prêté serment de dire la vérité, toute la vérité. Or, ce que vous venez de dire concernant vos déclarations sur France 24 est un mensonge. Le texte a été caviardé sur votre site internet, mais j’ai fait rechercher le verbatim de l’intégralité de l’interview que vous avez donnée à cette chaîne en septembre 2009 :
« Question : La France a commandé 92 millions de doses de ce vaccin, qui a été préparé en six mois, donc très rapidement. Quels sont les risques ?
« M. Marc Girard. On développe un vaccin dans des conditions d’amateurisme que je n’ai jamais vues. Prenons l’hypothèse pessimiste d’un décès chez 1 000 patients. On va vacciner 60 millions de gens. Eh bien, vous allez avoir 60 000 décès et, cette fois-ci, des gens jeunes, des enfants, etc. »
Vos affirmations avaient un caractère aussi péremptoire que tout ce que je viens d’entendre.
Dans la même interview, un peu plus loin :
« Maintenant, quand on regarde les quelques données qui sont quand même disponibles au regard des spécialistes, on se rend compte que c’est effrayant. Par exemple, il y a un essai clinique avec 1 100 patients. Il y a un mort, alors on dit : " C’est pas lié au vaccin ". Moi, j’aimerais bien savoir pourquoi. Ça fait trente ans que je fais du développement ».
Vous nous avez d’ailleurs resservi le même argument tout à l’heure.
Si ce que vous avez effectivement dit en septembre 2009 s’était avéré, et non pas ce que vous venez d’affirmer en disant qu’il y aurait des effets indésirables – à moins que, dans votre esprit, le décès soit un effet indésirable –, il y aurait déjà six mille morts. Où sont ces six mille morts ?
M. Marc Girard. Soixante mille.
M. le président Jean-Christophe Lagarde. Six mille, puisqu’il y a eu 6 millions de vaccinés. Je sais encore calculer, même si je raisonne « comme un chaudron » !
M. Marc Girard. Il y en a déjà 140, dit M. Gérard Bapt.
M. le président Jean-Christophe Lagarde. Les autres sont à venir ?
M. Marc Girard. Où est le taux de sous-notification ?
M. le président Jean-Christophe Lagarde. Je vous demande, pour comprendre, où sont les 6 000 morts que vous annonciez sur France 24 en septembre 2009.
M. Marc Girard. Quel est le facteur de sous-notification, à votre avis, quand toute l’administration sanitaire s’est liguée pour dire aux médecins que ce vaccin était sûr, avant même qu’il n’obtienne l’autorisation de mise sur le marché ?
M. le président Jean-Christophe Lagarde. Si je comprends bien, on aurait caché 5 800 morts. L’administration sanitaire, dans son ensemble, aurait accepté l’idée de cacher 5 800 décès liés à la vaccination.
M. Marc Girard. Vous êtes dans l’interprétatif.
M. le président Jean-Christophe Lagarde. Non, monsieur, je ne suis pas dans l’interprétatif : je lis vos propos. Je préside cette commission et j’ai tout de même le droit de poser des questions et de ne pas laisser dire n’importe quoi, surtout un mensonge. Je n’ai pas de parti pris, mais je viens d’entendre des choses péremptoires qui, si elles étaient vraies, mériteraient légitimement que les parlementaires que nous sommes, même s’ils sont membres d’un Parlement « croupion » et si « les résultats des commissions d’enquête sont connus d’avance » – je ne relirai pas toutes vos déclarations sur ce thème –, les soumettent à un examen très attentif.
Néanmoins, après avoir entendu vos explications et vos interprétations péremptoires de la manière dont, pour le dire d’un mot, tout cela a été monté par le lobby pharmaceutique, je m’interroge.
Lorsque je vous demande où sont les six mille décès, et alors que M. Gérard Bapt évoque 176 morts, vous dites que l’administration sanitaire s’est liguée pour les cacher. Je pourrais comprendre, et cela me paraîtrait plus crédible, que vous disiez que, la pharmacovigilance étant insuffisante, on ne connaît pas la réalité aujourd’hui. En revanche, expliquer sur un média destiné au grand public qu’il va y avoir 60 000 morts si on vaccine toute la population, et expliquer devant cette commission d’enquête que l’administration sanitaire, aux mains des lobbys pharmaceutiques – point sur lequel je ne me prononcerai d’ailleurs pas –, aurait caché 6 000 morts, me paraît aussi crédible que l’affirmation selon laquelle c’est George Bush qui a organisé les attentats du 11 septembre.
M. Marc Girard. Je peux vous répondre. On sait comment se déroulent ces émissions et vous êtes des hommes de la parole. Quant au script, je le vérifierai.
M. le président Jean-Christophe Lagarde. Il est ici.
M. Marc Girard. Je le vérifierai, mais je suis un peu surpris
M. le président Jean-Christophe Lagarde. Vous l’avez caviardé sur votre site.
M. Marc Girard. Caviardé ?
M. le président Jean-Christophe Lagarde. Vous ne reprenez pas ces propos. Vous vérifierez et vous y rajouterez vos prévisions, afin qu’elles puissent être comparées à celles des autres experts, que vous qualifiiez tout à l’heure de « collègues » et qui ont, quant à eux, prévu 30 000 décès à cause de la grippe – lesquels ne se sont pas produits non plus, je vous l’accorde.
Que les autres experts se trompent et se soient trompés à chaque fois, comme vous venez de le dire, peut inviter chacun à un peu plus d’humilité.
M. Marc Girard. Je vérifierai. De toute façon, je me plaçais dans une perspective qui a constamment été la mienne : celle de la puissance statistique – qui consiste à dire, toutes choses égales par ailleurs, ce qui peut se passer.
Par ailleurs, vous m’avez interpellé sur mes engagements passés. Je me permets de vous rappeler quand même…
M. le président Jean-Christophe Lagarde. Il n’a pas été question de vos engagements passés.
M. Marc Girard. Pour ce qui est de mon travail passé, je dois aussi ma connaissance des mécanismes de la pharmacovigilance aux milliers d’heures que j’ai passées, sur ordre du pôle santé, à les décortiquer. C’est la raison pour laquelle je dis que je n’ai pas grande confiance en la pharmacovigilance.
Nous ne jouons pas à armes égales, car je suis tenu au secret de l’instruction. Si vous me déchargez du secret de l’instruction en vertu de vos pouvoirs d’investigation, je pourrai vous dire bien des choses.
M. le président Jean-Christophe Lagarde. Monsieur Marc Girard, la question n’est pas là. D’abord, je ne vous ai rien demandé concernant vos activités passées : vous venez de l’imaginer. J’ai simplement remis les déclarations que vous avez faites ce soir en relation avec celles que vous faisiez voici quelques mois. Je ne suis le défenseur d’aucun groupe de pression. On chercherait en vain la preuve du contraire : je n’avais jamais rencontré aucun laboratoire avant cette commission d’enquête et je n’en ai rencontré que dans le cadre de celle-ci.
Je ne doute pas que vos connaissances soient infiniment supérieures aux miennes, qui sont inexistantes. J’ai simplement, comme citoyen et comme parlementaire, le souhait d’y voir clair. Qu’il s’agisse de vos confrères ou de vous-même, il me semble difficile de se fonder sur la parole des experts, tant de précisions ayant été systématiquement infirmées. Je n’ai donc pas parlé de vos expériences passées et me contente de dire que, pour défendre les intérêts de la collectivité, chacun gagnerait à un peu plus d’humilité dans ses prévisions et dans ses analyses.
J’ai lu par ailleurs que vous jugiez inutile la campagne de vaccination contre la grippe saisonnière. Pouvez-vous l’expliquer aux membres de la commission – cette fois avec des faits, et non pas à l’aide de chiffres extrapolés ou fantasmés ? C’est là en effet une position originale parmi les personnes auditionnées – y compris celles qui étaient hostiles à la vaccination en général ou opposées à la vaccination contre la grippe A(H1N1). Vous pourriez sans doute, avec des arguments scientifiques et peut-être plus mesurés, nous expliquer en quoi la campagne de vaccination qui a lieu chaque année et qui est remboursée par l’État pour un certain nombre de publics – et qui donc nous concerne à double titre en tant que parlementaires – vous paraît inutile, voire nuisible.
M. Marc Girard. C’est très facile. Je suis engagé par les centaines de pages que j’ai écrites sur le sujet. Je me permets de rappeler que le 1er septembre 2009, j’ai été le premier Français à faire intervenir dans le débat national les fameuses évaluations Cochrane, dont le diagnostic est absolument convergent : les vaccins contre la grippe ne fonctionnent pas.
Cela me permet d’ailleurs de rebondir sur la question de Mme Catherine Lemorton : il y a eu un dérapage réglementaire consistant à appliquer aux modifications des vaccins contre la grippe, au lieu d’une nouvelle autorisation de mise sur le marché (AMM), ce qu’on appelle en termes réglementaires une « variation de type II », ce qui est un coup de force. Alors que, pour modifier ne serait-ce qu’un excipient du Doliprane par exemple, il faut présenter un nouveau dossier d’AMM, ce qui prend au moins un an, il s’agissait ici de changer l’antigène, le principe actif du vaccin – ce qui signifie, par définition, qu’on ignorait absolument quels en seraient les effets à l’intérieur de l’organisme. La réponse a été que tout cela était du pipeau, qu’on savait faire et, de fait, tout a été fait en deux mois – je vous renvoie pour cela aux propos du Professeur Marc Gentilini. Pour un spécialiste du médicament, c’est atterrant.
M. le président Jean-Christophe Lagarde. Cela signifie-t-il qu’à vos yeux, tous les vaccins réalisés chaque année contre la grippe saisonnière sont dangereux ?
Je cite encore, à cet égard, un extrait de la même émission télévisée :
« Question. C’est presque grave, ce que vous dites là. On est prêt à tous se faire vacciner, et vous, vous dites : il ne faut pas se faire vacciner. On est bien d’accord ?
« M. Marc Girard. Oui. C’est un vaccin qui est absolument développé à la va-vite, dans des conditions qui mettent en danger la santé publique. »
En quoi ces vaccins ont-ils mis la santé publique plus en danger que les vaccins saisonniers ? Considérez-vous que les deux, en réalité, la mettent en danger ?
M. Marc Girard. Malheureusement, on se heurte là à des limites pharmaceutiques. Prenons l’exemple d’un médicament bien connu : pour développer le Prozac, qui est un produit hyper-simple, composé d’un principe actif et d’excipients, il a fallu quinze ans. Certes, il ne s’agissait pas de la grippe. Cependant, le fabricant du Prozac avait autant envie que les autres de faire de l’argent. Le fait qu’il ait passé quinze ans à développer ce produit donne une indication du temps nécessaire pour procéder à des essais, rédiger des documents et faire ce qui doit être fait. Dans des situations d’urgence, on peut certes contraindre les choses, mais je dis, je maintiens et je maintiendrai toujours qu’il n’est pas raisonnable de faire des vaccins en deux ou trois mois. La réglementation européenne qui a accepté de substituer à une nouvelle AMM une variation de type II a été un coup de force réglementaire.
Mme Marie-Louise Fort. Je n’ai pas de questions. Je suis probablement l’une des seules ici à ne pas être médecin…
M. le président Jean-Christophe Lagarde. Avec moi !
Mme Marie-Louise Fort. Je suis atterrée par vos propos, qui me ramènent à une période que j’ai connue quand j’étais petite fille, au début des vaccinations antipoliomyélitiques : je me souviens des scandales que provoquaient, dans certaines écoles, les parents qui, à l’instigation de certaines personnes, venaient reprendre leurs enfants pour qu’ils ne soient pas vaccinés.
Tout au long des travaux de cette commission d’enquête, et cet après-midi encore, nous avons entendu des témoignages selon lesquels les populations les plus défavorisées de notre pays ne souhaitaient pas se faire vacciner, faute d’avoir eu accès aux bonnes informations.
J’ai d’abord cru que vous étiez passionné, mais je crois maintenant qu’il y a là plus que de la passion. Dans mon esprit, les médecins ont une obligation de moyens, et non pas forcément de résultats. En outre, si l’espérance de vie augmente, c’est sans aucun doute parce que nous avons eu tous ces vaccins. Si vous avez toutes les qualités que vous alléguez – je ne vous connais pas –, le discours que vous tenez sur tous les médias est de nature à faire que les gens ne croient plus en rien, et c’est très dommage. De fait, les extraits de votre interview que nous a lus le président sont atterrants.
Je voulais vous faire part de mes impressions. Si je peux comprendre qu’on engage une forme de croisade contre ce qui serait de nature à détériorer la pharmacologie à l’avenir, il me semble tout de même que ce qui est excessif n’a pas de poids.
M. le président Jean-Christophe Lagarde. Vous avez déclaré qu’un vaccin n’est acceptable que dans le cas de maladies très graves, comme la poliomyélite ou le tétanos, et s’il n’y a pas beaucoup de vaccins, c’est-à-dire, je suppose, s’il n’y a pas à vacciner trop de monde.
Cela signifie-t-il que les vaccins contre la polio ou le tétanos, qui s’appliquent à toute la population par obligation légale, font courir aux gens un risque important et qu’on a tort de vacciner contre ces maladies ?
M. Marc Girard. Peut-être ai-je dit : « et pas beaucoup de vaccins », mais je pense avoir voulu dire : « et pas de traitement curatif ».
M. le président Jean-Christophe Lagarde. Ces auditions étant enregistrées, nous pourrons vérifier. Pour ma part, j’ai entendu ce que je vous ai dit.
M. Marc Girard. Parmi les droits des personnes auditionnées, vous n’avez apparemment pas mentionné celui de faire un lapsus. Je l’ai cependant écrit assez souvent. C’est aussi ce qui explique pourquoi, historiquement, des vaccins qui ont pu être justifiés peuvent cesser de l’être – par exemple des vaccins que l’on pratiquait avant qu’on ne dispose de la réanimation ou des antibiotiques. On peut être amené à réévaluer très régulièrement le rapport bénéfice/risque de ces vaccins.
M. le président Jean-Christophe Lagarde. Cela a été le cas, par exemple, pour le vaccin contre la tuberculose, malgré une pression invraisemblable et en dépit de la complicité de l’administration sanitaire, je suppose ?
M. Marc Girard. C’est surtout que le vaccin contre la tuberculose ne rapporte pas d’argent : il n’intéresse personne.
Mme Catherine Lemorton. Un euro vingt !
M. Marc Girard. Un autre problème dont on pourrait discuter, qui est aussi une gifle pour les politiques, est qu’on ne trouve plus les vaccins obligatoires – ce n’est pas Mme Catherine Lemorton qui va me contredire. À partir de 1975, le législateur a voulu, dans un souci d’équilibre, compte tenu des vaccinations obligatoires qu’il imposait, mettre en place un dispositif d’indemnisation – c’est l’article L. 3111-9 du code de la santé publique, qui définit le schéma de la responsabilité sans faute de l’État. Ainsi, en cas d’accident vaccinal – une encéphalopathie, par exemple –, il suffit de démontrer un lien de causalité avec le vaccin pour être indemnisé. Or, aujourd’hui, pour des raisons que Mme Catherine Lemorton peut certainement mieux détailler que moi, on ne trouve plus ces vaccins sur le marché qu’en association, ce qui pose un vrai problème de consentement, car les patients ne savent pas ce que contiennent ces associations. En outre, si l’expert reconnaît, en cas d’accident, la responsabilité du vaccin, le tribunal administratif refuse de reconnaître celle des vaccins obligatoires lorsqu’il est question d’indemnisation.
Nous sommes donc confrontés à une situation très grave, sur laquelle j’ai l’intention d’interpeller les politiques dans les semaines qui viennent : alors que vous avez voulu une indemnisation des victimes des vaccins, ce dispositif d’indemnisation est, par suite d’une situation difficile à comprendre, voué à l’échec. Aujourd’hui, il n’est plus possible de se faire indemniser après un accident vaccinal, ce qui est très préoccupant.
M. le président Jean-Christophe Lagarde. C’est une accusation grave. Pouvez-vous nous rappeler l’article du code de la santé auquel vous avez fait référence ?
M. Marc Girard. Bien volontiers. Il s’agit de l’article L. 3111-9. Cet article a été voté par le Parlement pour remplacer une vieille législation selon laquelle il fallait, pour être indemnisé, démontrer l’existence d’une faute. Il n’est pourtant pas nécessaire d’être antivaccinaliste pour savoir que des accidents de type encéphalopathie sont possibles. Après donc une période où prévalait une jurisprudence un peu sauvage du Conseil d’État, le Parlement a voté, en 1975 si je ne me trompe, ce dispositif d’indemnisation sans faute de l’État.
M. le président Jean-Christophe Lagarde. Vous reconnaissez donc, si j’ai bien compris, que la vaccination contre la poliomyélite et le tétanos est légitime.
M. Marc Girard. Tout à fait.
M. le président Jean-Christophe Lagarde. Vous avez également évoqué la mort subite chez le nourrisson, semblant établir un lien entre celle-ci et les vaccinations qu’on fait subir aux enfants. Existe-t-il des données scientifiques étayant votre affirmation ?
M. Marc Girard. S’agit-il de danger ou de risque ? Quand on saute par la fenêtre du troisième étage, il y a danger. Le risque, c’est ce qui est inclus dans le rapport bénéfice/risque. Je vous renvoie à la législation sur les produits de santé : le niveau de sécurité auquel on peut légitimement s’attendre présuppose que des études aient été faites. Ce qui est ennuyeux avec la pharmacovigilance, c’est qu’on ne fait pas les études adéquates chaque fois qu’il y a une alerte. Je ne connais pas aujourd’hui d’étude sérieuse sur le risque de mort subite après vaccination, alors qu’à l’évidence un certain nombre de cas nous obligent à nous poser la question.
C’est aussi pour cela que je dis que la pharmacovigilance ne fonctionne pas. Elle repose sur des notifications spontanées, marquées par un énorme taux de sous-notification. Vient un moment où, au vu de la situation, on se dit qu’il faudrait faire des études – et c’est là que ça bloque.
Ce problème est typiquement celui qui s’est posé lors de la multiplication des cas de scléroses en plaques qui a alarmé les neurologues de la Pitié, après la vaccination contre l’hépatite B. Le 15 septembre 1994, la première réunion de la commission de pharmacovigilance concluait que les soupçons appelaient des études épidémiologiques
– études qui n’ont pas été faites. En 1998, M. Bernard Kouchner a tapé du poing sur la table en réclamant ces études. Or, dans l’intervalle, 30 millions de Français avaient été vaccinés et, à l’évidence, il était trop tard pour dire qu’il y avait un risque. On a donc lancé – je pourrais vous en parler longuement – des études conçues pour ne pas conclure, c’est-à-dire ne disposant pas de la puissance statistique suffisante, et on a annoncé qu’il n’y avait pas de risque démontré. Peut-être ai-je dit, un soir de fatigue, quelque chose qui dépassait ma pensée, mais, je le répète, ma position figure dans les centaines de pages que j’ai écrites, ainsi que les milliers de pages rédigées pour le pôle santé.
Autrefois, on ne prenait pas de médicaments si on n’était pas malade – pas d’anticancéreux si on n’avait pas de cancer, pas d’antimigraineux si on n’avait pas la migraine. Sous prétexte de prévention, on a réussi à faire tomber les limites naturelles du marché pharmaceutique et désormais, tous les gens en bonne santé, comme vous et moi, doivent prendre des médicaments. Le problème se pose en termes de rapport risque/bénéfice, et non pas de danger.
La chose est facile à comprendre : dans les procès auxquels donne lieu le vaccin contre l’hépatite B, on nous dit qu’à défaut de bénéfice individuel, il y aurait un bénéfice collectif. Or, le seul niveau de risque qu’on puisse admettre pour un bénéfice collectif est un risque zéro. C’est bien là que le bât blesse : avec des vaccins qui tendent à couvrir de plus en plus de maladies dites bénignes de l’enfance – j’ai d’ailleurs écrit récemment que l’Institut de veille sanitaire devrait nous dire quelles sont les maladies bénignes qu’on a encore droit de contracter ! –, le bénéfice tend asymptotiquement vers zéro, ce qui n’est pas le cas pour le risque. Tout médicament comporte en effet des impuretés, un risque allergique, ou un risque auto-immun, etc. In fine, le rapport bénéfice/risque de ces produits à usage préventif – car le propos pourrait s’élargir bien au-delà des vaccins – devient inacceptable. Le bénéfice individuel est proche de zéro. Quel est votre risque d’attraper une hépatite B grave, ou qui d’entre vous en a déjà vu un cas ? En revanche, même si on peut chipoter sur le chiffre, le risque n’est pas incompressible. Multipliez cela par le nombre de personnes vaccinées… J’attends encore une explication décente du fait que, tandis qu’on comptait en 1991, avant la campagne vaccinale, 25 000 scléroses en plaques dans ce pays, tout le monde s’accorde à dire qu’il y en a maintenant 80 000.
M. le président Jean-Christophe Lagarde. Pour la sclérose en plaques, les éléments établis ramènent certains propos à leur juste proportion.
Dans toute votre réponse, cependant, je n’ai pas entendu, de façon intelligible pour tous, si d’après vous, oui ou non, on peut établir aujourd’hui un lien entre la mort subite du nourrisson et la vaccination obligatoire qu’on impose aux enfants.
M. Marc Girard. Formellement non, mais la suspicion est telle que des études guidées par l’éthique et l’esprit scientifique devraient s’imposer.
M. le président Jean-Christophe Lagarde. Voilà une réponse qui me paraît à la fois plus sensée et plus modérée que votre explication initiale.
Mme Catherine Lemorton. Pour ramener de la sérénité sur un sujet que je connais par cœur depuis quinze ans et à propos duquel j’ai tendance à m’énerver,…
M. le président Jean-Christophe Lagarde. Restez sereine, chère collègue.
Mme Christine Lemorton. … je rappellerai qu’un vaccin est un médicament, et que tout médicament a des effets secondaires. Les bénéfices sont nombreux mais, à la marge, il se produit des accidents. J’ai eu assez de débats sur les radios nationales avec les représentants des Entreprises du médicament (LEEM) pour savoir que les industries pharmaceutiques ont aujourd’hui deux stratégies : la stratégie vaccinale et la stratégie de la biomédecine. Elles n’en ont pas d’autre, car elles sont – de leur faute ou non – en panne d’innovation.
Une vaccination, je le répète, n’est pas anodine. Je refuse de faire le procès de M. Marc Girard et je tiens à rappeler que d’autres avant lui ont évoqué devant cette commission d’enquête le vaccin contre l’hépatite B pour expliquer la réticence de nos concitoyens à l’égard de campagnes de vaccination dans lesquelles ils ne voient pas bien leur intérêt individuel. Ainsi, M. Bernard Bégaud, pharmacologue qui n’a rien d’un hystérique, cité dans un article de La Presse médicale, déclare que tant que la France n’aura pas réglé son problème avec le vaccin de l’hépatite B, la population française se montrera réticente face à des campagnes massives – surtout quand les parents apprennent que leurs enfants ont été vaccinés contre l’hépatite B à trois mois, avec un rappel à quatre mois, sans qu’on le leur ait dit. La transparence commande à tout praticien de dire aux parents quels sont les six agents pathogènes contre lesquels il vaccine leur enfant. Or, aujourd’hui, au comptoir de la pharmacie, plus d’un patient est surpris quand je lui annonce que son enfant a été vacciné contre l’hépatite B par le vaccin hexavalent. Est-il normal que le pédiatre ne le lui ait pas dit ? Si vous ne voulez pas que nous nous fâchions, ne me dites que j’ai tort !
M. le rapporteur. Madame Catherine Lemorton, le travail de notre commission d’enquête porte sur la campagne de vaccination contre la grippe A(H1N1).
Mme Catherine Lemorton. Nous sommes en train de relancer la campagne de vaccination contre l’hépatite B, selon le souhait exprimé par Mme Roselyne Bachelot-Narquin depuis six mois. Tout cela fait un ensemble. Si nous voulons éviter les erreurs lors de la prochaine pandémie, il faut tenir un discours clair à nos concitoyens.
Ce problème a été évoqué par M. Bernard Bégaud, puis par le syndicat des infirmières scolaires, que nous avons auditionné, il y a quinze jours. Or, lorsque celles-ci ont, sous une autre forme, tenu des propos qui s’apparentaient à ceux de M. Marc Girard, on a commencé à faire leur procès. Si les Français se posent des questions, on ne peut pas leur dire qu’il n’y a aucun problème et qu’ils doivent se faire vacciner. Je me réjouis d’ailleurs que, lors de l’examen d’un projet de loi de financement de la sécurité sociale, il y a deux ans, des collègues de l’UMP aient défendu un amendement, relatif aux services départementaux d’incendie et de secours, tendant à l’indemnisation des problèmes neuromusculaires susceptibles d’aboutir à une sclérose en plaques susceptible de se déclarer chez les pompiers, tenus de se faire vacciner contre l’hépatite B. Cet amendement ne venait pas de nos rangs, monsieur Jean-Pierre Door, mais de la majorité.
M. le rapporteur. Madame Catherine Lemorton, vous vous égarez. Si vous voulez faire le procès de la vaccination contre l’hépatite B, il y a d’autres lieux pour cela.
Mme Catherine Lemorton. Vous ne me laissez pas finir !
M. le rapporteur. La commission d’enquête procède à l’audition de M. Marc Girard. Nous aurons tout le loisir d’écouter vos explications à un autre moment. Ce n’est pas le sujet aujourd’hui et il est déjà vingt et une heures.
M. le président Jean-Christophe Lagarde. Nous sommes en effet ici pour auditionner M. Marc Girard. La commission des affaires sociales pourra, si elle le souhaite, reprendre le débat sur l’hépatite B. Ce n’est pas le propos de notre commission d’enquête.
Mme Catherine Lemorton. On ne me laisse pas finir. J’en prends acte et je me retire.
M. le président Jean-Christophe Lagarde. C’est trop facile ! Avez-vous une question à poser à M. Marc Girard ?
Au demeurant, je ne souscris pas à tout ce que vous avez dit à propos de l’hépatite B. Plus exactement, ceci ne justifie pas cela. Certaines personnes nous ont dit qu’à la suite de la vaccination contre l’hépatite B, les Français avaient davantage de doutes à propos de la vaccination. Je me souviens cependant que, selon le sociologue que nous avons auditionné, l’élément déterminant en la matière était que les Français considéraient la grippe comme peu dangereuse pour eux ; comme l’illustrait un graphique, ils étaient peu nombreux à invoquer le précédent de l’hépatite B. Il ne me semblait pas inutile de rectifier ce point.
Mme Catherine Lemorton. À propos du vaccin contre la grippe A(H1N1), internet a véhiculé tout et n’importe quoi, provenant de gens sans aucune crédibilité, voire de sectes. Je rappelle que les effets secondaires dont les Français ont peur ne sont ni la rougeur qui apparaît au point d’injection, ni le pic de fièvre à 39°C le lendemain, ni la douleur au bras qui dure une semaine, mais les effets secondaires à long terme. Il ne s’agit pas de remettre en cause la politique vaccinale, mais s’il y a de tels effets, comment les pouvoirs publics réagissent-ils ?
Monsieur Marc Girard, trouvez-vous normal que M. Jean Marimbert, directeur général de l’Agence française de sécurité sanitaire des produits de santé, réponde qu’il faut prouver l’existence d’un lien entre le vaccin et les effets secondaires à long terme ? Ces propos sont-ils de nature à donner confiance aux Français ?
M. Marc Girard. Bien sûr que non. Cela renvoie à la notion que j’essaie d’introduire : il faut cesser de parler des vaccins en général et de les considérer comme des médicaments parmi d’autres. Cependant, les études sur les vaccins sont beaucoup plus complexes que celles qui portent sur les médicaments. Lorsque, par exemple, vous cessez de prendre le Prozac que vous preniez parce que vous étiez déprimé, les effets disparaissent en quelques semaines. En revanche, lorsqu’on vous injecte un vaccin, les effets vont durer des années – le vaccin est même conçu pour cela. Les adjuvants qui l’accompagnent sont des produits relativement « costauds », qui mériteraient évaluation. À cela s’ajoutent des conservateurs qu’on ne trouve nulle part ailleurs, comme le thiomersal.
Ce n’est donc pas être antivaccinaliste, mais réagir en spécialiste du médicament que de dire que, comparés à des médicaments banals, les vaccins sont en quelque sorte des « monstres » pharmaceutiques.
Pour ce qui est par ailleurs de leur efficacité, quand bien même vous montreriez
– ce que les fabricants n’ont jamais réussi à faire – que le nombre de personnes atteintes de la grippe a baissé, vous n’auriez nullement démontré que vous avez réduit le nombre de complications graves, qui est, en matière de vaccins, la seule chose qui nous intéresse. Je le répète, attraper la grippe n’inquiète personne, ce n’est pas grave. Mais il n’y a aucune étude là-dessus.
Quant aux études sur le risque de mort subite, il n’y en a pas de sérieuses. Cependant, on peut aussi inverser la question : quelles sont les études sur l’intérêt des vaccins ? Vous êtes-vous avisés – je suis persuadé que vous pouvez le faire – de commander les comptes rendus des réunions du comité technique des vaccinations ? Faites-le : vous verrez sur la base de quelle évidence épidémiologique est décidé le calendrier vaccinal et vous ne serez pas déçus du voyage !
M. le président Jean-Christophe Lagarde. Monsieur Marc Girard, je vous remercie d’avoir participé à nos travaux.
La séance est levée levée à vingt et une heures dix.
Audition de M. Didier Houssin,
directeur général de la santé au ministère de la santé et des sports
(Procès-verbal de la séance du jeudi 10 juin 2010)
(Présidence de M. Gérard Bapt, secrétaire,
puis de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à neuf heures quarante.
M. Gérard Bapt, président. Au nom du président Jean-Christophe Lagarde, je vous remercie, monsieur Didier Houssin, d’avoir à nouveau répondu à l’invitation de cette commission. Depuis votre première audition, le 6 avril, nous avons certes beaucoup travaillé mais nous avons jugé cette nouvelle réunion indispensable. Dans ce contexte, il n’est pas utile que vous prêtiez serment une seconde fois.
M. Jean-Pierre Door, rapporteur. Au cours de notre enquête, qui arrive à sa fin, certaines questions sont revenues régulièrement. Ainsi, pourquoi a-t-on accepté la clause de responsabilité des contrats avec les laboratoires, qui a suscité une certaine suspicion ? Le plan général de la lutte contre la pandémie n’a-t-il pas souffert d’une trop grande rigidité, d’une absence d’ajustement ? Cela va-t-il donner lieu à des modifications ? Quel est, par ailleurs, l’état des stocks et que sont devenus les produits non utilisés ? Où en est la négociation avec le laboratoire GSK, la seule qui n’ait pas encore abouti ? Comment évaluer en outre le coût global de la campagne ? Après des estimations d’un milliard, voire deux, la ministre de la santé et des sports ne parle plus que de cinq cents millions... Il faudra aussi revenir sur le rôle des professions de santé et sur la position de la France au sein de l’Organisation mondiale de la santé, notamment lors de sa dernière assemblée générale.
(M. Jean-Christophe Lagarde, président de la commission d’enquête, remplace M. Gérard Bapt à la présidence.)
M. Didier Houssin, directeur général de la santé au ministère de la santé et des sports. La question des clauses de responsabilité dans les contrats a toujours été très difficile. Assumer la responsabilité d’éventuels effets secondaires de vaccins qui concerneront des populations très nombreuses, sans compter l’incertitude qui entoure la survenue d’événements imprévus, constitue un risque tel que les industriels ne parviennent pas à le faire couvrir par les assurances. Le New England Journal of Medicine vient d’ailleurs de publier un article sur ces aspects. On aboutit dans la plupart des pays à une responsabilité partagée, les pouvoirs publics assumant la prise en charge des effets secondaires et l’indemnisation des victimes, tandis que les industriels assument la responsabilité du fait du produit – une contamination durant la production par exemple. Lors des négociations avec les laboratoires, l’un des projets de contrat, celui de GSK, donnait le sentiment de vouloir faire porter à l’État la responsabilité du fait du produit. La ministre de la santé et des sports a vivement réagi et s’est rapprochée de ses homologues pour résister à cette perspective. Très vite, le laboratoire a fait savoir qu’il ne s’agissait que d’une difficulté de traduction. Bref, c’est l’incapacité pour les industriels du vaccin d’assurer la totalité des risques qui explique ce partage de responsabilité.
S’agissant du plan de préparation à la pandémie, nous travaillons aux leçons à tirer de sa mise en œuvre – et j’ai bien sûr lu le rapport d’étape de l’Office parlementaire d’évaluation des choix scientifiques et technologiques sur le sujet. Ce travail est effectué avec le secrétariat général de la défense nationale, comme pour toute menace de grande ampleur. Le bilan est assez partagé.
Le plan s’est en effet montré très utile à de nombreux points de vue, mais il a souffert du même problème que les trains qui arrivent à l’heure : tout ce qui fonctionne passe inaperçu… Préparé pendant cinq ans, il était principalement tourné vers le virus H5N1, qui était la menace la plus évidente, mais ne lui était pas pour autant dédié. Nous avons essayé de le rendre cohérent avec les phases identifiées par l’Organisation mondiale de la santé et avec les plans de nos voisins. Il prévoyait deux catégories d’actions, de préparation – contrats d’acquisition de vaccins par exemple – ou de réaction. Le plan a été testé au niveau local, régional et national – quatre exercices nationaux ont eu lieu, dont le dernier en février 2009. En fait, il a été élaboré dans un esprit proche de ceux de la défense : la menace de conflit existe et l’on s’y prépare sans savoir quand elle surviendra, en achetant des équipements et en entraînant le personnel par exemple. Les mesures étaient extrêmement diverses : constitution des stocks, information, formation des professionnels, communication, avec la création d’un site internet…
Ce plan a été soumis, comme ceux de nos voisins, à une évaluation lancée par la Commission européenne, avec l’appui du Centre européen de prévention et de contrôle des maladies. Sa qualité principale était sa dimension très intersectorielle et interministérielle – à tel point que nous avons été amenés à expliquer au plan international comment nous avions procédé. Une évaluation scientifique menée par la London School of Tropical Medicine and Hygiene a même classé le plan français parmi les trois ou quatre meilleurs.
Ce plan s’est révélé très utile. Il nous a permis d’adopter tout de suite une stratégie interministérielle, ce qui était crucial. Le 24 avril, date de l’alerte de l’Organisation mondiale de la santé, j’ai demandé à la ministre la tenue d’une réunion interministérielle à Matignon le jour même. Vingt-quatre heures plus tard, nous travaillions avec Aéroports de Paris sur la question de la police des frontières, des masques ou de l’information des voyageurs. Grâce à cette préparation, nous avons donc pu travailler dès le premier jour en étroite coordination avec les ministères des affaires étrangères, de l’intérieur et de l’économie et des finances notamment. Oublier les bons aspects du plan serait une erreur aussi grave pour l’avenir que ne pas se préoccuper de ce qui n’a pas bien fonctionné.
La préparation a en particulier été insuffisante sur deux points.
D’abord, le travail sur les plans de continuité d’activité n’a pas été mené à terme. Certains ministères, comme celui de l’agriculture, ou certaines grandes villes étaient très bien préparés. Certaines grandes entreprises l’étaient aussi, généralement celles qui ont une perception aiguë des menaces internationales – travaillant dans les secteurs de l’énergie ou des télécommunications, par exemple. Mais il n’en était pas de même partout. La cellule interministérielle de crise a donc dû demander une actualisation rapide de ces plans de continuation d’activité, ce qui a mobilisé beaucoup d’énergie en juin et juillet. Heureusement, nous n’avons en définitive pas eu à les activer, mais ce travail préparatoire n’a pas été achevé. Ceci dit, je ne suis pas sûr que seul le temps nous ait manqué : peut-être aurait-il fallu une concrétisation de la menace pour agir plus efficacement.
Ensuite, la préparation de la vaccination elle-même a été incomplète. La raison est assez simple : aucun scientifique, aucun expert des pandémies n’a jamais imaginé que nous pourrions, en métropole, avoir à vacciner avant la première vague pandémique. C’est un concours de circonstances qui l’a rendu possible : le virus est apparu dans des pays, comme le Mexique et les États-Unis, qui ont eu le courage de le signaler tout de suite. Ils ont transféré les souches dans les laboratoires de référence de l’Organisation mondiale de la santé, qui les ont très vite identifiées et ont transmis les souches semences aux 35 producteurs mondiaux de vaccins. En outre, le virus est arrivé, pour l’hémisphère Nord, à la fin de l’épidémie saisonnière. La perspective d’une vague estivale ne s’étant pas concrétisée, nous avions le temps d’effectuer la vaccination avant la vague d’automne-hiver. Mais si nous étions au point s’agissant des acquisitions de vaccins ou de l’ordre des priorités par exemple, si nous disposions de l’avis n° 106 du Comité consultatif national d’éthique de février 2009, l’organisation elle-même de la campagne de vaccination n’était pas planifiée et il a fallu inventer un dispositif durant les mois de juin, juillet et août.
Le plan a été vécu comme étant rigide, automatique. C’est le signe que nous ne l’avons pas bien expliqué, et nous sommes en train d’y réfléchir avec le secrétariat général de la défense et de la sécurité nationale. Ce plan n’était pas une check-list qui aurait conduit à cocher systématiquement chaque case. C’était plutôt une boîte à outils : la cellule interministérielle de crise choisissait, parmi toutes les mesures possibles, celles qui devaient être appliquées ou non. Le port de masques FFP2 par les professionnels exposés au public ou les plans de continuité d’activité, par exemple, n’ont pas été activés.
Il faut maintenant réexaminer le plan, en accentuant sa dimension d’évaluation du risque : il faut notamment le présenter non pas en fonction des décisions de l’Organisation mondiale de la santé, mais comme un guide directement utilisable par les gestionnaires de crise selon la situation. J’ajoute que son volet technique a fait l’objet d’un travail considérable de mise à jour en mai et juin, ce qui nous a permis d’édicter des recommandations, en particulier sur les mesures d’hygiène ou la prescription des antiviraux. Cela étant, si on recense nombre d’éléments positifs, il reste des points d’amélioration incontestables.
Pour ce qui est du bilan de la campagne de vaccination, je vous ai fait parvenir des données détaillées : entre cinq et six millions de vaccinations, dont la plupart en centre de vaccination. Concernant les stocks de vaccins, nous avons aujourd’hui 9,7 millions de Pandemrix, 9,3 millions de Panenza, 5,4 millions de Focetria et 15 000 doses de Celvapan, dont les délais de péremption sont bien sûrs tous différents. Sur les 25 millions de vaccins disponibles, il en restera environ 10 millions à la fin 2010.
Venons-en aux coûts – nous avons reçu de nombreuses questions de la Cour des comptes sur ce thème.
Je voudrais d’abord appeler votre attention sur la question des périmètres : on ne peut comparer que ce qui est comparable. Il y a trois dimensions possibles, voire quatre. Si l’on retient le périmètre de la préparation de la lutte contre la pandémie grippale, par exemple, il faut tenir compte des coûts depuis 2004 ou 2005. Si l’on ne parle que de la lutte contre la pandémie grippale en 2009, il faut inclure les dépenses d’organisation, les produits utilisés, le coût des soins, en tenant compte si possible des dépenses évitées… Bref, le calcul est complexe. Nos réponses à la Cour des comptes retiennent ce périmètre.
Les coûts, du côté du ministère de la santé, concernent les vaccins, les produits médicaux et les prestations logistiques, le dispositif des bons de vaccination, la gestion des déchets à risque infectieux, la communication et l’indemnisation des professionnels de santé ; du côté du ministère de l’intérieur, le fonctionnement des centres de vaccination et l’indemnisation des personnels administratifs. S’agissant de la lutte contre la pandémie, les coûts concernent les antiviraux, les masques chirurgicaux et respirateurs, le fonctionnement des plateformes logistiques départementales, la communication et les dépenses de l’Institut de veille sanitaire. L’ensemble représentait, en mars, 699 millions d’euros. La Cour des comptes nous a posé de nouvelles questions en mai, sans différence significative de périmètre.
Pour ce qui vous intéresse, à savoir la campagne de vaccination, la ministre a effectivement fait état il y a quelques jours de chiffres moins élevés qu’annoncé. La première raison tient à la déduction du don fait par la France à l’Organisation mondiale de la santé
– 73 millions d’euros –, qui n’a pas à figurer dans le coût global de la campagne de vaccination. La deuxième est que les dépenses d’indemnisation des professionnels de santé
– pour ce qui est du ministère de la santé, pas de l’intérieur – semblent avoir été surévaluées. Elles se montent aujourd’hui à une vingtaine de millions d’euros et pourraient ne s’accroître que de huit ou dix millions. Elles n’atteindront donc pas les cent millions qui avaient été initialement prévus. Au total, l’estimation des dépenses de la campagne est donc de l’ordre de 500 millions d’euros. Reste la question de la résiliation des vaccins : on évalue l’indemnisation globale à 48 millions d’euros mais, si les accords sont conclus avec Novartis, à hauteur de 16 % de la commande, et avec Sanofi, rien n’est fait encore avec GSK. Il y a donc toujours une incertitude sur ce montant de 48 millions d’euros.
Vous avez évoqué le rôle des professionnels de santé. Il est évidemment crucial. Les professionnels hospitaliers ont été tout de suite mobilisés dans la prise en charge des malades en milieu hospitalier. À partir du 20 juillet 2009, Mme la ministre de la santé et des sports ayant demandé que la prise en charge se fasse plutôt en ville, le secteur ambulatoire s’est trouvé en première ligne. Beaucoup de professionnels ont ensuite participé au fonctionnement des centres de vaccination. Dans le système français, les soins de premier recours sont assez dispersés, les professionnels assez isolés. Ils ne sont pas, contrairement à certains pays, rassemblés dans des organisations. Cela a tout de suite constitué une contrainte majeure du fait du mode de présentation des vaccins.
Compte tenu du contexte – la discussion du projet de loi portant réforme de l’hôpital et relatif aux patients, à la santé et aux territoires, qui soulevait des réactions très vives de la part de certains syndicats – le sentiment que l’organisation mise en place visait à écarter les médecins s’est développé. Ce n’était absolument pas le cas : la situation nécessitait une organisation collective de la vaccination. D’ailleurs beaucoup y ont participé, y compris des généralistes.
Notre organisation des soins primaires constitue indéniablement une difficulté pour s’adresser aux médecins. Des relais existent, à commencer par l’Ordre des médecins, puis les unions régionales des professionnels de santé, qui ont participé à de nombreuses réunions, et les syndicats. D’autres dispositifs ont été mis en place, comme les messages DGS-urgent, auxquels tous les médecins ne sont néanmoins pas abonnés. Mais la question de l’organisation des soins primaires en France et surtout de la meilleure façon pour les pouvoirs publics de s’adresser aux médecins dans une situation critique est un sujet de réflexion pour l’avenir.
S’agissant du fonctionnement de l’Organisation mondiale de la santé, la ministre de la santé et des sports était présente lors de la dernière assemblée, à Genève. La première journée de travail, sur cinq, a été consacrée à la pandémie grippale. Il y a eu consensus autour de l’importance du rôle de l’organisation, de sa réactivité, de sa capacité à fournir une information rapide, les États étant ensuite libres d’agir comme ils l’entendaient. Bref, la pandémie ne fait pas partie des sujets à problème, contrairement au dossier de la propriété intellectuelle des médicaments, l’atmosphère étant tendue entre les pays développés, émergents et moins avancés. L’Organisation mondiale de la santé a engagé de toute façon une évaluation de son action, menée par M. Harvey Fineberg – un excellent choix puisqu’il était déjà l’auteur, pour l’Institute of Medicine, du rapport sur la gestion de la grippe porcine de 1976 par les autorités américaines, rapport qui a d’ailleurs constitué pour nous une base de réflexion très utile.
M. le président Jean-Christophe Lagarde. Je souhaiterais revenir sur l’indemnisation des laboratoires : les représentants de GSK, lors de leur audition, ont fait état de difficultés avec le gouvernement français. Aucun accord ne semble en vue. Lorsque vous parlez de 48 millions, s’agit-il de doses ?
M. Didier Houssin. Non. L’indemnisation globale réservée aujourd’hui aux résiliations est de 48 millions d’euros, répartis entre GSK, Novartis et Sanofi sur la base de 16 % de la commande annulée.
M. le président Jean-Christophe Lagarde. Le président de GSK affirme qu’il a tenu à la disposition de la France 18 millions de doses au 28 février et qu’il en a produit 30 autres millions, dont il ne réclame le paiement que pour une moitié, l’autre étant réutilisable. En clair, 15 millions de doses ont été conditionnées et 15 millions sont encore en vrac. Le total serait de 33 millions de doses dont on nous réclamerait le paiement à raison du prix initialement prévu.
M. Didier Houssin. C’est effectivement la demande de GSK : 33 millions de doses sur une base de 6 euros la dose, soit plus de 180 millions d’euros. Mais la notification faite à GSK par les autorités françaises ne se monte qu’à 35,8 millions.
M. Jean Mallot. Merci pour toutes ces précisions. À propos du plan, l’analogie avec les trains qui arrivent à l’heure n’est pas très heureuse : la campagne de vaccination n’a pas atteint ses objectifs et l’image même de la vaccination dans le public n’en est pas sortie renforcée. Je ne pense donc pas qu’on puisse être satisfait. La boîte à outils était manifestement incomplète ou alors, si des outils – tels que le recours aux médecins généralistes pour vacciner ou le recours aux marchés à tranches conditionnelles pour acheter les vaccins – y figuraient, ils n’ont pas été utilisés. Le plan avait été préparé pour faire face à une pandémie très grave, bloquant l’ensemble du pays. Un tel plan était indispensable mais il a été appliqué tel quel, alors qu’il est rapidement apparu comme décalé par rapport à l’ampleur réelle de la pandémie et la virulence du virus. N’était-il pas prévu d’appliquer une version plus souple selon les circonstances ? Pourquoi cela n’a-t-il pas été fait ?
J’aimerais aussi en savoir plus sur les relations entre la direction générale de la santé et l’Établissement de préparation et de réponse aux urgences sanitaires (ÉPRUS) dans le domaine des achats de vaccins : qui décidait de la quantité à acheter ou de la formule juridique retenue ? Pourquoi n’a-t-on pas utilisé la formule des marchés à tranches conditionnelles au lieu d’acheter ferme, d’entrée de jeu, 94 millions de doses ?
Enfin, en matière de communication, les expressions de « verrouillage » et de « propagande du Gouvernement » ont été assez répandues par la presse. Comment avez-vous vécu l’articulation avec les services du Premier ministre ? On a reconnu la stratégie habituelle du Gouvernement : maximiser la crise, conditionner l’opinion, puis piloter à vue en fonction des circonstances. La communication conduite par les services du Premier ministre vous convient-elle ? Y avez-vous pris part ? Comment voyez-vous les choses pour l’avenir ?
M. Didier Houssin. Je suis navré si j’ai donné le sentiment de penser que, parce que certains aspects du plan avaient été mis en œuvre, tous les trains étaient arrivés à l’heure. Je voulais simplement dire que beaucoup de ce qui devait être mis en œuvre l’avait été sans difficulté. Je ne me référais pas à la question de la compliance de la population à la vaccination – le fait qu’elle l’accepte. J’évoquais plutôt, par exemple, la mise en place de l’ÉPRUS, d’un établissement pharmaceutique capable d’acquérir des produits et de s’occuper de logistique, ce qui paraît tout naturel aujourd’hui, mais n’existait pas en 2006, voire 2007. Cela a été un élément de progrès important. Je ne sais pas comment nous aurions fait sans cela : toutes les fonctions logistiques étaient assumées auparavant par la direction générale de la santé, mais dans des conditions loin d’être optimales.
Le recours aux médecins généralistes, effectivement, a été une difficulté majeure. Il n’a pas été possible, pour des raisons multiples, de les entraîner autant qu’on aurait pu le souhaiter dans cette action de santé publique. En revanche, le mécanisme des tranches conditionnelles avait été utilisé pour les contrats de 2005. C’est pour les achats décidés par le Premier ministre le 3 juillet qu’il n’a pas été possible d’y recourir, parce que le calendrier de livraison et les quantités livrées initialement étaient liés à la quantité globale acquise.
M. Jean Mallot. Mais il fallait au moins tenir compte du fait qu’on ne savait pas s’il fallait une ou deux doses, soit tout de même 47 ou 94 millions de vaccins.
M. le président Jean-Christophe Lagarde. D’autant que les autres pays avaient des contrats à tranches conditionnelles et qu’ils ont parfaitement pu se faire livrer. On a bien compris que les laboratoires avaient joué avec les États pour obtenir le maximum de commandes – leur absence de coordination leur a malheureusement laissé les mains libres –, mais pourquoi ne pas avoir obtenu autant que nos voisins, comme la Grande-Bretagne ?
M. Didier Houssin. L’idée qu’une seule dose pouvait être suffisante n’était absolument pas défendable en mai, juin ou juillet. Cela a constitué une véritable surprise en septembre, après les premiers résultats des essais cliniques et n’a été confirmé qu’au mois de novembre. Or, la question de l’acquisition des vaccins se posait en mai et juin.
À cette époque, la France était dans une situation particulièrement difficile : les deux industriels avec lesquels nous avions passé des contrats de réservation semblaient ne pas pouvoir être au rendez-vous pour la livraison. Sanofi Pasteur n’avait pas obtenu d’autorisation de mise sur le marché (AMM) pour son vaccin adjuvanté Emerflu. L’espoir qu’il puisse assurer une livraison précoce dans le cadre de notre contrat – à tranches conditionnelles – était quasiment nul. Cette analyse s’est confirmée, puisque l’autorisation de mise sur le marché n’a été obtenue qu’en février ou mars 2010. Nous ne pouvions donc pas compter sur ce grand professionnel du vaccin, qui représentait la part la plus importante de nos acquisitions. Les capacités de production de notre deuxième partenaire, Novartis, avec lequel nous étions engagés en moindre quantité, étaient plus faibles et nous doutions qu’il puisse délivrer suffisamment en temps utile. Il a donc fallu in extremis se tourner vers un industriel avec lequel nous n’avions pas de contrat – alors que d’autres pays en avaient ! Or, c’est celui qui a progressé le plus vite entre 2006 et 2009 et qui disposait des capacités de production les plus importantes, avec deux usines, l’une à Dresde et l’autre au Canada, ce qui permet de changer de source en cas de problème de production. Début mai, j’ai indiqué à la ministre de la santé et des sports que l’industriel le plus à même de délivrer tôt et en quantité suffisante était selon toute vraisemblance, GSK. Cela s’est confirmé. N’ayant pas de contrat de réservation, nous n’étions pas en position de force pour négocier des tranches conditionnelles. Le contexte, par malchance, n’était donc pas favorable à la France.
M. le président Jean-Christophe Lagarde. Pas par malchance ! Puisque la direction générale de la santé semble admettre dorénavant que certaines choses pourraient être améliorées –c’est un progrès –, ne pensez-vous pas que la France aurait intérêt à passer des contrats de réservation avec plus de deux laboratoires, et prévoir dès le départ des tranches conditionnelles en toutes circonstances ? Si nous ne traitions pas avec les bons laboratoires, si nous nous sommes retrouvés en situation de faiblesse, obligés de surcommander ou de nous lier les mains pour pouvoir espérer une livraison dans les délais, ce n’est pas de la malchance.
M. Didier Houssin. Si nous n’avions pas passé de contrat de réservation avec GSK en 2005, c’est tout simplement qu’ils n’avaient pas soumissionné – j’en ignore la raison. Nous avons sélectionné les deux industriels qui, à ce moment-là, paraissaient les plus indiqués.
M. le président Jean-Christophe Lagarde. Mais on n’a pas rouvert le dossier entre 2007 et 2009, alors que GSK avait beaucoup progressé. On n’a pas adapté le plan, qu’on a estimé suffisant.
M. Didier Houssin. Nous n’avons appris l’absence d’autorisation d’Emerflu que très tardivement. Peut-être aurions-nous dû alors réexaminer l’ensemble de notre stratégie de réservation de vaccins, mais la réflexion avait pris une orientation quelque peu différente : nous nous interrogions sur l’intérêt des vaccins prépandémiques. Lors de nos échanges avec le cabinet de la ministre sur ce sujet, début avril, GSK était mentionné comme un partenaire potentiel au cas où la France déciderait d’acquérir de tels vaccins. Le sujet n’était donc pas négligé, mais la perspective était différente. Reste la difficulté majeure : notre partenaire principal n’avait pas l’autorisation de mise sur le marché pour son vaccin adjuvanté.
J’en viens à cette critique selon laquelle les pouvoirs publics n’auraient pas su tenir compte des réalités, freiner les choses, « débrayer », bref faire preuve d’esprit d’adaptation. Nombre d’interventions devant votre commission, d’après ce que j’ai lu, ont tourné autour de cette question. Cela mérite un développement.
Le processus de décision a été préparé de manière à permettre aux responsables politiques de renoncer à certaines décisions s’ils le jugeaient nécessaire. On avait tiré en cela les leçons de la campagne de vaccination américaine de 1976 : le rapport de l’Institute of Medicine montrait que Gerald Ford avait été lié par son administration en devant prendre une seule décision, qui comprenait l’acquisition des vaccins, l’ordre de priorité et le lancement de la campagne. J’avais été extrêmement attentif à pouvoir procéder différemment. Nous avons donc fait en sorte que l’administration puisse formuler ses propositions en se fondant sur l’expertise la plus large possible, pour que le responsable politique puisse à chaque étape prendre ou non la décision.
Les décisions les plus importantes ont été celles prises par le Premier ministre le 3 juillet pour l’acquisition de vaccins et le 24 septembre pour fixer un ordre de priorité pour la vaccination, et celle prise par la ministre de la santé le 20 octobre de lancer la campagne de vaccination. Nous avions bien sûr réfléchi à l’éventualité de devoir stopper la campagne, qui ne s’est pas concrétisée puisque les vaccins se sont révélés tout à fait sûrs.
Dans la mesure où toute la phase initiale s’était déroulée dans une très grande incertitude sur l’avenir, les pouvoirs publics auraient pu arrêter les choses, ne pas lancer la campagne de vaccination. Pour préparer la prise de décision, la direction générale de la santé a demandé le 15 septembre à l’Institut de veille sanitaire, notre expert épidémiologiste, son analyse de la situation. Par un avis du 28 septembre, l’Institut de veille sanitaire a répondu qu’il fallait s’attendre à une vague pandémique et qu’il était plausible qu’elle ait un impact sanitaire majeur en termes de mortalité et d’hospitalisation, y compris dans le scénario le plus optimiste. Le 22 septembre, le Haut conseil de la santé publique était interrogé sur l’opportunité de lancer la campagne de vaccination. Le 23 octobre, il répondait que la balance bénéfice/risque était en faveur du démarrage de la vaccination, en commençant par les professionnels de santé et les populations identifiées en priorité 1.
Nous avons parallèlement observé que les autres pays européens se prononçaient tous pour un lancement le plus rapide possible des campagnes de vaccination. Celles-ci ont été lancées le 12 octobre en Suède, le 15 en Italie, le 20 en Norvège, le 21 en Grande-Bretagne, le 26 en Allemagne, le 27 octobre en Autriche et au Luxembourg, le 1er novembre Danemark, le 7 en Belgique, le 9 en Irlande, le 16 en Espagne et en Grèce ou le 23 novembre aux Pays-Bas et en République tchèque. La direction générale de la santé a donc préconisé, dans une note du 5 octobre, le lancement de la campagne. Celle-ci a commencé le 20 octobre dans les établissements de santé pour les professionnels et le 12 novembre dans les centres de vaccination pour les autres groupes prioritaires, ce délai étant lié essentiellement au calendrier de livraison des vaccins et à la mise en place des centres. Était-il possible de débrayer à ce moment-là ? Nous nous y étions préparés, nous avions interrogé des experts en ce sens et la réponse a été qu’il fallait lancer la campagne.
On peut aussi se demander si, face aux réactions de la population – le vaccin étant perçu comme dangereux et le virus comme un risque modéré – on aurait pu limiter la campagne au premier groupe prioritaire, et il faut se souvenir des intentions de la population. Lors du lancement de la campagne, les autorités sanitaires s’attendaient déjà à un taux d’intention de se faire vacciner plus faible que l’estimation faite en vue de l’acquisition des vaccins. Les diverses enquêtes menées au fil des mois en France ont montré une évolution importante. En juillet août, on comptait 54 à 65 % d’intentions de se faire vacciner dans différents sondages, dont ceux de l’École des hautes études en santé publique, du Service d’information du Gouvernement-OpinionWay, du Figaro-OpinionWay et de Sud-Ouest-Ifop. Mi-septembre, le taux avait chuté à 39 % dans un sondage SIG-OpinionWay, puis à 30 % fin septembre pour TNS Sofres. La baisse devait se poursuivre, avec des taux de 15 à 25 % entre octobre et décembre.
En dépit du travail d’explication des autorités sanitaires, les interventions visant dans les médias à critiquer l’opportunité ou l’organisation de la vaccination ont sans doute contribué à cette évolution. Les propos sur la dangerosité des vaccins tenus pas certains professionnels de santé, médecins ou infirmiers, repris très largement par les médias, ont provoqué une baisse rapide des intentions de se faire vacciner dans les quinze premiers jours de septembre. Un élément déterminant, de mon point de vue, a été le communiqué de presse du Syndicat national des professionnels infirmiers du 1er septembre, qui mettait l’accent sur les dangers des vaccins. Il se répétait le 8 septembre, dans un second communiqué, en présentant en outre un sondage selon lequel 26 % du personnel infirmier seulement avaient l’intention de se faire vacciner. L’écho médiatique avait été important et la conjonction des deux arguments était extrêmement dissuasive : « les professionnels de santé nous disent que les vaccins sont dangereux et la grande majorité d’entre eux n’ont pas l’intention de se faire vacciner… ». Dans l’eurobaromètre de novembre 2009, la France est ainsi l’un des trois pays qui considère le danger représenté par les vaccins comme le principal argument dissuasif – pour 40 % des Français contre une moyenne de 30 % en Europe.
Dans ces conditions donc, aurait-on pu limiter la vaccination aux groupes de population prioritaires ? Nous avons pensé que cette décision risquait d’accréditer l’idée que les vaccins étaient effectivement dangereux. En outre, nous ne savions pas si c’étaient bien les populations prioritaires qui avaient l’intention de se faire vacciner. Enfin, dans un contexte épidémiologique, l’intention de se faire vacciner peut fluctuer fortement, et à brève échéance : ainsi, l’affluence, qui était très faible avant le 20 novembre, a brusquement augmenté après l’annonce d’une mutation possible du virus chez des malades en Norvège.
Voilà deux exemples d’adaptation des pouvoirs publics à la situation, et je pourrai vous en donner d’autres.
M. Gérard Bapt. Merci de cette explication très circonstanciée. Il semble clair, d’après aussi les fonctionnaires qui faisaient partie de la cellule de crise, que les rouages de l’État ont bien fonctionné pour ce qui est de la préparation à un risque signalé le 24 avril et qui demandait à être précisé. Mais hier, un préfet nous faisait part de ses difficultés à mettre en œuvre les mesures de préparation et de communication sur le terrain pour cause d’effectifs insuffisants dans les directions départementales des affaires sanitaires et sociales, ce qui ne laisse pas d’être inquiétant dans le contexte du non-remplacement d’un fonctionnaire sur deux partant à la retraite : le meilleur plan possible, le meilleur plan central ne sert à rien si les moyens humains manquent au niveau déconcentré pour le mettre en place ! La révision générale des politiques publiques (RGPP) devrait prendre en considération certains impératifs de sécurité sanitaire, et même civile.
Vous êtes le représentant permanent de la France à l’Organisation mondiale de la santé. Vous avez dit que lors de la dernière assemblée générale, les États avaient globalement approuvé l’action de l’organisation. Le contraire aurait été étonnant : cela serait revenu à ce qu’ils se critiquent eux-mêmes, puisque la mise en œuvre des recommandations de l’Organisation mondiale de la santé relève toujours de leur décision ! Mais certaines questions ont été posées, y compris pendant l’assemblée générale, sur les maladies émergentes ainsi que sur les conflits d’intérêts ou l’influence du Groupe Impact, dénoncée par l’Inde et le Brésil, qui mettent en cause la crédibilité de l’organisation. La création de l’Organisation mondiale de la santé a été un grand progrès, elle continue à mener des actions très positives dans un certain nombre de domaines mais elle connaît aussi de graves problèmes : l’enquête du British Medical Journal, le rapport du Conseil de l’Europe, les dénonciations d’experts individuels concernant l’influence de l’industrie pharmaceutique sur les conclusions du groupe de travail sur les maladies émergentes ne peuvent être évacués aussi négligemment.
D’après M. Rony Brauman, de Médecins sans frontières, la principale faute de l’Organisation mondiale de la santé a été de ne pas distinguer entre la contagiosité et la dangerosité du virus. En transformant, le 4 mai, sa définition d’une pandémie, l’organisation a évacué cette notion de dangerosité. N’est-ce pas une des raisons fondamentales qui explique que tous les États se soient lancés dans des plans de réponse à une menace plutôt de type H5N1 ? Ne s’est-on pas trompé de cible ? S’agissait-il vraiment d’une pandémie ? Si l’on réintègre la notion de dangerosité, ne s’agissait-il pas plutôt d’une épidémie ?
M. le président Jean-Christophe Lagarde. Voilà une question importante.
M. Gérard Bapt. Le fiasco a conduit à une perte de crédibilité de toutes les autorités sanitaires, mondiales, européennes et nationales. Avouez qu’avec ou sans intervention de syndicats infirmiers, tous les États européens, à l’exception de la Suède, ont vu une décroissance très rapide de la vaccination !
M. Didier Houssin. Une des leçons à tirer de cette pandémie est que, dans une crise d’aussi longue durée, la capacité à maintenir les effectifs opérationnels est un point crucial. Nous avons même pensé à activer les plans de continuité d’activité pour ce seul motif. Les militaires connaissent beaucoup mieux cette question, qu’il va falloir approfondir. Je ne reviens pas sur la question de la Révision générale des politiques publiques : des réorganisations importantes sont en cours au niveau territorial, et c’est un sujet majeur.
Pour ce qui est de l’Organisation mondiale de la santé, j’ai évoqué les discussions qui se multiplient autour de la question de la propriété intellectuelle des médicaments. Elles dépassent le sujet de la crédibilité de l’expertise, qui n’est qu’une sorte d’alibi : ce qui les sous-tend, c’est la confrontation géopolitique et économique sous-jacente entre un monde développé à la production pharmaceutique importante, un monde émergent où la place des génériques est considérable et qui a l’espoir d’acquérir lui aussi une capacité d’innovation, et un monde beaucoup moins développé qui essaye de pouvoir disposer des vaccins, d’une manière ou d’une autre. C’est le grand enjeu actuel. Les questions qui entourent la crédibilité de l’expertise, aussi importantes soient-elles, sont mises en avant mais, derrière, il y a les intentions politiques de certains États qui veulent, tout simplement, voir le monde changer.
Pour ce qui est de la dangerosité, en matière d’épidémie, il y a deux notions à considérer. La première est la virulence du virus, c’est-à-dire sa capacité intrinsèque à causer des dommages graves chez un être vivant, et éventuellement à le tuer. Nous avons su très tôt qu’elle était assez faible, ou en tout cas que ce virus ne portait pas les gênes de virulence connus. Il est même incroyable d’avoir pu le savoir aussi vite.
M. le président Jean-Christophe Lagarde. Quand ?
M. Didier Houssin. Au cours du mois de mai, par des études génétiques.
M. le président Jean-Christophe Lagarde. Cela fait tout de même un mois et demi avant le 3 juillet.
M. Didier Houssin. La seconde notion à considérer est le taux d’attaque. Si une très large proportion de la population est touchée, il peut y avoir, bien que la virulence soit faible, un nombre extrêmement important de malades et donc, par la loi des grands nombres, de décès. Ce que nous redoutions le plus, c’était un taux d’attaque élevé. Or, d’après les analyses de l’Institut de veille sanitaire et d’autres organismes sur la situation dans l’hémisphère Sud pendant l’été, il n’y avait pas d’indice que le taux d’attaque serait faible. Un des grands enseignements est que nous sommes aujourd’hui capables d’en savoir beaucoup, et très vite, en matière d’épidémiologie et de virologie, mais qu’il reste des progrès considérables à faire dans la discipline de l’immunologie, c’est-à-dire l’étude de la réceptivité d’une population. Nous n’avons su qu’en septembre que certaines personnes pouvaient avoir des anticorps protecteurs, et ce n’est qu’en décembre que la revue PNAS a publié un article de M. Jason Greenbaum et ses collaborateurs montrant que des éléments immunologiques pouvaient peut-être expliquer qu’une partie importante de la population n’ait pas déclenché une maladie, ou alors bénigne. Il ne faut donc pas se focaliser sur la virulence : le taux d’attaque aussi est important, et c’est sur ce point que nous avons connu des surprises.
Mme Catherine Génisson. Je m’étonne, sans bien sûr vouloir vous mettre en cause personnellement, du bilan extrêmement positif que vous faites de l’application du plan gouvernemental. Le critère d’efficacité est tout de même de savoir si l’objectif fixé par le Gouvernement a été rempli, à savoir à la fois vacciner massivement et permettre à tous les publics cibles de l’être. Quelle a été la proportion de public prioritaire vaccinée ?
Les questions qu’ont posées MM. Jean Mallot et Gérard Bapt sont fondamentales. Certes, les connaissances en virologie sont bonnes, moins en immunologie, mais cela devrait être complètement intégré dans le plan ! Il doit pouvoir s’adapter ! Or, son application a été pour le moins rigide : un vrai rouleau compresseur. Il ne semble pas avoir été possible d’en modifier le déroulé.
Je vous trouve sévère avec les professionnels de santé, dont les propos auraient détourné le public de la vaccination. Dans le même temps, en effet, la communication du Gouvernement était assez étrange puisqu’elle revenait à dire, et je caricature à peine : « il est fondamental de se faire vacciner mais vous faites comme vous voulez ». L’enchaînement des volte-face et des rétropédalages était suffisamment de nature à déstabiliser nos concitoyens. Au départ, les SAMU-Centre 15 et les services d’urgence étaient massivement mobilisés pour accueillir toute personne suspecte de fièvre ou d’éternuements, mais du jour au lendemain, les grippes devaient se soigner à domicile et il n’était plus question d’effectuer de diagnostics biologiques ! Dans de telles conditions, il est difficile de vouloir mobiliser une population.
Par ailleurs, on ne peut réellement pas accepter vos propos selon lesquels la contestation d’un certain nombre de mesures de la loi portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires aurait entraîné le désintérêt, voire la désaffection des professionnels de santé. Vous ne l’avez pas dit de façon aussi catégorique, mais vous l’avez suggéré. Et puisque vous cherchez un moyen efficace de les contacter, je rappelle que l’inscription à l’ordre est obligatoire et que cela devrait être une solution toute trouvée même si le peu de fiabilité et le mauvais fonctionnement des ordres en France est un autre sujet.
Vous avez insisté sur les nombreux exercices menés, qui prouveraient la fiabilité du plan. Mais seuls les exercices de terrain sont valables, avec une mobilisation réelle. Ils auraient peut-être permis de montrer qu’on manquait d’acteurs de terrain, sur le plan tant administratif que strictement opérationnel.
Enfin, concernant le périmètre budgétaire, il faut rappeler que les annonces initiales dépassaient largement ce qui a été effectivement dépensé. On peut peut-être s’en féliciter. En attendant, les mutuelles et le système assuranciel ont-ils versé la contribution qui leur avait été demandée, soit 300 millions ? Est-il prévu qu’ils soient remboursés, à hauteur du coût réel de la vaccination ?
M. Didier Houssin. L’objectif du Gouvernement n’était pas de vacciner massivement, mais de faire en sorte qu’il y ait le moins de morts possibles : c’est à cela que devait se mesurer le succès de son action. Un des moyens envisagés était de proposer la vaccination ; elle n’a pas été acceptée par une grande majorité de la population.
Mme Catherine Génisson. Dans ces conditions, pourquoi avoir commandé 94 millions de vaccins ?
M. le président Jean-Christophe Lagarde. Pourquoi nous avoir répondu que la décision du Gouvernement de commander ces 94 millions de doses, compte tenu de sa position de faiblesse face aux laboratoires, avait été dictée par le taux d’attaque du virus et non la mortalité ? On savait depuis début mai que le virus présentait peu de dangerosité. Certes, l’information n’a pas été communiquée, mais tous les virologues la connaissaient : ils nous l’ont dit. Ce n’est donc pas, contrairement à ce que vous avez répondu à l’instant, la peur d’une mortalité importante qui a présidé à la décision de commander les vaccins, même si on craignait une mutation éventuelle du virus – qui peut d’ailleurs concerner toute forme de virus –, mais bien le taux d’attaque. Il y a donc une contradiction entre vos deux réponses.
M. Didier Houssin. La dangerosité se traduisant par un nombre de surdécès en valeur absolue, il n’y a pas contradiction si on prend en compte les deux aspects du problème.
Le premier est la virulence intrinsèque du virus. C’est ainsi que le virus Ébola est considéré comme très dangereux parce que très virulent : il tue huit malades sur dix, mais il ne touche pas un grand nombre de personnes. En revanche – c’est le second aspect du problème –, un virus dix fois moins virulent peut toucher dix fois plus de personnes. Au bout du compte, la mortalité sera la même. La question de la dangerosité doit donc être traitée à travers ces deux prismes. Ce n’est donc pas parce qu’au mois de mai nous étions un peu rassurés sur la dangerosité en matière de virulence, que nous l’étions sur la dangerosité du virus d’un point de vue général. L’objectif était donc bien d’éviter un nombre important de décès liés à la propagation très importante du virus au sein de la population.
M. le président Jean-Christophe Lagarde. Certes, mais tous les épidémiologistes et, plus généralement, tous les scientifiques que nous avons auditionnés, dont certains étaient consultés par Mme la ministre de la santé et des sports et par vous-même – je pense notamment au professeur Claude Hannoun –, nous ont clairement indiqué le peu d’efficacité d’une telle vaccination. Le Haut conseil de la santé publique, dans son avis du 26 juin, précise même que « la mise en place d’une vaccination au-delà de trente jours suivant le début de la circulation active du nouveau virus A(H1N1) en France aurait un impact très limité sur l’évolution de la vague pandémique en cours en France, quelle que soit la population ciblée ». Cela signifie qu’à partir du moment où le virus se propageait, la vaccination, générale ou ciblée – on nous a affirmé qu’il eût été préférable qu’elle fût ciblée, contrairement à ce que vous nous avez dit sur le débrayage –, n’avait pas d’effet sur l’étendue de la propagation et donc, pour reprendre votre analyse, sur la dangerosité et la mortalité liées à cette propagation. Il y a donc bien contradiction.
M. Didier Houssin. Le document précise un peu plus loin que cela ne retire en rien l’intérêt de la protection sur le plan individuel.
M. le président Jean-Christophe Lagarde. Le haut conseil, qui a rendu deux avis similaires, les 26 juin et 8 juillet 2009, n’a pas vocation à affirmer que la vaccination ne présente aucun intérêt. En règle générale, on en retire toujours un bénéfice individuel.
Toutefois, lorsqu’on lance une campagne de vaccination pour 47 millions de Français, on ne poursuit pas le seul bénéfice individuel : on cherche sinon à « casser », du moins à freiner la pandémie.
Vous avez prétendu que le Haut conseil de la santé publique avait recommandé le lancement de la vaccination : son avis est plus modéré. M. Roger Salamon, son président, a même estimé qu’il y avait eu, de la part des autorités, une volonté excessive de faire la publicité de la pandémie et du vaccin.
Les boîtes à outils, pour reprendre votre expression, ont-elles été réellement adaptées à la réalité de la pandémie ? Si l’information sur sa faible mortalité n’a pas été communiquée à la population, celle-ci s’en est toutefois rendue compte par elle-même et a fini par en tirer les conséquences en n’allant plus se faire vacciner. Quant à la propagation du virus, pour importante qu’elle ait été, on n’est pas en mesure de l’estimer. Le seul point qui n’ait jamais varié, c’est la campagne générale de vaccination qui a été conduite jusqu’à son terme, en janvier, alors que les centres, courant décembre, étaient déjà relativement vides. Un tel manque d’adaptation m’étonne.
M. Didier Houssin. J’ai déjà évoqué les mesures qu’on envisageait de prendre pour freiner, voire pour ne pas lancer la campagne.
M. le président Jean-Christophe Lagarde. Ou pour la lancer de façon ciblée sur 10 millions de personnes – les groupes prioritaires –, ce qui, de l’avis des scientifiques que nous avons auditionnés, était l’option la plus raisonnable.
M. Didier Houssin. A posteriori, oui.
M. Gérard Bapt. Ils le disaient dès cette époque.
Le plan de lutte contre la pandémie aviaire, dont M. Jean-Pierre Door a eu à s’occuper en tant que rapporteur d’une mission d’information, ciblait déjà 30 % de la population. La lecture des comptes rendus du Comité de lutte contre la grippe nous permet de constater que, dès l’origine, on a évoqué la possibilité d’une immunité croisée chez les plus de soixante-cinq ans. De même, on a commencé à se douter qu’une seule injection pourrait suffire, du fait qu’il s’agissait d’un virus A(H1N1) dont on avait l’expérience, et non d’un virus A(H5N1). De plus, le choix que vous avez fait, qui était de permettre à tous les Français qui le souhaitaient d’être vaccinés, pouvait être modulé en fonction de cette incertitude. Il semble, en fait, que le Comité de lutte contre la grippe vous ait recommandé le 10 mai jusqu’à l’acquisition de 108 millions de doses, en se contentant de faire un « copier-coller » des recommandations relatives à la grippe A(H5N1). Le 11 mai, vous avez fait parvenir cet avis, présenté en toute sincérité comme celui des experts, à la ministre de la santé et des sports, alors même que GSK « mettait la pression » en déclarant que toute commande passée après le 12 mai ne pourrait pas être honorée. La ministre a transmis l’information au Premier ministre qui a donné l’ordre de passer commande et engagé, dès le 14 mai, 75 millions d’euros pour une préréservation, auprès de GSK, de 50 millions de doses.
M. Didier Houssin. D’un point de vue épidémiologique, on s’est vite aperçu que l’objectif d’arrêter l’épidémie grâce à un nombre suffisant de vaccinations, avant la montée de la vague, serait inaccessible. Il n’en fallait pas moins, sans intention d’arrêter l’épidémie, nous donner la possibilité de proposer la vaccination à ceux qui désiraient éviter d’attraper la maladie. Du reste, les chiffres de la mortalité montrent que, dans 15 % à 20 % des cas, les personnes décédées ne présentaient aucun facteur de risque. Telle est l’option qui a été prise : avoir la possibilité de proposer le vaccin également aux personnes ne présentant aucun facteur particulier de risque, afin de limiter autant que possible le risque de mortalité.
S’agissant du sujet de l’obligation vaccinale, évoqué par Mme Catherine Génisson, il est vrai qu’il peut paraître contradictoire que le Gouvernement propose sans obliger. Je vous renvoie à l’article du New England journal of medicine sur les aspects légaux d’une telle obligation : les États-Unis ont essayé de mettre en place l’obligation vaccinale dans l’État de New York et dans un système d’hospitalisation privé. Ils ont eu à faire face immédiatement à des actions en justice en raison des incertitudes pesant sur l’innocuité des vaccins.
Après s’être posé la question de l’obligation vaccinale, le Gouvernement a pris la décision politique importante de ne pas imposer la vaccination. Du reste, il aurait fallu assortir cette obligation de mesures de coercition, ce qui est peu réaliste.
M. le président Jean-Christophe Lagarde. Il est légitime qu’un gouvernement refuse qu’un citoyen puisse un jour lui reprocher de n’avoir pas eu la possibilité de se faire vacciner : cela ne justifie pas pour autant, en termes de santé publique, toute l’organisation qui a été mise en place, visant à faire face à une pandémie mortelle. Je le répète : les outils employés n’étaient pas adaptés. Était-il cohérent de décider de lancer une campagne de vaccination générale, ouverte en premier lieu à un public prioritaire, de se rendre compte que les vaccins ne pourraient pas arriver à temps, puis d’assister à une baisse générale de l’intention vaccinale, sans en tirer toutes les conséquences ? Du reste, les centres devaient à l’origine n’accueillir que les groupes prioritaires, puis, faute de public, ils se sont mis à vacciner tous ceux qui se présentaient. Lorsque l’affluence s’est accrue à partir du 20 novembre, l’ordre a été de nouveau donné de ne plus accepter que les porteurs de bon : il n’a pas pu être exécuté, du fait que l’habitude inverse avait été prise.
Le principal défaut du plan est de ne pas avoir pris en compte la réaction de la population. Il aurait fallu lui dire beaucoup plus tôt la vérité. Or je ne me rappelle pas avoir entendu les autorités, notamment scientifiques, déclarer que le virus n’était pas aussi mortel qu’on l’avait cru après son apparition au Mexique. Pourquoi ne pas avoir repris le mode de communication employé pour la grippe saisonnière puisqu’il donnait toute satisfaction ? La priorité aurait été donnée à certains publics mais il aurait été précisé à l’ensemble de la population qu’elle pouvait se faire vacciner ailleurs que dans les centres car on avait observé des décès touchant des personnes ne présentant aucun facteur de risque. S’agissant de la grippe A(H1N1), leur nombre n’a pas, du reste, été très important, même s’il a légitimement inquiété.
De plus, pourquoi les médecins libéraux n’ont-ils pas été impliqués plus tôt dans le système ? Les raisons invoquées en termes de conservation des doses dans les réfrigérateurs sont surréalistes. Du reste, les médecins libéraux allemands et italiens ont su regrouper les patients pour les vacciner.
Novartis a livré 250 000 doses le 12 novembre. Fin novembre, nous disposions de 1,980 million doses individuelles. Pourquoi ne pas les répartir entre les pharmacies pour les mettre à la disposition des personnes désireuses de se faire vacciner, puisqu’on n’observait pas de ruée dans les centres de vaccination ? Était-ce donc impossible sur le plan logistique ? Dans ces conditions, pourquoi a-t-on attendu de disposer de 5 millions de doses en janvier pour procéder de la sorte ?
M. Didier Houssin. Mme Catherine Génisson a évoqué le rôle de l’ordre des médecins : son avis n’a peut-être pas été suivi, mais il a clairement pris position en faveur de la vaccination.
En ce qui concerne le périmètre budgétaire de l’opération et la participation des mutuelles, je vous transmettrai l’information ultérieurement.
M. Gérard Bapt a affirmé que, dès l’origine, on se doutait qu’une dose pourrait suffire. Il est important de savoir que cette éventualité n’est apparue que tardivement, à partir du mois de septembre, et n’a été confirmée qu’en novembre.
Une des leçons importantes à tirer des événements, c’est qu’il faut effectivement tenir compte de la perception du risque par la population. Recourir à des sondages demande un certain délai de mise en œuvre. La capacité de mesurer la réaction de la population devrait être davantage prise en considération dans la gestion des crises. En revanche, je ne pense pas qu’il aurait été possible de passer d’un dispositif logistique tourné vers l’alimentation des centres de vaccination à un dispositif orienté vers les 23 000 pharmacies, même s’il s’agissait de vaccins conditionnés en monodoses. M. Thierry Gentilhomme, que vous avez auditionné, a souligné les problèmes logistiques qui se posent dans un contexte de gestion de crise. Toutes les adaptations n’étaient pas techniquement réalisables. Celles concernant les femmes enceintes ou les personnes atteintes du VIH ont été les plus difficiles à mettre en œuvre : il fallait en effet offrir à ces deux publics la possibilité de se faire vacciner dans les meilleures conditions.
M. le président Jean-Christophe Lagarde. La distribution en pharmacie de 2 millions de monodoses ne me paraît pas poser des problèmes logistiques aussi considérables que vous le prétendez ! Les représentants des centrales d’achat nous ont expliqué que les répartiteurs pharmaceutiques savaient le faire. On aurait pu, dès la fin du mois de novembre, associer les médecins libéraux au dispositif sans fermer les centres de vaccination. Je le répète : pourquoi attendre le 4 janvier, à savoir la fin de la campagne, pour répartir les doses en pharmacie, quand leur nombre s’élevait alors à 5 millions ?
M. Jean-Pierre Door, rapporteur. Je tiens à souligner que 16 000 personnes se sont fait vacciner dans le secteur libéral depuis le 4 janvier.
M. le président Jean-Christophe Lagarde. C’est peu au regard du nombre de doses individuelles dont nous disposions depuis fin novembre : 2 millions. On a fourni ces doses individuelles au secteur libéral avec au moins un mois de retard. Le faire plus tôt aurait permis de mieux associer les professionnels de santé. C’est d’autant plus incompréhensible que se posait la question des personnes isolées ne pouvant se déplacer – les élus locaux étaient interpellés à ce sujet.
M. Didier Houssin. Cette question exige des éléments d’analyse plus précis que ceux que je pourrais vous fournir ce matin. Je vous les transmettrai après les avoir rassemblés. J’ignore s’il était possible fin novembre de modifier le dispositif de distribution des doses afin d’en faire profiter les pharmacies.
M. le président Jean-Christophe Lagarde. Il s’agissait de faire fonctionner en parallèle un second dispositif de distribution.
Je rappelle les chiffres. Nous disposions le 12 novembre de 250 000 monodoses, le 19 novembre, de 1,784 million et, fin décembre, de 2,3 millions. Il y avait là une capacité considérable de démultiplication de la vaccination, alors que seuls 6 millions de personnes ont été vaccinés.
Mme Catherine Lemorton. La circulaire du 21 août 2009 indiquait aux préfets et aux directions départementales et régionales des affaires sanitaires et sociales : « Vous informerez la population sur les modalités de préparation de la campagne à la fin du mois de septembre, par une communication systématique dans la presse locale » : était-ce là le meilleur vecteur, alors que, chacun le sait, dans la presse locale, l’information officielle ne pouvait qu’être précédée et suivie d’articles la contredisant ?
Pour expliquer la baisse d’adhésion de nos concitoyens à une éventuelle campagne de vaccination, vous avez évoqué les déclarations des professionnels de santé. Il ne faut pas oublier que les parents, après avoir été avertis durant tout l’été que les enfants étaient des facteurs de contamination 4 – ce qui est vrai –, s’attendaient début septembre à devoir les garder à la maison seulement quelques jours après la rentrée scolaire. Or il ne s’est rien passé, en dehors de quelques manques de postes de professeurs dans les classes. Du reste, la lecture de cette même circulaire du 21 août relativise l’argument généralement invoqué sur les conséquences qu’auraient eu sur le taux de vaccination les informations véhiculées par des sectes antivaccinales concernant les effets négatifs des vaccins. La circulaire précisait en effet : « Les vaccins qui seront utilisés sont des produits nouveaux, les laboratoires ayant dû attendre, pour se lancer dans le processus, la mise à disposition des souches du nouveau virus au niveau mondial » : il s’agissait donc bien d’un produit nouveau dont le développement serait très rapide. Elle ajoutait : « Les premières autorisations de mise sur le marché pourraient être délivrées en septembre, mais le périmètre exact de ces autorisations n’est pas connu. En particulier, la question de l’inclusion des enfants et adolescents de moins de dix-huit ans reste ouverte » : faut-il rappeler que nous n’étions alors qu’à un mois et demi du lancement de la campagne ? Elle poursuivait : « Il n’est également pas exclu que le champ de l’autorisation de mise sur le marché diffère d’un vaccin à l’autre ». Les raisons de douter étaient données à la population dans la circulaire du 21 août 2009 par la cellule interministérielle de crise elle-même. Il n’est pas besoin de stigmatiser les infirmières, les médecins ou les sectes anti-vaccinales !
Cette même circulaire précisait que « pour une vaccination de masse, avec un vaccin nouveau, les exigences de la pharmacovigilance sont majeures » : quelles sont aujourd’hui, monsieur Didier Houssin, les exigences de la pharmacovigilance concernant les quatre vaccins ? Je ne cherche pas à entretenir la peur de nos concitoyens, mais à faire en sorte qu’en cas de nouvelle pandémie, on ne se retrouve pas, comme hier, à devoir supporter des discours stériles visant à stigmatiser les uns ou les autres, parce que les études de pharmaco-épidémiologie n’auront pas été suffisamment sérieuses pour écarter ou confirmer les doutes. Des études très sérieuses sont actuellement conduites en Grande-Bretagne sur les séroconversions et la séropositivité des différents vaccins, en particulier chez les enfants qui constituent la population la plus problématique en matière de réactions, en ce qui concerne les aspects réactogènes et immunogènes de deux vaccins. Nous devons faire preuve de la même pharmacovigilance. Je serai, monsieur Didier Houssin, exigeante au nom de mon groupe quant au suivi de cette pharmacovigilance post-vaccinale.
M. Gérard Bapt m’a fait passer, à l’instant, un document de l’Agence française de sécurité sanitaire des produits de santé faisant état de décès intervenus après la vaccination, sans qu’on puisse aujourd’hui affirmer qu’ils ont été causés par le vaccin. Menons les études nécessaires pour avoir un recul statistique suffisant, à défaut de disposer de liens scientifiques avérés. Lien statistique et lien scientifique sont du reste indissociables.
La même circulaire précisait : « Enfin, la traçabilité individuelle sera également utilisée pour assurer un suivi du taux de couverture de la population par l’Institut de veille sanitaire ». Je ne reviendrai pas sur les questions soulevées par mes collègues sur les populations prioritaires. Connaît-on aujourd’hui le nombre de personnes prioritaires qui ont été vaccinées ? Hier, lors des auditions, nous avons entendu des chiffres quelque peu différents, du fait que certaines personnes se rendaient dans les centres munies de bons et d’autres pas, ce qui interdit toute coordination avec les caisses de référence, seul moyen d’identifier le peu de monde qui a été vacciné.
Par ailleurs, ne croyez-vous pas que les pays ont agi concurremment en dépit de l’existence de l’Organisation mondiale de la santé, une organisation internationale censée coordonner les politiques internationales de santé publique ? Une fois que le constat a été établi, la loi du marché n’a-t-elle pas prévalu, chaque pays se battant dès le mois de juillet pour avoir le plus grand nombre de vaccins possible ? Ne faudrait-il pas, au moins au sein de l’Union européenne, coordonner les stratégies afin de ne pas entrer en concurrence commerciale en matière de santé publique, ce qui me semble particulièrement inadmissible ?
En outre, vous avez déclaré au Sénat, lorsque vous avez été auditionné par M. François Autain, que, le 3 juillet, le Premier ministre avait acté la commande de 94 millions de doses : lors d’une prochaine pandémie, pourrait-on consulter les sociétés savantes, notamment l’Académie nationale de médecine ? Elle a souligné dans un communiqué, le mardi 23 février 2010, que « le choix entre une vaccination de masse et une vaccination ciblée pour les personnes à risque n’a pas fait l’objet d’un débat préalable. L’acquisition des vaccins aurait dû se faire par étapes en fonction de l’évolution de la pandémie au sein de la population générale […]. La décision d’une vaccination de masse aurait dû être expliquée et justifiée ». C’est une nouvelle preuve de l’absence d’adaptation.
Enfin, confirmez-vous que, pour la prochaine campagne de grippe saisonnière qui commencera en octobre 2010, les personnes auront le choix entre un vaccin monovalent, qui contiendra la valence H1N1, et un vaccin trivalent, sur le modèle des vaccins saisonniers habituels, qui contiendra lui aussi la valence H1N1 ? Un tel choix sera-t-il cohérent avec le fait que les plus de soixante-cinq ans ont été écartés de la vaccination massive contre la grippe A(H1N1) en raison d’une supposition d’immunité croisée et que ce sont ces mêmes personnes qui sont visées par le vaccin de la grippe saisonnière ? N’y aurait-il pas là une contradiction ?
M. Didier Houssin. La circulaire que vous avez évoquée avait pour objet de préparer l’organisation de la campagne : elle était donc destinée principalement aux préfets. Les informations sur les vaccins qui y figurent sont celles qui étaient disponibles à cette époque-là. Affirmer qu’il s’agit de « produits nouveaux », c’était traduire simplement la réalité : cela ne signifiait pas qu’ils étaient dangereux. Le glissement de sens me paraît excessif. En ce qui concerne le périmètre, souligner qu’il n’était pas exactement connu parce que les autorisations de mise sur le marché n’avaient pas encore été délivrées revenait, de nouveau, à dire seulement la vérité. Aurait-on dû affirmer autre chose dans la circulaire, au risque d’être accusé de cacher la vérité ?
Il convient par ailleurs de distinguer la pharmacovigilance de l’étude de l’efficacité vaccinale. Vous avez auditionné M. Jean Marimbert, directeur général de l’Agence française de sécurité sanitaire des produits de santé : vous savez que la France a tout fait pour parer la crainte liée à l’utilisation d’un vaccin nouveau, notamment par le biais d’un plan renforcé de pharmacovigilance. Pour la première fois, on a donné la possibilité à d’autres personnes que des professionnels de santé, notamment à des personnes vaccinées, de faire part directement de leurs troubles ; des études de cas témoins pharmaco-épidémiologiques ont été mises en place ; on a surveillé très précisément des éléments particuliers comme l’apparition du syndrome de Guillain-Barré. L’Agence française de sécurité sanitaire des produits de santé a fait toutes les semaines un point de pharmacovigilance concernant la vaccination et les antiviraux – la France a été le seul pays à procéder de la sorte. Les études se poursuivent. Le dernier point de pharmacovigilance de l’Agence française de sécurité sanitaire des produits de santé est disponible sur son site et M. Jean Marimbert a fait récemment un point presse sur le sujet.
Les études de mesure de l’efficacité du vaccin visent, quant à elles, à établir nos connaissances en termes de séroconversion. Vous avez évoqué les études réalisées par les Britanniques : l’Institut de veille sanitaire pourrait vous donner des informations sur les études qui sont réalisées en France, notamment dans le cadre de I-MOVE, une étude menée par le Centre européen de prévention et de contrôle des maladies, qui tente d’évaluer l’efficacité vaccinale.
Des éléments convergents, qui s’appuient sur différentes méthodes de mesure de l’efficacité, laissent actuellement penser que les vaccins ont été d’une efficacité voisine de celle qui est observée pour ceux contre la grippe saisonnière – 70 %.
En ce qui concerne la traçabilité, la Commission nationale de l’informatique et des libertés ne nous a pas permis d’accéder à certaines informations concernant les populations prioritaires. Toutefois, l’étude des bons anonymisés qui ont été recueillis par l’Institut de veille sanitaire nous donnera assez rapidement une idée de la couverture vaccinale en fonction des catégories.
Les professionnels de santé font partie de ceux qui se sont fait le plus vacciner, avec les femmes enceintes et l’entourage des jeunes enfants, même si le taux reste faible par rapport à ce qu’il était possible d’espérer. Les populations prioritaires sont donc celles qui ont été les plus vaccinées. Il existe par ailleurs des différences de couverture vaccinale entre les régions : c’est en Bretagne, en Corse et en Champagne qu’on s’est fait le plus vacciner, et en Languedoc-Roussillon le moins vacciner.
En ce qui concerne la concurrence entre les pays, je tiens à rappeler que l’Organisation mondiale de la santé n’est pas un gouvernement sanitaire mondial. C’est un organisme qui produit des normes, qui donne des informations et qui fait des recommandations. Il n’a aucun pouvoir de coordination.
Sur le plan européen, les compétences sanitaires sont principalement du ressort des États, sous réserve de quelques exceptions. Il appartient au politique d’en juger. En matière de sécurité et de menaces sanitaires, on a effectivement besoin d’un renforcement de l’Europe. C’est un point sur lequel Mme la ministre de la santé et des sports a insisté au cours de la présidence française : à l’époque, elle a tenu à mettre l’accent sur le thème de la sécurité sanitaire. Le séminaire « Eurogrippe », destiné à renforcer le niveau européen en matière de préparation aux épidémies, s’est tenu, à point nommé, en septembre 2008 et a donné lieu à une résolution très utile, notamment pour le fonctionnement du comité de sécurité sanitaire.
En ce qui concerne l’avis de l’Académie nationale de médecine de février 2010, je ne reviendrai pas sur les contraintes qui se sont exercées sur les pouvoirs publics en matière d’acquisition des vaccins. De manière générale, il convient d’arriver en même temps à gérer la crise et à organiser le débat public. C’est un enjeu crucial pour notre société. La gestion de crise est tournée vers l’action qui, si j’utilise une comparaison appartenant à la physiologie du mouvement, ferme l’horizon et oriente vers le but. Il n’est donc pas facile d’organiser des débats à la marge.
Enfin, un avis du Haut conseil de la santé publique recommande la vaccination contre la grippe saisonnière des personnes comprises dans la cible habituelle – personnes de plus soixante-cinq ans et malades atteints d’affections de longue durée – avec le vaccin trivalent qui sera produit, lequel comportera en effet la valence H1N1/California qui circule actuellement. Il recommande également l’élargissement de la cible aux personnes jugées les plus à risque vis-à-vis de cette valence : les femmes enceintes, l’entourage des nourrissons et les personnes obèses. Il n’a pas encore recommandé la vaccination des personnes ne présentant pas de facteurs de risque. Toutefois, dans la mesure où on ignore le tour que prendront les événements, ces recommandations seront susceptibles d’évoluer. Nous sommes prêts, en cas de nécessité, à recourir à notre stock de vaccin A(H1N1) monovalent, dans l’éventualité, plausible, d’un nombre insuffisant de doses de vaccin trivalent saisonnier. Nous nous préparons à toute éventualité : mettre en place le dispositif de vaccination contre la grippe saisonnière selon le schéma habituel, avec les bons de la Caisse nationale d’assurance maladie des travailleurs salariés, tout en travaillant avec elle à l’élargissement du dispositif à certaines populations. Si nous devons utiliser les vaccins monovalents, il conviendra d’associer de manière plus sereine les professionnels de santé et de trouver des modes d’organisation permettant d’utiliser, le cas échéant, des vaccins multidoses. Ce travail a également été lancé.
M. le président Jean-Christophe Lagarde. Sur les 10 millions de doses de vaccin qui seront encore valables à la fin de l’année, quelle est la répartition entre les monodoses et les multidoses ?
M. Didier Houssin. Il me faut vérifier les chiffres, car ceux-ci doivent prendre en compte la date de péremption. Je crains qu’il ne nous reste pas beaucoup de monodoses.
M. le président Jean-Christophe Lagarde. Cela signifie-t-il que les monodoses se périment plus vite que les multidoses ?
M. Didier Houssin. Oui.
Mme Marie-Louise Fort. Nous avons bien compris que la gestion de l’épidémie a été transversale. Nous n’avons pas manqué, sinon de bras, du moins d’écrivains pour publier des notes aussi diverses que variées, comme en ont témoigné les préfets, les représentants de l’éducation nationale, les médecins libéraux ou les pharmaciens. Quelle conclusion en avez-vous tiré en matière de communication ? En effet, les populations défavorisées n’ont pas été touchées – peut-être les médias ont-ils semé le trouble – et on a alimenté les inquiétudes des populations plus averties – il suffisait de se rendre dans les centres de vaccination pour s’en rendre compte. Conviendrait-il d’utiliser le réseau habituel de proximité, comme vous l’avez suggéré à l’instant ? Est-il normal que les médecins aient reçu des notes provenant d’un peu partout ?
Une réflexion est-elle menée afin de prévoir, demain, une communication plus pointue à l’égard des professionnels et plus simple et fiable en direction de l’ensemble de la population ?
M. le rapporteur. Pour compléter la question de Mme Marie-Louise Fort, je souhaite savoir si la répartition des tâches entre le ministère de l’intérieur et celui de la santé a été satisfaisante. Ne conviendrait-il pas plutôt de renforcer la cellule interministérielle de crise en y intégrant une mission de veille sur les réseaux sociaux et professionnels, comme l’a fait le Centre de prévention et de contrôle des maladies d’Atlanta ? Il me semble que vous souhaitez vous-même un tel renforcement de la cellule de crise.
M. Didier Houssin. Un effort a été fait en direction des populations défavorisées, notamment sans domicile fixe, afin qu’elles puissent accéder, sans bon, à la vaccination. Des instructions ont été données et des équipes mobiles ont été créées. Il n’en reste pas moins que la couverture des quartiers défavorisés a été deux fois plus faible que celle des autres quartiers, ce qui pose le problème général de l’inégalité d’accès non seulement aux soins, mais également à la prévention, que nous avons déjà constaté dans le domaine sanitaire à de nombreuses occasions. Cette inégalité peut provenir d’un manque d’information ou de compréhension, notamment en raison de l’emploi d’un langage inadéquat. Le développement d’une action de prévention qui ne creuserait pas les inégalités est un véritable enjeu pour les années à venir.
Nous avons identifié la production de quelque trois cents textes durant la période visée : votre analyse est donc exacte. Il convenait toutefois de s’adapter à l’évolution de la situation, ce qui entraînait la modification de notre message et donc l’envoi de nouvelles notes. Nous devions également réagir rapidement aux dysfonctionnements des centres de vaccination qu’un dispositif d’analyse nous permettait de déceler. On peut difficilement nous demander d’être vigilants et réactifs et nous reprocher d’avoir produit des messages correctifs.
Il n’en reste pas moins vrai que nous rencontrons des difficultés à nous adresser à certains relais, notamment aux médecins. Nous avons beau nous adresser aux syndicats, aux unions régionales des professionnels de santé ou à l’ordre, nous ne sommes pas certains que le relais se fasse. Quant aux dispositifs directs, comme DGS-urgent, ils ont leurs limites : les médecins ne sont pas en permanence en train de consulter leur ordinateur. Ce problème est lié au manque de structuration des soins de premier secours dans notre pays. Nous avons moins de difficulté pour nous adresser aux établissements de santé qui ont un dispositif de relais de l’information.
S’agissant de la cellule interministérielle de crise, nous avons eu trop tendance à considérer que la communication venait après la décision, ce que traduisait le fonctionnement de la cellule : analyse de la situation sanitaire et de ses évolutions et prise des décisions en premier lieu, la communication n’intervenant que comme la conséquence de celle-ci. Une des leçons très importantes à tirer des événements devrait nous conduire à intégrer beaucoup plus tôt la communication dans le processus de décision. Le livre de M. Dominique Wolton, Informer n’est pas communiquer est très éclairant sur ce point. Des dispositifs permettant de mesurer la perception du risque par la population ou l’état d’esprit d’un corps professionnel doivent être intégrés, comme relevant des sciences de la communication, en amont de la prise de décision comme autant d’éléments appelés à la réguler.
M. le président Jean-Christophe Lagarde. Ne pensez-vous pas que le débat public a eu lieu de toute façon sur internet, un champ qui a été évacué ? De plus, pourquoi l’Académie nationale de médecine n’a-t-elle jamais été consultée alors que, dans l’esprit des Français, elle serait le lieu naturel de ce débat ? Son intervention aurait du reste permis de hiérarchiser dans leur esprit la multiplicité des autorités qui sont intervenues sur le sujet. Enfin, les positions des instances d’expertise nationale, notamment celle du Comité de lutte contre la grippe, ne devraient-elles pas être rendues publiques dans ce type de crise ? Pourquoi ne le sont-elles pas ?
M. Didier Houssin. Le rôle de l’État vis-à-vis d’internet pose un problème en démocratie. Des fonctionnaires peuvent-ils intervenir sur la toile et doivent-ils le faire de manière anonyme ou non ?
M. le président Jean-Christophe Lagarde. Tout le monde étant anonyme sur internet, on peut intervenir sous le couvert de l’administration.
M. Didier Houssin. Vous avez raison : pour cette crise et pour d’autres crises, la question de l’action de l’État sur internet doit être précisée. L’État a tendance aujourd’hui à se contenter d’informer au travers de sites sans aller jusqu’à argumenter. C’est un débat essentiel, qui pose des enjeux politiques et éthiques majeurs. Il convient de réfléchir aux modalités d’une telle intervention.
C’est vrai que l’Académie nationale de médecine, héritière principalement de l’Académie royale de chirurgie et de la Société royale de médecine, a été durant plusieurs siècles l’organe d’expertise des sociétés. Au fil du temps, en raison de la complexification et de la spécialisation des sciences, les organismes d’expertise sont devenus les références. L’Académie nationale de médecine continue de jouer un rôle : nous l’interrogeons sur certains sujets, sans pour autant lui demander systématiquement son avis sur la gestion de toutes les crises. Ce point mériterait d’être étudié.
M. le président Jean-Christophe Lagarde. Je le répète : dans l’esprit des Français, l’Académie nationale de médecine, en raison même de son ancienneté, a, pour engager un débat public, une autorité supérieure à celle de personnes récemment auditionnées qui s’autoproclament experts. Elle permettrait de rétablir une hiérarchie dans le débat.
M. Didier Houssin. J’entends le message, monsieur le président.
Le Comité de lutte contre la grippe est, quant à lui, un comité technique qui, dans notre esprit, avait pour fonction de préparer, notamment dans le domaine de la vaccination, les avis du Comité de lutte contre la grippe, auxquels, il est vrai, nous avons tardé à donner toute la publicité nécessaire. Nous devons nous interroger – la question a été posée au Sénat – sur l’avenir de ce comité : doit-il subsister en l’état ou être rattaché au haut conseil ?
M. le président Jean-Christophe Lagarde. La transparence est nécessaire. En effet, à vouloir maîtriser l’information, on finit par favoriser la désinformation.
Les médecins se sont plaints de devoir chercher l’information eux-mêmes, ce qui n’est pas normal. Or, comme vous l’avez vous-même souligné, il n’existe aujourd’hui aucun système permettant de prendre contact avec eux. Pourquoi n’impose-t-on pas à un médecin qui s’installe – bien qu’il relève d’une profession libérale, il est affilié à la Sécurité sociale et il est inscrit à un ordre – d’avoir une adresse électronique permettant à la direction générale de la santé de le joindre en permanence ? Ce serait une obligation simple et peu coûteuse à mettre en œuvre, mais nécessaire. C’est avec effarement que j’ai découvert que l’État ne pouvait pas contacter, en cas de besoin, les médecins ni les infirmiers, qui relèvent eux aussi d’un ordre.
M. Didier Houssin. Cette idée me paraît excellente. Lorsque nous avons demandé aux médecins de nous indiquer la façon dont ils souhaitaient être informés, beaucoup nous ont répondu qu’ils voulaient que le ministère de la santé mette en place un site dédié, ce que nous avons fait. Pouvoir disposer, pour chaque médecin, d’une adresse électronique afin de lui envoyer des messages, sans qu’il ait à faire volontairement la démarche de s’abonner, même s’il est vrai que DGS-urgent ne coûte rien, serait une évolution tout à fait souhaitable.
M. le président Jean-Christophe Lagarde. Je poserai également la question au ministre de l’éducation nationale : est-il vrai que les équipes mobiles, dans les établissements scolaires, ne vaccinaient pas les enseignants en même temps que les élèves ? Si oui, cela vous paraît-il logique ?
M. Didier Houssin. C’est l’option qui avait été retenue, en application, il est vrai un peu systématique, de la décision qui avait été prise à l’origine pour la vaccination des populations prioritaires. À l’expérience, il se révèle très difficile de dissocier une population prioritaire de ceux qui en ont la charge. Le problème se posait également pour les détenus.
M. le président Jean-Christophe Lagarde. On a, de la même façon, fini par vacciner l’entourage du personnel hospitalier.
Le professeur Antoine Flahault, directeur de l’École des hautes études en santé publique, nous a affirmé qu’on fait face, dans cette affaire, à des années d’incurie sur les études de vaccination, si bien qu’on ne sait pas démontrer la nécessité ou l’efficacité des vaccinations, même en milieu médical. La vaccination contre la grippe saisonnière toucherait également un nombre insuffisant de Français, pour des raisons financières, puisqu’on ne cesse de restreindre le public remboursé. C’est donc manifestement une affaire d’argent, alors même qu’on vient d’en dépenser largement dans la gestion de la grippe A(H1N1).
Nous nous retrouvons donc dans la situation suivante : d’une part, l’efficacité de la vaccination en cas d’épidémie ou de pandémie n’est pas démontrée en matière de santé publique – j’écarte le bénéfice qu’on en retire en termes de protection individuelle –, c’est pourquoi le professeur Antoine Flahault pense qu’il serait temps de procéder aux études nécessaires ; d’autre part, certains nous ont affirmé que si, en France, comme c’est le cas aux États-Unis, la vaccination contre la grippe saisonnière touchait un public beaucoup plus large, on gagnerait en efficacité en cas de pandémie grippale dangereuse, d’autant qu’on a cherché à vacciner un public a priori moins intéressé puisqu’il n’était pas habituellement sollicité pour la vaccination contre la grippe saisonnière.
M. Didier Houssin. De manière générale, il est toujours très difficile de démontrer l’efficacité des mesures de prévention. En effet, comme il s’agit de prévenir un événement, on ne peut jamais affirmer de façon objective que si l’événement ne s’est pas produit, c’est grâce à l’action qui a été menée, que ce soit en matière de vaccination ou dans d’autres domaines.
Des arguments convergents peuvent suggérer une efficacité vaccinale, ne serait-ce qu’à travers les études de séroconversion ; il ne s’agit toutefois que d’un indicateur. La démonstration de l’efficacité des campagnes de vaccination exige donc des études très précises sur des populations très larges, ce qui suppose de pouvoir recueillir des données en grand nombre. La vaccination est toutefois très utile sur le plan sanitaire comme sur le plan économique, puisqu’elle permet de réduire l’absentéisme. De ce point de vue, il y a avantage à vacciner. C’est probablement en termes de vaccination que la prévention se révèle la plus efficace.
S’agissant de la cible touchée par la vaccination contre la grippe saisonnière, des différences existent entre les pays. La France, après avis des experts, a déterminé une cible relativement limitée : les personnes âgées de plus de soixante-cinq ans, les malades atteints d’affections de longue durée et les très jeunes enfants présentant des facteurs de risque parce qu’il s’agit de populations chez lesquelles les conséquences les plus sévères de la grippe saisonnière ont été identifiées. Nous avons donc tendance à proposer la vaccination à ceux qui nous semblent les plus menacés. Dans ce contexte, la couverture vaccinale est, en France, une des plus élevées d’Europe – de 65 % à 70 %, alors que le taux fixé par l’Organisation mondiale de la santé tourne autour de 75 %. Ce sont les Hollandais qui ont la couverture vaccinale la plus importante. Chaque année, nous menons un travail de conviction et d’information avec l’assurance maladie, travail pour lequel, cette année, nous redoublerons d’effort.
Il est vrai qu’aux États-Unis la cible de la vaccination contre la grippe saisonnière est plus large et concerne davantage les enfants. Il s’agit du reste souvent d’initiatives individuelles. Désormais nous nous poserons, chaque année, la question de l’élargissement de cette cible, notamment aux enfants.
M. le président Jean-Christophe Lagarde. Les représentants des laboratoires nous ont affirmé qu’en matière de vaccins monodoses ou multidoses ils ne rencontraient pas tant des difficultés de production que de remplissage. Une réflexion a-t-elle été lancée, sur le plan national ou européen, pour améliorer la situation en la matière ?
M. Didier Houssin. J’étais présent hier au comité de sécurité sanitaire européen : nous avons évoqué cette question. Un des facteurs limitant les délais de livraison consiste non dans la production, mais dans la mise en flacon, les monodoses accroissant encore les difficultés. Dès le mois de mai, les industriels avaient clairement identifié les limites tenant aux capacités des sociétés de façonnage, lesquelles doivent, du reste, remplir des critères très stricts de qualité. C’est la raison pour laquelle, à partir du mois de septembre, les fabricants de vaccins ont déposé progressivement des demandes d’autorisation de mise sur le marché parce qu’ils tentaient d’élargir leur capacité de façonnage et introduisaient dans le dispositif de nouveaux acteurs, y compris en France.
Dans les études que nous lancerons sur la révision des stratégies de vaccination contre la grippe, notamment en situation de pandémie, la question des capacités de façonnage sera sûrement évoquée.
M. le président Jean-Christophe Lagarde. Lors de son audition, le professeur Pierre Bégué, membre de l’Académie nationale de médecine, a regretté qu’on forme de moins en moins les médecins à la vaccination. Entreprendrez-vous des actions pour corriger cet état de fait ?
Par ailleurs, pourquoi les centres de protection maternelle et infantile n’ont-ils pas été sollicités pour la vaccination, alors que – je le dis en tant que député élu en Seine-Saint-Denis – ce sont les populations fragilisées qui les fréquentent ?
M. Didier Houssin. La direction générale de la santé a lancé depuis plusieurs mois une étude sur un projet intitulé « stratégie nationale de vaccination », qui vise, d’une part, à répondre à la complexité de la lecture du calendrier vaccinal par les professionnels et le public, complexité qui résulte de la multiplication des vaccins, et, d’autre part, à comprendre le positionnement des professionnels vis-à-vis des trois grandes catégories de vaccins : les vaccins infantiles et traditionnels, dans la prescription desquels les médecins jouent un rôle actif ; les vaccins destinés aux voyageurs dans les pays exotiques, qui ne posent également aucun problème de prescription ; les nouveaux vaccins, enfin, qui conduisent à des positionnements différenciés. Il convient de préparer une stratégie nationale de vaccination qui prenne en considération ces éléments nouveaux.
En ce qui concerne les centres de protection maternelle et infantile, nous avions évidemment réfléchi à la possibilité de s’adresser à eux, notamment pour les femmes enceintes. Nous y avons renoncé pour des raisons d’espace : nous ne voulions pas courir le risque d’amener dans les centres de protection maternelle et infantile une population potentiellement importante. Compte tenu du contexte, la mise en place de centres de vaccination nous a semblé préférable.
M. le président Jean-Christophe Lagarde. J’ai voulu la création de cette commission d’enquête pour faire avancer les choses ; j’ai du reste constaté, à travers nos travaux, que vous avez modifié certaines de vos positions depuis votre première audition, et j’en suis heureux. Je souhaiterais qu’il en fût de même du secrétariat général de la défense et de la sécurité nationale qui m’a paru beaucoup plus assuré de la perfection du plan qui a été mis en place.
Je gère cinq centres de protection maternelle et infantile dans la commune de 60 000 habitants dont je suis le maire. La Seine-Saint-Denis a une forte tradition en matière de protection maternelle et infantile. Il n’était pas besoin de demander aux personnes de venir massivement, il suffisait de proposer la vaccination à toutes celles, et elles sont nombreuses, qui viennent consulter, ce qui n’aurait posé aucun problème en termes d’affluence. Nous aurions parfaitement pu gérer une telle pratique sur le terrain.
M. Didier Houssin. Dans la gestion d’une telle crise à l’échelon national, on a beaucoup de peine à faire preuve d’un discernement suffisant pour décider si telle ou telle pratique se révélera finalement possible sur le terrain. Il est en effet difficile de concilier la gestion globale avec une perception aiguë des possibilités locales. Je n’ignore pas le rôle exemplaire que jouent les centres de protection maternelle et infantile en Seine-Saint-Denis.
M. le président Jean-Christophe Lagarde. Il convenait de se servir de cette possibilité, du moins là où elle existe.
Du reste, il serait d’autant plus utile que les maires soient représentés au sein de la cellule interministérielle de crise – j’en ferai la remarque au ministre de l’intérieur – que le bon fonctionnement des centres a été, in fine, assuré par les municipalités.
M. Gérard Bapt. Sans doute ne déclareriez-vous pas aujourd’hui que si c’était à refaire, vous referiez la même chose. La réflexion que nous menons ensemble vise à améliorer les conditions de déploiement d’un éventuel nouveau plan.
Pourquoi les débats du Comité de lutte contre la grippe sont-ils secrets ? Je m’en étonne tout autant que le président de la commission d’enquête. Si j’y ai eu accès, c’est en tant que rapporteur spécial, puis en tant que membre de cette commission d’enquête. J’ai également été frappé par le fait que les membres du Comité de lutte contre la grippe se sont demandés, lors d’un débat, s’il ne serait pas opportun d’inviter en leur sein un pneumologue. Il n’y avait en son sein ni clinicien ni sociologue, ce qui lui aurait évité de tracer des plans sur la comète. Le 10 mai, il vous a proposé un plan tout fait, qui a été suivi jusqu’au terme de la crise.
Il aurait également fallu publier les conflits d’intérêts au sein du comité : le fait que certains de ses membres travaillaient en même temps pour des laboratoires producteurs de vaccins crée un malaise.
En ce qui concerne l’efficacité du vaccin, il faut peser les bénéfices et les risques. Je suis partisan, à titre préventif, de la vaccination : toutefois, l’Institut de veille sanitaire fait état de trois cent douze décès, dont cinquante sans pathologie associée connue. Quant au nombre des patients admis en unité de soins intensifs – mille cent trente –, seulement dix-huit avaient été vaccinés préalablement à l’hospitalisation, dont dix-sept moins d’une semaine auparavant – le vaccin n’était donc pas encore efficace, puisqu’il n’avait pas encore permis le développement d’anticorps. Convenait-il dès lors de vacciner aussi largement pour faire obstacle à la pandémie, d’autant que, selon les données de l’Agence française de sécurité française des produits de santé, vingt et un décès peuvent être rattachés à la vaccination ? La crédibilité des décisions est fonction de la clarté du débat : quand on a des doutes, mieux vaut les exposer à la population car cela permet d’éviter qu’internet ne diffuse des informations erronées.
M. le président Jean-Christophe Lagarde. Je suis d’accord avec vous. Du reste, le directeur général a déjà répondu que ce qui était visé, ce n’était pas la pandémie, mais le bénéfice individuel.
M. Dider Houssin. Peut-être ai-je été cité partiellement. Lorsque j’avais affirmé que nous referions la même chose, je sous-entendais : avec les mêmes éléments de connaissance. Compte tenu de ceux dont nous disposons aujourd’hui, nous procéderions très différemment. Nous avons beaucoup de leçons à tirer des événements et de nombreux points à améliorer.
Nous nous sommes au fond rarement trouvés dans des situations où nous pouvions hésiter sur l’option à prendre. Ce fut le cas de certaines décisions politiques très importantes, pour lesquelles plusieurs options se présentaient : l’obligation vaccinale, la gratuité ou l’ordre de priorité. Il en fut différemment de l’acquisition des vaccins ou de l’organisation de la campagne.
S’agissant du débat public, j’ai, récemment, saisi officiellement la Conférence nationale de santé pour qu’elle travaille sur le sujet suivant : gestion de crise et organisation du débat public.
C’est moi qui ai demandé à ce que le Comité de lutte contre la grippe introduise en son sein une compétence pneumologique, en raison de l’observation de plusieurs pneumopathies graves asphyxiantes qui nous ont conduits à acquérir des appareils de circulation extracorporelle et des respirateurs.
M. Gérard Bapt. Ce fut une décision heureuse.
M. Dider Houssin. Si nous n’avions pas procédé à de telles mesures, il est probable que la mortalité eût été plus importante.
En ce qui concerne les conflits d’intérêts, je suis prêt à balayer devant ma porte : alors que les agences ont été exemplaires en la matière, peut-être la direction générale de la santé n’a-t-elle pas été suffisamment réactive. Nous le serons davantage la prochaine fois.
Sur la comparaison entre l’efficacité vaccinale et l’observation de la pharmacovigilance, il convient d’être prudent. Il faudra relire avec précision le compte rendu de l’Agence française de sécurité sanitaire des produits de santé. En effet, comme l’a observé Mme Catherine Lemorton, que signifie l’affirmation selon laquelle vingt et un décès sont « rattachés » à la vaccination ? S’agit-il d’un lien de causalité ou d’une association fortuite ? En revanche, pour la grande majorité des décès observés, le lien est assez net entre l’infection virale et le décès, compte tenu, parfois, de facteurs de risques associés.
M. le président Jean-Christophe Lagarde. Monsieur le directeur général, l’ambiance entre le ministère de la santé et les médecins, au moment de la prise des décisions, semble avoir été tendue, tant en raison de la question de la tarification de l’acte médical que du vote de la loi portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires. Ces difficultés ont-elles pesé sur les discussions entre le ministère de la santé et les syndicats de médecins visant à les associer à la campagne ? Aujourd’hui les syndicats déclarent qu’ils y étaient prêts alors qu’un grand nombre d’acteurs, dont les préfets, prétendent le contraire.
M. Didier Houssin. Vous mettez le doigt sur un sujet important qui dépasse ma compétence. Nous pouvons constater la relative malchance d’avoir eu, en même temps, à traiter d’un texte important qui concernait directement l’organisation du travail des médecins et à gérer un phénomène de santé publique qui aurait volontiers conduit les pouvoirs publics à s’appuyer le plus possible sur eux. Cette conjonction n’était pas la plus heureuse.
M. le président Jean-Christophe Lagarde. J’ai noté ces deux affirmations : « Quand on est face à une médecine de catastrophe, mieux vaut utiliser les dispositifs éprouvés que des dispositifs nouveaux », « médecine de catastrophe » pouvant être traduit par « situation de crise », et : « Une contractualisation particulière serait-elle possible, notamment avec le monde libéral en de telles situations ? » Ce qui est frappant, c’est qu’on ait attendu de se trouver en situation de crise pour se poser la question, et uniquement parce que les médecins étaient mécontents du prix de l’acte et de la loi qui venait d’être adoptée. Ne conviendrait-il pas d’anticiper, à l’avenir, ce genre de situation ?
M. Dider Houssin. La superstructure s’était préparée : l’appareil d’État, les grands organismes, les grandes entreprises. Les autres échelons de la société, y compris les citoyens, n’étaient pas préparés à la crise. Si un chantier est à mener, il doit porter sur la résilience, au sein de la société, non seulement de chaque citoyen pris dans son individualité, mais également des professionnels les plus concernés. C’est un enjeu important pour l’avenir.
M. le président Jean-Christophe Lagarde. En cas de crise grave, pensez-vous que la France pourrait vacciner 66 millions de Français ?
M. Didier Houssin. S’ils souhaitaient se faire vacciner…
M. le président Jean-Christophe Lagarde. Si 66 millions souhaitaient se faire vacciner, pensez-vous que nous en aurions les moyens ?
M. Didier Houssin. Une des leçons à tirer de la pandémie, c’est qu’il est très difficile de vacciner un grand nombre de personnes dans de brefs délais. Les capacités du dispositif que nous avons mis en place, bien qu’importantes, ont connu des limites en termes de dimensionnement et de ressources humaines. S’il avait fallu aller très vite, nous aurions été confrontés à des difficultés, comme ce fut le cas dans des pays où l’affluence a été plus forte.
Les agents infectieux émergents constituant un sujet très important, la société doit se préparer à vacciner, dans de brefs délais et à grande échelle, la population qui le souhaite. C’est un objectif important.
M. le président Jean-Christophe Lagarde. S’il convient de s’y préparer, c’est que nous ne sommes pas prêts.
Je ne prétends pas que la France soit le pays le moins préparé. Toutefois, il existe un télescopage entre l’État qui pense avoir préparé son dispositif et la confiance, voire la croyance que les Français ont dans l’État, sans pouvoir se rendre compte des incertitudes qui émaillent ce type de crises. On a également évoqué le plan variole : si de graves crises sanitaires survenaient, nous ne serions pas capables de vacciner, dans de brefs délais, 66 millions de Français. Il convient donc de définir des ordres de priorité, ce qui implique que chacun prenne son mal en patience. Vous avez évoqué la faculté de résilience d’un pays : cette question pose, à mes yeux, celle du déficit de communication de l’État, par-delà les alternances politiques, lequel ne parvient pas à éduquer les citoyens sur de tels sujets. Il devrait leur expliquer posément, c’est-à-dire en dehors des périodes de crise, que nous sommes confrontés à des difficultés en matière sanitaire et qu’il conviendra, en cas de crise, de faire face aux événements le mieux possible.
J’ajouterai, puisque, je le répète, j’ai noté une évolution dans votre raisonnement, évolution qui devra se traduire dans les décisions qui seront prises, qu’il faudrait aller jusqu’à expliquer à nos concitoyens qu’il est possible que l’État lance, un jour, une alerte maximale à propos d’un phénomène inquiétant susceptible de se révéler moins grave que prévu et que ce sera toujours mieux que de faire semblant de ne pas voir, comme ce fut le cas du nuage de Tchernobyl ou du sang contaminé. Malheureusement, on n’a jamais réussi depuis à trouver l’équilibre permettant de s’armer contre une menace, tout en acceptant que ce soit en vain, ce qui, après tout, est toujours préférable. Le tout est de savoir adapter le dispositif en cas de diminution de la menace – je pense à ce qui se passe avec le plan Vigipirate.
L’adaptabilité, contrairement à ce que pense le secrétariat général de la défense et la sécurité nationale, ne concernait pas les mesures individuelles mais consistait à reconnaître que la menace pouvait évoluer. J’ai la conviction, monsieur le directeur général, qu’en septembre dernier, avant de lancer la campagne de vaccination, on pouvait reconnaître publiquement que la menace avait diminué et qu’on pouvait restreindre la campagne aux populations à risque, tout en assurant nos concitoyens que la France possédait suffisamment de vaccins pour faire face à une éventuelle mutation du virus. Aucun Français n’en voudrait à quelque gouvernement que ce soit ni, évidemment, à l’administration sanitaire, d’avoir tenté de parer une grave menace sans avoir jamais cherché à le tromper sur la réalité de celle-ci.
Je vous remercie, monsieur le directeur général.
La séance est levée à douze heures trente.
Audition de Mme Roselyne Bachelot-Narquin,
ministre de la santé et des sports
(Procès-verbal de la séance du mardi 15 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à neuf heures trente.
M. le président Jean-Christophe Lagarde. Madame la ministre de la santé et des sports, l’objectif de cette commission d’enquête est de faire le bilan des points forts et des points faibles de la campagne de vaccination contre la grippe A(H1N1), en vue d’une gestion optimale de problèmes de santé publique similaires au cas où ils viendraient à se présenter
– ce qui est malheureusement probable. De ce point de vue, je tiens à observer que nos travaux seront handicapés par le refus de l’Organisation mondiale de la santé, pourtant encore assez largement financée par les différents États, d’être auditionnée par notre commission, alors même qu’elle a accepté de l’être par d’autres instances.
L’heure du bilan approche. Le rapport de M. Jean-Pierre Door devra être mis à la disposition des membres de la commission d’enquête le 30 juin prochain, et la commission sera appelée à se prononcer sur ses préconisations le 6 juillet. Nous entamons donc la dernière série de nos auditions, consacrée aux responsables ministériels.
Comme vous le savez, notre commission d’enquête a beaucoup travaillé, dans le temps très court qui lui était imparti, et a pu entendre de nombreux responsables administratifs. À cet égard, je tiens à souligner la parfaite disponibilité de vos services, madame la ministre, notamment celle du directeur général de la santé, présent à vos côtés aujourd’hui, que nous avons entendu deux fois. Soyez-en remerciés tous les deux.
(Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports, prête serment.)
Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports. Monsieur le président, monsieur le rapporteur, mesdames et messieurs les députés, je suis très heureuse d’être parmi vous aujourd’hui. Soyez assurés que je partage votre préoccupation de rendre plus opérationnels, plus efficaces et plus réalistes nos futurs plans de vaccination contre les pandémies, en tirant tous les enseignements de la manière dont a été gérée la campagne de vaccination contre la grippe A(H1N1). De cette gestion, il nous appartient de préserver les aspects positifs, voire de les améliorer encore. Je souhaite aussi que votre travail puisse enrichir celui de mon ministère, en vue des campagnes de demain. Nous en sommes tous convaincus : nous avons non seulement une marge de progression en la matière, mais aussi l’impérieuse nécessité de favoriser les démarches de prévention.
Une des questions centrales qui ont commandé mon action dès l’émergence de l’alerte et tout au long de la pandémie est celle de l’évaluation du risque.
Nous avons su très tôt que le virus A(H1N1) n’était pas le virus A(H5N1) et que sa virulence était beaucoup plus modérée. Néanmoins, nous avons dû supporter, tout au long de la pandémie, l’incertitude quant à sa possible mutation et à l’acquisition de facteurs de virulence, voire de résistance ou de contagiosité. Comme vous l’a dit le professeur Claude Hannoun, les virus sont « facétieux » ; ils n’évoluent jamais comme on le croit.
Lors de l’émergence de l’alerte, j’ai donc ouvert le champ des possibles. Je n’ai retenu ni l’option d’une disparition pure et simple du virus, ni celle d’un scénario noir de type grippe aviaire. Conduire une politique, ce n’est pas suivre une croyance, ni faire un pari. J’ai retenu un scénario fondé sur des hypothèses plausibles qui s’est révélé plus pessimiste que ce qui est advenu dans la réalité. En l’occurrence, nous avons su, j’en suis convaincue, prendre des mesures adaptées face à cette pandémie qui a pu être qualifiée de « grippette » par certains d’entre vous.
Je voudrais donc vous rappeler, d’une part, les événements favorables qui ont lissé le risque et, d’autre part, les éléments positifs de la gestion de l’alerte. En effet, je souhaiterais que l’évaluation de la politique de prévention que j’ai engagée soit réalisée à l’aune du risque tel qu’il a été évalué puis réévalué tout au long de la préparation à la vague pandémique, et non pas tel qu’il s’est réalisé à la fin de l’année 2009. Quand vous assurez votre voiture en début d’année, vous ne regrettez pas, en décembre, de n’avoir pas eu d’accident : il n’y a besoin d’aucun accident pour justifier a posteriori le coût de votre prime d’assurance !
Tout d’abord, en tant que responsable politique, et même s’ils ne doivent rien à l’action que j’ai menée depuis le 24 avril 2009, je me félicite sincèrement des événements favorables qui ont rendu acceptable la menace que nous avons eu à affronter.
Certains ne tiennent pas au hasard. Nous avons su nous préparer. La menace de grippe aviaire a amené la France à se doter d’un plan de prévention et de lutte contre la pandémie grippale régulièrement actualisé. Pour autant, lorsqu’elle se concrétise, la menace ne prend jamais tout à fait le visage que l’on avait imaginé, et le plan a été la première victime du virus A(H1N1) – il faudra nous en souvenir pour l’avenir. Il n’a cependant pas été inutile, puisque nous en avons extrait les outils adaptés à la situation rencontrée – à aucun moment, je n’ai renversé la « boîte à outils » sur la table !
De la même façon, l’Organisation mondiale de la santé avait actualisé son mode de gestion et de coordination de l’alerte sanitaire ; et le règlement sanitaire international, adopté tout récemment, a permis le partage du signal d’alerte, puis celui de son analyse, entre tous les États parties à cette organisation.
D’autres événements tiennent davantage au caractère « facétieux » de ce virus A(H1N1). Il a émergé dans un pays où le système de surveillance a permis une détection précoce. Il s’est révélé étonnamment stable. Il n’a pas muté vers une forme plus dangereuse ; en tout cas, les mutations inquiétantes qui sont apparues, comme la mutation dite « norvégienne », n’ont pas acquis la capacité de se transmettre. En outre, il est resté sensible aux antiviraux et aux vaccins.
A compté, enfin, le moment auquel a surgi l’alerte. Son émergence au printemps a laissé le temps de produire des vaccins et d’obtenir leurs autorisations de mise sur le marché. C’était sinon inespéré, du moins imprévu.
Ce nouveau virus a par ailleurs évincé les virus saisonniers. Nous n’avons pas eu de grippe saisonnière, ce qui a permis d’éviter un cortège de complications chez les personnes âgées et un nombre important de décès.
En outre, une seule dose de vaccin a suffi pour protéger la majeure partie d’entre nous, et certains – les plus âgés – avaient, ce que nous ne savions pas au départ, gardé une immunité naturelle. Ces deux éléments ont réduit la circulation du virus.
Au-delà de ces événements favorables, je veux que nous puissions capitaliser sur les points positifs de la gestion de cette pandémie, car ils ont été nombreux et je souhaite en souligner aujourd’hui quelques-uns plus particulièrement.
Le premier, c’est la réactivité à l’alerte et l’adéquation des mesures proposées face à un virus inconnu.
Dans la toute première phase de l’alerte, dès le 24 avril et jusqu’au 23 juillet 2009, les établissements de santé se sont consacrés à la prise en charge systématique de tous les cas. Les centres 15 ont effectué la régulation de cette prise en charge et ont signalé les cas à l’Institut de veille sanitaire ; les services d’urgence et de maladies infectieuses ont isolé et mis sous traitement les patients, et les laboratoires hospitaliers ont réalisé le diagnostic biologique.
Cette phase avait pour objectif de ralentir la pénétration du virus sur notre territoire. Je ne peux, certes, assurer de l’efficacité de ces seules mesures. Mais je peux constater, avec vous, qu’un mois s’est écoulé entre l’apparition des premiers cas importés du Mexique – dès le 26 avril – et l’apparition de cas secondaires signant une transmission virale autochtone. Je constate également la différence d’évolution avec le Royaume-Uni qui n’a pas pris de mesures aussi drastiques et qui a été touché assez sévèrement dès le mois de juillet 2009.
Cette phase, dite « de contingentement », nous a permis de parfaire notre préparation et de mieux connaître les caractéristiques du virus.
Deuxième point positif : l’acceptation par nos concitoyens des mesures
– essentielles – d’hygiène, dites « mesures barrières ».
Selon les enquêtes d’opinion, 40 % d’entre eux ont modifié leur comportement. Ce résultat, je dois le dire, m’impressionne. S’il est difficile de mesurer l’impact qu’ont eu ces mesures sur la pandémie, je constate avec l’ensemble des professionnels de santé que la gastroentérite et la bronchiolite, habituellement sources d’encombrement des salles d’attente et des urgences en hiver, ont reculé. J’envisage donc de poursuivre cet automne une campagne de sensibilisation qui nous a permis de ne pas revivre le cauchemar de janvier 2009, quand les établissements de santé étaient débordés.
Troisième point positif : la capacité qu’a démontrée notre système de soins à faire face à une épidémie nouvelle.
Les établissements de santé comme les médecins traitants ont su s’adapter aux particularités de la prise en charge des malades atteints du virus. La précocité de la prise en charge des cas de grippe par la médecine de ville, la précocité de la délivrance des antiviraux par les pharmaciens et la qualité des soins de réanimation pour des formes graves inusitées en sont trois exemples significatifs. Je veux le dire avec reconnaissance et respect : les professionnels de santé ont été au rendez-vous, et je les en remercie.
Le quatrième point positif a trait aux vaccins.
Beaucoup de choses ont été dites à ce sujet. Ce que je veux retenir, c’est d’abord la rapidité avec laquelle la souche a été mise à la disposition des laboratoires de référence par l’Organisation mondiale de la santé. C’est ensuite le temps précieux que nous a fait gagner la procédure maquette, dite « mock-up », mise en œuvre par l’Agence européenne du médicament – c’est la première fois que nous disposons d’un vaccin avant une pandémie ! C’est encore la qualité de la pharmacovigilance mise en place par l’Agence française de sécurité sanitaire des produits de santé, dans le cadre du plan de gestion des risques de l’agence européenne. Ce sont, enfin, les résultats de cette surveillance, qui ont confirmé le bon rapport bénéfices/risques des vaccins utilisés, avec ou sans adjuvant.
En cinquième lieu, l’Institut Pasteur mérite un coup de chapeau pour avoir su, dès le 5 mai, mettre au point un test de diagnostic fiable, diffusé ensuite au réseau de laboratoires et qui a permis d’affirmer le diagnostic d’infection liée au virus pandémique.
Enfin, concernant l’organisation de la campagne de vaccination elle-même, la réponse à la pandémie a montré la capacité de mobilisation de l’appareil d’État. Hier, en ouvrant la journée d’auditions de l’Office parlementaire d’évaluation des choix scientifiques et technologiques, j’ai eu l’occasion de féliciter toutes celles et tous ceux qui ont été mobilisés dès le début de l’alerte. Je veux y revenir aujourd’hui et remercier encore celles et ceux qui ont été présents, sur le terrain, dans les centres, tout au long des dix semaines de la campagne de vaccination. Ma gratitude va aux professionnels de santé : étudiants, internes, médecins, infirmières. Elle s’adresse également aux personnels administratifs, au premier rang desquels les chefs de centre. Je n’oublie pas non plus les bénévoles, tout particulièrement ceux de Croix Rouge, qui sont venus améliorer les conditions d’accueil.
Aujourd’hui, je me réjouis de ne pas avoir eu à affronter une grippe d’une virulence extrême et je veux rappeler qu’il y a eu, dans de nombreux domaines, une gestion adaptée. Pour la première fois, face à une menace sanitaire majeure, nous nous sommes donnés les moyens de la prévention.
Cependant, nous avons été confrontés à deux paradoxes. En premier lieu, l’ensemble des acteurs – et les parlementaires ne sont pas les derniers – s’accorde pour dire qu’il faut privilégier les politiques de prévention plutôt que celles de soin. C’est ce que j’ai fait face au virus A(H1N1). Pourtant, l’acceptabilité n’a pas été au rendez-vous. En second lieu, alors que nos concitoyens appréhendent une approche strictement comptable de la santé et une limitation de l’accès aux soins, nous avons vu une vaccination universelle et gratuite faire l’objet, contre toute attente, de critiques, voire de suspicion…
Comme vous le savez, le coût de cette pandémie – environ 500 millions d’euros – a été bien moindre que celui que nous avions anticipé en juillet 2009, ce qui montre que nous avons su adapter nos mesures. Je ne sous-estime pas ce coût, surtout en ces temps de difficultés économiques, mais que représente-t-il par rapport aux sommes importantes consacrées chaque année aux soins et que vous serez bientôt amenés à examiner dans le cadre du prochain projet de loi de financement de la sécurité sociale ?
La menace pandémique exigeait, selon moi, de permettre un accès universel à la prévention. J’ai défendu, auprès du Gouvernement, le principe d’un vaccin gratuit pour tous, et je suis fière d’avoir porté ce principe éthique.
Nos acquisitions de vaccins ont par ailleurs permis au Président de la République de faire jouer à fond la solidarité avec des pays moins favorisés. Nous avons ainsi mis à la disposition de l’Organisation mondiale de la santé 11 millions de doses au total et je me félicite de cette solidarité.
Pour autant, je le dis avec simplicité, restent ce que j’appelle des points noirs, que vous avez pu identifier tout au long de vos auditions et sur lesquels nous avons encore beaucoup à travailler.
Ces points noirs ont cristallisé les réactions et les passions, au risque, parfois, de masquer tout le reste. Ils sont cependant réels et recouvrent des difficultés qui vont bien au-delà de la pandémie pour interroger toute notre organisation de santé publique. Au fond, la pandémie a été le révélateur d’un certain nombre d’insuffisances de notre système de santé et peut-être de notre système administratif.
Ces points noirs me préoccupent.
Le premier est le fait que l’expertise soit mise à mal, critiquée, décrédibilisée. Je le redis avec force : cette expertise est irremplaçable et je crains aujourd’hui qu’elle ne nous fasse défaut demain. Nous devons trouver les moyens de réconcilier expertise et opinion publique ! Nous n’avons nul besoin de boucs émissaires. Il est de notre responsabilité de gouvernants et d’élus de préparer l’avenir. L’expertise restera indispensable à la décision. Elle doit être du plus haut niveau possible. Je continuerai d’y veiller.
Le deuxième point noir tient aux difficultés rencontrées dans l’organisation d’une vaccination de grande ampleur.
Aujourd’hui, quel est le constat ? Les centres de vaccination n’ont pas atteint leur objectif : ils ont permis, au meilleur de leur fonctionnement, de vacciner 250 000 à 300 000 personnes par jour, alors que nous attendions le double.
La médecine de ville et les établissements de santé, pour lesquels le soin reste la priorité, n’auraient pas suffi non plus. Il n’y a donc pas de solution unique, pas de solution miracle. Il y a sans doute un réseau d’acteurs à mobiliser et peut-être des pistes nouvelles à explorer.
Troisième point noir : la communication avec la médecine de proximité s’est heurtée à de nombreuses difficultés, malgré des efforts non négligeables, l’exploration de multiples pistes et un investissement personnel de ma part. Il me semble que cette communication a été vécue par les praticiens comme une intrusion et une atteinte à leur indépendance. Cette perception a été relayée et, sinon instrumentalisée, du moins amplifiée par des organisations syndicales, dans le contexte électoral que vous connaissez.
Comme dans d’autres domaines, je constate une forme d’antagonisme entre l’individualité de la médecine libérale et la compétence régalienne de l’État face à une menace sanitaire, entre une démarche individuelle et une démarche populationnelle. Je serai très intéressée de pouvoir débattre de ce sujet avec vous tout à l’heure, ou de lire plus tard les préconisations de votre rapport à cet égard. Il y a là un élément clé pour l’avenir, et pas seulement dans le contexte de l’alerte sanitaire. Le problème de la diffusion de l’actualisation des connaissances scientifiques, lorsque celles-ci évoluent en quelques semaines comme cela a été le cas lors de cette pandémie, nous est posé.
Le quatrième point noir, peut-être le plus grave, se rapporte au principe même de la vaccination.
Comme l’indiquent les sondages, nos concitoyens ont d’abord massivement voulu se faire vacciner, puis ne l’ont plus voulu. Pourquoi ? D’après les sondages, ils ont pris peur, car beaucoup de choses – trop sans doute – ont été dites, par tous et n’importe qui, sur les adjuvants, sur le thiomersal ou sur la rapidité de leur préparation. On a même parlé d’« expérimentation en grandeur nature » ! Puis-je parler à mon tour de sabotage ? Il suffit de regarder aujourd’hui nos résultats de pharmacovigilance pour appréhender le degré de la désinformation qui a été conduite. Les responsables en sont remarquablement divers : occultes et dissimulés derrière la « toile » d’internet, ou bien notables en quête d’une éphémère célébrité médiatique.
Nos politiques de prévention doivent, pour l’avenir, se doter de la solidité nécessaire pour leur résister.
Nous devons apprendre pour demain, car demain – n’en doutons pas – une autre menace émergera et sans doute plus vite que nous ne le souhaitons. La mondialisation rend inévitable la multiplication des alertes sanitaires ou des alertes à conséquence sanitaire. Cela ne sera peut-être pas la grippe, peut-être même pas une pandémie. Cela pourra être un accident industriel ou une catastrophe environnementale, un risque nucléaire ou chimique. Nous vivons dans un monde d’incertitude.
La préparation à la menace de demain, j’en porte la responsabilité avec le Gouvernement et je l’assume devant l’ensemble des institutions qui, aujourd’hui, se penchent sur la question : votre commission d’enquête, celle du Sénat, la mission de la Cour des comptes, etc. Demain, nous devrons encore solliciter les experts, mobiliser les médecins généralistes, proposer à nos concitoyens des moyens de protection et engager des fonds dans des actions de prévention face à une menace nouvelle et par définition incertaine. Dans tous ces domaines, nous devons travailler et, pour ce faire, il nous faut d’abord rétablir la confiance. Je souhaite que nos échanges y contribuent.
Je vous remercie de votre attention et suis prête à répondre à vos questions.
M. Jean-Pierre Door, rapporteur. Madame la ministre, selon vous, la première victime du virus est le plan lui-même. L’appareil d’État s’est mobilisé, dites-vous. L’articulation entre l’action du ministère de la santé et des sports et celle du ministère de l’intérieur, de l’outre-mer et des collectivités territoriales a-t-elle été satisfaisante, en particulier pour la campagne de vaccination sur le terrain ? La cellule interministérielle de crise a-t-elle été réellement opérationnelle ; sinon, faut-il la renforcer ?
La communication de l’État doit-elle être améliorée ?
À l’avenir, comment comptez-vous mobiliser les professionnels de santé si une nouvelle campagne de vaccination devait être menée ? Comptez-vous donner un rôle important aux agences régionales de santé ?
Mme la ministre. Par définition, la gestion d’une pandémie ne peut s’effectuer qu’au niveau interministériel. L’évaluation proprement sanitaire et la mobilisation des professionnels de santé relèvent de la responsabilité du ministre chargé de la santé, mais, face à une pandémie, celle de nombreux autres ministres entre en jeu : la responsabilité du ministre de l’éducation nationale pour éventuellement fermer des écoles touchées par un foyer pandémique ; celle du ministre chargé des transports en cas de limitation au droit de circulation, notamment – nous l’avons vu au début de la pandémie – dans les aéroports ; celle du ministre chargé des affaires étrangères pour les Français de l’étranger ou pour les déplacements de nos compatriotes à l’étranger. Et la liste n’est sans doute pas exhaustive.
Quant au ministre de l’intérieur, il faut rappeler avec force qu’il est celui de l’interministérialité, ce que nos compatriotes semblent avoir découvert avec stupéfaction : pour eux, il est avant tout le ministre de la sécurité et bien peu apparemment savent que les préfets sont placés sous son autorité. Face à une crise pandémique, qui réclame une gestion interministérielle, il est donc « à la manœuvre », bien évidemment avec l’appui constant du ministre chargé de la santé.
Nous avions réfléchi à cette gestion interministérielle dans le cadre du plan de prévention et de lutte contre la pandémie grippale. Le Premier ministre a dirigé l’action gouvernementale ; la plupart des grands arbitrages ont été rendus à son niveau lors de réunions spécifiques rassemblant l’ensemble des ministres concernés ; certains de ces arbitrages ont été confirmés par le Président de la République qui s’est, personnellement et de façon continue, tenu informé sur ce sujet. Si la gestion au quotidien a été confiée au ministère de l’intérieur dès le 30 avril, vingt-deux réunions interministérielles ont été présidées par le Premier ministre lui-même ou par un membre de son cabinet : quotidiennes au début de la crise, elles se sont tenues ensuite en fonction des arbitrages sollicités, et le ministère de l’intérieur et le ministère de la santé en ont été les principaux contributeurs.
Ainsi, les changements de phase successifs – phase 4 le 28 avril et phase 5 le 30 avril –, le transfert du pilotage au ministère de l’intérieur et la création de la cellule interministérielle de crise le 30 avril, l’objectif d’une commande de 94 millions de doses, la gratuité de la vaccination et son caractère non obligatoire le 3 juillet, puis l’ordre de priorité des populations à vacciner le 24 septembre 2009, tout cela a été arbitré au niveau du Premier ministre lors de réunions qu’il présidait, hormis le passage en phase 4 pour lequel il n’y a pas eu de réunion. Évidemment, j’ai assisté personnellement à ces réunions et soumis des propositions.
Le Président de la République a, pour sa part, présidé cinq réunions – permettant de l’informer des mesures prises – les 29 avril, 13 juillet, 1er septembre, 10 novembre et 30 novembre 2009. Ces réunions ont permis de conforter les arbitrages rendus.
Le ministère de l’intérieur a assuré la conduite opérationnelle de la réponse à la pandémie. L’ensemble des ministères, au niveau du ministre ou du directeur de cabinet, a apporté son concours à la cellule interministérielle de crise qui s’est réunie quarante-trois fois au total à partir de l’émergence de l’alerte en avril. Des représentants de la Présidence de la République et du cabinet du Premier ministre participaient également aux travaux de cette cellule.
En marge de cette dernière, plusieurs groupes de travail thématiques se sont réunis en vue d’organiser la communication. Le service d’information et de communication piloté par le délégué à l’information et à la communication du ministère de l’intérieur a tenu trente réunions en vue de coordonner la communication des différents ministères, de produire des éléments compréhensibles par le grand public et des outils communs destinés à être relayés auprès du public par des sites internet et une plateforme téléphonique. Un groupe de travail réunissant les hauts fonctionnaires de défense des différents ministères a veillé à la finalisation des plans de continuité d’activité. Sous la direction du Secrétariat général de la défense et de la sécurité nationale, les hauts fonctionnaires de défense ont mené une réflexion sur les personnes à vacciner prioritairement compte tenu de leur rôle critique en période de pandémie – du fait de la virulence modérée du virus, nous n’avons pas utilisé ce concept qui pourrait toutefois l’être dans d’autres circonstances.
Faut-il renforcer la cellule interministérielle de crise ? Il conviendrait sans doute de faire plus de place à la communication en amont des décisions et de tenir compte plus finement de l’état de l’opinion. C’est une préconisation à laquelle on peut donc réfléchir pour en définir les modalités.
M. le rapporteur. Comment, pour l’avenir, envisageriez-vous d’assouplir le mode de pilotage et de mieux associer les professionnels de santé à la campagne ?
Mme la ministre. Pour répondre à votre question, il faut bien comprendre comment nous avons organisé la campagne de vaccination et ce qui a motivé nos choix. Mais je le répète : aucune autre pandémie ne sera comparable à celle-là et il ne faut pas rechercher un modèle idéal de gestion de la pandémie car il n’en existe pas.
Deux impératifs de santé publique majeurs nous ont déterminés à opter pour une organisation collective de la vaccination.
Le premier était de protéger le plus grand nombre de personnes dans les meilleurs délais. Il fallait donc mettre en place un dispositif autorisant une vaccination à grande échelle, susceptible de concerner toute la population dans un délai restreint et compatible avec le rythme de livraison attendu des vaccins.
Le deuxième impératif était de conserver la capacité du système de soins, puisque, et cela a été vérifié, le pic de la vaccination devait se produire au moment où il y aurait le plus de cas de grippe. En outre, le dispositif se devait de préserver la capacité du système de soins de premier recours à traiter d’autres pathologies, sachant que l’épidémie de grippe allait survenir dans un état d’extrême tension de ce système.
Nous étions en outre confrontés à des contraintes matérielles.
La première était celle de la traçabilité, pour des exigences de pharmacovigilance qui s’imposaient d’autant plus que nous étions dans le cadre d’un schéma de vaccination à deux doses. Rappelez-vous : la modification des autorisations de mise sur le marché n’est intervenue que fin novembre, alors que la campagne avait déjà démarré.
La deuxième contrainte tenait à la présentation en multidoses : la majeure partie des vaccins nous était livrée en boîtes de 500 doses – des boîtes de 50 flacons de 10 doses non déconditionnables.
La troisième découlait du calendrier prévisionnel de livraison : nous avons toujours été en flux tendu. Les caricatures me représentant, à l’époque, assise sur des caisses de vaccins en quantité ne reflétaient pas la réalité !
La quatrième contrainte était liée à la coexistence de quatre vaccins différents, qui tous avaient des indications différentes.
La cinquième était d’ordre logistique – il nous fallait notamment respecter la chaîne du froid.
Enfin, le coût de la campagne se devait d’être maîtrisé.
L’ensemble de ces éléments a conduit très tôt à concevoir un dispositif de vaccination adapté, articulé autour de centres de vaccination collectifs. Et aucune des contraintes apparues progressivement – présentation en multidoses, avis du Haut conseil de la santé publique recommandant l’utilisation de certains types de vaccins pour certaines indications, livraisons toujours plus faibles que prévues – n’est venue remettre en cause ce choix. Elles l’ont, au contraire, conforté.
Pour ce qui est des professionnels de santé, en dépit de toute l’énergie que nous y avons consacrée tout au long de la campagne, la communication a donné des résultats mitigés. C’est qu’il n’existe pas, dans notre système de santé, un moyen rapide et facile de toucher de façon exhaustive les médecins généralistes et les spécialistes de ville.
Pour y remédier, nous avons utilisé l’ensemble des outils à notre disposition.
La communication sur internet a été assurée, d’abord, grâce à des outils préexistants comme DGS-Urgent, service gratuit d’alerte de la direction générale de la santé qui compte aujourd’hui plus de 60 000 abonnés, mais aussi à des outils que nous avons créés, comme la rubrique grippe du site internet du ministère de la santé, ouverte le 22 juillet 2009, régulièrement actualisée et qui a enregistré 1 030 588 consultations.
Le relais dépendait de la presse spécialisée, ensuite, avec Le Quotidien du médecin, Impact pharmacien, etc., auxquels j’ai accordé régulièrement des entretiens.
Autre outil : les relais d’opinion, en l’occurrence les syndicats, les unions régionales des professionnels de santé, les relais de proximité avec les comités départementaux d’aide médicale urgente, de la permanence des soins et des transports sanitaires, etc. Nous avons tenu onze réunions avec les représentants des médecins, neuf avec les représentants des infirmiers, six avec ceux des pharmaciens d’officine, et au moins deux réunions de comités départementaux d’aide médicale urgente, de la permanence des soins et des transports sanitaires ont été tenues dans chaque département. Nous avons donc mené des réunions d’information au niveau central aussi bien que des réunions décentralisées.
Enfin, nous avons eu recours à la communication écrite : j’ai envoyé trois lettres aux médecins, une aux infirmières et deux aux étudiants et internes.
Je me suis parfois demandé si les médecins étaient abonnés à internet ou aux organes de presse, s’ils jetaient le courrier qu’ils recevaient et lisaient la presse généraliste !
Lors des réunions, j’ai demandé aux professionnels de santé de m’indiquer tout autre moyen qui pourrait leur être utile, afin que je le mette en place. Ils ont été incapables de me répondre. Inutile de vous dire que si vous me recommandiez un moyen auquel je n’aurais pas songé, je m’en emparerais immédiatement !
M. le président Jean-Christophe Lagarde. Comme les médecins ont déjà un certain nombre d’obligations – s’inscrire auprès de l’Ordre, par exemple –, je suggère, et cela n’a pas paru déplacé au directeur général de la santé lorsque nous l’avons auditionné la semaine dernière, l’obligation pour eux d’avoir un contact par internet avec l’administration. Cela pourrait concerner également les infirmières. Ce moyen peu coûteux remédierait à beaucoup de difficultés – même si, selon moi, les difficultés pour communiquer avec eux n’étaient pas seulement liées à un problème de moyens, mais peut-être aussi à un état d’esprit.
Mme la ministre. Je préfère que cette obligation de communiquer leur adresse électronique au ministère de la santé soit faite aux médecins par la Représentation nationale plutôt que par le ministère de la santé. Nous verrons comment leurs organisations représentatives réagiront : vous allez, je pense, connaître certaines déconvenues…
Il n’y a évidemment aucun doute quant à la capacité des médecins et des infirmiers à vacciner – ce serait absurde, s’agissant d’un acte auquel un infirmier est apte dès sa première année d’études. Mieux associer les professionnels de santé à la gestion d’une pandémie est avant tout une question d’organisation. J’ai donc convié les organisations de médecins généralistes à réfléchir à la façon dont on peut, dans un système libéral, passer d’une démarche individuelle à une démarche populationnelle. Cette organisation ne peut pas être mise en place quand la pandémie est déjà là : il conviendrait d’y réfléchir maintenant pour disposer d’un système « dormant » pendant plusieurs années, qui serait réactualisé et mis en œuvre lorsque la pandémie survient. Des cabinets ou des réseaux de santé pourraient-ils y être dédiés, par exemple ?
Cette demande d’organisation, qui aurait été totalement irrecevable auparavant, est peut-être devenue acceptable pour les professionnels de santé – la pandémie a eu au moins cet avantage. Souvenez-vous : leurs discours étaient très différents, et la moitié des médecins libéraux, par exemple, ne voulaient pas vacciner. Comment, dans ces conditions, organiser la campagne ? Comment faire en sorte que les cabinets, déjà surchargés en période de pandémie, assurent en outre la vaccination ?
J’ai donc demandé aux organisations professionnelles de réfléchir à l’implication et à la participation de la médecine de proximité à des gestions d’alerte sanitaire. Beaucoup de questions restent à résoudre.
M. Yves Bur. Qui pourrait promouvoir une telle approche populationnelle ? L’État, l’Ordre national des médecins, les syndicats ?
Mme la ministre. La médecine ambulatoire de proximité et libérale travaille dans le cadre du colloque singulier. Gérer une crise sanitaire relève des missions régaliennes de l’État, dont l’appareil est en cours de territorialisation. Ainsi, demain, ce sont les agences régionales de santé qui seront à la manœuvre. Elles auront face à elles des organisations représentatives et le Conseil national de l’ordre des médecins – mais ce n’est ni à celles-là ni à celui-ci d’organiser la réponse à une alerte sanitaire.
M. le rapporteur. Les unions régionales des professionnels de santé ont pour mission de faire de la prévention…
Mme la ministre. Ce sont des partenaires, mais face à une alerte sanitaire, le rôle de l’État est majeur. J’ai voulu remédier aux défaillances de notre organisation sanitaire bien avant d’avoir à gérer la pandémie qui, comme je l’ai dit, a été le révélateur de la parcellisation manifeste de notre administration d’État. Au sein des agences régionales de santé, j’ai regroupé pas moins de dix services de l’État et de l’assurance maladie – dont on connaît le rôle important dans l’appel des publics prioritaires et dans la gestion des bons de vaccination. Tout au long de cette pandémie, je me suis dit que les choses nous auraient été tellement plus faciles avec les agences régionales de santé !
M. Gérard Bapt. Madame la ministre, il est bien naturel que vous assumiez, avec le Gouvernement, la responsabilité de la réponse sanitaire opposée à la pandémie. Mais vous n’avez pas dit que vous agiriez de même à l’avenir, dans une situation équivalente. J’aimerais en particulier connaître l’attitude que vous adopteriez vis-à-vis de l’Organisation mondiale de la santé.
Par ailleurs, vous avez indiqué qu’on avait su très tard que les personnes de plus de soixante-cinq ans bénéficiaient d’une certaine immunité. Or on l’a su presque dès le début.
Mme la ministre. Tout de même pas ! Il a fallu le vérifier. Et si on l’a su assez vite, on ne l’a pas su tout de suite. Je n’ai pas dit « très tard ». Ne transformez pas mes propos !
M. Gérard Bapt. Je remarque aussi que vous avez repris le propos selon lequel le virus était extrêmement capricieux. Mais comme le professeur Antoine Flahault l’a dit, et l’a répété hier devant l’Office parlementaire d’évaluation des choix scientifiques et technologiques, une pandémie n’est terminée que quand le virus mute. Cela signifie qu’en mutant, le virus en cause, agent de la pandémie, ne laisse pas à un nouveau virus la place de se développer. Arrêtons de dire que l’on ne sait jamais ce que le virus peut devenir. Ce sont là des éléments sur lesquels il faudrait s’entendre car il en va de la conduite de la stratégie vaccinale.
Avant qu’elle ne tienne son assemblée générale, je vous avais écrit pour vous suggérer de prendre une certaine distance vis-à-vis de l’Organisation mondiale de la santé, qu’il s’agisse de sa façon de gérer la crise ou, plus généralement, de son fonctionnement. Un « grand journal du soir » a d’ailleurs noté que cette organisation avait été la première victime du virus ! Et, après enquête, l’une des plus prestigieuses revues de santé publique, le British medical journal, a fourni des indications précises sur la façon très contestable dont est gérée cette organisation, qu’il s’agisse de vaccins ou de conflits d’intérêts. Cet article a été conforté, à peu près à la même date, par un rapport du Conseil de l’Europe.
Au-delà du soutien d’ordre général que vous avez exprimé à Mme Margaret Chan lors de l’assemblée générale de l’Organisation mondiale de la santé, ne pensez-vous pas que la France et, plus largement, l’Europe devraient prendre des initiatives pour que cette organisation s’efforce à plus de transparence et prenne de la distance avec les organismes qui soutiennent les stratégies des laboratoires ? Je pense à l’association IMPACT, mise en cause par le Brésil et l’Inde, ou à l’association du professeur Albert Osterhaus, financée exclusivement par les laboratoires. Ces organismes nourrissent la « pensée unique » des virologistes qui, par la suite, vous conseillent.
Mme la ministre. Je suis très heureuse que vous citiez le professeur Antoine Flahault, qui nous avait promis 30 000 morts !
M. Gérard Bapt. Il a reconnu s’être trompé.
Mme la ministre. Je préfère m’appuyer sur des décisions collégiales et argumentées et je n’ai pas pour habitude de choisir, parmi les analyses des experts, celles qui m’arrangent.
Je me suis appuyée en premier lieu sur l’expertise des agences sanitaires issues de la loi du 1er juillet 1998. Le sénateur Claude Huriet avait posé pour principe que ces institutions de contrôle devaient être fonctionnellement indépendantes et disposer d’une légitimité scientifique. De fait, en leur sein, les fonctions de gestion sont séparées des fonctions d’évaluation, exercées indépendamment de la tutelle économique, et le rôle des experts a été clarifié de façon à limiter les conflits d’intérêts ; par exemple, au sein de l’Institut de veille sanitaire, personne n’a un lien, occulte ou avéré, avec les entreprises pharmaceutiques.
Le mode de fonctionnement des agences a été conçu pour assurer la qualité et préserver l’indépendance de l’expertise. Entièrement tournée vers un objectif de santé publique, celle-ci doit satisfaire aux exigences de compétence et de transparence.
Lors d’une pandémie, l’évaluation scientifique porte forcément sur des champs très divers, ce qui implique pluridisciplinarité et collégialité. J’ai donc toujours veillé à mobiliser une expertise pluridisciplinaire et transversale, et je n’ai pas de « gourou » derrière mon épaule. Je me suis toujours refusée à écouter un seul et unique conseiller ! L’expertise à laquelle j’ai eu recours a toujours été collégiale et à même d’affronter un débat contradictoire. Même sur des thèmes plus restreints mais de façon informelle, je me suis appuyée sur des collèges d’experts et de scientifiques : spécialistes de neurologie – pour le syndrome de Guillain-Barré –, pédiatres, réanimateurs, infectiologues, etc.
L’expertise ne doit pas être non plus exclusivement scientifique. Une pandémie a toujours des implications sociales, sociétales et éthiques. À cet égard, nous étions préparés : le Comité consultatif national d’éthique, dans son avis n° 106, avait déjà traité des grandes questions qui peuvent se poser en cas de pandémie – en particulier celle de la conciliation de l’équité et de la priorité pour l’accès aux moyens de prévention.
Enfin, l’expertise nationale s’est appuyée sur l’expertise internationale : au niveau européen, sur celle du Centre européen de prévention et de contrôle des maladies, qui a participé à l’analyse de la situation épidémiologique et de ses évolutions possibles, et sur celle de l’Agence européenne du médicament, qui rassemble l’expertise des États membres sur les produits de santé ; au niveau mondial, sur celle de l’Organisation mondiale de la santé.
On ne peut imaginer une sorte de complot mondial, où des milliers d’experts auraient été payés par les laboratoires pharmaceutiques …
Cela étant, en matière d’expertise, des progrès sont certes à faire…
M. le président Jean-Christophe Lagarde. Tous les laboratoires directement concernés et un certain nombre d’experts nous ont déclaré qu’ils souhaitaient que nous inscrivions dans la loi l’obligation de publier les liens d’intérêts existants. Cela ne pose de problème à personne, mais tout le monde souhaite que ce soit le législateur qui intervienne, plutôt que de le faire volontairement !
Mme la ministre. J’avais chargé Mme Marie-Dominique Furet, une scientifique de la direction générale de la santé, d’étudier cette question. L’une de ses propositions principales, qui portait sur l’adoption d’un code de déontologie de l’expertise, a été reprise. À partir de juin 2009, un groupe de travail, constitué au sein du comité d’animation du système d’agences et piloté par la Haute Autorité de santé, a mené une réflexion sur la gestion et la prévention des conflits d’intérêts de l’expertise en santé publique. Il en est sorti une charte déontologique, destinée à sécuriser le processus d’expertise interne et externe et à garantir la qualité de l’expertise institutionnelle. De son côté, Mme Valérie Pécresse, ministre de l’enseignement supérieur et de la recherche, a souhaité que les organismes de recherche adoptent une charte nationale de l’expertise scientifique et technique.
La question de l’indépendance de l’expertise se pose dans tous les pays comparables au nôtre : ainsi les États-Unis se sont dotés de Sunshine Acts et vos homologues du Congrès ont adopté en mars dernier un texte prévoyant un certain nombre de déclarations, devant entrer en vigueur en 2013.
En France, le service des relations entre médecins et industrie du Conseil national de l’ordre des médecins analyse depuis 2007 les conventions passées entre les médecins et les laboratoires pharmaceutiques. La loi portant réforme de l’hôpital et relative aux patients, à la santé et aux territoires du 21 juillet dernier est enfin venue compléter les dispositifs existant en la matière. Les dispositions de l’article L. 4113-9 du code de la santé publique ont notamment été modifiées pour permettre à l’Ordre national des médecins d’enclencher des poursuites judiciaires à l’encontre des praticiens qui ne respecteraient pas les règles d’indépendance.
Aujourd’hui, je veux pousser encore la réflexion et, bien entendu, les préconisations que vous ferez sur ce sujet seront les bienvenues. J’ai demandé à mes services de travailler sur une déclaration qui émanerait non pas des médecins et des professionnels de santé, mais des industriels eux-mêmes, et de réfléchir aux modalités de publication des liens entre industriels et médecins.
Je le dis clairement : il n’y a pas eu de dictature des experts. De toutes façons, tous leurs avis ont été analysés et évalués par la direction générale de la santé de manière tout à fait indépendante. C’est sur la base de cette évaluation que j’ai proposé des décisions au reste du Gouvernement.
Pour ce qui est de l’Organisation mondiale de la santé, l’article 37 de sa constitution pose pour principe général la désignation d’experts choisis pour leurs compétences techniques individuelles, et non leur nomination par les États membres. Il existe deux structures.
La première est le groupe consultatif stratégique d’experts sur la vaccination, ou Strategic advisory group of experts on immunization, qui a pour mission de conseiller l’organisation en matière de politique vaccinale. Il est composé de quinze membres désignés pour trois ans et se réunit deux fois par an. Il est appuyé par cinq sous-groupes, dédiés aux souches suivantes : coqueluche, grippe A(H1N1), grippe A(H5N1), poliomyélite et rougeole. L’organisation peut inviter informellement d’autres experts : le professeur Daniel Camus de la direction générale de la santé a été associé à certaines sessions, de même que le professeur Christian Perronne, président du comité technique des vaccinations, lors de la réunion de juillet 2009 consacrée au virus A(H1N1).
La seconde est le comité d’urgence sur la grippe, qui a été instauré dans le cadre du règlement sanitaire international. Il se prononce sur la question de savoir si un événement constitue une urgence de santé publique de portée internationale et sur la proposition d’émettre, de modifier, de proroger ou d’annuler des recommandations importantes. Ce comité a été réuni à plusieurs reprises par le directeur général de l’organisation, la première fois le 25 avril 2009. Conformément au règlement sanitaire international, il revient au même directeur général de fixer la composition de ce comité non permanent ; celle-ci n’a pas été rendue publique par l’Organisation mondiale de la santé, qui souhaite protéger ses experts des influences extérieures. Les pressions ne viennent d’ailleurs pas uniquement de l’industrie pharmaceutique. Elles émanent surtout de certains États membres – par exemple, les États-Unis ou le Royaume-Uni, qui étaient parmi les plus touchés, n’auraient pas été favorables au passage en phase 6 en raison des répercussions économiques ou sociales non négligeables qu’il aurait entraînées. Les membres de ce comité à géométrie variable sont choisis dans un vivier d’experts. C’est ainsi que Mme Margaret Chan s’est adressée à huit nouveaux membres – qui représentaient l’Australie, le Canada, le Chili, le Japon, le Mexique, l’Espagne, le Royaume-Uni et les États-Unis – pour étudier le passage en phase pandémique. Le président de ce comité d’urgence est M. John Mackenzie.
La modification de la qualification de pandémie a donné lieu, au sein de l’Organisation mondiale de la santé, à un débat d’experts – et je crois savoir que MM. Marc Gentilini et François Bricaire se sont affrontés sur ce thème devant votre commission. Cette qualification doit-elle prendre en compte une notion de gravité ? L’organisation s’est appuyée sur une notion d’extension géographique et, contrairement à ce qui a été dit ici ou là, ce changement n’est pas allé dans le sens d’une édulcoration, mais bien d’un durcissement des critères. Il est même certain que le passage au niveau 6, dans l’ancien système, se serait produit plus vite qu’il ne s’est produit avec la nouvelle définition des phases, laquelle ressort d’un processus lancé en 2007, soit bien avant que la pandémie de grippe A(H1N1) ne commence.
M. le président Jean-Christophe Lagarde. Madame la ministre, pourriez-vous être plus précise ?
Mme la ministre. Je vous communiquerai le tableau comparatif entre l’ancienne et la nouvelle définition, qui date de 2009.
M. le rapporteur. Qui a procédé à ce changement ?
Mme la ministre. Il est le fait d’experts.
La définition de la pandémie n’a pas changé, les trois critères étant : la globalité de l’épidémie, l’émergence d’un nouveau virus et la naïveté immunitaire de la population. Mais dans le cadre de la révision de son plan de prévention et de lutte contre la pandémie grippale, l’Organisation mondiale de la santé avait engagé un travail de modification de la définition des différentes phases d’une pandémie – la structure en six phases étant conservée pour pouvoir s’appuyer sur des critères objectifs.
Cette révision avait été entamée dès novembre 2007. Elle n’est donc pas liée à la survenue de la pandémie de grippe A(H1N1). La nouvelle version – la précédente datait de 2005 – a fait l’objet d’une consultation publique d’octobre à novembre 2008, pour aboutir, en janvier 2009 – là encore, bien avant la pandémie – à une version définitive qui a été validée avant d’être publiée officiellement en mai 2009. La concomitance entre cette publication et la survenue de l’épidémie, relevée par certains, n’a donc rien de suspect, elle s’explique par le temps nécessaire pour publier ce travail. Actuellement, une nouvelle révision est en cours et la prochaine version est attendue pour 2014.
Ce qui a été fait, c’est un travail d’objectivation des critères de définition des différentes phases. La nouvelle classification est plus restrictive et plus précise. Le plan de prévention et de lutte contre la pandémie grippale de 2005 définissait les phases d’alerte en fonction de la transmission du virus sans considération d’extension géographique. Par exemple, la phase 5 était définie par l’existence de foyers importants mais localisés, ce qui pouvait permettre des interprétations très variées. Dans la nouvelle version, elle l’est par l’existence d’une transmission interhumaine dans au moins deux pays d’une région telle que définie par l’organisation. Il s’agit là d’une information beaucoup plus objective, qui témoigne de l’imminence de l’extension d’une maladie.
Contrairement à ce qui a été dit, ni la sévérité de la pandémie ni le nombre de décès n’ont jamais été pris en compte pour définir les phases d’alerte, que ce soit en 2005 ou en 2009. Il y a eu évolution, non de la définition de la pandémie, mais des critères de définition des phases du plan. La publication de la version révisée a sans doute été accélérée par l’émergence du virus, mais le travail était engagé depuis très longtemps.
On n’a donc pas fait disparaître le critère de sévérité de la maladie de la définition. Au contraire, à la demande de certains États parties, dont la France, l’Organisation mondiale de la santé a assorti sa déclaration de pandémie d’une appréciation de la sévérité de la pathologie causée par le virus A(H1N1), ce qui n’était pas prévu par le règlement et elle a, en l’espèce, qualifié la pandémie de « modérée ».
M. le rapporteur. À quelle date ?
Mme la ministre. Le 11 juin 2009.
M. le président Jean-Christophe Lagarde. Dès la fin du mois de mai, on savait que la létalité du virus était relativement modérée. Comment expliquez-vous que, malgré tout, les articles de presse, les communications et les débats se soient multipliés de façon incontrôlable pendant tout l’été ?
Cette question n’est pas sans rapport avec la difficulté de communiquer avec la médecine de proximité, vers laquelle les patients se tournent naturellement pour comprendre ce qui se passe. Vous avez soulevé ce point tout à l’heure mais les discussions en cours alors sur la nouvelle organisation sanitaire de notre pays, y compris sur les conditions économiques de l’exercice médical, n’y étaient sans doute pas pour rien. À cela s’ajoutait l’approche des élections, avez-vous dit…
Mme la ministre. Des élections internes à la profession, pas des élections régionales.
M. le président Jean-Christophe Lagarde. Le fait que la ministre chargée de la santé se charge personnellement de la communication à l’adresse du public ne risquait-il pas de politiser le débat et de porter atteinte à la légitimité des considérations très scientifiques que vous aviez mises en avant, à savoir que la pandémie était modérée et qu’il ne fallait pas paniquer ?
Mme la ministre. C’est ce que je n’ai pas arrêté de répéter.
M. le président Jean-Christophe Lagarde. Sauf que ce message a été en permanence contrebattu, soit pour des raisons politiques, soit pour les besoins de la presse : tout l’été, nous avons entendu dire que la situation était dramatique et le virus ravageur. Et le lancement d’une campagne générale de vaccination gratuite a renforcé le sentiment de l’imminence d’un problème sanitaire majeur.
Mme la ministre. Vous vous demandez donc si le ministre de la santé n’aurait pas dû laisser cette communication au directeur général de la santé ?
M. le président Jean-Christophe Lagarde. Ou à quelqu’un que l’on considère comme neutre.
Mme la ministre. Peut-on charger un haut fonctionnaire de la communication de décisions qui ne peuvent être prises qu’au niveau gouvernemental ? Ce serait un peu curieux que le ministre de la santé n’ait pas la responsabilité de justifier devant l’opinion publique des décisions qui sont avant tout politiques. En l’occurrence, la décision de proposer la vaccination à l’ensemble de la population était appuyée sur des éléments techniques et sur une expertise scientifique la plus large possible, mais aussi sur des considérations éthiques et politiques, au sens noble du terme. J’ai du mal à m’imaginer envoyer le professeur Didier Houssin en émissaire, pour échapper à mes responsabilités. Pour autant, lorsque j’ai communiqué, j’étais toujours accompagnée de M. Didier Houssin, de Mme Françoise Weber ou de M. Jean Marimbert…
M. Jean Mallot. De tous vos conseillers.
Mme la ministre. Non, ce ne sont pas mes conseillers, mais de hauts fonctionnaires placés à la tête des agences. Ils ont servi mes prédécesseurs socialistes, monsieur Jean Mallot. Et demain, si vous gagnez les élections, j’espère que vous aurez le bon goût de ne pas faire de chasse aux sorcières et de continuer à employer des personnes de cette qualité, dont je ne connais d’ailleurs même pas les options politiques.
M. le président Jean-Christophe Lagarde. Madame la ministre, nous n’allons pas faire de politique-fiction. Pourquoi ai-je évoqué la question ? Parce qu’au mois de juillet, lorsque vous avez annoncé un certain nombre de décisions, et peut-être parce que c’était le ministre de la santé qui les annonçait, on vous a reproché, notamment parmi l’opposition, de ne pas en faire assez. Cela dit, en auriez-vous fait davantage qu’on vous aurait accusée d’en faire trop, comme ce fut le cas par la suite... Je me demande donc si, lorsque surgit un problème de santé publique, il ne faut pas adopter une méthode de communication qui évite toute polémique.
Mme la ministre. Vous posez une vraie question. Puisqu’on parle de conflits d’intérêts, parlons des conflits d’intérêts politiques. En effet, la contestation d’un certain nombre de décisions a été le fait de personnes qui souhaitaient faire de cette affaire un débat d’abord politique. Il est tentant de « taper » sur un gouvernement avec lequel on n’est pas d’accord, mais quand j’ai entendu des responsables syndicaux soutenir que les vaccins étaient inefficaces, les bras m’en sont tombés : sur quels éléments d’expertise se fondaient-ils ? Un syndicat a même prétendu qu’on allait forcer les professionnels de santé à se faire vacciner, tout cela pour mettre à feu et à sang le milieu hospitalier !
Mme Catherine Génisson. La communication, manifestement, n’a pas été des plus satisfaisantes. Ne pensez-vous pas que les changements de cap gouvernementaux ont nourri les interrogations des professions de santé et de la population ? En juin, on a annoncé qu’à la moindre suspicion de grippe A(H1N1), il fallait envoyer le patient à l’hôpital, puis, du jour au lendemain, ces consignes ont été retirées.
La question de la participation de la communauté soignante ne se posait pas uniquement pour la vaccination, mais aussi pour l’information de la population. On a dit que les médecins généralistes n’étaient pas là pour vacciner. Certes, et comme vous l’avez souligné, la moitié d’entre eux ne le souhaitaient pas. Reste qu’ils sont tout de même les mieux placés pour diffuser un message sanitaire auprès de nos concitoyens.
Bien sûr, c’est au Gouvernement d’assumer ses responsabilités. Certaines décisions relèvent de son pouvoir régalien. Mais comment, dans le respect de la liberté d’expression et de la liberté de la presse, communiquer de façon suffisamment ferme sans donner lieu à tous les errements que l’on a constatés et qui ont nui à une bonne prise en charge de cette vaccination ?
Mme la ministre. D’abord, il n’y a pas eu de changements de cap, il y a eu des adaptations. Il est d’ailleurs tout à fait curieux qu’on nous reproche à la fois d’être restés prisonniers d’un plan de prévention et de lutte contre une pandémie de type A(H5N1), et d’avoir procédé à des changements.
Mme Catherine Génisson. Sans explications…
Mme la ministre. Heureusement que nous avons fait des changements ! Je vous remettrai le tableau des mesures d’adaptation que nous avons prises en continu pour tenir compte des éléments nouveaux qui venaient à notre connaissance.
Lors de la première phase de la pandémie, nous étions dans une stratégie de « contingentement » – d’observation et de limitation de la diffusion du virus. Ensuite, quand nous avons réuni les éléments nécessaires, nous avons décidé de nous adresser à la médecine de ville. Mais cette décision, qui date du 21 juillet, n’a été prise qu’après examen, et après avoir réuni et informé les professionnels de santé. Le passage à une prise en charge ambulatoire de la grippe a donc été préparé.
De la même façon, nous avions élaboré un dispositif de traçabilité absolument indispensable dans la mesure où l’on prévoyait une vaccination avec deux doses. Ensuite, les organisations sanitaires nous ont annoncé qu’une vaccination monodose suffirait. Vous imaginez bien que le passage de l’une à l’autre a exigé des adaptations.
De la même façon encore, l’affluence dans les centres a posé des problèmes d’organisation : on est passé de centres vides à des centres très fréquentés. Le problème a finalement été résolu en une semaine. Pourtant, il est difficile de modifier une organisation d’État qui n’est pas une organisation dédiée. Je n’allais pas installer des sortes de « forts Bastiani » dans lesquels des milliers de lieutenants Drogo auraient attendu indéfiniment la survenue d’une éventuelle pandémie ! J’ai dû puiser dans les forces vives et procéder, tout au long du mois de novembre, à des adaptations.
La fois prochaine, il faudra agir de la même façon et gérer la crise en fonction des évolutions parce que, par définition, la situation en cours de pandémie est peu stable. Dans notre pays, où l’on est très cartésien, on aimerait disposer d’une sorte de modèle idéal et immuable, avec une administration de la pandémie, une agence de la pandémie et des fonctionnaires de la pandémie. Mais ce n’est pas ainsi que cela se passe, et il nous faudra toujours gérer la crise en nous adaptant continûment.
Lors du pic du début du mois de décembre, jusqu’à 300 000 personnes venaient se faire vacciner et un million de consultations supplémentaires liées à la grippe A(H1N1) ont été constatées. Le phénomène allait-il perdurer ? Nous l’ignorions et ne pouvions donc prendre le risque, sur un pari optimiste, de démonter un dispositif complexe. Mais dès que l’affluence a cessé, j’ai décidé de faire fonctionner les centres de vaccination au ralenti pendant la période des fêtes, de telle sorte que les professionnels de santé mobilisés puissent profiter de celle-ci, tout en préservant la possibilité de réactiver le dispositif en cas de nouvel emballement.
Le professionnel de santé est certes l’informateur idéal de sa patientèle, Madame Catherine Génisson, mais une pandémie n’affecte pas que des personnes malades ou celles qu’il reçoit dans son cabinet, et le médecin généraliste ne peut pas informer l’ensemble de la population. Comment néanmoins mener des politiques de santé publique avec l’appui de la médecine générale, par exemple sous forme de réunions d’information dans les établissements scolaires ou sur les lieux de travail ? Il faudrait trouver des modes alternatifs de rémunération car la rémunération à l’acte est très mal adaptée dans ce cas. La loi devrait nous donner les outils nécessaires et je m’emploie à les définir.
J’ai entendu que les médecins n’étaient pas informés. Mais bien sûr que si ! Après presque dix ans d’études, ils savent quels conseils donner à leurs malades face à une grippe, sévère ou non. Ce sont sans doute les professionnels qui ont la formation la plus longue et la plus adaptée au métier qu’ils vont exercer.
Mme Catherine Génisson. Je remercie Mme la ministre de la façon dont elle a interprété ma question qui, bien évidemment, s’agissant des généralistes, ne visait pas leurs seules relations avec la patientèle mais, beaucoup plus largement, leur rôle de médecins de prévention. Ne pensez-vous pas, tout de même, que le conseil de l’ordre soit la structure ad hoc pour informer les médecins et un certain nombre de professions paramédicales ?
Par ailleurs, les mutuelles avaient été sollicitées pour contribuer à la prise en charge financière de la vaccination et de cette pandémie. Où en est-on, compte tenu du coût bien moindre de cette prise en charge ? Les mutuelles ont-elles versé les 300 millions d’euros prévus ? Seront-elles remboursées ? Il faut savoir qu’en raison de cette sollicitation et d’autres dont nous aurons à reparler dans le cadre du projet de loi de financement de la sécurité sociale, les mutuelles augmentent régulièrement leurs tarifs.
Mme la ministre. Quelle structure utiliser pour informer les médecins ? Le conseil de l’ordre ? Je l’ai toujours associé aux multiples réunions organisées au ministère – onze ont eu lieu avec les représentants des médecins, ce qui n’est pas rien –, mais je ne sais pas si c’est à lui de se charger de l’information technique et de la formation professionnelle des médecins. De la même façon, je ne reprocherai pas aux syndicats de ne pas avoir fait de formation sur le sujet, même si je les ai réunis et leur ai donné des informations. Beaucoup d’entre eux en ont fait, mais ce n’est pas leur mission.
Je souhaite réformer la formation continue des médecins et je souhaite qu’ils en définissent les grands axes, en partenariat avec nous. On pourrait sans doute passer par le développement professionnel continu pour aborder, notamment, la gestion des crises. Mais l’affaire n’est pas tranchée, et j’attends avec intérêt vos préconisations.
Enfin, les mutuelles n’ont pas été les seules sollicitées : tous les organismes complémentaires l’ont été, dans le cadre de la loi de financement de la sécurité sociale pour 2010, dont l’article 10 a institué une contribution exceptionnelle. L’assiette de celle-ci est égale à celle de la contribution destinée au financement de la couverture maladie universelle complémentaire et son taux avait été fixé à 0,94 %. Il avait été calibré sur la base d’un coût prévisionnel de 710 millions d’euros et pour assurer une participation similaire à ce qui aurait été acquitté si le ticket modérateur de 35 % avait été appliqué. Dans la loi de finances rectificative, ce taux a été ramené à 0,77 % pour prendre en compte la baisse de taxe sur la valeur ajoutée liée à l’obtention de l’autorisation de mise sur le marché – un médicament dépourvu d’une telle autorisation est taxé à 19,6 % ; avec une autorisation, il bénéficie du taux réduit de 5,5 % – et les dons humanitaires, qui représentaient à l’époque 56 millions d’euros.
Le coût des vaccins a considérablement diminué : il est estimé aujourd’hui à 310 millions d’euros, soit 56 % de moins que le coût ayant servi de base au calibrage de la contribution. Une baisse de taux s’impose donc. La loi n’ayant pas prévu d’ajustement automatique de la contribution, cela nécessite une mesure législative, qui figurera dans la partie rectificative de la prochaine loi de financement de la sécurité sociale.
Le rendement attendu de la contribution est de 35 % de 310 millions d’euros, soit 110 millions d’euros. Et comme l’assiette devrait s’établir à 32,3 milliards d’euros en 2010, son taux devrait être de 0,34 %.
La mesure devra également régler les modalités pratiques de récupération des sommes acquittées par les organismes complémentaires. Il faudra procéder à des restitutions nettes en leur faveur, sur leur dernier acompte dû en janvier 2011. Ils seront remboursés à due concurrence du nouveau coût des vaccins. C’est normal, et il n’a d’ailleurs jamais été question qu’il en soit autrement. J’ai encore rencontré les représentants des organismes complémentaires il y a quelques jours. Il n’y a aucune polémique sur le sujet, l’affaire a été réglée en toute transparence.
Mme Catherine Lemorton. Je remarque que l’Ordre national des pharmaciens, à l’égard duquel il m’arrive d’être très critique, a été un très bon vecteur d’information pendant toute la durée de la pandémie. Tous les quinze jours, nous recevions un bulletin, notamment sur les mesures barrières. Je pense donc que les ordres ne sont donc pas à écarter.
On a parlé de la gratuité des vaccins. Mais, à terme, ils vont coûter à nos concitoyens : la mutualité a augmenté les cotisations dues par ses adhérents de 3,8 %, la prévoyance de 6,7 % et les assurances privées de 11,5 %.
La moitié des médecins ont dit qu’ils ne souhaitaient pas vacciner leur patientèle. Lors d’une réunion de l’Office parlementaire d’évaluation des choix scientifiques et technologiques, en septembre 2007, le sénateur Paul Blanc a expliqué que dans les circuits de « vaccination traditionnelle », on mettait souvent en avant des contre-indications qui n’en sont pas pour éviter de vacciner les patients. Il y a donc un travail global à mener auprès des médecins pour contrer cette tendance d’ordre « culturel », que je déplore.
J’en viens à ma question. Vous avez commandé 94 millions d’unités vaccinales en juillet. Dernièrement, vous vous êtes exprimée très clairement à ce propos lors de votre audition par le Sénat, déclarant : « De plus, le déséquilibre entre l’offre et l’importance de la demande au niveau mondial plaçait les laboratoires en position de force. Ceux-ci privilégiaient les commandes fermes et définitives ». Vous ajoutiez : « En mai 2009, les estimations de la capacité de production mondiale variaient entre 500 millions et moins d’un milliard de doses ». Vous précisiez, en vous faisant le relais de ce que les laboratoires vous disaient : « Si le rendement de la souche virale était inférieur aux prévisions, la capacité de production pouvait même descendre à 250 millions de doses ». L’Organisation mondiale de la santé a fait son travail d’alerte, mais elle n’a pas vocation à gérer la pandémie dans chaque pays. S’en est alors ensuivi une espèce de « course à l’échalote » plutôt malsaine entre les États : c’était à celui qui commanderait le plus de vaccins pour donner à sa population l’impression qu’il la protègeait mieux que ne le faisaient les autres. Or une pandémie ne connaît pas les frontières. Ne croyez-vous pas qu’il faudrait améliorer le partenariat avec les autres pays du monde, solvables ou non, pour faire face aux pandémies d’une manière un peu plus équilibrée ?
Le 22 juillet 2009, je vous avais déjà interrogée à propos des 94 millions d’unités vaccinales que vous aviez commandées et qui devaient permettre de vacciner 47 millions de personnes. Comment aurait-on pu vacciner, par deux fois, 47 millions de personnes sans désorganiser l’offre de soins habituelle en pathologie hivernale, alors même que les médecins libéraux étaient écartés du processus de vaccination ? Autant éviter de refaire certaines erreurs lors des pandémies à venir, non ? Enfin, comment le nombre de 47 millions de personnes à vacciner a-t-il été calculé ?
Mme la ministre. La profession des pharmaciens a su s’organiser : il n’y a qu’à voir le succès que remporte le dossier pharmaceutique. Sans doute a-t-elle une bonne capacité d’adaptation et est-elle moins individualiste que d’autres professions. Il faut dire aussi que le pharmacien travaille au sein d’une équipe, qu’il n’est pas tout seul dans un cabinet et qu’il est confronté à des nécessités commerciales qui l’obligent à faire preuve d’une certaine souplesse.
Vous avez raison, rien n’est gratuit et, in fine, les dépenses de santé sont toujours payées par nos concitoyens, d’une façon ou d’une autre. On connaît l’origine de ces sommes : les cotisations salariales pour 47 % ; la contribution sociale généralisée pour 37 % ; les taxes affectées pour 15 %, plus la part à la charge des ménages. Et comme tout ce qui sera prélevé sur le capital sera dédié aux retraites, on sait maintenant que cette ressource sera indisponible pour les dépenses de santé, lesquelles seront donc payées par tout le monde, y compris par les plus modestes.
La vaccination est bien la meilleure prévention des maladies infectieuses. Si l’on a éradiqué les grandes pandémies infectieuses, on le doit quasiment à elle seule. Je ne peux que constater comme vous, avec inquiétude et parfois désespérance, l’influence sur le corps médical de certaines démarches et ligues antivaccinales. Des responsables politiques ont mené une campagne délirante contre la vaccination, ce qui ne les a d’ailleurs pas empêchés de nous reprocher que cette campagne-ci n’ait pas eu le succès escompté. Il faut dire que l’on a entendu beaucoup de stupidités à cette époque. Au début du mois de juillet, à l’occasion d’une question au Gouvernement, l’un de vos collègues, allié dans vos majorités locales, sinon nationales, ne m’a-t-il sommée d’acheter 120 millions de lunettes de natation, autant de combinaisons de peintre et 7 milliards de masques supplémentaires pour combattre la pandémie grippale ? Superbe, n’est-ce pas ?
La France a effectivement acheté 94 millions de doses pour vacciner 47 millions de personnes. Parmi les autres pays, du moins les pays comparables au nôtre, dix ont souhaité acheter des vaccins à deux doses pour couvrir 100 % de leur population – même si, finalement, ils n’ont pas toujours pu en acheter autant. Il s’agissait du Royaume-Uni (qui a acheté 130 millions de doses), des États-Unis (qui voulaient passer commande de 600 millions de doses), des Pays-Bas (qui en ont acheté 34 millions), de l’Autriche (16 millions), de la Norvège (9,4 millions), de Chypre, de l’Allemagne, du Luxembourg et de l’Irlande. D’autres États, qui auraient voulu vacciner, pour des raisons éthiques, l’ensemble de leur population, mais n’avaient pas les moyens d’acheter deux doses, ont fait un choix un peu étrange en l’état de la doctrine vaccinale à l’époque : ils ont décidé de couvrir 100 % de la population avec une dose. Ce sont Malte, la Belgique, la Finlande et l’Islande.
En France, nous avons fait, seuls, un autre choix : celui de proposer la vaccination à l’ensemble de la population, mais aussi, comme nous savions que la population ne se ferait pas vacciner à 100 %, de tenir compte d’un taux d’attrition raisonnable.
Pour calculer celui-ci, nous avions à notre disposition les sondages d’opinion. En juillet 2009, 67 % des Français déclaraient qu’ils se feraient vacciner. Ce pourcentage est resté pratiquement stable jusqu’à la fin du mois d’août. Nous connaissions également le nombre de personnes qui se font vacciner quand elles sont confrontées à un risque sanitaire, mineur ou non.
M. Didier Houssin, directeur général de la santé. Nous disposions du taux d’attrition, dans la population cible, pour la vaccination contre la grippe saisonnière, qui est de 35 %, et du taux constaté lors de l’épidémie de méningite en Seine-Maritime, qui avait été de 15 %. Nous avons fait la moyenne.
Mme la ministre. La France a fait preuve d’originalité. Aucun autre pays n’a adopté cette démarche qui nous a permis de concilier éthique et réalisme sanitaire.
M. le président Jean-Christophe Lagarde. Le directeur général de la santé nous a expliqué que plus les commandes étaient importantes, plus les laboratoires étaient disposés à fournir des vaccins – ce qui n’a pas empêché certains pays de prévoir des tranches optionnelles. Ne pourrions-nous pas mettre au point une politique préventive avec nos partenaires européens pour nous éviter d’être soumis à la dictature des laboratoires ou du marché, et d’être entraînés dans cette « course à l’échalote » plutôt indécente : plus on commande de vaccins, plus vite on est livré ?
Mme la ministre. En situation de pénurie, l’industrie pharmaceutique se trouve évidemment en position de force vis-à-vis des acheteurs que sont les États. Certains de ceux-ci auraient préféré que les achats passent par les circuits traditionnels de grossistes : c’est par exemple la position qu’a maintenue la Pologne. Sauf que la présentation des vaccins faisait qu’il était impossible de procéder ainsi, que les États devaient être à la manœuvre et devenir, en quelque sorte, les clients des laboratoires pharmaceutiques.
Peut-être, demain, les Chinois ou les Indiens lanceront-ils des chaînes de fabrication de grande capacité. Certains de nos concurrents se sont en effet mis en position de venir « tailler des croupières » à notre propre industrie pharmaceutique. N’oublions pas que nous vivons dans un monde global et que l’éthique de l’Organisation mondiale de la santé consiste à proposer les souches à tout le monde, et gratuitement. De la même façon, la France milite pour qu’il n’y ait pas de droits de propriété sur les souches virales. Mais au nom de l’éthique, on risque de dynamiter l’industrie pharmaceutique sur les sols européen et américain.
Peut-on améliorer la gouvernance, à la fois internationale et européenne, en matière de pandémie ?
Au niveau mondial, l’Organisation mondiale de la santé existe et il ne faut pas « jeter le bébé avec l’eau du bain ». Rappelez-vous les bagarres qui ont eu lieu à propos du virus A(H5N1), les pays du Sud-Est asiatique ne voulant pas nous donner les souches, ou du moins ne voulant les donner que contre rémunération.
Les pays du G7 – l’Allemagne, le Canada, les États-Unis, l’Italie, la France, le Japon, le Royaume-Uni – ainsi que le Mexique se sont réunis à Londres, au début du mois de décembre, pour étudier les mesures mises en place pour lutter contre la grippe A(H1N1).
De mon côté, j’ai eu des rencontres bilatérales avec de nombreux collègues européens et avec la secrétaire à la santé des États-Unis, Mme Kathleen Sebelius. J’ai appelé au téléphone mes homologues allemande et belge de l’époque, Mmes Ulla Schmidt et Laurette Onkelinx. De manière formelle et informelle, j’ai toujours été en relation avec eux pour m’assurer qu’ils étaient en phase avec nous. Enfin, dans le cadre de l’Union européenne, j’ai toujours plaidé pour une réponse européenne unique. Mais en ce domaine, je reconnais que nous avons des progrès à faire. Nos partenaires ont des organisations politiques très diverses et nous nous sommes trouvés très démunis pour mener des politiques de coopération avec des pays comme l’Espagne, l’Italie ou l’Allemagne dont l’organisation de la santé est complètement décentralisée. Comment, dans un État fédéral, mener une politique globale de gestion de pandémie ?
M. le président Jean-Christophe Lagarde. Je pense qu’il faut anticiper suffisamment pour que ces États passent des accords avec leur système décentralisé, de manière à pouvoir mener ensuite des coopérations interétatiques.
Mme la ministre. On peut l’envisager. Des coopérations transfrontalières existent, mais elles ne permettront pas de résoudre les difficultés qui nous sont posées. Tous les pays de l’Union européenne n’ont pas les mêmes capacités de prise en charge : les nouveaux entrants ont des niveaux de vie et une organisation sanitaire sans commune mesure avec les nôtres.
Mme Marie-Louise Fort. Je veux vous remercier pour la clarté et la pertinence de votre témoignage. Venant un peu plus tôt, peut-être eût-il évité bien des polémiques…
La communication autour de la campagne de vaccination a été importante mais les informations données étaient parfois ardues, comme en témoignent les documents distribués aux familles par les chefs d’établissements scolaires. Ne faudrait-il pas à l’avenir sérier et diversifier cette communication et, sans rien enlever à la responsabilité des parents, la rendre plus accessible ?
Mme la ministre. Comment, sur un sujet par définition scientifique, élaborer une communication de qualité, accessible à tous mais aussi évolutive ? Pour communiquer sur n’importe quel problème de santé se pose la question de la diversité des interlocuteurs, d’âges et de conditions physiques inégaux, ainsi que de la diversité des émetteurs, multiples dans une société moderne. Nous allons lancer un site internet grand public, proposant des informations validées et de qualité, comme alternative aux sites institutionnels
– DGS-Urgent, site de la Haute Autorité de santé… –, qui eux dispensent des informations d’un niveau technique élevé, et aux sites délivrant des informations sujettes à caution.
Nous avons voulu délivrer une information de qualité tout au long de la crise, tout en essayant, en vain, de résister à la pression des journalistes. Je me suis ainsi vue contrainte d’organiser des conférences de presse hebdomadaires alors que j’aurais préféré laisser la place à une communication plus technique. Dès le 25 avril, date de l’alerte, le « barnum médiatique » était en place : il était dès lors exclu que je délègue la communication. Je n’ai jamais réussi à contenir cet emballement, malgré tous mes efforts pour « baisser le rhéostat ».
M. le rapporteur. Il est heureux que nous ayons connu l’épisode du virus A(H5N1) qui a entraîné la modification du règlement sanitaire international et permis d’interdire l’appropriation des souches virales.
J’avoue avoir été choqué par l’intervention d’une grande personnalité lors de l’audition publique organisée hier par l’Office parlementaire d’évaluation des choix scientifiques et technologiques, expliquant en substance que la France aurait dû procéder de la même manière que la Pologne.
On vous reproche de ne pas avoir suffisamment associé à la campagne le corps social. Vous avez dit que vous aviez l’intention d’organiser un débat public citoyen : qu’en est-il ? Celui-ci ne permettrait-il pas de combattre le risque de refus vaccinal, qui pourrait aller grandissant ?
On vous reproche également d’avoir sous-estimé l’apport qu’auraient pu fournir l’Académie nationale de médecine et le Haut conseil de la santé publique. Envisagez-vous désormais de les associer davantage à vos décisions ?
Mme la ministre. Entendre des « experts » citer en exemple la Pologne m’irrite fortement. Ce pays déclare vingt cas de grippe saisonnière par an, ce qui laisse dubitatif sur la qualité de sa veille sanitaire.
Devant la Diète, Mme Ewa Kopacz, ministre de la santé, a qualifié les vaccins d’« eau miraculeuse », émettant des doutes sur la sécurité de produits pourtant évalués par l’Agence européenne du médicament, agence à laquelle son pays contribue. La vaccination d’une cinquantaine de millions d’Européens a fait justice du propos ! Reste que la Pologne est le seul État développé à avoir refusé de vacciner sa population. Cependant, Mme Kopacz a également expliqué, dans le même discours, que son département juridique avait trouvé « au moins vingt points douteux dans le contrat » proposé à son pays par les laboratoires, mais qu’elle ne pouvait en dire plus en raison des négociations en cours. Il est pour le moins paradoxal de souligner la dangerosité de produits tout en avouant conduire des négociations pour en obtenir !
Je peux attester de la réalité de ces négociations puisque, dans un courrier adressé à mon cabinet le 23 septembre 2009, l’ambassade de Pologne, proposant de faire vacciner nos diplomates à Varsovie en échange de la vaccination des diplomates polonais en France, affirmait que le ministère de la santé polonais disposerait du vaccin dans les mois suivants… Je tiens bien entendu ce courrier à votre disposition.
Mme Kopacz, très en retrait des grands rendez-vous européens tout au long de la crise, n’a pas eu l’occasion de répéter ces propos devant ses homologues. Ce n’est pas que la Pologne n’a pas voulu vacciner. Elle n’a tout simplement pas pu ! Pour négocier avec les laboratoires, il ne faut pas être en position de faiblesse. Or le pays est en conflit ouvert avec les laboratoires implantés sur son sol et se trouve en infraction avec la législation pharmaceutique européenne. Il faut noter également que l’État polonais ne souhaitait pas assumer la responsabilité de la commande de vaccins et préférait que les grossistes et les pharmaciens s’en chargent.
Je suis tout à fait favorable à la tenue d’un débat public citoyen, si, toutefois, il n’est pas fait référence à une « expertise citoyenne » que je récuse. J’ai saisi la Conférence nationale de santé pour qu’elle m’indique la façon dont un tel débat pourrait être organisé sur l’acceptation sociale de la vaccination ou sur la limitation des libertés publiques qui pourrait résulter d’une pandémie sévère, par exemple.
Le 13 octobre 2009, l’Académie nationale de médecine a émis un avis dans lequel elle s’est déclarée en accord avec les propositions formulées par le ministère de la santé et a rappelé l’intérêt de poursuivre conjointement la vaccination contre la grippe saisonnière. Cet avis a été adopté à une majorité de trente-trois voix pour, deux voix contre et huit abstentions – dont celle du Professeur Didier Houssin.
M. le président Jean-Christophe Lagarde. Dans l’esprit public, l’Académie nationale de médecine est le lieu naturel des débats et une autorité de référence objective et fiable. Ses interventions ne peuvent que contribuer à neutraliser les effets délétères de certaines déclarations infondées reprises par les médias.
Ne pensez-vous pas que les futurs médecins généralistes, relais auprès de l’opinion publique, devraient mieux connaître la mécanique des crises sanitaires et la part d’incertitudes qu’elles comportent – surtout s’agissant de la grippe, affection réputée bénigne mais qui n’évolue jamais comme on s’y attend ? Cela faciliterait largement la communication d’État, dans un pays cartésien où la science est censée tout savoir, remédier à tout et nous garantir contre tout. Les Français comprendraient alors mieux que l’on prenne au début un maximum de précautions, avant de passer à une phase de décélération si ces précautions se révélaient, par chance, inutiles. Mais c’est uniquement hors temps de crise que l’on peut procéder à cette formation.
Mme la ministre. L’opinion publique, qui veut être rassurée, attend de nous des certitudes et des avis tranchés, quitte à nous les opposer ensuite si nous nous trompons. Je tiens à votre disposition l’intégralité de mes interventions : j’ai toujours exposé toutes les éventualités, en me gardant de privilégier tel ou tel scénario et en évitant, en bonne scientifique, d’être péremptoire. Mais ces précautions déontologiques pèsent peu face aux réductions simplificatrices des débats médiatiques où la parole de l’expert ne pèse pas plus que celle des auditeurs. C’est aussi la raison pour laquelle il faut bien réfléchir aux modalités d’un débat public citoyen, sous peine de le faire tourner au café du commerce.
M. Paul Jeanneteau. Il conviendrait de s’inspirer de la façon dont les états généraux de la bioéthique incluaient des panels de citoyens préalablement formés aux questions sur lesquelles ils seraient appelés à débattre. À cette occasion, nous nous sommes aperçus que l’avis de nos concitoyens divergeait peu de celui de la Représentation nationale.
Mme la ministre. J’avais moi-même organisé, selon la même méthodologie, le débat citoyen sur la Charte de l’environnement, dont la qualité avait été saluée. Pour autant, ce type de démarche ne peut être entrepris en temps de crise, sous le coup de l’émotion.
M. le président Jean-Christophe Lagarde. Avec le risque de laisser le champ libre aux lobbies et aux groupes d’influence… La voie est étroite.
Mme Catherine Lemorton. En effet, le débat ne doit pas être mené à chaud. De plus, l’expertise doit être laissée aux experts.
Nos concitoyens ont découvert qu’un vaccin nouveau, susceptible d’être administré aux tout-petits, pouvait être développé très rapidement, que les dates de péremption pouvaient être repoussées, que des bioéquivalences – auxquelles je vous sais très attentive – pouvaient être décrétées sans délai... Pour les rassurer, il conviendrait peut-être de développer un plan de recherche pharmaco-épidémiologique, à moyen et long termes, qui aille au-delà des effets secondaires immédiats. Les gens doivent comprendre qu’un vaccin reste un médicament, avec des effets secondaires qui augmentent statistiquement avec l’importance de la couverture vaccinale, et qui ne se limitent pas à l’état fébrile du lendemain.
À ce sujet, il me semble dommageable que les citoyens puissent rapporter directement sur le site de l’Agence française de sécurité sanitaire des produits de santé les effets secondaires qu’ils ont subis, sans passer par le filtre d’un professionnel de santé. Certains des signes ainsi rapportés n’avaient rien à voir avec le vaccin.
Mme la ministre. Il est extrêmement important que le suivi d’une campagne de vaccination soit assuré pendant plusieurs années. Nous disposons d’outils pour mettre en place un plan de gestion des risques : l’Agence française de sécurité sanitaire des produits de santé a collecté et continue de recueillir les données nécessaires et la Caisse nationale d’assurance maladie des travailleurs salariés a recensé les personnes vaccinées.
L’extension de la date de péremption n’est pas choquante. La décision, qui est une décision de bonne gestion, a été prise sur la base d’études scientifiques effectuées, pour ce qui est des masques, par le Laboratoire national de métrologie et d’essais.
Vous avez raison de dire que je suis très rigide sur la question des bioéquivalences, pour ne pas dire opposée à leur pratique. Les docteurs en pharmacie que nous sommes savent bien qu’aucune molécule, même apparentée, n’est équivalente à une autre et que la présentation galénique peut entraîner des biodisponibilités différentes pour la même molécule thérapeutique.
Il est précisé sur le site de l’Agence française de sécurité sanitaire des produits de santé qu’il est préférable de passer par son médecin pour décrire les effets secondaires du vaccin. Mais j’ai aussi voulu élargir le champ des possibles et permettre aux citoyens de s’exprimer sans filtre.
M. le président Jean-Christophe Lagarde. Pensez-vous qu’un taux de vaccination plus élevé contre la grippe saisonnière aurait permis de mobiliser davantage la population en faveur d’une vaccination de masse ? La France a fait le choix de cibler des populations à risques, contrairement aux États-Unis où les citoyens, habitués, se sont montrés du coup moins réticents à la vaccination contre la grippe A(H1N1).
Mme la ministre. La prochaine campagne de vaccination contre la grippe saisonnière sera élargie à de nouveaux groupes qui se sont révélés à risques pendant la pandémie de grippe A(H1N1). Les personnes éligibles seront donc les plus de soixante-cinq ans, les personnes en affection de longue durée, l’entourage des nourrissons de moins de six mois et les enfants de moins de dix-huit ans dont l’état de santé justifie un traitement par l’acide acétylsalicylique. Les professionnels de santé et des établissements médico-sociaux ou de soins de suite, les personnels navigants ou de voyage seront également concernés.
Comme chaque année, l’Organisation mondiale de la santé s’est prononcée sur la composition optimale du vaccin antigrippal, qui sera la même pour l’hémisphère Nord et pour l’hémisphère Sud : antigènes de virus A(H1N1) 2009, antigènes de virus A(H3N2) et antigènes d’un type de virus B. Ce vaccin trivalent sera commercialisé en France à la fin du mois de septembre et pourra être, comme d’habitude, administré par le médecin traitant ou l’infirmière.
Dans son avis du 23 avril 2010, le Haut conseil de la santé publique recommande le vaccin monovalent – toujours disponible – et, à défaut, le vaccin trivalent pour les femmes enceintes, les personnes obèses et les personnes atteintes de maladies endocriniennes et métaboliques susceptibles d’être décompensées par une infection aiguë. Je vais engager avec la Caisse nationale d’assurance maladie des travailleurs salariés des discussions pour voir dans quelle mesure ces personnes peuvent bénéficier d’un bon de vaccination saisonnier. La chose étant exclue pour les personnes obèses, il reviendra aux médecins traitants d’inciter leurs patients présentant un indice de masse corporelle supérieur ou égal à 30 à se faire vacciner. Nous engagerons une campagne de communication en direction de la communauté soignante et des personnes à risques.
M. le rapporteur. Pouvez-vous évaluer le coût de cette campagne de vaccination ?
Mme la ministre. Une campagne classique représente une dépense d’environ 110 millions d’euros. Le nombre de personnes vaccinées passerait de 11 à 15 millions cette année.
M. le président Jean-Christophe Lagarde. L’effet de protection collective de la vaccination était nul dès lors que la pandémie était déclarée, en France métropolitaine, en octobre, avant le lancement de la campagne. Un certain nombre de personnes auditionnées estiment qu’il aurait été préférable, de ce fait, de concentrer l’effort sur les personnes à risque, lesquelles auraient été davantage incitées à se protéger. Au lieu de quoi, celles-ci se sont trouvées noyées dans la masse.
Mme la ministre. Bien au contraire, nous avons beaucoup insisté sur la notion de populations cibles et convoqué les personnes à risque en priorité, grâce aux bons ! La vaccination dans les établissements de santé a été lancée le 20 octobre, la campagne menée dans les centres a démarré le 12 novembre et l’ensemble de la population a été appelé le 10 décembre 2009. Ces personnes n’ont jamais été noyées dans la masse.
En toute franchise, je dois avouer que les retards dans la livraison des vaccins et les problèmes de logistique que nous avons connus nous ont conduits à ne pas convoquer tout le monde d’emblée et à suivre l’ordre de priorité que nous avions arrêté, ordre rendu possible par l’avis du Comité consultatif national d’éthique.
M. le président Jean-Christophe Lagarde. La part des personnes à risque devrait donc être prédominante dans la population des personnes vaccinées…
Mme la ministre. Sans aucun doute, car elles sont plus attentives à leur santé. Je laisserai à M. Didier Houssin le soin de vous communiquer les statistiques.
S’agissant de la couverture vaccinale totale, je veux rappeler que contrairement aux autres pays faisant étant de taux très élevés, nous avons établi le taux de vaccination à partir du nombre de bons de vaccination qui nous étaient retournés et non à partir du nombre de doses de vaccin mises à disposition. Les résultats ne sont pas les mêmes, car la perte en ligne est massive : songez que nous avons envoyé 1 million de doses à destination des médecins généralistes, et que seules 16 000 personnes ont été vaccinées – ce qui est, au passage, un indice de l’implication de la médecine libérale dans la campagne.
La France est ainsi le seul pays à ne pas avoir surévalué le taux de vaccination ; si l’on tient compte du fait que nombre de bons ont pu s’égarer avant de nous revenir, nous pouvons même dire que nos chiffres sont au-dessous de la réalité.
M. le président Jean-Christophe Lagarde. L’échec de la vaccination par les médecins généralistes à partir du 4 janvier est moins dû à leur manque d’implication qu’à la faible demande de la population à cette date, y compris dans les centres de vaccination.
Accessoirement, vous avez dit que vous aviez demandé que les horaires d’ouverture des centres soient assouplis pendant la période des fêtes. Nous sommes ici plusieurs élus locaux à nous être vus contraints par la préfecture d’ouvrir les centres de 8 heures à 22 heures les 24 et 31 décembre !
Monsieur Didier Houssin, vous avez prêté serment lors de vos auditions par la commission d’enquête. À ce titre, vous pouvez prendre la parole.
M. Didier Houssin, directeur général de la santé. L’Institut de veille sanitaire nous a communiqué les premières données concernant la couverture vaccinale de certains groupes ciblés : femmes enceintes, entre 20 et 25 % ; enfants de moins de six mois ayant des facteurs de risque et leur entourage, entre 15 et 20 % ; enfants de six à vingt-quatre mois, entre 20 et 25 % ; enfants de vingt-quatre mois à onze ans, 10 % ; professions de santé, 30 %. Si le taux global reste faible, ces données correspondent à nos prévisions concernant l’ordre de priorité.
M. le président Jean-Christophe Lagarde. Le directeur général de Novartis nous a indiqué que, le 19 novembre, sa firme avait livré à l’Établissement de préparation et de réponse aux urgences sanitaires 1 784 000 monodoses. Fin novembre, 1 980 000 monodoses avaient été livrées au total ; fin décembre, 4,3 millions. Ne pouvait-on pas dès lors coupler la vaccination dans les centres et la vaccination en cabinets de ville, à un moment où l’affluence était importante dans les premiers et où se posait la question de la vaccination des personnes invalides ?
Le directeur départemental des affaires sanitaires et sociales de Paris, que nous avons entendu, a été déchargé de ses fonctions durant l’épidémie. Ne lui aurait-on pas fait payer la mauvaise communication entre les préfets de la zone de défense? Quel est votre sentiment sur cette question ?
Mme la ministre. Novartis a livré les monodoses conditionnées en boîtes de dix, qu’il n’était pas si aisé d’utiliser dans le circuit de la médecine libérale. Il est vrai cependant que nous avons très vite envisagé de proposer ces monodoses aux médecins qui souhaitaient vacciner les personnes à domicile, ce qui a été possible dès le 3 décembre grâce à la création des équipes mobiles.
J’ai beaucoup d’estime pour M. Philippe Coste, un fonctionnaire de très haute qualité. Lorsque je me suis rendue à la direction départementale des affaires sanitaires et sociales de Paris, qui n’avait pas reçu de visite d’un ministre de la santé depuis trente ans, il m’a fait part des difficultés auxquelles il était confronté et de l’épuisement de son personnel. Il s’est vu offrir, depuis, un poste tout à fait approprié à ses mérites.
M. le président Jean-Christophe Lagarde. J’aurai l’occasion de dire demain au ministre de l’intérieur, de l’outre-mer et des collectivités territoriales que l’organisation administrative à Paris, dans le contexte de telles crises sanitaires, est franchement à revoir.
Mme la ministre. Si l’agence régionale de santé d’Île-de-France avait été opérationnelle, les choses ne se seraient pas passées de la même manière.
M. Gérard Bapt. Les fonctionnaires se sont engagés dans cette campagne jusqu’à l’épuisement physique. Je n’ose imaginer ce qui se serait passé si la pandémie s’était révélée beaucoup plus grave.
Je vous sais gré de débattre et de travailler sur les retours d’expérience. Sans doute faudra-t-il que les parlementaires soient associés à cette tâche, comme ils le furent à propos de la grippe A(H5N1), en la personne de M. Jean-Pierre Door, rapporteur de la mission d’information sur la grippe aviaire. Le Parlement est un rouage important qui a souvent permis de dépasser les débats partisans en période de crise.
Vous avez porté un jugement sévère sur la Pologne. Sans doute faudra-t-il examiner attentivement les statistiques pays par pays, que la vaccination y ait été proposée ou non.
Mme la ministre. Le travail que vous effectuez au sein de cette commission d’enquête et les conclusions auxquelles vous parviendrez seront source de propositions : c’est la raison pour laquelle j’ai accepté avec joie cette audition, tout comme j’ai déféré à toutes les invitations qui m’ont été faites par le Parlement. Rarement un ministre se sera rendu aussi fréquemment devant la Représentation nationale durant une crise.
Lorsqu’un corps social est obligé de prendre sur ses propres forces pour installer un dispositif inédit, des imperfections sont inévitables. Les files d’attente sont inhérentes à ce genre de campagne et je suis certaine qu’elles se reformeront à l’avenir. J’avoue que les manifestations d’impatience m’ont stupéfiée : ceux qui acceptent de battre le pavé pendant des heures pour un événement médiatique ou commercial sont les mêmes qui protestent, alors qu’on leur propose gratuitement un médicament qui peut leur sauver la vie !
Cette organisation avait tous les défauts d’une organisation non pérenne, mais je peux vous dire, pour avoir vu travailler ensemble des personnes de tous horizons et pleurer les équipes lors de la fermeture des centres, que le sentiment d’utilité était partagé par tous, et les critiques, très durement ressenties.
M. le président Jean-Christophe Lagarde. Cette commission d’enquête n’a pas été facile à créer, tant il paraissait extraordinaire de traiter de ce sujet alors même que vous vous étiez déclarée disposée à en débattre. Au fur et à mesure des auditions, nous avons vu les esprits évoluer et les passions s’apaiser. Les membres du Gouvernement ont été entendus à la fin de nos travaux pour tenir compte de ce qui s’était dit auparavant et en tirer des conclusions pour l’avenir, conformément à l’intitulé de notre commission. Nous avons fait la démonstration qu’une enquête pouvait ne pas être menée sur un mode accusatoire et être utile à l’ensemble du pays. Je vous remercie.
Mme Catherine Lemorton. Permettez-moi de préciser que l’opposition n’a jamais cessé de demander une mission d’information sur ce sujet.
La séance est levée à treize heures.
Audition de M. Luc Chatel,
ministre de l’éducation nationale, porte-parole du Gouvernement
(Procès-verbal de la séance du mercredi 16 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à seize heures vingt.
M. le président Jean-Christophe Lagarde. Avant de commencer cette audition, chers collègues, je vous informe que M. le ministre de l’intérieur ne sera entendu qu’à 18 heures 30 et non à la suite de M. le ministre de l’éducation nationale comme initialement prévu. M. Brice Hortefeux, en effet, a dû se rendre en urgence dans le département du Var suite aux violentes intempéries qui s’y sont déroulées.
Je vous remercie, monsieur le ministre de l’éducation nationale, d’avoir répondu à l’invitation de notre commission d’enquête. Nous souhaitons aborder avec vous la question du déroulement de la campagne de vaccination, notamment dans le système scolaire, mais également celle des moyens que vous aviez alors envisagés pour pallier une éventuelle pandémie qui aurait entraîné une interruption du service public de l’éducation nationale.
(M. Luc Chatel, ministre de l’éducation nationale, porte-parole du Gouvernement,
prête serment.)
M. Luc Chatel, ministre de l’éducation nationale, porte-parole du Gouvernement. Dès le mois de décembre 2008, le ministère de l’éducation nationale avait arrêté un plan de prévention et de lutte contre la pandémie grippale en collaboration avec le ministère de l’enseignement supérieur et de la recherche afin de contrer une éventuelle pandémie de grippe A(H5N1), dite « grippe aviaire ». À partir du mois d’avril 2009, lors de l’apparition, au Mexique, du virus A(H1N1), l’action du ministère de l’éducation nationale s’est inscrite dans le cadre de la cellule interministérielle de crise, la vulnérabilité des jeunes enfants et la circulation plus active des virus en milieu scolaire conférant à l’éducation nationale une place particulière dans la politique de prévention. Pendant cette pandémie, sur les plans national et local, les décisions ont donc été élaborées et mises en œuvre en concertation interministérielle sous l’égide du ministère de l’intérieur et des préfets. Outre que mon ministère a bien entendu systématiquement participé à ces réunions, une concertation permanente a eu lieu entre les inspecteurs d’académie, directeurs des services départementaux de l’éducation nationale et les préfets, notamment les services des préfectures et les directions départementales des affaires sanitaires et sociales.
Dès ma nomination au ministère de l’éducation nationale, le 23 juin 2009, je me suis fixé une ligne de conduite dont je n’ai pas dévié : ni dramatiser, ni sous-estimer la situation à laquelle nous étions ou risquions d’être confrontés. Nous avons donc eu un souci constant d’anticipation et d’adaptation à l’évolution épidémiologique afin de protéger la santé de nos enfants et d’assurer la continuité du service public de l’éducation nationale.
Le virus étant d’abord apparu à l’étranger, nous avons décidé d’interdire temporairement les voyages scolaires, en l’occurrence au Mexique et aux États-Unis. Avec l’extension de la pandémie dans le monde entier, cette mesure a été ensuite progressivement assouplie, mais nous avons recommandé une profonde vigilance ainsi que l’application de mesures préventives en fonction des destinations.
Avec l’apparition des premiers cas en France, nous avons agi principalement dans trois directions.
Première direction : l’information des enfants, des parents et des enseignants sur le virus A(H1N1) et ses conséquences.
Dès le mois de mai 2009, l’alerte pandémique a favorisé une prise de conscience quant à l’importance des mesures d’hygiène dans les espaces collectifs, en particulier en milieu scolaire. À cet effet, l’Institut national de prévention et d’éducation pour la santé a diffusé à tous les établissements des affiches présentant les règles élémentaires d’hygiène visant à retarder la propagation du virus : se laver régulièrement et soigneusement les mains, utiliser des mouchoirs en papier et éviter les contacts avec une personne malade.
Dans la perspective de la préparation de la rentrée de 2009, nous avons également décidé de distribuer à 12 millions d’élèves un dépliant de quatre pages dont je vous remettrai un exemplaire, mesdames et messieurs les députés, afin d’informer les familles sur le virus et sur l’importance d’enseigner les « gestes barrières » aux enfants. Nous avons par ailleurs, par une note de service du 19 août 2009, organisé dans toutes les classes une séance d’information sur les gestes limitant la transmission de la grippe. Cette double initiative était articulée avec la campagne nationale « Stop au virus de la grippe », laquelle a été appuyée fortement – et je les en remercie – par les collectivités territoriales dans le domaine de l’équipement et de la rénovation des installations sanitaires et dans celui des produits de lavage de mains, des mouchoirs et des serviettes en papier.
Enfin, nous demeurons vigilants, aujourd’hui encore, afin que les habitudes acquises à l’école pendant cette période demeurent. C’est d’autant plus nécessaire qu’en matière d’hygiène et de développement durable, ce sont souvent les enfants qui éduquent leurs parents ! D’après un récent sondage, 43 % des Français ont d’ailleurs changé leur comportement en la matière.
Deuxième direction : le traitement des cas de grippe en milieu scolaire. Toujours dans l’objectif d’anticiper les conséquences de l’épidémie, nous avons souhaité, dès la fin du mois d’août 2009, donner à notre encadrement des indications précises sur les conduites à tenir dans les établissements scolaires en cas d’apparition de cas grippaux individuels ou groupés – toutes les procédures ont bien entendu été conçues en relation avec le ministère de la santé dans le cadre de la cellule interministérielle de crise que j’ai évoquée et, après arbitrage interministériel final, les instructions ont fait l’objet d’une circulaire adressée aux chefs d’établissement le 25 août 2009. Pour les cas individuels, qu’il s’agisse d’élèves ou de personnels, nous avons mis en place un dispositif d’isolement, de prise en charge immédiate et d’information des familles. Par ailleurs, l’Institut de veille sanitaire ayant défini la notion de « cas groupés » comme la survenue de trois cas au moins de syndromes grippaux en moins d’une semaine dans une classe ou des classes différentes, mais dont les élèves ont des activités scolaires partagées, nous sommes convenus que seuls les préfets de département étaient compétents pour décider de fermetures partielles ou totales de classes ou d’établissements. Je le répète : nous n’avons pas instauré une règle systématique, mais un seuil à partir duquel les préfets, en fonction de considérations locales et après avoir consulté les autorités académiques et sanitaires ainsi que les collectivités locales concernées, pouvaient décider de ces fermetures. Les décisions ont d’ailleurs évolué en fonction de la situation épidémiologique : de septembre à décembre 2009, les préfets ont pris des arrêtés de fermeture pour 1 882 classes et 1 067 écoles ou établissements. Cette stratégie s’est appuyée sur une analyse locale de la situation sanitaire et a permis de retarder la diffusion du virus dans l’attente de la campagne de vaccination. Il était du devoir de l’éducation nationale, en effet, de jouer ce rôle de « barrière ».
Enfin, le 1er septembre 2009, j’ai signé une circulaire relative au maintien de la continuité pédagogique, laquelle a été organisée sous la responsabilité des directeurs d’école et des chefs d’établissement avec le concours des enseignants, en s’appuyant notamment sur les espaces numériques de travail, les ressources du Centre national d’enseignement à distance ainsi que d’autres formules mises en place localement afin d’assurer le lien entre les élèves et les professeurs. Nous avons aussi développé avec France Télévisions des modules d’enseignements disponibles en cas de fermeture plus massive des établissements scolaires.
Troisième direction, enfin : la vaccination des enfants et adolescents en âge scolaire sur la base des recommandations du Haut conseil de la santé publique rendues publiques le 7 septembre 2009. Cette vaccination a été engagée pour deux raisons principales : les enfants étaient particulièrement touchés par le virus – parfois par des formes virulentes – et l’enceinte scolaire constitue un lieu privilégié de transmission. De plus, les enfants en âge scolaire figuraient dans la liste des publics prioritaires annoncée par le Premier ministre le 24 septembre 2009. La campagne de vaccination a donc été lancée dans les établissements dès que les vaccins ont été disponibles, le 25 novembre 2009 ; M. Brice Hortefeux, Mme Roselyne Bachelot-Narquin et moi-même l’avions préparée début novembre en envoyant aux préfets de département ainsi qu’aux recteurs et inspecteurs d’académie une circulaire interministérielle datée du 9 novembre et publiée au Bulletin officiel de l’éducation nationale le 12 novembre.
Nous avons en l’occurrence distingué deux cas de figure. Dans le premier degré, nous avons considéré que les élèves des écoles maternelles et primaires devaient être orientés, avec leurs parents, dans les centres de vaccination, les collégiens et lycéens ayant quant à eux la possibilité de se faire vacciner au sein même de leurs établissements scolaires à partir du 25 novembre après que les parents avaient rempli un questionnaire médical. Le 19 novembre, j’ai adressé aux chefs d’établissement du second degré une note de service précisant ces modalités d’organisation. J’ajoute qu’entre le 25 novembre et le 18 décembre 2009, 9 250 établissements scolaires ont été visités par une équipe mobile de vaccination et qu’ainsi, à la veille des vacances scolaires, 97 % des élèves « ciblés » s’étaient vus proposer une vaccination.
La circulaire du 23 décembre 2009 relative au dispositif de vaccination dans les établissements scolaires à partir du mois de janvier détaillait par ailleurs les modalités de la seconde campagne de vaccination en direction des personnels et des élèves, laquelle a commencé le 5 janvier 2010. Au total, 458 692 élèves ont été vaccinés, soit 9,1 % des élèves inscrits dans les établissements scolaires et 4 620 agents de l’éducation nationale, soit 0,42 % des personnels. Cette campagne a contribué à protéger une part non négligeable de la population scolaire et à éviter une propagation du virus.
Dès la fin du mois d’août, j’avais nommé auprès de chaque recteur un correspondant académique chargé du dossier de la grippe et des réunions ont eu lieu à plusieurs reprises avant la rentrée ainsi que pendant la pandémie sous l’autorité du haut fonctionnaire de défense, du directeur général de l’enseignement scolaire et du secrétaire général du ministère.
La réunion visant à analyser le retour d’expérience que nous avons organisée le 26 mai dernier avec l’ensemble des correspondants témoigne, tout d’abord, de la prégnance des inégalités sociales face à la politique de santé publique : les vaccinations ont ainsi été plus nombreuses dans le sud et l’ouest de la région parisienne que dans le nord ou dans l’est, dans les lycées généraux et technologiques que dans les lycées professionnels. À l’avenir, nous devrons donc engager des actions ciblées auprès des publics les plus fragiles comme y invite d’ailleurs déjà le « plan Santé » sur lequel nous travaillons avec Mme Roselyne Bachelot-Narquin et qui sera présenté à la rentrée prochaine. Cette campagne a ensuite montré que les équipes de l’éducation nationale étaient capables de mettre en place un dispositif très complexe sans aucune expérience préalable, ce qui résulte d’une prise de conscience collective des enjeux de santé publique, mais également d’une forte mobilisation de nos personnels de santé, administratifs, techniques ou enseignants. Non seulement la quasi-totalité de nos médecins – environ 1 300 – et de nos personnels infirmiers – environ 6 700 – a participé aux campagnes de vaccination au sein des établissements scolaires, mais nombre d’entre eux ont été réquisitionnés par les préfets pour vacciner dans les centres de vaccination. Enfin, je tiens également à saluer le travail accompli par les chefs d’établissement et, plus généralement, par nos personnels qui ont veillé à l’organisation logistique de la campagne et à l’accueil des équipes mobiles de vaccination.
M. le président Jean-Christophe Lagarde. La commission d’enquête vise également à trouver des pistes afin d’améliorer les futurs plans de prévention et de lutte contre la pandémie grippale puisqu’il est, hélas, à craindre que des situations de ce type ne manqueront pas de se reproduire.
Vous avez donné des éléments sur le nombre de personnes qui ont été vaccinées, mais le fait que les personnels de l’éducation nationale et ceux des collectivités territoriales ne fassent pas partie des publics prioritaires n’a-t-il pas favorisé un manque d’adhésion à cette campagne ? C’est d’autant plus étonnant que, dans le secteur hospitalier, les familles des praticiens se sont vues elles-mêmes proposer une telle vaccination.
En outre, en qualité d’élu local, j’ai vu diffuser sur internet des informations complètement folles à destination des fédérations de parents d’élèves : les enfants seraient contraints de se faire vacciner sans que l’autorisation des parents ne soit nécessaire, etc. M. Thierry Saussez, directeur du service d’information du Gouvernement, a expliqué lors de son audition que l’État ne disposait peut-être pas, en l’occurrence, de tous les moyens ou de la réactivité nécessaires pour faire face à des rumeurs aussi délirantes.
J’ajoute que le document de quatre pages que vous nous avez remis semble remarquablement mieux fait que celui communiqué par le service d’information du Gouvernement. A-t-il été diffusé par le Gouvernement à 12 millions d’exemplaires ou était-ce aux établissements de l’imprimer ? Aucun de mes enfants en âge scolaire, en effet, ne me l’a apporté… Le questionnaire de vaccination, quant à lui, était complexe et inadapté, en particulier pour les classes populaires.
Enfin, combien d’infirmières ou de médecins scolaires ont-ils été réquisitionnés dans les centres de vaccination avant, voire après le 25 novembre ?
M. le ministre. La question des publics prioritaires a été débattue au sein de la cellule interministérielle de crise. Dans un premier temps, nous avons décidé de ne pas proposer la vaccination aux professeurs tant que nous ne disposions pas d’un nombre de vaccins suffisant. Outre que l’éducation nationale emploie un million d’agents, les vaccins arrivaient alors, si j’ose dire, au compte-gouttes et les experts en santé publique rappelaient systématiquement que le virus touchait en particulier les enfants.
En ce qui concerne la communication et l’information, on n’en fait jamais assez et sans doute aurions-nous pu mieux faire. Nous sommes d’ailleurs déçus par le faible nombre d’enfants et d’enseignants vaccinés compte tenu de l’ampleur du dispositif qui avait été mis en place. Parce que je tenais absolument à ce que les parents soient informés dès la rentrée, le document de quatre pages a quant à lui été élaboré en quinze jours après la première réunion, le 17 juillet, de la cellule ministérielle de l’éducation nationale regroupant le secrétaire général, le directeur de l’enseignement scolaire, le directeur de l’encadrement, le haut fonctionnaire défense, le directeur de la communication et l’ensemble de mon cabinet. Imprimé par nos soins à 12 millions d’exemplaires au début du mois d’août, il a été diffusé dans l’ensemble des académies puis dans chaque établissement. La circulaire de rentrée à laquelle j’ai fait allusion dans mon propos liminaire prévoyait qu’une distribution serait faite auprès de chaque élève le jour même de la rentrée. Certes, ce document n’est pas parfait mais nous avons essayé de résumer simplement les questions et les réponses qui pouvaient être formulées. Parce que le questionnaire de vaccination, quant à lui, était sans doute en effet trop complexe, notre ministère y a ajouté une fiche d’information plus accessible et pratique.
Enfin, ce sont bien environ 2 000 personnels de l’éducation nationale qui ont été réquisitionnés dans les centres de vaccination – 1 500 infirmières et 500 médecins (153)– en dehors de leur temps de service et, donc, en soirée ou en fin de semaine. Nous n’avons pas, si j’ose dire, déshabillé Pierre pour habiller Paul.
M. le président Jean-Christophe Lagarde. Je vous invite à vérifier cette information, monsieur le ministre, car – comme ce fut le cas dans ma bonne ville de Drancy – des personnels de santé scolaires ont bel et bien été réquisitionnés en journée, sur leur temps de travail. Le retour d’expérience en la matière, vous l’imaginez aisément, n’a pas été très positif.
M. le ministre. Je vous ai communiqué la règle générale en vigueur mais il y avait une exception prévoyant que, avec l’accord des autorités académiques, les personnels de santé de l’éducation nationale pouvaient être mis à disposition des préfets. Quoi qu’il en soit, à ma connaissance, aucun système de vaccination au sein des établissements scolaires n’a souffert de la réaffectation de ces personnels dans les centres de vaccination.
M. le président Jean-Christophe Lagarde. Certes, mais il n’en a pas été de même, par exemple, de la diffusion de moyens contraceptifs comme la « pilule du lendemain ». Cela dit, il y a des priorités.
M. Jean-Pierre Door, rapporteur. Combien de voyages scolaires ont-ils été annulés ?
Quelles réactions avez-vous recueillies de la part des fédérations de parents d’élèves ?
Par ailleurs, un syndicat de personnels infirmiers scolaires – dont nous avons d’ailleurs auditionné un représentant – ayant diffusé un document selon lequel la vaccination des enfants était inutile, comment ne pas comprendre leur relative abstention ?
Enfin, une véritable culture de la santé publique ne nous fait-elle pas défaut ? Ne serait-il pas opportun d’introduire un module d’éducation dédié au sein de l’enseignement scolaire ?
M. le ministre. Je ne suis pas en mesure, monsieur le rapporteur, de vous donner le nombre exact d’annulations de voyages scolaires sur les 11 000 établissements publics d’enseignement.
M. le président Jean-Christophe Lagarde. D’autant que certains voyages ont été annulés à l’initiative de collectivités locales.
M. le ministre. Nous avons assurément reçu à plusieurs reprises les fédérations de parents d’élèves et nous les avons associées à chacune de nos décisions, notamment en ce qui concerne le système de vaccination. C’est dans ce cadre que nous sommes convenus que les parents accompagneraient dans les centres de vaccination les enfants du premier degré et que les élèves du second degré seraient vaccinés au sein des établissements. Par ailleurs, les fédérations nous ont alertés à plusieurs reprises sur l’insuffisance des informations disponibles alors que, je le répète, on n’en fait jamais trop en la matière. Nous avons en effet eu beaucoup de difficulté pour toucher certaines familles assez rétives à l’endroit de l’école, ce qui contribue d’ailleurs à expliquer la faiblesse du nombre de vaccinations.
En outre, je tiens à souligner le sens des responsabilités dont a fait preuve l’immense majorité des personnels de santé. Si je ne suis pas quant à moi responsable des propos de tel ou tel responsable syndical, je me suis tenu à prendre et à faire appliquer des décisions, dans un cadre interministériel ou non, à partir de constats établis par des autorités nationales ou internationales en matière de santé.
Enfin, l’éducation à la santé fait d’ores et déjà partie du socle commun de connaissances et de compétences nécessaires, mais sans doute la préparation du « plan Santé » peut-elle être l’occasion d’améliorer encore l’enseignement de l’hygiène et l’éducation à la santé, dans le premier degré en particulier.
M. le président Jean-Christophe Lagarde. Sans doute cela aurait-il également l’avantage de mieux impliquer le personnel de l’éducation nationale.
Qu’en a-t-il été de la vaccination des jeunes majeurs dans les lycées ?
M. le ministre. Ils n’ont pas eu besoin de l’autorisation parentale, bien entendu.
M. Jean-Paul Bacquet. Je n’évoquerai pas la question de la gestion de la crise avec vous, monsieur le ministre, car ce n’était pas à vous d’évaluer la nature du risque auquel nous étions confrontés, non plus que de décider ou pas de l’application du principe de précaution. Je considère quant à moi que vous avez bien fait ce que vous deviez faire avec les moyens dont vous disposiez.
S’agissant du retour d’expérience, avez-vous été informé de la campagne de vaccination de masse qui a eu lieu il y a quelques années dans le Puy-de-Dôme en raison d’une épidémie de méningite ? C’est d’autant plus important que les anomalies que nous avons constatées l’automne dernier sont les mêmes que celles qui avaient été signalées jadis.
Par ailleurs, la présence d’inégalités culturelles et sociales en matière de santé est révélatrice de la différence de perception du corps qu’ont les milieux familiaux, ce qui ne manque pas d’avoir des incidences sur le nombre de vaccinations et, plus généralement, sur ce que j’appellerais la « nature » de notre politique de santé publique… si elle existait, notamment en matière de prévention. Si tel était le cas, en effet, les familles accepteraient sans doute certaines contraintes. Je rappelle, tout de même, que la tuberculose a été éradiquée grâce aux vaccins et aux radios obligatoires et que cela n’aurait sans doute pas été le cas si le volontariat avait été de rigueur. Il est vrai qu’en ce temps-là le courage politique ne faisait pas défaut…
Enfin, quid de l’absence – sauf en fin de crise – de la médecine libérale dans cette campagne de vaccination, tant dans le milieu scolaire qu’à l’extérieur, d’autant plus que le nombre de médecins scolaires est bien trop réduit ? Quelles mesures conviendrait-il donc de prendre, à l’avenir, pour être plus crédibles et efficaces ?
M. le ministre. Je vous remercie pour vos propos liminaires.
S’agissant de la campagne de vaccination, le correspondant académique de Limoges – il est vrai que ce n’est pas celui de Clermont-Ferrand –, a indiqué lors de la réunion du 26 mai 2010 que 80 % des élèves de cette académie avaient été vaccinés suite au retour d’expérience qui avait eu lieu sur un risque de contagion de méningite.
Par ailleurs, je me souviens, en effet, de la visite médicale annuelle qui était naguère en vigueur dans les établissements scolaires. Elle est aujourd’hui obligatoire aux âges de six, neuf, douze et quinze ans mais, dans les faits, seule celle des six ans est suivie. Nous travaillons à cette question avec Mme Roselyne Bachelot-Narquin dans le cadre du « plan Santé ». Quoi qu’il en soit, l’insuffisance de l’accompagnement médical est aujourd’hui patente, nombre d’enfants défavorisés ayant rarement l’occasion de voir un médecin de famille.
M. Jean Mallot. Les statistiques relatives à la vaccination des agents auxquelles vous avez fait allusion concernent-elles seulement ceux dont le statut relève de l’éducation nationale ?
Par ailleurs, quelles sont les principales différences entre les plans contre le virus A(H5N1) et la grippe A(H1N1) ? Avez-vous rencontré des difficultés spécifiques dans le passage de l’un à l’autre ?
Comment expliquer la différence entre la ligne de conduite du ministre de l’éducation nationale et porte-parole du Gouvernement – ni dramatiser, ni sous-estimer – et celle du directeur du service d’information du Gouvernement – maximiser l’importance de la crise et la piloter en fonction des connaissances ?
Enfin, comment lutter au sein des établissements scolaires contre les inégalités sociales dans le domaine de la santé publique, de l’éducation et de la prévention ?
M. le ministre. Les statistiques que j’ai mentionnées concernent l’ensemble des agents de l’éducation nationale, quel que soit leur statut.
En ce qui concerne les deux plans, plusieurs dispositifs communs pourront être ou ont été utilisés, respectivement le recours aux ressources pédagogiques afin d’assurer la continuité du service public de l’éducation, l’utilisation de masques FFP2 pour les personnels de santé, ainsi que le processus spécifique de fermeture de classes ou d’établissements après avis des autorités sanitaires au-delà de trois cas diagnostiqués (154).
M. Jean Mallot. Quid des processus de décision entre les ministères de l’éducation nationale, de l’intérieur et de la santé ?
M. le ministre. Je ne pense pas qu’une cellule interministérielle pilotée par le ministère de l’intérieur ait été mise en place lors de l’épisode de la grippe dite aviaire, à la différence de ce que nous avons donc fait à la demande du Président de la République et du Premier ministre contre la grippe A(H1N1).
En matière de communication, je maintiens mes propos : la ligne du Gouvernement, jusqu’au plus haut niveau, n’a jamais variée et je m’y suis quant à moi toujours conformé. Nous n’avons donc voulu ni dramatiser ni sous-estimer la crise tout en jugeant aussi que, sur ce plan-là, on n’en fait jamais assez. Je vous avoue même que j’ai eu quelques déconvenues avec la presse au début de la campagne, considérant qu’elle avait donné trop de relief à notre communication en dramatisant la situation. En bref, nous avons tenu à ne pas faire peur tout en étant très mobilisés.
En ce qui concerne les inégalités sociales et compte tenu de ce que je vous ai dit précédemment sur le fait que peu de familles défavorisées se rendent chez le médecin, sans doute pourrions-nous œuvrer à un renforcement des visites médicales dans les établissements, en zone d’éducation prioritaire en particulier.
M. le président Jean-Christophe Lagarde. N’est-il pas possible d’opérer un croisement de fichiers avec les caisses primaires d’assurance maladie comme cela se fait déjà pour les enfants de zéro à trois ans avec le suivi de la protection maternelle et infantile ? Si certains enfants ne voient jamais de médecins, d’autres y vont dix fois par an et je ne suis pas sûr que, pour eux, la médecine scolaire soit indispensable.
M. le ministre. Déjà que l’on m’accuse de trop utiliser les fichiers internes à l’éducation nationale !
Plus sérieusement, il est toujours possible de travailler sur cette question mais il n’en reste pas moins que nombre d’enfants ne rencontrent que le médecin scolaire.
M. le président Jean-Christophe Lagarde. Précisément, ce ne sont pas ceux qui voient dix fois un médecin dans l’année qu’il faut cibler !
M. Guy Lefrand. Disposez-vous de données précises quant aux difficultés liées à la réquisition des personnels de santé de l’éducation nationale, certaines adolescentes n’ayant pas pu bénéficier, par exemple, de la « pilule du lendemain » ?
Par ailleurs, pensez-vous que les équipes pédagogiques et sanitaires aient joué un rôle déterminant dans les réticences à l’endroit de la vaccination ? Il serait d’autant plus étonnant que des pédagogues n’aient pas su faire montre de force de conviction en la matière que la vaccination était hautement recommandée.
M. le ministre. Comme vous, j’ai entendu qu’un syndicat soutenait que des infirmières avaient été dans l’impossibilité d’effectuer leurs missions de base. Peut-être en
a-t-il été en effet ainsi temporairement – quoique je n’aie pas eu écho de drames qui seraient survenus pour cette raison – mais j’assume quant à moi une hiérarchie des priorités. Que n’aurait-on dit si nos personnels de santé n’avaient pas été mobilisés !
En outre, je ne crois pas que les personnels de l’éducation nationale se soient opposés à cette campagne et je n’ai en tout cas pas eu le sentiment d’être confronté à une fronde syndicale. Ils ont réagi à l’image de l’ensemble des Français et lorsqu’ils ont eu la possibilité de se faire vacciner, au mois de janvier, la pandémie refluait déjà, ce qui explique une moindre demande de vaccination.
M. Guy Lefrand. Quelles ont été les relations interministérielles pendant la mise en œuvre du plan et, en particulier, entre votre ministère et celui de l’intérieur ?
M. le ministre. Il n’y a jamais eu de désaccord ni de divergences quant aux objectifs en matière de vaccination.
Mme Catherine Lemorton. Monsieur le président, la perception qu’un médecin ou un professionnel de santé peut avoir d’un enfant change parfois selon que ce dernier est vu ou non dans un cadre scolaire et sans ses parents. Je parle d’expérience.
Je me permets de vous citer un extrait d’une circulaire du Centre national de la recherche scientifique, datée du mois de janvier dernier, concernant le retour d’expérience dans les collectivités d’outre-mer :
« De même, une partie des mesures barrières prévues par le plan n’a pas eu à être mise en œuvre. De ce fait, une partie des instructions adoptées dans ce cadre pour limiter la propagation du virus a pu être analysée comme excessive, d’autant plus qu’elles sont intervenues outre-mer alors que le pic pandémique était déjà passé. L’exemple le plus marquant est celui des mesures préventives de fermeture de classe ou d’école dès lors que des cas suspects de grippe A(H1N1) étaient recensés. Au cours du mois d’août 2009, période de rentrée des classes pour les territoires du Pacifique, alors que la vague pandémique était au plus haut dans ces territoires, les autorités locales ont dans un premier temps appliqué strictement les recommandations nationales. Elles ont très vite abandonné cette rigueur car la fermeture systématique de classes générait des conséquences sociétales importantes et injustifiées au regard de la réalité de la situation sanitaire. »
Je tiens à ce propos à saluer également certains préfets qui, en métropole, n’ont pas toujours appliqué les mesures rigoureuses qui avaient été préconisées dès le mois de juillet. Le préfet de la région Midi-Pyrénées, en concertation avec les fédérations de parents d’élève, les professeurs et l’ensemble des agents concernés de l’éducation nationale, a ainsi justement décidé de ne pas fermer des établissements où 10 % des élèves étaient atteints par le virus A(H1N1), la contamination se poursuivant de toute façon dans les lieux collectifs d’habitation comme, par exemple, les immeubles. Pourquoi n’a-t-il donc pas été tenu compte de ces retours d’expérience ?
Par ailleurs, monsieur le ministre, je confirme que dans des lycées et des collèges où l’on dénombre une seule infirmière pour 1 500 élèves, la réquisition de cette dernière a entraîné la fermeture de l’infirmerie pour plusieurs jours alors qu’il est en l’occurrence plus urgent de donner un certain type de contraceptif que de vacciner contre une grippe dont on savait, avec le recul, qu’elle était moins virulente que prévu.
Enfin, ne pensez-vous pas que notre modèle sanitaire est tellement marqué par le colloque singulier entre parents et enfants, d’une part, et médecin libéral, d’autre part, que toute volonté politique de mettre en œuvre, par exemple, une vaccination commune dans des gymnases – fût-ce dans le cas d’une grave pandémie – n’est plus envisageable ? Je rappelle, de surcroît, que l’épisode de la vaccination contre l’hépatite B a laissé des traces chez les syndicats de personnels médicaux et paramédicaux mais, également, de l’enseignement ainsi que chez les parents et dans l’ensemble de la population.
M. le ministre. Vos propos constituent un véritable plaidoyer pour la méthode que nous avons retenue : un seuil de malades a été défini par les autorités sanitaires à partir duquel les préfets pouvaient décréter la fermeture de classes ou d’établissements scolaires, étant entendu qu’à partir d’un certain stade de contamination, cette fermeture ne jouait plus en effet son rôle préventif – à La Réunion, par exemple, l’épidémie est survenue dès la rentrée et la propagation a été très rapide ; la marge de manœuvre dont disposaient les préfets a donc été très utile en fonction des situations.
Par ailleurs, je vous laisse la liberté de vos propos, madame la députée, quant aux missions prioritaires des infirmières scolaires. Quoi qu’il en soit, je prends note de la situation que vous avez décrite même si elle ne correspond pas aux informations dont je dispose. Je le répète : la règle générale était celle de la réquisition en dehors des heures de service, les exceptions éventuelles étant soumises à l’accord des autorités académiques (155).
Enfin, la cellule interministérielle de crise a retenu un système collectif de vaccination – et de conditionnement collectif des vaccins – à la demande du ministère de la santé afin de vacciner le plus possible de personnes dans un minimum de temps compte tenu du faible nombre de doses dont nous disposions. Je suis d’autant moins certain qu’il ait été la cause d’un frein à la vaccination que, pour les élèves du second degré, celle-ci se déroulait au sein même des établissements scolaires.
Mme Catherine Lemorton. Il n’en reste pas moins que la vaccination échappant de la sorte au contrôle des parents – les fédérations de parents d’élèves en ont d’ailleurs fait le reproche au Gouvernement – et le rôle de la médecine libérale étant de plus en plus important, je m’interroge sur le succès des vaccinations collectives en cas de grave pandémie.
M. le ministre. L’exemple de l’académie de Limoges que je vous ai donné semble prouver que vous êtes sans doute trop pessimiste.
M. le président Jean-Christophe Lagarde. L’expérience d’un cas de méningite d’origine bactériologique et non virale, donc non contagieuse, que j’ai vécue, m’amène à penser que les demandes de vaccination peuvent tout à fait être massives de la part des parents.
M. Patrice Debray. L’organisation sanitaire de la vaccination dans l’éducation nationale a été selon moi exemplaire, à la différence de ce qui s’est passé dans le secteur libéral ou dans les centres de vaccination publics. Il n’en reste pas moins que les statistiques du nombre de personnes finalement vaccinées sont désastreuses, en particulier s’agissant des agents de l’éducation nationale et des élèves mais, également, du corps médical libéral ou hospitalier. Sans doute conviendra-t-il de s’interroger à ce propos.
De plus, nous savons tous que, pour éviter de franchir le seuil épidémique, il importe de vacciner rapidement le plus grand nombre possible de personnes saines et à risque. Sachant que les chercheurs travaillent sur les prochaines mutations du virus jusqu’au stade dit H5N1, il me semble qu’en cas de résurgence, la vaccination devrait être obligatoire pour s’inscrire dans un établissement scolaire, comme ce fut jadis le cas de la vaccination contre la poliomyélite, la variole ou la diphtérie.
M. le ministre. Une telle décision, vous le comprendrez, dépasse le périmètre du ministère de l’éducation nationale, relève des plus hautes politiques et sanitaires et devrait s’inscrire dans le cadre d’un plan Santé national.
M. Patrice Debray. Je rappelle à Mme Catherine Lemorton que les seules victimes de cette grippe ont été des adolescents entre quinze et vingt ans dont la plupart ne faisait pas partie d’une population à risque. En outre, sachant qu’il n’est pas plus dangereux de se faire vacciner contre la grippe A(H1N1) que contre la grippe saisonnière, nous avons tout intérêt à réfléchir aux situations à venir, lesquelles pourraient être beaucoup plus dramatiques.
M. le président Jean-Christophe Lagarde. Comme me l’a dit en aparté M. le rapporteur, nous avons deux médecins, MM. Bernard Debré et Patrice Debray, dans la commission : leurs avis sont pourtant opposés !
Les 458 692 élèves vaccinés auxquels vous avez fait allusion, monsieur le ministre, l’ont bien été en milieu scolaire ?
M. le ministre. En effet.
M. le président Jean-Christophe Lagarde. Je vous remercie.
La séance est levée à dix-sept heures quarante.
Audition de M. Brice Hortefeux,
ministre de l’intérieur, de l’outre-mer et des collectivités territoriales
(Procès-verbal de la séance du mercredi 16 juin 2010)
(Présidence de M. Jean-Christophe Lagarde, président de la commission d’enquête)
La séance est ouverte à dix-huit heures trente.
M. le président Jean-Christophe Lagarde. Monsieur le ministre de l’intérieur, je vous remercie d’avoir répondu à l’invitation de notre commission d’enquête. Je vous remercie d’autant plus que vous avez dû aujourd’hui même vous rendre dans les régions du sud-est de la France touchées par de dramatiques inondations. Vous avez parfaitement compris l’importance de cette audition, la dernière de la commission d’enquête d’ailleurs, puisque nous achevons avec vous notre cycle de travaux publics commencé à la fin du mois de mars.
Il ne s’agit pas, à ce stade, de reprendre l’analyse du rôle du ministère de l’intérieur, mais d’approfondir certains points et surtout de connaître les leçons que vous avez tirées de la campagne de vaccination : vous avez en effet animé la cellule interministérielle de crise et votre ministère a notamment eu la charge de la partie logistique de la campagne de vaccination.
Je vous propose de débuter par un bref exposé sur le bilan que vous tirez de la campagne de vaccination, des difficultés que vous avez pu rencontrer et des leçons que vous en tirez pour l’avenir, puis nous procéderons à un échange de questions et de réponses.
(M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales, prête serment.)
M. Brice Hortefeux, ministre de l’intérieur, de l’outre-mer et des collectivités territoriales. Merci, monsieur le président, d’avoir accepté de décaler légèrement cette audition. Je me suis en effet rendu dans le Var, où l’on déplore à l’heure où je vous parle dix-neuf personnes décédées et une douzaine de disparus. J’ai pu néanmoins constater la parfaite coordination entre élus locaux, militaires, sécurité civile, gendarmerie et police. L’opinion publique ne sait pas toujours que nous devons prévoir des effectifs lourds afin d’éviter que les particuliers, les entreprises et les centres commerciaux ne soient victimes de pillage ou de vandalisme. Le ministère de l’intérieur a affecté à cette seule mission de sécurisation 375 des 1 600 personnes mobilisées sur le terrain.
Je réponds à votre invitation à la fois comme responsable de la cellule interministérielle de crise et comme ministre de l’intérieur, chargé de l’administration préfectorale, de la sécurité civile et de l’ordre public. Je n’interviendrai donc pas sur les questions épidémiologiques ni sur les arbitrages purement sanitaires. Vous avez déjà reçu, pour cela, la ministre de la santé et des sports ainsi que les experts concernés.
J’attache une grande importance aux travaux que vous avez engagés. Nous poursuivons un objectif commun : assurer la sécurité de nos concitoyens. Comme vous l’avez dit, nous devons tirer les leçons de cette expérience pour être, à l’avenir, plus opérationnels, plus efficaces et plus réalistes dans l’élaboration et la mise en œuvre de nos plans d’action contre les pandémies.
Nous nous étions dotés d’une doctrine reposant sur trois piliers. L’anticipation, tout d’abord, ce dont témoignent toutes les initiatives prises à compter de la fin du mois d’avril 2009. L’endiguement ensuite, pour contenir le virus et diminuer le plus possible les risques de propagation. L’adaptation enfin, c’est-à-dire une réponse qui se voulait proportionnée à l’importance de la situation mais aussi équilibrée au regard des contraintes qu’une telle pandémie faisait peser sur la vie sociale.
Nous avons tout d’abord anticipé la crise grâce à un réseau d’alerte éprouvé.
Sur le plan international, et en dépit des lourdes critiques émises par certains – les « y’a qu’à » et les « faut qu’on », toujours très faciles –, l’Organisation mondiale de la santé a constitué la référence scientifique constante de notre action. Du reste, même les plus critiques n’ont jamais proposé de solution alternative...
Le 24 avril 2009, nous avons été alertés par l’Organisation mondiale de la santé de l’émergence d’un nouveau virus de la grippe A(H1N1) susceptible de se transmettre d’homme à homme.
Dès le 30 avril, la cellule interministérielle de crise, présidée par mon prédécesseur, Mme Michèle Alliot-Marie, s’est réunie à la demande du Premier ministre afin de mettre en œuvre les préconisations de l’Organisation mondiale de la santé, seule institution de référence dans ce domaine.
Au niveau national, c’est l’Institut de veille sanitaire qui nous a alertés lorsque la métropole est passée, le 9 septembre 2009, au-dessus du seuil épidémique de la grippe – c’est-à-dire 90 cas pour 100 000 habitants. Nous suivions déjà la situation en outre-mer, où le seuil épidémique était déjà dépassé depuis plusieurs semaines.
Au-delà de ce réseau d’alerte, nous disposions des outils élaborés quelques années plus tôt en prévision d’une pandémie de grippe A(H5N1).
L’intérêt manifesté par le Parlement a constitué une assistance précieuse face à cette crise. Je pense, notamment, au travail mené par la mission d’information parlementaire présidée par M. Jean-Marie Le Guen et dont le rapporteur était M. Jean-Pierre Door.
C’est donc le plan de prévention et de lutte contre la pandémie grippale du 20 février 2009 qui a servi de base pour faire face au nouveau virus de la grippe A(H1N1).
Grâce à cette anticipation de la crise, nous avons pu apporter une réponse en temps réel à l’évolution de la situation épidémiologique.
Comme ministre de l’intérieur, j’ai veillé en priorité à protéger les personnels placés sous mon autorité et à mettre en œuvre le plan de continuité d’activité du ministère. J’ai également veillé à assurer l’ordre public, c’est-à-dire à prévenir les troubles potentiels, protéger l’unique site de production français de vaccins et sécuriser les transports de doses de vaccins, de masques de protection et d’antiviraux (rétrospectivement, certains pourraient en sourire mais je vous garantis qu’à l’époque il n’était pas question de sourire : toutes les menaces étaient envisageables, qu’elles émanent d’éléments nationaux ou de services de pays n’ayant pas les moyens scientifiques et techniques pour produire un vaccin). Enfin, j’ai veillé à animer, informer et conseiller les collectivités territoriales, en particulier pour ce qui concerne les centres de vaccination.
En tant que président de la cellule interministérielle de crise, j’ai assuré l’animation, la coordination et la mise en œuvre interministérielle de ces mesures, par délégation du Premier ministre.
Au début du mois de juillet 2009, le Président de la République a demandé que l’on accélère la mise en place du dispositif. J’ai donc réuni le 3 juillet, place Beauvau, la cellule interministérielle de crise. À partir de cette date et jusqu’à la fin de la crise, s’est tenue, chaque mercredi et sans interruption, même pendant la trêve estivale, une réunion hebdomadaire. Au total, la cellule s’est réunie quarante-trois fois et toujours au plus haut niveau puisque j’ai exigé, après certains tâtonnements, que soient présents les ministres et les secrétaires d’État concernés ou, en leur absence, leur directeur de cabinet ou leur secrétaire général. J’ai personnellement présidé plusieurs de ces réunions, dont celle du 27 août qui a réuni pas moins de sept ministres et secrétaires d’État.
Entre les mois d’avril 2009 et de janvier 2010, nous avons élaboré plus de quarante circulaires interministérielles à l’intention des préfets. Chaque fois, nous avons apporté un soin particulier à ce que les décisions soient immédiatement efficaces et opérationnelles tout en veillant à adapter en permanence notre action à la réalité de la situation.
Le nombre de circulaires ne doit pas étonner. En dépit de l’image d’unité que donne le corps préfectoral, il faut savoir qu’il existe une grande disparité : certains préfets avaient une longue carrière derrière eux et connaissaient tous les rouages de l’État ; d’autres, en poste dans des territoires plus petits, n’avaient pas cette expérience et étaient très heureux de recevoir des instructions précises.
Nous avons élaboré l’architecture générale de notre gestion de crise en fonction de plusieurs critères : les modalités de la campagne de vaccination ; les conséquences de l’intégration, à partir de juillet 2009, de la médecine ambulatoire dans la prise en charge des malades ; la gestion de l’apparition de cas groupés de grippe, en particulier dans des cadres de vie collective – les mesures d’isolement que nous avons prises lors de la première alerte, dans une colonie de vacances à Megève, se sont révélées adaptées ; la gestion des grands rassemblements, culturels ou sportifs, dont l’annulation supposait une appréciation poussée, des comparaisons internationales, etc. ; la prise en compte des spécificités de l’outre-mer, où la pandémie était partie en flèche ; l’organisation des services de l’État et des autres services publics en situation de pandémie pour réussir à concilier le plus haut niveau d’activité possible avec la protection de la santé de nos compatriotes. Il fallait élaborer, pour chaque administration, un plan de continuité d’activité et ce fut très difficile à obtenir.
Dans la phase de gestion de la crise, nous avons articulé notre action autour de trois mesures.
Nous avons, d’abord, cherché à protéger les publics les plus vulnérables selon l’Organisation mondiale de la santé, à savoir les jeunes. Par la circulaire interministérielle du 21 août 2009, il a été décidé, en collaboration étroite avec le ministre de l’éducation nationale, de fermer les classes dans lesquelles étaient recensés plus de trois cas de grippe A(H1N1). Cette mesure, dont nous avions pu tester l’efficacité pendant l’été avec les fermetures des centres de vacances et l’isolement immédiat des enfants susceptibles d’être atteints, a constitué une barrière particulièrement efficace à la contamination massive. De surcroît, ces fermetures n’ont pas entraîné de perturbation majeure du service public de l’éducation nationale. Sur les 66 000 établissements implantés sur le territoire national, moins de 1 % ont été intégralement fermés ou ont fait l’objet de fermetures de classes.
Il convenait également de veiller à assurer la continuité de l’activité économique et sociale du pays. Les conséquences sanitaires du virus, tout comme ses retombées sur notre vie collective, économique et sociale, demeuraient imprévisibles. Nous n’avions pas d’exemple auquel nous référer. Pendant plusieurs semaines, le niveau de notre activité aurait pu être fortement ralenti. Il était donc de notre devoir de préparer les Français à cette éventualité. Les consignes ont été rappelées pour que toutes les administrations d’État se dotent d’un plan de continuité d’activité. Les collectivités territoriales, les opérateurs publics et privés et les grandes entreprises ont également été sensibilisés. Tous les ministères ont élaboré un plan de ce type, ainsi que les grandes entreprises – en particulier celles responsables de la gestion des réseaux – et la plupart des grandes collectivités territoriales.
Enfin, la mesure la plus importante a consisté à organiser une campagne de vaccination collective.
De l’avis unanime des experts, la vaccination constituait le plus sûr moyen de casser la dynamique de l’épidémie en protégeant de la contagion la personne vaccinée et en contribuant, par ricochet, à la protection de son entourage. Nous nous sommes donné un objectif ambitieux : être capables, en quatre mois, de vacciner 40 millions de personnes.
Pour atteindre cet objectif, nous nous sommes dotés d’un réseau dense de centres de vaccination. Afin d’assurer le meilleur maillage territorial, nous avons retenu comme critère que chaque centre devait correspondre à un bassin de population à vacciner n’excédant pas 100 000 personnes et que chaque département devait compter au moins trois centres de vaccination.
Je tiens à rappeler – c’est un choix qui, à l’évidence, mérite réflexion pour l’avenir – que pour créer ces centres de vaccination et les armer du personnel nécessaire à leur fonctionnement, le principe de base a été celui du volontariat. Le choix des locaux a été fait en concertation avec les collectivités territoriales, au premier rang desquelles les communes et, dans une moindre mesure, les départements. Aucun lieu d’implantation de centre de vaccination n’a été choisi par le préfet sans que le propriétaire – souvent la commune – n’ait été favorable à sa mise à disposition.
La mobilisation des personnels nécessaires au bon fonctionnement des centres s’est heurtée à plusieurs difficultés, en particulier à un très faible volontariat. Peut-être, si la pandémie avait atteint le degré de gravité que l’on craignait, aurait-on assisté à un sursaut collectif ; mais nous avons incontestablement rencontré un problème.
S’agissant des personnels administratifs, nous avons diffusé des instructions nationales pour mobiliser non seulement les personnels territoriaux, mais également les personnels de l’État en fonction dans les services déconcentrés, par instruction du Premier ministre du 3 décembre 2009.
La question des conditions de fonctionnement des centres de vaccination s’est également posée. Pour éviter les deux écueils opposés d’une extrême rigidité ou d’une trop grande disparité de fonctionnement d’un département à l’autre, nous avons défini, dans un premier temps, un cadre délimitant le système de base des jours et heures d’ouverture, tout en laissant des marges d’appréciation aux préfets en matière d’organisation. Ce n’est que dans un second temps, à partir du mois de décembre, qu’un régime particulier, notamment dominical, est apparu en Île-de-France et dans certaines grandes agglomérations.
J’en viens aux réquisitions. Ce régime juridique visait, avant tout, à protéger juridiquement les agents concernés, volontaires ou non, en jouant sur le transfert de responsabilité auprès de l’autorité requérante, à savoir l’État. C’est uniquement au mois de décembre qu’il a été procédé à des réquisitions de façon unilatérale, pour faire face à la défaillance du volontariat.
En termes d’ordre public, il était également essentiel de s’assurer que seuls les centres de vaccination soient correctement approvisionnés en doses de vaccins.
En tant que ministre de l’intérieur et donc de l’ordre public, j’ai personnellement veillé à la sécurisation de la production et de l’acheminement des doses de vaccins. J’ai reçu, en juillet, les dirigeants de l’usine Sanofi-Aventis du Val-de-Reuil, seul site français de production de vaccin, pour déterminer, avec eux, les mesures à mettre en œuvre. À la suite de cette réunion, une unité de compagnie républicaine de sécurité a assuré, du 27 juillet à la fin du mois de décembre 2009, la sécurisation de ce site. Je le répète, même si cela peut faire sourire aujourd’hui, il existait à l’époque une vraie interrogation.
Dans la continuité de cette action, j’ai assuré, en lien avec les laboratoires GSK et Novartis, nos principaux fournisseurs étrangers, la sécurisation du transport des doses de vaccins sur le territoire national.
Enfin, concernant le partage du coût de cette campagne de vaccination, l’arbitrage interministériel a reposé sur le principe du respect des compétences de chaque ministère. Le ministère de l’intérieur, de l’outre mer et des collectivités territoriales prend donc en charge toutes les dépenses afférentes à l’organisation territoriale de la campagne. Sur les 500 millions d’euros du coût total estimé, il contribue ainsi à hauteur de 91,3 millions d’euros.
Cinq mois après la fin de la campagne de vaccination, l’heure est au bilan. Ce n’est pas une probabilité mais une certitude : dans le futur, nous aurons à faire face à d’autres épisodes pandémiques. L’exercice est donc essentiel.
En dépit des nombreuses difficultés rencontrées, la campagne de vaccination a permis, en moins de trois mois, de vacciner 9 % de la population française. Entre le 12 novembre 2009 et le 30 janvier 2010, les 1 168 centres fixes ont permis de vacciner 4,6 millions de personnes. Si l’on prend en compte les vaccinations de certains personnels particuliers, intervenus en dehors des centres fixes, le nombre de Français vaccinés en douze semaines est de 5,7 millions.
Je vous l’accorde, ces résultats n’ont pas été atteints sans difficultés ni tensions. Au caractère inédit de l’opération se sont, en effet, ajoutées la difficile mobilisation du personnel médical, la mauvaise acceptation du principe des réquisitions administratives, qui, à l’évidence, n’est plus dans les mœurs ou dans l’air du temps, et enfin, la très forte concentration dans le temps de la demande réelle de vaccination.
On peut ainsi distinguer quatre phases au cours de la campagne de vaccination collective.
Lors de la première phase, on a constaté un faible « décollage » de l’activité des centres entre le 12 et le 24 novembre 2009. La fréquentation maximale a été atteinte le 20 novembre avec 68 000 personnes vaccinées.
La deuxième phase s’est caractérisée par une poussée exponentielle puis un maintien à un haut niveau entre le 25 novembre et le 16 décembre. La fréquentation journalière était systématiquement comprise entre 100 000 et 200 000 personnes et le record absolu a été enregistré le 9 décembre avec 197 000 vaccinations.
Lors de la troisième phase, a été observée une décrue progressive liée à l’achèvement de la protection de la population prioritaire, aux congés de fin d’année et à l’allégement concomitant du dispositif entre le 17 décembre 2009 et le 4 janvier 2010.
Enfin, la quatrième phase a été marquée par le maintien de l’ouverture d’un grand nombre de centres en dépit d’une demande de vaccination de plus en plus faible, jusqu’à la fermeture anticipée de tous les centres le 30 janvier.
Au cours de cette campagne, le système des centres de vaccination ad hoc a plutôt fait ses preuves.
Pour ce qui est des horaires d’ouverture, nous avons retiré divers enseignements. Les pics de fréquentation hebdomadaire ont été observés les mercredis et les samedis. L’ouverture des centres le dimanche, mise en œuvre à partir du mois de décembre, répondait à une demande réelle de nos concitoyens ; le préfet de Haute-Normandie avait d’ailleurs anticipé cette mesure car il avait dû gérer auparavant des cas de méningite.
L’inadéquation temporaire observée entre l’offre et la demande à la fin du mois de novembre – dont les médias se sont bien entendu emparés – était, pour une part importante, liée à la fréquentation des centres par des personnes non prioritaires venues sans bon de vaccination et qui ne se préoccupaient manifestement pas du respect des formalités administratives...
M. le président Jean-Christophe Lagarde. Sans doute parce que la faiblesse de la demande entre le 12 et le 24 novembre a poussé les centres à accepter tout le monde. Le bouche à oreille aidant, les personnes qui souhaitaient se faire vacciner s’y sont rendues puisqu’elles savaient qu’il y avait peu de monde.
M. le ministre. C’est juste.
Le quatrième enseignement concerne le plafond théorique de vaccination quotidienne qui se situait, dans le cadre mis en place, autour de 300 000 personnes. Dès lors, le système de vaccination en centres apparaît adapté pour vacciner entre 200 000 et 250 000 personnes par jour sur une longue période, ce qui représente environ 1,5 million de personnes par semaine et de 6 à 8 millions de personnes en un mois.
J’en ai la conviction : la gestion de cette crise a permis à l’État mais aussi à l’ensemble des acteurs d’acquérir une expérience utile. J’ai le souvenir d’une municipalité de ma région où le local s’est révélé trop exigu pour accueillir une population à cran et où le maire, dans les quarante-huit heures, a mis un grand gymnase à disposition. Les collectivités locales ont joué le jeu. Celles qui étaient frileuses au départ ont vite compris que la réponse à la demande des administrés dans ce domaine faisait partie de leurs missions et pouvait leur être utile par la suite.
Parmi les éléments positifs, je relève l’effort d’anticipation sans précédent mené par l’État ; l’expérience d’une crise de longue durée (huit mois, dont quatre bénéficiant d’une couverture médiatique quotidienne forte – dans les trois premières semaines d’août, le quotidien Le Parisien et sa déclinaison provinciale Aujourd’hui ont consacré trois ou quatre unes à ce sujet, signe d’un battage médiatique sans précédent) ; la variété et la complexité des questions logistiques, juridiques, organisationnelles et éthiques posées ; enfin, la prise en compte des enjeux de communication et du rôle joué par internet dans l’évolution de l’opinion publique : les pouvoirs publics ont dû s’adapter et la communication qu’ils ont pratiquée n’a rien à voir avec celle qui était de mise il y a dix ou quinze ans.
Dans un souci permanent de transparence, un point quotidien d’information a été fait par les services du ministère de la santé et du ministère de l’intérieur à compter du début du mois de décembre. J’ai, pour ma part, participé avec la ministre chargée de la santé à six conférences de presse tout au long de la crise.
En dépit du caractère inédit de cette crise et des contraintes techniques inhérentes à une démarche d’une telle ampleur, nous avons respecté l’objectif qui nous était assigné : garantir la meilleure protection possible face à un « adversaire » par nature invisible, évolutif et, disons-le, peu connu.
Je souhaiterais, à cet égard, rendre hommage aux préfets et aux services placés sous leur autorité. Il est de bon ton de les critiquer. Or, je constate qu’on leur demande de plus en plus de choses dans des domaines de plus en plus vastes et complexes où leur responsabilité est de plus en plus souvent engagée. Sollicités pour mettre en œuvre un dispositif complexe dans des délais contraints, ils ont apporté une bonne réponse dans leur très grande majorité. Les quelques motifs d’agacement ont été vite corrigés.
L’objet de votre commission d’enquête est de tirer les leçons de la gestion de cette crise. Il nous faudra, certes, être encore plus performants. Je crois beaucoup à l’approche interministérielle et je pense que le ministère de l’intérieur doit conserver la responsabilité de la cellule de crise : on s’était rendu compte lors de la crise précédente, celle de la canicule, que les seules structures qui fonctionnent sept jours sur sept et vingt-quatre heures sur vingt-quatre sont les autorités préfectorales et les services qui en dépendent. Le ministère de l’intérieur a sans doute une capacité de transmission directe des décisions nationales plus importante que d’autres ministères.
À ceux qui nous ont reproché d’en avoir trop fait, je réponds que je préfère me présenter ainsi devant votre commission d’enquête plutôt que d’entendre : « Vous n’en avez pas assez fait, cela a dérapé et cela a été un drame ». Je n’ai aucun état d’âme sur ce sujet et je suis totalement solidaire des décisions prises par Mme Roselyne Bachelot-Narquin.
Nous avons suivi scrupuleusement les orientations et les avis scientifiques émis par le Haut conseil de la santé publique. Nous avons également toujours agi en fonction des analyses épidémiologiques présentées par les plus hautes instances internationales.
Nous n’en ferons jamais trop au service de la sécurité des Français. Cela ne signifie pas, pour autant, que des adaptations ne doivent pas être apportées par une approche plus souple des situations pandémiques.
Rappelons enfin que la pandémie a tout de même provoqué la mort de trois cent quarante-et-une personnes.
M. le président Jean-Christophe Lagarde. Comme vous l’avez souligné, monsieur le ministre, la raison d’être de cette commission d’enquête est de tirer des enseignements afin de nous préparer le mieux possible à une prochaine crise que nous considérons malheureusement comme certaine.
M. Jean-Pierre Door, rapporteur. Lors de la crise de la grippe aviaire, les premiers rapports évoquaient déjà la question d’un pilotage renforcé via une cellule interministérielle de crise, sans que l’on retienne, alors, nos propositions.
Comme vous, je crois à cette cellule interministérielle de crise. Il faudra sans doute l’améliorer et la renforcer en lui donnant plus de moyens et plus de personnel. Pour m’être rendu au centre opérationnel avenue de Ségur, je sais que l’on doit apporter des améliorations pour faire face à d’éventuelles agressions bactériennes, virales, toxicologiques, etc.
Une des causes de l’échec a été la violence des propos sur internet. La succession rapide de messages et de rumeurs nous a fait entrer dans l’irrationnel. Vous avez indiqué avoir commencé à répondre à ce phénomène à la fin du mois de décembre. C’était sans doute un peu tard. La cellule interministérielle de crise devrait pratiquer une veille informatique afin d’être en mesure d’apporter des réponses immédiates dans ce domaine. Le Centre de prévention et de contrôle des maladies d’Atlanta dispose ainsi d’un service spécial fonctionnant jour et nuit et répondant immédiatement à toutes les rumeurs.
Notre commission d’enquête a remarqué que la déclinaison des circulaires ministérielles dans les préfectures et auprès des élus locaux s’est parfois heurtée à quelques difficultés. Ne conviendrait-il pas de placer auprès de chaque préfet de région ou de zone un référent sanitaire issu des futures agences régionales de santé ?
M. le ministre. L’architecture institutionnelle de la cellule interministérielle de crise remonte au mois de juin 2008 et au Livre blanc sur la défense et la sécurité nationale. Une cellule interministérielle de crise a depuis été aménagée sur deux étages en sous-sol de la place Beauvau, avec toutes sortes de liaisons sécurisées. Je l’inaugurerai très prochainement.
Les questions relatives à internet sont en effet d’apparition récente. Le site pandemie-grippale.gouv.fr a été au cœur de la communication gouvernementale. Le service d’information du Gouvernement, placé auprès du Premier ministre, en a assuré la gestion technique, tandis que le volet communication de la cellule interministérielle de crise l’alimentait. Des spécialistes en communication des ministères concernés ont ainsi élaboré des argumentaires de manière hebdomadaire.
Mais, à l’avenir, il est en effet souhaitable qu’une cellule soit exclusivement consacrée à ces questions.
M. le rapporteur. Il faut apporter une réponse immédiate aux réseaux sociaux comme Facebook ou Twitter, que la population utilise en permanence et qui peuvent véhiculer des messages contraires à ceux du Gouvernement.
M. le ministre. Le site mis en place apportait une information sur les vaccins et sur la couverture du territoire en centres de vaccination, mais il n’existait pas de « réponses aux rumeurs ». Cet aspect doit être pris en compte à l’avenir.
M. le président Jean-Christophe Lagarde. Même sur internet, la communication de l’État est statique. Étant donné que votre ministère comporte des services d’observation d’internet dans d’autres domaines, peut-être pourrait-on intégrer dans les missions de la cellule l’observation des rumeurs, ce qui permettrait d’y répondre sur les réseaux mêmes où elles se répandent.
M. le ministre. C’est ce que nous pratiquons aujourd’hui pour les « apéros géants ».
Enfin, les préfets de zone ont auprès d’eux un référent sanitaire – anciennement dénommé « inspecteur de la santé publique ».
M. Guy Lefrand. Comme vous, monsieur le ministre, je rends hommage au corps préfectoral. Médecin moi-même, j’ai vu la préfète de ma circonscription venir dans les centres de vaccination tous les soirs pour s’enquérir du déroulement des opérations.
Parmi les trois piliers – anticipation, endiguement et adaptation – que vous avez distingués, vous avez assez peu parlé de l’adaptation. Or c’est peut-être à ce niveau que le dispositif a péché. Nous avons souvent entendu, au cours de nos auditions, que le train était lancé et que l’on ne pouvait plus l’arrêter. Pensez-vous que c’est ce qui s’est produit avec cette machine que vous estimez vous-même à la fois lourde, compliquée à mettre en œuvre et quelque peu expérimentale ? Prévoyez-vous une meilleure adaptabilité et plus de souplesse pour la gestion de pandémies futures ?
À cet égard, quelle appréciation portez-vous sur les relations et les prises de décisions interministérielles ? Cela a-t-il été facile ? Le ministère de l’intérieur a-t-il pris le « commandement » ?
En matière de réquisitions, les choses semblent s’être plutôt bien passées avec les collectivités territoriales. En va-t-il de même pour le remboursement des frais ?
S’agissant des réseaux sociaux et d’internet, il serait sans doute nécessaire de pratiquer une « contre-communication » – comme on pratique le contre-espionnage –, et pas seulement une communication reposant sur des sites dédiés.
Vos services ont-ils connaissance de ligues anti-vaccination spécifiques ?
Enfin, vous avez indiqué que le dispositif mis en place permettait de vacciner environ 6 millions de personnes en un mois. Sera-t-il suffisant s’il faut un jour vacciner l’ensemble, ou même 60 % de la population ? Doit-on réfléchir à la mise à contribution du système libéral ?
M. le ministre. Votre dernière question n’est pas simple !
Pour ce qui est du premier point, le plan de prévention et de lutte contre la pandémie grippale – dont j’ai hérité et que j’assume pleinement – a été conçu pour répondre à une pandémie de grippe A(H5N1). C’est, j’y insiste, un outil utile, mais peut-être, en partie, inadapté à la réalité de la grippe A(H1N1).
Les caractéristiques du virus de la grippe aviaire étaient qu’il circulait peu, mais qu’il était hautement pathogène – on estimait à l’époque qu’il pouvait provoquer 90 000 à 200 000 décès. À l’opposé, le virus de la grippe A(H1N1) est très contagieux, mais pas particulièrement virulent.
Incontestablement, le dispositif s’est révélé adapté pour la gestion de la phase de prévention, jusqu’à l’été 2009, de même qu’il a fourni un cadre opérationnel utile par la suite. La délégation interministérielle à la lutte contre la grippe aviaire et le secrétariat général de la défense et de la sécurité nationale devront maintenant le décliner pour l’adapter à une pandémie modérée.
Lors des réunions de la cellule interministérielle de crise, je n’étais pas favorable au passage aux niveaux 5B ou 6.
Pour ce qui est des relations entre ministères, il y a eu bien entendu des discussions et des débats. Néanmoins, je n’ai jamais été en désaccord avec Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports, notamment en ce qui concerne les niveaux d’alerte.
Par ailleurs, le code de la santé publique dispose que « si l’afflux de patients ou de victimes ou la situation sanitaire le justifie, le représentant de l’État dans le département peut procéder aux réquisitions nécessaires de tous biens et services ». La réquisition se justifiait donc par l’urgence et l’ampleur de la mise en œuvre de la campagne de vaccination. Je le répète, cette procédure permettait de transférer la responsabilité vers l’État, donc d’uniformiser et de sécuriser le statut juridique des personnes et des locaux réquisitionnés. De plus, nous n’avons procédé à ces réquisitions unilatérales qu’à partir du mois de décembre, c’est-à-dire « en fin de parcours ».
S’agissant enfin de l’indemnisation des collectivités locales, le barème retenu visait à couvrir les dépenses normales d’entretien des locaux et les dépenses supplémentaires liées à la campagne de vaccination. L’accord portait sur le chauffage, le ménage et la fourniture d’eau et d’électricité, sur une surface forfaitaire de 80 mètres carrés par chaîne de vaccination. Pour les biens non productifs de revenus – gymnases, écoles, stades, centres de protection maternelle et infantile, mairies, hôpitaux, foyers –, le barème était fixé à 16,80 euros par jour et par centre. Il était doublé – soit 33,60 euros – pour les centres de grande capacité comprenant deux chaînes de vaccination. Lorsqu’il s’agissait de biens productifs de revenus – centres culturels, salles d’exposition, salles des fêtes –, il était majoré de 50 %. L’indemnisation a commencé en février. À ce jour, 75 % des sommes dues ont été versées.
M. le président Jean-Christophe Lagarde. Quel est le montant total de cette indemnisation ?
En tant que maire de Drancy, je trouve que 33,60 euros par jour pour nettoyer et chauffer un gymnase, ce n’est pas cher payé !
Qu’en est-il des ligues anti-vaccination ? Peuvent-elles, comme on l’a évoqué devant la commission, provenir de l’étranger ?
M. le ministre. Plusieurs associations anti-vaccination se sont manifestées. Elles ont engagé des recours contre les décisions préfectorales mais toutes ont été déboutées.
Quant au montant total des remboursements aux collectivités, il est compris entre 67 et 70 millions d’euros.
Mme Marie-Louise Fort. Je rends hommage à mon tour au corps préfectoral, qui s’est beaucoup démené.
Les préfets et les responsables de l’éducation nationale que nous avons entendus ont tous constaté que la communication en direction du public avait été compliquée. En cas de nouvelle pandémie, comptez-vous améliorer ce volet ?
M. le ministre. Nous le savons tous : s’il y a bien deux domaines dont on n’est jamais totalement satisfait, ce sont l’organisation et la communication !
Mme Roselyne Bachelot-Narquin et moi-même avons commencé par assurer ensemble la communication, puis nous l’avons élargie au ministre de l’éducation nationale et à la ministre chargée des personnes âgées...
Mme Marie-Louise Fort. Je faisais surtout allusion aux documents distribués...
M. le ministre. En situation de pandémie, il faut une communication quotidienne. Vous savez comme sont les médias : si on ne leur apporte pas l’information, des erreurs peuvent être diffusées.
À quels documents faites-vous allusion ?
Mme Marie-Louise Fort. À celui qui a été distribué dans les écoles pour engager les parents à faire vacciner leurs enfants. Certains préfets ont fait état de difficultés.
M. le président Jean-Christophe Lagarde. Nous avons été choqués par le contenu du document distribué dans les écoles, incompréhensible pour la plupart des familles.
M. le ministre. On peut certainement progresser dans ce domaine, de même que l’on peut progresser dans l’organisation des permanences des centres d’appels téléphoniques ou dans l’harmonisation des visuels nationaux. Nous avons néanmoins fait parvenir des kits dans chaque préfecture, ainsi qu’un modèle de lettre que les maires auraient pu envoyer à leurs administrés.
À l’évidence, nous devrons accorder une attention particulière aux permanences téléphoniques et à la vulgarisation des documents.
M. Jean Mallot. L’anticipation est, bien sûr, une excellente chose, mais elle n’a jamais été synonyme d’exagération ou de rigidité. La formule selon laquelle « on n’en fait jamais assez » revient un peu trop souvent. Elle n’est pas éloignée de l’image utilisée hier par Mme Roselyne Bachelot-Narquin, ministre de la santé et des sports, qui alléguait que l’on ne saurait se plaindre si, après avoir payé sa prime d’assurance, on n’a pas d’accident de voiture. Si la prime s’élève à 500 000 ou un million d’euros, on n’en relèvera pas moins, accident ou pas, un certain décalage !
Bref, si l’on s’en est finalement bien tiré, on ne peut en déduire que tout a été pour le mieux.
Vous avez regretté « un battage médiatique sans précédent », monsieur le ministre, en évoquant notamment la une du Parisien. Ce n’est pourtant pas une surprise. Lors de son audition, M. Thierry Saussez a clairement exposé la stratégie de communication du Gouvernement, qui consistait à maximiser la crise. Il n’y a rien d’étonnant à ce que cela se retrouve dans les médias !
Par ailleurs, les 67 à 70 millions d’euros de remboursement aux collectivités locales sont-ils inclus dans les 91,3 millions d’euros que le ministère aurait consacrés à la crise ? Si tel est le cas, il ne reste plus qu’une vingtaine de millions à la charge du ministère, ce qui semble assez faible.
Vous avez également évoqué l’« objectif ambitieux » que vous vous étiez donné avec votre collègue chargée de la santé : vacciner 40 millions de personnes – ou, en réalité, 47 millions. Quand avez-vous choisi cet objectif et sur quelles bases ? Si l’on se réfère à la capacité du dispositif mis en place – 8 millions de vaccinations par mois dans la meilleure hypothèse –, il faut six mois pour vacciner cette population, et même un an s’il faut deux doses. Le décalage entre le dispositif et l’objectif saute aux yeux. Or, c’est un constat que l’on aurait pu faire rapidement, avant même la fin de la campagne de vaccination.
M. le ministre. Votre question est de bon sens : quelle évaluation pouvait-on faire de l’ampleur de la crise ?
M. Jean Mallot. Et quelle adaptation pouvait-on ménager au fil du temps ?
M. le ministre. Certes, cette pandémie s’est révélée modérée, mais attention à la lucidité a posteriori ! Car, a priori, toutes les autorités sanitaires internationales et nationales encourageaient à se préparer à une pandémie massive. Il est facile, après coup, de dire que la réaction des pouvoirs publics a été excessive. Sur le moment, de graves incertitudes pesaient sur l’évolution de la situation. Croyez-moi, lorsque l’on a de telles décisions à prendre, on n’a pas le cœur léger ! Après avoir écouté les organismes internationaux, les experts et Mme Roselyne Bachelot-Narquin, on ne pouvait écarter du revers de la main un scénario catastrophe : nous n’avions aucune certitude scientifique sur la nature réelle de la pandémie.
Bien entendu, cela ne signifie nullement que la gestion de la crise a été parfaite en tous points. Mais, en l’état de nos connaissances au début de la pandémie, c’était la seule gestion responsable. Nous n’avions pas le choix.
Je vous confirme par ailleurs que les 67 à 70 millions d’euros de remboursement font bien partie de l’enveloppe globale de 91,3 millions d’euros.
Le chiffre de 40 millions de personnes vaccinées nous a été communiqué par les autorités scientifiques, qui considéraient que c’était à ce niveau-là que l’on obtenait presque certainement un effet barrière stoppant la pandémie. L’objectif a été fixé à la fin de l’été ou au début de l’automne. Je vous communiquerai la date exacte.
Mme Catherine Lemorton. Donc on savait déjà à cette époque que l’on avait commandé trop de vaccins.
M. le président Jean-Christophe Lagarde. Non, puisque c’est à la fin du mois d’octobre que l’on savait qu’une seule dose suffisait.
Mme Catherine Lemorton. Si l’on multiplie 40 millions par 2, on arrive à 80 millions ; or on a commandé 93 millions de doses.
M. le président Jean-Christophe Lagarde. 10 % étaient destinées à l’étranger.
Mme Catherine Lemorton. Je constate que la décision a été prise fin septembre.
M. le rapporteur. L’Organisation mondiale de la santé avait demandé très tôt aux pays riches de réserver 10 % de leurs doses pour les autres pays.
M. le président Jean-Christophe Lagarde. Notre commission se réunira demain matin à 9 heures 30. Nous aurons tout le loisir de soumettre alors nos réflexions au rapporteur.
Mme Catherine Lemorton. Le Gouvernement a mis rapidement en place une cellule de décision, une cellule de situation et une cellule de communication. Celle-ci a élaboré la stratégie de communication associée aux décisions de la cellule interministérielle, la coordination des éléments d’information et de communication destinés aux ministères et aux services territoriaux de l’État, et elle a assuré la « veille médias ».
La cellule de communication comportait deux groupes, l’un dédié à l’organisation de l’État et à la fonction publique, l’autre aux entreprises. Le pilotage du premier groupe a été confié au porte-parole du ministère de l’intérieur et au délégué à l’information et à la communication. Or, à l’expérience, les médias ont contourné le service dédié et ont utilisé ce délégué pour obtenir des informations. Ne pourrait-on améliorer cela à l’avenir ?
Autre aspect que je souhaite aborder : la gestion « binomiale » de la crise. Bien qu’il entérine la responsabilité du ministère de l’intérieur dans la conduite opérationnelle de la gestion de crise sur le territoire, le plan de prévention et de lutte contre la pandémie grippale précise également que la responsabilité des questions sanitaires demeure du ressort du ministre de la santé. Cette séparation entre les responsabilités opérationnelles et sanitaires semble ne pas toujours avoir facilité la conduite de l’action interministérielle par le ministre de l’intérieur. Confirmez-vous cette difficulté ?
Lors de votre audition devant la commission des affaires sociales, vous étiez à la tête de cette cellule et l’on voyait bien que vous éprouviez beaucoup de difficulté à répondre aux questions sanitaires. Je comprends bien que ce n’est pas votre spécialité, mais on devrait être capable de répondre à ces questions lorsque l’on exerce cette responsabilité.
La difficulté de la gestion binomiale a été bien mise en évidence par la réticence du ministère de la santé à rendre effectives les dispositions de l’article L. 3131-1 du code de la santé publique, permettant de fonder juridiquement l’action de l’État et des préfets à l’échelon local. On peut se demander si la gestion binomiale est vraiment optimale, surtout en cas de pandémie grave.
Par ailleurs, la coordination de la communication territoriale avec le niveau central devrait être renforcée par la création d’un réseau de communicants zonaux. L’échelon zonal devient en effet de plus en plus important du point de vue opérationnel. On a bien vu l’écart entre les décisions nationales prises en métropole et les difficultés rencontrées par l’outre-mer. Il a manqué, au sein de la cellule interministérielle, une structure d’adaptation du plan aux problèmes qui se posaient au fur et à mesure.
M. le ministre. Permettez-moi de revenir sur le nombre de vaccins. Ce n’est qu’en novembre que nous avons su qu’une seule dose suffirait.
Mme Catherine Lemorton. La France a pris la décision en novembre. Ce n’était pas le cas d’autres États.
M. le président Jean-Christophe Lagarde. Tous les spécialistes nous ont confirmé que c’est à ce moment-là qu’il a été prouvé qu’une seule dose de vaccin suffisait – même si, comme Mme Roselyne Bachelot-Narquin l’a indiqué hier, certains pays ont décidé de ne proposer qu’une seule dose alors que l’Organisation mondiale de la santé recommandait encore deux doses.
M. Jean Mallot. Avec deux doses, le caractère inadapté du dispositif apparaît avec encore plus d’évidence : pour le coup, on était certain de ne pas pouvoir vacciner la population !
M. le président Jean-Christophe Lagarde. À raison de 6 ou 8 millions de personnes vaccinées par mois, il faut plusieurs mois pour arriver à vacciner toute la population.
M. le ministre. Pour ce qui est de la communication, madame Catherine Lemorton, je ne partage pas tout à fait notre analyse. Afin d’assurer une unité de réponse gouvernementale, nous avons délibérément choisi de demander au porte-parole du ministère de l’intérieur, M. Gérard Gachet, et au professeur Didier Houssin pour le ministère de la santé, d’effectuer ensemble un point quotidien. Le premier s’exprimait sur la partie organisationnelle, le second sur la partie sanitaire. De même, je n’ai pour ma part jamais fait de communication solitaire : je me suis toujours exprimé avec la ministre de la santé, et éventuellement le ministre de l’éducation nationale, le ministre chargé des personnes âgées, etc.
La preuve de cette unité de communication, c’est qu’il n’y a pas eu le moindre « couac », la moindre contradiction dans l’expression des différents responsables publics.
Mme Catherine Lemorton. Ma question ne portait pas sur la communication, qui en effet a été uniforme, mais sur la prise de décision en amont de la communication pour organiser l’information sur le terrain.
M. le ministre. Je ne vois pas à quoi vous faites allusion. La spécificité de l’outre-mer, que vous avez évoquée, a été prise en compte, d’autant que c’est de ces régions que les premiers signes nous sont parvenus. La Polynésie française et la Nouvelle-Calédonie ont été touchées par la pandémie alors qu’aucun vaccin n’existait encore.
S’agissant de la gestion de la crise, j’ai trouvé très efficace ce partenariat total entre compétences sanitaires, compétences organisationnelles et activités sectorielles. Il ne vous a pas échappé que d’autres responsables ministériels se sont agrégés au dispositif au fur et à mesure.
Naturellement, il y a pu avoir des débats au sein de la cellule, mais presque toutes les décisions ont été prises à l’unanimité et il n’y a pas eu la moindre dissonance dans l’expression gouvernementale.
M. Michel Lejeune. La communication qui se développe sur internet via les courriers électroniques ou Facebook a quelque chose d’infernal. On y affirme tout et n’importe quoi. Les journalistes y récupèrent des informations qui, aussi fantaisistes soient-elles, deviennent en quelque sorte « vraies ».
Le phénomène, je le sais, est mondial. Y a-t-il néanmoins des moyens de l’empêcher ?
M. le ministre. C’est un sujet très sensible. On le savait dès avant internet : un mensonge répété plusieurs fois ne fait pas forcément une vérité.
La question du contrôle d’internet va bien au-delà des sujets dont traite votre commission. C’est une préoccupation majeure en matière de lutte contre la pédophilie ou encore de surveillance de réseaux islamistes. Dans ces secteurs, le suivi que nous exerçons est assez au point. Peut-être faut-il l’étendre à des épisodes bien ciblés, tels que celui que nous évoquons aujourd’hui. Attention cependant au droit applicable à internet : il ne faut pas mettre le doigt dans l’engrenage.
Mme Catherine Lemorton. La question des sites internet consacrés à la santé revient régulièrement dans la discussion des projets de loi de financement de la sécurité sociale. Une recherche sur la « vaccination contre le cancer de l’utérus » ne fait apparaître ni le site de la Haute Autorité de santé ni celui de l’Agence française de sécurité sanitaire des produits de santé : on tombe sur « doctissimo.fr », visité par deux millions de personnes et où l’on trouve des informations fausses, en contradiction avec les recommandations des autorités sanitaires. Le problème, criant en période de pandémie, se pose tous les jours. On ne sait pas qui fait circuler ces informations.
M. le président Jean-Christophe Lagarde. S’agissant des sites des instances de sécurité sanitaire, il serait sans doute bon d’engager une négociation avec les responsables des moteurs de recherche. En ce domaine, les sites les plus visités sont souvent les plus fantaisistes.
M. le ministre. Bien que ce ne soit pas de mon ressort, je crois que l’on peut se reporter à la loi favorisant la diffusion et la protection de la création sur internet, dite loi « Hadopi ».
M. le président Jean-Christophe Lagarde. Dans le cas où nous aurions à faire face à une pandémie de type grippe aviaire, est-il envisageable que les services essentiels à la vie de la Nation – pompiers, policiers, gendarmes notamment – se voient imposer la vaccination ? Le risque est, non pas qu’ils soient indisponibles pendant quelques jours, mais qu’ils décèdent en masse !
Notre commission a relevé de grandes différences de réactivité et d’efficacité selon les départements. Manifestement, l’habitude qu’avaient les acteurs de parler entre eux a joué un grand rôle. Il y a là une piste de réflexion pour nos préfets.
Enfin, Paris est la seule zone où un directeur départemental des affaires sanitaires et sociales a été remercié. Il me semble que la tâche de ce directeur et des autres acteurs se trouvait compliquée par la multiplicité des préfets intervenant dans le dossier : préfet de Paris, préfet de région, préfets de département, préfet de zone... Sans doute une réorganisation est-elle nécessaire en Île-de-France afin qu’il n’y ait qu’un seul pilote.
Plus généralement, de même que le ministère de l’intérieur pilote la cellule interministérielle de crise, il faudrait, sur le terrain, que le préfet de zone, voire le préfet de région, ait autorité sur l’agence régionale de santé, laquelle deviendrait le référent en matière de santé durant la crise.
M. le ministre. La vaccination des personnels obéit au principe du volontariat. Il peut y avoir une incitation forte, mais ce principe ne peut être remis en cause.
Pour ce qui est des préfets et des différences observées entre les départements, croyez bien que j’ai suivi personnellement et quotidiennement les données relatives aux centres de vaccination : leur nombre, leur ouverture, leur amplitude, leurs résultats. Et j’ai constaté des diversités. Comme je l’ai dit, les préfets qui avaient déjà été confrontés à des expériences similaires se sont montrés, au moins dans un premier temps, beaucoup plus réactifs. Désormais, l’ensemble du corps préfectoral a fait cette expérience.
Dans le cas de Paris, le dysfonctionnement ne m’a pas été rapporté par une note : je l’ai personnellement constaté. Par la suite, on m’a confirmé plusieurs autres lacunes.
Comme vous le savez, il y a eu de fortes tensions avec le responsable en question et il a fallu prendre un certain nombre d’initiatives. Ce n’était ni le fruit du hasard ni une décision anonyme : c’était quelque chose que j’avais personnellement constaté et j’ai partagé la décision avec tous ceux qui avaient à gérer cette crise. Je vous confirme mon très vif mécontentement à l’issue de la visite d’un centre de vaccination un samedi après-midi à Paris.
M. le président Jean-Christophe Lagarde. Permettez-moi d’insister sur la difficulté qu’il y a à gérer les crises en région parisienne, non seulement à cause de la multiplicité des préfets mais aussi à cause du rôle de l’Assistance publique-Hôpitaux de Paris, notamment en matière de réquisition des médecins ou des internes.
M. le ministre. Je tiens le préfet de zone en haute estime. Néanmoins, contrairement à mes collaborateurs ici présents, je pense que le dispositif a quelque peu « patiné » dans un premier temps. Je partage votre sentiment, monsieur le président. Les choses ont été rapidement corrigées mais sans doute y a-t-il là une piste de réflexion.
M. le président Jean-Christophe Lagarde. Il faudra également veiller à ce que les relations entre l’Assistance publique-Hôpitaux de Paris et la future agence régionale de santé soient bien « huilées ». En Île-de-France, c’est le directeur général de l’Assistance publique-Hôpitaux de Paris qui dispose des moyens sanitaires les plus importants.
Monsieur le ministre, merci.
La séance est levée à vingt heures quinze.
1 () Ces références sont, pour des raisons de commodité, utilisées dans l’ensemble du rapport même si la pandémie de 2009 était due à une variante, un virus A(H1N1)v. La lettre A fait référence à une des trois classes de virus de la grippe (A, B, C), le H représentant l’hémagglutinine et le N la neuraminidase. Il existe 16 formes connues de H et 9 de N. Ces références scientifiques sont parfois remplacées par des expressions plus compréhensibles (« grippe aviaire » par exemple, pour le virus H5N1) mais parfois sources de confusions et de raccourcis problématiques (« grippe porcine », par exemple, pour le virus H1N1 qui n’est pas exclusivement lié à une origine porcine).
2 () Voir le texte de cette résolution en annexe.
3 () Voir composition de la commission en annexe.
4 () Voir comptes rendus des auditions en annexe.
5 () L’article 6 de l’ordonnance n° 58-1100 du 17 novembre 1958 relative au fonctionnement des assemblées parlementaires dispose que la mission des commissions d’enquête prend fin « à l’expiration d’un délai de six mois à compter de la date d’adoption de la résolution qui les a créées ».
6 () « Nous regrettons de ne pouvoir accepter cette invitation. En effet, en tant qu’organisation intergouvernementale, l’Organisation mondiale de la Santé (OMS) ne participe normalement pas aux auditions tenues par des instances parlementaires ni ne prend part aux commissions d’enquête établies par ces instances. »
7 () La visioconférence faisait partie des modalités d’entretien proposées.
8 () Voir en annexe.
9 () Voir les rapports, également signés de votre rapporteur, n° 2314 du 19 février 2010 et n° 2654 du 24 juin 2010. Pour leur préparation, votre rapporteur a été amené notamment à se rendre à La Réunion, à Stockholm au Centre européen de prévention et de contrôle des maladies, à Washington à l’Administration américaine pour la nourriture et le médicament et à l’Agence nationale pour la santé, à Atlanta au Centre américain pour la prévention et de contrôle des maladies, à Lyon au Laboratoire P4, à Genève à l’Organisation mondiale de la santé, à Londres à l’Agence européenne du médicament, à Hong-Kong dans un laboratoire spécialiste du virus H5N1, à Shangaï à l’Institut Pasteur, à Canton au Centre chinois pour la prévention et le contrôle des maladies.
10 () En dehors d’un déplacement effectué à Genève.
11 () Rapport de M. Paul Flynn (Groupe socialiste, Royaume-Uni).
12 () Audition du 15 juin 2010.
13 () Audition du 26 mai 2010.
14 () Le suivi de la couverture vaccinale est encadré par les dispositions du décret n° 2009-1273 du 22 octobre 2009 autorisant la création d’un traitement de données à caractère personnel et au suivi des vaccinations contre la grippe A(H1N1).
15 () Audition du 9 juin 2010.
16 () Audition du 9 juin 2010.
17 () Audition du 13 avril 2010.
18 () Audition du 13 avril 2010.
19 () Audition du 27 avril 2010.
20 () Audition du 13 avril 2010.
21 () Audition du 13 avril 2010.
22 () Cette annonce a été faite par la ministre lors de l’émission radiophonique Le Grand Jury-RTL-Le Figaro le 6 juin 2010.
23 () Audition du 6 avril 2010.
24 () L’article 24 du cahier des clauses administratives générales applicables aux marchés publics de fournitures courantes et de services, approuvé par le décret n° 77-699 du 27 mai 1977 modifié, prévoit que : « 24.1. La personne publique peut à tout moment, qu’il y ait ou non faute du titulaire, mettre fin à l’exécution des prestations faisant l’objet du marché avant l’achèvement de celles-ci par une décision de résiliation du marché. Sauf dans les cas de résiliation prévus aux articles 25 à 28, le titulaire a droit à être indemnisé du préjudice qu’il subit du fait de cette décision comme il est dit à l’article 31. »
25 () Le pouvoir de résiliation unilatérale d’un contrat par l’administration a été reconnu très tôt par la jurisprudence administrative (CE, 11 mars 1910, Compagnie générale française des tramways) : ce pouvoir lui appartient « en tout état de cause, en vertu des règles applicables aux contrats administratifs » (CE, 2 mai 1958, Distillerie de Magnac-Laval). Ce pouvoir a reçu une triple confirmation : le Conseil d’État a considéré que l’administration peut mettre fin avant terme à un contrat, en l’espèce de concession « pour des motifs d’intérêt général justifiant, à la date à laquelle elle prend sa décision, que l’exploitation du service concédé doit être abandonnée ou établie sur des bases nouvelles » (CE, Ass, 2 février 1987, Société T.V.6) ; que l’administration « peut user de cette faculté alors même qu’aucune disposition législative ou réglementaire, non plus qu’aucune stipulation contractuelle, n’en ont organisé l’exercice » (CE, 22 avril 1988, Société France 5 et Association des fournisseurs de la cinq). Ce pouvoir de résiliation unilatéral pour motif d’intérêt général a été confirmé par le Tribunal des conflits (TC, 2 mars 1987, Société d’aménagement et de développement de Briançon-Montgenèvre contre commune de Montgenèvre) et par le Conseil constitutionnel (CC, 84-185 DC du 18 janvier 1985).
26 () Audition du 28 avril 2010.
27 () Arrêté du 29 décembre 2009 fixant les montants d’indemnisation de certains professionnels de santé en exercice, retraités ou en cours de formation réquisitionnés pour assurer la vaccination dans le cadre de la lutte contre la pandémie grippale.
28 () Les professionnels de santé retraités ou sans activité sont indemnisés par l’Établissement public de réponse aux urgences sanitaires sur des crédits de l’État, tandis que l’assurance maladie assure directement l’indemnisation des professionnels de santé libéraux et des médecins et infirmiers du travail, avant d’être elle-même remboursée par l’État. En outre, les hôpitaux avancent l’indemnisation de leurs personnels réquisitionnés, y compris des internes et étudiants en médecine qui leur sont rattachés, les élèves infirmiers étant indemnisés par les établissement de formation pour leur réquisition intervenue hors période de stage : ceux-ci seront également remboursés pour ces frais. Enfin, les professionnels de santé de la fonction publique sont directement indemnisés par leur ministère d’origine.
29 () L’article 7 de l’arrêté du 4 février 2010 fixant les montants d'indemnisation des personnes réquisitionnées dans le cadre de la campagne de vaccination contre le virus de la grippe A(H1N1) pour occuper des fonctions administratives et des propriétaires ou gestionnaires des locaux réquisitionnés dans le même cadre prévoit une indemnisation de 16,80 euros par jour de réquisition pour les locaux comportant une chaîne de vaccination (33,60 euros pour les locaux en comportant une seconde), et une majoration de 50 % de ces montants lorsque le local est normalement productif de revenus.
30 () Audition du 26 mai 2010.
31 () Article 10 de la loi n° 2009-1646 du 24 décembre 2009 de financement de la sécurité sociale pour 2010.
32 () Article 96 de la loi n° 2009-1674 du 30 décembre 2009 de finances rectificative pour 2009.
33 () Sur la gestion de la pandémie de grippe A(H1N1) aux États-Unis, voir le rapport d’étape de M. Jean-Pierre Door et de Mme Marie-Christine Blandin pour l’Office parlementaire d’évaluation des choix scientifiques et technologiques, Mutation des virus et gestion des pandémies : l’exemple du virus A(H1N1), février 2010.
34 () Audition du 15 juin 2010.
35 () Article 5 de la Charte de l’environnement : « Lorsque la réalisation d’un dommage, bien qu’incertaine en l’état des connaissances scientifiques, pourrait affecter de manière grave et irréversible l’environnement, les autorités publiques veillent, par application du principe de précaution et dans leurs domaines d’attribution, à la mise en oeuvre de procédures d’évaluation des risques et à l’adoption de mesures provisoires et proportionnées afin de parer à la réalisation du dommage ».
36 () Audition du 13 avril 2010.
37 () Audition du 13 avril 2010.
38 () Audition du 13 avril 2010.
39 () Audition du 6 avril 2010.
40 () La proportion de cas asymptomatiques pourrait représenter jusqu’à 70 % de la population comme l’a indiqué Mme François Weber, directrice générale de l’Institut de veille sanitaire, devant la commission d’enquête le 6 avril 2010.
41 () Ces données sont issues d’un article publié le 6 mai 2010 dans The New England Journal of Medecine et intitulé « Clinical Aspects of Pandemic 2009 Influenza A(H1N1) Virus Infection ».
42 () « Preliminary Estimates of Mortality and Years of Life Lost Associated with the 2009 A/H1N1 Pandemic in the US and Comparison with Past Influenza Seasons », de Cécile Viboud (National Institute of Health), publié dans PLoS Currents: Influenza, mars 2010.
43 () Audition du 10 juin 2010.
44 () Audition du 28 avril 2010.
45 () Audition du 28 avril 2010.
46 () Audition du 28 avril 2010.
47 () Les adjuvants contenus dans les vaccins servent à élargir le spectre d’efficacité de ces derniers, ce qui leur permet d’agir même contre un virus qui se serait légèrement modifié. Ils permettent aussi de limiter la quantité d’antigène nécessaire pour obtenir la réaction immunitaire permettant de protéger la personne vaccinée et d’augmenter le nombre de vaccins produits dans une période donnée. Les vaccins contre la grippe sont traditionnellement de « mauvais » vaccins, au sens où ils ne sont pas d’une excellente efficacité : des adjuvants sont donc généralement utilisés pour les améliorer. Les adjuvants utilisés dans les vaccins contre le virus A(H1N1) de GlaxoSmithKline, Novartis et dans un vaccin de Sanofi sont à base de squalène : l’un de ces adjuvants (MF59) est d’ailleurs présent dans des vaccins déjà administrés à plusieurs dizaines de millions d’exemplaires, contre la grippe saisonnière en Europe. La large utilisation de tels vaccins n’a pas conduit au signalement d’effets indésirables postvaccinaux importants. Notons d’ailleurs que l’expérience américaine de la vaccination de 1976-1977 qui avait entraîné un débat sur le symptôme de Guillain-Barré concernait un vaccin sans adjuvant, les États-Unis n’ayant jamais utilisé d’adjuvants dans leurs vaccins administrés contre la grippe.
48 () S’agissant des vaccins contre la grippe saisonnière dans l’hémisphère Nord, les souches sélectionnées par l’Organisation mondiale de la santé sont annoncées en général autour du 15 février : le processus de production s’étend alors jusqu’au mois d’août. S’agissant des vaccins saisonniers dans l’hémisphère Sud, les souches sont communiquées aux laboratoires au début du mois de septembre, date du début de production de vaccin, dont la commercialisation est effectuée durant les deux premiers trimestres de l’année suivante.
49 () Audition du 28 avril 2010.
50 () Audition du 28 avril 2010.
51 () Audition du 28 avril 2010.
52 () Les trois vaccins concernés sont Pandemrix (GlaxoSmithKline), Celvapan (Baxter) et Focetria (Novartis).
53 () Audition du 5 mai 2010.
54 () Avis du Haut conseil de la santé publique : actualisation de l’utilisation des vaccins pandémiques contre la grippe A(H1N1), 27 novembre 2009.
55 () Audition du 12 mai 2010.
56 () Ce passage a été annoncé par l’Agence européenne du médicament le 19 novembre pour les vaccins Focetria et Pandemrix, et le 27 novembre pour le vaccin Panenza par le Haut conseil de la santé publique. Pour le vaccin Celvapan, l’indication est demeurée inchangée, à deux doses.
57 () Le taux de compliance correspond à l’estimation du nombre de personnes susceptibles de se présenter à la vaccination : ce taux a été établi pour la vaccination contre le virus A(H1N1) à partir du taux de compliance à la vaccination contre la grippe saisonnière, évalué entre 65 % et 70 %, et du taux de compliance à la vaccination contre la méningite en Seine-Maritime, de l’ordre de 85 %.
58 () Ce principe rejoint d’ailleurs l’avis formulé par le Comité consultatif national d’éthique pour les sciences de la vie et de la santé (avis n° 106 : « Questions éthiques soulevées par une possible pandémie grippale »), dans lequel le comité déclare que : « En vertu du sens égalitaire de la justice, il s’agit en premier lieu de rappeler que le but est de protéger toute la population, quelle que soit la position de ses membres dans l’échelle sociale et son âge. ».
59 () Audition du 11 mai 2010.
60 () Audition du 2 juin 2010.
61 () Rapport du comité de lutte contre la grippe fonctionnant en groupe de travail du Haut conseil de la santé publique / Comité technique des vaccinations sur la pertinence de l’utilisation d’un vaccin pandémique dirigé contre le virus grippal A(H1N1)v, 22 juin 2009.
62 () Ainsi, le 11 mai, lors d’une réunion interministérielle, le directeur général de la santé appelait l’attention sur cette difficulté, soulignant les limites des capacités mondiales annuelles de production d’un vaccin contre la grippe, alors que les États-Unis venaient de faire part de leur intention de commander un stock massif de vaccins contre le nouveau virus, et le fait que les fournisseurs étaient déjà fortement sollicités ou susceptibles de l’être assez rapidement par d’autres pays.
63 () Audition du 28 avril 2010.
64 () Audition du 6 avril 2010.
65 () Ce montant correspond au versement d’arrhes à hauteur de 1,50 euro hors taxes par dose de vaccin.
66 () Audition du 28 avril 2010.
67 () Audition du 6 avril 2010.
68 () Audition du 23 mars 2010 devant la commission d’enquête du Sénat sur le rôle des firmes pharmaceutiques dans la gestion par le Gouvernement de la grippe A(H1N1)v.
69 () Audition du 5 mai 2010.
70 () Ces conditions n’ont été réunies qu’avec la parution de l’arrêté du 4 novembre 2009 relatif à la campagne de vaccination contre le virus de la grippe A(H1N1) 2009.
71 () Audition du 10 juin 2010.
72 () Audition du 26 avril 2010.
73 () Ce modèle mathématique a été évoqué par M. Antoine Flahault, directeur de l’école des hautes études en santé publique (EHESP) et par M. Bernard Bégaud, pharmacologue, lors de leurs auditions respectives du 27 avril 2010 et du 13 avril 2010.
74 () Audition du 27 avril 2010.
75 () Code des marchés publics, article 72 : « Le pouvoir adjudicateur peut passer un marché sous la forme d’un marché à tranches conditionnelles. Le marché à tranches conditionnelles comporte une tranche ferme et une ou plusieurs tranches conditionnelles. Le marché définit la consistance, le prix ou ses modalités de détermination et les modalités d’exécution des prestations de chaque tranche. Les prestations de la tranche ferme doivent constituer un ensemble cohérent ; il en est de même des prestations de chaque tranche conditionnelle, compte tenu des prestations de toutes les tranches antérieures. L’exécution de chaque tranche conditionnelle est subordonnée à une décision du pouvoir adjudicateur, notifiée au titulaire dans les conditions fixées au marché. Lorsqu'une tranche conditionnelle est affermie avec retard ou n’est pas affermie, le titulaire peut bénéficier, si le marché le prévoit et dans les conditions qu'il définit, d'une indemnité d'attente ou d'une indemnité de dédit. »
76 () Auditions du 28 avril 2010.
77 () Audition de Mme Roselyne Bachelot-Narquin le 20 janvier 2010 devant la commission des affaires sociales du Sénat.
78 () Audition du 28 avril 2010.
79 () Audition du 10 juin 2010.
80 () L’article 5 de la Charte de l’environnement prévoit bien « l’adoption de mesures provisoires et proportionnées afin de parer à la réalisation du dommage ».
81 () Audition du 13 avril 2010.
82 () L’urgence de santé publique de portée internationale est définie, aux termes de l’article 1er du règlement, comme « un évènement extraordinaire dont il est déterminé, comme prévu dans le présent Règlement,
« i) qu’il constitue un risque pour la santé publique dans d’autres États en raison du risque de propagation internationale des maladies ; et
« ii) qu’il peut requérir une action internationale coordonnée. »
83 () Audition du 12 mai 2010.
84 () Audition du 6 avril 2010.
85 () Audition du 6 avril 2010.
86 () Devenu depuis secrétariat général de la défense et de la sécurité nationale.
87 () Audition du 11 mai 2010.
88 () Audition du 10 juin 2010.
89 () Audition du 15 juin 2010.
90 () Audition du 11 mai 2010.
91 () Audition du 6 avril 2010.
92 () Compte rendu de la réunion interministérielle du jeudi 14 mai 2009 à 18 h 30.
93 () Voir partie IV du présent rapport.
94 () Audition du 15 juin 2010.
95 () Audition du 5 mai 2010.
96 () Audition du 26 mai 2010.
97 () Audition du 11 mai 2010.
98 () Proposition de loi de M. Jean-Pierre Door visant à renforcer la coordination contre les risques épidémiques (n° 3540), enregistrée le 20 décembre 2006.
99 () Audition du 12 mai 2010.
100 () Audition du 16 juin 2010.
101 () Voir la partie II du présent rapport.
102 () Audition du 2 juin 2010.
103 () Audition du 16 juin 2010.
104 () Audition du 27 avril 2010.
105 () Voir la partie A du I du présent rapport.
106 () Audition de Mme Annie Podeur, directrice générale de l’offre de soins, 7 avril 2010.
107 () Audition du 7 avril 2010.
108 () Audition du 26 mai 2010.
109 () Audition du 2 juin 2010.
110 () M. Thierry Amouroux, secrétaire général du syndicat des personnels infirmiers, audition du 27 avril 2010.
111 () Audition des 27 avril et 2 juin 2010.
112 () Audition du 27 avril 2010.
113 () Commission d’enquête sur les conséquences sanitaires et sociales de la canicule, créée par l’Assemblée nationale le 7 octobre 2003.
114 () Audition de M. Bernard Fragneau, ancien préfet du Loiret, 9 juin 2010.
115 () Audition du 5 mai 2010.
116 () Audition du 16 juin 2010.
117 () Cet article dispose que « En cas de menace sanitaire grave appelant des mesures d'urgence, notamment en cas de menace d'épidémie, le ministre chargé de la santé peut, par arrêté motivé, prescrire dans l'intérêt de la santé publique toute mesure proportionnée aux risques courus (…).
« Le ministre peut habiliter le représentant de l’État territorialement compétent à prendre toutes les mesures d'application de ces dispositions, y compris des mesures individuelles (…). »
118 () Audition du 9 juin 2010.
119 () Relevé de décisions de la cellule interministérielle de crise du 4 novembre 2009.
120 () Audition du 27 avril 2010.
121 () Audition du 1er juin 2010.
122 () Circulaire des ministres chargés de l’intérieur et de la santé, du 1er octobre 2009, relative à la mobilisation des professionnels de santé / virus A(H1N1).
123 () Relevé de décisions de la cellule interministérielle de crise du 28 octobre 2009.
124 () Audition du docteur Jacques Fontan, responsable du centre de vaccination de Capbreton, 2 juin 2010.
125 () Audition de Mme Valérie Lévy-Jurin, maire-adjointe de Nancy, présidente du réseau français des villes santé de l’Organisation mondiale de la santé, membre de l’Association des maires de France, 2 juin 2010.
126 () Audition du 2 juin 2010.
127 () Audition du 5 mai 2010.
128 () M. Thierry Amouroux, secrétaire général du Syndicat national des professionnels infirmiers.
129 () Audition du 15 juin 2010.
130 () Ce syndrome est « une atteinte des nerfs qui se traduit par une paralysie rapide, débutant au niveau des membres inférieurs puis remontant vers le haut du corps. C’est une maladie potentiellement grave : dans 85 % des cas, la récupération est complète, 10 % des patients gardent des séquelles motrices et 5 % décèdent. » (Source : ministère de la santé et des sports).
131 () Le Parisien, lundi 14 septembre 2009.
132 () M. Paul Benkimoun, journaliste au Monde, audition du 27 mai 2010.
133 () Mission d’information commune créée le 7 avril 2010, présidée par M. Jean-Luc Warsmann et dont les corapporteurs sont MM. Patrick Bloche et Charles-Ange Ginesy.
134 () Audition du 5 mai 2010.
135 () Audition du 13 avril 2010.
136 () Audition du 13 avril 2010.
137 () Réalisée par questionnaire auprès d’un échantillon représentatif de 1 001 personnes.
138 () Relevé de décisions de la cellule interministérielle de crise du 23 septembre 2009.
139 () Flash Eurobarometer 287.
140 () Michaël Schwarzinger, Rémi Flicoteaux, Sébastien Cortarenoda, Yolande Obadia et Jean-Paul Moatti, “Low acceptability of A/H1N1 pandemic vaccination in French adult population: did public health policy fuel public dissonance ?”, PloS One, avril 2010.
141 () Audition du 13 avril 2010.
142 () Audition du 13 avril 2010.
143 () Audition du 27 avril 2010.
144 () Audition du 27 avril 2010.
145 () Audition du 13 avril 2010.
146 () Le rapport n° 237 de M. Paul Blanc, sénateur, fait au nom de l’Office parlementaire d’évaluation des politiques de santé sur La politique vaccinale en France, du 27 septembre 2007, estimait ainsi que seuls 5 % des médecins généralistes avaient reçu une formation dans le domaine des vaccins au cours des quatre dernières années dans le cadre de la formation professionnelle conventionnelle.
147 () Avis du 18 juin relatif à l’expertise en santé publique, disponible sur http://www.sante-sports.gouv.fr/IMG//pdf/avis_expertise_180608.pdf.
148 () Loi n° 95-101 du 2 février 1995 relative au renforcement de la protection de l’environnement, dite loi « Barnier », instaurant la Commission nationale du débat public (CNDP), loi n° 2002-276 du 27 février 2002 relative à la démocratie de proximité, qui intègre un nouveau chapitre intitulé « Participation du public à l’élaboration des projets d’aménagement ou d’équipement ayant une incidence importante sur l’environnement ou l’aménagement du territoire ».
149 () Également introduit dans le droit français par la loi « Barnier ».
150 () Hubert Blanc, « Réformer l’enquête publique », table ronde « Comment organiser la concertation ? », colloque organisé par les maires des grandes villes de France, 22 mars 2000.
151 () Précision de M. le professeur Pierre Bégué : « Le ministère de la santé a bien choisi pour cible les nourrissons et les enfants et adolescents de onze à dix-sept ans. Mais en 1996, on constatait que la vaccination avait en fait porté sur des millions d’adultes de vingt à quarante ans, etc. D’autre, part, c’est auprès du Haut comité de la sécurité sociale que nous avions présenté le coût et les objectifs de la vaccination de l’hépatite B en avril 1994. »
152 () Par courrier en date du 7 mai 2010, le président de la chambre syndicale de la répartition pharmaceutique a rectifié les chiffres communiqués lors de l’audition, et a indiqué que le nombre de « 5 millions ne correspond pas aux doses qui ont été livrées, mais à une estimation du nombre de personnes qu’elles ont permis de vacciner au sein des centres de vaccination ». Il n’inclut donc pas les personnels hospitaliers et les Français de l’étranger.
Le président de la chambre syndicale de la répartition pharmaceutique a indiqué par ailleurs, dans le même courrier, que s’agissant du nombre de doses de vaccins livrées par les répartiteurs pharmaceutiques, elles n’ont pu faire l’objet d’une comptabilisation précise, pour trois raisons : en premier lieu, la rémunération des répartiteurs s’est fondée sur le nombre de livraisons effectuées et non sur le nombre de doses livrées ; deuxièmement, l’approvisionnement des centres de vaccination n’a pu être opéré par le biais du système informatisé classiquement utilisé pour l’approvisionnement des officines : les informations relatives aux livraisons ont donc dû être recueillies manuellement pour leur consolidation ; enfin, la convention signée avec l’établissement public de réponse aux urgences sanitaires prévoyait un suivi portant sur le nombre de boîtes de vaccins acheminées et non sur les doses de vaccins livrées.
153 () Précision du ministère de l’éducation nationale : « Ce sont les chiffres qui sont remontés au secrétariat général dans une enquête de début décembre 2009 auprès des académies ; en revanche, cette mobilisation, en particulier avant le 25 novembre, a pu intervenir en journée, pendant le temps de service des agents. Quand la vaccination a commencé dans les établissements scolaires, nos personnels ont plutôt été affectés aux équipes mobiles de vaccination sans préjudice d’interventions en dehors de leur temps de service dans les centres de vaccination. »
154 () Précision du ministère de l’éducation : seuil ne concernant pas le plan H5N1.
155 () Précision du ministère de l’éducation nationale : la circulaire du 9 novembre (MEN-Intérieur-Santé) prévoyait ainsi que :
« La participation des infirmiers(ères) et des médecins de l’éducation nationale à la vaccination en milieu scolaire constitue une priorité durant la compagne de vaccination. L’organisation de l’exercice de leurs missions statutaires doit en tenir compte sans négliger pour autant des priorités du service public de l’éducation nationale (plus particulièrement la gestion des situations d’urgence – survenue de méningite, situation de maltraitance, cellule de soutien lors d’évènements graves – ou la mise en place des mesures d’accompagnement de la scolarité des élèves (projet d’accueil individualisé, projet personnalisé de scolarisation, délivrance d’avis médicaux d’aptitude).
« Les agents de l’éducation nationale, notamment les personnels de santé, sont par ailleurs invités à se porter volontaires pour participer à la campagne de vaccination engagée en faveur du reste de la population. »
© Assemblée nationale

