

| Accueil > Travaux en commission > Commission des finances, de l'économie générale et du contrôle budgétaire > Les comptes rendus |
La Commission entend Mme Rolande Ruellan, présidente de la sixième chambre de la Cour des comptes, sur un rapport demandé à la Cour des comptes, en application de l'article 58-2° de la LOLF, relatif aux comptes et à la gestion de l'Établissement de préparation et de réponse aux urgences sanitaires (EPRUS) depuis sa création.
M. le président Jérôme Cahuzac. J’ai le plaisir de souhaiter en votre nom la bienvenue à Mme Rolande Ruellan, présidente de la sixième chambre de la Cour des comptes, accompagnée de Mme Marianne Lévy-Rosenwald, présidente de section, de M. Christian Phéline, rapporteur et responsable du secteur santé, et de M. Simon Berthoux, auditeur à la Cour.
La commission des Finances vient d’adopter, sur le rapport de M. Gérard Bapt, les crédits de la mission « Santé ».
C’est également sur sa proposition que le bureau de la Commission a décidé, après concertation avec nos collègues des affaires sociales, de demander une enquête sur l’EPRUS. Ce travail, qui va nous être présenté, rappelle les difficultés qui ont accompagné la mise en place de l’établissement. Il nous a semblé naturel de saisir la Cour pour faire le point sereinement. Nous vous remercions de la contribution que vous apporterez à notre réflexion.
Mme Rolande Ruellan, présidente de la sixième chambre de la Cour des comptes. Je vais m’y efforcer, mais il est probable que vous sachiez déjà tout grâce à la commission d’enquête que vous avez constituée.
La demande nous a été adressée à la fin du mois de décembre de l’année dernière. MM. Bapt et Door nous ont confirmé, au mois de février, que la commande portait plus généralement sur les comptes et la gestion de l’EPRUS depuis sa création.
En mai dernier, la commission d’enquête a bien voulu nous auditionner à huis clos, car nos travaux n’étaient pas encore achevés et ils n’avaient donné lieu ni à un débat collégial au sein de la Cour, ni à procédure contradictoire.
Le contrôle a été réalisé par Christian Phéline, avec le concours d’autres spécialistes de la Cour. A la demande de la commission des Affaires sociales du Sénat, nous avons réalisé en parallèle un travail sur la gestion et l’utilisation des fonds destinés à la campagne de lutte contre la grippe A, auquel Simon Berthoux a notamment participé. Ces deux rapports comportent une partie commune, relative au rôle de l’EPRUS dans l’acquisition des vaccins.
Nous n’avons pas jugé utile de convoquer les acteurs déjà auditionnés par les commissions d’enquête des deux Assemblées : nous avons préféré nous appuyer sur les comptes rendus des auditions et travailler selon nos propres méthodes. Nous avons ainsi réalisé des enquêtes sur pièces et sur place, aussi bien à l’EPRUS que dans les départements.
Je rappelle que l’EPRUS est un établissement public administratif créé par la loi du 5 mars 2007 pour remplir deux missions principales : acquérir et gérer des stocks pour faire face à des catastrophes sanitaires, mais aussi constituer et gérer un corps de réserve sanitaire. Entré en action en août 2007, il a connu des débuts très difficiles : à la veille du déclenchement de la campagne de lutte contre la pandémie, il était à peine en état de marche.
Le rapport examine successivement les caractéristiques du nouvel établissement, la façon dont il a été mis en place, la façon dont il a mis en œuvre ses missions, notamment à l’occasion de la récente pandémie, enfin les conditions de son financement.
L’EPRUS est un nouvel opérateur de l’État. Il existait auparavant un plan d’intervention contre les risques de type nucléaire, radiologique, biologique ou chimique, et des stocks d’antibiotiques, d’antidotes, de masques de protection, d’antiviraux, de vaccins avaient été constitués. La Cour avait eu à en connaître à l’occasion de ses travaux sur l’exécution budgétaire et sur les comptes de l’État. Ces plus importants stocks civils de l’État représentaient 210 millions d’euros fin 2005. La Cour avait critiqué leur gestion directe par l’État, relevant différents problèmes en matière d’inventaire physique, de traçabilité, de suivi logistique et comptable, mais aussi de validité des produits après leur date de péremption. En juin 2008, elle avait adressé un référé « confidentiel défense » sur la gestion de ces stocks stratégiques. La ministre avait répondu, au mois d’octobre suivant, que la mise en place de l’EPRUS permettrait d’apporter les réponses nécessaires.
La création d’un tel établissement public administratif paraît totalement justifiée à la Cour, car les missions exercées ne relèvent pas d’une administration centrale. L’utilité de cet établissement de petite taille, qui emploie 35 personnes, n’est pas en cause. Le problème est qu’il dispose de pouvoirs limités, même si c’est un choix que l’on peut comprendre : l’État, garant de la politique de santé publique, conserve la responsabilité principale en cas de crise sanitaire, d’origine terroriste ou épidémique.
La loi charge l’établissement d’acquérir, de fabriquer, d’importer, de distribuer et d’exporter des produits et services nécessaires à la protection de la population, et d’assurer la gestion administrative et financière d’une réserve sanitaire. Il peut également financer des actions de prévention des risques sanitaires majeurs. C’est dans ce cadre que l’EPRUS a financé des masques destinés aux administrations et qu’il a indemnisé les professionnels réquisitionnés. La loi en a fait un simple exécutant des décisions du ministre de la santé, un logisticien chargé d’acheter et de gérer des stocks sanitaires à la demande du ministre.
Son conseil d’administration paritaire, qui réunit l’État et l’assurance-maladie, a des pouvoirs très limitées : les décisions prises par le directeur sur instruction du ministre ne sont pas soumises au conseil d’administration. Tout ce qui concerne les marchés et les conventions est donc exclu de sa compétence, bien que l’assurance maladie finance la moitié des dépenses.
La convention entre l’État et l’EPRUS, signée au début de l’année 2009, témoigne d’une conception extrêmement extensive des pouvoirs de l’État à l’égard de l’établissement. Sur ce point, vous me permettrez de renvoyer aux pages 19 et 20 du rapport. L’EPRUS est « tenu en laisse », si j’ose dire, par le ministère de la santé. La convention avait même prévu que les stocks acquis par l’EPRUS demeuraient la propriété de l’État.
L’EPRUS a également signé une convention avec l’Agence française de sécurité sanitaire des produits de santé (AFSSaPS), qui vise notamment les expertises réalisées par l’agence sur la validité des produits stockés. Une convention a par ailleurs été signée avec la Caisse nationale d’assurance maladie des travailleurs salariés (CNAMTS) et l’Agence centrale des organismes de sécurité sociale (ACOSS) : la CNAMTS finance la moitié des dépenses de l’EPRUS, via l’ACOSS, sur la base des appels de l’établissement. Les fonds restent abrités au sein de la trésorerie de la sécurité sociale tant que l’EPRUS n’en a pas besoin.
Les débuts de l’établissement ont été compliqués par des divergences stratégiques entre son premier directeur et le ministère de la santé. Le directeur actuel, M. Coudert, a reçu une lettre de mission qui lui demandait notamment d’installer l’établissement à la Plaine de France, de constituer une réserve sanitaire et de créer un établissement pharmaceutique. Hormis la constitution de la réserve sanitaire, ces missions ont été accomplies, mais nous déplorons l’absence de tout contrat pluriannuel. Les indicateurs de la mission « Santé » ne peuvent s’y substituer.
Le transfert des stocks sanitaires de l’État a constitué une lourde tâche lors du démarrage effectif de l’EPRUS. Il a fallu constituer en son sein un établissement pharmaceutique. Une fois cet établissement autorisé par l’AFSSaPS, en mars 2009, les stocks de vaccins ont pu être transférés, ainsi que tous les marchés déjà passés, y compris ceux qui étaient achevés – l’exigence de traçabilité l’exigeait.
Conformément à une demande formulée par la Cour et en application de la norme comptable n° 8, les stocks ne figurent plus dans le bilan de l’État, mais dans celui de l’EPRUS. Alors qu’ils ne représentaient que 552 millions d’euros au 31 décembre 2008, leur valeur brute a dépassé un milliard d’euros au 31 décembre 2009.
Nous avons ensuite procédé à une étude de la passation des marchés, qui a eu lieu dans différents cadres : celui des procédures définis par le code des marchés publics (CMP) ; celui de l’article 3-7° du même code, qui dispense de respecter les procédures du code lorsque un marché exige le secret et doit s’accompagner, pour son exécution, de mesures particulières de sécurité, ou bien lorsque la protection des intérêts essentiels de l’État est en jeu ; celui des conventions passées avec l’UGAP (Union des groupements d'achats publics) ; celui d’une convention passée avec la direction centrale du service de santé des armées au sujet d’un antivirus spécifique.
De 2007 à 2009, des marchés concernant des médicaments, des dispositifs médicaux et des services, ou concernant la réserve sanitaire, ont été conclus pour un montant de 584 millions d’euros. Les vaccins et les médicaments acquis pour lutter contre la pandémie H1N1 représentent, à eux seuls, 72 % des achats en 2009.
La Cour a observé des améliorations dans l’organisation de l’EPRUS en matière de passation des marchés. Elle s’est professionnalisée, même si l’établissement demeure une petite structure. Nous avons constaté, en examinant un échantillon de marchés passés dans le cadre du CMP, que l’EPRUS respecte les règles en vigueur. S’agissant des marchés passés en dehors du CMP, la Cour a émis des doutes sur le bien fondé du recours à cette procédure en tant que telle, mais elle n’a pas constaté d’anomalies majeures dans les marchés examinés.
J’en viens à la mise en œuvre des missions de l’EPRUS. La Cour avait déjà appelé l’attention sur la durée de validité des stocks sanitaire et sur les règles de leur valorisation à l’époque où ils étaient gérés par l’État. La durée de validité des antiviraux et des vaccins est fixée par l’autorisation de mise sur le marché (AMM). Or un médicament ayant dépassé la date de péremption peut continuer à présenter une certaine efficacité. Compte tenu du coût des stocks, il est problématique de s’en débarrasser. Comme la Cour a déjà eu l’occasion de l’indiquer, il est urgent de définir une procédure d’appréciation des stocks et de renouvellement. L’AFSSaPS a proposé, après avoir réalisé des tests, d’augmenter la durée d’utilisation de certains produits, mais elle n’a pas le pouvoir d’en décider. Elle réalise une expertise scientifique, sans pouvoir assumer la responsabilité juridique d’une éventuelle décision.
Une solution a pourtant été proposée : la validité des produits pourrait être contrôlée chaque année par des examens réalisés en laboratoire, et les produits destinés aux stocks d’urgence ne mentionneraient plus de date limite ; seuls figureraient alors la date de fabrication et le numéro du lot concerné. Mais l’AFSSaPS est réticente à l’idée de créer deux catégories de médicaments, les uns pourvus d’une date limite, fixée dans le cadre de l’AMM, les autres sans date limite. En l’absence de base légale, aucune solution n’est envisageable pour le moment.
M. Gérard Bapt. Dans l’hypothèse où la décision serait prise par l’AFSSaPS, la logique voudrait que l’État en assume la responsabilité.
Mme Rolande Ruellan. L’AFFSAPS n’est qu’un opérateur scientifique. Il faudrait une disposition législative habilitant l’État à garantir la validité des produits sur la base des tests réalisés.
M. Gérard Bapt. L’agence n’est pas qu’un simple opérateur. Son directeur général prend prendre la décision de retirer un produit du marché…
M. le président Jérôme Cahuzac. Mais il ne peut pas prolonger sa durée de validité au-delà de la date prévue par l’AMM.
Mme Rolande Ruellan. Les questions de péremption ont évidemment des traductions comptables en matière de dépréciation des stocks. Alors que l’EPRUS a longtemps récusé la notion d’« utilisabilité », il a prévu de déprécier, à partir de la fin de l’année, la totalité de la valeur des articles périmés mais non détruits, dès lors que l’AFSSaPS n’a pas formellement étendu leur durée de validité. Nous restons, en revanche, dans l’incertitude pour les autres produits.
Cette question a, bien sûr, une incidence sur le renouvellement des produits : on ignore quand il faut les détruire et les sortir des stocks. Il n’existe pas aujourd’hui de politique de renouvellement bien établie. Compte tenu des masses financières en jeu, mieux vaudrait procéder à un étalement dans le temps.
Je ne reviens pas, pour le moment, sur le stockage des produits, qui pose des questions essentielles en matière de sécurité et de disponibilité – certains produits doivent être rapidement accessibles –, mais aussi en matière de conditions de conservation. Je rappellerai seulement qu’il existe un projet de stockage à Vitry-le-François, dans une enceinte militaire. La gestion logistique et les systèmes d’information constituent des enjeux considérables : il faut assurer la traçabilité des stocks et parvenir à savoir à tout moment où on en est.
A peine créé, l’EPRUS a été conduit à passer des marchés considérables pour l’acquisition de vaccins dans le cadre de la lutte contre l’épidémie H1N1. Ces marchés ont représenté 446 millions d’euros entre 2009 et 2010, ce montant n’inclut pas les antiviraux déjà en stock, ni les masques qui auraient dû être renouvelés parce qu’ils étaient arrivés à la date de péremption. Sur ce point, le Gouvernement a présenté un décret d’avance que vous avez trouvé contestable, le renouvellement des masques faisant partie des missions normales de l’EPRUS en l’absence de toute pandémie.
Les acquisitions de vaccins ont été réalisées sous la forme d’avenants à deux contrats déjà signés avec Sanofi Pasteur et Novartis dans le cadre de la lutte contre la grippe aviaire, et de deux contrats soumis à l’article 3-7° du code des marchés publics, le plus important d’entre eux ayant été signé avec GSK, et l’autre avec Baxter. Au total, 94 millions de doses ont été commandées afin de vacciner l’ensemble de la population à raison de deux doses par personne – on avait estimé que 25 % de la population n’accepteraient pas de vaccination. Les deux contrats préexistants ne permettant pas de fournir un tel nombre de doses, il a fallu se tourner vers d’autres fournisseurs, notamment GSK, qui était le seul à promettre de fournir 50 millions de doses.
La France s’est alors trouvée en concurrence avec d’autres pays face aux quelques laboratoires qui pouvaient assurer une production aussi importante dans de si brefs délais. Une course de vitesse s’est engagée, chaque État ayant peur de ne pas pouvoir protéger sa population s’il s’y prenait trop tard. Sans prétendre que les laboratoires ont fait du chantage, on peut dire qu’ils ont exercé une pression lorsqu’ils ont fait savoir qu’ils ne s’engageraient pas à fournir des vaccins au-delà d’une certaine date. C’est un élément qu’il faut retenir à la décharge des pouvoirs publics.
Quatre contrats ont été conclus en juillet et en août 2009 pour un montant de 712 millions d’euros TTC. L’achat de 50 millions de doses ayant été finalement annulé, le coût des vaccins s’est élevé à 382 millions d’euros, y compris les indemnités de résiliation partielle.
Les marchés ont été passés dans des conditions très particulières : leur passation a été très encadrée par la ministre et par son cabinet. La politique de commande et de négociation a été exclusivement définie par le ministère, tant en ce qui concerne les décisions de principe que les éléments de négociation. Parfois, la pré-négociation a même été conduite directement par le ministère. Il faut se replacer dans le contexte d’urgence de l’époque pour le comprendre.
M. Gérard Bapt. Quid des prix ?
Mme Rolande Ruellan. Il n’y a pas eu de discussion. On aurait pourtant pu essayer de renégocier les prix dans le cadre des contrats déjà passés avec Sanofi et Novartis. Quand on sait que le prix demandé par GSK était de sept euros, dont six euros pour le seul adjuvant et un euro pour l’antigène, on peut se demander si le prix des vaccins sans adjuvant n’aurait pas dû être beaucoup plus faible.
Je le répète : il n’y a pas eu de négociation sur les prix. Ce n’est pas l’EPRUS qui en a décidé ainsi, mais le ministère. Nous avons même constaté, en réalisant l’étude demandée par le Sénat, que les instructions sont remontées jusqu’au Premier ministre et à l’Elysée. La prise de décision a dépassé de très loin l’EPRUS, qui s’est contenté de signer et d’exécuter des marchés en partie pré-négociés. Nous en concluons qu’il y a eu une sorte de partage du pouvoir adjudicateur.
J’ajoute que le recours à l’article 3-7° du code des marchés publics, qui fait l’objet d’une étroite surveillance de la Commission européenne, a été quasiment dicté à l’EPRUS dans une lettre qui lui était adressée. La rédaction des contrats a également été prédéterminée. On est donc allé bien au-delà de ce que prévoyait la lettre de la loi et de la convention signée avec l’EPRUS. Les contacts préalables avec les laboratoires ont été établis directement par le cabinet de la ministre.
Les quantités, les prix et les conditions de résiliation ont été exclus de la négociation. Nous avons par ailleurs établi que les conditions très restrictives qui encadrent le recours à l’article 3-7° du CMP n’étaient pas réunies. Il aurait été possible de recourir à l’article 35-II-1° du même code, qui permet en cas d’urgence impérieuse de contracter sans publicité et sans mise en concurrence, mais en respectant un certain nombre de garanties, telles que les règles régissant l’octroi des avances et des acomptes aux fournisseurs. De fait, ce ne sont pas les laboratoires, mais plutôt les États qui étaient en concurrence.
Malgré d’importantes incertitudes sur le virus, dont on redoutait des mutations, et sur la date de disponibilité des vaccins – les laboratoires ne s’engageaient pas sur les délais, de telle sorte qu’on ne pouvait pas savoir s’il serait possible de vacciner toute la population avant le début de l’épidémie –, des commandes fermes ont été passées. Aucune clause conditionnelle n’a été prévue, ni aucune clause de renégociation.
Le conditionnement en multidoses a été imposé par certains laboratoires, tels que GSK, et des clauses d’irresponsabilité ont laissé aux pouvoirs publics le soin d’apporter la preuve de la faute du fabricant, même si ces clauses ont été adoucies par rapport aux premières exigences de GSK. Heureusement qu’il n’y a pas eu d’accident grave à la suite des vaccinations ! L’État est, en revanche, resté ferme sur l’exigence, essentielle, de l’obtention d’une AMM.
Ces autorisations ont été très vite délivrées, mais les délais ont été longs à cause de la faiblesse du rendement antigénique du vaccin. On sait par ailleurs que l’Agence européenne du médicament avait indiqué, dès le 20 novembre 2009, qu’une seule dose suffirait. Il est vrai que le Haut conseil de la santé publique s’est prononcé un peu plus tard, mais on aurait tout de même pu éviter d’attendre le début du mois de janvier pour procéder à la dénonciation, unilatérale ou négociée, d’une partie des commandes. Des vaccins ont donc été produits en quantités excessives pendant toute cette période. On savait aussi, compte tenu de la faible létalité du virus, que le niveau d’adhésion de la population à la vaccination serait faible.
Les réductions de commande ont fait l’objet d’une négociation pour un contrat passé avec Sanofi et de trois décisions unilatérales à l’égard de GSK, de Novartis et de Sanofi. Il n’y a finalement pas eu de recours contre ces décisions unilatérales. Le montant des indemnisations versées n’a donc pas dépassé les 48 millions prévus. Les délais de recours sont expirés depuis la fin du mois d’août dernier.
Au total, la dépense s’élève à 382 millions TTC pour 44 millions de doses. Seuls six millions de doses ont été utilisés en France pour la vaccination de 5,3 millions de personnes – certaines d’entre elles ont reçu deux doses, soit parce qu’elles ont été vaccinées tout au début de la campagne, soit parce qu’il s’agissait d’enfants qui n’étaient pas du tout protégés à l’origine. Des doses ont été revendues à Monaco et au Qatar, mais la facture n’en a été allégée que de 6,8 millions d’euros.
Les pertes en lignes, sujet sur lequel nous revenons plus en détail dans le rapport réalisé pour le Sénat, ont été considérables. Certaines doses devaient être détruites, soit parce que la chaîne du froid a été rompue, soit parce qu’elles ont été ouvertes sans que les dix doses conditionnées ensemble soient utilisées, mais on constate également qu’une partie des vaccins a été tout simplement perdue. L’EPRUS n’était pas responsable des doses en dehors de ses propres plateformes départementales. On ignore combien il en reste dans les centres de vaccination et dans les pharmacies. Cela étant, ces doses seront périmées au plus tard en novembre 2011, et l’actuel vaccin contre la grippe saisonnière inclut la souche H1N1 : les doses restantes ne présentent donc plus d’utilité.
J’en viens à la réserve sanitaire, dont la constitution était la première mission assignée à l’EPRUS lors de sa création, à l’initiative du Sénat. Après la canicule de l’été 2003 et l’épidémie de chikungunya, il s’agissait de disposer d’un corps de professionnels de santé volontaires ayant bénéficié d’une formation préalable, dotés de modalités propres d’indemnisation, jouissant d’une protection personnelle et susceptibles d’intervenir très rapidement, y compris à l’étranger. Deux types de réserves étaient prévus : une réserve d’intervention, plutôt formée de professionnels en activité, et une réserve de renfort, composée d’étudiants et de retraités, même si le partage entre les deux types de réserves n’était pas très clair. Les effectifs prévus – 1 000 professionnels de santé pour la réserve d’intervention et 20 000 pour la réserve de renfort – étaient trop ambitieux par rapport au nombre d’étudiants et de professionnels retraités depuis moins de trois ans disponibles.
Je rappelle, en outre, que l’appel à la réserve doit être décidé par arrêté conjoint du ministre de la santé et du ministre chargé de la sécurité civile et qu’une doctrine d’emploi de la réserve a été annexée au contrat entre l’État et l’EPRUS.
Le dispositif est monté en charge très lentement et il n’a jamais été vraiment utilisé selon les règles prévues, sauf dans trois cas relatifs à l’épidémie grippale et un cas à Haïti. Pour le reste, c’est la procédure de réquisition, en vigueur depuis longtemps, qui a été utilisée pour obtenir le concours des professionnels de santé. L’Agence européenne du médicament ayant exigé la présence d’un médecin, il a fallu solliciter très vite des médecins dans les centres de vaccination. Des flottements importants ont été alors constatés : des confusions dans les références aux articles du code, ou encore des sollicitations de médecins par voie d’arrêté du seul ministre de la santé, voire par simple lettre. Tout cela ne pose pas seulement des problèmes au plan procédural, mais aussi au plan budgétaire, car les financements de la CNAMTS ne doivent pas être affectés à la réserve sanitaire. Toutefois, il faut être conscient qu’il n’existait pas, en l’absence de réserve sanitaire opérationnelle, d’autre solution que les réquisitions de médecins auxquelles les services déconcentrés sont habitués.
Au plan budgétaire, les crédits destinés à la réserve sanitaire n’ont pas été entièrement consommés, car la réserve est montée très lentement en charge, et les conditions ont été desserrées.
L’expérience récente devrait servir à repenser la réserve sanitaire. Une réflexion a d’ailleurs été lancée, dans tous les ministères concernés, pour coordonner les différentes catégories de réserves actuelles : il s’agirait de constituer une sorte de grande réserve de sécurité nationale, incluant les pompiers, les militaires, la sécurité civile et la réserve sanitaire.
J’en terminerai par les modalités de financement, question à laquelle votre Commission est naturellement sensible. Un principe de financement paritaire a été retenu pour les dépenses concernant les produits stratégiques et les produits nécessaires pour les actions de prévention, ce qui exclut la réserve sanitaire, comme je l’ai indiqué tout à l’heure. Le principe s’apprécie sur trois exercices consécutifs, mais on ne sait pas encore s’il s’applique aux dépenses décaissées ou aux dépenses encourues.
Les dépenses de l’État ont été imputées sur le programme 204 de la mission « Santé », à l’action n° 16, et sur le programme 128 de la mission « Sécurité civile ». Le bilan n’a toujours pas été réalisé pour les années 2007 à 2009, mais nous avons observé un surfinancement de l’État et plus encore de l’Assurance maladie. Les versements ne se faisant qu’en fonction des besoins, la sécurité sociale conserve les fonds dans sa trésorerie, mais les sommes considérées restent dues à l’EPRUS.
Les prévisions 2010 font état de 184 millions de dotations inutilisées en provenance de l’Assurance maladie et de 42 millions en provenance de l’État. La loi de financement de la sécurité sociale pour 2011 prévoit un reversement de 100 millions à la CNAMTS.
L’intégralité des dépenses de l’EPRUS liées à la prévention de la grippe H1N1, soit 446 millions, a été financée par des dotations votées en loi de financement de la sécurité sociale (LFSS) et en loi de finances pour 2009. Les crédits pour 2010 sont donc excessifs, ce qui conduit à d’importants reports de crédits – 226 millions à la fin de l’année. On peut penser que cette situation conduira à une réduction des dotations futures de l’assurance maladie et de l’État, mais l’absence de bilan triennal ne facilite pas la tâche.
Les modalités de financement retenues nous paraissent quelque peu contestables. Une avance massive de 879 millions de la CNAMTS a ainsi été prévue pour préfinancer l’achat des vaccins. Cette procédure a été justifiée par l’urgence, alors qu’on aurait pu recourir à un décret d’avance, solution également très rapide. L’argument selon lequel il fallait éviter la constitution d’une réserve de trésorerie me semble plus convaincant : si un décret d’avance avait été adopté, les crédits n’auraient pas été mobilisés en fonction des besoins, mais immédiatement versés. En fin de compte, seuls 78 millions d’euros ont été utilisés.
Comme vous, nous avons en outre trouvé contestable le recours à un décret d’avance pour la fourniture de masques, mais je n’y reviens pas.
Une contribution exceptionnelle des organismes complémentaires d’assurance maladie a été prévue par la LFSS pour 2010. Initialement fixée à 0,94 % du chiffre d’affaires, elle a ensuite été ramenée à 0,77 %, car, les vaccins ayant bénéficié d’une AMM, le taux réduit de TVA s’est appliqué. Elle devrait finalement être réduite à 0,34 % par la LFSS pour 2011. Objet de nombreux amendements, le produit de cette contribution a été attribué à la CNAMTS, qui pourra ainsi financer la campagne des bons de vaccination. Au total, les soins imputables à la grippe A auront coûté 95 millions d’euros.
En conclusion, on peut dire que l’EPRUS a été soumis à rude épreuve alors même qu’il était à peine en état de fonctionner. Ce fut une expérimentation grandeur nature – et même davantage. Les critiques que nous formulons ne s’adressent pas tant à l’établissement lui-même, qui s’est comporté en bon exécutant, qu’aux autorités de tutelle. Ce sont elles qui ont réalisé tous les choix en matière de stratégie, de financement et de modalités techniques, y compris pour la passation des marchés.
Il faut maintenant se tourner vers l’avenir en tirant toutes les leçons possibles, aussi bien pour la gestion des pandémies que pour le fonctionnement de l’EPRUS lui-même : un bilan du cofinancement doit être enfin réalisé et il faut établir un contrat de performances pluriannuel pour définir des orientations en matière de réserve sanitaire, de doctrine de renouvellement des stocks, de stockage et de cofinancement.
M. le président Jérôme Cahuzac. Merci pour cet exposé fort complet et fort intéressant : vous avez répondu par anticipation aux questions que je souhaitais vous poser.
M. Gérard Bapt. Nous n’avons hélas pas eu le temps d’étudier votre rapport avant cette audition qui, par certains aspects, me rappelle celles de la commission d’enquête sur la grippe…
Vous avez évoqué la relative faiblesse du conseil d’administration de l’établissement, mais avez-vous fait des propositions pour revoir le statut et les missions de l’EPRUS ?
Mme Rolande Ruellan. Non, notre rapport ne comporte pas de propositions à cet égard.
M. Gérard Bapt. Dans un article, un professeur de droit conteste la légalité des conditions dans lesquelles les contrats ont été passés, un peu dans l'urgence, entre l'État et les laboratoires. C'est aussi ce que vous pointez du doigt dans votre rapport.
M. Christian Phéline. Il y est même fait explicitement référence, page 70, à cet article de M. François Brenet : « Le droit des marchés publics, victime de la grippe A ? »
M. Gérard Bapt. Quatre laboratoires ont été concernés, Sanofi et Novartis par des pré-contrats, GSK et Baxter lorsque l’OMS a lancé le signal d’urgence sanitaire. Si le pré-contrat permet de négocier, il présente l'inconvénient de reposer sur des hypothèses qui ne se confirment pas obligatoirement – en l'espèce, on était parti sur celle du virus H5N1 – et de porter sur des produits dont on ignore la nature, si ce n'est qu'ils sont de type vaccinal. Quant aux contrats passés dans l'urgence, leur principal défaut est qu'on est alors sous la pression : GSK a ainsi menacé, si la commande n'était pas passée tout de suite et au prix voulu, de livrer sa production à d'autres demandeurs. Il paraît donc difficile à un gestionnaire de faire un choix entre les deux formules.
J'avoue que j'ignorais le problème lié à la responsabilité lorsqu'un produit est prorogé. Certes, les vaccins ne le seront pas et les premiers seront d'ailleurs périmés dès ce mois-ci, mais il y a déjà eu des prorogations pour les antiviraux. Si je comprends bien, une initiative législative est nécessaire pour sortir de cette situation, mais je vois mal comment formuler un amendement au projet de loi de finances qui ne soit pas qualifié pas de cavalier budgétaire... Faut-il s'en remettre à l'initiative gouvernementale ou devrions-nous déposer une proposition de loi ?
Mme Marie-Anne Montchamp. Vous avez évoqué, madame Ruellan, le milliard d'euros de stocks au bilan de l’EPRUS ainsi que cette question des dates de péremption. Avez-vous une idée de l’effet de valorisation comptable qu'aurait une initiative législative permettant de prolonger la durée de validité du stock ?
M. Louis Giscard d'Estaing. Ma question a trait aux liens entre l’EPRUS et le ministère de la défense, dont nous avons examiné le budget ce matin même. Vous avez mentionné le projet de construction d'un hangar de stockage, sur une emprise militaire à Vitry-le-François. À la lecture de votre rapport, je n'ai pas l'impression qu'il s'agisse d'une cession, donc que le ministère puisse en attendre une recette immobilière. Le confirmez-vous ?
Plus généralement, quelles sont les relations entre l’EPRUS et le service de santé des armées, certaines de leurs missions semblant se recouper ?
Mme Rolande Ruellan. M. Bapt a évoqué les pré-contrats. En fait, il s’agissait de contrats existants, qui auraient pu être mobilisés si le virus de la grippe aviaire avait prospéré, et auxquels des avenants ont été passés ultrieurement. On peut s’étonner qu’un avenant soit passé pour un virus à un contrat qui en concernait un autre, mais apparemment cela n’a pas posé problème. Il semble en outre assez difficile de se positionner par anticipation vis-à-vis d’un virus qu’on ne connaît pas…
Je ne vois pas d’autre solution qu’une disposition législative pour autoriser la prorogation de la responsabilité d’un produit, mais je n’ai pas compétence pour dire quel serait le vecteur le plus approprié.
La prorogation aurait effectivement un effet comptable mais l’on ne sait guère comment calculer les provisions pour dépréciation de stocks.
Mme Marie-Anne Montchamp. Il serait pourtant nécessaire de chiffrer les différents scénarios envisagés…
Mme Rolande Ruellan. À ma connaissance, aucun loyer n’est prévu au profit du ministère de la défense pour le site de Vitry-le-François.
M. René Couanau. Il est probable que les gouvernements seront confrontés, dans les années qui viennent, à d'autres événements du même type, donc à la nécessité de réagir rapidement. À la lumière de votre analyse de la conduite des marchés et des décisions qui ont été prises, pensez-vous qu'il serait justifié de modifier la réglementation des marchés précisément pour permettre d'agir plus vite, c'est-à-dire de mettre la législation en conformité avec les faits ?
Mais j'ai une autre question, plus impertinente, à tel point qu'elle aurait pu être posée par notre collègue Jean-Pierre Brard… Le rapport de la Cour des comptes insiste sur l'impact de tout ceci sur les finances publiques, mais n'aurait-il pas été également utile de voir quel a été l'effet sur les résultats des quatre grands groupes pharmaceutiques concernés ? Ne pourrait-on, par exemple par l'intermédiaire des services fiscaux, voir s'ils en ont tiré des bénéfices exceptionnels ? A-t-on évalué la fluctuation de leurs cours en bourse en fonction des événements ? J'ajoute que, dans la mesure où l’État était en situation de faiblesse au regard du non-respect des marchés, si ces entreprises ont fini par accepter que ce contentieux se règle à l'amiable, c'est sans doute parce que, au bout du compte, cette affaire s'est soldée pour elles par des gains et non par des pertes.
M. Christian Phéline. Nous évoquons page 24 du rapport la coopération avec le service de santé des armées. Elle a fait l’objet d’une convention, en particulier sur la fabrication de produits par la pharmacie centrale des armées, sur le partage de responsabilités logistiques et sur les échanges de produits. Tout ceci est assez technique et bien maîtrisé de part et d’autre.
Il n’est pas question de déposséder les armées du site de Vitry-le-François, qui sera simplement utilisé en coopération. La responsabilité budgétaire des équipements a été débattue au conseil d’administration de l’EPRUS, qui doit maintenant définir avec sa tutelle les modes de financement. Il est en revanche un peu prématuré de se pencher sur les échanges ultérieurs de services et sur les compensations économiques.
S’agissant des prorogations, les réalités juridique et comptable sont quelque peu différentes, la seconde privilégiant fort logiquement les aspects pratiques. Les articles du code de la santé qui règlent les AMM et la responsabilité de l’AFSSaPS ne permettent pas de modifier la date de péremption – sauf à prendre une nouvelle AMM, ce qui supposerait une demande du laboratoire pour l’ensemble des stocks. Même si le ministère aurait sans doute jadis souhaité qu’il en aille différemment, il paraît aujourd’hui évident que le cadre légal ne permet pas de considérer qu’un certificat délivré par l’AFSSaPS – dont elle dit elle-même qu’il est purement technique – pourrait être l’équivalent juridique de l’AMM et opposable à ce titre.
C’est une question de responsabilité : si on utilise un produit simplement sur la base d’un tel certificat, le fournisseur est déchargé de sa responsabilité et les professionnels de santé pourraient être mis en cause en cas d’incident. On a pu envisager de recourir à l’article L. 3331-1 du code de la santé publique, qui permet au ministre, en cas de situation d’urgence grave, de prendre des dispositions qui dégagent la responsabilité de l’usage du produit, dans une mesure proportionnée au risque encouru, mais cela ne vaut pas pour des produits qui sont en stock de façon pérenne et dont l’utilisation ne paraît pas justifiée par une situation d’urgence.
Pour toutes ces raisons, la voie législative fait l’objet de réflexions depuis les premiers rapports de la Cour. Aux États-Unis, le stock d’État a un statut juridique particulier.
Cette réflexion juridique ne préjuge pas des questions logistiques, en particulier quant à la nécessité de réétiqueter les produits.
À partir du moment où l’AFSSaPs a délivré un certificat pour une catégorie de produits et où ce produit n’est pas détruit, du point de vue comptable, on peut admettre qu’il demeure « sanitairement » utilisable, même s’il y a des obstacles juridiques à son utilisation effective. Tout ceci ayant des incidences budgétaires, une demi-mesure a été prise en 2009. Entre temps, le ministère avait élaboré une doctrine aux termes de laquelle, dès lors qu’il a demandé à l’AFSSaPs de prendre une décision, même si cette dernière n’a pas été prise, on maintient en stock. Nous critiquons cette position : si la décision n’est pas prise avant la date de péremption, on doit opérer une dépréciation. Il semble qu’il y a désormais accord entre la comptabilité publique, le ministère de la santé et l’EPRUS, lequel nous a annoncé qu’il dépréciera fin 2010 tous les produits qui se trouveraient dans cette situation. Le rapport comporte un tableau qui montre ce que serait le rythme de dépréciation du milliard d’euros de stocks qui a été évoqué, dans l’hypothèse où on ne ferait rien. Si on perd plus d’un tiers de la somme les deux premières années, en raison du stock de vaccins antigrippaux, par la suite, les pertes sont de l’ordre de 150 millions chaque année et c’est dans cette proportion qu’il faut envisager un étalement des renouvellements.
Mme Marianne Lévy-Rosenwald. Si le bilan du partage des dépenses entre l’État et l’assurance-maladie n’a pas été fait, l’article 6 du PLFSS pour 2011 prévoit un remboursement par l’EPRUS de 331,6 millions à l’assurance-maladie, ce qui correspond, peu ou prou, au report des dotations non consommées lors de la période 2006-2009.
Une autre disposition du PLFSS 2011, la réduction de 0,77 à 0,34 % du taux de la contribution demandée aux complémentaires, confirme ce que nous avançons dans le rapport.
Mme Rolande Ruellan. M. Couanau a posé une question très iconoclaste sur la modification de la réglementation des marchés, dont un article permet, en cas d’urgence, de s’affranchir de beaucoup de règles, tout en conservant quelques garde-fous. Nous disons simplement qu’il ne fallait pas priver l’EPRUS de toute garantie alors que les intérêts vitaux du pays n’étaient pas menacés à un point justifiant cette entorse aux principes. Outre que les assouplissements du code des marchés publics intervenus ces dernières années permettent déjà d’agir, mieux vaut ne pas s’affranchir de toutes règles lorsque des sommes aussi importantes sont en jeu.
M. le président Jérôme Cahuzac. Merci beaucoup.
Je suis persuadé que les conseils de la Cour seront très utiles aux pouvoirs publics pour gérer au mieux à l’avenir des événements de ce genre, qui m’apparaissent inéluctables face d’une part à la loterie sanitaire que représente l’adaptation à l’homme des virus animaux, d’autre part à l’application généralisée du principe de précaution, notamment sur le plan politique.
*
* *
Membres présents ou excusés
Commission des finances, de l'économie générale et du contrôle budgétaire
Réunion du jeudi 14 octobre 2010 à 11 h 30
Présents. - M. Gérard Bapt, M. Michel Bouvard, M. Jérôme Cahuzac, M. René Couanau, M. Louis Giscard d'Estaing, M. Jean-Louis Idiart, Mme Marie-Anne Montchamp
——fpfp——

COMMUNICATION
A LA COMMISSION DES FINANCES, DE L’ECONOMIE
GENERALE ET DU CONTRÔLE BUDGETAIRE
(article 58-2 de la LOLF)
ET À LA COMMISSION DES AFFAIRES SOCIALES
(article LO 132-3-1 du code des juridictions financières)
DE L’ASSEMBLEE NATIONALE
LES COMPTES ET LA GESTION
DE L’ETABLISSEMENT DE PRÉPARATION
ET DE RÉPONSE AUX URGENCES SANITAIRES (EPRUS) DEPUIS SA CRÉATION
Septembre 2010
AVERTISSEMENT
Le rapport qui suit a été établi sur la demande formulée par la Commission des finances, de l’économie générale et du contrôle budgétaire et la Commission des affaires sociales de l’Assemblée nationale par une lettre du 3 décembre 2009 se référant à l’article 47-2 de la Constitution, relative à l’élaboration d’un rapport d’enquête « sur les comptes et la gestion de l’EPRUS depuis sa création ». En conséquence, la présente enquête a été conduite dans le cadre des articles 58-2 de la LOLF et LO 132-3-1 du code des juridictions financières. Les observations de la Cour ont été soumises à la direction de l’EPRUS et aux administrations concernées afin de recevoir leurs remarques qui ont été prises en compte dans la rédaction finale de ce rapport.
SOMMAIRE
Avertissement
Synthèse
INTRODUCTION
PARTIE I : UN NOUVEL OPERATEUR DE l’ETAT 9
A. UN NOUVEL ETABLISSEMENT PUBLIC ADMINISTRATIF 9
1. Les urgences sanitaires : un enjeu majeur 9
2. Les limites d’une gestion directe par l’Etat 10
3. Le choix de la création d’un établissement public 10
4. Un nouvel opérateur de l’Etat, cofinancé par l’assurance maladie 12
B. UNE MISSION DE MISE EN ŒUVRE ET NON D’ORIENTATION STRATEGIQUE 13
1. Un établissement chargé d’importantes missions de mise en œuvre 13
2. Un pouvoir d’impulsion relevant toujours du ministre 14
3. Un conseil d’administration à la compétence limitée 16
PARTIE II : LA MISE EN PLACE DE L’ETABLISSEMENT 18
A. LA FORMALISATION DES RAPPORTS AVEC LA TUTELLE ET LES PRINCIPAUX PARTENAIRES 18
1. La convention Etat-EPRUS 18
2. L’exercice de la tutelle 20
3. La convention avec la CNAMTS et l’ACOSS 21
4. La convention avec l’AFSSaPS 21
5. Les relations avec le ministère de la défense et le ministère de l’intérieur 22
6. Contrat de performance : une négociation toujours différée 24
B. LE RECRUTEMENT DU PERSONNEL ET SON ORGANISATION 27
1. La direction et l’organigramme 27
C. LES LOCAUX ET LES INVESTISSEMENTS 29
1. Le déménagement à Saint-Denis 29
2. Les investissements informatiques et les outils de gestion 30
D. LE TRANSFERT DES STOCKS SANITAIRES 31
1. L’établissement pharmaceutique : une mise en place différée de deux ans 31
2. Un transfert désormais achevé du pouvoir adjudicateur 32
3. Une inscription des stocks s’opérant désormais dans la comptabilité de l’établissement 32
E. LA PASSATION DES MARCHES 34
1. Les commandes de l’établissement 34
2. Organisation et contrôle des procédures 37
3. Observations sur quelques marchés et conventions 38
PARTIE III : LA MISE EN ŒUVRE DES MISSIONS 42
A. LA GESTION DES STOCKS SANITAIRES 42
1. Les durées de validité et les règles de valorisation 42
2. La programmation des renouvellements 52
4. La gestion logistique et le système d’information 56
B. LA GESTION DES STOCKS ACQUIS POUR LA LUTTE CONTRE L’EPIDEMIE H1N1. 58
2. La passation des marchés 62
3. L’exécution et la renégociation des contrats relatifs aux vaccins 84
4. Les reventes et dons internationaux de vaccins 91
5. La gestion logistique des produits 92
6. L’utilisation du stock de produits de prévention H1N1 : un premier bilan 96
C. LA CONSTITUTION ET L’ORGANISATION DE LA RESERVE SANITAIRE 100
1. Réglementation et « doctrine d’emploi » de la réserve 101
2. La constitution de la réserve 103
4. Une gestion budgétaire marquée par des risques importants et une sous-consommation de départ 111
5. Une réorientation nécessaire 112
D. LES ACTIVITES INTERNATIONALES 113
1. Plusieurs interventions d’urgence à l’étranger 113
2. Des coopérations internationales encore limitées 115
PARTIE IV : LE FINANCEMENT DE L’EPRUS 116
A. Un financement à parité par l’Etat et les régimes obligatoires de base d’assurance maladie 116
1. Un principe légal clairement affirmé 116
2. Un surfinancement de l’EPRUS, déséquilibré au détriment de l’assurance maladie 117
3. Un bilan toujours en suspens à l’issue de la période 2007-2009 118
1. Une succession de décisions budgétaires modificatives en 2009 123
2. Un usage inapproprié de la procédure des décrets d’avance 124
4. Une révision budgétaire significative en décembre 2009 127
5. L’annulation partielle des commandes de vaccins 128
1. La formation du résultat 129
2. La physionomie du bilan 130
SYNTHESE
Issu en 2007 d’une proposition sénatoriale, l’EPRUS constitue un nouvel opérateur de l’Etat dans le domaine sanitaire. Sa création visait à la fois à surmonter les limites rencontrées par une gestion administrative directe de l’acquisition et la gestion des stocks publics de produits sanitaires et à mettre en place un nouveau cadre de mobilisation de personnels de santé aptes à faire face à des situations d’urgence, la réserve sanitaire.
1. Un établissement voué à des tâches de mise en œuvre
Le législateur a entendu réserver à l’autorité ministérielle d’importants pouvoirs propres de décision dans la conduite de telles activités. Ce choix assigne des limites étroites à l’autonomie de l’établissement et au pouvoir délibératif de son conseil d’administration, restriction qui s’est trouvée sensiblement accrue par les termes assez impérieux de la convention passée début 2009 entre l’Etat et l’EPRUS et par les instructions particulièrement impératives et détaillées adressées à ce dernier au sujet de la passation puis de la renégociation des marchés relatifs à la campagne de lutte contre la grippe H1N1. Dans ces conditions, l’association de la Caisse nationale de l’assurance maladie des travailleurs salariés (CNAMTS) au conseil d’administration souhaitée par le législateur conserve un caractère relativement formel, alors même que l’assurance maladie est appelée à cofinancer les principales activités de l’établissement, dans la limite d’un plafond légal de 50 % des dépenses concernées.
Si la complexité des tâches de constitution de gestion logistique des stocks comme de la réserve sanitaire suffit à justifier la création d’un établissement public, l’autonomie de celui-ci doit légitimement se concilier avec la responsabilité de conception stratégique qui revient à l’Etat dans un domaine aussi sensible. Dans la recherche délicate d’un tel équilibre, il est impératif qu’au-delà d’une phase de mise en place puis d’une situation d’urgence, le mode d’exercice de la tutelle fasse désormais plus substantiellement droit au potentiel d’expertise et de proposition de l’établissement et à la pleine information de son conseil d’administration.
2. Une mise en place difficile
La mise en place de l’EPRUS a été marquée par d’importantes hésitations ou difficultés qui se sont traduites par le départ de son premier directeur général à l’été 2008 et par d’importants retards dans la constitution de ses effectifs, la passation des conventions prévues avec l’Etat et les différents partenaires institutionnels de l’Agence centrale des organismes de sécurité sociale (ACOSS) et de l’Agence française de sécurité sanitaire des produits de santé (AFSSaPS), la constitution juridique d’un établissement pharmaceutique apte à gérer des stocks de produits de santé, le transfert effectif du pouvoir adjudicateur et le recrutement des premiers effectifs de la réserve sanitaire.
Ce n’est qu’à la fin du printemps 2009 que l’établissement a pu réunir les conditions d’une intervention opérationnelle. Cette même période a également permis de réaliser d’importants progrès en matière de système d’information ou d’outils de gestion, d’arrêter les grandes lignes d’un schéma directeur de stockage et d’aboutir, à partir des comptes 2009, à des modes d’enregistrement des stocks et de leur péremption tendant à se conformer aux recommandations de la Cour.
Ces premières mesures d’organisation ont permis à l’établissement de répondre pour l’essentiel en bon ordre de marche aux tâches qui lui ont été confiées à partir de la mi 2009 dans la gestion de la campagne contre la grippe H1N1 qui a constitué pour lui un « baptême du feu ».
3. Un rouage essentiel de la campagne de lutte contre la grippe H1N1
Conçue et conduite par les pouvoirs publics dans un climat d’urgence, la stratégie de vaccination générale alors retenue faisait reposer sur l’EPRUS tant la négociation de contrats de fournitures sanitaires d’un montant élevé que les tâches logistiques de mise en place des vaccins et autres produits de santé puis de remontée de ceux qui n’avaient pas été utilisés.
Les conditions dans lesquelles ont été conduites tant la passation des contrats que leur renégociation font apparaître de multiples faiblesses qui relèvent cependant davantage de la stratégie de négociation définie par la tutelle que des tâches de pure exécution réservées à l’établissement : recours discutable à l’article 3-7° du code des marchés publics, absence de clauses conditionnelles permettant un ajustement aux incertitudes sur les délais et les quantités, exigences imposées par les fournisseurs en matière de prix, de mode de conditionnement ou de clauses d’irresponsabilité, caractère tardif de la dénonciation unilatérale des contrats (l’indemnisation due aux fournisseurs à l’issue de celle-ci s’élève en définitive à 48,5 M€).
De même un bilan quantitatif de la vaccination met en lumière la très faible proportion de doses effectivement utilisées sur le territoire national (13,4 % des livraisons) ainsi que la part élevée (1/3) des vaccins mis en place qui ont été perdus ou devront être détruits. Ces constats ne mettent pas en cause la responsabilité logistique de l’établissement qui s’arrêtait au stade des répartiteurs. La mise en place des produits de la campagne H1N1 a au demeurant permis à l’EPRUS d’anticiper la mise en place de plateformes logistiques zonales. D’importants progrès sont également en cours pour mieux assurer la cohérence entre inventaire physique et comptabilisation des stocks.
4. Un financement ayant fait massivement appel à l’assurance maladie en 2009
Le financement de la campagne de vaccination et de l’acquisition des vaccins s’est fondé sur des procédures budgétaires parfois discutables et en faisant recours à une avance de l’assurance maladie. La loi prévoit que le plafond s’imposant aux apports de celle-ci s’applique sur trois exercices. Le respect de ce plafond doit être apprécié au vu des dépenses constatées à fin 2009. En conséquence, l’administration s’est engagée à ce que la parité de financement entre l’Etat et l’assurance maladie soit rétablie à l’occasion des lois de finances et de financement de la sécurité sociale votées fin 2010.
5. La « réserve sanitaire » : une doctrine de constitution et d’emploi à repenser
Compte-tenu du faible avancement de la constitution de la réserve sanitaire, la mobilisation de personnels de santé pour la campagne de vaccination s’est faite pour l’essentiel sous le régime de la réquisition. Les quelques actions ayant fait recours, en France ou à l’étranger, aux effectifs de la réserve mettent en lumière par ailleurs le caractère contraignant des procédures d’utilisation prévues par la loi et les incertitudes juridiques affectant les dispositifs plus souples parfois employés.
De manière plus générale, les difficultés de recrutement rencontrées conduisent à s’interroger sur la pertinence de la doctrine d’emploi adoptée jusqu’à présent et à envisager une réorientation profonde tendant à une décentralisation des recrutements qui mettrait à profit le savoir-faire acquis localement dans l’expérience des procédures de réquisition.
Une réflexion interministérielle engagée sous l’égide du Secrétariat général de la défense et de la sécurité nationale (SGDSN) tend par ailleurs à replacer le développement attendu de la réserve sanitaire dans la perspective plus large d’une « réserve de sécurité nationale » qui fédèrerait les diverses réserves susceptibles d’intervenir en situation de crise.
6. La nécessité d’un contrat de performances
La conclusion du contrat de performances entre l’Etat et l’EPRUS a été différée jusqu’à présent par les difficultés de mise en place de l’établissement puis par les urgences liées à la campagne de vaccination. Un tel document, couvrant au moins trois années, serait indispensable pour arrêter, au vu de l’expérience récente, les orientations à prendre en matière de constitution de la réserve sanitaire, de doctrine de renouvellement des divers stocks et de rationnalisation du stockage. Les administrations se sont engagées à ce qu’il soit établi d’ici la fin 2010. Il serait indispensable à son réalisme qu’il décrive le cadre pluriannuel de cofinancement de ces diverses missions.
INTRODUCTION
L’Etablissement de préparation et de réponse aux urgences sanitaires (EPRUS) est un établissement public administratif de l’Etat créé par la loi n° 2007-294 du 5 mars 2007 « relative à la préparation du système de santé à des menaces sanitaires de grande ampleur », elle-même issue d’une proposition de loi déposée par le sénateur Francis Giraud le 24 novembre 2006. Les dispositions législatives le concernant ont été codifiées aux nouveaux articles L. 3135-1 à 5 du code de la santé publique (CSP). L’établissement a reçu son appellation dans le décret d’organisation n° 2007-1273 du 27 août 2007, codifié aux articles R. 3135-1 à 13 de ce même code.
Le législateur lui a confié deux missions principales, d’une part, d’assurer l’acquisition et la gestion des stocks sanitaires publics destinés à faire face à des situations d’urgence, tâche qui était antérieurement sous la responsabilité directe du ministère chargé de la santé, d’autre part, de procéder à la constitution et à la gestion d’un nouveau « corps de réserve sanitaire » dont la mise en place a été prévue par la même loi du 5 mars 2007 dans des dispositions codifiées aux articles L. 3132-1 à 3134-3 du CSP.
Le nouvel établissement est entré en fonction à la fin du mois d’août 2007 et a connu une première mise à l’épreuve à travers le rôle opérationnel majeur que lui a imparti la politique gouvernementale de lutte contre la pandémie grippale H1N1.
Parallèlement à l’enquête dont rend compte le présent rapport, la Cour a examiné, selon la procédure juridictionnelle qui lui est propre, les comptes de l’EPRUS pour les exercices 2007 et 2008. Si la présente communication s’attache à présenter les conditions d’ensemble dans lesquelles ont été conclus les importants marchés de fourniture de produits sanitaires dont l’établissement a assuré la passation et leur incidence pour les finances publiques, le contrôle détaillé de cette passation a dû, dans les délais impartis à cette enquête, se limiter à un échantillon de ces divers contrats tout en examinant de manière plus systématique les conditions dans lesquelles ont été négociées puis partiellement remises en cause les commandes de produits, principalement de vaccins, relatifs à la lutte contre la pandémie H1N1.
Par ailleurs, la Cour a également été saisie le 28 décembre 2009 par la Commission des affaires sociales du Sénat d’une demande d’enquête « sur l’utilisation des fonds mobilisés pour la lutte contre la pandémie grippale A H1N1 ». L’enquête en vue de l’établissement de cette autre communication a été conduite dans le même calendrier que celle dont il est ici rendu compte. Les deux communications ayant, pour partie, un objet commun, plusieurs développements qui y figurent comportent une rédaction voisine.
Enfin, il convient de rappeler l’existence du rapport établi pour la Commission des finances du Sénat par M. Jean-Jacques Jégou sur la gestion par l’EPRUS des stocks de produits de santé1 qui, s’il ne traite pas du recrutement et de la gestion de la « réserve sanitaire » et reste antérieur à l’implication de l’établissement dans la phase opérationnelle de lutte contre la pandémie grippale, analyse en détail les dispositions prises au cours des deux premières années d’existence de l’EPRUS pour sa mise en place et en ce qui concerne la gestion des stocks sanitaires d’urgence. La communication examinera successivement les principes ayant présidé à la création de ce nouvel opérateur de l’Etat dans le champ de la politique sanitaire (I), les divers aspects de sa mise en place (II), la manière dont il s’est acquitté, notamment lors de la campagne de lutte contre la grippe H1N1, des missions qui lui ont été confiées par la loi (III) et enfin son financement (IV).
PARTIE I : UN NOUVEL OPERATEUR DE l’ETAT
La conception ayant présidé à la constitution de l’EPRUS est marquée à la fois par la volonté de confier à un établissement public des missions logistiques en matière d’urgences sanitaires dont la gestion directe par l’Etat semblait difficile (A) et par le souci de conserver un pilotage ministériel de ces activités opérationnelles (B).
A. un nouvel etablissement public administratif
1. Les urgences sanitaires : un enjeu majeur
Plusieurs événements des années récentes ont rappelé à la conscience collective l’existence de risques de grande ampleur pour la santé tenant à la possible survenue d’événements naturels ou climatiques, comme la canicule de l’été 2003, épidémiologiques, comme l’apparition du chikungunya, de cas humains de la grippe aviaire en Asie et d’épidémies localisées de méningite, ou politiques, comme les attentats terroristes du 11 septembre 2001 aux Etats-Unis.
Si de tels événements restent pour une large part imprévisibles, l’idée s’est renforcée que l’efficacité des réponses à ces risques tient principalement à l’existence préalable de dispositifs y préparant de manière anticipée. C’est ainsi que, devant la possible recrudescence de menaces terroristes, les pouvoirs publics ont entendu mettre en place un plan gouvernemental d’intervention face aux risques de type nucléaire, radiologique, biologique ou chimique (NRBC), décliné dans les trois volets biologique (« Biotox »), chimique (« Piratox ») et nucléaire (« Piratome »). De même, dès 2005, a été élaboré, en réponse à la menace tenant au virus H5N1, un premier plan de prévention et de lutte contre la pandémie grippale qui a fait l’objet depuis de plusieurs actualisations et d’exercices de simulation. La réponse aux épidémies de méningite, pour sa part, fait l’objet d’une circulaire du 23 octobre 2006.
Ces différents dispositifs ont conduit au cours de la dernière décennie à la constitution par l’Etat d’importants stocks de produits et matériels de santé destinés à la prévention ou au soin des populations susceptibles d’être touchées par les diverses menaces concernées.
A l’égard des risques NRBC, la France a ainsi acquis des antibiotiques (Ciflox, Oflocet, Tavanic), des antidotes (Cyanokit, Contrathion, Kelocyanor), de l’iode stable destiné à parer aux effets d’une irradiation nucléaire, des vaccins antivarioliques et du matériel d’injection.
Face aux risques de pandémie grippale, a été constitué un stock de masques de protection (masques chirurgicaux, destinés aux patients, et FFP2, pour la protection des personnels de santé), d’antiviraux (Tamiflu, Relenza, Oseltamivir poudre), de vaccins (H5N1 et H1N1) et de matériels de vaccination.
Enfin, des vaccins (MenBvac, Neisvac, Ménomune) ont également été acquis pour faire face aux accès récurrents de méningite.
L’acquisition de cet ensemble de produits, et les premiers renouvellements nécessités par la péremption de certains d’entre eux, ont représenté un enjeu financier majeur. La valeur totale du stock sanitaire national atteignait 210 M€ dès 2005, soit plus de la moitié des stocks de l’Etat hors défense. Suite à une forte croissance correspondant aux achats liés à la pandémie grippale, sa valeur brute, telle qu’enregistrée dans les comptes de l’EPRUS au 31 décembre 2009, a dépassé le milliard d’euros. Ce montant correspond à un volume de produits dont le stockage représente plus de 110 000 palettes et qui comprend désormais 156 références.
2. Les limites d’une gestion directe par l’Etat
Jusqu’en 2007, l’acquisition et la gestion de ces stocks sanitaires publics ont été pour l’essentiel assurées directement par le ministère de la santé, cette responsabilité étant confiée au département des situations d’urgence sanitaire (DESUS) créé en 2004 au sein de la direction générale de la santé (DGS). Plusieurs contrôles ont mis en lumière les difficultés rencontrées dans cette gestion directe, difficultés qui ont en définitive conduit à rechercher une meilleure organisation par l’externalisation des fonctions commerciales et logistiques auprès d’un opérateur autonome.
Par des observations successives formulées à partir de ses travaux d’évaluation de la comptabilité du ministère de la santé pour l’année 2005, La Cour avait précocement contribué à alerter les pouvoirs publics sur les risques rencontrés dans la gestion des stocks sanitaires d’urgence. Ces observations soulignaient à la fois la fragilité de l’outil de suivi logistique des produits, les incertitudes comptables tenant à l’absence de séparation claire entre coûts d’achat et charges de stockage et à la méconnaissance des coûts de remplacement, et les incertitudes juridiques tenant au maintien dans le stock de produits ayant dépassé leur date officielle de péremption. Elles ont contribué à ce que ces risques soient pris en compte comme « élevés » dans le « plan d’action ministériel » établi en 2006.
Pour sa part, un rapport de la mission d’audit, d’évaluation et de contrôle (direction générale de la comptabilité publique) sur les « Stocks des médicaments du ministère de la santé et des solidarités »2 faisait également apparaître d’importantes lacunes en matière d’application informatique et de contrôle interne et soulignait la nécessité de mieux fiabiliser l’inventaire physique et la traçabilité des différents stocks et d’assurer une réelle corrélation de l’information avec les nombreux prestataires de stockage.
3. Le choix de la création d’un établissement public
De 2002 à 2006 le financement des mesures sanitaires de crise a été assuré par le budget de l’Etat et l’assurance maladie par l’intermédiaire de deux fonds de concours 35-1-6-955, créé en 2002, et 35-1-6-900, créé en 2003. Dans ce cadre, le financement des divers plans de préparation et de réponse aux urgences sanitaires (« Biotox », « Pandémie grippale », « Epidémiologie ») fut, sur cette même période assuré quasi exclusivement (775 M€ sur 830) par l’assurance maladie.
Lors de son examen de la loi de financement de la sécurité sociale pour 20063, le Conseil constitutionnel a jugé que cette contribution ne revêtait pas le caractère « volontaire » que l’article 17 de la LOLF exige pour les versements aux fonds de concours et n’a validé les articles en cause que sous réserve d’une mise en conformité à compter de l’année 2007.
Une solution qui s’avéra transitoire fut adoptée par la loi de financement pour 2007 avec la création sous forme d’un établissement public dédié à ce financement du Fonds de prévention des risques sanitaires (FOPRIS), dont la gestion fut confiée au Fonds de solidarité vieillesse (FSV).
Le sénateur Jégou, rapporteur pour avis du projet de loi de financement, avait fait adopter lors de sa discussion plusieurs dispositions tendant à encadrer le recours au financement par l’assurance-maladie, le montant de la contribution de celle-ci devant être désormais fixé dans la loi de financement de la sécurité sociale, et non plus par arrêté, et plafonné à 50 % du budget de l’établissement. Corrélativement, les régimes d’assurance maladie étaient représentés au sein du conseil d’administration du Fonds à parité avec l’Etat.
Cette formule d’un organisme à vocation purement financière fit cependant long feu, le Parlement étant saisi de la proposition de loi n° 159 (2006-2007) déposée le 24 novembre 2006 par le sénateur Giraud et « relative à la préparation du système de santé à des menaces de grande ampleur ». Son adoption a conduit dès mars 2007 à la création d’un nouvel établissement public administratif de l’Etat, reprenant les biens, droits et obligations du FOPRIS, mais qui s’est vu confier par la loi des missions opérationnelles importantes tant au regard de la gestion des stocks sanitaires jusque là assurée directement par l’Etat que pour le recrutement et la gestion de la « réserve sanitaire » mise en place par cette même loi qui en définit ainsi le rôle au premier paragraphe du nouvel article L. 3132-1 du CSP :
« En vue de répondre aux situations de catastrophe, d’urgence ou de crise sanitaire grave sur le territoire national, il est institué un corps de réserve sanitaire ayant pour objet de compléter, en cas d’évènement excédant leurs moyens habituels, ceux mis en œuvre dans le cadre de leurs missions de sécurité civile ; ce corps de réserve est constitué de professionnels et anciens professionnels de santé et d’autres personnes répondant à des conditions d’activité, d’expérience professionnelle ou de niveau de formation fixées, en tant que de besoin, par arrêté des ministres chargés de la santé et de la sécurité civile ».
Prenant acte des faiblesses de la gestion antérieure des stocks sanitaires, faiblesses que des rapporteurs parlementaires avaient également relevées à plusieurs reprises, la création d’un établissement public proposée par le sénateur Giraud4 visait notamment à offrir un cadre escompté plus propice à la solution de ces divers problèmes. Elle avait aussi pour objectif de remédier aux « conditions fragiles » et à l’insuffisance en personnels dédiés dans lesquelles la DGS assurait jusque-là la gestion du stock sanitaire national5.
La Cour, à la suite de ses premières observations sur les risques encourus par la gestion des stocks sanitaires, avait mené sur cette même question une enquête spécifique conduite sous le régime « confidentiel défense ». Ses principales conclusions ont fait l’objet d’un référé adressé au ministre chargé de la santé le 26 juin 2008. Ce courrier signé du Premier président, prenant acte de la création récente de l’EPRUS comme opérateur de l’Etat, posait la question du contrôle que l’Etat garderait sur des stocks d’une importance stratégique.
De manière plus générale, il soulignait que ce nouvel outil institutionnel, pour autant qu’il devienne opérationnel, ne saurait résoudre les problèmes rencontrés tant que la puissance publique n’aurait pas pris les décisions stratégiques qui lui reviennent, ni prévu et mis en place une organisation administrative et sanitaire garantissant que la prorogation de produits officiellement périmés s’effectue dans des conditions optimales de responsabilité et de sécurité.
Dans sa réponse en date du 17 octobre 2008, le ministre chargé de la santé après avoir présenté son analyse de la situation et des nécessités de renouvellement des divers stocks concernés saluait la création de l’EPRUS comme une étape importante dans la rationalisation de la gestion des stocks grâce, notamment, à la mise en place d’un système d’information performant , et faisait droit à l’observation de la Cour, en ouvrant à une réflexion sur une organisation administrative et sanitaire propre à sécuriser l’emploi par les professionnels de santé de ces produits en cas d’urgence et en vue de définir des modalités et dispositions à mettre en place pour encadrer l’éventuelles prorogation de la validité des produits.
Pour autant, en 2008, la Cour constatait encore, devant les retards et tensions ayant marqué la phase de mise en place de l’établissement, que cet exercice « au plan des transferts de compétence, de la fixation du partage de la gestion des stocks, de la détermination d’une doctrine comptable aura été une année blanche ». Quand au rapport Jégou, publié quelques mois plus tard, il relevait qu’à la veille de l’épreuve de la pandémie H1N1, l’EPRUS faisait encore l’objet d’« attentes fortes » autant que d’« interrogations » sur sa capacité à rationaliser et professionnaliser la gestion des stocks qui lui avait été transférée.
4. Un nouvel opérateur de l’Etat, cofinancé par l’assurance maladie
La loi du 5 mars 2007 a confirmé les principes adoptés pour le FOPRIS en ce qui concerne la participation des organismes d’assurance maladie à l’administration et au financement de l’établissement public :
- l’article L. 3135-2 du CSP prévoit que le conseil d’administration est constitué « à parité, de représentants de l’Etat et de représentants des régimes obligatoires d’assurance maladie » ;
- l’article L. 3135-4 qui énumère les ressources de l’établissement prévoit « une contribution à la charge des régimes obligatoires d’assurance maladie dont le montant est fixé chaque année par la loi de financement de la sécurité sociale » et précise que son montant « ne peut excéder 50 % des dépenses de l’établissement public au titre des missions mentionnées au deuxième alinéa de l’article L. 3135-1 ». Cette formulation exclut tant les dépenses afférentes à la réserve sanitaire que celle entreprises en cas d’indisponibilité exceptionnelle de certains produits, mais inclut celles tenant au « financement d’autres actions de prévention ». L’article L. 3135-4 indique également que « le respect de ce plafond est apprécié sur trois exercices consécutifs ».
A partir du projet de loi de finances pour 2008, le nouvel établissement s’est inscrit dans la liste des opérateurs de l’Etat au côté des diverses agences sanitaires. Selon la nomenclature des missions alors en vigueur, il a trouvé place dans la mission interministérielle « Sécurité sanitaire » au sein du programme 228 « Veille et sécurité sanitaire » dépendant du ministre chargé de la santé, où son action relevait de l’action préexistante n° 2 « Gestion des urgences, des situations exceptionnelles et des crises » et, de manière assez indirecte, de l’objectif 1 « Améliorer la préparation et la qualité de la gestion des alertes sanitaires » et des deux indicateurs qui lui sont associés.
Un important remembrement de la cartographie des projets annuels de performance a conduit à partir de l’exercice 2009 à supprimer la mission « Sécurité sanitaire » pour regrouper dans la mission « Santé » l’ensemble des actions impliquant le ministère chargé de la santé. Dans ce cadre, c’est le nouveau programme 204 « Veille et sécurité sanitaire » qui accueille une action n° 16 intitulée « Réponse aux alertes et gestion des urgences, des situations exceptionnelles et des crises sanitaires ». S’y rattache l’objectif 7 intitulé « Améliorer le système de défense sanitaire en vue de faire face aux menaces » qui comporte désormais trois indicateurs. Cette typologie n’a pas été modifiée en 2010 sous réserve de la suppression de deux des indicateurs de l’exercice précédent et de la création d’un nouveau (voir infra, partie II, A, 6).
La description du financement et de l’activité de l’établissement reste partielle dans les documents budgétaires associés aux projets de lois de finances compte-tenu du principe de cofinancement par l’assurance maladie et de la part élevée des moyens qui, face à la survenue de la pandémie H1N1, lui ont été apportés courant 2009 par avance de cette dernière ou, au titre de l’Etat, par voie de décret d’avance ou à travers la loi de finances rectificative. Les rapports annuels de performance pour 2008 et 2009 retracent cependant les conditions contrastées de l’exécution budgétaire de ces deux exercices (voir infra, partie IV, B).
B. Une mission de mise en œuvre et non d’orientation strategique
1. Un établissement chargé d’importantes missions de mise en œuvre
La plus large part des dispositions de la loi du 5 mars 2007 et du titre « Menaces sanitaires graves » du CSP où elles se trouvent codifiées6, est destinée à décrire la « constitution et l’organisation du corps de réserve sanitaire », les « dispositions applicables aux réservistes sanitaires » et les « règles d’emploi de la réserve ». Ces principes législatifs ont appelé de nombreuses mesures d’application par décret en Conseil d’Etat7.
C’est par ailleurs au titre de la mission d’« assurer la gestion administrative et financière de la réserve sanitaire » que la création d’un nouvel établissement public est introduite à l’article L. 3135-1 du CSP, le transfert de la tâche jusque là ministérielle visant à « acquérir, fabriquer, importer, distribuer et exporter des produits et services nécessaires à la protection de la population face aux menaces sanitaires graves » ne résultant que, dans un second alinéa, d’une mission qui lui est « également » confiée. A cet effet, ce même article dispose que l’EPRUS ouvrira un « établissement pharmaceutique », au sens du CSP, propre à conduire des actions relatives à des médicaments et produits de santé, disposition dont la mise en œuvre a fait l’objet d’un important retard (voir infra, partie II, D, 1) :
« Lorsque les actions menées par l’établissement public concernent des médicaments, produits et objets mentionnés à l’article L. 4211-1 du présent code, elles sont réalisées par un établissement pharmaceutique qui en assure, le cas échéant, l’exploitation».
Aucune disposition légale nouvelle n’a, en revanche, été prise concernant le statut des produits relevant du stock sanitaire d’urgence qui, de ce fait, au-delà des modalités publiques de leur gestion, restent soumis aux contraintes de la réglementation de droit commun des médicaments et des dispositifs médicaux.
Ces deux tâches principales ne sont cependant pas exclusives d’autres missions susceptibles d’être confiées à l’établissement à l’initiative du ministre de la santé. L’article L. 3135-1 du CSP prévoit en effet, au titre de son second alinéa, que le nouvel établissement « peut également financer des actions de prévention des risques sanitaires majeurs » et qu’il peut également :
« mener à la demande du ministre chargé de la santé, les mêmes actions pour des médicaments, des dispositifs médicaux ou des dispositifs médicaux de diagnostic in vitro répondant à des besoins de santé publique, thérapeutiques ou diagnostiques, non couverts par ailleurs, qui font l’objet notamment d’une rupture ou d’une cession de commercialisation, d’une production en quantité insuffisante ou lorsque toutes les formes nécessaires ne sont pas disponibles ».
La première de ces dispositions a pu être utilisée, lors de la campagne de lutte contre la grippe H1N1, tant pour confier à l’EPRUS l’acquisition de masques à destination des différentes administrations8 que pour mettre à sa charge l’indemnisation des professionnels de santé retraités ou sans emploi réquisitionnés à l’occasion de la campagne de vaccination9. Dans les deux cas cependant et bien que ces deux actions aient été conduites en référence juridique au deuxième alinéa de l’article L. 3135-1 du CSP, la destination administrative de la première action et le caractère régalien de la seconde ont conduit à ne pas faire recours au mécanisme de cofinancement par l’assurance maladie.
2. Un pouvoir d’impulsion relevant toujours du ministre
Si la loi du 5 mars 2007 a délégué à un établissement autonome la gestion tant des stocks d’urgence que de la réserve sanitaire, elle a entendu réserver au ministre chargé de la santé la responsabilité d’orienter la constitution et la mise en œuvre de ces deux moyens d’intervention en cas de crise sanitaire. Plusieurs dispositions en ce sens méritent d’être signalées :
- s’agissant de la réserve sanitaire, l’article L. 3134-1 dispose que son emploi en cas de situations le justifiant relève des « ministres chargés de la santé et de la sécurité civile » qui « peuvent conjointement » y « faire appel par arrêté motivé ». L’article 3135-1 confie par ailleurs à un décret en Conseil d’Etat la mission de définir « les modalités de mise en œuvre et d’emploi de la réserve au plan territorial, sous l’autorité des représentants de l’Etat compétents » ;
- s’agissant des stocks sanitaires, ce même article précise que c’est « à la demande du ministre chargé de la santé » que l’établissement exerce sa mission d’acquisition et de gestion de tous produits. Il en va de même pour les actions en cas d’indisponibilité exceptionnelle de ceux-ci ;
- enfin, l’article L. 3135-2 indique que l’EPRUS est soumis « à un contrôle de l’Etat adapté à la nature particulière de sa mission » et que, si le directeur général « agit au nom de l’Etat », il « prend les actes nécessaires à l’accomplissement des missions que le ministre chargé de la santé confie à l’établissement ».
Au vu de ces dispositions, le rapport Jégou précité constate que « l’EPRUS est placé sous le contrôle étroit de la DGS et est cantonné à un rôle de strict logisticien » et qu’il « ne participe pas à la planification ni à l’élaboration des plans de réponse aux urgences sanitaires », situation qui « semble d’ailleurs avoir été à l’origine de divergences entre la première équipe dirigeante de l’EPRUS et le ministère de la santé ». Il y voit une sérieuse « question de positionnement » et est conduit « à s’interroger sur l’opportunité de la création de l’EPRUS » alors même qu’il lui semble « difficile d’envisager une amélioration du dispositif si la DGS régit en détail son action, alors qu’elle a elle-même rencontré des difficultés importante, par le passé, dans la réalisation des tâches qui lui incombaient ». En cela, il fait écho aux interrogations formulées à plusieurs reprises par la sénatrice Nicole BRICQ, rapporteure spéciale de la mission « Sécurité sanitaire » sur l’opportunité de mettre en place une telle structure.
Pour autant, le rapport Jégou n’a pas souhaité préconiser la suppression de l’établissement au vu notamment de sa relative « jeunesse » et préféré proposer qu’« un bilan de l’action menée par l’EPRUS soit dressé une fois le risque pandémique passé, afin d’apprécier toute la mesure du rôle effectif dévolu à l’établissement, ainsi que la « valeur ajoutée » apportée par sa création ». Il souligne par ailleurs qu’en cas de maintien, l’EPRUS devrait, pour le moins, voir « sa participation à la phase de planification et de préparation aux menaces sanitaires être renforcée dans la mesure où l’établissement doit également pouvoir faire preuve de capacités d’anticipation, de réactivité et d’adaptation en cas de dysfonctionnement des plans de défense ».
De ce point de vue, le préambule de la convention passée début 2009 entre l’Etat et l’EPRUS exprime sans nul doute en des termes particulièrement impérieux le rôle directeur exclusif revendiqué en ce domaine par le ministère :
« Le ministère de la santé est garant de la politique de santé publique et de la réponse aux menaces sanitaires. A ce titre, il définit les stratégies de réponse aux menaces sanitaires et de prise en charge des actions collectives de santé publique. Il élabore les plans de réponse, définit la liste des contremesures médicales et des produits associés, s’assure des moyens nécessaires et en exprime la doctrine d’emploi.
Il est en charge de la gestion des crises sanitaires et apporte, le cas échéant, son concours aux autres ministères. Il assure, à ce titre, l’interface avec ces derniers ».
Dans le principe, il ne paraît pas illégitime que, dans un domaine d’action où l’Etat ne manque pas d’être principalement mis en cause dans sa responsabilité de gestion des crises, le rôle de pilotage stratégique soit clairement revendiqué par le ministère.
L’existence d’un opérateur autonome pour la mise en œuvre financière, administrative et logistique des actions en découlant n’en est pas, pour autant, dépourvue d’intérêt. Elle conduit à constituer un pôle de compétences et d’expertise très spécialisé qu’il s’est avéré difficile d’organiser sous les contraintes d’une structure d’administration centrale. A la différence d’une gestion menée en régie sous la responsabilité directe du ministère, l’autonomie administrative, financière et comptable d’un tel établissement permet, en outre, d’identifier avec plus de transparence l’essentiel des moyens engagés à l’appui d’une telle mission. Enfin, la séparation des personnalités morales oblige à un plus grand formalisme dans le partage entre les décisions appartenant à l’autorité gouvernementale et les mesures d’exécution déléguées à l’établissement, ce qui peut contribuer à une plus claire évaluation des responsabilités de conception et de mise en œuvre.
On le verra cependant, telle qu’elle a été conçue par le ministère, la mise en œuvre d’un tel projet a conduit à réduire l’autonomie de l’établissement au-delà de ce qu’impliquaient les dispositions déjà limitatives de la loi :
- La convention passée avec le nouvel établissement public (voir infra, partie II, A, 1) prétend trancher la question de la propriété des stocks sanitaires dans un sens qui, pour le moins, sollicite fortement les termes de la loi et traduit selon des modalités singulièrement impérieuses le rôle assigné au ministère dans la conduite des activités de l’établissement. En cela, elle s’est refusée à faire droit au potentiel d’expertise attendu d’un organisme dédié, à lui reconnaître formellement des plages de proposition et de validation dans l’élaboration des stratégies de préparation et de réponse aux urgences sanitaires et à l’associer plus systématiquement aux procédures de décision.
- Dans le climat d’urgence où s’est mis en place le dispositif de lutte contre la grippe H1N1, le ministre chargé de la santé ne s’est pas limité à « demander » à l’EPRUS, ainsi que l’y invite la loi, de procéder aux acquisitions de vaccins et produits de santé jugés nécessaires à la stratégie sanitaire retenue ; il a cru, par l’intermédiaire de son cabinet, devoir prendre lui-même les contacts avec les laboratoires concernés, arrêter par avance des éléments essentiels de la négociation et donner à l’établissement les instructions les plus détaillées sur les procédures et la teneur même des contrats qu’il était supposé négocier et conclure (voir infra, partie III, B, 2). Outre les risques de toute nature qu’elle comporte, cette participation extensive à l’exercice d’un pouvoir adjudicateur légalement transféré à l’EPRUS excédait à l’évidence les prévisions de la loi de 2007 ; au-delà des circonstances exceptionnelles qui l’ont inspirée, elle ne saurait être considérée comme un mode normal d’exercice de la tutelle sur l’établissement.
3. Un conseil d’administration à la compétence limitée
Conformément à l’article R. 3135-2 du CSP, le conseil d’administration de l’établissement comprend, outre son président, douze représentants de l’Etat10 et douze représentants des régimes obligatoires d’assurance maladie11. Le rapport Jégou souligne cependant qu’en dépit de cette parité au sein du conseil d’administration, le rôle de l’assurance maladie dans la gestion du stock national santé et dans la détermination de la stratégie d’acquisition et de renouvellement est très réduit et « semble ainsi se limiter à celui de simple cofinanceur ».
Ceci est pleinement confirmé par le fait que les prérogatives du conseil d’administration lui-même se trouvent limitées par les dispositions constitutives de l’établissement qui font qu’échappent à sa compétence les actions mises en œuvre par le directeur général sur demande directe du ministre ainsi que le prévoit expressément le dernier alinéa de l’article L. 3135-2. En conséquence, le 12° de l’article R. 3135-7 exclut formellement du champ de ses délibérations les contrats, marchés et conventions « passés à la demande du ministre chargé de la santé en application des dispositions des deuxième et troisième alinéa de l’article L. 3135-1 ». C’est dire que l’essentiel de l’activité de l’EPRUS tout au long de la période pandémique de 2009 s’est développé hors du contrôle de son organe délibérant.
Ce partage entre activités de la compétence du conseil et celles où le directeur général agit sur instruction directe du ministre ne va cependant pas sans incertitude juridique, comme en témoigne le débat qui a occupé la plus grande part du conseil d’administration du 2 mars dernier s’agissant de savoir si les dispositions de l’article R. 3135-7 suffisaient pour que le directeur général soit également habilité à négocier les conséquences de la modification unilatérale décidée par le ministre chargé de la santé des marchés de fourniture des vaccins H1N1, ou s’il fallait appliquer en l’espèce le 14° de ce même article qui prévoit que le conseil délibère des « actions en justice et (des) transactions portant sur un montant supérieur au seuil qu’il détermine ». A titre de précaution « dans cette affaire très délicate » visant à « consolider les supports juridiques » de la décision ministérielle et à éviter que l’issue des négociations puisse être attaquée sur ce point de forme, le conseil à en définitive adopté une résolution dont la rédaction reflète son embarras devant cette « zone d’ombre » du CSP :
« En application du deuxième alinéa de l’article R. 3135-7 du code de la santé publique, le conseil d’administration délègue, dans les conditions ci-après et dans la limite de ses compétences, au directeur général les décisions concernant les actions en justice et transactions mentionnées au 14° de l’article R. 3135-7.
La présente délégation est accordée pour les seules actions en justice et transactions qui, quel que soit leur montant, seraient engagées ou conclues consécutivement aux modifications unilatérales des marchés de fourniture de vaccins contre la grippe A(H1N1) notifiées à la demande de la ministre chargée de la santé publique.
Le directeur général informe le conseil d’administration, lors de chacune de ses séances, des actions en justice et transaction décidées, depuis la dernière séance ».
La situation juridique que reflète une telle décision manifeste une dissymétrie majeure entre le périmètre des dépenses sur lesquelles l’assurance maladie est engagée à assurer une parité de financement et le champ des questions sur lesquelles elle participe au pouvoir délibératif. Cet écart est encore accru par l’hypothèse, retenue dans les tableaux budgétaires prévisionnels établis lors du conseil d’administration du 7 mai 2010, selon laquelle les charges d’indemnisation faisant suite à la renégociation des contrats de vaccins H1N1 seraient elles mêmes financées à parité. La passation initiale des marchés comme la décision de leur annulation partielle échappant juridiquement au débat du conseil d’administration, l’assurance maladie se trouve ainsi à devoir financer pour moitié tant les coûts des commandes de départ que les conséquences de leur interruption, sans avoir eu à délibérer sur les conditions dont celles-ci auront été définies puis remises en cause par la seule décision du ministère.
La CNAMTS souligne par ailleurs que le champ des compétences reconnues à cet organe et celui qui en est exclu au titre des missions exercées à la demande du ministre peuvent parfois se recouper, le Ministre demandant à l’établissement la mise en œuvre de plans d’achats et la passation des marchés et le conseil d’administration délibérant sur le budget, ce qu’il n’est en mesure de faire qu’à la condition de disposer d’une information suffisante sur les prévisions de dépenses , ce qui n’a pas toujours été le cas lors de la mise en place de l’établissement ou lorsque les exigences de confidentialité ou le secret défense ont été invoquées à l’appui d’une présentation restant « globale » des facteurs concernés.
Dans la mesure où les pouvoirs publics jugent nécessaire une organisation institutionnelle où une partie majeure des activités de l’établissement relève de la décision directe de l’autorité ministérielle, il convient de prévoir au bénéfice du conseil d’administration un droit à l’information sur la teneur de ces décisions lui permettant d’exercer de manière pleinement éclairée son rôle délibératif notamment dans le domaine budgétaire.
PARTIE II : LA MISE EN PLACE DE L’ETABLISSEMENT
La mise en place de l’établissement sera examinée du point de vue de la formalisation des rapports de l’établissement avec sa tutelle et ses principaux partenaires (A), du recrutement du personnel et de l’organisation des services (B), de son installation matérielle et des investissements notamment en informatique (C), du transfert des marchés et stocks antérieurement gérés par l’Etat (D) et des procédures de passation des marchés (E).
Le nouvel établissement public a été organisé par le décret du 27 août 2007 précité. La gestion du FOPRIS s’est poursuivie entre la date d’entrée en vigueur de la loi et le 29 août 2007, date à laquelle ses droits et obligations ont été transmis à l’EPRUS.
Le premier directeur général, M. Bernard Boubé, préfet, antérieurement en fonctions au Secrétariat général de la défense nationale, a été nommé par décret du Président de la République le 29 août et est resté en fonction jusqu’à sa démission en juin 2008. La secrétaire générale, Mme Auburtin a assuré son intérim12 jusqu’à la nomination, le 16 octobre 2008, de l’actuel titulaire du poste, M. Thierry Coudert, administrateur civil hors classe. La première année de fonctionnement a été marquée, on l’a vu, par des frictions avec la tutelle et, comme le souligne le rapport Jégou, « de nombreuses incertitudes, tant en ce qui concerne la conception du rôle du nouvel établissement et son positionnement par rapport au ministère de la santé chargé de sa tutelle, que des modalités juridiques de transfert à l’EPRUS des principaux marchés passés antérieurement par la DGS ». Cette situation s’est traduite par d’importants retards dans la mise en place de l’établissement, en ce qui concerne notamment « son implantation, dans des conditions pérennes, la formalisation de ses relations avec la DGS et les problèmes juridiques soulevés par l’ouverture de l’établissement pharmaceutique ». Six mois ont alors été nécessaires pour que ces obstacles soient levés et que les principales conditions de l’opérationnalité de l’établissement soient réunies.
A. La formation des rapports avec la tutelle et les principaux partenaires
Le rapport Jégou observe que « la tutelle exercée sur l’EPRUS se distingue de celle à laquelle sont soumises les autres agences de sécurité sanitaire, dans la mesure où l’établissement public exécute la plupart de ces actes à la demande expresse du ministre ». De fait, au-delà même des dispositions expresses de la loi en ce sens, la « convention cadre fixant les relations entre l’Etat et l’EPRUS dans l’exercice de ces missions », signée le 16 février 2009, organise l’ensemble de l’activité de l’établissement sur la base de directives émanant de la DGS. En tant que « chargée de mettre en œuvre » les missions imparties au ministre chargé de la santé, cette dernière :
- « définit » annuellement, et le cas échéant « modifie », « le programme d’acquisition ou de renouvellement des stocks » (article 2.2) ;
- « adresse à l’EPRUS une commande écrite » pour « toute acquisition de produits » et en fixe « le calendrier d’exécution » (article 2.2) ;
- « participe en tant qu’expert à l’analyse des offres » (article 2.3) ;
- a « accès, à tout moment » aux stocks et peut y faire « des contrôles inopinés » (article 3.1) ;
- donne « instruction expresse » pour toute cession de produits (article 3.3) ;
- « fixe les objectifs » de gestion des stocks (article 3.5) ;
- « autorise » la destruction des stocks périmés ou altérés (article 3.10) ;
- « élabore » la doctrine de constitution et d’emploi de la réserve sanitaire, laquelle fait l’objet d’un « protocole additionnel » à la convention (articles 7 à 9).
L’établissement ne se voit expressément reconnaître de pouvoir d’alerte ou de proposition que dans les quelques domaines où il :
- « propose » les principes du « schéma directeur de stockage » (article 3.5) ;
- « participe au programme d’extension des durées de validité des produits » mis en œuvre avec l’AFSSaPS et le ministère (article 3.9) ;
- « participe aux instances de gestion de crise mises en place par le ministre de la santé et l’assiste lorsque ce dernier apporte son concours à un autre ministère » (article 10).
L’EPRUS est en revanche soumis à de nombreuses obligations d’exécution, de compte rendu ou d’information du ministre et notamment :
- « instruit dans un délai d’un mois » les ordres d’acquisition et « en informe le ministre » (article 2.3) ;
- « adresse » au DGS les documents nécessaires à la passation des marchés et l’« informe » avec un an d’avance des marchés pluriannuels (article 2.3) ;
- « alerte » le ministre « sur les besoins de renouvellement des produits un an avant leur date de péremption » (article 3.9) ;
- « transmet » un état trimestriel des stocks (article 3.8), les documents nécessaires à la certification des comptes de l’Etat (article 5.1) et un état annuel de la valorisation des stocks (article 5.3), et « tient à jour » un état des autres produits que ceux relevant du stock d’urgence (article 6) ;
- « informe par écrit » des « modalités d’astreinte » mise en place dans l’établissement (article 11).
La convention ainsi passée traduit une application impérieuse, et parfois presque vexatoire, des prérogatives légales reconnues au ministère de la santé dans le pilotage tant stratégique que courant des activités de l’établissement. Selon la DGS, cette rédaction qu’elle qualifie plutôt de « précise et volontaire » visait délibérément à « clore les sujets de divergence qui avaient retardé la mise en place effective de l’établissement » et n’aurait, par la suite, pas fait « obstacle à une collaboration riche et empreinte de confiance ». Pour autant, la convention interprète fortement l’intention du législateur sur des points où elle n’était pas explicite. Tel est notamment le cas de son article 3.1 selon lequel tant les stocks acquis par l’EPRUS que ceux qui lui sont confiés « demeurent la propriété de l’Etat ». Pour aller indiscutablement dans ce sens, il aurait cependant fallu que la loi précise que les stocks transférés à l’EPRUS l’étaient afin que, selon l’expression retenue par la convention, il en assume « la garde », et que ses acquisitions étaient faites « pour le compte de l’Etat ». Tel n’est pas le cas.
La signature de cette convention début 2009 a mis un terme à une vive divergence d’appréciation qui avait opposé le ministère de la santé au premier directeur de l’établissement, M. Bernard Boubé, jusqu’à la démission de ce dernier en juin 2008, quant aux rôles respectifs qui pouvaient leur être reconnus sur la base des dispositions voulues par le Législateur13.
Quoi qu’il en soit, le système ainsi mis en place a au moins pour mérite d’assurer une formalisation des instructions données par l’Etat à son opérateur, propice à la claire identification et à la traçabilité des décisions prises par les pouvoirs publics dans un domaine particulièrement sensible de leur action. Au-delà des pouvoirs expressément confiés par la loi au ministre chargé de la santé en matière de gestion des situations d’urgence (voir supra, partie I.B.2), par la convention Etat-EPRUS, la DGS s’oblige en effet à formaliser chacune des décisions qu’elle revendique en matière de constitution, de gestion et de renouvellement des stocks d’urgence.
Le préambule de la convention Etat-EPRUS indique que « la direction générale de la santé et, en son sein, le département des urgences sanitaires (DUS), sont en charge de la tutelle administrative et financière de l’EPRUS ».Toutefois, le secrétaire général de la DGS assure de manière transversale le suivi des diverses agences sanitaires et il lui arrive de représenter le DGS au sein du conseil d’administration. En outre, le chef du département des urgences sanitaires est haut fonctionnaire de défense adjoint et, à ce titre, relève de l’autorité fonctionnelle du secrétaire général des ministères sociaux qui est également, pour ce même domaine, haut fonctionnaire de défense et de sécurité (HFDS)14.
Le DUS a été créé par l’arrêté du 11 mai 2007 portant organisation de la DGS qui restructurait la fonction sanitaire des ministères sociaux et pour prendre en compte la création alors toute récente de l’EPRUS. Conçu comme « l’entité unique au sein du ministère chargé de la santé qui a compétence pour recevoir et synthétiser les alertes sanitaires, décliner et mettre à jour les plans de réponse aux menaces », il regroupe les fonctions liées à la préparation et à la gestion d’alertes sanitaires précédemment réparties au sein de la DHOS (« Cellule de gestion des risques ») et des services du haut fonctionnaire de défense. Il a remplacé le DESUS, créé au sein de la DGS par arrêté du 14 octobre 2004 qui cumulait des fonctions d’administration centrale et la difficile gestion en régie directe des stocks d’urgence. Le rapport Jégou soulignait cependant que « la création de l’EPRUS n’a pas conduit à une diminution des effectifs de la DGS » et ne s’était traduite que par la suppression de deux postes de logisticiens récemment recrutés par le DESUS.
En tant qu’établissement public, l’EPRUS participe par ailleurs aux travaux du comité d’animation du système des agences (CASA) que la DGS a mis en place, en mai 2008, entre les diverses agences sanitaires en vue d’harmoniser et améliorer le fonctionnement des relations entre l’Etat et ses divers opérateurs intervenant dans la mise en œuvre de la politique de santé. Lieu d’information mutuelle dans le suivi de la pandémie H1N1, cette instance a pu élaborer une « Charte qualité relative aux saisines par la DGS des établissements constituant le CASA » dont l’article 5 précise que « le suivi des saisines est assuré par la mise en place d’un tableau de bord, destiné à suivre l’ensemble des saisines de la DGS, et, dans chaque établissement, d’un outil de suivi des saisines en cours de traitement ».
A cette fin, un groupe de travail animé par l’AFSSET a proposé une maquette de tableau de bord qui devrait aboutir à la mise en place d’une application dédiée dont la saisie sera réalisée par la DGS. Pour sa part, l’EPRUS dispose déjà du logiciel ENNOV DOC qui enregistre les saisines et les réponses qui leur sont apportées, dont les dates respectives sont suivies sur tableur.
Depuis la création de l’EPRUS, un comité stratégique a été mis en place pour définir et suivre les orientations données à l’établissement dans ses différents domaines d’intervention. Présidé par le DGS, il est composé de représentants du ministère chargé de la santé (le secrétaire général, le haut fonctionnaire de défense et de sécurité, le DGS-adjoint, le chef du département des urgences sanitaires), de l’EPRUS (le directeur général, le directeur général adjoint et les chefs de pôles concernés), de l’AFSSaPS, du Service de santé des armées, du ministère de l’intérieur (direction de la sécurité civile). A chaque réunion, le DUS convoque les participants, établit en concertation avec l’EPRUS l’ordre du jour et rédige un projet de compte-rendu soumis à la validation du DGS.
Enfin l’article R. 3135-10 du CSP précise que l’EPRUS en tant qu’établissement public administratif de l’Etat est soumis au contrôle financier prévu par le décret n° 2005-757 du 4 juillet 2005. Un arrêté du 3 septembre 2007 a confié l’exercice de cette mission au contrôleur budgétaire et comptable du ministère chargé de la santé.
3. La convention avec la CNAMTS et l’ACOSS
Ainsi que prévu à l’article R. 3135-13 du CSP et à l’article 4.1 de la convention Etat-EPRUS, une convention a été signée le 9 mai 2009 avec ces deux organismes nationaux de sécurité sociale en vue de définir les modalités de versement à l’EPRUS de la « contribution des régimes obligatoires d’assurance maladie au financement de l’EPRUS »15.
Afin d’éviter une mobilisation excessive de la trésorerie du régime général de sécurité sociale, cette convention repose sur un mécanisme d’appel par l’EPRUS en fonction de ses besoins prévisionnels de trésorerie, l’établissement disposant ainsi d’un « droit de tirage » sur l’ACOSS à hauteur des dotations votées en LFSS non encore versées. A ce titre, l’EPRUS communique chaque mois à l’ACOSS un échéancier prévisionnel de demandes de versements pour les trois mois suivants, et, chaque année avant le 20 septembre, une prévision de demande annuelle pour l’exercice à venir. Un comité technique est prévu qui doit examiner, au moins une fois par an, le fonctionnement de ce mécanisme.
4. La convention avec l’AFSSaPS
L’activité de l’établissement en matière de stocks sanitaires requiert l’intervention de l’AFSSaPS à un double titre :
- en tant qu’autorité réglementaire et de police sanitaire, l’Agence autorise et contrôle l’établissement pharmaceutique de l’EPRUS qui doit lui fournir les états périodiques nécessaires et est soumis à ses inspections. L’établissement adresse également à l’Agence les pièces administratives relatives aux démarches d’acquisition, d’importation, de distribution de médicaments et de dispositifs médicaux, et assure les démarches administratives nécessaires à ces opérations.
En sa qualité d’exploitant pour l’Oseltamivir PG 30 mg comprimés16 et de distributeur pour les autres médicaments des stocks nationaux, l’EPRUS est en rapport constant avec l’AFSSAPS dans l’exercice de sa mission de pharmacovigilance sur ces produits.
- En tant qu’instance d’expertise sanitaire, l’AFFSaPS, à la demande du ministère de la santé, intervient notamment dans l’évaluation de la conservation et de la durée de validité des stocks stratégiques. L’EPRUS peut également demander l’assistance de l’agence sur toute question relative à son domaine de compétence.
Alors que les expertises sur la durée de validité de produis stockés faisaient antérieurement l’objet de simples échanges de lettres ad hoc entre la DGS et l’AFSSaPS, elles s’inscrivent désormais dans un programme relatif aux stocks stratégiques nationaux dit « PQRS2N » (voir infra, partie III, A, 1) dont la mise en œuvre fait l’objet d’une convention tripartite signée le 26 mai 2009 entre l’Etat, l’EPRUS et l’Agence.
En vue de rappeler les « obligations et responsabilités des parties » en matière d’extension de la durée de validité de produits, cette convention indique que celle-ci « est fondée sur un protocole scientifique » mis en œuvre par l’AFSSaPS. Elle décrit les modalités selon lesquelles les produits soumis à un tel protocole sont définis à l’initiative de la DGS, la méthodologie du test élaborée et validée, les prélèvements opérés et les résultats formalisés, la décision d’élimination ou de maintien en stock relevant du seul ministre et cette décision exécutée par l’EPRUS. Il est également précisé que le financement du programme annuel d’évaluation des stocks est à la charge de l’établissement.
5. Les relations avec le ministère de la défense et le ministère de l’intérieur
Le rapport Jégou relevait comme l’un des éléments du « problème de positionnement » auquel lui semblait confronté l’EPRUS, « la question de l’articulation entre les deux outils dont dispose l’EPRUS – le « stock national santé » et la « réserve sanitaire » -, avec les instruments de gestion de crise des autres ministères, notamment le ministère de l’intérieur chargé de l’administration de la réserve de sécurité civile et le ministère de la défense ».
En effet, si l’établissement a bien la responsabilité unique des stocks de produits acquis par le ministère en charge de la santé pour faire face aux besoins de la population ou des professionnels de santé dans le cas d’une menace sanitaire grave, les stocks détenus ou acquis par les ministères de la défense et de l’intérieur dans le cadre de leur mission spécifique, ou par les divers ministères, collectivités locales ou autres opérateurs, comme à l’occasion de la pandémie grippale pour la protection de leurs agents (masques FFP2), ne relèvent pas du périmètre de gestion de l’EPRUS, même si celui-ci a été circonstanciellement chargé en 2009 d’effectuer un achat groupé de masques FFP2 pour les besoins de différents ministères (voir infra, partie IV, C, 2).
Dans sa réponse à la Cour, l’EPRUS estime néanmoins que les domaines d’actions des divers organismes publics en matière de stocks d’urgence « sont parfaitement délimités et justifiés par leur mission respective » et que « leur coopération est active et efficace dans la conception des réponses (mise au point des stratégies, engagement des personnels et des moyens) et la complémentarité de leurs actions ». Cette coopération concerne plus particulièrement les services des ministères de la défense et de l’intérieur.
Une réflexion prospective sur l’harmonisation des diverses réserves de crise a par ailleurs été récemment engagée sous l’auspice du Secrétariat général de la défense et de la sécurité nationale (SGDSN, voir infra, partie III, C, 5).
La coopération avec le service de santé des armées (SSA)
Les stocks constitués par le service de santé sont destinés au ravitaillement sanitaire des forces armées (unités, hôpitaux et opérations extérieures) et n’ont pas la même finalité que les stocks stratégiques gérés par l’EPRUS qui visent à couvrir les besoins en cas d’urgence sanitaire de tout ou partie de la population française. Néanmoins, le directeur du Service de santé des armées est membre du conseil d’administration de l’EPRUS et participe ou est représenté aux réunions du comité stratégique DGS/EPRUS.
La coopération engagée par le ministère avec le SSA concerne :
- la fabrication par la pharmacie centrale des armées (PCA) de médicaments antiviraux (pandémie grippale), d’antidotes (risque chimique) et de traitements des radio-contaminations (comprimés d’iodure de potassium, CA-DTPA…) ;
- le stockage pour le compte de l’EPRUS, dans les établissements de ravitaillement sanitaires des armées de produits particulièrement sensibles (antiviraux, vaccins antivarioliques, antitoxines botuliniques….) qui bénéficient ainsi de conditions très sécurisées et sont accessibles 24 h/24 ;
- d’autres prestations comme la cession de produits provenant des stocks de l’armée ou la constitution pour le compte de l’établissement de lots d’intervention.
Un protocole-cadre de coopération a été conclu le 8 juin 2009 entre l’EPRUS et le SSA et les modalités de certaines collaborations fixées par des accords spécifiques17. Des marchés (production et fourniture de comprimés d’iode et ampoules de CA-DTPA, antidotes contre la radio-contamination) complètent les relations EPRUS-SSA. Un projet de construction d’entrepôts au profit de l’EPRUS sur le site de l’établissement de ravitaillement sanitaire des armées de Vitry-le-François, qui dispose déjà du statut d’établissement pharmaceutique, a reçu l’aval de principe du ministre de la défense. La procédure administrative de cette opération est en cours d’étude conjointe (voir infra, partie III, A, 3).
La formalisation des relations avec le SSA constitue la seule « évolution » depuis sa démission à laquelle le précédent directeur de l’établissement reconnaît explicitement un caractère « favorable » tout en rappelant qu’elle reprend des « modalités » qu’il aurait été antérieurement empêché de soumettre au conseil d’administration18.
Les relations avec le ministère de l’intérieur
De même que pour l’armée, les approvisionnements constitués et entretenus pour les besoins des missions quotidiennes de protection civile n’entrent pas dans le périmètre des missions de l’EPRUS et ne les concurrencent pas.
Outre son rôle central dans la gestion de crise en période pandémique, ce ministère est représenté au sein du conseil d’administration de l’EPRUS par le directeur de la sécurité civile qui est également membre du comité de pilotage stratégique DGS/EPRUS.
L’établissement est également en relation avec ce ministère dans le cadre des travaux des groupes et commissions chargés des différents plans de réponse aux urgences sanitaires et de leur application au niveau départemental, régional ou national.
6. Contrat de performance : une négociation toujours différée
L’EPRUS ne dispose aujourd’hui d’aucun contrat de performance ou d’objectifs et de moyens formalisé. Lors de sa nomination en octobre 2008, l’actuel directeur général a toutefois reçu une lettre de mission signée du directeur général de la santé lui assignant des objectifs.
Faisant suite à une période de près d’un an et demi marquée par des désaccords d’orientation entre la tutelle et le premier responsable de l’établissement, cette lettre soulignait l’urgence de « mesures permettant à l’EPRUS d’être en capacité d’assumer pleinement ses fonctions ». A cet effet, elle évoquait notamment la nécessité de faire aboutir l’implantation de l’établissement à la Plaine-de-France, le dossier d’autorisation de l’établissement pharmaceutique et la mise en place de la réserve sanitaire.
Dans cette perspective, une liste d’objectifs opérationnels pour l’année 2009 a été communiquée à l’établissement par la DGS lors du conseil d’administration réuni le 19 décembre 2008, cette liste impliquant notamment :
- l’élaboration d’un schéma directeur de stockage, prenant en compte la perspective de l’installation d’une plateforme nationale près de Vitry-le-François ;
- le lancement effectif d’une campagne de recrutement de la réserve sanitaire ;
- un renforcement des moyens du secrétariat général en vue de rationaliser la fonction support, mieux gérer la masse salariale et sécuriser le système d’information ;
- la mise en œuvre des diverses taches programmées à travers les conventions passées ou en cours de conclusion avec l’Etat, la CNAMTS et l’ACOSS, l’AFSSaPS, le Service de santé des armées et les établissements de santé de référence ;
- l’engagement d’une démarche qualité visant la certification ISO 9001 de l’établissement pharmaceutique.
Dans un courrier du 10 mars suivant, le directeur de l’établissement prenait acte de ces indications sous la forme d’une proposition d’indicateurs de performance applicables au nouvel exercice en précisant qu’ils avaient été validés par le conseil d’administration de décembre. Les objectifs suivants étaient ainsi actés :
- achever le transfert des marchés et des stocks produits de santé encore à charge de l’Etat (mi-2009) ;
- définir un schéma directeur du stockage des produits de santé (fin 2009) ;
- ouvrir l’établissement pharmaceutique prévu à l’article L. 3135-1 dernier alinéa. A cette fin, des crédits ont été notamment prévus pour mettre en place un système d’information permettant la gestion des stocks et la traçabilité des lots et pour permettre la mise en place d’un système qualité (1er semestre 2009) ;
- garantir la réactivité de l’EPRUS et le respect des calendriers de livraison souhaités par la DGS. Sauf en cas d’urgence, le délai de réponse aux demandes relatives aux produits de santé ne sera pas supérieur à un mois ;
- mettre en place (fin 2009) et rendre opérationnelle la réserve sanitaire, composée de 500 réservistes d’intervention et 1.000 réservistes de renfort (fin 2009). A cette date, 20 % de ces deux catégories de réservistes seront formés. En cas de mobilisation, le taux de réponse en termes de personnels de santé engagés dans une mission sera au minimum de 75 % de l’effectif sollicité. Le délai de réactivité en matière de mobilisation de la réserve sanitaire (délai d’arrivée sur le terrain du premier réserviste/délai demandé par la DGS) doit être inférieur à 1.
Le conseil d’administration du 29 avril 2009 avait, entre-temps, précisé les tâches concrètes en découlant en 2009, période définie comme devant être pour l’établissement « une année de plein exercice ». La survenue de la menace pandémique quelques jours après ce débat a conduit à confier à l’établissement de lourdes tâches jusque-là imprévues. Si celles-ci ont fait l’objet d’un étroit pilotage stratégique de la part du ministère, l’urgence n’a permis ni de formaliser les nouvelles priorités s’imposant à la gestion de l’exercice, ni de les inscrire dans la perspective pluriannuelle propre à un contrat d’objectifs et de moyens.
Outre que l’éventualité en est expressément prévue par le 2° de R. 3135-7 du CSP, la nécessité d’un document pluriannuel fixant les objectifs de l’établissement et les moyens qui s’y attachent, est d’autant plus nécessaire que le ministère joue un rôle particulièrement directif dans la conduite des missions de l’EPRUS, que celles-ci se développent par nature à un rythme de moyen terme, que l’expérience de la période récente peut inspirer des réorientations importantes par rapport aux principes de départ et que le mécanisme de cofinancement à parité est lui-même organisé légalement sur la base de plusieurs exercices.
Il est donc impératif qu’un contrat de performance couvrant au moins trois années définisse notamment :
- les nouveaux principes et objectifs retenus pour la constitution de la réserve sanitaire dont les premiers résultats sont restés relativement décevants (voir infra, partie III, C, 5) ;
- une doctrine d’ensemble de renouvellement des divers stocks sanitaires fondant une programmation physico-financière pluriannuelle des acquisitions ;
- un plan de rationalisation des stockages s’articulant autour du projet de magasins centraux de Vitry-le-François et un programme d’intégration des systèmes d’information de l’établissement et de ses prestataires ;
- le cadre d’une programmation pluriannuelle du cofinancement des missions de l’établissement.
La DGS partage cette analyse, souhaitant « consolider les acquis » de l’établissement en le dotant « d’une feuille de route propre à lui donner […] les outils juridiques nécessaires à une gestion efficace et dynamique des stocks et donnant un cadre plus adapté à la constitution de la réserve. » et s’est engagée à ce que ces orientations soient « formalisées dans le cadre du contrat de performance d’ici la fin de l’année ».
De son côté, la direction du budget, si elle s’associe aux remarques de la Cour sur la nécessité d’un tel document, considère, au vu de la « spécificité de l’établissement et du nombre d’hypothèses encore non stabilisées […] qu’il ne serait pas pertinent que ce contrat affiche les moyens à mettre au regard des objectifs ». Cette réserve est à regretter, un tel exercice de programmation financière étant, sous réserve des souplesses nécessaires d’ajustement annuel ou face à un risque imprévu, l’un des moyens indispensables pour assurer de manière réaliste la cohérence stratégique souhaitée.
On peut être en revanche en plein accord avec la direction du budget pour attendre d’un tel document qu’il contribue à « faire émerger des outils de planification qui renforceront le positionnement du conseil d’administration » et à « inscrire la trajectoire en termes de fiabilisation des comptes de l’EPRUS et de renforcement des contrôles internes comptable et budgétaire ». Il devrait en outre poser les bases d’une évaluation circonstanciée de la montée en charge de l’établissement et du bon accomplissement de ses missions opérationnelles. Aucun des indicateurs retenus au titre de la LOLF ne paraît en effet de nature à mesurer de manière significative sa performance :
- pour autant qu’on puisse lui trouver un sens, l’indicateur 1 introduit en 2006 « Impact des retours d’expérience sur les procédures » et devenu, l’année suivante, « Pourcentage de plans nationaux et de procédures ayant fait l’objet d’un retour d’expérience ou d’un exercice au cours des trois dernières années », concerne l’autorité ministérielle ayant en charge la définition des plans et stratégies d’alerte et non pas un opérateur chargé d’exécution logistique de certaines des tâches en découlant19 ;
- l’indicateur 2 « Pourcentage d’agents assurant des astreintes formés à la gestion des alertes sanitaires », qui a été suivi de 2002 à 2009, couvrait un périmètre trop vaste (DGS, services déconcentrés DRASS et DDASS et agences sanitaires) pour rendre compte de la part propre à l’EPRUS créé entre-temps. S’il concerne spécifiquement l’établissement, le nouvel indicateur qui l’a remplacé en 2010 « Pourcentage des membres de la réserve sanitaire d’intervention ayant bénéficié d’une formation dans l’année écoulée », indicateur dont la valeur était de 40 % en 2009 et qui devrait atteindre 60 % en 2010 et 80 % l’année suivante, reste d’une portée limitée vu le faible effectif atteint à ce jour par cette réserve elle-même ; il serait plus illustratif des difficultés rencontrées dans la constitution de la réserve de rapporter ce chiffre et celui correspondant pour la réserve de renfort aux objectifs quantitatifs qu’un contrat pluriannuel assignerait en matière d’effectifs ;
- enfin l’indicateur « Pourcentage du coût de fonctionnement de l’EPRUS par rapport à son budget total » risquait fort de connaître une évolution erratique compte-tenu des variations circonstancielles que pouvait subir ce budget du fait de la survenue imprévisible de menaces comme la pandémie grippale. Introduit en 2009 avec une valeur d’objectif de 10 estimée en référence aux autorisations d’engagement (AE) retenues dans le cadre du budget pluriannuel 2009-2011, il s’est établi à 0,7 pour ce même exercice, après avoir été de 5,8 en 2008. Il n’a pas été repris dans le projet de loi de finances pour 2010, le rapport annuel de performances (RAP) du ministère de la santé pour 2009 constatant que « la variabilité du budget de l’établissement, qui est inscrite dans sa nature même, entraîne mécaniquement d’année en année une variabilité extrême de l’indicateur sans pour autant signifier une inflexion, dans un sens ou dans l’autre, des dépenses de fonctionnement de l’établissement ».
B. le recrutement du personnel et son organisation
1. La direction et l’organigramme
Sous l’autorité de son second directeur général, M. Thierry Coudert20, et de M. Claude Avaro21, directeur général adjoint recruté le 1er décembre 2008, l’établissement a renouvelé et complété son équipe dirigeante qui était au complet au début de l’année 2009.
Comme l’a souligné le rapport Jégou, les difficultés initiales de direction de l’établissement ont conduit à ce que son organigramme ne se stabilise que « près de deux ans après sa mise en place ». L’organigramme validé par le conseil d’administration le 29 avril 2009 n’a évolué que très marginalement depuis lors, afin de répondre, au fur et à mesure de leur développement, aux contraintes liées à la crise sanitaire et au lancement du projet de certification ISO 9001-2008 (voir annexe).
L’organisation opérationnelle de l’établissement est basée sur deux pôles d’activité, correspondant à ses deux grandes missions légales : l’établissement pharmaceutique qui comporte une cellule « opérations pharmaceutiques » (deux pharmaciens) et une cellule logistique (quatre logisticiens et un gestionnaire de stocks) ; la réserve sanitaire, composée d’une cellule « gestion » et d’une cellule « formation ». L’ensemble des fonctions de soutien (ressources humaines, finances, affaires générales, informatique) relève du secrétariat général. Les fonctions transverses (qualité, contrôle interne, contrôle de gestion) sont rattachées à la direction générale.
L’article L. 3135-3 du CSP dispose que les agents de l’établissement public sont régis par les articles L. 5323-1, 2 et 4 du même code qui définissent les conditions d’emploi des personnels de l’AFSSaPS. Il précise que l’EPRUS « peut faire appel à des agents contractuels de droit privé pour occuper des fonctions de caractère scientifique et technique » et que ses agents sont soumis au secret professionnel. On compte quinze fonctionnaires détachés sur un effectif de 35 agents, dont six en provenance de la fonction publique hospitalière et deux de la fonction territoriale.
Initialement fixé, en 2007, à 17 équivalents temps plein (ETP), le plafond d’emplois de l’EPRUS a été porté par les lois de finances de 2008 et 2009 à 35. Ce plafond a été atteint en juillet 2009, l’établissement se trouvant ainsi au plein de ses moyens en personnel à la veille de la phase opérationnelle de lutte contre la pandémie grippale. Il est cependant à observer qu’au-delà du départ de ses premiers directeur général et secrétaire général et sans rapport direct avec lui, l’établissement a subi un renouvellement très important de son effectif initial puisque 17 autres agents ont quitté l’établissement alors que l’effectif était d’une vingtaine de personne jusqu’à la fin 2008. Certains services, à commencer par le secrétariat général, était donc encore en complet renouvellement au printemps 2009. Cette forte rotation d’effectifs se traduit par le fait que huit agents seulement sont en poste depuis 2007, pour 24 depuis 2008 et treize depuis 2009.
Après constitution de l’effectif, les seuls recrutements envisageables concernent le remplacement des agents démissionnaires. Néanmoins, la montée en charge de l’activité de l’EPRUS, notamment au sein du pôle réserve sanitaire, conduit au recrutement ponctuel d’agents contractuels.
Au cours du premier semestre 2010, la charge de travail liée à la période de crise pandémique reste encore importante pour le secteur logistique qui doit fiabiliser les inventaires de stocks, assurer le retour des approvisionnements non utilisés (établissements de santé, centres de vaccination, officines…), pour les services financiers et comptables qui ont à traiter un volume exceptionnel d’engagements à liquider et mandater et pour le département de la réserve sanitaire qui doit faire face à l’afflux massif des dossiers des professionnels de santé retraités ou sans emploi réquisitionnés pendant la campagne de vaccination.
La rémunération annuelle brute moyenne par ETP s’établit à 34 227 € en 2009. Les évolutions constatées sur les rémunérations des agents correspondent à celle de la valeur du point d’indice de la fonction publique et aux progressions individuelles d’échelons.
La rémunération annuelle brute en 2009 est de 96 920 € en moyenne pour les cinq principales rémunérations avec un écart de près de 60 % entre les deux situations extrêmes.
Les rémunérations des dirigeants de l’établissement ne font pas partie des matières soumises à la délibération du conseil d’administration par l’article R. 3135-7 du CSP. Elles ont été fixées par lettre du ministère du budget pour ce qui concerne le directeur général et l’agent comptable, et, pour les trois autres, en application des dispositions du décret 2003-224 du 7 mars 2003 fixant les règles applicables aux personnels contractuels de droit public recrutés par certains établissements publics intervenant dans le domaine de la santé publique et de la sécurité sanitaire.
L’encadrement de l’établissement ne bénéficie d’aucun avantage de fonction ou en nature, le seul véhicule dont l’EPRUS dispose, en location, servant à l’ensemble des besoins de service.
Des règles de fonctionnement provisoires de l’EPRUS avaient été approuvées par le conseil d’administration le 20 novembre 2007. Suite à l’installation dans les nouveaux locaux (voir infra), un projet de règlement intérieur a été élaboré qui traite notamment des droits et obligations des agents, du temps de travail, de l’hygiène et de la sécurité, des sanctions disciplinaires, du fonctionnement de l’EPRUS et des mesures de crise. Il comprend en annexe un tableau indicatif des horaires hebdomadaires, le plan de continuité d’activité (PCA) ainsi qu’une charte relative à l’utilisation et à la sécurité des systèmes et ressources informatiques de l’établissement visant à se concilier avec la liberté de ceux qui y travaillent, charte qui a été préparée par le service informatique et le correspondant informatique et libertés (CIL) de l’EPRUS.
Conformément à la réglementation, ces actes ont été soumis pour avis au comité technique paritaire (CTP) en avril 2010, puis à la délibération du conseil d’administration du 7 mai 2010.
Comme prévu par l’article 11 de la convention Etat-EPRUS, une note organisant les modalités et le calendrier des astreintes auxquelles est soumis le personnel de l’établissement a été élaborée par son responsable sécurité et participe du « système qualité » de l’EPRUS.
La liste des agents chargés d’assurer les astreintes et leur calendrier semestriel sont validés par le directeur général. Un cahier d’astreintes enregistrant tout évènement survenu est soumis au visa mensuel du correspondant du haut fonctionnaire de défense et de sécurité du ministère de la santé et du responsable de la sûreté de l’établissement. Un dossier d’astreinte comprend notamment les coordonnées téléphoniques utiles, un classeur regroupant les procédures et les « fiches réflexes » applicables en cas d’événement le justifiant et pour répondre à une demande soit d’information, soit d’intervention.
La rémunération des astreintes se fait en référence aux dispositions de l’arrêté du 26 novembre portant application du décret n° 2004-1290 du 26 novembre 2004 « fixant le régime indemnitaire applicable aux personnels recrutés par certains établissements publics intervenant dans le domaine de la santé publique ou de la sécurité sanitaire » qui régit de manière uniforme les principales agences sanitaires.
L’établissement a par ailleurs élaboré un projet de plan de continuité des activités (PCA) décrivant les conditions dans lesquelles l’EPRUS pourrait assurer la poursuite de ses missions « en mode dégradé ou en situation de crise majeure », en maintenant notamment une disponibilité suffisante de ses personnels et de son système d’information.
Enfin, il est à signaler que le conseil d’administration du 7 mai 2010 a adopté la décision d’attribuer une « prime destinée à compenser la surcharge de travail due à la gestion de la grippe A H1N1 », d’un montant uniforme de 500 € bruts à tous les agents ayant participé activement à cette campagne et assuré des permanences exceptionnelles à ce titre.
C. Les locaux et les investissements
1. Le déménagement à Saint-Denis
En décembre 2008 et ainsi que son nouveau directeur en avait reçu la mission, l’EPRUS, qui était antérieurement sis au 140 bis, rue de Rennes à Paris, s’est installé dans des bureaux en location au 21, avenue du Stade de France à Saint-Denis, dans le même quartier que la HAS et l’Etablissement français du sang, et non loin du quartier Pleyel où sont localisées plusieurs agences sanitaires dont l’AFSSaPS.
Selon le précédent directeur général, cette relocalisation avait été précédée sous son mandat d’une recherche ayant porté sur « vingt-huit sites » et lui ayant permis de faire « très rapidement une proposition visant à installer l’établissement dans une tour parfaitement sécurisée ». Le désaccord de la tutelle sur ce projet serait, selon lui, la raison principale du retard subi dans l’autorisation de l’établissement pharmaceutique indispensable au bon accomplissement par l’EPRUS de sa mission de gestion des stocks.
Les bureaux actuels, loués à bail à la SCI BRECAL, se situent à l’étage d’un immeuble à vocation « commerciale et bureaux » où ils voisinent avec une société de télésurveillance de locaux et avec la société des pianos Pleyel. A ce même niveau, l’EPRUS dispose en propre d’un hall d’entrée où sont installés son service d’accueil et une salle de réunion.
D’une surface locative de 665 m², à laquelle s’ajoutent douze emplacements de stationnement et un sous-sol à destination de local d’archives, les installations de l’établissement comportent 28 bureaux pour 35 agents permanents. A ce jour aucune extension n’est envisagée. L’EPRUS fait valoir la substantielle économie de gestion que comporte cette solution, le loyer annuel ayant été ramené de 734 K€ en 2008 à 188 K€ en 2009.
Il est cependant à signaler que, selon la direction de l’établissement, le faible nombre de trains s’arrêtant à la gare « Saint-Denis/Stade de France » aux heures de pointe et la sécurité affaiblie du quartier en fin d’après-midi pourraient être à l’origine d’une partie des départs d’agents constatés depuis l’installation à Saint-Denis.
2. Les investissements informatiques et les outils de gestion
Hormis les investissements liés à l’installation de l’EPRUS dans ces nouveaux locaux (mobiliers et travaux) et le projet de construction d’entrepôts EPRUS à Vitry-le-François (voir infra, partie III, A, 3) les investissements réalisés ou envisagés concernent avant tout l’équipement informatique et la sécurité du réseau de l’EPRUS.
L’établissement s’est doté d’un ensemble d’outils destinés à sécuriser une gestion particulièrement complexe :
- PARTEOR, progiciel de gestion intégrée des stocks, permet notamment de gérer les entrées, sorties et transferts, de générer des états, d’accéder à des données logistiques, de gérer des emplacements, de tracer une partie du processus d’achat, d’assurer une traçabilité par lots ; son déploiement se poursuit s’agissant de la gestion des achats ;
- AGIRS, progiciel de gestion de dossiers développé pour la réserve sanitaire, permet de gérer les candidatures en dématérialisant une partie de la procédure. Des modules en cours de développement augmenteront les capacités de cet outil en ajoutant le suivi des opérations et de la formation, et le calcul des rémunérations dues aux réservistes et des cotisations associées ;
- CONCERTO, progiciel de gestion budgétaire et comptable permet notamment de préparer le budget, de suivre les opérations budgétaires, les dépenses, les recettes et la comptabilité générale. Cet outil sécurisé et authentifié a été adapté pour assurer la gestion d’un service facturier et assure une traçabilité des opérations, l’identification des acteurs et la comptabilisation des AE/CP en classe 8 ;
- VISIO, logiciel permettant de modéliser les processus et procédures sous forme de logigramme ;
- ENNOV DOC, progiciel de gestion électronique de documents qui garantit une identification simple et rapide de la version des documents et de leurs signataires (rédacteurs, vérificateurs, approbateurs).
Les acquisitions des logiciels ou progiciels PARTEOR (148 K€), ENNOV (60 K€) et AGIRS (161 K€) constituent l’essentiel des opérations d’investissements engagées en 2009 (676 K€ au total, dont 508 K€ d’informatique). Un budget informatique réduit de près de moitié a été prévu en 2010 en vue d’assurer la poursuite de la mise en œuvre des applications PARTEOR et AGIRS.
Les différents outils de gestion dont l’établissement a ainsi fait l’acquisition ne sont pas encore pleinement opérationnels. Début mai 2010, les gestionnaires de l’EPRUS indiquaient ainsi que le principal d’entre eux, le progiciel CONCERTO, instrument budgétaire classique pour les établissements publics administratifs, n’était guère adapté pour le suivi de marchés, qui constitue le chef principal de dépense de l’établissement et l’essentiel des charges dans le champ du cofinancement Etat-assurance maladie, ni pour la gestion budgétaire prévisionnelle qui est au cœur du dialogue de gestion.
Un autre outil interne, GEBUS, devrait donc être prochainement finalisé pour cette fonction prévisionnelle, y compris pour les achats et commandes. Un instrument de « requêtage » MY REPORT, est également attendu pour interroger à la fois CONCERTO, GEBUS et le progiciel de gestion des stocks PARTEOR en vue notamment de l’établissement des rapports quadrimestriels de gestion adressés au CBCM. L’ensemble du système ne devrait cependant être parachevé qu’avec l’installation d’un module « achats » de PARTEOR et l’organisation de son interface fonctionnelle avec l’outil budgétaire, CONCERTO.
Cette situation signifie que l’intense activité de commandes qui a caractérisé l’année 2009 et la gestion des « retours » de produits de santé pandémiques du début 2010 ont dû, pour une large part, être suivies avec des moyens de fortune.
D. Le transfert des stocks sanitaires
1. L’établissement pharmaceutique : une mise en place différée de deux ans
La loi de mars 2007 ayant créé l’établissement lui a confié la gestion de stocks stratégiques composés essentiellement de médicaments, de vaccins et de dispositifs médicaux, et prévu qu’à cet effet, un établissement pharmaceutique soit chargé de l’acquisition, de la gestion, de l’importation, de l’exportation et de la distribution de ces produits (dernier alinéa de l’article L. 3135-1 du CSP). Elle dispose également que cet établissement pourra exploiter ou fabriquer des spécialités pharmaceutiques, le Législateur visant par là des produits orphelins nécessaires au traitement de maladies rares ou des antidotes peu usités en pratique médicale courante, mais efficaces contre les effets de produits potentiellement utilisables dans le cadre d’attaques chimiques ou biologiques.
A sa création, l’EPRUS ne correspondait cependant à aucun des établissements pharmaceutiques énumérés par l’article R. 5124-2 du CSP. En particulier, il ne pouvait réclamer le statut de distributeur en gros qui exigeait du titulaire de disposer en propre de l’ensemble des locaux où il exerçait son activité, y compris du point de vue du stockage. Le retard mis à apporter une solution réglementaire adaptée à cette contrainte a lourdement pénalisé la mise en place de l’établissement pharmaceutique et le transfert effectif des fonctions de gestion des stocks d’urgence.
Il a fallu, en effet, attendre un décret du 22 août 2008 pour que soit ajouté un 14ème alinéa à l’article R. 5124-2 CSP, alinéa spécifique à l’EPRUS qui prévoit l’exercice de toutes les activités prévues par la loi et la possibilité de sous-traitance. Le recrutement du responsable du futur établissement pharmaceutique ayant abouti en décembre, le dossier d’autorisation n’a cependant été déposé à l’AFSSaPS que début janvier 2009 ; il précise notamment les activités pour lesquelles il est fait appel à la sous-traitance. Et ce n’est que le 23 mars suivant, soit deux ans après le vote de la loi, que l’établissement pharmaceutique a été autorisé à ouvrir, ce qu’il a fait trois jours plus tard par décision du directeur général. Ce n’est qu’alors qu’a pu être engagé, dans les conditions réglementaires requises, le transfert effectif de la gestion des produits pharmaceutiques jusqu’alors conservée par la DGS.
La constitution de l’établissement pharmaceutique s’est accompagnée de la décision d’engager une démarche de certification qualité ISO 9001. L’audit de certification à cet effet doit intervenir fin octobre 2010.
2. Un transfert désormais achevé du pouvoir adjudicateur
L’EPRUS a transmis à la Cour un tableau récapitulant le calendrier selon lequel s’est opéré le transfert à l’établissement du pouvoir adjudicateur sur les marchés encore actifs antérieurement passés par le ministère ou au titre du FOPRIS. Ce transfert, après avoir été retardé par les délais de mise en place juridique de l’établissement pharmaceutique, est aujourd’hui achevé. Il fait notamment apparaître que :
- le transfert du marché des vaccins Neisvac comme MenBvac, étant intervenu avant la création de l’établissement pharmaceutique a nécessité une procédure dérogatoire par laquelle le ministre et l’AFSSaPS ont autorisé transitoirement un prestataire pharmaceutique à procéder à l’acquisition et au stockage ;
- deux transferts qui restaient encore en instance début 2010 (vaccins Memomume et immuserums anti-botuliniques), la DGS souhaitant régler elle-même diverses questions avec le prestataire, sont désormais opérés ;
- arrivé à échéance, le marché relatif à une subvention de l’Institut Pasteur pour la mise en place d’un réseau de surveillance de la pandémie grippale en Afrique doit faire l’objet d’une nouvelle convention visant à la poursuite de ce projet.
Pour parfaire cette passation, l’établissement avait demandé à la DGS de lui transmettre également pour sa complète information les marchés désormais non actifs concernant tous les produits entrant dans la composition des stocks stratégiques22 en communiquant à cette occasion copie ou originaux des marchés d’acquisition permettant d’en retracer l’historique et d’éviter des erreurs de prise en compte (notamment concernant les prix et l’unité d’achat). Des informations sont encore attendues concernant les commandes les plus anciennes comme celles des vaccins antivarioliques qui remontent à plusieurs décennies. Cette situation expliquerait qu’ainsi que l’a noté la mission nationale d’audit dans son rapport de mars 2010, « sur l’échantillon retenu par les auditeurs, quatre références représentant un montant total de 370,8 M, soit 39 % des stocks, sont valorisés sur une base invérifiable, dont l’exactitude ne peut être attestée à ce jour ». Des échanges23 entre l’EPRUS et la DGS ont conduit fin juin à dresser la liste de 23 contrats pour lesquels la documentation de l’établissement restait à assurer en tout ou partie. 17 des marchés identifiés devraient être communiqués à l’EPRUS à l’issue d’un protocole de transfert qui était en cours de signature fin août.
Ces dispositions devraient permettre de mener à terme, à partir des pièces des marchés d’acquisition, une vérification systématiques des prix unitaires retenus dans PARTEOR (les 2/3 en avaient, selon l’EPRUS, été réexaminés au 5 août dernier). En cas d’impossibilité de produire le marché, il est prévu que la DGS fixe un prix pour le produit en cause.
3. Une inscription des stocks s’opérant désormais dans la comptabilité de l’établissement
Selon la rédaction initiale de l’article 5-1 de la convention Etat-EPRUS, les stocks sanitaires dont la gestion était assurée par l’EPRUS avaient vocation à être comptabilisés dans le bilan de fin d’exercice de l’Etat, position dont la DGS tient à rappeler qu’elle avait été adoptée à la demande de la DGFiP, soucieuse que soit clarifiée « la domanialité de ces stocks », et en accord avec elle, et qu’elle a été ultérieurement modifiée conformément à la demande de la Cour. Ce choix se voulait cohérent tant avec la volonté de l’Etat de conserver la maîtrise stratégique de la politique menée en matière de stocks d’urgence qu’avec les dispositions de l’article 3-1 de cette même convention selon lesquelles tant les stocks antérieurement acquis par le ministère que ceux nouvellement acquis par l’établissement « demeurent la propriété de l’Etat ». Il est à noter que la loi de 2007 ne tranchait pas nettement ce dernier point, sa rédaction de l’article L. 3135-1 du CSP se limitant à indiquer que le nouvel établissement est chargé « à la demande du ministre de la santé, d’acquérir » ces produits, sans préciser si cela se fait pour son compte propre ou pour celui de l’Etat.
La convention Etat–EPRUS prévoyait à ce titre une procédure d’enregistrement comptable sui generis, en deux temps : la valeur du stock confié à l’EPRUS était inscrite dans ses comptes au 1er janvier de l’année n et enregistrait en cours d’année la valeur des mouvements effectués, pour être par la suite « contrepassée dans la comptabilité de l’EPRUS et inscrite dans celle de l’Etat, propriétaire de ces stocks » à sa valeur arrêtée au 30 novembre de cette même année.
Cette position avait conduit à comptabiliser l’ensemble des stocks sanitaires au bilan de l’Etat pour une valeur approchant 552 M€ au 31 décembre 2008, bien qu’à cette date une partie d’entre eux, représentant 226,7 M€, ait déjà été transférée à l’EPRUS. Ce montant correspondait pour l’essentiel à des matériels destinés à la lutte conte la pandémie grippale- masques chirurgicaux, masques FFP2, seringues et collecteurs- qui, n’étant alors pas soumis à la réglementation pharmaceutique avaient pu être transférés à l’EPRUS avant que celui-ci soit constitué en établissement pharmaceutique. Une observation d’audit de la Cour formulée lors de la certification des comptes de l’Etat pour cet exercice 2008 a cependant considéré qu’au vu de la norme comptable n° 8 relative aux stocks et de la norme n° 6 relative aux immobilisations corporelles à laquelle elle renvoie sur ce point24, les responsabilités légalement confiées à l’établissement lui assuraient un « contrôle » opérationnel sur les stocks qu’il gère ou acquiert et que la valeur de ceux-ci devait être portée à son bilan.
Cette observation d’audit a été acceptée par l’administration, celle-ci ayant cependant tenu à préciser que « le changement de traitement comptable n’entraîne aux yeux du ministère chargé de la santé garant de la politique de santé publique et de la réponse aux urgences sanitaires, aucun changement dans les rôles respectifs des signataires de la convention du 16 février 2009 ».
En conséquence, un avenant à la convention Etat-EPRUS a été signé le 4 septembre 2009 qui précise que « les stocks restant dans la comptabilité de l’Etat au 31 décembre 2008 seront transmis à l’EPRUS au fur et à mesure des transferts de marché correspondants » et que « la valeur des stocks détaillée par nature de produits est inscrite au bilan de l’EPRUS au 31 décembre de l’exercice. Cette valeur est justifiée par la production d’un inventaire détaillé ». Les comptes 2008 de l’établissement ont par suite été rectifiés par l’inscription au bilan de stocks d’une valeur de 235 M€ (incluant les stocks acquis par l’EPRUS courant décembre) et les comptes de l’établissement pour 2009 se sont conformés à la nouvelle règle, en enregistrant l’ensemble des stocks transférés à l’établissement ou acquis par lui au cours de l’exercice, sous réserve des principes de valorisation ou de dépréciation désormais retenus (voir infra, partie III, A, 1).
Dans ces conditions, la valeur brute des stocks gérés par l’EPRUS et inscrits à son bilan s’élève au 31 décembre 2009 à 1 007,3 M€ au total, dont la décomposition par produits est donnée dans le tableau ci-après25. On remarquera que le montant relatif aux vaccins comprend pour près de 106,8 M€ les acquisitions des divers vaccins contre la grippe H1N1 ayant été mandatées au cours de l’exercice, diminuées des sorties alors opérées vers les répartiteurs, considérées par l’établissement comme échappant dès lors à son contrôle direct26.
Tableau n° 1 : Décomposition de la valeur brute des stocks au 31 décembre 2009

Source : EPRUS
La mise en place de la réserve sanitaire n’ayant été que très progressive (voir infra, partie III, C), la fonction d’achat et de commande découlant de la mission de gestion des stocks sanitaires que lui a confiée la loi et le suivi des procédures de négociation qu’elle comporte a mobilisé une part essentielle de l’activité et des moyens financiers de l’EPRUS au cours de ses trois premières années d’existence. Si sa contribution à la mise en œuvre de la stratégie de lutte contre la pandémie grippale H1N1 qui a dominé tout l’exercice 2009 sera examinée plus loin (voir infra partie III, B), on examinera ci-après les caractéristiques d’ensemble de cette activité.
1. Les commandes de l’établissement
Une diversité de procédures
Les achats d’un établissement public administratif tel que l’EPRUS sont, par principe, effectués dans le cadre du code des marchés publics, ce qui implique, pour l’essentiel, que la conclusion des contrats doit être précédée, sauf exceptions, d’une publicité et d’une mise en concurrence. De ce point de vue, les achats de l'établissement ont été effectués dans des contextes distincts :
- des marchés antérieurement conclus par la DGS ou le FOPRIS ; c’est le cas, notamment, des contrats en vue de la fourniture de vaccins contre le virus A/H1N1, conclus en juillet 2009 en tant qu’avenants aux marchés passés en 2005 par la DGS avec les laboratoires Sanofi Pasteur et Chiron Vaccine devenu ultérieurement Novartis ;
- des marchés publics passés par l’EPRUS : à cet égard, l'établissement, comme toutes les entités soumises au code des marchés publics, est tenu, en application de l'article 133 de ce texte, d’établir tous les ans un tableau recensant les marchés conclus lors de l'exercice précédent ;
- des contrats conclus en dehors du code des marchés publics en vertu de l’exception prévu à l'article 3-7° de ce dernier pour les marchés « qui exigent le secret ou dont l'exécution doit s'accompagner de mesures particulières de sécurité […] ou pour lesquels la protection des intérêts essentiels de l’Etat l’exige. » ;
- des conventions avec l’Union générale des achats publics (UGAP), centrale d’achats au sens du code des marchés publics, auprès de laquelle les pouvoirs adjudicateurs sont habilités à acquérir des fournitures sans devoir faire une publicité et une mise en concurrence, celles-ci étant déjà effectuées par la centrale d’achats ;
- une convention avec la direction centrale du service de santé des armées, conclue en juillet 2009 en vue du développement et de la production de l’antivirus Oseltamivir PG 30 mg.
Des montants très variables
L’EPRUS a communiqué les indications requises par l'article 133 et ses arrêtés d’application : la liste des contrats passés dans le cadre du code des marchés, classés par type d’objet (fournitures ou services) et par tranche de montant, avec l’indication, pour chaque marché, de son objet, son titulaire et sa date de conclusion. Ces tableaux recensent dix marchés qui ont été conclus par l’EPRUS en 2008 et 28 signés en 2009.
S'agissant des marchés de faible montant, figurent, pour 2008, des prestations informatiques relatives au logiciel de gestion comptable pour moins de 20 000 € HT. Dans la tranche de 20 000 à 50 000 € HT, l’on trouve des marchés d’objets divers, soit en rapport avec le fonctionnement de l'établissement (prestations d’accueil téléphonique), soit des achats de doses de vaccins anti-méningococciques. Du fait du relèvement, par le décret n° 2008-1356 du 19 décembre 2008, de 4 000 € HT à 20 000 € HT du seuil en dessous duquel les pouvoirs adjudicateurs ne sont pas tenus de faire une publicité et une mise en concurrence, la liste des marchés de 2009 commence par la tranche de 20 000 à 50 000 € HT où se côtoient l’acquisition d’un progiciel de gestion documentaire et des prestations d’impression, façonnage et livraison de notices pharmaceutiques.
Parmi les achats de moyenne importance (tranches allant de 50 000 à 206 000 € HT), sont notamment répertoriés, en 2009 :
- des achats de fournitures courantes et de consommables informatiques, une étude de programmation pour la construction de bâtiments de stockage ;
- des acquisitions relatives à la réserve sanitaire (fournitures de paquetages et de tenues vestimentaires des réservistes, application de gestion informatique de réserve sanitaire),
- des prestations de réception, stockage et déstockage de masques.
Les marchés des tranches les plus élevées (à partir d’un million d’euros) comprennent pour une grande part, des marchés à bons de commande assorties de reconduction et ayant pour objet, soit des services (l’assistance juridique ; des prestations de transport de personnes notamment pour la réserve sanitaire ; un progiciel de gestion des produits de santé ; le transport de produits de santé, etc.), soit des fournitures (en 2008, acquisition de vaccins anti-méningococciques ; en 2009, achats de Tamiflu, de masques FFP2 et de masques chirurgicaux pédiatriques).
L’EPRUS a en outre communiqué les listes, pour 2008 et 2009, des marchés passés en dehors du code par application de l’exception prévue à l'article 3-7° précité. Indépendamment du bien-fondé du recours à cette exception (voir infra, partie III, B), il ressort de ces listes que ces contrats ont eu pour objet :
- en 2008, des achats de médicaments notamment antibactériens relevant des plans « Biotox » et « Piratox », à hauteur de 7,5 M€ ;
- en 2009, pour l’essentiel, le plan Pandémie, avec, comme principal contrat, la réservation des vaccins H1N1 Pandemrix de GlaxoSmithKline (GSK) et, par ailleurs, un grand nombre d’achats (antiviraux, matériels nécessaires à la vaccination, etc.) et des services, notamment de réception, de stockage et de déstockage.
L’EPRUS a enfin eu recours à l’UGAP pour l’acquisition de masques FFP2, en complément d’un marché négocié. S'agissant spécifiquement de la pandémie grippale, les achats ont porté sur les masques chirurgicaux pédiatriques, des consommables nécessaires à la vaccination (en complément des acquisitions faites dans le cadre de l'article 3-7° du code des marchés publics) et des ventilateurs et équipements de circulation et oxygénation extracorporelle (voir infra).
Un enjeu financier majeur
Les charges afférentes aux achats de fournitures et de services de l’établissement effectués dans le cadre des contrats conclus par l’EPRUS ou des contrats antérieurement passés par la DGS ou par le FOPRIS ont été d’un montant total de 51,9 M€ en 2007, 69,0 M€ en 2008 et 463,2 M€ en 2009.
Tableau n° 2 : Les achats de fournitures et de services
En M€ |
2007 |
2008 |
2009 |
Total |
Fonctionnement de l'établissement |
0,9 |
1,9 |
7,2 |
10,1 |
Produits de santé |
51,0 |
67,0 |
455,7 |
573,7 |
- Médicaments |
5,4 |
345,8 |
||
Vaccins Grippe |
0,0 |
323,2 |
||
Vaccins hors Grippe |
1,7 |
5,7 |
||
Autres médicament Pandémie |
0,0 |
10,4 |
||
Autres médicaments Hors pandémie |
3,7 |
6,5 |
||
- Dispositifs médicaux |
0,0 |
5,7 |
||
- Autres matériels médicaux |
54,7 |
87,5 |
||
- Services (logistique, stockage autres services) |
7,0 |
16,7 |
||
- Réserve sanitaire |
0,0 |
0,2 |
||
Total |
51,9 |
69,0 |
463,2 |
584,0 |
Source : EPRUS
Sur l’ensemble des trois exercices, les achats relatifs au fonctionnement de l'établissement ont représenté 1,7 % de l’ensemble, ceux en rapport avec la réserve sanitaire seulement 0,04 %, les achats de produits de santé et de services associés s’élevant à 98,2 % du total.
La part du total des achats dans le total des charges de l’établissement, hors variations de stocks, a été de 97 % en 2008 et 96 % en 2009.
A eux seuls, les vaccins et les médicaments en rapport avec la pandémie AH1N1 (sans préjudice des autres achats afférents à celle-ci – voir infra) ont pesé pour 72 % dans les achats de 2009.
2. Organisation et contrôle des procédures
Une cartographie de risques établie début 2009 sous la responsabilité du directeur général et avec la coopération de l’agence comptable permet de mesurer l’ampleur de ceux qui affectaient alors la procédure de passation et d’exécution des marchés qui constitue l’une des missions essentielles de l’établissement. Parmi la cinquantaine de facteurs ainsi identifiés, le plus préoccupant tenait à ce qu’il « n’existe pas au sein de l’EPRUS une fonction commande publique dédiée » et à ce que « de ce fait, aucune politique d’achat n’est déterminée ». Les conséquences en étaient ainsi décrites :
« Il n’est pas garanti que l’ensemble des achats de l’EPRUS soit conforme aux dispositions réglementaires […]Les coûts ne sont pas rationalisés, chaque service passant ses propres marchés sans prise en compte des besoins globaux ».
Il était également observé que le pôle produits de santé qui est en charge d’approvisionnements sanitaires majeurs les enregistrait sous tableur sans interface avec le logiciel budgétaire CONCERTO et sans garantir « une traçabilité des personnes ayant saisi ou modifié un dossier » ni « suivi nominatif des corrections apportées » ; un risque particulier d’erreur était aussi signalé pour les virements à l’étranger. Quant aux marchés d’un montant inférieur à 20 000 €, certains d’entre eux étaient « gérés directement par les services opérationnels alors même qu’ils ne disposent pas des compétences juridiques pour juger de la validité du montage contractuel envisagé », pratique qui « favorise, par ailleurs, les pratiques anticoncurrentielles ». De nombreux autres défauts d’information ou de gestion étaient recensés susceptibles d’induire des sous-provisionnements budgétaires, des non-récupérations d’avances, des intérêts moratoires, des absences de visa obligatoire, des erreurs sur le service fait, le paiement, la comptabilisation des opérations ou l’archivage des contrats.
La constitution à la fin du printemps 2009 d’une cellule juridique de trois agents a conduit à modifier les procédures de passation des contrats de telle façon que l’ensemble des contrats, même de montant modique, soient soumis à son examen. Dès lors que l’achat atteint 4 000 € HT, une procédure de passation doit être suivie, trois niveaux de procédure étant prévus : de 4 000 à 20 000 € HT, de 20 000 à 90 000 € HT et de 90 000 à 125 000 € HT. Les dispositifs ainsi prévus sont de nature à concilier la souplesse de gestion et les exigences des principes généraux de la commande publique vis-à-vis des marchés de ces montants. Les aspects budgétaires et financiers sont également pris en compte. L’organisation d’un suivi des paiements devrait permettre d’identifier erreurs et retards notamment dans les virements à l’étranger.
Il est, par ailleurs, à souligner que si un arrêté « relatif aux modalités d’exercice du contrôle financier » sur l’EPRUS a été pris le 11 mars 2008, ce texte ne fixe pas directement les seuils financiers au-dessus desquels les opérations, et en particulier les contrats, sont soumis au visa du contrôle financier, cette fixation devant intervenir « après consultation de l’établissement ». Cette procédure n’a pas encore formellement abouti, même si un projet élaboré par le CBCM du ministère de la santé et des sports propose de soumettre à son avis préalable les contrats d’un montant global supérieur à 350 000 €.
3. Observations sur quelques marchés et conventions
La régularité des procédures de passation
Un échantillon de cinq marchés sur les 38 conclus en 2008 et 2009 a été examiné au regard de la régularité formelle de leur passation. Les points de contrôle ont porté sur la publicité (avis d’appel public à la concurrence et règlement de la consultation), les délais laissés aux candidats pour faire acte de candidature et / ou présenter une offre, les exigences en matière de candidatures et les décisions relatives à celles-ci, l’examen des offres au regard des critères annoncés dans la publicité, l'information des candidats évincés et le respect d’un délai avant la signature du marché, la présence, avec les mentions appropriées, du rapport de présentation.
De façon générale, l’examen a montré que les avis d’appel public à la concurrence comportent les mentions prévues par le modèle fixé par le règlement (CE) n° 1564/2005 de la Commission du 7 septembre 2005 et précisées par la jurisprudence administrative. Le règlement de la consultation de chaque marché examiné est de nature à donner aux candidats intéressés toutes les informations utiles sur les prestations attendues et sur le déroulement de la consultation. Les offres ont fait l'objet d’examens détaillés au regard de tous les critères annoncés.
De manière plus détaillée, il peut être relevé, en ce qui concerne le marché EPRUS/08-15, passé par appel d'offres ouvert, relatif à l’acquisition et à la réservation de vaccins anti-méningococciques, la présence, dans le dossier, d’une définition des besoins étayée de manière claire par divers documents, dont une note de l’AFSSaPS. Le marché EPRUS/09-12, relatif au transport de produits de santé en France métropolitaine, étant un marché à bons de commande sans montant maximum, a fait l'objet, à juste titre, d’un appel d'offres avec publicité communautaire. Pour le marché EPRUS/09-19 en vue de l’acquisition de Tamiflu, le rapport de présentation justifie, comme il est exigé, le motif du recours à la procédure négociée sans publicité ni mise en concurrence, prévue à l'article 35-II-8° du code des marchés publics pour les marchés qui ne peuvent être confiés qu'à un opérateur économique déterminé. Le marché EPRUS/08-22 relatif à des prestations d’assistance juridique, a été passé en tant que marché à procédure adaptée comme l’autorise l'article 30 du code des marchés publics pour les marchés de services, notamment juridiques ; sa passation a donné lieu à une publicité suffisante, notamment par la publication d’un avis au Bulletin officiel d’annonces des marchés publics (BOAMP) ; la sélection des candidatures et l'attribution des différents lots ont été effectués en toute conformité avec les exigences rappelées par le juge administratif pour cette catégorie de marchés, en particulier, l'information des candidats sur les critères de sélection27. Il est cependant relevé que sur demande ministérielle, l’EPRUS a eu recours, début 2010, aux prestations de deux cabinets d’avocats qui n’avaient pas été retenus dans le cadre de cette procédure de sélection (voir infra, partie III, B, 3).
Le seul écart par rapport aux règles de la passation constaté dans l’échantillon examiné a été relevé à propos du marché EPRUS/09-28 relatif à l’acquisition de masques FFP2 et dont la consultation a été lancée le 20 mai 2009. Alors que les documents de publicité indiquaient que le contrat serait attribué à l’issue d’une procédure négociée après publicité et mise en concurrence, comme l’autorise l'article 35-I-4° du code des marchés publics dès lors qu’il s’agit « de fournitures ou de services dont la nature ou les aléas qui peuvent affecter leur réalisation ne permettent pas une fixation préalable et globale des prix », le choix des titulaires des divers lots est intervenu à la suite de l’examen des offres sans qu’il soit procédé à une négociation avec les candidats retenus. Cette décision, que l’EPRUS explique par le contexte de l’urgence liée la crise pandémique, aurait pu donner lieu à des contestations de la part des candidats non retenus.
A ces réserves près, il apparaît pour l’échantillon examiné, que l’EPRUS se conforme bien aux règles du code des marchés publics.
Les contrats négociés hors code des marchés publics
Un autre échantillon de trois marchés passés en dehors du code des marchés publics en vertu de l'article 3-7° (et autres que les marchés de vaccins A/H1N1) a donné lieu à un bref examen. Il s’agit des marchés EPRUS/09-48 (réception, stockage, déstockage de produits de santé dans le cadre du plan Pandémie), EPRUS/09-56 (transport de produits pharmaceutiques en froid dans le cadre de la campagne de vaccination) et EPRUS/ 09-869 (acquisition et livraison d’alcool modifié).
Sans préjudice des doutes sérieux susceptibles d’être formulés sur le bien-fondé du recours à une telle exception (voir infra, à propos des commandes liées à l’épidémie H1N1, partie III, B, 2), il est observé que les contrats en cause, d’une part, font état des conditions particulières de leur conclusion, d’autre part, comportent, notamment le marché de réception et de stockage, l'ensemble de clauses appropriées à leur objet.
Le recours à l’UGAP
Comme indiqué ci-dessus, l’EPRUS a eu recours à l’UGAP, comme la DGS le pratiquait antérieurement, pour trois séries d’achats d’un montant total de 155,6 M€. En premier lieu, une convention a été conclue en septembre 2008 pour l’acquisition de 350 millions de masques FFP2 pour un montant de 146,6 million d’euros. En deuxième lieu, une convention (EPRUS/09-44) a été conclue en juillet 2009 pour la fourniture de masques chirurgicaux pédiatriques. Peu après, le 14 août 2009, celle-ci a été intégrée à une nouvelle convention EPRUS/09-45 portant sur des matériels et des consommables divers. Les acquisitions de masques pédiatriques ont été au nombre de 9 millions pour un montant de 0,9 M€. Les commandes de consommables de vaccination (seringues et aiguilles, gants d’examen, désinfectants, draps d’examen, compresses) se sont élevées à 3,3 M€ et l’acquisition des matériels spécifiques (« ventilateurs » et dispositifs d’oxygénation) à 4,9 M€.
Tableau n° 3 : Achats à l’UGAP
Conventions |
Objet |
Montant (M€) |
EPRUS/09-34 |
Masques FFP2 |
146,6 |
EPRUS/09-44 et 45 |
Masques chirurg. péd. |
0,9 |
EPRUS/09-45 |
Consommables vacc. |
3,3 |
EPRUS/09-45 |
Ventilateurs et oxygénation |
4,9 |
Total |
155,6 |
Source : EPRUS
Le rapport Jégou retient comme une critique de principe s’agissant d’un établissement dont l’une des missions légales principales est précisément d’assurer l’approvisionnement en produits du stock sanitaire national, le fait que « L’EPRUS a recours, comme le faisait autrefois la DGS, à l’Union des groupements d’achats publics (UGAP), pour la passation de certains marchés d’acquisition de produits ou de convention de stockage, fonctions qui constituent pourtant son cœur de métier28 ».
Il ne semble pas qu’une telle situation soulève difficulté au plan de la régularité, ni qu’elle soit, dans son principe incompatible avec les missions dévolues à l’EPRUS. Ainsi, dans un cas assez comparable, le décret n° 2009-300 du 17 mars 2009 créant le Service des achats de l'État (SAE), service à compétence nationale rattaché au ministre chargé du budget, prévoit des synergies de cette nature en indiquant que le SAE « peut, le cas échéant, confier (…) à l’Union des groupements d’achats publics la conclusion, pour son compte, de marchés, d’accords-cadres ou de contrats ».
L’EPRUS souligne au demeurant les avantages économiques et pratiques du recours à l’UGAP pour les fournitures concernées, recours qui lui permet de réduire la charge souvent lourde que représentent les procédures de passation tout en conservant la maîtrise de la logistique (stockage et diffusion) qui lui revient en propre. Ce partage des rôles peut être mis en œuvre aussi bien pour des achats courants que, comme le montre l’exemple des respirateurs, pour des acquisitions de fournitures spécifiques dont l’UGAP a déjà effectué la commande pour le compte d’autres acheteurs publics.
La marge demandée par la centrale d’achats constitue le prix du service ainsi rendu. Au cas des conventions avec l’EPRUS, elle est d’un montant modeste (1,4 %) dans la mesure où l’UGAP est mise à contribution pour des achats en quantités importantes. Cette modicité tient à ce que, pour certains achats, tels les ventilateurs et le matériel d’oxygénation, l’UGAP a pu déjà passer commande en vue de satisfaire les besoins des hôpitaux. Les commandes que lui adresse l’EPRUS ne lui occasionnent donc pas de coûts particuliers.
*
* *
Retardée de plus d’un an par les différences de conception entre la tutelle et la première direction de l’établissement et par les délais de création de l’établissement pharmaceutique, la mise en place de l’EPRUS pouvait être considérée comme achevée au printemps 2009. L’organisme, installé dans ses nouveaux locaux, avait stabilisé sa direction et réglé le fonctionnement de ses relations avec le ministère chargé de la santé et achevait de renouveler et complété un effectif ayant subi une importante vague de départs. La survenance à cette même époque de la menace de pandémie grippale H1N1 a alors constitué une mise à l’épreuve en vraie grandeur tant de la conduite stratégique revendiquée par l’autorité gouvernementale dans la réponse aux crises sanitaires majeures que de la capacité de mise en œuvre financière et logistique désormais confiée à l’établissement29. Dans le même temps, les urgences propres à la gestion de cette crise ont pu perturber ou différer la mise en œuvre des diverses tâches constitutives de l’ordre de marche normalement assigné à l’EPRUS.
partie iii : LA MISE EN ŒUVRE DES MISSIONS
Cette partie analysera successivement l’activité de l’EPRUS en matière d’acquisition et de gestion des stocks sanitaires (A), les conditions spécifiques de passation des achats de vaccins et produits de santé et le rôle logistique dévolu à l’établissement dans la lutte contre l’épidémie H1N1(B), les difficultés rencontrées dans la constitution de la réserve sanitaire (C) et les activités encore limitées conduites par l’EPRUS au plan international (D).
A. LA GESTION DES STOCKS SANITAIRES
1. Les durées de validité et les règles de valorisation
a. Un stock de produits à durée limitée
L’EPRUS a transmis à la Cour la liste des produits de santé qu’il gère. Classés par plan d’urgence national et comportant 156 références, ceux-ci relèvent pour le plus grand nombre soit de la lutte contre les pandémies grippales, soit des divers aspects de la lutte contre la menace terroriste. La liste comprend les rubriques suivantes :
- Piratox : terrorisme, arme chimique et risques chimiques industriels ;
- Piratome : terrorisme par produits radioactifs ;
- Plan Iode : Risques liés à des accidents de centrales (iode radioactif) ;
- Biotox : terrorisme biologique (charbon…) ;
- Variole : plan spécifique de réponse au bioterrorisme utilisant ce vecteur ;
- Pandémie grippale : articles nécessaires à la lutte contre la pandémie grippale (tous virus), comportant les antiviraux, les vaccins pandémiques (H1N1) et pré-pandémique (H5N1) ainsi que les articles et produits consommables (masques, respirateurs) acquis pour la campagne de vaccination mais pouvant être utilisés pour d’autres besoins ;
- Epidémiologie localisée et produits d’urgence : regroupement de produits nécessaires au traitement de foyers épidémiques (méningites A, B, C) et d’articles rares nécessaires à des traitements d’urgence (antitoxine botulinique trivalente) ; certains de ces produits sont en voie d’acquisition (immunoglobulines anti-vaccine, sérum diphtérique, immunoglobuline botulinique heptavalente…).
L’établissement a, par ailleurs, établi les tableaux de synthèse suivants qui retracent la répartition par plans sanitaires du stock global en janvier 201030 et décrit le rythme prévisible de sa dévalorisation dans l’hypothèse où il ne serait procédé ni à achats de renouvellement, ni à prorogation des dates de péremption de chacun des produits. Cet exercice fait apparaître qu’un montant de 316 M€ serait à déprécier à la fin de l’exercice, soit plus de 30 % du montant initial, et que celui-ci s’amoindrirait à nouveau de près de 15 % au cours de chacune des années suivantes. Cette indication permet de mesurer à la fois l’ampleur du stock sanitaire d’urgence et le rythme soutenu auquel doit se soumettre son renouvellement si l’objectif est de le maintenir à l’identique.
Tableau n° 4 : Répartition du stock de l’EPRUS en janvier 2010
ETAT DES STOCKS JANVIER 2010 EPRUS (montant par destination) | ||
Plan |
Catégorie |
Total |
Pandémie grippale |
antiviral |
231 640 690 € |
antiviral (principe actif) |
114 674 133 € | |
consommable vaccination |
9 495 826 € | |
masque chirurgical |
32 589 436 € | |
masque FFP2 |
210 801 706 € | |
masque pédiatrique |
2 065 104 € | |
mat premières |
800 941 € | |
vaccin grippe "aviaire" |
22 597 815 € | |
vaccin grippe AH1N1 |
147 591 580 € | |
Total pandémie grippale |
|
772 257 232 € |
NRBC (risque variole) |
consommable vaccination |
7 092 952 € |
NRBC (risque variole) |
vaccins variole |
78 948 285 € |
NRBC (risque chimique) |
antidote |
6 818 481 € |
NRBC (risque biologique) |
antibiotique |
162 517 515 € |
NRBC (radio-contamination) |
décontamination |
1 201 262 € |
NRBC (radio-contamination) |
plan iode |
40 890 € |
total NRBC |
|
256 619 384 € |
Urgence-épidemio |
immunoglobuline botulinique |
174 807 € |
méningites (vaccins) |
4 361 850 € | |
Total urgence-épidemio |
|
4 536 658 € |
Total général |
1 033 413 274 € | |
Montant des stocks (situation janvier 2010) par millésime de date limite de validité, en supposant le stock constant (pas de sortie, pas d'entrée et pas de nouvelle prolongation) | |
millésime péremption |
MONTANT |
<2010 |
36 000 000 € |
2010 |
280 000 000 € |
2011 |
164 400 000 € |
2012 |
144 700 000 € |
2013 |
148 500 000 € |
2014 |
32 000 000 € |
2015 |
29 500 000 € |
articles sans date limite de validité |
160 000 000 € |
articles en attente prolongation |
37 500 000 € |
Source : EPRUS
b. La mise en œuvre du programme de contrôle sanitaire des stocks ayant atteint leur date de péremption
Lors des contrôles qu’elle avait effectués à partir de 2006, la Cour avait attiré, notamment à travers le référé adressé au ministre chargé de la santé en juin 2008, l’attention des pouvoirs publics sur l’urgence qu’il y avait à définir une politique raisonnée de renouvellement des principaux produits constitutifs du stock stratégique. Le ministre chargé de la santé, dans sa réponse, avait apporté diverses précisions sur les mesures que l’administration sanitaire avait prises ou préparait à cet égard s’agissant des divers produits concernés et souligné l’effort entrepris en vue d’un contrôle systématisé de leurs durées de validité :
- S’agissant des antidotes chimiques, ceux de ces stocks initiaux dont les dates de péremption s’échelonnaient entre juillet 2004 et juillet 2006 ont fait l’objet, dès le début 2004, d’une première saisine de l’AFFSaPS qui avait alors attesté la possibilité d’un usage prolongé de six mois pour le Cyanokit et le Contrathion, et d’un an pour le Kelocyanor. Le ministre indiquait dans sa réponse au référé qu’il escomptait une proposition semblable pour les stocks de renouvellement opérés en 2005 et 200731, mais que les stocks périmés de Contrathion seraient détruits par l’EPRUS, ce qui a été effectivement fait en 2009. Suite à deux demandes récemment adressées à l’établissement par le ministère, des achats de renouvellement sont programmés en 2010 pour le stock de Contrathion arrivé à échéance en 2009 afin de rester en mesure d’assurer le traitement de 4 000 personnes32, et d’ici 2012 pour le Cyanokit.
- Pour les comprimés d’iode destinés à faire face à des radiations nucléaires et fabriqués par la pharmacie centrale des armées, une modification d’autorisation de mise sur le marché (AMM) du 1er avril 2005 avait porté leur durée de cinq à sept ans, le ministre indiquant dans sa réponse au référé que seuls 5 % du stock seraient de ce fait périmés en 2008 et que l’essentiel des péremptions s’étaleraient entre 2009 et 2012. Par ailleurs, l’autorité de sûreté nucléaire ayant préconisé un nouveau comprimé d’un dosage limité à 65 g plutôt que 130, le remplacement du stock devait se réaliser sur la base d’une nouvelle AMM à partir de l’été 2009.
Cette autorisation a effectivement été accordée le 24 février 2009, avec une durée de validité de cinq ans. Sur demande du DGS, un marché à bons de commandes a été passé le 19 août suivant pour des renouvellements s’échelonnant jusqu’à 2012 selon l’objectif d’une fourniture d’ensemble de 110 millions de comprimés. Devant l’insuffisance de la production prévue fin 2009 au regard des exigences de protection de la population, un nouvel avenant a dû être signé le 9 février 2010 permettant, par une production en 2 x 8 d’atteindre une fourniture de 43,2 millions de doses en avril 2010.
- Pour les vaccins antivarioliques, dont la fabrication remonte à 1975, l’AFFSaP avait attesté d’une possibilité d’usage jusqu’en 2007, 2008 ou 2009 selon les fabricants d’origine, le haut fonctionnaire de défense proposant cependant, le 15 septembre 2005, le maintien du stock en l’état, dans l’attente de la disponibilité d’un vaccin de troisième génération suffisamment sûr. Le ministre indiquait que l’AFSSaPS avait confirmé le 12 mars 2008 cette possibilité et que la prochaine campagne de contrôle serait réalisée en 2012. Dans ces conditions, les vaccins antivarioliques sont inscrits dans les stocks de l’EPRUS, celui-ci indiquant que les progrès des techniques d’inoculation leur assurant un potentiel effectif de vaccination triple ou quadruple, la possibilité d’une couverture de l’ensemble de la population est garantie.
Des nécessités de renouvellement se faisant par ailleurs jour, à partir de 2007-2008 pour les embouts de pipettes, à partir de 2006 pour les aiguilles bifurquées et de début 2009 pour les microtubes, le ministre indiquait que l’Agence avait été saisie des délais d’utilisation de ces dispositifs médicaux nécessaires à la vaccination. Un rapport de contrôle de la stérilité des aiguilles bifurquées et des embouts de pipette transmis à l’EPRUS le 10 mars dernier conclut à leur conformité. Sous réserve de nouveaux contrôles proposés en 2010 pour les aiguilles arrivant en péremption en 2009-2010, une nouvelle campagne de contrôle du matériel de vaccination pourrait, selon l’EPRUS, être reportée à 2012.
Pour les stocks relatifs à la grippe aviaire, une étude de l’IGAS soulignant la faible durée de certains lots de masques FFP2 et la nécessité de « se préparer à un renouvellement massif en 2008 », le ministre admettait que la question « commencerait à se poser sensiblement en 2009 ». C’est néanmoins, on l’a vu, l’imprévisibilité qui a été invoquée pour justifier le recours à un décret d’avance pour assurer le financement des stocks de renouvellement opéré courant 2009.
La réponse au référé de la Cour indiquait par ailleurs que la poursuite de la transformation en comprimés par la pharmacie centrale des armées de la poudre d’Oseltamivir acquise auprès du laboratoire Roche, permettrait de disposer d’un nombre suffisant de traitements antiviraux « jusqu’en janvier 2010 ». Une AMM a été accordée le 24 novembre 2009 pour une durée limitée à un an qui pourrait être reconsidérée au vu de nouveaux tests de validité.
A l’expérience des difficultés de gestion des stocks et des limitations de durée de validité des divers produits observées à partir de 2004 et en s’inspirant des dispositions prises en matière de stocks stratégiques en produits de santé par plusieurs pays, notamment les Etats-Unis, la France s’est dotée, parallèlement à la mise en place de l’EPRUS d’un programme dénommé « Qualité et renouvellement des stocks stratégiques nationaux » (QRS2N) visant à mieux contrôler l’état des produits stockés. Ce programme vise principalement à systématiser les prolongations de durée de validité de produits atteignant leur date officielle de péremption et s’appuie à cet effet sur l’organisation d’examens périodiques sur des échantillons prélevés dans les stocks, expertises confiées à l’AFSSaPS pour les médicaments et dispositifs médicaux et à l’APAVE, groupe spécialisé dans la mesures de risques, pour les masques.
L’AFFSaPS a proposé fin 2007 une méthodologie de mise en œuvre de ce programme, conduisant à en exclure les produits présentant soit des « spécifications à péremptions élargies » ou un « surdosage à la formulation », soit les « solutions » et « excipients qui vieillissent mal », ce qui conduisait à se concentrer sur six médicaments, dont un antiviral (Tamiflu gélules 75 mg)33. Pour ces produits, il était proposé de procéder en 2008 à un contrôle de tous les lots concernés puis, pour ceux qui n’étaient pas dégradés, de procéder par la suite à un contrôle annuel d’une sélection de lots pour chacun des produits arrivant à trois mois avant leur date de péremption. Pour une durée totale de cette phase s’étalant sur dix ans (2009-2019), l’Agence tablait alors, pour des contrôles portant sur 18 lots chaque année, sur un coût prévisionnel de consommables et de rémunérations de techniciens de 33 000 €, faisant suite à un investissement initial estimé à 220 000 €.
En préalable aux premiers contrôles faits au titre de ce programme34, l’AFSSaPS avait fait valoir au DGS qu’elle ne « pourrait [les] débuter qu’à condition d’être autorisée à proposer, dans une prochaine décision modificative, d’abonder les crédits de l’Agence pour couvrir les moyens en personnel et en investissements nécessaires » et que « le financement de cet abondement [soit] assuré par l’EPRUS »35. La contribution de l’établissement à la charge des contrôles de ce type a, en définitive, été organisée par la convention AFSSaPS/EPRUS et fait l’objet d’une dotation annuelle dans le budget de l’établissement.
Les premiers examens de médicaments prévus au titre du programme QRS2N ont porté sur quatre produits et ont déjà conduit l’AFFSaPS à établir, en date du 18 décembre 2009, deux attestations proposant :
- une augmentation d’un an de la durée d’utilisation pour les différents lots de l’antibiotique Ciflox 500 mg (plan Biotox) d’une durée initiale de cinq ans, en vue de proroger, selon les lots, leur validité jusqu’au début de juillet à septembre 201036 ;
- une augmentation de deux ans au total37 pour 22 lots de Tamiflu (antiviral grippal), au-delà de la durée initiale de cinq ans, en vue de porter leur date limite, selon les lots, entre le début février 2010 et le 1er août 2012.
Les résultats des prélèvements opérés pour les stocks de deux autres antibiotiques, le Tavanic 500 mg et d’Oflocet 200 mg, sont attendus en 2010.
Cette même année, de nouveaux prélèvements seront effectués sur ces mêmes produits - pouvant conduire notamment pour le Tamiflu à une nouvelle proposition de prolongation d’un an, et de nouveaux produits ou articles pourraient être introduits dans le programme QRS2N.
L’antiviral Oseltamivir PG 30 mg et les comprimés d’iode 65 mg produits par la pharmacie centrale des armées pourraient voir, par ailleurs, leur validité étendue par l’échéance annuelle des études de stabilité soumises à l’AFFSaPS dans le cadre de leur autorisation de mise sur le marché qui, par prudence, n’a comporté que des durées de validité de respectivement un an et 30 mois.
c. Incertitudes juridiques et difficultés pratiques d’une prolongation des durées de validité
L’utilisation effective de produits soumis à AMM et pour lesquels l’AFSSaPS a attesté la possibilité d’une prolongation de validité pose deux problèmes, l’un juridique, l’autre technique.
Juridiquement, la constatation par voie d’expertise de la qualité maintenue du produit, ne suffit ni à modifier la date de péremption qui, selon les articles L. 5121-8 et R. 5121-14 du CSP est un élément constitutif des éléments fournis à l’appui de la décision d’« autorisation de mise sur le marché » et engage à ce titre la responsabilité du fabricant ou du titulaire de l’AMM, ni à exonérer de leur responsabilité les professionnels de santé qui en feraient usage en contravention de la durée formelle de validité.
Dans une lettre du 15 octobre 2004 faisant suite aux premiers tests réalisés à la demande de la DGS sur les stocks d’antidotes chimiques, l’AFSSaPS avait ainsi souligné qu’au vu des résultats, elle attestait « seul le ministre chargé de la santé peut prendre la décision » d’extension formelle de la validité du produit concerné et que la voie d’une modification de l’AMM et du dossier la justifiant « n’apparaît pas non plus réalisable car elle devrait concerner l’ensemble des produits fabriqués et pas seulement les lots » relevant du stock d’Etat. On peut ajouter qu’une décision du ministre, même prise en application des pouvoirs exceptionnels que l’article L 3131-1 du CSP lui confère « en cas de menace sanitaire grave » pour prendre « toute mesure proportionnée aux risques courus », reviendrait à une nouvelle mise sur le marché d’un produit n’engageant plus la responsabilité du producteur initial. En outre, l’invocation de la condition d’une crise sanitaire grave serait juridiquement abusive pour tenter de donner une base légale à des décisions ministérielles de prorogation prises dans une situation de gestion courante des stocks, de préférence à une mesure de renouvellement des produits ayant atteint leur date officielle de péremption.
Aucune modification législative n’étant intervenue depuis lors tendant à ce que la gestion des stocks d’urgence échappe à ces contraintes de droit commun, la procédure en vigueur s’assortit d’ambiguïtés que la récente convention passée entre l’EPRUS et l’AFSSaPS ne peut que ménager. Elle précise bien que les protocoles scientifiques mis en œuvre ne permettent que « d’apprécier par des tests périodiques le maintien de la conservation des qualités initiales de ces produits », que l’expertise de l’AFSSaPS ne conduit qu’à « formaliser les résultats et les communiquer à la fois à la DGS et à l’EPRUS » et que la décision du ministre ne porte que sur le fait « de faire procéder à la destruction des produits concernés ou d’en assurer la conservation en vue de répondre à une crise sanitaire ». De manière aussi prudente, les attestations délivrées par l’agence s’en tiennent à formuler une « proposition » se fondant sur la « possibilité », au vu des tests effectués, de repousser, pour une durée définie, le délai d’utilisation du produit concerné.
Dans ces circonstances, on peut certes admettre que des produits bénéficiant d’une telle « attestation » technique de validité délivrée par l’AFSSaPS, ne soient pas détruits durant la durée de cette attestation, voire qu’ils conservent, pour cette même durée, leur valeur comptable. En revanche, c’est de manière excessive que les gestionnaires parlent de « prolongation accordée par l’AFSSaPS », comme si, au-delà de l’attestation des résultats techniques des examens effectués, celle-ci pouvait modifier la durée juridique de validité inscrite dans l’AMM initiale. Quant à la décision de maintien dans les stocks en résultant pour la DGS et l’EPRUS, elle ne suffit pas davantage à lever les problèmes de responsabilité en cas d’utilisation effective d’un produit ayant franchi formellement sa date initiale de péremption. Le directeur général de l’EPRUS peut donc souligner à juste titre qu’en l’état actuel du droit positif, les résultats des examens de l’AFSSaPS « ne sont pas opposables faute de statut particulier réglementaire »38 et qu’une décision à titre exceptionnel du ministre correspondrait « de fait à une nouvelle mise sur le marché d’un produit dépourvu de statut juridique »39.
Du point de vue technique, l’extrapolation des résultats des tests effectués dans les laboratoires de l’AFSSAPS ou de l’APAVE dépasse rarement un an. L’application de cette extension aux stocks détenus impose, vis-à-vis de tous professionnels de santé potentiellement utilisateurs comme vis-à-vis des patients concernés, un nouvel étiquetage s’appliquant sur chaque unité de produit (boite, carton, voire blister pour les médicaments) et, le cas échéant, une mise à jour des notices d’emploi des médicaments. Cette opération, dont le coût est non négligeable, représenterait par ailleurs un temps de traitement de plusieurs mois (jusqu’à huit mois pour certains lots de médicaments) diminuant notablement l’intérêt de cette procédure.
Cette contrainte de sécurité sanitaire se trouve encore renforcée par l’exigence formelle introduite par le récent rapport de la mission nationale d’audit (MAEC) de la DGFiP sur la valorisation des stocks qui recommande expressément que « les tests portant sur la péremption éventuelle des produits devront être réalisés de façon annuelle et pour la totalité des produits présents dans les stocks ».
Deux réunions, l’une au cabinet du ministre de la santé, le 3 février 2010, et l’autre, le 25 février, organisée à l’initiative du DGS en présence de l’AFSSaPS, ont confirmé l’analyse de l’impasse juridique actuelle en constatant, à propos de certains antibiotiques ou antidotes, que « les recommandations d’extension faites par l’AFSSaPS ne sont pas suivies de décision prise par la DGS » et que « les questions juridiques relatives au fondement de cette décision et à la responsabilité liée reste présentes ». Cette situation conduit à explorer les implications d’une solution à ces difficultés, fondée sur deux principes :
- au plan juridique, un statut légal spécifique serait applicable aux produits relevant des stocks stratégiques et la validité de ces produits, au lieu d’être fixée ab initio comme dans le système actuel des AMM, serait contrôlée chaque année par examens en laboratoire et maintenue jusqu’à non-conformité avérée des résultats des contrôles ainsi pratiqués ;
- du point de vue technique, les produits commandés au fabricant pour constitution de ces même stocks ne comporteraient pas mention de date limite de validité, mais uniquement la date de fabrication et le numéro de lot de fabrication.
Ce système conduirait à étendre et formaliser la méthode utilisée par exception pour la constitution du stock d’iodure de potassium 65 mg où la durée pourra être prolongée au vu des tests successifs de stabilité.
Ce débat semble loin d’être clos. L’AFFSaPS est réticente devant l’hypothèse d’un statut légal spécifique « qui pourrait fragiliser la confiance accordée à des produits ayant obtenu une AMM pleine et entière »40, et a suggéré lors des échanges récents de s’en tenir à une utilisation des possibilités réglementaires existantes lui permettant déjà d’aménager de manière dérogatoire les règles d’étiquetage41 ou d’introduire, en ce domaine, des règles propres au stock d’Etat42. La DGS souligne, non sans raisons, que si cette disposition permettrait d’éviter le réétiquetage systématique en cas de prorogation, elle ne résout ni la question de la base légale de cette décision, ni celle de la responsabilité tant des laboratoires que des professionnels de santé utilisateurs de ces produits. En outre, la marge de manœuvre étroite résultant de la réglementation européenne appellerait une expertise juridique et un groupe de travail associant l’EPRUS et l’AFFSaPS a été mis en place à cet effet.
d. Des règles de valorisation comptables en progrès
Le rapport Jégou relevait qu’« en dépit de l’arrivée à péremption d’une part importante du stock national santé, aucune dépréciation du stock n’a(vait) été constatée en comptabilité ». Liant ce fait à une hésitation persistante entre la destruction suivie d’un renouvellement des produits périmés et la pratique tendant à les conserver en recherchant le moyen de proroger leur délai d’utilisation, le rapport soulignait que « les incertitudes juridiques et comptables induites par ce procédé appel(aient) une clarification rapide ».
Suite à ces observations, à celles de la Cour et de la MAEC, l’établissement s’est engagé dans une démarche tendant à préciser, en vue de l’établissement des comptes 2009, les méthodes de valorisation des stocks à inscrire à son bilan. Par lettre du 3 novembre 2009, l’agent comptable de l’EPRUS a saisi la DGFiP de propositions sur les modalités de traitement comptable des dépréciations des produits de santé, propositions auxquelles il a été répondu par lettre du 6 janvier 2010.
L’établissement fait valoir qu’alors qu’aucune dépréciation n’avait été constatée au titre des exercices antérieurs, des principes méthodologiques de valorisation ont été élaborés en 2009 et que leur application a conduit à prendre en compte, selon divers mode d’écritures, des baisses de valeur s’élevant au total à 57,5 M€, soit quelque 6 % de la valeur brute du stock total. Les principes retenus et les analyses fondant leur mise en œuvre sont en outre bien décrits dans l’annexe aux comptes annuels (« Notes sur le bilan »).
Les comptes ainsi établis ont intégré pour partie les recommandations provisoires formulées par la DGFiP lors de l’élaboration par la mission nationale d’audit d’un rapport sur « Les stocks sanitaires de l’EPRUS »43. En liaison avec cet audit, la Cour a pour sa part formulé, dans le cadre de la certification des comptes de l’Etat pour l’exercice 2009, une observation d’audit portant sur ces mêmes comptes.
Trois points font l’objet des débats ou observations quant aux dépréciations à opérer :
La prise en compte des baisses de la valeur de remplacement
S’agissant de produits distribués gratuitement, la norme comptable de l’Etat n° 8 relative aux stocks, prévoit que leur valorisation doit prendre en compte l’évolution des prix de marché en appréhendant leur valeur de remplacement. C’est d’ailleurs pourquoi, par son article 5.3, la convention passée avec l’Etat charge l’établissement d’assurer une veille des prix. Si la base de valorisation retenue à la clôture de l’exercice pour le stock géré par l’EPRUS est le prix moyen pondéré, une dépréciation doit en effet être constatée en cas d’amoindrissement de la valeur du stock et d’une reprise, dans la limite du prix historique d’acquisition, si la valeur ainsi dépréciée augmente lors d’un exercice ultérieur. En revanche, une éventuelle augmentation de valeur des produits au-dessus du prix historique n’aurait pas lieu d’entraîner la réévaluation du stock existant.
S’agissant des comptes 2009, l’analyse pour intégrer les prix de marché actualisés s’est portée sur les postes de stocks de produits de santé les plus significatifs du bilan. Si aucune dépréciation n’est apparue nécessaire au regard des dernières conditions d’acquisition en ce qui concerne les masques chirurgicaux et les vaccins H1N1, une dépréciation d’un total de 10,7 M€ a été constatée portant principalement sur le Tamiflu (1,4 M€) et les masques de protection pliables (9,4 M€).
Le principe retenu en définitive sur ce point et son application en 2009 ne font pas l’objet de divergences entre l’EPRUS et la mission d’audit.
Les conséquences de la péremption des produits détenus
Il en va différemment sur ce second point, pour lequel l’EPRUS et le ministère de la santé ont considéré d’un commun accord que des dépréciations de stocks n’ont pas à être constatées dans la mesure où ces stocks sont considérés comme étant « utilisables » dans leur état, à la date d’inventaire. Si un stock est définitivement déclaré périmé, il est détruit et sa valeur doit être annulée. En revanche, si la date officielle de péremption des produits n’est pas échue ou pourrait être prorogée grâce aux résultats d’études menées par les organismes compétents (exemple : AFSSaPS), le stock n’a pas à être déprécié. Ce procédé visait, selon l’établissement, à « permettre de connaître à tout moment le potentiel d’utilisation immédiate du stock et d’en préciser à tout moment le taux d’indisponibilité voire (sous réserve d’une réévaluation) de déterminer le coût de remplacement de tout ou partie du stock indisponible ».
Il reste que, tel qu’il est mis en œuvre, le critère de « l’utilisabilité » n’est pas d’une grande clarté dès lors qu’on l’applique à des produits ayant dépassé leur date initiale de péremption :
. des produits pour lesquels l’AFSSaPS se serait prononcée de manière favorable à une prolongation de validité, peuvent certes être considérés comme « utilisables » en pratique sans risque de sécurité sanitaire, mais, au moins tant que perdure le vide réglementaire actuel, il ne le sont pas dans des conditions exemptes de risque du point de vue de la sécurité proprement juridique ;
. quant aux produits pour lesquels une telle attestation a simplement été sollicitée, ce n’est que par un abus préjugeant d’une expertise indépendante qui n’appartient qu’à l’Agence, qu’ils peuvent être réputés « utilisables en l’état ». La doctrine de l’EPRUS et du ministère les comprend cependant dans cette catégorie au titre des « articles en attente ». C’est ce qu’indiquent explicitement les notes de l’annexe aux comptes annuels selon lesquelles ne sont pas dépréciés « notamment des produits dont la péremption est atteinte à l’inventaire mais dont la prolongation est examinée par l’AFFSaPS à cette même date ».
On ne peut donc de ce point de vue que se ranger à la position de principe prise par la DGFiP qui rappelle qu’il est « nécessaire d’apprécier, à la date de la clôture des comptes, le risque d’amoindrissement de la valeur des produits proches de leur date de péremption aussi bien que de ceux qui nécessitent, pour pouvoir être utilisés, une analyse, une réparation, une décision de prolongation de validité ». Il semble en découler que des articles officiellement périmés devraient faire l’objet de dépréciation au moins tant que l’AFSSaPS ne se serait pas prononcée, du point de vue sanitaire, sur une possible extension de durée, quitte à ce qu’une position favorable ultérieure donne alors lieu à une reprise en stocks.
Le montant litigieux concerné à la fin 2009, s’élevait à 37,4 M€ correspondant à des stocks d’antibiotiques, pour lesquels l’EPRUS n’a pas retenu de dépréciation, ce que l’observation 4.2-03 d’audit de la Cour conteste du point de vue de la norme comptable.
Critiquable de ce point de vue, le critère de l’utilisabilité tel que le définit l’établissement n’a de surcroît été que partiellement appliqué en 2009 en ce qui concerne des produits qui auraient indiscutablement dû être considérés comme « inutilisables ».
En effet, l’EPRUS a limité cette application au stock des masques de protection, d’une valeur globale de 185 677 625 € TTC. Ceux d’entre eux qui étaient périmés en 2009, soit 111 434 370 masques, représentant une valeur d’environ 46,7 M€ TTC, ont ainsi été constatés pour une valeur nulle dans les stocks au 31 décembre 2009, sans cependant constater une provision mais en enregistrant les masques dans l’inventaire pour une valeur unitaire à zéro, sous la dénomination de masques FFP2 périmés.
Les contraintes de la gestion budgétaire44 et sans doute un souci d’étaler l’incidence des dépréciations ont cependant conduit à reporter aux comptes 2010 la dépréciation d’articles déjà périmés en 2009 relevant d’autres composantes du stock, les antiviraux (23,68 % de la valeur du stock), les antidotes (0,84 % de la valeur du stock) et les antibiotiques (11,68 % de la valeur du stock). Au total, les montants de dépréciations qui ont ainsi été différés s’élèvent à 13 M€.
La prise en compte des observations d’audit de la Cour aurait conduit à porter dès 2009 la baisse globale de la valeur du stock des 57,5 M€ pratiqués sous divers formes d’écriture45 à un montant global de près de 107,9 M€, prenant en compte tant les produits pharmaceutiques officiellement périmés (13 M€) que ceux pour lesquels une demande de test de validité reste en instance auprès de l’AFSSaPS (36,7 M€). Pour ces derniers, le rapport de la mission nationale d’audit précise qu’ils auraient dû être dépréciés « pour le montant total des produits périmés » et qu’« en cas de réactivation sur décision ministérielle, cette provision sera reprise, totalement ou partiellement ».
L’EPRUS a cependant fait part au conseil d’administration du 7 mai dernier de son intention de désormais « déprécier la totalité de la valeur des articles périmés mais non détruits au 31 décembre 2010, dès lors que l’AFSSAPS n’aura pas prononcé formellement d’extension de durée de validité », les crédits nécessaires à la constatation de la dépréciation devant être inscrits à son budget à l’occasion de la dernière décision modificative.
Lors de l’élaboration de sa note d’audit, la Cour avait, par ailleurs, admis avec l’EPRUS qu’au moment de la clôture des comptes de l’exercice 2009, le risque inhérent à la réduction des commandes de vaccins H1N1 ne pouvait pas être évalué avec une suffisante certitude pour permettre une provision pour risques, de même que l’indemnisation des professionnels de santé retraités ou sans emploi requis pour la campagne de vaccination H1N1.
L’incidence des baisses du titrage de certains produits.
Enfin, certains produits, comme certains vaccins voient leur titre ou leur efficacité diminuer dans le temps, un article entré en stock avec une posologie de 100 doses à 20 µg pouvant voir son potentiel ramené à 80 doses. Dans ce cas, l’EPRUS propose d’établir un procès-verbal de perte de doses appuyé par un certificat d’analyse attestant de la diminution de titre. Une sortie de stock proportionnée sera constatée en charge de l’exercice.
Dans le cas inverse où un même produit permettrait d’effectuer plus de vaccinations, l’évolution sera considérée comme n’induisant pas une augmentation du coût du stock mais seulement un accroissement du potentiel vaccinal de la dose.
Les analyses nécessaires pour mettre en œuvre ces principes seront conduites sur les produits concernés à partir de 2010. L’établissement et la DGFiP s’accordent pour estimer que, dans ce cas, une inscription sous forme d’entrées / sorties est bien adaptée.
2. La programmation des renouvellements
L’article 2.1 de la convention Etat/EPRUS dispose qu’« un programme d’acquisition ou de renouvellement de stocks est défini annuellement par le ministre chargé de la santé » et transmis à l’EPRUS « dans les délais lui permettant de le prendre en compte dans sa programmation budgétaire annuelle ». En mars 2010, cette procédure restait à mettre en œuvre, aucun programme formalisé d’acquisition ou de renouvellement des stocks n’ayant jusque-là été communiqué à l’établissement. Cependant, selon ce dernier, un certain nombre d’éléments concourent au même objectif :
- les réunions du comité stratégique permettent de faire un point sur les différents objectifs fixés à l’EPRUS et les axes prioritaires définis par la tutelle, des réunions techniques avec le DUS précisant l’examen des sujets ainsi évoqués. Ces réunions ont constitué en 2009 la base d’un programme d’activités adapté à l’époque à l’avancement de l’état de préparation de l’établissement à ses missions. Chaque opération fait ensuite l’objet d’une saisie individuelle.
- Le dialogue de gestion avec les services du ministère a permis les échanges et réunions nécessaires à une élaboration ordonnée du budget 2010 de l’établissement ;
- la mise en place en cours du logiciel de gestion des stocks PARTEOR permettrait, par extraction, de formaliser automatiquement les propositions de stocks à renouveler en fonction en particulier des prévisions sur la durée de validité des produits.
Un note intitulée « Programme d’acquisition et de renouvellement des stocks stratégiques nationaux » a, en définitive, été adressée par la DGS à l’EPRUS le 15 avril 2010. Elle se limite cependant à deux tableaux, l’un ne valant que « pour mémoire » qui récapitule les livraisons attendues pour des commandes passées antérieurement au début de cet exercice, l’autre donnant la liste des six marchés de renouvellement attendus en 2010. Il s’agit de produits classés « confidentiel défense », dont deux fournitures ayant déjà fait l’objet de saisines officielles de la DGS en 2010. Pour les autres, la lettre précise que le tableau récapitulatif « ne vaut pas autorisation de commande » et que « naturellement, [il] peut bénéficier de notre part de modifications ou compléments que nous jugerions alors, en fonction des évènements conjoncturels, utiles et nécessaires d’apporter ». Outre ce caractère restant indicatif, il est à noter que ce « programme » ne fournit que les quantités physiques à acquérir par produits, sans aucune évaluation même estimative de leur coût probable d’acquisition. En tant que tel, il ne permet donc aucune vérification de l’adéquation des disponibilités budgétaires de l’établissement aux volumes de commandes envisagés.
Une programmation physico-financière annuelle arrêtée formellement en accord entre l’établissement public et sa tutelle serait pourtant une condition minimale à la bonne maîtrise technique et budgétaire tant par l’établissement que par sa tutelle des échéances de court terme. On peut en outre s’étonner que, dans un domaine où la question de la péremption et du renouvellement des stocks se joue à la fois à rythme soutenu et sur des périodes couvrant plusieurs exercices, il n’ait pas été prévu que le calendrier des opérations et les moyens financiers qu’elle requiert fassent l’objet d’un exercice systématique de prévision et de programmation pluriannuelles. Il est particulièrement surprenant à cet égard que la convention Etat-EPRUS, si dirigiste par ailleurs, se limite à un objectif de programmation annuelle qui n’a, de surcroît, été satisfait que d’une manière minimale. Un tel exercice serait d’autant plus indispensable que la réflexion engagée lors des réunions de février 2010 relatives aux stocks stratégiques a conduit à explorer, au-delà des questions proprement juridiques, les infléchissements susceptibles d’être apportés à la doctrine de renouvellement des stocks stratégiques.
Le dimensionnement des divers stocks relevant, selon les produits, soit de la responsabilité de la DGS (épidémies ou pandémies), soit de celle du SGDSN (menaces terroristes), il a semblé nécessaire lors de ces réunions de saisir tant ce dernier que le Haut conseil de santé publique (HCSP) en vue d’une actualisation d’ensemble des besoins prévisibles. L’EPRUS a souligné à cet égard l’intérêt qu’il y aurait à ce que « la politique d’acquisition des stocks soit « lissée » sur plusieurs années afin de ne pas avoir à renouveler les stocks en totalité très rapidement ».
A été, plus fondamentalement envisagée « la possibilité de passer d’une gestion où l’on achète en une seule fois la totalité des produits dont on veut disposer pour passer à une logique de stock minimal servant de fonds de roulement permettant de faire face à l’alerte dans un premier temps avec lissage dans le temps des commandes et donc des péremptions »46.
a. Une cartographie complexe des lieux de stockage
Un état des lieux de stockage établi à la mi-mars 2010 à destination de la Cour comporte 55 sites répartis entre plateformes logistiques et établissements de santé, la cartographie plus précise par produits et quantités étant classée« confidentiel défense ». Ce tableau diffère de celui présenté dans le rapport Jégou47 qui laissait l’impression d’une plus grande dispersion des lieux de stockage et des prestataires de l’établissement en adjoignant aux treize sites hospitaliers de référence détenteurs de stocks, une trentaine de sites hospitaliers secondaires où les centres de référence ont réparti, sous leur propre responsabilité, leurs approvisionnements.
Pour l’essentiel, la cartographie actuelle du stockage est héritée des dispositions prises dans la phase de gestion ministérielle et obéit aux nécessités suivantes :
- les plateformes logistiques « nationales » sont essentiellement consacrées au stockage de masques dans le cadre de la pandémie grippale (19 sites) ou de médicaments pour les produits « Biotox « et, pour cinq sites, les vaccins grippe H1N1 ;
- du fait de leurs courts délais avant emploi, les antidotes « Piratox » sont pré-positionnés dans des établissements de santé de référence ;
- des conditions de sécurité et d’accessibilité accrues sont assurées par des plateformes logistiques pharmaceutiques du service de santé des armées (quatre sites) ou du ministère de l’intérieur (un site).
En outre, par anticipation du futur schéma directeur de stockage étudié par l’EPRUS (voir infra) qui prévoit un site de stockage/distribution dans chacune des zones de défense (celui d’Ile-de-France étant également dédié à la desserte des collectivités d’outre-mer), sept plateformes de distribution zonales ont été créées à l’occasion de la crise pandémique ; elles ont vocation à être multi-produits et disposent de stocks adaptés aux besoins immédiats ou à court terme des zones qu’elles desservent. Elles disposent du statut d’établissement pharmaceutique. Dans certain cas, elles sont situées sur la même emprise qu’un dépôt national mais sont gérées séparément.
Chacun des lieux de stockage est lié à l’EPRUS par un accord spécifique :
- les plateformes logistiques relevant de prestataires privés font l’objet de marchés transférés du ministère de la santé ou, pour certains d’entre eux, conclus par l’établissement ;
- les établissements du service de santé des armées sont régis par une convention cadre et une convention propre à chaque site ;
- les établissements de santé qui détenaient les stocks à titre gratuit se verront proposer en 2010 une convention conforme à un contrat-type élaboré par l’EPRUS qui prévoit notamment la contribution que celui-ci assurera aux charges de stockage.
Le projet de schéma de stockage implique une réduction du nombre de sites prestataires remplacés pour partie par le « projet Vitry » et le transfert d’une grande partie des stocks entreposés dans les établissements hospitaliers vers les plateformes zonales, dans le but de séparer clairement les périmètres de compétence et d’assurer une mutualisation accrue des moyens.
b. Un programme de recensement et de contrôle de la qualité des stocks devant être achevé en 2010
Un programme de visites de recensement et de contrôle de la qualité des stocks ayant été entrepris par l’EPRUS dès l’ouverture de l’établissement pharmaceutique, trois sites ont pu être contrôlés avant que l’alerte pandémie ne le suspende. La visite de l’Agence des équipements et produits de santé (AGEPS) dépendant de l’AP-HP a cependant pu être faite en juillet 2009 compte-tenu de la proximité du site48. Les constats effectués étaient satisfaisants, l’échantillon étant cependant trop réduit pour être représentatif des conditions de stockage.
Le programme 2010 qui a débuté le 9 mars dernier, prévoit la visite de la totalité des sites de stockage des prestataires logistiques et établissement de santé. Il vise à la fois les mêmes objectifs qu’en 2009 et à consolider la situation de l’inventaire à l’issue de la période de pandémie H1N1.
Dans le même objectif et pour pouvoir disposer d’un recensement exhaustif et simultané de tous les sites prestataires logistiques, l’EPRUS prépare en outre un appel d’offres pour prestation d’inventaire physique qui s’adressera à des « inventoristes » professionnels. Ceux-ci procéderont à un « inventaire flash » qui, à la différence du programme de visites en cours qui s’étale sur plusieurs mois, assurera un comptage exhaustif à date donnée de l’ensemble du stock. Les résultats physiques en seront repris dans PARTEOR et leur éventuelle incidence comptable inscrite dans la valeur des stocks en fin d’exercice.
c. L’élaboration en cours d’un schéma directeur de stockage
Le point 3.5 de la convention Etat-EPRUS chargeait le directeur général de l’établissement de proposer un schéma directeur de stockage répondant prioritairement à des « objectifs relatifs aux délais de mise à disposition des produits, au niveau des stocks à maintenir et aux conditions de distribution à respecter » fixés par le ministre de la santé. Selon les « indicateurs de performance » proposés par le directeur de l’établissement le 10 mars 2009, ce schéma devait être finalisé à la fin de cette même année.
Cette étude a été lancée en mars 2009 et l’établissement prévoyait d’en livrer les conclusions pour la fin du premier semestre 2010. Sa phase de diagnostic a confirmé l’intérêt de disposer en complément de sites de stockage centraux, dont le nombre pourrait être réduit, dans l’idéal à un unique site de stockage central (« projet Vitry », voir infra), de sites de distribution-stockage à compétence régionale : les plateformes logistiques zonales.
Ces deux axes ont déjà donné lieu à une étude de programmation en vue d’un futur site central unique et à une première matérialisation du principe des plateformes zonales de distribution à l’occasion de la période d’épidémie grippale AH1N1.
Des « fiches articles » établies par plan d’urgence sanitaire devraient permettre de positionner chaque produit en fonction de différents critères : délais de mise à disposition, contraintes logistiques liées aux conditions de conservation, au volume ou au poids transportés. Ces fiches sont primordiales pour assurer une gestion des stocks efficiente. Elles sont conçues en étroite collaboration avec les personnels intervenant dans le processus logistique, le service informatique qui met en œuvre le logiciel PARTEOR et le système d’assurance qualité dont elles constituent un élément fondamental au sein des processus logistique et achat.
d. Le projet de construction de hangars de stockage à Vitry-le-François
Le projet d’édification d’un ensemble de deux hangars de stockage d’une surface totale de 30 000 m², dont l’un (20 000 m²) répondant aux normes industrielles standard et l’autre (10 000 m²) aux normes pharmaceutiques, est envisagé depuis la création de l’EPRUS. Après de nombreux contacts préalables, un accord de principe du ministère de la défense a été obtenu début 2009 pour un équipement occupant une partie de l’emprise de l’Etablissement de ravitaillement sanitaire des armées (ERSA) à Marolles, près de Vitry-le-François. Le conseil d’administration a depuis lors été régulièrement informé de l’avancée du projet.
Ce projet vise à répondre aux difficultés rencontrées pour garantir la qualité des conditions de stockage et à optimiser les coûts résultant de l’existence actuelle de prestataires nombreux. Il tend également à concentrer la majeure partie du stock sur un site centralisé qui facilite les études menées en collaboration avec l’AFSSaPS et l’APAVE en vue de l’extension de la validité des produits constituant les stocks stratégiques. Il se veut également propice à une collaboration active du service de santé des armées offrant la possibilité de mutualiser l’exploitation et les coûts d’un tel site. Celui-ci qui dispose déjà du statut d’établissement pharmaceutique autorisé par l’AFFSaPS, bénéficierait en outre d’un haut niveau de sécurisation.
L’évaluation du montant du projet a fait l’objet d’un marché d’aide à la maîtrise d’ouvrage passé avec l’autorisation du conseil d’administration. Il a été confié à la SCET qui a remis en janvier dernier un programme qui a été validé par l’établissement. Cette étude fait apparaître un coût prévisionnel de travaux approchant 29 M€ et une dépense totale de 31 M€.
Sur cette base et celle d’une analyse des impératifs « installations classées pour la protection de l’environnement », une réunion entre la DGS, la DGFiP, et l’EPRUS s’est tenue le 22 mars 2010 afin de préciser les modalités de financement du projet. L’accord de la DGFiP sur le principe du projet a été acquis à cette occasion, sans que les modalités de financement soient encore arrêtées. En renvoyant cette décision à la date de lancement des travaux, une délibération du conseil d’administration du 7 mai 2010 a approuvé le coût d’objectif du projet à hauteur de 30,7 M€ et autorisé le lancement de la procédure de concours de maîtrise d’œuvre définie par le code des marchés publics.
Dans l’attente, l’EPRUS avait réalisé une étude de coût prenant en compte, outre les coûts de construction proprement dits, le montant des équipements techniques à réaliser (racks palettiers, chariots-élévateurs, chambres froides, centrales d’alarmes….)49 et la charge annuelle de fonctionnement (gardiennage, prévention, nettoyage, maintenances, chauffage, climatisation).
En l’absence de précision sur le mode de financement qui sera retenu pour l’opération, l’établissement s’est basé sur un recours à l’emprunt et a intégré le coût annuel du crédit (sur la base d’un prêt sur dix ans de la totalité de la construction) dans le calcul du coût de possession de cette structure logistique, coût qui inclut également l’amortissement annuel sur dix ans de l’infrastructure et l’amortissement sur cinq ans des équipements. Ces montants ont été ensuite comparés au coût des contrats de stockage en cours. Cette évaluation ferait apparaître que, même dans le cas défavorable d’un investissement basé sur l’emprunt et dans la perspective de la capacité minimale de stockage envisageable, l’opération s’avère intéressante dès la fin de construction et devient rentable en fin d’amortissement, pour une économie annuelle de l’ordre de 4 à 5 M€50.
L’établissement vise une désignation du maître d’œuvre par concours en octobre prochain et un démarrage du chantier en mai 2011. Un montant de 2,9 M€ est prévu au budget 2010 au titre de l’assistance à maîtrise d’ouvrage et d’organisation du concours, la programmation budgétaire pour 2011 retenant un montant de 28,8 M€ pour la construction de l’entrepôt et de 1,5 M€ pour son équipement.
4. La gestion logistique et le système d’information
L’une des critiques les plus vives du rapport Jégou portait sur la fiabilité encore insuffisante du système d’inventaire des stocks tenant notamment à ce que leur « suivi précis » était « rendu complexe par l’outil informatique actuel, non relié aux systèmes d’information des prestataires de l’EPRUS ». Cette défaillance était rendue responsable de divergences dans l’évaluation du stock, le rapport relevant, à titre d’exemple, des variations allant de 537 à 723 millions d’unités entre divers chiffrages publics du nombre de masques FFP2 disponibles début 2009. Si l’établissement explique plutôt ces derniers écarts par des raisons de champ statistique51, il s’est préoccupé activement d’améliorer son système d’information logistique, tout en admettant que sa fonctionnalité reste encore perfectible.
Face à ces constats, l’établissement rappelle que ce n’est qu’en septembre 2009, qu’après paramétrage, le progiciel de gestion PARTEOR a été mis en service et que les stocks jusqu’alors gérés sur une application développée au sein du ministère de la santé (AMG) ont été transférés dans le nouvel outil.
Le dernier trimestre 2009 a été utilisé pour intégrer l’ensemble des mouvements de la période afin de permettre de clore la situation de l’inventaire de fin d’exercice. Cette période a également permis aux gestionnaires de stock de se familiariser avec l’utilisation de ce nouvel instrument de gestion. Désormais chaque mouvement de stock y est enregistré dès sa validation.
L’établissement se donne dès lors pour objectif de poursuivre et consolider la formation des utilisateurs, et d’effectuer la mise au point des requêtes standards (états périodiques de situation, indicateurs de gestion, formulaires…). Il déploie depuis avril 2010, le module marchés, met au point les interfaces avec les logiciels de gestion d’entrepôts des stockeurs et installe l’outil d’interface entre PARTEOR et les logiciels de suivi budgétaro-comptable (CONCERTO et GEBUS).
Selon ces perspectives, le déploiement de PARTEOR devrait être achevé au début du quatrième trimestre 2010 ainsi que sa connexion avec les logiciels comptable et budgétaires.
Le rapport établi par la mission nationale d’audit de la DGFiP en mars 2010 a toutefois mis à jour que, si la migration des données d’AMG vers PARTEOR s’est effectuée dans des conditions techniques satisfaisantes, les résultats attendus du passage au nouveau logiciel PARTEOR étaient encore perfectibles en vue d’une meilleure évaluation des stocks :
- la non-transmission à l’agent comptable des informations sur les sorties de stocks courant 2009 ne lui a pas permis de mettre en œuvre pour cet exercice la méthode de « l’inventaire permanent » prévue par la convention Etat-EPRUS. De même, le rapport relève que les circonstances de l’année 2009 n’ont pas permis à l’EPRUS de respecter pleinement les obligations d’information trimestrielle du ministère sur l’évolution du niveau des stocks ;
- les écarts observés par l’agent comptable lors d’une vérification opérée en septembre 2009 entre les « stocks réels » déclarés par les stockeurs et les « stocks théoriques » inscrits dans AMG n’ont pas tous été expliqués, le stock réel étant inférieur à celui semblant ressortir de la comptabilité matière. Le rapport souligne donc que « seule la conduite d’un inventaire physique exhaustif pourra permettre de fiabiliser la comptabilité des stocks » ; cette observation a conduit à ce que l’EPRUS lance l’appel d’offres visant à ce qu’un inventoriste extérieur réalise l’« inventaire flash » exhaustif de l’ensemble des sites de stockage mentionné précédemment ; la mission d’audit recommande en outre que l’établissement sensibilise les sites présentant le plus d’écart sur les nécessités d’un suivi plus rigoureux des entrées et sorties de produits du stock
- la formalisation des procédures d’alimentation de PARTEOR devra être renforcée, avec mise en place d’instances de supervision, et l’agent comptable obtenir communication de l’ensemble des instructions de l’ordonnateur aux préposés chargés de la comptabilité matière ;
- les prix unitaires provenant d’AMG appellent encore des corrections pour ceux des contrats arrivés à échéance que la DGS n’avait pas jusque-là transmis à l’établissement. Le rapport recommandait donc d’obtenir la transmission de tous les justificatifs nécessaires et de retenir systématiquement les prix indiqués sur le marché ou modifiés par avenant ;
- la règle prévoyant d’ajouter au prix tous les coûts directement liés à l’acquisition du produit, notamment les frais de transports et de manutention, n’a jusqu’à présent été appliquée qu’imparfaitement et l’établissement est invité à corriger systématiquement les sous-évaluations en résultant.
Enfin, il est à noter que l’indication de l’établissement selon laquelle « le caractère opérationnel des interfaces automatiques avec les stockeurs, sera fonction de leur capacité à intégrer dans leur propre système les exigences de l’EPRUS en matière de transmission des données et ceci sans surcoûts ajoutés » laisse entendre que la compatibilité effective avec les systèmes d’information des divers prestataires ou partenaires repose pour partie sur des facteurs échappant encore à la maîtrise de l’établissement. Aussi est-on amené à se demander si l’adoption de PARTEOR par l’ensemble des gestionnaires de sites ne serait pas la seule voie pour garantir vraiment la fiabilité d’ensemble du système d’information en matière de gestion et d’inventaire des stocks.
Les diverses sources d’erreurs constatées par la mission nationale d’audit ont pu être prises en compte dans les comptes 2009 de l’établissement pour un montant (63,5 M€) représentant un peu plus de 6 % de la valeur totale du stock Ceci conduit le rapport à qualifier les procédures relatives aux stocks d’« un niveau de fiabilité comptable encore insuffisant ». Les recommandations formulées visent cependant à des progrès rapides de l’établissement dans la maîtrise de la comptabilité matière, l’exhaustivité de l’inventaire physique et la mise en œuvre de l’inventaire permanent. Pour autant, la mission d’audit a pu relever que « l’agence comptable présentait un très bon niveau de formalisation de ses contrôles » et que « l’engagement de l’EPRUS en faveur d’une consolidation de ses dispositifs de contrôle et d’une meilleure connaissance des stocks, tels que l’illustrent nombre de ses travaux et initiatives, constitue un gage tangible et important d’amélioration ». La Cour fait sienne cette appréciation.
B. LA GESTION DES STOCKS ACQUIS POUR LA LUTTE CONTRE L’EPIDEMIE H1N1
Le développement courant 2009 du plan de lutte contre la pandémie grippale H1N1 qui était fondé notamment sur un objectif de vaccination massive de la population a conféré un rôle majeur à l’EPRUS tant comme opérateur des négociations visant à l’approvisionnement en vaccins et autres produits sanitaires que comme logisticien de leur livraison, de leur stockage et de leur distribution. Le bilan ex post d’une stratégie dont la mise en œuvre s’est largement écartée des prévisions initiales doit être tiré en prenant en compte que le partage des responsabilités entre l’Etat et son opérateur était substantiellement différent pour chacune de ces deux missions.
Conformément aux dispositions légales et souvent au-delà de celles-ci, l’intervention de l’établissement dans la négociation des différents contrats et dans la renégociation de ceux relatifs aux vaccins s’est faite dans le cadre d’instructions impératives du ministre chargé de la santé, instructions qui ont porté non seulement sur les objectifs généraux de ces négociations mais aussi sur les éléments juridiques, techniques, voire tactiques les plus détaillés. La responsabilité de l’EPRUS en ce domaine doit donc être évaluée exclusivement dans son efficacité de mise en œuvre des instructions ainsi reçues.
Il n’en va pas de même sur l’aspect logistique pour lequel l’établissement a dû concevoir et mettre en œuvre les dispositions concrètes propres à atteindre efficacement les objectifs de mise en place des produits qu’exigeait la stratégie sanitaire définie par les pouvoirs publics. Si le choix des centres de vaccination et la géographie d’ensemble de leur réseau a échappé à l’établissement, celui-ci a conçu et mis en place, indépendamment de toutes instructions de ses tutelles quant aux prestataires à retenir et aux accords à établir avec eux, le schéma de distribution fondé sur des plateformes zonales et les grossistes distributeurs52. Sa responsabilité de logisticien est donc entière, dans la limite bien sûr de la portion du réseau territorial sur laquelle il conservait le contrôle des produits, ce contrôle cessant à partir de l’échelon départemental.
L’ensemble des dépenses d’achat spécifiquement liées à la lutte contre la grippe H1N1 s’élèvent à près de 450 M€ si l’on prend en compte le budget modificatif adopté au conseil d’administration du 7 mai dernier, incluant les effets de l’interruption des contrats de vaccins et l’hypothèse d’une indemnisation des laboratoires limitée à 48,5 M€ (voir infra, point 3).
Hormis un faible montant de produits pédiatriques, ce total ne comprend pas les stocks d’antiviraux dont l’achat avait été effectué dès les exercices antérieurs au titre du plan contre la grippe aviaire et dont l’utilisation effective face à l’épidémie H1N1 s’est d’ailleurs avérée limitée malgré une mise en place massive dans les officines53.
Dans la mesure où les masques de protection FFP2 sont susceptibles d’utilisation face à d’autres risques sanitaires et où les achats réalisés en 2009 et 2010 (200 M€ au total) répondent en principe à des besoins de renouvellement du stock antérieur, ils ne figurent pas dans ce montant. A la mi-2009, la perspective de la pandémie H1N1 a conduit la DGS à demander à l’EPRUS de procéder au renouvellement de masques officiellement arrivés à péremption bien que leur contrôle ait attesté leur validité plutôt que de les remettre en circulation. L’urgence attachée à la survenue de l’épidémie H1N1 a également été invoquée comme « faisant émerger54 » la nécessité d’un renouvellement du stock de masques destinés aux administrations et à l’appui du financement de 38,6 M€ prévu à cet effet par décret d’avance (voir infra, partie IV, C, 2). Par la suite, le caractère plus bénin qu’attendu de l’épidémie à conduit à différer les achats et à reporter à 2011 l’échéance des renouvellements prévue pour septembre 2010 ; un report de l’ordre de 100 M€ était constaté fin 2009.
Si la stratégie de lutte contre la grippe H1N1 a également mobilisé de nombreux autres produits de vaccination et d’importantes charges de logistique, les acquisitions de vaccins représentent la plus grosse part des dépenses engagées.
Tableau n° 5 : Dépenses TTC de l’EPRUS au titre de la pandémie H1N1 (2009-2010)
En M€ |
2009 |
2010 (prév.) |
Total |
Vaccins |
322,7 |
11,5 |
334,2 |
Indemnisation des laboratoires |
48,5 |
48,5 (non taxé) | |
Dépenses de logistique |
6,0 |
23,8 |
29,8 |
Dispositifs et consommables médicaux (masques, matériel d'injection...) |
9,1 |
14,5 |
23,6 |
Antiviraux pédiatriques |
4,0 |
0,8 |
4,8 |
Respirateurs |
5,8 |
5,8 | |
Total des dépenses au titre de la pandémie |
347,6 |
99,1 |
446,7 |
Source : Cour des Comptes d’après données EPRUS
La vaccination étant l’élément majeur du dispositif de la lutte contre la pandémie H1N1, quatre contrats ont été conclus en juillet et août 2009 en vue de l’acquisition d’un total de 94 050 000 doses de vaccins contre le virus A/H1N1 pour un montant global de 674,9 M€ HT (712,1 M€ TTC). Seules 44 050 000 doses ont été facturées, correspondant à un prix hors taxes de 316,8 M€ HT (334,2 M€ TTC). La différence, soit 50 millions de doses, a fait l'objet d’une réduction de commande dans les conditions exposées ci-après (point 3)
Ces quatre contrats ont été conclus par l’EPRUS avec les laboratoires GlaxoSmithKline (GSK), Sanofi Pasteur, Novartis et Baxter. Si formellement, ils portent bien la signature du directeur général de l’EPRUS, ce dernier a agi sur instruction du ministre chargé de la santé selon les modalités qui seront précisées infra.
Tableau n° 6 : Contrats d’achat de vaccins contre la grippe H1N1
Prestataire/ dénomination commerciale du vaccin |
Contrat |
Quantités initiales commandées |
Prix (HT) |
Glaxo Group Limited et Laboratoire GlaxoSmithKline Pamdemrix |
Marché EPRUS/09-29 du 10 juillet 2009 relatif à la fourniture de vaccin adjuvanté A/H1N1 Swine Lineage |
50 millions de doses |
350 M€ |
Sanofi Pasteur SA Panenza |
Avenant n° 3 notifié le 8 juillet 2009, au marché DGS du 19 octobre 2005 |
28 millions de doses |
175 M€ |
Société Novartis Vaccine and Diagnostics SRL Focetria |
Avenant n° 4 notifié le 29 juillet 2009, au marché DGS du 29 juillet 2005 |
16 millions de doses |
149,4 M€ |
Total vaccins sur œufs |
94 millions de doses |
674,4 M€ | |
Baxter SA Celvapan |
Marché EPRUS/09-36 du 7 août 2009 juillet 2009 relatif à l’acquisition de vaccin contre le virus H1N1 |
50 milliers de doses |
0,5 M€ |
Source : EPRUS
1/ Le contrat avec GSK (Glaxo Group Limited et Laboratoire GlaxoSmithKline) a été signé par l’EPRUS le 10 juillet 2009 dans le cadre de l’exception de l'article 3-7° au code des marchés publics. Il porte sur 50 millions de doses de Pandemrix, vaccin adjuvanté conditionné en flacons de dix doses, livrés par boîtes de 50 flacons, l’adjuvant et l’antigène étant conditionnés séparément et destinés à être mélangés lors des séances de vaccination. Le prix unitaire des doses étant de 7 € HT, dont 6 € HT pour l’adjuvant et 1 € HT pour l’antigène, le montant de la commande initiale était de 350 M€ HT.
2/ Le contrat avec Sanofi Pasteur SA a été signé par le titulaire le 7 juillet 2009 et notifié le 8, après signature du directeur général de l’EPRUS. Il a été pris sous la forme d’un avenant au marché conclu le 19 octobre 2005 pour une durée de six ans entre ce laboratoire et la DGS à l’issue d’un marché négocié, faisant suite à un appel d'offres infructueux, passé selon le code des marchés publics. Ce dernier marché avait un double objectif : d’une part, l’acquisition, au moyen d’une tranche ferme, de 1,4 million de doses de vaccins contre le virus aviaire H5N1, d’autre part, la réservation, au moyen de cinq tranches conditionnelles, de quantités de vaccins pouvant aller jusqu’à 56 millions de doses en cas de pandémie aviaire reconnue par l’OMS55.
L’avenant de juillet 2009, outre le fait d’étendre le recours aux tranches conditionnelles à une pandémie autre qu’aviaire, a eu pour effet d’affermir la première tranche conditionnelle à hauteur de 28 millions de doses, 28 autres millions de doses étant susceptibles d’être commandées dans le cadre des tranches conditionnelles restantes. Le prix unitaire de ces doses étant de 6,25 € HT, le montant de la commande ferme était de 175 M€HT (184,6 M€ TTC). La commande de 2009 n’a pas spécifié la nature précise du vaccin, Sanofi Pasteur ayant alors en projet le développement, à la fois, d’un vaccin adjuvanté et d’un vaccin non adjuvanté (voir infra). Au cours de l'exécution du marché, le laboratoire allant obtenir plus rapidement une AMM pour son vaccin non adjuvanté (Panenza), c’est ce dernier qui a été livré. Il est conditionné, à titre principal, en flacons de dix doses, 300 000 doses ayant, par ailleurs, été livrées sous formes de monodoses.
3/ Le contrat avec Novartis (Société Novartis Vaccine and Diagnostics SRL) a été signé par le titulaire le 10 juillet 2009 notifié le 29. De manière analogue au contrat avec Sanofi Pasteur, il a été pris sous la forme d’un avenant à un marché conclu le 29 juillet 2005 pour une durée de six ans entre le laboratoire Chiron Vaccine, devenu ultérieurement Novartis, et la DGS à l’issue d’un appel d'offres lancé simultanément avec celui ayant abouti au marché négocié évoqué ci-dessus56. Tel que conclu en juillet 2005, le marché visait, d’une part, l’acquisition au moyen d’une tranche ferme de 1,2 million de doses de vaccins contre le virus aviaire A/H5N1, d’autre part, la réservation, au moyen de trois tranches conditionnelles, de quantités de vaccins pouvant aller jusqu’à 24 millions de doses en cas de pandémie aviaire reconnue par l’OMS.
L’avenant de juillet 2009, tout en étendant le recours aux tranches conditionnelles à une pandémie autre qu’aviaire, a affermi la première tranche conditionnelle à hauteur de 16 millions de doses et prévu que 8 autres millions de doses pourraient être commandées dans le cadre des tranches conditionnelles restantes. Le prix unitaire des doses étant de 9,34 € HT, le montant de la commande ferme était de 149,4 M€ HT (157,7 M€TTC).
La commande de 2009 a porté sur le vaccin adjuvanté Focetria, conditionné en flacons de dix doses, l’adjuvant et l’antigène étant d’emblée mélangés. Le contrat de juillet 2009, qui avait prévu qu’une partie des vaccins, allant jusqu'à 10 %, pourrait être conditionnée en monodoses, a été modifié par un avenant du 1er octobre supprimant cette limite. Novartis a ainsi fourni, pour le même prix, une quantité importante de monodoses (près de 5,9 millions de doses sur le total de 9 millions livrées).
4/ Le contrat avec Baxter SA a été signé le 7 août 2009 par l’EPRUS dans le cadre, comme le contrat avec GSK, de l’exception de l'article 3-7° au code des marchés publics. Il porte sur 50 000 doses de Celvapan, vendues au prix unitaire de 10 € HT. Ce vaccin se distingue des trois précédents par le fait qu’il provient de virus développés sur des cultures de cellules et non sur des œufs embryonnés. Il est donc susceptible d’être administré aux personnes intolérantes aux protéines aviaires. Toutes les quantités prévues ont été livrées : à la différence des précédents, ce contrat n’a pas donné lieu à une réduction des commandes.
Tableau n° 7 : Quantités et prix (HT)
GSK |
Sanofi P. |
Novartis |
Baxter |
Total | |
Prix unitaire (€ HT) |
7,00 € HT |
6,25€ HT |
9,34€ HT |
10,00€ HT |
|
Qtés commandées |
50,00 |
28,00 |
16,00 |
0,05 |
94,05 M doses |
Prix des commandes (M€ HT) |
350,00 M€ |
175,00 M€ |
149,44 M€ |
0,50 M€ |
674,94 M€ |
Qtés livrées |
18,00 |
17,00 |
9,00 |
0,05 |
44,05 M doses |
Prix des cdes livrées (M€ HT) |
126,00 M€ |
106,25 M€ |
84,06 M€ |
0,50 M€ |
316,81 M€ |
Qtés annulées |
32,00 |
11,00 |
7,00 |
0,00 |
50,00 M doses |
Prix des cdes annulées (M€ HT) |
224,00 M€ |
68,75 M€ |
65,38 M€ |
0,00 M€ |
358,13 M€ |
Indemnisation (M€ HT) au 01-07-10 |
36, 00 M€ |
2,00 M€ |
10,50 M€ |
0,00 M€ |
48,50 M€ |
Total des paiements HT |
162,00 M€ |
108,25 M€ |
94,56 M€ |
0,50 M€ |
365, M€ |
Source : Cour des comptes à partir des données de l’EPRUS
Le total des paiements TTC est égal à la somme du prix TTC des doses livrées (334,2 M€) et des indemnités versées (48,5 M€), soit 382,7 M€ TTC.
a. Des procédures dérogatoires
Une politique de commande et de négociation définie exclusivement par le ministère
Les décisions relatives à la commande des vaccins et, symétriquement, les décisions de résiliation partielle, ont été prises par le directeur général de l’EPRUS sur demande du ministre chargé de la santé comme le prévoient les articles L. 3135-1 et R. 3135-1 du CSP et la convention du 16 février 2009 entre l'État et l’EPRUS, évoqués supra, en vertu desquels les achats de produits et services nécessaires à la protection de la population face aux menaces sanitaires graves sont effectués par l’établissement à la demande du ministre chargé de la santé. L’article 2.2 de la convention mentionne en effet que, pour toute acquisition de produits, une commande écrite est adressée par le ministre au directeur général de l’EPRUS.
En l’espèce, le ministre chargé de la santé est le plus souvent intervenu à l’égard de l’EPRUS, non pas par l'intermédiaire du DGS comme c’était antérieurement le cas pour d’autres commandes sanitaires, mais sous la signature de son directeur de cabinet. De plus, ce dernier a été à l'initiative des principaux premiers contacts avec les laboratoires. A l’issue de ces contacts, certains éléments économiques, notamment le prix, ont été arrêtés, se trouvant ainsi exclus d’emblée du mandat de négociation donné à l’EPRUS.
Ainsi, avant que les avenants et contrats soient conclus en juillet 2009 (et août pour Baxter) avec les quantités vues ci-dessus, une première configuration des achats avait été établie dans le cadre de lettres d’intention de commande adressées par le directeur de cabinet du ministre chargé de la santé aux laboratoires pour un total de 93 millions de doses :
- le 14 mai 2009 à GSK pour 50 millions de doses de Pandemrix ;
- le 2 juin 2009 à Novartis pour 24 millions de doses de Focetria ;
- le 3 juin 2009 à Sanofi Pasteur pour 15 millions de doses d’un vaccin H1N1 non encore précisé ;
- le 5 juin 2009 à Baxter pour 4 millions de doses de Celvapan.
Ces réservations se sont faites en parallèle avec la définition de la stratégie de vaccination.
Elles ont été suivies d’instructions du ministre chargé de la santé à l’EPRUS afin que ce dernier engage des négociations en vue d’aboutir à la conclusion des contrats. Ces instructions ont fait l'objet de lettres du directeur de cabinet du 20 mai (pour le contrat avec GSK), 22 juin (contrat avec Baxter), 25 juin (contrat avec Sanofi Pasteur) et 1er juillet (contrat avec Novartis). A la suite de l’arbitrage du Premier ministre du 3 juillet 2009, le ministre chargé de la santé a demandé à l’EPRUS, par lettre du 8 juillet 2009, de conclure les contrats sous une semaine en veillant à ce qu’ils comportent diverses clauses destinées à préserver les intérêts des pouvoirs publics (voir infra).
A l’issue de ces négociations, l’EPRUS a conclu les contrats avec les montants définitifs, les variations par rapport aux instructions ministérielles résultant, pour l’essentiel, de la réduction de la disponibilité des vaccins Baxter et Novartis.
De même, en ce qui concerne les réductions des commandes de vaccins, les principales décisions ont été prises par l’EPRUS sur instructions données directement par le ministre, y compris, on l’a vu, pour le choix des avocats alors consultés.
Outre le cas des vaccins, le directeur de cabinet a également adressé ses instructions à l’EPRUS pour les autres achats en lien avec la lutte contre la pandémie :
- lettres des 6 et 11 mai 2009 demandant à l’EPRUS de procéder à un inventaire des masques FFP2 dont disposaient les différents ministères et opérateurs publics et de procéder aux acquisitions nécessaires ;
- lettre du 8 juillet 2009 pour la commande de masques pédiatriques et lettre du 22 janvier 2010 en vue de l’abandon de la procédure de passation d’un marché à cet effet ;
- lettre du 14 août 2009 pour l’acquisition de produits et matériels médicaux nécessaire à la campagne de vaccination.
La manière particulièrement impérative et détaillée dont la mission de négociation de l’EPRUS a ainsi été encadrée par les instructions ministérielles et justifiée par la jeunesse de l’établissement, la fragilité qu’auraient induite les divergences avec son premier directeur général et le souhait de conforter et sécuriser son successeur par des instructions précises, couvrant sa responsabilité.
Prises dans le climat d’urgence où s’est développée la gestion de la lutte contre la menace de grippe H1N1, ces nombreuses et substantielles interventions du ministre chargé de la santé et de son cabinet, ont considérablement restreint le champ des responsabilités et les marges de manœuvre dont disposait l’EPRUS pour conduire et conclure les négociations dont il était chargé en titre. Dès lors que des contacts préalables étaient établis en dehors de lui avec les prestataires, que ces contacts conduisaient à exclure de la négociation ultérieure des éléments aussi importants que la répartition des quantités et les prix et que les instructions les plus détaillées lui étaient données sur la procédure à suivre et de nombreux points des contrats à venir, le pouvoir adjudicateur s’est trouvé de fait exercé de manière partagée entre la personne morale légalement contractante et sa tutelle.
Cette pratique excède manifestement le parti retenu par le Législateur en 2007 lorsqu’il prévoyait que l’EPRUS n’intervienne en matière d’acquisition qu’« à la demande » du ministre, disposition qui, légitimement, réservait à ce dernier la responsabilité de la définition du besoin à satisfaire en cohérence avec la stratégie sanitaire retenue mais ne lui confie nullement d’intervenir dans la passation des contrats elle-même. Soulevant de sérieux problèmes de régularité, elle ne saurait être renouvelée au-delà de la situation particulière qui l’a inspirée.
Des contrats considérés comme non soumis au code des marchés publics
Ainsi qu’il a été vu ci-dessus, les vaccins ont été commandés dans deux cadres distincts :
- un avenant à un marché existant, lui-même conclu conformément au code des marchés publics pour les commandes de vaccins auprès de Sanofi Pasteur et de Novartis ;
- des contrats nouveaux, signés dans le cadre d’une exception à l’application du code, prévue au 7° de son article 3 pour les commandes de vaccins auprès de GSK et de Baxter.
Pour les achats autres que les vaccins, l’EPRUS a eu recours, selon les cas, à cette même exception, à des marchés passés selon le code, à des conventions avec l’UGAP ou avec le service de santé des armées.
Le choix du recours à la procédure de l’article 3-7° du code des marchés
De manière générale, le code des marchés publics, par son article 3, exclut de son application les :
« 7° Accords-cadres et marchés, autres que ceux qui sont passés en application du décret prévu au II de l'article 4 du présent code, qui exigent le secret ou dont l'exécution doit s'accompagner de mesures particulières de sécurité conformément aux dispositions législatives ou réglementaires en vigueur ou pour lesquels la protection des intérêts essentiels de l'Etat l'exige. Un arrêté du Premier ministre fixe les conditions dans lesquelles est assuré, à l'occasion de la passation et de l'exécution des accords-cadres et des marchés mentionnés au présent alinéa, le respect de la protection du secret ainsi que des informations ou des intérêts concernant la défense nationale, la sécurité publique ou la sûreté de l'Etat ».
Cette disposition ne s’applique pas à certains marchés de la défense pour lesquels le décret n° 2004-16 du 7 janvier 2004 modifié prévoit des conditions particulières de passation ou de contractualisation propres aux divers achats en ce domaine. Dans son champ d’application, l’exception de l'article 3-7° est à justifier au regard de considérations relatives au secret, à la sécurité ou à la protection des intérêts essentiels de l'État57.
Antérieurement à la crise pandémique, l’EPRUS avait eu recours à l'article 3-7° en 2008 pour l’acquisition de divers antibiotiques et autres substances dans le cadre des plans « Biotox »et « Piratox » dont les objectifs sont de nature à satisfaire aux conditions énoncées par le code (quatre contrats en 2008 et un en 2009, pour un montant total de 7,5 M€).
S'agissant de la lutte contre la pandémie, l'établissement a été incité à faire appel à cette procédure dès la lettre du 20 mai 2009 mentionnée supra transmettant au directeur général de l'établissement les instructions du ministre chargé de la santé en vue de la réservation de vaccins H1N1 auprès de GSK. La demande expresse « de recourir aux dispositions du code des marchés publics pour que ces approvisionnements s’effectuent dans les conditions élevées de confidentialité, de rapidité et de sécurité qu’exige la protection des intérêts essentiels de l'État » ne lui laissait en effet que peu de marge de choix. Une demande identique a été formulée dans les instructions relatives à l’acquisition des autres vaccins. Elle figure également dans la lettre du 14 août 2009 mentionnée supra dans laquelle le directeur de cabinet a donné instructions en vue des achats nécessaires à la campagne de vaccination et s’y trouve étendue à la plupart des autres produits et matériels mobilisés dans la lutte contre la grippe H1N1.
Le cas des vaccins
S’agissant des vaccins H1N1 et dès lors qu’était recherchée la fourniture rapide d’un nombre massif de doses, de nombreuses spécificités de la situation économique de négociation s’écartaient des conditions usuelles de passation d’un marché public qui suppose la réunion des trois aspects suivants :
- une définition précise des besoins, des modalités spécifiques pouvant cependant être mises en œuvre pour faire face aux incertitudes, en particulier les marchés fractionnés, tels les marchés à tranches conditionnelles ;
- le choix du titulaire à l’issue d’une publicité visant à faire connaître les besoins à tous les opérateurs économiques susceptibles de les satisfaire et d’une mise en concurrence destinée à sélectionner l’attributaire du marché en assurant un traitement égal aux candidats, des aménagements étant prévus pour diverses situations particulières marquées par l’urgence, la complexité des besoins ou toute autre spécificité ;
- un contrat dont les clauses assurent un équilibre satisfaisant entre les droits et obligations du pouvoir adjudicateur et ceux du cocontractant, tant en ce qui concerne le prix, que les délais, pénalités, responsabilités et modalités de résiliation.
En l’espèce, la définition des besoins dans le courant du mois de mai et le début du mois de juin 2009, s’est arrêtée, au vu de la stratégie sanitaire alors retenue, à l’objectif d’un ordre de grandeur de 90 à 100 millions de doses, permettant une vaccination au moyen de deux doses d’environ 75 % de la population, étant supposé que 25 % de celle-ci ne demanderait pas à être vaccinée. Le nombre de deux doses pour une vaccination (administrées à trois semaines d’intervalle), élément tout à fait déterminant dans l’appréciation des quantités nécessaires, n’a guère été mis en débat : au vu de l’expérience du virus H5N1, il a été considéré comme à la fois plus probable et plus prudent du point de vue sanitaire pour conférer une immunité envers un virus supposé entièrement nouveau. Selon la procédure dite mock up58, plusieurs des éléments de l’AMM des vaccins H1N1 devaient être déduits de ceux des vaccins H5N1, notamment la stratégie vaccinale qui, pour ces derniers vaccins, prévoyait deux doses.
Les besoins ainsi estimés ne pouvaient être que partiellement satisfaits par les deux fournisseurs avec lesquels l'État avait déjà passé des marchés en 2005. En ce qui concerne Sanofi Pasteur, si le contrat prévoyait notamment une première tranche conditionnelle de 28 millions de doses, le laboratoire ne disposait cependant pas alors, à la différence des trois autres, d’un vaccin H5N1 doté d’une AMM à partir duquel il aurait pu développer un vaccin pandémique susceptible d’obtenir rapidement une autorisation dans le cadre de la procédure accélérée. S’agissant de Novartis, qui, en revanche, disposait d’un vaccin de cette nature, les premiers contacts pris avec ce laboratoire montraient qu’il ne pourrait satisfaire qu’une part réduite des besoins (12 millions de doses à fin novembre et 12 autres millions à fin janvier). L’État devait donc se tourner vers les autres producteurs susceptibles de fournir des vaccins contre la pandémie dès lors qu’il s’était assigné un objectif de l’ordre de 90/100 millions de doses.
A cet effet, le ministère a établi des contacts avec le laboratoire GSK dès le 10 mai (offre de ce dernier adressée au directeur de cabinet du ministre chargé de la santé) et le laboratoire Baxter dès le 15 mai (lettre de Baxter au DGS) sans procéder par la voie d’un avis d’appel public à la concurrence, assorti d’un délai laissé aux candidats potentiels pour proposer leur candidature et faire part de leur offre. A vrai dire, l’État aurait été fondé à entrer directement en relation avec ces producteurs en application de l'article 35-II-1° qui autorise de contracter sans publicité ni mise en concurrence en cas d’urgence impérieuse, voire en vertu de l’article 35-II-8° pour le cas où des prestations ne peuvent être assurées que par tel ou tel opérateur économique. En tout état de cause, et à supposer qu’il en existe, aucun autre fabricant n’a intenté de contentieux, notamment par la voie largement ouverte aux entreprises que constitue le référé précontractuel, au motif que le principe du libre accès à la commande publique aurait été méconnu en raison de l’absence des mesures habituelles de publicité.
Après la publicité, le second impératif de la commande publique est de mettre les candidats en concurrence en veillant à les traiter de manière égale. En l’espèce, l'État ne se trouvait pas dans la situation de devoir choisir, pour satisfaire les besoins tels qu’il les avait définis, entre les offres des différents fournisseurs, qu’il s’agisse d’ailleurs des nouveaux prestataires potentiels, GSK et Baxter, ou des cocontractants existants, Sanofi Pasteur et Novartis. En effet, pour parvenir à commander un nombre de 90 à 100 millions de doses, il lui fallait, à titre principal, 40 ou 50 millions de doses du laboratoire GSK, ce dernier étant susceptible de fournir dans les meilleurs délais un vaccin doté d’une AMM.
Ainsi, à la différence de la situation habituelle où un pouvoir adjudicateur met en concurrence des candidats, la demande des pouvoirs publics français contribuait à une situation où les laboratoires étaient en position de mettre en compétition les divers États. C’est ce qu’exprime la lettre adressée le 15 mai 2009 par le président de GSK France au directeur de cabinet : « Nous souhaitons attirer une nouvelle fois votre attention sur le fait que notre capacité de production sera pleinement allouée aux différents États, dont la France, ayant déjà signé des contrats et des lettres d’intention avec GSK ». Dans ce contexte, qui plaçait la France dans un rapport de négociation peu favorable, l’impératif de mise en concurrence des candidats n’avait plus d’objet. Là encore, aucun opérateur économique n’est venu contester un quelconque manquement aux règles de la commande publique. Sous cet angle, il importait peu que l’absence de publicité et de mise en concurrence résulte du recours à l'article 35-II-1° et 8° ou de l’exception de l'article 3-7°.
Le recours à cette dernière disposition se distingue cependant très nettement de l’application de l’article 35-II. D’une part, le code des marchés publics étant mis à l’écart, le pouvoir adjudicateur peut estimer ne pas être tenu de respecter les règles relatives à l'exécution financière qui figurent dans ce texte, notamment les dispositions portant sur les avances (voir infra). D’autre part, et surtout, l’usage de l'article 3-7° doit reposer sur des motifs autres que l’urgence ou l’exclusivité, étant réservé « aux marchés qui exigent le secret ou dont l'exécution doit s'accompagner de mesures particulières de sécurité conformément aux dispositions législatives ou réglementaires en vigueur ou pour lesquels la protection des intérêts essentiels de l'Etat l'exige ».
S’agissant d’une exception totale aux règles de la commande publique, cette disposition fait l'objet d’une interprétation limitative. Faute de références dans la jurisprudence nationale, il convient de considérer les décisions prises par le juge communautaire sur le fondement de l’article 14 de la directive « marchés publics » n° 2004/18/CE du 31 mars 2004 dont la transposition est à l’origine de l'article 3-7° du code des marchés publics – ou des dispositions analogues des directives antérieures. La jurisprudence de la Cour de justice des Communautés européennes met l’accent sur le fait que toute dérogation à la réglementation communautaire en matière de marchés publics impose que celui qui entend s’en prévaloir apporte la preuve que des circonstances exceptionnelles ont justifié l’application de cette mesure59. Les hypothèses dans lesquelles une dérogation au droit communautaire de la commande publique a été admise sont rares et aucune, pour l’instant, ne se rapproche quelque peu du cas des vaccins60.
Cette circonstance ne suffit pas pour autant à présumer de l’opinion qui serait celle du juge communautaire s’il était saisi par la Commission européenne à l’égard de l’argumentation des pouvoirs publics, développée dans une note interne du 8 avril 2010 émanant du directeur général de l’EPRUS et qui repose sur deux arguments principaux : d’une part, la nécessité d’une confidentialité dans le contexte de la concurrence existant entre les États en vue « d’obtenir, dans les meilleures conditions possibles, un stock suffisant de doses de vaccin destiné à leur population », d’autre part, le souci d’assurer « la sécurité des approvisionnements, des sites de production, de stockage et de livraison ».
L’EPRUS doute qu’une alternative ait pu être trouvée dans un recours à l’article 35-II du code qui aurait notamment supposé « l’imprévisibilité » du besoin. On a cependant peine à comprendre pourquoi, si ce besoin avait été effectivement « prévisible », la commande a été différée jusqu’au dernier moment et comment « l’urgence » tenant à des « délais contraints » pourrait être simultanément invoquée, comme le fait l’établissement, à l’appui du recours à l’article 3.7°61.
Par ailleurs, il peut être observé au regard, non plus du droit de la commande publique mais du point de vue des règles de la transparence administrative, que la Commission d’accès aux documents administratifs (CADA), saisie à propos du caractère confidentiel des marchés de vaccins, a estimé dans son avis du 8 octobre 2009 que celui-ci ne pouvait se justifier au regard de la protection de la sûreté de l’État, la sécurité publique ou la sécurité des personnes (voir infra).
Le cas des autres services ou fournitures
Le recours à l’exception de l’article 3-7°, s'agissant des achats en rapport avec la pandémie, autres que les vaccins, pouvait, à la rigueur, se justifier pour les prestations de stockage et de transport, au regard d’impératifs de sécurité afin, comme l’indique la note du 8 avril 2010 précitée, « d’éviter dans le cadre de l’exécution de ces contrats, la survenance d’agissements susceptibles de troubler l’ordre public » dans la mesure où « une attaque dirigée contre […] les lieux de livraison des produits aurait été de nature à affaiblir considérablement le potentiel de l'État dans sa réponse à la pandémie grippale ».
Ce même recours se comprend plus difficilement pour des acquisitions de compresses, thermomètres, blouses, étiquettes autocollantes, pansements adhésifs, sacs à déchets etc. Là aussi, c’est cependant du cabinet du ministre que l’établissement a d’emblée reçu l’ordre de faire recours à la même procédure d’exception pour toute « une liste de produits de santé » nécessaires à la vaccination62, pour lesquelles le recours à la procédure négociée sans publicité ni mise en concurrence au motif de l’urgence de l’article 35-II du code aurait constitué un écart plus justifié par rapport au droit commun des marchés publics.
La question de la confidentialité
Par ailleurs, l’utilisation de l'article 3-7° pour des motifs invoquant la confidentialité, conjuguée aux clauses imposées par certains laboratoires (GSK et Baxter au premier chef) dans une conception très extensive du secret commercial, a contribué à entretenir l’opacité de ces contrats vis-à-vis de l’opinion publique. Saisie par des journalistes à la suite du refus du directeur général de l’EPRUS de leur communiquer les quatre contrats de vaccins et leurs annexes63, la CADA a rendu son avis lors de sa séance du 8 octobre 2009, publié le 15 octobre.
En premier lieu, la commission a rappelé « qu'une fois signés, les marchés publics et les documents qui s'y rapportent sont considérés comme des documents administratifs soumis au droit d'accès institué par la loi du 17 juillet 1978 », droit qui « doit toutefois s'exercer dans le respect du secret en matière industrielle et commerciale, protégé par les dispositions du II de l'article 6 de cette loi », en second lieu, « que peuvent également être écartées de la communication les pièces ou informations dont la révélation porterait atteinte à la sûreté de l'État, à la sécurité publique ou à la sécurité des personnes ».
Or, en l’espèce, la commission a considéré, au regard de la nature de ces documents, que « ceux-ci sont susceptibles de comporter des indications relevant du secret en matière industrielle et commerciale mais non d'être couverts, de manière générale, par les restrictions au droit de communication prévues pour protéger la sûreté de l'État, la sécurité publique ou la sécurité des personnes », le directeur de l'EPRUS n’apportant à cet égard « aucune précision sur les conséquences défavorables que pourrait entraîner la divulgation de ces documents ». Elle a estimé en conséquence « que de telles informations ont vocation à être portées à la connaissance de tous dans le cadre d'une politique de santé publique transparente ».
Dans un communiqué du 28 octobre 2009, le ministre chargé de la santé a indiqué que les contrats relatifs à ces commandes seraient désormais transmis à toute personne morale en faisant formellement la demande au ministère en charge de la santé, dans le respect de la loi du 17 juillet 1978 et des dispositions de son article 6. S’agissant du contrat GSK, les principales dispositions en étaient occultées dans les documents désormais ouverts à la communication, notamment celles à caractère technique, qui furent en définitive publiées, une fois l’AMM obtenue, sur le site de l’AFSSaPS ou celui de l’EMEA. Quant au contrat Baxter, dont l'article 17 interdisait la communication, il a d’abord été occulté jusqu’à ce que le laboratoire lève cette clause de confidentialité.
L’impossibilité de faire jouer la concurrence entre laboratoires et la position défavorable de négociation dans lesquelles se sont trouvés placés les pouvoirs publics a découlé entièrement de l’objectif de quantités de vaccins que ceux-ci s’étaient assignés. Une stratégie de vaccination fondée sur un nombre de doses plus limité tout en permettant de protéger les populations à risques aurait, en effet, pu être satisfaite en recherchant parmi les divers laboratoires du marché l’offre la plus compétitive au vu des divers critères à prendre en compte.
Cette position de dépendance vis-à-vis des fournisseurs a sans nul doute été aggravée par l’absence de toute coordination, notamment européenne, entre les différents Etats demandeurs.
Même dans les circonstances de négociation créées par le choix du schéma vaccinal initial, n’étaient pas remplies pas d’une manière assurée les conditions juridiquement requises pour justifier le recours à l’article 3-7° du code des marchés publics. En toute hypothèse, ce recours a été abusivement étendu à l’acquisition de produits autres que les vaccins. D’autres procédures, notamment celles de l’article 35-II, permettaient d’ailleurs de répondre au caractère d’urgence de l’achat des vaccins sans priver les pouvoirs publics de certaines des protections utiles du code des marchés publics.
b. Des commandes fermes malgré des incertitudes importantes et manifestes
Ainsi qu’il a été indiqué ci-dessus, le besoin avait été estimé à au moins 90 millions de doses à fournir en 200964. Selon la stratégie vaccinale de masse alors retenue, un impératif quant au délai (vacciner à temps) coexistait avec celui sur la quantité (pouvoir vacciner tous ceux qui le demanderaient) sous la contrainte de devoir vacciner au moyen de deux doses.
L’impératif temporel s’est présenté comme une sorte de course de vitesse entre les délais nécessaires à la mise à disposition de vaccins et l’arrivée de la pandémie. A compter de la déclaration de pandémie par l’OMS le 11 juin 2009, l’objectif était de disposer de quantités importantes de vaccins dès le mois d’octobre.
Des incertitudes qui pouvaient être identifiées
L’objectif de la vaccination de la majeure partie de la population dans ce délai résulte davantage d’un scénario prévisionnel empirique et affecté d’incertitudes, que de considérations purement scientifiques. En effet, les instances d’expertise ont rappelé à plusieurs reprises que pour faire barrière à une épidémie appelant vaccination, celle-ci doit être suffisamment précoce au regard du développement de l’épidémie65 et être effectuée sur 30 à 50 % de la population. Or les contraintes de délai affectant la disponibilité des vaccins (le délai pour leur développement et celui nécessaire à la délivrance de leur autorisation) ne permettaient pas d’espérer pouvoir opposer l’effet « barrière » requis dès l’arrivée de l’épidémie. A défaut d’un tel effet, la vaccination peut se donner un autre objectif qui est de protéger les personnes exposées à des risques particuliers. Or, dans le cas du risque H1N1, les instances d’expertise ont éprouvé des difficultés à cerner les populations à risque qui, en tout état de cause, différaient de celles exposées lors des épidémies de grippe saisonnière. De plus, par son avis rendu le 5 février 2009, le Comité consultatif national d’éthique avait indiqué que la vaccination de certaines catégories prioritaires de la population ne pouvait avoir qu’un caractère transitoire et qu’il fallait que l’accès à la vaccination soit offert à toute la population. Bien qu’exprimée à l’égard de toute « possible pandémie grippale », cette prise de position précoce ne trouvait vraiment de sens que dans l’hypothèse d’une pandémie au moins aussi grave que celle de H5N1. Elle a cependant lourdement influencé la conception de la campagne H1N1. De même, les coûts d’une campagne générale de vaccination ont alors volontiers été mis en regard avec celui des conséquences pour la sécurité sociale comme pour l’économie en général d’une épidémie attendue comme particulièrement sérieuse. Le 3 juillet 2009, une lettre du ministre chargé de la santé au premier ministre estimait ainsi entre 6 et 7,5 Md€ le coût de l’absentéisme prévisible dans une telle hypothèse. Le dispositif entériné par le Premier ministre le 3 juillet 2009 a ainsi confirmé la commande ferme de 90 millions de doses permettant la vaccination de 75 % de la population au moyen de deux doses66.
Le DGS explique également le choix d’une vaccination générale en mettant l’accent sur le fait que le virus a été découvert précocement et que l’on pouvait supposer que la pandémie ne se développerait qu’à l’automne. Il pouvait donc sembler plausible au début de l’été de parvenir à réaliser une vaccination de grande ampleur dès la première vague, même si celle-ci ne pouvait intervenir suffisamment tôt pour assurer un effet de barrière.
Pour parvenir à réaliser cet objectif de protection vis-à-vis d’une pandémie dont il estimait qu’elle pouvait devenir grave, l'État a estimé devoir procéder à des commandes fermes, alors même qu’il ne pouvait ignorer les incertitudes qui affectaient la réalisation des marchés et leur adéquation à la réalité des besoins sanitaires. En premier lieu, les vaccins pouvaient ne pas être fabriqués en nombre suffisant et/ou au moment voulu si leur développement était perturbé par un retard dans la disponibilité des réactifs fournis par l’OMS et, surtout, par la faiblesse du rendement antigénique des cultures, susceptible de varier dans de larges proportions. En second lieu, bien que développé, tel ou tel vaccin pouvait s’avérer inutilisable faute d’obtention de l’AMM67. Enfin, s’agissant d’un virus inconnu, sa dangerosité en termes de contagion comme d’incidence sanitaire sur les personnes atteintes pouvait fort bien ne pas obéir au même schéma que celui observé sur la souche H5N1 et, en cas de risque manifestement moindre, conduire à réviser à la baisse tant l’adhésion de la population à l’objectif d’une vaccination de masse que l’impératif même de celle-ci.
On sait certes aujourd’hui que cette dernière hypothèse est celle qui s’est réalisée en 2009, l’essentiel restant, dans l’évaluation de la politique suivie, que rien ne permettait de l’écarter a priori et qu’une décision publique devant, bien sûr, se préparer à une situation potentiellement plus grave, aurait également pu et dû prévoir des dispositifs de repli en cas de situation moins alarmante.
Quant au risque d’un retard dans la disponibilité des vaccins, il pouvait d’autant moins être ignoré que le rapport Jégou, examiné début mai 2009 par le Sénat, soulignait dès cette date : « Votre rapporteur spécial s’interroge, enfin, sur le calendrier d’acheminement des nouveaux produits et équipements récemment commandés (masques et vaccins). En effet, alors que le « pic » pandémique est prévu pour cet automne, les masques FFP2 ne seront livrés qu’à hauteur d’environ 25 millions par mois entre juin 2009 et septembre 2010. Quant aux vaccins contre le virus A/H1N1, les livraisons seront échelonnées entre le mois d’octobre 2009 et le mois de janvier 2010, voire le mois de mars ou avril 2010 selon les capacités de production des laboratoires. Sachant que les deux injections nécessaires doivent être séparées de 3 semaines et que le patient n’est totalement immunisé qu’au bout de plusieurs semaines, votre rapporteur spécial s’interroge sur le risque d’une livraison tardive de certaines doses de vaccins et indirectement sur l’opportunité d’une commande aussi importante si une partie des doses ne peut être livrée à temps ».
Enfin, si, comme on le verra, un scenario sanitaire de prudence conduisait au départ à retenir, en référence à l’expérience de la pandémie H5N1, le principe d’une vaccination à deux doses, une telle hypothèse restait à vérifier au vu des tests cliniques réalisés sur la souche H1N1. On ne pouvait donc écarter que l’économie générale de la vaccination soit affectée dans une proportion majeure s’il s’avérait alors que son efficacité requérait en définitive, soit une posologie supérieure (trois doses), soit au contraire une dose simple. Si le risque d’un besoin supérieur a été considéré, la négociation contractuelle n’a pas accordé suffisamment d’importance à cette hypothèse basse ni cherché à s’en prémunir par des dispositions adéquates.
La conduite des négociations
En tout état de cause, le rapport de force défavorable à l'État l’a amené à mettre au premier plan la sécurité de ses approvisionnements en vaccin en termes de quantités et de délais. De ce fait, la tactique de négociation avait accepté d’emblée de fermer deux autres variables essentielles, le niveau des prix souhaité par les laboratoires comme leur refus d’un marché à clauses conditionnelles, pour mieux écarter la clause scélérate du transfert abusif de responsabilité, et être livré dans le meilleur délai du maximum de doses.
Bien qu’ayant conclu un contrat de réservation de 56 millions de doses avec Sanofi Pasteur par le biais des tranches conditionnelles du marché d’octobre 2005, les pouvoirs publics ne pouvaient attendre des livraisons en provenance de ce producteur qu’à compter de décembre 2009. En effet, Sanofi Pasteur s’était vu refuser, le 9 avril 2009, une AMM pour son vaccin contre le virus A(H5N1) : dès lors, l’obtention d’une AMM, même par une procédure d’urgence, prenait plus de temps que pour les autres vaccins qui bénéficiaient de la procédure dite mock-up. Par ailleurs, Sanofi Pasteur devait partager ses capacités de production, d’une part, entre le vaccin saisonnier et le vaccin pandémique, et, d’autre part, pour ce dernier, entre les divers États.
La situation était un peu plus favorable s’agissant de Novartis. Son vaccin prépandémique ayant obtenu une AMM, il pouvait bénéficier, pour le vaccin pandémique A/H1N1 Focetria, de la procédure accélérée mock-up. Toutefois, il n’était disposé à ne livrer à la France, dans le cadre de l’affermissement de tranches conditionnelles du marché de juillet 2005, qu’une quantité assez modeste de vaccins et à la condition que celle-ci prenne rapidement une commande ferme ; par ailleurs, il est rapidement apparu que les capacités de production de ce laboratoire étaient limitées.
S’agissant de GSK, ce producteur était en position d’arbitre comme le seul à pouvoir répondre aux quantités et délais exigés par la stratégie d’acquisition massive de la France. Celle-ci, à la différence d’autres pays, comme la Grande-Bretagne et l’Allemagne, n’avait pas conclu de contrat de réservation68 auprès de ce laboratoire en vue de bénéficier de livraison de son vaccin adjuvanté pandémique Pandemrix, considéré comme le plus efficace et dont le développement pouvait être lancé dès l’annonce de la pandémie. Comme Novartis, GSK disposait en effet d’une AMM pour son vaccin prépandémique ; dès lors, pour bénéficier de livraisons du futur vaccin, l'État était invité à passer sans tarder une commande ferme.
Enfin, en ce qui concerne Baxter, le laboratoire indiquait, dans une lettre du 15 mai 2009 au DGS : « Baxter répondra en priorité à toute demande des autorités françaises si d’une part, des vaccins s’avéraient être en surplus par rapport à nos engagements contractuels actuels et si d’autre part, des doses de vaccins devenaient disponibles au cas où les contrats en cours de négociation actuellement ne se concrétisent pas en accords de réservation de capacités ». Par la suite, le projet d’une commande de 2 millions de doses fermes et 2 millions conditionnelles du vaccin Celvapan, doté d’une AMM prépandémique, n’a pu se réaliser, le laboratoire ayant des difficultés dans la production de son vaccin ; au total, seules 50 000 doses lui ont été commandées dans le cadre du marché conclu en août 2009.
L’absence de clauses conditionnelles ou de renégociation
Les tranches conditionnelles prévues dans les contrats de commandes ne concernaient que les contrats avec Sanofi Pasteur (28 millions de doses additionnelles) et Novartis (8 millions de doses) et étaient destinées, en cas de pandémie grave, à étendre la couverture vaccinale de deux doses à l'ensemble de la population et/ou à faire face à une deuxième vague de pandémie.
Il n’existe, en revanche, dans les contrats aucune disposition décrivant les conditions économiquement prédéfinies69 dans lesquelles une fraction des 94 millions de doses aurait pu être annulée, soit au vu des caractéristiques cliniques de la pandémie, soit en cas de désajustement entre son cycle et le calendrier de fourniture du vaccin, soit enfin dans le cas d’une posologie définitive ne justifiant qu’une dose. On n’y trouve pas davantage de « clause de renégociation » de nature à faire évoluer le contrat en fonction de la réalité des besoins. Tout au contraire, la proposition faite par GSK le 12 mai de réserver à la France 6,66 % des capacités de production de son site de Dresde ne laissait pas de place à un quelconque aménagement70.
L’argument selon lequel les laboratoires auraient d’emblée écarté de la négociation toute demande d’un dispositif contractuel de repli conditionnel des commandes ne peut guère être reçu dès lors qu’aucune trace écrite du fait qu’une demande ait été sérieusement avancée en ce sens par les pouvoirs publics ne figure ni dans les premiers échanges précédant les lettres d’intention de commande, ni dans celles-ci, ni dans les instructions de négociation adressées à l’EPRUS. Le seul document évoquant la nécessité de « conduire une réflexion (…) au cas où le flux d’utilisation serait plus favorable qu’attendu », notamment par « un non- affermissement des tranches conditionnelles »71 date du début septembre, époque où les contrats étaient déjà conclus.
Sur le fond, l’idée souvent avancée par les pouvoirs publics selon laquelle l’ouverture d’une négociation sur ce point aurait suffi à ce que les fournisseurs privilégient d’autres pays clients au détriment de la France n’entraine pas pleinement la conviction. Même dans l’hypothèse d’un jeu effectif de clauses de repli conditionnel, le volume résiduel des livraisons pouvant être escomptées aurait constitué pour les laboratoires concernés un élément de maximisation des marges totales pouvant être attendues de la campagne de production et de vente internationale des vaccins H1N1, suffisamment significatif pour qu’ils n’y renoncent pas hâtivement. En outre, l’impossibilité invoquée est démentie par l’obtention de clauses de ce type dans les contrats conclus par plusieurs pays étrangers.
Ainsi le président de Baxter France a confirmé à la Cour que le contrat passé par ce laboratoire avec plusieurs pays « prévoyait la réservation d’un pourcentage de la capacité de production de Baxter, une quantité minimale commandée en cas de déclenchement de la pandémie et des quantités additionnelles de commandes déclenchées par tranche par le cocontractant en fonction de la sévérité de l'évolution de la pandémie72 ». Le ministère de la santé espagnol indique pour sa part que les contrats d’acquisition des vaccins qu’il a négociés incluaient des clauses de renégociation permettant de tenir compte des incertitudes notamment sur la population destinataire de la vaccination et le nombre de doses nécessaires et qu’ainsi les acquisitions de doses ont pu, in fine, être ramenées à un volume similaire à celui de la grippe saisonnière73.
L’obtention par la France de telles dispositions de renégociation aurait facilité l’observation concertée des divers facteurs susceptibles de justifier un tel redimensionnement des commandes. Il aurait ainsi permis d’ajuster, sans délais d’inertie excessifs et au bénéfice des deux contractants, les frais variables engagés. En outre, l’obtention de telles clauses de repli partiel aurait sans nul doute donné la possibilité aux pouvoirs publics d’opérer la réduction des commandes qui s’est rapidement révélée indispensable pour un quantum supérieur, dans des conditions progressives ou plus précoce, et avec un bilan financier global nettement plus favorable que ce qu’a permis une tardive réduction unilatérale du montant des contrats (voir infra, point 3).
En même temps qu’ils s’assuraient des commandes fermes, les producteurs ont obtenu de ne prendre aucun engagement sur les délais de livraison, ne consentant à ne faire apparaître dans les contrats que des calendriers purement indicatifs. L’absence de pénalités de retard était la conséquence logique de cette position.
c. Une négociation soumise à des contraintes inégalement justifiées
Outre les quantités, les prix et les acomptes qui en constituaient les principales variables économiques, les contrats d’acquisitions ont conduit notamment à préciser le mode de conditionnement des produits, certaines de leurs caractéristiques sanitaires (présence ou non d’adjuvant), la responsabilité encourue par les fournisseurs et les garanties en cas d’absence d’AMM. Les négociations paraissent avoir été conduites avec une inégale vigueur dans ces différents domaines.
Un mode de conditionnement en multidoses majoritairement imposé par les fabricants au nom de l’urgence
L’arbitrage fait en faveur des objectifs de fourniture massive et rapide des vaccins a conduit les pouvoirs publics à n’introduire a priori qu’un minimum de spécifications concernant leur mode de conditionnement. Aucune indication à cet égard ne figure d’ailleurs dans les instructions initiales adressées aux négociateurs. Cette situation a permis aux laboratoires de privilégier massivement des conditionnements en doses nombreuses, en invoquant d’ailleurs des contraintes techniques que la réalisation des contrats n’a pas vérifiées dans tous les cas. Cette contrainte imposée par les fabricants en faveur des conditionnements en multidoses s’est avérée pourtant pénalisante en termes de gaspillage de doses dans les centres de vaccination et de difficulté d’utilisation des stocks restant hors d’un cadre collectif.
Lors de leurs auditions du 28 avril 2010 devant la commission d’enquête de l'Assemblée nationale, les dirigeant de GSK, Sanofi Pasteur et Novartis ont été interrogés sur les raisons pour lesquelles les livraisons avaient été faites de manière prépondérante en multidoses, ce mode étant approprié à la vaccination dans les centres et, sans doute, convenant beaucoup moins à la vaccination en cabinet médical, sauf à prendre des mesures exceptionnelles d’organisation, telles que des séances collectives.
Toute la production du vaccin Pandemrix de GSK a été fournie en multidoses. En premier lieu, le président de GSK France a indiqué que le dossier réglementaire de vaccin prototype A/H5N1 en vue de l’AMM portait sur un vaccin multidoses et qu’à plusieurs reprises, les autorités françaises avaient interrogé le laboratoire sur la possibilité de constituer un dossier de vaccin monodose. Celui-ci avait répondu que, ce faisant, GSK risquait de perdre l’avantage procuré par un dossier réglementaire déjà déposé et approuvé. En second lieu, selon le dirigeant de GSK, le principal goulet d’étranglement de la fabrication du vaccin n’est pas la production de l’antigène, mais le remplissage des flacons. Il a précisé que pour l’heure, l’industrie pharmaceutique n’avait pas, à l’échelle mondiale, les capacités de remplissage suffisantes pour que, en cas de pandémie, le vaccin soit mis à la disposition des populations sous la forme d’un produit fini dans des délais suffisamment rapides pour assurer leur protection.
En ce qui concerne Sanofi Pasteur, la lettre d’intention de commande du 3 juin 2009, indiquait que le marché en préparation prévoyait la fourniture du vaccin en flacons multidoses (10 doses) mais que le ministère souhaitait disposer de vaccins présentés en flacons monodoses. Au titre de l'avenant de juillet 2009, 300 000 vaccins monodoses ont été livrés lors de la semaine du 9 novembre 2009 pour le même prix unitaire de 6,25 € HT que celui des multidoses. Le président de Sanofi Pasteur a, lors de son audition, mis également l’accent sur la capacité de production, en soutenant que le conditionnement en flacons multidoses s’imposait afin de mettre à disposition au plus vite la plus grande quantité possible d’un vaccin. Il a précisé par ailleurs que le conditionnement en monodoses entrainerait un prix unitaire plus élevé.
S'agissant de Novartis, l’avenant de juillet 2009 prévoyait la livraison d’au plus 10 % des vaccins en monodoses. Sans qu’une demande ait été formellement adressée par les pouvoirs publics au laboratoire, ce ratio a pu être considérablement augmenté puisque, dans le cadre d’un avenant conclu en octobre 2009 en vertu duquel la part des monodoses serait d’au moins 10 %, Novartis a fourni sans augmentation de prix à partir de la semaine du 9 novembre la majeure partie de sa production livrée (9 millions de doses), soit en monodoses conditionnées en boîtes de 10 (5 millions de doses), soit en doses isolées (près de 900 000), les seules alors adaptées, pour des raisons de réglementation pharmaceutique, à une utilisation en cabinet médical jusqu’à ce que l’obstacle réglementaire soit levé en janvier 2010.
Deux raisons, qui ressortent peu ou prou de l’audition du directeur général de Novartis Vaccins et diagnostics, expliquent la production relativement abondante de monodoses. D’une part, le prix unitaire, plus élevé que celui des autres vaccins (voir infra) a pu permettre au laboratoire de porter ses livraisons en majorité sur les monodoses, plus coûteuses en termes de fabrication, d’autre part, il a pu mettre à profit les réorganisations de certaines de ses chaînes de production pour satisfaire les attentes des pouvoirs publics français mais n’aurait pas été en mesure de répondre à des demandes plus massives de monodoses qui auraient émané d’autres pays.
Le particularisme de l’offre de Novartis suggère que la fourniture de vaccins conditionnés en monodoses n’était pas inaccessible industriellement dès lors que les laboratoires auraient déposé un dossier en ce sens. Il resterait néanmoins à établir de manière objective quel écart de coût réel ce choix aurait été susceptible d’induire. Celui-ci mériterait au demeurant d’être rapproché du gaspillage massif auquel le recours au conditionnement multidoses pourrait avoir contribué (voir infra).
La question des vaccins avec adjuvant
Trois sortes de vaccins coexistent :
- à titre spécifique, le vaccin Celvapan de Baxter qui, développé sur cultures cellulaires et non sur des œufs, est recommandé en cas d’allergie aux protéines aviaires ; son emploi a été réservé aux opérations de vaccination effectuées à l’hôpital ;
- à titre majoritaire, les vaccins adjuvantés (Pandemrix de GSK et Focetria de Novartis) ;
- le vaccin non adjuvanté Panenza de Sanofi Pasteur.
Les adjuvants
(D’après la fiche « Les adjuvants dans les vaccins pandémiques H1N1 », AFSSaPS, octobre 2009)
Depuis plus de 30 ans, de nombreux vaccins comportent dans leur composition des substances dénommées adjuvants, dont l’ajout permet d’augmenter de façon spécifique la réponse immunitaire pour une même dose d’antigène vaccinal. Toutes choses égales par ailleurs, on peut donc produire davantage de doses à partir d’une même quantité d’antigène. Outre cet apport quantitatif, l’adjuvant peut aussi s’avérer utile en cas de mutation du virus, car il peut favoriser une efficacité immunitaire plus large, c'est-à-dire en assurant un certain degré de protection vaccinale face à une souche virale modifiée.
Les diverses études scientifiques qui ont été conduites en Europe et dans le monde, n’ont pas permis d’établir un lien entre l’utilisation de vaccins avec adjuvants et l’apparition de perturbations du système immunitaire aux conséquences graves dans la période suivant la vaccination. Il existe déjà un vaccin contre la grippe saisonnière contenant un adjuvant à base de squalène, autorisé depuis 2001 en France et qui a déjà été utilisé très largement (environ 45 millions de doses), notamment en Europe. Le Focetria de Novartis et le Pandemrix de GSK ont le squalène pour adjuvant.
Le 22 juin 2009, le Haut conseil de la santé publique (HCSP) a appelé l’attention sur les limites à l’utilisation de vaccins contenant des adjuvants. Il a en effet indiqué que « concernant les adjuvants de type émulsion lipidique, il est impératif d’insister sur l’absence de données de tolérance à long terme lors de l’utilisation de cette classe d’adjuvant, notamment en cas de vaccination de masse. La perspective d’utiliser dans ces conditions un vaccin contenant un adjuvant stimulant fortement l’immunité chez des sujets dont le système immunitaire est en pleine maturation ou modifié n’est pas sans soulever de nombreuses questions et doit être étudiée ».
Le HCSP a précisé ultérieurement sa position. Alors que, selon son avis rendu le 8 juillet 2009 sur la pertinence de l’utilisation d’un vaccin monovalent, sans adjuvant, dirigé contre le virus grippal H1N1, la stratégie la plus efficiente est la vaccination précoce des enfants, il est relevé qu’une « stratégie utilisant des vaccins pandémiques sans adjuvant pourrait être privilégiée si ces vaccins pouvaient être mis à disposition et utilisés plus rapidement que les autres ». Un raisonnement analogue a été tenu à propos des femmes enceintes. Selon les avis des 2 et 28 octobre 2009, il conviendrait que la vaccination des femmes enceintes à partir du deuxième trimestre de grossesse puisse débuter dès la mise à disposition du vaccin fragmenté sans adjuvant dès lors qu’il aura été enregistré par les agences compétentes.
Or, le 25 octobre 2009, Sanofi Pasteur a proposé de remplacer 12,1 millions de doses de vaccin adjuvanté par du vaccin non adjuvanté. Cette proposition a été acceptée du fait notamment des doutes sur la date d'obtention de l'AMM du vaccin adjuvanté (l’AMM de l’Humenza n’a effectivement été accordée qu’en février 2010). Le vaccin non adjuvanté (Panenza) a obtenu le 16 novembre 2009 une AMM émanant de l’AFSSaPS.
Dans son avis du 27 novembre 2009, le HCSP en a recommandé l’utilisation aux enfants de 6 mois à 8 ans, à raison de deux doses et a indiqué que « dans un contexte pandémique, il ressort de l’évaluation que ce vaccin sans adjuvant peut être administré chez la femme enceinte quel que soit le trimestre de la grossesse ».
On notera, par ailleurs, qu’au cours des négociations de départ, les pouvoirs publics ont voulu croire que le conditionnement séparé de l’adjuvant livré par GSK et sa durée de validité plus longue que celle de l’antigène pourraient constituer, dans la mesure de la proportion réputée élevée de la valeur de l’adjuvant dans le prix total (6 € sur 7), une certaine garantie économique de réutilisation dans le cas, qui s’est bien présenté, où les commandes seraient excédentaires. Cet argument a même été avancé dans une note adressée le 26 mai 2009 par le DGS au ministre chargé de la santé74 et dans la lettre du 6 juillet précitée par laquelle le directeur de cabinet a donné ses instructions au directeur général de l’EPRUS en vue d’entamer les dernières négociations avant la signature des marchés. Il a encore été repris dans un compte-rendu de réunion au cabinet le 2 septembre. En pratique, l’avantage escompté s’avère peu évident (voir infra).
Des clauses d’irresponsabilité s’écartant du droit commun
Lors de la négociation avec GSK, il est apparu que ce laboratoire voulait que l'État le couvre totalement de sa responsabilité, y compris en cas de produit défectueux, c’est-à-dire ne répondant pas à ce que l’on attend d’un tel produit, en particulier en cas de faible effet antigénique, caractéristique du produit. Une analyse juridique de la proposition de contrat faite le 28 juin 2009 par l’AFSSaPS à l’attention du ministre chargé de la santé a montré qu’une telle couverture par l'État n’était pas permise par les textes. En premier lieu, les articles 1386-1 à 1386-18 du Code civil, qui définissent le régime de droit commun de la responsabilité du producteur, indiquent que ce dernier (y compris lorsqu’il produit des vaccins) est responsable du fait des produits défectueux. Les causes d’exonérations sont limitativement énumérées : entre autres, un mauvais stockage après livraison ou le « risque de développement » quand l'état des connaissances scientifiques et techniques, au moment où le produit a été mis en circulation, n'a pas permis de déceler l'existence du défaut. En second lieu, si la responsabilité du producteur est plus étroitement définie en cas de menace sanitaire grave appelant des mesures d'urgence, notamment en cas de menace d'épidémie (article L. 3131-1 du CSP), elle n’est cependant pas écartée. En effet, en pareille circonstance, l'article L. 3131-3 du CSP prévoit que le fabricant d'un médicament ne peut être tenu pour responsable des dommages résultant de l'utilisation d'un médicament en dehors des indications thérapeutiques ou des conditions normales d'utilisation prévues par son AMM ou bien de l’utilisation d’un médicament sans AMM recommandée ou exigée par le ministre de la santé en application de l'article L. 3131-1. Pour autant, même dans cette situation, les fabricants ne sont pas exonérés « de l'engagement de leur responsabilité dans les conditions de droit commun en raison de la fabrication (…) du médicament ».
Sur l’insistance des pouvoirs publics, la clause d’irresponsabilité voulue initialement par GSK a été retirée. En définitive, dans le contexte du rapport de forces décrit ci-dessus, une clause de compromis, a été insérée, de manière identique pour l’essentiel, dans tous les contrats :
« L'administration déclare que l’utilisation des vaccins du titulaire, objet du présent marché, ne se fera qu’en cas de situation épidémiologique le nécessitant. Dans ces conditions, les opérations de vaccination de la population seront décidées par la seule administration et seront placées sous la responsabilité de l'État.
Dans ce cadre, le titulaire est, en principe, responsable du fait des produits défectueux.
Toutefois, considérant les circonstances exceptionnelles qui caractérisent l'objet du présent marché, l'État s’engage à garantir le titulaire contre les conséquences de toute réclamation ou action judiciaire qui pourraient être élevées à l’encontre de ce dernier dans le cadre des opérations de vaccination sauf en cas de faute du titulaire ou sauf en cas de livraison d’un produit non conforme aux spécifications décrites dans l’autorisation de mise sur le marché ou, à défaut d’autorisation de mise sur le marché, aux caractéristiques du produit telles qu’elles figurent dans le dossier d’autorisation de mise sur le marché dans l’état où il se trouvait au moment de chaque livraison ».
Le contexte général de la vaccination étant retracé, la clause rappelle, dans un premier temps, le principe de la responsabilité des laboratoires pour produit défectueux. Mais c’est pour l’écarter aussitôt, du moins à titre général, compte tenu des circonstances exceptionnelles (les conditions de développement et d’autorisation des vaccins). Cette immunité des laboratoires est cependant exclue dans le cas de la faute du titulaire et, ce qui résulte de la volonté des pouvoirs publics, en cas de livraison d’un produit non conforme aux spécifications de l’AMM (ou, le cas échéant du dossier constitué à cet effet, si des circonstances exceptionnelles avaient conduit à vacciner sans attendre l’AMM).
Il est à noter qu’une clause de nature assez voisine avait déjà été introduite, dans des conditions d’une régularité d’ailleurs douteuse, dans les marchés conclus en 2005 avec Novartis75 et Sanofi Pasteur76.
Ce dispositif complexe conduit à ce que « si les vaccins sont conformes aux spécifications contenue dans l’autorisation de mise sur le marché et que des effets secondaires apparaissent néanmoins, la responsabilité en incombe alors à l'État et non aux laboratoires »77. Par rapport au droit commun, il revenait donc à obliger l’Etat à apporter la preuve de la faute. Cette dérogation aurait pu s’avérer lourde de conséquences dans l’hypothèse d’effets indésirables graves ou massifs dont l’origine aurait pu donner lieu à d’infinies contestations. De fait, cette situation ne s’est heureusement pas présentée.
La recherche de garanties en cas d’absence d’AMM
Bien que d’une portée réduite, les dispositions visant à garantir au moins partiellement les pouvoirs publics vis-à-vis du risque de l’achat d’un vaccin n’obtenant pas l’AMM sont parmi les rares mesures78 par lesquelles ceux-ci ont tenté de rééquilibrer quelque peu les contrats.
Dès les premiers échanges avec les laboratoires en mai 2009, les pouvoirs publics ont mis l’accent sur leur volonté de conditionner la réception et le paiement à l’obtention de l’AMM (tout en réservant cependant l’hypothèse où ils auraient pu être amenés à prendre la responsabilité de vacciner avec des produits dont l’AMM n’aurait pas encore été accordée). Ayant pris connaissance de cette exigence, le président de GSK a informé le directeur de cabinet par lettre du 15 mai 2009 que « les autres États ayant commandé le vaccin A/H1N1 Swine Lineage – ou confirmé leur intention de le faire – demandent à être livrés dès production, indépendamment de l’obtention d’une autorisation de mise sur le marché ».
Dans sa lettre du 3 juillet au Premier ministre, le ministre chargé de la santé indiquait, s’agissant de l'AMM que « du fait de la virulence modérée du virus, il est probable que l'analyse du bénéfice/risque poussera les autorités sanitaires à ne proposer le vaccin en population générale que si toutes les garanties en matière de sécurité et de qualité du produit sont réunies. Cela passe par l'obtention d'une AMM pleine et entière. Par conséquent, un vaccin acquis sans garantie d'obtention de cette AMM présenterait, a minima, le risque financier de son coût d'acquisition. Afin de limiter ce risque financier, la question se pose de vouloir lier, dans le contrat, la livraison et le paiement des doses à l'obtention préalable des AMM. Ceci permettrait de faire porter sur l'industriel le risque financier d'un échec dans le processus d'obtention de l'AMM. A notre connaissance, la France est cependant le seul pays à avoir demandé une telle clause. Cette exigence fragilise aujourd'hui nos discussions contractuelles, dans un marché où la demande est supérieure à 1'offre, et risque de nous mettre dans une situation où les industriels concernés retarderont le calendrier des livraisons destinées à la France. Il peut donc être envisagé de céder sur tout ou partie de cette exigence. Deux solutions « dégradées» sont envisageables :
- transformer la clause en une disposition visant à obtenir le remboursement total ou partiel du produit, si l'AMM n'est pas obtenu dans un certain délai;
- chercher à obtenir la livraison gratuite d'antigène H5Nl si l'AMM sur le vaccin HINl n'est pas obtenue (solution proposée par GSK), l'adjuvant d'une durée de vie de 5 ans restant acquis ».
Ces orientations, déjà mentionnées dans les instructions données en mai et juin par le directeur de cabinet au directeur général de l’EPRUS en vue de l’ouverture de négociations avec chaque laboratoire, ont été reprises et développées dans la lettre du 8 juillet 2009 par laquelle des instructions étaient à nouveau données pour la phase finale des négociations en vue de la conclusion des marchés.
Les contrats avec Sanofi Pasteur et Novartis ont prévu que l’EPRUS conditionne le paiement des 20 % restants à l’obtention de l’AMM79 . Il en a été de même pour le marché avec Baxter. Cette clause, qui revenait à faire une sorte de retenue de garantie sur les paiements successifs, procurait, en revanche, un avantage de trésorerie appréciable une fois l’AMM obtenue.
GSK, pour sa part, a préféré une clause selon laquelle, en cas de non-obtention de l’AMM, il livrerait des doses de vaccin contre le virus A/H5N1 pour lequel il disposait déjà d’une autorisation. L’intérêt de cette « compensation » paraît des plus réduits pour les pouvoirs publics si l’on considère que, au titre de la tranche ferme du marché initial de 2005, l’EPRUS disposait déjà de près de 1,2 million de doses de vaccin contre le virus A/H5N1.
Une clause du marché Baxter liée à un autre contrat conclu avec ce même laboratoire
Le contrat de fourniture de vaccin H1N1 passé avec Baxter, a prévu que le laboratoire livre 50 000 doses pour la fin 2009, dont 12 000 doses avant la fin août, et qu’« en contrepartie, l’EPRUS s’engage à acquérir les 150 000 doses de vaccins NEISVAC [vaccin contre le méningocoque] conformément aux termes du marché n° EPRUS/08-15 pour livraison et réception desdits vaccins au plus tard le l5 décembre 2009 »80. Cette clause conduisait à accélérer la transformation d’une réservation de 150 000 doses en commande ferme (mesure représentant un coût de 2,5 M€ environ).
Dans une demande d’arbitrage adressée au cabinet du Président de la République le 31 juillet 2009, le directeur de cabinet du ministre chargé de la santé soulignait à propos de la « contrepartie » ainsi exigée par le laboratoire qu’il était « peu probable » que l’on ait « l’usage de ces doses, car le stock actuellement disponible est suffisant au regard des enjeux », et proposait en conséquence, « de ne pas donner suite à la proposition de Baxter ». Une note du 7 août suivant indiquait néanmoins que « suite à vos instructions » [du cabinet du président de la République], un contrat était signé incluant « la livraison de 150 000 doses de vaccin contre la méningite C ». Selon l’EPRUS, cela n’était pas sans avantage en termes de sécurité sanitaire, en garantissant que la reconstitution du stock stratégique antiméningococcique ne soit pas entravée par la mobilisation des chaines de fabrication du laboratoire par les urgences liées à la pandémie H1N1. Pour autant, et à supposer que l’avantage obtenu soit à la mesure du surcoût économique consenti, il ne semble guère de bonne méthode de susciter l’impression d’un « marchandage » en liant deux fournitures ayant un objet absolument différent. C’est d’ailleurs une pratique qui aurait été formellement proscrite dans un contrat passé selon le code des marchés publics.
d. Un régime particulier en matière de prix et de financement
Les prix
Il convient de distinguer les prix unitaires des avenants aux marchés conclus en 2005 avec Sanofi Pasteur et Novartis et ceux des marchés passés en 2009 avec GSK et Baxter81.
Le prix dans l'avenant du marché Sanofi Pasteur (6,25 € HT) est inférieur à celui du marché conclu après négociation en 2005 (7 € HT) et il est du même ordre de grandeur que celui du vaccin saisonnier vendu en France.
Celui de l'avenant du marché Novartis (9,34 € HT) est légèrement inférieur à celui du marché initial (9,44 € HT prévu pour les tranches conditionnelles, le prix unitaire de la tranche ferme étant alors de 9,9 € HT), l’écart pouvant s’expliquer par le fait que l'avenant ne prévoit pas, à la différence du marché initial, de prestations de stockage et de destruction des vaccins périmés. Le marché initial avait été attribué à Chiron Vaccine (devenu ultérieurement Novartis) à l’issue d’un appel d'offres ouvert où il était en compétition avec Sanofi Pasteur. L’offre de ce dernier laboratoire n’ayant pas répondu aux exigences du cahier des charges, seule celle de Chiron est restée en lice, avec le prix tel que demandé, bien que très supérieur à celui finalement obtenu de Sanofi Pasteur après négociation. Lors de son audition du 28 avril 2010 devant la commission d’enquête de l'Assemblée nationale, le directeur de Novartis a pu ainsi rappeler, à juste titre, que les prix du marché initial résultaient de l’acceptation par la DGS de l’offre du laboratoire à l’issue de la procédure d’appel d'offres qui n’en permettait pas la négociation. L’absence de raisons économiques connues à un tel niveau de prix aurait donc dû conduire à ne pas faire remobiliser un contrat aussi défavorable pour faire face aux besoins de 2009, à moins qu’il puisse être établi que cet écart trouvait une justification objective, au moins partielle, dans le fait que le laboratoire fournirait une part majoritaire de sa production sous forme de monodoses, censées être plus coûteuses.
Sur ce point, l’EPRUS fait valoir que le choix de procéder à l’égard de Sanofi Pasteur et Novartis par des avenants plutôt que par une nouvelle négociation a tenu aux « impératifs opérationnels liés à l’adaptation rapide des marchés […] plutôt qu’aux considérations économiques préexistantes au regard des références tarifaires » et que, dès lors, les règles applicables à une procédure d’avenant interdisaient, dans chacun des cas, de « bouleverser l’économie du marché » de départ. La justification ainsi donnée confirme, qu’en l’espèce, le sentiment de l’urgence l’a emporté dans le choix des pouvoirs publics sur le souci de l’optimisation économique.
S’agissant des nouveaux contrats, il n’y a pas lieu de s’arrêter sur le prix unitaire du vaccin Baxter en raison du faible nombre de doses commandées et du caractère plausible d’une explication fondée sur la technique particulière de son développement. Il est, en revanche, particulièrement utile de porter une appréciation sur le prix unitaire de 7 € HT du marché GSK compte tenu du nombre important de doses commandées (50 millions). Ce prix, s’il est supérieur à celui des vaccins saisonniers vendus en France – lesquels sont, à une exception près, les moins chers d’Europe – est inférieur à celui de la moyenne des vaccins saisonniers vendus en Europe. Il est identique quel que soit les États acheteurs, le prix n’ayant pas été utilisé comme critère de répartition des commandes entre les demandeurs. En particulier, lors de l'établissement des contrats de réservation en 2006, la Grande-Bretagne a payé en livres l’équivalent de 7 € compte tenu de la parité £/€ de cette époque, ce prix intégrant un droit de réservation de 1,5 € HT (voir infra).
Il existe cependant des écarts importants entre les vaccins au regard de leur prix rapporté à la quantité d’antigène. On remarquera, en outre, que le prix global de 9,34 € du vaccin Focetria de Novartis qui ne distingue pas les parts de l’antigène et de l’adjuvant, est très supérieur à celui du Pandemrix de GSK, sans que l’on puisse vérifier que sa teneur plus élevée en antigène (7,5 µg) suffit à l’expliquer. Ceci souligne l’absence d’information objective sur les coûts et la formation des prix.
Tableau n° 8 : Comparaison des prix unitaires de l’antigène
vaccin |
laboratoire |
caractéristiques |
antigène/dose |
prix dose |
px/µg antigène |
Panenza |
Sanofi Pasteur |
non adjuvanté |
15 µg |
6,25 € |
0,42 € |
Pandemrix |
GSK |
adjuvanté |
3,75 µg |
1,00 € antigène seul* |
0,27 € |
Source : Cour des Comptes - * Pour un prix total de 7 €.
Au total, s’il n’apparait pas de façon manifeste que les laboratoires aient utilisé l’excès de la demande sur l’offre suscité par la crainte de la pandémie pour en tirer avantage en matière de prix, on peut s’interroger sur le recours fait par les pouvoirs publics au contrat antérieur avec Novartis dont les prix, non négociés, semblaient pénalisants même au vu d’un mode de conditionnement monodose.
S’agissant des autres contrats, en l’absence de tous éléments objectifs sur la formation des coûts unitaires, des charges fixes et variables et leur évolution en fonction des quantités produites, il n’est pas possible d’évaluer si, dans la circonstance d’une commande aussi massive, l’alignement approximatif sur les prix de marchés antérieurs ou des vaccins de la grippe saisonnière est économiquement justifié ou ne s’assortit pas pour les fournisseurs d’un effet de marge excessif.
Il en va de même de la part singulièrement élevée attribuée à l’adjuvant dans le prix prévu par le contrat GSK (6 € sur 7), qui, si elle avait été justifiée, aurait dû conduire à s’interroger sur le prix des produits non adjuvantés. Sanofi-Pasteur avait pour sa part contracté avec un prix unique que le vaccin soit adjuvanté ou pas et s’en est tenu à ce prix de départ lorsqu’il a orienté sa production vers un produit sans adjuvant.
Enfin, en ce qui concerne les deux marchés à tranches conditionnelles, il peut être également observé qu’il n’y a pas de dégressivité du prix en fonction des quantités commandées, ni dans le mécanisme conditionnel initial82, ni dans sa réactivation en 2009, procédure qui porte sur des quantités fort élevées par rapport aux tranches fermes initiales ; il est vrai, sur ce dernier point, que l’on ne connaît pas le montant des coûts à engager pour la production du nouveau vaccin pandémique.
Le paradoxe est donc que le recours à une procédure échappant à l’appel d’offres ouvrait toute possibilité d’une négociation se fondant sur des arguments économiques objectivement établis. Les circonstances ont fait que les pouvoirs publics n’ont ni exploité cette faculté, ni considéré qu’ils disposaient d’une véritable possibilité de négocier et que les prix, comme la plupart des autres éléments du contrat, ont été acceptés au seul vu de données comparatives apparemment rassurantes. Dans le cas du contrat le plus important, cette variable essentielle n’a pas même pu être mise en discussion contractuelle, l’autorité ministérielle ayant elle-même arbitré d’emblée en faveur du niveau du prix de départ avancé par le fournisseur. Cette décision préalable ne pouvait qu’encourager les autres prix à s’aligner sur les références préexistantes.
Des avances ou acomptes en définitive coûteux pour l’Etat
Les clauses relatives aux contrats conclus avec GSK, Sanofi Pasteur et Novartis comportent des dispositions qui, indépendamment de leur dénomination, ont le caractère d’avances au sens du code des marchés publics83.
Le cas de GSK
Dans sa lettre du 14 mai 2009 au président de GSK, le directeur de cabinet du ministre chargé de la santé a confirmé l’intention du Gouvernement français de procéder à la commande de 50 millions de doses de vaccin adjuvanté contre le nouveau virus H1N1 et a convenu que cette commande devait faire l’objet d’une réservation immédiate dont le coût serait facturé par GSK à raison de 1,5 € HT par dose de vaccin, soit 21,4 % du prix unitaire et la somme totale de 75 M€ HT.
Outre que cette lettre acceptait d’emblée le prix par dose de 7 € HT, elle indiquait que le montant versé à la réservation, soit la somme de 75 M€ HT, serait déduit du montant total de la commande et que la commande ferme serait subordonnée à la mise à disposition de la souche appropriée par l’OMS et qu’en l’absence de celle-ci, l’acompte de réservation sera restitué84.
Ce dispositif dérive du système de réservation que GSK avait déjà mis en place avec d’autres États ainsi que l’a indiqué le président de ce laboratoire lors de son audition, le 28 avril 2010, devant la commission d’enquête de l’Assemblée nationale. Il a été intégré dans le marché du 10 juillet 2009 en y prenant la valeur d’une avance au sens du code des marchés publics, c’est-à-dire d’un versement précédant le commencement d’exécution et visant à financer le lancement de la production.
L’article 5 de l’annexe B « conditions spécifiques » de ce contrat porte sur la facturation. Il y est indiqué qu’à la signature du marché, GSK facturera à l'EPRUS la somme de 75 M€ HT, correspondant à un acompte de 1,5 € HT par dose de vaccin et qu’après chaque livraison, GSK facturera à l'EPRUS le montant de la commande restant, soit 275 M€ HT hors taxes, au prorata des quantités livrées de vaccin. Il peut être observé que le contrat ne définit pas de manière précise le remboursement de l’avance ainsi consentie, alors que, même dans le cadre de l’article 3-7°, il aurait été protecteur de s’inspirer sur ce point des règles de bonne gestion fixées par le code des marchés publics.
L’avance a été réglée le 2 septembre 2009 pour son montant intégral et, dans le silence du contrat, a été traitée comme devant se résorber sur la durée de l'exécution du marché, GSK déduisant de ses factures 1,5 € par dose, ce qui aurait rendu inapplicable la règle selon laquelle le remboursement de l’avance doit se terminer lorsque 80 % des prestations sont effectuées. Tout au contraire, l’avance n’était récupérée qu’à hauteur de 13,2 M€ (soit 17,6 % seulement du montant initial) lorsque l’EPRUS a pris la décision de réduire les commandes de plus de 64 %. En pratique, 9,2 millions de doses dont le paiement n’avait pas encore été effectué ont été réglées en s’imputant sur l’avance restante.
Au total, l’avance moyenne de trésorerie consentie à GSK de manière permanente entre début septembre 2009 et janvier 2010 s’élève à quelque 68,4 M€. A l’inverse, le laboratoire avait dû assurer son préfinancement pendant les deux mois précédant le versement effectif de l’avance début septembre et l’indemnité de résiliation partielle n’a été réglée que début juin 2010.
Quoi qu’il en soit, pour l’Etat cette avance permanente a représenté ex post nettement plus de la moitié du montant des livraisons effectives. C’est l’une des conséquences financières du surdimensionnement constaté de la commande initiale et de l’absence de clauses conditionnelles de repli.
Les cas de Sanofi Pasteur et Novartis
Les deux avenants aux marchés de 2005 ont prévu que des versements substantiels interviendraient dès la conclusion des contrats, ce que ne prévoyaient pas les marchés initiaux qui s’en tenaient aux 5 % usuels du code des marchés publics. L’avenant conclu avec Sanofi Pasteur pour un total de 175 M€ a ainsi mis en place un mode de paiement plutôt généreux :
- 30 % à la notification de l’avenant, payé le 7 août 2009 à hauteur de 52,5 M€ ;
- 10 % au démarrage de la première étude clinique, payé le 10 septembre 2009 pour 17,5 M€ ;
- 20 % lors de l’obtention de l’AMM.
En conséquence, le contrat prévoyait que les paiements au titre de chaque livraison ne portent que sur 40 % du prix de celle-ci. Pour cet avenant à un marché conclu conformément au code des marchés publics, l’octroi d’une avance dépassant 30 % aurait dû donner lieu à la constitution d’une garantie.
En pratique, le taux de 20 % exigible après AMM a été appliqué, à juste titre, non pas à la totalité de la commande ferme (28 millions de doses), mais aux 13,5 millions de doses de Panenza que le laboratoire prévoyait alors de fournir et pour lesquelles il avait obtenu l’AMM le 16 novembre 2009, tandis que l’autorisation pour le produit adjuvanté restait en souffrance.
Comme pour le contrat avec GSK, une part importante des commandes (12,3 millions de doses, soit 78 M€) a été réglée par imputation sur l’avance restante lors de l’interruption unilatérale du contrat. Le profil complexe des avances successives et des imputations conduit à un niveau moyen de trésorerie accordé à Sanofi Pasteur dépassant 65 M€, soit plus de 60 % du coût global ex post des livraisons effectives.
L’avenant conclu avec Novartis pour un total de 149,44 M€ a pour sa part prévu des versements à hauteur de :
- 20 % à la notification de l'avenant : 29,9 M€ ont été payés le 28 août 2009 ;
- 20 % au démarrage de la première étude clinique, 29,9 M€ payés le 29 septembre 2009 ;
- 20 % à titre de dernier paiement, sous la condition que l’AMM ait été obtenue85.
Ce dispositif ayant conduit globalement à un montant de 40 % versé avant les livraisons aurait justifié, comme le contrat de Sanofi Pasteur, la constitution d’un dépôt de garantie. Lors de l’interruption du contrat, un montant de 38,6 M€ n’avait pas été remboursé, le volume moyen global de trésorerie avancé à la société sur toute la période avoisinant 48 M€, soit 57 % ex post du coût des livraisons effectives.
Au total, il apparaît que le système d’avances consenti aux trois principaux contractants a été bâti en méconnaissance, soit des règles applicables aux avances supérieures à 30 % pour les deux contrats relevant du code des marchés publics (Sanofi Pasteur et Novartis), soit du principe de fixation contractuelle des modalités de remboursement qu’il aurait été de bonne gestion d’introduire dans un contrat de l’importance de celui de GSK, même si celui-ci était conclu selon la procédure d’exception.
De surcroît, le montant relatif des avances s’est trouvé de fait considérablement augmenté par la réduction postérieure des livraisons, jusqu’à représenter une part de celle-ci largement supérieure à la moitié.
Un risque additionnel a pu, en revanche, être évité. En effet, des factures en souffrance lors de l’interruption du contrat ont pu être imputées en résorption de l’ensemble des avances non encore remboursées. La situation contraire aurait pu conduire à ce que ce remboursement soit différé jusqu’à fixation et versement des indemnités définitives.
3. L’exécution et la renégociation des contrats relatifs aux vaccins
L'exécution des marchés de vaccins a d’abord été marquée, globalement, par le retard dans la production de ceux-ci du fait d’un rendement antigénique particulièrement faible. Mais ce problème, qui aurait pu constituer une difficulté majeure si la population, sous l’effet d’une pandémie réellement grave, avait demandé à bénéficier de la vaccination, s’est vite effacé devant celui de l’excédent des vaccins au regard des besoins effectifs. Si nombre d’éléments pouvaient inciter dès le début de septembre 2009 à revoir le cas échéant à la baisse les grandeurs et encore redimensionner les modalités du système de vaccination, les informations épidémiologiques alors reçues de la zone australe sur le taux d’attaque du virus et de possibles formes pulmonaires fulminantes de la grippe ont alors conduit le ministère de la santé à écarter cette option.
Quoi qu’il en soit, la disproportion entre les commandes initiales et les besoins réels a été manifestement confirmée vers la fin novembre 2009. Ce n’est cependant qu’en début d’année suivante qu’est intervenue la décision de réduire les commandes de plus de la moitié (50 millions de dose sur les 94 millions commandées). Cette résiliation partielle impliquait une indemnisation : celle-ci a pu se faire par transaction avec Novartis. Elle s’est traduite par une décision unilatérale d’indemnisation pour les deux autres laboratoires concernés, GSK et Sanofi Pasteur : ce dernier laboratoire a pris acte de l’indemnisation ; jusqu’à la fin du mois d’août, GSK était encore en mesure de faire un recours devant le juge administratif.
Un écart croissant entre le niveau des commandes et des livraisons et le rythme observé et attendu des vaccinations
Des commandes d’abord tardives puis surabondantes
Deux incertitudes pesaient sur la mise à disposition de vaccins en temps utile : l’obtention des autorisations de mise sur le marché et un rendement antigénique satisfaisant.
Les AMM ont été accordées sans retard : le 29 septembre 2009, la Commission européenne, suite aux avis de l’EMEA, a autorisé le vaccin de GSK (Pandemrix) et celui de Novartis (Focetria) selon la procédure dite mock-up ; le 6 octobre, elle a délivré son autorisation pour le vaccin de Baxter ; 16 novembre, l’AFSSaPS a accordé l’AMM pour le vaccin non adjuvanté de Sanofi Pasteur (Panenza).
En revanche, les trois laboratoires ont précocement signalé à l’EPRUS des rendements antigéniques très inférieurs à leurs estimations. Ainsi, fin octobre, 4 millions de doses de Pandemrix avaient été livrées, alors que le contrat avec GSK indiquait – certes, à titre purement indicatif – que dans l’hypothèse la plus défavorable quant au rendement antigénique, près de 5 millions de doses seraient disponibles à ce moment. Novartis avait annoncé, également dans l’hypothèse d’un rendement de 30 % de celui observé en moyenne pour le développement des vaccins saisonniers, la livraison de 1,5 million de doses en octobre : ce montant ne sera atteint que vers la mi novembre. En revanche, Sanofi Pasteur, qui ne s’était engagé à livrer son vaccin qu’à compter de début décembre 2009, a été en mesure de commencer ses livraisons dès avant la mi novembre.
Tableau n° 9 : Livraison des vaccins – cumuls
Semaine du |
GSK |
Sanofi P ; |
Novartis |
Baxter |
TOTAL |
Pandemrix |
Panenza |
Focetria |
Celvapan |
||
5-oct.-09 |
1 072 000 |
0 |
0 |
0 |
1 072 000 |
12-oct.-09 |
1 646 000 |
0 |
0 |
0 |
1 646 000 |
19-oct.-09 |
2 961 500 |
0 |
0 |
0 |
2 961 500 |
26-oct.-09 |
4 205 000 |
0 |
0 |
0 |
4 205 000 |
2-nov.-09 |
4 205 000 |
0 |
0 |
0 |
4 205 000 |
9-nov.-09 |
5 643 000 |
1 400 000 |
1 056 382 |
12 000 |
8 111 382 |
16-nov.-09 |
5 928 500 |
1 400 000 |
3 241 672 |
12 000 |
10 582 172 |
23-nov.-09 |
7 605 000 |
1 400 000 |
3 771 112 |
12 000 |
12 788 112 |
30-nov.-09 |
9 812 500 |
4 700 000 |
4 833 683 |
12 000 |
19 358 183 |
7-déc.-09 |
10 865 000 |
4 700 000 |
7 155 732 |
50 000 |
22 770 732 |
14-déc.-09 |
10 865 000 |
9 307 700 |
7 603 052 |
50 000 |
27 825 752 |
21-déc.-09 |
11 599 000 |
11 025 100 |
8 016 762 |
50 000 |
30 690 862 |
28-déc.-09 |
12 338 000 |
14 379 300 |
8 413 272 |
50 000 |
35 180 572 |
1-janv.-10 |
12 973 000 |
14 379 300 |
8 868 842 |
50 000 |
36 271 142 |
4-janv.-10 |
13 475 500 |
14 379 300 |
9 070 542 |
50 000 |
36 975 342 |
11-janv.-10 |
13 915 000 |
14 379 300 |
9 070 542 |
50 000 |
37 414 842 |
18-janv.-10 |
14 849 500 |
14 379 300 |
9 070 542 |
50 000 |
38 349 342 |
25-janv.-10 |
14 849 500 |
14 379 300 |
9 070 542 |
50 000 |
38 349 342 |
1-févr.-10 |
16 510 000 |
16 156 400 |
9 070 542 |
50 000 |
41 786 942 |
8-févr.-10 |
18 000 500 |
17 001 700 |
9 070 542* |
50 000 |
44 122 742 |
* L’excédent de doses a été restitué à Novartis
Source : D’après un tableau communiqué par l’EPRUS
Cependant, même si elles ont été tardives, les livraisons ont rapidement dépassé les besoins liés à la campagne vaccinale qui, s'agissant des centres de vaccination, a débuté le 12 novembre.
Le passage de deux à une dose
Le fait de devoir recourir à l'administration de deux doses à trois semaines d’intervalle ou, au contraire, de se contenter d’une seule injection de vaccin pour obtenir une immunité dépend de l’immunogénicité du vaccin lui-même (à cet égard, la présence d’un adjuvant est de nature à renforcer celle-ci) et de facteurs propres à la personne qui reçoit le vaccin. Ainsi, un jeune enfant peut, toutes choses égales par ailleurs, avoir besoin de deux doses quand d’autres personnes, notamment des personnes âgées déjà en partie immunisées, pourraient être vaccinées avec une seule.
Au cas d’espèce, la population étant considérée comme non immunisée (« naïve ») vis-à-vis de ce virus qui apparaissait nouveau, l’hypothèse du recours de principe à deux doses apparaissait justifiée. Ce point de vue a encore été confirmé par les AMM délivrées à l’automne, lesquelles prévoyaient effectivement deux doses.
Ce choix, toutefois, demeurait un sujet d’interrogation. Ainsi, dès le 12 octobre 2009, les laboratoires Novartis et GSK ont déposé une demande en vue de faire varier leurs AMM respectives pour passer à un scénario à une injection. Ceci n’a pu être ignoré des pouvoirs publics et, dès le 16 octobre, le ministre chargé de la santé signalait au Président de la République le « possible passage à un schéma vaccinal mono- injection » et indiquait : « des contacts informels vont être prudemment pris avec les industriels pour investiguer la possibilité de rétrocessions au profit d’autres pays acquéreurs »86. Cette prudence semble cependant avoir été telle qu’elle ne déboucha sur des mesures que deux mois et demi plus tard.
Le 28 octobre 2009, le HCSP a rendu un avis par lequel il actualisait ses recommandations sur l'utilisation des vaccins pandémiques. S’appuyant lui-même sur un avis rendu le 23 octobre par le Committee for Medicinal Products for Human Use (CHMP), instance qui prépare les décisions de l’Agence européenne du médicament (EMEA), selon lequel l'administration d’une seule dose pourrait suffire dans la tranche d’âge de 18 à 60 ans87, le Haut Conseil a recommandé un tel schéma de vaccination sauf pour les personnes de cette tranche d’âge atteintes de dysfonctionnements innés ou acquis du système immunitaire. Mais cette recommandation était immédiatement tempérée, le HCSP indiquant que « la nécessité d’administration d’une deuxième dose de vaccin sera considérée en fonction des données complémentaires à venir concernant l’immunogénicité des vaccins, la durée de protection qu’ils confèrent, ainsi que la durée de la pandémie », position qui était alors celle de l’AFSSaPS.
Le 20 novembre 2009, l’EMEA a rendu un avis favorable à un schéma de vaccination à une dose pour les personnes de plus de 9 ans.
Le 27 novembre, le HCSP a procédé à une nouvelle actualisation de ses recommandations sur l’utilisation des vaccins. Il en est ressorti :
- qu’une dose suffisait pour les personnes âgées de 9 à 59 ans quel que soit le vaccin utilisé ;
- qu’une seule dose suffisait également pour les personnes de 60 ans et plus à condition de recourir au Pandemrix ;
- que, selon les cas, deux doses ou deux demi-doses convenaient aux enfants de 24 mois à 8 ans ;
- et, enfin, que la vaccination des nourrissons de 6 à 24 mois était à pratiquer exclusivement au moyen de deux demi-doses de Panenza.
Un nouvel avis du HCSP du 11 décembre a modifié à la marge le précédent, étendant quelque peu les cas pour lesquels une seule dose était considérée comme suffisante.
Même dans l’attente d’un avis du HCSP tirant formellement toutes les conséquences de l’avis de l'EMEA, les pouvoirs publics pouvaient considérer dès le 20 novembre 2009 que la posologie à deux doses devait être abandonnée et que, toutes choses égales par ailleurs, le besoin quantitatif en vaccins était radicalement modifié par rapport aux commandes initiales. Ils auraient pu d’autant mieux s’être préparés aux conséquences à en tirer sans délai, qu’ils n’ignoraient pas le caractère incertain de l’hypothèse des deux doses retenue au départ à titre de précaution et que des indications se multipliaient depuis le début octobre dans le sens de sa probable révision.
En outre, il était clairement établi à la mi-novembre que le virus H1N1 présentait une dangerosité beaucoup plus modérée que celle qui avait été envisagé. Par ailleurs, la campagne de vaccination n’ayant effectivement commencé qu’à cette date, son rythme au cours des premières semaines a vite rendu hors d’atteinte l’objectif d’une couverture quasi-générale de la population. Au 30 novembre, un million de personnes seulement avaient été vaccinées88. Il était donc manifeste qu’un excédent majeur s’était constitué et que le niveau des commandes initiales était surnuméraire dans une proportion considérable.
Une dénonciation unilatérale notifiée tardivement
Malgré les circonstances et le calendrier rappelés ci-dessus, il aura fallu près d’un mois pour que la réduction des commandes initiales de vaccins soit formellement envisagée par les pouvoirs publics, et près d’un mois et demi pour qu’elle connaisse un début de mise en œuvre effective.
Les instructions données par le ministre chargé de la santé
Le principe d’une réduction des commandes a été posé par une lettre du directeur de cabinet du ministre chargé de la santé du 18 décembre 2009 au directeur général de l’EPRUS. Il s’est réalisé de deux manières :
- par un avenant conclu avec Sanofi Pasteur ;
- par une décision unilatérale portant sur les trois contrats, y compris celui de Sanofi Pasteur.
Dans sa lettre du 18 décembre 2009, le directeur de cabinet faisait référence à la prise de position de l’Agence européenne du médicament en faveur d’une stratégie vaccinale à une dose ainsi qu’au constat d’un taux d’adhésion plus faible que prévu de la population à la vaccination, pour estimer l’excédent de stock à 40 millions de doses. Il demandait en conséquence au directeur général de l’EPRUS d’examiner plusieurs pistes, dont, principalement, l’annulation d’une partie de la commande, lui indiquant toutefois de n’engager le processus de négociation que dans les premiers jours de l’année. Conformément à ces instructions, les mesures visant à réduire les quantités commandées n’interviendront que le 4 janvier 2010.
Plusieurs explications ont été avancé par le ministère de la santé pour justifier ce retard: le fait que des « experts français crédibles » auraient alors continué à considérer que « face à un virus nouveau […] deux injections seraient peut-être un jour nécessaires » ; l’illusion qu’aurait conservée un temps les pouvoirs publics que « la solution de la revente à des pays étrangers » puisse avoir un effet équivalent à une résiliation ; le risque que l’annonce rapide d’une résiliation aurait entraîné d’une « non-livraison » des importantes quantités, notamment d’unidoses, attendues pour la fin décembre.
Le délai de près d’un mois et demi ménagé entre fin novembre, quand il devenait certain que d’importants excès de vaccins se constituaient, et le début du mois de janvier, moment où ont été prises les mesures visant à interrompre les livraisons et, en amont, la production, a eu pour conséquence de rendre plus difficiles les négociations qui ont suivi (voir infra) et d’accroître le coût de l’indemnisation ou le risque contentieux résultant d’une interruption unilatérale du contrat. Outre l’éventuelle compensation d’un manque à gagner (lucrum cessans), la jurisprudence recherche en effet dans cette matière la perte subie du fait des dépenses déjà engagées par le prestataire (damnum emergens). C’est un calcul se fondant sur cette dernière notion qui, on le verra, a été développé par GSK pour étayer, au vu du nombre de doses selon lui déjà produites, le montant élevé d’indemnisation exigé par lui. Par ailleurs, même dans l’hypothèse d’un rebond de l’épidémie, le repli de 40 millions de doses envisagé en décembre aussi bien que celui effectivement pratiqué qui a porté sur 50 millions se situent bien en deçà de l’excédent de commandes qui pouvait être constaté et anticipé au regard du besoin réel. On le verra (voir infra), le nombre réel de doses utilisées sur l’ensemble de la campagne, toutes filières confondues y compris la médecine de ville, n’aura en réalité pas dépassé 6 millions. La dangerosité relativement faible du virus ayant déjà été constatée par la population, il paraît bien peu probable que même la survenue d’une nouvelle vague pandémique ait pu susciter un comportement massivement plus favorable à la vaccination et mobiliser plus de 20 millions de doses additionnelles. La réduction totale des approvisionnements envisagée fin novembre aurait donc pu être fixée à 65 millions de doses en conservant une marge de sécurité encore appréciable. Une telle hypothèse devenait cependant d’autant plus difficile à négocier que la décision, comme on l’a vu, tardait à en être formulée auprès des prestataires.
L’annulation d’une part des commandes
Une première décision a fait suite à une négociation. Signé le 4 janvier 2010 par le prestataire et le 6 janvier par le directeur général de l’EPRUS sur instruction du ministre chargé de la santé, un avenant au marché avec Sanofi Pasteur indique que « la tranche conditionnelle n° 1 relative à la mise à disposition de 28 millions de traitement pandémique telle qu'affermie par l'avenant n° 3 porte, dorénavant, sur la fourniture de 19 millions de doses de vaccins ». Cet avenant n’a prévu aucune contrepartie financière au bénéfice de Sanofi-Pasteur.
Trois décisions unilatérales ont été prises ce même jour par l’EPRUS sur instruction du ministre. Elles indiquaient qu’en vertu des règles générales applicables aux contrats administratifs, l’EPRUS se voyait contraint de modifier unilatéralement les quantités de doses de vaccin commandées dans le cadre de chacun des trois contrats avec GSK, Sanofi Pasteur et Novartis « au motif que la quantité de doses de vaccins préalablement commandée ne correspond plus aux exigences de l'intérêt général ». S’agissant de l’indemnisation, il était mentionné que l’EPRUS était à la disposition du prestataire pour envisager avec lui les conséquences de la modification du marché.
Par fournisseur, la réduction des doses commandées, qui ne concerne pas les vaccins de Baxter, a été la suivante :
- GSK : de 50 à 18 millions de doses (réduction de 32 millions de doses, représentant 64 % de la commande initiale) ;
- Novartis : de 16 à 9 millions de doses (réduction de 7 millions de doses, soit 43,8 % de la commande initiale) ;
- Sanofi-Pasteur : réduction convenue par avenant de 28 à 19 millions, soit 9 millions de doses, à laquelle s’ajoute la réduction unilatérale de 19 à 17 millions de dose, soit une réduction totale de 11 millions de doses, représentant 39,3 % de la commande initiale.
Le taux global de réduction des commandes initiales a été de 53,3 %.
Le fondement juridique des modifications unilatérales
Les contrats ne prévoyaient pas l’hypothèse d’une réduction des commandes. En revanche, dans la mesure où ces réductions peuvent s’assimiler à des résiliations partielles, il y a lieu de prendre en considération leurs clauses en matière de résiliation.
A cet égard, les marchés avec Sanofi-Pasteur et Novartis renvoyaient tous les deux, comme il est d’usage mais sans que cela soit obligatoire, au cahier des clauses administratives générales applicable aux marchés de fournitures et de services courants (CCAG-FCS). Ce document prévoit divers cas de résiliation, notamment la résiliation unilatérale par la personne publique, qu’il y ait ou non faute du titulaire. S'agissant de l’indemnisation, le CCAG indique, pour un marché de cette durée, que la personne publique « évalue le préjudice éventuellement subi par le titulaire et fixe, s'il y a lieu, l'indemnité à lui attribuer ». Quant au contrat avec GSK, il ne faisait aucune référence à un CCAG et ne comportait, par ailleurs, aucune clause autorisant la personne publique à résilier ou modifier unilatéralement le marché.
En tout état de cause, les parties ne se sont pas référées au CCAG pour déterminer l’indemnisation. Il y a donc lieu de considérer que les réductions de commandes ont leur fondement, ainsi qu’indiqué dans les lettres du 4 janvier, dans le droit reconnu aux personnes publiques par la jurisprudence de modifier unilatéralement les contrats administratifs pour motif d'intérêt général avec, pour contrepartie, l’indemnisation du cocontractant89. Dans les discussions qui ont fait suite aux réductions de commandes, les laboratoires n’ont en aucune manière contesté le droit pour l’EPRUS d’appliquer ce principe général du droit administratif.
Un coût total d’indemnisation de 48,5 M€
Par lettre du 11 février 2010, la ministre de la santé a donné ses instructions au directeur général de l’EPRUS pour les négociations à mener en vue de l’indemnisation des producteurs. Elle a déclaré lors de son audition le 23 mars 2010 devant la commission d’enquête du Sénat que l'indemnisation ne pourrait être calculée sur le manque à gagner des laboratoires, mais uniquement sur les dépenses réellement engagées et constatées90. Une estimation communément admise à cette époque était alors que le coût global de celle-ci pourrait être limité à 50 M€.
Les frais d’avocats engagés par l’EPRUS pour faire face à cette situation se sont élevés à près de 209 400 € se répartissant entre deux cabinets missionnés sur instruction ministérielle. Le premier de ces cabinets a facturé pour 64 500 € de prestations sur la base d’une rémunération horaire de 200 € HT. Les factures du second se sont élevées à 144 900 €, sur la base de rémunérations horaires de 575 et 740 € HT.
La transaction avec Novartis
Il a été convenu, dans le cadre d’une transaction signée le 15 mars 2010, du versement d’une indemnisation à hauteur de 10,5 M€, soit un peu plus de 16 % (16,06 %) du montant des commandes annulées (65,38 M€).
L’indemnisation décidée unilatéralement de Sanofi Pasteur et de GSK
Faute de parvenir à un accord avec ces deux laboratoires, l’EPRUS, toujours sur instructions du ministre chargé de la santé, leur a adressé une lettre leur indiquant qu’il leur était alloué une indemnité au prorata du montant des commandes annulées.
S'agissant de Sanofi Pasteur, la lettre, envoyée le 2 avril 2010 faisait état d’une indemnité de 2 M€, correspondant à 16 % du montant des quantités résiliées unilatéralement. Le 1er juin, peu avant la fin du délai de contentieux, le directeur du laboratoire a informé l’EPRUS qu’il prenait acte de cette décision et ne donnait pas de suite juridique aux réclamations qu’il avait formulées à la suite de la décision unilatérale du 4 janvier.
En ce qui concerne GSK, son dirigeant pour la France a fait part, dans des lettres adressées à l’EPRUS les 5 janvier, 26 février et 1er mars 2010, du point de vue selon lequel l’indemnisation devait couvrir le coût des vaccins déjà produits et non livrés et l’a confirmé devant la commission d’enquête de l'Assemblée nationale. La demande indemnitaire de GSK formulée dans la lettre du 26 février s’établit à 108,5 M€, soit bien davantage que l'indemnité que l’EPRUS, par lettre du 30 avril 2010, a accordée à hauteur de 36 M€, soit 16,07 % des commandes annulées.
Conformément à l’article R. 421-7 du code de justice administrative, la lettre du 30 avril 2010 ayant été envoyée au président de Glaxo Group Limited en Angleterre, son destinataire disposait d’un délai de quatre mois à compter de la notification de la décision de l’EPRUS pour saisir le tribunal administratif de Montreuil. GSK ayant alors annoncé qu’il avait renoncé à ouvrir un contentieux, le total des indemnités s’élève définitivement à 48,5 M€.
L’incertitude sur un éventuel recours contentieux de GSK étant désormais levée, un montant total d’indemnisation de 48,5 M€ porte à près de 365,3 M€ HT (382,7 M€ TTC) le coût des quelque 44 millions de doses de vaccins qui auront été livrées. On peut donc considérer que, bien que trop tardive et portant sur une quantité qui aurait pu être sensiblement supérieure, la dénonciation unilatérale des contrats de fourniture de vaccins a permis d’économiser 329,3 M€ TTC par rapport à ce qu’aurait impliqué l’exécution des contrats initiaux (soit 382,7 M€TTC de commandes annulées dont il faut déduire les 48,5 M€ d’indemnités). Même ainsi réduit, le coût global des livraisons doit cependant être également rapproché du nombre de doses qui aura été effectivement utilisé pour des vaccinations sur le territoire national, soit moins de 6 millions. Le coût unitaire de la dose ainsi employée conformément à la destination attendue s’élève ainsi à au moins 61 € HT91, pour un prix moyen de la dose livrée de 7,2 € HT.
4. Les reventes et dons internationaux de vaccins
Les disponibilités manifestement excessives du stock de vaccins constitué en 2009 ont justifié à partir de la fin de l’année d’en consacrer un montant total dépassant le quart des livraisons à des exportations à titre payant ou gratuit :
- une livraison à prix coûtant à la Principauté de Monaco de quatre lots représentant au total 80 000 doses a été requise par le Centre de crise du ministère des affaires étrangères par lettre du 5 novembre 2009 et a fait l’objet d’une convention signée entre la Principauté et la préfecture des Alpes-Maritimes. Le décompte des quantités effectives à facturer est en cours ;
- par un courriel du directeur de cabinet du ministre chargé de la santé en date du 12 novembre 2009, il a été enjoint à l’établissement de mettre en œuvre à bref délai un accord passé avec le Qatar et prévoyant la fourniture au prix coutant de 300 000 doses (220 000 de Pandemrix et 80 000 de Panenza) et de 330 000 seringues. Cette transaction a donné lieu dès le 24 novembre 2009 à l’émission d’une facture s’élevant à 2,125 M€ ;
- enfin, comme suite à l’annonce faite par le Président de la République dès le 17 septembre 2009 de l’intention de la France de consacrer 10 % de ses commandes initiales de vaccins à un effort de solidarité internationale, le ministre chargé de la santé a, par une lettre du 15 janvier dernier, donné pour instruction à l’établissement de signer une lettre d’accord prévoyant la fourniture gracieuse à l’OMS de 9,4 millions de doses (2,365 de Focetria, immédiatement disponibles, et 7,035 de Panenza à livrer « d’ici la mi-février »). De fait, ces livraisons ont dû se poursuivre jusqu’au début juin 2010 (un tiers environ restaient à opérer au 5 mai 2010).Un avenant était cependant en cours de signature, début juin 2010, pour répondre à la demande de l’OMS de bénéficier du don de 1,2 million de doses supplémentaires de Panenza. Une ultime demande courant août a porté en définitive le volume de doses données à l’OMS à un peu plus de 12 millions, soit une valeur totale estimée par la DGS à 87,2 M€.
S’agissant de ces opérations internationales, un échange de lettres entre l’établissement et les administrations financières relative au régime de TVA applicable aux achats de vaccins (voir infra, partie IV, C, 4) a conduit à admettre que les quantités faisant l’objet de reventes à prix coûtant donnent lieu à déduction de TVA et que celles correspondant aux dons à l’OMS puissent, dès lors qu’il sera établi que ces vaccins ont été exclusivement destinés à des pays en voie de développement, bénéficier d’une dispense de taxation, l’EPRUS précisant qu’un dossier de demande de remboursement de TVA sera élaboré dès lors qu’une copie de la totalité des lettres contresignées par les gouvernements étrangers bénéficiaires acceptant les donations lui sera parvenue. Une moindre charge fiscale nette d’environ 4,2 M€ résultera de ces dispositions, tandis que les ressources totales de revente pourraient s’élever au total (Monaco et Qatar) à plus de 2,6 M€. Le coût global TTC d’acquisition des vaccins en serait, au total, atténué de 6,8 M€ environ.
5. La gestion logistique des produits
La stratégie de lutte contre la pandémie H1N1 définie par les pouvoirs publics faisait reposer sur l’établissement pharmaceutique de l’EPRUS l’essentiel de la responsabilité logistique de mobilisation et de distribution nationale des stocks de produits sanitaires qu’elle requérait.
Cette responsabilité impliquait notamment :
- la mobilisation de stocks préconstitués dans le cadre du plan pandémie grippale (grippe aviaire) : antiviraux, masques, moyens d’injection et collecteurs pour aiguilles ou seringues usagées ;
- la réception et le stockage des commandes ou fabrications92 additionnelles de ces mêmes produits et celles afférentes aux vaccins H1N1 et autres produits nécessaires à la campagne anti-pandémique93 ;
- la distribution des antiviraux, masques, vaccins et autres produits ou matériels notamment aux établissements de santé et grossistes répartiteurs, à la fois en France métropolitaine et outre-mer ;
- l’adaptation des circuits de distribution lors de la modification de la stratégie vaccinale opérée début 2010 en direction de la médecine de ville ;
- l’organisation de la « remontée » en bon ordre des produits inutilisés ou devant être détruits.
Les choix d’organisation logistique
Les opérations logistiques ainsi mises à la charge de l’EPRUS ont concerné l’ensemble du territoire national (métropole et outre-mer) ainsi que les représentations diplomatiques et les ressortissants français de l’étranger et, selon les articles (masques, antiviraux ou vaccins) et la période, avaient pour destinataires les établissements de santé, les centres de vaccination, les professionnels de santé (médecine de ville et officines), les organismes et administrations diverses relevant d’autres ministères (défense, intérieur…), les organismes internationaux bénéficiaires de cession gratuite (OMS). Les acquisitions effectuées au titre de la campagne de vaccination ont été livrées par les fournisseurs au fil des commandes sur les divers sites de stockage de l’EPRUS ou sur les plateformes zonales alors constituées par celui-ci, les transports plus massifs vers les dépositaires étant assurés sous escorte de gendarmerie ou de police.
Pour la bonne gestion de tels flux, l’établissement a anticipé la mise en œuvre d’une stratégie que formalisera son futur plan de stockage. Celui-ci entend s’appuyer sur l’existence d’un acteur logistique de distribution à compétence régionale demeurant dans le périmètre de gestion EPRUS et permettant le regroupement des approvisionnements issus des achats ou des stocks centralisés et leur distribution « au détail » Dès le mois de mai 2009, des plateformes zonales ont ainsi été créées dans chaque zone de défense en métropole, un contrat de mise à disposition de sites (quelque 3000 palettes par site) étant conclu à cet effet avec deux opérateurs logistiques (GEODIS et AEXXDIS) disposant du statut de dépositaire pharmaceutique.
La distribution des produits
Ces plateformes, approvisionnées à partir des stocks centraux ont assuré le ravitaillement en produits et articles de santé relevant de la lutte contre la pandémie selon des schémas adaptés aux divers cadres d’emploi des produits ou matériels comme à la diversité de ceux-ci : médicaments, dispositifs médicaux, masques. La responsabilité de l’EPRUS sur ces produits cessait à partir de leur livraison aux plateformes départementales, placées sous l’autorité du préfet, aux établissements de santé et aux répartiteurs pharmaceutiques94.
Les masques
Ces flux ont concerné :
- à compter du mois de mai 2009, les masques FFP2, masques chirurgicaux et produits antiviraux, destinés aux centres hospitaliers (108 sièges de SAMU dans un premier temps) ;
- à partir de juin 2009, les masques FFP2 et chirurgicaux livrés à des plateformes départementales de distribution mises en place par les préfectures pour assurer l’approvisionnement des professionnels de santé du secteur libéral (médecins, infirmiers, kinésithérapeutes).
Les demandes d’approvisionnement concernant les masques et les antiviraux en provenance des établissements de santé et les demandes de masques émanant des plateformes logistiques départementales devaient, en principe, être adressées à la DGS qui, après validation, les transmettait à l’EPRUS qui les faisait honorer par la plateforme logistique zonale compétente. Cette procédure centralisée ayant conduit à une rapide saturation, elle a été abandonnée par la suite.
- Entre le 20 juin et le 3 juillet 2009, le dispositif logistique de ravitaillement en produits de santé a été étendu pour approvisionner les 330 établissements hospitaliers supplémentaires ayant ouvert des consultations dédiées à la grippe conformément à une liste établie et tenue à jour par les ARH et validée par le centre de crise du ministère de la santé.
Aux mêmes dates, sur saisine de la DGS, l’EPRUS a procédé à la répartition via ses plateformes zonales de Tamiflu formes pédiatriques (45 et 30 mg) sur l’ensemble des établissements de soins dédiés à la grippe. Ces stocks ont dû être complétés par des achats, jusqu’à obtention de l’autorisation de mise sur le marché de l’Oseltamivir PG 30 mg fabriqué par la PCA (24 novembre 2009).
- Le 23 juillet 2009, le ministre de la santé ayant décidé de faire appel aux officines pour distribuer les masques chirurgicaux du stock Etat prescrits aux malades grippés en accompagnement du traitement antiviral, les plateformes zonales ont assuré l’approvisionnement des établissements de répartition pharmaceutique de métropole et d’outre-mer (environ 200 établissements qui, à leur tour, ont desservi les 23 000 officines pharmaceutiques du pays). La participation des pharmaciens grossistes-répartiteurs et des pharmaciens officinaux à la distribution des antiviraux et des masques a fait l’objet de conventions préparées par la DGS dans le cadre du plan pandémie grippale, mais qui ont été finalisées par l’EPRUS avec la chambre syndicale de la répartition pharmaceutique, d’une part, et les syndicats de pharmaciens officinaux, d’autre part.
- Dès l’ouverture de la campagne vaccinale pour les personnels soignants à la mi-octobre, les plateformes zonales ont également assuré la distribution des articles consommables, dispositifs médicaux et produits de santé nécessaires au fonctionnement des 1 200 centres de vaccination.
- Le 21 décembre 2009, la mise à disposition des traitements antiviraux du stock Etat dans les officines (Tamiflu 75 mg gélules, Relenza, Oseltamivir PG 30 mg comprimés) a utilisé le circuit de distribution des plateformes zonales et grossistes répartiteurs selon le même schéma que celui retenu en juillet pour la distribution des masques chirurgicaux via les officines.
Les vaccins
S’agissant des vaccins, l’organisation du stockage et de la distribution des vaccins devait en outre garantir la maîtrise de la chaîne du froid. Elle a connu trois étapes distinctes en fonction des destinataires visés :
- A la mi-octobre, sont concernés quelque 450 hôpitaux : sièges de SAMU de France métropolitaine (96 établissements dont tous les CHU/CHR) et d’outre mer (4) ; établissements de santé sièges d’une consultation dédiée (346 hôpitaux en France métropolitaine et une dizaine d’hôpitaux d’outre-mer).
- Du 13 novembre 2009 au 30 janvier 2010, les destinataires étaient les centres de vaccination dont la chaîne d’approvisionnement s’est appuyée sur un réseau de 93 grossistes répartiteurs pharmaceutiques choisis en fonction de critères de desserte géographique et de capacité de conservation des volumes nécessaires à l’approvisionnement régulier des centres rattachés. Ce circuit a permis le ravitaillement quotidien des centres de vaccinations auxquels étaient rattachées des équipes mobiles.
- A partir de janvier 2010, la vaccination est transférée à la médecine de ville dont le circuit d’approvisionnement passe par les 93 sites répartiteurs et les centres de vaccination puis, à partir du 1er février 2010, est élargie aux 185 répartiteurs alimentant les officines. La nouvelle stratégie de vaccination avait, en outre, impliqué de doter chaque médecin d’un « kit vaccinal»95.
L’outre-mer
La Polynésie Française et la Nouvelle-Calédonie étant compétentes en matière de santé publique, la mise à disposition des moyens offerts au plan national au titre de la lutte contre la pandémie s’y est bornée à l’expédition, sur un site désigné par les autorités sanitaires locales, de ces moyens dans des quantités convenues avec le ministère de la santé local.
Les DOM et collectivités territoriales ont en revanche bénéficié des mesures prises au plan national avec des adaptations liées à la situation épidémiologique locale (anticipation ou décalage de mise en place) et réception de l’ensemble des vaccins sur un point unique (en particulier afin de garantir le respect de la chaîne du froid) avant répartition selon la programmation des autorités sanitaires du département ou de la collectivité.
Les besoins spécifiques de certains ministères
Le ministère de la défense a reçu livraison en novembre 2009 auprès de trois établissements de ravitaillement sanitaire du SSA de doses de Pandremix et de matériels d’injection.
Le ministère de l’intérieur a mis sur pied une campagne de vaccination autonome, soit sous forme centralisée pour laquelle étaient destinataires le service médical de la brigade des sapeurs pompiers de Paris (vaccination de l’administration centrale) et les trois établissements de ravitaillement sanitaire du service de santé des armées (vaccination de la gendarmerie), soit sous une forme décentralisée par rattachement à un centre de vaccination départemental d’une « équipe mobile » constituée au sein du service médical des services départementaux d’incendie et de secours (SDIS) en vue de la vaccination des personnels des services déconcentrés.
Le ministère des affaires étrangères a désigné un dépositaire pharmaceutique chargé du conditionnement et de l’expédition vers les postes diplomatiques des vaccins nécessaires à leurs personnels et aux Français résidant à l’étranger.
Le repli du dispositif
La fermeture des centres de vaccinations le 30 janvier 2010 puis l’épuisement de la vague pandémique impliquaient pour l’EPRUS d’organiser au plan logistique la recentralisation des produits inutilisés ou devant être détruits encore en place dans les divers lieux de la chaîne de mise en place. Cette opération concerne tant les masques de protection (FFP2) et masques chirurgicaux, que les vaccins et matériels de vaccination ou les antiviraux du stock Etat mis en place dans les officines.
S’agissant de ces derniers produits, la direction de l’EPRUS estimait que l’établissement « n’aura aucune difficulté à assurer la remontée des produits détenus par les répartiteurs pour le réapprovisionnement des officines de pharmacie ». Elle admettait en revanche que le stock résiduel des officines au moment de l’arrêt de l’opération « poserait problème, non pour les pharmacies qui pourront restituer leur stock au grossiste mais pour l’EPRUS qui devrait trier par lot et selon leur état, des boites provenant de 23 000 sites, puis les reconditionner avant reprise en stock ».
A partir du 30 janvier, les consommables de vaccination ont été concentrés sur un site unique par département (plateformes logistiques départementales), les boites entamées ou articles isolés utilisables étant redistribuées au sein du département sur les sites pérennes de vaccination (établissements de santé, centres de protection maternels et infantiles, dispensaires…). Les boites et cartons intacts sont collectés par l’EPRUS qui les regroupe sur ses plateformes logistiques zonales où ils sont triés, reconditionnés en palettes en vue d’être repris dans les stocks de l’établissement. Le volume des articles à récupérer est estimé, en moyenne, à 5 m3 par centre de vaccination.
Quant aux vaccins, la remontée sur les sites du dépositaire a été organisée, à partir de fin janvier, pour les stocks de vaccins que détenaient les établissements de répartition pour l’approvisionnement des centres de vaccination. Cette collecte concernait des produits n’ayant jamais quitté la filière de conservation pharmaceutique et devait être effectuée dans le respect des bonnes pratiques de distribution et de transport. Elle devait être achevée pour le 20 février, date à laquelle les établissements de répartition conservaient néanmoins les stocks nécessaires à l’approvisionnement des officines pour les besoins de la médecine de ville.
6. L’utilisation du stock de produits de prévention H1N1 : un premier bilan
Mise en place et récupération des vaccins
Un bilan de localisation des stocks de vaccins (en nombre de doses) à la date du 15 septembre 2010 a été, à la demande de la Cour, opéré par l’établissement :
Tableau n° 10 : Situation des vaccins grippe H1N1 au 15 septembre 2010
Entrées en stock définitives (1) : GSK (18,00 M de doses) SANOFI (17,00) NOVARTIS (9,00), BAXTER (0,05) |
44 052 200 |
Sorties de stocks : |
|
Etablissements de santé (y compris DOM) (3) |
1 603 200 |
Centres de vaccination et autres (y compris DOM) (2) |
9 582 100 |
Dons à l’OMS |
12 053 300 |
Sorties officines (3) |
1 277 000 |
Ministère des affaires étrangères + Territoires d’outre-mer |
858 000 |
Ventes au Qatar |
300 000 |
Campagne interne ministères |
83 500 |
Total des sorties de stocks |
25 757 100 |
Stock disponible total au 15/09/2010 |
18 295 100 |
(1) Ce montant diffère de celui des livraisons au 8 février 2010 (44 122 742 doses) d’un contingent de 70 542 doses de Focetria restitué à Novartis. Il s’écarte, par ailleurs, du nombre de doses facturées (44 050 000) de 2 200 doses livrées par GSK et Sanofi mais non facturées.
(2) Y compris équipe mobiles de vaccination, établissements d’hébergement pour personnes âgées dépendantes, centres pénitentiaires, entreprises et structures pérennes de vaccination.…
Vaccins récupérés par l’EPRUS à l’issue de la fermeture des centres :
o vaccins mis au rebut et récupérés pour destruction : 691 000 doses (flacons entamés, boîtes ouvertes, non-conformités, rupture chaîne du froid etc.) ;
o vaccins en bon état récupérés dans les centres : 1 632 954 doses (conditionnement intact et conditions de conservation respectées). Ces vaccins sont stockés en quarantaine sur le site dépositaire DEPOLABO d’Arras mais ne sont pas comptabilisés dans les stocks disponibles.
(3) Le retour des moyens d’injection et des vaccins encore en stock dans les établissements de répartition pharmaceutiques et dans les officines ainsi que des vaccins encre détenu par les établissements de santé était programmé mi –septembre.
Source : EPRUS, septembre 2010
On observera que, selon l’EPRUS, le chiffre de près de 9,6 millions de doses ici recensées comme mises en place dans les centres de vaccination et auprès des équipes mobiles incluait encore 691 000 doses mises au rebut et déjà récupérées pour destruction par l’établissement (flacons entamés, boites ouvertes, non conformités, rupture chaîne du froid) ainsi que près de 1 633 000 doses en bon état (conditionnement intact et conditions de conservation respectées) déjà remontées auprès de l’établissement96. Déduction faite de ces quantités, le nombre de doses susceptibles d’avoir été « utilisées » par les centres et équipes mobiles, DOM compris, ou à partir d’eux se ramène à quelques 7,3 millions de doses.
Le nombre de doses mises en place dans les officines (près de 1,3 million) correspond aux livraisons effectuées à partir de la fin janvier dernier en vue d’alimenter la médecine de ville.
Il résulte de ces indications que le maximum absolu de doses susceptibles d’avoir effectivement servi à la vaccination sur le territoire national (DOM compris) n’a pas dépassé 10,2 millions de doses (dont 7,3 dans les centres et unités mobiles), soit quelque 10,8 % des commandes initiales et 23,1 % des quantités effectivement achetées et livrées. Ce chiffre est nettement inférieur au nombre de vaccins, près de 12,4 millions de doses, qui aura été réalloué à des usages internationaux (reventes au Qatar, dons à l’OMS), ces utilisations internationales atteignant quelque 13,1 % de la commande initiale et 28 % des livraisons effectives à l’établissement.
L’incidence sur les stocks des vaccinations effectives
Le chiffre probable des vaccinations effectives sur le territoire national s’établit cependant très en deçà du nombre des doses mises en place.
Le dernier bilan quotidien établi par la direction de la sécurité civile remonte au 30 janvier 2010, jour de la fermeture des centres de vaccinations. Dans l’attente du bilan définitif résultant de l’exploitation complète des bons de vaccination adressés à la CNAMTS, la DGS a adressé à la Cour, le 9 juin 2010, l’évaluation ci-après. Ces chiffres, qui incluent les résultats des départements d’outre-mer font ressortir un nombre total de personnes vaccinées ne dépassant pas 5,4 millions, soit moins de 8,5 % de la population totale97.
Tableau n° 11 : Nombre de personnes vaccinées et de doses utilisées
au cours de la campagne 2009-2010
Nb de personnes vaccinées |
en milliers |
centres de vaccination |
4 168,0 |
équipes mobiles |
553,9 |
établissements de santé |
520,8 |
médecine libérale |
16,4 |
centres de secours |
36,0 |
centres de rétention |
0,3 |
vaccination en entreprise et administration |
2,7 |
vaccination Français à l'étranger |
62,8 |
Nombre de personnes vaccinées |
5 360,9 |
+ deuxièmes doses |
563,3 |
Nombre total de vaccins utilisés |
5 924,2 |
Source : DGS, 9 juin 2010
Par rapport au décompte des personnes vaccinées, le nombre de doses utilisées inclut l’incidence des cas, limités en nombre, ayant donné lieu à l’administration de deux doses, que le bilan mentionné ci-dessus évalue à 563 000 unités, soit 10,5 % du nombre des personnes vaccinées.
Compte-tenu de cette correction, le nombre total de doses effectivement employées pour des vaccinations lors de la campagne nationale ne dépasserait donc pas quelque 5,9 millions d’unités, soit moins de 6,3 % des quantités initialement commandées et 13,4 % de celles effectivement livrées. Il représente moins de la moitié du nombre total de doses qui auront été utilisées en définitive pour des reventes et dons internationaux (12,4 millions de doses). Il présente un écart de près de 5,2 millions d’unités par rapport à la quantité qui, selon le bilan de l’EPRUS, est censée avoir été « utilisée » dans les différentes filières nationales de vaccination.
- Même en prenant en compte les doubles doses, les vaccinations effectuées dans les établissements de santé ne dépassent pas un tiers des doses qui y ont été mises en place ;
- l’utilisation en médecine de ville s’est trouvée fortement limitée par le caractère tardif de la mise en œuvre de cette modalité au regard du calendrier de la pandémie. Le nombre de personnes vaccinées n’y représente qu’une part minime (16 400) des doses adressées aux officines à cette destination. Un bilan établi par la CNAMTS le 14 juin 2010 ne fait apparaître qu’un chiffre à peine supérieur de 17 909 coupons retournés par les professionnels de santé libéraux, parmi lesquels 6 725 actes de vaccination cotés à 6.60 € applicable aux vaccinations distinctes des consultations de médecine générale cotées en C ;
- s’agissant des centres de vaccination et unités mobiles, environ 5,2 millions de doses (y compris doubles doses) auraient été ainsi employées à leur usage normal alors qu’on l’a vu plus haut dans le commentaire du tableau fourni par l’EPRUS, 7,3 millions de doses sont restées à ce jour dans ces mêmes lieux. Ce seraient donc un écart de plus de 2 millions de doses qui devrait s’ajouter au près de 0,7 million de doses inutilisables récupérées à ce jour par l’établissement. Ce montant peut, au moins pour partie, correspondre à des fournitures à d’autres utilisateurs potentiels (entreprises, centres médico-sociaux) qui, dans la dernière phase de la campagne de vaccination, ont été invités à se fournir auprès des centres. Pour l’essentiel, il correspond cependant plus probablement à des pertes, aux diverses étapes de la mise en œuvre, ou à des mises au rebut pour rupture des règles de sécurité sanitaire (boîtes ouvertes, non-respect de la chaîne de froid etc.). Alors qu’une perte de 10 % était jugée incompressible du fait de l’emploi de flacons de dix doses, le montant des doses effectivement gaspillées pourrait ainsi avoisiner le tiers du nombre total n’ayant pas fait l’objet d’une remontée auprès de l’établissement.
Les centres n’étant pas placés sous sa responsabilité, l’EPRUS n’est pas en mesure d’établir les différentes causes ayant pu contribuer à cette perte globale. L’ampleur de celle-ci et le risque sanitaire important s’attachant à une dispersion incontrôlée de produits laissés sans garantie de la chaîne du froid et soumis à rapide péremption, justifieraient qu’une enquête approfondie soit diligentée, centre par centre, sur l’utilisation effectivement faite des stocks alloués et non restitués à l’établissement. Dans un souci de sincérité, les comptes de l’EPRUS devront par ailleurs distinguer parmi les quantités de vaccins donnant lieu à sortie des stocks, celles correspondant à une utilisation effective pour la vaccination, celles ayant fait l’objet d’une destruction par l’établissement lui-même et celles relevant d’une perte dans des circonstances non identifiées.
La péremption des stocks disponibles de vaccins
Comme l’indique le bilan de situation établi par l’EPRUS, le stock réputé « disponible » après enlèvement de l’ensemble des quantités faisant l’objet d’un don à l’OMS, devrait avoisiner 20 millions de doses dont un peu plus de 1,6 en voie de réintégration dans les comptes de l’établissement), soit 3,4 fois le nombre de doses utilisées pour des vaccinations effectivement réalisées sur le territoire national lors de la campagne 2009/2010.
Selon les indications fournies par l’EPRUS les stocks disponibles sont, pour environ moitié, composés de Celvapan, de Focetria et de Panenza qui se périmeront entre juillet et octobre 2010 et ne seront donc plus utilisables lors d’une éventuelle vague pandémique H1N1 qui interviendrait en fin d’année.
Quant aux doses restantes, constituées uniquement de Pandemrix, leur péremption s’échelonne entre mars et novembre 2011. Il est vrai que, pour ce produit, l’antigène et l’adjuvant sont conditionnés séparément et que l’adjuvant qui, selon l’EPRUS, dispose en moyenne d’une durée de péremption plus longue d’environ dix mois, pourrait, en principe, être réutilisé avec de nouveaux antigènes. Mais l’emploi éventuel tant de l’adjuvant que de l’antigène sera fortement entravé par le fait que ces produits sont conditionnés par boîtes de 50 flacons de dix doses, modalité qui n’est guère utilisable dans les conditions usuelles de la médecine de ville.
En outre, dans ses recommandations de stratégie vaccinale pour 2010/2011 formulées le 1er juin 2010, le Haut conseil de la santé publique a privilégié l’usage pour les personnes éligibles à la vaccination de la grippe saisonnière d’un nouveau vaccin « trivalent » incluant les souches H1N1 et H3N2 et limité le recours au vaccin H1N1 monovalent à certaines catégories seulement de personnes non éligibles à la vaccination contre la grippe saisonnière98. Les perspectives d’utilisation des stocks restant disponibles à l’issue de la campagne 2009/2010 en sont réduites d’autant.
Le risque existe donc que l’essentiel des stocks de vaccins H1N1 encore détenus par l’établissement à l’issue de la campagne ouverte en 2009 donne lieu à destruction physique et dépréciation comptable à l’issue des exercices 2010, puis 2011.
Mise en place et remontée des antiviraux et des masques
L’établissement a, par ailleurs, assuré, dans le cadre de la campagne de lutte contre le virus H1N1, la mise en place dans le réseau médical d’importantes quantités d’antiviraux et de masques de protection :
- 3,4 millions de boîtes d’antiviraux, dont 1,1 de Tamiflu (périmé en 2012), 0,3 million de Relenza (périmé en 2011) et 2 millions d’Oseltamivir (périmé en 2011) ;
- 243 millions de masques chirurgicaux (non périmables) et 180 millions de masques FFP2 (périmés entre 2010 et 2013).
La « remontée » vers l’EPRUS des antiviraux et des masques antérieurement mis en place était achevée pour l’essentiel à la mi-septembre99. Les sorties nettes des reprises de stocks sont, au total, de 850 000 boîtes environs pour les antiviraux. Le nombre des masques non repris en stocks à ce jour reste de près de 162 millions de masques chirurgicaux et de 48 millions de masques FFP2. Le coût des masques, effectivement utilisés ou non, qui, après bilan définitif, n’auraient pas été réintégrés dans les stocks de l’établissement, pris en compte dans l’évaluation globale du coût de la campagne anti-pandémique de 2009-2010.
C. LA CONSTITUTION ET L’ORGANISATION DE LA RESERVE SANITAIRE
Née d’une initiative sénatoriale faisant suite aux réflexions suscitées par les difficultés rencontrées pour organiser la riposte à des crises comme la canicule de 2003 ou l’épidémie de chicungunya, la création de la réserve sanitaire par la loi du 5 mars 2007, visait l’objectif de constituer, aux côtés des dispositifs permanents d’intervention sanitaires et de sécurité civile (hôpitaux et médecins libéraux, SAMU, pompiers etc.), un potentiel de ressources humaines réunies sur la base du volontariat et pouvant renforcer les structures de soins et médico-sociales dans des situations d’urgence le requérant, soit localement, soit à l’échelle nationale.
La constitution préalable d’un tel corps de volontaires et les garanties apportées par la loi entendaient faire en sorte qu’à la différence de la procédure usuelle de la réquisition, les personnes engagées dans de telles actions bénéficient d’un cadre organisé d’emploi, de formation préalable, d’une rémunération et d’une protection personnelle.
L’EPRUS a été chargé de mettre en œuvre cette orientation. Les difficultés rencontrées en ce sens et l’impossibilité de recourir effectivement à la réserve sanitaire lors de la campagne de vaccination H1N1 ont conduit à de premiers assouplissements du cadre réglementaire d’origine et devraient amener à reformuler à la lumière de cette expérience la « doctrine d’emploi » de la réserve formulée au départ.
1. Réglementation et « doctrine d’emploi » de la réserve
Une réglementation contraignante
Recrutement des réservistes
Conformément aux dispositions de l’article L. 3132-3 du CSP, les dispositions prises par décret en Conseil d’Etat et codifiées aux articles R. 3132-1 à 8 du même code précisent les personnes susceptibles de postuler à l’emploi dans la réserve ainsi que la procédure et les conditions de leur recrutement.
Si le recrutement des réservistes relève du volontariat, celui-ci n’est ouvert qu’aux professionnels de santé ou ancien professionnels de santé (retraités depuis une durée maximale fixée initialement à trois ans), aux internes et étudiants en médecine, odontologie et pharmacie, ou futurs sages-femmes et auxiliaires médicaux, et aux « personnes répondant à des conditions d’activité, d’expérience professionnelle ou de niveau de formation » fixées par arrêté.
Les étudiants remplissant les conditions de niveau d’études ne peuvent entrer que dans « la réserve de renfort ».
La candidature adressée au préfet conduit à la signature d’un contrat d’engagement avec l’établissement précisant les activités, zones géographiques et durées acceptées par le réserviste, les formations qu’il doit recevoir, et sa rémunération. La conclusion de ce contrat est cependant subordonnée à une série d’examens médicaux, à la fourniture d’un certificat d’immunisation et d’un certificat d’aptitude médicale.
Il n’est pas exclu que, quelles que soient leurs justifications, cet ensemble de conditions et de contraintes aient pu avoir un effet dissuasif sur le développement du volontariat.
Rémunération des réservistes et remboursement de leur éventuel employeur
Les fonctions de réservistes ne s’accomplissant pas à titre gratuit, des dispositions sont prévues à la fois pour assurer leur rémunération quel que soit par ailleurs leur statut d’emploi et pour dédommager leur éventuel employeur de la perte de service subie du fait de leur utilisation au titre de la réserve.
C’est ainsi que l’article L. 3133-1 dispose que les réservistes salariés ou agents publics sont mis à disposition de la réserve avec maintien de leur rémunération et que l’établissement rembourse à leur employeur la charge correspondante.
Quant aux réservistes retraités, sans emploi, étudiants ou exerçant à titre libéral ils sont «rémunérés » ou « indemnisés » par l’établissement pendant leur périodes d’emploi ou de formation.
Les articles L. 3133-2 à 6 prévoient qu’une « convention de mise à disposition » est établie avec chaque réserviste (et avec son employeur au cas où il est salarié) qui définit les conditions et limites dans lesquelles l’accord de son éventuel employeur est requis pour des absences dépassant cinq jours et les droits dont le maintien est garanti aux réservistes pendant leurs durées d’emploi et de formation. Toutes ces dispositions font l’objet de modalités réglementaires d’application détaillées aux articles R. 3133-1 à 6.
Règles d’emploi de la réserve
Les articles L. 3134-1 et 2 décrivent comment l’appel à la réserve sanitaire est décidé par arrêté conjoint des ministres chargés de la santé et de la sécurité civile qui précise le nombre des réservistes, la durée de leur mobilisation et leur répartition territoriale, et comment leur affectation est assurée par arrêté du représentant de l’Etat dans le département ou dans la zone de défense, soit auprès d’un service de l’Etat ou d’une personne morale, soit en remplacement de professionnels de santé libéraux.
Les réservistes sont dégagés de leur obligation s’ils sont par ailleurs mobilisés au titre de la réserve opérationnelle ou au titre du service départemental d’incendie et de secours.
On le verra (voir infra, point 3), cette procédure contraignante a conduit, dans la période récente, à parfois privilégier d’autres possibilités juridiques de mobilisation des professionnels de santé, la réquisition notamment.
Une « doctrine d’emploi » volontariste
Un document intitulé « doctrine d’emploi de la réserve sanitaire » est annexé au contrat Etat-EPRUS. Daté du 8 septembre 2008, il a arbitré dans le sens souhaité par la DGS les vifs débats engagés sur cette question avec le premier directeur général de l’EPRUS, démissionnaire au début de l’été. Encore aujourd’hui et au vu de l’expérience de la vaccination H1N1, ce dernier se prononce en faveur d’un « élargissement » de la conception initiale de la réserve sanitaire « pour en faire, à l’exemple des réserves militaires, un corps beaucoup plus large, répandu sur le territoire, qui pourrait, tout d’abord servir à tester nos réactions en termes de mobilisation, ou du moins de sensibilisation, ce qui nécessiterait la prise en charge sur fonds publics de formations et d’échanges techniques, appelés à devenir opératoires le moment venu » et souligne qu’« une réserve de quelques dizaines de milliers de professionnels ne peut être gérée comme une réserve minimale de quelques centaines »100.
On le verra, sans s’engager dans une voie aussi ambitieuse, la « doctrine d’emploi » édictée par la DGS apparaît, à l’expérience de la période écoulée, n’avoir guère fait preuve de réalisme, ni dans les modalités de recrutement très centralisées et contraignantes, ni dans la fixation de ses objectifs quantitatifs censés être atteints dans une concurrence mal définie avec les procédures traditionnelles de la réquisition préfectorale. Ce n’est par ailleurs que récemment qu’une coopération organique entre les diverses formations d’urgences a commencé à être recherchée sous l’égide du SGDSN (voir infra).
Au-delà d’une paraphrase des diverses dispositions du CSP, ce document tend notamment à préciser les objectifs respectifs de la réserve d’intervention et de la réserve de renfort et à fixer à leur constitution des objectifs quantitatifs d’une ambition sans doute très volontariste.
Alors que le CSP ne précise pas davantage cette distinction, la « doctrine d’emploi » tente de caractériser les deux réserves tant dans leur base de recrutement que dans leurs modalités d’emploi.
- La réserve d’intervention serait « principalement constituée de professionnels de santé en activité, et [pourrait] être mobilisée dans des délais très court pour faire face à des évènements graves sur le territoire national ou à l’étranger ». En outre, sa constitution « doit reposer sur une assiette la plus large possible afin de limiter les risques de déstabilisation de l’offre de soins et compte-tenu de ses conditions d’emploi qui relèvent de situations graves mais localement circonscrites ». A ce titre, « son programme d’emploi s’inscrit d’emblée dans un cadre national ».
- La réserve de renfort est la seule ouverte aux étudiants et accueille par ailleurs « les candidats à la réserve n’ayant pas formulé le vœu d’intégrer la réserve d’intervention lors de leur engagement ». Elle a vocation « à être mobilisée en cas de crise sanitaire majeure comme la pandémie grippale ou en cas de conséquences sanitaires d’un évènement de longue durée, notamment climatique (canicule) ». Elle est donc destinée à « apporter son concours lors d’évènements sanitaires plus diffus et mettant en cause une population importante dont le traitement nécessitera, éventuellement la mise en place de structures d’accueil spécifiques ». Ceci conduit à « veiller à l’équilibre territorial de la ressource » et à considérer la zone de défense comme « le cadre le plus adapté pour la programmation de son emploi ».
On remarquera, d’une part, qu’hormis le cas des étudiants, le recrutement de la réserve de renfort n’est défini que par défaut et, d’autre part, que la destination préférentielle des professionnels retraités n’est pas mentionnée si ce n’est a contrario par le fait que la réserve d’intervention comprend « principalement » des agents en activité ou par la mention selon laquelle « la sensibilisation des jeunes retraités constitue une action prioritaire pour l’établissement » du point de vue notamment de la constitution de la réserve de renfort.
Or, les retraités constituent semble-t-il le principal gisement de volontaires susceptibles de s’engager dans les meilleures conditions de disponibilité et de durée. Par ailleurs, la réserve dite de « renfort », contrairement à ce que cette appellation pourrait suggérer, n’a en rien un caractère purement supplétif : c’est elle qui devrait être susceptible d’apporter de véritables moyens additionnels à l’échelle que pourraient nécessiter les crises sanitaires touchant le plus massivement ou le plus longtemps la population.
C’est ce que reflètent les « effectifs cibles » initialement avancés par cette « doctrine d’emploi » qui envisageait de recruter « 1 000 personnels dont la moitié de profession médicale » pour la réserve d’intervention, et « 20 000 réservistes » pour la réserve de renfort.
Le document ne dissimule cependant pas le caractère très ambitieux de ces objectifs, notamment du second, soulignant que « le facteur limitatif » en est « le taux d’adhésion des médecins retraités », dont l’effectif moyen, dans le délai maximum après cessation d’activité alors fixé à trois ans, était de 7 000 environ. Le document se limite dans un premier temps à envisager au mieux un recrutement de 1 400 retraités, chiffre jugé « faible, en particulier au regard de la nécessité de satisfaire à un équilibre territorial suffisant ». L’effectif global visé aurait en outre supposé un apport d’étudiants en médecine ou infirmiers à l’évidence irréaliste, l’effectif total, au niveau d’études requis, ne dépassant pas, selon les chiffres indiqués par la circulaire du 1er octobre 2009 sur la mobilisation des professionnels de santé dans la vaccination H1N1, un total de 53 000 (20 000 internes, 13 000 étudiants en médecine, 20 000 étudiants infirmiers).
Des objectifs opérationnels bien moindres ont donc été retenus par l’établissement, dont la réalisation s’est d’ailleurs avérée très partielle.
2. La constitution de la réserve
Le recrutement
Selon un bilan détaillé établi pour la Cour à la date du 11 mars dernier, le recrutement des professionnels de santé en vue de constituer la réserve sanitaire qui avait débuté en décembre 2008, avait conduit à l’engagement de 392 personnes, dont 232 réservistes d’intervention et 160 réservistes de renfort (hors professionnels de santé retraités ou sans emploi ayant participé à la campagne de vaccination H1N1, voir infra).
Par compétence, ces 232 réservistes d’intervention comprennent davantage d’infirmiers(113) que de médecins (69), à la différence des 160 réservistes de renforts, où l’on trouve 72 médecins pour 40 infirmiers. Dans les « autres catégories » que comportent par ailleurs ces effectifs, dominent respectivement les aides soignants (13 sur 50) et les pharmaciens (11) pour les réservistes d’intervention, et les pharmaciens (21 sur 48) pour les réservistes de renfort. Enfin si les généralistes (18), les urgentistes (15) et les anesthésistes (13) se partagent l’essentiel de l’effectif médical d’intervention, les généralistes représentent la majorité (45 sur 72) des médecins de renfort.
A la même date, 46 autres réservistes étaient en attente de la signature de leurs contrats, dont 20 infirmiers, 11 médecins et 7 pharmaciens. Au début juin 2010, l’établissement indiquait que les effectifs recensés trois mois plus tôt avaient été portés à 268 pour la réserve d’intervention et 235 pour la réserve de renfort et atteignaient donc 503 réservistes au total. Les résultats dont il est ainsi fait état près de deux ans après l’adoption de la « doctrine d’emploi » témoignent de la grande difficulté à atteindre les objectifs quantitatifs avancés dans ce même document. Pour la réserve d’intervention, à peine plus du quart de « l’effectif initial » visé de 1 000 réservistes avait été recruté. Quant à la réserve de renfort qui visait un « effectif initial cible » de 20 000 réservistes, elle ne dépassait pas 1,2 % de cet objectif. Cette situation conduit à considérer que ces objectifs, notamment le chiffre de 20 000, n’avaient qu’une vertu d’affichage.
L’activité de l’établissement doit donc plutôt être appréciée au regard des « indicateurs de performance » proposés par le directeur de l’établissement dans sa lettre du 10 mars 2009 après accord du conseil d’administration du 19 décembre précédent : il était alors envisagé la mise en place opérationnelle fin 2009 de 500 réservistes d’intervention et 1 000 réservistes de renfort. Les résultats acquis début juin 2010 se situent à respectivement près de 54 % et moins du quart de ces objectifs. Ce constat conduit l’EPRUS à simplement reconduire pour la fin 2010 les objectifs quantitatifs qu’il s’était assignés pour la fin de l’année précédente.
En termes de réglementation, la simplification des examens médicaux nécessaires à l’engagement dans la réserve sanitaire (arrêté du 20 août 2009), ainsi que l’augmentation de trois à cinq ans du délai maximal entre la cessation d’activité et l’entrée dans la réserve sanitaire (décret du 30 décembre 2009, modifiant sur ce point l’article R. 3132-1) devraient favoriser les engagements.
Sur le plan organisationnel, la mise en œuvre depuis le 1er février 2010 d’un système de gestion en ligne des candidatures permet à chaque réserviste de s’inscrire et de gérer son dossier via internet.
Plus fondamentalement, la médiocrité des premiers résultats quantitatifs de recrutement de la réserve semble à mettre en rapport avec le bref délai séparant la constitution de l’établissement de l’ouverture de l’épidémie grippale. Celui-ci n’a pas été suffisant pour faire percevoir par des institutions déconcentrées (préfectures, DRASS) bien rodées à la procédure usuelle de la réquisition et disposant déjà de listes plus ou moins formelles de professionnels réquisitionnables, l’apport de la nouvelle formule et la nécessité de procéder dans des délais rapides à une campagne de recrutement s’entourant de règles contraignantes.
Rémunérations et défraiement
La mise en place de la réserve sanitaire a conduit l’établissement à passer des accords tant avec les établissements fournisseurs de réservistes qu’avec divers partenaires :
- 185 établissements sont liés avec l’EPRUS par des conventions tripartites de mise à disposition ;
- 20 centres hospitaliers universitaires sièges de SAMU et trois syndicats de médecins lui sont liés par des conventions de coopération pédagogique ;
- un accord de coopération a été passé avec le SAMU de France et un accord de partenariat avec l’Association des Transmetteurs.
Le mécanisme de mise à disposition des réservistes fonctionnaires, agents publics contractuels ou salariés permet le maintien de leur rémunération par leur employeur. L’EPRUS rembourse ensuite l’employeur à partir du nombre de jours travaillés figurant dans l’ordre de mission.
Les professionnels de santé indépendants sont, pour leur part, directement payés par l’établissement, sur la base de la rémunération annuelle de la profession telle que la CNAMTS la fournit annuellement.
Ainsi, le réserviste jouit, quel que soit son secteur professionnel d’origine, de la continuité de ses droits en matière de protection sociale et, le cas échéant, d’ancienneté, d’avancement et de congés payés. Ce statut favorable est complété par la protection accordée au réserviste par l’Etat en cas de mise en cause de sa responsabilité civile ou pénale à l’occasion de son activité dans la réserve sanitaire.
De même, l’EPRUS indemnise le réserviste, ou ses ayants droit, pour les dommages subis dans ce cadre.
Enfin, tous les frais engagés dans le cadre d’une mission sont remboursés sur la base des textes applicables aux fonctionnaires en déplacement.
Les indemnisations et ou les défraiements s’élèvent globalement pour l’année 2009 à 31 303 euros, ce chiffre ne tenant pas compte des dernières missions à l’étranger survenues fin 2009 et début 2010 (Haïti, Chili, voir infra).
Les actions de communication et d’information
Des actions de communication vers les professionnels de santé, les étudiants et les retraités ont été menées à partir d’avril 2009 afin de sensibiliser ces catégories à la réserve sanitaire. L’équipe en charge de celle-ci a participé aux salons et congrès professionnels des pharmaciens, des médecins et infirmiers urgentistes. De nombreux contacts avec la presse spécialisée ont permis la diffusion d’articles dans Le Généraliste, le Quotidien du Médecin, La Revue Soins, Le Moniteur des pharmacies, les revues des étudiants en médecine, en pharmacie et en soins infirmiers, et les différentes revues ordinales.
En juin suivant, la présentation de la réserve sanitaire a été faite lors des assemblées générales des associations des étudiants en médecine et en pharmacie et s’est poursuivie, à la rentrée de septembre, par la diffusion de plus de 46 000 dossiers d’information et d’affiches dans l’ensemble des facultés de pharmacie, de médecine, de sages-femmes et dans les instituts de formation en soins infirmiers.
Les médecins retraités ont été destinataires d’un courrier DGS–DHOS relayé par le conseil national de l’ordre des médecins et 11 300 dépliants ont été envoyés, via la Caisse autonome de retraite des médecins de France (CARMF), aux médecins ayant cessé d’exercer depuis moins de cinq ans. Une nouvelle campagne de communication était envisagée en début d’année 2010. Deux premiers bulletins ont été adressés en septembre 2009 et janvier 2010 à tous les réservistes par un système d’information instantané visant notamment à les informer des évolutions de la réserve et des mobilisations.
L’établissement a, par ailleurs, pris diverses initiatives visant à satisfaire au mieux à ses obligations réglementaires en termes de formation des réservistes :
- élaboration de référentiels de compétences de la réserve sanitaire d’intervention et de renfort, qui ont fait l’objet d’une validation du comité consultatif de l’EPRUS ;
- recensement de l’ensemble des programmes universitaires de formation existant dans le domaine de l’urgence sanitaire ;
- conception d’un programme de formation en cinq modules en vue de proposer aux volontaires réservistes des supports pédagogiques adaptés à leurs futures missions et déclinant l’acronyme de l’établissement :
module E : aspects administratif, juridique, organisationnel de la réserve sanitaire.
module P : conditions de préparation d’une mission.
module R : réponses possibles en termes de compétences à mobiliser.
module U : l’urgence d’une mission de la réserve sanitaire.
module S : les spécificités sanitaires auxquelles les réservistes devront répondre.
La mise en place d’une plateforme d’enseignement à distance est prévue qui permettra aux volontaires réservistes d’accéder aux contenus de formation. Le marché public a été notifié le 3 mars 2010. Cette plate forme permettra une souplesse d’utilisation pour les réservistes et une économie sur les coûts de déplacement pour l’établissement.
Néanmoins, des formations par groupes compléteront cette formule dans le souci de « favoriser les échanges et ainsi développer l’esprit d’appartenance au corps de la réserve sanitaire ». Ainsi, douze réservistes participeront à l’exercice de 2010 du diplôme universitaire « d’expertise dans la gestion des interventions d’urgence sanitaire » sous l’égide de l’université Paris 12, en particulier l’UFR de médecine de Créteil.
Les premières formations dispensées par l’EPRUS se sont déroulées dans le contexte de l’épidémie grippale et ont permis de former 48 médecins réservistes à l’aide à la régulation médicale des appels au SAMU–Centre, et quinze aux situations de crise sanitaire dans huit sites (Pontoise, Amiens, Angers, Metz, Bordeaux, Nancy, Nantes, Lyon).
Ce module a nécessité un travail de collaboration entre l’Association les Transmetteurs, le DUS, le SAMU de France et les trois principaux syndicats de médecins généralistes et également avec les 33 CHU et les deux CH de Corse sièges de SAMU-Centre d’enseignement aux soins d’urgences (CESU). L’objectif était de former à l’échelle locale des compétences de proximité.
3. Une utilisation encore limitée de la réserve sanitaire au regard d’autres modalités de mobilisation des ressources humaines
L’article L. 3134-1 du CSP prévoit que dans une situation le justifiant, tant en France qu’à l’étranger, « les ministres chargés de la santé et de la sécurité civile peuvent conjointement faire appel à la réserve sanitaire par arrêté motivé » et que cet arrêté « détermine le nombre de réservistes mobilisés, la durée de leur mobilisation ainsi que le département ou la zone de défense dans lequel ils sont affectés ».
Cet article de portée législative donne à cette procédure de l’arrêté conjoint et motivé le caractère d’une procédure obligatoire, le mot « peuvent » visant l’appréciation d’opportunité du recours à la réserve sanitaire et, en aucune manière, à donner un caractère facultatif à cette exigence de forme juridique.
En outre, la « doctrine d’emploi » du 8 septembre 2008 l’a encore renforcée en précisant (point 3.1) que cette « formalisation » par arrêté conjoint devait être assortie d’une « évaluation préalable » réalisée « par le ministère de la santé conjointement avec le ministère de la sécurité civile, voire le ministère des affaires étrangères » et à laquelle l’EPRUS soit « associé ». En réalité, cette procédure formalisée n’a été respectée que dans une minorité des cas récents de mobilisation de personnels sanitaires.
Quatre cas seulement de recours formel à la « réserve sanitaire »
Sous le titre « Liste des opérations ayant mobilisé la réserve sanitaire en 2009 » (voir tableau ci dessous), l’EPRUS récapitule neuf interventions s’étant développées soit en France, soit à l’étranger101. Ce bilan est cependant pour partie trompeur car la procédure légale de saisine propre à la réserve sanitaire stricto sensu n’est intervenue, en réalité, que dans trois cas concernant l’épidémie grippale (arrêtés d’août 2009 concernant la Nouvelle-Calédonie et la Polynésie française et relatif à Wallis et Futuna ; arrêté du 9 février 2010 pour le territoire métropolitain et les DOM) et pour l’une des interventions à Haïti (arrêté du 27 janvier 2010).
Tableau n° 12 : « Liste des opérations ayant mobilisé la réserve sanitaire en 2009 »
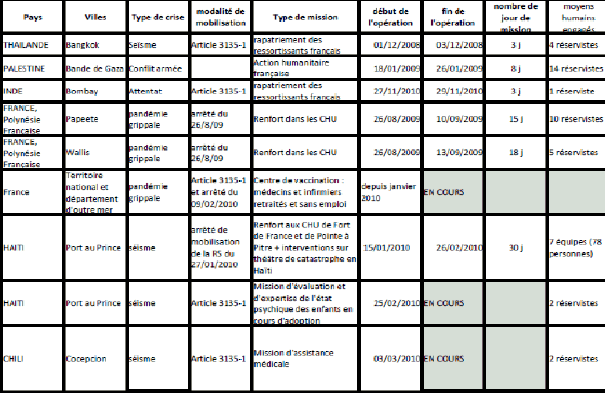
Source : EPRUS
La réquisition employée pour les personnels retraités et sans emploi de la campagne de vaccination H1N1
Bien que la mobilisation des professionnels de santé retraités ou sans emploi pour la campagne de vaccination soit mentionnée par l’établissement dans son récapitulatif des saisines de la réserve, elle s’est en réalité opérée en vertu de l’article L. 3131-8 du CSP qui organise la réquisition des professionnels de santé et l’arrêté pris le 9 février 2010 qui met leur rémunération à la charge de l’EPRUS vise comme justification de cette imputation la fin du deuxième alinéa de l’article L 3135-1 qui est relative aux « actions de prévention ».
L’échelle encore limitée de constitution du corps des réservistes et les exigences spécifiques de la campagne de vaccination grippale ont en effet conduit à ce que la mobilisation nécessaire de personnels de santé ne puisse faire recours au dispositif de la réserve sanitaire. Le caractère interministériel du dispositif mis en place aurait de surcroît soulevé des difficultés tenant aux règles différentes d’emploi qui régissent la réserve de sécurité civile dépendant du ministère de l’intérieur. Ces différentes considérations ont conduit à privilégier le recours à la réquisition par voie d’arrêté préfectoral telle que l’autorise l’article L. 3131-8 du CSP. Cette procédure a été organisée par un arrêté du 4 novembre 2008, en considération notamment de « l’enjeu sanitaire d’une protection rapide des populations les plus exposées ou les plus à risques et (de) la nécessité d’adapter l’offre de vaccination en fonction des publics ». Un arrêté du 29 décembre suivant a fixé les conditions d’indemnisation des divers professionnels concernés.
Dans un document établi en février 2010, l’établissement attirait cependant l’attention sur le cheminement complexe des décisions prises s’agissant des personnels, décisions successives qui témoignent en effet tant des difficultés à organiser dans des conditions d’urgence un recours à la réserve sanitaire selon les procédures légales de recrutement et de mobilisation en vigueur que de l’ambiguïté du régime juridique sous lequel ces agents ont en définitive été mobilisés :
- Une circulaire du 1er octobre 2009 ayant pour objet « la mobilisation des professionnels de santé virus A (H1N1) » confiait au préfet de département d’assurer « la cohérence d’ensemble » de cette mobilisation en précisant que le cadre d’emploi en était la réquisition, tout en envisageant, au troisième rang des onze possibilités possibles, que les agents recrutés soient des retraités de moins de cinq ans ou des membres de la réserve sanitaire. Ce même texte ne mentionnait pas l’intervention de l’EPRUS dans les actions de formation et faisait reposer le financement de celles-ci dans le cadre de l’ONDAM.
- Une circulaire du 28 octobre relative à « l’organisation de la campagne de vaccination contre le virus A (H1N1) 2009 » réaffirmait que l’ensemble du personnel employé dans les centres de vaccination le serait sous le régime de la réquisition et que les dépenses en découlant pour les professionnels de santé seraient réglées par l’assurance maladie.
- Une fiche adressée postérieurement à cette circulaire qui a prévu que l’EPRUS liquiderait l’indemnisation pour les professionnels retraités et sans activité en précisant à la fois que cela se ferait notamment « sur la base de l’arrêté de mobilisation de la réserve sanitaire », texte qui pourtant n’avait nullement été pris, et que les indemnisations étaient dues aux professionnels « ayant signé un contrat d’engagement dans le cadre de la procédure simplifiée », cette formule visant de facto l’arrêté de réquisition et d’affectation des agents concernés, actes étrangers au cadre réglementaire propre à la réserve.
Dans ces conditions marquées par une grande confusion juridique, l’établissement s’est mis en capacité de traiter les dossiers individuels en les qualifiant, en contradiction avec les dispositions légales, d’« inscription dans la réserve sanitaire selon des modalités simplifiées définies par les services du ministère » ou en décrivant leur situation comme celle d’agents « intégrés pour la durée de leur activité dans les centres comme réservistes sanitaires ». Ces formulations ambigües reflètent les incertitudes qui, pendant longtemps, ont perduré sur le statut des personnels mobilisés dans l’attente que leur contrat s’inscrive dans le cadre juridique de la réserve. Pour autant, l’arrêté indispensable à la mise en paiement de leur rémunération a été pris en définitive, le 9 février 2010, par le seul ministre de la santé sur la base de la réquisition et en faisant référence, on l’a vu, aux « actions de prévention » imputables à l’EPRUS, et non pas au titre de la réserve sanitaire, comme cela avait été initialement envisagé ; l’arrêté conjoint qui aurait été nécessaire à cet effet ne pouvait en effet être pris à titre rétroactif dès lors que la situation de crise pandémique n’était plus d’actualité.
L’établissement entendait cependant donner trois mois aux agents concernés pour porter à sa connaissance « leur souhait de s’engager dans la réserve sanitaire », sous réserve que soit validée leur aptitude physique à le faire. Les personnels retraités ou sans emploi réquisitionnés dans le cas de la campagne contre la grippe peuvent en effet être considérés comme le gisement le plus accessible pour le développement escompté de la réserve, notamment de renfort.
Comme suite à une demande de l’établissement, la DGFiP a indiqué le 5 janvier dernier que, si les facturations de charges afférentes aux réservistes salariés ou agents publics qui continuent à être rémunérés par leurs employeurs doivent être imputées au compte 6214 « Personnel prêté à l’établissement », les rémunérations destinées aux réservistes libéraux, retraités ou sans emploi, directement versées par l’EPRUS, peuvent l’être au compte 6448 « Autres rémunérations du personnel recruté en application de conventions ». Bien que leur régime juridique soit distinct, puisqu’il relève de la réquisition, c’est aussi ce dernier traitement comptable qui est appliqué aux rémunérations versés aux personnels de la campagne de vaccination H1N1 visés par l’arrêté du 9 février 2010.
Compte tenu des incertitudes susceptibles de persister au regard de l’hypothèse précédemment envisagée d’une mobilisation se faisant sous le régime formel de la « réserve sanitaire », la lettre conjointe des directeurs de cabinet des ministres de l’intérieur, du budget et de la santé du 31 janvier 2010 organisant l’indemnisation des professionnels de santé mobilisés pour la campagne de vaccination a encore dû préciser, s’agissant des personnels retraités ou sans emploi, que, « dans un souci de simplification et d’allègement des procédures » leur rémunération serait assurée « sans qu’il soit nécessaire d’avoir recours à un contrat de réserviste ».
A la mi-septembre, 10 842 dossiers avaient été traités par l’EPRUS et fait l’objet d’un versement par l’Agence de services et de paiement102 (ASP), établissement public d’assistance administrative auquel l’établissement a fait recours, l’agence comptable ne disposant pas du personnel nécessaire pour servir des rémunérations en aussi grand nombre par un marché public passé et notifié en date du 22 décembre 2009103.. Le total de la rémunération et des charges versées à la mi-septembre atteignait 12,8 M€, pour un coût moyen employeur de 1 188 €, 55 dossier, incomplets, faisant encore l’objet d’une relance
Des modalités plus informelles de mobilisation des professionnels salariés
Quatre des mobilisations recensées dans le tableau récapitulatif établi par l’EPRUS ne font référence ni à la procédure formelle de saisine propre à la réserve sanitaire, ni à celle de la réquisition, mais ont fait l’objet d’une simple lettre du DGS. En pratique, l’ensemble des professionnels ainsi mobilisés ont pourtant, à la différence de ceux mobilisés dans le cadre de la campagne de vaccination, tous appartenu à l’effectif formel de la réserve sanitaire. Il s’agit des interventions consécutives aux attentats de Bombay (lettre du 27 novembre 2008), aux tremblements de terre en Thaïlande (lettre du 1er décembre 2008), en Haïti pour l’envoi de deux médecins devant examiner des enfants en cours d’adoption (lettre du 24 février 2010), et au Chili (lettre du 3 mars 2010), cas auxquels on pourrait ajouter une lettre du même type relative aux suites des évènements de Nairobi (lettre du 4 février 2009).
On observe que le choix de faire ou non recours à la procédure légale prévue par l’article L. 3134-1 ne semble obéir ni à un critère territorial distinguant entre opérations nationales ou internationales (puisque l’une des opérations en Haïti a fait l’objet d’un arrêté conjoint), ni à un critère de taille (puisque l’arrêté pris pour Wallis-et-Futuna ne concerne que cinq réservistes). Pour les interventions ne faisant pas l’objet d’un arrêté, le tableau se réfère, dans des conditions juridiques mal établies, à une application de l’ « article L. 3135-1 », laquelle est également invoquée pour deux des opérations faisant par ailleurs l’objet d’un arrêté : la campagne antigrippale en France, qui, on l’a vu, a en définitive a été traitée au moins budgétairement comme une réquisition, et l’intervention en Haïti. De surcroît, deux des lettres de saisine directes de l’établissement font, par erreur entre les dispositions législatives et réglementaires du code, référence à un « alinéa 6 » de l’article L. 3135-1 qui ne comporte que quatre alinéas.
Au-delà de ces éléments de confusion, il semble que la DGS fasse appel à une interprétation extensive du deuxième alinéa de l’article L. 3135-1 en ce qu’il dispose que l’établissement « a également pour mission, à la demande du ministre chargé de la santé, d’acquérir, de fabriquer, d’importer, de distribuer et d’exporter les produits et services nécessaires à la protection de la population face aux menaces sanitaires graves ». A vrai dire, la rédaction de l’article suggère surtout que les « services » ici mentionnés pourraient concerner des prestations de stockage, conditionnement ou transports de produits sanitaires. Mais l’interprétation retenue conduit à assimiler la mobilisation de personnels de santé à des fins d’urgence à une telle « acquisition de services », et à leur « exportation » dans le cas d’intervention à l’étranger. Cet élargissement de la portée juridique de l’article se heurte cependant au fait que, si l’intention du législateur avait vraiment été de prévoir, par dérogation à la voie de l’arrêté, une procédure de saisine de la réserve sanitaire par simple lettre, c’est à l’article L. 3134-1 que cette faculté aurait dû être introduite et ses critères d’utilisation précisés. Ne pouvant ignorer cette difficulté, la « doctrine d’emploi » de septembre 2008 a tenté de la tourner en apportant les précisions suivantes :
« La mobilisation de professionnels de santé sur la base de l’article 1. 3135-1 (sic) n’a pas vocation à se substituer à la réserve sanitaire mais à permettre une plus grande souplesse dans la mobilisation de professionnels de santé exerçant dans la fonction publique hospitalière. Ces derniers ont la possibilité d’être mis à la disposition de l’EPRUS pour une période donnée dans le cadre d’une convention passée entre les établissements hospitaliers auxquels ils appartiennent ».
On constate cependant en pratique que, dans plusieurs cas, la procédure de la simple lettre se « substitue » bien à la procédure légale de recours à la réserve sanitaire par arrêté, l’établissement lui-même recensant d’ailleurs parmi les cas de « saisine de la réserve », six situations où celle-ci s’est opérée par « mises à disposition de la réserve sanitaire ». La seule limite posée à cette substitution paraît donc être de ne l’appliquer qu’à la mobilisation de réservistes relevant de la fonction publique hospitalière, à l’exclusion de recrues d’origine libérale.
Si l’on peut admettre l’opportunité d’une pratique simple et rapide de mobilisation d’équipes médicales dans des situations d’urgence, une étude juridique approfondie mériterait d’être conduite sur la compatibilité de cette pratique avec le cadre légal actuel lorsqu’il s’agit de faire recours à des membres de la réserve sanitaire, et pour préciser les critères et modalités d’articulation entre les procédures relevant respectivement des articles L. 3134-1 du CSP (emploi de la réserve), L. 3138-1 (réquisition) et L. 3135-1, deuxième alinéa (acquisition ou exportation de services). En outre, il apparaitrait choquant que le recours pour des interventions de réservistes en France, ou a fortiori à l’étranger, à de simples lettres de saisine se réclamant du deuxième alinéa de l’article L. 3135-1 conduise à faire entrer les dépenses exposées dans le décompte de la parité assurance maladie/Etat alors que le législateur a voulu explicitement exclure les charges engagées au titre de la réserve sanitaire de ce périmètre de cofinancement.
S’agissant des missions internationales, la DGS a cependant confirmé à la Cour que « les dépenses engagées, qu’elles concernent des produits ou des personnels, » sont à mettre « à la charge du ministre des affaires étrangères et non de crédits abondés par l’assurance maladie ».
On remarquera par ailleurs que l’EPRUS n’a pas été en mesure de fournir de relevés de décisions ou comptes-rendus témoignant de ce que les diverses saisines, qu’elles aient été faites par voie d’arrêtés ou de simples lettres, avaient été effectivement précédées de l’ « évaluation préalable » dont la DGS s’était fait une obligation dans sa « Doctrine d’emploi ». Cela suggère que si cette démarche a été conduite c’est par une simple concertation orale entre administrations concernées104.
4. Une gestion budgétaire marquée par des risques importants et une sous-consommation de départ
Comme l’indiquait une cartographie des risques établie préalablement au lancement effectif de la campagne de recrutement qui n’a débuté que le 1er décembre 2008, l’estimation du coût de la mobilisation de la réserve sanitaire ou de la mobilisation de professionnels de santé dans le cadre du deuxième alinéa de l’article R. 3135-1 « est difficile, pour ne pas dire impossible à réaliser », le coût annuel dépendant du nombre, de l’effectif, de la durée et du matériel nécessaires de missions d’urgence, par nature peu prévisibles.
La cartographie réalisée par l’établissement identifiait par ailleurs l’existence de risques budgétaires propres aux mobilisations de la réserve sanitaire, dont le principal semblait a priori le non-remboursement à l’EPRUS des rémunérations par les organismes d’affectation des réservistes, « notamment pour les affectations à l’étranger mais également auprès des cabinets médicaux et même auprès des hôpitaux ». La perte ou la destruction de matériels lourds et une imputation à l’établissement de la responsabilité de l’Etat en cas de décès de réservistes apparaissaient également comme des risques potentiels.
Pour sa part, l’exercice 2009 a été marqué par un taux exceptionnellement élevé de sous-consommation des crédits prévus pour la réserve sanitaire, les engagements n’ayant pas dépassé 643 K€, et les mandatements 270 K€ pour une dotation initiale de 4,1 M€. Les diverses opérations mises en œuvre depuis 2008 ont reposé pour l’essentiel sur les ressources budgétaires de l’établissement, aucune contrepartie financière de la part des institutions d’accueil n’étant enregistrée à l’exception du remboursement de certains moyens matériels (postes de secours) installés dans le cadre d’interventions à l’étranger pilotées par le ministère des affaires étrangères ; même dans ces derniers cas, les frais d’acheminement des personnels et leur entretien sur place n’ont pas donné lieu à remboursements.
Avec des « dépenses de développement et de maintien de la réserve sanitaire » s’élevant à 5 063 K€, le budget pour 2010 table, après les retards subis au départ, sur l’adoption d’un régime de croisière de recrutement des réservistes et inclut les coûts de formation de 350 d’entre eux ainsi que, pour un montant de 1 235 K€, les rémunérations correspondant à l’hypothèse d’une catastrophe sanitaire survenant dans l’année.
5. Une réorientation nécessaire
Une doctrine d’emploi à remettre sur pied
Les difficultés rencontrées dans la première phase de recrutement comme à travers la campagne de vaccination ont conduit l’EPRUS à élaborer des propositions tendant à reformuler profondément les orientations tracées précédemment à cette activité. Une note de synthèse préparée en ce sens par son directeur général n’a cependant pas été officialisée dans l’attente d’une réunion prochaine du comité stratégique qui devrait tendre à formuler une position concertée avec la DGS.
Entre-temps, le directeur général de l’EPRUS avait indiqué, lors du conseil d’administration du 7 mai 2010, qu’il jugeait nécessaire un « repositionnement du statut de la réserve sanitaire» qu’il résumait ainsi :
« Il semble opportun aujourd’hui, à l’aune de l’expérience passée, de réfléchir à la redéfinition des missions et du champ d’action de la réserve sanitaire en général. Il pourrait par exemple être envisagé :
- une réserve d’intervention composée de 250 personnes (organisées en équipes constituées) spécialistes des situations d’urgence et de catastrophe ayant une expérience avérée sur les théâtres d’opérations extérieures ;
- une réserve de renfort composée de plusieurs milliers de professionnels de santé (étudiants, actifs, retraités) gérés à partir d’un fichier consolidé réalisé en collaboration avec les ARS ».
Cette formulation un peu elliptique semble de nature à inspirer une réorientation profonde notamment pour la réserve de renfort, de laquelle est attendue la plus forte contribution quantitative en cas de crise. Il semble envisagé, à travers la médiation des ARS, de rechercher une décentralisation des recrutements permettant de bénéficier du savoir faire et des fichiers dont bénéficient l’administration préfectorale et les réseaux sanitaires locaux par leur expérience ancienne des procédures de réquisition.
Sur cette base, des objectifs de recrutement et de formation de réservistes devraient être redéfinis sur une base pluriannuelle en prenant en compte de manière réaliste les effectifs des divers gisements disponibles et les possibilités d’intégration des personnes requises à l’occasion de la campagne de vaccination H1N1 dont l’effectif pourrait dépasser les 10 000. Ces objectifs seraient à officialiser dans le contrat de performance de l’établissement et assortis d’indicateurs annuels d’exécution.
La DGS admet que l’expérience récente a mis en lumière la mauvaise adaptation des règles actuelles régissant la réserve aussi bien pour « la mobilisation massive de professionnels de santé » requise pour la campagne de vaccination H1N1 que face à des urgences sanitaires à l’étranger réclamant « des profils médicaux spécifiques (chirurgiens orthopédiques, pédiatres ». Elle considère donc comme « un chantier pour les mois à venir » une adaptation de la doctrine d’emploi de la réserve, n’excluant pas « l’aménagement des textes la régissant » en vue de « donner à l’EPRUS les marges de manœuvre lui permettant de disposer d’une plus grande souplesse dans la mobilisation des ressources et de prendre en compte les nécessités d’une gestion moins centralisée en harmonie avec la montée en puissance de la zone et la mise en place des agences régionales de santé ».
Vers une « réserve de sécurité nationale » ?
Reconnaissant les difficultés de mise en place de la réserve sanitaire, la DGS avance que la première direction générale de l’EPRUS aurait insuffisamment perçu que, loin d’intervenir « dans un paysage vierge de toutes initiatives », elle devait prendre en compte le rôle tant de la sécurité civile que des professionnels de santé réunis autour de SAMU de France.
En vue d’améliorer les dispositifs de gestion de crise sur le territoire national et d’optimiser l’usage des ressources humaines de sécurité, le « Livre blanc sur la défense et la sécurité nationale » recommande la mise en place d’une coopération interministérielle sur l’engagement des réserves en situation de crise aigüe. L’EPRUS et son ministère de tutelle étaient invités à la réflexion autour du concept d’une réserve de sécurité nationale. Cette perspective se trouvait renforcée par les difficultés que l’organisation de la lutte contre l’épidémie grippale avait permis de pressentir tenant aux règles différentes régissant la réserve sanitaire d’urgence.
Une première réunion s’est tenue au SGDSN le 19 mars 2010 en vue de réaliser un point de situation des réserves en France et de définir le cadre de leur coopération. Selon le compte-rendu élaboré par le SGDSN, l’objectif serait de constituer, en vue de situations de crise grave (multi-attentats terroristes, pandémie, catastrophes naturelles, industrielles ou technologiques, forte dégradation de l’ordre public), un dispositif qui « s’appuiera sur les corps existants » et permettant de « coordonner l’engagement des réservistes, dans le respect des prérogatives des ministères organiques ». Cette réserve nationale coordonnerait des membres de la réserve militaire, de la réserve civile de la police nationale, de la réserve sanitaire, de la réserve civile pénitentiaire et vraisemblablement des réserves communales de sécurité civile ; pour ces dernières qui ne sont pas gérées par l’Etat, les modalités de leur emploi devraient être définies par la loi. Un tableau liste les études à entreprendre en ce sens, en ce qui concerne notamment le recensement des compétences et emplois des divers réservistes, la fixation des activités d’importance vitale, les éventuelles harmonisations juridiques entre les corps.
Lors d’une seconde réunion tenue le 10 mai 2010, le SGDSN a présenté un avant-projet tendant à introduire dans un nouveau chapitre s’insérant dans le titre « Défense civile » du code de la défense des dispositions législatives visant à créer une réserve de sécurité nationale, outil non-exclusif de conduite de crise permettant d’harmoniser les modalités d’engagement des réservistes, notamment vis-à-vis de leur employeur. La réserve sanitaire serait donc, selon ce projet, une composante de la réserve de sécurité nationale Aucun nouveau corps ne serait créé et seul le premier ministre pourrait activer ce dispositif exceptionnel par décret dans le respect des prérogatives actuelles des divers ministères. Ce projet a été de nouveau examiné lors d’une nouvelle réunion, le 17 juin, et, après échanges plus approfondis entre les diverses administration, pourrait être validé en octobre prochain.
D. LES ACTIVITES INTERNATIONALES
1. Plusieurs interventions d’urgence à l’étranger
Si, implicitement, elles visent à titre principal une intervention sur le territoire national, les missions légalement confiées à l’EPRUS par l’article L. 3135-1 n’excluent pas que celui-ci soit appelé à participer à la gestion des crises à l’étranger que ce soit sous la forme d’un appui logistique ou par un renfort en ressources humaines. S’agissant du corps de réserve sanitaire, l’article L. 3132 après avoir indiqué qu’il avait vocation à répondre aux situations de crise « sur le territoire national », précise d’ailleurs que le contrat d’engagement des réservistes « peut prévoir l’accomplissement de missions internationales » et que les modalités de sélection à cet effet relèvent d’un arrêté des ministres chargés de la santé et de la sécurité civile. Les missions de ce corps le préparent en effet à renforcer la prise en charge de soins ou médico-sociales des victimes ou à assurer l’accompagnement sanitaire de rapatriements.
Outre les remarques juridiques faites précédemment sur les modalités de recours à la réserve sanitaire, il est à remarquer que cet arrêté, annoncé comme « en cours de rédaction » dans la « doctrine d’emploi » ne paraît pas avoir été publié.
Sur les dix saisines dont, jusqu’à début mars 2010, la réserve sanitaire avait fait l’objet de la part du ministre de la santé, six ont concerné des interventions à l’étranger105. L’intervention en Haïti a mobilisé, à elle seule, près de 80 personnes, dont 31 médecins, et huit tonnes de matériel médical. Cette expérience a mis en lumière le risque de demandes adressées de manière dispersée à l’EPRUS ou à des établissements hospitaliers, ce qui a conduit à réaffirmer le principe d’une validation unique par la DGS et le rôle de son centre de crise dans la validation des demandes. C’est ainsi que l’opération à Gaza a fait l’objet d’une saisine informelle directe par les Affaires étrangères, ce qui a amené la DGS à rappeler à l’établissement qu’elle entendait rester en ce domaine « le seul interlocuteur autorisé ». S’agissant du Chili, les difficultés rencontrées vis-à-vis d’un grossiste devaient conduire à la passation d’un accord-cadre pour les livraisons en urgences de médicaments et dispositifs médicaux.
Par ailleurs, pour faire face à ces missions internationales, l’EPRUS s’est doté de 50 paquetages individuels assurant une autonomie de 24 h et de 180 tenues adaptées. Il s’est également porté acquéreur de deux téléphones satellites, de quatre téléphones GSM ainsi que de cinq ordinateurs portable durcis et, s’agissant des dispositifs médicaux, de 8 moniteurs de surveillance (Propaq et Lifepak défibrillateurs) et de trois équipement de diagnostic médical HemoCues.
Une convention spécifique a, en outre, été passée le 10 décembre 2009 entre le service de santé des armées et l’EPRUS pour l’assortiment et le réassortiment de sacs de matériels et de médicaments à destination des réservistes sanitaires de l’établissement ; elle devait permettre d’équiper rapidement treize équipes mobiles constituées au minimum d’un médecin et d’un infirmier, en vue d’intervenir dans les situations « catastrophes », « rapatriement » ou « pré-hospitalier ».
Un bilan des missions en Haïti a été réalisé en février 2010 par le DUS en liaison avec l’équipe du pôle de la réserve sanitaire. Lors de ces rencontres, les réservistes ont soulignés, notamment, l’importance de définir précisément le cadre de la mission, de partir en équipe constituée, d’assurer une présence continue sur le site de mission, d’identifier les réservistes de l’EPRUS et de mieux adapter le matériel opérationnel aux missions demandées.
Des actions correctrices ont été prises en ce sens par le pôle réserve sanitaire. Pour répondre au souhait d’autonomie financière des missions, l’établissement envisage pour l’avenir qu’elles se voient attribuer une régie d’avance, selon la procédure décrite dans la base de gestion des procédures qualité de l’établissement (ENNOV5).
Face au manque de moyens de télécommunication sur site, il a mis à l’étude l’acquisition de moyens de radio-télécommunication à courte portée, de clefs USB permettant l’accès à un réseau de type 3G. De plus, l’EPRUS entend créer un module de formation pour les personnels susceptibles de partir en mission en vue de les préparer à l’utilisation des moyens satellites.
2. Des coopérations internationales encore limitées
Les tâches requises pour sa mise en place puis les urgences tenant à la gestion de la lutte contre la grippe H1N1 n’ont pas permis jusqu’à présent à l’EPRUS de tisser des coopérations avec les divers organismes nationaux chargés de missions comparables ou avec les instances multilatérales compétentes.
Une seule initiative peut être mentionnée. Un représentant de l’établissement a assuré, à l’occasion d’une conférence internationale sur les risques nucléaire, radiologiques, bactériologiques et chimiques (NRBC) tenue à Washington en novembre 2009, une présentation de ses missions et du mode d’organisation français de la gestion des stocks et de la réserve sanitaire. La DGS a communiqué ce texte à ses homologues japonais.
partie iv : LE FINANCEMENT DE L’EPRUS
Le financement de l’EPRUS est évoqué ci-après sous trois aspects largement interdépendants. D’une part, la Cour examine l’application du principe légal de financement à parité entre l’Etat et l’assurance maladie pour les activités de l’établissement pharmaceutique. Celle-ci n’a pas encore donné lieu à un bilan à l’issue de la première période triennale d’activité de l’EPRUS, alors que l’exécution budgétaire sur ces mêmes exercices a été marquée par un important surfinancement de l’établissement par l’assurance maladie (A). D’autre part, elle évoque les modalités de financement de la campagne de lutte contre la grippe H1N1, qui apparaissent pour partie contestables (B). Enfin, est commentée la situation résultant de ces évolutions pour les comptes de l’établissement (C). Pour sa part, la question de la programmation budgétaire pluriannuelle a été évoquée dans la partie III.A.2 supra.
A. Un financement à parité par l’Etat et les régimes obligatoires de base d’assurance maladie
1. Un principe légal clairement affirmé
En application de l’article L. 3135-4 du CSP, les ressources de l’EPRUS sont constituées d’une subvention de l’Etat et d’une contribution des régimes obligatoires de base d’assurance maladie106, ainsi que, de manière marginale, des produits des ventes et des placements de trésorerie, ou, le cas échéant, de taxes ou redevances affectées à l’établissement.
Ce même article dispose que la contribution des régimes d’assurance maladie ne peut excéder 50 % des dépenses de l’établissement public au titre des missions mentionnées au deuxième alinéa de l’article L. 3135-1 du CSP, dont l’objet est « d’acquérir, de fabriquer, d’importer, de distribuer et d’exporter des produits et des services nécessaires à la protection de la population face aux menaces sanitaires graves » ainsi que « de financer des actions de prévention des risques sanitaires majeurs ».
Cette définition légale vise principalement les dépenses de l’établissement pharmaceutique constitué au sein de l’EPRUS107. Elle implique a contrario que les dépenses relevant des autres missions de l’EPRUS (gestion administrative et financière de la réserve sanitaire) sont financées en totalité par l’Etat, de même que les frais de fonctionnement de l’établissement.
L’article L. 3135-4 du CSP précise enfin que « le respect de ce plafond est apprécié sur trois exercices consécutifs ».
Cependant, le champ des dépenses cofinancées par l’Etat et les régimes d’assurance maladie et les modalités d’appréciation de la parité du financement n’ont pas été précisés par des dispositions réglementaires ou conventionnelles. Dans ce contexte, l’EPRUS fait une application directe des dispositions législatives pour déterminer la part des dépenses qui incombent respectivement à l’Etat et à l’assurance maladie.
En pratique, le champ des dépenses financées à parité, (produits de santé, consommables, logistique) ne paraît pas avoir soulevé de désaccord de principe entre l’Etat et la CNAMTS, notamment s’agissant de l’indemnisation des laboratoires pharmaceutiques suite à l’annulation partielle des commandes de vaccins contre la grippe H1N1.
Pour l’appréciation du respect du principe de parité, l’article L. 3135-4 du CSP vise le montant des dépenses (« la contribution [des régimes d’assurance maladie] ne peut excéder 50 % des dépenses de l’établissement au titre des missions mentionnées au deuxième alinéa de l’article L. 3135-1 »).
La mention de « dépenses » exclut la prise en compte de critères liés aux dotations de l’Etat et de l’assurance maladie ouvertes ou versées. En revanche, elle est susceptible de recouvrir deux acceptions distinctes : les dépenses décaissées (logique de comptabilité budgétaire) ou les dépenses encourues (logique de comptabilité d’engagement).
A ce jour, ces interrogations demeurent pendantes. En effet, les modalités d’établissement du premier bilan financier triennal n’ont pas encore fait l’objet d’échanges approfondis entre la CNAMTS et l’Etat et demeurent à définir.
2. Un surfinancement de l’EPRUS, déséquilibré au détriment de l’assurance maladie
Les tableaux ci-dessous présentent la synthèse des résultats de l’exécution budgétaire de l’EPRUS au titre de la période 2007-2009 et des prévisions les plus récentes pour 2010, en distinguant la part de l’Etat et celle des régimes d’assurance maladie.
Tableau n° 13 : Exécution du budget de l’EPRUS 2007-2009108
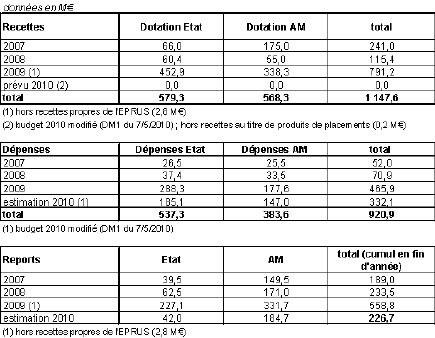
Source : Cour des Comptes sur la base de données EPRUS
Ces données chiffrées reflètent :
- une importante sous-consommation des crédits de paiement de l’exercice 2007 (189,0 M€), en raison des difficultés ayant affecté la mise en place de l’EPRUS et de l’absence de constitution de l’établissement pharmaceutique à cette date ; cette sous-consommation n’a pas été résorbée par la suite, que ce soit au titre du rattrapage du budget 2007 ou du financement de la campagne de prévention contre la grippe H1N1 ;
- une activité limitée en 2008, avec des dépenses (70,9 M€) encore inférieures aux recettes pour ce même exercice (115,4 M€) ;
- d’importantes dépenses en 2009 et 2010 (798 M€ au total) liées en grande partie à la campagne de prévention contre la grippe H1N1 (446,2 M€) ; dans le budget prévisionnel modifié de l’EPRUS pour 2010, le financement des dépenses 2010 de l’établissement (332,1 M€, dont 98,6 M€ pour la campagne contre la grippe H1N1) est assuré en quasi-totalité par les reports de crédits au titre de l’exercice 2009 (325,3 M€), le solde étant financé par les reports des exercices antérieurs.
Au titre de 2010, les prévisions budgétaires les plus récentes adoptées par le conseil d’administration de l’EPRUS le 7 mai 2010 font apparaître, pour la fin de l’exercice, un surfinancement de 226,7 M€ au titre des exercices 2007 à 2010, qui pèse pour l’essentiel sur l’assurance maladie. Selon ces prévisions, les dotations inutilisées de l’assurance maladie s’élèveraient en effet à 184,7 M€ au 31 décembre 2010 contre 42,0 M€ pour celles de l’Etat.
3. Un bilan toujours en suspens à l’issue de la période 2007-2009
Comme la Cour l’avait souligné dans son rapport sur les décrets d’avance du 27 novembre 2009109, l’achèvement en 2009 de la première période triennale d’activité de l’EPRUS aurait dû conduire à l’établissement d’un bilan financier destiné à apprécier le respect de la règle du financement à parité de l’établissement pour cette période.
En réponse au rapport précité, le ministre du budget avait précisé que « le schéma de financement proposé par le gouvernement dans le cadre des PLFSS [pour 2010] et PLFR [pour 2009] a bien été construit dans le sens de la loi, avec un objectif de respect de la règle de 50 % des dépenses de produits de santé sur la période 2006-2009 ».
Le calibrage initial des dotations de l’Etat et de l’assurance maladie à l’EPRUS dans le cadre de la préparation du PLFR pour 2009 et du PLFSS pour 2010 a effectivement reposé sur l’objectif d’un rétablissement de la parité du financement à fin 2009, qui avait été rompu dès la première année d’activité de l’EPRUS (voir tableau supra).
Cependant, des évènements postérieurs ont conduit à remettre en cause les besoins de financement de l’EPRUS :
- la réduction du taux de TVA applicable aux achats de vaccins suite à l’obtention des autorisations de mise sur le marché intervenues en septembre 2009 (application du taux réduit de 5,5 % et non plus du taux normal de 19,6 %, voir infra) a réduit de 97 M€ l’évaluation des dépenses de l’EPRUS entrant dans le champ d’un financement paritaire, et, ce faisant, le besoin de financement de l’établissement ;
- la décision, en novembre 2009, de procéder à des dons de vaccins en faveur de l’OMS (73,7 M€110) financés en totalité par l’Etat, a également conduit à retirer les dépenses correspondantes du champ des dépenses financées à parité ;
- dans le cadre du débat parlementaire, la contribution exceptionnelle des organismes complémentaires au financement de la campagne de prévention (dont le produit attendu était alors évalué à 300 M€) a été affectée à la CNAMTS et non à l’EPRUS, contrairement au souhait du gouvernement. Privant l’EPRUS d’une ressource potentielle, le changement d’attributaire de cette contribution a eu pour effet de majorer son besoin de financement paritaire.
L’affectation à la CNAMTS d’une contribution exceptionnelle des organismes complémentaires au titre de la pandémie H1N1
Au terme d’une procédure législative nourrie par de nombreux amendements, la CNAMTS s’est vu affecter par la LFSS pour 2010 une contribution exceptionnelle des organismes complémentaires, assise sur leur chiffre d’affaires, « au titre de leur participation à la mobilisation nationale contre la pandémie111 ». La CNAMTS bénéficiera d’environ 85 % du produit de cette contribution, qu’elle est chargée de répartir entre les régimes d’assurance maladie sur le fondement des clés de répartition des dotations hospitalières112.
Dans le PLFSS déposé au Parlement début octobre 2009, la contribution était affectée à l’assurance maladie, son taux était fixé à 0,94 % et son produit prévisionnel s’élevait à près de 300 M€.
Au cours du débat sur le projet de loi de finances (PLF) pour 2010 à l’Assemblée nationale en novembre, concomitant à celui sur le PLFSS, le gouvernement a proposé par amendement un nouvel article affectant cette même contribution à l’EPRUS, qui a été adopté. S’agissant du changement d’affectataire de cette contribution, l’exposé des motifs de l’amendement indiquait sans plus de justification que « vu que l’EPRUS a acheté les vaccins, il a paru pertinent au Gouvernement et aux assurances complémentaires que la contribution lui soit affectée ».
Cet article a ensuite été supprimé par le Sénat suite à deux amendements déposés au nom de la commission des affaires sociales, par coordination avec les dispositions adoptées dans le cadre du PLFSS. Par ailleurs, plusieurs amendements proposant une réduction du taux de la contribution à 0,77 %, pour tenir compte de l’économie liée à l’application d’un taux de TVA réduit aux vaccins, ont été présentés sans être adoptés dans le cadre de l’examen du PLF.
La LFSS ayant été adoptée sans modification par rapport au PLFSS, la réduction du taux de la contribution à 0,77 % a finalement été introduite dans la loi de finances rectificative pour 2009, suite à un amendement sénatorial. Les dispositions pour 2010 de la LFSS pour 2010 auront ainsi été modifiées à quelques jours d’intervalle par celles de la loi de finances rectificative pour 2009.
L’annulation d’une partie des commandes de vaccins ayant réduit de près de 400 M€ l’estimation des dépenses liées à la campagne de prévention, la fédération des mutuelles de France a saisi la ministre pour demander une révision à la baisse du taux de la contribution. Le ministre chargé de la Santé a annoncé le 15 juin 2010 que celle-ci serait réduite à 0,34 %113. Le produit de la contribution s’élèverait en définitive à environ 100 M€ pour l’ensemble des régimes d’assurance maladie.
En dépit d’un réajustement partiel du montant des dotations à l’EPRUS pour 2009 intervenu avant l’adoption définitive de la LFR et de la LFSS114, la décision du gouvernement début janvier 2010 d’annuler une partie des commandes de vaccins a rendu surabondantes les dotations respectives de l’assurance maladie et de l’Etat fixées par la loi au titre de 2009. S’agissant des crédits budgétaires de l’Etat votés en LFR pour 2009 (433 M€ de crédits de paiement), la somme versée à l’EPRUS a été finalement minorée de 100 M€ pour tenir compte de cette situation115.
Dans ce contexte, la CNAMTS a adressé le 29 janvier 2010 un courrier au ministre du budget, des comptes publics, de la fonction publique et de la réforme de l’Etat et à la ministre de la santé et des sports pour demander une « réduction de charges » en sa faveur de 190 M€ au titre du financement de l’EPRUS pour la période 2007-2009, dont la constatation interviendrait dès l’établissement des comptes de l’exercice 2009.
Comme le montre le tableau récapitulatif de l’exécution du budget de l’EPRUS depuis sa création (voir supra), le montant avancé par la CNAMTS a un ordre de grandeur voisin de celui des crédits en provenance de l’assurance maladie ouverts au budget de l’EPRUS depuis sa création et demeurés inutilisés en prévision à fin 2010.
Le montant demandé par la CNAMTS a été estimé sur le fondement des contributions de l’assurance maladie votées en LFSS et comptabilisées en charges par la CNAMTS, indépendamment des montants effectivement décaissés. A cet égard, il convient de rappeler que, dans le cadre de la convention du 7 mai 2009 entre l’EPRUS, l’ACOSS et la CNAMTS, le versement des dotations de l’assurance maladie est effectué en fonction des besoins de trésorerie de l’EPRUS. Ainsi, au 31 décembre 2009, seuls 352 M€ avaient été versés au titre des contributions fixées en LFSS pour les années 2007, 2008 et 2009 qui s’élevaient au total à 568,3 M€. Le solde restant à verser (216,3 M€) était inscrit en créance au bilan de l’EPRUS.
En réponse au courrier de la CNAMTS, les ministres ont indiqué le 5 mars 2010 qu’une « restitution » de la contribution de la CNAMTS au titre du financement triennal de l’EPRUS, d’un montant « au moins supérieur à 100 M€ », interviendrait dans le cadre des dispositions de la LFSS pour 2010 et qu’ « aucune disposition législative ne pouvait revenir sur le montant [comptabilisé au titre de 2009 sur le fondement des dispositions rectificatives pour 2009 de la LFSS pour 2010] avant la clôture des comptes ».
En outre, ils ont précisé que le montant de la régularisation « ne pourra […] être établi qu’au cours de l’année 2010, une fois connu le montant des indemnités qui seront versées aux laboratoires pharmaceutiques par l’EPRUS du fait de la résiliation de 50 millions de doses de vaccins et compte tenu des ajustements éventuels de la programmation de l’EPRUS en cours d’année ».
***
En définitive, l’intégralité des dépenses de l’EPRUS liées à la prévention de la grippe H1N1 (446,2 M€116, voir tableau infra) auront été financées par les dotations votées en LFSS et en lois de finances pour 2009. Le budget de l’EPRUS pour 2010 fait apparaître d’importants reports de crédits en fin d’année, estimés à 226,7 M€. Ces reports, qui traduisent un excédent de financement des dépenses au titre de la grippe H1N1, devraient entraîner une réduction des dotations futures de l’Etat et de l’assurance maladie à l’établissement. A la demande des tutelles, le conseil d’administration de l’EPRUS a d’ores et déjà annulé les recettes inscrites au budget primitif de l’établissement pour 2010, à hauteur des dotations fixées par la LFSS et la LFI pour 2010 (85 M€)117.
En outre, l’objectif d’un équilibre à parité du financement de l’EPRUS par l’Etat et par l’assurance maladie n’a pas été atteint à la fin de l’exercice 2009, au détriment de l’assurance maladie et le bilan financier définitif pour la période triennale 2007-2009 demeure à établir. Les dépenses de l’EPRUS liés à la pandémie grippale étant désormais connues, ce bilan devrait être établi sans tarder afin que les conséquences puissent en être tirées dès la préparation du PLFSS pour 2011 et du PLFR pour 2010.
La CNAMTS souligne qu’elle « attache la plus grande importance à l’élaboration du constat triennal qui permettra de confirmer ou non le niveau de la contribution de l’assurance maladie », ce constat ayant vocation à « clairement identifier les dépenses devant rester à la charge exclusive de l’Etat (dépenses de fonctionnement, dépenses relatives à la réserve sanitaire, dépenses engagées exclusivement pour le compte de l’Etat ». Précisant qu’elle « ne dispose pas, à ce jour, de l’ensemble des données nécessaires à l’analyse détaillée des dépenses relevant du cofinancement », elle indique avoir rappelé « à plusieurs reprises la règle de parité de contribution avec l’Etat, celle-ci devant s’apprécier, comme le souligne la Cour, par rapport au montant des dépenses et non par rapport à l’ensemble des contributions reçues ».
En outre, la CNAMTS rappelle que le « caractère incomplet des informations dont disposait l’assurance maladie, associé à une surévaluation des besoins de financements initiaux » de l’EPRUS l’avaient conduite à demander, dans le cadre de l’élaboration de la convention financière EPRUS / CNAMTS / ACOSS signée le 7 mai 2009, l’introduction de dispositions « destinées à veiller à la bonne adéquation entre ses versements et les besoins de trésorerie effectifs » de l’EPRUS et soumettant « à la validation préalable du directeur général de la santé les demandes de versement de l’EPRUS ». La CNAMTS souligne enfin que la réduction de sa contribution au titre du financement de la campagne de prévention contre la grippe H1N1 « implique une disposition législative, qui pourrait être adoptée dans le cadre du PLFSS pour 2011 ».
La direction du budget, quant à elle, précise que « les dispositions législatives relatives au plafond de financement par l’assurance maladie n’ont pas pu être respectées à fin 2009, du fait de l’enchaînement d’évènements liés à la pandémie de grippe H1N1, qui est rappelé dans le rapport ». Elle indique que « la LFSS pour 2011 intégrera une reprise sur dotation à l’EPRUS qui permettra, a posteriori, le respect de l’article L. 3135-4 du code de la santé publique pour la période 2006-2009 », en précisant que « pour cette opération, ce seront les dépenses effectives qui seront prises en compte, et non celles engagées » et que « le montant exact de cette correction est actuellement en cours de détermination puisqu’il devra prendre en compte d’éventuels dons de vaccins complémentaires à l’OMS pris en charge intégralement par l’Etat ».
B. Des modalités pour partie contestables de financement des dépenses liées à la campagne de prévention contre la grippe H1N1
1. Une succession de décisions budgétaires modificatives en 2009
Le budget primitif de l’EPRUS pour 2009, adopté par le conseil d’administration en décembre 2008, reposait sur des prévisions de recettes et dépenses d’un montant respectif de 114 M€ et 289 M€, laissant apparaitre une insuffisance de financement de 176 M€, devant être compensée par un prélèvement sur les reports des exercices antérieurs. Les dépenses prévisionnelles portaient principalement sur le plan de prévention des pandémies grippales (236,7 M€)118.
La survenance du risque épidémique lié à la grippe H1N1 au 1er semestre 2009 a conduit à procéder, entre le 30 juin et le 16 décembre 2009, à trois décisions budgétaires modificatives successives en dépenses et recettes pour prendre en compte les dépenses imprévues alors apparues ainsi que les mesures de financement correspondantes décidées par l’Etat.
Ces évolutions sont synthétisées ci-dessous :
Tableau n° 14 : Evolution du budget de l’EPRUS en 2009
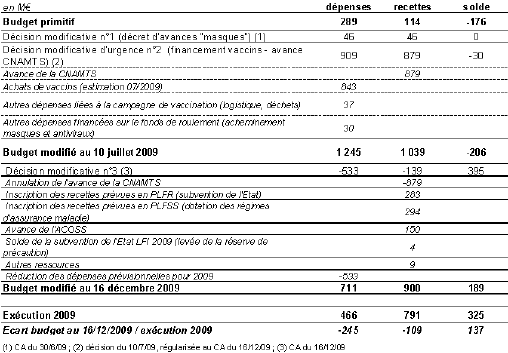
Source : Cour des Comptes à partir des décisions budgétaires modificatives de l’EPRUS
Au cours du deuxième semestre de 2009, le budget prévisionnel pour 2009 a ainsi atteint jusqu’à 1 245 M€ en dépenses (1 039 M€ en recettes), pour être ramené en fin d’année à 711 M€ (900 M€ en recettes). L’exécution budgétaire s’est finalement inscrite en net retrait par rapport au dernier budget prévisionnel modifié à la mi-décembre 2009, avec des dépenses de 466 M€ et des recettes de 791 M€, en raison principalement des décalages intervenus dans les livraisons de vaccins.
Les dépenses de l’EPRUS liées à la campagne de prévention contre la grippe H1N1 s’élèvent en définitive à 347,6 M€ pour 2009, compte non tenu des achats de masques de protection FFP2 (68 M€).
Suite à la décision du gouvernement, début janvier 2010, d’annuler une partie des commandes de vaccins pour un montant de 377,8 M€, le budget 2010 de l’EPRUS a été révisé à la baisse en mai 2010 pour s’établir à 332,1 M€ en dépenses, dont 98,6 M€ au titre de la campagne de prévention contre la grippe H1N1. Les recettes prévisionnelles (85 M€) ont été annulées en totalité.
Au total, les dépenses de l’EPRUS pour 2009 et 2010 se décomposent ainsi :
Tableau n° 15 : Dépenses de l’EPRUS (2009-2010)
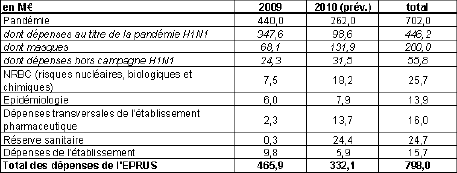
Source : Cour des Comptes à partir des données de l’EPRUS
2. Un usage inapproprié de la procédure des décrets d’avance
Un décret d’avance du 13 juillet 2009 a attribué 46,2 M€ de crédits supplémentaires à la mission « Santé » (programme 204) en vue de l’achat de masques de protection pour les agents du service public (hors secteur de la santé). La réalisation de cet achat a été confiée à l’EPRUS119, suite à une décision en ce sens de la cellule interministérielle de crise. La dépense engagée par l’EPRUS s’est en définitive limitée à 38,7 M€ en raison d’un prix unitaire d’achat inférieur à la prévision. A fin mai 2010, le solde (7,5 M€), qui avait été réaffecté au financement de besoins éventuels des autres administrations, n’était pas mobilisé.
Les instructions adressées à l’établissement par le ministère de la santé ne précisent pas le fondement juridique de la prise en charge de ces achats par l’EPRUS. Au regard de la définition légale des missions de l’EPRUS, il ne semble guère pouvoir être que la dernière phrase du second alinéa de l’article L. 3135-1 du CSP, qui dispose que l’EPRUS « peut également financer des actions de prévention des risques sanitaires majeurs ».
Compte tenu de l’emploi par l’alinéa précité de termes très généraux pour désigner les missions de l’EPRUS et, par renvoi, les dépenses entrant dans le périmètre du financement à parité par l’Etat et par l’assurance maladie, les achats de masques auraient pu légalement être imputés pour partie à l’assurance maladie. A juste titre au vu de leur destination administrative, ils ont cependant été financés par l’Etat, en l’espèce au titre du décret d’avance.
Par ailleurs, à l’occasion de l’examen du projet de décret d’avances, la commission des finances du Sénat a émis de « nettes réserves quant à l’imprévisibilité de ces acquisitions qui semblent moins résulter de l’urgence que de la mauvaise gestion des stocks de santé constitués en cas de pandémie »120.
Dans son rapport sur les décrets d’avance évoqué précédemment, la Cour a quant à elle souligné que « l’urgence invoquée en gestion 2009 devant la survenance du risque pandémique a résulté principalement d’une programmation budgétaire qui, en différant l’ouverture des crédits nécessaires pour effectuer une dépense pourtant connue et jugée prioritaire, a créé une situation d’insuffisance budgétaire qui aurait pu être évitée ». Elle rappelait que la ministre avait reconnu dès l’automne 2008, dans sa réponse au référé de la Cour, la nécessité de renouveler les stocks de masques. De fait, la lettre du directeur de cabinet indiquait qu’une partie des achats visait à « acquérir des masques pour les organismes qui ne l’avaient pas encore fait à hauteur du besoin évalué ».
En définitive, 46,2 M€ de crédits ont été ouverts par décret d'avance sur la mission « Santé » pour financer l’acquisition de masques de protection contre la grippe H1N1 au motif du caractère imprévisible de l’épidémie, alors que la mesure visait en fait à renouveler tardivement des stocks périmés qui auraient dû l’être en tout état de cause.
3. Le recours à une avance de la CNAMTS pour préfinancer les dépenses liées à la pandémie grippale
Le 8 juillet 2009, le directeur de cabinet du ministre chargé de la santé demandait à l’EPRUS « de mener toutes les actions nécessaires en vue de signer des contrats [relatifs à l’achat des vaccins contre la grippe H1N1] avec [les] quatre laboratoires sous une semaine ».
Le même jour, les ministres du budget et de la santé ont demandé conjointement à la CNAMTS de « procéder par anticipation à un versement couvrant la totalité du financement de l’opération d’acquisition des vaccins et des consommables qu’il est nécessaire de commander dès à présent. Au total, l’avance s’élève à 879 M€. (…) Des crédits seront inscrits en loi de finances rectificative pour 2009 pour financer la part de l’Etat ». Cette avance, dont le versement était fixé par un échéancier prévisionnel, était destinée à permettre l’engagement des dépenses relatives à la campagne de vaccination, alors estimées par le ministère de la santé à 879 M€ pour 2009, dont 836,2 M€ au titre des vaccins.
Dans ce contexte, une décision budgétaire modificative d’urgence a été prise par le directeur général de l’EPRUS le 10 juillet 2009 pour prendre en compte ces dépenses et recettes imprévues. Cette décision a été entérinée par le conseil d’administration le 16 décembre 2009.
Dans son rapport sur les décrets d’avance précédemment évoqué, la Cour avait souligné qu’aucune ouverture de crédits budgétaires n’avait été opérée en gestion au titre de la participation de l’Etat aux dépenses d’achat de vaccins, en principe financés à parité, alors même que des crédits, de montant limité, avaient été ouverts par les décrets d’avance des 13 juillet et 9 novembre pour financer l’acquisition de masques pour les agents des services publics et l’organisation matérielle de la campagne de vaccination. La Cour observait dès lors qu’ « en procédant ainsi, l’Etat a choisi de faire peser sur l’assurance maladie le préfinancement intégral de la campagne ».
Dans sa réponse au rapport précité, le ministre du budget indiquait :
« Le choix de recourir à une avance remboursable pour l’acquisition de vaccins a été motivé par un triple souci de :
- soutenabilité des dépenses de l’EPRUS (pas d’engagement financier sans assurance d’une capacité de règlement des créanciers) ;
- prévention des risques de trésorerie excessive au niveau de l’EPRUS (en écho aux recommandations sur ce sujet), puisqu’il était prégnant que tant les calendriers de livraison des vaccins, que le montant des dépenses (dépendant de la date d’obtention de l’autorisation de mise sur le marché) étaient sujets à forte variabilité. La solution d’une avance de l’assurance maladie, fondée sur des appels de fonds en tant que de besoin, couvrait le risque d’une trésorerie dormante à l’EPRUS ;
- rapidité de mise en œuvre, afin de pouvoir effectuer les commandes dans les meilleurs délais ».
S’agissant du choix de recourir à une avance de la CNAMTS, la Cour estime que les contraintes évoquées à propos de la procédure habituelle des décrets d’avance (délai d’élaboration, impossibilité d’étaler le versement des crédits ouverts en gestion), guère contestables dans un contexte à la fois d’urgence et d’aléas importants quant au montant des dépenses à engager, ne sauraient pour autant conduire à écarter sa mise en œuvre en cas de survenance d’une nouvelle menace sanitaire. S’agissant en particulier des délais, l’élaboration et l’adoption d’un décret d’avance nécessitent un délai maximal de neuf jours121. Il n’apparaît pas excessif, sauf cas exceptionnel, dès lors que le plan de réponse à la menace a correctement anticipé la question du financement.
En tout état de cause, la LOLF prévoit, à titre exceptionnel « en cas d’urgence et de nécessité impérieuse d’intérêt national »122, une procédure accélérée d’ouverture de crédits par décret d’avance pris en Conseil des ministres sur avis du Conseil d’Etat, après information des commissions de l’Assemblée nationale et du Sénat chargées des finances. L’utilisation de cette procédure aurait pu être envisagée afin d’ouvrir les crédits nécessaires à l’engagement par l’EPRUS des dépenses relatives aux achats de vaccins.
En l’espèce, il apparaît que la question du financement des dépenses de prévention, dont il était prévisible dès le mois de mai qu’elles seraient massives, n’a été abordée qu’au moment où a été prise la décision de commander les vaccins (début juillet 2009). En dehors de la lettre des ministres à la CNAMTS du 8 juillet 2009 lui demandant de préfinancer ces dépenses, aucun document permettant d’éclairer le choix des modalités de financement n’a été porté à la connaissance de la Cour. Plus généralement, l’examen des plans antérieurs de préparation aux menaces pandémiques met en évidence une insuffisante prise en compte des questions de financement.
En pratique, l’avance de la CNAMTS n’a été mobilisée qu’à hauteur de 78 M€ au cours des deux derniers mois de l’année 2009, soit 801 M€ de moins que prévu, en raison des décalages intervenus dans les livraisons de vaccins, de la réduction du taux de TVA applicable à ces derniers, et, surtout, des droits de tirage de l’EPRUS sur la CNAMTS au titre des dotations de l’assurance maladie (528,3 M€ début 2009)123. Ces droits de tirage ont permis de financer l’essentiel des dépenses de 2009 au titre de la grippe H1N1, l’avance devenant dès lors un simple appoint. Elle a été régularisée en totalité à la fin de l’exercice 2009.
Il apparaît donc a posteriori que cette avance a eu pour principale fonction de procurer à l’EPRUS les autorisations d’engagements nécessaires au plan budgétaire pour conclure les marchés d’acquisitions de vaccins.
4. Une révision budgétaire significative en décembre 2009
Une troisième décision budgétaire modificative (DM) a été prise par le conseil d’administration de l’EPRUS le 16 décembre 2009. A cette date, l’annulation partielle des commandes de vaccins, pour un montant total de 377,8 M€, n’était pas encore intervenue.
. S’agissant des dépenses, elle constate une réduction à hauteur de 533 M€ des dépenses prévisionnelles de l’établissement pour 2009, essentiellement au titre de la campagne de vaccination contre la grippe H1N1. Cette évolution significative résulte principalement des facteurs suivants :
- le retard pris dans les livraisons de vaccins par les laboratoires pharmaceutiques, par rapport à l’échéancier préliminaire fixé en juillet 2009, a conduit à reporter 271 M€ de dépenses de vaccins sur l’année 2010 ; de même, les livraisons de masques FFP2 prévues dans le budget prévisionnel initial, avant la survenance de la menace pandémique, ont été décalées à 2010 pour un montant de 95 M€ (sur un total de 196,5 M€) ;
- la réduction du taux de TVA applicable aux achats de vaccins de 19,6 % à 5,5 % suite à l’obtention des AMM intervenues en septembre 2009 a réduit les dépenses de l’EPRUS de 97 M€. Comme l’a confirmé une note de la direction de la législation fiscale en date du 25 septembre 2009, les achats de vaccins, qu’ils soient effectués auprès de laboratoires situés en France (Sanofi Pasteur) ou dans d’autres Etats de l’Union européenne (GSK, Novartis et Baxter), ne pouvaient être assujettis au taux réduit de la TVA de 5,5 %124 dès lors qu’ils n’étaient pas, ou pas encore, titulaires d’une AMM ou d’une autorisation d’utilisation temporaire (ATU).
S’il n’est pas contestable que le taux normal de TVA devait s’appliquer en l’absence d’AMM, il n’était guère envisageable qu’une campagne de vaccination ayant vocation à toucher l’ensemble de la population puisse reposer sur un produit dépourvu d’autorisation. En outre, les délais incompressibles de fabrication industrielle rendaient hors d’atteinte une première livraison de vaccins antérieure à la date d’aboutissement normale de la procédure d’AMM. Dès lors, l’hypothèse d’un taux de TVA de 19,6 %, retenue pour évaluer le montant de l’avance demandée à la CNAMTS, apparaît résulter davantage d’une logique de précaution budgétaire que d’une démarche d’évaluation au plus juste des dépenses qui seraient effectivement encourues.
. S’agissant des recettes, l’avance accordée par la CNAMTS (879 M€) a été annulée en totalité (voir supra) et remplacée par les montants des dotations de l’Etat et de l’assurance maladie à l’EPRUS prévues par le PLFR 2010 et le PLFSS 2010. Si le montant de la dotation de l’assurance maladie inscrit en recettes dans le budget prévisionnel 2009 de l’EPRUS correspond bien à celui adopté par la LFSS (294 M€), il doit être souligné que, compte tenu de la date d’élaboration du budget, celui de la dotation de l’Etat était fondé sur le montant prévu initialement dans le PLFR (283 M€) et non sur celui, réévalué, qui a finalement été voté sur proposition gouvernementale (433 M€).
En outre, bien que l’avance de la CNAMTS ait été annulée, la décision modificative de décembre 2009 prévoyait « une recette d’un montant de 150 M€ sous la forme d’une avance de la part de l’ACOSS pour assurer le financement complémentaire des engagements de l’établissement. Cette mesure exceptionnelle sera suivie par une mesure rectificative ultérieure ».
Le procès verbal du CA du 16 décembre 2009 indique à cet égard125 : « les derniers arbitrages ne sont pas encore rendus mais il a été demandé à l’EPRUS d’inscrire dans la DM 2009, puis en report dans la DM 2010, une avance de l’assurance maladie de l’ordre de 150 M€ qui permettraient de passer le cap de trésorerie en début d’année 2010 (…). Il est possible que cette avance ne soit pas nécessaire si nous décidions d’ouvrir des montants supplémentaires dans le PLFR au-delà de ce qui est déjà prévu ».
Il apparaît ainsi que l’inscription de cette recette dans le budget prévisionnel, demandée par les tutelles de l’EPRUS, n’a pas de fondement juridique et n’a été effectuée qu’à titre conservatoire dans l’hypothèse où les crédits ouverts en PLFR n’auraient finalement pas été relevés à l’initiative du ministère du budget préalablement à l’adoption définitive de la LFR. De fait, l’avance de la CNAMTS n’a pas été mobilisée. Elle n’a en outre pas fait l’objet d’une décision modificative ultérieure.
5. L’annulation partielle des commandes de vaccins
La décision du gouvernement, début janvier 2010, d’annuler une partie des commandes de vaccins a réduit le montant des achats de vaccins de 377,8 M€ (TTC) et a conduit le conseil d’administration de l’EPRUS à adopter en mai 2010 une décision modificative du budget pour 2010 prenant en compte l’indemnisation des laboratoires pharmaceutiques (voir supra, partie III.B.3). Comme indiqué précédemment, cette décision modificative a également annulé, à la demande des tutelles de l’EPRUS, la totalité des recettes pour 2010 inscrites dans le budget primitif (85 M€ au titre des dotations de l’Etat et des régimes d’assurance maladie prévues en LFI et en LFSS pour 2010).
Tableau n° 16 : Décision modificative (DM) du budget 2010
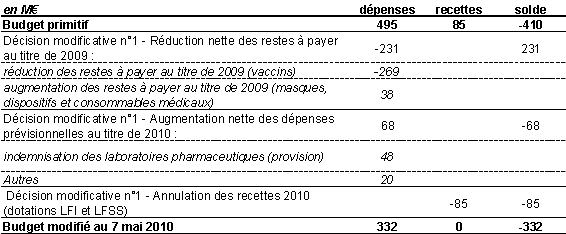
Source : Cour des Comptes
S’agissant de l’indemnisation des laboratoires pharmaceutiques, l’évaluation de 48 M€ retenue par la DM se fonde sur une indemnisation à hauteur de 16 % des commandes annulées ; le débours à ce titre versée en définitive à 48,5 M€ (voir supra).
En tant qu’établissement public à caractère administratif, l’EPRUS établit ses comptes sur le fondement de l’instruction comptable M9-1, elle-même très proche des principes fixés par le plan comptable général. L’EPRUS n’est pas soumis à l’obligation d’avoir un commissaire aux comptes.
Les résultats des exercices 2007 à 2009 sont présentés ci-dessous.
Tableau n° 17 : Résultats des trois derniers exercices

Source : Cour des comptes (à partir des données de l’EPRUS)
Compte tenu de son activité de gestionnaire de stocks, le compte de résultat de l’EPRUS retrace en charges de l’exercice l’effet de la variation des stocks entre le 1er janvier et le 31 décembre, conformément aux règles comptables applicables aux stocks d’approvisionnements et de marchandises.
Cette variation de stock positive, qui vient en minoration des charges au titre des achats126, a une incidence majeure sur la formation des résultats 2008 et 2009 en raison principalement du transfert à l’établissement des stocks antérieurement gérés par l’Etat (618 M€ en 2009 et 227 M€ en 2008). Le résultat de l’exercice 2009 atteint ainsi 1 090,1 M€. Si l’on isole les écritures de variation de stocks, qui répondent à une logique de comptabilité patrimoniale, les résultats cumulés de l’EPRUS au 31 décembre 2009 s’élèvent à 555,2 M€, soit un niveau très proche de celui des reports de crédits budgétaires de l’EPRUS cumulés à la même date (558,8 M€).
Comme indiqué précédemment (voir supra, partie III.A.4), les opérations de comptabilisation des stocks en 2009 se sont écartées des dispositions de la convention Etat-EPRUS, dans la mesure où les mouvements de stocks n’ont pas été inscrits en comptabilité à mesure de leur réalisation (méthode de l’inventaire permanent) en l’absence de connaissance complète en cours d’année des mouvements de sortie de stocks. De ce fait, la variation de la valeur des stocks n’a été constatée qu’en fin d’année (méthode de l’inventaire intermittent). Un avenant à la convention avec l’Etat est en cours de finalisation afin d’autoriser la mise en œuvre de la méthode de l’inventaire intermittent au titre de l’exercice 2010. Le conseil d’administration a été informé de ce changement de méthode lors de sa séance du 7 mai dernier.
Les questions liées à la valorisation des stocks en comptabilité et à la tenue de l’inventaire des stocks sont présentées au point III.A. supra.
Les bilans de l’EPRUS au titre des trois derniers exercices clos se présentent comme suit :
Tableau n° 18 : Bilans des trois derniers exercices
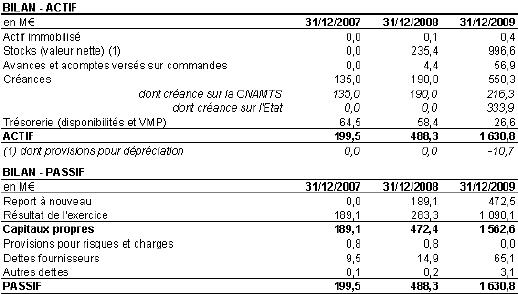
Source : Cour des comptes (à partir des données de l’EPRUS)
Figurent à l’actif, outre les stocks, des créances sur l’Etat et la CNAMTS au titre des dotations votées en LFSS et en lois de finances restant à verser.
Au 31 décembre 2009, les créances sur l’Etat correspondent exclusivement aux crédits votés en LFR pour 2009 (433 M€) minorés de l’annulation des crédits décidée début 2010 (100 M€, voir supra). Ces crédits ont été versés le 8 janvier 2010, majorant d’autant la trésorerie de l’EPRUS qui s’établissait ainsi à 360 M€ en début d’année, soit un niveau suffisant pour couvrir les dépenses prévisionnelles pour 2010 (332 M€).
Sous réserve des ajustements de dépenses qui interviendront en 2010, cette situation devrait conduire l’EPRUS à ne mobiliser sa créance sur la CNAMTS (216 M€ au 31/12/2009) que de manière marginale dans le cadre de la convention EPRUS-ACOSS-CNAMTS. A la fin de 2010, la créance de l’EPRUS sur la CNAMTS demeurera donc à un niveau élevé, proche de celui constaté à la fin de 2009. Comme l’illustre le tableau ci-dessous, les dotations de l’assurance maladie depuis la création de l’EPRUS n’ont en effet été que partiellement appelées en trésorerie en raison de la sous-consommation budgétaire évoquée précédemment.
Tableau n° 19 : Dotations de l’assurance maladie à l’EPRUS

Source : EPRUS
Par décision du 9 janvier 2008, l’agent comptable de l’établissement a été autorisé à procéder au placement des excédents de trésorerie disponibles en valeurs du Trésor à court terme127. En revanche, l’EPRUS n’a pas été sollicité pour placer ses excédents de trésorerie auprès de l’ACOSS, faculté ouverte par le décret du 22 juillet 2009 relatif à la trésorerie des organismes de sécurité sociale et des organismes en relation avec l’ACOSS128. En raison de la faiblesse des taux d’intérêt à court terme, les produits de placements ont représenté 0,2 M€ en 2009.
Plus récemment, l’agent comptable a effectué un placement de 150 M€ en comptes à terme d’une durée de quatre mois, placement qui a procuré à l’EPRUS une plus-value de 130 K€, bien supérieure à celle qu’aurait généré un placement en SICAV monétaire. A l’échéance de ces placements à terme, une somme de 135 M€ a de nouveau été placée de la même manière, dont 60 M€ à trois mois et 75 M€ à quatre mois.
****
ANNEXE
Organigramme de l’EPRUS
Source : EPRUS
1 Rapport d’information n° 388 du 6 mai 2009.
2 Rapport d’audit n° 2006-02.
3 Décision n° 2005-528 DC du 15 décembre 2005.
4 Rapport n° 159 (2006-2007) relatif à la proposition de loi déposée le 24 novembre 2006.
5 Sénat, rapport n° 159 (2006-2008).
6 Articles L. 3132-1 à 3136-1.
7 Décret n° 2007-1273 du 27 août 2007, codifié aux articles R. 3132-1 à 3134-3.
8 Lettre du directeur de cabinet du ministre de la santé et des sports, 6 mai 2009.
9 Arrêté du 9 février 2010.
10 Dont quatre pour le ministère chargé de la santé (le directeur général de la santé, le directeur de l’organisation des soins, le directeur de la sécurité sociale et le secrétaire général).
11 Huit représentants de la CNAMTS, deux de la Caisse nationale du régime social des indépendants et deux de la caisse centrale de la mutualité sociale agricole Le président du conseil d’administration, M. Jean-Louis Buhl, contrôleur budgétaire et comptable ministériel au ministère des affaires étrangères, a été nommé pour trois ans par décret du président de la République ; ayant atteint la limite d’âge fixée à de telles fonctions, il ne pouvait bénéficier du renouvellement autorisé par l’article R. 3135-3 du CSP et devait être remplacé. Entre-temps, le conseil d’administration du 7 mai 2010 a été présidé à titre exceptionnel par le DGS.
12 En application d’une lettre du DGS datée du 21 juin 2008.
13 Lors de son audition par la commission d’enquête de l’Assemblée nationale le 6 avril 2010, M. Boubé a ainsi analysé la première année d’existence de l’EPRUS comme « l’histoire du rejet d’une greffe par un organisme – la DGS, voire le ministère de la santé – qui n’en éprouvait pas le besoin » et « condamnait » de ce fait l’établissement « à un rôle subordonné interdisant toute perspective de progrès ». Il met en cause la conformité aux intentions du législateur de plusieurs des dispositions prises en ce sens.
14 Le HFDS s’appuie sur deux hauts fonctionnaires de défense adjoints, respectivement chargés d’un pôle défense et d’un pôle santé dont la direction se confond avec celle du DUS.
15 La contribution des régimes d’assurance maladie est répartie entre eux sur le fondement de la clé prévue à l’article L. 174-2 du code de la sécurité sociale au titre des dotations aux établissements de santé.
16 Cet antiviral contre la grippe est conditionné directement par la pharmacie centrale des armées à partir du produit brut livré par le laboratoire Roche.
17 Accord EPRUS/08-18 relatif au stockage de masques FFP2 notifié le 15 octobre 2008 ; accord EPRUS/08-19 relatif à du stockage froid notifié le 15 octobre 2008 ; accord EPRUS/09-24 (1) relatif au développement de l’OSELTAMIVIR PG 30 mg notifié le 2 juillet 2009 ; accord EPRUS/09-24 (2) relatif à l’étude de bioéquivalence OSELTAMIVIR–TAMIFLU notifié le 20 juillet 2009 ; accord EPRUS/09-24 (3) relatif à l’assortiment et le réassortiment de sacs de matériels à destination des réservistes sanitaires de l’EPRUS notifié le 10 décembre 2009.
18 Lors de son audition devant la Commission d’enquête de l’Assemblée nationale, le 6 avril 2010, M. Boubé a cependant indiqué que ses expériences antérieures liées à « la sécurité d’opérateurs d’importance vitale » lui avaient inspiré « une conception précise de la manière de procéder » voulant prendre en compte plus fortement les nécessités de la préparation et de la réponse aux « hypothèses d’attentat » et « au terrorisme en général ».
19 Le rapport annuel de performances (RAP) établi pour le ministère de la santé indique, de surcroît, que l’année 2009 a « été perturbée par la pandémie grippale A (H1N1) et qu’en conséquence, il n’y a plus eu d’exercices après le mois d’avril ».
20 Administrateur civil hors classe, celui-ci était antérieurement directeur de cabinet du ministre de l’immigration, de l’intégration, de l’identité nationale et du développement solidaire.
21 Antérieurement pharmacien général inspecteur relevant du ministre de la défense, celui-ci dirige l’établissement pharmaceutique.
22 Les marchés concernés figurent dans le tableau transmis par l’EPRUS sous la rubrique « Transmis pour information et gestion des stocks ».
23 Courriels du 21 juin 2010.
24 Cette dernière norme dispose notamment dans son exposé des motifs que « les biens appartenant à l’Etat et mis à la disposition des établissements publics sans transfert de propriété sont enregistrés au bilan de ces établissements » et, dans son point 1.3.5, que « les biens placés sous le contrôle des établissements publics (…) ne sont pas inscrits au bilan de l'Etat mais à l'actif du bilan de ces entités ».
25 Net de la provision de 10,7 M€ résultant de la veille sur les prix (voir infra, partie III.A.1) ce montant s’établit à 996,6 M€. Il s’écarte quelque peu du montant résultant du montant total de l’inventaire fourni par le service pharmaceutique (946,6 M€) du fait de trois rectifications d’un montant total de 60,8 M€ portant sur des erreurs de prix moyens pondérés et une erreur sur la valeur des quantités unitaires.
26 Les produits concernés devant être réintégrés dans le stock en cas de retour à l’établissement pour non-utilisation.
27 Voir la décision du Conseil d'État du 30 janvier 2009, ANPE, req. n° 290236, confirmant l'arrêt de la cour administrative d’appel de Versailles du 6 décembre 2005, Association Pacte, req. n° 03VE04081.
28 P. 71 du rapport.
29 Dans un document élaboré début 2010 sous le titre « Grippe A H1N1, Les concepts à l’épreuve de la réalité », complété par une chronologie détaillée de la pandémie et sa gestion, l’EPRUS a tenu à retracer les différents aspects de sa contribution à cette politique publique d’urgence et à lui donner pour sous-titre « Le Baptême du feu ».
30 Etablis à une date postérieure, ces montants diffèrent quelque peu de ceux enregistrés dans les comptes au 31 décembre 2009.
31 Le Kelocyanor ayant été retiré de la liste des antidotes prévus dans les stocks nationaux.
32 Lettre du DGS du 18 septembre 2009.
33 Les autres produits étaient le Ciflox, l’Oflocet, le Tavanic, le Cyanokit et le Contrathion.
34 Ces contrôles concernaient le Tamiflu.
35 Lettre du 21 février 2008.
36 Fait exception un lot de Guyane dont la péremption initiale remonte à 2007.
37 Une première prorogation d’un an avait été proposée suite aux contrôles opérés en 2008.
38 Lettre au cabinet du ministre du 24 septembre 2009.
39 Lettre au DGS du 4 février 2010.
40 Note au DGS du 24 février 2010, « Réunion DGS-AFSSaPS-EPRUS du 25 février 20103.
41 Articles 5121-139 et 140 du CSP.
42 L’Agence propose de compléter la rédaction l’article R. 5121-140 en y visant le cas où « le médicament est destiné à constituer un stock détenu par l’Etat en prévision d’une menace sanitaire grave », et d’ajouter à la possibilité d’exonérer de la nécessité de faire figurer sur l’étiquette certaines mentions, celle d’y ajouter des « mentions supplémentaires particulières ».
43 Rapport d’audit n° 2010-03, mars 2010.
44 La constatation de provisions est subordonnée à l’inscription de crédits budgétaires.
45 A cet égard, la DGFiP a fait valoir que les masques périmés auraient dû faire l’objet d’une dépréciation par réduction à zéro de leur valeur plutôt que par le mécanisme de sortie/entrée qui a été utilisé. L’établissement semble disposé à tenir compte de cette observation dans les prochaines opérations de ce type.
46 Relevé de décisions de la réunion du 3 février 2010.
47 Page 66 du rapport.
48 Deux représentants de l’EPRUS ont par ailleurs accompagné la visite du sénateur Jégou sur le site Pharmalog de Val-de- Reuil.
49 S’agissant du potentiel de stockage offert par ce projet, l’EPRUS a postulé deux hypothèses fonctions du nombre de niveaux autorisés pour les racks palettiers. (42 000 ou 51 000 palettes).
50 Les frais de stockage comparés se résument aux frais de stockage statiques (palette sur rack) et excluent les frais de manutention (coût entrée palette et sortie palette) qui dans les deux options se surajoutent aux frais comparés pour des montants équivalents.
51 Selon l’EPRUS, les différentes évaluations citées sont cohérentes si l’on tient compte du fait que le chiffre de 723 millions prenait en compte une commande de 200 millions de masques dont 150 millions étaient à livrer entre janvier 2009 et juin 2010 et que les chiffres avancés par l’EPRUS entre mai et juillet 2009 tenaient compte des mouvements effectués pour les masques entre stocks centraux et stocks locaux (établissements hospitaliers et plateformes départementales).
52 En pratique, la constitution de ce réseau a pu exploiter de premiers contacts et des éléments de pré-négociation avec les grossistes répartiteurs réunis par la DGS dans la perspective d’organiser la distribution d’antiviraux vers les officines.
53 N’est notamment pas repris dans le présent récapitulatif, un marché de 6,1 M€ passé en 2009 pour des livraisons d’antiviraux destinés aux ambassades et qui visait à renouveler le stock antérieur d’antiviraux H5N1.
54 Lettre du directeur de cabinet à l’EPRUS du 11 mai 2009.
55 1ère tranche conditionnelle : 28 millions de doses ; tranches 2 à 5 : 7 millions de doses chacune.
56 La procédure de passation regroupait deux lots, chacun constitués d’une tranche ferme (vaccin prépandémique) et de tranches conditionnelles (pour un éventuel vaccin pandémique). Le recours à deux lots s’expliquait par la recherche d’une diversification minimale des approvisionnements, l’un des lots – le plus important en volume – comportant une obligation de développement et stockage sur le territoire national afin de se prémunir d’une possible préemption par l'État du lieu de production.
57 L’arrêté du Premier ministre auquel renvoie le code est celui du 18 avril 2005 relatif aux conditions de protection du secret et des informations concernant la défense nationale et la sûreté de l'État dans les contrats. Il a pour but de traduire précisément dans les contrats les impératifs relatifs au secret. Il n’a pas donné lieu à une application particulière au cas des contrats passés par l’EPRUS.
58 Mock-up, maquette en anglais. On désigne par là une procédure d’instruction en vue d’une AMM se fondant, dans l’attente d’une nouvelle souche pandémique, sur une extension raisonnée des caractéristiques d’un vaccin ayant fait été testé dans la phase prépandémique. En l’espèce, il s’agissait des vaccins élaborés contre le virus H5N1. Extrait d’un communiqué de l’EMEA sur la filière Mock-up : “All mock-up vaccines have been prepared with an H5N1 strain of flu virus that needs to be changed now to the H1N1 strain that is causing the current pandemic.” Cette procédure ne peut être mise en œuvre qu’en cas de déclaration de pandémie par l’OMS.
59 CJCE, 8 avril 2008, Commission c/Italie, aff. C-337/05, points 57 et 58, et 2 octobre 2008, Commission c/Italie, aff. C-157/06, point 23.
Voir pour une étude détaillée de cette jurisprudence, l'article de François Brenet, « Le droit des marchés publics, victime de la grippe A ? », Contrats et Marchés Publics n° 6/2010.
60 La Cour de justice des communautés européennes a admis la dérogation à l’application de la directive sur les marchés de services n° 92/50 dans le cas d’une prestation de télédétection aérienne des côtes belges (CJCE, 16 octobre 2003, Commission c/ Belgique, aff. C-252/01).
61 L’établissement n’entraine pas davantage la conviction lorsqu’il maintient que l’extension de cette procédure à des produits banalisés tels que pansements, blouses ou sacs à déchet se justifiait « pleinement » tant par l’application du principe Accessorium sequitur principale qu’au vu du risque qu’un appel à concurrence engendre, « dans un contexte de « tension des marchés, […] une hausse significative des prix et un risque de pénurie », ou face à « une action contre les lieux de livraison » suite à « l’accès par des personnes mal intentionnées à des informations sensibles » sur la fourniture de tels produits.
62 Lettre précitée du 14 août 2010.
63 Rappelant les instructions du ministre de la santé, le directeur général de l’EPRUS avait indiqué à la commission que le respect des exigences de confidentialité et de sécurité ne permettait pas de communiquer les documents demandés, en application des dispositions du I de l'article 6 de la loi du 17 juillet 1978 qui précisent notamment que « (...) ne sont pas communicables / : (...) 2° Les autres documents administratifs dont la consultation ou la communication porterait atteinte : (...) / d) A la sûreté de l'État, à la sécurité publique ou à la sécurité des personnes ; (...) ».
64 Le rapport entre le nombre de doses commandées et la population totale situe la France comme l’un des pays ayant adopté l’attitude de précaution la plus élevée :
Europe : France : 1,47 ; Allemagne : 0,61 ; Italie : 0,40 ; Royaume-Uni : 2,13.
Hors d’Europe : Canada : 1,50 ; États-Unis : 0,84 ; Mexique : 0,27.
65 Voir parmi d’autres avis, celui du HCSP du 8 juillet 2009. Ce point a été par ailleurs évoqué par M. Didier Houssin, directeur général de la santé, lors de son audition devant la commission d’enquête de l'Assemblée nationale.
66 Audition du DGS devant la commission d’enquête de l'Assemblée nationale : « S’agissant de l’acquisition des vaccins, deux stratégies se présentaient à nous : une stratégie « santé publique » consistant à vacciner de façon suffisamment large pour bloquer l’épidémie avant qu’elle ne survienne, ce qui était assez peu probable compte tenu de ce que l’on pouvait craindre de la cinétique de celle-ci ; une stratégie de protection individuelle consistant à encourager les personnes à se faire vacciner. Chacune des options conduisait à dimensionner un stock de vaccins, qu’il fallait acquérir suffisamment tôt. La décision politique la plus importante a été celle du 3 juillet, lorsque le Premier ministre a validé l’acquisition de 94 millions de doses ».
67 Ceci pouvait se produire en cas d’insuccès des tests d’efficacité (immunogénicité) et de tolérance, nécessaires pour compléter l’AMM dont disposaient déjà les laboratoires pour leurs vaccins prépandémiques qui avaient servi de vaccin-prototype ou mock-up.
68 Ces contrats de réservation ont été facturés par GSK à ces pays au prix de 1,5 € HT. Ils sont parfois désignés sous le nom d’Advanced Purchase Agreements.
69 L'article précité de F. Brenet relève à ce propos « qu’en parvenant à contraindre l'État à effectuer des commandes fermes et à ne pas insérer une clause de révision, voire une clause de résiliation qui lui aurait permis de limiter les conséquences financières d’une remise en cause des contrats, les laboratoires pharmaceutiques ont obtenu un avantage important, lequel a des répercussions énormes au moment de déterminer l’indemnisation qui doit leur être accordée au titre de la résiliation unilatérale de leur contrat pour motif d'intérêt général ».
70 Ces 6,66 % seront portées à 8,33 % dans le marché conclu en juillet.
71 Relevé de décision de la réunion du 2 septembre 2009 sous la présidence du directeur de cabinet.
72 Lettre du 29 juin 2010.
73 Informe proceso negociacion de los contratos de adquisicion de vacuna contra la gripe A, 29 juin 2010.
74 Note 009-9531.
75 Cette clause avait été ajoutée lors de la « mise au point » du marché, excédant d’ailleurs les simples ajustements auxquels il est licite de procéder une fois que le marché est attribué.
76 Pour ce marché, il s’agit d’une modification importante par rapport au cahier des charges soumis à l'appel d'offres initial et qui, de ce fait, pourrait être considérée comme irrégulière (CE, 25 juillet 2001, Commune de Gravelines - req. n° 229666).
77 F. Brenet, article précité, p. 9.
78 Elles ont porté notamment sur une amélioration de l’étiquetage et la fourniture de notices.
79 Ou, puisque cette possibilité, bien que très improbable, n’était pas totalement exclue, à l’utilisation du vaccin décidée avant l’obtention de l’AMM, à concurrence des quantités de doses ainsi utilisées.
80 Article 11.1 du contrat.
81 Les données comparatives et certains éléments de raisonnement ont été présentés devant la commission d’enquête du Sénat par M. Noël Renaudin, président du Comité économique des produits de santé et précisés par lui à l’attention de la Cour lors d’un entretien téléphonique.
82 Si le prix de la tranche ferme du marché de 2005 avec Chiron était plus élevé (9,9 € HT) que celui des tranches conditionnelles (9,44 € HT), l’explication réside sans doute dans le fait que le vaccin prépandémique de la tranche ferme était conditionné en monodoses, alors que le vaccin pandémique prévu dans les tranches conditionnelles devait être livré en multidoses (mais, a contrario, il a été relevé que Novartis avait livré la majeure partie des doses de vaccin A/H1N1 en monodoses pour le même prix).
83 Le code des marchés publics prévoit deux dispositifs de financement des titulaires de marchés :
- les acomptes, auxquels ouvrent droit les prestations qui ont donné lieu à un commencement d’exécution du marché ; leur montant ne peut excéder la valeur des prestations auxquelles ils se rapportent ;
- les avances, qui sont versées avant tout commencement d’exécution. A titre obligatoire une avance d’au moins 5 % du montant du marché doit être versée dès lors que le montant de celui-ci ou d’une tranche dépasse 50 000 € HT. Le taux de l’avance peut être fixé librement jusqu’à 30 % du montant du marché. L’avance peut toutefois être portée à un maximum de 60 % sous réserve que le titulaire constitue une garantie à première demande.
Le remboursement de l’avance s'impute sur les sommes dues au titulaire, selon un rythme et des modalités fixés par le marché par précompte sur les sommes dues à titre d'acomptes ou de règlement partiel définitif ou de solde. Il doit, en tout état de cause, être terminé lorsque le montant des prestations exécutées par le titulaire atteint 80 % du montant TTC des prestations qui lui sont confiées. Dans le silence du marché, le remboursement s’impute sur les sommes dues au titulaire quand le montant des prestations exécutées par le titulaire atteint 65 % des montants du marché.
84 Sauf si le Gouvernement français décidait d’examiner d’autres propositions de GSK pour l'utilisation de cette réservation.
85 Aucun paiement n’a cependant été fait à ce titre, le contrat n’ayant pas été mené à son terme.
86 Note du directeur de cabinet du ministre chargé de la santé du 16 octobre 2009.
87 L’EMEA avait auparavant précisé dans un communiqué de presse que la stratégie de vaccination était décidée par chaque État-membre.
88 1 011 254 personnes vaccinées selon le bulletin hebdomadaire de la direction de la sécurité civile pour la semaine du 24 au 30 novembre 2009.
89 Voir notamment, la décision du Conseil d'État du 2 février 1983, Union des transports publics (req. n° 34027, RDP 1984, 212 ; note Auby).
90 Exposé de l’audition du ministre chargé de la santé le 23 mars 2010 devant la commission d’enquête du Sénat http://www.gouvernement.fr/gouvernement/roselyne-bachelot-grippe-ah1n1-le-calcul-du-nombre-de-doses-commandees-est-realiste.
91 Ce prix est celui du seul vaccin et ne comporte le coût des autres produits de vaccination ni celui du fonctionnement des centres de vaccination.
92 Dans le cas de l’Oseltamivir.
93 Outre les vaccins contre la grippe H1N1 initialement prévus pour la vaccination à deux doses de l’ensemble de la population, il s’agissait :
. de réactifs et de tests pour identification du virus A H1N1 et leur mise en place auprès des laboratoires de biologie désignés comme centre de référence ;
. de respirateurs et d’appareils de circulation et d’oxygénation sanguine extracorporelle (E.C.M.O) destinés à renforcer l’équipement des services de réanimation des centres hospitaliers ;
. de produits, dispositifs médicaux et articles consommables destinés au fonctionnement des centres de vaccination ;
. de masques chirurgicaux pédiatriques.
94 L’EPRUS conservait cependant un suivi des quantités de vaccins en place chez ces mêmes répartiteurs.
95 Ce kit individuel comprenait 20 seringues pré-remplies mono-doses de Focetria (Novartis), deux flacons de 10 doses de Panenza (SANOFI), les moyens d’injection associés aux flacons multi-doses de Panenza ou une boite de 200 seringues adulte (23G), une boite de 200 seringues enfants (25G).
96 Ces derniers produits étaient stockés en quarantaine pour contrôle avant péremption sur le site dépositaire DEPOLABO d’Arras et, dans l’attente, n’étaient pas comptabilisés dans les « stocks disponibles » recensés par l’établissement.
97 Le chiffre de 9 % résultant de la statistique établie par la direction de la sécurité civile fin janvier n’était pas corrigé des cas de vaccinations à double dose.
98 Femmes enceintes sans facteurs de risques, personnes atteintes de maladies endocriniennes et métaboliques susceptibles d’être décompensées par une infection aiguë, personnes obèses.
99 minime des quantités restituées sont encore en cours de tri avant reprise en stock.
100 Audition devant la Commission d’enquête de l’Assemblée nationale, 6 avril 2010.
101 Au neuf cas mentionnés dans le tableau, peut être ajoutée une intervention au Kenya, ayant fait l’objet d’une lettre du DGS du 4 février 2009.
102 Née de la fusion entre le CNASEA et l'Agence unique de paiement.
103 Un avenant avait prévu une avance de 803 880 euros permettant à l’ASP de procéder aux règlements des premières vacations.
104 Comme en témoigne, par exemple, un avis de réunion sur l’aide humanitaire à Gaza au centre de crise des Affaires étrangères le 6 janvier 2010.
105 L’Inde en novembre 2008 (attaques terroristes de Bombay), la Thaïlande en décembre 2008 (séisme), la Palestine en janvier 2009 (conflit armé dans la bande de Gaza), le Kenya en février 2009 (événements de Naïrobi), Haïti en janvier 2010 (deux saisines face au séisme), le Chili en février 2010 (séisme). Comme on l’a vu au point C, 3, supra, l’EPRUS a omis de faire figurer, l’intervention au Kenya dans la « liste des opérations ayant mobilisé la réserve sanitaire en 2009 » transmise à la Cour.
106 Cette contribution est répartie entre les régimes obligatoires d’assurance maladie selon les règles définies à l’article L. 174-2 du CSS relatif à la répartition des dotations des régimes d’assurance maladie aux établissements de santé.
107 A l’exception toutefois des dépenses engagées exclusivement pour le compte de l’Etat, telles les achats de masques pour les besoins des administrations, financés par un décret d’avance, ou les vaccins ayant fait l’objet d’un don à l’OMS.
108 Certaines dépenses de l’établissement, principalement celles liées à la réserve sanitaire, n’entrant pas dans le champ des dépenses à parité, il n’est pas possible d’apprécier l’équilibre du financement sur la base de ces données chiffrées, qui portent sur l’ensemble des activités de l’EPRUS. Cependant, les dépenses devant être financées à parité ont un caractère prépondérant.
109 Rapport au Parlement conjoint au projet de loi de finances rectificative. Mouvements de crédits opérés par voie administrative.
110 Suite à des dons additionnels au cours de l’été 2010, le montant total des dons à l’OMS a atteint 87,2 M€.
111 Exposé des motifs de l’article 10 du PLFSS pour 2010. Cette contribution a la même assiette que la contribution des organismes complémentaires au fonds CMUC-C (5,9 % de leur chiffre d’affaires) et est recouvrée, exigible et contrôlée dans les mêmes conditions.
112 Art. L 174-1 du CSS.
113 Audition devant la commission d’enquête parlementaire de l’Assemblée nationale.
114 La contribution de l’assurance maladie a été ajustée en prenant en compte l’impact des dons de vaccins à l’OMS et la réduction du taux de TVA applicable aux vaccins : fixée dans le PLFSS à 414,8 M€, elle a été ramenée à 338,3 M€. La dotation de l’Etat à l’EPRUS en LFR a été portée de 284,9 M€ à 433 M€.
115 Le projet de loi de règlement pour l’année 2009 prévoit l’annulation des crédits non versés.
116 Ce montant, qui correspond aux prévisions les plus récentes de l’EPRUS (budget adopté le 7 mai 2010), exclut les masques de protection acquis pour le compte de l’Etat au titre des agents des administrations (voir infra, point B.2), rattaché aux dépenses de l’Etat (programme 204) ainsi que l’estimation de certaines dépenses liées à la fin de la campagne de prévention contre la grippe H1N1.
117 Séance du conseil d’administration du 7 mai 2010.
118 S’agissant de l’élaboration de la programmation budgétaire annuelle et pluriannuelle, voir supra, partie III. A.3.
119 Lettre du directeur du cabinet du ministre chargé de la santé en date du 6 mai 2009.
120 Avis du 24 juin 2009, adressé au Premier ministre le 25 juin.
121 Un jour pour la préparation du décret (direction du budget), un jour pour l’avis du Conseil d’Etat, sept jours pour l’avis des commissions compétentes de l’Assemblée nationale et du Sénat. Ce dernier délai, fixé par la LOLF, peut cependant être réduit.
122 Article 13 de la LOLF.
123 Dans le cadre de la convention EPRUS-ACOSS-CNAMTS, la CNAMTS avait versé au 1er janvier 2009 seulement 40 M€ au titre des dotations votées pour les années 2007, 2008 et 2009 (568,3 M€).
124 Ou à 2,1 % dans l’hypothèse où ils auraient été remboursables aux assurés ou agréés à l’usage des collectivités.
125 Intervention du représentant de la direction du budget.
126 Dans l’hypothèse d’une diminution de la valeur brute des stocks, la variation de stocks majore les achats.
127 Placements effectués dans les SICAV monétaires CDC Trésor Première Monétaire et Dexia Localys Première.
128 Dispositions introduites à l’article R. 3135-10 du CSP: « Les disponibilités excédant les besoins de trésorerie peuvent être également déposées suivant les modalités fixées par la convention prévue à l’article L. 225-1-3 du code de la sécurité sociale auprès de l’ACOSS. Elles sont alors productives d’intérêt ».