

N° 1582
CONSTITUTION DU 4 OCTOBRE 1958 TREIZIÈME LÉGISLATURE |
N° 318
SESSION ORDINAIRE DE 2008-2009 | |
Enregistré à la Présidence de l’Assemblée nationale |
Annexe au procès-verbal de la séance |
__________
OFFICE PARLEMENTAIRE D'ÉVALUATION
DES POLITIQUES DE SANTÉ
__________
RAPPORT
sur
le dépistage et le traitement du cancer de la prostate,
par M. Bernard DEBRÉ, Député
Déposé sur le Bureau de l'Assemblée nationale par M. Pierre MÉHAIGNERIE Président de l'Office |
Déposé sur le Bureau du Sénat par M. Nicolas ABOUT Premier Vice-Président de l'Office | ||||
Cet Office est composé de : MM. Pierre Méhaignerie, président, Gérard Bapt, Mme Jacqueline Fraysse, MM. Jean Bardet, Jean-Pierre Door, Marc Bernier, Mme Valérie Boyer, M. Bernard Debré, Mme Michèle Delaunay, M. Philippe Nauche, Mme Dominique Orliac, M. Jean-Luc Préel, députés
MM. Nicolas About, premier vice-président, Gilbert Barbier, Jean-Pierre Godefroy, Alain Vasselle, Paul Blanc, Mme Maryvonne Blondin, MM. Bernard Cazeau, Gérard Dériot, Guy Fischer, Dominique Leclerc, Alain Milon, Jean-Jacques Mirassou, sénateurs.
INTRODUCTION 7
I.- LA DÉTECTION PRÉCOCE DU CANCER DE LA PROSTATE EST UN ENJEU THÉRAPEUTIQUE ESSENTIEL 9
A. UN MAL SOURNOIS 9
1. Une glande masculine liée aux fonctions de reproduction 9
2. Un cancer fréquent chez les hommes 9
B. LE DÉPISTAGE CANCÉREUX, UNE ÉTAPE DÉCISIVE POUR UN TRAITEMENT CURATIF 10
1. Le stade clinique auquel le cancer est découvert détermine son évolution ultérieure 10
a) Les stades de la maladie 11
b) Des traitements appropriés à chaque stade clinique 11
2. Les éléments constitutifs du dépistage 13
a) Dépistage et diagnostic, deux étapes distinctes 13
b) Une nouvelle dynamique du dépistage du cancer de la prostate liée à l’introduction d’un test de détection efficace 14
c) Des questions de stratégie de dépistage non tranchées 15
d) L’éclairage apporté par des études américaine et européenne récentes 19
II.– L’ÉTUDE SCIENTIFIQUE ENGAGÉE PAR L’OPEPS ET SES RÉSULTATS 21
A. UN DÉPISTAGE VOLONTAIRE QUI A ATTEINT L’AMPLEUR D’UN DÉPISTAGE DE MASSE 21
B. DES PRATIQUES HÉTÉROGÈNES RÉDUISANT L’EFFICACITÉ DU DÉPISTAGE 23
1. Les tests de dépistage sanguins comportent des limites et doivent être complétés 23
2. L’hétérogénéité des pratiques a des conséquences négatives sur la régularité avec laquelle est suivi le taux de PSA 26
3. Les examens de dépistage sont plus efficaces 27
4. L’origine de l’hétérogénéité des pratiques est à rechercher dans les divergences d’opinion parmi les médecins généralistes sur l’intérêt du dépistage 28
C. DES PARCOURS DE SOINS DIVERSIFIÉS 29
1. Une forte augmentation du nombre d’interventions curatives… 29
2. …mais des stratégies de traitement variées 30
III.- VERS UNE POLITIQUE DE DÉPISTAGE PLUS EFFICACE 37
A. LE CONSTAT : UNE POLITIQUE DE DÉPISTAGE LACUNAIRE 37
1. Un bilan positif sur le plan quantitatif… 37
2. … mais qui révèle les limites de la politique actuelle de dépistage 37
a) Les pratiques hors référentiels nuisent à l’efficacité du dépistage. 37
b) La détection des cancers précoces se heurte à la difficulté d’identifier les cancers les plus agressifs. 38
c) L’information doit être améliorée. 38
d) Les questions éthiques ne peuvent être laissées en l’état. 39
e) Les stratégies de traitement demeurent trop variées selon les départements 40
B. LES RECOMMANDATIONS DE L’OPEPS 40
1. Favoriser un dépistage de meilleure qualité 40
a) Mettre en place et généraliser des instruments d’évaluation de l’agressivité des cancers dès le stade du dépistage 41
b) Développer la recherche et l’expérimentation sur les marqueurs moléculaires dans des centres de référence 41
2. Améliorer l’organisation du dépistage du cancer de la prostate 42
a) Clarifier les rôles et les responsabilités dans la chaîne de dépistage, en instituant une procédure standardisé de dépistage 42
b) Différencier l’usage du dosage de PSA en tant que test de dépistage 42
c) Développer des référentiels de prise en charge 43
d) Poursuivre les efforts de standardisation des tests de dépistage et de diagnostic 43
e) Améliorer les instruments de suivi des conditions de dépistage 43
f) Moduler la politique de dépistage en la ciblant 43
3. Approfondir l’analyse du rapport bénéfice/risque des traitements ainsi que la connaissance des données médico-économiques relatives au dépistage et au traitement du cancer de la prostate 44
a) Différencier le rapport bénéfice/risque selon le profil des patients 44
b) Promouvoir les techniques médicales innovantes 44
c) Poursuivre l’évaluation médico-économique des scénarios de dépistage et des options de traitement du cancer de la prostate 44
4. Préparer le dépistage systématique du cancer de la prostate 44
a) Informer la population sur l’intérêt d’un dépistage du cancer de la prostate 45
b) Mettre en place des structures départementales chargées de promouvoir le dépistage du cancer de la prostate, à l’instar des structures existantes pour le dépistage du cancer du sein et du cancer colorectal 45
Treize recommandations pour améliorer le dépistage et le traitement du cancer de la prostate 47
TRAVAUX DE L’OFFICE 49
ÉTUDE 57
L’Office parlementaire d’évaluation des politiques de santé (OPEPS), dont la mission est d’éclairer le Parlement sur les conséquences des choix de santé publique, a choisi le cancer de la prostate comme sujet d’étude en 2008, en raison de la fréquence de cette pathologie et du coût de sa prise en charge pour la collectivité.
Deuxième cancer le plus fréquent (60 000 nouveaux cas par an environ), le cancer de la prostate certes a fait l’objet d’une attention soutenue des pouvoirs publics, mais demeurent de véritables interrogations sur les modalités de dépistage et de prise en charge.
L’apparition d’un test sanguin – le dosage sérique de l’antigène prostatique spécifique – a révolutionné le dépistage. En moins de dix ans, ce test s’est progressivement imposé comme un examen de routine, au point de concerner aujourd’hui des millions de Français de plus de cinquante ans. Pourtant, le dépistage du cancer de la prostate reste aujourd’hui controversé, certaines organisations professionnelles plaidant pour un dépistage systématique de cette forme cancéreuse tandis que d’autres experts font valoir les incertitudes demeurant sur l’impact du dépistage en termes de baisse de la mortalité.
En raison des coûts induits, l’OPEPS se devait d’examiner les conditions dans lesquelles le cancer de la prostate est actuellement recherché et traité. À cette fin, il a fait réaliser par un groupe d’experts réuni sous l’égide de l’Association Française d’Urologie, partenaire sélectionné par appel d’offre, une étude visant à apporter les éléments scientifiques nécessaires à une réflexion sur la politique à mener par les pouvoirs publics à l’égard du dépistage du cancer de la prostate.
Même si elle n’apporte pas toujours des conclusions nettes aux questions posées par l’OPEPS et si certains de ses développements ne paraissent pas aboutis, l’étude, nourrie de la contribution de plusieurs éminents spécialistes a servi de support à l’élaboration de propositions innovantes, présentées dans le cadre du présent rapport en vue d’améliorer le dépistage du cancer de la prostate.
I.- LA DÉTECTION PRÉCOCE DU CANCER DE LA PROSTATE
EST UN ENJEU THÉRAPEUTIQUE ESSENTIEL
1. Une glande masculine liée aux fonctions de reproduction
En grec ancien, le prostatès est « celui qui se tient devant ». Il aurait d’abord désigné le combattant de la première ligne, puis le chef d’un parti dans les États démocratiques, enfin l’homme sous la protection duquel tout étranger qui désirait s’installer à Athènes devait se placer. Il serait à l’origine du terme « un prostate » en français, avec le sens « diplomatique » de protecteur des étrangers. Au XVIe siècle, des savants ont appelé « prostate » une glande de l’appareil génital masculin, réputée protectrice mais jusque-là innomée, et, pour éviter la confusion, ont féminisé le mot.
La prostate est une glande qui a pour fonction de sécréter et de stocker un liquide qui, mélangé aux spermatozoïdes élaborés par les testicules et au liquide des vésicules séminales, forme le sperme. La prostate entoure l’urètre, juste au-dessous de la vessie. L’urètre masculin a deux fonctions : évacuer l’urine pendant la miction et transporter le sperme pendant l’éjaculation. C’est à l’intérieur de la prostate que se fait la jonction entre l’urètre venant de la vessie et la vésicule séminale. Entre 10 % et 30 % du fluide séminal est produit par la prostate, le reste est produit par la vésicule séminale.
La prostate contient également un muscle qui aide à expulser le sperme pendant l’éjaculation. Pour fonctionner correctement, la prostate a besoin d’androgènes (hormones masculines). L’androgène principal est la testostérone, principalement produite par les testicules.
Une prostate saine est approximativement de la taille d’une noix, de 15 à 25 grammes à l’âge adulte. Très petite à la naissance, elle prend du volume lors de la puberté. Mais la glande continue de croître de volume sur un rythme plus lent pendant tout l’âge adulte, engendrant après l’âge de soixante ans divers troubles urinaires du fait de son volume excessif.
2. Un cancer fréquent chez les hommes
Le cancer de la prostate se distingue des autres cancers par trois principales caractéristiques :
– c’est un cancer qui est parfois d’évolution très lente, dont la période de latence, dépourvue de symptômes, peut s’étendre sur une dizaine d’années ;
– c’est un cancer qui se manifeste traditionnellement dans la soixantaine. L’âge médian des patients au moment du diagnostic était de soixante-quatorze ans en 2000. On observe toutefois une tendance à l’abaissement de l’âge au moment du diagnostic, en raison des progrès du dépistage mais également de l’apparition plus précoce de cancers agressifs (à partir de quarante-cinq ans) ;
– c’est un cancer fréquent, même s’il n’est pas très létal du fait de la combinaison des facteurs précédents (âge avancé des patients et évolution lente). L’incidence du cancer de la prostate est estimée par l’Institut de veille sanitaire à 40 000 nouveaux cas chaque année ; parmi les 23 localisations cancéreuses suivies par l’Institut de veille sanitaire, il s’agit du deuxième cancer le plus fréquemment diagnostiqué chez les hommes. Le nombre de décès attribués à cette pathologie est de 10 000 par an (sur 531 000 décès annuels recensés en 2004 par l’Institut de veille sanitaire), ce qui correspond à 3 % du total des décès. Le cancer de la prostate est la cinquième cause de décès par cancer pour la population et la deuxième pour les hommes.
Si le nombre de nouveaux cas de cancers enregistrés annuellement est passé de 26 500 en 1995 à plus de 40 000 en 2000 et 62 000 en 2005 (1), les épidémiologistes s’accordent à considérer que l’explosion constatée est davantage le reflet des progrès du dépistage que d’un développement de la maladie. Le recours à un test sanguin, le dosage de l’antigène prostatique spécifique (PSA), permet en effet aujourd’hui de repérer des cancers débutants qui auparavant n’auraient normalement pas été détectés avant des années. Il est donc logique que le nombre de cancers connus augmente pendant quelques années. Il devrait se stabiliser à un niveau supérieur, une fois l’effet du dépistage régulé.
Il y avait en 2002 un peu plus de 150 000 patients vivants avec un cancer de la prostate diagnostiqué au cours des cinq années précédentes (2).
Le hiatus entre la prévalence de la maladie (nombre de personnes atteintes par la maladie à un moment donné) et sa faible létalité tient en deux données : un homme né en 1940 à 18,6 % de chance d’avoir un cancer avant soixante-quinze ans mais seulement 0,85 % d’en mourir avant cet âge (3).
B. LE DÉPISTAGE CANCÉREUX, UNE ÉTAPE DÉCISIVE POUR UN TRAITEMENT CURATIF
1. Le stade clinique auquel le cancer est découvert détermine son évolution ultérieure
La connaissance du degré de développement d’un cancer est un enjeu thérapeutique de première importance. Elle commande les options thérapeutiques proposées au patient et permet de prédire l’évolution ultérieure de la maladie. Seule la détection du cancer à un stade précoce peut être associée à un traitement suffisamment efficace pour être curatif.
L’évolution du cancer de la prostate tient au développement des cellules cancéreuses dans la prostate, le plus souvent dans la zone périphérique de celle-ci.
Un cancer détecté à un stade précoce l’est à l’intérieur de la prostate. À mesure que le cancer progresse, la tumeur peut se propager en dehors de la « capsule » prostatique, en commençant par les tissus environnants. Le cancer avancé correspond à des stades de développement du cancer où les cellules cancéreuses se diffusent dans l’ensemble de l’organisme sous la forme de métastases cancéreuses. Le cancer de la prostate s’étend alors en général à la colonne lombaire ou aux os pelviens et provoque des douleurs lombaires. Les symptômes cliniques sont ainsi fréquemment associés à un cancer de la prostate de stade avancé.
Il existe donc différents « stades » de cancer de la prostate qui indiquent le degré d’extension du cancer de la prostate aux tissus avoisinants et aux autres organes. Pour les décrire, les médecins utilisent le système de classification TNM, qui caractérise l’extension de la tumeur primitive (T), l’absence ou la présence de métastases ganglionnaires (N), et l’absence ou la présence de métastases à distance (M).
La classification TNM
Quatre catégories décrivent la tumeur primitive. Le stade « T1 » correspond à une tumeur non perçue au toucher rectal. Il s’agit d’une agrégation de cellules cancéreuses découvertes incidemment lors de l’examen du tissu prostatique obtenu au cours d’une intervention pour cause d’hypertrophie bénigne de la prostate, ou découvertes par biopsies à la suite d’une élévation suspecte du taux d’antigène prostatique spécifique. Le stade « T2 » correspond à une tumeur cancéreuse d’un volume palpable au toucher rectal et qui semble localisé à la glande, touchant un seul ou les deux lobes de la prostate. Le stade « T3 » correspond à un cancer qui s’étend en dehors de la prostate, aux vésicules séminales. Le stade « T4 » correspond à un cancer qui a envahi les organes adjacents à la prostate (vessie, rectum, muscle).
La description de la tumeur primitive est complétée par la notation d’une atteinte des ganglions lymphatiques, les premiers touchés par la migration des cellules cancéreuses – N0 en cas d’absence d’envahissement lymphatique et N1 en cas d’envahissement d’un ou de plusieurs ganglions du petit bassin –, ainsi que par le signalement de métastases à distance – M0 pour l’absence de métastases à distance et M1 en cas de présence de métastases en dehors du petit bassin.
b) Des traitements appropriés à chaque stade clinique
Chaque stade du cancer détermine le choix du traitement le plus adapté à l’état du patient. Des cancers au stade T1 ou T2 (M0N0) sont des cancers localisés pour lesquels les traitements curatifs peuvent avoir une action curative tandis que les patients dont le cancer est à un stade avancé ou généralisé se voient proposer des traitements palliatifs visant à ralentir au mieux la progression de la maladie tout en limitant le plus possible les effets secondaires du traitement.
Les traitements par lesquels il est possible de traiter médicalement le cancer de la prostate sont multiples. Il y a trois principales modalités : la chirurgie, le traitement par rayons et le traitement par anti-hormones. Les deux premières font partie de la panoplie des traitements à visée curative ; la troisième des traitements à visée paliative.
● Les traitements à visée curative
Ils sont pleinement efficaces pour les cancers qui n’ont pas franchi les limites de la capsule prostatique, ce qui correspond aux cancers des stades T1 et T2 dans la classification TNM.
Il s’agit tout d’abord de l’ablation chirurgicale des deux lobes de la glande prostatique : c’est la prostatectomie radicale, réalisée par voie chirurgicale classique ou par cœlioscopie (laparoscopie).
En alternative, une radiothérapie externe peut être prescrite afin de détruire par irradiation les cellules des foyers cancéreux localisées dans la prostate.
Une troisième technique peut être utilisée dans le cas où le cancer est encore localisé à l’intérieur de la prostate. Il s’agit de la curiethérapie, qui consiste à implanter des grains de matière faiblement radioactive dans la prostate à proximité des foyers cancéreux, afin de reproduire le principe de la radiothérapie, sur une période de temps plus longue.
Ces techniques visent à éradiquer définitivement toutes les cellules porteuses du cancer ; elles conduisent à intervenir de manière agressive dans une région du corps humain innervé où passent notamment les nerfs érecteurs. Elles conduisent alors à des séquences postopératoires fréquentes, se traduisant par des troubles urinaires et de l’érection. C’est pourquoi la prostatectomie est parfois perçue comme une opération mutilante. L’amélioration des techniques chirurgicales minimisent les effets secondaires.
● Les traitements à visée palliative
Ces traitements visent à éviter la dissémination des cellules cancéreuses dans l’organisme et à réduire les foyers existants. En effet, lorsque les tumeurs cancéreuses ont dépassés les limites de la capsule prostatique, un traitement local (par chirurgie ou radiothérapie) est probablement inutile et un traitement hormonal est recommandé car il permet de bloquer les cellules prostatiques quel que soit l’endroit du corps où elles se trouvent.
Les traitements palliatifs agissent de manière moins agressive sur l’organisme, suscitant moins d’effets secondaires, et sont donc synonymes d’un meilleur confort de vie pour les patients. Ce sont des traitements qui s’inscrivent dans la durée et qui vise à exploiter la très longue période d’incubation du cancer de la prostate pour engager une « course de lenteur » avec la maladie. Ces traitements sont donc privilégiés chez les personnes âgées, de sorte que l’« on ne meurt pas du cancer de la prostate, mais avec le cancer de la prostate ».
L’hormonothérapie (ou thérapie hormonale) est un de ces traitements. Il agit en réduisant la quantité d’hormones masculines à un taux extrêmement faible. Les cellules prostatiques, et en particulier les cellules cancéreuses, qui se multiplient plus rapidement que les cellules normales, ont en effet besoin de testostérone pour se développer. Les cellules tumorales de la prostate en ont toujours besoin, même quand elles ont envahi d’autres parties du corps. Chez l’homme, la testostérone est en grande partie sécrétée par les testicules. Pour cette raison, l’ablation des testicules par voie chirurgicale permet de réduire de façon efficace le taux de testostérone dans l’organisme. Cette opération porte le nom d’orchitectomie (castration). De manière alternative, l’injection de certaines anti-hormones peut provoquer, par voie chimique, l’arrêt temporaire de production de la testostérone par les testicules.
2. Les éléments constitutifs du dépistage
a) Dépistage et diagnostic, deux étapes distinctes
Dépistage et diagnostic obéissent à des logiques thérapeutiques différentes.
Le diagnostic consiste à confirmer ou invalider la présence d’une maladie chez une personne potentiellement malade. Le dépistage se situe en amont du diagnostic : il consiste à rechercher parmi une population d’individus en bonne santé des personnes potentiellement malades en vue d’un diagnostic plus précoce et d’un traitement plus efficace.
Dans un cas, il s’agit d’une étape du processus thérapeutique s’adressant à des personnes a priori malades. Dans l’autre, il s’agit d’une démarche de santé publique, menée auprès d’une population bien portante dans une logique préventive. Ces deux actions concernent des acteurs médicaux, mettent en œuvre des modalités et sont régis par des principes d’action distincts.
Le dépistage des tumeurs cancéreuses s’est considérablement développé ces dernières années sous l’influence de plusieurs facteurs : l’apparition de nouveaux tests de dépistages, utilisant notamment des marqueurs tumoraux (4), le développement des campagnes de dépistage dans une perspective d’amélioration de la santé publique, et la demande des patients eux-mêmes qui s’informent de plus en plus.
Les pratiques de dépistage les plus anciennes concernent le cancer du sein, dont les nodules ont pu être détectés par palpation, puis par radiographie. Un programme national de dépistage systématique du cancer du sein a été établi par la Direction générale de la santé du ministère de la santé en 1994, puis sa généralisation a été inscrite comme priorité dans le programme national de lutte contre le cancer en février 2000. Depuis, deux autres cancers bénéficient du soutien des pouvoirs publics pour un dépistage systématique : le cancer colo-rectal, dont le dépistage organisé est en cours de généralisation, et le cancer du col de l’utérus.
Schéma général d’organisation du dépistage du cancer
![]()
![]()
![]()
![]()
![]()
Test de dépistage Examens de diagnostic Examens de suivi
Médecin généraliste Médecin spécialiste Service spécialisé ou ou médecine préventive centre de lutte contre le cancer
b) Une nouvelle dynamique du dépistage du cancer de la prostate liée à l’introduction d’un test de détection efficace
Le dépistage du cancer de la prostate s’est longtemps fait par la méthode du toucher rectal (5).
Mais à la fin des années 80, l’introduction d’un test sanguin a révolutionné le dépistage du cancer de la prostate. Alors que le test clinique antérieur était d’une mise en œuvre difficile et ne décelait qu’une faible fraction des cancers prostatiques, le nouveau test sanguin, qui requiert une simple prise de sang, a permis un taux de détection du cancer de la prostate jamais atteint jusqu’alors.
Ce test sanguin permet de détecter une protéine fabriquée exclusivement par la prostate, l’antigène spécifique de la prostate (dite PSA). L’antigène spécifique de la prostate sert à liquéfier le sperme afin de faciliter le déplacement des spermatozoïdes. Il est présent dans le sperme à la concentration de l’ordre de 1 milligramme par litre, mais il se retrouve à une concentration infime dans le sang (de l’ordre de 1 nanogramme (6) par millilitre). Son dosage sanguin est utilisé pour le diagnostic ou le suivi du cancer de la prostate.
Le nombre de dosages de PSA remboursés par l’assurance maladie permet de suivre le développement des tests de dépistage de cancer de la prostate. Une très forte augmentation au cours de ces dernières années peut être constatée :
Augmentation du nombre de dosages de PSA remboursés par le régime général de l’assurance maladie entre 2001 et 2007 (source CNAMTS)
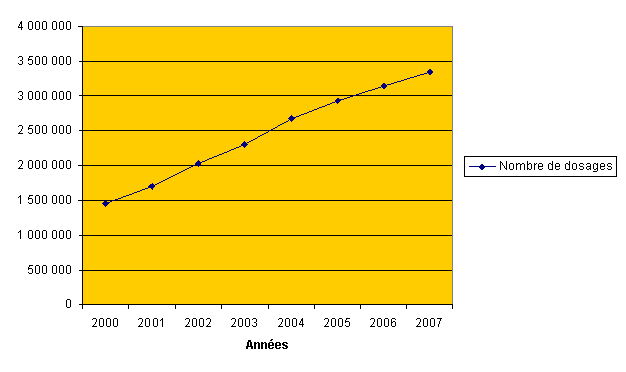
Ces données placent le dépistage du cancer du cancer de prostate parmi l’un des principaux dépistages cancéreux réalisés chaque année en France. Le cancer de la prostate est devenu, à l’évidence, en quelques années, l’objet d’un dépistage de masse, à un niveau équivalent au dépistage organisé du cancer du sein ou du cancer colorectal.
c) Des questions de stratégie de dépistage non tranchées
La particularité du dépistage du cancer de la prostate est qu’il se déroule actuellement sous la forme d’un dépistage volontaire, en dehors de tout cadre organisationnel mis en œuvre par les pouvoirs publics. Cette situation est la conséquence des réserves émises par les épidémiologistes et les spécialistes de santé publique sur l’intérêt d’un dépistage systématique du cancer de la prostate en terme de santé publique. Or la controverse scientifique a pour conséquence de retarder les décisions des pouvoirs publics en faveur du dépistage du cancer de la prostate.
● La spécificité de la démarche de dépistage
Il convient de rappeler la spécificité de la démarche de dépistage.
D’une façon générale, le dépistage vise à isoler au sein d’une population bien portante un groupe de personnes pour lesquels il existe un risque de présence de la maladie statistiquement supérieur par rapport à la population générale et en faveur desquels des examens diagnostiques pourront être utilement menés.
Appliquée à un seul individu, la démarche de dépistage correspond en fait à une démarche de prédiagnostic : la personne veut savoir si elle fait partie d’un groupe à risque et s’il serait utile qu’elle fasse des examens complémentaires de diagnostic de présence ou d’absence de la maladie.
Le dépistage est permis par l’existence d’un test. Ce test détermine le risque statistique de manière binaire (positif ou négatif), mais sa réalisation n’a d’intérêt médical que si un traitement thérapeutique de la pathologie est possible à ce stade.
Or bien que le dépistage systématique à l’échelle d’une population se présente comme le prolongement naturel du dépistage individuel, son intérêt dépend d’un certain nombre de paramètres complexes à maîtriser.
Selon l’Organisation mondiale de la santé (OMS), l’intérêt du dépistage dépend :
– de l’existence d’un test permettant d’isoler une population à risque à un coût raisonnable ;
– de l’existence d’un traitement utile et efficace de la maladie. Le dépistage d’une maladie dépourvue de thérapeutique au stade où elle est dépistée n’a pas d’utilité médicale ;
– de l’absence d’effets secondaires des actes consécutifs au dépistage (examens de diagnostic et traitements thérapeutiques).
En pratique, si le choix des pouvoirs publics en termes de dépistage est déterminé par l’équilibre existant entre inconvénients médicaux pour la population et les avantages thérapeutiques attendus, cet équilibre dépend en dernier ressort du test de dépistage et de ses performances.
Plus le test de dépistage est sensible, c’est-à-dire permettant d’isoler au sein d’une population bien portante des personnes présentant réellement un risque élevé de développer la maladie, et plus les inconvénients médicaux (effets secondaires) sont circonscrits aux personnes malades, plus l’on se rapproche d’une démarche thérapeutique classique. Au contraire, moins le test de dépistage est sélectif, plus on expose un grand nombre de personnes à différents inconvénients médicaux qu’ils n’auraient pas subis en l’absence de dépistage, moins le dépistage systématique doit être promu par les pouvoirs publics.
En d’autres termes, pour bien comprendre comment la problématique du dépistage se présente en termes de santé publique, les autorités publiques doivent pouvoir être en mesure d’établir un rapport favorable entre le bénéfice thérapeutique retiré par les malades et les inconvénients médicaux supportés par l’ensemble des personnes du fait du dépistage. Que les traitements n’aient pas d’efficacité patente – ce qui est en l’occurrence discuté sur le plan épidémiologique pour le cancer de la prostate –, ou que les tests de dépistage ne soient pas en mesure de cerner les cancers débutants effectivement agressifs, et le rapport bénéfice/risque devient défavorable, au point de dissuader les pouvoirs publics d’organiser un dépistage systématique.
● Les obstacles au dépistage organisé du cancer de la prostate
Les réticences exprimées à l’égard du dépistage systématique du cancer de la prostate sont principalement fondées sur :
– la crainte de surdiagnostics (7), lesquels ont des conséquences sur les patients concernés compte tenu des effets secondaires ;
– des doutes sur son efficacité réelle, les études épidémiologiques n’ayant en effet pas mis en évidence, pour le moment, de lien clair entre dépistage et réduction de la mortalité associée au cancer de la prostate.
Sur le plan médical, les arguments invoqués à l’encontre d’un dépistage organisé portent plus précisément sur l’évolution naturelle (sans traitement) des cancers diagnostiqués au stade précoce, sur la létalité spécifique du cancer de la prostate, sur sa prévalence histologique (mesurée à l’autopsie) et de manière plus secondaire sur la valeur prédictive des tests de dépistage retenus.
C’est pourquoi, au niveau international, le Conseil européen et l’Organisation mondiale de la santé ont exclu le cancer de la prostate de la liste des cancers pour lesquels un dépistage est recommandé (8). De leur côté, les autorités sanitaires américaine et canadienne s’interrogent également la pertinence d’un dépistage systématique.
La crainte des autorités publiques est que le dépistage n’induise une forte augmentation du nombre de traitements coûteux, sans réduction significative de la mortalité globale du fait de l’incidence des autres causes de mortalité aux âges avancés où sont détectés ce type de cancer.
● Des obstacles qui ne sont toutefois pas spécifiques au cancer de la prostate
Dans une certaine mesure, les arguments avancés à l’encontre du dépistage du dépistage du cancer de la prostate ne sont pas spécifiques à ce type de cancer.
Le dépistage des pathologies cancéreuses présente en effet certaines similarités d’un point de vue de santé publique, que ces cancers fassent déjà l’objet de campagnes publiques de dépistage déjà engagées (pour le cancer du sein ou le cancer colorectal) ou bien simplement envisagées (cancer de la prostate).
Les dépistages ont en commun leur objectif, la détection des cancers au stade précoce asymptomatique, en vue d’améliorer l’efficacité des traitements curatifs. Ils soulèvent également tous des questions relatives à leur efficacité du point de vue de la mortalité, à l’existence de surdiagnostics et à la gestion des faux-positifs.
En ce qui concerne le cancer du sein, l’OPEPS a consacré un rapport au dépistage de ce cancer en 2003, à la suite notamment de la publication par deux chercheurs danois, Peter Gotzsche et Ole Olsen, en 2000, d’une analyse mettant en doute l’impact, en termes de baisse de mortalité des campagnes publiques de dépistage. La controverse, qui souligne l’importance de la question des surdiagnostics, n’est toujours pas éteinte, puisque l’Institut de veille sanitaire et l’Institut national du cancer ont rendu publique, en septembre 2006, une note sur le dépistage du cancer du sein répondant à plusieurs articles de revues françaises (9) relayant les doutes sur les bénéfices des programmes de dépistage.
La question des faux-positifs (10) vient d’être également posée par les autorités médicales à propos du programme de dépistage du cancer colorectal en cours de déploiement. L’Académie nationale de médecine a ainsi adopté, le 30 janvier 2007, un rapport remettant en cause le choix du test Hémoccult II, du fait du taux élevé de faux-positifs associé. L’utilisation de ce test, peu sensible, provoque de nombreuses coloscopies inutiles. L’académie recommande donc que la méthode immunologique automatisée soit privilégiée dans les nouveaux départements proposés pour le dépistage en 2007 et préconise une évaluation des résultats tenant compte en particulier du rapport bénéfice/risque du dépistage.
● Un dépistage individuel présentant moins de garanties qu’un dépistage organisé
Les deux types de dépistage – individuel ou systématique – ne sont pas exclusifs l’un de l’autre. Le cas du cancer du sein, où ils coexistent, le prouve. Mais le dépistage organisé par les pouvoirs publics au travers de campagnes est réalisé de manière plus structurée et selon des pratiques plus standardisées que le dépistage individuel.
L’absence de dépistage systématique pour le cancer de la prostate ne signifie pas que le dépistage ne fait l’objet d’aucune politique de la part des pouvoirs publics. Le test de dépistage du cancer (dosage sanguin du PSA) est remboursé par la Sécurité sociale, ce qui est favorable à sa prescription par les médecins généralistes. Mais, le dépistage ne faisant pas l’objet d’une recommandation favorable de la part des autorités sanitaires, se fait jour un certain flottement parmi les médecins prescripteurs.
Il est vrai que les pouvoirs publics manquent d’informations sur les conditions de réalisation des dépistages individuels. Les circonstances du dépistage, l’âge des patients, l’information qui leur est donnée à ce moment, les modalités de réalisation de la confirmation du diagnostic, les filières de soins activées en cas de diagnostic positif, le coût des dépistages spontanés constituent pourtant autant de thèmes qui mériteraient attention.
Or il conviendrait d’appliquer aux dépistages spontanés les mêmes grilles d’analyse et d’évaluation que celles qui sont utilisées pour les dépistages organisés, l’objectif étant d’en améliorer la pratique collective. C’est le but principal que l’OPEPS a fixé à l’étude qu’il a commandé, après appel d’offre, à l’Association Française d’Urologie.
d) L’éclairage apporté par des études américaine et européenne récentes
Deux études, publiées dans une revue médicale de prestige (New England Journal of Medicine) viennent d’analyser de manière rigoureuse le bénéfice du dépistage du cancer de la prostate sur la survie des patients.
L’une d’entre elles est américaine (étude PLCO), et l’autre européenne (étude ERSPC). Elles ont toutes les deux le mérite d’avoir inclus un grand nombre de sujets, et d’avoir comparé de manière randomisée deux groupes : un groupe d’hommes chez qui le dépistage du cancer prostatique n’était pas réalisé, et un autre groupe d’hommes qui avait un dépistage du cancer prostatique (dosage du PSA en moyenne tous les quatre ans).
Dans l’étude américaine PLCO, 76 693 hommes ont été inclus entre 1993 et 2001. Après sept ans de suivi, l’incidence du cancer prostatique était de 116/10 000 personnes et par an dans le groupe dépistage, versus 95/10000 personnes et par an dans le groupe contrôle. La mortalité était de 2/10000 personnes et par an dans le groupe dépistage, versus 1,7 pour 10 000 personnes et par an dans le groupe contrôle. Ces deux taux de mortalité n’étaient pas statistiquement différents.
Dans l’étude européenne ERSPC, 162 243 hommes d’un âge compris entre cinquante-cinq et soixante-neuf ans ont été inclus. Après un suivi médian de neuf ans, l’incidence du cancer prostatique était de 8,2 % dans le groupe dépistage, versus 4,8 % dans le groupe contrôle. Le ratio de décès spécifiques du cancer de la prostate dans le groupe dépistage, par rapport au groupe contrôle, était de 0,8. Cette différence était statistiquement significative. La différence en terme de risque absolu était de 0,71 décès pour 1 000 hommes. La différence en terme de mortalité spécifique entre les deux groupes était de 20 %.
Ces deux études multicentriques randomisées, portant sur une large population, ont donc abouti à des résultats contradictoires. L’étude américaine ne montre pas de bénéfice du dépistage du cancer prostatique en terme de mortalité, alors que l’étude européenne montre un très net bénéfice (différence de mortalité spécifique de 20 % entre les deux groupes). Ces deux études ont bien sûr des biais méthodologiques. Néanmoins, la méthodologie est meilleure dans l’étude européenne. En effet, elle a inclus un nombre beaucoup plus élevé de sujets, et avec un recul supérieur. Par ailleurs, l’étude américaine comporte un biais majeur puisque environ la moitié des hommes appartenant au groupe contrôle, c’est-à-dire n’étant pas supposé avoir eu un dépistage, avait en réalité déjà eu un dosage du PSA avant l’inclusion. Pour ces raisons, on peut aujourd’hui considérer que l’étude européenne fait référence, et que jusqu’à preuve du contraire le dépistage du cancer prostatique apporte un réel bénéfice en terme de survie.
II.– L’ÉTUDE SCIENTIFIQUE ENGAGÉE PAR L’OPEPS
ET SES RÉSULTATS
L’étude scientifique que l’OPEPS a lancée et fait réaliser au cours de l’année 2008 avait pour but de compléter les données existantes sur la politique actuelle de prise en charge du cancer de la prostate en France.
Le cahier des charge de l’étude était centré sur trois aspects de cette politique : les pratiques de dépistage, les parcours de soins et les coûts des traitements.
A. UN DÉPISTAGE VOLONTAIRE QUI A ATTEINT L’AMPLEUR D’UN DÉPISTAGE DE MASSE
● Une large population concernée par le dépistage volontaire
On sait que 3,5 millions de test de dépistage sont remboursés par le régime général de l’assurance maladie chaque année, pour une population visée de 6,5 millions de personnes (effectif de la classe d’âge cinquante/soixante-dix ans) et une population concernée au sens large plus proche de 9 millions de personnes (effectif intégrant une partie de la classe d’âge quarante-cinq/cinquante ans et de la classe d’âge soixante-dix/quatre-vingts ans). Le taux de couverture se situe donc entre 30 % et 50 % de la population cible.
L’OPEPS a demandé qu’un bilan quantitatif plus précis du dépistage individuel soit réalisé. L’étude a ainsi fait apparaître plusieurs obstacles à la connaissance du nombre de tests de dépistage réalisés chaque année : double usage du dosage de PSA, en tant que test de dépistage et en tant qu’examen diagnostique ou de suivi, caractère partiel des bases de suivi des remboursements, non prise en compte dans les statistiques d’une partie des tests fabriqués.
Il semble cependant que, dans leur globalité, ces éléments jouent pour l’instant dans le sens d’une sous-évaluation du nombre de tests effectivement réalisés. Le nombre de tests vendus chaque année par les fabricants de tests de dépistage serait en réalité supérieur au nombre de tests remboursés par l’assurance maladie. Au total, le rapport scientifique évalue entre 7 et 8 millions le nombre de dosages de PSA prescrits chaque année (11).
● Une opinion largement favorable à la généralisation du dépistage du cancer de la prostate
Une grande majorité des médecins ayant répondu à l’enquête réalisée pour le compte de l’OPEPS est favorable à un dépistage régulier de ce cancer. Elle déclare le proposer à leurs patients, dès l’âge de cinquante ans et au moins jusqu’à soixante-quinze ans. Seule une faible fraction des médecins généralistes interrogés est opposé à la prescription du test de dépistage, principalement par désaccord avec les recommandations édictées sur ce point par les organisations professionnelles (12).
● Une augmentation corrélative du nombre de cancers recensés
La diffusion du dépistage a permis d’améliorer la détection des cancers de la prostate et donc le nombre de cancers encore au stade précoce qui n’étaient pas connus auparavant. Ce progrès de la connaissance médicale s’est traduit mécaniquement par une augmentation du nombre de cas recensés. Le nombre de cas enregistrés est ainsi passé de 11 000 nouveaux cas annuels en 1980 à plus de 62 000 en 2007, sans que les spécialistes notent une aggravation de la maladie durant cette période.
Cette augmentation devrait, selon l’étude réalisée pour le compte de l’OPEPS, atteindre son plafond, à l’instar de ce qui a été observé aux États-Unis (13). Dans ce pays, la diffusion du test du PSA a provoqué un doublement du taux de cancers récents en cinq ans (qui est passé de 73/100 000 à 140/100 000), avant qu’une baisse brutale ne survienne du fait de l’épuisement du stock de cancers non découverts.
● Un abaissement induit de l’âge au moment de la découverte du cancer
C’est la seconde conséquence importante du dépistage. En effet, en dehors de toute action de dépistage, le cancer de la prostate n’est découvert qu’au stade des symptômes, correspondant généralement à un âge avancé. La généralisation du dépistage précoce se traduit, logiquement, par une augmentation de la proportion de cas dépistés au stade asymptomatique, c’est-à-dire par une « avance au diagnostic » – le moment du diagnostic de cancer est avancé de plusieurs années par rapport à la date de manifestation des symptômes – et donc par un abaissement de l’âge moyen des patients au moment du dépistage.
Le recul de l’âge moyen lors de la découverte du cancer est un phénomène visible dans les études qui ont pris en compte cette variable.
Âge moyen des patients atteints de cancers de la prostate
Étude Tarn/Isère 1985-1995 (14) |
Étude FRANCIM 1995 (15) |
Étude OPEPS |
Étude RSI | |
Âge moyen |
73,5 ans |
71,6 ans |
71,3 ans |
70,3 ans |
Ce phénomène d’avance au diagnostic se traduit logiquement par un recul de l’âge des personnes opérées pour cancer de la prostate. Le rajeunissement des patients est manifeste lorsque l’on suit l’évolution de l’âge des personnes opérées entre 2002 et 2007.
Âge des patients opérés pour prostectomie en 2002 et 2007 (18)
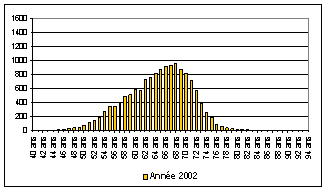
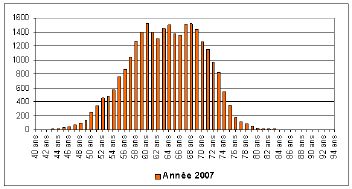
On constate, en 2007 l’apparition d’un second pic, centré autour de cinquante-huit ans, correspondant à une augmentation importante du nombre d’interventions chirurgicales concernant des patients plus jeunes.
B. DES PRATIQUES HÉTÉROGÈNES RÉDUISANT L’EFFICACITÉ DU DÉPISTAGE
L’étude réalisée pour le compte de l’OPEPS a fait apparaître que les pratiques de dépistage individuel du cancer de la prostate ne sont pas toujours conformes aux prescriptions des organisations professionnelles. Cette hétérogénéité, qui s’observe également au niveau de la régularité des examens, n’est pas sans affecter l’efficacité globale du dépistage.
1. Les tests de dépistage sanguins comportent des limites et doivent être complétés
● Une combinaison de deux tests recommandée par les organisations professionnelles qui n’est pas systématiquement employée
L’état actuel des recommandations médicales professionnelles concernant le dépistage volontaire du cancer de la prostate repose sur la mise en œuvre combinée de deux tests : le dosage sanguin du taux d’antigène prostatique spécifique (PSA) et le toucher rectal.
Alors que les recommandations professionnelles préconisent l’association du test sanguin (PSA) et du test clinique (toucher rectal), en raison du manque de sensibilité des deux tests faits isolément, les conditions matérielles de réalisation semblent privilégier une pratique isolée du test sanguin.
En région Picardie, 91 % des médecins généralistes ont prescrit au moins une fois un dosage de PSA, mais 51 % seulement déclarent y associer systématiquement le toucher rectal (19).
D’après l’enquête déclarative menée pour l’OPEPS, à laquelle 1 000 médecins ont répondu, 90 % des médecins proposent un test de PSA à leurs patients, mais celui-ci n’est associé systématiquement au toucher rectal que par 40 % des praticiens (20).
● Un test sanguin qui n’est pas toujours probant
Une certaine confusion entoure l’utilisation et l’interprétation du dosage sanguin de PSA. Les performances de ce test ne sont en réalité pas suffisantes pour en faire un test d’avenir. Dès lors, il s’agit de savoir comment il est possible d’améliorer l’usage de ce test.
L’outil présente plusieurs limites :
– c’est un instrument controversé.
Le test de dépistage PSA est, on l’a dit, fondé sur le dosage du taux d’une protéine, l’antigène prostatique spécifique produit par les tissus de la prostate. Le taux normal dans le sang est de l’ordre de 1 nanogramme/millilitre. Il augmente lorsque les cellules qui produisent l’antigène prostatique spécifique se développent. Mais plusieurs pathologies peuvent être responsables d’une élévation du taux de PSA dans le sang : les infections de la prostate, l’hypertrophie bénigne de la prostate et le cancer de la prostate. Donc, le taux sanguin de PSA n’est pas à proprement parler un marqueur tumoral (21). S’il y a un lien entre un taux de PSA élevé et le cancer de la prostate, ce lien n’est ni univoque ni absolu ; il n’est que statistique.
Le taux de PSA peut ainsi augmenter pour d’autres causes que le cancer de la prostate. Inversement, un cancer peut se développer sans se traduire par une augmentation corrélative du taux de PSA. Les deux cas de figure – croissance du taux de PSA en l’absence de cancer et développement d’un cancer sans élévation concomitante du taux de PSA – définissent les limites du taux de PSA comme instrument de dépistage, et leur fréquence détermine les performances du test.
D’une manière générale, les performances du test du PSA dans son utilisation actuelle ne sont pas suffisamment satisfaisantes pour le consacrer comme test de référence.
– ses performances sont moyennement satisfaisantes.
L’OPEPS a demandé qu’un bilan de ses performances soit réalisé dans le cadre de l’étude scientifique.
Dans la pratique la plus courante, le test du PSA est déclaré positif pour des taux supérieurs ou égaux à 4 nanogrammes/millilitre. Pour établir les performances du test à cette valeur seuil, l’étude scientifique s’est référée à l’essai clinique le plus fiable en la matière, l’étude américaine Prostate cancer prévention trial (PCPT), au terme de laquelle l’ensemble des patients (plus de 5 000 personnes) ont fait l’objet d’une biopsies pour contrôler la présence effective d’un cancer.
Selon cette étude, le test de PSA avec une valeur seuil de positivité de 4 nanogrammes/millilitre présente une sensibilité, c’est-à-dire une capacité à déceler les cancers existants, de 24 %. Ce qui signifie que près des trois quarts des cancers existants ne sont pas détectés par le test sous sa forme actuelle. De plus, la valeur prédictive du test, c’est-à-dire le nombre de cancers que l’on trouvera parmi toutes les personnes ayant un test positif, n’est pas très élevée. Elle se situe entre 25 % et 35 % (22), ce qui conduit à réaliser un certain nombre de biopsies inutiles au titre des examens diagnostiques.
Certains souhaitent abaisser la valeur seuil du test pour améliorer sa sensibilité. Ils font valoir qu’un grand nombre de cancers se développent à des états précoces pour des valeurs inférieures à 4 nanogrammes/millilitre. Les résultats de l’étude PCPT montrent toutefois que, si on abaisse la valeur seuil au-dessous de 4 nanogrammes/millilitre, on améliore certes la sensibilité du test mais on diminue également sa spécificité et on augmente le risque de surdiagnostic, c’est-à-dire de traitement de cancer cliniquement non significatifs (23).
Il faut donc conclure, avec l’étude scientifique, à l’incapacité du test du PSA, dans ses modalités d’utilisation actuelles, à détecter davantage de cancers cliniquement significatifs sans biopsies inutiles. Pour une valeur seuil comprise dans la tranche 4-10 nanogrammes/millilitre, l’utilisation du test PSA détecte des cancers significatifs avec une sensibilité et une spécificité acceptables mais le test du PSA montre ses limites pour la recherche de cancers plus précoces à des valeurs seuils inférieures à 4 nanogrammes/millilitre. Pour ces valeurs, « les résultats d’études à long terme ne sont pas disponibles pour permettre une recommandation sur une valeur seuil optimale de PSA » (24).
– il peut utilement être complété par une mesure du rapport entre le PSA libre et le PSA total.
L’étude de l’OPEPS montre l’intérêt de prendre en compte non seulement la mesure du taux de PSA dans le sang mais également le rapport entre le PSA libre et le PSA total.
Le PSA est en effet présent dans le sang sous deux formes : une forme libre et une forme complexée, c’est-à-dire associée aux antiprotéases contenues dans le sang. La forme libre du PSA est moins abondante en cas de cancer que pour les autres pathologies de la prostate. Si le taux de PSA est élevé et que la proportion de PSA sous forme libre est faible, la présence d’une atteinte cancéreuse est presque certaine : l’étude commandée par l’OPEPS montre qu’on atteint alors une sensibilité de 95 % pour une valeur seuil de 25 %.
L’inconvénient de ce test complémentaire est qu’il pose des difficultés pratiques car le rapport PSA libre/PSA total se dégrade dans le temps dès lors que les échantillons ne sont pas conservés dans des conditions optimales.
– la mesure de la vélocité du PSA doit être davantage prise en compte.
Plus que la valeur atteinte par le PSA, c’est la progression continue du taux de PSA dans la durée qui signe la présence d’un cancer au stade précoce. L’étude commandée par l’OPEPS montre que, lorsqu’on dispose de trois dosages successifs sur une période de dix-huit mois, l’augmentation du PSA doit être considérée comme suspecte dès que son rythme est supérieur à 0,75 nanogramme/millilitre/an. La sensibilité de cet indicateur est de 80 % pour les taux de PSA compris entre 4 et 10 nanogrammes/millilitre (mais de 11 % pour les taux de PSA demeurant inférieurs à 4 nanogrammes/millilitre). Le calcul de la vélocité du PSA s’avère donc un indicateur précieux pour affirmer la présence d’un cancer pour un taux de PSA entre 4 et 10 nanogrammes/millilitre.
La mise en œuvre de cet indicateur suppose toutefois une standardisation des procédures de dosage pour la collecte des données relatives au PSA pour un patient et le suivi de leur évolution dans le temps.
2. L’hétérogénéité des pratiques a des conséquences négatives sur la régularité avec laquelle est suivi le taux de PSA
La régularité avec laquelle est pratiquée le test du PSA est un élément essentiel à la qualité du suivi médical des hommes de plus de cinquante ans. On vient en effet de voir que les mesures isolées du taux de PSA sont beaucoup moins intéressantes pour la détection du cancer de la prostate qu’une série de valeurs permettant de suivre la dynamique d’augmentation du PSA.
L’ampleur du nombre de dosages de PSA, qui se situe entre 3,5 millions (nombre de tests remboursés par le régime général de la Sécurité sociale) et 8 millions de tests annuels (plafond de l’estimation de l’étude OPEPS), ne peut d’ailleurs s’expliquer, si l’on considère le nombre d’hommes âgés de plus de cinquante ans dans la population française, que par une réitération périodique des tests par les personnes concernées.
L’étude commandée par l’OPEPS est pourtant peu concluante sur ce point. Une autre étude, réalisée par la caisse d’assurance maladie de la région Centre, a cependant montré que les dosages isolés de PSA étaient prépondérants en 2001 (72 % des remboursements réalisés, sur un échantillon de 61 500 dosages), et que seulement 22,8 % des dosages remboursés avaient été précédé d’un premier dosage moins d’un an auparavant (25).
Par ailleurs, une enquête de terrain menée en région Picardie a montré que, lorsque le dépistage est pratiqué régulièrement, les médecins généralistes optent pour le rythme de dépistage annuel (57 % des réponses), de préférence à un rythme bi-annuel (32 %) (26).
3. Les examens de dépistage sont plus efficaces
Deux critères permettent de mesurer l’impact du dépistage : le taux de détection des cancers et leurs stades cliniques.
● Taux de détection des cancers
Les données de la caisse d’assurance maladie de la région Centre (27) ont fait apparaître que sur 44 249 dosages réalisés, 1 % conduisait à une déclaration en affection de longue durée (ALD) pour cancer de la prostate dans un délai de six à dix-huit mois.
Une étude plus ancienne (1998) situait les taux de cancers détectés dans le cadre des actions de dépistage entre 0,55 % de la population dépistée (taux observé dans le département du Lot-et-Garonne) et 3 % (moyenne des taux décrits dans la littérature internationale) (28).
● Stades cliniques auxquels sont découverts les cancers
Le stade clinique indique la précocité de la découverte du cancer. Un cancer découvert au stade T reste localisé à la prostate et peut être traité par prostatectomie radicale ou radiothérapie conformationnelle (ciblée sur l’organe). Il est alors généralement asymptomatique. Les stades N et M correspondent à un envahissement des ganglions (N) ou au développement de métastases (M). Quinze ans en moyenne séparent le stade localisé de celui des métastases, mais le développement du cancer dépend de l’agressivité de celui-ci.
Les résultats présentés dans l’étude réalisée pour le compte de l’OPEPS montrent une prédominance de plus en plus marquée des cancers décelés au stade localisés (85 % des cancers de l’échantillon de 2 181 patients constitué à partir de 2001 par le réseau Francim et exploité par l’étude commandée par l’OPEPS).
Répartition des cancers découverts selon le stade clinique
Stade clinique |
Étude pour l’OPEPS (29) (échantillon de 2 181 personnes) |
Étude RSI (30) |
Étude FRANCIM (31) (échantillon de 798 personnes) |
T1 |
27 % |
22 % |
26 % |
T2 |
58 % |
48 % |
33 % |
T3 ou T4 |
3 % |
30 % |
15 % |
N+ |
10 % (avec M+) |
8,5 % |
17 % |
M+ |
10 % (avec N+) |
13 % |
7,8 % |
Cette évolution tend à montrer l’efficacité des dépistages permettant la détection des cancers au stade précoce.
4. L’origine de l’hétérogénéité des pratiques est à rechercher dans les divergences d’opinion parmi les médecins généralistes sur l’intérêt du dépistage
Si l’étude commandée par l’OPEPS, met en évidence une faible proportion de médecins généralistes véritablement opposés à la pratique du dépistage du cancer de la prostate, les pratiques de prescription des médecins généralistes semblent refléter la diversité des positions des représentants de cette profession à l’égard du dépistage sanguin du cancer de la prostate.
Autour d’une moyenne relevée par la caisse d’assurance maladie de la région Centre (32) de 22 dosages par médecin généraliste, les disparités sont assez importantes : 17 % des généralistes ont prescrit moins de 5 dosages sur les douze derniers mois tandis que 1 % en a prescrit plus de 100. Des écarts similaires ont été observés chez les spécialistes, le nombre de dosage prescrits sur les douze mois précédents variant de 5 à 733 par urologue.
Ainsi que le rappelle l’étude d’une équipe du centre hospitalier universitaire de Rennes, « les controverses sur le dépistage précoce du cancer de la prostate par le PSA, qui est recommandé par certaines sociétés savantes et déconseillé par de nombreux experts, rendent l’information et la conduite à tenir des médecins généralistes particulièrement délicate. Ce d’autant qu’ils sont confrontés à une population informée sur l’existence de ce test diagnostique, sans que soit mis en balance le manque de spécificité du dosage et le bénéfice escompté. » (33).
L’enquête déclarative réalisée pour le compte de l’OPEPS auprès de 1 000 médecins montre par ailleurs que seulement trois quarts des médecins généralistes adhéraient aux référentiels professionnels édictés par les sociétés savantes (34).
C. DES PARCOURS DE SOINS DIVERSIFIÉS
1. Une forte augmentation du nombre d’interventions curatives…
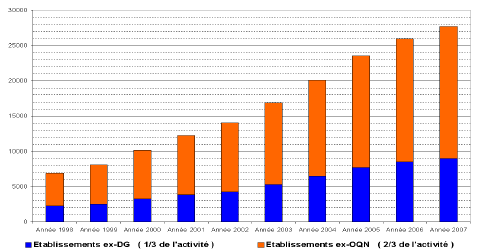
Les progrès du dépistage, favorisé par la diffusion du test sanguin de PSA, ont favorisé une détection plus précoce des cancers de la prostate. Celle-ci a permis d’identifier davantage de cancers à un stade localisé susceptibles d’être traités par les techniques chirurgicales radicales classiques. En France, le nombre de cancers de la prostate opérés par voie chirurgicale a ainsi plus que quadruplé en neuf ans, passant de 6 881 prostatectomies en 1998 à 27 733 en 2007.
Évolution du nombre d’opérations d’ablation de la prostate en 1998 et 2007
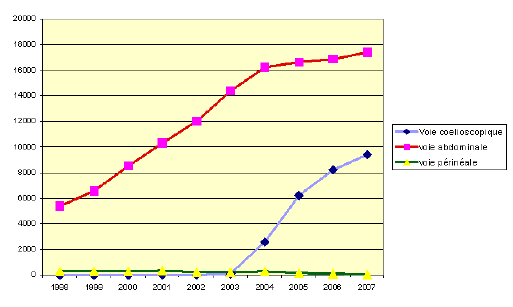
Source : Étude réalisée pour le compte de l’OPEPS
On note néanmoins l’émergence très rapide des techniques coelioscopiques qui représentaient 12 % des opérations chirurgicales en 2004 et 34 % en 2007.
2. …mais des stratégies de traitement variées
Au vu de l’augmentation du nombre de prostatectomies pratiquées, on aurait pu penser que cela induirait une modification des stratégies de traitement du cancer de la prostate. Or les statistiques montrent que les stratégies de traitement n’ont pas significativement évolué.
Répartition des cancers selon la stratégie de traitement initiale
(échantillon de 2 181 personnes)
Prostatectomie radicale |
31,1 % |
Radiothérapie |
26,8 % |
Hormonothérapie |
22,8 % |
Abstention thérapeutique et autres |
18,8 % |
Source : Étude réalisée pour le compte de l’OPEPS
Les traitements administrés restent en réalité étroitement dépendants du stade clinique de la tumeur (cancer localisé ou avancé) et corrélés, de manière secondaire, avec l’âge des patients.
Les prostatectomies sont ainsi d’autant plus fréquemment pratiquées que le cancer est traité au stade précoce et que les risques de récidive sont faibles. Dans les données exploitées par l’étude réalisée pour le compte de l’OPEPS, la part des prostatectomies est respectivement de 45 %, 41 % et 16 % selon que les patients étaient porteurs d’une tumeur correspondant à un risque de récidive faible, intermédiaire ou élevé (35). À l’inverse plus de 75 % des traitements réalisés chez des patients présentant un cancer de la prostate étendu (stade T3, T4, N+ ou M+) sont fondés sur l’hormonothérapie.
Cependant, même pour les cancers localisés, la proportion de patients traités par prostatectomie diminue fortement avec l’âge. 70 % des patients âgés de moins de cinquante-neuf ans sont traités par prostatectomie, contre à peine 4 % des patients âgés de soixante-quinze à soixante-dix-neuf ans. Parallèlement, la proportion des patients traités par hormonothérapie est de 42 % pour les patients âgés de soixante-quinze à soixante-dix-neuf ans et de 80 % des patients âgés de plus de quatre-vingts ans (36). Il faut voir dans ces données l’impact des recommandations professionnelles, qui déconseillent les traitements radicaux dès lors que l’espérance de vie restante est inférieure à dix ans, en raison de la lenteur du développement du cancer de la prostate. D’un point de vue général, les enquêtes ne recensent d’ailleurs qu’un petit nombre de traitements s’écartant des référentiels professionnels : les prostatectomies n’ont concerné que 3 % des patients dont l’espérance de vie est inférieure à dix ans dans l’étude RSI (37), et 14 % des patients âgés de plus de soixante-dix ans dans l’étude comparée Tarn/Isère (38).
Ces résultats confirment, dans l’ensemble, ceux des enquêtes de terrains qui tendent également à monter qu’aucune stratégie thérapeutique n’est privilégiée.
Répartition des cancers selon la stratégie de traitement initiale
Étude FRANCIM (39) |
Étude RSI (40) | |
Prostatectomie radicale |
22 % |
34 % |
Radiothérapie |
19 % |
28 % |
Hormonothérapie |
33 % |
29 % |
Abstention thérapeutique et autres |
26 % |
8 % |
L’analyse des résultats selon les départements montre de son côté des différences territoriales non négligeables.
Ainsi, en 2006, deux régions (Bretagne et Franche-Comté) se distinguaient par un taux d’ablations chirurgicales de la prostate supérieur de plus de 25 % au taux moyen français, tandis que trois régions se situaient à 20 % (Provence-Alpes-Côte d’Azur, Centre et Corse) en dessous de la même référence.
L’étude réalisée pour l’OPEPS a analysé de manière approfondie les stratégies de traitement adoptées dans une dizaine de départements. Cette analyse fait apparaître une grande hétérogénéité des stratégies de traitement, qui trouve son origine dans les particularités de l’offre de soins départementale et qui repose sur la substituabilité des traitements curatifs, prostatectomie et radiothérapie.
Le taux de prostatectomie radicale peut ainsi varier, pour les personnes à plus faible risque de récidive, de 80 % en Loire-Atlantique, 66 % dans la Somme et 61 % dans le Vaucluse, à 25 % dans le Calvados, le Haut-Rhin et l’Isère. Les taux de prostatectomies, lorsqu’ils sont faibles, sont en réalité associés à des taux de radiothérapies plus élevés, de telle sorte que l’ensemble des deux modes de traitement curatifs représente alors, par exemple, près de 60 % pour les personnes à faible risque de récidive (41).
Ces résultats tiennent aux particularités de l’offre de soins dans les départements, notamment à la répartition de l’activité entre le secteur public, où l’on pratique davantage de radiothérapies, et le secteur privé, où l’on pratique principalement des prostatectomies chirurgicales. On sait notamment, si l’on s’en tient aux données nationales, que les établissements spécialisés dans la cancérologie, centres de lutte contre le cancer, se sont désengagés de cette activité (moins de 1 % de l’activité totale) alors que la part assurée par les établissements privés y est prépondérante (70 % de l’activité totale).
Part des établissements publics et privés dans les actes chirurgicaux de prostatectomie (42)
Source : Étude réalisée pour le compte de l’OPEPS
D. DES TAUX DE GUÉRISON SATISFAISANTS
Dans l’ensemble, les cancers de la prostate peuvent être considérés comme des cancers peu létaux en comparaison avec d’autres formes cancéreuses : les taux de survie, corrigés des effets de l’âge, sont de 94 % à un an et de 80 % à cinq ans(43).
L’étude réalisée pour l’OPEPS a cependant fait apparaître un phénomène de surmortalité des patients les plus jeunes (moins de cinquante-cinq ans), lié semble-t-il à l’apparition de formes de cancers plus agressives. Ces formes se manifestent semble-t-il plus précocement et touchent aujourd’hui des patients plus jeunes.
Ainsi on peut observer que la survie notée chez les malades de moins de cinquante-cinq ans est inférieure d’au moins six points au taux de survie à cinq ans des patients âgés de cinquante-cinq à soixante-quatre ans (68 % pour les premiers, 74 % pour les seconds), alors que les simples effets de l’âge et des comorbidités devraient produire l’effet inverse (44).
La connaissance des coûts des traitements du cancer de la prostate n’est pas facilitée par les données existantes. Celles-ci sont très approximatives et justifient des investigations complémentaires.
Une étude économique antérieure a identifié quatre catégories de coûts associés au dépistage précoce :
– le coût du dépistage par le médecin généraliste, comprenant le coût des consultations et celui des actes médicaux de dépistage biologique (dosage du PSA) et clinique (toucher rectal) ;
– le coût du diagnostic par le médecin spécialiste, comprenant le coût des consultations chez un urologue et celui du remboursement des examens diagnostique ;
– le coût des traitements à visée curative ;
– les coûts logistiques éventuels attachés à l’organisation du dépistage (en cas de dépistage systématique) (45).
En ce qui concerne le coût global des soins, le rapport de l’Institut national du cancer (INCA), Analyse économique des coûts du cancer en France, publié en mars 2007, a évalué à 965 millions d’euros le coût des soins relatifs au cancer des organes génitaux masculins (prostate comprise) pour l’assurance maladie, ce qui représente environ 9 % des coûts totaux des soins pour le cancer en France en 2004 (46).
L’OPEPS a demandé que l’étude commandée effectue une modélisation aussi réaliste que possible des coûts de dépistage et de traitement du cancer de la prostate, en fonction des diverses stratégies thérapeutiques possibles.
Il ressort des travaux réalisés que le coût moyen estimé de la prise en charge thérapeutique sur cinq ans d’un cancer de la prostate est de 12 731 €. 49 % des coûts sont représentés par le traitement initial réalisé dans les six premiers mois et 41 % par les traitements secondaires. Le coût lié au suivi représente 3 %, le coût des complications 2 % et celui des transports 5 % (47).
Les coûts de traitement varient notamment significativement en fonction du stade clinique atteint par le cancer au moment de sa découverte : la prise en charge thérapeutique des cancers aux stades localisés coûte en moyenne 12 259 €, mais 16 608 € quand le cancer a atteint un stade avancé et 9 994 € aux stades métastasés.
Ces divergences résultent en partie des différences dans les stratégies mises en œuvre à chaque stade du cancer. Une étude du coût moyen des traitements a cependant mis en évidence une grande dispersion autour de ces coûts moyens comme le montre le tableau de résultats ci-dessous.
Coût du traitement initial au cours des six premiers mois
(En euros)
Traitement |
Coût moyen |
Écart-type |
Prostatectomie |
9 680 |
2 432 |
Radiothérapie |
12 052 |
4 444 |
Hormonothérapie |
4 189 |
4 015 |
Abstention surveillance |
3 833 |
3 280 |
Source : Étude réalisée pour le compte de l’OPEPS
Afin d’expliquer cette grande variabilité du coût des traitements, une décomposition des coûts par nature de dépenses a été faite pour chaque type de traitement.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
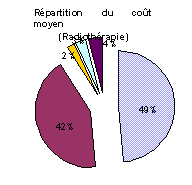
![]()
![]()
![]()
![]()
![]()
![]()
![]()

![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

Sur cinq ans, le modèle de coûts élaboré pour l’OPEPS a permis d’estimer le coût moyen à 14 053 € pour les patients traités initialement par chirurgie prostatectomique, à 19 616 € par radiothérapie et à 17 372 € pour l’hormonothérapie. Une prise en charge par une surveillance coûte 8 525 €. Dans le cas d’une chirurgie et de la radiothérapie, 69 % et 61 % des coûts respectivement sont dépensés dans les six premiers mois.
À titre de comparaison, le coût moyen de traitement était évalué à 29 000 € pour un cancer de l’appareil digestif, 46 000 € pour un cancer hématologique, 19 000 € pour un cancer du sein et 26 000 € pour un cancer de l’appareil respiratoire, en 2004 (48).
III.- VERS UNE POLITIQUE DE DÉPISTAGE PLUS EFFICACE
Si elle est perfectible, l’étude scientifique réalisée pour le compte de l’OPEPS n’en demeure pas moins la première synthèse réalisée en France sur le dépistage du cancer de la prostate. Les informations collectées permettent, pour la première fois, de dresser un bilan du dépistage du cancer de la prostate dans notre pays.
A. LE CONSTAT : UNE POLITIQUE DE DÉPISTAGE LACUNAIRE
1. Un bilan positif sur le plan quantitatif…
Le bilan dressé comporte trois constats principaux :
– bien qu’effectué sur un mode individuel, le dépistage du cancer de la prostate a atteint aujourd’hui le stade d’un dépistage de masse, concernant plusieurs millions d’hommes de plus de cinquante ans ;
– le dépistage a permis une meilleure détection des cancers, à un stade plus précoce ;
– l’augmentation des cancers décelés au stade localisé a permis le développement des traitements à visée curative.
2. … mais qui révèle les limites de la politique actuelle de dépistage
a) Les pratiques hors référentiels nuisent à l’efficacité du dépistage.
En dépit de son ampleur, le dépistage ne s’inscrit pas dans un ensemble cohérent, faute d’une véritable adhésion aux principes du dépistage.
La procédure, qui fait du test de dépistage une étape préalable au diagnostic, n’est pas souvent intégrée en tant que telle par les médecins généralistes. Ces derniers mettent en œuvre le test du PSA sans faire véritablement référence aux référentiels professionnels, ce qui rend l’exploitation des tests aléatoire. La réalisation du test du PSA n’est en réalité pas appréhendée comme un acte visant à orienter le patient vers un diagnostic ultérieur mais davantage comme l’élément d’une séquence d’examens diagnostiques.
L’étude réalisée pour l’OPEPS montre en outre que le test du PSA s’inscrit fréquemment dans le cadre de séries d’examens hétérogènes : association aléatoire avec le test du toucher rectal, pourtant recommandé, combinaison encore peu fréquente avec la mesure de la vélocité ou du rapport PSA libre/PSA total et utilisation complémentaire de moyens d’imagerie médicale (échographie, voire IRM).
Votre rapporteur considère qu’il convient d’aboutir à une meilleure standardisation du test de dépistage et de son exploitation.
S’agissant du recours au dépistage chez les patients les plus âgés, les stratégies apparaissent trop hétérogènes, certains préconisant l’arrêt du dépistage pour les personnes de plus de soixante-quinze ans, conformément aux recommandations professionnelles, tandis que d’autres praticiens souhaitent ne pas priver leurs patients d’un instrument de connaissance de leur état de santé.
b) La détection des cancers précoces se heurte à la difficulté d’identifier les cancers les plus agressifs.
Le dépistage par le test du PSA, s’il a permis de mieux connaître la population à risque, ne présente que des performances moyennement satisfaisantes du point de vue de la détection précoce des cancers. Une exploitation plus intensive du même test – l’abaissement de la valeur seuil de positivité en dessous de 4 nanogrammes/millilitre est notamment évoquée – n’augmenterait le nombre de cancers traités qu’au prix d’un nombre élevé de faux positifs et de surdiagnostics (49).
En réalité, la question est moins de viser à un inventaire de tous les cancers, y compris les cancers latents, qu’à l’identification, en vue d’un traitement précoce, des cancers agressifs susceptibles de mettre en danger, à moyen terme, la santé des patients. L’utilisation du PSA doit être, de ce point de vue, complétée par d’autres indicateurs. La méthode du score de Gleason, qui évalue l’agressivité du cancer grâce à un examen anatomo-pathologique, ne peut être mis en œuvre qu’au stade du diagnostic, au moyen d’une biopsie. Au stade du dépistage, c’est, pour le moment, principalement la mesure de vélocité du PSA (sa dynamique sur une période d’au moins dix-huit mois) qui manifeste le mieux l’agressivité des tumeurs cancéreuses présumées. Or cet examen reste encore peu pratiqué, faute d’une information appropriée des médecins généralistes.
c) L’information doit être améliorée.
Les modalités actuelles du dépistage de la prostate reposent actuellement sur l’initiative individuelle, qui a pour origine, selon l’enquête réalisée pour le compte de l’OPEPS, dans plus de 70 % des cas le médecin et dans moins de 20 % des cas, le patient (50).
Ces données soulignent le rôle primordial de l’information et de sa diffusion pour la mise en œuvre du dépistage. D’une information hétérogène, touchant de manière très diverse les hommes de plus de cinquante ans et leurs médecins traitants, naissent des inégalités de traitement qui ne doivent pas subsister.
Très dépendant du niveau d’information des patients et de leur médecin traitant, le bénéfice du dépistage est trop inégalement réparti sur le territoire et selon les catégories professionnelles.
d) Les questions éthiques ne peuvent être laissées en l’état.
Les pratiques de dépistage volontaire suscitent également des interrogations de nature éthique.
Les incertitudes sur le dépistage, sur la décision de traiter ou de ne pas traiter au stade précoce en cas de découverte d’un cancer, ainsi que sur le type de traitement à mettre en œuvre font que le cancer de la prostate est certainement un des domaines dans lesquels l’information du patient et son implication dans les décisions sont les plus importantes.
Au stade du dépistage, les acteurs du processus doivent prendre conscience que le dépistage peut placer ultérieurement les patients devant des choix difficiles. À quoi sert-il pour un patient d’effectuer le test du PSA pour la détection précoce du cancer de la prostate si, une fois mieux informé, il ne souhaite pas recourir aux moyens thérapeutiques radicaux ? Il est nécessaire, d’un point de vue éthique, que les patients soient informés, dès le stade du dépistage, des traitements auxquels celui-ci peut aboutir, afin de décider en toute connaissance de cause d’aller plus avant dans cette démarche. Or si les résultats de l’étude réalisée pour l’OPEPS sont malheureusement incomplets sur ce point, ils suggèrent que l’information des patients au stade du dépistage est aujourd’hui trop lacunaire et ne répond guère aux exigences d’une éthique médicale rigoureuse (51).
Certes, au stade du diagnostic (réalisé après un test de dépistage positif), il faut noter les efforts des autorités sanitaire en faveur d’une information exhaustive et transparente. L’Agence nationale d’accréditation et d’évaluation en santé (ANAES) (52) a ainsi publié une étude exhaustive en septembre 2004, qui aborde de manière détaillée la question des vecteurs d’information et du contenu de l’information à délivrer (53). Mais force est de constater que le cœur de la question reste à la charge des médecins, dans la mesure où ils doivent estimer l’espérance de vie de leur patient au moment de faire le choix de leur traitement. Du fait de leurs effets secondaires, certains traitements, les plus curatifs, ne sont préconisés que lorsque l’espérance de vie est supérieure à dix-quinze ans. Comment respecter à ce moment fatidique le droit du patient à « ne pas savoir », affirmé par la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé ? Les témoignages et les retours d’expériences ne sont pas assez nombreux sur ce sujet et il serait probablement utile de constituer une enquête, au travers de groupes de parole, auprès des médecins concernés afin de déterminer la nature des problèmes et l’instance la plus compétente pour les aborder. Une saisine du Comité national d’éthique ne doit pas être exclue à ce stade de la réflexion.
e) Les stratégies de traitement demeurent trop variées selon les départements.
La cancérologie prostatique se caractérise en France par la multiplicité des filières de prise en charge, et une majorité de patients est prise en charge dans le secteur privé. Comme on l’a vu, les stratégies de traitement mises en œuvre à l’issue d’un dépistage positif varient significativement selon les départements, ce qui conduit à postuler une forte influence de l’offre de soins départementale (cliniques pratiquant la prostatectomie chirurgicale, hôpitaux privilégiant la radiothérapie).
Sur un plan plus secondaire, il semble, au vu des données présentées par certains départements, que certains spécialistes adoptent une attitude de surveillance attentive pour les stades les plus précoces avant de mettre en œuvre dans un second temps des traitements plus radicaux.
B. LES RECOMMANDATIONS DE L’OPEPS
Les enjeux actuels de la politique de dépistage du cancer de la prostate sont aujourd’hui davantage à rechercher du côté d’une amélioration de l’efficacité globale du dépistage que de son développement quantitatif, le dépistage ayant déjà atteint l’ampleur d’un dépistage de masse.
Le premier enjeu est de favoriser une meilleure détection des cancers agressifs qui mettent en jeu la vie des patients à moyen terme. Le second enjeu est l’amélioration de l’efficacité du dépistage actuel par sa rationalisation de son organisation (standardisation des procédures médicales, mise en place d’instruments de suivi,…). À moyen terme, il convient également de développer les instruments permettant une meilleure analyse du rapport bénéfice/risque et donc de préparer une généralisation du dépistage sous la forme de campagnes de dépistage organisé.
Cinq groupes de recommandations peuvent être formulés :
1. Favoriser un dépistage de meilleure qualité
La détection et le traitement des cancers prostatiques agressifs constitue aujourd’hui un des principaux axes d’amélioration de la politique de dépistage.
Il s’agit de compléter la découverte de lésions prostatiques cancéreuses par une évaluation de l’agressivité de ces formes cancéreuses, dès le stade du dépistage. Ceci rendrait les actions de dépistage plus efficaces en concentrant les efforts sur les formes les plus graves de cancers et limitant les cas de surdiagnostics.
a) Mettre en place et généraliser des instruments d’évaluation de l’agressivité des cancers dès le stade du dépistage
L’étude réalisée pour le compte de l’OPEPS montre les limites d’une mesure ponctuelle du taux de PSA. Pour des valeurs de PSA inférieures à 4 nanogrammes/millilitre, ce n’est pas tant la valeur brute atteinte par le PSA que le rythme d’augmentation de cet indicateur qui est révélateur de formes cancéreuses agressives.
Il est donc nécessaire d’instituer un test à part entière qui permette le calcul du rythme d’augmentation du taux de PSA et qui soit universellement reconnu comme un test de dépistage, utilisé en tant que tel par les praticiens et remboursé à ce titre par l’assurance maladie.
L’Académie nationale de médecine conçoit comme une première priorité de « soutenir des recherches de biologie clinique pour valider des tests non-invasifs d’agressivité complétant le PSA » (54).
De même, dans le rapport qu’il vient de remettre au Président de la République le 14 février 2009, Recommandations pour le plan cancer 2009-2013, le professeur Jean-Pierre Grünfeld recommande de lancer un programme de recherche sur les moyens de caractériser le mode évolutif des cancers prostatiques et de reconnaître les formes cancéreuses agressives, afin de pouvoir mieux adapter les traitements.
b) Développer la recherche et l’expérimentation sur les marqueurs moléculaires dans des centres de référence
Pour compléter l’information apportée par le dosage du PSA, il est nécessaire de valider d’autres marqueurs non invasifs qui permettront de différencier les cancers de la prostate à risque, nécessitant des examens complémentaires, des formes cancéreuses bénignes pour lesquels une simple surveillance suffit.
Une série de marqueurs candidats est ainsi en cours d’étude. Ils sont recensés par l’étude réalisée pour le compte de l’OPEPS. Ils comprennent des marqueurs de type protéine, ADN ou ARN (55). L’intérêt que présente une validation et une mise en œuvre sans tarder de ces marqueurs justifie le soutien actif des pouvoirs publics.
À titre d’exemple, le test PCA3, qui suscite actuellement de nombreux espoirs, est encore à un stade pré-industriel. Il n’est réalisé que dans un faible nombre de laboratoires et est facturé 300 € sans remboursement, alors que le test du PSA est facturé 18 € remboursés. On conçoit qu’un tel contexte ne soit pas favorable au développement du test PCA3 et à son utilisation en tant que test de dépistage. Le soutien des pouvoirs publics est indispensable pour une montée en puissance rapide de ces tests.
2. Améliorer l’organisation du dépistage du cancer de la prostate
« Le véritable enjeu lorsqu’on met en place un programme de dépistage est de mettre en œuvre un processus d’assurance qualité qui garantisse un dépistage optimal aux populations qui y ont recours. Il faut par ailleurs souligner que le bénéfice d’un programme de dépistage repose également sur une prise en charge adaptée des lésions détectées » (56).
a) Clarifier les rôles et les responsabilités dans la chaîne de dépistage, en instituant une procédure standardisé de dépistage
L’étude réalisée pour le compte de l’OPEPS montre qu’une des raisons expliquant la mauvaise exploitation des tests de dépistage tient à la confusion qui subsiste entre l’étape du dépistage et celle du diagnostic : les praticiens généralistes ont tendance à vouloir donner suite à un résultat positif du test de dépistage par une série d’examens complémentaires, visant à poser le diagnostic de cancer.
Une action d’information doit, à l’évidence, être conduite par l’assurance maladie en direction des médecins généralistes pour favoriser une meilleure prise de conscience des différences entre les actions de dépistage et de diagnostic, ainsi que pour les informer de la procédure à suivre en cas de résultat positif du test de dépistage.
La création d’une nouvelle catégorie tarifaire, désignée spécifiquement comme « test de dépistage du cancer de la prostate » (voir ci-dessous), contribuerait également à une meilleure prise de conscience des spécificités des actions de dépistage.
b) Différencier l’usage du dosage de PSA en tant que test de dépistage
Aujourd’hui, le dosage du PSA est un examen biologique prescrit par les médecins généralistes avec de multiples intentions : dépistage du cancer de la prostate, suivi des cancers en cours de traitement ou examen dans le cadre d’un diagnostic. Il en résulte une difficulté à suivre la diffusion et la répartition géographique des actions de dépistage, ainsi que cela a été relevé dans le présent rapport.
Il est nécessaire d’individualiser le test du dépistage du cancer de la prostate au sein de la grille de remboursement de l’assurance maladie, afin de le différencier des dosages de PSA réalisés pour d’autres motifs (surveillance d’un cancer connu, etc.).
Identifier clairement le dosage du PSA lorsqu’il est mis en œuvre en tant que test de dépistage permettrait également de mieux différencier, dans la pratique médicale, les examens qui sont de l’ordre du dépistage et ceux qui sont de l’ordre du diagnostic. Il est résulterait une clarification des rôles et des responsabilités dans la chaîne de dépistage.
c) Développer des référentiels de prise en charge
L’étude réalisée pour l’OPEPS préconise notamment avec raison :
– la construction pour chaque patient d’un programme personnalisé de dépistage en fonction d’un nombre limité de situations cliniques types ;
– la construction raisonnée d’algorithmes d’indication des examens complémentaires selon l’âge, les antécédents familiaux, les données du toucher rectal afin d’améliorer le rendement diagnostic et d’optimiser l’utilisation des ressources. Cette action se traduirait par la création de trois algorithmes concurrents au niveau national à financer pour 2 000 patients.
d) Poursuivre les efforts de standardisation des tests de dépistage et de diagnostic
Parallèlement à la mise en œuvre de tests de dépistage spécifiques, il convient d’améliorer la standardisation des examens existants. L’étude scientifique montre bien que les modalités de lecture des échantillons de biopsies ne sont pas satisfaisantes et préconise de mettre en place une nouvelle procédure de relecture des échantillons cancéreux par les spécialistes anatomo-pathologistes, organisant une double lecture des échantillons les plus difficiles à analyser.
e) Améliorer les instruments de suivi des conditions de dépistage
Un échantillon représentatif permanent de patients et de médecins traitants devrait être mis en place pour assurer un suivi des modalités de dépistage du cancer de la prostate. Cet échantillon devrait permettre d’identifier et de suivre le niveau de conformité des pratiques de dépistage avec les référentiels médicaux, leur régularité ainsi que l’évolution des inégalités de traitement.
f) Moduler la politique de dépistage en la ciblant
La politique de dépistage du cancer de la prostate, qui se résume aujourd’hui au remboursement du test de dépistage, pourrait éventuellement être modulée pour orienter le dépistage vers sa cible principale, les hommes âgés de cinquante à soixante-quinze ans.
3. Approfondir l’analyse du rapport bénéfice/risque des traitements ainsi que la connaissance des données médico-économiques relatives au dépistage et au traitement du cancer de la prostate
a) Différencier le rapport bénéfice/risque selon le profil des patients
Les suggestions d’investigations complémentaires présentées par l’Association Française d’Urologie à l’issue de l’étude réalisée pour l’OPEPS comprennent notamment les propositions suivantes :
– reconnaître la diversité des prises en charge et en présenter les profils bénéfice/risque lors de la décision partagée ;
– évaluer le taux de survenue des effets secondaires pour en connaître la fréquence et développer une prise en charge adaptée :
– promouvoir l’évaluation des comorbidités chez l’homme de plus de soixante-quinze ans afin d’évaluer le rapport bénéfice/risque de l’hormonothérapie ;
– réévaluer tous les ans le rapport bénéfice/risque du traitement hormonal chez le sujet âgé en utilisant, en complément des éléments cliniques et biologiques, des outils validés d’évaluation des comorbidités et de l’espérance de vie ;
– privilégier dans l’allocation des ressources les éléments qui participent, de manière directe, à l’amélioration du profil bénéfice/risque de la prise en charge ;
– aider à la diffusion d’outils d’information des patients (rapport bénéfice/risque, conduite à tenir en cas de biopsies négatives).
b) Promouvoir les techniques médicales innovantes
Afin de diminuer le coût de réalisation des examens diagnostiques, et notamment des biopsies prostatiques, il convient de développer le recours aux alternatives de l’hospitalisation pour la réalisation des biopsies.
c) Poursuivre l’évaluation médico-économique des scénarios de dépistage et des options de traitement du cancer de la prostate
Le travail d’analyse des coûts de prise en charge du cancer de la prostate, initié par l’étude réalisée pour le compte de l’OPEPS doit être approfondi en vue de comprendre l’origine des disparités de coûts constatés par l’étude.
4. Préparer le dépistage systématique du cancer de la prostate
L’institutionnalisation de campagnes de dépistage organisé constitue un prolongement naturel de la politique de dépistage du cancer de la prostate même si le lancement de ces campagnes a été jusqu’à maintenant suspendu au résultat des études épidémiologiques visant à vérifier l’impact positif du dépistage du cancer de la prostate en termes de baisse de la mortalité.
L’organisation de campagnes publiques de dépistage serait assurément un élément de structuration du dépistage cancéreux, ainsi que le montre l’exemple des campagnes de dépistage pour le cancer du sein et pour le cancer colorectal. Ces campagnes reposent en effet sur la définition d’un test de dépistage, clairement identifié comme tel, ainsi que sur la constitution d’une structure servant de support assurant la promotion du test de dépistage et le suivi des patients en cas de test positif.
a) Informer la population sur l’intérêt d’un dépistage du cancer de la prostate
Comme cela a été dit, l’information présente une importance particulière dans les actions de dépistage du cancer de la prostate, pour résorber les inégalités liées aux pratiques de dépistage mais également en raison des choix auxquels le patient est confronté en cas de test positif.
Il est donc nécessaire de concevoir des actions visant à mieux informer les patients concernés et les médecins sur les différentes problématiques attachées au dépistage du cancer de la prostate. L’étude réalisée pour l’OPEPS propose ainsi à juste titre :
– une campagne de sensibilisation au cancer de la prostate à l’adresse du grand public et des professionnels de santé.
À titre d’exemple, on peut mentionner la campagne de sensibilisation entreprise aux États-Unis intitulée « 50 over 50 Prostate Health Challenge » avec la participation du quadruple vainqueur de l’US Open de tennis, John Mc Enroe, en vue de convaincre les américains âgés de plus de cinquante ans de faire vérifier l’état de leur prostate par leur médecin traitant (57).
– une invitation par l’assurance maladie à réaliser un dosage du PSA total à cinquante ans ;
– la construction d’actions spécifiques en direction des populations actuellement écartées du dépistage en raison de conditions socio-économiques de situations géographiques défavorables.
b) Mettre en place des structures départementales chargées de promouvoir le dépistage du cancer de la prostate, à l’instar des structures existantes pour le dépistage du cancer du sein et du cancer colorectal
L’exemple des campagnes organisées pour le dépistage systématique du dépistage du cancer du sein et du cancer colorectal montre enfin que ces structures départementales jouent un rôle essentiel dans la standardisation des procédures de dépistage et la prise en compte des spécificités de cette étape préalable au diagnostic.
Treize recommandations pour améliorer le dépistage
et le traitement du cancer de la prostate
Favoriser un dépistage de meilleure qualité
1) Mettre en place et généraliser des instruments d’évaluation de l’agressivité des cancers dès le stade du dépistage
2) Développer la recherche et l’expérimentation sur les marqueurs moléculaires dans des centres de référence.
Améliorer l’organisation du dépistage du cancer de la prostate
3) Clarifier les rôles et les responsabilités dans la chaîne de dépistage, en instituant une procédure standardisé de dépistage
4) Différencier l’usage du dosage de PSA en tant que test de dépistage
5) Développer des référentiels de prise en charge
6) Poursuivre les efforts de standardisation des tests de dépistage et de diagnostic
7) Améliorer les instruments de suivi des conditions de dépistage
8) Moduler la politique de dépistage en la ciblant
Approfondir l’analyse du rapport bénéfice/risque des traitements ainsi que la connaissance des données médico-économiques relatives au dépistage et au traitement du cancer de la prostate
9) Différencier le rapport bénéfice/risque selon le profil des patients
10) Promouvoir les techniques médicales innovantes
11) Poursuivre l’évaluation médico-économique des scénarios de dépistage et des options de traitement du cancer de la prostate
Préparer le dépistage systématique du cancer de la prostate
12) Informer la population sur l’intérêt d’un dépistage du cancer de la prostate
13) Mettre en place des structures départementales chargées de promouvoir le dépistage du cancer de la prostate, à l’instar des structures existantes pour le dépistage du cancer du sein et du cancer colorectal
Compte rendu de la réunion du mercredi 1er avril 2009
Présentation de l’étude scientifique réalisée par l’Association Française d’Urologie sur le dépistage et le traitement du cancer de la prostate
M. Pascal Rischmann, président de l’Association Française d’Urologie, a présenté les principales conclusions de l’étude scientifique réalisée pour le compte de l’OPEPS.
M. Pascal Rischmann, président de l’Association Française d’Urologie. Le rapport scientifique que j’ai l’honneur de vous présenter est le résultat du travail d’un consortium réunissant différents spécialistes médicaux, des urologues, des oncologues, des épidémiologistes, des biologistes et des économistes de la santé.
Je rappellerai tout d’abord que la prostate est une petite glande située en dessous de la vessie, au carrefour des voies urinaires et des voies génitales. Cette glande peut grossir de façon bénigne, et elle peut alors être traité par des interventions très simples ; c’est la maladie la plus fréquente. Mais elle est aussi sujette à un cancer, le cancer de la prostate, qui se développe en périphérie de la glande et qui se manifeste par des symptômes cliniques très tardifs. C’est ce qui fait l’intérêt du dépistage. Les caractéristiques de ce cancer font qu’il tue rarement avant dix ans – cela dépend bien entendu du moment où il est découvert – mais il tue presque toujours vingt ans après son début.
La question du dépistage est souvent mal comprise, car il s’agit de faire la différence entre le dépistage et le diagnostic. Le test de dépistage Prostate specific antigen (PSA) ne signe pas spécifiquement la présence d’un cancer de la prostate mais une anomalie plus générale de la prostate. Il est toutefois utilisé pour dépister des populations éventuellement suspectes de cancer prostatique. Le seul test parfaitement sûr est la biopsie de la prostate : c’est un test diagnostique.
Le dépistage du cancer de la prostate connaît une double actualité. D’une part, le Professeur Jean-Pierre Grünfeld a préconisé, dans le rapport qu’il vient de remettre au Président de la République sur le plan Cancer, une politique nationale de dépistage du cancer de la prostate. D’autre part, nous venons de prendre connaissance des résultats de la plus grande étude européenne réalisée sur l’intérêt du dépistage et son impact sur la mortalité : elle va dans le même sens.
Notre étude scientifique est également convergente.
Pour résumer les travaux du consortium, nous avons fait un certain nombre de constats.
Tout d’abord, le cancer de la prostate est un problème de santé publique : il y a actuellement plus de 65 000 nouveaux cas de cancers chaque année et on enregistre entre 9 000 et 10 000 décès par an. Un homme qui est né avant 1940 a un risque de plus de 18 % d’avoir un cancer de la prostate avant l’âge de soixante-quinze ans et l’on sait qu’à cet âge l’espérance de vie est encore de dix ans. Deuxième constat, le dépistage du cancer de la prostate est pratiqué par plus de 80 %, voire 90 % des médecins généralistes. Il faut en effet rappeler que les médecins généralistes sont en première ligne pour le dépistage même si leur information doit être améliorée. Troisième constat, l’information des patients est insuffisante : un tiers des personnes qui vont réaliser un dosage de PSA dans un laboratoire ne savent pas pourquoi ils font cet examen et deux tiers ne sont pas en mesure de répondre à des questions simples concernant l’intérêt de ce test. Quatrième constat, on constate des hétérogénéités dans les pratiques de dépistage du cancer de la prostate sur le territoire national, à l’instar de ce que l’on peut aussi constater pour le cancer du sein et pour le cancer colorectal. Les variations vont de un à deux, principalement entre le Sud-Est et le Nord-Ouest. Cinquième observation, les dépistages ne suivent pas les recommandations professionnelles : le dépistage est inutilement proposé par 40 % des médecins généralistes à des hommes de plus de soixante-quinze ans. La sixième remarque concerne l’interprétation des résultats de dosage de PSA, qui varient selon les laboratoires. Il y a un travail à faire d’homogénéisation des tests, afin d’avoir des résultats plus clairs. Il faut également prendre en compte les conclusions de l’étude européenne European Randomized Study of Screening for Prostate Cancer, que j’ai mentionnée précédemment, et qui est une des études épidémiologiques majeures de ce début du siècle. Elle montre, à partir d’une cohorte de 190 000 personnes, une diminution de plus de 20 % de la mortalité par cancer de la prostate grâce à la pratique du dépistage chez les hommes de cinquante-neuf à soixante-cinq ans. En France depuis 1990, il a été constaté, concomitamment au développement du dépistage, une réduction de 7 % par an de la mortalité en moyenne. Aux États-Unis, la réduction de la mortalité depuis 1990 est de 50 %, uniquement du fait du développement du dépistage. On constate toutefois deux phénomènes de surmortalité spécifiques, d’une part, chez les hommes jeunes, de moins de cinquante-cinq ans et, d’autre part, chez les personnes pour lesquelles le diagnostic de cancer a été fait à un stade trop avancé. Enfin, il faut remarquer qu’une partie des traitements pourrait être évitée, notamment les traitements hormonaux. Il apparaît en effet qu’un tiers des patients pour lesquels la maladie est encore localisée à la prostate sont traités par hormonothérapie, alors que ces traitements ne sont pas utiles à ce stade. Pour finir, on observera que le coût moyen de prise en charge d’un patient en France est comparable à celui dans les autres pays développés, un peu en-dessous de 10 000 euros.
Pour ce qui est des propositions d’action, il faut tout d’abord améliorer l’information du public sur l’intérêt et les conséquences du dépistage. Il faut renforcer la formation des médecins généralistes en matière de dépistage. L’Association Française d’Urologie recommande de dépister systématiquement le cancer de la prostate pour les personnes entre cinquante et soixante-cinq ans et de manière individuelle entre soixante-six et soixante-quatorze ans. Les études épidémiologiques ne montrent toutefois pas de bénéfices nets en termes de mortalité au-delà de soixante-cinq ans. En ce qui concerne les suites à donner à un test positif, il convient d’éviter de recouvrir systématiquement aux biopsies afin de ne pas exposer les patients à un risque de surdiagnostic, c’est-à-dire au traitement d’un cancer qui n’aurait pas été létal, soit parce que le cancer est trop petit, soit parce que le patient est trop âgé, soit parce que le cancer n’est pas très agressif. Il faut normaliser l’interprétation des biopsies, développer, pour des raisons économiques, les alternatives à l’hospitalisation en cas de biopsies à l’hôpital, et standardiser l’information sur les traitements délivrée au patient lors de la réalisation d’une biopsie après un résultat positif. Enfin, du point de vue des traitements thérapeutiques, il convient de développer les traitements focaux, qui permettent de traiter seulement la partie atteinte de la prostate.
En conclusion, il faut mieux cibler la population à dépister pour éviter les surdiagnostics et les surtraitements ; il faut mieux former les médecins en général à la politique de dépistage ; il faut développer les marqueurs d’activité prostatique et les études relatives à la surveillance sans traitement des cancers diagnostiqués ainsi qu’aux traitements focaux.
M. Gérard Bapt, député. Qu’en est-il des traitements par radiothérapie ? Y a-t-il des progrès dans la capacité de ces traitements à cibler les zones cancéreuses ?
M. Pascal Rischmann, président de l’Association Française d’Urologie. Il y a deux techniques, la radiothérapie conformationelle, qui est pratiquée de manière externe, et la curiethérapie, qui consiste à implanter des grains de matière radioactive à proximité des zones cancéreuses. Globalement, on peut dire qu’il n’y a pas de supériorité démontrée d’un traitement par rapport à un autre. En réalité, on va de plus en plus, en cancérologie, et ce n’est pas spécifique à la prostate, vers des traitements individualisés. La radiothérapie est, pour faire simple, plus spécialement indiquée pour les personnes de plus de soixante-dix ans.
M. Nicolas About, sénateur, président. La durée d’évolution du cancer de la prostate, dont vous avez dit qu’elle était supérieure à dix ans, est-elle fonction de l’âge du patient ? Quel est de taux de guérison après traitement ?
M. Pascal Rischmann, président de l’Association Française d’Urologie. Les formes du cancer de la prostate ne varient pas en fonction de l’âge. Mais leur potentiel d’évolution est différent : plus le cancer atteint un patient jeune, plus celui-ci a de risques d’en mourir. Même si, heureusement, il n’y a pas beaucoup de personnes atteintes d’un cancer entre cinquante et cinquante-cinq ans, elles ont plus de 50 % de chances d’en mourir.
M. Bernard Debré, député, rapporteur. Plus un cancer est agressif – on peut évaluer cette agressivité grâce à un examen anatomopathologique – plus les traitements sont inefficaces et plus le pronostic est mauvais.
M. Pascal Rischmann, président de l’Association Française d’Urologie. L’âge n’a pas d’importance. La pratique clinique nous conduit à distinguer trois catégories de patients : ceux pour lesquels le risque est faible, ceux pour lesquels le risque est intermédiaire et ceux pour lesquels il est important. Or ces trois catégories se retrouvent à tout âge. Le risque est fonction de l’agressivité cellulaire, ou glandulaire, mais aussi du degré d’extension du cancer : la tumeur a-t-elle dépassé les limites de la glande prostatique, a-t-elle déjà atteint les ganglions lymphatiques ?
M. Bernard Debré, député, rapporteur. Il faut savoir que l’agressivité du cancer au niveau cellulaire, que l’on mesure à l’aide du score de Gleason, évolue lorsque le cancer s’étend. Or on s’aperçoit que plus le score de Gleason est élevé, moins les cellules cancéreuses secrètent de PSA. C’est pourquoi l’on voit parfois des cancers évoluer de manière négative alors que le taux de PSA baisse ! Comme le PSA n’est pas un marqueur spécifique du cancer prostatique, mais seulement du tissu prostatique, les mesures qu’il donne sont imparfaites. Un homme égale un cancer : je veux dire par là que chaque homme malade présente un cas particulier qui doit conduire à un traitement spécifique. Les cancers ont tous des agressivités différentes.
M. Pascal Rischmann, président de l’Association Française d’Urologie. Ce qui est important, c’est de diagnostiquer le cancer tôt afin de pouvoir influer sur son évolution. Si on intervient, par une ablation chirurgicale de la prostate, sur un cancer de faible grade ou de grade intermédiaire, on a plus de 80 % de chance de le guérir. Dans 15 % des cas, on voit réapparaître des taux de PSA élevés au bout de plusieurs années, mais on peut alors mobiliser d’autres moyens thérapeutiques.
M. Bernard Cassou, membre du conseil d’experts de l’OPEPS. Cette étude apporte des informations intéressantes dans un domaine où les données sont encore confuses. Il faut préciser que les résultats connus de l’étude européenne qui a été évoquée concernent l’impact du dépistage sur la mortalité, mais que les résultats en termes de qualité de vie et de coût/efficacité sont encore à venir. Ce que l’on attend, ce sont des propositions claires en matière de dépistage : à quel âge ? quels seuils retenir ? quelle fréquence des tests ?
M. Marc Bernier, député. Dans le rapport que j’avais présenté sur le dépistage du cancer du sein en juin 2004 devant l’OPEPS, il avait été fait un constat similaire sur les disparités géographiques et le besoin de formation des médecins généralistes. Faut-il qu’il y ait également un dépistage systématique pour le cancer de la prostate ?
M. Gilbert Barbier, sénateur, vice-président. Le problème du dépistage, c’est qu’il est parfois anxiogène pour les patients. Lorsqu’ils sont informés de la nature de l’examen, ils peuvent avoir la tentation de consulter un autre médecin pour confirmer, ou infirmer, l’avis de leur médecin traitant.
M. Guy Fischer, sénateur. Le fait que le dépistage soit dépendant du degré d’information des patients a-t-il une influence sur les catégories sociales des personnes qui en bénéficient ? Par ailleurs, certaines catégories sociales sont-elles plus touchées que d’autres par le cancer de la prostate ?
M. Pascal Rischmann, président de l’Association Française d’Urologie. Le principal argument en faveur du dépistage systématique est son impact positif sur la mortalité : généraliser le dépistage, c’est garantir une baisse d’au moins 20 % de la mortalité. En ce qui concerne les traitements proposés aux patients, on voit que leur répartition est équilibrée : pour 65 000 nouveaux cas annuels, on compte 22 000 opérations d’ablation de la prostate, soit un tiers des patients.
Sur l’environnement, j’indiquerai simplement que les facteurs héréditaires ne sont pas négligeables en matière de cancer de la prostate. En présence d’ascendants atteints, il convient bien évidemment de consulter jeune. Le cas des populations afro-antillaises doit être également mentionné. Il s’agit de populations à risques.
Mme Maryvonne Blondin, sénatrice. J’insisterai pour ma part sur l’importance de la formation des généralistes. Ce sont eux la porte d’entrée du dépistage.
M. Bernard Debré, député, rapporteur. Leur information médicale continue doit être développée. Leur culture en matière de lecture d’image ou de biotechnologie doit être en permanence mise à jour compte tenu des progrès incessants en la matière.
M. Nicolas About, sénateur, président. Il s’agit là d’une priorité. Les unités de valeur de la formation continue doivent être clairement sélectionnées et hiérarchisées.
Il me reste à remercier M. Pascal Rischmann pour son exposé aussi dense qu’éclairant.
(M. Pascal Rischmann quitte la salle, et l’OPEPS examine le rapport de M. Bernard Debré sur le dépistage et le traitement du cancer de la prostate).
Présentation du rapport de M. Bernard Debré, rapporteur, sur le dépistage et le traitement du cancer de la prostate
M. Bernard Debré, député, rapporteur. Le rapport scientifique présenté par l’Association Française d’Urologie contient des éléments intéressants, même si sa qualité formelle n’est pas, loin s’en faut, au niveau que l’on était en droit d’attendre.
Sur le fond, il convient de rappeler qu’elle a été commencée avant que l’on dispose des résultats de deux études de grande ampleur, l’une européenne, l’autre américaine.
Le cancer de la prostate est un cancer relativement fréquent. Actuellement, 150 000 personnes vivent avec ce cancer en France. Les formes de ce cancer suscitent des réponses différentes en fonction de l’évolutivité de la maladie et de l’âge du patient.
Pour les personnes de plus de soixante-quinze ans, le dépistage ne doit pas être réalisé de façon systématique, mais à la demande du patient. Dans ce cas, le dépistage consiste avant tout en un examen clinique, associé éventuellement à un dosage du PSA. La décision de traiter dépend d’un grand nombre de paramètres : l’âge du patient, ses comorbidités, son espérance de vie ; mais l’intervention chirurgicale est en tout cas à proscrire. Le traitement de référence – les anti-hormones qui opèrent une castration chimique – est idéal ; il est devenu très simple d’emploi puisqu’il n’implique qu’une injection tous les six mois ; il permet d’offrir une amélioration de la qualité de vie à tous les patients de plus de soixante-quinze ans. Ceci ne doit pas être négligé. Ces patients ne mourront peut-être pas du cancer mais, en tout état de cause, ils ne doivent pas être abandonnés.
Pour les personnes entre cinquante et soixante-dix ans, plus le cancer est détecté précocement, plus sont accessibles les traitements curatifs. 90 % des hommes de cette tranche d’âge font faire un dosage de PSA mais cela ne peut pas toujours être considéré comme du dépistage car les dosages sont diversement et globalement mal interprétés. Pour améliorer les pratiques de dépistage, il faut d’abord normaliser les conditions d’analyse des résultats en laboratoire du test de dépistage du PSA. Il faut, de plus, apporter aux médecins généralistes l’information adéquate : le dépistage du cancer de la prostate doit concerner tous les hommes entre cinquante et soixante-dix ans. Il faut avoir, sur cette tranche d’âge, une action systématique de dépistage annuel.
Comme cela a été dit, le taux de PSA n’est pas un marqueur spécifique au cancer de la prostate. Il peut être augmenté par plusieurs types d’affections : une infection aiguë, un adénome de la prostate ou le cancer de la prostate. Mais d’autres indicateurs permettent alors de faire un diagnostic différentiel. Il s’agit tout d’abord du rapport PSA libre sur PSA total. Cette mesure biologique doit être demandée par le médecin généraliste car, quand ce rapport est élevé, l’affection est probablement bénigne et, quand il est faible, l’affection est probablement maligne. Un troisième indicateur complète la panoplie d’instruments : il s’agit de la vélocité du PSA. Dès que l’augmentation du PSA est supérieure à 0,75 nanogrammes par millilitre et par an, c’est un signe inquiétant devant déclencher une réponse appropriée de la part du médecin généraliste, qui doit alors passer le témoin au spécialiste. La valeur du taux du PSA est donc relative : elle doit être analysée au regard de la vélocité du PSA et du rapport PSA libre sur PSA total.
Pour résumer les recommandations au stade du dépistage, il faut que les hommes de cinquante à soixante-dix ans bénéficient d’un dépistage systématique du cancer de la prostate. L’information de PSA doit être renforcée, en montrant que la valeur brute du taux de PSA n’est pas en elle-même une indication suffisante et qu’il faut la confronter à d’autres mesures. Enfin, l’examen clinique – le toucher rectal – doit être systématiquement assorti aux prescriptions de dosage de PSA.
Les traitements ne constituaient pas le centre de l’étude mais quelques idées-force peuvent être dégagées. Le traitement curatif privilégié est l’ablation de la prostate. Il existe plusieurs techniques qui sont en concurrence : la chirurgie à ciel ouvert, la voie cœlioscopique et le recours au robot. Les positions relatives de ces techniques évoluent très vite. La chirurgie à ciel ouvert a été très critiquée en raison du pourcentage d’incontinence et d’impuissance qui y est associé. En réalité, les résultats sont très dépendants de l’opérateur. Les promesses que la technique cœlioscopique a apportées avec elle ne se sont pas réalisées : loin de diminuer, les risques d’incontinence paraissent plutôt augmenter. En revanche, il semble que le recours au robot puisse, pour sa part, apporter une amélioration des suites postopératoires. Il faut aussi évoquer la curiethérapie, qui est l’introduction dans la prostate de grains radioactifs et qui donne des résultats quasiment identiques à ceux de la chirurgie, avec des suites négatives moindres, mais il faut que le score de Gleason soit inférieur à 7 et que le PSA soit inférieur à 15. La radiothérapie conformationnelle est actuellement moins utilisée, car elle provoque des troubles au niveau du rectum et de la vessie ainsi que des cas de tumeurs radio-induites au niveau de la vessie, sous la forme de polypes de vessies. On peut également mettre en œuvre des traitements focaux, par micro-ondes notamment, qui permettent de détruire ponctuellement les foyers cancéreux identifiés mais qui n’empêchent pas les récidives. En tout état de cause, il est évident que, lorsque le cancer a dépassé les limites de la capsule prostatique, ces traitements curatifs sont inutiles, à l’exception de la radiothérapie qui n’est alors plus conformationnelle et dont le champ est élargi aux ganglions lymphatiques. Cela étant, le coût total de prise en charge d’un cancer de la prostate, 12 500 euros en moyenne, est équivalent, voire inférieur à celui d’autres cancers.
En conclusion, les recommandations présentées à l’OPEPS concerne la promotion du dépistage du cancer de la prostate, l’information des médecins généralistes, la standardisation des méthodes et la normalisation des pratiques, ainsi que le développement de la recherche sur les nouveaux marqueurs tumoraux, tels que la sarcosine, qui sont plus spécifiques.
M. Bernard Cassou, membre du conseil d’experts. Une des difficultés en matière de dépistage concerne la cible à atteindre en termes de groupe d’âge. Il convient d’éviter que la filière de soin soit envahie par les plus de soixante-quinze ans. Vos recommandations portent sur les tests – à améliorer – , les médecins – à former – et la population – à mobiliser. Quel doit être l’ordre des priorités ?
M. Bernard Debré, député, rapporteur. Le test du PSA est déjà très largement répandu. Le premier impératif est la formation des médecins généralistes. Il faut faire attention à ne pas reporter sur le patient les difficultés de choix entre les différentes options thérapeutiques. Les patients ne sont pas toujours en position de choisir, parfois du fait de l’information surabondante et souvent complexe devant laquelle ils sont placés, en particulier sur internet.
M. Bernard Cassou, membre du conseil d’experts. Il est clair que les pratiques des généralistes doivent être harmonisées. Ceux-ci doivent être sensibilisés à la nécessité d’accorder du temps au dialogue avec les patients.
M. Gérard Dériot, sénateur, vice-président. On sait que la prescription du dosage de PSA est faite par les médecins généralistes, mais on n’est pas sûr qu’ils se placent véritablement dans une démarche de dépistage. Il faut codifier la procédure de dépistage pour qu’elle soit appliquée de manière uniforme, comme cela a été fait pour le cancer du sein.
M. Bernard Debré, député, rapporteur. Le message à faire passer aux médecins généralistes est, d’une part, qu’il faut toujours privilégier l’examen clinique et, d’autre part, que la valeur brute du PSA doit être complétée par d’autres paramètres, le rapport PSA libre sur PSA total et la vélocité du PSA.
M. Gilbert Barbier, sénateur, vice-président. D’un point de vue étiologique, quelles sont les causes du cancer ?
M. Bernard Debré, député, rapporteur. Il y a certainement un facteur génétique. On observe ainsi que les personnes dont le père a eu un cancer de la prostate à un âge assez avancé, après soixante-quinze ans, en sont souvent victimes plus jeunes. En ce qui concerne les facteurs environnementaux, l’hypothèse d’un lien entre le chlordécone et le cancer de la prostate a été avancée pour expliquer le taux élevé de cancers en Guadeloupe, mais elle n’est fondée sur aucune étude probante et elle néglige le facteur ethnique, le cancer de la prostate étant plus répandu chez les populations de couleur noire. Pour la population asiatique, on observe des taux de cancer plus faibles mais ces taux n’expriment pas forcément l’influence d’un facteur ethnique, dans la mesure où, d’une part, l’alimentation de ces populations est à base de soja, qui contient naturellement des hormones œstrogènes inhibitrices de l’hypophyse, et que, d’autre part, on n’y pratique pas de dépistage… Plusieurs études ont été faites pour évaluer l’influence de l’alimentation au travers de certains aliments, en particulier le lait et la viande, mais on n’a pas trouvé de lien statistique évident. Aucune corrélation n’a non plus été trouvée avec le tabac, l’alcool ou l’activité sexuelle.
Mme Maryvonne Blondin, sénatrice. Mon expérience en matière d’organisation du dépistage du cancer du sein dans le Finistère me laisse penser que si la formation des médecins est essentielle, elle nécessite du temps, des directives claires et peut-être des structures adaptées.
À l’issue de la discussion, l’Office parlementaire d’évaluation des politiques de santé a autorisé le dépôt du rapport présenté par M. Bernard Debré en vue de sa publication.
La suite de ce rapport est disponible en format pdf.
1 () Étude réalisée pour le compte de l’OPEPS, p. 129.
2 () Étude réalisée pour le compte de l’OPEPS, p. 147.
3 () Étude réalisée pour le compte de l’OPEPS, p. 137.
4 () Un marqueur biologique tumoral est une substance présente dans le corps et dont le taux est lié au développement de cellules cancéreuses. À chaque type de cancer correspond donc un ou plusieurs marqueurs tumoraux spécifiques.
5 () La prostate est située devant le rectum et une partie peut être sentie pendant un examen rectal. La prostate peut ainsi être palpée par sa face postérieure, ce qui permet d’apprécier sa taille et de sentir une induration, signe de la présence d’un nodule tumoral.
6 () Un millionième de milligramme.
7 () Les surdiagnostics correspondent « à la part des cancers détectés lors du dépistage qui n’auraient pas évolué vers un cancer symptomatique », selon la définition que donne du terme la note de l’Institut de veille sanitaire et l’Institut national du cancer de septembre 2006 sur le dépistage du cancer du sein. Un rapport de l´Agence nationale d’accréditation et d’évaluation en santé indique en ce qui concerne le cancer de la prostate que « si 30 à 40 % des hommes de plus de 50 ans peuvent en effet être porteurs d’un cancer de la prostate, 8 % seulement sont susceptibles de devenir cliniquement significatifs» (Opportunité d’un dépistage systématique de la prostate par le dosage de l’antigène spécifique de la prostate, ANAES, 1999).
8 () La recommandation du Conseil européen relative au dépistage du cancer, adoptée par le 2 novembre 2003, ne préconise un dépistage systématique que pour trois affections : le cancer du sein chez les femmes de cinquante à soixante-neuf ans, le col de l’utérus chez les femmes de vingt à trente ans et le cancer colorectal pour les personnes de cinquante à soixante-quatorze ans.
Le document de référence de l’Organisation mondiale de la santé est le suivant : Should mass screening for prostate cancer be introduced at the national level ?, 2004.
9 () Les revues Prescrire et Que choisir ont notamment publié un dossier sur ce sujet au premier trimestre 2006.
10 () Un test faux-positif correpond à une réaction positive du test de dépistage en dépit de l’absence de cancer.
11 () Étude réalisée pour le compte de l’OPEPS, p. 37.
12 () Étude réalisée pour le compte de l’OPEPS, p. 25.
13 () Étude réalisée pour le compte de l’OPEPS, p. 140.
14 () Le cancer de la prostate dans les départements de l’Isère et du Tarn entre 1985 et 1995 : évolution des indications thérapeutiques. Étude portant sur 871 patients en 1985 et 1995. E. Chirpaz et alii.
15 () Le cancer de la prostate en France : résultats de l’enquête CCAFU-FRANCIM. Étude réalisée en 1995, publiée en 2000, portant sur 798 cas de cancers localisés, M. Soulier et alii, Réseau français des registres de cancer.
16 () L’étude réalisée pour le compte de l’OPEPS a exploité les données d’une cohorte constituée par les registres du cancer regroupant 2 181 cas de cancer de la prostate suivis depuis 2001.
17 () Cancer de la prostate en France : état des pratiques en 2003 et 2004. Étude portant 717 patients bénéficiant du régime d’affection de longue durée au titre du cancer de la prostate. Caisse nationale des travailleurs indépendants.
18 () Étude réalisée pour le compte de l’OPEPS, p. 211.
19 () Prévention des cancers par les médecins généralistes de Picardie : résultats d’une enquête de type déclarative. Enquête de 2004 sur les prescriptions des médecins généralistes de Picardie portant sur 480 médecins généralistes, O. Ganry et T. Boche.
20 () Étude réalisée pour le compte de l’OPEPS, p. 23.
21 () Un marqueur tumoral est une substance présente dans le sang (ou éventuellement les urines) qui signe de manière plus ou moins spécifique un cancer.
22 () « La valeur prédictive positive du PSA est de 25 à 35 % pour une valeur seuil entre 4 et 10 ng/ml et de 50 à 80 % pour une valeur seuil au-dessus de 10 ng/ml, en fonction des données du toucher rectal », selon l’étude réalisée pour le compte de l’OPEPS, p. 102.
23 () Étude réalisée pour le compte de l’OPEPS, p. 102.
24 () Étude réalisée pour le compte de l’OPEPS, p. 103.
25 () Étude des prescriptions des dosages d’antigène prostatique spécifique (PSA). Étude de la CNAMTS de la région Centre portant sur 61 500 dosages de PSA remboursés aux assurés, réalisée en 2001, publiée en 2003.
26 () PSA : le difficile positionnement du médecin généraliste entre patients et urologues. Enquête sur les prescriptions des médecins généralistes de Picardie, réalisée auprès de 200 patients adressés au service d’urologie du CHU d’Amiens, S. Vincendeau et alii, 2004.
27 () Étude des prescriptions des dosages d’antigène prostatique spécifique (PSA). Étude de la CNAMTS de la région Centre portant sur 61 500 dosages de PSA remboursés aux assurés, réalisée en 2001, publiée en 2003.
28 () Dépistage du cancer de la prostate – Approche économique : les coûts des tests de dépistage et des traitements, O. Haillot et alii, 1998.
29 () Exploitation dans le cadre de l’étude réalisée pour l’OPEPS en 2008 des données d’une cohorte constituée par les registres du cancer regroupant 2 181 cas de cancer de la prostate suivis depuis de 2001 (cf. p. 165 du rapport d’étude).
30 () Cancer de la prostate en France : état des pratiques en 2003 et 2004. Étude portant 717 patients bénéficiant du régime d’affection de longue durée au titre du cancer de la prostate. Caisse nationale des travailleurs indépendants.
31 () Le cancer de la prostate en France : résultats de l’enquête CCAFU-FRANCIM. Étude réalisée en 1995, publiée en 2000, portant sur 798 cas de cancers localisés M. Soulier et alii, Réseau français des registres de cancer.
32 () Étude des prescriptions des dosages d’antigène prostatique spécifique (PSA). Étude de la CNAMTS de la région Centre portant sur 61 500 dosages de PSA remboursés aux assurés, réalisée en 2001, publiée en 2003.
33 () PSA : le difficile positionnement du médecin généraliste entre patients et urologues. Enquête sur les prescriptions des médecins généralistes de Picardie, réalisée auprès de 200 patients adressés au service d’urologie du CHU d’Amiens, S. Vincendeau et alii, 2004.
34 () Étude réalisée pour le compte de l’OPEPS, p. 47.
35 () Étude réalisée pour le compte de l’OPEPS, p. 158.
36 () Étude réalisée pour le compte de l’OPEPS, p. 161.
37 () Cancer de la prostate en France : état des pratiques en 2003 et 2004. Caisse nationale des travailleurs indépendants.
38 () Le cancer de la prostate dans les départements de l’Isère et du Tarn entre 1985 et 1995 : évolution des indications thérapeutiques. Étude portant sur 871 patients en 1985 et 1995. E. Chirpaz et alii.
39 () Le cancer de la prostate en France : résultats de l’enquête CCAFU-FRANCIM, M. Soulier et alii, Réseau français des registres de cancer, 2000.
40 () Cancer de la prostate en France : état des pratiques en 2003 et 2004. Caisse nationale des travailleurs indépendants.
41 () Étude réalisée pour le compte de l’OPEPS, p. 169.
42 () Les établissements publics, anciennement soumis à la dotation de fonctionnement, sont notés ex-DG.
43 () Étude réalisée pour le compte de l’OPEPS, p. 144.
44 () Étude réalisée pour le compte de l’OPEPS, p. 145.
45 () Dépistage du cancer de la prostate – Approche économique : les coûts des tests de dépistage et des traitements. O. Haillot et alii, Comité de cancérologie de l’Association Française d’Urologie, 1998.
46 () Étude réalisée pour le compte de l’OPEPS, p. 268.
47 () Étude réalisée pour le compte de l’OPEPS, p. 314. Si l’on multiplie ce coût moyen par le nombre de nouveaux cas de cancer chaque année (62 000 en 2005), on obtient un coût actualisé de 789 millions d’euros par an, estimation compatible avec celle du rapport de l’Institut national du cancer précité (965 millions d’euros pour tous les cancers des organes génitaux masculins).
48 () Étude réalisée pour le compte de l’OPEPS, p. 332.
49 () Les cas de surdisgnostic représenteraient jusqu’à 30 % de l’ensemble des cancers de la prostate selon les premiers résultats partiels de l’étude européenne citée p.19 du présent rapport.
50 () Le solde (10 % des réponses) correspond à une décision conjointe du médecin et du patient. Étude réalisée pour le compte de l’OPEPS, p. 29.
51 () L’étude signale que « la plupart des patients ne peuvent répondre à des questions plus précises concernant le dosage et/ou le cancer (environ 70 %), suggérant une information imparfaite, non adaptée ou mal comprise ». Étude réalisée pour le compte de l’OPEPS, p. 30.
52 () Remplacée par la Haute autorité de santé à partir de 2005.
53 () Éléments d’information des hommes envisageant la réalisation d’un dépistage individuel du cancer de la prostate. Document à l’usage des professionnels de santé, Agence nationale d’accréditation et d’évaluation en santé, 2004.
54 () Étude réalisée pour le compte de l’OPEPS, p. 349.
55 () Étude réalisée pour le compte de l’OPEPS, p. 121.
56 () Dépistage du cancer du sein : que peut-on dire aujourd’hui des bénéfices attendus ?, note de l’Institut national de veille sanitaire, 2006.
57 () Le Monde du 18 mars 2009, p. 21.
© Assemblée nationale