

N° 2718 N° 652
____ ___
ASSEMBLÉE NATIONALE SÉNAT
CONSTITUTION DU 4 OCTOBRE 1958
TREIZIÈME LÉGISLATURE SESSION EXTRAORDINAIRE DE 2009 - 2010
____________________________________ ___________________________
Enregistré à la présidence de l’Assemblée nationale Enregistré à la présidence du Sénat
le 8 juillet 2010 le 8 juillet 2010
________________________
________________________
la recherche sur les cellules souches
Par MM. Alain Claeys et Jean-Sébastien Vialatte, députés
__________ __________
Déposé sur le Bureau de l'Assemblée nationale Déposé sur le Bureau du Sénat
par M. Claude BIRRAUX, par M. Jean-Claude ÉTIENNE,
Président de l'Office Premier Vice-Président de l'Office
_________________________________________________________________________
Composition de l’office parlementaire d’évaluation
des choix scientifiques et technologiques
Président
M. Claude BIRRAUX
Premier Vice-Président
M. Jean-Claude ÉTIENNE
Vice-Présidents
M. Claude GATIGNOL, député Mme Brigitte BOUT, sénatrice
M. Pierre LASBORDES, député M. Christian GAUDIN, sénateur
M. Jean-Yves LE DÉAUT, député M. Daniel RAOUL, sénateur
|
députés |
sénateurs |
M. Christian BATAILLE M. Claude BIRRAUX M. Jean-Pierre BRARD M. Alain CLAEYS M. Pierre COHEN M. Jean-Pierre DOOR Mme Geneviève FIORASO M. Claude GATIGNOL M. Alain GEST M. François GOULARD M. Christian KERT M. Pierre LASBORDES M. Jean-Yves LE DÉAUT M. Michel LEJEUNE M. Claude LETEURTRE Mme Bérengère POLETTI M. Jean-Louis TOURAINE M. Jean-Sébastien VIALATTE |
M. Gilbert BARBIER M. Paul BLANC Mme Marie-Christine BLANDIN Mme Brigitte BOUT M. Marcel-Pierre CLÉACH M. Roland COURTEAU M. Marc DAUNIS M. Marcel DENEUX M. Jean-Claude ÉTIENNE M. Christian GAUDIN M. Serge LAGAUCHE M. Jean-Marc PASTOR M. Xavier PINTAT Mme Catherine PROCACCIA M. Daniel RAOUL M. Ivan RENAR M. Bruno SIDO M. Alain VASSELLE |
SOMMAIRE
Première partie : Les avancées cognitives importantes sur les divers types de cellules souches 11
1. Origine des cellules souches 13
2. Origine des lignées de cellules souches embryonnaires 14
B. Les cellules souches fœtales : une catégorie particulière de cellules souches mésenchymateuses 15
1. Les cellules du sang de cordon 15
2. Les cellules de la paroi du cordon ombilical 15
b) Des cellules souches mésenchymateuses aux propriétés particulières 16
1. Les cellules souches mésenchymateuses (CSM) 17
2. Les cellules souches neurales 18
3. La peau humaine, réservoir de cellules souches 18
4. Les cellules souches de l’intestin 18
1. Connaître la carte d’identité des cellules 21
2. Comprendre les mécanismes de pluripotence et multipotence 21
a) L’interrogation sur la définition de la pluripotence 21
b) Les mécanismes moléculaires 22
3. L’importance de l’environnement in vivo 23
1. Les phénomènes précédant l’implantation 23
2. Les recherches prometteuses permises à l’étranger 24
Deuxième partie : Les perspectives d’utilisation des cellules souches 27
1. Identifier les problèmes de toxicité 27
a) Limiter le recours aux tests sur animaux 28
b) Améliorer la validité des tests 28
2. Les iPS : modèles cellulaires 29
a) Une perspective intéressante 29
b) Les limites à la modélisation 29
2. La nécessité de disposer d’un vaste panel de cellules 30
1. Les thérapies anti-cancéreuses 33
2. Les maladies du système nerveux 34
a) Les maladies neurodégénératives 34
b) Les lésions de la moelle épinière 34
c) Les accidents vasculaires cérébraux (AVC) 35
4. La réparation du muscle cardiaque 36
5. Les maladies associées au foie 36
6. La dégénérescence maculaire 37
7. Les autres maladies ciblées par la médecine régénérative 37
1. L’action directe : remplacement direct des cellules lésées 38
a) L’utilisation des cellules souches adultes épithéliales 38
b) L’utilisation provisoire de cellules souches embryonnaires 39
2. L’action indirecte par la production de molécules trophiques 39
a) La mise en évidence de l’effet paracrine 39
b) L’impact de l’effet paracrine 40
c) Les traitements associant thérapie cellulaire et thérapie génique 40
3. L’association de plusieurs stratégies 40
a) La recherche sur les biomatériaux 41
1. La manipulation des cellules souches in vitro 43
a) Caractériser et standardiser les milieux de culture 43
b) Maîtriser la prolifération in vitro 44
c) Garantir la stabilité génétique des cellules souches embryonnaires (CSE) 44
d) Guider les processus de différenciation des cellules souches in vitro 44
2. Gérer le comportement des cellules souches injectées in vivo 45
a) Comprendre et maîtriser les modalités d’administration 45
b) Maîtriser la relocalisation des cellules injectées 45
c) Gérer les problèmes immunitaires 45
2. Les technologies avancées de tri 46
3. La création de bio banques et de banques de sang de cordon 47
a) La création de bio banques pour la recherche 47
b) La création de banques de sang de cordon allogénique 47
4. L’implication des industriels 49
b) Des tentatives d’investissements 49
1. Une recherche médiatisée suscitant des espoirs 50
2. L’existence inquiétante d’un tourisme cellulaire 51
1. Des manipulations complexes 57
2. Des interrogations sur les similitudes avec les CSE 58
3. Des enjeux éthiques importants 58
Troisième partie : Les aspects internationaux ; panorama des législations et des recherches 59
a) Évaluation des dépôts de brevet sur les cellules souches 59
2. Les exclusions de la brevetabilité 60
a) L’utilisation d’embryons humains à des fins industrielles ou commerciales. 61
b) L’exclusion du corps humain, aux différents stades de sa constitution et de son développement 62
c) Les procédés de clonage des êtres humains 62
3. Les limitations quant à la portée des brevets 63
4. L’application stricte de la règle de non patrimonialité en France 63
1. Un débat long et difficile 64
2. Des règles de financement complexes 65
3. Les projets de recherches soutenus par la Commission 65
4. La procédure de sélection. 66
a) Les critères de sélection des projets impliquant l’utilisation de CSEh 66
b) Une procédure contraignante d’élaboration du contrat de recherche 67
5. La mission de coordination et de rationalisation des recherches 67
1. Le rôle de régulation de l’International Society for Stem Cell Research (ISSCR) 67
2. Les principales lignes directrices 68
a) Les lignes directrices sur la recherche 68
b) Les lignes directrices concernant les applications cliniques 68
1. Le nombre d’autorisations 105
2. L’état des lieux de la recherche sur les embryons et les cellules souches embryonnaires 106
3. L’importance du bilan annuel de l’Agence de la biomédecine 107
1- Les cellules souches embryonnaires humaines (CSEh) 108
2- Les cellules souches adultes humaines (CSA) 108
3- Les cellules souches pluripotentes induites (iPS) 108
B. Des financements à accroître et pérenniser 125
C. L’implication du secteur public dans la recherche 125
1. La protection de l’embryon et du fœtus in utero 129
2. La protection de l'embryon in vitro 129
3. L’embryon préimplantatoire : catégorie inconnue du droit français 130
1. Un compromis difficilement trouvé 131
4. Un système critiqué très tôt 133
a) Les interrogations de l’ABM 133
b) La problématique de l’évaluation par l’OPECST et l’Agence de la biomédecine 133
1. Les recommandations de la Mission d’information de l’Assemblée nationale 137
2. Les recommandations du Conseil d’État 137
1. Des recherches susceptibles de permettre des « progrès thérapeutiques majeurs » 141
2. L’absence d’une méthode alternative « d’efficacité comparable » 142
1. La finalité scientifique et médicale 142
2. Les trois critères complémentaires 143
1. L’embryon exclu de la recherche 145
2. Permettre les recherches au profit de l’embryon 146
1. Le cas emblématique de la vitrification ovocytaire 147
1. Les ambiguïtés de la loi de 2004 150
2. Les suggestions de l’ABM et les recommandations de l’OPECST 151
a) Les recherches impliquant la destruction d’embryon 151
b) Les projets de recherche à caractère technologique 152
c) Le consentement au don d’embryon à des fins de recherche 152
3. L’exportation et l’importation des lignées 153
1) Les différents types de démarches. 156
2) L’utilité de cette technique 157
2. Le débat au Royaume-Uni 160
3. Un statut juridique à définir 161
Examen du rapport par l’Office 165
Composition du comité de pilotage 171
Personnalités entendues par les rapporteurs à l’étranger et en France 173
Annexe 1 : Liste des recommandations 181
Annexe 2 : Protocoles de recherche sur l’embryon et les cellules embryonnaires autorisés 185
Ce rapport sur la recherche sur les cellules souches s’inscrit dans le prolongement d’une longue série de travaux conduits dans le cadre de l’Office parlementaire d’évaluation des choix scientifiques et technologiques (OPECST). Qu’il suffise de rappeler que la première incursion de l’Office parlementaire dans le domaine de la bioéthique eut lieu dès 1992, grâce au rapport du sénateur Franck Sérusclat,1 « Les sciences de la vie et les droits de l’Homme : bouleversement sans contrôle ou législation à la française ? ». Ce rapport comportait une série de fascicules consacrés successivement aux différentes approches en matière de réflexion éthique, à la procréation médicalement assistée, aux premières étapes de la vie et au statut des recherches sur l’embryon, aux diagnostics anténataux, aux conséquences des progrès de la génétique, au statut du corps humain et de la personne humaine, à l’euthanasie et aux soins palliatifs. Le regroupement de ces différents fascicules portait le titre évocateur : « Questions clés et réponses contradictoires ».
Depuis, les travaux réalisés, dans le cadre de l’Office, sur les cellules souches, se sont succédés afin de répondre aux défis nouveaux que les progrès dans l’étude de ces cellules lancent au législateur, voire de les anticiper. Pour mémoire, l’on citera le rapport de l’Office sur l’application de la loi de bioéthique de 1994, présenté en 1999 par Claude Huriet et l’un de vos rapporteurs2, celui qu’ils ont présenté de concert, en 20003, sur le clonage, la thérapie cellulaire et l'utilisation thérapeutique des cellules embryonnaires, ou le rapport, en 20014, de l’un de vos rapporteurs sur la brevetabilité du vivant.
Au fil des années, l’Office est devenu une instance reconnue du débat sur la bioéthique, et plus largement des débats sur les problèmes éthiques que posent à notre société les avancées scientifiques et technologiques, dont la rapidité et la médiatisation soulèvent des interrogations, et des controverses.
C’est la raison pour laquelle la loi du 6 août 2004 confie à l’Office parlementaire deux missions. Elle lui demande tout d'abord d’en évaluer l’application dans un délai de quatre ans, première mission dont nous nous sommes acquittés en présentant il y a un an, un rapport intitulé « La loi bioéthique de demain»5, après avoir organisé trois auditions publiques dans le cadre de l’Office, de très nombreuses auditions privées sur les futurs thèmes en débat, et effectué deux missions à l’étranger.
Les questionnements et propositions que nous avons présentés fin 2008 ont nourri nos réflexions sur la révision de la loi bioéthique, voire anticipé nombre de débats qui ont eu lieu depuis.
L’objet du présent rapport répond à la deuxième mission que la loi de 2004 assigne à l’Office parlementaire. Son article 26 prévoit que « Six mois avant le terme de la période de cinq ans mentionnée au troisième alinéa de l'article L. 2151-5 du code de la santé publique (CSP), l'Agence de la biomédecine et l'Office parlementaire d'évaluation des choix scientifiques et technologiques établissent chacun un rapport évaluant les résultats respectifs des recherches sur les cellules souches embryonnaires et sur les cellules souches adultes afin de permettre un nouvel examen de ces dispositions par le Parlement ».
La loi de 2004 consacre son Chapitre III intitulé « Recherche sur l'embryon et les cellules souches embryonnaires et foetales humaines » à la réglementation de ces recherches. Dans son article 25 modifiant les articles
L.2151-1 et suivants du CSP, elle pose un principe d’interdiction de la recherche sur l'embryon humain, cependant qu’elle autorise certaines recherches, à titre dérogatoire, pendant cinq ans et à certaines conditions.
Dans ce contexte, soit pour confirmer, soit pour infirmer le caractère dérogatoire et/ou temporaire de cette dérogation, la loi demande à l’Office parlementaire et à l’Agence de la biomédecine d’établir un rapport évaluant les recherches sur les cellules souches embryonnaires et sur les cellules souches adultes six mois avant la fin du moratoire de cinq ans. Celui-ci a commencé à courir lors de la publication du décret en Conseil d'État du 6 février 2006 ; il expirera le 5 février 2011.
Fin 2006 l’un d’entre nous avait présenté un rapport dans le cadre de l’Office sur « les recherches sur le fonctionnement des cellules humaines 6 » qui, comme le rapport du M. Pierre-Louis Fagniez7 remis à la même époque au Premier Ministre, se prononçait pour une évolution du cadre législative de ces recherches.
Les recommandations de ces deux rapports ont largement inspiré les propositions que nous avons présentées lors de notre évaluation de la loi bioéthique de 2004, et dans nos contributions respectives au rapport de la Mission d’information de l’Assemblée nationale8 sur la révision des lois de bioéthique présenté en janvier dernier par notre collègue Jean Leonetti9. Nous avons d’ailleurs été très étroitement associés aux travaux de cette mission car nous en avons assumée l’un, la présidence, et l’autre, l’une des vice présidences.
Nous avons au cours de notre mission collaboré avec l’Agence de la biomédecine (ABM) et avec l’Alliance nationale pour les sciences de la vie et de la santé (AVIESAN) qui nous a transmis un état détaillé des recherches sur les cellules souches en France. Nous avons, en outre, largement bénéficié du concours des services scientifiques et technologiques de nos ambassades. Que tous ces organismes en soient remerciés.
Des participations à des colloques, des visites de laboratoires et des auditions privées ont complété notre information nourrie, tout au long de l’année 2009, par les travaux de la Mission d’information sur la révision des lois de bioéthique. En outre, l’audition publique du 27 janvier 2010 animée par plusieurs membres de notre comité de pilotage, et trois missions à l’étranger, nous ont permis de dresser un état des lieux de ces recherches qui seront sans doute l’un des grands enjeux de la révision prochaine de la loi de 2004.
Concilier la liberté de la recherche et le respect de l’embryon humain, tel a été le sens de notre démarche : c’est-à-dire concilier droit des chercheurs et respect des principes qui fondent notre droit bioéthique : dignité, gratuité, non marchandisation du vivant, notamment.
PREMIÈRE PARTIE :
LES AVANCÉES COGNITIVES IMPORTANTES SUR LES DIVERS TYPES DE CELLULES SOUCHES
La période récente a connu une accélération considérable des travaux et connaissances sur la biologie des cellules souches humaines, due à une diversification importante des types de cellules souches qui font l'objet de recherches.
Quelques définitions et classifications :
Une cellule souche se définit par ses propriétés de prolifération, de multipotence ou pluripotence et d’autorenouvellement, ce qui lui confère la capacité de reconstitution d’un tissu après greffe in vivo. Selon Mme Nicole Le Douarin, professeur au Collège de France, membre de l’Académie des sciences 10, ce qui distingue les cellules souches des autres cellules de l’organisme, c’est la manière dont elles se divisent et se multiplient. « Une cellule fournit deux cellules identiques à la cellule initiale, c’est une division symétrique. Au contraire, la division d’une cellule souche fournit à la fois une première cellule identique, qui demeure indifférenciée, et une seconde cellule dont le destin sera tout autre, car si les cellules indifférenciées constituent une réserve de cellules se divisant très peu et très lentement, les cellules du second type prolifèrent jusqu’à se différencier en types cellulaires multiples. La cellule souche est donc une cellule pluripotente, à division asymétrique, produisant des cellules et capable d’auto renouvellement ».
Les cellules souches adultes (CSA) sont présentes dans la majorité des tissus en faible quantité (1 pour 100 000 cellules). Leur potentiel est restreint par rapport aux cellules souches embryonnaires (CSE) ; elles sont multipotentes et non pluripotentes, et ont un faible potentiel de multiplication. Les progéniteurs/précurseurs désignent les cellules filles des cellules souches, faiblement multipotentes, parfois confondues avec les cellules souches adultes.
Les cellules iPS (Induced Pluripotent Stem Cells) sont des cellules adultes différenciées dans lesquelles l’expression de gènes responsables du maintien de la pluripotence des cellules souches embryonnaires humaines (CSEh ) entraîne leur reprogrammation en cellules souches pluripotentes, ayant des attributs presque similaires aux CSEh. Cette similitude reste cependant débattue, comme le montrent les échanges lors de l’audition publique du 27 janvier 2010.
I. LA DIVERSIFICATION DES CATÉGORIES DE CELLULES SOUCHES
Les cellules embryonnaires humaines ont la propriété d’être des cellules souches totipotentes jusqu’au stade de 8 cellules, puis pluripotentes du stade de la morula à celui de blastocyste (du 5,5ème au 7,5ème jour de développement). Ces cellules se spécialisent ensuite.
- Sont totipotentes, les cellules souches capables de se différencier en tous les types cellulaires embryonnaires et extra embryonnaires.
- Sont pluripotentes, les cellules ayant la capacité de donner, après différenciation, l’ensemble des tissus d’un organisme, excepté les annexes embryonnaires (placenta et cordon ombilical, entre autres). Dérivées de la masse cellulaire interne du blastocyste, elles sont à l’origine des trois tissus primaires de l’embryon : endoderme, ectoderme et mésoderme.
- Sont multipotentes, les cellules souches capables de donner un grand nombre de types cellulaires mais pas tous les types, telles les cellules souches sanguines multipotentes qui peuvent générer des globules rouges, blancs et les plaquettes.
- Sont oligopotentes, les cellules souches capables de générer seulement quelques types cellulaires d’un tissu donné, telles les cellules souches de la peau pouvant donner des cellules épidermiques, des glandes sébacées ou des follicules pilaires.
- Sont unipotentes, les cellules souches pouvant donner un type seulement de cellules avec la capacité de s’auto régénérer, telles les cellules souches épidermiques qui peuvent se différencier uniquement en kératinocytes.
A. LES CELLULES SOUCHES EMBRYONNAIRES (CSE)
1. Origine des cellules souches
Les cellules souches embryonnaires se trouvent dans l’embryon très précoce (morula, blastocyste). Les lignées de CSE humaines (CSEh) proviennent de la prolifération in vitro d'une fraction des cellules de la masse interne d'un blastocyste, embryon préimplantatoire au cinquième jour de développement, issu d'une procédure de fécondation in vitro (FIV). Lorsque l’œuf se divise, il produit des cellules totipotentes ou pluripotentes, qui ont la même potentialité future de production de cellules que l’œuf lui-même. Chez l’embryon, au stade de la pluripotence, succède une première étape de différenciation, appelée la gastrulation ou formation des trois feuillets : l’ectoderme, qui produira la peau et le système nerveux, l’endoderme, qui produira la paroi du tube digestif et, entre eux, le mésoderme qui produira un grand nombre d’autres organes.
Chacun de ces compartiments aura ses propres cellules souches, qui ne seront plus totipotentes : leurs capacités de développement seront restreintes. En effet, au fur et à mesure que les feuillets se spécialisent en tissus et en organes, les cellules sont de moins en moins pluripotentes.
Or, chez l’embryon comme chez l’adulte, les cellules différenciées ont une durée de vie déterminée. Chaque année, un individu perd l’équivalent de son poids en cellules mortes. La mort cellulaire est donc un processus normal, très actif et très important : lorsqu’il est entravé, surgit une tendance à la tumorisation et à la formation de cancers.
Les CSE sont des cellules normales au plan physiologique. Si elles sont réimplantées dans l’embryon, elles fabriqueront de nouveau des tissus embryonnaires.
2. Origine des lignées de cellules souches embryonnaires
L’extraction et les conditions de culture in vitro « gèlent » ces cellules dans l'état pluripotent qui est le leur in vivo, avant la spécification des différents organes, processus qui peut se perpétuer à l'identique de façon indéfinie en culture. Les CSE sont le produit des biotechnologies, elles sont maintenues éternellement en culture grâce à l’utilisation de conditions particulières. L'expérimentateur, en changeant ces conditions et en sélectionnant des combinaisons appropriées de molécules et de substrats, les guident dans une voie de différenciation donnée. Cette double propriété, de prolifération indéfinie (auto-renouvellement), et de différenciation dans tous les types de tissus (pluripotence), assure un nombre illimité de cellules capables de multiples destins cellulaires.
Au cours de ces dernières années, un grand nombre de protocoles a été mis au point. Ils permettent la différenciation, de façon reproductible, de CSEh en plusieurs types cellulaires différenciés : hépatocytes, neurones, épiderme, etc. Des succès ont été obtenus pour le développement des cardiomyocytes, des cellules des îlots 3 de Langerhans (pancréas) sécrétant l'insuline, des progéniteurs neuraux etc. « L'une des leçons de la période récente concerne l'importance de la connaissance de l'embryologie pour progresser dans la maîtrise de la différenciation des CSEh. L'efficacité de l'obtention de cellules différenciées dépend en effet de la reproduction, in vitro, de la succession des étapes du développement embryonnaire aboutissant in vivo, à partir du blastocyste, à la formation du tissu »11.
B. LES CELLULES SOUCHES FœTALES : UNE CATÉGORIE PARTICULIÈRE DE CELLULES SOUCHES MÉSENCHYMATEUSES
Plusieurs études ont fait état de propriétés particulières des cellules souches fœtales, notamment isolées du sang placentaire ombilical ou du tissu conjonctif du cordon. En effet à la période fœtale, les tissus sont déjà parfaitement spécifiés, les cellules souches qui les constituent n'ont plus les attributs des CSE, mais gardent cependant une capacité de prolifération très supérieure à celle des cellules souches adultes (CSA) qui leur permet d'assurer la croissance des organes. Elles n'ont pas encore accumulé les altérations liées à l'âge qui expliquent les dysfonctionnements des CSA.
D’après Mme Nicole Le Douarin,12, ces propriétés sont corrélées à des voies de signalisation moléculaires spécifiques, et notamment à une régulation particulière du cycle cellulaire. Néanmoins, aucune preuve définitive ne démontre, pour l'instant, que certaines populations de cellules fœtales aient la capacité de proliférer indéfiniment sous forme de lignées, comme c'est le cas des lignées de CSE. Leur intérêt tient essentiellement à la disponibilité des cellules souches fœtales qui circulent dans le sang placentaire et pourraient résider dans le tissu conjonctif du cordon, facilement accessible sans effet délétère pour le donneur.
1. Les cellules du sang de cordon
Le sang de cordon ombilical est une source de cellules souches hématopoïétiques connu depuis les années quatre-vingt. Il est prélevé après l’accouchement sur le cordon ombilical qui vient d’être coupé, sans douleur pour la mère et l’enfant. Après qualification et validation, le sang prélevé peut alors servir de greffon et/ou être stocké dans des banques de sang placentaire autorisées. Le sang placentaire présente un avantage très important par rapport à la moelle osseuse : les cellules souches issues du sang de cordon sont moins agressives pour le receveur, car elles sont « naïves » sur le plan immunologique. Le risque de réaction du greffon contre l’hôte est donc moindre. Ces avantages expliquent que l’utilisation croit constamment et représente maintenant près de 27% des greffes. Cependant, le volume des prélèvements est souvent trop faible.
2. Les cellules de la paroi du cordon ombilical
Il existerait dans le cordon ombilical des milliards de cellules assez bien caractérisées, au phénotype stable, possédant une importante capacité de prolifération et indépendant du système HLA, ce qui ouvrirait une perspective de greffes allogéniques.
D’après M. Jacques Caen, professeur émérite, membre de l’Académie nationale de médecine13, dans la gelée de Wharton, à savoir dans le cordon ombilical lui-même, et non dans le sang de cordon, on trouve des cellules souches mésenchymateuses qui pourraient être utilisées en pathologie cardio-vasculaire. Elles seraient utilisées en Chine dans le traitement des diabétiques et de maladies du sang.
b) Des cellules souches mésenchymateuses aux propriétés particulières
Diverses expériences préliminaires montrent qu’à partir de ces tissus néonataux, il est possible d’isoler des cellules souches mésenchymateuses ayant des propriétés identiques à celles de la moelle osseuse en matière de production de facteurs de croissance, et même supérieures en matière de prolifération et présentant de surcroît, de par leur « naïveté », d’intéressantes propriétés immunologiques.
Ceci a été confirmé par M. Zhong-Chao Han14, professeur à l’Université de Tianjin qui a abandonné ses recherches sur le sang de cordon pour se tourner vers le cordon lui-même, ainsi que le placenta. Selon lui, « les cellules souches placentaires se situent juste après les CSE au niveau du développement. Cependant, le risque de tératome est moins élevé qu’avec les CSE, de plus, il n’y a pas de rejet immunitaire. On pourrait en faire un médicament. Ces cellules sont plus naïves que des cellules souches issues de la moelle osseuse, elles ont un effet régulateur. Quand il existe un effet immunogène trop haut, elles peuvent le diminuer, et quand il est trop bas, elles peuvent l’augmenter. Il existe des interactions cellulaires entre les cellules que l’on greffe et les cellules de l’organisme avec une combinaison de plusieurs facteurs.
Il a indiqué que des recherches récentes montraient que le tissu placentaire contenait dix fois plus de cellules souches que le sang de cordon. Cependant elles doivent être traitées dans les 36 heures qui suivent l’obtention des placentas. Des technologies pour produire des cellules souches pures à 99, voire 100% ont été développées. Selon M. Han, il serait possible de produire des cellules souches en une fois pour mille patients avec un seul tissu. Le centre hospitalier de l’Université de Tianjin a établi des standards au niveau du filtrage des placentas ou des cordons ombilicaux. Il ne trie pas, mais cultive les cellules pour les induire dans telle ou telle direction. L’Académie nationale de médecine15 a examiné ces travaux, et a adopté le 26 janvier 2010 des recommandations visant notamment à :
« - promouvoir les recherches sur les cellules souches mésenchymateuses du cordon et du placenta, tant dans le domaine fondamental que préclinique ;
- organiser la collecte, la conservation, la distribution des cordons, des placentas et de leurs dérivés, en créant des centres de ressources biologiques spécifiquement dédiés à ces missions».
C. LES DIVERSES CATÉGORIES DE CELLULES SOUCHES ADULTES
1. Les cellules souches mésenchymateuses (CSM)
Cette catégorie de cellules a été très étudiée au cours des cinq dernières années, elle a suscité interrogations et espoirs : ces cellules peuvent être facilement amplifiées à partir de tissus accessibles, moelle osseuse, tissu adipeux, tissu conjonctif du cordon, et probablement d'autres tissus.
Les cellules obtenues ne sont pas immortelles, peuvent se différencier en précurseurs osseux ou cartilagineux, et ont la capacité d'induire une tolérance immunologique, propriété très utile face à des maladies auto immunes ou à des rejets de greffe (moelle osseuse ou organes).
Contrairement aux cellules souches adultes spécifiques d'un tissu, on ne sait pas à quoi correspondent in vivo ces CSM. Quelle est leur fonction? Quelle est leur cellule d'origine ? On ignore encore à l’heure actuelle leur rôle physiologique in vivo. On se demande si l’on n’induit pas en les cultivant in vitro des propriétés n’existant pas in vivo. D’après Mme Laure Coulombel16, directrice de recherche, INSERM, « les propriétés de pluripotence qu'on a parfois attribuées aux cellules souches mésenchymateuses doivent être considérées avec prudence. Les critères utilisés pour démontrer cette « pluripotence» restent flous, souvent limités à l'expression de marqueurs phénotypiques ».
Ces interrogations se portent également sur les cellules stromales, qui fabriquent efficacement de l’os. Ces dernières, qui ne sont pas hématopoïétiques, forment le stroma de la moelle osseuse où les cellules souches hématopoïétiques pourront se loger. Elles sont également à l’origine des cellules de l’os et du cartilage ainsi que des cellules adipeuses et conjonctives.
D’après M. Jean-Jacques Lataillade17, professeur de médecine (hôpital Percy), parmi ces cellules stromales, « les cellules souches mésenchymateuses semblent être le chef d’orchestre principal. Elles sont multipotentes, capables de se différencier notamment en cellules de la lignée osseuse, cartilagineuse, stromale ». Elles ont aussi une activité dite paracrine, fabriquant des protéines à effet anti-inflammatoire et antiseptique, mais aussi des chimiokines attirant vers les lésions des cellules endogènes favorisant la réparation des tissus. Elles induisent également une immuno-tolérance qui rend possible de les utiliser de manière allogénique.
2. Les cellules souches neurales
Mme Nicole Le Douarin18, les décrit ainsi : « les cellules neurales du cerveau peuvent être cultivées in vitro. Elles forment des amas de cellules indifférenciées qui flottent dans le milieu de culture. Si on change les conditions de culture les cellules adhèrent au substrat. Certaines se différencient en neurones et cellules gliales de divers types. D’autres restent indifférenciées et sont capables de reformer des neurosphères. Lorsqu’elles peuvent adhérer à un substrat, certaines d’entre elles se divisent et se différencient ». Elles sont un espoir de thérapie par cellules souches adultes.
3. La peau humaine, réservoir de cellules souches
La peau humaine contient cinq types de cellules souches qui possèdent le potentiel de générer plus de 25 lignages. On les trouve principalement dans le follicule pileux. D’après Mme Michèle Martin, directrice de recherche au CEA19, ces cellules souches font partie des quelques usages thérapeutiques des cellules souches de la peau. En effet, on peut soigner des maladies qui provoquent des dépigmentations de la peau, comme le vitiligo et la leucoderma, par transplantation de follicules pileux.
Dans la papille dermique, selon elle, il existe un autre type de cellules, très proche des cellules mésenchymateuses existant dans la moelle osseuse. Le follicule pileux constitue un réservoir fabuleux. Ses potentiels sont multiples, mais ce ne sont que des potentiels. Deux nouveaux réservoirs ont été identifiés : la glande sébacée et la glande sudoripare ; elles auraient chacune leur type de réservoir de cellules souches adultes, avec des potentiels.
On trouve dans la peau humaine, un autre type de cellules souches caractérisé par le fait qu’elles expriment toutes un marqueur assez précis, la nestine. Ces cellules souvent montrées in vitro, auraient selon Mme Michèle Martin un potentiel de différenciation en neurones, en adipocytes, en vaisseaux. « On a isolé ces cellules chez une souris verte, génétiquement modifiée (la protéine GFP ayant servi de marqueur), cela a permis de visualiser une formation de vaisseaux, à partir de ces cellules pour les injecter dans une souris normale. Il existe donc un potentiel de différenciation in vivo chez l’animal ».
4. Les cellules souches de l’intestin
M. Hans Clevers, professeur à l’Université d’Utrecht, a isolé l’une des cellules souches de l’intestin qu’il a faite proliférer à partir d’une matrice extracellulaire appropriée. Il a ainsi pu régénérer les quatre types cellulaires principaux ; il a pu produire, en très grande quantité, de mini intestins.
D’après Mme Nicole Le Douarin20, ces cellules souches ont été découvertes, en utilisant comme marqueur de la thymidine tritiée. Si on en injecte à des souris, on observe que certaines cellules, dans les cryptes de l’intestin, conservent le marquage, alors que la plupart des autres cellules le perdent. « Le marqueur était maintenu dans ces cellules souches qui se divisent très peu, tandis qu’il se diluait au moment de la resynthétisation du DN1 dans les cellules qui se multiplient beaucoup. On s’était rendu compte que ces cellules souches possédaient un pouvoir prolifératif considérable, sans pour autant parvenir à les cultiver comme on cultive des cellules souches hématopoïétiques. C’est donc une des grandes acquisitions de l’année 2009 que d’y être arrivé ».
D’autres catégories de cellules souches ont été caractérisées et leur capacité à être des cellules souches est débattue. Lors de l’audition publique du 27 janvier 2010, les échanges entre les intervenants l’ont démontré.
D. LES CELLULES SOUCHES PLURIPOTENTES INDUITES (iPS) : UNE RÉVOLUTION SCIENTIFIQUE
Les cellules souches pluripotentes induites ou iPS représentent la dernière révolution scientifique dans le domaine des cellules souches. En août 2006, M. Shinya Yamanaka, professeur à l’Université de Kyoto, a découvert qu’il était possible, en dehors de toute cellule germinale, de forcer une cellule différenciée adulte à adopter de nouveau, comme si on lui faisait remonter le temps, la conformation d’un noyau de cellule souche embryonnaire pluripotente.
Ainsi, à partir de toute cellule adulte, il est possible d’obtenir une cellule quasi identique à une cellule embryonnaire pluripotente naturelle ; elle peut être mise en culture, et subir un processus de différenciation.
La technique de reprogrammation d'une cellule somatique adulte (par exemple, un fibroblaste de peau) en une cellule souche pluripotente par un simple transfert de gènes a été mise au point, après des années de recherche et l'essai systématique de combinaisons des gènes soupçonnés de jouer un rôle dans la pluripotence des cellules souches embryonnaires murines, puis humaines.
M. Yamanaka a prouvé que l'induction de la pluripotence dans une cellule complètement différenciée ne nécessitait que l'expression de quatre gènes. En novembre 2007, l’équipe de M. Yamanaka démontrait que cette technique était applicable aux cellules d’origine humaine. Cependant, l'expression forcée de ces quatre « transgènes» passait par l'utilisation d'un vecteur viral « intégratif », s'insérant directement dans l'ADN de la cellule cible, pouvant donc causer des altérations graves de cette dernière. Depuis cette découverte, les avancées se sont succédées avec rapidité, notamment dans la compréhension de ce mécanisme.
Dès 2008, plusieurs équipes ont réussi à dériver selon cette méthode des cellules spécifiées à partir de prélèvements effectués sur des personnes atteintes de maladies génétiques, ouvrant ainsi la perspective de produire des matériels d’étude aisément disponibles, similaires aux cellules in vivo, qui aideront à la compréhension des mécanismes pathologiques. En mai 2009, une expérience combinant la reprogrammation cellulaire et la thérapie génique pour obtenir des cellules indemnes d’une anomalie génétique a donné des résultats encourageants.
En août 2009, M. Yamanaka démontrait qu’en inactivant directement le gène p53, gène dit suppresseur de tumeurs, il était possible d’augmenter considérablement (avec un facteur de 10) le nombre de cellules déprogrammées.
Seuls quatre gènes sont nécessaires pour induire la reprogrammation des cellules adultes différenciées. De ces gènes impliqués dans l’induction des cellules (Klf4, c-Myc, Oct3/4 et Sox2), seul Oct3/4 est indispensable ; les autres pouvant être remplacés par des gènes aux fonctions similaires.
La découverte des iPS a ainsi ajouté une troisième voie de recherche à celles ouvertes depuis plusieurs années sur les cellules souches adultes et les cellules souches embryonnaires
Comme nous l’avions souligné dans notre rapport précité « la loi bioéthique de demain », cette découverte démontre que les recherches sur les cellules souches se « fertilisent mutuellement », qu’il n’est donc pas pertinent d’opposer les recherches sur les cellules souches embryonnaires et celles sur les cellules souches adultes, réputées plus éthiques.
Recommandation n° 1:
Il convient :
– de prendre acte de l’intérêt que porte la communauté scientifique à tous les types de recherche ;
– d’éviter d’opposer les recherches sur les diverses catégories de cellules souches les une aux autres ;
– de considérer que ces recherches se fertilisent mutuellement ;
– d’examiner sans a priori les problèmes éthiques que chaque catégorie de cellules soulève.
II. L’ACCÉLÉRATION DES CONNAISSANCES SUR LA BIOLOGIE DES CELLULES SOUCHES
A. LA CARACTÉRISATION, À LARGE ÉCHELLE, DE LA CELLULE
1. Connaître la carte d’identité des cellules
On connaît désormais la séquence des gènes dans le noyau (épigénome et génome), les modifications qui permettent l’expression des gènes, leur traduction en termes d’acides ribonucléiques (ARN). On peut, à l’heure actuelle, caractériser d’une part, tous les ARN d’une cellule : c’est la transcriptomie ; et d’autre part, les protéines qui sont fabriquées par ces gènes : c’est la protéomie.
On possède ainsi la carte d’identité complète d’une cellule, ce qui a été très précieux, ces trois dernières années, pour caractériser de façon très précise les cellules souches embryonnaires, les cellules souches adultes, et les cellules reprogrammées. Les CES servant de base de référence.
2. Comprendre les mécanismes de pluripotence et multipotence
a) L’interrogation sur la définition de la pluripotence
Les plus exigeants n’accordent ce label qu’aux cellules capables de former un individu entier ; les moins exigeants se satisfont de critères phénotypiques ; pour eux, une cellule qui, dans différentes conditions de culture, exprime des marqueurs de tissus dérivés des trois feuillets embryonnaires (ectoderme, endoderme, mésoderme) sera déclarée pluripotente ; ce qui n’est pas suffisant compte tenu de l’expression aberrante de certains gènes, explique Mme Laure Coulombel21. Le tableau ci-après, qui figure dans l’article qu’elle a rédigé dans Médecine-Science d’octobre 2009, énumère les différents critères de la pluripotence.
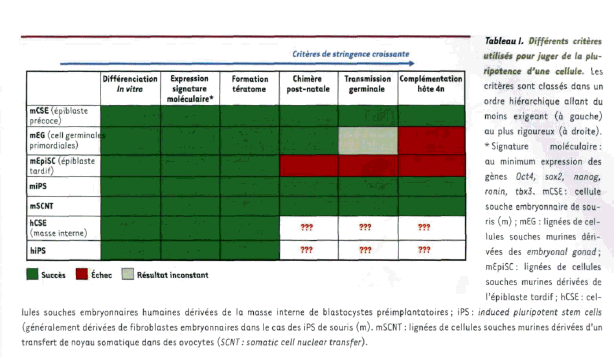
Source : Médecine-Science (octobre 2009 – volume 25)
b) Les mécanismes moléculaires
D’après Mme Laure Coulombel22, « C’est l’organisation de son environnement qui permet, ou ne permet pas à un gène de s’exprimer. Dans une cellule souche pluripotente embryonnaire ou une cellule iPS, l’ADN est déroulé, ce qui permettra à un grand nombre de gènes de s’exprimer, car c’est une structure ouverte ou permissive. Dans une cellule souche adulte, la structure est fermée, et seuls s’expriment les gènes du tissu donné ».
Cette organisation permet de dégager clairement l’explication mécanistique du potentiel d’une cellule. La reprogrammation, qui consiste à passer d’une structure fermée à une structure ouverte ou permissive, constitue un progrès scientifique considérable. « C’est parce qu’on a pu décrypter les mécanismes moléculaires du potentiel, qu’on a pu arriver au processus de reprogrammation : les travaux qui ont été effectués sur les cellules souches embryonnaires pluripotentes ont permis d’atteindre ce résultat », ajoute-t-elle.
. 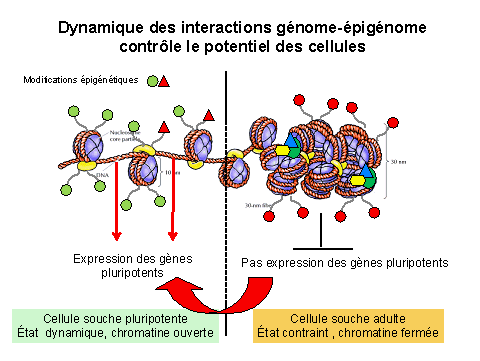
Source : audition publique du 27 janvier 2010 – Mme Laure Coulombel
3. L’importance de l’environnement in vivo
Chez l’adulte et, à un moindre degré, chez l’embryon, les cellules ne sont pas indépendantes : leur fonctionnement normal dépend des composants et de la structure de leurs niches tissulaires, à savoir de leur environnement, ce qui pose le problème de leur transplantation. En termes thérapeutiques, il convient de les transplanter dans un environnement où elles puissent fonctionner. Lorsqu’elles sortent de la niche, elles se différencient et meurent. D’après Mme Nicole Le Douarin23 « La niche, qui est un réseau complexe de cellules et de molécules régulatrices, sert à conserver les propriétés des cellules et, chez l’embryon, à fabriquer les tissus ».
B. ACCROÎTRE LES CONNAISSANCES SUR L’EMBRYOGÉNÈSE
1. Les phénomènes précédant l’implantation
Que se passe-t-il durant la première semaine du développement, qui précède l’implantation dans l’utérus ? Pourquoi certains embryons se développent-ils et d’autres pas. Selon M. Pierre Jouannet24, professeur des universités, membre de l’Académie nationale de médecine, plus de 85 % des embryons jugés « de bonne qualité » ne se développent pas dans l’utérus de la mère. 8,2 % des embryons transférés ont donné naissance à un enfant. In vivo, seuls 50 % des embryons fécondés donnera un fœtus qui se développera.
Au stade du blastocyste, des phénomènes extrêmement importants se produisent, mais ils sont mal connus. Les développements de la technologie, de la génomique, de la protéomique, de la transcriptomique et des micro méthodes conçues pour travailler sur de très petites quantités de cellules, et sur des embryons précoces, permettent de caractériser les embryons en établissant un lien entre leur composition protéique ou leur composition en ARN, et leur capacité de développement.
2. Les recherches prometteuses permises à l’étranger
Certains travaux ont ainsi permis de distinguer, en fonction de la surexpression ou de la sous-expression de diverses protéines, des blastocystes jugés anormaux, en voie de dégénérescence, et des blastocystes jugés normaux. D’autres études portent sur le profil métabolique des embryons et sur l’analyse de leur milieu de culture.
Un autre travail réalisé par une équipe australienne a consisté à pratiquer, avant le transfert de l’embryon dans l’utérus et sans toucher à la masse cellulaire interne, une biopsie sur les cellules du trophectoderme, à l’origine du placenta et des annexes embryonnaires. On a découvert que plus de 7 000 transcrits étaient exprimés exclusivement dans les blastocystes viables. Ce type d’études est très intéressant pour améliorer le choix des embryons que l’on transfère dans l’utérus, et les chances de donner naissance à un enfant en bonne santé.
C. CELLULES SOUCHES ET CARCINOGÉNÈSE
L’étude des cellules souches embryonnaires qui ont, comme les cellules cancéreuses, la capacité de s’auto renouveler permet de mieux comprendre comment une cellule devient cancéreuse.
L’apparition d’un cancer est un processus « multi-étapes » dû à l'accumulation de mutations dans des gènes impliqués dans la régulation de la prolifération cellulaire. Ces altérations génétiques induisent une transformation progressive d'une cellule normale en une cellule dérivée maligne. Les anomalies de nombre et de structure des chromosomes (ou anomalie caryotypiques) sont des événements fréquemment observés dans les cancers.
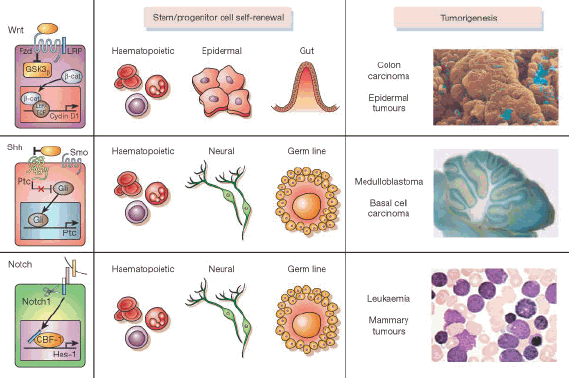
Source : audition publique du 27 janvier 2010 – M. Daniel Louvard
Ci-dessus, le schéma transmis par M. Daniel Louvard25, professeur à l’Institut Pasteur, directeur du centre de recherche de l’Institut Curie, montre que des mécanismes similaires régulent l’auto renouvellement des cellules souches normales et des cellules cancéreuses.
D’après les travaux réalisés par M. John Dick, professeur à l’Université de Toronto, en 1994, des cellules à l’origine de certaines leucémies présentaient des propriétés communes avec les cellules souches normales. Selon M. Louvard, l’apparition des cancers résulte du dérèglement du fonctionnement des gènes, du fait de gains et de pertes de fonctions de gènes particuliers, les oncogènes et les gènes suppresseurs de tumeurs. Il s’est d’ailleurs demandé dans quelle mesure les cellules tumorales sont semblables aux cellules souches normales, et si elles sont les premières à avoir subi les dérèglements du fonctionnement du génome et à avoir accumulé des mutations.
Une anomalie récurrente dans le génome des cellules souches embryonnaires humaines laissées trop longtemps en culture a été identifiée. Cette même anomalie est retrouvée dans un certain nombre de cancer. Cette découverte laisse entrevoir qu’un même processus pourrait être à l’origine de la prolifération des cellules souches et des cellules cancéreuses. Un contrôle régulier de l’intégrité du génome de cellules souches embryonnaires humaines a permis l’identification d’une région du génome hautement instable chez l’homme, localisée sur le chromosome 20. Une copie surnuméraire d’un fragment du chromosome 20 apparaît de façon récurrente dans les cellules souches embryonnaires humaines maintenues pendant une longue période in vitro à l’état indifférencié. Cette région a déjà été décrite comme amplifiée dans de nombreux cancers, notamment dans les cancers du sein, de la vessie, du poumon, du foie, dans les mélanomes, dans le cancer cervical. Ces recherches progressent vite au plan cognitif.
M. Irving Weismann, directeur de l’Institut de médecine régénérative de l’Université de Stanford26 et son équipe, ont montré comment fonctionnaient les cellules souches cancéreuses et identifié leurs signaux moléculaires. Selon lui, le signal peut être une cible thérapeutique valable pour de nombreux types de cancers car les cellules souches cancéreuses se protègent ainsi des cellules macrophages de l’organisme qui engloutissent et détruisent les cellules cancéreuses ou malades. Les cellules souches cancéreuses reconstituent leur «ruche» de cellules tumorales. Il précise : « les thérapies qui tuent les cellules cancéreuses sont susceptibles de réduire la taille de la tumeur et les symptômes de la maladie, mais elles échouent si l’on n’éradique pas les cellules souches ».
M. Peter Andrew, professeur à l’Université de Sheffield27 a rappelé que « dans une forme de cancer testiculaire, découvert il y a 40 ans, les tumeurs ressemblent à des sortes d’embryons. La cellule souche cancéreuse est celle d’un carcinome embryonnaire ».
Les cellules souches embryonnaires humaines peuvent donc contribuer à une meilleure compréhension des événements précoces jouant un rôle dans la progression tumorale.
DEUXIÈME PARTIE :
LES PERSPECTIVES D’UTILISATION DES CELLULES SOUCHES
En dehors des cellules souches hématopoétiques, (CSH) et des cellules du sang de cordon, l’utilisation en routine des cellules souches n’est pas envisagée à court terme. De nombreuses recherches à base de multiples essais cliniques sur l’homme doivent être conduits tant sur les CSEh que sur les iPS avant une telle utilisation. Actuellement les CSEh et les iPS permettent des progrès cognitifs considérables dans deux domaines : le criblage et la modélisation des maladies génétiques.
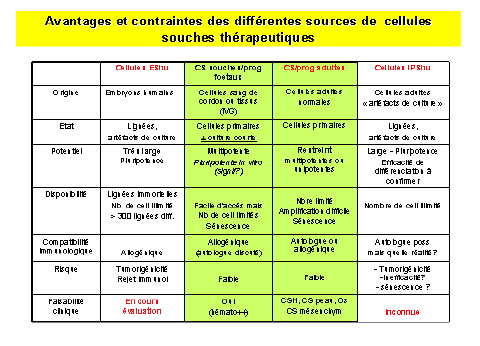
Source : audition publique du 27 janvier 2010 – Mme Laure Coulombel28
A. LE CRIBLAGE PHARMACEUTIQUE : TESTER LA TOXICITÉ
1. Identifier les problèmes de toxicité
Le criblage pharmaceutique sur les cellules souches vise à identifier précocement les problèmes de toxicité et l’efficacité d’une molécule thérapeutique sur des cultures cellulaires humaines plutôt que sur des animaux ou des patients pour éviter les effets indésirables sévères détectés tardivement. Il permet de remplacer par des cultures de cellules souches une partie des millions d’animaux utilisés aujourd’hui lors les études pré-cliniques.
a) Limiter le recours aux tests sur animaux
De l’avis des experts auditionnés, les difficultés auxquelles sont confrontées les équipes qui effectuent des recherches sur les animaux et notamment les primates dans la plupart des pays accentueront cette tendance. Nous avons été frappés lors de notre visite à l’Université de Stanford, de constater qu’il était aisé d’accéder à de nombreux laboratoires et d’obtenir des explications sur l’usage de certains appareils fabriqués spécialement pour des opérations spécifiques de tri et de purification à grande échelle. En revanche, les animaleries restaient cachées et quasi secrètes.
En effet, le développement d’un nouveau médicament prévoit la validation de sa sécurité et de son efficacité sur des animaux (études pré-cliniques), puis sur des hommes (études cliniques). Une fois le médicament commercialisé, la pharmacovigilance permet de suivre à grande échelle la performance sur les patients. Au cours du développement très long et très coûteux d’un nouveau médicament, les modèles animaux-mammifères sont supposés mimer ce qui se passe sur l’homme.
En pratique, ils ne sont pas fiables à 100%, car la toxicité de certaines molécules peut parfois échapper à la détection sur les modèles animaux : elle ne se révèle alors qu’à des stades avancés du développement, voire plusieurs années après le lancement du médicament sur le marché.
b) Améliorer la validité des tests
La possibilité de tester la toxicité et l’efficacité des molécules sur des cellules souches humaines permet d’améliorer la validité, la productivité et le coût de ces étapes critiques du développement pharmaceutique. Il s’agit de créer des modèles de cellules souches humaines saines sur lesquelles il serait possible de tester de façon spécifique la toxicité de nombreuses molécules afin d’écarter précocement celles qui présentent des effets indésirables.
Les cellules souches peuvent être différenciées en hépatocytes (cellules du foie), qui métabolisent la plupart des molécules, et sont des cellules de choix pour prédire les caractéristiques pharmacologiques d’une molécule, y compris sa toxicité. Les cellules cardiaques sont le second candidat potentiel pour le criblage pharmaceutique. L’importance du marché des médications cardiaques, et le nombre de personnes atteintes, justifient cette démarche. Par ailleurs, la possibilité de pouvoir disposer de cellules souches provenant de différentes origines permettrait de vérifier la tolérance des molécules au travers des diverses populations humaines. Cela constituerait une ouverture vers une médecine personnalisée.
2. Les iPS : modèles cellulaires
a) Une perspective intéressante
Les iPS pourraient permettre de produire des modèles cellulaires jusqu’alors impossible à créer pour des maladies génétiques. Elles offrent la possibilité de produire n’importe quelle cellule à partir d’une cellule prélevée sur un patient, ce qui laisse envisager de nombreuses applications en médecine personnalisée, car elles sont proches de la réalité physiologique du patient.
b) Les limites à la modélisation
M. Eran Meshorer29, chercheur à l’Université de Jérusalem, a montré l’intérêt de ce type de modélisation dans la maladie de Joseph Machado et la Chorée d’Huntington.
Comme la plupart des experts rencontrés, il a souligné les limites de cette modélisation, car les iPS gardent la trace de la cellule à l’origine de la dédifférenciation. Ceci nous a été confirmé à diverses reprises. La mission a eu l’occasion d’observer ces différences lors de sa réunion avec M. Eran Meshorer.
B. LE CRIBLAGE MOLÉCULAIRE : TESTER UNE SÉRIE DE MOLÉCULES
Les objectifs sont semblables au criblage pharmaceutique, mais l’échelle est différente. Ce procédé industriel qui existe depuis un peu plus de vingt ans est né notamment de la possibilité de mettre au point une quantité considérable de produits potentiellement utiles en thérapeutique, grâce à la chimie combinatoire qui s’est substituée à la chimie extractive. La chimie combinatoire a permis aux grands laboratoires pharmaceutiques de constituer des chimiothèques comportant aujourd’hui plusieurs centaines de milliers, voire millions, de composés différents. Les tester en parallèle, pour évaluer à la fois leur efficacité et leur innocuité, prendrait un temps considérable et exigerait un très grand nombre d’animaux avec les techniques traditionnelles.
La miniaturisation des essais et la robotisation des manipulations, auxquelles est parvenue l’industrie pharmaceutique, ont permis de surmonter ces obstacles. Au début des années quatre-vingt-dix, les laboratoires ont pu mettre très rapidement sur le marché les antirétroviraux utilisés dans le traitement du sida, par criblage systématique de composés issus de chimiothèques, testés à l’époque sur des cibles chimiques. Comme l’a précisé M. Marc Peschanski, directeur scientifique de l’Institut des cellules souches pour le traitement et l’étude des maladies monogéniques (I-Stem)30, c’est désormais possible en utilisant des cellules souches.
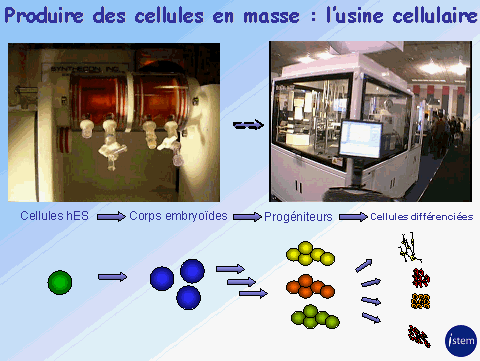
Source : audition publique du 27 janvier 2010 – M. Marc Peschanski
2. La nécessité de disposer d’un vaste panel de cellules
Pour fiabiliser le criblage, il faut d’une part disposer d’un panel étendu et spécifique de cellules souches (obtenues à partir de sujets sains et de personnes présentant des variations génétiques, des maladies spécifiques ou des sensibilités à certaines molécules) afin de tester la sécurité et la toxicité des molécules à la fois sur des cellules d’individus sains et malades, et d’autre part, s’assurer que les lignées cellulaires sur lesquelles sont testées les molécules pharmaceutiques sont identiques d’un test à l’autre.
II. LA MODÉLISATION DES MALADIES
Le principe est de créer des modèles de « cellules souches » représentatives de maladies humaines, qu’elles soient dégénératives ou génétiques, pour tester l’efficacité comparative de molécules thérapeutiques sur ces cellules.
D’après M Marc Peschanski31, on a pu tester directement divers traitements sur des lignées dont le génome comportait l’anomalie responsable d’une pathologie catastrophique. « Ainsi avons-nous observé, dans les noyaux de cellules provenant d’une lignée porteuse du gène de la dystrophie myotonique de type I, une accumulation d’ARN, à l’origine de la maladie. Nous recherchons les traitements permettant de réduire cette accumulation intra-nucléaire, dans l’espoir d’atténuer les effets pathologiques chez les patients. La banque d’I-Stem comporte aujourd’hui 25 lignées porteuses d’une vingtaine de pathologies différentes, toutes d’origine génétique ».
Source : audition publique du 27 janvier 2010 – M. Marc Peschanski
La médecine régénérative englobe les thérapies médicales qui permettent de réparer, remplacer, restaurer et régénérer les organes, tissus et cellules lésés ou malades. Son objectif est d’augmenter la durée et la qualité de vie du patient. La médecine régénérative par thérapie cellulaire associant la thérapie génique pourrait devenir une alternative crédible aux greffes d’organes classiques, caractérisées par la pénurie d’organes et les risques de rejet. Jusqu’à une période récente, elle se limitait à la greffe totale d’organes (poumon, coeur, foie...), ou de tissus (peau, vessie, cartilage).
La médecine régénérative par thérapie cellulaire vise à la prévention, au traitement, à la guérison ou la stabilisation de maladies (dégénératives ou génétiques) ou de blessures par l’administration de cellules manipulées ou modifiées in vitro. La médecine régénérative pharmaceutique cible directement les cellules souches adultes des patients à l’aide de molécules spécifiques afin de les induire à reformer un tissu endommagé. La médecine régénérative à base de cellules souches permet d’envisager le traitement de maladies ou d’affections réputées incurables ou mal contrôlées par les thérapies actuelles. Elle intervient actuellement le plus souvent en dernière intention, et parfois même pour des protocoles compassionnels.
1. Les thérapies anti-cancéreuses
Malgré les méthodes de diagnostic précoce, la chirurgie et les traitements médicaux (chimiothérapie, radiothérapie...) qui ciblent la tumeur, les traitements actuels présentent des limites. Ils détruisent les cellules cancéreuses, mais aussi les cellules saines, en particulier les cellules sanguines et lymphatiques, et ils ne détruisent généralement pas les cellules souches cancéreuses tenues pour responsables de rechutes et de métastases, selon la plupart des scientifiques.
Pour détruire les cellules souches cancéreuses, on tente de mieux les caractériser pour mieux les cibler. Certains cancers (lymphomes, leucémies, myélomes) résultent d’une mutation génétique. La transplantation de cellules souches hématopoïétiques (CSH) provenant du sang, de la moelle osseuse ou du sang de cordon ombilical, est aujourd’hui le traitement de référence. Il s’agit actuellement d’améliorer leur performance afin d’obtenir, selon le cancer considéré, le type de lignée sanguine requis, et en quantité importante.
Il faut isoler de façon certaine des CSH à partir de la moelle osseuse : opération délicate en raison de la variabilité des marqueurs de surface spécifiques. Ensuite il faut induire leur prolifération, ce qui reste difficile à maîtriser in vitro. Ceci nous a été expliqué tant à Paris à l’Institut Curie par l’équipe de M. Daniel Louvard, que par M. Irving Weissmann à l’Université de Stanford.
2. Les maladies du système nerveux
Les maladies neurodégénératives comme la maladie de Parkinson, ou neuro-inflammatoires comme la sclérose en plaques, et les maladies psychiatriques occasionnent en France un tiers des dépenses de santé, tant elles sont invalidantes. On imagine l’enthousiasme que peut susciter l’espoir d’un traitement par les cellules souches. « Cet enthousiasme doit néanmoins être tempéré. Plusieurs défis demeurent en effet, certains d’ordre scientifique, d’autres ayant trait à l’organisation de notre recherche, d’autres encore à sa mise en cohérence »32, estime M. Hervé Chneiweiss, directeur de recherche, INSERM, membre du conseil scientifique de l’OPECST.
a) Les maladies neurodégénératives
On observe une capacité d’autoréparation du cerveau grâce aux cellules souches neurales. Ces cellules seraient capables de remplacer les cellules ayant perdu leur fonctionnalité lors de maladies neurodégénératives (maladie de Parkinson, maladie d’Huntington, maladie d’Alzheimer...), de lésions de la moelle épinière (paralysies accidentelles) ou d’attaque cérébrale. M. Anselme Perrier33, chargé de recherche (I-Stem-INSERM) a évoqué ces possibilités pour améliorer l’état des patients atteints de la Chorée d’Huntington. Il utilise des cellules souches d’origine fœtale (morceaux de cerveau).
Cette stratégie est utilisée dans la maladie de Parkinson pour combler le déficit de dopamine lié à la mort de neurones spécifiques à l’origine des difficultés motrices caractéristiques de cette maladie. La greffe de neurones dopaminergiques issus de tissu fœtal est actuellement explorée comme traitement avec des résultats variables. Des études récentes ont montré sur des modèles animaux de la maladie de Parkinson que certains facteurs de croissance auraient un effet neuro-protecteur significatif.
b) Les lésions de la moelle épinière
D’origine traumatique ou pathologique, les lésions de la moelle épinière endommagent les neurones qui permettent la communication entre le cerveau et les neurones moteurs, entraînant une perte de motricité ou de sensibilité d’intensité variable. La thérapie cellulaire vise à réparer ou remplacer à la fois les neurones et les oligodendrocytes (cellules qui entretiennent la gaine de myéline des neurones). Il s’agit d’obtenir des neurones capables de fabriquer des axones assez longs pour traverser les sites lésés et se reconnecter avec leurs cibles.
c) Les accidents vasculaires cérébraux (AVC)
Le défi pour traiter des lésions liées à un AVC par thérapie cellulaire est considérable car les zones atteintes, étendues et variables, affectent de nombreux types de cellules et de connections nerveuses. M. Marc Peschanski estime possible de relever ce défi. Le schéma ci-dessous explicite son projet.
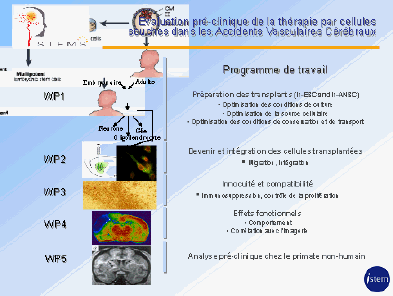
Source : audition publique du 27 janvier 2010 – M. Marc Peschanski
La prise en charge du diabète est très contraignante pour les patients (dosage régulier du glucose sanguin) et la maladie, même avec l’insulinothérapie, peut provoquer des complications secondaires majeures (insensibilité à la douleur, cécité, plaies...). Le risque de coma est important. Des centaines de diabétiques ont pu être traités par transplantation d’îlots de Langerhans à partir de pancréas de donneurs. Cependant trop peu de pancréas sont disponibles pour traiter les millions de patients atteints. Pour traiter le diabète de type 1 d’origine génétique, il faut transplanter des cellules humaines produisant de l’insuline dans le pancréas où elles remplaceront les cellules déficientes.
Trois voies de recherche sont actuellement explorées pour obtenir des cellules pancréatiques à insuline de façon efficace pour des applications médicales : une voie vise à identifier les molécules qui stimulent la réplication naturelle de ces cellules, une autre voie vise à contrôler toutes les étapes intervenant dans le processus de différenciation depuis la cellule souche jusqu’à la cellule pancréatique, la dernière voie est la « reprogrammation directe » qui vise à transformer une cellule pancréatique sans passer par le stade embryonnaire.
Ces voies sont prometteuses mais des travaux sont encore nécessaires avant de pouvoir disposer en routine de cellules pancréatiques produisant de l’insuline. The Juvenile Research Diabets Foundation34 soutient ces recherches sur les cellules souches notamment pour le diabète de type I. Ses dirigeants ont établi une commission spéciale, car ils estiment que les grands groupes pharmaceutiques s’intéressent trop peu aux possibilités qu’offre la thérapie cellulaire aux diabétiques.
4. La réparation du muscle cardiaque
L’infarctus du myocarde entraîne la destruction massive des cellules musculaires, les cardiomyocytes, compromettant la fonction contractile du cœur. À terme, cela peut conduire à l’insuffisance cardiaque. Dans les cas les plus avancés, la seule solution thérapeutique est la transplantation cardiaque. La prise en charge médicale de l’infarctus n’est pas toujours satisfaisante et il n’existe pas de traitement pour restaurer les cardiomyocytes morts. La stratégie pour traiter l’infarctus par thérapie cellulaire est d’injecter des cardiomyocytes dans le cœur du patient pour remplacer les cellules endommagées. M. Anthony Mathur35, professeur à la Queen Mary University de Londres, a expliqué que l’un des défis était d’identifier la cellule appropriée, et de la purifier.
Il est aujourd’hui possible de produire de grandes quantités de cardiomyocytes humains hautement purifiés. Ces cellules, obtenues par différenciation in vitro, expriment les marqueurs cardiaques et présentent des mécanismes d’excitabilité-contractilité similaires à ceux de cardiomyocytes humains adultes. La transplantation de ces cardiomyocytes préserve la fonction contractile du coeur de rats atteints d’infarctus.
Ces études pré-cliniques démontrent que les cardiomyocytes dérivés de cellules souches embryonnaires humaines peuvent participer à la remuscularisation, et préservent la fonction ventriculaire du cœur. Dans ce domaine la recherche est très avancée. L’équipe de M. Philippe Menasché36, professeur des universités, directeur de recherche à l’INSERM, envisage très prochainement un essai clinique avec des cellules souches embryonnaires.
5. Les maladies associées au foie
Le projet de recherche européen (Liv-ES) visant à développer des thérapies cellulaires à partir de cellules souches embryonnaires humaines pour les maladies associées au foie regroupe neuf équipes de recherches (Espagne, Finlande, France, Israël, Royaume-Uni). Le consortium est financé par la Commission européenne dans le cadre du 7ème Programme cadre de recherche et développement.
Ce projet consiste à créer les conditions pour que des thérapies cellulaires puissent faire l’objet d’essais et à proposer des alternatives aux transplantations du foie. À cette fin, le consortium mettra en place, d’ici fin 2011, une banque d’hépatocytes humains matures utilisables dans des conditions cliniques acceptables. Aujourd’hui, pour les affections hépatiques consécutives aux hépatites et cirrhoses, la seule option thérapeutique efficace à long terme est la transplantation du foie qui n’est pas accessible à tous les patients.
6. La dégénérescence maculaire
Elle affecte les cellules épithéliales pigmentées de la rétine qui finit par dégénérer, bloquant ainsi la vision centrale. Il existe deux types de dégénérescence maculaire, sèche et humide, seule cette dernière (10 % des cas) peut aujourd’hui être traitée par laser. La thérapie par cellules souches offrirait une solution aux 90 % de patients souffrant de dégénérescence maculaire sèche.
Selon M. José-Alain Sahel37, professeur des Universités, directeur scientifique de l’Institut de vision : « l’enjeu principal est de traiter les maladies responsables de la majorité des cécités actuelles, parmi lesquelles un grand nombre de maladies génétiques. Les plus connues sont les rétinopathies pigmentaires, qui touchent de 40 000 à 50 000 personnes en France, la dégénérescence maculaire liée à l’âge (DMLA), dont le nombre de cas devrait doubler dans les quinze ans à venir du fait du vieillissement de la population, et qui, affectant la rétine centrale, est très invalidante. Elle entraîne une perte de la vision centrale ». Les sources de cellules transplantables ont longtemps été des progéniteurs rétiniens obtenus à partir de rétines embryonnaires, très facilement chez l’animal, soit des cellules souches neurales adultes, soit des cellules souches hématopoïétiques, soit des cellules de l’œil lui-même. Mais selon lui, aucune approche n’a été efficace, et il note un écart important entre les résultats obtenus in vitro et ceux obtenus in vivo chez l’animal.
Pour M. Peter Andrew, professeur à l’Université de Sheffield38, des progrès pourraient être accomplis car l’œil est d’accès facile, les cellules injectées ne migrent pas, et il est possible de contrôler d’éventuelles proliférations.
7. Les autres maladies ciblées par la médecine régénérative
De nombreuses autres maladies dégénératives sont candidates à la médecine régénérative. L’arthrose, les maladies auto-immunes, les maladies génétiques sont aussi une des cibles de la médecine régénérative, telle la mucoviscidose, maladie génétique incurable et mortelle due à un défaut portant sur un seul gène. Il n’existe pas de traitement spécifique de cette maladie génétique excepté la greffe de poumon ou la thérapie cellulaire. D’autres pathologies notamment les maladies génétiques orphelines sont concernées.
Les processus de reprogrammation permettent de comprendre le contrôle de l’identité cellulaire. Il faut cependant décrypter les différents degrés de reprogrammation, afin de les maîtriser et de diriger les cellules vers la voie choisie.
On peut utiliser les cellules souches comme vecteurs de drogues cytotoxiques, notamment dans certains problèmes tumoraux, car elles savent généralement retourner dans leur tissu d’origine.
1. L’action directe : remplacement direct des cellules lésées
a) L’utilisation des cellules souches adultes épithéliales
D’après Mme Michèle Martin39, les cellules souches épithéliales offrent de vraies applications cliniques dans les cas suivants: grands brûlés, grands irradiés, plaies chroniques, épidermolyse bulleuse, alopécie. Facilement accessibles, elles disposent d’un très fort potentiel de régénération. Il est encore difficile de travailler sur les cellules souches des kératinocytes de l’épiderme humain, parce qu’il n’y a pas de marqueur unique des cellules souches. Ces cellules sont donc difficiles à isoler et mal connues. Or ces cellules souches adultes sont utilisées en clinique, depuis vingt cinq ans, pour soigner les grands brûlés, les grands irradiés et d’autres pathologies.
Les kératinocytes de l’épiderme sont aussi utilisés pour le traitement des ulcères veineux chroniques, un essai international randomisé en a montré l’intérêt pour les plaies du pied, fréquentes chez les diabétiques, et très difficiles à soigner. Il est possible de mélanger une thérapie cellulaire et une thérapie génique en utilisant une population enrichie en cellules souches.
Il en est de même pour les grands brûlés ou les irradiés traités à l’Hôpital Percy dans le service de M. Jean Jacques Lataillade. Le principe est celui de la culture autologue : les tissus du brûlé lui-même sont mis en culture, pour préparer un greffon. Greffé sur le patient, le greffon ne prend que s’il contient des cellules souches. Cependant, il n’existe pas de qualification de la qualité des greffons ; on ne sait pas si ceux-ci contiennent des cellules souches et en quelle proportion. C’est la prise du greffon, un mois environ après la greffe, qui sera le test de la qualité du greffon.
Le kératinocyte, semble particulièrement intéressant pour la reprogrammation. Une équipe espagnole a comparé le taux de cellules iPS qu’on obtenait à partir d’un fibroblaste humain et d’un kératinocyte humain: il serait cent fois plus facile de reprogrammer le kératinocyte.
b) L’utilisation provisoire de cellules souches embryonnaires
L’équipe de M. Marc Peschanski40 a prouvé qu’il était possible d’aboutir à une peau reconstruite, dont la qualité était supérieure à ce que les autres équipes avaient obtenu jusque là à partir de cellules souches embryonnaires. On peut ainsi commencer à reconstruire une peau, qui semble physiologiquement proche de la peau humaine. L’équipe de M. Marc Peschanski a proposé, dans un premier temps, que ce type de construction puisse être testé comme pansement, pour faire attendre le patient avant la greffe définitive.
2. L’action indirecte par la production de molécules trophiques
Il arrive que les cellules apportées n’aient pas des effets réparateurs directs, mais agissent sur l’environnement. On a pu constater que les cellules souches mésenchymateuses inhibaient la réponse immunitaire. Cette capacité de réduction de la réponse immunitaire trouve des applications thérapeutiques.
Dans ces cas, les cellules souches ne sont pas seulement utilisées dans un but de reconstruction mais aussi pour traiter des pathologies immunologiques et des rejets de greffes. Des essais cliniques sont réalisés concernant le traitement de la maladie du greffon contre l'hôte grâce à des cellules souches mésenchymateuses.
a) La mise en évidence de l’effet paracrine
Comme le montre le schéma ci-dessous, une cellule qui produit une sécrétion agit sur les cellules des tissus du voisinage avec un rôle immuno modulateur.

Source : audition publique du 27 janvier 2010 – M. Jean-Jacques Lataillade
D’après M. Jean-Jacques Lataillade, on peut faciliter la réparation de cellules malades grâce à l’importation de cellules endogènes qui synthétiseront des facteurs importants pour la réparation et aideront à induire une tolérance immunologique modulée. C’est une voie de recherche thérapeutique importante.
b) L’impact de l’effet paracrine
M. Han Zongchaoa41, professeur à l’Université de Tianjin, a détaillé l’impact de l’effet paracrine des cellules souches de la paroi du cordon. Ces cellules libèrent des facteurs immuno modérateurs que l’on n’a pas encore complètement identifiés, mais qui induisent une tolérance particulière et facilitent les greffes d’autres tissus.
Ce procédé implique de connaître les cellules souches in situ et de stimuler leur fonction en agissant sur la niche ou directement sur les cellules, ce qui se pratique déjà dans le système hématopoïétique.
Les cellules souches mésenchymateuses ont une activité paracrine, elles fabriquent des protéines à effet anti-inflammatoire et antiseptique, mais aussi des chimiokines qui attirent vers les lésions des cellules favorisant la réparation des tissus.
c) Les traitements associant thérapie cellulaire et thérapie génique
Les cellules souches comme les cellules mésenchymateuses peuvent détecter les lésions et les sites tumoraux. Il serait possible de les charger en molécules thérapeutiques et de les vectoriser pour qu’elles aillent réparer des lésions ou détruire des cellules tumorales.
Un essai a été mené par un groupe italien pour traiter une épidermolyse bulleuse, liée à une mutation, et pour laquelle on ne dispose pas de traitement. Le groupe italien a prouvé que, par une culture de kératinocytes du patient (thérapie cellulaire) corrigé par un gène médicament (thérapie génique), la greffe permettait localement de traiter complètement la maladie et le patient, dans cette zone-là, ne présentait plus la maladie.
3. L’association de plusieurs stratégies
L'un des atouts qu'offre la diversité des cellules souches est la possibilité d'associer plusieurs populations complémentaires en un greffon plus fonctionnel. En effet, il ne s'agit pas seulement d'obtenir la population de cellules/précurseurs différenciés appropriée, mais de s'insérer très rapidement dans un environnement qui lui offre la possibilité de survivre et de fonctionner. Cela implique, par exemple, une vascularisation immédiate, un substrat sur lequel adhérer et/ou migrer, ou encore la présence de facteurs anti-inflammatoires, car la greffe se fera souvent dans un milieu lésé, donc réactif et hostile. Cela souligne l'importance probable pour les futurs greffons de combinaisons de cellules d'origines diverses (associant cellules souches tissulaires spécifiques, cellules souches mésenchymateuses, et peut-être cellules souches vasculaires). L’ouverture à l'interdisciplinarité, et l’inventivité des ingénieurs chargés de créer les substrats adaptés, jouent un rôle essentiel dans ces recherches.
a) La recherche sur les biomatériaux
Selon M. Hervé Chneiweiss42 : « On peut également anticiper des progrès dans la science de la bio-ingénierie cellulaire. Peu médiatique, la recherche sur les biomatériaux est un pré requis indispensable, car les cellules souches ne pourront ni survivre, ni fonctionner en l'absence d'un substrat adéquat, imbibé de facteurs de croissance, et de cellules de soutien reconstituant une « niche » indispensable » (voir ci dessus). Il cite « l'utilisation de polymères de type hydrogel, pour conférer une structure tridimensionnelle et assurer le contact entre ces cellules ». Ces stratégies sont à l'essai dans les greffons osseux utilisant des cellules mésenchymateuses, ou pour les greffes d'épithélium rétinien pigmentaire. Elles ont également permis des greffes de vessies synthétiques, et la greffe d'un segment important de trachée.
Nous nous sommes entretenus avec M. Anthony Hollander43, professeur à l’Université de Bristol, qui a effectué des recherches sur la biologie du cartilage et sur l'arthrite. Dans le cadre d'une collaboration internationale financée par l'Union européenne, il a développé de nouveaux tests de mesure de la qualité de la réparation des tissus dans des biopsies du cartilage des patients atteints de blessures au genou.
Il a participé à la première greffe de trachée à partir de tissus cartilagineux, en utilisant les cellules souches mésenchymateuses d’une patiente, qui a subi la transplantation avec succès. Actuellement la patiente se porte bien. Cette technique encore coûteuse est prometteuse relève de la médecine personnalisée.
D’autres travaux sont en cours ; ainsi, l’équipe de M. Lior Gepstein44, professeur à l’Université de Haïfa, a mis en culture des cardiomyocites, et a produit du tissu cardiaque contractile, à l’hôpital Rambam de Haïfa.
D’après M. Hervé Chneiweiss45 : « Loin de s’opposer, pharmaco génomique et phénomique cellulaire doivent aller de pair. Il faut mener l’effort en parallèle sur les deux fronts. Pour beaucoup de maladies humaines, nous ne disposons pas de modèles animaux, ou seulement de mauvais modèles. Comme le faisait observer Sydney Brenner, Prix Nobel de médecine 2002 avec deux autres chercheurs pour leurs travaux de biologie moléculaire, l’an dernier lors d’un congrès de cancérologie: « We need no more models, we are the model ».
Il faut inventer des systèmes pour valider les protocoles, et modéliser suffisamment l’interaction observée in vitro entre un tissu et les cellules qui y sont greffées, pour pouvoir simuler ce qui se passera dans le temps. C’est ainsi que l’on en vient à une biologie de système.
Selon M. Philippe Menasché et M. Marc Peschanski46, pour les pathologies qui touchent des milliers de malades, il est difficile d’imaginer qu’une médecine personnalisée répondra à toutes les demandes. L’industrie pharmaceutique cible des modèles allogéniques, avec des produits quasiment prêts à l’emploi, après des essais cliniques ; une demande d’autorisation de mise sur le marché suppose des coûts qui restent raisonnables.
Il ne faut pas négliger une autre voie de « réparation », via l'action médicamenteuse directe : l'idée étant de stimuler in situ les composants de l'environnement (niche), afin d'activer une réparation endogène.
On peut aussi considérer qu’une thérapie cellulaire bien menée puisse conduire à la guérison complète et éviter des traitements à vie. Ceci rendrait obsolète le modèle actuel des grands groupes pharmaceutiques.
L'explosion récente des connaissances dans le domaine des cellules souches, très médiatisée, est encore du domaine de la recherche et n'aura pas de traduction immédiate en termes de progrès médicaux à large échelle. En revanche, l'existence d'une diversité beaucoup plus vaste des types cellulaires utilisables, la confirmation de la plasticité inhérente à nombre de cellules (dont le potentiel pourrait alors être modulé) permet d'envisager des stratégies cliniques elles-mêmes plus diversifiées : adaptation du produit de thérapie cellulaire à la pathologie ciblée (type de cellules, préparation autologue ou allogénique, contrôle de qualité), type d'administration (injection, patch, encapsulation), stratégie de préparation. Outre la coopération multidisciplinaire et internationale entre chercheurs travaillant sur des types cellulaires différents, il sera nécessaire d'associer à la conception et au déroulement des essais cliniques des compétences supplémentaires : qualiticiens, ingénieurs, spécialistes des biomatériaux, mathématiciens spécialistes de la modélisation, entre autres.
IV. LES PRINCIPAUX DÉFIS À RELEVER
Pour pouvoir utiliser les cellules souches embryonnaires et les iPS en médecine régénérative ou pour le criblage pharmaceutique, il est indispensable de maîtriser les mécanismes gouvernant leur prolifération et leur différenciation in vitro ainsi que leur relocalisation et leur tolérance in vivo. Il faut disposer de cellules de sources variées, sûres et reproductibles. Pour cela, les obstacles à surmonter restent encore nombreux, d’après le rapport47 de Mme Mireille Guyader, attachée pour la science et la technologie à l’Ambassade de France aux États-Unis, Mme Florence Béranger, représentante de l’ INSERM et Mme Rachel Jouan, consultante.
A. LES ENJEUX SCIENTIFIQUES ET MÉDICAUX : LES OBSTACLES À SURMONTER
Plus de 500 lignées de CSEh ont été dérivées et caractérisées dans le monde. Ces lignées sont partagées entre les différents laboratoires; des possibilités de banques internationales avec typage HLA (Human Leucocyte Antigen) existent avec une très grande variabilité des lignées. Les lignées ne sont équivalentes ni en termes de conditions de culture, ni en termes de potentiel de différenciation, ce qui impose d’en tester un grand panel afin de sélectionner celles qui se différencient dans la voie choisie avec la plus grande efficacité et la meilleure reproductibilité. Comme l’ont souligné MM. Daniel Aberdam et Joseph Itskovitz-Eldor48, co-directeurs du laboratoire INTERTECH (Technion) à Haïfa, la dérivation est une forme d’art, il faut « sentir » les cellules, savoir comment les choisir en vue de telles ou telles applications.
1. La manipulation des cellules souches in vitro
Pour leur application future en médecine régénérative, il est nécessaire de parfaitement maîtriser les conditions de culture des cellules souches in vitro, de les produire en grande quantité et de façon reproductible. À cette fin, plusieurs types d’obstacles restent à surmonter.
a) Caractériser et standardiser les milieux de culture
Un des enjeux est la mise au point des conditions de culture capables de favoriser la prolifération cellulaire tout en évitant de provoquer des mutations. L’un des premiers défis réside dans la biosécurité. Il faut aussi éviter tout risque de toxicité, non seulement celui éventuellement présenté par la greffe de cellules, mais aussi d’autres, liés à l’apparition de nouvelles maladies, pas encore nécessairement connues et qui pourraient se développer dans les cellules greffées. C’est l’un des défis auxquels se sont attaqués MM. Daniel Aberdam et Joseph Itskovitz-Eldor. La standardisation des milieux de cultures est essentielle pour pouvoir passer à l’industrialisation. Or, le milieu de culture influe sur le processus de différenciation et de stabilisation des lignées.
b) Maîtriser la prolifération in vitro
Si le processus moléculaire de prolifération in vitro est maîtrisé sur les CSE de souris, il ne l’est pas encore totalement sur les CSE humaines. De plus, ces dernières ont une capacité moindre à la prolifération in vitro que celles de souris. Il est donc plus difficile d’en obtenir de grandes quantités. Les cellules souches adultes, quant à elles, ont une capacité d’auto-renouvellement in vitro plus faible que les cellules souches embryonnaires, ce qui augmente la difficulté d’obtenir les quantités requises pour les thérapies cellulaires. Il faut éviter tout risque de transformation et de développement tumoral car il existe, dans le génome, des micros régions instables, présentant d’importants risques de duplication ou de délétion.
c) Garantir la stabilité génétique des cellules souches embryonnaires
In vitro, les CSE ont tendance à accumuler mutations et anomalies chromosomiques lors de leur prolifération. Elles deviennent tératogènes une fois injectées à un patient, et sont donc dangereuses. Les transformations épigénétiques ayant lieu au cours de l’amplification des lignées de CSE doivent être mieux comprises et maîtrisées. Avant d’envisager leur utilisation en clinique, il faut s’assurer que les cellules utilisées sont fiables, et que leur phénotype demeure durablement stable, non seulement in vitro mais in situ, car on traite essentiellement des patients jeunes. On doit également s’assurer que le phénotype des cellules greffées demeure efficace dans le temps.
d) Guider les processus de différenciation des cellules souches in vitro
Pour l’usage clinique, il est nécessaire d’obtenir de façon reproductible la cellule différenciée souhaitée pour le traitement ciblé. Il faut connaître, pour chaque cellule spécialisée, les facteurs biochimiques, micro-environnementaux et épigénétiques capables d’orienter de façon reproductible la différenciation vers une cellule spécialisée d’un tissu plutôt que d’un autre. Il faut ensuite identifier, maîtriser et sécuriser la fenêtre critique au cours de laquelle la différenciation de la cellule est idéale pour coloniser le tissu ciblé sans générer de tumeur. Des cellules souches utilisées à des stades trop précoces de différenciation sont tératogènes après injection chez l’animal. Selon MM. Daniel Aberdam et Joseph Itskovitz-Eldor49, certaines lignées de CESh sont instables ; c’est pourquoi, il est nécessaire d’en créer de nouvelles. En outre, la dérivation prend un aspect artisanal, il faut déterminer la plus ou moins grande capacité d’une lignée à se différencier en tel ou tel type de cellule « il faut sentir la lignée ». Certains processus ne s’expliquent pas encore clairement.
2. Gérer le comportement des cellules souches injectées in vivo
a) Comprendre et maîtriser les modalités d’administration
Il faut connaître les quantités optimales de cellules à injecter, les phénomènes de migration, de relocalisation, d’interconnections avec les cellules du patient, et les conditions de survie des cellules transplantées. La généralisation de traitement est compliquée comme l’a expliqué Dame Julia Polak, professeur émérite, Imperial College de Londres.50
b) Maîtriser la relocalisation des cellules injectées
La plupart des chercheurs et des autorités de contrôle que la mission a rencontrés tant en France qu’à l’étranger ont fait état des problèmes posés par la différenciation et la sélection des cellules adéquates pour la transplantation. Ils s’interrogent sur certaines modalités pratiques de relocalisation, d’intégration tissulaire et de tolérance des cellules injectées, et font état de leur inquiétude quant au risque de développement de tumeur.
c) Gérer les problèmes immunitaires
Les greffes, qu’elles soient organiques ou cellulaires exigent des traitements immuno-suppresseurs lourds, avec un risque persistant de rejet. La maîtrise de la reprogrammation cellulaire rend a priori plus accessibles les greffes autologues obtenues à partir des cellules du patient, et ouvre la porte à une médecine régénérative personnalisée.
B. LA MISE EN œUVRE D’OUTILS ET DE PROCÉDURES ADAPTÉS ET PERFORMANTS
Au cours de nombreuses visites de laboratoires en France et aux États-Unis, en Israël, nous avons constaté un changement d’échelle dans les procédures. Au Génopole d’Evry, l’Institut des cellules souches pour le traitement et l’étude des maladies monogéniques (I-Stem) dispose d’un bioréacteur qui permet de cultiver non plus quelques centaines de milliers ou quelques millions de cellules, mais jusqu’à un milliard de cellules en une quinzaine de jours. Ce changement d’échelle majeur ouvre de nouvelles perspectives, bien au-delà des besoins des laboratoires de recherche académique. « Une telle production industrialisée permet d’envisager une utilisation elle-même industrielle de ces cellules, des robots permettant de trier des dizaines de milliers de composés et d’en tester en parallèle les effets sur des populations cellulaires », selon M. Marc Peschanski51.
Les cellules souches embryonnaires permettent d’avoir accès à des quantités de cellules assez importantes pour envisager, grâce à la miniaturisation et à la robotisation, de remplacer les cibles chimiques par des cibles biologiques, c'est-à-dire du vivant. « Les applications industrielles de l’utilisation des cellules souches embryonnaires sont porteuses d’un grand espoir. La maîtrise de cette production de biomasse et celle de la pluripotence sont devenues des enjeux industriels. Au point que l’activité I-Stem, qui est consacrée pour deux tiers à la recherche classique relative aux cellules souches embryonnaires, l’est déjà pour un tiers à la recherche technologique, pour laquelle des robots sont utilisés pour travailler sur des milliards de cellules en même temps. On peut tester en parallèle, dans tout essai de criblage, jusqu’à 70 000 molécules potentiellement thérapeutiques ».
Il précise : « Nous entrons sur le terrain industriel des tests de médicaments, qu’il s’agisse de toxicologie, où nous avons déjà obtenu des résultats intéressants, ou de tests de criblage sur des cellules porteuses de maladies génétiques. Il s’agit encore de preuve de concept, mais elle intéresse déjà les industriels, comme nous l’ont fait savoir les représentants des directions des laboratoires Servier, Sanofi, GSK et Roche ».
Selon M. Marc Peschanski, ce changement d’échelle offre des possibilités nouvelles d’applications en thérapie cellulaire. La production d’épiderme pour traiter par thérapie cellulaire est une indication majeure non seulement pour les lésions cutanées des grands brûlés dont le nombre de bénéficiaires potentiels est limité, mais aussi pour les ulcérations cutanées des patients atteints de drépanocytose ou de diabète, des dizaines de millions de personnes étant là potentiellement concernées. Il serait également possible de traiter certains accidents vasculaires cérébraux.
2. Les technologies avancées de tri
Pour M. Daniel Louvard52, il est possible d’identifier, au sein d’un tissu tumoral, une population minoritaire de cellules que l’on peut transplanter d’un animal à un autre pour régénérer une tumeur, ce qui a des conséquences considérables sur la façon d’envisager le traitement des cancers. Or, « ce type de recherches et d’analyses n’aurait pas pu être conduit sans deux avancées majeures, issues de la recherche fondamentale sur les cellules souches normales : d’une part, l’identification de marqueurs de surface par les hématologistes et les immunologistes, et d’autre part, l’apparition de technologies avancées de tri et d’identification cellulaires, la cytométrie de flux, encore appelée analyse par FACS (Fluorescence Activated Cell Sorting) ».
La mission a pu observer ces outils en fonctionnement lors des visites de laboratoires qu’elle a effectuées en France et à l’étranger.
3. La création de bio banques et de banques de sang de cordon
a) La création de bio banques pour la recherche
Le nombre de lignées de cellules souches humaines fiables utilisées pour la recherche est actuellement limité. Depuis près de dix ans, les scientifiques ont essayé d’en créer de nouvelles par clonage thérapeutique sans beaucoup de succès. Cette technique, relativement efficace dans un certain nombre d’espèces animales, se heurte à des difficultés inattendues avec les cellules humaines.
Grâce à la nouvelle technologie de reprogrammation cellulaire (les iPS), les espoirs de créer de nouvelles lignées de cellules souches d’origine humaine renaissent.
Pour autant même si la recherche avance, il reste encore bien des obstacles à surmonter avant d’entrer dans les phases pré-cliniques et cliniques préalables à la commercialisation de produits à base de cellules souches.
Une banque centralisant et distribuant les cellules souches, accessible aux chercheurs et qui serait un interlocuteur pour les instances nationales et internationales, simplifierait les démarches administratives et offrirait d’intéressantes possibilités de prospective. Plusieurs pays se sont dotés de banques de cellules pour faciliter la recherche et accroître les synergies entre les équipes.
La plupart des chercheurs souhaitent disposer, grâce à ces banques nationales ou internationales, de données cellulaires recensant le patrimoine génétique de milliers de maladies que l’on ne peut à ce jour étudier faute de cellules en nombre suffisant.
b) La création de banques de sang de cordon allogénique
Comme l’ont souligné le rapport précité de l’OPECST sur la loi bioéthique de demain et celui de la Mission d’information de l’Assemblée nationale sur la révision de la loi relative à la bioéthique, la collecte de sang de cordon est encore insuffisante en France. Bien qu’en constante augmentation depuis 2005, collecte et stockage restent faibles (6 400 unités en cumulé en 2007). La France est encore en retard en termes d’unités stockées par habitant (16ème rang mondial en 2007). Seulement 25 à 30% des échantillons prélevés seront utilisables (c’est-à-dire validés et stockés), car le volume obtenu par échantillon est trop réduit. En outre, plus de la moitié des cordons ne contiennent pas de cellules souches.
Les greffons peuvent aussi provenir de l’étranger ; le principal problème en ce cas est financier, car les greffons importés de l’étranger sont deux fois plus onéreux que les greffons français, pour des raisons logistiques. Or, plusieurs greffons doivent être administrés à un même patient, comme l’a rappelé M. Jacques Caen53. Les «bigreffes» sont courantes en routine. En 2007, 55% des greffes étaient réalisées avec deux greffons. Le nombre de greffons maximal utilisés est de 7 (en recherche).
On compte 8 banques de sang de cordons en France contre 3 en 2008 ; elles sont gérées soit par les Établissements français du sang (EFS) ; soit par des structures hospitalières (AP-HP ou CHU), créées en 2008 et 2009.
Nous ne pouvons que souscrire à la recommandation de l’Académie nationale de médecine54 qui prévoit d’organiser la collecte, la conservation, la distribution des cordons, des placentas et de leurs dérivés, en créant des centres de ressources biologiques spécifiquement dédiés à ces missions. Elle suggère judicieusement d’informer largement les parents dans les maternités de l’utilité du don de cordon et de placenta pour poursuivre et amplifier la recherche sur les cellules souches humaines, avant de leur demander l’autorisation de procéder à la collecte.
En revanche, l’interdiction du prélèvement et de la conservation du sang de cordon à des fins autologues doit être maintenue, voire renforcée. En effet l’Agence de la biomédecine a constaté des dérives mercantiles inquiétantes que nous dénonçons fermement. Des promesses sont faites à des femmes dans des conditions douteuses, alors qu’elles viennent d’accoucher.
Il n’y a aucune garantie de conservation dans des conditions satisfaisantes des cordons ainsi prélevés. Lors de notre mission en Israël, où cette pratique est répandue, les personnalités que nous avons interrogées se sont montrées très réservées, parfois gênées. Elles ont estimé qu’il s’agissait de dérives mercantiles. Quant à la solution des banques mixtes liant conservation autologue et allogénique, elle paraît a priori intéressante, mais n’est pas adéquate car un seul cordon suffit rarement pour procéder à une greffe, et il est peu réaliste d’envisager un partage.
Recommandation n° 2:
Il convient :
– de maintenir l’interdiction du prélèvement et de la conservation du sang de cordon à des fins autologues ;
– d’informer les parents dans les maternités de l’utilité du don de cordon et de placenta pour poursuivre des recherches, avant de demander le
consentement à la collecte ;
– de veiller à assurer la gratuité de la collecte et de la conservation de ces produits ;
– d’organiser la collecte, la conservation, la distribution des cordons et de leurs dérivés ;
– de créer des bio banques et des centres de références accessibles aux
chercheurs, pour favoriser les recherches menées en France, ainsi que la coopération internationale.
4. L’implication des industriels
Il est apparu que l’industrie pharmaceutique était très en retrait par rapport aux recherches sur les cellules souches en dehors du criblage. Il leur apparaissait même qu’elle rachetait certains brevets pour les mettre en réserve afin d’éviter que des développements ne se produisent trop rapidement. Ce point n’a été démenti ni par les personnalités rencontrées aux États-Unis, ni par celles rencontrées en Israël, ni par celles rencontrées au Royaume-Uni.
La démarche actuelle des industriels pharmaceutiques décrite par nos interlocuteurs, à l’étranger comme en France, implique principalement des partenariats plutôt que des développements en interne. Les industriels pharmaceutiques attendent un succès clinique concret d’une société de biotechnologie (biotech) de thérapie cellulaire avec un modèle économique proche de celui de l’industrie pharmaceutique. Ils suivent particulièrement les sociétés développant des produits cellulaires allogéniques, permettant une distribution large et simplifiée, n’exigeant pas d’installations techniques complexes et pouvant être administrés à un grand nombre de patients, contrairement aux produits cellulaires autologues qui suivent le paradigme « un produit pour un patient ». Coûteux à court terme, de tels produits pourraient être rentables, s’ils guérissent définitivement le patient sans recours à des traitements tout au long de la vie.
b) Des tentatives d’investissements
D’après les entreprises du médicament, le LEEM55, les industriels pharmaceutiques investissent de plus en plus dans la thérapie cellulaire, mais les montants dédiés sont encore limités. À titre d’exemple, Pfizer investit 100 millions de dollars dans son unité Pfizer Regenerative Medicine. Cette unité est spécialisée dans les pathologies cardiaques et dégénératives du système nerveux central, pour un budget total de recherche et développement (R&D) annuel d’environ 8 milliards de dollars pour l’ensemble de la société, alors que le budget total de développement d’un produit pharmaceutique « conventionnel » est estimé à 1 milliard de dollars.
Il existe maintenant des divisions clairement labellisées « médecine régénérative » chez Sanofi Aventis et Roche. Ces sociétés s’intéressent aux iPS, mais aussi aux cellules mésenchymateuses, en raison de leurs éventuelles propriétés immuno modulatrices.
Tous les industriels pharmaceutiques sont à la recherche de modèles cellulaires plus prédictifs, c’est-à-dire plus proches de la réalité biologique, et donc permettant de mieux comprendre les mécanismes biologiques liés à l’action des molécules actives. Les modèles issus de cellules souches permettent d’avancer sur cette voie, mais des efforts de R&D importants sont encore à fournir.
Un exemple de partenariat en France est l’accord signé en juin 2009 entre I-Stem et Roche (d’un montant de 7,5 millions d’euros sur deux ans) pour le criblage des molécules de Roche sur les modèles cellulaires de pathologies neuronales d’I-Stem.
C. LES ENJEUX MÉDIATIQUES ET LEURS RÉPERCUSSIONS
« Il ne se passe pas de semaine sans que la presse non scientifique rapporte et publie un essai portant sur une pathologie ou une autre, le cœur, le foie, l’œil, l’oreille, etc. Ces essais ont plusieurs caractéristiques communes : ils concernent très peu de patients, cinq, dix, voire quinze; ils impliquent une petite société de biotechnologie cherchant à valoriser ses résultats ». Tel est le constat de M. Philippe Menasché56, constat alarmant que nous avons également fait. Trop d’espoirs ont sans doute été soulevés dans l’opinion publique pour des applications thérapeutiques à court terme utilisant des cellules souches embryonnaires humaines. Il est indispensable désormais d’informer la société civile sur les limites actuelles de l’utilisation thérapeutique des cellules souches, et sur la nécessité de progresser davantage dans les connaissances fondamentales avant de pouvoir envisager des applications cliniques encore trop peu maîtrisées.
1. Une recherche médiatisée suscitant des espoirs
La recherche sur les cellules souches offre un immense potentiel pour le développement de nouvelles thérapies applicables à des maladies et lésions graves. L’attention accordée dans les médias aux premières recherches réalisées sur les cellules souches a suscité de grands espoirs chez de nombreux patients atteints de maladies incurables et d’affections très invalidantes. Les patients et leur famille peuvent avoir des attentes irréalistes, lorsqu’ils prennent part à des essais cliniques sur des thérapies expérimentales.
Le passage aux essais cliniques exige des protocoles spécifiques. En outre dans tous les domaines de la médecine, l’aboutissement d’une intervention expérimentale de premier stade, en pratique médicale standard acceptée, est un processus long et complexe, qui nécessite habituellement de nombreuses années d’essais pré cliniques et cliniques rigoureux. Ce processus est ponctué de nombreux reculs et échecs. Ce n’est qu’avec le temps que la plupart des nouveaux traitements cliniques deviennent des traitements acceptés par les professionnels de la santé.
Or, nos sociétés s’accommodent mal de ce tempo, d’autant que la diversité des publicités vantant les mérites des cellules souches dans des domaines parfois futiles, incite à banaliser leur usage dans les esprits.
Les textes de loi qui exigent en France et dans d’autres pays des visées thérapeutiques pour autoriser les recherches sur l’embryon et les CESh ajoutent à la confusion des esprits ; ce critère est nuisible et nous l’avons dénoncé à maintes reprises sans être entendus. Nous le déplorons. On se reportera à nos recommandations visant à clarifier le régime de ces recherches.
2. L’existence inquiétante d’un tourisme cellulaire
De nombreuses cliniques dans le monde exploitent l’espoir suscité par la prétention d’offrir de nouvelles thérapies efficaces à base de cellules souches pour les pathologies graves, sans justification scientifique crédible, sans transparence, sans supervision et sans protection pour les patients. Ce sont parfois des essais cliniques sauvages.
Le tourisme cellulaire existe. Les personnes en situation désespérée car on leur a expliqué que l’on ne pouvait plus rien pour elles, pianotent sur Internet et se laissent piéger par des sociétés très bien organisées. D’après M. Philippe Menasché : « On leur fait payer le billet d’avion, les trois nuits à l’hôtel, l’injection de cellules dont on ignore ce qu’elle contient, et leur retour. Des patients atteints de pathologies graves courent ainsi des dangers physiques, psychologiques et financiers. Ils s’exposent à des « thérapies » à base de cellules souches non éprouvées et au manque de transparence scientifique et de responsabilité professionnelle de ceux qui se lancent dans de telles activités ».
La commercialisation d’inventions à base de cellules souches non éprouvées est particulièrement inquiétante, lorsque des patients souffrant de maladies ou de lésions graves se rendent dans des pays étrangers pour suivre de prétendus traitements ou thérapies qui ne font pas partie du domaine de la pratique médicale standard. Les patients qui obtiennent des services médicaux à l’étranger sont particulièrement vulnérables, puisque la réglementation et la supervision locale de ces cliniques peuvent être insuffisantes. De plus, certains pays ne disposent d’aucun système de réclamation pour négligence médicale ; la responsabilité du suivi des patients étrangers peut même être atténuée.
Il semblerait qu’en Inde et en Chine, les essais cliniques se développent dans une « anarchie légale » ; à Taiwan, un tourisme thérapeutique se mettrait en place, avec pignon sur rue. Certaines compagnies privées vantent le bénéfice de ce genre de thérapies. Une information sur les risques encourus est nécessaire, d’autant qu’il est malaisé de déceler ces pratiques malhonnêtes.
Recommandation n° 3:
Il convient :
– d’informer le public sur les risques encourus lors de thérapie cellulaire proposée à l’étranger via Internet ;
– qu’une veille par les services compétents de l’Agence de biomédecine soit instaurée sur ces pratiques .
V. LES ESSAIS CLINIQUES EN COURS
Les premiers essais cliniques utilisant les dérivés des CSEh devraient débuter dans les cinq prochaines années, et les essais cliniques avec les cellules souches mésenchymateuses, qu'elles soient d'origine fœtale ou adulte, se poursuivront parallèlement. Pour ces derniers, des essais randomisés (phase II/III) permettront une conclusion statistiquement validée sur leur réel bénéfice thérapeutique dans différentes indications (notamment la maladie de Crohn, la sclérose en plaques, le diabète). Ils permettront, en outre une appréciation des bénéfices comparés des cellules souches mésanchymateuses (CSM) d'origine adipeuse, médullaire ou fœtale (cordon). Les premiers essais cliniques de CSM pour la réparation osseuse, en association avec des biomatériaux, devraient également débuter.
A. LES CELLULES SOUCHES ADULTES
Le tableau suivant résume l’état des essais cliniques pour les cellules souches adultes.
CELLULES |
ACTIONS |
EXEMPLES DE MALADIES CIBLÉES |
RÉSULTATS |
Cellules souches mésenchymateuses (moelle osseuse, sang placentaire) |
Remplacement os, cartilage |
Ostéo nécrose tête fémorale/pertes osseuses |
Essais en cours et bio-ingénierie |
Immuno modulation, Anti-inflammatoire |
- Induction tolérance (greffes organes/CSH) - Maladies inflammatoires (Crohn) |
Essais cliniques en cours (bénéfices GVH) | |
Action trophique |
Stimulation réparation spontanée (ischémie rénale, cerveau, insuffisance cardiaque) |
Essais en cours co-injection avec autres CS | |
Vecteurs de drogues cytotoxiques |
Cancers (gliomes) |
Essais en cours | |
Cellules souches hématopoïétiques (autologues /allogéniques) |
Multiples indications hématologiques et immunologiques, thérapie génique |
Déficits immunitaires, hémoglobinopathies, VIH, adrénoleucodystrophies |
Validation thérapeutique Succès |
Cellules souches épidermiques (autologues) |
Réparation transitoire ou permanente |
Brûlures |
Validation thérapeutique |
Thérapie génique |
Maladies génétiques (épidermolyses huileuses) |
Succès | |
Cellules souches neurales (neurosphères allogénques) |
Remplacement de neurones ou action trophique (sécrétion paracrine) |
Lipofuscinose Ischémie cérébrale |
Essais Phase l - ll en cours |
Progéniteurs cardiaques (biopsies myocardiques) |
Insuffisance cardiaque |
Essai en cours phase I |
Source : rapport de l’Agence de la biomédecine
au Parlement et au Gouvernement, avril 2010
Les essais de phase I sur les cellules souches adultes restent positifs en raison des enseignements qu’ils permettent de tirer.
D’après M. Philippe Menasché57, les essais de phase II/III actuellement enregistrés sur le site américain clinicaltrials.gov ont été actualisés. De ces essais, on peut vraisemblablement attendre des résultats qui, quels qu’ils soient, seront intéressants et interprétables dans la mesure où ils portent sur un nombre plus élevé de patients, avec de vrais groupes contrôles placebos et des évaluations menées conformément aux règles méthodologiques devant présider aux essais thérapeutiques. Les pathologies concernées sont très diverses : 174 essais concernent le cœur, 74 essais le foie, 26 essais l’œil, 11 essais les défaillances ostéo-articulaires, et 7 essais l’artériopathie des membres inférieurs.
Dans la majorité des cas, les cellules utilisées sont des cellules souches médullaires, et très souvent des cellules souches mésenchymateuses.
B. LES CELLULES SOUCHES EMBRYONNAIRES
Quatre essais cliniques sont sur le point d'être autorisés aux États-Unis par la Food and Drug Administration (FDA), tous menés par des sociétés pharmaceutiques en collaboration avec des équipes académiques. Un essai clinique est en cours d’examen en France.
Trois de ces cinq essais peuvent être commentés à la lumière des informations recueillies au cours des auditions.
- Essais cliniques envisagés avec les CSEh dans les 5 ans |
|||
PHÉNOTYPE DES CELLULES THÉRAPEUTIQUES |
MALADIE |
COMPAGNIE/ LABORATOIRE |
PAYS |
Précurseurs d'oligodendrocytes |
Traumatisme de la moelle épinière |
Géron Corporation |
États-Unis |
Précurseurs des cellules beta du pancréas (insuline) |
Diabète (cellules encapsulées) |
Novocell |
États-Unis |
Précurseurs de l'épithélium pigmentaire de la rétine |
Dégénérescence maculaire liée à l'âge |
États-Unis et Royaume-Uni | |
Précurseurs de cardiomyocytes |
Insuffisance cardiaque ischémique |
Inserm/APHP |
France |
Précurseurs de l'épithélium pigmentaire de la rétine |
Stargardt's macular dystrophy (SMD) |
Advanced Cell Technology |
États-Unis phase l-ll |
Source : rapport de l’Agence de la biomédecine
au Parlement et au Gouvernement avril 2010
Le premier essai clinique utilise des cellules embryonnaires humaines pré-différenciées en oligodendrocytes pour réparer des lésions traumatiques de la moelle. Il est mis en oeuvre par la société Geron, qui avait obtenu l’accord de la FDA. D’après les responsables de la FDA, rencontrés au cours de notre mission aux États-Unis58, il a été suspendu à la demande de la société elle-même, qui souhaite mener un certain nombre d’essais précliniques complémentaires. L’injection de cellules aurait provoqué, chez l’animal, des kystes, et non des tératomes. Mais les responsables de la FDA se sont montrés très discrets à ce sujet.
Cette discrétion serait liée à des raisons de propriété intellectuelle, ce qu’a confirmé M. Philippe Menasché59 : « La société Geron a été formidablement discrète sur les procédures utilisées, non pas tant pour transformer les cellules indifférenciées en oligodendrocytes, que pour ensuite les trier. On sait néanmoins que leur procédé de purification n’est peut-être pas optimal. S’agit-il d’un effet d’annonce ? Je ne le sais pas, mais ce ne serait pas impossible de la part de cette société, qui, dans le passé, nous y a habitués. Depuis le début, l’on s’étonne du choix de la lignée effectué par cette équipe, car il s’agit d’une lignée très ancienne, la lignée H1, connue pour ne pas être stable sur le plan génétique. Je n’ai pas l’explication du choix de cette lignée, mais il est très curieux ». Il observe qu’« on peut être inquiet à propos de cet essai parce qu’on n’a pas la certitude que toutes les garanties précliniques aient été prises. Leur étude est notamment menée sur le rat et la souris, et non sur un gros animal, ce qui serait impossible en France ». Cet essai devrait reprendre au cours de l’été 2010 ou, en tout cas, avant la fin de l’année 2010.
Le second essai concerne la dégénérescence maculaire de l’adulte. Il utilisera des cellules souches embryonnaires humaines pré-orientées pour devenir des progéniteurs rétiniens. À cet égard, une équipe de chercheurs de l'Université de Californie à Irvine (UCI) a réussi à recréer une rétine à partir de cellules souches embryonnaires. L'assemblage tridimensionnel obtenu par les chercheurs de UCI constitue une version précoce de la rétine. Ce résultat constitue une première dans le domaine de la recherche sur les cellules souches. L'assemblage a alors été testé par des méthodes d'immuno-histochimie afin de vérifier les niveaux d'expression de certains facteurs de transcription et marqueurs cellulaires spécifiques aux différents types de cellules constituant la rétine.
La présence de facteurs de transcription spécifiques du développement rétinien a confirmé la composition de l'assemblage. Les chercheurs de UCI viennent d’initier la phase d'essais sur modèle animal afin de tester les effets thérapeutiques d'une greffe de rétine utilisant leur assemblage tridimensionnel comme greffon. Le succès de cette étape pourrait mener à la conduite d'essais cliniques. Les chercheurs espèrent à terme pouvoir développer une technique de culture de rétine à base de cellules souches afin de traiter un grand nombre de troubles de la vision issus d'un endommagement ou d'une dégénérescence de la rétine. Aujourd'hui plus de 10 millions de personnes souffrent de dégénérescence maculaire, première cause de cécité chez les plus de 55 ans.
Le troisième essai vise l’insuffisance cardiaque. Il est en cours de préparation par l’équipe de M. Philippe Menasché. L’objectif global est de mieux comprendre les aspects fondamentaux de la différenciation cardiaque des cellules souches pluripotentes, puis d’utiliser les données obtenues pour mettre au point de nouvelles stratégies thérapeutiques applicables en clinique humaine. Le projet se décompose en deux parties principales. La partie fondamentale, sous la direction de M. Michel Pucéat, a pour objectif l’étude des mécanismes génétiques, épigénétiques et biomécaniques qui interviennent dans la différenciation cardiogénique des cellules souches embryonnaires humaines (CSEh) ou des cellules somatiques reprogrammées. Cette étude vise à une meilleure compréhension de ces pathologies, et à l’identification de nouvelles cibles cellulaires accessibles à la pharmacologie traditionnelle. À terme, elle a pour objectif de proposer de nouvelles cibles thérapeutiques.
La partie translationnelle préclinique du projet se propose de développer des techniques permettant de transférer dans des conditions optimales les cellules candidates issues de ces travaux fondamentaux, et d’en limiter le rejet quand elles sont allogéniques. Le projet vise à tester différentes approches qui incluent notamment des matrices cellularisées et l’encapsulation des cellules. Dans le domaine de l'artériopathie critique des membres inférieurs, le projet est ciblé sur l'utilisation de cellules allogéniques encapsulées, avec pour objectif l'exploitation des effets paracrines des cellules.
C. LES IPS : ABSENCE D’ESSAI CLINIQUE
1. Des manipulations complexes
La plupart des chercheurs estiment que l’utilisation des iPS dans le cadre d’essais cliniques est une perspective lointaine. A priori, les problèmes pratiques posés par l’utilisation clinique des iPS sont identiques à ceux des cellules embryonnaires. En effet, une fois que l’on a reprogrammé la cellule, il faut encore régler trois problèmes majeurs : l’amplification dans des conditions de Good Manufacturing Practice (GMP) ; la spécification pour aller vers tel ou tel type cellulaire ; le tri pour obtenir une population de cellules purifiées. À ces difficultés, s’ajoute la problématique de la reprogrammation.
Comme l’a montré M. Eran Meshorer60, chercheur à l’Université hébraïque de Jérusalem, la technique des cellules iPS générées peut être utilisée pour remplacer des cellules lésées, ou pour modifier des cellules porteuses de maladies, en médecine régénératrice. Cependant, les iPS présentent le risque de reprogrammation incomplète qui peut empêcher la différenciation des cellules dans la voie désirée, et accroître le risque de formation de tératome. Il est actuellement difficile d’évaluer précisément si une cellule est correctement reprogrammée ou non. Les méthodes les plus efficaces pour produire des iPS nécessitent une modification génétique. Or l’intégration des transgènes dans le génome peut aussi favoriser le «réveil» d’autres oncogènes. L’expression non contrôlée peut engendrer l’émergence de cancers iPS.
Des technologies sans transfert de gènes ont été développées ces deux dernières années. Les cellules ne seraient plus génétiquement modifiées, ce qui élimine les risques liés à l’intégration des gènes dans le génome des patients et réduit les problèmes éthiques. Les premières expériences fondées sur ces technologies utilisent des produits chimiques modulant les histones. Il semble possible de se soustraire complètement de la génétique, en apportant au milieu de culture les protéines codées par les gènes. Ces méthodes moins dangereuses sont nettement moins efficaces, et restent encore à un stade très fondamental, car le nombre de cellules induites est extrêmement faible et les quantités de protéines nécessaires sont considérables.
M. Michel Revel61, professeur à l’Institut Weizmann, membre de la commission de bioéthique de l’UNESCO, s’est montré optimiste quant à la possibilité de dépasser les problèmes inhérents aux iPS ; il estime possible des essais cliniques dans quatre à cinq ans en utilisant des procédés d’encapsulation des cellules.
2. Des interrogations sur les similitudes avec les CSE
D’après Mme Laure Coulombel62 : « les iPS étant un artefact, elles ne seront de toute façon pas identiques aux cellules souches embryonnaires, mais la question est de savoir si elles peuvent les remplacer. Or, aujourd’hui, cette interrogation demeure sans réponse ». Elle précise : « on obtient des iPS humaines très facilement; dans notre laboratoire, toutes les équipes ont aujourd’hui accès à une quinzaine de lignées ; nous nous efforçons de déterminer si ces cellules sont ou non différenciables, et donc si tous les protocoles qui devraient être applicables en théorie, et qui réussissent avec les cellules souches embryonnaires, le sont réellement. À ce jour, ils ne le sont pas ».
Elle ajoute : « Cette situation ne permet évidemment pas d’arrêter toute recherche utilisant des cellules souches embryonnaires pour se concentrer sur les seules iPS. Non seulement toutes les voies de recherche doivent être poursuivies, mais le potentiel théorique des iPS reste à concrétiser. Mieux vaut démontrer son effectivité puis définir, pour chaque nouvelle application, quel type de cellule est préférable pour quel objectif thérapeutique. En général, on poursuit plusieurs expérimentations en même temps, et on choisit la meilleure méthode ».
Au cours des deux dernières années, les recherches ont tendu à vérifier que la reprogrammation qui aboutit à la création de cellules proliférantes, dotées de capacités de différenciation, reproduisait effectivement ce qu’il advient lors des premières étapes de développement de l’être humain.
3. Des enjeux éthiques importants
Optimiste quant aux potentialités futures des iPS (voir ci dessus), M. Michel Revel63 a insisté sur les interrogations éthiques que suscitera le recours aux iPS en clinique. Il en a montré tous les inconvénients.
L’utilisation d’iPS implique un donneur vivant et une série de consentements informés. Or, il est difficile de prédire à l’avance vers quel type de cellules chaque don sera dirigé, ce qu’il adviendra en cas de conservation longue d’une lignée dérivée, voire en cas de transformation d’iPS en gamètes, induisant un clonage d’une autre manière.
M. Michel Revel a fait état de nouvelles méthodes de reprogrammation utilisables dans le traitement de l’infertilité masculine par ponction testiculaire et reprogrammation qui aurait eu lieu par hasard. Il y voit des risques de clonage.
TROISIÈME PARTIE : LES ASPECTS INTERNATIONAUX ; PANORAMA DES LÉGISLATIONS ET DES RECHERCHES
I. L’INTERNATIONALISATION DE LA RECHERCHE SUR L’EMBRYON ET LES CELLULES SOUCHES
A. LA PROBLÉMATIQUE DES BREVETS
Le développement de la recherche sur les cellules souches adultes et embryonnaires offre d’importantes promesses thérapeutiques à long terme. Les investisseurs potentiels dans le domaine des biotechnologies souhaitent avoir la certitude d’une protection juridique des inventions par le brevet, comme cela a été le cas dans le domaine de la recherche sur les séquences géniques. Pour autant, la spécificité de l’origine des cellules embryonnaires met en jeu l’éthique, notamment en France. Le principe de non marchandisation du vivant, auquel nous sommes attachés, est remis en cause aux États-Unis.
a) Évaluation des dépôts de brevet sur les cellules souches
D’après M. Philippe Menasché64 : « il ressort d’une cartographie des brevets établie en fonction du type cellulaire intéressé que la majorité des brevets couvre les cellules souches hématopoïétiques. Les brevets sur les cellules souches embryonnaires sont assez peu fréquents et concernent exclusivement les procédés de préparation, d’amplification, de spécification ou de tri, et non les cellules elles-mêmes.».
Il précise : « si l’on ne tient pas compte de tous les brevets japonais sur les iPS, sur les mille et quelques brevets mondiaux déposés, vingt sont considérés comme véritablement pertinents pour l’étude des cellules souches adultes ou embryonnaires. Sur ces vingt brevets, on compte seize brevets américains, trois brevets canadiens et un brevet israélien. Il n’y a malheureusement pas de brevet français. Si le manque de visibilité de la position française, telle qu’elle s’exprime au travers de la loi actuelle, perdurait, notre compétitivité internationale pourrait en pâtir du fait de la formulation ambiguë de la loi. Et nous risquerions de continuer à ne pas figurer dans le peloton de tête en matière de protection intellectuelle et de valorisation, malgré les travaux bien réels des équipes de recherche ».
D’après Mme Hélène Gaumont-Prat65, professeur de droit, directrice du laboratoire de droit médical et de la santé de Paris VIII, des recherches montrent qu’en 2005, une enquête britannique avait recensé plus de 18 000 brevets dans le monde ; au niveau de l’Office européen des brevets, quelques centaines de demandes de brevets sur les cellules souches humaines ont été déposées, tandis qu’on ne compte que 26 dépôts de brevets français auprès de l’Institut national de la propriété industriel (INPI) durant la période 1999-2008. Cela correspond à une moyenne oscillant entre 0 et 5 dépôts de brevets par an, ce qui est assez peu. Sur ces 26 brevets, 7 ont été délivrés par l’INPI et sont en vigueur. Les autres ont été soit rejetés, soit déchus, ou se trouvent encore en cours d’examen.
Les brevets ne peuvent pas porter sur la matière vivante elle-même, telle qu’elle existe dans la nature. Ils portent sur des procédés d’isolement de cellules souches à partir d’embryons ou de tissus, des procédés d’enrichissement en cellules souches de mélanges de cellules, des procédés de culture de cellules souches, des procédés de modification génétique de cellules souches, des procédés d’induction de la différenciation de cellules souches, des procédés d’induction de cellules souches adultes pour les soumettre à la rétrodifférenciation ou la transdifférenciation, des procédés de transformation de cellules somatiques en cellules souches.
Les demandes de brevets sur des produits portent sur des cellules souches, des compositions comprenant des cellules humaines et un additif des lignées de cellules souches, des cellules souches différenciées, et des cellules souches génétiquement modifiées. Les inventions peuvent également porter sur des utilisations de cellules souches (usage thérapeutique notamment).
La plupart des dépôts s’effectuent directement auprès de l’Office européen des brevets (OEB). Il ressort des bases de données de l’OEB que, sur les 200 dépôts de brevets relatifs à des cellules souches humaines, l’Office n’en a délivré pour l’instant que 48, qui sont essentiellement d’origine américaine ou anglaise. Aucun n’a été déposé par un Français, ni ne désigne un inventeur français.
2. Les exclusions de la brevetabilité
Un principe général du droit des brevets exclut en France les simples découvertes du domaine de la brevetabilité (articles L.611-10 du code de la propriété intellectuelle, et L. 611-18 du même code pour les éléments du corps humain). Les cellules souches, telles qu’elles existent au sein d’un embryon ou dans le corps humain, ne peuvent donc pas être brevetées. En revanche, le fait d’extraire ces cellules, de les purifier puis de les multiplier en dehors du corps humain ou de l’embryon nécessite des procédés techniques extrêmement pointus. Ces procédés conduisent à un résultat différent de celui présent dans le corps, puisque l’élément obtenu est isolé, purifié, parfois modifié et rendu de la sorte utilisable dans un cadre thérapeutique.
a) L’utilisation d’embryons humains à des fins industrielles ou commerciales.
D’après M. Fabrice Claireau66, directeur des affaires juridiques et internationales à l’INPI, des lignées de cellules souches embryonnaires ont été brevetées à l’Office américain des brevets (l’USPTO, United States Patent and Trademark Office), mais cela n’a été le cas ni à l’Office français, ni à l’Office européen des brevets (OEB). Les cellules souches ne peuvent faire l’objet d’un dépôt de brevet que pour autant qu’elles sont isolées du corps, c’est-à-dire extraites et reproduites artificiellement in vitro, dans le cadre de procédés techniques conduits par l’homme. Cette exclusion est sujette à interprétation, elle peut, dans une acception large, interdire tout dépôt de brevet portant sur des CSEh, de quelque type que ce soit.
À l’échelon européen, l’OEB a pratiqué de la même manière car la directive européenne de 1998, directive 98/44/CE, a été intégrée dans le règlement d’exécution de la convention sur le brevet européen, et constitue donc un corpus de règles applicable aux brevets européens. La décision WARF (Wisconsin Alumni Research Foundation) G0002/6 de la grande chambre de recours de l’OEB du 25 novembre 2008, a précisé l’interprétation que l’Office devait donner de cette exclusion : « doit être refusé tout brevet portant sur des cellules souches embryonnaires qui, au jour du dépôt de la demande, (en l’occurrence en 2003), ne peuvent être obtenues que par destruction initiale d’un embryon. L’exclusion s’applique quand bien même la méthode d’obtention des cellules souches, et donc de destruction de l’embryon, n’est pas revendiquée par le brevet ».
L’Office britannique, quant à lui, a récemment modifié sa pratique, pour tirer les conséquences de cette décision, car auparavant il acceptait de délivrer des brevets portant sur des cellules souches pluripotentes isolées. Désormais, il n’accepte de tels brevets qu’à la condition que les cellules puissent être obtenues à partir de méthodes n’impliquant pas la destruction d’un embryon humain, par exemple à partir de lignées déjà établies et déposées dans une banque cellulaire reconnue. Par ailleurs, il refuse de délivrer des brevets sur des procédés d’obtention de cellules souches embryonnaires humaines, ainsi que sur des cellules souches totipotentes. Ceci nous a été confirmé par M. Gerry Kamstra, avocat associé (Bird & Bird) et M. Julian Hitchcok, avocat associé (Field Fisher Waterhouse)67. Ces deux avocats britanniques spécialistes des brevets étaient également des scientifiques, ce qui est rare en France. Ils ont insisté sur la complexité des procédures de dépôt de brevets, et les risques de contentieux que cela induit.
L’Office allemand a, pour l’instant, une pratique équivalente à celle de l’office britannique. À la suite d’une décision de la Cour fédérale des brevets, il refuse de délivrer des brevets portant sur des cellules souches embryonnaires humaines. Toutefois, cette décision de la Cour fédérale des brevets a fait l’objet d’un recours devant la Cour suprême fédérale ; celle-ci a décidé de saisir la Cour de justice de l’Union européenne (CJUE) d’une question préjudicielle quant à l’interprétation qu’il convient de donner à la directive 98/44/CE, notamment à la disposition qui exclut de la brevetabilité les utilisations d’embryons humains à des fins industrielles et commerciales. Les questions sont les suivantes : quels stades de développement de l’œuf le terme « embryon » vise-t-il ? Couvre-t-il également le stade du « blastocyste », stade au cours duquel il n’y a plus de cellules souches pluripotentes susceptibles de reconstituer un organisme entier ? L’extraction de cellules souches constitue-t-elle nécessairement une « utilisation » de l’embryon ? Une utilisation à des fins de recherche ou dans un but thérapeutique constitue-t-elle une exploitation industrielle et commerciale ?
Pour l’INPI, la réponse à cette question préjudicielle est fondamentale. C’est d’ailleurs la raison pour laquelle l’Institut a arrêté de délivrer des brevets français portant sur des cellules souches embryonnaires humaines et a demandé aux déposants d’exclure ces cellules du texte du brevet. Il attend la décision de la CJUE pour se prononcer définitivement sur les brevets qui sont en cours d’examen, notamment sur les brevets qu’il envisageait de rejeter, les déposants ayant refusé de limiter leurs revendications quant au champ de leur brevet.
La pratique de l’Office américain (USPTO) est très différente : la brevetabilité du vivant y est très largement admise, y compris en ce qui concerne les cellules souches humaines, embryonnaires comme adultes. Une décision de la Cour suprême de 1980 a défini la pratique de l’Office américain en matière de brevetabilité, lequel s’y réfère toujours dans ses directives. Contrairement à l’OEB, il a délivré trois brevets portant sur des cellules souches embryonnaires au profit de la WARF (Wisconsin Alumni Research Foundation). La seule limite que l’on trouve dans les directives publiées par l’Office américain concerne les inventions qui peuvent être raisonnablement interprétées comme englobant l’être humain dans sa totalité, ce qui est flou et difficile à interpréter. En outre, une réforme du droit des brevets est actuellement débattue au Congrès ; elle pourrait influer sur le champ des brevets.
b) L’exclusion du corps humain, aux différents stades de sa constitution et de son développement
Cette exclusion conduit à écarter de la brevetabilité les CSEh totipotentes. (directive de 1998 et article L.611-18 du code de la propriété intellectuelle). Si elles sont réintroduites in vivo, ces cellules ont en effet la capacité de reconstituer un organisme entier : elles peuvent ainsi être considérées comme le corps humain au premier stade de son développement.
c) Les procédés de clonage des êtres humains
Les procédés permettant d’obtenir des cellules souches embryonnaires à partir de transferts nucléaires ne sont pas brevetables, de même que les cellules souches ainsi obtenues (directive de 1998 et article L.611-18 du code de la propriété intellectuelle).
3. Les limitations quant à la portée des brevets
Comme en matière de biotechnologie, le brevet voit sa portée limitée par rapport à ceux délivrés dans d’autres secteurs technologiques. La loi du 6 août 2004 (article L.611-18 précité) a précisé que « seule une invention constituant l’application technique d’une fonction d’un élément du corps humain peut être protégée par brevet. Cette protection ne couvre l’élément du corps humain que dans la mesure nécessaire à la réalisation et à l’exploitation de cette application particulière. Celle-ci doit être concrètement et réellement exposée dans la demande de brevet». Les brevets sont donc restreints à une fonction et à une application technique précises.
Si un procédé d’utilisation ou une lignée de cellules souches adultes, isolées du corps humain, peut faire l’objet d’un dépôt de brevet, c’est à la condition d’indiquer précisément l’application qui en est faite. Si une nouvelle application de cette lignée de cellules venait à être identifiée, elle pourrait faire l’objet d’un second brevet. Ce nouveau brevet ne serait pas dépendant du premier ; son titulaire n’aurait pas à demander l’autorisation du titulaire du premier brevet, ni à lui verser des redevances. Cette restriction aux fonctions, opérée par la loi française, repose sur la marge de souplesse laissée par la directive 98/44/CE sur la protection juridique des inventions biotechnologiques.
4. L’application stricte de la règle de non patrimonialité en France
En France, en amont de toute demande de brevet, les conditions d’obtention des cellules souches humaines adultes sont encadrées par les articles 16-1 et suivants du code civil, issus des lois de bioéthique de 1994, révisées en 2004.
Ils exigent le consentement de la personne soumise au prélèvement, et le don en vertu du principe de gratuité découlant de la règle de non patrimonialité inscrite à l’article 16-1 précité. Les règles concernant la recherche sur l’embryon sont visées aux articles L. 2151-5 et suivants, et L.2414-1 du code de la santé publique.
Quant à la brevetabilité des inventions issues de cellules souches, les règles applicables découlent de la directive 98/44 du 6 juillet 1998 (article 3, 5 et 6) et de la loi de transposition de 2004. A cette date, c’est principalement l’article 5 de la directive68 qui a posé problème : l’article L. 611-18 précité du code de la propriété intellectuelle (CPI) a été rédigé de manière plus restrictive quant à la portée du brevet, pour répondre aux critiques portant sur les conséquences de la brevetabilité du vivant.
Cependant ce sont les dispositions de la directive 98/44 qui sont appliquées au plan européen par l’Office européen des brevets (OEB) car, en juin 1999, le conseil d’administration de l’OEB a décidé d’incorporer les dispositions de la directive dans le règlement d’exécution de la convention de Munich.
D’après Mme Hélène Gaumont-Prat69, la plupart des brevets en ce domaine étant délivrés par l’OEB et non pas par l’INPI, ils ne sont pas affectés par la différence de rédaction, et aucun contentieux n’a vu le jour à cette date. Pour autant, on ne peut écarter cette possibilité. Cette modification aurait des conséquences si un brevet délivré par l’OEB venait à être contesté en France devant une juridiction française, car celle-ci s’appuierait sur les textes communautaire et français. La directive primant sur le texte français, la juridiction devrait interpréter les dispositions de l’article L. 611-18 du CPI à la lumière du texte communautaire et, en cas de contradiction entre les deux, elle aurait l’obligation légale de préférer le texte communautaire.
Recommandation n° 4 :
La position de la France doit être confortée, il convient de :
– prévenir toute dérive vers une marchandisation du vivant ;
– limiter le dépôt de brevet de portée large à l’Office européen des brevets.
B. L’IMPLICATION DE LA COMMISSION EUROPÉENNE
L’implication de la Commission européenne s’effectue à travers le septième programme-cadre de recherche, financé par elle à hauteur de 50 milliards d’euros d’investissements. Couvrant la période 2007-2013, ce programme-cadre repose sur quatre piliers : la coopération (recherche collaborative), le programme de recherche fondamentale « Idées », géré par le Conseil européen de la recherche ; le programme « People Marie Curie » de formation par la recherche à l’étranger ; et le programme « Capacités », qui concerne avant tout les infrastructures de recherche.
D’après M. Jacques Remacle70, responsable scientifique à la Commission européenne : « Le débat sur les cellules souches, au niveau européen, a été très tendu, au point que le vote de ce septième programme-cadre a été retardé de six mois uniquement à cause de cette question. Toute la recherche européenne sur les technologies de l’information, le nucléaire ou la physique en a été affectée, alors même que ce secteur ne mobilise, lui, qu’une fraction minime des financements. Et, quand on est enfin parvenu à débloquer la situation, ce fut pour conclure un compromis qui ne fait que calquer celui du programme-cadre précédent ».
Il ajoute : « Il a fallu parvenir à un accord entre des pays comme l’Autriche et Malte, où l’utilisation des cellules souches embryonnaires est totalement interdite, et d’autres comme la Belgique, le Royaume-Uni et la Suède, où on l’autorise tout en l’encadrant éthiquement. Reste qu’on a conclu le 31 décembre 2006 pour un programme qui commençait le 1er janvier 2007 ! ».
2. Des règles de financement complexes
Aux termes de l’accord, sont exclues du financement les recherches visant au clonage humain à des fins reproductives, les activités de recherche visant à modifier le patrimoine génétique d'êtres humains et qui pourraient rendre cette altération héréditaire, la création d’embryons humains uniquement à des fins de recherche ou pour l’approvisionnement en cellules souches, y compris par transfert de noyaux de cellules somatiques.
Sont également exclus du financement, les programmes qui ne sont pas autorisés par l’État membre concerné, ce qui dépend des législations nationales. Or pour financer les recherches sur les CSE, il faut passer par des comités se prononçant à la majorité qualifiée des États membres. D’après M. Jacques Remacle, il arrive qu’un pays vote contre un projet de recherche sur les cellules souches embryonnaires bien qu’il ne le concerne pas ; tel est le cas de l’Autriche ; ce qui complique encore la situation. « Il faut bien s’en accommoder et, fort heureusement, il ne s’est pas jusqu’ici trouvé de cas où un projet aurait été refusé faute de cette majorité qualifiée ».
Les activités de recherche sur les cellules souches humaines, adultes ou embryonnaires, peuvent être financées en fonction à la fois du contenu de la proposition scientifique et du cadre juridique de l’État membre ou des États membres intéressé(s). Toute demande de financement de la recherche sur les cellules souches embryonnaires humaines doit, le cas échéant, indiquer en détail les mesures qui seront prises en matière de licence et de contrôle par les autorités compétentes des États membres, ainsi que l'approbation qui sera donnée au plan éthique. S'agissant du prélèvement de cellules souches embryonnaires humaines, les institutions, organismes et chercheurs sont soumis à un régime de licence et de contrôle strict, conformément au cadre juridique des États intéressés.
3. Les projets de recherches soutenus par la Commission
La Commission soutient tous les projets de recherche sur les cellules souches, qu’elles soient adultes, embryonnaires, fœtales ou iPS. Au 1er mai 2010, le septième programme-cadre avait permis d’en financer 101, pour un investissement total de 187 millions d’euros. La plupart portaient sur des cellules souches adultes. Sur ces 101 projets, 16 projets utilisent des cellules souches embryonnaires humaines, soit la même proportion que dans le sixième programme-cadre ; ils représentent un investissement européen de 48 millions d’euros.
Ces projets portent sur des études comparatives des différents types de cellules souches, et ne se limitaient pas aux cellules souches embryonnaires (CSE). Ils visent, pour certains, à une meilleure compréhension des processus biologiques fondamentaux contrôlant les fonctions de « Stemness » (capacité d’être souche, appelée aussi « souchitude » en français), de différentiation et de reprogrammation, pour d’autres, au remplacement des animaux dans les études de toxicité des médicaments. Certains portent sur l’amélioration des conditions de culture et sur le développement de biomatériaux, en nanotechnologie notamment.
Quelques projets tendent à développer les premières étapes pour la mise en œuvre de tests cliniques en médecine régénérative (maladie de Parkinson, Huntington, réparation du myocarde, réparation de système auditif, diabète).
a) Les critères de sélection des projets impliquant l’utilisation de CSEh
Le premier critère est fondé sur la qualité scientifique : le projet doit viser à accroître les connaissances fondamentales ou à augmenter la connaissance médicale, pour le développement de nouvelles méthodes de diagnostic ou de nouvelles méthodes thérapeutiques pour l’homme. Ses auteurs doivent démontrer en s’appuyant sur des arguments scientifiques qu’ils ne peuvent atteindre leurs objectifs en recourant à d’autres types de cellules souches. Cette évaluation scientifique est réalisée par des experts indépendants de haut niveau.
Ensuite, on procède à l’évaluation éthique des projets ayant démontré une excellence scientifique. Le projet ne peut pas inclure des activités de recherche menant à la destruction d’embryons humains, en particulier pour générer de nouvelles lignées de cellules souches embryonnaires humaines. Seuls les travaux utilisant des lignées déjà existantes (en culture) peuvent recevoir des fonds européens. Les demandeurs doivent démontrer qu’ils sont en accord avec les lois, régulations, règlements éthiques et codes de conduite en place dans le pays dans lequel la recherche sera effectuée. Cette évaluation éthique est réalisée par des experts indépendants de haut niveau.
Les critères d’évaluation éthiques portent sur le consentement, la protection des données et le caractère surnuméraire de l’embryon. Les donneurs d’embryons doivent avoir donné librement leur consentement écrit en accord avec leur législation nationale avant la dérivation des cellules souches à partir des embryons dont ils ont fait don. Les embryons utilisés pour la dérivation de lignées de cellules souches embryonnaires humaines doivent résulter d’embryons surnuméraires provenant de programme d’AMP et qui ne seront plus utilisés à cet effet. La protection des données du donneur doit être assurée. Les chercheurs doivent présenter les données obtenues de manière à assurer l’anonymat du donneur.
b) Une procédure contraignante d’élaboration du contrat de recherche
Une fois les projets retenus au terme des deux phases d’examen, la Commission commence la préparation du contrat de recherche, et demande les autorisations éthiques nationales / régionales avant de signer ce contrat. Elle ne finance pas un projet qui n’est pas autorisé dans l’État membre dans lequel cette recherche est programmée. Avant la signature du contrat, la Commission européenne soumet le projet à l’approbation du Comité réglementaire, constitué des représentants des divers États membres. Le vote s’effectue à la majorité qualifiée. Une fois l’accord du Comité réglementaire obtenu, la Commission signe le contrat et le projet peut commencer.
Cette procédure, qui est indéniablement longue et contraignante, permet aux États membres de maintenir leur contrôle et éventuellement de refuser un projet, ne serait-ce que pour faire valoir cette opposition auprès de leur opinion publique.
5. La mission de coordination et de rationalisation des recherches
Dans l’accord sur le septième programme-cadre, la Commission européenne a pour mission d’une part, de soutenir les actions et initiatives qui contribueront à la coordination et rationalisation des lignées de cellules souches embryonnaires humaines en Europe, et d’autre part, de créer un « répertoire-banque » de CSEh, afin d’optimiser l’exploitation des lignées existantes, pour qu’il soit moins utile d’en dériver de nouvelles, par destruction d’embryons.
C. L’ÉLABORATION DE LIGNES DIRECTRICES INTERNATIONALES PAR LA COMMUNAUTÉ SCIENTIFIQUE
1. Le rôle de régulation de l’International Society for Stem Cell Research (ISSCR)
La Société internationale de recherche sur les cellules souches est une société indépendante, sans but lucratif qui a été créée en 2002 pour promouvoir et favoriser l'échange et la diffusion des informations relatives aux cellules souches, afin d'encourager cette recherche. Ses membres sont des chercheurs renommés de diverses nationalités.
L’ISSCR joue un rôle non négligeable dans les échanges entre scientifiques ; elle a récemment élaboré, à l’intention de la communauté scientifique comme des médias, des lignes directrices qui constituent un code de bonne conduite appliqué de manière uniforme dans la communauté scientifique.
2. Les principales lignes directrices
a) Les lignes directrices sur la recherche
Une série des lignes directrices révisables a été élaborée en 2007 ; elles concernent la recherche sur les CSEh ; elles définissent des principes éthiques : ce qui est permis et ce qui est interdit. Elles visent à mettre en place des systèmes de revue des publications par les pairs. Elles définissent les modalités d’informations éclairées des personnes concernées (donneurs, receveurs et leurs proches) et établissent des formulaires types de recueil des consentements, pour faciliter la rédaction des demandes de consentement.
b) Les lignes directrices concernant les applications cliniques
Une autre série de lignes directrices très détaillées a été publiée en 200871 : « elles portent sur les questions scientifiques, cliniques, réglementaires, éthiques et sociales qui doivent être examinées pour que la recherche sur les cellules souches puisse être utilisée de manière responsable dans des applications cliniques appropriées pour traiter les patients ». Elles régulent l’application clinique de produits provenant de CSEh ou d’autres cellules souches pluripotentes. Elles déterminent les bonnes pratiques concernant la transformation et la fabrication de cellules, les études pré cliniques, la recherche clinique.
Une quarantaine de recommandations ont été élaborées avec la volonté d’encadrer les essais cliniques par de bonnes pratiques. Les principales recommandations portent sur la mise en place de comité de surveillance de ces recherches, les vérifications et précautions concernant la santé des donneurs, les composants des milieux de cultures. En outre, les modalités des études pré cliniques sur les grands et petits animaux sont détaillées, ainsi que les évaluations des risques tumoraux et de toxicité.
Ces lignes directrices ont une influence non négligeable sur la communauté scientifique car les projets de recherches qui nécessitent des coopérations internationales les respectent pour être sûrs d’aboutir. Elles constituent des garanties efficaces, comme l’ont souligné lors de leur audition MM. Thierry Jaffredo, Vincent Mouly, directeurs de recherche au CNRS, Université de Paris VI, et M. Charles Durand72, maître de conférence des universités.
Recommandation n° 5 :
Il convient de tenir compte dans notre réglementation de l’existence des lignes directrices de l’International Society for Stem Cell Research dans le processus de régulation des recherches sur les cellules souches.
II. LÉGISLATION ET RECHERCHES SUR LES CELLULES SOUCHES À L’ÉTRANGER
La carte des recherches sur les cellules souches distingue trois catégories de pays en fonction de la position qu’ils adoptent en matière de recherche sur les cellules souches humaines. Selon les pays, la politique de recherche qu’ils adoptent peut être permissive comme en Australie, Belgique, Chine, Espagne, Inde, Israël, Japon, Royaume-Uni, Russie, Suède et Taiwan.
Elle peut être flexible tel est le cas du Brésil, du Canada, de la France, de l’Afrique du sud, des Pays-Bas, des États-Unis depuis la présidence d’Obama, de la Norvège et de la Suisse.
Une politique restrictive est menée en Allemagne, en Autriche, en Irlande, en Italie et en Pologne.
Dans la quasi totalité des pays, la recherche sur les CSEh est réglementée.
ÊChine
1. La législation
La législation procède du ministère des sciences et de la technologie (MOST). L’usage de cellules souches embryonnaires pour toute forme de clonage humain est interdit, mais le clonage à visée thérapeutique n’est pas réglementé. Les conditions dans lesquelles sont obtenues les lignées de cellules souches sont définies. Toute forme de commerce pour l'obtention de ces cellules est interdit et la mise en place de comités d'éthique y compris au niveau local est recommandée.
Les autorités chinoises prépareraient un nouveau texte sur la réglementation en matière de recherche et d'applications cliniques impliquant les cellules souches adultes.
2. La recherche
La Chine dispose de larges possibilités en matière de recherche et de développement sur les cellules souches. Un commerce florissant s'est instauré consistant à mettre en œuvre des « thérapies » basées sur l'utilisation de cellules souches. Elle présente aujourd'hui l'un des environnements les plus libres et les plus favorables au développement de la recherche sur les cellules souches embryonnaires humaines et sur leurs usages thérapeutiques.
Les premières lignées de cellules souches embryonnaires humaines ont été obtenues en 2002, et des cellules souches embryonnaires obtenues par transfert nucléaire (sur des ovocytes de lapin) en 2003. On estime à 25, voire plus, le nombre de lignées de cellules souches embryonnaires créées en Chine à ce jour. Compte tenu des questions éthiques soulevées par l'utilisation de cellules souches embryonnaires, nombre de chercheurs chinois ont développé des techniques de production de cellules souches à partir de moelle osseuse fœtale. D'autres recherches ont été conduites à partir de cellules reproductrices, et de cellules sanguines ombilicales, comme l’a expliqué M. Han Zangchaoa73.
Plus d'un millier d'articles de recherche sur la médecine régénérative par cellules souches ont été publiés par des chercheurs chinois en 2008, alors qu'on en recensait seulement 37 en 2000. Cette croissance spectaculaire a été obtenue grâce à une politique particulièrement volontariste des autorités gouvernementales et locales, combinant des recrutements de chercheurs de bon niveau74, la mise à disposition de fonds importants75, une législation permissive, et une volonté de transfert rapide des résultats de la recherche vers le développement et la commercialisation.
Parallèlement aux travaux de recherche fondamentale en laboratoire, cette politique sans contrôle rigoureux a conduit très rapidement à quelques débordements. Des tentatives de traitement thérapeutique et des essais cliniques ont été développés en laboratoire et en milieu hospitalier, en particulier pour le traitement des leucémies (le protocole a été autorisé dès 2004), les traitements après infarctus du myocarde et les diabètes. De nombreux articles ont été publiés au cours de la dernière décennie, pour la plupart en Chinois, mais beaucoup de résultats, traduits en anglais, montrent que le taux de succès de ces thérapies n'est pas significatif.
Malgré ces résultats contestables, on estime à plus de 200 le nombre de cliniques et d'hôpitaux qui se sont développés, le plus souvent sans aucun agrément des autorités. Ils mettent en œuvre une « médecine régénérative » basée sur les cellules souches. Jusqu'en mai 2009, les essais cliniques démontrant l'efficacité de ces traitements n’étaient pas exigés par les autorités. Cette situation a depuis changé. Ce n'est pas encore le cas à tous les niveaux, et ces centres continuent de prospérer. Nombre d'entre eux sont soutenus par les autorités locales. Il convient de noter qu'aucun de ces centres, qui s'enorgueillissent pourtant de succès, ne les a jamais publiés dans des journaux scientifiques.
L'Institut Xishan à lui seul a traité plus de 1500 patients, dont deux tiers d'étrangers, par injection de cellules fœtales en vue de remédier à des lésions de la moelle épinière et des affections du système nerveux central. En 2006, le journal international « Neurorehabilitation and Neural Repair » a publié un rapport détaillé sur les résultats obtenus par cet institut sur sept patients un an après le traitement. Cinq d'entre eux avaient contracté des complications importantes (dont trois méningites), et aucun des patients n'avait montré de signe évident d'amélioration. Le site Internet de cet institut fait référence à des patients atteints d'affections différentes, traités cependant avec les mêmes cellules souches.
Le soutien affirmé du gouvernement chinois pour la recherche sur les cellules souches et la médecine régénérative, une législation permissive, et une liberté presque totale laissée encore récemment à des « chercheurs » ou praticiens de créer leur propre entreprise commerciale, ont ouvert la porte à des dérives.
Ê Corée
En mars 2004, une équipe coréenne dirigée par le Pr. Hwang Woo Suk, de l’Université nationale de Séoul, annonçait avoir produit la première lignée de cellules souches embryonnaires humaines issues d’un embryon obtenu par clonage. Cette percée majeure qui s’avéra ensuite être la supercherie qui conduisit au scandale retentissant que l’on connaît, poussa alors le gouvernement coréen à promulguer en 2005 « la loi sur la sécurité et la bioéthique »76. Après le soulèvement de l’opinion publique et les cris d’alarme de certains experts, la loi de 2005 s’est voulue très restrictive, avec une totale interdiction de toute création d’embryons à d’autres fins que la procréation. Les recherches sur les cellules souches embryonnaires n’étaient autorisées que sur des lignées de cellules existantes (la Corée en détient 41) et la création de nouvelles lignées était interdite.
La loi de 2005 a été révisée en 2008 notamment sur les conditions du don d’ovocytes, la réglementation sur l’utilisation des cellules souches et l’interdiction du clonage inter-espèces. La version initiale de la loi sur la sécurité et la bioéthique a permis de mettre en place deux niveaux décisionnels en terme d’autorisation de pratiques : d’une part, les Institutionnal Review Boards, des conseils de bioéthique internes aux Instituts de recherche et aux hôpitaux, chargés d’étudier la faisabilité des projets de recherche et de définir les conditions de l’utilisation des produits de la recherche en milieu hospitalier, et d’autre part, le National Bioethics Council, un comité national d’évaluation, chargé d’examiner tous les projets de recherche ayant recours au clonage ou à des manipulations d’embryons humains. Chaque projet de recherche est donc soumis à autorisation du ministère de la santé.
Dans la nouvelle loi de 2008, le législateur identifie spécifiquement 18 maladies pour lesquelles des recherches sur les cellules souches embryonnaires sont autorisées. Les expériences de clonage demeurent strictement interdites puisque toute création d’embryons à des fins de recherche est bannie.
Néanmoins, une demande d’autorisation exceptionnelle a été déposée en mars 2009 par l’hôpital Cha de Séoul auprès du National Bioethics Council. Le comité ayant dans un premier temps réclamé un complément d’information a finalement autorisé les expérimentations, levant ainsi de facto l’interdiction des recherches sur les cellules souches embryonnaires décrétée en réponse au scandale de l'affaire Hwang.
Avec cet assouplissement, le gouvernement coréen permet à ses scientifiques d’engager des expériences jusqu’alors explicitement interdites. Il est désormais à nouveau possible de créer des lignées de cellules souches embryonnaires, mais à partir de dons d’embryons surnuméraires provenant de fécondations in vitro à des fins de assistance médicale à la procréation. Un nouvel assouplissement du cadre législatif pourrait être opérée d’ici à la fin 2010.
Le débat continue d’agiter la société coréenne : en réponse à une plainte remontant à 2005, la cour constitutionnelle coréenne a statué en mai 2010 quant à l’usage des embryons surnuméraires issus d’AMP. La cour, si elle reconnaît aux embryons humains de moins de quatorze jours le potentiel de devenir des êtres humains, ne leur concède pas le statut d’être humain à part entière (tant que ceux-ci ne sont pas implantés in utero). Cet arrêt de la cour constitutionnelle précise en outre que les embryons surnuméraires ne doivent pas être conservés plus de cinq années.
Les recherches sur les cellules souches adultes ne sont quant à elles pas soumises à des contraintes juridiques spécifiques. Les cellules souches adultes sont considérées comme tout autre type cellulaire humain. Comme pour tout autre produit d’origine humaine les tests cliniques doivent être approuvés au préalable par la KFDA (Korea Food and Drug Administration). Ces assouplissements successifs sont révélateurs de la volonté de la Corée de maîtriser les biotechnologies tout en encadrant tout risque de polémique par des conseils spécialisés.
Ê Espagne
La loi espagnole du 3 juillet 2007 régit la recherche biomédicale, le statut et l’usage des embryons notamment dans le clonage thérapeutique, les garanties d’éthique et de sécurité pour les citoyens. Les acteurs impliqués dans l’application de cette loi sont le ministère de la santé comme garant du système, l’Institut de santé Carlos III comme acteur fondamental dans la réalisation, la coordination et le financement de la recherche biomédicale, et enfin les Communautés Autonomes qui peuvent établir leurs propres plans de recherche biomédicale. L’Institut de santé Carlos III de Madrid est un organisme public de recherche et d’appui scientifique qui a pour objectif de favoriser la recherche en biomédecine et en sciences de la santé. Il développe et offre des services scientifiques et techniques en faveur du système national de santé et de l’ensemble de la société.
La loi espagnole a défini le préembryon comme un embryon produit in vitro et formé par un groupe de cellules résultant de la division progressive de l’ovocyte depuis sa fécondation jusqu’au 14ème jour. Les embryons humains qui ont perdu leur capacité de développement biologique, ainsi que les embryons ou fœtus humains morts, pourront avec le consentement des donneurs, être mis à disposition de la recherche médicale. En revanche, lors d’une interruption de grossesse, il est interdit à l’équipe médicale d’utiliser l’embryon ou le fœtus avorté.
Le don d’ovocyte est permis dans le cadre de la reproduction assistée. La recherche ou l’expérimentation avec des ovocytes et des préembryons surnuméraires provenant de la reproduction assistée est encadrée. Les travaux de recherche utilisant des ovocytes ou des préembryons devront s’inscrire dans un projet approuvé au préalable par la commission de garanties pour le don et l’utilisation de cellules et de tissus humains, puis autorisé par les autorités, locales ou régionales. Il est strictement interdit de maintenir en développement in vitro des préembryons au-delà du seuil limite de quatorze jours après la fécondation de l’ovocyte.
L’utilisation de n’importe quelle technique d’obtention de cellules souches embryonnaires humaines à des fins thérapeutiques ou de recherche est autorisée, y compris l’activation de l’ovocyte par transfert nucléaire. En revanche, la création de préembryons ou d’embryons destinés spécifiquement à la recherche est strictement interdite.
Trois organismes collégiaux ont été créés par la loi de 2007 pour encadrer la recherche. Il s’agit du Comité d’éthique de recherche, de la Commission de garanties pour le don et l’utilisation de cellules et de tissus humains, et du Comité de bioéthique d’Espagne. Ces organismes examinent les aspects méthodologiques, éthiques et légaux des projets de recherche ainsi que le bilan risques/bénéfices. Ils assurent la traçabilité des échantillons biologiques d’origine humaine et la protection des données de caractère personnel. Ils édictent un code des bonnes pratiques pour gérer les conflits.
Par ailleurs, l’observatoire de la bioéthique et du droit de l'Université de Barcelone est un centre de recherche et de transfert de savoirs sur les implications éthiques, sociales et juridiques en biotechnologie et en biomédecine. C’est une structure publique de réflexion et de proposition sans équivalent. La loi en recherche biomédicale s'inspire très fortement du travail de fond fait en amont par l’Observatoire, travail consigné dans différents rapports parus tout au long de ses treize années d'existence. Son travail fait référence et a été reconnu par l'UNESCO qui lui a attribué une des sept chaires au monde en bioéthique.
Le décret royal du 10 novembre 2006 établit les normes de qualité et de sécurité pour le don, l’obtention, la conservation, le stockage et la distribution de cellules et tissus humains à des fins d’application pour l’être humain. Les préembryons surnuméraires peuvent également être conservés dans les banques autorisées. Le sperme conservé, les préembryons, les ovocytes et les tissus ovariens peuvent être utilisés pour les donneurs eux-mêmes, pour un don à des fins reproductives, ou à des fins de recherche. Ils peuvent être éliminés. Dans le cas des préembryons, la femme ou le couple géniteur sera sollicité au moins tous les deux ans pour renouveler ou non le consentement à la conservation.
Les interventions à des fins thérapeutiques sur le préembryon vivant in vitro ne pourront se faire que dans le seul but de traiter une maladie ou d’empêcher sa transmission et ce, avec des garanties raisonnables de succès. Les gamètes peuvent être utilisés à des fins de recherche. Dans ce cas, ils ne pourront pas être implantés ni permettre la création de préembryons à des fins de procréation. L’utilisation de préembryons à des fins scientifiques est possible. Cela nécessite l’accord de la mère ou du couple et ne peut être fait que dans le cadre d’un projet scientifique dûment autorisé par la Commission nationale de reproduction humaine assistée.
Les bio banques sont organisées en réseau et coordonnent leurs activités. Chaque bio banque peut avoir ainsi accès à l’information existante sur les recherches passées et en cours menées par une autre banque.
La conservation du sang de cordon est particulièrement populaire dans l’opinion publique espagnole. Le Plan national de sang de cordon ombilical estime que l’Espagne disposera de 60 000 cordons ombilicaux en 2015 contre 29 000 à l’heure actuelle. Fin 2007, le sang de cordon n’était stocké que dans six bio banques publiques (Barcelone, Malaga, Madrid, Galicia, Valence et Tenerife) qui disposaient de 28 801 cordons dont 8 686 à Málaga. Cette quantité de cordon stockée place l’Espagne au 2ème rang mondial après les États-Unis.
Ê Inde
1. La législation
Le Department of Biotechnology et l’Indian Council of Medical Research (IMCR) ont publié un guide des bonnes pratiques concernant la recherche et le stockage de sang du cordon ombilical en 2007 et annoncé la mise en place d’un organisme chargé du contrôle et de l’analyse des recherches, technologies, techniques et pratiques cliniques dans le domaine des cellules souches : National Apex Committee for Stem Cell Research and Therapy (NAC-SCRT) qui sera chargé d’établir un registre de l’ensemble des expériences et des tests réalisés dans ce domaine. Une fois cet organisme mis en place, l’ensemble des structures liées à la recherche ou à l’utilisation de cellules souches devront y être répertoriées de façon systématique.
2. La recherche
La recherche dans le domaine des cellules souches est animée par le Gouvernement et par les entreprises privées. 52 millions d’euros, ont été alloués à la recherche sur les cellules souches au cours du dernier plan quinquennal. De nombreux instituts et quelques universités mènent aussi des recherches sur les cellules souches. Ils tentent de concentrer leurs recherches dans trois domaines : la régénération musculaire des tissus endommagés lors des attaques cardiaques, la régénération des tissus de la cornée et la réparation des dommages liés aux attaques cérébrales.
Ces instituts doivent explorer les pistes de développement et vérifier la reproductibilité de opérations afin d’élargir les domaines d’expérimentation. C’est dans cette phase qu’interviennent les sociétés privées. Ces recherches semblent avoir des débouchés prometteurs, mais de nombreuses dérives sont apparues.
Le flou de la législation a encouragé le développement d’une importante économie dans le domaine des cellules souches. Les banques de stockage affichent un chiffre d’affaires en pleine croissance. Ceux qui souhaitent stocker le sang de cordon de leur nouveau né, même si le prix de stockage est très élevé, sont de plus en plus nombreux. Les banques spécialisées font généralement payer leurs services de 900 euros à 1200 euros. Ces entreprises proposent de façon quasi systématique leurs services dans les cliniques privées indiennes, selon Stem Cell Global Foudation (SCGF), organisme de promotion et de recherche sur l’utilisation des cellules souches. Le marché représente l’équivalent de 15,1 millions d’euros avec un taux de croissance annuel de 35 %.
Des médecins indiens ont profité de l’enthousiasme suscité par les traitements médicaux à base de cellules souches pour abuser de la crédulité des patients en prescrivant des traitements dont l’efficacité n’est pas prouvée et à des coûts pouvant atteindre de près de 1400 euros.
Ê Israël
1. La législation
Il n’existe pas une loi générale de bioéthique mais une série de lois couvrant des domaines circonscrits. Paradoxalement, les fondements culturels et religieux de ces lois les rendent permissives dans le domaine de la recherche sur les cellules souches. Le professeur Michel Revel rappelait que la tradition juive autorisait le recours à la science avec beaucoup de souplesse lorsque les découvertes permettaient de sauver des vies humaines. En effet, en Israël, le problème du statut de l’embryon ne se pose pas. Dans la religion juive, l’embryon est considéré comme une personne qu’à partir du 40ème jour de son développement après implantation dans l’utérus.
Un Conseil national de bioéthique donne des avis au Gouvernement sur tous les sujets relatifs à la bioéthique, non encore couverts par la législation ou nécessitant un nouvel examen législatif. Il peut s’autosaisir, émettre des recommandations à la demande de ministres, de commissions de la Knesset ou de différentes agences gouvernementales et organismes scientifiques. Il conseille les décideurs sur les questions éthiques soulevées par les développements de la biotechnologie et de la médecine. C’est un organisme multidisciplinaire, pluraliste et indépendant de 17 membres désignés conjointement par le Comité de la recherche scientifique et technologique, le ministère de la science, de la culture et des sports et le ministère de la santé.
Des lignes directrices pour la recherche sur les cellules souches embryonnaires humaines ont été élaborées par l’Académie des sciences israélienne et différentes instances éthiques dans les hôpitaux et les centres de recherche. Il leur apparaît éthiquement acceptable de créer des embryons pour produire des cellules souches dans une optique thérapeutique. Les interrogations éthiques se portent sur la sécurité pour le receveur lorsque les cellules souches sont utilisées en thérapeutique, et sur la qualité de l’information du donneur : son consentement est-il suffisamment éclairé ? Sait-il sur quoi porteront les applications des cellules données? D’autres points, notamment les essais cliniques, les tests génétiques prénuptiaux et les brevets font débat entre scientifiques et juristes.
Ainsi, si le principe est l’autorisation des recherches sur les CSEh, les essais cliniques sont strictement encadrés comme l’a montré la visite de la mission à l’hôpital Hadassah à Jérusalem. La vérification des consentements au don et à des essais est stricte et les Commissions d’éthiques des centres hospitaliers veillent à donner une information claire. Une réflexion est en cours pour savoir comment clarifier la relation entre médecins et laboratoires pharmaceutiques.
2. La recherche
L’absence de lois limitant la recherche sur les cellules souches a permis de grandes avancées en Israël. Il a été l’un des premiers pays à étudier les cellules souches et reste un pays leader dans le domaine des biotechnologies. Avec plus de 750 entreprises dans ce secteur, Israël est le numéro un mondial concernant le nombre de brevet par habitant. Cette innovation se traduit par la création de 40 nouvelles sociétés par an. La compétitivité d'Israël dans le domaine des biotechnologies et des cellules souches est soutenue par le Gouvernement qui consacre plus de 28% des investissements publics au secteur des sciences de la vie. La mission a constaté que la plupart des titulaires de brevet avaient crée de petites entreprises de biotechnologies pour les valoriser.
Une coopération franco-israélienne très active s’est développée entre d’une part, M Daniel Aberdam, directeur de recherche à l’INSERM et professeur au Technion (Institut Rappaport) à Haïfa et M. Joseph Itskovitz-Eldor, professeur au Technion77. Ceux-ci ont expliqué que l’impossibilité de travailler sur les cellules souches embryonnaires (CES) humaines en France avant 2004, et la complémentarité de leur projet les ont conduits à créer le laboratoire commun INSERTECH, et à signer en Septembre 2006 une convention entre l’INSERM et le Technion. Concrètement, la coopération se manifeste par le partage de résultats, de lignées de cellules souches, et de projets de recherches communs aux deux équipes. Leurs travaux sont complémentaires : M Aberdam pilote les études fondamentales tandis que M. Itskovitz-Eldor dirige les recherches biotechnologiques et cliniques sur les milieux de cultures des cellules souches et étudie les iPS.
Actuellement INSERTECH sert d’incubateur et de passerelle entre le Technion et l’INSERM. Une demande de financement européen pour un projet franco-israélien a été déposée dans le cadre du 7ème PCRD (Programme Cadre de recherches et de Développement). Mais malgré les accords bilatéraux, la loi française restreint les possibilités de transfert des fonds obtenus par M. Aberdam en France. En conséquence l’INSERTECH reçoit pour l’instant moins de moyens que prévu. Concernant les aides nationales, son équipe a déjà obtenu deux financements par l’Israël Science Foundation (ISF) et le ministère de la Science israélien (Ministry Of Science and Technology, MOST).
Les principaux axes de recherche de l’équipe de M. Aberdam concernent la cornée oculaire à partir de cellules souches embryonnaires pour permettre la régénération visuelle, le développement de modèles cellulaires pour comprendre les pathologies cutanées et cardiaques. Les principaux axes de recherche de l’équipe de M. Itskovitz-Eldor portent sur les techniques de mise en culture des CSEh; en cherchant des modèles reproductibles de mise en culture de ces cellules sur des couches nourricières humaines sans apport de facteurs issus de l’animal dans des conditions de Good Manufacturing Practice afin de pouvoir les utiliser en clinique. Les deux équipes cherchent à caractériser les lignées de CSEh existantes à l’aide de méthodes de génomique et de protéomique pour accroître la connaissance de ces lignées. Elles étudient les mécanismes de la pluripotence. M. Itskovitz-Eldor a mis au point une méthode de culture en suspension. La standardisation des méthodes est essentielle pour passer au niveau industriel.
À l’Hôpital Rambam à Haïfa, l’équipe du professeur Lior Gepstein et du professeur Rafael Beyar étudie les cardiomyocytes, les met en culture et produit des tissus contractiles en trois dimensions.
À l’Hôpital Hadassah, l'équipe du professeur Benjamin Reubinoff, directeur du centre de recherche sur les cellules souches humaines embryonnaires, a initié un programme de recherche sur les lésions de la moelle épinières et la sclérose en plaque.
En collaboration avec M Itkovitz-Eldor, M Michel Revel, professeur à l’Institut Weizmann, ancien président de la Commission de bioéthique, a développé au sein de la société de biotechnologie Kadimastem des technologies de dérivation de cellules des îlots pancréatiques, qui seront utilisées dans les traitements du diabète insulino-dépendant (type I et II)) qui affecte environ 30 millions de personnes dans le monde. La greffe de cellules bêta pose problème, car il y a peu de pancréas disponibles chaque année. C’est pourquoi, l'utilisation de cellules souches dérivées d'îlots est devenue une stratégie intéressante pour guérir le diabète. Par ailleurs M Michel Revel s’efforce de cultiver des CSEh en suspension, de mener des recherches sur les tissus en trois dimensions.
En outre, différents types de recherches sont menées sur les iPS et particulièrement sur la comparaison entre les potentialités des CSEh et des iPS à l’Université hébraïque de Jérusalem. Des recherches de reprogrammation des cellules sans recours à des gènes sont conduites.
Ê Japon
1. La législation
En 2001, le ministère japonais de l’Education, de la Culture, des Sports, des Sciences et de la Technologie (MEXT) avait adopté une réglementation régissant l’utilisation des cellules souches embryonnaires qui, trop rigide, a été révisée en 2009.
Désormais, l’utilisation de cellules souches embryonnaires obtenues par la technique de transfert nucléaire de cellule somatique pour certaines recherches est explicitement autorisée. L’importation de cellules embryonnaires humaines est possible, à condition que les méthodes utilisées pour les produire respectent des critères équivalents aux critères japonais définis par le MEXT. L’approbation de l’utilisation de cellules embryonnaires n’incombe plus qu’au seul comité d’éthique de l’organisme. Le directeur de l’établissement de recherche notifie au MEXT l’approbation du plan de recherche ou d’éventuels amendements. Le ministère peut demander des compléments ou une enquête s’il les juge nécessaire. En revanche, les protocoles de dérivation de cellules souches restent soumis à la procédure de double approbation de la part à la fois du MEXT et du comité d’éthique.
La réglementation a été amendée en mai 2010 pour autoriser la production de cellules germinales (à des fins de recherche sur ce type de cellules) à partir de cellules embryonnaires humaines, ce qui était jusqu’alors interdit.
Les cellules souches iPS (découvertes au Japon en 2007) et les cellules souches adultes ne soulevant pas les questions éthiques posées par les cellules souches embryonnaires, le MEXT n’a pas émis de consignes particulières concernant leur production et leur utilisation. En mai 2010, il a annoncé que ces catégories de cellules souches pouvaient également être utilisées pour produire des cellules germinales à des fins de recherche.
2. La recherche
La recherche sur les cellules souches bénéficie de financements publics, principalement de la part du MEXT, du ministère de la Santé et du ministère de l’Economie, du Commerce et de l’Industrie, ce dernier agissant à travers son agence de financement de projets, l’Organisation pour le Développement des Energies Nouvelles et des Technologies Industrielles (NEDO).
Cellules souches embryonnaires :
Le MEXT mène un projet sur 10 ans (2003-2012), intitulé Projet pour l’Avènement de la Médecine Régénérative, consacré aux cellules souches (établissement d’une banque de cellules souches pour la recherche, mise au point de technologies pour manipuler les cellules souches, traitements).
La NEDO a également consacré entre 2005 et 2009 un projet à ce type de de cellules, intitulé « Development of Technology to Create Research Model Cells ».
S’agissant des cellules iPS, le gouvernement japonais a déjà investi 4,5 milliards de yen en 2008 et 14,5 milliards de yen en 2009. Le MEXT chapeaute un projet associant quatre institutions majeures dans le domaine : les universités de Tokyo et de Kyoto, l’université Keio et le RIKEN (premier institut de recherche publique du pays).
La NEDO a présenté en mai 2009 un programme de 5 ans visant à développer des applications pour la technologie des cellules iPS, regroupant une vingtaine d’institutions issues des secteurs académique, public et privé. Le budget total s’élève à plus de 5,5 milliards de yens (plus de 50 millions d’euros). Le programme s’articule sur trois axes majeurs :
- le développement de méthodes de production sûres et efficaces des cellules iPS ;
- la mise en place de ces méthodes ainsi que l’industrialisation et l’automatisation du processus de production ;
- l’établissement d’une méthode de criblage pour la recherche pharmaceutique.
Le professeur Shinya Yamanaka de l’Université de Tokyo, découvreur des cellules iPS, a reçu une dotation de 5 milliards de yen en 2010 pour ses recherches, dans le cadre d’un fonds spécial établi par le Council of Science and Technology Policy (CSTP).
Ê Royaume-Uni
1. La législation
Dans les années 1980, le comité Warnock a établi des principes majeurs : l’embryon, à l'extérieur du corps humain, doit bénéficier d’une protection légale ; les donneurs doivent être conseillés et éclairés avant de donner leur autorisation ; le bien-être de l’enfant doit être pris en compte, de même que son droit à l’accès à certaines informations relatives à ses parents génétiques ; l’utilisation de l’embryon in vitro à des fins de recherche doit être limitée à 14 jours.
La Human Fertilisation Embryology Authority (HFEA) est la pierre angulaire du cadre législatif ; c’est une autorité indépendante du gouvernement, mais financée par celui-ci. Elle reçoit des subsides des cliniques et d’autres organisations médicales. Les décisions prises, notamment en matière d’autorisations individuelles, n’impliquent ni ministre, ni personnes extérieures.
Le cadre législatif est conçu pour permettre de se tenir à jour des progrès de la médecine et de la science, de façon à informer le gouvernement pour l’élaboration de nouvelles réglementations. Elle dispose d’un pouvoir discrétionnaire pour certains cas individuels, comme pour l’octroi d’autorisations d’exportation d’embryons à l’extérieur du Royaume-Uni. Les politiques sont guidées par un code de conduite (code of practice). Il existe une commission des normes. Aucune nouvelle méthode ne peut être mise en œuvre tant qu’elle n’a pas été expressément autorisée. La HFEA donne des autorisations pour concevoir des embryons et pour l’utilisation des embryons surnuméraires. Les décisions sont prises par le Conseil d’orientation.
La HFEA doit informer le public et les chercheurs et être en phase avec les progrès et l’évolution des situations, avec les changements, de manière à être le plus proche possible de la réalité. La loi demande à la HFEA d’établir des principes, elle mène des consultations très approfondies. Il y a deux ans, elle en a conduite une sur la question très controversée du code de conduite de l’utilisation des cybrides. La loi distingue aussi les activités qui ne peuvent être menées qu’avec autorisation, et celles qui sont absolument interdites, comme la gestation d’un embryon humain dans un animal et inversement.
D’après Mme Hannah Darby, directrice de recherche à la HFEA78, il existe plusieurs dispositifs de consultation pour être en phase avec le public. Pour les autorisations, un panel composé d’embryologistes, de directeurs de cliniques et de médecins tient trois ou quatre réunions par an et assure la liaison avec la communauté scientifique. Ce panel tient une conférence annuelle. Les opinions et les éléments d’intérêt qu’il fait valoir sont transmis à deux comités de la HFEA, un comité consultatif pour la législation et un comité consultatif pour les avancées scientifiques et cliniques, qui ensuite les communiquent au conseil d’administration de la HFEA. L’autorité rend des comptes au Parlement et établit des rapports annuels.
C’est la question des hybrides qui a suscité le plus de débats à la Chambre des Lords et à la Chambre des Communes. En janvier 2008, la HFEA a octroyé deux autorisations, pour l’utilisation d’un ovule de vache et un de cochon, au moment même où le Parlement débattait de l’utilisation possible des hybrides. La HFEA a donné cette autorisation car elle a mené des consultations très approfondies avec des associations de patients et des scientifiques. Un processus de revue par les pairs extrêmement strict avait été conduit pour l’examen de la demande.
La loi limite à quatorze jours la période pendant laquelle il est possible de travailler sur l’embryon car ce moment est celui de l’apparition de la « primitive streak », la « ligne primitive », où un individu est créé. Auparavant, la division des cellules peut aboutir à plusieurs individus. À partir de l’apparition de la « primitive streak », la recherche est interdite.
Les brevets déposés sur les cellules souches et les technologies qui s’y rapportent ont engendré peu de litiges. En ce qui concerne les limites de brevets, l’« exception académique » est de plus en plus difficile à justifier : elle permet aux équipes universitaires de travailler sur des cellules brevetées car traditionnellement, ces équipes mènent une recherche fondamentale. Or, le paysage de la recherche a changé et des équipes universitaires démarrent des essais cliniques à petites échelles.
Les scientifiques rencontrés par la mission estiment que la combinaison d’un système légal actuel permissif et d’un système réglementaire extrêmement strict est nécessaire et adéquat, et a permis que ce type de recherche soit accepté par le plus grand nombre. Ils regrettent cependant la complexité du système d’autorisation qui est très lent. Un délai de six mois en moyenne est nécessaire. La moindre erreur entraînant du retard. Le tableau ci-après montre la manière dont le système fonctionne.
Procédure d’autorisation devant la HFEA (Human Fertilization and Embryology Authority)
2. La recherche
La mission s’est entretenue avec des universitaires et chercheurs travaillant dans le domaine des cellules souches spécialisés en cardiologie, médecine régénérative, neurosciences et maladies neurodégénératives, régénération de cartilages et oncologie. Selon eux, la recherche menée au Royaume-Uni, tout type de cellules souches confondu, est très avancée mais ils restent prudents quant aux applications cliniques.
La recherche universitaire est en mutation, et de plus en plus d’équipes s’engagent aujourd’hui vers la mise en œuvre d’essais pré cliniques ou cliniques. Bien que la recherche fondamentale ait fait de nombreux progrès et que la connaissance ait avancé, les compagnies pharmaceutiques ne s’étaient jusqu’à très récemment, pas intéressées à ce domaine. En effet, un traitement qui marche à l’aide de cellules souches peut signifier que la personne traitée est guérie à vie. Ceci ne correspond pas au modèle commercial traditionnel de ce secteur. Selon les scientifiques, ce modèle commercial risque de vivre une profonde mutation dans les années à venir. Les essais cliniques qui seront menés avec de telles cellules devront absolument être couronnés de succès, si l’on veut éviter de répéter la situation des années quatre-vingt-dix pour la thérapie génique, comme l’a souligné Dame Julia Polak79.
Les scientifiques rencontrés80 au Royaume-Uni par la mission considèrent que les cellules souches embryonnaires représentent toujours « le graal » en termes de thérapie cellulaire, mais indiquent que bien des recherches seront encore nécessaires pour accroître les connaissances et la compréhension des risques liés à ces cellules (notamment en termes de développement de cancers chez les patients traités). Ces cellules peuvent et doivent tout de même être étudiées, tout comme les iPS, pour permettre d’améliorer la compréhension et les connaissances de la pathophysiologie des maladies. Il est donc impératif que la recherche sur les cellules souches embryonnaires soit légalement autorisée, et réglementairement encadrée de manière stricte.
Si les applications thérapeutiques avec les cellules souches embryonnaires ne voient le jour que dans vingt à trente ans, elles auront d’autres applications à plus court terme tout aussi indispensables de diagnostic ou de criblage. Les travaux sur les cellules souches adultes auront plus de chances d’arriver en thérapies à court ou moyen termes. Ils présentent moins de risques pour la santé des malades que l’on tente de soigner.
Ê Russie
En Russie, la recherche scientifique sur les cellules souches est encadreée par un décret de 2003 « sur le développement des technologies cellulaires en Fédération de Russie ». Ce décret fixe les conditions d’utilisation de cellules souches obtenues uniquement par prélèvement sanguin placentaire ombilical, aux seules fins de recherche. Il précise également les conditions de création de la banque de cellules souches, placée sous le contrôle du ministère de la Santé, qui est censée constituer en principe la seule source autorisée en Russie à fournir des cellules souches. Cette banque se trouve actuellement au centre cryogénique de l’Institut national de recherche en accouchement et gynécologie.
Il existe également une « Instruction ministérielle sur les recherches en technologies cellulaires et leur utilisation » spécifiant entre autres que toute réception ou utilisation de cellules souches doit être soumise à autorisation du ministère de la Santé et placée sous le contrôle des comités d’éthique.
Cependant, même si la recherche fondamentale dans ce domaine est encadrée, il n’existe pas en Russie de législation définie pour l’utilisation des cellules souches embryonnaires. Les embryons non implantés, de même que le fœtus, n’ont pas de statut juridique particulier, et en principe rien n’interdit le clonage de tissu embryonnaire afin de produire des cellules souches.
Ce flou dans la législation a permis la multiplication des centres et cliniques proposant des traitements à l’aide de cellules souches. La majorité de ces centres ne possède pas de licence d’utilisation de cellules souches, dont l’origine n’est donc pas contrôlée, et ces traitements procèdent plus de la para-médecine que de la médecine scientifique proprement dit. Les traitements proposés relèvent essentiellement de la cosmétologie et de la « cure de rajeunissement », mais peuvent également viser des maladies variées comme par exemple les séquelles d’infarctus et d’AVC, arthrite, arthrose, maladie d’Alzheimer, maladie de Parkinson, diabète, névralgies, maladies auto-immunes, etc…
Bien que l’étude des cellules souches et de leurs propriétés n’en soit aujourd’hui qu’à ses débuts et que les connaissances dans ce domaine soient très fragmentaires, une certaine mythologie autour des cellules souches s’est développée auprès du grand public et explique le succès de ces centres. Il existe dans la région de Moscou plus d’une cinquantaine de centres proposant diverses cures de « rajeunissement » à base de cellules souches, pour des coûts s’élevant à plusieurs milliers d’euros, ce qui en fait une activité rentable.
ÊSuède
1. La législation
En matière de bioéthique, la Suède possède un dispositif réputé libéral. Les recherches effectuées dans les domaines les plus sensibles, notamment sur l’embryon, font l’objet de procédures poussées de validation et de contrôle en amont, par le Conseil national de la recherche, le Comité central d’examen éthique et le Conseil national d’éthique médicale. Le gouvernement suédois a opté pour un régime permissif, c’est-à-dire un régime d’autorisation avec encadrement par une autorité et des comités d’éthique.
La Suède jouit au sein de la communauté médicale de la réputation d’être à la pointe de la recherche et de la technologie sur les cellules souches. Elle est une référence pour l’industrie des biotechnologies au niveau mondial. Ce secteur bénéficie d’un contexte très avantageux à l’origine de son succès : un fort soutien public, un climat favorable à la bioéthique, une longue tradition de recherche médicale, ainsi qu’un financement public généreux.
Le Conseil national d’éthique médicale constitue le principal organe suédois chargé de donner des avis sur les questions éthiques soulevées par les avancées rapides de la technologie dans le domaine de la recherche médicale, du diagnostic et du traitement des maladies. Il a mission de conseiller le Gouvernement et le Parlement, d’encourager l’échange d’informations et de promouvoir le débat sur la recherche médicale et ses applications. Il est composé de représentants de tous les partis politiques présents au Parlement et de douze experts.
La loi du 1er janvier 2004 relative au contrôle et à l’éthique de la recherche sur l’être humain, complétée par la loi sur l’intégrité génétique votée le 18 mai 2006 prévoit que tout projet de recherche sur la personne doit faire l’objet d’un examen détaillé par un comité d’éthique et doit impérativement respecter la dignité de l’être humain. Cette règle concerne les expérimentations sur les personnes vivantes mais également la recherche sur les personnes décédées et le « matériel » biologique humain, ainsi que la recherche qui suppose un traitement de données sensibles sur la personne. Les dossiers de demande doivent être déposés auprès de l’un des six conseils régionaux d’éthique du pays. Il s’agit d’autorités indépendantes composées d’au moins deux départements, dont l’un traite des dossiers relevant du domaine médical et l’autre des dossiers relatifs aux autres domaines de recherche. Tous les membres et leurs suppléants sont désignés par le Gouvernement. L’information et la formation occupent une place centrale dans le dispositif.
La recherche sur l’embryon est permise depuis 1991. D’après la loi de 1991, cette recherche ne peut être conduite que jusqu’au quatorzième jour après la fécondation. L’ovocyte doit ensuite être détruit, comme prévoit la loi sur l’intégrité génétique de 2006.
La loi sur la confidentialité génétique entrée en vigueur le 1er juillet 2006 stipule qu’il est permis d’effectuer des recherches sur des ovocytes. A condition que la recherche soit pré-approuvée par un comité éthique, il est possible de procéder à des transferts nucléaires dans le but d’obtenir des cellules souches à des fins thérapeutiques. Cette nouvelle loi ne s’applique pas seulement aux ovocytes mais également aux cellules souches engendrées par transfert nucléaire vers des cellules somatiques.
2. La recherche
Plus de 30 équipes de chercheurs et près de 300 personnes réparties dans neuf centres sont impliqués dans la recherche sur les cellules souches. La Suède est considérée par la communauté scientifique comme l’un des pays les plus avancés, à la fois sur le plan de la recherche et sur celui de leur utilisation à des fins thérapeutiques sur certains groupes de patients. Elle possède actuellement le plus grand nombre de lignées de cellules souches de ce type au monde. Il en existe 19 dans les laboratoires de l’Académie Sahlgrenska (université de Göteborg), dont plusieurs ont fait l’objet de financements importants en provenance des NIH américains. Les restrictions de subventions européennes dédiées à ce type de recherche dans le 7ème PCRD ont entraîné un certain ralentissement de cette activité. Ceci a pu être partiellement comblé par une réallocation de ressources au niveau du Conseil de la recherche suédois qui qualifie toujours cette décision de sérieux revers pour la compétitivité européenne.
Dans le cadre des financements additionnels prévus dans la loi 2009-2011 sur la recherche et l’innovation, le gouvernement suédois a octroyé des moyens importants à la recherche sur les biotechnologies médicales. Il est par ailleurs prévu que 5 milliards d’euros soient investis d’ici à 2025, dans les laboratoires, les plateformes technologiques et les équipements scientifiques, investissement qui devrait significativement bénéficier aux recherches sur les cellules souches embryonnaires et somatiques.
En juin 2009, le conseil suédois de la recherche a pris la décision de créer et de financer une banque nationale de cellules souches dotée d’environ 1 million d’euros. La Fondation Alice et Knut Wallenberg vient pour sa part d’annoncer la mise en place d’un centre de recherche pour la médecine régénérative à l’Institut Karolinska (Stockholm), auquel il sera accordé un financement de 10 millions d’euros.
Les universités de Lund, de Linköping et d’Umeå hébergent également des laboratoires de recherche et d’essais cliniques utilisant des cellules souches embryonnaires. Les points forts de la recherche suédoise sont : la thérapie cellulaire, notamment pour les leucémies et les pathologies du système ostéoarticulaire, la constitution de lignées cellulaires de cellules souches embryonnaires humaines à des fins thérapeutiques (production de précurseurs de cellules nerveuses et celles musculaires cardiaques), le développement de nouveaux systèmes de culture sans composant d’origine animale, condition préalable au traitement de patients avec des cellules souches embryonnaires.
Deux sociétés suédoises produisent des cellules souches : Neuronova (basée à Stockholm, fondée en 1998, 14 employés) et Cellartis (basée à Göteborg, fondée en 2001, 50 employés).
La recherche sur les cellules souches demeure une priorité dans la recherche médicale suédoise, notamment pour les recherches sur le vieillissement et sur le diabète.
Ê Taiwan
1. La législation
La loi sur la recherche sur l’embryon humain et les cellules souches embryonnaires de juillet 2008 met en place un cadre légal, réputé peu contraignant pour la recherche dans le domaine des cellules souches.
Taiwan a ainsi voulu empêcher toutes dérives graves mais, souhaitant fermement devenir un acteur majeur dans le secteur des biotechnologies, les autorités ont jugé qu’il pourrait être contre productif de mettre en place un cadre trop restrictif dans un domaine aussi stratégique que la recherche sur les cellules souches. Le grand public ne se montre pas particulièrement préoccupé par ces questions.
2. La recherche
Les projets de recherche sur les cellules souches, financés par le Conseil national des sciences ou le département de la santé sont conduits par la plupart des instituts de recherche : Institut des sciences biomédicales de l’Acadmia Sinica, Institut national de recherche médicale, Institut de recherche en technologies industrielles, Institut des technologies animales.
En outre, les universités médicales et les CHU : Hôpital de l’Université nationale de Taiwan, Hôpital et Université Chang Gung, Hôpital général des vétérans et Université nationale Yang Ming, Hôpital de l’Université médicale chinoise de Taiwan, Université médicale de Taipei, Université médicale de Kaohsiung, Hôpital Cathay, Hôpital tri-service sont largement partie prenante de cette recherche.
Le secteur biomédical est un des premiers secteurs de recherche à Taiwan, qui peut compter sur des scientifiques formés, en particulier, dans les meilleures universités américaines. Les équipes souhaitant lancer un projet dans ce domaine doivent soumettre leur proposition aux comités d’éthique (Institution Review Boards), composés de représentants du corps médical, de la société civile, et de l’organisme dont ils dépendent.
Ê Brésil
1. La législation
L’utilisation et la recherche sur cellules souches est encadrée par la loi sur la biosécurité du 24 mars 2005 qui autorise, « à des fins de recherche et de thérapie, l’utilisation de cellules souches embryonnaires obtenues à partir d’embryons humains produits par fécondation in vitro », sous certaines conditions. Ces conditions sont cumulatives : les embryons doivent être non-viables ou congelés depuis au moins trois ans, les cliniques et les hôpitaux doivent tenir un registre de tous les embryons disponibles avec leur date de congélation, les géniteurs doivent donner leur accord.
Ce texte fait brièvement référence aux cellules souches adultes, sur lesquelles peuvent être effectuées des recherches pouvant déboucher sur des applications dans le domaine médical.
Plusieurs garde-fous institutionnels sont institués par la loi de 2005 pour faire respecter la bioéthique. Les instituts de recherches et les services de santé doivent soumettre leurs travaux sur les cellules souches embryonnaires (ainsi que l’ensemble de leurs recherches impliquant des êtres humains) à l’approbation des comités d’éthique de la recherche créés au sein des universités et dans les centres de recherche. Ces comités sont coordonnés par la Commission nationale d’éthique pour la recherche, instance collégiale du Conseil national de la santé, l’organe permanent du ministère de la santé brésilien.
L’Agence nationale de vigilance sanitaire (ANVISA), rattachée au ministère de la santé, a pour mission de définir des normes concernant l’utilisation des cellules souches. Une résolution de l’ANVISA en cours d’adoption prévoit un renforcement de la réglementation concernant l’usage des cellules souches embryonnaires (régime d’autorisation préalable et de contrôle). Au cours des travaux préparatoires, un recensement systématique des embryons en circulation a été effectué afin de mettre en place un registre détaillé.
Les normes édictées par l’ANVISA doivent permettre de combler les vides juridiques de la loi sur la biosécurité de 2005. En effet, si l’activité des organismes publics est bien contrôlée, les pratiques du secteur privé restent encore mal encadrées.
Le Conseil fédéral de la médecine (CFM), contribue également à la réflexion et à la définition des normes de bioéthique, la Constitution brésilienne lui attribuant des fonctions de contrôle et d’élaboration des normes encadrant les pratiques médicales. Ses prérogatives de contrôle des demandes de cellules souches embryonnaires devraient être étendues par la résolution de l’ANVISA.
L’autorisation d’utiliser des cellules souches embryonnaires a fait l’objet d’un vif débat au Brésil, grand pays catholique où les courants traditionalistes sont écoutés. Le Procureur de la République à l’époque avait formé en 2005 un recours en inconstitutionnalité auprès du Tribunal Suprême Fédéral contre la nouvelle loi de biosécurité. Ce recours, soutenu par les courants religieux et les mouvements anti-avortement, était fondé sur l’article 5 de la Constitution fédérale qui garantissait « l’inviolabilité de la vie humaine ». Le 29 mai 2008, le Tribunal Suprême Fédéral a confirmé la loi, faisant du Brésil le premier pays d’Amérique latine et le 26ème pays du monde à autoriser ce genre de recherches.
2. La recherche
La décision du Tribunal Supérieur Fédéral a encouragé une forte croissance des recherches sur les cellules souches. Le ministère des sciences et des technologies et celui de la santé, qui assurent, notamment par l’intermédiaire d’agences spécialisées et de la fondation Oswaldo Cruz, le financement et la coordination de projets de recherches en ce domaine, ont investi (environ 5 à 6 M€). Les fondations d’appui à la recherche des états de São Paulo, de Rio de Janeiro et du Minas Gerais ont également financé ces projets à hauteur de plusieurs millions de réaux (R$).
Le gouvernement brésilien pour lequel la recherche en matière de thérapie cellulaire est une priorité, appuie 40 groupes de recherche spécialisés en ce domaine. Le plus important d’entre eux, coordonné par l’Institut de cardiologie de Laranjeira Antonio Carlos Carvalho, a reçu 28 MR$ en 2008.
Cette même année, un Réseau national de thérapie cellulaire a été créé. Doté d’un budget initial de 21 MR$ (environ 10 M€), ce dispositif coordonne huit centres de technologie cellulaire, localisés dans cinq états brésiliens. Huit groupes de recherche ont été sélectionnés afin de structurer ces centres. Cinquante deux laboratoires produiront diverses variétés de cellules, l’un des principaux objectifs étant de créer des structures adaptées à la culture de cellules souches conformes aux « bonnes pratiques de manipulation ».
Grâce aux efforts déployés, la recherche brésilienne en matière de cellules souches adultes connaît actuellement de grandes avancées. Les travaux portant sur l’utilisation des cellules souches de la moelle osseuse pour le traitement des maladies cardiaques et neuromusculaires (maladie de Chagas, maladie coronaire chronique, cardiopathie dilatée) font l’objet de publications.
Les travaux permettant l’obtention de cellules souches à partir d’embryons humains menés par l’équipe de l’Institut de biosciences de l’Université de São Paulo, ainsi que les recherches de l’Université fédérale de Rio ont permis au Brésil de devenir le cinquième pays à produire des cellules souches pluripotentes induites, ils font l’objet d’importants investissements. en 2009, plus de 3 MR$ (environ 1,4 M€) ont été consacrés à la poursuite de ces études.
Ê Canada
1. La législation
Le cadre juridique est évolutif à travers des lignes directrices. Des organismes de cadrage qui existent au sein même des instituts de recherche en santé du Canada, ont publié des lignes directrices concernant les recherches sur des sujets humains. Ces lignes directrices ont été mises à jour régulièrement depuis 2005. Les établissements de recherche se doivent de créer des comités d’éthique pour la recherche, chargés d’évaluer et d’approuver toute recherche menée sur des êtres humains ou sur des tissus ou substances biologiques humains. Ils sont soutenus par le conseil national d’éthique en recherche chez l’humain et le Collège royal des médecins et chirurgiens du Canada.
La Commission royale sur les nouvelles techniques examine les répercussions et les conséquences des nouvelles techniques de reproduction et de génétique.
Les organismes fédéraux qui financent la recherche au Canada, sur appel d’offre ou projet exceptionnel, ont défini un ensemble de lignes directrices éthiques en 1998. En 2002, les lignes directrices sont mises à jour. Elles prévoient que :
- les embryons utilisés ainsi que les tissus embryonnaires humains doivent avoir été créés à l’origine pour la reproduction sans vente ni achat de gamètes et le consentement des deux parents doit être obtenu ;
- les prélèvements de tissus doivent être effectués avec le consentement de la personne et en conformité avec les lois en vigueur dans la province ;
- la confidentialité et la vie privée des donneurs doivent être respectées ;
- si les recherches débouchent sur des intérêts commerciaux, les chercheurs doivent en aviser un comité de surveillance ainsi que le Comité d’éthique et de recherche local et leur transmettre la documentation jugée nécessaire à l’évaluation.
Le texte énumère les recherches non éligibles aux financements des instituts de recherches : la création d’embryons humains uniquement pour la recherche, le transfert nucléaire de cellules somatiques et le don ciblé de cellules souches. Ainsi c’est le financement de la recherche qui encadre la recherche sur les cellules souches. Ce texte propose également la création d’un registre national des lignées de cellules souches embryonnaires humaines générées au Canada et disponible en ligne. Le texte s’applique aux trois organismes fédéraux canadiens de financement de la recherche.
Les lignes directrices établissent les recherches qui peuvent être financées par les organismes, mais ne permettent pas de réglementer la recherche sur les cellules souches humaines.
En mars 2004, la loi sur la procréation assistée au Canada est entrée en vigueur. Elle propose également une réglementation des activités de recherche liées aux prélèvements des cellules souches d’embryons « pré-existants ». Elle ne reconnaît pas l’embryon en tant que personne jouissant de tous les droits fondamentaux. Cependant, elle interdit la création d’embryons exclusivement créés pour la recherche, ainsi que leur vente ou achat.
Depuis 2006, les espèces non humaines auxquelles on a greffé des cellules souches humaines ne doivent pas être utilisées à des fins de reproduction. Nouveauté depuis 2009, le registre des lignées de cellules souches embryonnaires humaines, géré par les instituts de recherches, est mis en ligne. À ce jour, une seule lignée est répertoriée.
2. La recherche
Le financement est essentiellement fédéral. Une grande partie de la recherche sur les cellules souches est financée par les instituts de recherche. Les autres organismes subventionnaires, et plus particulièrement le Conseil de recherches en sciences naturelles et en génie, peuvent également financer certains projets. Toute demande de financement auprès de ces organismes pour des projets de recherche utilisant des cellules souches humaines doit satisfaire des lignes directrices en matière de recherche.
De nombreux financements sont également disponibles via le réseau de centre d’excellence « Réseau des cellules souches » (RCS). Ce réseau comprend plus de 145 partenaires (dont 41 universités et 36 entreprises) et regroupe 95 chercheurs et plus de 450 personnes hautement qualifiées. Il dispose d’un budget de 63 millions de US Dollars sur 7 ans, et a pour but de favoriser la concrétisation de la recherche sur les cellules souches. Le RCS finance de nombreux projets en recherche fondamentale (jusqu’à 300 000 US Dollars par an), mais également en recherche appliquée (financement pouvant aller jusqu’à 75 000 US Dollars pour un an). Les projets sont sélectionnés sur les recommandations d’un groupe d’experts et doivent correspondre à l’un des 4 programmes stratégiques du RCS : thérapie cellulaire, applications pharmacologiques, développement de technologies, politique publique et questions éthiques, juridiques et sociales. Les projets financés doivent respecter les lignes directrices des instituts de recherche en santé.
Les chercheurs peuvent également se porter candidats à un des programmes de la Fondation canadienne pour l’innovation permettant le financement des équipements et des infrastructures. Les chercheurs travaillant sur les cellules souches humaines sont également éligibles au programme de chaire de recherche du Canada, qui permet de financer (niveau 1 : 200 000 US Dollars par an pendant 7 ans, niveau 2 : 100 000 US Dollars par an pendant 5 ans) des recherches universitaires d’excellence dans un domaine précis.
Le projet « Canadian Human Embryonic Stem Cell Initiative » a regroupé entre 2006 et 2008 plusieurs chercheurs de différentes universités canadiennes. Le Centre de recherche sur les cellules souches Sprott de l’institut de recherche de l’hôpital d’Ottawa, créé en novembre 2006, est spécialisé en essais cliniques. Les activités de recherche portent sur les cellules souches embryonnaires (20 % des recherches) mais également des cellules souches provenant des muscles adultes. De plus, ce centre a entrepris les premiers essais cliniques canadiens portant sur des thérapies cellulaires régénératrices pour les maladies cardiovasculaires. Une base de données développée par ce laboratoire sur l’expression génétique des cellules souches, Stembase, est devenu un outil indispensable pour les chercheurs du monde entier. Au Canada, les essais cliniques sur humains impliquant des traitements d’origine biologique et des produits dérivés du sang doivent obtenir l’approbation de la Direction des produits biologiques et des thérapies génétiques de santé.
Le Canada a mis en place des pôles dédiés à la recherche sur les cellules souches. Ainsi le « Toronto Stem Cell Initiative » (TSCI) regroupe des laboratoires de l’université de Toronto et des instituts de recherches des hôpitaux. L’université MCMaster abrite le « MCMaster Stem Cell and Cancer Institute », un des plus importants centres de recherche sur les cellules souches humaines dont les activités de recherche portent notamment sur les cellules souches embryonnaires humaines et leur évolution afin de mieux comprendre la formation des cancers. L’institut en immunologie et cancérologie de l’université de Montréal effectue de nombreuses études sur les cellules souches en coopération avec d’autres pays et des scientifiques de renom. Récemment, une de ces équipes a pu produire une grande quantité de cellules souches à partir d’un petit nombre de cellules souches de mœlle osseuse.
Ê États-Unis
1. La législation
Il n’existe pas de lois fédérales encadrant la recherche sur les cellules souches, donc légalement tout est permis au niveau fédéral. Ce sont les États, individuellement, qui encadrent d’un point de vue légal ce type de recherches. En revanche, les financements fédéraux sont soumis à la loi fédérale.
Depuis le 9 août 2001, la recherche sur les cellules souches embryonnaires humaines (CESh) aux États-Unis était freinée par une loi qui limitait les possibilités de financement fédéral aux projets de recherche utilisant les lignées cellulaires déjà existantes à cette date. Aucune loi fédérale n'encadrant la recherche sur les cellules souches, il était possible de travailler avec des lignées de cellules souches obtenues après 2001, uniquement avec des financements d'États ou des fonds privés. Dans certains États, la recherche dans le domaine des CESh a toujours été très active, notamment en Californie, où le vote de la proposition 71 en novembre 2004 a permis la création du « California Institute for Regenerative Medicine » (trois milliards de dollars alloués sur onze ans).
Les lignées de CESh obtenues avant 2001 sont aujourd'hui obsolètes en raison des avancées réalisées dans ce domaine. La Chambre des représentants avait tenté par deux fois sans succès de lever la restriction concernant l'allocation de financements fédéraux pour ces recherches. En février 2009, le Président Obama a passé un ordre exécutif (et non une loi) autorisant le financement fédéral pour la recherche sur les cellules souches. Cet ordre exécutif peut être annulé par une future administration ce qui pourrait de nouveau bloquer l’avancée des recherches publiques dans ce domaine.
Le 9 mars 2009, le Président Obama a levé les restrictions bloquant la recherche sur les cellules souches embryonnaires et réouvert la possibilité de financement de ces recherches par le « National Institutes of Health » (NIH) et les autres Agences fédérales.
En juillet 2009, les « NIH Guidelines on Human Stem Cell Research » ont été publiées. Ces lignes directrices visent à définir un cadre éthique commun pour faciliter les pratiques de recherche en l'absence de standards fédéraux. Elles déterminent les règles éthiques et juridiques qui entourent l’utilisation des CSEh pour des travaux de recherche financés par des fonds publics. Ces recommandations seront régulièrement réactualisées en fonction de l’état des connaissances dans ce domaine et de l’opinion publique, en concertation avec la présidence des États-Unis et le directeur des NIH.
La signature du décret du 9 mars 2009 permet aux NIH de financer la recherche sur des milliers de lignées cellulaires créées depuis 2001 sur des fonds privées. Ces lignées doivent être conformes aux lignes directrices qui maintiennent certaines limites.
Il est interdit de financer les recherches portant sur l’introduction de CESh ou iPS dans des blastocystes de primates non humains, ou impliquant une reproduction animale dans laquelle l'introduction de CESh ou d'iPS pourrait conduire à une lignée germinale, ou utilisant des CESh dérivées d'embryons humains et conduisant à leur destruction. En outre, il est interdit de financer les recherches sur des CESh issues d'embryons créés dans les cliniques de fertilité dans le seul but de la recherche, ou créées par transfert nucléaire cellulaire somatique, ou créées par parthénogenèse (processus dans lequel le développement embryonnaire des œufs est activé artificiellement sans fécondation par un spermatozoïde).
Il est permis de financer les recherches sur les cellules CSEh issus d'embryons créés par fécondation in vitro (FIV) dans un but reproductif et ne faisant plus l'objet d'un projet parental, ou issus d'embryons ayant subi un diagnostic génétique pré-implantatoire montrant des anomalies, ou issus d'embryons provenant de dons d'individus ayant sollicité un traitement reproductif et ayant donné leur consentement volontaire pour une utilisation de ces embryons dans le cadre de la recherche.
S’agissant des CESh dérivées d'embryons créés avant la parution des lignes directrices, elles doivent soumettre leur matériel au « Working Group of Advisory Committee to the Director » qui fera des recommandations au directeur des NIH, qui prendra une décision finale. Les embryons donnés hors des États-Unis avant la parution des lignes directrices doivent se conformer à ces lignes.
Les chercheurs soumettent leur demande d'approbation pour des lignées cellulaires à l’aide d'un formulaire mis en place sur Internet. Les lignées acceptées sont éligibles pour une utilisation dans le cadre d'une recherche fédérale. Le registre des NIH enregistre les CESh pour lesquelles un financement fédéral est autorisé. Cependant, les NIH ne fournissent pas de formulaire de consentement de référence. Le consentement autorisant l'utilisation des embryons surnuméraires doit être obtenu au moment du don. Il est possible de faire un don sans restriction, sans bénéfice médical direct, sans compensation financière, sans rémunération en cas de retombées économiques ou d’associer dans le même formulaire de consentement « la participation à un traitement reproductif » et « le choix de faire un don pour la recherche ». Le consentement provient « des personnes qui ont sollicité un traitement reproductif », car elles sont responsables de la création des embryons et de leur utilisation. Les NIH ne peuvent pas interdire qu'un chercheur spécialisé en CESh soit également médecin spécialisé en médecine de la reproduction, mais recommandent une séparation entre ces deux types d'activité.
Les financements fédéraux pour la création de nouvelles lignées de cellules souches embryonnaires restent interdits81, en raison de l'amendement Dickey-Wicker, voté en 1996, prolongé chaque année, qui rend illégale l'utilisation de fonds fédéraux pour la création ou la destruction d'embryons humains. Cet amendement continue de susciter d’âpres débats au Congrès. Sont interdites, dans le cadre d'un financement fédéral : la création d'embryons humains à des fins de recherche, une recherche au cours de laquelle les embryons sont détruits, jetés, ou sciemment exposés à des risques de blessures ou de décès supérieurs à ceux autorisés pour la recherche sur les fœtus in utero. L'amendement Dickey-Wicker ne s'applique pas aux CESh créées avec des fonds privés.
En septembre 2009, le « NIH Human Embryonic Stem Cell Registry » a été mise en place. Il répertorie les lignées de cellules souches embryonnaires humaines créées grâce à des fonds privés et éligibles pour des financements publics, s’ils ont été obtenus dans les règles. C’est-à-dire avec la preuve du consentement des personnes, ce qui peut poser problème.
Les NIH et la nouvelle administration américaine encouragent désormais les recherches sur les cellules souches de toute provenance (adultes, embryonnaires ou iPS) pour ne pas entraver des travaux de recherche qui pourraient mener à des applications thérapeutiques éventuelles.
Les problèmes de bioéthique associés aux recherches sur les cellules souches embryonnaires humaines sont liés au fait que ces recherches sont financées principalement par des compagnies pharmaceutiques, dont on peut craindre la partialité quant aux retombées économiques de ces travaux.
2. La recherche
L’innovation est omniprésente dans le domaine de la recherche sur les cellules souches embryonnaires humaines : 55 demandes de brevets déposés, deux acceptés à l’université du Wisconsin, un essai clinique agréé par la FDA au profit de Geron (régénération de lésions aiguës de la mœlle épinière par des oligodendrocytes dérivés de cellules souches embryonnaires humaines). Il est suspendu.
La FDA approuve des essais pré cliniques et cliniques. Un essai clinique est actuellement en cours utilisant des cellules dérivées de cellules souches embryonnaires humaines. Les problèmes posés par ces cellules indifférenciées concernent majoritairement l’apparition de tératomes. La grande majorité des projets de recherche utilisant des CSEh à visée thérapeutique sont réalisés par des industries pharmaceutiques privées, les NIH n’ayant pas de droit de regard sur ces recherches. Les représentants de la FDA n’ont ni confirmé, ni infirmé l’existence, aux États-Unis, d’autres essais cliniques sur l’homme utilisant des lignées cellulaires dérivées de cellules souches embryonnaires humaines, ce type d’information restant strictement confidentiel.
Selon nos interlocuteurs,82 les droits de propriété intellectuelle actuels ne sont pas adaptés à ce type de recherche. Il est nécessaire de mener un débat public afin d’évaluer l’adéquation des lois actuelles encadrant la propriété intellectuelle aux recherches sur les cellules souches embryonnaires.
Le plan de relance que le président Obama a fait adopter l’année dernière incluait 10 milliards de dollars supplémentaires sur la seule année fiscale 2009 au bénéfice du National Health Institute, dont un milliard pour les recherches sur les cellules souches.
Crédits fédéraux de soutien à la recherche sur les cellules souches embryonnaires
(en million de dollars)
Research/Disease |
2005 |
2006 |
2007 (brutes) |
2007 |
2008 |
2009 |
2010 (estimation) |
Stem Cell Research |
609 |
643 |
657 |
968 |
938 |
963 |
977 |
dont : - Embryonic- Human |
40 |
38 |
42 |
74 |
88 |
91 |
92 |
- Embryonic - Non-Human |
97 |
110 |
106 |
120 |
150 |
154 |
155 |
- Nonembryonic - Human |
199 |
206 |
203 |
226 |
297 |
305 |
311 |
- Non-Human |
273 |
289 |
306 |
400 |
497 |
511 |
518 |
Stem Cell Research -Umbilical Cord Blood/ Placenta |
18 |
19 |
22 |
44 |
46 |
47 |
48 |
dont : - Human |
15 |
16 |
19 |
38 |
38 |
39 |
39 |
- Non-Human |
3 |
4 |
2 |
9 |
9 |
9 |
9 |
Sources : Synthèse de données transmises à l’Ambassade de France aux États-Unis
L’État de Californie a de même lancé un emprunt de 3 milliards de dollars destiné à financer des recherches sur ces cellules. Le premier appel d’offres a été lancé en octobre 2009 par le CIRM (Californian Institute for Regenerative Medicine). Cet institut créé en 2004 après une votation populaire a commencé de travailler en 2006 sur 14 projets thérapeutiques pour un montant total de 230 millions de dollars, auxquels s’ajoutent 43 millions de dollars alloués par des instituts de recherche anglais et canadiens. Sur ces 14 projets, 4 portaient sur des cellules souches embryonnaires et 10 sur des cellules souches de type hématopoïétiques ou mésenchymateuses transformées, plusieurs étant menés en collaboration avec des sociétés de biotechnologies.
Ê Norvège
1. La législation
Depuis 1987, l’utilisation d’œufs ou d’embryons humains fertilisés est réglementée dans le cadre légal prévu pour la reproduction assistée (loi relative à la reproduction assistée médicalement). En 1994, la loi relative à l’application des biotechnologies en médecine humaine (loi sur les biotechnologies) a maintenu l’interdiction des recherches sur les œufs fertilisés. Un amendement à cette loi (2002), a également interdit l’utilisation de lignées de cellules souches dérivées d’œufs fertilisés. L’interdiction déjà existante du clonage reproductif (depuis 1998) a aussi été étendue au clonage thérapeutique.
La loi sur les biotechnologies a été de nouveau amendée le 15 juin 2007. Depuis son entrée en vigueur le 1er janvier 2008, les recherches sur les cellules souches embryonnaires sont autorisées sous certaines conditions.
La recherche sur les œufs fertilisés surnuméraires ou sur les cellules souches embryonnaires dérivées d’œufs fertilisés surnuméraires, est possible si l’objectif est d’améliorer la fertilisation in vitro, de développer ou d’améliorer les techniques pour les diagnostiques préimplantatoires ou d’enrichir les connaissances sur le traitement des maladies graves.
Le projet de recherche doit obtenir un accord de la part du comité éthique régional. Le couple donneur ou le donneur de sperme doivent donner leur consentement. La création d’embryons uniquement à des fins de recherche, la recherche sur des embryons âgés de plus de quatorze jours (période de congélation non incluse), l’implantation d’un embryon utilisé dans un but de recherche (qui doit être détruit), l’étude de méthodes de thérapie génique de lignées germinales sont interdites.
Le clonage d’êtres humains, la recherche sur des embryons clonés ou sur des lignées cellulaires dérivées de tels embryons et la production d’embryons par insertion de matériel génétique humain dans un ovocyte d’animal restent interdits.
2. La recherche
Depuis 2002, la recherche sur les cellules souches somatiques (adultes) est un domaine stratégique et prioritaire, soutenu par le ministère de la santé et, depuis 2007, par le ministère de l’éducation et de la recherche. Le conseil norvégien de la recherche (CNR) est en charge du financement des activités de recherche. Depuis 2008, le gouvernement norvégien a suivi la nouvelle loi sur les biotechnologies en augmentant le budget alloué (de 15,7 millions de couronnes (NOK) en 2007 à 25,7 en 2008) et en créant un programme spécifique de recherche sur les cellules souches sur 2008-2012. Ce programme comprend à la fois des appels ouverts avec financement de projets attribués sur une base concurrentielle, et la création d’un centre national pour la recherche sur les cellules souches sous les auspices des autorités de santé de la région sud-est de la Norvège. Le budget total de recherche sur les cellules souches pour la période 2003-2012 est de 170 MNOK (environ 20 M€), dont 116,5 MNOK pour la période 2008-2012 incluant 28 MNOK pour le centre national.
Le centre norvégien de recherche sur les cellules souches est situé sur le site du centre hospitalo-universitaire d’Oslo afin de favoriser les liens entre les groupes de recherche fondamentale de l’Institut des sciences médicales fondamentales de l’Université d’Oslo et les groupes de recherches cliniques des hôpitaux de l’université d’Oslo. Ce centre accueille une infrastructure nationale complètement rénovée pour la production, la caractérisation et le stockage de cellules souches pluripotentes humaines (iPS). Le centre organise des réunions, des séminaires et des cours ainsi que la communication scientifique.
La recherche sur les cellules souches est également financée dans le cadre des activités de deux centres d’excellence : le centre de biologie moléculaire et des neurosciences et le centre de biomédecine pour le cancer. Le dispositif des Centres d’excellence (CoE) a été instauré par le Conseil de la recherche afin d’amener plus de chercheurs et groupes de recherche norvégiens à un standard international.
Le Centre de recherche pour l’innovation (« Cancer Stem Cell Innovation Center (CAST) » est un des centres de recherche basée sur l’innovation (CRI) labellisé. Les 14 CRI sélectionnés en 2007 sont financés par un budget d’environ 10 MNOK par an pendant 8 ans. L’institution hôte et les partenaires doivent contribuer en apportant au minimum le même financement que le conseil de la recherche.
Ê Les Pays Bas
La « loi embryon » adoptée en juin 2002 et révisée en 2008, interdit le clonage humain, la création d’embryons humains in vitro. Le clonage animal doit faire l’objet d’une demande de licence mais ne peut servir à un usage ultérieur sur l’humain. La recherche en matière de cellules souches adultes humaines ne pose pas de problème d’ordre éthique et est donc autorisée au même titre que la recherche sur n’importe quelle autre cellule du corps humain adulte.
Le Conseil pour la santé et les soins publics, organisme consultatif indépendant travaillant pour le Parlement et le Gouvernement, assure une veille sur ces questions.
Le Centre pour l’éthique et la santé créé en mai 2003, en association avec le Conseil de santé publique, évalue les avancées des questions d’éthique en regard des enjeux de la santé publique. La Commission centrale pour la recherche liée à l’homme est chargée de surveiller la recherche biomédicale chez l’homme sous toutes se formes : c’est elle qui attribue le droit de générer des lignées de cellules souches embryonnaires humaines.
Ê La Suisse
Au niveau fédéral, seules les lignées de cellules souches embryonnaires sont régies par un cadre spécifique, défini par la loi fédérale relative à la recherche sur les cellules souches embryonnaires (loi du 19 décembre 2003, elle-même complétée par l’ordonnance relative à la recherche sur les cellules souches embryonnaires du 2 février 2005. La loi et l’ordonnance, entrées en vigueur le 1er mars 2005, fixent les conditions régissant la production de cellules souches embryonnaires humaines à partir d’embryons humains surnuméraires, et l’utilisation de ces cellules à des fins de recherche.
Il est interdit de produire des cellules souches à partir d'embryons créés à des fins de recherche ou d'utiliser de telles cellules souches. Il est également interdit d'importer ou d'exporter des embryons surnuméraires ou de laisser se développer un embryon surnuméraire à des fins de recherche au-delà du quatorzième jour. Il est interdit de céder ou d'acquérir des embryons surnuméraires ou des cellules souches embryonnaires contre rémunération.
Les embryons surnuméraires et les cellules souches embryonnaires ne peuvent être utilisés qu'à des fins de recherche et en aucun cas à des fins commerciales. De ce fait, l'utilisation d'embryons surnuméraires ou de cellules souches embryonnaires est autorisée uniquement dans le cadre de projets de recherche précis, sauf s'il s'agit de la production de cellules souches embryonnaires qui est autorisée en vue de recherches futures.
Un embryon surnuméraire ne peut être utilisé à des fins de recherche qu'avec le consentement du couple, lequel a été préalablement informé de l'utilisation de l'embryon. Il ne doit y avoir aucun lien de dépendance entre la recherche sur les embryons surnuméraires, ou la production de cellules souches embryonnaires, et la procédure de procréation médicament assistée du couple concerné.
L'autorisation de l'Office fédéral de la santé publique est nécessaire pour lancer une recherche sur des embryons surnuméraires ou pour produire des cellules souches embryonnaires. Une recherche impliquant des cellules souches embryonnaires déjà existantes ne peut démarrer que si la commission d'éthique compétente a rendu un avis favorable. La recherche impliquant des embryons surnuméraires ou des cellules souches embryonnaires ne peut être réalisée que si des connaissances d'égale valeur ne peuvent pas être obtenues autrement. La recherche sur les cellules souches adultes, bien qu'également prometteuse, est aujourd'hui trop incertaine pour pouvoir constituer une alternative valable.
Tout projet de recherche impliquant des embryons surnuméraires ou des cellules souches embryonnaires doit remplir des critères éthiques et faire la preuve de sa pertinence scientifique. Les résultats d'un projet de recherche impliquant des embryons surnuméraires ou des cellules souches embryonnaires doivent être rendus publics, dès l'achèvement ou l'interruption du projet.
Les cellules souches embryonnaires ne peuvent être importées qu'à certaines conditions bien précises. Elles ne doivent pas être issues d'un embryon produit à des fins de recherche, c'est-à-dire qu'elles doivent être issues d'un embryon surnuméraire. Le couple concerné doit, d'une part, avoir préalablement donné son consentement pour l'utilisation de l'embryon à des fins de recherche et, d'autre part, ne pas avoir reçu de rémunération.
En dehors de la loi et de l’ordonnance, il est à noter que, lors de la votation fédérale du 7 mars 2010, la population suisse a accepté par 77,2 % la modification de la Constitution de la Confédération par l’arrêté fédéral relatif à un article constitutionnel concernant la recherche sur l’être humain. Le consentement des sujets, l’évaluation de l’utilité des projets de recherche par rapport aux risques et contraintes encourus, ainsi que l’avis d’une expertise indépendante garantissant la protection des personnes, sont désormais inscrits dans la Constitution.
Ê Allemagne
1. La législation
Le 28 juin 2002, l'Allemagne s'est dotée d'une loi sur les cellules souches modifiée le 11 avril 2008 par le Bundestag, qui s'est prononcé en faveur d'un relatif assouplissement. La loi de 2002 stipulait que seules les cellules souches embryonnaires obtenues en dehors du territoire allemand avant le 1er janvier 2002 pouvaient être importées et utilisées dans le cadre d'activités de recherche. Cette date butoir (ou date de référence) a été reportée au 1er mai 2007.
La loi sur les cellules souches interdit l'importation de cellules souches embryonnaires humaines mais les autorise exceptionnellement à des fins de recherche et sous certaines conditions. Au préalable une autorisation doit être délivrée par l'administration compétente, à savoir l'Institut Robert Koch (RKI). La Commission centrale d'éthique sur les cellules souches, instituée par la loi sur les cellules souches de 2002, participe également à la procédure d'autorisation. Pour que celle-ci soit délivrée, les cellules souches faisant l'objet de la demande doivent remplir certaines conditions, et notamment avoir été obtenues dans le pays d'origine avant le 1er mai 2007, être issues d'embryons surnuméraires, issus d'une fécondation médicalement assistée mais qui n'ont pas été écartés en raison de leurs caractéristiques génétiques, et servir à des projets de recherche prioritaires visant à apporter des connaissances ne pouvant vraisemblablement être acquises qu'à l'aide de cellules souches embryonnaires.
Les chercheurs qui pratiqueraient des recherches sur des cellules souches sans avoir obtenu au préalable cette autorisation s'exposent à des sanctions pénales. En Allemagne, seules sont autorisées les recherches avec des cellules souches embryonnaires susceptibles de permettre des progrès thérapeutiques majeurs et à la condition de ne pouvoir être menées par une méthode alternative d’efficacité comparable.
Les modifications intervenues en 2008 élargissent le panel contingenté des lignées autorisées qui atteint 500. La nouvelle version de la loi exclut explicitement qu'un chercheur allemand soit poursuivi au titre de la loi sur les cellules souches pour avoir participé à un projet portant sur des cellules souches localisées à l'étranger. En revanche, les sanctions pénales induites par la loi sur la protection de l'embryon en cas de participation à des projets de recherche étrangers entraînant la destruction d'embryons pour la production de cellules souches, restent inchangées.
En outre, en Allemagne il n’y a pas de législation réglementant les activités de recherche sur les cellules souches adultes. Les patients doivent donner leur accord pour le prélèvement de moelle osseuse ou de sang de cordon ombilical.
2. La recherche
L'Allemagne a décidé de soutenir fortement la recherche sur les cellules souches adultes à travers plusieurs programmes. Au-delà de la nécessité de progresser dans la connaissance du potentiel des cellules souches adultes pour éviter le recours aux cellules souches embryonnaires, l'utilisation des cellules souches (adultes) pourrait, dans certains cas, être également envisagée comme une alternative aux transplantations d'organes, ce qui est particulièrement important dans le contexte actuel de pénurie de dons d'organes en Allemagne.
En 1999, le ministère fédéral de l'enseignement et de la recherche (BMBF) a fait de la recherche sur les substituts biologiques assurant les fonctions d'organes un axe de soutien prioritaire. Via cette mesure, le potentiel thérapeutique des cellules souches pour différentes pathologies de société (ex. : diabète, maladie de Parkinson, ostéoporose, infarctus) a été sondé. Jusqu'en 2005, environ 10 millions d'euros ont été mis à disposition de 32 projets.
En 2004, ce ministère a lancé un autre axe prioritaire de soutien, intitulé « médecine régénératrice basée sur les cellules ». Dans cet axe, qui s'appuie sur une approche interdisciplinaire associant au sein de projets de partenariat biologie, médecine et sciences de l'ingénieur, les connaissances actuelles sur les cellules souches sont appliquées et approfondies, afin de progresser sur des pistes de mise en œuvre clinique. 47 projets sont regroupés en 10 groupements et un projet individuel. La première phase de trois ans, qui a démarré en 2005, bénéficie d'un soutien de 12,6 millions d'euros.
La deuxième phase de ces projets a débuté en 2008. Dans ces deux axes prioritaires de recherche, certains projets mènent des travaux de recherche sur des cellules souches embryonnaires humaines. Les travaux concernés et la nécessité de l'utilisation de cellules souches pour les mener à bien ont été examinés par l'Institut Robert Koch, qui leur a accordé son autorisation. Ils sont en conformité avec la loi sur la protection de l'embryon.
Un autre axe de recherche prioritaire a été mis en place. Il s'agit de l'obtention de cellules souches pluripotentes ou multipotentes. Ce programme s'intéresse en particulier aux perspectives liées à la dédifférenciation et à la reprogrammation de cellules souches adultes humaines et de mammifères, ainsi qu'à l'utilisation des cellules pluri- et multipotentes présentes de manière naturelle chez l'homme.
Deux autres mesures de soutien concernent, de plus, l'ingénierie des tissus et les centres de transplantation pour la médecine régénératrice. Les moyens accordés par le ministère fédéral de la recherche pour ces deux programmes portant sur les cellules souches s'élèvent à 10 millions d'euros par an, de 2001 à 2011.
En 2006, l'Agence de moyens pour la recherche allemande a financé à hauteur de 5 millions d'euros la création d'un centre de recherche sur les thérapies régénératrices « des cellules aux tissus et aux thérapies » à Dresde. Par ailleurs, 2 des 17 clusters d'excellence désignés à l'automne 2007 par cette agence se consacrent à la médecine régénératrice. Ces clusters reçoivent 7,5 millions d'euros par an, sur 5 ans, pour leurs travaux.
ÊPologne
1. La législation
En Pologne, il n’y a pas de loi spécifique sur la bioéthique ou les cellules souches. La loi du 7 janvier 1993, dispose que la vie de l’enfant à naître doit être respectée et protégée dès la conception. La constitution de 1997 contient deux articles relatifs à la protection juridique de la vie et à l’interdiction, sans libre consentement, de l’expérience scientifique et médicale (art. 39), limitant ainsi la marge de manœuvre du législateur.
À la demande du gouvernement en 2006, des experts de l’Académie polonaise des sciences avaient produit un rapport proposant de conserver la législation en vigueur et de créer un Comité national de bioéthique pouvant se saisir de cette question.
Une « commission sur la convention de bioéthique » a été créée en avril 2008. Elle devait formuler des propositions au Gouvernement concernant la recherche sur les cellules souches embryonnaires et le clonage thérapeutique, actuellement interdits par la législation.
Les travaux de cette commission, qui devait également formuler des propositions législatives sur la fécondation in vitro, se sont interrompus au deuxième semestre 2009.
2. La recherche
Un certain nombre de laboratoires de l’Académie polonaise des sciences conduisent des recherches sur les cellules souches adultes et les cellules souches extraites du cordon ombilical du nouveau-né.
Une banque de cellules souches à base de sang prélevé sur les cordons ombilicaux des nouveaux-nés a été créée en 2002. Elle propose aux familles, à titre onéreux, des thérapies innovantes fondées sur les cellules souches, notamment pour les enfants atteints de leucémie.
La création attendue d’un comité ou d’une commission nationale de bioéthique n’est toujours pas réalisée. On peut s’interroger, à ce sujet, sur l’influence de la communauté scientifique, dispersée aux travers d’un grand nombre de commissions de bioéthique auprès d’organismes variés : Académie de médecine, chambres régionales de médecins, grands hôpitaux, instituts de recherche ainsi qu’au sein de la commission bioéthique de l’église polonaise.
Comme l’ont montré les débats de la récente campagne présidentielle, les sujets de bioéthique (notamment la fécondation in vitro) demeurent sensibles en Pologne, ou les partisans d’une protection inconditionnelle de l’embryon semblent à ce stade majoritaires.
D. LE MARCHÉ MONDIAL DE LA THÉRAPIE CELLULAIRE
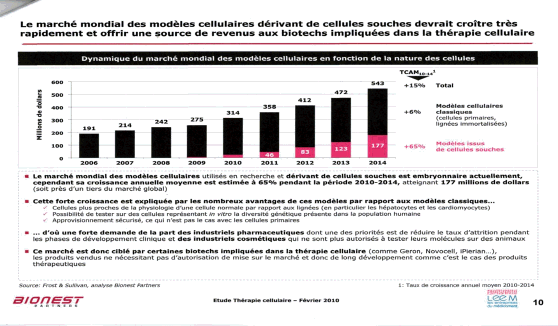
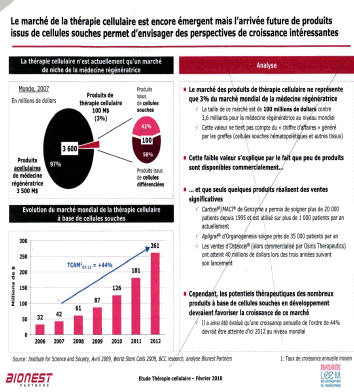
Source : Institute for Science and Society, Avril 2009, World Stem Cells 2009,
BBC research, Analyse Bionest Partners
III. L’ÉTAT DES LIEUX DES RECHERCHES SUR LES CELLULES SOUCHES EN FRANCE
Au 31 décembre 2007, on dénombrait 154 822 embryons cryo conservés, dont 62 % étaient en cours de projet parental.
Au 23 novembre 2009, 871 embryons étaient enregistrés par l’ABM en tant qu’objets d’un protocole de recherche autorisé.
A la même date, on comptait 20 lignées de cellules souches embryonnaires dérivées à partir d’embryons et déclarées auprès des services de l’ABM.
Enfin, depuis 2005, 97 lignées de cellules souches embryonnaires ont été importées par des équipes de recherches présentes sur le territoire.
Nombre d’embryons faisant l’objet d’une recherche
2006 |
2007 |
2008 |
2009 |
Total cumulé |
37 embryons |
251 embryons |
156 embryons |
427 embryons |
871 embryons |
A. LES DONNÉES TRANSMISES PAR L’AGENCE DE LA BIOMÉDECINE (ABM) EN TERMES D’AUTORISATION DE RECHERCHE SUR LES CSEH
L’Agence de la biomédecine a effectué un relevé de l’ensemble des autorisations de recherches qu’elle a délivrées ; il figure en annexe83 du rapport sur la base de celui figurant sur le site en juin 2010. Il se peut que d’ici la fin du moratoire, le 5 février 2010, l’Agence soit conduite à délivrer d’autres autorisations de recherches. Elle a sensibilisé les chercheurs à ce problème, et ceux-ci, conscients des difficultés qui pourraient surgir, ont déposé nombre de demandes d’autorisation : une fois le délai expiré les recherches sur les CES seront interdites.

Source : Audition publique du 27 janvier 2010 – Présentation de Mme Emmanuelle Prada-Bordenave
2. L’état des lieux de la recherche sur les embryons et les cellules souches embryonnaires

Source : Audition publique du 27 janvier 2010 – Présentation de Mme Emmanuelle Prada-Bordenave
On constate une forte concentration des équipes de recherche sur l’Ile-de-France et dans les régions dotées de centre de diagnostic prénatal : Paris, Montpellier et Strasbourg.
Les thématiques de recherches concernant les CSEh sont résumées dans le tableau suivant :

Source : Audition publique du 27 janvier 2010 – Présentation de Mme Emmanuelle Prada-Bordenave
3. L’importance du bilan annuel de l’Agence de la biomédecine
Tout au long des entretiens et auditions, chaque intervenant a salué le rôle de l’Agence de biomédecine. Elle a su adapter les procédures comme nous le montrerons dans la dernière partie du rapport. Elle n’a autorisé que les projets de recherche qui correspondaient aux exigences de la loi, sans tomber dans la fascination scientifique et technologique, ni pénaliser inutilement les chercheurs. Les liens entre cette institution et l’OPECST doivent être pérennisés. Elle constitue une source d’informations et d’alerte efficace. C’est pourquoi, comme nous le recommandions dans le rapport précité sur la loi bioéthique de demain, nous souhaitons que des réunions communes soient organisées et que l’Agence puisse alerter l’OPECST, si cela s’avère nécessaire.
Recommandation n° 6 :
– L’Agence de la biomédecine présente son rapport annuel d’activité qu’elle transmet au Président de la République, au Gouvernement, au Parlement qui en saisit l’OPECST ;
– Elle dresse un bilan annuel des autorisations de recherches sur les cellules souches embryonnaires ;
– Elle fait état des recherches effectuées à l’étranger et transmet ses recommandations.
B. LES DONNÉES TRANSMISES PAR L’ALLIANCE POUR LES SCIENCES DE LA VIE ET DE LA SANTÉ (AVIESAN)
La diversité des projets de recherche figurant dans les tableaux transmis par l’AVIESAN souligne l’intérêt des scientifiques français. Ces recherches portent sur toutes les catégories de cellules, parfois même une seule recherche concerne des cellules souches embryonnaires et des cellules souches adultes.
1- Les cellules souches embryonnaires humaines (CSEh)
Les recherches en France sur les CSE sont presque toutes à visée cognitive, elles portent sur la production de lignées épidermiques, limbiques, des modèles de cellules souches malignes et les systèmes de différenciation. Les mécanismes de la pluripotence font l’objet de plusieurs projets de recherche. En outre, de nombreux projets portent sur les cellules souches embryonnaires animales notamment pour étudier les effets du transfert de gènes.
2- Les cellules souches adultes humaines (CSA)
Les projets de recherche sur les CSA portent principalement sur les tissus adipeux, l’épiderme humain et les cellules hématopoïétiques. Le rôle des cellules macrophages dans les cancers est particulièrement étudié ainsi que les possibilités de cumuler les thérapies géniques et thérapies cellulaires, notamment dans les maladies héréditaires.
De nombreux projets de recherche visent à la compréhension de l’effet de la niche dans l’environnement des cellules souches et des cellules cancéreuses. Les mécanismes de prolifération des cellules souches font également l’objet de recherches afin de mieux comprendre la carcinogénèse pour combattre les cancers.
3- Les cellules souches pluripotentes induites (iPS)
Les projets de recherches portent sur les mécanismes de la pluripotence et sur la comparaison entre CSE et iPS. Les modèles animaux sont utilisés par les équipes.
État des lieux de la recherche avec des cellules souches embryonnaires et somatiques en France, transmis par l’AVIESAN
ÉQUIPES DE RECHERCHE UTILISANT DES CELLULES SOUCHES EMBRYONNAIRES HUMAINES
ÉQUIPES DE RECHERCHE UTILISANT DES CELLULES REPROGRAMMÉES
EQUIPES DE RECHERCHE UTILISANT DES CELLULES SOUCHES MÉSENCHYMATEUSES
Nom Prénom |
Unité de recherche |
Titre du projet |
Tissu ciblé |
Bouloumie Anne |
U 858 |
Les cellules souches / Progénitrices du tissu adipeux |
Vasculaire |
Casteilla Louis / Sensébé Luc |
Unité STROMALAB |
Cellules mésenchymateuses, homéostasie tissulaire et régénération |
Vasculaire et Hématopoïèse |
Dani Christian |
UMR 6543 |
Cellules souches et différenciation |
Tissu adipeux |
Jorgensen Christian |
U 844 |
Cellules souches mésenchymateuses, environnement articulaire et immunothérapies de la polyarthrite rhumatoïde |
Tissu conjonctif |
Larghero Jérôme |
CBT501 |
Cellules mésenchymateuses normales et pathologiques |
Hématopoïèse, os, vasculaire, œsophage |
Lataillade Jean-jacques |
U 972 |
Intérêt des Cellules Stromales Mésenchymateuses en Médecine Régénérative (traumatologie de guerre) |
Peau, os |
Lemarchand Patricia |
U 915, CIC 4 |
Thérapie cellulaire cardiaque avec des cellules souches adultes : du patient à la cellule |
Cœur |
Marie Pierre |
U 606 |
Biologie et pathologie de l'ostéoblaste |
Os |
Menasché Philippe/ Pucéat Michel |
U 633 |
Thérapie cellulaire en pathologie cardio -vasculaire |
Coeur |
Adnot Serge / Rodriguez Anne-Marie |
U 955 |
Amélioration du potentiel cardio-myogénique de cellules souches non immunogénique dérivées de tissu adipeux |
Cœur |
Tarte Karin |
U 917 |
Microenvironnement et cancer |
Immunosuppression |
Uzan Georges |
U 972 |
Les cellules souches : de leurs niches aux applications thérapeutiques |
Hématopoïèse et vasculaire |
EQUIPES DE RECHERCHE UTILISANT DES CELLULES SOUCHES SOMATIQUES HUMAINES
(hors CS Mésanchymateuses)
Nom Prénom |
Unité de recherche |
Titre du projet |
Tissu ciblé |
Allemand Isabelle |
U 967 |
Laboratoire Gamétogenèse, Apoptose et Génotoxicité |
Tissu germinal |
Amédée Joëlle |
U577 |
Biomatériaux et réparation tissulaire |
Biomatériaux et réparation osseuse |
Aubourg Patrick |
U 745 |
Thérapie génique de l’adrénoleucodystrophie liée à l’X |
Tissus hématopoïétique et nerveux |
Benoit Jean-Pierre / Montero-Menei Claudia |
U646 |
Ingénierie de la vectorisation particulaire |
Réparation neurale, biomatériaux |
Bernard Olivier |
U 985 |
Cellules souches hématopoïétiques normales et leucémiques |
Hématopoïèse |
Birembaut Philippe / Coraux Christelle |
U 903 |
Etude des mécanismes cellulaires et moléculaires de la régénération et du remodelage de l’épithélium respiratoire des voies aériennes humaines. Identification des cellules souches épithéliales. |
Epithélium respiratoire |
Canque Bruno |
U 944 |
Etapes précoces de la lymphopoïèse humaine |
Hématopoïèse |
Cavazzana-Calvo Marina |
U 768 |
Thérapeutique des déficits immunitaires héréditaires par thérapie cellulaire et génique |
Hématopoïèse |
Chelly Jamel/ Chazaud Benedicte |
Institut Cochin U1016 |
Caractérisation des cellules souches musculaires humaines dans le muscle normal et dystrophique |
Muscles |
Corlu Anne / Guillouzo Christiane |
U991 |
Foie, métabolisme et cancer |
Foie |
Isabelle Dusanter / Elisabeth Cramer |
U1016 |
De la cellule souche hémopatopoïétique à la plaquette : identification des régulateurs en conditions normales et pathologiques |
Hématopoïèse |
de Verneuil Hubert |
U 876 |
Transfert de gènes à visée thérapeutique dans les cellules souches |
Hématopoïèse |
Douay Luc |
U 938 |
Génération in vitro de globules rouges à partir de cellules souches pluripotentes adultes et embryonnaires |
Erythrocytes |
Ferry Nicolas |
U948 |
Biothérapies hépatiques |
Foie |
Galy Anne |
U 951 |
Thérapie génique de déficits immunitaires et de dystrophies musculaires |
Muscles, Hématopoïèse |
Garcia Sylvie |
URA 1961 |
Biologie des populations lymphocytaires |
Hématopoïèse |
Goureau Olivier |
U 968 |
Morphogenèse et développement du système visuel : régulations cellulaires et moléculaires |
Oeil |
Hamel Christian / Hugnot Jean-Pierre |
U583 |
Plasticité du système nerveux, cellules souches et tumeurs gliales |
Tissu nerveux |
Jaffredo Thierry |
UMR 7622 |
Identification des mécanismes cellulaires et moléculaires impliqués dans la production des cellules souches hématopoïétiques chez l’embryon |
Hématopoïèse et vasculaire |
Joubert Dominique / Hollande Frédéric |
Institut de Génomique Fonctionnelle |
Signalisation et cancer |
Intestins |
Maguer-Satta Véronique |
U590 |
Pharmaco génomique et chimiorésistance |
Sein |
Martin Michèle |
U 967 |
Cellules souches de l’épiderme humain : homéostasie, potentiel régénératif et radiosensibilité |
Peau |
Maurel Patrick / Daujat-Chavanieu Martine |
U632 |
Différenciation hépatique des cellules souches et biothérapie des maladies du foie |
Foie |
Peschanski Marc / Onteniente Brigitte |
U 861 |
Potentiel des cellules souches embryonnaires et des cellules souches induites à la pluripotence (iPS) dans les lésions neuro vasculaires |
Vasculaire |
Pflumio Françoise |
U 967 |
Etude du rôle des voies SCL/TAL1, Notch et ERK dans les cellules souches hématopoïétiques normales et dans les leucémies aigues lymphoblastiques T humaines |
Hématopoïèse |
Porteu Françoise |
U 1016 |
MAPK, cellules souches et différenciation hématopoïétique |
Hématopoïèse |
Savatier Pierre |
U 846 |
Cellules souches embryonnaires : étude des mécanismes de la pluripotence chez la souris et les primates |
Cellules souches embryonnaires |
Taylor Naomi |
UMR5535 |
Immuno modulation et immunothérapie |
Hématopoïèse |
Vainchenker William |
U 1009 |
Erythropoïèse et mégacaryopoïèse normale et pathologique |
Hématopoïèse |
Voit Thomas / Butler-Browne Gillian |
U 974 |
Remodelage, régénération et thérapie du muscle strié |
Muscles |
Weber Anne |
U 972 |
Progéniteurs hépatiques et endothéliaux |
Foie |
Klein Bernard |
U 847 |
Traitements cibles et biothérapie des cancers lymphoïdes |
Hématopoïèse |
Bennaceur-Griscelli Annelise |
U 935 |
Modèles de cellules souches malignes et thérapeutiques |
Maladies génétiques |
Lehmann Sylvain |
IGH |
Pathologies neurologiques et cellules souches |
Tissu nerveux, prions |
Lemaitre Jean-Marc |
U 661 |
Plasticité du génome et vieillissement cellulaire |
Cellules souches embryonnaires |
Prévot Vincent |
U 816 |
Développement et Plasticité du cerveau postnatal |
Tissu nerveux |
Louache Fawzia |
U 1009 |
Cellules souches hématopoïétiques et migration |
Hématopoïèse |
EQUIPES DE RECHERCHE UTILISANT DES CELLULES SOUCHES ANIMALES NON HUMAINES
EQUIPES DE RECHERCHE UTILISANT DES CELLULES SOUCHES CANCÉREUSES
Nom Prénom |
Unité de recherche |
Titre |
Cible |
Epelbaum Jacques / Chneiweiss Hervé |
U 894 |
Contrôle épigénétique par le microenvironnement des cellules souches cancéreuses de gliomes |
Gliomes |
Hamel Christian / Hugnot Jean-Pierre |
U583 |
Plasticité du système nerveux, cellules souches et tumeurs gliales |
Gliomes |
Klein Bernard |
U 847 |
Traitements cibles et biothérapie des cancers lymphoïdes |
Lymphomes |
Bernard Olivier |
U 985 |
Cellules souches hématopoïétiques normales et leucémiques |
Leucémies |
Birnbaum Daniel / Charafe-Jauffret Emmanuelle |
IFR 137 |
Cellules souches cancéreuses |
Cancer du sein |
Canque Bruno |
U 944 |
Etapes précoces de la lymphopoïèse humaine |
Leucémies |
Pflumio Françoise |
U 967 |
Etude du rôle des voies SCL/TAL1, Notch et ERK dans les cellules souches hématopoïétiques normales et dans les leucémies aigües lymphoblastiques T humaines |
Leucémies |
Porteu Françoise |
U 1016 |
MAPK, cellules souches et différenciation hématopoïétique |
Leucémies |
Roméo Paul-Henri |
U 967 |
Transcription et Réparation dans les Cellules Souches Hématopoïétiques |
Leucémies |
Vainchenker William |
U 1009 |
Erythropoïèse et mégacaryopoïèse normale et pathologique |
Leucémies |
Louache Fawzia |
U 1009 |
Cellules souches leucémiques et migration |
Leucémies |
Peyron Jean-François |
U 895 |
Inflammation, Cancer, Cellules Souches Cancéreuses |
Lymphomes |
Corlu Anne / Guillouzo Christiane |
U991 |
Foie, métabolisme et cancer |
Hépatocarcinome |
Joubert Dominique / Hollande Frédéric |
Institut de Génomique Fonctionnelle |
Signalisation et cancer |
Cancers digestifs |
Glukhova Marina / Deugnier Marie-Ange |
UMR144 |
Développement de la glande mammaire murine |
Cancer du sein |
Bennaceur-Griscelli Annelise |
U 935 |
Modèles de cellules souches malignes et thérapeutiques |
Leucémies Maladies génétiques |
Birnbaum Daniel / Charafe-Jauffret Emmanuelle |
IFR 137 |
Cellules souches cancéreuses |
Cancer du sein |
Perret Christine |
Institut Cochin |
Endocrinologie, métabolisme et cancer |
Hépatocarcinome |
Delattre Olivier |
U 830 |
Génétique et biologie des tumeurs pédiatriques et cancers du sein sporadiques |
Sarcome d'Ewing, les tumeurs rhabdoïdes malignes et le neuroblastome, du médulloblastome et cancer du sein |
Maguer-Satta Véronique |
U590 |
Pharmaco génomique et chimiorésistance |
Cancer du sein |
Tarte Karin |
U 917 |
Microenvironnement et cancer |
Lymphomes |
EQUIPES DE RECHERCHE UTILISANT DES CELLULES SOUCHES ET DE LA THÉRAPIE GÉNIQUE
Nom Prénom |
Unité de recherche |
Titre du projet |
Tissu ciblé |
Fischer Alain / Cavazzana-Calvo Marina |
U 768 |
Thérapeutique des déficits immunitaires héréditaires par thérapie cellulaire et génique |
Hématopoïèse |
De Verneuil Hubert |
U 876 |
Transfert de gènes à visée thérapeutique dans les cellules souches |
Hématopoïèse |
Taylor Naomi |
UMR5535 |
Immunomodulation et immunothérapie |
Hématopoïèse |
Aubourg Patrick / Cartier Nathalie |
U 745 |
Thérapie génique de l’adrénoleucodystrophie liée à l’X |
Hématopoïèse |
Ferry Nicolas |
U948 |
Biothérapies hépatiques |
Foie |
Galy Anne |
U 951 |
Thérapie génique de déficits immunitaires et de dystrophies musculaires |
Muscles, Hématopoïèse |
Weber Anne |
U 972 |
Progéniteurs hépatiques et endothéliaux |
Foie |
Munnich Arnold /Danos Olivier |
U 781 |
Génétique et épigénétique des maladies métaboliques, neurosensorielles et du développement / Transfert de gènes |
Tissu nerveux |
Leboulch Philippe |
U 733 |
Service des thérapies innovantes |
Hématopoïèse |
Boyer Olivier |
U 905 |
Physiopathologie et biothérapies des maladies inflammatoires et auto-immunes de l’appareil locomoteur |
Muscles |
Bonneville Marc / Moullier Philippe |
U 892 |
Vecteurs viraux et transfert de gènes in vivo |
Muscle, œil, cancer |
A. UNE RECHERCHE SUR LES CELLULES SOUCHES EMBRYONNAIRES (CSEH) ET LES CELLULES SOUCHES PLURIPOTENTES INDUITES (IPS) EN RETRAIT
D’après l’AVIESAN84, la recherche amont sur les iPS et les CSEh semble en retrait en France par rapport aux pays anglo-saxons. Ce choix a été fait par l’ensemble des chercheurs travaillant sur les CSEh et les cellules iPS. Il a été semble-t-il, dicté par les incertitudes juridiques qu’implique le moratoire de cinq ans. En revanche, dans le domaine du sang de cordon, la recherche est à la fois une recherche d’amont et une recherche clinique importante.
B. DES FINANCEMENTS À ACCROÎTRE ET PÉRENNISER
L’Agence nationale de la recherche (ANR) a mis en place cette année un programme thématique ciblé sur les cellules souches, comme nous l’avions préconisé dans notre rapport précité sur la loi bioéthique de demain. Ce programme s’intitule « le pré- Biotechnologies : Recherche finalisée sur les cellules souches (RFCS) ». La seule condition posée par l’ANR est l’association avec des entreprises privées.
Pour autant, d’après l’AVIESAN les laboratoires pharmaceutiques sont réticents, car il ne s’agit plus de molécules mais d’une nouvelle façon d’appréhender les maladies. Sanofi-Aventis s’intéressent à l’utilisation de cellules souches mésenchymateuses pour améliorer l’utilisation de greffons car des progrès majeurs ont été faits par M. Jean-Jacques Lataillade, dans l’amélioration des greffons de peau avec des sous-couches mésenchymateuses. Roche s’intéresse aux cellules souches pour effectuer du criblage de molécules et a signé un l’accord avec M Marc Peschanski. L’Oréal s’intéresse aux greffons de peau, pour tester ses produits en raisons des difficultés actuelles concernant les tests sur les animaux. L’AVIESAN doit négocier avec L’Oréal, Sanofi, Roche pour déterminer comment effectuer une recherche, industrie/académie, sur des projets où chacun est gagnant.
C. L’IMPLICATION DU SECTEUR PUBLIC DANS LA RECHERCHE
Le secteur public s’implique activement dans ces recherches. Plusieurs grands pôles rassemblant plusieurs dizaines de laboratoires sont regroupés et travaillent en coopération avec des laboratoires de référence pour les diagnostics préimplantatoires et/ou pour les banques de sang de cordon.
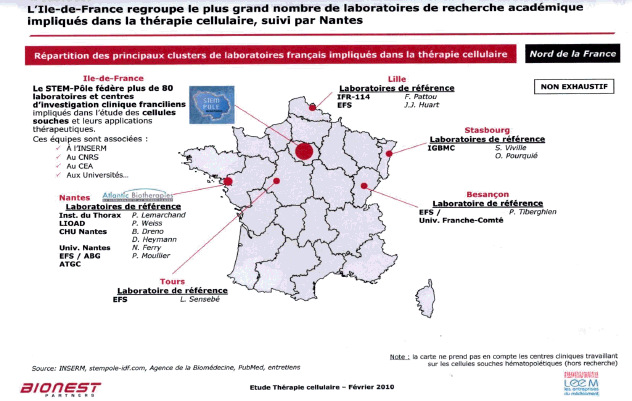
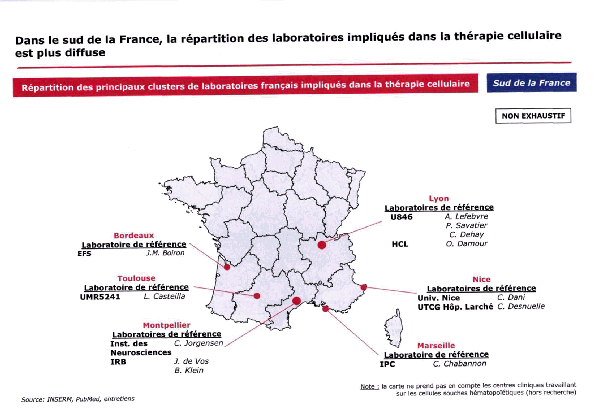
D. L’IMPLICATION DES LABORATOIRES PRIVÉS
Comme dans la plupart des pays, les grands groupes pharmaceutiques ont pris des positions attentistes. Ils attendent que des entreprises de biotechnologies de taille modeste, fondées à partir d’un brevet, développent des protocoles de qualité industrielle.
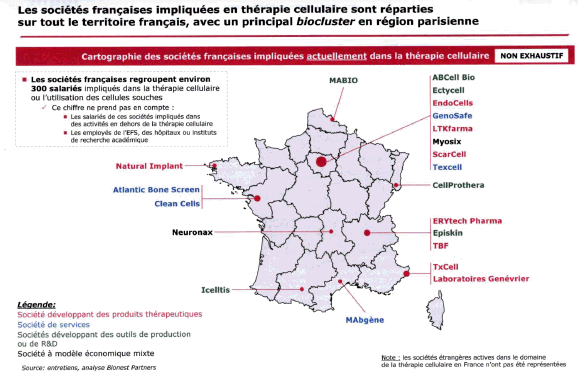
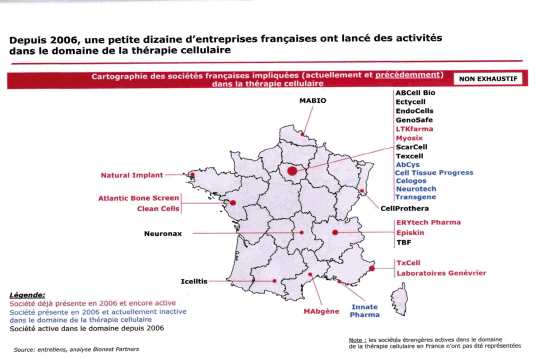
Source : Etude thérapie cellulaire – février 2010 – LEEM
E. LE MAINTIEN DES COOPÉRATIONS INTERNATIONALES
Les tableaux transmis par l’AVIESAN démontrent que la plupart des équipes françaises collaborent avec des partenaires à l’étranger. Cette coopération internationale est essentielle car les recherches sur les cellules souches sont très mondialisées. Les coopérations internationales s’effectuent de laboratoires à laboratoires avec une forte concurrence.
Le CIRM85, (California Institute of Regenerative Medecine) initiative propre de la Californie, a décidé d’investir 350 millions de dollars pour la recherche sur les cellules souches et la médecine régénérative au profit d’équipes mixtes, (une équipe en Californie et une équipe hors de la Californie) si celles-ci s’engagent à passer en quatre ans en essai de phase I, avec un système dégressif. Ce système fonctionne bien et des États adhèrent au CIRM. L’ANR pourrait collaborer avec le CIRM pour réaliser un projet commun entre une équipe française et une équipe californienne, et favoriser ainsi les regroupements thématiques.
Il est utile et opportun que l’on s’efforce, comme le souhaite M. André Syrota, président de l’AVIESAN86, de faire revenir des scientifiques de haut niveau en France. Pour autant, dans l’intérêt de la recherche en France, il est nécessaire de maintenir une présence de chercheurs de haut niveau à l’étranger. Ce maintien est indispensable au développement des recherches sur les CSEh en France. Des systèmes de financements pérennes doivent être mis en place. De même, il est très important que les services scientifiques et technologiques de nos ambassades ne souffrent pas de coupes budgétaires et de suppressions de postes intempestives. Celles-ci pénaliseraient inutilement des échanges essentiels pour la recherche en France.
Recommandation n°7 :
– de considérer les recherches sur les cellules souches comme prioritaires ;
– d’agir dans le cadre de l’Agence nationale de la recherche (ANR) pour susciter de nouveaux appels à projets ;
– que l’ANR accroisse son soutien aux recherches sur les cellules souches ;
– que des collaborations avec des laboratoires étrangers soient encouragées par l’Alliance pour les sciences de la vie et de la santé (AVIESAN), tant en France qu’à l’étranger ;
– que les services scientifiques et technologiques de nos ambassades soient renforcés et disposent de moyens financiers plus conséquents au niveau de l’attribution des bourses.
QUATRIÈME PARTIE : LES DÉBATS ÉTHIQUES ET JURIDIQUES SUR LA RECHERCHE SUR L’EMBRYON ET LES CELLULES SOUCHES EMBRYONNAIRES EN FRANCE
I. VERS UN CONSENSUS SUR LA LEVÉE DU MORATOIRE
A. LE STATUT JURIDIQUE INCERTAIN DE L’EMBRYON
Le statut juridique de l'embryon est souvent présenté comme une alternative entre les deux grandes catégories juridiques : les choses et les personnes. Seules les personnes peuvent être sujets de droit tandis que les choses sont objets de droit. Des juristes estiment que le législateur a considéré l'embryon comme une chose ; d'autres estiment qu'un tel statut n'est pas incompatible avec la protection légale que mérite une chose « sacrée » ou une chose « personnifiée ». L'absence de droits subjectifs n'exclut pas que la personne en devenir bénéficie d'une protection objective, à l'aide des instruments que sont les droits fondamentaux d'inspiration constitutionnelle : respect de l'être humain dès le commencement de la vie, dignité de la personne humaine, notamment.
1. La protection de l’embryon et du fœtus in utero
L'embryon ou le fœtus in utero n'a pas d'existence juridique autonome en dehors de la mère. La loi du 6 août 2004 relative à la bioéthique subordonne le prélèvement de tissus et de cellules embryonnaires ou fœtaux au consentement écrit de la mère, après une information sur les finalités du prélèvement (article L.1241-5 du code de la santé publique).
La loi ne s'est préoccupée du fœtus en tant que tel qu'à travers la répression de l'avortement, puis de la loi sur l'interruption de grossesse. Le Conseil d'État et la Cour de cassation ont, à plusieurs reprises, rappelé la conformité de la loi sur l'interruption volontaire de grossesse avec la Convention européenne de sauvegarde des droits de l'homme et ses dispositions garantissant le droit à la vie.
2. La protection de l'embryon in vitro
En vertu de la loi du 6 août 2004 (article L.2213-1 du code de la santé publique), le couple est consulté chaque année sur le point de savoir s'il maintient son projet parental. Le survivant après le décès d'un des membres du couple, peut demander la fin de la conservation. La demande doit être faite par écrit et confirmée au bout de trois mois. Les embryons conservés depuis plus de cinq ans pourront être détruits si le couple ne répond pas ou s'il existe un désaccord. Il en va de même pour les embryons si au bout de cinq ans après autorisation de don, ils n’ont pas pu faire l'objet d'un accueil. Pour éviter d'augmenter le nombre des embryons surnuméraires, il est prévu qu'aucune nouvelle tentative de fécondation in vitro ne peut être entreprise tant que le couple a encore des embryons conservés, sauf si « un problème de qualité affecte ses embryons ».
La loi autorise également le tri des embryons grâce au diagnostic préimplantatoire pratiqué afin d'éviter la naissance d'un enfant atteint d'une anomalie d'une particulière gravité.
La loi a voulu éviter l'instrumentalisation de l'embryon in vitro : l'embryon ne peut être conçu in vitro que dans le cadre et selon les modalités de l'assistance médicale à la procréation (AMP). Cette exigence est renforcée par l'interdiction de concevoir un embryon à des fins commerciales ou industrielles ou à des fins d'expérimentation ou de recherche.
3. L’embryon préimplantatoire : catégorie inconnue du droit français
Si l’embryon bénéficie d’une protection juridique, son devenir dépend essentiellement du projet parental, et en dernier ressort de la décision de la mère. La notion de préembryon ou d’embryon préimplantatoire est inconnue dans la législation française. La loi pose un principe de protection générale de l’embryon d’où procède la réglementation sur les cellules souches embryonnaires. Elle applique le principe d’un continuum dès la conception de l’embryon. Cela ne rend pas véritablement compte des avancées de la science sur la potentialité des cellules souches adultes depuis la découverte des iPS et des évolutions à l’œuvre des techniques d’assistance médicale à la procréation. La frontière entre cellules souches adultes et cellules souches embryonnaires tendra probablement à long terme à s’estomper dès lors qu’il sera possible de programmer des cellules souches adultes vers une lignée germinale humaine.
Quant au développement des embryons in vitro, tous ceux conçus ne s’implanteront pas, comme l’a fait observer M. Pierre Jouannet87 (voir Partie I). Il montre que près de 94 % des embryons ne sont pas devenus des enfants vivants.
Pour M. Henri Atlan88, directeur d’études à l’École des hautes études en sciences sociales, les découvertes les plus récentes de la biologie ont balayé les définitions traditionnelles de l’embryon. Il précise « La réponse était autrefois évidente : il y avait un embryon dès la fécondation, c’est-à-dire dès la fusion d’un ovule et d’un spermatozoïde. La découverte d’une plasticité cellulaire insoupçonnée dans les mécanismes moléculaires de régulation de l’activité des gènes a révolutionné la vision des choses. On s’est ainsi aperçu que l’organisme contrôlait les gènes au moins autant que les gènes ne le contrôlaient. D’où l’importance désormais donnée à l’épigénétique. Contrairement à ce qui a été trop souvent affirmé, toutes les possibilités de développement ne se trouvent pas d’emblée dans une cellule initiale : ces possibilités s’ajoutent les unes aux autres au fur et à mesure du développement lui-même. Et une implantation réussie dans un utérus est une condition sine qua non pour qu’on puisse parler d’embryon ». Il plaide pour la reconnaissance d’un gradualisme juridique qui permettrait d’introduire la notion de préembryon ou d’embryon préimplantatoire.
Les législations dites permissives (Royaume-Uni, Espagne, Israël) sont fondées sur ce raisonnement, souvent sans l’expliciter, ce qui ne restreint en rien l’encadrement de la recherche sur l’embryon et les cellules souches embryonnaires mais lui confère une cohérence et une lisibilité plus grande.
B. UNE INTERDICTION DE PRINCIPE AVEC DÉROGATION
1. Un compromis difficilement trouvé
La recherche sur les cellules souches embryonnaires humaines (CSEh) fut l’un des grands enjeux de la loi du 6 août 2004. Les débats furent passionnés, et un compromis fut trouvé, compromis qui fit difficilement consensus. Il fallait arriver à concilier les demandes des chercheurs et les réticences de celles et ceux qui refusaient toutes atteintes à l’embryon humain. Ils se fondaient sur la loi du 29 juillet 1994 qui interdisait la recherche sur l'embryon.
Devant les perspectives ouvertes par la recherche sur les CSE humaines, le Comité consultatif national d'éthique, le Conseil d'État, l'Académie nationale de médecine préconisèrent l'autorisation de ces recherches à certaines conditions : les géniteurs devront donner leur consentement et les embryons utilisés ne pourront plus être transférés.
Tout en réaffirmant l'interdiction de la recherche sur l'embryon, la loi de 2004 a autorisé, pendant cinq ans, les recherches permettant des progrès thérapeutiques majeurs. Les recherches sur les cellules embryonnaires issues d’embryons surnuméraires et portant atteinte à l’embryon sont régies par le principe de l’interdiction : « La recherche sur l’embryon humain est interdite ». Toutefois une procédure dérogatoire est prévue pour mener des recherches pendant cinq ans.
La dérogation est subordonnée à sept conditions : 1) une visée thérapeutique pour le traitement de maladies particulièrement graves ou incurables, ainsi que le traitement des affections de l’embryon ou du fœtus, 2) l’absence de méthode alternative d’efficacité comparable, en l’état des connaissances scientifiques, 3) des recherches intervenant sur les embryons conçus in vitro dans le cadre d’une AMP, 4) ne faisant plus l’objet d’un projet parental, par un consentement écrit préalable du couple, consentement confirmé à l’issue d’un délai de réflexion de trois mois et révocable à tout moment et sans motif, 5) le couple est dûment informé des possibilités d’accueil des embryons par un autre couple ou de l’arrêt de leur conservation, 6) le protocole de recherche a fait l’objet d’une autorisation par l’Agence de la biomédecine, en fonction « de la pertinence scientifique du projet de recherche, de ses conditions de mise en œuvre au regard des principes éthiques et de son intérêt pour la santé publique »,7) « les embryons sur lesquels une recherche a été conduite ne peuvent être transférés à des fins de gestation. »
Dans un premier temps, l’article 37 de la loi de 2004 a accordé, aux ministres de la santé et de la recherche, le pouvoir d'autoriser l'importation de cellules souches embryonnaires, à titre transitoire, après avis d'un comité ad hoc (décret n° 2004-1024 du 28 septembre 2004; arrêté du 28 septembre 2004). Ces dispositions étaient destinées à permettre aux chercheurs français de répondre aux appels à projets lancés par la Commission européenne. La loi a ensuite été complétée par le décret n° 2006-121 du 6 février 2006 relatif à la recherche sur l'embryon et sur les cellules souches embryonnaires et modifiant le code de la santé publique.
Le régime dérogatoire a commencé effectivement à fonctionner le 6 février 2006 et devrait courir jusqu’au 5 février 2011, date à partir de laquelle l’Agence de la biomédecine ne pourra plus délivrer d’autorisation de recherche.
3. Une procédure d’autorisation complexe remarquablement gérée par l’Agence de la biomédecine (ABM)
Les premières autorisations de recherches sur l’embryon et les cellules embryonnaires, d’importation de lignées de cellules et de conservation ont été délivrées entre 2005 et début 2006 dans le cadre du dispositif transitoire prévu par la loi. Ainsi, les ministres de la recherche et de la santé ont délivré, après avis d’un comité ad hoc, 40 autorisations à 12 équipes de recherche.
Depuis le 6 février 2006, date du décret fixant le cadre réglementaire des autorisations, l’ABM instruit les dossiers de demande et délivre les autorisations. Le Conseil d’orientation de l’ABM, émet un avis préalable à toute décision en s’appuyant sur l’expertise d’un collège d’experts scientifiques, composé de chercheurs, qui examine la pertinence scientifique des projets soumis. L’ABM peut faire appel à des experts scientifiques extérieurs au collège. La Mission d’inspection de l’ABM participe également à l’instruction des dossiers.
En 2007, l’ABM a précisé les conditions de dépôt et d’instruction des dossiers d’autorisation de recherche. Elle a notamment défini à cette occasion la notion de « modification substantielle » d’un protocole de recherche qui posait problème. L’ABM a aussi défini les règles de traçabilité des composants cellulaires et cellules différenciées obtenus. En outre, les procédures de demande et d’examen des modifications de protocoles déjà autorisés et d’importation de nouvelles lignées pour les équipes dont les protocoles sont déjà autorisés, ont également été allégées.

Source : audition publique du 27 janvier 2010 – Mme Emmanuelle Prada-Bordenave
Les circuits décisionnels sont simples. L’Agence de la biomédecine s’est remarquablement acquittée de cette tache de l’avis unanime des chercheurs, et ce sans tomber dans la fascination scientifique et technologique. Elle n’a autorisé que les projets qui répondaient aux conditions exigées, elle a interprété la visée thérapeutique de manière constructive. Pourtant le système mis en place aurait pu paralyser les recherches sur les CSEh en France, si l’ABM n’avait pas joué ce rôle.
4. Un système critiqué très tôt
a) Les interrogations de l’ABM
Le Conseil d’orientation de l’ABM s’est interrogé dans ses leçons d’expérience89 sur deux des conditions d’autorisations, à savoir : « l’exigence de progrès thérapeutiques majeurs » et « l’alternative d’efficacité comparable en l’état des connaissances scientifiques ». Il s’est demandé si les alternatives se limitent aux seules recherches sur les cellules souches adultes ou si elles incluent également les cellules issues de transferts nucléaires. Il a réfléchi sur l’origine des embryons.
b) La problématique de l’évaluation par l’OPECST et l’Agence de la biomédecine
Une évaluation, afin de permettre un nouvel examen des dispositions par le Parlement a été prévue par la loi. C’est l’objet de la présente saisine de l’OPECST, dont le libellé a conduit le Conseil d’orientation de l’ABM à soulever les questions méthodologiques concernant l’état des lieux des connaissances scientifiques90 : «L’évaluation des recherches actuellement menées sur les embryons surnuméraires ou les lignées de cellules embryonnaires doit-elle porter sur les seuls « progrès thérapeutiques », se limiter à contrôler la présence d’une « visée thérapeutique»; s’il s’avère que les investigations en cours n’ont qu’une portée cognitive, appartiennent-elles encore aux recherches devant être soumises à évaluation ? L’évaluation porte-t-elle sur les seules recherches conduites par des équipes françaises, ou concerne-t-elle l’ensemble des travaux réalisés à l’échelle internationale ; si l’approche est mondiale, les recherches sur le transfert nucléaire doivent-elles entrer dans le champ d’une étude comparée ?».
C’est pourquoi nous avons rendu compte des évolutions à l’œuvre à l’étranger.
C. VERS LA LEVÉE DU MORATOIRE : UN LARGE CONSENSUS
Relayant scientifiques et juristes, nous avons rappelé à maintes reprises combien le système mis en place en 2004 était illisible et à terme nuisible à la recherche en France. L’OPECST s’est déjà prononcé sur les difficultés qu’induit la rédaction de la loi dans le rapport sur « Les recherches sur le fonctionnement des cellules humaines »91. Le rapport préconisait notamment de réviser dès 2007 l'article 25 de la loi 2004 relative à la bioéthique afin que le régime d'interdiction, même assorti de dérogation, concernant la recherche sur l'embryon, soit supprimé au profit d'un régime d'autorisation strictement contrôlée.
La même année, M. Pierre-Louis Fagniez, alors parlementaire en mission, remettait au ministre de la santé le rapport précité intitulé « Cellules souches et choix éthiques » arrivant à des conclusions voisines dans sa recommandation numéro 4. « Passer d’un régime dérogatoire à un régime d’autorisation des recherches sur les cellules souches embryonnaires. L’expérience acquise par l’Agence de la biomédecine dans l’encadrement des recherches sur les cellules souches embryonnaires est très rassurante : les chercheurs se conforment totalement aux exigences très strictes du régime dérogatoire dont l’opportunité n’a plus de sens. Pas plus que l’exigence des progrès thérapeutiques majeurs qui n’est plus justifiée à ce stade de nécessaire développement de la recherche fondamentale. »
Dans notre rapport d’évaluation sur la loi de bioéthique de demain92, nous avons critiqué ce système et notamment le moratoire de cinq ans qui fait peser sur des recherches longues, des incertitudes rendant la France de moins en moins attractive pour les chercheurs étrangers, la date butoir du 5 février 2011 approchant. Les chercheurs étrangers ignorent qu’avant cette date l’ABM peut délivrer des autorisations de recherche valables cinq ans. Ils ne retiennent que les incertitudes générées par la loi.
Notre argumentation est reprise dans le rapport93 de la Mission d’information de l’Assemblée nationale (proposition n°43 §1) et dans nos contributions écrites respectives présentées lors de la discussion de ce rapport.
Nous avons été entendus sur un point important à savoir toutes les instances consultées notamment les Académies, le Conseil d’État, la Mission d’information de l’Assemblée nationale et à quelques rares exceptions près l’ensemble des personnalités entendues se sont accordées pour demander la levée du moratoire de cinq ans sur la recherche sur les cellules souches embryonnaires. Ainsi la possibilité de conduire de telles recherches devrait être pérennisée en France, dès la révision de la loi de 2004.
Recommandation n° 8 :
Il convient de :
– prendre acte rapidement du large consensus en faveur de la levée du moratoire sur la recherche sur les cellules souches et légiférer pour permettre à l’Agence de la biomédecine de délivrer des autorisations de recherche après le 5 février 2011.
A. LES DÉBATS SUR LE RÉGIME DE LA RECHERCHE SUR LES CELLULES SOUCHES EMBRYONNAIRES
On ne peut que s’interroger sur la valeur d’un interdit de principe pour lequel serait aménagé de façon permanente un régime dérogatoire, comme l’ont relevé la plupart des intervenants lors des missions conduites tant par l’OPECST que par la Mission d’information de l’Assemblée nationale. Il n’est pas certain qu’un régime d’interdiction soit plus éthique ou plus moral, eu égard aux développements récents des recherches.
Au plan scientifique, il n’y a plus grand sens, depuis que les iPS ont été découvertes, à opposer recherche sur les cellules souches embryonnaires et recherche sur les cellules souches adultes, même si certaines pathologies doivent être traitées de préférence par les unes plutôt que par les autres. En outre, les projets de recherche utilisent parfois plusieurs catégories de cellules.
1. Les recommandations de la Mission d’information de l’Assemblée nationale
La Mission d’information a suggéré de pérenniser le principe d’interdiction de la recherche sous prétexte que cela conduit dans les faits à un encadrement équivalent à un régime d’autorisation strictement encadré malgré les réserves émises par la plupart des juristes et des scientifiques. La Mission se fonde sur l’idée que ces recherches sont transgressives par nature ce que contestent la communauté scientifique et la plupart des courants philosophiques et religieux, dès lors que ces recherches sont encadrées et ont pour objectif des bénéfices cognitifs à visée médicale.
2. Les recommandations du Conseil d’État 94
Le Conseil d’État considère qu’il n’y a pas d’argument juridique à opposer à l’introduction d’un régime d’autorisation. Évoquant la décision du Conseil constitutionnel du 27 juillet 1994, il considère que « sous réserve que les atteintes portées à l’embryon soient justifiées par des motifs majeurs tenant à la protection de la santé, des recherches sur les cellules embryonnaires peuvent donner lieu à autorisation sans que le principe constitutionnel de protection de la dignité humaine puisse leur être opposé. »
Le principe constitutionnel cité par le Conseil d’État porte plus précisément sur la sauvegarde de la dignité de la personne humaine, et peut difficilement être invoqué dans le cas des embryons non pourvus de personnalité juridique. C’est donc en comparant la portée du principe du respect de tout être humain dès le commencement de sa vie, et le bénéfice que toute personne peut recueillir de telles recherches, que les autorisations sont délivrées. Le rapport généfice-risque est appliqué à ces recherches comme c’est le cas dans la plupart des domaines couverts par la bioéthique.
Aussi lever l’interdiction de recherche sur l’embryon ne paraît pas incompatible avec l’article 18 de la convention d’Oviedo, sous réserve que des conditions adéquates à la protection de l’embryon soient maintenues.
Sur la procédure, le Conseil d’État95 admet que la méthode d’interprétation des textes pourrait différer dans le cas où une situation donnée serait incertaine mais souligne que l’instauration d’un dispositif d’autorisation sous conditions strictes ou d’un régime d’interdiction avec dérogation n’emportent pas de différences importantes dans les modalités pratiques des contrôles administratifs qui pèseront sur ces recherches : « Juridiquement, la différence entre ces deux formules n’est pas fondamentale : l’un ou l’autre de ces schémas peut être indifféremment employé pour encadrer la recherche par des conditions en réalité identiques. Dans les deux cas, ce serait les mêmes recherches qui seraient interdites, et toute recherche non expressément autorisée serait interdite, sous peine de sanctions pénales. »
Le régime suggéré par la Mission d’information nous a conduit à présenter une contribution écrite au rapport de cette Mission. Nous estimons qu’un système organisant une transgression restera illisible pour nombre de chercheurs étrangers. Il est malsain et vise à culpabiliser les chercheurs sans pour autant assurer une protection plus efficace de l’embryon.
En réalité comme nous l’avons fait observer à plusieurs reprises, c’est l’intérêt scientifique et médical qui justifie la recherche et la destruction d’embryons surnuméraires avec le consentement des parents. Les pays qui ont mis en place un système d’autorisations strictement encadrées de ces recherches ne sont en rien laxistes.
B. LA POSITION DE L’OPECST : UN RÉGIME D’AUTORISATION STRICTEMENT ENCADRÉE
Comme l’a souligné Mme Anne Fagot-Largeault, professeur au Collège de France96, l’encadrement juridique actuel est obsolète, car on a démontré que n’importe quelle cellule du corps peut être reprogrammée pour devenir une cellule souche, voire une cellule souche totipotente, capable de produire un organisme entier ou un embryon. Si l’on admet l’idée que toute cellule dispose d’un potentiel embryonnaire, la frontière actuelle perd sa pertinence. Mieux vaudrait la situer selon elle, « entre ce que l’on peut autoriser dans le cadre de la recherche, sans intention de donner naissance à un enfant, et ce que l’on peut pratiquer dans le cadre de l’assistance médicale à la procréation ou de la thérapie régénérative, lorsque l’on passe à des applications sur des êtres humains appelés à vivre ».
D’après M. Jean-Claude Ameisen, professeur de médecine, membre du Comité national consultatif d’éthique97, comme pour nombre de scientifiques, on a l’impression que cette recherche serait transgressive par nature. Tout se déroule comme si le refus de savoir, l’absence de recherche était garant du caractère éthique d’une conduite. On induit une contradiction dans la perception que la société peut avoir de la recherche sur les CSEh, et l’on culpabilise les chercheurs.
Selon M. Jean-Claude Ameisen, il s’agit du seul cas, dans les recherches sur l’être humain, où l’autorisation de conduire ou pas une recherche ne dépend pas de la qualité de la recherche, de sa capacité de produire des découvertes, mais du but, des applications qu’on estime possibles au moment où on décide de la mener. Citant le professeur François Jacob, il souligne que l’intérêt d’une découverte se mesure pourtant à l'intensité de la surprise qu'elle provoque.
En écho, l’Académie nationale de médecine a récemment rappelé que « l’interdiction de la recherche sur l’embryon ne peut être maintenue par principe. Il est inadéquat et il serait même dangereux qu’une interdiction de principe soit maintenue au nom d’un antagonisme entre recherche et protection de la vie. L’interdiction de principe de toute recherche sur l’embryon ne peut être justifiée par la protection d’embryons qui n’ont pas d’autre avenir que l’arrêt de leur vie. Elle ne serait pas dans l’intérêt des embryons susceptibles de se développer et de vivre »98.
Il n’est pas pertinent de maintenir un principe d’interdiction de la recherche sur l’embryon et les cellules souches embryonnaires. Prôner un interdit pour en organiser la transgression revient à stigmatiser les chercheurs qui conduisent ces recherches. C’est une forme indirecte d’atteinte à la liberté de la recherche sans réelle justification. Un régime d’autorisation encadrée par l’Agence de la biomédecine est plus adapté à la réalité scientifique, et tout aussi protecteur de l’embryon. Il permettra de prendre en compte les avancées scientifiques et surtout la diversité des situations que les recherches en cours, notamment celles sur les iPS, pourraient entraîner.
En effet, la différence entre le régime d’interdiction avec dérogation et d’autorisation avec encadrement portera sur l’interprétation qui pourrait être faite par le juge éventuellement saisi d’un litige sur l’autorisation de recherche : « Les conséquences juridiques directes ne seraient pas tout à fait les mêmes car lorsqu’un texte d’application ne répond pas à une situation donnée, on remonte au principe ; or ici les principes – interdiction, autorisation – sont opposés », a expliqué M. Bertrand Mathieu, professeur de droit à l’université de Paris I 99. Dans un cas la possibilité de déroger est d’interprétation stricte, dans l’autre c’est la condition qui restreint la liberté qui l’est.
Or pour nous c’est bien les conditions de la recherche restreignant la liberté qui importe afin que l’embryon humain ne soit pas assimilé à un simple matériau de laboratoire. À cet égard, le Conseil constitutionnel a explicitement reconnu une marge d’interprétation au législateur sur l’application de principe du respect de la vie dès son commencement. Cette liberté signifie que la question de la nature de l’embryon demeure ouverte et que le législateur peut fixer des degrés de protection différents.
Recommandation n°9 :
Il convient de passer d’un régime d’interdiction des recherches sur les cellules souches embryonnaires humaines (CSEh), à un régime d’autorisation strictement encadré.
III. DÉFINIR LES CRITÈRES DES AUTORISATIONS DE RECHERCHE
1. Des recherches susceptibles de permettre des « progrès thérapeutiques majeurs »
Le décret n° 2006-121 du 6 février 2006 a précisé que « Sont notamment susceptibles de permettre des progrès thérapeutiques majeurs, au sens de l’article L. 2151-5, les recherches sur l’embryon et les cellules embryonnaires poursuivant une visée thérapeutique pour le traitement de maladies particulièrement graves ou incurables, ainsi que le traitement des affections de l’embryon ou du fœtus. » Ce critère réserve les autorisations de recherche aux seules activités scientifiques orientées vers une finalité thérapeutique. Or un décalage existe entre le niveau cognitif dans lequel évoluent encore les recherches, et la nécessité de démontrer que des avancées thérapeutiques majeures en découleront.
En réalité, presque partout dans le monde, les chercheurs s’inscrivent spontanément dans une démarche de soin, lorsqu’ils présentent un projet comme nous l’avons montré tout au long de ce rapport. La plupart des projets de recherches en France comme à l’étranger ont d’abord des visées cognitives permettant ensuite le passage à la clinique. De plus, les financements nécessaires sont rarement réunis si cet objectif n’apparaît pas. Les lignes directrices internationales renforcent cette tendance.
Contrairement au Conseil d’État, nous sommes hostiles à toute référence à la notion « de progrès thérapeutiques majeurs », non pour faciliter telle ou telle recherche, mais au contraire pour introduire cohérence et clarté. La recherche sur les CSEh a indéniablement progressé, mais tous les chercheurs que nous avons rencontrés ont estimé que les applications thérapeutiques à large échelle de telles ou telles découvertes exigeraient un temps plus ou moins long et un travail minutieux de contrôle.
Il nous paraît illusoire et de surcroît peu moral de laisser croire à des progrès thérapeutiques majeurs dès qu’un projet de recherche reçoit une autorisation d’essai clinique. Ces recherches suscitent d’immenses espoirs chez des patients atteints de pathologies graves, il ne faut pas laisser croire qu’à court terme les aveugles retrouveront la vue, les paralysés marcheront etc.. On ne doit pas susciter de faux espoirs.
De plus, le caractère majeur ou non du progrès attendu n’a pas constitué un critère effectif dans le cadre d’un contrôle exercé sur ces activités de recherches par l’Agence de la biomédecine, car il est difficile pour le chercheur d’anticiper la portée des applications thérapeutiques des résultats de sa recherche et la nature même de ces résultats. Il peut être surpris par des résultats inattendus.
Comme l’a montré le rapport précité de la Mission d’information « Viser une finalité médicale et non seulement thérapeutique serait en outre, plus en cohérence avec les dispositions relatives à l’expérimentation sur la personne humaine et celles portant sur l’utilisation des éléments et produits du corps humain, sous réserve que la finalité exclusivement scientifique soit écartée. Une des conditions posées à la réalisation de recherches biomédicales sur l’être humain est en effet qu’« aucune recherche biomédicale ne peut être effectuée sur l’être humain si […] elle ne vise pas à étendre la connaissance scientifique de l’être humain et les moyens susceptibles d’en améliorer la condition.»
2. L’absence d’une méthode alternative « d’efficacité comparable »
Le décret du 6 février 2006 n’a pas précisé les modalités d’application de cette condition posée par le législateur en 2004. Elle a pour finalité de maintenir le caractère exceptionnel de l’utilisation de l’embryon à des fins de recherche et suppose l’exercice d’une veille portant sur l’état des connaissances. Selon l’ABM, « cette condition, bien que n’ayant pas posé de problèmes lors de l’examen des demandes, semble, au regard des réalités scientifiques, superflue ».
Reconnaissant que ce critère « n’est pas en adéquation avec les réalités de la recherche », le Conseil d’État a estimé important de « maintenir dans la loi l’idée que la recherche sur les cellules embryonnaires n’est autorisée que lorsqu’elle permet d’aller dans des directions impossibles à emprunter selon d’autres méthodes ». Mais cette démarche met en concurrence les diverses voies de recherches, ce que la communauté scientifique ne prend pas en compte. Comme nous l’avons montré, la même équipe est susceptible d’effectuer des recherches sur des cellules souches adultes, des iPS ou des CSEh. Il n’y a pas grand sens à induire des comparaisons. La suppression de tout critère comparatif est cohérente avec le développement de ces recherches.
1. La finalité scientifique et médicale
Le recours aux CSEh au plan médical, et à une large échelle passe par le développement de technologies appropriées encore au stade de prototype. L’établissement de standards de qualité pour les nouvelles lignées ainsi que pour des protocoles d’amplification et de différenciation est obligatoire, chacun en convient. De plus ces recherches sont de facto encadrées par les pairs, quelle que soit la réglementation du pays où elles se déroulent. L’obtention des lignées de CSEh importées, une fois la recherche autorisée dans un pays, est soumise à l’agrément de l’université ou du laboratoire qui les a produites et conservées, et qui s’assure lui aussi de la pertinence et de la finalité de la recherche. Comme l’a constaté l’ABM, peu d’équipes mènent ce type de recherche, ce qui limite les demandes d’autorisation de moindre valeur scientifique et explique le faible nombre de refus. Ces recherches exigent de plus, des technologies spécifiques parfois mises au point spécialement pour assurer leur progrès.
Comme nous l’avions proposé dans le rapport sur « la loi bioéthique de demain », et à la Mission d’information dans nos contributions respectives, la notion de « finalité scientifique et médicale» rendrait mieux compte de l’objectif de ces recherches, surtout de celles qui visent à la compréhension de mécanismes cellulaires complexes. D’ailleurs ce critère est celui que retient l’Académie nationale de médecine dans son rapport précité. La référence à la recherche fondamentale nous paraît indispensable pour accroître la pertinence des critères retenus et le niveau d’information des consentements au don.
2. Les trois critères complémentaires
L’article L. 2151-5 du code de la santé publique subordonne la délivrance par l’ABM des autorisations à trois conditions: la pertinence scientifique du projet, le respect des principes éthiques et l’intérêt du projet pour la santé publique.
La pertinence scientifique du projet est un critère essentiel qui justifie en lui-même l’autorisation. Un projet médiocre n’a aucune chance de franchir les différents filtres de l’ABM et plus généralement de la recherche académique. Le nombre de refus par l’ABM est restreint ; c’est également le cas dans les pays que nous avons visités, car la plupart des équipes respectent les lignes directrices internationales et doivent expliciter les objectifs scientifiques et médicaux de leur projet tant pour obtenir les autorisations administratives, que pour obtenir les financements de leur recherche.
Le respect des principes éthiques renvoie aux principes fondamentaux relatifs au respect du corps humain posés par le code civil, à savoir, le respect de l’être humain et du corps humain, la non patrimonialité du corps humain, de ses éléments et de ses produits, le consentement éclairé pour toute atteinte à l’intégrité du corps humain, l’interdiction de toute pratique eugénique et de clonage, de toute pratique pouvant porter atteinte à l’intégrité de l’espèce ou visant à modifier la descendance de la personne, la gratuité et l’anonymat des dons d’un élément ou d’un produit du corps. Quant à l’intérêt pour la santé publique, il est inclus dans la finalité médicale.
Recommandation n° 10 :
Il convient de retenir comme critères d’autorisation des recherches sur les cellules souches embryonnaires, la finalité et la pertinence scientifique et médicale du projet de recherche.
IV. LE DÉBAT SUR LE MAINTIEN DE L’UNITÉ DU RÉGIME DE CONTRÔLE DES RECHERCHES
A. LA RECHERCHE AU PROFIT DE L’EMBRYON
1. L’embryon exclu de la recherche
Ce n’est pas le moindre des paradoxes qu’en l’état actuel du droit, aucune expérimentation visant à améliorer des techniques d’AMP ne soit possible, si sa mise en œuvre peut s’analyser comme une recherche sur l’embryon faisant l’objet d’un projet parental. On aboutit ainsi à des systèmes d’expérimentation directe sur l’enfant à naître au nom de la protection de l’embryon. Ni le Conseil d’État, ni la Mission d’information n’ont formulé des préconisations claires à ce sujet. Cette situation paradoxale est dénoncée par nombre de praticiens de l’AMP comme Mme Jacqueline Mandelbaum100, responsable du laboratoire de fécondation in vitro de l’Hôpital Tenon, membre du Comité national consultatif d’éthique. L’introduction, selon un protocole d’expérimentation validé, d’une méthode de fécondation artificielle innovante telle que l’ICSI serait actuellement illégale, explique-t-elle.
Ainsi, comme l’a rappelé M. Pierre Jouannet101 : « grâce aux développements de la technologie, de la génomique, de la protéomique, de la transcriptomique et des micro méthodes permettant de travailler sur de très petites quantités de cellules, et par conséquent sur des embryons précoces, on commence à pouvoir caractériser les embryons beaucoup plus finement ».
Il cite une recherche, réalisée par une équipe australienne, consistant à pratiquer, avant le transfert de l’embryon dans l’utérus et sans toucher à la masse cellulaire interne, une biopsie sur les cellules du trophectoderme, à l’origine du placenta et des annexes embryonnaires.
Il regrette que « ce qui est possible sur l’être humain à tous les âges de la vie est aujourd’hui interdit sur l’embryon ». Rappelant que 94 % des embryons créés dans les laboratoires de fécondation in vitro en France n’ont pas d’autre perspective que l’arrêt de leur développement, c’est-à-dire la mort, il se demande si on a le droit de ne pas chercher à comprendre pourquoi ces embryons ne se développent pas : « Nous sommes dans une situation semblable à celle qui prévalait au Moyen Âge lorsqu’on interdisait les autopsies, pourtant fort utiles pour comprendre les causes de la mort. Nous constatons qu’une très grande quantité d’embryons créés ne se développent pas, mais sans vraiment chercher à comprendre pourquoi ». Il déplore que la seule recherche envisageable sur l’embryon consiste à utiliser l’embryon pour une autre finalité que lui-même.
M. Jean-Claude Ameisen102 fait le même constat : « …Il y a un cas particulier qui me semble mériter attention : le souci éthique de ne pas créer un embryon in vitro à seule visée de recherche peut entrer en conflit avec un souci d’éthique médicale : celui d’agir au mieux pour éviter de faire courir un danger à un enfant à naître, dans le cadre de l’utilisation d’une nouvelle technique visant à améliorer l’AMP. Je pense que cette question, qui pose des problèmes éthiques complexes, mérite attention et réflexion ».
2. Permettre les recherches au profit de l’embryon
L’Académie nationale de médecine dans son rapport précité explique : « Une recherche peut être menée au bénéfice de l’embryon de manière similaire aux recherches de type clinique qui peuvent être menées à tous les âges de la vie. Dans tous les cas, les recherches sur l’embryon devraient faire l’objet d’un encadrement réglementaire rigoureux qui devrait distinguer 2 catégories de recherches, celles réalisées sur des embryons n’ayant pas d’autre avenir que l’arrêt de leur développement et celles réalisées sur des embryons destinés à vivre. Ces dispositions ne seraient pas incompatibles avec les recommandations du Conseil Constitutionnel, ni avec l’article 18 de la convention d’Oviedo ».
Ce rapport rappelle que : « L’opportunité d’une recherche sur l’embryon a été soulignée par l’Académie nationale de médecine dès 1995 ; cette position a été confirmée en 1996103 et en 2002 quand l’Académie a développé les deux notions originales de « médecine de l’embryon » et d’ « embryon patient » qui fondent au plan déontologique et éthique à la fois le respect dû à l’embryon et l’obligation de recherche clinique à cet âge comme à tout autre âge de la vie104».
Selon l’Agence de la biomédecine (ABM), les dispositions qui interdisent ces recherches aboutissent à une qualité de soins diminuée, puisque des innovations pratiquées efficacement à l’étranger ne peuvent être testées et mises en pratique en France.
Ainsi, comme nous le constations dans notre rapport précédent, l’embryon reste exclu de la recherche pour lui-même et de la recherche clinique en particulier. L’on s’interdit ainsi de progresser dans la compréhension des mécanismes qui favorisent l’implantation d’embryons.
D’après les praticiens de la reproduction, on aboutit à des situations étranges et peu compatibles avec l’éthique biomédicale : la recherche sur les gamètes peut entraîner la création d’embryons (interdite), conséquence de cette recherche et étape nécessaire pour vérifier certains paramètres avant de passer à la phase clinique. Or, les progrès de la reproduction humaine seront liés en partie, à ces catégories de recherche. Paradoxalement, on autorise l’ICSI et IMSI, on féconde avec des gamètes nouvellement traités, et on observe à la naissance si l’enfant ne présente pas de troubles. Afin d’éviter la création d’embryons, conséquence de la recherche, on préfère aujourd’hui conduire une sorte d’expérimentation sur les enfants à naître. Ne pourrait-on accepter que la recherche biomédicale soit possible, à cette période de la vie, comme elle est possible à tous les autres âges de la vie ?
Recommandation n° 11 :
Toute technique ayant pour objectif d’améliorer les possibilités de développement in utero d’un embryon humain devrait être considérée comme un soin et non comme une recherche. Il convient d’encourager la recherche et l’utilisation de techniques permettant d’améliorer le transfert in utero des embryons pouvant se développer.
B. PRÉCISER LE RÉGIME D’INTERDICTION DE CRÉATION D’EMBRYON POUR LA RECHERCHE
La création d’embryons à des fins de recherche est interdite. Les sanctions encourues sont celles définies à l’article 511-18 du code pénal. Cette interdiction, justifiée par des principes éthiques, rend cependant impossible l’évaluation expérimentale de nouvelles techniques d’assistance médicale à la procréation. Aussi, selon M. Axel Kahn, président de l’Université Paris V – René Descartes105, conviendrait-il d’assouplir le dispositif légal en aménageant des exceptions au principe de l’interdiction : « Je n’ignore toutefois pas que pour effectuer des recherches sur l’infécondité, notamment sur les moyens d’améliorer le pouvoir fécondant d’un spermatozoïde ou la fécondabilité d’un ovule, la seule manière de tester l’efficacité des techniques est de pratiquer des fécondations in vitro, en fabriquant donc des embryons n’étant pas destinés à être implantés. C’est là accepter de créer des embryons hors d’un projet parental. Le législateur devra, dans son infinie sagesse, envisager cette exception à la règle et l’Agence de la biomédecine et la jurisprudence permettre que s’applique l’esprit, et non la lettre, de la loi ».
1. Le cas emblématique de la vitrification ovocytaire
D’après M. René Frydman, professeur des universités, chef de service à l’hôpital Antoine Béclère106 « L’intérêt de la congélation d’ovules est triple. Elle diminue le nombre d’embryons surnuméraires, permet de préserver la fertilité des femmes jeunes, particulièrement celles qui vont bénéficier d’un traitement de chimiothérapie, salvateur de leur maladie, mais stérilisant. Elle faciliterait l’accessibilité au don d’ovocytes en France en permettant de créer des banques d’ovocytes congelés surnuméraires, anonymes, plus facilement donnés par les patientes ayant réalisé leur projet parental ».
Cette méthode s’est répandue, aboutissant à plus de 50 publications scientifiques dans le monde. En 2009, le suivi de plus de 900 enfants nés en Italie après congélation d’ovocytes était rassurant. Pourtant cette technique ne peut être appliquée en France. Plusieurs équipes y ont, depuis 2007, déposé des demandes d’autorisation à l’Agence de biomédecine et à l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS). Cette situation a conduit à des divergences d’interprétation entre la direction générale de la santé et l’ABM qui n’ont pas permis la publication de l’arrêté prévoyant de fixer la liste des techniques d’AMP d’effet équivalent, et donc de l’accepter en France.
Pour l’ABM, les techniques innovantes et émergentes doivent être retenues dans cette liste « dans la mesure où elles peuvent être considérées comme de simples évolutions des techniques existantes ». Pour la direction générale de la santé, « seules les techniques ayant fait preuve de leur qualité, de leur innocuité, de leur efficacité et de leur reproductibilité peuvent figurer sur cette liste réglementaire ». In fine, le ministère de la santé, considère que les recherches visant à améliorer les techniques d’AMP sont une transgression de l’article L.2151-5 du code de la santé publique qui interdit la conception d’embryons humains à des fins de recherche, explique M. René Frydman. Il se demande comment progresser si tous les projets d’amélioration des techniques d’AMP sont considérés comme susceptibles d’entraîner la constitution d’embryons pour la recherche.
Pourtant la vitrification ovocytaire pourrait être considérée comme l’application d’une technique déjà scientifiquement et éthiquement validée. Selon l’argumentation retenue par le législateur en 2004, l’évaluation complète d’une nouvelle technique d’AMP ne pouvant se concevoir sans une expérimentation sur l’embryon in vitro, puis sur l’embryon réimplanté in utero, l’interdiction de la création d’embryons à des fins de recherche, et l’interdiction d’implanter des embryons ayant fait l’objet de recherche, seraient toujours enfreintes si de nouvelles techniques étaient découvertes.
En l’état actuel du droit aucune expérimentation visant à améliorer une de ces techniques n’est donc possible si sa mise en œuvre peut s’analyser comme une recherche sur l’embryon faisant l’objet d’un projet parental. Ces dispositions aboutissent à une qualité de soins diminuée, puisque des innovations pratiquées efficacement à l’étranger ne peuvent être testées et mises en pratiques en France. Abolir l’interdiction systématique d’implanter des embryons soumis aux « recherches » permettrait de prendre en compte les difficultés d’évaluer en termes de sécurité, de fiabilité, voire d’efficacité, d’éventuelles nouvelles techniques d’AMP.
En dépit des compétences reconnues par la loi à l’ABM dans le domaine de la reproduction, l’Agence a préféré faire intervenir l’AFSSAPS dans le processus d’autorisation de recherches sur l’AMP, car le milieu et la technique de vitrification influeraient sur les ovocytes.
Plusieurs demandes d’autorisation d’essais cliniques portant sur les milieux de culture, les techniques de fécondation et de congélation sont en attente d’instruction par l’AFSSAPS. Il s’agit notamment : d’abord de projets de vitrification ovocytaire afin de tester un nouveau peptide, ajouté dans un milieu de fécondation existant qui permettrait l’augmentation des taux de fécondation ; ensuite, des essais de comparaison des techniques de vitrification embryonnaire et des techniques de congélation lente d’embryons ; enfin, d’un projet de recherche incluant un embryon.
L’embarras de certains spécialistes de l’AMP face aux difficultés juridiques qui leur sont opposées pour mettre en œuvre des expérimentations portant sur la vitrification des ovocytes est réel, comme l’ont prouvé les débats lors du colloque organisé le 7 avril 2010 pour le 25ème anniversaire des centres privés de fécondation in vitro. Nombre de jeunes femmes risquant de devenir stériles à la suite de traitement n’ont pas accès en France à ces techniques, ce qui est préoccupant et injuste, car certaines doivent se rendre à l’étranger pour en bénéficier, et d’autres ne le peuvent.
Recommandation n° 12 :
Il convient d’autoriser l’introduction de nouvelles techniques améliorant l’AMP, notamment la vitrification ovocytaire.
C. JUSQU’OÙ LE RÉGIME DU CONTRÔLE DE L’ABM DOIT-IL S’EXERCER ?
Comme le montre cette étude, l’objet sur lequel porte le contrôle confié à l’ABM s’est modifié à mesure des progrès scientifiques. L’embryon surnuméraire est détruit pour en extraire des cellules souches. Celles-ci sont mises en culture et multipliées sous forme de lignées. Ces dernières sont à leur tour dérivées en une grande diversité de cellules souches de tissus. Faut-il introduire des distinctions, qui renverraient à des règles de contrôle différentes, entre les embryons, les lignées de cellules souches embryonnaires et les cellules différenciées qui en sont dérivées ? Par ailleurs, comment traitera-t-on les lignées de cellules souches embryonnaires qui pourraient être un jour dérivées de cellules pluripotentes induites (iPS) ?
1. Les ambiguïtés de la loi de 2004
Selon M. Jean-Claude Ameisen 107, la loi actuelle comporte une ambiguïté majeure, liée au fait qu’elle ne distingue pas entre les recherches sur l’embryon vivant et celles sur des cellules provenant d’un embryon détruit. Or, les deux ne sont pas de même nature. « Cette interdiction, sauf dérogation, de la recherche sur des cellules issues d’embryons humains détruits pour des raisons sans rapport avec l’éventualité d’une recherche a un caractère tout à fait exceptionnel : à titre de comparaison, la recherche sur des cellules issues d’embryons ou de fœtus détruits après interruption médicale ou volontaire de grossesse fait l’objet non pas d’une interdiction sauf dérogation, mais d’une autorisation. Et cette autorisation est sous condition non pas d’un consentement libre et informé du couple, mais d’une simple absence d’opposition de la mère ».
Selon lui tout se passe comme si le législateur avait confondu une entité vivante et les éléments qui la composent en rangeant dans la même catégorie les recherches sur l’embryon avant sa destruction et celles qui sont conduites sur des cellules isolées lors de sa destruction.
Il ajoute « Les avancées des recherches sur les cellules souches du corps adulte ont été présentées, de manière probablement un peu naïve, comme une réponse de nature scientifique aux problèmes éthiques posés par les recherches sur les cellules souches embryonnaires. En rendant l’impossible possible, les avancées de la science peuvent apporter des réponses à des problèmes éthiques, mais elles créent souvent aussi de nouveaux problèmes éthiques ».
Rappelant que la révolution récente des recherches sur les cellules iPS (ou cellules souches pluripotentes induites) permet la transformation de cellules du corps adultes, en cellules aux propriétés semblables à celles des cellules souches embryonnaires pluripotentes, il considère qu’à l’avenir elles poseront des problèmes éthiques que l’on gagnerait à évoquer dès maintenant.
« Un autre problème éthique est posé par des travaux récents qui suggèrent que l’on pourrait dériver des spermatozoïdes, et probablement des ovocytes, à partir de cellules iPS dérivées de cellules de la peau. Le seul moyen de savoir s’il s’agit vraiment d’un spermatozoïde ou d’un ovocyte serait de déterminer si ces cellules sont capables de fécondation, c’est-à-dire de participer à la création d’un embryon in vitro. Peut-on envisager de faire de telles recherches ? ».
La législation britannique n’impose aucune autorisation pour les recherches sur les lignées de cellules souches. La législation allemande interdit les recherches sur l’embryon et les recherches sur les cellules souches embryonnaires dérivées, mais paradoxalement autorise les recherches sur les lignées de cellules souches importées. Aux États-Unis cela dépend des États, toutefois une fois les consentements obtenus, les lignées appartiennent aux universités ou laboratoires et les financements dépendent de la nature de la recherche.
2. Les suggestions de l’ABM108 et les recommandations de l’OPECST
a) Les recherches impliquant la destruction d’embryon
Pour l’Agence de la biomédecine, on pourrait considérer que « l’interrogation éthique semble d’une autre nature » dans le cas des recherches conduites sur des lignées de cellules souches déjà établies. Il ne s’agit pas de recherche entraînant la destruction d’embryon. Les lignées de cellules souches « ne disposent pas des propriétés organisatrices qui leur permettraient de reproduire un nouvel organisme » Certaines lignées importées sont utilisées en routine depuis plusieurs années par des laboratoires renommés (les plus anciennes lignées datent de 1998). L’ABM souligne elle aussi, l’existence d’une ambiguïté de la loi, qui utilise tantôt les termes de « cellules embryonnaires », tantôt ceux de « cellules souches embryonnaires ».
Elle estime qu’une cellule différenciée à partir d’une cellule souche embryonnaire est une cellule embryonnaire, mais n’est plus une cellule souche embryonnaire. Selon l’ABM, il convient de revoir les termes utilisés dans la loi, et de n’encadrer que les recherches portant sur les cellules souches embryonnaires.
Pour le Conseil d’État, toutes les activités de recherche impliquant une atteinte à l’embryon sont à considérer de manière identique, et doivent relever du même régime. La Mission d’information de l’Assemblée nationale109 se range de cet avis. « Si l’on peut comprendre la demande des chercheurs, il n’en reste pas moins qu’exclure les recherches faites sur les lignées de cellules souches embryonnaires du régime de contrôle auxquelles sont soumises les recherches sur les embryons reviendrait à introduire des degrés variables d’exigence éthique peu compatibles avec la nature même de l’éthique. À partir de quand, par exemple, estimera-t-on qu’une lignée de cellules souches est « bien établie » ? La démarche de contrôle fixée dans la loi de 2004 doit conserver sa cohérence. Il ne paraît par conséquent pas opportun de procéder aux distinctions suggérées sur ce point par l’ABM.»
On comprend le souci de cohérence du Conseil d’État et de la Mission d’information de l’Assemblée nationale. Cependant le législateur doit trancher. L’encadrement doit à notre sens être limité aux seules recherches sur les cellules souches embryonnaires, et non aux cellules souches qui ont perdu cette caractéristique.
Recommandation n° 13 :
Il convient de limiter l’encadrement des recherches aux seules cellules souches embryonnaires et d’exclure de cet encadrement les lignées de cellules souches déjà différenciées.
b) Les projets de recherche à caractère technologique
L’ABM reçoit de plus en plus de demandes d’autorisation pour des manipulations à caractère technologique dont la pertinence scientifique, condition de l’autorisation, est difficile à établir. Elle estime que la nouvelle loi devrait faire une place à de tels projets de manipulation de cellules. Certains ont un caractère essentiellement technologique, comme la sécurité virale des lignées ou de leur milieu de culture.
Cette tendance ira en s’accentuant, car les évolutions que nous avons observées tant en France que lors de nos missions à l’étranger ont montré combien les procédés de tri, de culture, et de purification des cellules avaient un retentissement sur la qualité des recherches, leur reproductibilité et leur impact futur. Lors de nos visites aux génopoles d’Évry et de Toulouse, comme au centre de recherche de l’Université de Stanford, les méthodes de manipulations et de tri à large échelle nous ont largement fait pressentir cette évolution.
Recommandation n° 14 :
Il convient de déterminer le régime juridique et les conditions d’autorisation des projets technologiques impliquant des manipulations de cellules souches embryonnaires.
c) Le consentement au don d’embryon à des fins de recherche
L’ABM110 rappelle que « la loi dispose que ce consentement peut être révoqué « à tout moment », ce qui n’apparaît guère réaliste : imaginez qu’il le soit au moment où l’on s’apprête à utiliser ces cellules en thérapeutique ! ». Elle propose de limiter cette révocabilité, d’être chargée d’émettre et de faire évoluer des recommandations sur ce sujet, en tenant compte de la pratique nationale et internationale.
Fort justement la Mission d’information de l’Assemblée nationale a proposé de s’assurer du caractère éclairé du consentement du couple en l’informant de la nature des recherches projetées, et de préciser les conditions dans lesquelles son consentement peut être retiré, lorsque le couple accepte de donner à la recherche des embryons surnuméraires.
Pour l’Académie nationale de médecine (rapport précité), les couples devraient pouvoir donner leur consentement pour une ou plusieurs des grandes catégories de recherche auxquelles les embryons qu’ils donnent seraient destinés : à savoir les recherches pour lutter contre la stérilité et améliorer les méthodes d’AMP, ou celles pour améliorer les connaissances sur le développement embryonnaire, ou celles sur les cellules souches embryonnaires et leurs dérivés.
L’information préalable au recueil du consentement doit être précise, car il s’agit de détruire un embryon surnuméraire ; la nature des recherches envisagées doit être clairement et simplement définie sans que la loi énumère des catégories de recherche.
En revanche, les conditions et les possibilités de révocabilité du consentement doivent être mieux précisées et être limitées dans le temps. La proposition de l’ABM qui vise à faire évoluer des recommandations sur ce point en s’inspirant des standards internationaux est à retenir.
Recommandation n° 15 :
À l’occasion de la demande de consentement des couples au don d’embryons surnuméraires, il convient :
– de les éclairer sur la finalité des recherches ;
– de limiter ainsi les conditions de révocation de ce consentement.
3. L’exportation et l’importation des lignées
L’ABM considère qu’il faut faciliter l’échange des lignées de cellules souches embryonnaires entre les équipes françaises et les équipes étrangères. C’est une question de réciprocité. S’agissant de l’importation de cellules, elle suggère que ne soit soumise à autorisation que celles des lignées qui n’ont jamais été importées en France, car pour les autres, le Conseil d’orientation de l’ABM a procédé à toutes les vérifications nécessaires quant aux conditions de leur obtention ; les exigences éthiques ayant déjà été vérifiées, une simple déclaration suffit.
Pour l’exportation, l’article L.2151-6 du code de la santé publique dispose qu’elle est « subordonnée en outre à la condition de la participation d’un organisme de recherche français au programme de recherche international».
Cette disposition peu claire ignore totalement la pratique scientifique et peut conduire à limiter de façon significative la diffusion des travaux de recherche français (distribution de lignées, mais aussi publication). En 2004, quand la France a dû importer des lignées de cellules souches embryonnaires, les instituts de recherche étrangers qui les lui ont procurées n’ont pas demandé une collaboration avec les laboratoires français, ni le partage des résultats des recherches.
L’ABM estime que dès qu’elle est publiée, une lignée doit être à la disposition de la communauté scientifique internationale, et toute demande de communication venant d’une équipe étrangère doit recevoir satisfaction.
Après plusieurs missions à l’étranger, nous avons pu mesurer l’importance des coopérations internationales dans ce domaine. Nous pouvons que souscrire à cette exigence.
Recommandation n° 16 :
Il convient :
– de faciliter les échanges de lignées de cellules souches embryonnaires
entre les équipes françaises et étrangères ;
– de permettre l’exportation à l’étranger de cellules souches
embryonnaires sans conditions de réciprocité.
V. LE RECOURS ENCADRÉ AU TRANSFERT NUCLÉAIRE ET AUX CYBRIDES
Un noyau de cellule somatique inséré dans un ovocyte énucléé déclenche, sous certaines conditions, la formation artificielle d’un blastocyste car les ovocytes ont la capacité de reprogrammer le noyau d’une cellule adulte. Si le transfert nucléaire est fait entre espèces, en insérant un noyau de cellule humaine dans un ovocyte de vache, le produit est un embryon hybride cytoplasmique, c'est-à-dire un cybride.
A. LE TRANSFERT NUCLÉAIRE : UNE TECHNIQUE CONTROVERSÉE
À plusieurs reprises des questions sémantiques pertinentes ont été soulevées par nos interlocuteurs, par exemple, M. Henri Atlan qui souhaite que soit bannie l’expression clonage thérapeutique. Il s’agit pour lui de transfert de noyau somatique. Le rapport précité de M. Pierre-Louis Fagniez reprend cette distinction dans sa recommandation n°7 :
« Modifier la terminologie : « La législation doit substituer au terme “clonage thérapeutique” les expressions “clonage non reproductif” ou “transfert nucléaire somatique” qui reflètent davantage les réalités actuelles de la recherche. L’emploi juxtaposé du terme “thérapeutique” à celui de “clonage” est à l’origine d’un contresens sur l’état de développement actuel des recherches dans ce domaine, qui demeure très en amont de toute application thérapeutique ».
Comme l’a rappelé Mme Anne Fagot-Largeault111 qui a transmis la carte ci-après, un jugement moral pèse sur cette technique. Elle précise que certains pays au nom de la morale n’ont pas la même vision de cette technique. Elle ajoute « Il faudrait gommer le jugement moral inhérent à l’interdiction actuelle. On peut interdire la technique du transfert de noyau, comme le fait le Royaume-Uni en matière de reproduction, mais il est ridicule de la qualifier de “crime contre l’espèce humaine” : ce ne serait vrai que si l’on en faisait la seule méthode de reproduction de l’espèce humaine ». La confusion provient, en grande partie, de la sémantique. Le transfert nucléaire à visée scientifique ne vise pas la reproduction, mais la recherche cognitive.
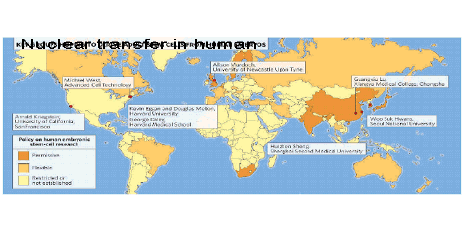
Source : audition publique du 27 janvier 2010 – Mme Fagot-Largeault
1) Les différents types de démarches.
Il convient de distinguer deux types de démarches, selon le sort réservé à l’ovocyte dans lequel le noyau d’une cellule somatique est implanté. Dans le clonage dit reproductif, l’ovocyte devenu une cellule diploïde sera implanté dans l’utérus d’une femelle animale porteuse lorsqu’il aura atteint le stade blastocyste.
Dans « le clonage » dit thérapeutique, à savoir le transfert nucléaire, le développement de l’ovocyte ayant subi le transfert nucléaire est interrompu lorsque le stade blastocyste est atteint. La masse cellulaire interne, dont les cellules sont totipotentes, est placée en culture in vitro, dans des conditions telles que cet état différencié, totipotent et prolifératif des cellules embryonnaires puisse être perpétué. On obtient ainsi des lignées permanentes de cellules souches humaines dont l’expérimentateur peut, en principe, induire la différenciation selon la voie qu’il choisit.
D’après Mme Nicole Le Douarin112 : « contrairement à ce que laissent parfois entendre les polémiques, le clonage thérapeutique ne consiste en aucune façon à produire un clone destiné à fournir des pièces de rechange à la personne dont il serait dérivé. Il se borne à cultiver des tissus dérivés de cellules totipotentes, sans chercher à produire un individu complet où ces tissus viendraient s’intégrer ».
Elle précise que : « Dans le cas du clonage à visée thérapeutique ou scientifique, l’ovocyte est privé de son noyau, qui est remplacé par celui d’une cellule somatique. Le processus de la transposition nucléaire comprend trois étapes. Il faut d'abord enlever l'A.D.N. nucléaire de l'ovocyte en faisant attention à l'endommager le moins possible. Il faut ensuite faire fusionner l'ovocyte énucléé avec une cellule somatique. L'ovocyte doit normalement donner le signal permettant la reprogrammation de l'A.D.N. de la cellule somatique. Enfin, il faut isoler le groupe de cellules de la masse interne du blastocyste et les faire croître sur des substrats de culture. Dans un certain nombre de cas, l’œuf ainsi constitué commence à se développer en se segmentant, une forte proportion de ses embryons atteint le stade blastocyste ». Les chercheurs qui tentent de reproduire des cellules souches embryonnaires à partir d’un ovocyte muni d’un noyau de cellule somatique adulte visent à disposer de cellules spécifiques d’un patient donné dans un but thérapeutique.
Comme tous les scientifiques, Madame Nicole Le Douarin souligne le faible rendement de cette technique. Pour obtenir le développement d’un tel œuf jusqu’au stade blastocyste, il faut parfois des centaines d’ovocytes. C’est pourquoi cette technique est peu utilisée actuellement.
2) L’utilité de cette technique
Le transfert nucléaire reste assimilé au clonage et suscite à ce titre de grandes réserves, renforcées, fin 2005, par la révélation de la fraude de M. Woo Suk Hwang, professeur à l’université de Séoul, qui avait affirmé avoir cultivé onze lignées de cellules souches obtenues à partir d’embryons clonés. La mise à jour des conditions dans lesquelles les ovocytes, nécessaires à ces expériences, avaient été prélevés sur les collaboratrices de M. Hwang contre rémunération, ont jeté la suspicion sur ce type de recherche.
Deux arguments sont avancés pour maintenir l’interdiction du transfert nucléaire. D’une part, la pénurie d’ovocytes pour réaliser des procréations médicales ne permet pas la mise à disposition en quantité suffisante de ce type de gamète au bénéfice des chercheurs sans risque d’instrumentalisation des femmes. D’autre part, les iPS ont fait perdre beaucoup d’intérêt à cette voie de recherche actuellement. Ceci nous a été confirmé au Royaume-Uni et en Israël, pays dans lesquels cette technique est autorisée et encadrée. Cette analyse est, en particulier, partagée par M. Axel Kahn, président de l’université Paris V- René Descartes113, qui a estimé que « le transfert de noyau nucléaire est certes intéressant sur un plan scientifique mais cette méthode n’est toutefois pas la mieux à même de créer des cellules souches à usage médical. Le clonage thérapeutique […] n’a plus grand sens – si jamais il en a eu un. ».
Le Conseil d’orientation de l’Agence de la biomédecine avait d’ailleurs été saisi, en 2006, pour rendre un avis sur le questionnement éthique lié à cette technique. Dans ses leçons d’expériences publiées en juillet 2008, il a posé les termes de l’alternative: est-il scientifiquement pertinent de vouloir poursuivre une recherche sur des cellules souches issues d’embryons clonés, au moment où s’ouvre une voie alternative, dans le même champ scientifique de recherche, avec les iPS ? Ou bien ne faut-il pas, face à l’incertitude des connaissances, favoriser toutes les voies possibles de recherche pour obtenir des réponses aux questions scientifiques.
L’ABM reconnaît comme nous que le développement des techniques de reprogrammation cellulaire a fragilisé les arguments en faveur du transfert nucléaire. Cependant, cette technique constitue un moyen d’engendrer des cellules embryonnaires sans détruire d’embryons. Si des lignées de cellules pouvaient être dérivées selon cette méthode, elles seraient immuno-compatibles avec le patient. La possibilité de mieux connaître les maladies humaines, une meilleure compréhension des mécanismes de l’embryogenèse, l'élaboration de nouveaux instruments de recherche et la thérapie cellulaire, resteraient les domaines d’application du transfert nucléaire.
C’est pourquoi, le rapport précité du M. Pierre-Louis Fagniez se prononçait, avant la découverte des iPS, en faveur de l’autorisation, sous contrôle strict, du transfert nucléaire. Il en allait de même du rapport précité de l’OPECST en 2006 qui recommandait d’autoriser la transposition nucléaire : « La transposition nucléaire devrait être autorisée par la loi relative à la bioéthique, qui devrait prévoir un dispositif rigoureux de contrôle de l'Agence de la biomédecine ».
Même après la découverte des iPS, nous avons défendu le principe d’une autorisation encadrée du transfert nucléaire dans notre rapport précité d’évaluation de la loi de bioéthique et, parallèlement, nous soutenions qu’il convenait que la France ratifie la Convention du Conseil de l'Europe sur les droits de l'Homme et la biomédecine dite Convention d'Oviedo, et le Protocole additionnel à cette Convention du 12 janvier 1998 qui interdit, dans son article 1er : « toute intervention ayant pour but de créer un être humain génétiquement identique à un autre être humain vivant ou mort » pour réaffirmer notre attachement à l’interdiction du clonage reproductif.
Nous préconisions, par ailleurs, que l'article 18 de cette Convention fasse l’objet d’une réserve interprétative. En effet, cette disposition pourrait interdire la transposition nucléaire car elle prévoit :
« 1- lorsque la recherche sur les embryons in vitro est admise par la loi, celle-ci assure une protection adéquate de l'embryon.
2- la constitution d'embryon aux fins de recherche est interdite ».
Actuellement, la technique du transfert nucléaire ne présente plus d’intérêt pour les chercheurs qui explorent les potentialités réelles qu’offrent les iPS, même si celles-ci pourraient poser, à terme, des problèmes éthiques. Toutefois, le droit ne peut constamment courir derrière la science et varier au gré des fluctuations des techniques scientifiques et médicales.
Certes, actuellement, le transfert nucléaire est une voie de recherche qui semble peu prisée des chercheurs. Cependant, nous estimons qu’une levée de l’interdiction du transfert nucléaire à des fins de recherche reste cohérente avec une démarche prônant le maintien de toutes les voies envisageables de production de cellules embryonnaires, pourvu que l’ensemble soit encadré strictement par l’ABM. Si, dans quelques temps, le problème de la disponibilité ovocytaire était résolu par des techniques de vitrification, et qu’en revanche, les iPS ne donnaient pas les résultats escomptés ou posaient des problèmes éthiques, cette technique pourrait présenter de nouveau un intérêt.
Aussi, souhaitons-nous maintenir la recommandation formulée dans notre rapport précité.
Recommandation n° 17 :
Il convient d’autoriser, sous réserve de la disponibilité des ovocytes humains, les recherches à partir de la technique de transposition nucléaire, avec un dispositif rigoureux de contrôle par l’Agence de la biomédecine, fondé sur la pertinence scientifique et médicale de la recherche, avec une interdiction d’implantation.
Le mot « cybride » provient de la contraction de « cytoplasme » et « hybride ». La création d'un embryon « cybride » (hybride cytoplasmique) consiste à remplacer le noyau d’un ovocyte d'origine animale par un noyau d'origine humaine.
L'embryon ainsi formé n'est donc pas complètement humain. L'ADN du génome, est bien humain; en revanche, l'enveloppe est d'origine animale, ainsi qu'une petite partie du milieu entourant le noyau, ce qui donne un patrimoine génétique presque entièrement humain sauf en ce qui concerne les mitochondries. Cette technique est attestée dans la recherche scientifique depuis plus d’un siècle.
Mélanger du matériel génétique humain et animal est une pratique à laquelle on a souvent eu recours et qui a fait avancer la recherche. Ainsi, la cartographie du génome a fait intervenir la fusion de cellules humaines et animales. La création d’animaux transgéniques a permis de modéliser des maladies humaines, de fabriquer des produits thérapeutiques, d’identifier le rôle particulier de tel ou tel gène.
Les animaux chimériques obtenus par transfert de cellules humaines dans des embryons animaux ont permis d’étudier le développement embryonnaire, et la pluripotence des cellules souches. Les cybrides ont aidé à comprendre le rôle du génome mitochondrial ; ils ont aussi permis des essais de clonage d’espèces en voie de disparition.
On ne peut pas démontrer que la création de « cybrides » soit indispensable, mais on peut considérer que c’est une voie intéressante pour apprendre à construire des thérapies cellulaires immuno compatibles avec le profil d’un patient donné, les alternatives n’ayant pas fait leurs preuves de façon convaincante.
En novembre 2006, la Human Fertisation Embryology Authority (HFEA) a reçu deux dossiers de demande d’autorisation, portant sur la dérivation de cellules souches d’embryons créés par transfert de noyau, en utilisant des noyaux de cellules humaines et des ovocytes animaux. À la réunion du 10 janvier 2007, la HFEA délibère pour savoir si la régulation de la recherche utilisant des embryons hybrides est de son ressort ; elle conclut que, dans le cadre de la loi actuelle, ce type de recherche ne serait sans doute pas interdit, et décide, avant de prendre une décision finale, qu’il convient de lancer une consultation publique sur « les implications éthiques et sociales de la création de telles entités ».
En septembre 2007 après un débat vif au Royaume-Uni, ces manipulations ont été formellement autorisées et strictement encadrées. Après de longues discussions, le gouvernement britannique s'est finalement laissé convaincre par la création de « cybrides » à des fins scientifiques, à la stricte condition que ceux-ci soient détruits au bout de quatorze jours, limite en deçà de laquelle une grande partie des chercheurs anglo-saxons estiment que l'embryon n'est pas encore un être humain et peut donc, selon eux, être manipulé sans porter atteinte à la dignité humaine. Cette limite correspond à l’apparition de la crête neurale.
Le Royaume-Uni est ainsi le premier pays à autoriser formellement cette manipulation. La production d'embryons hybrides a déjà été tentée dans d'autres pays, notamment aux États-Unis, dans des sociétés travaillant sur fonds privés (notamment, depuis 2001, Advanced cell technology), ou en Chine.
En 2008, l’université de Newcastle a affirmé avoir obtenu un embryon cybride homme-animal à partir d’un ovocyte de vache. Cette entité a cependant été créée à partir d’une cellule souche embryonnaire et non d’une cellule adulte ; les avantages attendus de cette technique n’ont donc pas reçu de preuve à cette occasion.
Aussi, compte tenu des progrès réalisés dans d’autres voies de recherches, les équipes ayant demandé, au Royaume-Uni, des autorisations de recherches sur les embryons hybrides y ont, semble-t-il, renoncé, faute d’avoir obtenu les crédits nécessaires. C’est ce qui ressort des entretiens que la mission a eu au Royaume-Uni.114
3. Un statut juridique à définir
M. Axel Kahn s’est déclaré favorable à la légalisation de cette voie de recherche en France 115: « Pour ma part, je ne suis pas opposé à cette technique. […]. L’embryon a une singularité qui mérite d’être respectée, mais sa sacralité n’est pas telle qu’il ne puisse faire l’objet de recherches. Les recherches sur les modalités de la reprogrammation des gènes d’une cellule somatique quelconque placée dans un environnement ovocytaire sont extrêmement importantes. Je ne suis pas choqué que l’on puisse, à cette fin, transférer une cellule humaine de peau ou de sang dans un ovocyte de vache ou de lapine. En effet, de ce protocole expérimental, ne naîtra pas un minotaure ! Ces embryons dégénèrent rapidement. À l’inverse d’un embryon cloné, ces artefacts n’ont aucune chance de donner un bébé. Pour moi, c’est un matériau expérimental, de première importance, et rien ne me semble pouvoir justifier d’interdire ces recherches. »
Selon Mme Anne Fagot Largeault116, les discussions et évolutions récentes concernant la production, pour la recherche, d’embryons cybrides, nécessitent, « une réflexion nouvelle sur la manière de tracer les frontières entre ce que la loi peut ou doit interdire et ce qui pourrait être autorisé et encadré au titre de la recherche et géré par l’Agence de la biomédecine ».
Si la plupart des pays n’ont, à ce jour, pas légiféré sur ces questions délicates, ces recherches sont possibles en Israël, au Royaume-Uni, dans une certaine mesure au Canada, et expressément interdites aux États-Unis. Quant aux législations belge, chinoise, espagnole ou sud coréenne, elles manquent de clarté sur ce point.
Recommandation n° 18 :
Il convient :
– de maintenir l’interdiction du clonage reproductif humain, et de poursuivre les efforts de la France en faveur de cette interdiction ;
– d’autoriser la transposition nucléaire inter espèces ;
– d’interdire l’utilisation d’ovocytes humains, l’implantation et le développement de cybride au-delà de quatorze jours.
La recherche sur les cellules souches est à un tournant, des progrès considérables ont été accomplis en l’espace de cinq ans, rendant d’ailleurs obsolète le libellé même de notre saisine tant les frontières entre les cellules souches embryonnaires et les cellules souches adultes sont devenues floues. La découverte des iPS a bouleversé les schémas juridiques et éthiques pré-établis.
Aussi, le régime d’autorisation avec un encadrement strict des recherches qui posent des questions éthiques nous parait-il préférable à celui de l’interdiction. Le régime d’autorisation sera plus efficace s’il est assorti d’un système d’alerte institutionnalisé entre les organismes chargés de l’encadrement des recherches et le législateur, afin d’anticiper les défis et de réagir rapidement en cas de difficultés.
Les recherches sur les cellules souches embryonnaires fascinent, elles suscitent espoirs et controverses. En aucun cas elles ne doivent être banalisées. Si nous sommes favorables à leur développement dans un environnement juridique clarifié, nous ne méconnaissons pas le questionnement éthique qu’elles suscitent car elles touchent aux origines de la vie.
Ce questionnement est nécessaire car il permet d’éviter que les recherches touchant l’embryon ne soient victimes des icônes corruptrices de l’humanisme scientifique et médical que décrit avec pertinence M. Axel Kahn117 dans son dernier ouvrage.
C’est pourquoi, il convient de se méfier des effets d’annonce médiatisés sur des remèdes miracles ou sur des publicités tapageuses faits, ici et là, sur telle ou telle catégorie de cellules souches réputée plus éthique qu’une autre. Toutes pourraient, à plus ou moins long terme, poser des questions éthiques, dès lors que les principes de consentement éclairé des donneurs et de non marchandisation du vivant, sont bafoués, et que des promesses inconsidérées sont faites à des patients.
Comme l’ont souligné la plupart de nos interlocuteurs, ces recherches exigent, pour aboutir à des traitements, un temps long et des efforts considérables, alors que les perspectives thérapeutiques à court terme sont encore limitées.
Actuellement, s’agissant des recherches sur les cellules souches embryonnaires, les progrès réalisés sont avant tout d’ordre scientifique et technologique. Ils permettent de mieux comprendre et cerner des mécanismes jusqu’ici mal connus, voire inconnus. Ces recherches sont mondialisées. C’est pourquoi, elles doivent s’inscrire dans le cadre international de la Convention d’Oviedo que la France n’a toujours pas ratifié, ce que nous déplorons, au fil de tous nos rapports.
EXAMEN DU RAPPORT PAR L’OFFICE
M. Jean-Sébastien Vialatte, député, rapporteur, a rappelé que ce rapport répond à la deuxième saisine de l’Office prévue par la loi relative à la bioéthique de 2004. Elle demande à l’Agence de la biomédecine (ABM) et à l’Office d’évaluer chacun les recherches sur les cellules souches adultes (CSA) et celles sur les cellules souches embryonnaires (CSE) en vue de décider du maintien d’un principe d’interdiction des recherches sur les CSE, assorti ou pas de possibilités d’y déroger. Ce rapport fait suite à ceux présentés dans le cadre de l’Office parlementaire sur les lois de bioéthique. Il prend en compte les débats tenus dans diverses enceintes, les avis des Académies, le rapport du Conseil d’État et celui de la Mission d’information de l’Assemblée nationale sur la révision des lois de bioéthique.
M. Alain Claeys, député, rapporteur, a présenté les quatre parties du rapport : les avancées cognitives sur les divers types de cellules souches (1), les perspectives de leur utilisation (2), un panorama des législations et des recherches à l’étranger et en France (3), les débats éthiques et juridiques auxquelles elles donnent lieu (4).
S’agissant des avancées cognitives qui ont permis de découvrir les cellules souches pluripotentes induites (iPS) produites à partir de CSA, le rapporteur a souligné le caractère ambigu et dépassé de la saisine. Les chercheurs ont montré que les iPS ne sont pas encore superposables ou comparables aux CSE. Les cellules souches mésenchymateuses de la paroi du cordon ombilical et du placenta semblent ouvrir une nouvelle voie de recherche pertinente fondée sur leur capacité d’interagir et de sécréter des substances immuno-modulatrices. Ces découvertes démontrent qu’aucune recherche ne doit exclure les autres et qu’elles se fertilisent mutuellement.
M. Alain Claeys, député, rapporteur a estimé qu’à l’avenir le législateur devait prendre du recul face aux découvertes de la science, rappelant qu’en 1994 lors de l’élaboration de la législation sur l’assistance médicale à la procréation (AMP), le législateur n’avait pas pu examiner, une méthode nouvelle l’ICSI (Intra Cytoplasmic Sperm Injection), pourtant devenue la référence actuelle.
Sur les perspectives d’utilisation des cellules souches, M. Jean-Sébastien Vialatte, député, rapporteur a souhaité que soit maintenue l’interdiction de prélèvement du sang de cordon à des fins autologues, considérant qu’il était nécessaire d’en améliorer la collecte, d’informer les parents, de veiller au respect du principe de gratuité et de prévoir la collecte de placentas et de cordons. Il a préconisé la création de bio banques et de centres de références accessibles aux chercheurs. Il s’est inquiété du développement du tourisme cellulaire conduisant des patients, mal informés des risques encourus, à recevoir à l’étranger des produits inefficaces et dangereux.
Concernant les aspects internationaux de ces recherches, M. Alain Claeys, député, rapporteur, a évoqué la problématique des brevets jugeant qu’il fallait se prémunir contre toute possibilité de marchandisation du vivant en veillant à ce que l’Office européen des brevets exclue les brevets de produits, alors que l’Office américain les accepte en brevetant des lignées de cellules souches. Il faut veiller à ce que seul le procédé et son application soient brevetables.
Abordant l’état des lieux des recherches sur les cellules souches en France, il s’est félicité de la qualité des documents transmis à l’Office parlementaire par l’Alliance pour les sciences de la vie et de la santé (AVIESAN), ce qui pour la première fois, a permis de donner une vision quasi exhaustive de ces recherches en France, et des collaborations internationales des équipes. Si la France a rattrapé son retard sur les recherches en amont, ce n’est pas tout à fait le cas en aval, aussi convient-il de soutenir la présence de chercheurs français dans des laboratoires à l’étranger.
Concernant les débats éthiques et juridiques sur ces recherches, M. Jean-Sébastien Vialatte, député, rapporteur, a estimé que l’Agence de la biomédecine (ABM) avait assuré un encadrement rigoureux des recherches sur les CES tout en permettant aux chercheurs de travailler. C’est pourquoi, un consensus s’est dégagé en faveur de la levée du moratoire qui expire le 5 février 2011, pénalisant actuellement les projets de recherches sur les CES en France. Il est donc urgent de légiférer. En accord avec le Conseil d’État, mais contrairement à la Mission d’information sur la révision de la loi bioéthique, il a plaidé pour un régime d’autorisation strictement encadrée de ces recherches, l’autorisation devant être soumise à la visée «scientifique et médicale» et à la pertinence du projet. La référence au terme «thérapeutique» doit être supprimée, car les recherches actuelles ont une visée cognitive.
M. Alain Claeys, député, rapporteur, a insisté sur l’importance de ces préconisations, les deux rapporteurs ayant dû présenter chacun une contribution au rapport de la Mission d’information sur ce point. À cet égard, il a estimé nécessaire que l’Agence de la biomédecine présente chaque année un rapport sur l’état des recherches en cours devant l’Office parlementaire.
M. Jean-Sébastien Vialatte, député, rapporteur, a expliqué qu’il fallait permettre les recherches au profit de l’embryon afin d’améliorer les techniques d’assistance médicale à la procréation, car on ignore pourquoi 94% des embryons in vitro ne se développent pas. S’agissant du consentement au don d’embryon pour la recherche, actuellement révocable à tout moment, mieux vaudrait organiser une information précise des familles sur les recherches qui seront menées, et limiter les possibilités de révocation du consentement. Concernant le régime d’exportation des lignées de cellules souches, il a suggéré de supprimer la condition de réciprocité à l’échange de lignées, car tel n’est pas l’usage international dans ce domaine.
S’agissant de la transposition nucléaire, peu utilisée depuis la découverte des iPS, M. Alain Claeys, député, rapporteur, a observé que son interdiction n’était pas justifiée si elle n’est utilisée que pour la recherche et encadrée strictement, les problèmes de disponibilité des ovocytes humains justifiant un tel encadrement. Cette décision repose sur les préconisations du rapport « cellules souches et choix éthique » de M. Pierre-Louis Fagniez qui, comme lui, avait estimé qu’il ne fallait pas exclure cette voie. Lorsque l’encadrement des recherches est bien réalisé, ce qui est le cas grâce à l’Agence de la biomédecine, le mot clé reste la liberté de la recherche. Il n’est pas nécessaire de hiérarchiser les diverses voies de recherche, d’autant qu’elles relèvent toutes de la recherche fondamentale.
A cet égard, M. Jean-Sébastien Vialatte, député, rapporteur a ajouté que l’on ne comptait dans le monde que quatre projets d’études pré cliniques concernant l’utilisation des cellules souches embryonnaires : d’une part, trois études américaines, dont deux sur la dégénérescence maculaire, et une sur la moelle épinière déjà autorisée par la Food and Drug Administration, mais arrêtée en raison de la formation de kystes ; d’autre part, une étude pré clinique conduite en France par le professeur Philippe Menasché sur la réparation du muscle cardiaque, cette dernière étant en cours de préparation.
M. Claude Birraux, député, président de l’OPECST, a souhaité que la vigilance éthique par rapport à ces recherches soit assurée par le Parlement, l’Office évaluant l’encadrement des recherches par l’Agence de la biomédecine.
Mme Catherine Proccacia, sénateur a demandé si les propositions des rapporteurs pouvaient être intégrées à la future loi de bioéthique et dans quels délais le projet de révision serait examiné. Par ailleurs, elle a voulu savoir pourquoi seulement 6% des embryons étaient susceptibles de s’implanter dans le cadre d’une fécondation in vitro.
M. Alain Claeys, député, rapporteur a répondu que la loi de 2004 édictait un principe d’interdiction de la recherche sur les cellules souches et que, parallèlement, elle organisait un système d’autorisation pendant cinq ans de ces recherches, sous réserve du respect de sept conditions vérifiées par l’Agence de la biomédecine. C’est donc le législateur qui a édicté les règles éthiques encadrant la recherche sur l’embryon, et il lui appartiendra de les modifier ; faute de quoi ces recherches seront interdites à partir du 6 février 2011, le moratoire ayant expiré la veille ; l’ABM ne pourra plus alors délivrer d’autorisation. Il a ajouté que lors d’une réponse à une question d’actualité, la ministre de la santé et des sports avait indiqué qu’un projet de loi définissant le cadre juridique à venir serait déposé avant l’été.
M. Jean-Sébastien Vialatte, député, rapporteur a observé que l’on ne connaissait pas les raisons du haut niveau d’échec en cas d’implantation de l’embryon, et que cela nécessitait des recherches, et motivait l’une des recommandations des rapporteurs.
M. Jean-Louis Touraine, député, s’est félicité de l’évolution significative et importante proposée par les rapporteurs. Le passage d’un régime d’interdiction des recherches à un régime d’autorisation, strictement encadré juridiquement serait bénéfique, tant en France que vis-à-vis des pays voisins. Ce serait un authentique encouragement à des recherches utiles sur les anomalies génétiques, et sur les infertilités dont on doit pouvoir se prémunir. Ces recherches ne s’opposent pas les unes aux autres, et il convient de disposer des moyens de développer toutes les potentialités thérapeutiques. Signalant que les cellules du foie fœtal pouvaient échapper aux règles d’histocompatibilité, et que l’âge de personnes prélevées influe sur les systèmes de reprogrammation, il a jugé que les diverses cellules n’étaient pas substituables les unes aux autres. Il s’est demandé si, sur le plan éthique, il fallait privilégier les embryons surnuméraires sans projet parental ou s’il ne valait pas mieux produire des embryons pour la recherche. Comme les rapporteurs, il a indiqué que le transfert nucléaire n’avait pas de finalité thérapeutique dans un avenir proche.
M. Claude Birraux, député, président de l’OPECST, a jugé qu’il était difficile d’anticiper l’état des connaissances scientifiques et s’est interrogé sur l’opportunité de supprimer la révision périodique au profit d’une intervention en tant que de besoin du législateur. Selon lui, on ne doit pas se laisser dépasser, on doit pouvoir anticiper.
M. Alain Claeys, député, rapporteur, a estimé qu’il n’était pas forcément utile de réviser l’ensemble de la loi relative à la bioéthique tous les cinq ans, et qu’il était de la responsabilité du législateur, et donc du Parlement et du Gouvernement d’opérer les modifications partielles nécessaires.
M. Jean-Sébastien Vialatte, député, rapporteur, a fait valoir qu’il revenait à l’Agence de la biomédecine d’introduire dans son rapport annuel un point sur l’évolution scientifique et technique des recherches sur les cellules souches, et de jouer un rôle de veille.
M. Claude Birraux, député, président de l’OPECST, a proposé que l’Agence de la biomédecine présente son rapport annuel de façon solennelle, devant les commissions et/ou l’Office parlementaire, celui-ci pouvant en conduire une évaluation. Il s’est interrogé sur l’autorisation de produire des cybrides.
M. Jean-Sébastien Vialatte, député, rapporteur, lui a indiqué que le procédé des cybrides avait été autorisé après un débat au Royaume-Uni. Il n’est pas très utilisé actuellement et en tout état de cause, les artéfacts produits devaient être détruits au bout de quatorze jours, sous condition d’une interdiction absolue de réimplantation.
M. Claude Birraux, député, président de l’OPECST, a demandé des précisions sur les facteurs de croissance des cellules souches dans les milieux de culture.
M. Jean-Louis Touraine, député, rapporteur, a demandé comment les cellules souches greffées fonctionnaient in vivo. Il a précisé que la mobilisation du sang périphérique pouvait stimuler les facteurs de croissance.
M. Jean-Sébastien Vialatte, député, rapporteur a indiqué que des facteurs de croissance secrétés par les cellules souches mésenchymateuses avaient un rôle immuno modulateur. Ils sont utilisés par le professeur Jean-Jacques Lataillade à l’Hôpital Percy dans le traitement des irradiés.
Au terme de ce débat, les recommandations proposées par les rapporteurs ont été adoptées et la publication du rapport autorisée.
COMPOSITION DU COMITÉ DE PILOTAGE

PERSONNALITÉS ENTENDUES PAR LES RAPPORTEURS À
L’ÉTRANGER ET EN FRANCE
PERSONNALITES ENTENDUES A L’ETRANGER
Aux États-Unis (28 septembre-2 octobre 2009)
Ê Au National Institute of Health (NIH)
M. Story Landis, président du NIH Stem Cell Task Force
M. James Battey, vice-president, NIH Stem Cell Task Force
M. Pamela Robey, chef du département des pathologies cranofaciales et bucodentaires
Ê A la Food and Drug Administration (FDA)
Mlle Judy Arcidiacono, biologiste
Mlle Shena Arellano, analyste pour les questions internationales
M. Steve Bauer, directeur de la division -thérapies géniques et cellulaire
Mme Alta Charo, consultant, membre du comité pour les cellules souches de l’Académie nationale des sciences
M. Richard McFarland, directeur associé
M. Raj Puri, directeur, division de la thérapie génique et de la thérapie cellulaire
Ê A l’Ambassade de France
Son Exc. M. Pierre Vimont, ambassadeur de France aux États-Unis
M. Jacques Drucker, professeur, conseiller pour les affaires sociales et la santé à l’Ambassade de France aux États-Unis
Mme Florence Beranger, représentante de l’INSERM aux États-Unis
M. Mark Frankel, directeur scientifique, responsable du programme américain de l’Association pour l’avancement de la science (AAAS)
Mme Joanne Padron Carney, directrice du Centre pour la Science
M. Daniel Davis, directeur exécutif du Comité de bioéthique de la Présidence
M. Jonathan Moreno, professeur d’éthique médicale à l’Université de Pennsylvanie, et conseiller au département de science et technologie de la maison blanche
M. Edmund Pellegrino, professeur à la Georgetown University, ancien président Comité de bioéthique de la Présidence
M. Larry Soler, vice-président, Juvenile Diabetes Research Foundation
Ê Au Congrès
M Eric Satami, directeur de l’équipe du sénateur Arkin
Mme Katherine Haley, conseiller politique du représentant John Boehner
Ê Au Consulat général de France à San-Francisco
M. Pierre-François Mourrier, consul général
Mme Mireille Guyader, attachée pour la science et la technologie
Ê A l’Université de Californie à San Francisco (UCSF)
Mme Elena Gates, directrice de la banque de cellule souches embryonnaires
Mme Linda Giudice, PhD, directrice du département de gynécologie et de la reproduction
Mme Susan Fisher, PhD, directrice du centre de recherche sur les cellules souches embryonnaires de l’UCSF
M. Bruce Clonkin, MD, professeur de médecine UCSF
Mme Diana Laird, PhD, maître assistant, institut de médecine régénérative
Ê Au CIRM (California Institute of Regenerative Medicine)
M. Alan Tounson, président
M. Robert Klein, président de l’Independant Citizens’ Oversight Committee
Mme Patricia Olson, directeur scientifique
M. Geoffrey Lomax, médecin, ancien responsable des standards éthiques et médicaux
Ê A Stanford au centre de médecine régénerative
M. Irving Weissman, professeur de biologie, directeur de l’institut de biologie des cellules souches et de médecine régénérative de l’Université de Stanford
Au Royaume-Uni (7-9 Décembre 2009)
Ê A Londres
Docteur Serge Plattard, conseiller pour la science et la technologie
Dr Claire Mouchot, attachée scientifique
Me Gerry Kamstra, docteur en psychologie, avocat, associé à Bird & Bird
Me Julian Hitchcok, avocat, Field Fischer, Waterhouse
Mme Hannah Darby, directrice de recherche sur la régulation (HFEA)
M. Anthony Mathur, professeur à l’université,cardiologue directeur du programme cellules souches autologues adultes au Chest hospital à Londres
M. Evans Harris, MP, Chambre des communes
Dame Julia Polak, professeur émérite Imperial College Londres
Ê A Cardiff
M. Stephen Dunnett, professeur, école de biosciences de l’Université de Cardiff
Mme Anne Rosser, professeur, département de neurologie et psychologie clinique
M. Nicholas Allen, médecin, école de biosciences de l’Université de Cardiff
Ê A Bristol
M. Anthony Hollander, professeur, directeur du département de médecine cellulaire et moléculaire de l’Université de Bristol
Ê A Sheffield
M. Peter Andrews, professeur, département des sciences biomédicales de l’Université de Sheffields
Israël (21 - 23 juin 2010)
Ê A Haïfa
Faculté de médecine du Technion
M. Daniel Aberdam, directeur de recherche à l’INSERM (co-directeur) du laboratoire INSERTECH
M. Itskovitz-Eldor, professeur au Technion co-directeur du laboratoire INSERTECH
Hôpital Ramban
M. Rafael Beyar, professeur, directeur de l’hôpital Rambam
M. Lior Gepstein, professeur de cardiologie, hôpital Rambam
Mme Ora Israel, directrice du département de médecine nucléaire
Mme Ronya Rubinstein, conseillère juridique
Université de Haïfa
Mme Mouna Maroun, professeur, département de neurobiologie
M. Gal Richter-Levin, professeur, département de neurobiologie et éthologie
M. Kobi Rosenblum, chef département neurobiologie, professeur
Ê A Rehovot
M. Michel Revel, professeur à l’Institut Weizmann des sciences, fondateur de la société Kadimastem
Ê A Tel Aviv
A l’Ambassade de France
Son Exc. Christophe Bigot, ambassadeur de France
M. Eric Seboun, professeur de génétique, attaché pour la science et la technologie
M. Asa Kasher, philosophe, Université de Tel Aviv
Ê A Jérusalem
Mme Ruth Arnon, Institut Weizmann des sciences
Dr Eran Meshorer, Université hébraïque de Jérusalem
Pr David Givol, Institut Weizmann des sciences
Au ministère de la Santé
Mme Talia Agmon, avocate
Mme Miriam Huebner-Harel, conseillère juridique
M. Zvi Borochowitz, Président de la Commission nationale de génétique et fécondation
M. Joel Zlotogora, directeur du département de génétique des populations
A l’hôpital Hadassah
M. Avinoam Reches, professeur de médecine
M. Jacques Michel, professeur de médecine, président du Comité d’éthique de l’hôpital
M. Menahem Segal, professeur à l’université de Jérusalem Bar Ilan (Centre de neuroscience)
AUDITIONS DES RAPPORTEURS ET VISITES EN FRANCE
Visites en France
27 mai 2008
Visite de l’Institut de la vision
Juillet 2008
Visite du Génopole de Toulouse
4 novembre 2009
Visite de l’Institut Pasteur
20 mai 2009
Visite de l’Institut Curie
26 mai 2010
Visite du centre de recherche commun MIRCen (Molecular Imaging Research Center)
Auditions des rapporteurs
17 novembre 2009
M. Thierry Jaffredo, directeur de recherche au CNRS
M. Vincent Mouly, directeur de recherche au CNRS
M. Charles Durand, maître de conférence des universités
18 novembre
Mme Emmanuelle Prada-Bordenave, directrice générale de l’Agence de la biomédecine (ABM)
M. Arnaud De Guerra, responsable de l’unité recherche à l’ABM
27 Janvier 2010
Audition publique cellules souches : état des lieux quelles régulation ? (voir le compte-rendu en annexe 3)
16 fevrier 2010
Audition de M Jean Marimbert, directeur général de l’AFSSAPS
11 mai
Réunion avec les entreprises du médicament LEEM
Mme Isabelle Diaz, directrice Biotechnologie et Recherche,
Mme Annick Schwebig, PDG, Actelion Pharmaceuticals France
Mme Aline Bessis, directrice en charge des affaires publiques
18 mai
M. Jacques Caen, professeur émérite, Membre de l’Académie des sciences
1er Juin
Colloque sur les cellules souches à l’Académie des sciences : nouveaux développements
8 juin
M. André Syrota, Président de l’Alliance pour les sciences de la vie et de la santé (AVIESAN)
M. Paul-Henri Roméo, directeur de l'ITMO (Institut thématique Immunologie, hématologie, pneumologie)
M. Victor Demaria-Pesce, chargé des relations avec les Parlements français et européen
Mme Armelle Regnault, chargée de mission scientifique, ITMO AVIESAN
Mardi 30 juin
M. Han Zhongchaoa, directeur de l’hôpital de Tianjin et du centre de thérapie cellulaire
M. Jacques Caen, Professeur Emérite, Membre de l’Académie des sciences
PARTICIPATION A DES COLLOQUES
Juin 2008 – Janvier 2010
Participation aux auditions de la Mission d’information relative à la loi de bioéthique et contribution au Rapport d’information
Novembre 2008 – Juillet 2009
Participation aux Etats généraux de la bioéthique
17 mars 2009
Conférence à l’Académie nationale de médecine
30 mai 2009
Conférence à l’Ecole nationale de la magistrature
25 juin 2009
Conférence au CHU de Saint-Etienne
10 mars 2010
Participation au colloque de la MGEN « Ethique au 21ème siècle »
7 avril 2010
Participation à un colloque sur l’éthique en AMP
ANNEXE 1 : LISTE DES RECOMMANDATIONS
Partie I - Des avancées cognitives importantes sur les divers types de cellules souches
Recommandation n°1 : Il convient :
- de prendre acte de l’intérêt que porte la communauté scientifique à tous les types de recherche ;
- d’éviter d’opposer les recherches sur les diverses catégories de cellules souches les unes aux autres ;
- de considérer que ces recherches se fertilisent mutuellement ;
- d’examiner sans a priori les problèmes éthiques que chaque catégorie de cellules soulève.
Partie II - Les perspectives d’utilisation des cellules souches
Ê Banque de sang de cordon et biobanques
Recommandation n°2 : Il convient :
- de maintenir l’interdiction du prélèvement et de la conservation du sang de cordon à des fins autologues ;
- d’informer les parents dans les maternités de l’utilité du don de cordon et de placenta pour poursuivre des recherches avant de demander le consentement à la collecte ;
- de veiller à assurer la gratuité de la collecte et de la conservation de ces produits ;
- d’organiser la collecte, la conservation, la distribution des cordons et de leurs dérivés ;
- de créer des biobanques et des centres de références accessibles aux chercheurs pour favoriser les recherches menées en France et favoriser la coopération internationale.
Ê Risques de « tourisme cellulaire »
Recommandation n°3 : Il convient :
- d’informer le public sur les risques encourus lors de thérapie cellulaire proposée à l’étranger via Internet ;
- qu’une veille par les services compétents de l’Agence de biomédecine soit instaurée sur ces pratiques.
Partie III - Panorama des législations et des recherches impliquant les divers types de cellules souches
Recommandation n°4 : La position de la France doit être confortée, il convient de :
- prévenir toute dérive vers une marchandisation du vivant ;
- limiter le dépôt de brevet large à l’Office européen des brevets.
Recommandation n°5
Il convient de tenir compte dans notre réglementation de l’existence des lignes directrices de l’International Society for Stem Cell Research) dans le processus de régulation des recherches sur les cellules souches.
Ê L’état des lieux des recherches sur les cellules souches en France
Recommandation n°6
- L’Agence de la biomédecine présente son rapport annuel d’activité qu’elle transmet au Président de la République, au Gouvernement, au Parlement qui en saisit l’OPECST.
- Elle dresse un bilan annuel des autorisations de recherches sur les cellules souches embryonnaires.
- Elle fait état des recherches effectuées à l’étranger et transmet ses recommandations.
Recommandation n°7 : Il convient :
- de considérer les recherches sur les cellules souches comme prioritaires ;
- d’agir dans le cadre de l’Agence nationale de la recherche (ANR) pour susciter de nouveaux appels à projets ;
- que l’ANR accroisse son soutien aux recherches sur les cellules souches ;
- que des collaborations avec des laboratoires étrangers soient encouragées par l’Alliance pour les sciences de la vie et de la santé (AVIESAN), tant en France qu’à l’étranger ;
- que les services scientifiques et technologiques de nos ambassades soient renforcés et disposent de moyens financiers plus conséquents au niveau de l’attribution des bourses.
Partie IV - Les débats éthiques et juridiques sur la recherche sur l’embryon et les des cellules souches embryonnaires en France
Ê Le régime des recherches sur l’embryon et les cellules souches embryonnaires
Recommandation n°8 - Il convient de :
- prendre acte rapidement du large consensus en faveur de la levée du moratoire sur la recherche sur les cellules souches et légiférer pour permettre à l’Agence de la biomédecine de délivrer des autorisations de recherche après le 5 février 2011.
Recommandation n°9
Il convient de passer d’un régime d’interdiction des recherches sur les cellules souches embryonnaires humaines (CSEh), à un régime d’autorisation strictement encadré.
Recommandation n°10
Il convient de retenir comme critères d’autorisation des recherches sur les cellules souches embryonnaires, la finalité et la pertinence scientifique et médicale du projet de recherche.
Recommandation n°11
Toute technique ayant pour objectif d’améliorer les possibilités de développement in utero d’un embryon humain devrait être considérée comme un soin et non comme une recherche. Il convient d’encourager la recherche et l’utilisation de techniques permettant d’améliorer le transfert in utero des embryons pouvant se développer.
Ê La recherche au profit de l’embryon
Recommandation n°12
Il convient d’autoriser l’introduction de nouvelles techniques améliorant l’AMP, notamment la vitrification ovocytaire.
Ê Les recherches impliquant la destruction d’embryon
Recommandation n°13
Il convient de limiter l’encadrement des recherches aux seules cellules souches embryonnaires et d’exclure de cet encadrement les lignées de cellules souches déjà différenciées.
Ê Les projets de recherche à caractère technologique
Recommandation n°14
Il convient de déterminer le régime juridique et les conditions d’autorisations des projets technologiques impliquant des manipulations de cellules souches embryonnaires.
Ê Le régime du consentement au don d’embryon
Recommandation n°15
À l’occasion de la demande de consentement des couples au don d’embryons surnuméraires, il convient :
- de les éclairer sur la finalité des recherches ;
- de limiter ainsi les conditions de révocation de ce consentement.
Ê Le régime d’importation et d’exportation des lignées de cellules souches
Recommandation n°16 : Il convient :
- de faciliter les échanges de lignées de cellules souches embryonnaires entre les équipes françaises et étrangères ;
- de permettre l’exportation à l’étranger de cellules souches embryonnaires sans conditions de réciprocité.
Ê La transposition nucléaire
Recommandation n°17
Il convient d’autoriser, sous réserve de la disponibilité des ovocytes humains, les recherches à partir de la technique de transposition nucléaire avec un dispositif rigoureux de contrôle par l’Agence de la biomédecine fondé sur la pertinence scientifique et médicale de la recherche avec une interdiction d’implantation.
Ê Les cybrides
Recommandation n°18 : Il convient :
- de maintenir l’interdiction du clonage reproductif humain, et que la France poursuive ses efforts en faveur de cette interdiction ;
- d’autoriser la transposition nucléaire inter espèces ;
- d’interdire l’utilisation d’ovocytes humains, l’implantation et le développement de cybride au-delà de quatorze jours.
ANNEXE 2 :
PROTOCOLES DE RECHERCHE SUR L’EMBRYON ET LES CELLULES EMBRYONNAIRES AUTORISÉS
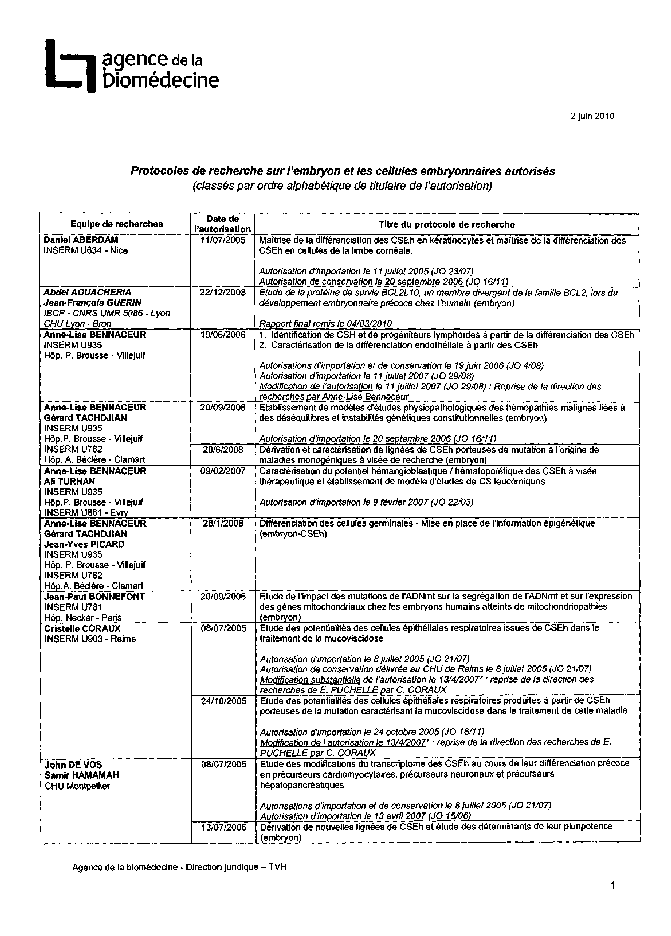
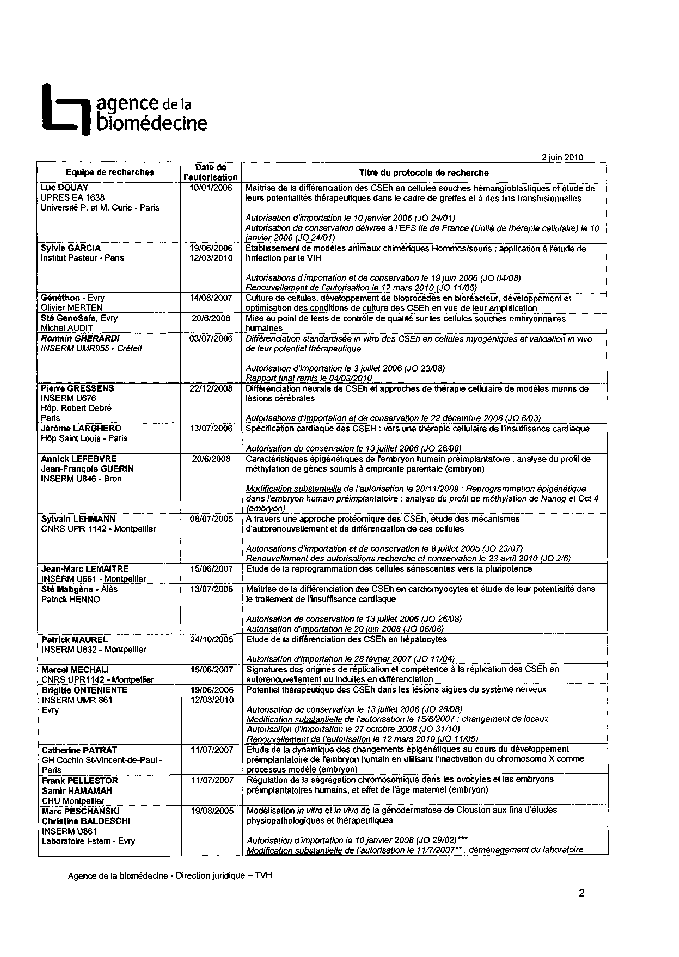
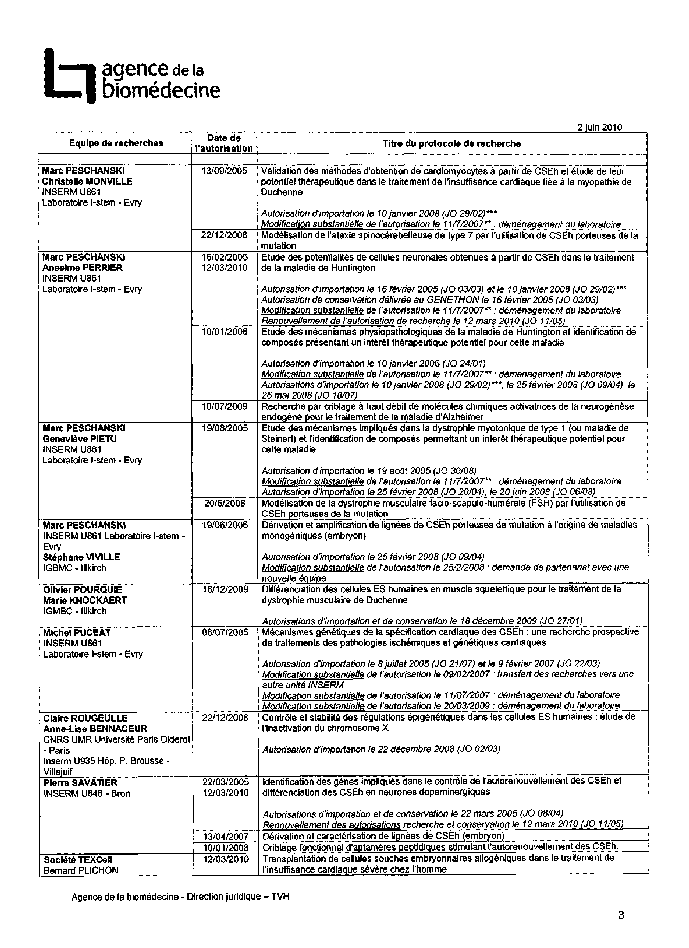

ANNEXE 3 :
COMPTE RENDU DE L’AUDITION PUBLIQUE DU 27 JANVIER 2010 SUR LES CELLULES SOUCHES : ÉTAT DES LIEUX
Sommaire
Introduction 1
M. Claude Birraux, député, président de l’OPECST
M. Alain Claeys, député
M. Jean-Sébastien Vialatte, député
Table ronde : État des connaissances : quels enjeux scientifiques et éthiques ? 7
Mme Nicole Le Douarin, professeur au Collège de France, membre de l’Académie des sciences
Mme Laure Coulombel, directrice de recherche à l’INSERM, rédactrice en chef adjoint de Médecine Science
M. Daniel Louvard, professeur à l’Institut Pasteur, directeur du centre de recherche de l’institut Curie, membre de l’Académie des sciences
M. Pierre Jouannet, professeur des universités, membre de l’Académie nationale de médecine
Mme Anne Fagot-Largeault, professeur au Collège de France, membre de l’Académie des sciences
M. Jean-Louis Touraine, député
Table ronde : Avancées thérapeutiques et essais cliniques : quels brevets ? 27
M. Philippe Menasché, professeur des universités, directeur d’unité de recherche à l’INSERM
M. Anselme Perrier, chargé de recherche, équipe maladies neurodégénératives (INSERM/UEVE, I-STEM)
Mme Michèle Martin, directrice de recherche, CEA
M. Fabrice Claireau, directeur des affaires juridiques, INPI
Mme Hélène Gaumont-Prat, professeur de droit à l’université Paris VIII, directrice du laboratoire de droit médical et de droit de la santé
Table ronde : Thérapie du futur : quelles perspectives ? 52
M. Marc Peschanski, directeur scientifique de l’Institut des cellules souches pour le traitement et l’étude des maladies monogéniques (I-Stem)
M. Hervé Chneiweiss, directeur de recherches à l’INSERM, Unité de plasticité gliale, INSERM, membre du conseil scientifique de l’OPECST, rédacteur en chef de Médecine Science
M. José-Alain Sahel, professeur des universités, directeur scientifique de l’Institut de la vision, membre de l’Académie des sciences.
M. Jean-Jacques Lataillade, professeur de médecine au laboratoire de recherche et de thérapie cellulaire du Centre de transfusion sanguine des armées
M. Jacques Caen, professeur émérite des universités, membre de l’Académie nationale de médecine et de l’Académie des technologies
M. Charles Durand, maître de conférences des universités
M. Thierry Jaffredo, directeur de recherche au CNRS
M. Vincent Mouly, directeur de recherche au CNRS
Table ronde : Quelle régulation ? 77
M. Jean Claude Ameisen, professeur des universités, président du comité d’éthique de l’INSERM, membre du Comité consultatif national d’éthique
Mme Emmanuelle Prada-Bordenave, directrice générale de l’Agence de la biomédecine
M. Arnaud Guerra, responsable de l’Unité de recherches, Direction médicale et scientifique (ABM)
M. Raymond Ardaillou, secrétaire adjoint de l’Académie nationale de médecine, professeur de médecine
M. Jacques Remacle, conseiller scientifique à la direction générale de la recherche, unité génomique et systèmes biologiques, de la Commission européenne
Mme Laurence Brunet, Juriste
OFFICE PARLEMENTAIRE D’EVALUATION
DES CHOIX SCIENTIFIQUES ET TECHNOLOGIQUES
Mercredi 27 janvier 2010
Présidence de M. Claude Birraux, président de l’OPECST
Audition publique, ouverte à la presse, sur la recherche sur les cellules souches :
état des lieux.
M. Claude Birraux, président de l’OPECST. Mesdames et Messieurs, je tiens tout d’abord à remercier mes collègues Alain Claeys et Jean-Sébastien Vialatte, rapporteurs de l’Office parlementaire des choix scientifiques et technologiques, non seulement de m’avoir proposé d’ouvrir ces auditions publiques consacrées à l’état des lieux de la recherche sur les cellules souches, mais surtout du travail admirable qu’ils accomplissent en toute complémentarité, tant sur le plan politique que sur le plan scientifique, dans un domaine qui soulève des interrogations fondamentales sur l’homme. Leur travail fait honneur au Parlement : je leur présente mes plus chaleureuses félicitations.
Cette réunion, qu’ils ont prévue de longue date, intervient alors que les débats sur les recherches ont été relancés par le rapport de la mission de l’Assemblée nationale relative à la révision des lois bioéthiques, présenté par Jean Leonetti, dont Alain Claeys était le président et Jean-Sébastien Vialatte l’un des vice-présidents : c’est dire si l’Office a été associé aux débats.
L’Office parlementaire se situe à la croisée du scientifique, du politique, du juridique et du médiatique. C’est donc une instance parlementaire de réflexion et d’évaluation, dont le travail est conduit à partir de liens qu’elle a tissés depuis sa création en 1983 avec la communauté scientifique. Ses trente-six membres sont des députés et des sénateurs désignés à la proportionnelle des groupes politiques dans chacune des deux assemblées. Son conseil scientifique lui permet de recueillir l’avis des experts les plus renommés. Le comité de pilotage constitué lors de chaque étude a le même objectif : permettre à des scientifiques d’éclairer les travaux des parlementaires.
Les propositions présentées par les rapporteurs de l’Office parlementaire sont généralement le fruit d’un large consensus entre ses membres, par-delà leur appartenance politique. L’Office permet d’organiser un débat raisonné, apaisé et serein sur des sujets qui soulèvent des interrogations parmi nos concitoyens. Il doit être en mesure de présenter en termes accessibles au grand public les questions scientifiques les plus complexes. Il peut également faire progresser le débat en reformulant des questions ou en faisant le lien entre plusieurs réponses.
Les auditions publiques d’aujourd’hui sur la recherche sur les cellules souches relèvent de cette démarche. Elles s’inscrivent dans le prolongement de la longue série de travaux conduits dans le cadre de l’Office sur la bioéthique dès 1992. À cet égard, je tiens à rappeler le rapport de feu le sénateur Franck Sérusclat, « Les sciences de la vie et les droits de l’Homme : bouleversement sans contrôle ou législation à la française ? », qui est la première incursion de l’Office parlementaire dans le domaine de la bioéthique. La démarche adoptée par son auteur est restée d’une rare pertinence car ce rapport comportait une série de fascicules consacrés successivement aux différentes approches en matière de réflexion éthique, à la procréation médicalement assistée, aux premières étapes de la vie et au statut des recherches sur l’embryon, aux diagnostics anténataux et à leurs conséquences, aux conséquences des progrès de la génétique, au statut du corps humain et de la personne humaine, à l’euthanasie et aux soins palliatifs. Le regroupement de ces différents fascicules portait le titre évocateur : « Questions clés et réponses contradictoires ». Pour Franck Sérusclat, il appartenait à chacun d’apporter ses réponses en fonction de ses convictions politiques ou philosophiques.
Depuis, les études réalisées sur la bioéthique dans le cadre de l’Office, sur le thème qui nous réunit aujourd’hui, se sont succédé afin de répondre aux défis nouveaux que la science lance au législateur, voire de les anticiper. Pour mémoire, je citerai le rapport de l’Office sur l’application de la loi de bioéthique de 1994, présenté en 1999 par Claude Huriet et Alain Claeys, celui qu’ils ont présenté de concert, en 2000, sur le clonage, la thérapie cellulaire et l'utilisation thérapeutique des cellules embryonnaires, ou le rapport, en 2001, d’Alain Claeys sur la brevetabilité du vivant. Au fil des années l’Office est devenu une instance reconnue du débat sur la bioéthique, et plus largement des débats sur les problèmes éthiques que posent à notre société les avancées scientifiques et technologiques, dont la rapidité et la médiatisation soulèvent des interrogations, voire des controverses.
C’est la raison pour laquelle la loi du 6 août 2004 confie à l’Office parlementaire deux missions. Elle lui demande tout d'abord d’en évaluer l’application dans un délai de quatre ans, première mission dont Alain Claeys et Jean Sébastien Vialatte se sont fort bien acquittés en présentant il y a un an un rapport intitulé « La loi bioéthique de demain », après avoir organisé trois auditions publiques dans le cadre de l’Office et de très nombreuses auditions privées sur les futurs thèmes en débat. Les questionnements et propositions qu’ils ont présentés fin 2008 ont pour la plupart nourri les réflexions sur la révision de la loi bioéthique, voire anticipé nombre de débats qui ont eu lieu depuis.
L’objet de l’audition publique d’aujourd’hui répond à la deuxième mission que la loi de 2004 confie à l’Office parlementaire. La loi de 2004 interdit la recherche sur l'embryon humain mais l’autorise, à titre dérogatoire pendant cinq ans et à certaines conditions. La loi demande à l’Office d’établir un rapport évaluant les résultats respectifs des recherches sur les cellules souches embryonnaires et sur les cellules souches adultes six mois avant la fin du moratoire de cinq ans. Celui-ci a commencé à courir lors de la publication du décret en Conseil d'État en février 2006, il expirera en février 2011.
Fin 2006, Alain Claeys avait présenté un rapport dans le cadre de l’Office sur les recherches sur le fonctionnement des cellules humaines qui, comme le rapport de Pierre-Louis Fagniez remis à la même époque au Premier Ministre, se prononçait pour une évolution du cadre législatif de ces recherches. Ces conclusions ont été reprises par les rapporteurs dans le rapport sur la loi bioéthique de demain.
Aussi l’objet de l’audition publique d’aujourd’hui vise-t-elle surtout à dresser un état des lieux des recherches sur les cellules souches qui sont en pleine évolution actuellement, sans les opposer les unes aux autres pour mieux comprendre leurs divers enjeux et les perspectives que chacune d’entre elles ouvre.
M. Alain Claeys, député de la Vienne, rapporteur. Monsieur le président, Mesdames et Messieurs, je vous remercie d’avoir répondu à notre invitation. Je tiens à remercier plus particulièrement notre président qui accomplit un travail remarquable pour mettre en relation l’Assemblée nationale et le monde de la recherche. À l’heure où chacun s’interroge sur la notion de progrès, il est essentiel qu’un tel lien puisse se nouer : à ce titre, l’Office remplit parfaitement ses missions. Nous sommes à l’heure où doit être dressé un bilan comparé des recherches menées sur les cellules souches embryonnaires et les cellules souches adultes, conformément aux prescriptions du législateur de 2004. Si nous devions rédiger aujourd’hui cette saisine, nous n’utiliserions pas la même formulation.
Comme nous l’avons écrit, Jean-Sébastien Vialatte et moi-même, dans le rapport de l’Office sur l’évaluation de la loi de 2004, cette législation n’est pas satisfaisante en raison de son ambiguïté : d’une part, elle interdit les recherches sur les cellules souches embryonnaires tout en prescrivant un moratoire de cinq ans – pourquoi cinq ans ? – et, d’autre part, elle recourt à des termes qui posent problème. Ces recherches, en effet, ne sont autorisées que si elles ont des finalités thérapeutiques et ne peuvent être réalisées par d’autres voies. Ces dispositions sont quelque peu hypocrites, et il a fallu la sagesse et le talent de l’Agence de la biomédecine pour que les protocoles de recherche sur les cellules souches embryonnaires soient autorisés durant cette période.
Aujourd'hui le débat est de nouveau ouvert. Avant que la Mission d’information, dont Jean Leonetti a été le rapporteur, ne se mette au travail, Jean-Sébastien Vialatte et moi-même nous étions déjà exprimés en faveur d’une nouvelle rédaction de la loi sur ces recherches. L’encadrement de l’Agence de la biomédecine étant satisfaisant, le législateur doit autoriser la recherche sur les cellules souches embryonnaires en l’encadrant. L’Office en avait du reste déjà fait plusieurs fois la proposition. La position française en sera rendue plus lisible au plan international. Il nous restera à convaincre certains de nos collègues.
Le paysage scientifique s’est modifié depuis 2004. Toutefois, mesdames et messieurs, l’objet de notre rencontre d’aujourd'hui n’est pas de modifier la loi mais de présenter devant la représentation nationale et devant nos concitoyens, l’état des lieux, au plan national comme au plan international, de la recherche fondamentale sur les cellules souches adultes, les cellules souches embryonnaires et les cellules pluripotentes induites iPS. Lorsque les premiers travaux sur les cellules souches iPS ont été publiés, certains qui étaient opposés à la recherche sur les cellules souches embryonnaires ont été soulagés. Or il se révèle que c’est bien plus compliqué ! C’est pourquoi, nous vous demandons de nous éclairer sur la question.
Le projet de loi devrait être déposé avant l’été 2010, afin que la révision de la loi actuelle puisse aboutir avant la fin de l’année. Si tel n’était pas le cas, il conviendrait toutefois que les recherches sur les cellules souches embryonnaires fassent l’objet d’une décision avant février 2011. C’est la raison pour laquelle l’Office a été saisi : le Parlement doit se prononcer sur le sujet.
M. Jean-Sébastien Vialatte, député du Var, rapporteur. Je m’associe aux remerciements qui ont été adressés à Claude Birraux, dont le soutien à nos initiatives fut très précieux. Je remercie également les membres du conseil scientifique et du comité de pilotage, ainsi que tous ceux qui nous permettront aujourd'hui de compléter notre information sur la recherche sur les cellules souches. Nos positions, qu’a rappelées Alain Claeys, sont connues.
Il ne s’agira pas dans cette étude comparative d’opposer les recherches les unes aux autres. Nous savons que les cellules souches adultes sont depuis longtemps utilisées pour traiter certaines pathologies graves. Nous n’ignorons pas les bénéfices présents et futurs du recueil et de la conservation du sang de cordons dans des banques allogéniques, lorsqu'ils sont riches en cellules souches. Alain Claeys et moi-même soutenons la création de telles banques en France ainsi que toutes les initiatives visant à développer dans de bonnes conditions le recueil et la conservation de ce produit.
Nos travaux ne seront donc pas un plaidoyer en faveur de telles ou telles recherches au détriment des autres. Il faut être très vigilant. On assiste actuellement à une inflation d’articles destinés au grand public contenant des promesses de plus en plus considérables sur les bienfaits de telles ou telles thérapeutiques issues de telles ou telles recherches sur les cellules souches. L’accumulation des découvertes scientifiques et technologiques et leur médiatisation, quelquefois avant même que des essais thérapeutiques n’aient été pratiqués chez l’homme, créent autant d'espoirs que de déceptions. C’est pourquoi il est plus honnête de bannir le mot « thérapeutique » quand on évoque les conditions d’encadrement d’une recherche soumise à autorisation. En revanche sa pertinence scientifique comme son impact cognitif ou ses possibilités d’utilisation médicale doivent faire partie des conditions d’obtention de l’autorisation.
Les auditions publiques d’aujourd’hui, qui sont les quatrièmes que l’Office organise dans le cadre de la révision des lois bioéthiques, visent à dresser un état des lieux des recherches sur les cellules souches et à réfléchir aux bouleversements que les cellules pluripotentes induites iPS provoquent et continueront de provoquer non seulement dans la connaissance des mécanismes de la pluripotence, mais également au plan éthique, dès lors qu’on les utilisera, si cela se révèle possible, chez l’homme en vue d'améliorer les techniques d’assistance médicale à la procréation.
Lors de nos missions aux États-Unis et au Royaume-Uni, nous avons été frappés par l’importance accordée à ces recherches et par la spécificité des matériels, gros appareils ou marqueurs, nécessaires à toutes les opérations de purification des cellules. Au-delà des contrôles exercés par les autorités chargées de la délivrance des autorisations de projets de recherche, contrôles que les chercheurs jugent parfois tatillons, nous avons constaté que dans ces pays, comme d’ailleurs en France, existe un contrôle indirect des recherches par les pairs eux-mêmes. Toute demande d’importation de lignées de cellules souches embryonnaires déjà autorisée doit être justifiée par un projet de recherche pertinent auprès du laboratoire ou de l’université qui délivre ce produit, ce qui témoigne d’une réelle volonté d’encadrement de la communauté scientifique, laquelle a conduit à l’élaboration de guidelines, de lignes directrices internationales.
Toutefois, certaines questions demeurent.
Quels sont les acquis et les perspectives des recherches en cours ? Quels en sont les enjeux scientifiques et éthiques ? Est-il encore pertinent d’opposer cellules souches adultes et cellules souches embryonnaires à la lumière des travaux sur la pluripotence induite ? Quelles perspectives ces recherches offrent-elles dans la compréhension de l’apparition et du développement de certains cancers ? Faut-il ouvrir d’autres voies de recherche, notamment au profit de l’embryon lui-même, en vue de favoriser la réussite d’une assistance médicale à la procréation ? D’autres procédés, tels que l’utilisation de cybrides, sont-ils utiles ? Tels seront les thèmes de la première table ronde.
Au cours d’une deuxième table ronde, nos questions porteront sur les essais cliniques déjà réalisés et les projets de demande d’autorisation. Quelles sont les avancées thérapeutiques actuelles découlant des promesses de la médecine régénérative et de celles des thérapies cellulaires ? Que peut-on en attendre, dans quels délais et sur quelles pathologies? Quels bouleversements des politiques de santé et de l’attitude des grands groupes pharmaceutiques privés l’utilisation de cellules souches est-elle susceptible de provoquer ? En effet, lorsqu’elle réussit, cette médecine personnalisée réduit considérablement la prise de médicaments fabriqués à grande échelle, ce qui ne sera pas sans entraîner un changement radical. Ces sujets seront abordés au cours d’une deuxième table ronde.
Enfin, au cours d’une troisième table ronde, nous nous interrogerons sur le foisonnement des découvertes et sur les thérapies du futur. Ces avancées seront-elles à la portée de tous ou freinées par des dépôts de brevets trop nombreux et trop coûteux ?
Telles sont les thématiques qui, au cours des tables rondes de cette journée, seront évoquées en recourant à des exemples concrets.
Il nous appartiendra ensuite de réfléchir aux régulations possibles qui permettront de dépasser la tension entre la liberté de la recherche, qui est essentielle aux progrès de la science, et le respect de la dignité humaine, principe fondamental auquel nous sommes tous très attachés.
TABLE RONDE : ÉTAT DES CONNAISSANCES : QUELS ENJEUX SCIENTIFIQUES ET ÉTHIQUES ?
M. Jean-Sébastien Vialatte, député du Var, rapporteur. J’appelle maintenant les intervenants de la première table ronde intitulée « État des connaissances : quels enjeux scientifiques et éthiques ? ». Je les remercie d’être parmi nous. Mme Nicole Le Douarin qui est professeur au Collège de France et membre de l’Académie des sciences va introduire cette table ronde.
Mme Nicole Le Douarin, professeur au Collège de France, membre de l’Académie des sciences. Il convient de faire un état des lieux général des recherches sur les cellules souches, non seulement en France mais également à travers le monde, la recherche étant par définition internationale.
Le terme et la notion de cellules souches sont venus à la connaissance du grand public en 1998, lorsqu’une équipe américaine du Wisconsin travaillant avec des fonds privés a montré qu’il était possible de cultiver les cellules de l’embryon humain très précoce et de les maintenir en culture pluripotentes et indifférenciées dans un état sain sans dérive tumorale. Les cellules, qui se reproduisent par repiquage successif de manière apparemment indéfinie, demeurent capables, comme elles l’étaient dans l’embryon, de fournir tous les tissus existant dans le corps humain fini.
La perspective de pouvoir disposer dans un récipient de culture de cellules humaines capables de produire tous les types de tissus a frappé l’imagination. La presse s’est d’autant plus emparée de la découverte qu’on pensait pouvoir arriver à constituer une réserve inépuisable de cellules permettant de réparer les lésions dues à l’âge ou les traumatismes des cellules malades du corps humain.
Les cellules souches sont trop souvent évoquées de manière approximative, aussi me paraît-il nécessaire de les définir. Leur concept est désormais précis car il est fondé sur une définition expérimentale, établie dans les années soixante grâce à l’étude du renouvellement des cellules du sang. Comme chaque globule rouge ne vit que 120 jours mais que nous en avons des milliards, leur renouvellement, nécessairement très rapide, s’effectue de manière régulée à partir d’un très petit contingent de cellules résidant dans des niches au sein de la moelle des os. Il a pu être démontré qu’une seule de ces cellules est capable de produire tous les types cellulaires du sang.
Ce qui distingue les cellules souches des autres cellules de l’organisme, c’est la manière dont elles se divisent et se multiplient. Généralement, une cellule fournit deux cellules identiques à la cellule initiale, c’est une division symétrique. Au contraire, la division d’une cellule souche fournit à la fois une première cellule identique, qui demeure indifférenciée, et une seconde cellule dont le destin sera tout autre, car si les cellules indifférenciées constituent une réserve de cellules se divisant très peu et très lentement, les cellules du second type prolifèrent jusqu’à se différencier en types cellulaires multiples. La cellule souche est donc une cellule pluripotente, à division asymétrique, produisant des cellules et capable d’auto renouvellement.
Nous en sommes désormais au stade de la génétique : nous savons en effet que tous les comportements cellulaires sont fondés sur le fonctionnement des gènes, ce qui nous a conduits, il y a trois ou quatre ans, à chercher les gènes responsables de la propriété spécifique de la cellule souche, la stemness ou qualité de cellule souche, par le biais de l’étude du transcriptome. On a observé des variations non seulement à travers le temps et en fonction du type de cellules souches étudié, mais également, pour une seule lignée de cellules souches, en fonction des laboratoires où elles étaient cultivées. On a pu toutefois identifier une vingtaine de gènes de stemness, stables et communs à toutes les cellules souches.
Les cellules souches se trouvent tout d’abord dans l’embryon très précoce (morula, blastocyste): lorsque l’œuf se divise, il produit des cellules, totipotentes ou pluripotentes, qui ont la même potentialité future de production de cellules que l’œuf lui-même. Ce sont elles qui ont été mises en culture. Les cellules souches embryonnaires (embryonic stem cells) sont donc le produit des biotechnologies. Captées et perpétués à un stade de développement qui, chez l’embryon, est très fugitif, elles sont maintenues éternellement en culture grâce à l’utilisation de conditions de culture particulières.
Ordinairement, chez l’embryon, au stade de la pluripotence, succède une première étape de différenciation, appelée la gastrulation ou formation des trois feuillets : l’ectoderme, qui produira la peau et le système nerveux, l’endoderme, qui produira la paroi du tube digestif et, entre eux, le mésoderme qui produira un grand nombre d’autres organes. Chacun de ces compartiments aura ses propres cellules souches, qui ne seront plus totipotentes : leurs capacités de développement seront restreintes. En effet, au fur et à mesure que les feuillets se spécialisent en tissus et en organes, les cellules sont de moins en moins pluripotentes.
Or, chez l’embryon comme chez l’adulte, les cellules différenciées ont une durée de vie déterminée. Chaque année, un individu perd l’équivalent de son poids en cellules mortes. La mort cellulaire est donc un processus normal, très actif et très important : lorsqu’il est entravé, une tendance à la tumorisation et à la formation de cancers peuvent surgir.
Il reste chez l’adulte une réserve des cellules souches de l’embryon dans tous les tissus. Il s’agit notamment des cellules souches hématopoïétiques, qui produisent le sang. Les études ont essentiellement porté sur les trois tissus qui, chez les mammifères, se renouvellent rapidement : le sang, (un globule rouge vit 120 jours), la peau (30 jours pour un renouvellement complet) et l’épithélium intestinal (renouvellement 5 à 7 jours). Ces cellules souches, par rapport à celles de l’embryon, sont spécialisées : celles qui résident dans la moelle osseuse ne peuvent produire que du sang ; celles qui sont dans la peau, que l’épiderme et les glandes annexes ; celles qui se trouvent dans l’épithélium intestinal, que le revêtement intérieur du tube gastrique. En d’autres termes, elles possèdent à la fois des capacités de différenciation restreintes mais de prolifération et de développement très importantes.
C’est ainsi qu’à la base de la villosité intestinale, dans l’intestin grêle, au fond de la crypte, résident des cellules souches qui sont à l’origine du renouvellement de l’épithélium qui borde la crypte et la villosité. À l’auto renouvellement de la cellule souche, succède la phase transitoire de prolifération de cellules identiques avant la dernière phase de différenciation, qui conduit à la mort : en effet, les cellules différenciées, qui ont des fonctions digestives importantes, vivent peu de temps.
Le processus est identique pour le sang : une seule cellule produit tous les types de cellules sanguines. La multi potentialité et l’auto renouvellement caractérisent donc ces cellules souches. Depuis la fin des années cinquante, l’usage thérapeutique des cellules hématopoïétiques, dont le fonctionnement a été découvert grâce aux recherches en physique nucléaire, est connu : elles permettent de soigner, voire de guérir des malades du sang en renouvelant le tissus sanguin.
En ce qui concerne la peau, les cellules souches, situées à la base du poil, pourvoient à son renouvellement ainsi qu’à celui de l’épiderme. Dans les années quatre-vingt, Howard Green, professeur américain enseignant à Harvard, qui a été le premier à cultiver des cellules souches de l’épiderme, a appliqué cette méthode à la thérapie cellulaire des brûlés : en quinze jours, des cellules isolées issues de peau restée saine se multiplient par colonies jusqu’à former une couche uniforme d’épiderme, qui est utilisée pour soigner la brûlure. Il est particulièrement important que ce soit la propre peau du brûlé qui lui soit greffée car il n’y a rien de plus antigénique que la peau : tout autre épiderme serait rejeté.
Les cellules souches hématopoïétiques sont présentes dans la moelle osseuse durant toute la vie. Elles sont utilisées en thérapie cellulaire lors des greffes de moelle osseuse.
D’autres cellules souches ont été découvertes, notamment les cellules souches neurales qui servent à remplacer certains neurones alors que durant très longtemps on a pensé que l’homme possédait un capital déterminé de neurones à la naissance et qu’aucun n’était produit durant la vie adulte, je l’ai moi-même enseigné. Or certains neurones, pas tous, il est vrai, sont renouvelés dans certaines régions du cerveau, je pense notamment à la zone dédiée à la mémoire. Les cellules neurales du cerveau peuvent être cultivées in vitro. Elles forment des amas de cellules indifférenciées qui flottent dans le milieu de culture. Si on change les conditions de culture les cellules adhèrent au substrat. Certaines se différencient en neurones et cellules gliales de divers types. D’autres restent indifférenciées et sont capables de reformer des neurosphères. Lorsqu’elles peuvent adhérer à un substrat, certaines d’entre elles se divisent et se différencient. Il y a là un espoir de thérapie par cellules souches adultes.
Il existe également les cellules satellites musculaires et les cellules souches mésenchymateuses. Ces dernières, qui ne sont pas hématopoïétiques, forment le stroma de la moelle osseuse où les cellules souches hématopoïétiques pourront se loger. Elles sont également à l’origine des cellules de l’os et du cartilage ainsi que des cellules adipeuses et conjonctives. Il s’agit donc de cellules pluripotentes, qui font l’objet, elles aussi, d’espoir pour la thérapie cellulaire, d’autant qu’elles sont très abondantes dans le sang de cordon, qui contient, à la fois, un grand nombre de cellules souches hématopoïétiques et de cellules mésenchymateuses.
On utilise déjà les cellules souches adultes dans certains traitements. Toutefois, il faudrait en obtenir davantage pour en augmenter les possibilités thérapeutiques. En effet, comme elles sont d’une très grande efficacité, elles sont naturellement fort peu nombreuses. Il conviendrait dès lors de les retirer de leurs niches, qui sont des unités de régénération exclusivement capables de produire une catégorie définie de cellules différenciées en petit nombre, afin de les cultiver puis de les réintroduire. Si l’opération peut être menée avec les cellules du patient lui-même, il n’y aura aucun problème de rejet. Malheureusement, la plasticité de ces cellules est faible et augmenter leur capacité de différenciation se révèle très difficile. C’est pourquoi, si des progrès thérapeutiques sont à attendre des cellules souches adultes, le procédé n’est toutefois pas très prometteur.
Si bien que la découverte, en 2006, de la transformation des cellules adultes en cellules souches totipotentes ou pluripotentes, capables de reprogrammation en fonction de l’environnement, à l’instar de celles de l’embryon, a sonné comme un véritable coup de tonnerre. Shinya Yamanaka et son équipe, dans le cadre de recherches effectuées sur la stemness, ont en effet transformé des fibroblastes, cellules présentes dans le tissu conjonctif, en cellules ES like, après avoir introduit avec des vecteurs rétroviraux dans des fibroblastes adultes de souris les vingt-quatre gènes de la stemness, ce qui leur a permis d’obtenir, en proportion assez faible il est vrai, la reprogrammation du noyau des cellules en noyau de cellule embryonnaire souche. Puis, retirant un gène à chaque nouvelle expérience, afin d’alléger le processus, ils se sont aperçus que quatre gènes étaient suffisants.
C’est une très grande avancée non seulement en raison des espoirs qu’elle permet de susciter sur le plan pratique mais également d’un point de vue purement scientifique. Pour tout embryologiste qui s’intéresse à la différenciation cellulaire, cette découverte ouvre d’immenses horizons. C’est la raison pour laquelle les travaux sur les cellules souches naturelles comme sur les cellules souches induites par les biotechnologies doivent être encouragés car ils représentent une véritable révolution dans les études sur la biologie cellulaire afin de mieux comprendre à la fois leur fonctionnement et leur transformation en tumeurs. C’est ainsi qu’on observe que la souris dans laquelle ont été injectées des cellules souches embryonnaires et celle dans laquelle ont été injectées des cellules souches pluripotentes induites (iPS en anglais pour induced pluripotent stem cells) présentent toutes les deux des tératomes, ce qui signifient bien que ces cellules se développent pour former des tissus de toutes catégories.
L’injection d’iPS peut être pratiqué sur l’homme. On peut du reste transformer non seulement des fibroblastes, mais également presque tous les types de cellules, notamment celles de l’épithélium digestif, du foie ou encore des lymphocytes. Les iPS représentent donc un grand espoir du fait du caractère véritablement pluripotent de ces cellules : elles sont capables de fournir une souris complète. De fait, nous nous trouvons bien devant une révolution.
M Alain Claeys, rapporteur. Je vous remercie beaucoup de cette présentation introductive et donne la parole à Mme Laure Coulombel, directrice de recherche à l’INSERM, rédactrice en chef adjoint de Médecine Science.
Mme Laure Coulombel, directrice de recherche à l’INSERM, rédactrice en chef adjoint de Médecine Science. Je tiens à rappeler tout d’abord que de multiples types de cellules souches fonctionnant tout au long de la vie de l’individu ont été identifiés. Celles-ci possèdent donc une grande diversité, puisque chaque type possède une identité propre ainsi qu’un potentiel et une fonction uniques et non redondants.
De plus, on connaît désormais les mécanismes qui contrôlent l’état des cellules et leurs fonctions au niveau moléculaire ainsi que le rôle important que joue leur environnement pour leur permettre de remplir correctement leurs fonctions. On sait enfin que la flexibilité de l’état des cellules débouche sur la possibilité de reprogrammation et que la découverte de ce nouveau type de cellules permet la modélisation des maladies humaines.
Les utilisations cliniques actuelles des cellules souches sont toutefois peu nombreuses. De nombreuses cellules souches ont été identifiées in vivo. Tout au long de la vie de l’individu, dans l’organisme, après les cellules embryonnaires totipotentes puis pluripotentes, apparaissent chez le fœtus puis chez l’adulte des cellules souches de potentiel variable et restreint à un tissu donné. Au fur et à mesure de la vie de l’individu, elles connaissent une perte de prolifération et de potentialité irréversible in vivo. Il n’y a ni immortalité des cellules souches in vivo ni retour en arrière spontané.
Il convient également de préciser que, in vivo, les cellules souches embryonnaires ainsi que les cellules fœtales et adultes – je mets « fœtales » et « adultes » dans la même catégorie – sont deux entités très différentes. Par la gastrulation, l’embryon fabrique les trois feuillets embryonnaires avant de produire tous les tissus de l’organisme dans le cadre de mécanismes de contrôle très spécifiques. Chez l’adulte, les cellules, situées dans leurs organes, n’ont plus les mêmes caractéristiques. Nous ne sommes plus dans l’embryologie mais dans l’étude de la survie, du vieillissement et de la mort des cellules adultes, qui sont confrontées à d’éventuelles dérives pathologiques, notamment tumorales.
Chez l’adulte et, à un moindre degré, chez l’embryon, les cellules ne sont pas indépendantes : leur fonctionnement normal dépend des composants et de la structure de leurs niches tissulaires, à savoir de leur environnement, ce qui pose le problème de leur transplantation. En termes thérapeutiques, il convient de les transplanter dans un environnement où elles puissent fonctionner. Lorsqu’elles sortent de la niche, elles se différencient et meurent. La niche, qui est un réseau complexe de cellules et de molécules régulatrices, sert à conserver les propriétés des cellules et, chez l’embryon, à fabriquer les tissus.
Nous sommes confrontés au problème de la non amplification chez l’adulte des cellules souches fonctionnant in vivo. En dehors des cellules hématopoïétiques du sang de cordon et de la moelle osseuse et des cellules de la peau, on ne peut pas utiliser à des fins thérapeutiques directes des cellules primaires ni des cellules embryonnaires in vivo, elles sont trop peu nombreuses. Il convient donc de les amplifier in vitro, de manière artéfactuelle. Il s’agit de savoir si les cellules ainsi amplifiées sont identiques aux cellules in vivo. Les lignées de cellules souches embryonnaires conservent in vitro leurs propriétés in vivo.
Il existe une autre catégorie de cellules amplifiées pour lesquelles on ignore encore à l’heure actuelle leur rôle physiologique in vivo : n’a-t-on pas induit en les cultivant in vitro des propriétés n’existant pas in vivo ? C’est le cas des cellules souches mésenchymateuses, des cellules stromales, qui fabriquent efficacement de l’os, et de celles qui poussent sous forme de neurosphères et qui peuvent avoir un intérêt thérapeutique. C’est enfin le cas des cellules reprogrammées. Le scientifique, lorsqu’il sort une cellule de son environnement, doit se pencher sur les propriétés artéfactuelles qu’elle peut acquérir et qui peuvent être utiles.
Je tiens à rappeler que les cellules souches embryonnaires sont des cellules normales physiologiques, c’est ce que nous a appris la souris. Si elles sont réimplantées dans l’embryon, elles fabriqueront de nouveau des tissus embryonnaires. Ce sont des cellules neuves pluripotentes, qui se différencient en de multiples tissus. Il en existe un grand nombre de lignées par le monde plus de 300, car la recherche est internationale. Ces lignées sont partagées entre les différents laboratoires ; des possibilités de banques internationales avec typage HLA existent.
Depuis dix ans, on connaît l’efficacité de différenciation des cellules souches embryonnaires. Il demeure toutefois des problème éthiques et des risques : d’une part, l’incompatibilité immunologique, sur laquelle des progrès ont été réalisés grâce aux traitements immunosuppresseurs et aux recherches sur l’induction d’une tolérance immunologique ; d’autre part, l’instabilité génétique, que tend à pallier l’amélioration considérable des procédés de purification des progéniteurs. Les essais cliniques auront probablement lieu dans quatre ans.
La caractérisation, à large échelle, de la cellule est un autre grand progrès scientifique. On connaît désormais la séquence des gènes dans le noyau (épigénome et génome) les modifications qui permettent l’expression des gènes, leur traduction en ARN. On peut à l’heure actuelle caractériser d’une part tous les ARN d’une cellule : c’est la transcriptomie, et d’autre part, les protéines qui sont fabriquées par ces gènes c’est la protéomie.
On possède ainsi la carte d’identité complète d’une cellule, ce qui a été très précieux, ces trois dernières années, pour caractériser de façon très précise les cellules souches embryonnaires, les cellules souches adultes, qui continuent de poser des problèmes de purification, et les cellules reprogrammées. Les cellules souches embryonnaires possèdent des caractéristiques uniques qui les rendent totalement différentes des cellules souches adultes, qu’il s’agisse de l’expression des gènes ou de l’expression protéique. Le contrôle des cellules souches embryonnaires est unique, ce qui a permis de définir l’état de pluripotence.
C’est l’organisation de son environnement qui permet, ou ne permet pas à un gène de s’exprimer. Dans une cellule souche pluripotente embryonnaire ou une cellule iPS, l’ADN est déroulé, ce qui permettra à un grand nombre de gènes de s’exprimer car c’est une structure ouverte ou permissive. Dans une cellule souche adulte, la structure est fermée et seuls s’expriment les gènes du tissu donné. Cette organisation permet de dégager clairement l’explication mécanistique du potentiel d’une cellule. La reprogrammation, qui consiste à passer d’une structure fermée à une structure ouverte ou permissive, constitue un progrès scientifique considérable.
C’est parce qu’on a pu décrypter les mécanismes moléculaires du potentiel, qu’on a pu arriver au processus de reprogrammation : les travaux qui ont été effectués sur les cellules souches embryonnaires pluripotentes ont permis d’atteindre ce résultat. La reprogrammation n’est pas un processus physiologique puisqu’elle a pour origine une cellule différenciée. Il existe trois processus de reprogrammation.
Le premier consiste dans le transfert nucléaire : un noyau somatique est implanté dans un ovocyte de façon à recouvrer sa capacité de fabriquer un embryon et les tissus dérivants de cet embryon. Cette technique n’a pas encore été réalisée chez l’homme mais chez d’autres mammifères.
Le deuxième est la reprogrammation en iPS, qui consiste à forcer une cellule différenciée à exprimer des gènes pluripotents embryonnaires.
Le troisième et dernier processus, important d’un point de vue thérapeutique, consiste dans une reprogrammation partielle : il s’agit non de retourner à un état pluripotent, mais, pour un tissu donné, à un état de transdifférenciation, processus qui a été réalisé récemment pour le pancréas et l’est depuis longtemps pour les cellules hématopoïétiques. Il ne convient donc pas de limiter la reprogrammation à la technique iPS. Le recul actuel sur les iPS est très faible : trois ans seulement. Leur utilité thérapeutique n’est donc pas encore avérée.
Il est toutefois indiscutable que les processus de reprogrammation sont de fabuleux outils pour comprendre le contrôle de l’identité cellulaire. Il reste à décrypter les différents degrés de reprogrammation, afin d’inventer notamment des outils de reprogrammation. Cette connaissance permet également la modélisation de maladies humaines. En revanche, comme on ne sait pas encore maîtriser les processus de différenciation, on ignore l’utilité de la reprogrammation en thérapie cellulaire. Quant à l’idée de produire des cellules autologues pour un patient spécifique, elle n’a pas encore été vérifiée d’un point de vue immunologique. De plus, on ignore si elle est réaliste d’un point de vue thérapeutique.
Il importe d’acquérir la compréhension des différents mécanismes de réparation tissulaire puisque les cellules souches peuvent être greffées pour remplacer des cellules malades. C’est une méthode peu utilisée à l’heure actuelle, exception faite des cellules souches hématopoïétiques et des cellules souches épidermiques. Peut-être concernera-t-elle bientôt les cellules de l’os ?
Il est possible d’envisager, dans le cadre d’un effet indirect, non de remplacer la cellule malade, mais de faciliter sa réparation grâce à l’importation de cellules endogènes qui, par un effet trophique, synthétiseront des facteurs importants pour la réparation et aideront à induire une tolérance immunologique modulée. C’est une voie de recherche thérapeutique importante.
On peut également utiliser les cellules souches comme vecteurs de drogues cytotoxiques, notamment dans certains problèmes tumoraux, car elles savent généralement retourner dans leur tissu d’origine.
Un dernier mécanisme consiste à stimuler la fonction des cellules souches in situ, procédé qui, dans certains traitements, a certainement plus d’avenir que la greffe de cellules souches. Ce procédé implique de connaître les cellules souches in situ et de stimuler leur fonction en agissant sur la niche ou directement sur les cellules, ce qui se pratique déjà dans le système hématopoïétique.
Je tiens à livrer quelques réflexions en guise de conclusion.
Il convient de reconnaître l’importance et la nécessité de la recherche cognitive, indépendamment d’une finalité thérapeutique rapide, ce que ne fait pas la France.
Il faut maintenir la diversité des sources de cellules souches, c’est indispensable pour assurer une réponse thérapeutique adaptée. Il n’y aura pas de cellule souche universelle car les cellules souches ne sont pas redondantes.
On doit également reconnaître la difficulté de la recherche pré clinique sur les modèles in vivo, et l’importance de la recherche sur les biomatériaux et les structures tridimensionnelles, qui a beaucoup progressé ces dernières années, d’où l’importance de l’interdisciplinarité. On ne pourra en effet, jamais injecter une cellule souche directement à un patient.
Il faut de plus à rappeler que les enjeux sont internationaux et que, malheureusement, la place de la France est insuffisante.
J’estime par ailleurs que l’information scientifique qui est délivrée à la société devrait être plus rigoureuse et qu’il faudrait enfin harmoniser rapidement avancée scientifique et réglementation.
M. Alain Claeys, rapporteur. Je vous remercie de cet exposé précis. Y a-t-il des questions ?
M. Jacques Remacle, conseiller scientifique, direction générale de la recherche, unité génomique et systèmes biologiques commission européenne. Les cellules souches intéressent l’industrie pharmaceutique, non seulement en raison de leur aspect thérapeutique, mais également parce que celle-ci pourrait tester la toxicité des drogues sur des tissus cultivés in vitro. De cette manière, elle pourrait commercialiser des médicaments plus prometteurs.
M. Jean-Sébastien Vialatte, rapporteur. Je donne la parole à M. Daniel Louvard, qui est professeur à l’Institut Pasteur, directeur du centre de recherche de l’institut Curie et membre de l’Académie des sciences
M. Daniel Louvard, professeur à l’Institut Pasteur, directeur du centre de recherche de l’institut Curie, membre de l’Académie des sciences. J’avais déjà attiré l’attention de l’office parlementaire, il y a quelques années, au cours d’une réunion semblable à celle-ci, sur l’importance des cellules souches tumorales, et il semble que l’évolution de la recherche m’ait donné raison.
La notion de cellules souches tumorales renvoie tout d’abord à l’origine cellulaire des cancers. Il ne fait aucun doute que l’apparition des cancers résulte du dérèglement du fonctionnement de nos gènes, du fait de gains et de pertes de fonctions de gènes particuliers, les oncogènes et les gènes suppresseurs de tumeurs. Cela étant dit, toutes les cellules de l’organisme sont-elles équivalentes, ou bien existe-t-il des cellules qui sont à l’origine de la tumeur et dans lesquelles vont s’accumuler les mutations ? Cette question est fondamentale pour les biologistes qui s’intéressent à la cancérogénèse, mais elle a aussi un impact fondamental d’un point de vue thérapeutique. Quel type d’innovations peut-on espérer ? Quels sont les indicateurs à suivre pour mesurer l’efficacité d’une drogue contre la prolifération cellulaire ? Quelles sont les cibles auxquelles s’attaquer pour faire disparaître une tumeur et éviter la récidive ?
On a observé sur des modèles animaux et sur des patients, il y a déjà cinquante ans, qu’il fallait utiliser un nombre élevé de cellules d’une tumeur parfois près d’un million pour parvenir à la transplanter et pour la voir proliférer. Il en a résulté deux hypothèses : soit toutes les cellules sont équivalentes au sein de la tumeur et seules quelques unes d’entre elles parviennent à s’adapter à leur nouvel environnement au terme d’un processus stochastique peu efficace ; soit il existe non seulement une hétérogénéité génétique au sein de la tumeur, bien connue et liée à l’instabilité du génome, mais aussi une population relativement minoritaire de cellules ayant les capacités de la régénérer.
Il a fallu attendre les travaux conduits sur les cellules hématopoïétiques et la moelle osseuse à la fin des années quatre-vingt et le début des années quatre-vingt-dix pour avancer. On doit au professeur Irving Weissman, de l’université de Stanford, la démonstration formelle du caractère unique et clonal de certaines cellules de la moelle osseuse, capables de reproduire la différenciation sanguine à partir d’une seule cellule et de générer les différents types cellulaires. Les travaux réalisés par le professeur John Dick en 1994 ont ensuite montré que des cellules à l’origine de certaines leucémies présentaient des propriétés communes avec les cellules souches normales.
Il s’agit dès lors de savoir dans quelle mesure ces cellules tumorales sont semblables aux cellules souches normales et si elles sont les premières à avoir subi les dérèglements du fonctionnement du génome et à avoir accumulé ses mutations. Certains auteurs anglo-saxons préfèrent utiliser, pour les désigner, les termes de tumor initiating cells, c’est-à-dire de cellules à l’origine de la tumeur.
Les recherches sur le développement et l’embryologie des métazoaires, vertébrés comme invertébrés, et l’identification des « voies de signalisation », c’est-à-dire des réseaux de gènes contrôlant la différenciation des cellules souches pluripotentes en tissus différenciés, ont accrédité l’idée qu’il existait des points communs entre ces cellules et les cellules souches normales. Les travaux menés en parallèle en biologie du cancer ont mis en évidence que des voies de signalisation majeures revêtaient une importance considérable dans l’apparition de tumeurs d’origine et de localisation différentes : tumeurs du tube digestif, du système nerveux central, du système hématopoïétique, mais aussi tumeurs de l’épiderme. Ces réseaux de gènes jouent un rôle important dans la différenciation des cellules souches normales et dans l’émergence des tumeurs.
L’idée s’est établie qu’une tumeur est non seulement un tissu anarchique, mais aussi une « niche » présentant une hétérogénéité cellulaire, avec une masse importante de cellules différenciées entourant des cellules, en nombre plus restreint, qui assurent la pérennité, la croissance et la prolifération de la tumeur.
Ce type de recherches et d’analyses n’aurait pas pu être conduit sans deux avancées majeures, issues de la recherche fondamentale sur les cellules souches normales : d’une part, l’identification de marqueurs de surface par les hématologistes et les immunologistes, et d’autre part, l’apparition de technologies avancées de tri et d’identification cellulaires, la cytométrie de flux, encore appelée analyse par FACS (fluorescence activated cell sorting.) Grâce à ces techniques, il est possible d’identifier, au sein d’un tissu tumoral, une population minoritaire de cellules que l’on peut transplanter d’un animal à un autre pour régénérer une tumeur. De telles expérimentations ont été réalisées pour des leucémies myéloïques et des tumeurs d’origine hématopoïétique, puis pour des tumeurs cérébrales et des cancers du sein. Ces recherches n’auraient qu’un intérêt seulement cognitif si elles n’emportaient pas des conséquences considérables sur la façon dont on peut envisager le traitement des cancers.
Nous disposons aujourd’hui d’approches thérapeutiques cytotoxiques faisant certes régresser la masse tumorale, mais s’accompagnant de récidives au bout de quelques semaines ou de quelques mois. Ce phénomène peut être interprété de deux façons, qui ne sont pas exclusives : on peut considérer que la récidive résulte de la mutation des gènes auxquels s’attaque l’agent cytotoxique et qu’il existe un phénomène de résistance identique à celui que l’on observe dans le cas des antibiotiques ; une autre approche consiste à penser que l’on a certes détruit la masse tumorale principale en s’attaquant aux cellules différenciées, mais sans atteindre le mal à la racine, les cellules souches tumorales étant résistantes à l’agent utilisé, ce qui explique la régénérescence de la masse tumorale. En les détruisant grâce à un autre agent, on serait alors à même d’éradiquer la tumeur, soit par la seule action de cet agent, soit par une combinaison des traitements classiques avec des traitements innovants.
Nous sommes aujourd’hui dans une phase exploratoire qui ne permet pas d’écarter la seconde hypothèse, malgré les précautions qui s’imposent. La première question est de savoir si l’on a affaire à des cellules totalement différentes des cellules souches ou bien à des cellules qui leur sont apparentées. Il faut également comprendre ce qui contrôle, parmi les voies de signalisation connues, la croissance des cellules souches tumorales. Quelle est l’importance de l’épigénome, aujourd’hui au cœur de la biologie des cancers et d’autres maladies ? Quel est le rôle de la programmation, de la reprogrammation et de la plasticité du génome ?
Il en résulte toute une série d’interrogations qui sont autant d’obstacles que de possibilités d’avancer. On constate que les cellules souches normales se divisent de façon asymétrique. Or, si nous en savons beaucoup sur la division symétrique, la division asymétrique reste en grande partie méconnue. Si les cellules tumorales et les cellules souches normales obéissent à un mécanisme commun, nous devons pourtant nous efforcer de maîtriser ses règles biologiques fondamentales. En second lieu, nous savons que les cellules souches sont résistantes à l’action des xénobiotiques, et c’est heureux, car nous ne serions pas capables de préserver ce réservoir essentiel à la réparation de nos tissus si tel n’était pas le cas. Il serait logique de penser que les cellules souches tumorales ont hérité de cette résistance aux radiations et aux agents chimio thérapeutiques, ce qui correspond aux observations que l’on peut faire.
Y a-t-il des liens entre le phénotype des cellules tumorales et leur capacité à devenir invasives, c’est-à-dire à migrer et à donner naissance à des métastases ? La caractéristique du cancer dans sa phase terminale, que nous ne savons pas gérer, est de créer à distance des foyers secondaires. Quelle est l’importance de la « niche » et des cellules stromales dans ce phénomène ? Ces caractéristiques sont-elles reproductibles dans des modèles animaux dans le cadre de xénogreffes ?
Il existe un lien étroit entre les recherches conduites sur les cellules souches normales et l’étude des tumeurs et de leur éradication. Il ne s’agit pas, en l’occurrence, de pratiquer une thérapie cellulaire pour réparer, mais pour faire disparaître une sous population particulière de cellules qui permet aux tumeurs de se développer et de se disséminer.
Dans une publication datant de l’été dernier, le professeur Robert Weinberg, du Massachusetts Institute of Technology (MIT), a conclu qu’il existait suffisamment de données expérimentales pour penser que les cellules souches tumorales sont au cœur du problème. Selon lui, il existe des cellules capables de s’engager grâce à leurs caractéristiques propres, en particulier leur plasticité, dans la transition épithélio-mésenchymateuse, propriété intrinsèque des cellules embryonnaires qui permet à une cellule de migrer d’un tissu à un autre. Il a apporté une preuve expérimentale, certes relativement artificielle, car elle a été administrée dans le cadre d’un modèle créé de toutes pièces, utilisant des cellules de tumeur du sein dotées de gènes leur permettant de s’engager dans la transition épithélio-mésenchymateuse, qu’un antibiotique connu, la salinomycine, avait une efficacité cent fois supérieure à celle du paclitaxel, qui est à ce jour le meilleur agent cytotoxique pour le type de tumeur étudié. Ce travail ne fait pas de la salinomycine une nouvelle réponse aux cancers, mais il démontre que certains agents thérapeutiques, parfois connus pour d’autres propriétés, sont capables d’agir sur des cellules jouant un rôle dans la dissémination des tumeurs.
Il existe aujourd’hui une controverse au sein de la communauté scientifique sur l’abondance relative de ces cellules dans les tumeurs. Dans le cas du mélanome, certains travaux suggèrent que ces cellules sont beaucoup plus nombreuses qu’on peut l’imaginer, ce qui pose la question de la validité de nos modèles expérimentaux et conduit à s’interroger sur les variations que l’on observe entre les laboratoires, question déjà évoquée par Nicole Le Douarin. Il serait probablement utile de définir en commun des règles rigoureuses pour l’observation et la conduite des expériences. Si ce débat présente un intérêt d’un point de vue quantitatif, il ne remet nullement en cause l’existence de la sous-population de cellules en cause.
Dans une autre publication, Robert Weinberg s’est interrogé sur l’existence d’une plasticité, variable d’un tissu à l’autre, voire d’un individu à l’autre, qui permettrait à des cellules différenciées ou progénitrices d’acquérir sous l’action des gènes à l’origine des tumeurs des propriétés les faisant ressembler à des cellules souches. Si une telle réversibilité existe, l’utilisation d’agents permettant de détruire des cellules souches à l’origine des tumeurs ne ferait que reporter le problème à l’infini. Toutefois, la combinaison des agents déjà connus avec d’autres agents attaquant la tumeur à la racine pourrait autoriser des progrès que nous attendons tous.
M. Jean- Sébastien-Vialatte, rapporteur. Je vous remercie de cette présentation et donne la parole, s’il n’y a pas de question à M. Pierre Jouannet, professeur des universités, praticien hospitalier qui est consultant en biologie de la reproduction à l’hôpital Cochin et membre de l’Académie nationale de médecine
M. Pierre Jouannet, professeur des universités, praticien hospitalier consultant en biologie de la reproduction à l’hôpital Cochin, membre de l’Académie nationale de médecine. L’embryon est aujourd’hui quasiment ignoré, ou oublié, dans la plupart des débats et des rapports dans notre pays. Si les conditions de culture in vitro sont appropriées, les cellules embryonnaires, résultant de la rencontre des gamètes et identifiables par la présence de deux pronoyaux, vont se développer jusqu’au stade du blastocyste, qui apparaît au bout de cinq ou six jours. C’est l’étape ultime du développement in vitro et le dernier moment où une implantation de l’embryon dans la muqueuse utérine est praticable.
Ces embryons ne sont pas créés dans n’importe quelles circonstances, mais au bénéfice de couples rencontrant des problèmes de stérilité et pour lesquels la fécondation in vitro est la seule façon de réaliser un projet parental. Quand les embryons ne peuvent pas être transférés dans l’utérus ou quand il y a plus d’embryons que l’on peut en transférer, il est possible de procéder à une congélation. Le transfert dans l’utérus et la congélation peuvent être pratiqués à tous les stades du développement in vitro, de l’apparition de l’œuf fécondé, le zygote, jusqu’à la formation du blastocyste.
La fécondation in vitro ne conduit pas à la création d’un seul embryon, mais d’une cohorte embryonnaire : on prélève en général une dizaine d’ovocytes afin de créer plusieurs embryons. En effet, ces derniers sont souvent hétérogènes : certains sont normaux, tandis que d’autres ne le sont pas. Il faut notamment éliminer les embryons triploïdes, comportant trois pronoyaux et incapables de donner un enfant vivant, ainsi que les embryons fragmentés, dont les altérations cellulaires réduisent les capacités de développement. Parmi les embryons restants, ceux qui paraissent les plus aptes à se développer seront choisis pour un transfert immédiat dans l’utérus, et les autres seront congelés.
La création d’embryons in vitro nécessite de pratiquer des choix. Le développement des embryons qui peuvent être considérés comme pathologiques sera interrompu, car c’est leur seul devenir possible ; d’autres seront, en revanche, conservés pour la réalisation du projet parental, soit immédiatement par voie de transfert dans l’utérus, soit de façon différée par voie de congélation.
Dans le laboratoire de Cochin dont je me suis occupé, près de 10 000 embryons sont créés par an. Selon le dernier bilan détaillé de l’Agence de la biomédecine, il y a eu, au cours de l’année 2006, 50 000 tentatives de fécondation in vitro en France dans le cadre de la procréation intra-conjugale, c’est-à-dire avec les gamètes de l’homme et de la femme formant le couple intéressé. Plus de 450 000 ovocytes ont été recueillis et 233 447 embryons ont été créés, soit près de deux fois moins. Certains de ces embryons, jugés inaptes au développement, ont été éliminés tout de suite. Les autres, 57 % du total, ont été soit transférés, soit congelés.
On observe que seuls 11 647 enfants sont nés par fécondation in vitro en 2006, alors que 84 907 embryons avaient été transférés. Plus de 85 % des embryons jugés « de bonne qualité » ne se sont donc pas développés dans l’utérus de la mère. Il faut ajouter à cela les 24 556 embryons initialement congelés qui ont eux aussi été transférés, donnant lieu à 2009 naissances. Dans ce cas, seuls 8,2 % des embryons transférés ont donné naissance à un enfant. Au total, il y a eu 13 756 enfants nés pour 233 447 embryons créés en 2006. Cela signifie que près de 94 % des embryons ne sont pas devenus des enfants vivants. On a bien sûr envie de comprendre pourquoi on compte tant d’échecs, c’est-à-dire pourquoi certains embryons se développent et d’autres non. Que se passe-t-il durant la première semaine du développement, qui précède l’implantation dans l’utérus ?
Le premier événement est l’activation de l’ovocyte : la pénétration du spermatozoïde va déclencher, au sein de l’ovocyte, une série de réactions métaboliques et moléculaires qui permettent le développement embryonnaire. L’essentiel de ces phénomènes dépend du cytoplasme de l’ovocyte : ce ne sont donc pas les gènes de l’embryon qui contrôlent le début de son développement, mais les gènes maternels par l’intermédiaire des transcrits et les protéines présents dans l’ovocyte, le génome embryonnaire lui-même n’étant activé qu’à partir du stade « 4 à 8 cellules ».
Indépendamment de cette activation, on constate des phénomènes extraordinaires au niveau épigénétique. Ce qui compte en effet, comme d’autres intervenants l’ont rappelé avant moi, ce n’est pas la structure des gènes, mais les facteurs qui régulent leur expression, laquelle dépend des histones, mais aussi de la méthylation de l’ADN. On observe qu’une déméthylation se produit massivement, mais de façon distincte, au moment de la fécondation au sein du pronoyau d’origine maternelle, et du pronoyau d’origine paternelle. Une reméthylation progressive du génome a ensuite lieu à partir de l’apparition du blastocyste. Il existe néanmoins une exception à ce phénomène général : la méthylation des gènes soumis à empreinte, qui sont essentiels pour un développement normal de l’embryon, reste inchangée au cours de la première semaine.
Outre la mise en place des marqueurs épigénétiques, qui contrôleront la régulation des gènes à ce stade et bien au-delà, des événements métaboliques se produisent. Les besoins de l’embryon sont en effet évolutifs. Schématiquement, le métabolisme, et partant les besoins de l’embryon, varient selon que l’on se place avant ou après l’activation du génome. Il se produit tout un ensemble de phénomènes extrêmement importants à ce stade du développement ; or, nous les connaissons très mal aujourd’hui.
Quant aux choix des embryons les plus susceptibles de se développer, les critères utilisés pour le moment sont essentiellement morphologiques. Toutefois, grâce aux développements de la technologie, de la génomique, de la protéomique, de la transcriptomique et des micro méthodes permettant de travailler sur de très petites quantités de cellules, et par conséquent sur des embryons précoces, on commence à pouvoir caractériser les embryons beaucoup plus finement en établissant un lien entre leur composition protéique ou leur composition en ARN et leur capacité de développement. Certains travaux ont ainsi permis de distinguer, en fonction de la surexpression ou de la sous-expression de diverses protéines, des blastocystes aptes à conduire à la naissance d’enfants et d’autres ne se développant pas alors qu’ils auraient été tous jugés normaux. D’autres études portent sur le profil métabolique des embryons et sur l’analyse de leur milieu de culture.
Un autre travail réalisé par une équipe australienne a consisté à pratiquer, avant le transfert de l’embryon dans l’utérus et sans toucher à la masse cellulaire interne, une biopsie sur les cellules du trophectoderme, à l’origine du placenta et des annexes embryonnaires. On a découvert que plus de 7 000 transcrits étaient exprimés exclusivement dans les blastocystes conduisant à la naissance d’enfants.
Ce type d’études est très intéressant pour améliorer le choix des embryons que l’on transfère dans l’utérus et les chances de donner naissance à un enfant en bonne santé. Or il est impossible de réaliser un tel travail dans notre pays en l’absence de tout crédit disponible. Une condamnation morale, sociale et politique interdit en effet toute recherche sur l’embryon. La loi française prohibe, en outre, le transfert d’embryons ayant fait l’objet d’une recherche, comme ce fut le cas dans l’étude que je viens de citer.
Les recherches sur l’embryon pour l’embryon, et non sur l’embryon comme simple apport de cellules dans une finalité autre que lui-même, sont tout à fait essentielles. Je fais partie de ceux qui considèrent que les études sur les cellules souches sont indispensables mais que les recherches doivent aussi porter sur l’embryon pour l’embryon. De telles recherches peuvent être non invasives, notamment lorsqu’on étudie un milieu de culture, ou bien au contraire invasives lorsque l’on prélève des cellules. Nous le faisons déjà sur l’embryon pour réaliser des diagnostics préimplantatoires : on prélève alors deux blastomères sur un embryon de huit cellules, et surtout plus tard à tous les âges de la vie, sous la forme de prises de sang et de biopsie. Toutefois, ce qui est possible sur l’être humain à tous les âges de la vie est aujourd’hui interdit sur l’embryon.
Le Conseil d’État considère qu’il faut « apporter à cette personne humaine potentielle des protections qui lui soient propres en pensant non seulement à ce qu’elle est, mais à ce qu’elle a vocation à devenir ». De son côté, l’OPECST a qualifié l’embryon de « personne humaine en devenir ». Lors des états généraux de la bioéthique, il a également été avancé que les recherches sur l’embryon destiné à naître bafouent de toute évidence le principe de non instrumentalisation d’un corps humain en devenir et que l’embryon destiné à naître doit bénéficier d’un statut protecteur. Une récente mission parlementaire a enfin considéré que la protection de l’embryon demeurait un impératif légal. Or, je rappelle que 94 % des embryons créés dans les laboratoires de fécondation in vitro en France n’ont pas d’autre perspective que l’arrêt de leur développement, c’est-à-dire la mort.
A-t-on le droit de ne pas chercher à comprendre pourquoi ces embryons ne se développent pas ? Nous sommes dans une situation semblable à celle qui prévalait au Moyen Âge lorsqu’on interdisait les autopsies, pourtant fort utiles pour comprendre les causes de la mort. Nous constatons qu’une très grande quantité d’embryons créés ne se développent pas, mais sans vraiment chercher à comprendre pourquoi. On peut même lire dans le rapport du Conseil d’État, qui ne porte que sur les cellules souches et fait l’impasse sur la recherche au profit de l’embryon, qu’il n’y aura plus aucune raison de développer une recherche sur l’embryon à partir du moment où l’on pourra utiliser d’autres cellules que les cellules embryonnaires comme cellules souches. On dirait que la seule recherche envisageable consiste à utiliser l’embryon pour une autre finalité que lui-même.
Je trouve également très curieux qu’il soit interdit d’implanter les embryons une fois que des recherches ont eu lieu, je cite l’OPECST. Si l’on se place aux autres âges de la vie, cela revient à dire que l’on ne peut plus faire de recherche sur l’être humain, sauf lorsqu’il va mourir.
M. Alain Claeys, rapporteur. Je précise que c’est la loi qui interdit ces transferts, et pas l’OPECST. En outre, la mission parlementaire que vous évoquez a étudié la question de la recherche au profit de l’embryon, même si elle n’a pas fait de propositions spécifiques dans de domaine.
M. Pierre Jouannet. En effet, mais ce sujet n’a fait l’objet que de cinq lignes sur un total de vingt pages consacrées à l’embryon. Pourquoi la recherche sur l’embryon devrait-elle être plus exceptionnelle que la recherche sur l’être humain à tous les âges de sa vie ? Pourquoi refuser, par principe, ce type de recherche ? Le développement embryonnaire précoce est une période très sensible, dont nous ignorons de nombreux aspects. Pour améliorer les connaissances, nous avons besoin de développer la recherche sur l’embryon lui-même.
Refuser le transfert dans l’utérus d’embryons ayant fait l’objet d’une recherche constitue, selon moi, une déshumanisation, et cela revient à considérer qu’il y a une incompatibilité entre la recherche et la vie. Il devrait pouvoir exister des recherches sur l’embryon au même titre qu’il y en a sur l’être humain vivant à tous les âges de la vie.
C’est une question éthique, mais également politique, car le financement de la recherche, son organisation et son évaluation sont en jeu. Pour respecter l’embryon, il faut lui porter d’autant plus d’intérêt qu’il est destiné à devenir une personne humaine. Cela implique également d’accorder plus d’attention aux laboratoires de fécondation in vitro qui les créent et qui s’occupent d’eux. Force est de constater que ces centaines de milliers d’embryons et ces laboratoires intéressent peu aujourd’hui.
M. Alain Claeys, rapporteur. Je vous remercie beaucoup pour votre intervention qui concerne l’un des sujets dont nous allons devoir débattre dans le cadre de la révision des lois de bioéthique, et peut-être avancerons nous ? Y a-t-il des questions ?
Mme Nicole Le Douarin. Les chiffres que vous avez présentés sont fort intéressants. J’aimerais savoir si les statistiques sont similaires pour les souris. Divers travaux ayant montré que de nombreuses fécondations naturelles n’aboutissent pas à une grossesse et que le taux d’échec est plus élevé dans l’espèce humaine que chez d’autres mammifères, on peut se demander si la situation que vous avez rappelée est propre à la fécondation in vitro ou bien à l’espèce humaine en tant que telle.
M. Pierre Jouannet. Je ne peux pas apporter de réponse en ce qui concerne la souris, ni les autres espèces car je n’ai pas connaissance de travaux de fécondations in vitro pratiquées sur l’animal et rapportant des résultats à une si grande échelle.
On peut penser que les capacités de développement de l’espèce humaine sont moins bonnes que celles d’autres espèces. In vivo, seuls 50 % des embryons fécondés donnent un fœtus qui se développe. C’est beaucoup moins que chez les bovins, les ovins ou les souris, mais cela reste bien supérieur aux résultats obtenus dans les laboratoires de fécondation in vitro.
Les taux de naissance que nous enregistrons sont relativement bons : on compte environ 30 % de grossesses et 25 % de naissances par tentative, soit autant que dans le cadre de la fertilité naturelle ; cela étant, il ne faut pas oublier que nous devons prélever, à chaque tentative, une dizaine d’ovocytes pour arriver à ce résultat. Le rendement, si j’ose dire, est donc bien inférieur.
M. Jean-Sébastien Vialatte, rapporteur. Je donne maintenant la parole à Mme Anne Fagot-Largeault qui est professeur au Collège de France et membre de l’Académie des sciences.
Mme Anne Fagot-Largeault, professeur au Collège de France, membre de l’Académie des sciences. À la différence des précédents intervenants, je ne suis pas chercheuse en biologie ; mon domaine est la philosophie des sciences de la vie. Je vais m’efforcer de dresser un état des lieux des tâtonnements du jugement moral et des tâtonnements législatifs en ce qui concerne la recherche sur les cellules souches. Ce sera l’occasion de montrer qu’il n’existe pas aujourd’hui d’opinion consensuelle en la matière.
Je suis d’accord avec Pierre Jouannet sur le caractère périlleux des grands principes, trop péremptoires et adoptés trop vite. La veille et l’encadrement assurés par l’Agence de la biomédecine me paraissent, en revanche, très bénéfiques. C’est à mes yeux une grande réussite de la loi de 2004.
En dépit d’une réflexion éthique précoce et approfondie, et en dépit d’un consensus global sur les objectifs (thérapies régénératives), il reste de fortes divergences de jugement sur l’acceptabilité des diverses stratégies de recherche, et sur les manières d’encadrer la recherche.
La carte des recherches sur les cellules souches (World stem cell map ) distingue quatre catégories de pays en fonction de la position qu’ils adoptent en matière de recherche sur les cellules souches humaines. Selon les pays la politique de recherche qu’ils adoptent peut être permissive comme le Royaume-Uni, l’Australie, la Chine, l’Inde, Israël, Singapour, la Suède, et la Belgique. Elle peut être flexible tel est le cas du Brésil, du Canada, de la France, de l’Afrique du sud, de l’Espagne, des Pays-Bas, de Taiwan, des États-Unis depuis la présidence d’Obama. Une politique restrictive est menée en Autriche, en Irlande, en Norvège, en Pologne, en Italie. Dans certain pays il n’y a pas de politique et pas de recherche.
En Europe, la France est donc aujourd’hui classée, aux côtés des Pays-Bas et de l’Espagne, parmi les pays ayant adopté une politique de recherche flexible. Le Royaume-Uni, la Suède et la Belgique sont considérées comme plus permissives, l’Irlande, la Norvège, la Pologne et l’Italie comme plus restrictives. Le cas de l’Allemagne est particulier
Si nous sommes classés dans une catégorie intermédiaire, c’est que certaines recherches sur les cellules souches sont autorisées dans notre pays, mais pas toutes. Un plus grand nombre de types de recherche est autorisé dans les pays considérés comme plus permissifs, et un moins grand nombre d’entre elles dans les pays plus restrictifs.
La première caractéristique de la politique de recherche française est que le législateur a autorisé, depuis 2004, la recherche sur les embryons surnuméraires, initialement créés en vue de la procréation, puis donnés à la recherche par les couples. Le « clonage humain », c’est-à-dire la dérivation de lignées de cellules souches humaines à partir de cellules créées par transfert de noyau, est en revanche interdit, ce qui peut sembler paradoxal. Cette interdiction est assortie d’un jugement moral grave, la loi qualifiant le clonage à visée reproductive de « crime contre l’espèce humaine », le clonage à des fins de recherche constituant également un délit.
J’ai pu constater qu’un tel jugement moral n’existait pas dans d’autres pays. En Tunisie, par exemple, il paraît extrêmement choquant de proposer à un couple un don de sperme en cas de stérilité masculine : l’homme ne serait plus le père de son enfant et la lignée serait rompue. L’idée que l’homme puisse donner le noyau d’une de ses cellules pour créer un embryon avec un ovocyte de sa femme paraît, en revanche, très acceptable, car la continuité de la lignée est assurée. Ce qui est qualifié de « crime contre l’espèce humaine » d’un côté de la Méditerranée paraît de l’autre côté de la méditerranée, plus souhaitable, que les solutions offertes en France aux couples atteints de stérilité.
Cette divergence indique, me semble-t-il, qu’il faudrait gommer le jugement moral inhérent à l’interdiction actuelle. On peut interdire la technique du transfert de noyau, comme le fait le Royaume-Uni en matière de reproduction, mais il est ridicule de la qualifier de « crime contre l’espèce humaine » : ce ne serait vrai que si l’on en faisait la seule méthode de reproduction de l’espèce humaine.
Une seconde particularité de la loi de 2004 est d’autoriser, sous conditions, la recherche sur les cellules souches prélevées sur des embryons créés dans une finalité reproductive, tout en interdisant la recherche sur des cellules souches créées à des fins de recherche. Il n’est pas certain, intuitivement, qu’il soit préférable de ne pratiquer la recherche que sur des cellules embryonnaires initialement conçues à des visées reproductives. Au plan de la sensibilité morale, il serait plus acceptable de n’autoriser la recherche que sur des embryons ou des cellules souches embryonnaires créés pour la recherche en laboratoire.
Cet encadrement juridique est en outre obsolète, car on a montré que n’importe quelle cellule du corps peut être reprogrammée pour devenir une cellule souche, voire une cellule souche totipotente, capable de produire un organisme entier ou un embryon. Si l’on admet l’idée que toute cellule a un potentiel embryonnaire, la frontière actuelle perd sa pertinence. Mieux vaudrait la situer entre ce que l’on peut autoriser dans le cadre de la recherche, sans intention de donner naissance à un enfant, et ce que l’on peut pratiquer dans le cadre de la procréation médicalement assistée ou de la thérapie régénérative, lorsque l’on passe à des applications sur des êtres humains appelés à vivre.
M. Jean Sébastien Vialatte, rapporteur. Je vous remercie de cette présentation très précise, j’ouvre le débat.
M. Jean-Louis Touraine, député du Rhône, membre de l’OPECST. J’ai trouvé très intéressante votre réflexion sur le caractère paradoxal de la législation actuelle, qui consiste à interdire les travaux de recherche sur des embryons conçus à cette seule fin.
On observe d’ailleurs que la réglementation communautaire tend à interdire, à terme, la recherche sur des primates non humains s’ils sont nés dans la nature, cette possibilité étant réservée à des primates conçus dans ce but. Comment expliquer une telle différence entre les principes applicables aux primates non humains et aux embryons humains ? N’y a-t-il pas une contradiction ?
Je crois que vous avez raison d’affirmer qu’il n’existe pas d’argument, au plan intuitif, justifiant l’interdiction actuelle. Un élargissement des possibilités de recherche permettrait, en revanche, de mener des travaux très utiles dans de nombreux domaines, notamment en ce qui concerne le développement embryonnaire.
Mme Anne Fagot-Largeault. Votre remarque sur les primates me paraît très pertinente.
J’en profite pour indiquer que j’ai récemment visité, l’institut du cerveau et de la moelle épinière, où une grande animalerie abritant des primates doit être créée. Ma première réflexion a été de penser que cette animalerie allait être bien triste, mais on m’a détrompée, car elle comportera des arbres et un espace commun propice à une vie sociale. Il paraît même que si l’on ouvre les portes, les primates sur lesquels on mène des recherches ne s’en vont pas d’eux-mêmes.
M. Alain Claeys, rapporteur. Je remercie chaleureusement l’ensemble des participants à cette première table ronde. Nous en venons à une autre série d’interventions portant sur les avancées thérapeutiques et les essais cliniques et la délicate question de la brevetabilité de ces inventions.
TABLE RONDE : AVANCÉES THÉRAPEUTIQUES ET ESSAIS CLINIQUES : QUELS BREVETS ?
M. Alain Claeys, rapporteur. Je donne la parole à M. Philippe Menasché qui est professeur des universités, chirurgien cardiaque à l’hôpital Georges Pompidou et directeur d’unité de recherche à l’INSERM.
M. Philippe Menasché, professeur des universités, chirurgien cardiaque à l’hôpital Georges Pompidou, directeur d’unité de recherche à l’INSERM. On peut parler d’avancée thérapeutique lorsque le pronostic relatif à l’évolution d’une maladie contractée par une personne se trouve amélioré de façon significative par rapport aux thérapeutiques existantes. S’agissant des cellules souches adultes, les essais cliniques publiés à ce jour montrent qu’il n’y en a eu aucune, quelle que soit la pathologie considérée.
J’évoquerai d’abord les essais de phase I. Il ne se passe pas de semaine sans que la presse non scientifique rapporte et publie un essai portant sur une pathologie ou une autre, le cœur, le foie, l’œil, l’oreille, etc. Ces essais ont plusieurs caractéristiques communes : ils concernent très peu de patients, cinq, dix, voire quinze; ils impliquent une petite société de biotechnologie cherchant à valoriser ses résultats ; dans la quasi-totalité des cas, ils portent sur des cellules souches hématopoïétiques, notamment mésenchymateuses, dont la caractérisation phénotypique a été pendant longtemps et reste encore floue et discutée. Cela permet à chacun de déclarer qu’il a trouvé la bonne cellule mésenchymateuse avec un procédé de préparation particulier et breveté, qu’il a identifié la bonne cellule avec tel ou tel marqueur spécifique. On se demande alors si l’auteur de l’essai n’a pas tout simplement capturé la même cellule en utilisant des marqueurs différents, ou à des stades de différenciation différents. En raison même du schéma de ces essais, (faible nombre des malades, absence de groupe de contrôle et d’évaluation en aveugle), on ne peut pas tirer de conclusions permettant de dire qu’on a effectivement amélioré le pronostic relatif à l’évolution d’une maladie contractée par une personne.
Néanmoins des tentatives de méta-analyses regroupant ces différents essais, notamment dans le domaine du cœur, ont eu lieu. Ainsi, en fonction de critères bien définis, il est possible de mettre en évidence une amélioration statistiquement significative par rapport à des groupes dits de contrôle. Toutefois, ces différences, qui sont significatives au plan statistique, ne le sont en aucun cas en termes de pertinence clinique. Quand on a commencé à procéder à des greffes de cellules souches musculaires dans le cœur sur un groupe d’une dizaine de patients, certains signaux encourageants nous ont laissé à penser, en nous fondant sur des critères habituels, que ces greffes avaient pu améliorer l’état fonctionnel des patients. Mais quand on est passé à la phase II, à l’étude randomisée, en double aveugle, on a dû en conclure que les greffes n’apportaient aucun bénéfice de ces greffes par rapport aux placebos. La médecine fourmille de ce genre d’exemple.
S’agissant des essais de phase I sur les cellules souches adultes, même si on ne peut pas les considérer aujourd’hui comme des avancées thérapeutiques, ces travaux restent positifs en raison des enseignements qu’ils permettent de tirer.
Les essais de phase II/III actuellement enregistrés sur le site américain clinicaltrials.gov ont été actualisés. De ces essais, on peut vraisemblablement attendre des résultats qui, quels qu’ils soient, seront intéressants et interprétables dans la mesure où ils portent sur un nombre plus élevé de patients, avec de vrais groupes contrôles placebos et des évaluations menées conformément aux règles méthodologiques devant présider aux essais thérapeutiques. Les pathologies concernées sont très diverses : 174 essais concernant le cœur, 74 le foie, 26 l’œil, 11 les pathologies ostéo-articulaires, et 7 l’artériopathie des membres inférieurs.
Cependant dans la majorité des cas, les cellules utilisées sont des cellules souches médullaires et très souvent des cellules souches mésenchymateuses.
S’agissant des cellules souches pluripotentes, il n’y a pas eu à ce jour d’essais cliniques utilisant des cellules souches embryonnaires humaines (ES). Deux essais cliniques sont annoncés. Le premier, dont il est question depuis longtemps, utilise des cellules embryonnaires humaines pré-différenciées en oligodendrocytes pour réparer des lésions traumatiques de la moelle. Mis en oeuvre par une société américaine, qui avait obtenu l’accord de la Food and Drug Administration (FDA), il a été suspendu à la demande de la société elle-même, qui souhaite mener un certain nombre d’essais précliniques complémentaires. Cet essai devrait reprendre au cours de l’été 2010 ou, en tout cas, avant la fin de l’année 2010.
Le second essai concerne la dégénérescence maculaire de l’adulte. Il utilisera des cellules souches embryonnaires humaines pré-orientées pour devenir des progéniteurs rétiniens.
On peut y ajouter un troisième essai qui vise l’insuffisance cardiaque et que nous sommes en train de préparer sur la base des résultats obtenus avec des cellules souches adultes.
Quant aux cellules souches pluripotentes induites iPS, la communauté scientifique a une position un peu ambiguë. C’est infiniment plus compliqué qu’on ne le pensait au départ. L’efficience du procédé reste très limitée. Il faut des millions et des millions de cellules adultes pour arriver à en reprogrammer une correctement. Laure Coulombel évoquait l’éventualité de s’arrêter avant la reprogrammation complète. Shinja Yamanak a insisté beaucoup sur le risque de reprogrammation aberrante et sur la nécessité qu’il y aurait à génotyper tous les clones obtenus, pour être sûr que les cellules que l’on va redifférencier à partir des celles qu’on a dédifférenciées ne donneront pas naissance à des proliférations incontrôlées. Ainsi, le problème du degré de la reprogrammation qui est réel n’est pas réglé.
En laboratoire, on a pu s’affranchir des rétrovirus, du proto-oncogène, etc. Mais, pour des raisons réglementaires évidentes, on ne peut pas envisager, dès lors que l’on passera en essai clinique, d’utiliser les méthodes employées à ce jour pour reprogrammer ces cellules. Tout espoir n’est malgré tout pas perdu : je pense notamment au criblage des molécules sur des lignées humaines et à la modélisation des pathologies. Quoi qu’il en soit, il existe tout de même un certain consensus pour penser que l’utilisation des iPS dans le cadre d’essais cliniques est une perspective lointaine et sans doute plus lointaine encore que pour les cellules souches embryonnaires. Les problèmes pratiques posés par l’utilisation clinique des iPS sont absolument identiques à ceux des cellules embryonnaires. En effet, une fois que l’on a reprogrammé la cellule, il faut encore régler trois problèmes majeurs : l’amplification dans des conditions Good Manufacturing Practice (GMP); la spécification pour aller vers tel ou tel type cellulaire ; le tri pour obtenir une population de cellules purifiées. À ces difficultés s’ajoute la problématique de la reprogrammation.
Je conclurai en insistant sur trois facteurs, qui n’ont pas une pertinence médicale ou scientifique, mais qui pèsent fortement sur les essais cliniques actuels ou à venir.
Le premier est celui des contraintes réglementaires. Notre pays a été marqué par des drames sanitaires qui ont conduit à une interprétation de plus en plus hypertrophique du principe de précaution. Si l’on continue de la sorte, il sera de plus en plus difficile d’implémenter en France des essais innovants de thérapie cellulaire. Certains de nos voisins européens ont, de ce point de vue là, des réglementations moins rigoureuses que les nôtres. Il existe des Agences européennes de régulation, mais chacun reste libre d’agir à sa guise. Au moment où tout se mondialise, on constate déjà un déplacement d’essais cliniques de thérapie cellulaire hors de France. Il faut être vigilant et conscient de ce problème.
L’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) fait très bien son travail, mais la superposition progressive des contraintes réglementaires rend ces essais difficiles. Il faut admettre que lorsque l’on travaille à des thérapies innovantes, le risque zéro n’existe pas, le risque est à apprécier à l’aune du bénéfice potentiel et de l’évolution naturelle de la maladie que l’on cherche à traiter. Cependant l’idée selon laquelle il n’y a pas de risque et, surtout, qu’il ne doit pas en exister, est absurde. Le risque existe, et il faudra, à un moment donné, l’assumer.
L’implication de la grande industrie pharmaceutique, phénomène nouveau, transformera quelque peu le paysage. Il se peut que l’ère des blockbusters soit révolue. Jusqu’à présent, le domaine des cellules souches était celui des biotechnologies. Aujourd’hui, les grandes sociétés pharmaceutiques s’y intéressent de plus en plus, non pas uniquement pour cribler les médicaments, mais aussi dans une perspective de thérapie régénérative. Sanofi Aventis et Roche ont récemment créé des divisions de médecine régénérative dont l’objectif est clairement de mener ces thérapies jusqu’à l’utilisation clinique.
Je souhaiterais insister, comme Laure Coulombel, sur l’aspect un peu « magique » de ces médecines dites personnalisées. Pour des pathologies qui touchent des milliers de malades, s’imaginer que l’on va pouvoir faire une médecine à façon n’est pas très réaliste. L’industrie pharmaceutique ne s’y trompe pas, qui, d’emblée, cible des modèles allogéniques, avec des produits quasiment prêts à l’emploi. Elle a en tête des essais cliniques, ce qui suppose, à un moment donné, une demande d’autorisation de mise sur le marché et un remboursement. Par conséquent, il faut que les coûts soient raisonnables. Or le coût de la médecine autologue est considérable ; nous l’avons vécu avec les cellules musculaires. On ne peut l’envisager pour traiter des centaines de malades.
Il faut enfin souligner les difficultés de la protection intellectuelle en ce domaine. Pour autant, elles ne dissuaderont pas l’industrie pharmaceutique de se lancer dans ces recherches. De nombreux brevets ont été déposés sur les cellules souches, et on en dépose tous les jours. C’est particulièrement le cas des iPS, dont le champ a été pratiquement investi par le Japon.
Il ressort d’une cartographie des brevets établie en fonction du type cellulaire intéressé que la majorité des brevets couvre les cellules souches hématopoïétiques. Les brevets sur les cellules souches embryonnaires sont assez peu fréquents et concernent exclusivement les procédés de préparation, d’amplification, de spécification ou de tri, et non les cellules elles-mêmes. On peut les classer de cette manière : cultures 3 D / matrices (92), administration (73), différenciation (190), expansion (424) mobilisation (30), type (194), utilisation (275) extraction/préservation (156).
Si l’on ne tient pas compte de tous les brevets japonais sur les iPS, sur les mille et quelque brevets mondiaux pertinents qui ont été déposés, vingt sont considérés comme les plus pertinents pour l’étude des cellules souches adultes ou embryonnaires. Sur ces vingt brevets, on compte seize brevets américains, trois brevets canadiens et un brevet israélien. Il n’y a malheureusement pas de brevet français. Si le manque de visibilité de la position française, telle qu’elle s’exprime au travers de la loi actuelle, perdurait, notre compétitivité internationale pourrait en pâtir du fait de la formulation ambiguë de la loi. Et nous risquerions de continuer à ne pas figurer dans le peloton de tête en matière de protection intellectuelle et de valorisation des travaux, malgré tout bien réels, des équipes de recherche.
M. Jean-Sébastien Vialatte, rapporteur. Pourquoi l’équipe américaine a-t-elle suspendue son essai clinique ? Une reprise est annoncée, aura-t-elle lieu ou bien s’agit-il d’un effet d’annonce ?
M. Philippe Menasché. S’agit-il d’un effet d’annonce ? Je ne le sais pas, mais ce ne serait pas impossible de la part de cette société, qui, dans le passé, nous y a habitués. Pourquoi les membres de cette équipe américaine ont-ils suspendu leur essai ? Depuis le début, l’on s’étonne du choix de la lignée effectué par cette équipe car il s’agit d’une lignée très ancienne, la lignée H1, connue pour ne pas être stable sur le plan génétique. Je n’ai pas l’explication du choix de cette lignée, mais il est très curieux.
Par ailleurs, ils ont toujours, pour des raisons de propriété intellectuelle, été formidablement discrets sur les procédures qu’ils utilisent, non pas tant pour transformer les cellules indifférenciées en oligodendrocytes que pour, ensuite, les trier. On sait néanmoins que leur procédé de purification n’est peut-être pas optimal.
Quoi qu’il en soit, c’est la constatation, chez l’animal, de kystes, et non de tératomes qui les aurait conduits à solliciter eux-mêmes la possibilité de reprendre toute une série d’études précliniques avant de revenir vers leur essai humain. On peut être inquiet à propos de cet essai parce qu’on n’a pas la certitude que toutes les garanties précliniques aient été prises. Leur étude est notamment menée sur le rat et la souris et non sur un gros animal ce qui serait impossible en France.
M. Jean-Sébastien Vialatte, rapporteur. Au cours des auditions précédentes, nous avons eu l’impression que l’industrie pharmaceutique était très en retrait par rapport à ces voies de recherche, en dehors du criblage, qui rentre dans leur modèle économique actuel Il nous a semblé que l’industrie pharmaceutique avait même mis le pied sur le frein, en rachetant certains brevets qu’elle mettait sous cloche pour éviter que des développements ne se produisent trop rapidement.
M. Philippe Menasché. C’est tout à fait exact, mais apparemment, la situation est en train de changer. Chez Sanofi Aventis et Roche, il existe maintenant des divisions clairement labellisées « médecine régénérative ». Ces sociétés s’intéressent aux iPS, mais aussi aux cellules mésenchymateuses, en raison de leurs éventuelles propriétés immuno modulatrices. On pourrait les utiliser sans ou au moins au prix d’un traitement immunosuppresseur assez léger. On peut d’ailleurs espérer de ce changement de position une certaine dynamisation de la recherche et des moyens mis à disposition.
M. Jacques Remacle. Il se dit qu’en Inde et en Chine, les essais cliniques se développent dans une anarchie légale. Un tourisme thérapeutique se mettrait même en place, certaines compagnies privées vantant le bénéfice de ce genre de thérapies. Cela me semble très dangereux. Vos statistiques tiennent-elles compte de tous les essais ? Les scientifiques ont-ils l’intention de mettre en place des outils légaux pour éviter de telles dérives ?
M. Philippe Menasché. Je me suis basé sur le nombre d’essais déclarés et enregistrés auprès du National Institute of Health (NIH). Quand vous effectuez un essai clinique, n’importe où mais notamment en Inde ou en Chine, vous n’êtes absolument pas tenu de le déclarer au NIH. Il est donc évident qu’un certain nombre d’essais menés dans ces pays ne figurent pas sur ces listes.
Le tourisme cellulaire existe. Il a été favorisé par le caractère très contraignant de la réglementation. Les personnes qui sont dans une situation désespérée parce qu’on leur a dit qu’on ne pouvait plus rien pour eux pianotent sur Internet et se laissent piéger par des sociétés qui sont très bien organisées : on leur fait payer le billet d’avion, les trois nuits à l’hôtel, l’injection des cellules on ne sait pas ce qu’elles contiennent, et leur retour.
Ces dérives sont difficiles à contrôler. Évitons de les encourager par une réglementation, qui est tellement contraignante chez nous que des gens prêts à n’importe quoi vont se faire traiter ailleurs.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie de ces précisions et donne maintenant la parole à M. Anselme Perrier, chargé de recherche équipe maladies neurodégénératives.
M. Anselme Perrier, chargé de recherche, équipe maladies neurodégénératives (INSERM/UEVE, I-STEM, AFM). Mon propos portera sur une dérogation à l’interdiction d’utiliser des cellules souches embryonnaires humaines pour la recherche.
Je dirige une équipe INSERM qui s’intéresse à la maladie de Huntington et à son traitement, notamment par des approches de thérapie cellulaire. Il s’agit d’une maladie neurodégénérative particulièrement dévastatrice. C’est une maladie génétique (autosomique dominante) causée par la mutation d’un seul gène (HTT) qui touche environ 6 000 Français, généralement âgés de plus de 35. C’est une maladie qui entraîne inévitablement la mort entre dix et vingt ans après le déclenchement des premiers symptômes moteurs, psychiatriques et cognitifs, lesquels sont très sévères. Elle provoque la destruction progressive de certains neurones au centre du cerveau, atrophie du striatum, et des atteintes secondaires d’autres régions du cerveau (cortex, globus pallidus…). Actuellement, aucun traitement n’est disponible.
À la fin des années quatre-vingt-dix, Marc Peschanski a choisi de traiter cette maladie par la thérapie cellulaire. Le principe est d’apporter des cellules qui vont se substituer à celles qui sont soit malades, soit déjà perdues. La source utilisée est constituée de cellules souches fœtales, donc des tissus de fœtus obtenus par interruption volontaire de grossesse, lesquels sont disséqués par des chirurgiens et réimplantés dans le cerveau des patients. Des essais cliniques pilotes, réalisés entre 1996 et 2000, ont démontré une amélioration durable des symptômes moteurs et cognitifs. D’autres essais sont en cours.
M. Alain Claeys, rapporteur. La cohorte était-elle suffisante pour ces essais?
M. Anselme Perrier. Non car il s’agissait d’essais de phases I/II portant sur un très petit nombre de patients, cinq ou six. L’essai complémentaire européen, multicentrique, qui porte sur une centaine de patients, fournira de vrais résultats. Pour autant, et avant même de commencer, on savait que l’origine et la biologie de ces cellules souches ne permettraient pas une utilisation à large échelle. Les problèmes d’approvisionnement, de dissection, de standardisation, ainsi que l’impossibilité d’amplifier ces cellules in vitro font qu’on ne peut pas gérer la production « en masse » de lots cliniques qui pourraient être fournis aux chirurgiens pour soigner plusieurs dizaines ou centaines de patients.
Très vite, on a cherché une alternative à ces cellules souches fœtales. On a d’abord pensé aux cellules souches pluripotentes humaines, en raison de leurs propriétés décrites par Laure Coulombel à savoir capacité d’auto renouvellement et pluripotence. Puis, en 2004, quand a été révisée la loi de bioéthique, on a commencé à s’intéresser aux cellules souches embryonnaires humaines, qui étaient alors les seules cellules souches pluripotentes humaines disponibles.
De mon point de vue de non juriste, cette loi introduit une présomption de culpabilité. Mais, heureusement, elle autorise, dans certains cas particuliers, des dérogations. Certes, ces dérogations ne nous ont pas permis de participer à l’extraordinaire explosion du savoir sur les cellules souches humaines, en particulier la stemness, la « souchitude » comme on pourrait le formuler. Toutefois, elles ont rendu possible l’exploration du potentiel thérapeutique de ces cellules souches, à l’occasion de programmes de recherche à visée très thérapeutique.
M. Alain Claeys, rapporteur. Avez-vous obtenu l’accord de l’Agence de la biomédecine ?
M. Anselme Perrier. Oui, ce travail est l’une des toutes premières dérogations qui aient été obtenues. Il rentrait très clairement dans le cadre de la dérogation prévue par la loi : « permettre des progrès thérapeutiques majeurs, et à la condition de ne pouvoir être poursuivies par une méthode alternative d’efficacité comparable en l’état des connaissances scientifiques ». L’idée est de remplacer l’origine fœtale par des cellules souches embryonnaires humaines (ESh) et, comme on ne peut pas les utiliser immédiatement, de produire des cellules différenciées, a priori striatales, similaires à celles qui avaient été transférées précédemment, pour obtenir le même genre de résultat.
Quels sont les défis auxquels ce type de traitement est confronté dans le cas de la maladie de Huntington ? Ils ont été résumés en plusieurs grandes catégories pour l’étude préclinique.
Le premier défi est la différenciation dirigée des cellules ESh in vitro; il faut savoir produire le greffon intéressant. Les cellules ESh ne sont pas utilisables telles quelles, il faut obtenir des intermédiaires différenciés. Il convient non seulement de savoir produire ce greffon pour en explorer le potentiel au laboratoire, mais aussi imaginer de pouvoir le produire dans des conditions compatibles avec une utilisation clinique, ce qui implique des contraintes bien différentes. Ensuite, il est nécessaire d’explorer le potentiel réel de ce type de culture : d’abord, la biologie cellulaire par le biais de modèles animaux, puis la fonctionnalité en termes d’efficacité thérapeutique. Enfin, il faut se préoccuper très sérieusement des problèmes de sécurité qui sont liés à l’utilisation de cellules souches pluripotentes.
Nous avons travaillé avec quelques cellules ESh; nous avons développé différents protocoles qui permettent de les différencier, soit en des cellules ressemblant à celles qui sont présentes dans le cerveau lorsqu’il est en cours de développement, soit en des cellules pouvant se transformer en cellules identiques à celles qui meurent dans le cas de la maladie de Huntington. Nous avons aussi travaillé sur le deuxième défi, qui consiste à identifier quels pourraient être les risques associés à la thérapie cellulaire, à partir de cellules souches pluripotentes humaines ou des cellules ESh. Nous avons travaillé chez le rat, avec différents types d’injections.
On savait déjà que les cellules souches ES, par définition, pouvaient créer des tératomes. La présence de cellules souches ES dans le greffon pourrait donc poser de graves problèmes. Nous avons découvert plus récemment que des intermédiaires de différenciation, qui n’étaient pas encore parvenus à un stade intéressant pour la greffe mais étaient susceptibles de contaminer une éventuelle greffe, pouvaient aussi produire des tumeurs bénignes ou des tumeurs neurales. Ces tumeurs peuvent grossir considérablement et poser des problèmes pour une éventuelle utilisation clinique ; nous sommes en train de travailler sur les moyens de résoudre ce problème.
Le troisième défi à relever consiste à observer quels types de propriétés biologiques les greffons issus des cellules ESh peuvent posséder, dans un contexte de traitement en thérapie cellulaire de la maladie de Huntington. Pour cela, on utilise des modèles animaux, que ce soit des rats ou des singes, pour mimer une approche thérapeutique de thérapie cellulaire. Chez le rat, il s’agit de xénogreffes ; on est donc assez limité. On utilise des dérivés de cellules ESh et l’on regarde les propriétés biologiques de ces cellules après greffe, puisqu’elles doivent encore proliférer et se différencier. Nous avons commencé plus récemment à travailler dans un cadre davantage préclinique, avec des modèles plus sophistiqués chez le primate ; cela implique également des cellules ES de primates, avec une imagerie qui ressemble à celle qui avait été utilisée pour commencer à mesurer l’efficacité thérapeutique de ce genre de cellules.
Vous avez là un exemple de dérogation. En cinq ans, sur un tel projet, deux ou trois lignées ESh ont été utilisées. Il faut relativiser la destruction de deux ou trois embryons, comparée à cinq ans de travail, ce qui correspond à peu près à un demi million ou un million d’embryons non utilisés ou détruits dans le cadre de fécondations in vitro.
M. Jean-Sébastien Vialatte, rapporteur. Si je vous ai bien suivi, la législation actuelle ne vous a pas empêchés d’avancer dans votre recherche, si ce n’est le sentiment de culpabilité. Comment faites-vous pour purifier ces cellules et éliminer les cellules souches embryonnaires, ES qui risquent de donner des tératomes ? Comment l’équipe anglaise qui travaille sur l’œil et sur la dégénérescence maculaire peut-elle passer à un essai clinique et avoir la certitude de ne pas utiliser ces cellules ES ?
M. Anselme Perrier. Il n’y a pas forcément d’étape de purification. Il s’agit alors essentiellement de maîtriser le mieux possible l’étape de différenciation, de spécification des cellules ES vers le type cellulaire, qu’il s’agisse de cellules de l’œil ou de cellules nerveuses. Cela implique des recherches beaucoup plus fondamentales sur la compréhension de cette différenciation et sur la maîtrise de la mesure des contaminants On peut se trouver dans des cas où la cellule n’est pas bien différenciée. C’est une première approche.
Pour notre part, nous développons d’autres approches, dans le cadre desquelles on peut imaginer des mesures visant à protéger les greffons. Il s’agirait alors d’intervenir a posteriori chez le patient lorsque l’on détecte un problème de surcroissance cellulaire, sachant que les tumeurs qu’on observe ne sont pas malignes, mais bénignes. Il convient, là encore, de relativiser le risque par rapport aux bénéfices attendus.
M. Alain Claeys, rapporteur. J’ouvre le débat.
Mme Nicole Le Douarin. Si j’ai bien compris, on n’a pas procédé à des greffes de cellules ESh dans le cerveau de malades ?
M. Anselme Perrier. En effet, mais des essais cliniques ont été réalisés avec des cellules souches fœtales, il y a maintenant dix ans, dans le groupe de M. Marc Peschanski, à Créteil.
Mme Nicole Le Douarin. Est-ce le seul groupe à en avoir fait ?
M. Anselme Perrier. Non, d’autres groupes en Europe en ont fait. Maintenant, l’essai est multicentrique et certains centres européens sont impliqués.
Mme Nicole Le Douarin. Quel était l’âge des cellules ?
M. Anselme Perrier. Il s’agit de cellules abusivement appelées fœtales, dans la mesure où elles sont encore à un stade embryonnaire : entre 9 et 10 semaines de gestation.
Mme Nicole Le Douarin. Ce ne sont pas des cellules souches. Vous ne les triez pas pour être sûrs d’avoir des cellules souches.
M. Anselme Perrier. Non, ce sont des morceaux de cerveau en développement.
Mme Nicole Le Douarin. Pour traiter la maladie de Parkinson, A. Bjorklund s’est lancé dans des opérations équivalentes. Mais les résultats ne sont pas très positifs : les cellules que l’on greffe ne survivent pas convenablement dans le cerveau ; elles n’établissent pas de connexions. L’injection de cellules productrices de dopamine permet un petit bénéfice, tant qu’elles survivent. Toutefois, elles ne survivent pas longtemps. Finalement, ce n’est pas une façon de traiter la maladie.
M. Anselme Perrier. Le cas de la maladie de Parkinson est un peu différent de celui de la maladie d’Huntington. Dans le cas de la maladie d’Huntington, les cellules survivent plutôt bien, prolifèrent, et une démonstration de la reconnexion des cellules et de la fonctionnalité par imagerie est possible. C’est un début de preuve.
Mme Nicole Le Douarin. Les injections sont-elles faites de façon précise ?
M. Anselme Perrier. Oui, dans les zones lésées.
M. Charles Durand, maître de conférences des universités, directeur de la formation doctorale en biologie des cellules souches à l’université Pierre et Marie Curie (ParisVI). Quel est le pourcentage de différenciation de neurones spécifiques du striatum à partir des cellules ESh?
M. Anselme Perrier. Je précise qu’on ne greffe pas des neurones, mais des précurseurs de neurones ; les neurones ne survivent pas bien à la greffe. Ainsi, la différenciation terminale en neurones est une manière in vitro de prouver la qualité de ce que l’on greffe. Dans ce cas de figure là, à peu près la moitié des cellules deviennent des neurones et un tiers des neurones sont d’un type adéquat. Évidemment, cela exige un gros travail avant d’obtenir un moyen de trier ce qui est intéressant, ou un moyen d’obtenir des populations bien plus pures. On maîtrise d’autres méthodes pour obtenir 100 % de neurones, mais ce ne sont pas forcément les neurones intéressants.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie de vos interventions et précisions et donne la parole à Mme Michèle Martin, directrice de recherche dans le laboratoire de génomique et radiobiologie de la kératinopoïèse du CEA.
Mme Michèle Martin, directrice de recherche, laboratoire de génomique et radiobiologie de la kératinopoïèse, CEA. La peau humaine constitue un véritable réservoir de cellules souches, puisque pas moins de cinq types de cellules souches possèdent le potentiel pour générer plus de 25 lignages. Parmi ces cellules souches, les mélanocytes permettent à notre peau et à nos cheveux d’être colorés. On les trouve principalement dans le follicule pileux. On les a d’abord découverts chez la souris, avant de les rechercher dans la peau humaine. Ces cellules souches font partie des quelques usages thérapeutiques des cellules souches de la peau. En effet, des maladies provoquent des dépigmentations de la peau, comme le vitiligo et la leucoderma. On peut soigner ces maladies par transplantation de follicules pileux. Il n’y a pas de purification des cellules souches, mais les cellules souches qui se trouvent à l’intérieur du follicule transplanté permettent une repigmentation par cellules souches des mélanocytes.
Un deuxième type de cellules souches est caractérisé par le fait qu’elles expriment toutes un marqueur assez précis qui est la nestine. On les trouve souvent dans la littérature sous le nom de SKP. Ce réservoir est très intéressant, dans la mesure où il serait multipotent. Un peu comme s’il nous restait, dans notre peau adulte, des cellules embryonnaires à l’état physiologique, ce qui est fascinant. Ces cellules sont souvent montrées in vitro, mais elles auraient un potentiel de différenciation en neurones, en adipocytes, en vaisseaux. On a isolé ces cellules chez une souris verte, génétiquement modifiée (la protéine GFP ayant servi de marqueur), cela a permis de visualiser une formation de vaisseaux, à partir de ces cellules pour les injecter dans une souris normale. Il existe donc un potentiel de différenciation in vivo chez l’animal.
Tout en bas du follicule pileux, dans une petite structure appelée la papille dermique, existe un autre type de cellules, très proche des cellules mésenchymateuses. Ces cellules semblent en effet, de par leur fonction, très proches de celles qu’on a pu trouver dans la moelle osseuse. Il a été possible de montrer, chez la souris, qu’elles soutiennent une régénération hématopoïétique. Cela a été fait pour des cellules isolées de souris, mais aussi pour des cellules isolées de peau humaine.
Le follicule pileux constitue un réservoir fabuleux. Ses potentiels sont multiples, mais ce ne sont que des potentiels. En fait, presque rien n’est utilisé aujourd’hui en clinique, en dehors des cellules souches de mélanocytes.
Il existe plusieurs localisations pour les cellules souches de type épithélial, à commencer par le follicule pileux. Une petite structure appelée le bulge, est enrichie de cellules souches chez la souris. Ces cellules sont pluripotentes ; elles sont capables de fabriquer, par exemple, de l’épiderme, du poil, de la glande sébacée chez la souris.
Dans la peau humaine, il n’existe pas de structure anatomique bien définie comme dans la peau de souris. Il y a néanmoins une zone où l’on retrouve de telles cellules, dont le potentiel est très intéressant. Cependant, à l’heure actuelle, il n’y a pas d’application spécifique pour ces cellules souches. Deux nouveaux réservoirs ont été identifiés : la glande sébacée et la glande sudoripare auraient chacune leur type de réservoir de cellules souches adultes, avec des potentiels.
Dans l’épiderme, le réservoir majeur reste toujours la couche la plus superficielle de notre peau. Cet épiderme est constitué de kératinocytes, qui constituent un type de cellules. Le modèle le plus accepté est le suivant. Dans la couche la plus profonde de notre épiderme, on trouve la couche basale constituée d’une population très rare, de l’ordre de 0,2 % de cellules souches, qui se reproduisent par division asymétrique, et une population majoritaire constituée par les progéniteurs ou cellules d’amplification transitoire, responsables du renouvellement, sur trente jours, de l’épiderme humain.
Il est encore difficile de travailler sur les cellules souches des kératinocytes de l’épiderme humain, parce qu’il n’y a pas de marqueur unique. Si on examine une coupe de peau humaine, on ne peut pas dire : voilà où se trouve une telle cellule souche. Ce cellules sont donc difficiles à isoler et mal connues. Pourtant, elles font partie des deux types de cellules souches adultes qui sont vraiment utilisées en clinique, et ce depuis 25 ans maintenant, pour soigner les grands brûlés, les grands irradiés et d’autres pathologies.
Le principe est celui de la culture autologue : les tissus du brûlé lui-même sont mis en culture. On prépare à partir de cela un greffon, qui est greffé sur le patient. Le greffon ne prend que s’il contient des cellules souches. Or l’un des problèmes majeurs est qu’il n’y a pas de qualification de la qualité des greffons ; on ne sait pas si ceux-ci contiennent des cellules souches et en quelle proportion. C’est la prise du greffon, un mois environ après la greffe, qui sera le test de la qualité du greffon.
Les kératinocytes de l’épiderme sont maintenant utilisés pour d’autres applications thérapeutiques comme le traitement des ulcères veineux chroniques, un essai international randomisé en a montré l’intérêt. Elles sont aussi utilisées pour des pathologies auxquelles on pense le moins, comme des plaies du pied, fréquentes chez les diabétiques, qui sont très difficiles à soigner.
On peut mélanger une thérapie cellulaire et une thérapie génique en utilisant une population enrichie en cellules souches. Un très bel essai a été mené par un groupe italien. Il s’agissait de traiter une épidermolyse bulleuse, liée à une mutation, et pour laquelle on ne dispose pas de traitement. Le groupe italien a prouvé qu’en faisant une culture autologue avec les kératinocytes du patient ce qui est une thérapie cellulaire, et en corrigeant ces cellules par un gène médicament ce qui relève de la thérapie génique, la greffe permettait localement de traiter complètement la maladie et permettait au patient, dans cette zone-là, de ne plus présenter la maladie.
Les cellules souches épithéliales offrent donc de vraies applications cliniques pour les grands brûlés, les grands irradiés, les plaies chroniques, l’épidermolyse bulleuse, l’alopécie. Ce sont des cellules facilement accessibles, sachant qu’un prélèvement de peau n’est pas très traumatique. Elles ont un très fort potentiel de régénération. Ce sont des cellules normales, sans risque de transformation utilisées en autologue, ce qui exclut les rejets.
Ces cellules ont un très fort potentiel régénératif. C’était déjà connu, mais nous avons souhaité, dans mon groupe, aller plus loin. Pour ce faire, nous avons développé un brevet sur un procédé de clonage des cellules souches. Je précise tout de suite que ce clonage n’a rien à voir avec les clonages thérapeutiques, cela signifie simplement que l’on travaille sur la cellule unique. On part d’une biopsie cutanée normale, on isole tous les kératinocytes, que l’on trie un par un, grâce à un trieur de cellules. À partir d’une cellule souche unique, on pourra caractériser tout le potentiel de cette cellule et sa descendance.
Dans le cadre de cette expérience, nous avons isolé tous les kératinocytes de la couche basale d’un patient. Nous les avons mis en culture, regardé pendant combien de temps ils étaient capables de pousser, puis comptabiliser le nombre de cellules qu’ils étaient capables de produire. Nous nous sommes aperçus que tous les clones cellulaires que nous avions étudiés pouvaient produire l’amplification nécessaire à une utilisation clinique, qu’un nombre important d’entre eux étaient capables de régénérer l’épiderme d’un humain adulte entier et que la majorité d’entre eux seraient capables, théoriquement, de faire l’épiderme de l’ensemble des humains de la planète. On se rend ainsi compte du potentiel de ces cellules que, jusque là, nous classions uniquement en progéniteurs. Et pour ce qui est des rares cellules que, d’après nos critères, nous appelons souches, les potentiels d’expansion sont invraisemblables.
Cela ne risque-t-il pas de s’accompagner d’anomalies ? Nous avons caractérisé la stabilité génomique de ces cellules. Nous avons pu montrer, en particulier pour celles que nous classons comme ayant un potentiel souche, que jusqu’à cent doublements de population, donc très au-delà de la nécessité clinique, il n’y avait pas d’anomalies quand on travaillait dans des conditions extrêmement contrôlées.
Nous sommes en autologue. Cela évite les immunosuppressions à vie, les effets secondaires chez le patient et un coût pour la société. Il y a donc de nombreux points forts pour l’utilisation de ces cellules souches adultes : pas de problème éthique, pas de risques génétiques. À mon avis, elles restent idéales pour les tissus accessibles.
Des limitations existent néanmoins. Il s’agit :
- de la qualité des greffons, problème auquel nous nous attaquons avec Jean-Jacques Lataillade, à l’hôpital Percy, en développant des tests prédictifs;
- de l’absence de reconstitution des annexes épidermiques, aujourd’hui, par exemple, on ne reconstitue pas les glandes;
- de l’imperfection de la cicatrisation parce que le greffon n’a pas de substrat dermique;
- de la loi relative à la bioéthique, de 2004 qui pour notre recherche concrète de tous les jours, en laboratoire, a été une catastrophe dans l’année qui a suivi. En effet, nous travaillons sur des déchets opératoires. Cela signifie que ce qui est prélevé est, de fait, jeté. Or la loi de bioéthique a exigé le consentement des patients quand on travaille sur des déchets opératoires. Cela n’a rien de choquant en soit mais, pendant six mois, nous n’avons pas pu procéder à une seule biopsie de peau humaine normale. D’abord, cela exige la présence de quelqu’un à la clinique ou à l’hôpital pour faire signer le consentement ; or les cliniciens sont déjà soumis à une pression très forte et il n’y a personne pour remplir ce rôle.
Il est très difficile de trouver un clinicien suffisamment motivé pour faire de la recherche, qui prenne le temps pour faire signer les consentements ou qui le fasse prendre par quelqu’un de son équipe pour les faire signer. Ensuite, même avec un clinicien motivé, on se heurte souvent à l’incompréhension des patients qui ne veulent pas signer, bien que nous ayons fait établir des documents les plus simples possibles. De ce fait, l’accès aux prélèvements est devenu difficile, alors qu’il s’agit de déchets jetés. Il me semblait très important de souligner ici ces problèmes indirects auxquels, je suis sûre, le législateur n’avait pas du tout pensé.
S’agissant des cellules souches adultes, les besoins en recherche fondamentale, en biologie ou en ingénierie tissulaire sont considérables. Il ne s’agit pas du tout d’opposer un type de recherche à un autre, mais de maintenir suffisamment de financements en ce domaine.
M. Jean-Sébastien Vialatte, rapporteur. Nous avons lu dans la presse grand public les résultats d’une recherche sur les cellules souches embryonnaires, qui aurait abouti à la formation de peau.
Mme Michèle Martin. Effectivement, cela fait un certain temps que des équipes essaient de faire des kératinocytes à partir d’ES. Certaines ont montré qu’en travaillant sur des milieux de culture, on arrivait à obtenir une différenciation vers le kératinocyte. Le groupe de Marc Peschanski a prouvé qu’il était possible d’aboutir à une peau reconstruite, dont la qualité était supérieure à ce que les autres équipes avaient obtenu jusque là. À partir de cellules souches embryonnaires, on peut ainsi commencer à reconstruire une peau, qui semble physiologiquement proche de la peau humaine.
M. Jean-Jean Sébastien Vialatte, rapporteur. Avec les glandes ?
Mme Michèle Martin. Non, ce problème n’est pas encore résolu. L’équipe de Marc Peschanski a proposé, dans un premier temps, que ce type de construction puisse être testé comme pansement, pour faire attendre le patient avant la greffe définitive. Il a bien été expliqué qu’on pouvait produire des iPS à partir de tous les types cellulaires humains. Il semble que la cellule de la peau, le kératinocyte, soit particulièrement intéressante pour la reprogrammation. Une équipe espagnole a comparé le taux de cellules iPS qu’on obtenait à partir, par exemple, d’un fibroblaste humain et d’un kératinocyte : il serait cent fois plus facile de reprogrammer un kératinocyte humain, peut-être parce que les cellules de base expriment très fortement un des quatre gènes qui sont dans le cocktail de Yamanaka.
S’agissant de la peau, je n’avais pas choisi de développer tous ces aspects aujourd’hui. Mais il y a bien un boom des recherches ES/iPS. Dans mon équipe, je pense développer la recherche sur les iPS.
M. Hervé Chneiweiss, directeur de recherches, unité de plasticité gliale, INSERM, membre du conseil scientifique de l’OPESCT, rédacteur en chef de Médecine-Science. Il est important de souligner le lien entre la réglementation et les moyens mis en place. Il faut faire attention. La proposition de loi Jardé tente d’apporter des réponses, s’agissant des cohortes et des collections. Toutefois, lorsqu’une réglementation est mise en œuvre, il convient d’assurer aux différentes équipes des moyens suffisants dans les centres de ressources biologiques : en amont, avec les cliniciens, en matière de formation, en matière d’information délivrée au patient.
Il faut aussi se garder de tout « excès éthique ». Les travaux actuellement réalisés sur les iPS pourraient faire croire que n’importe quelle cellule peut sauver de n’importe quelle maladie, n’importe quel patient. L’idée selon laquelle il conviendrait de préserver n’importe quel tissu de chacun d’entre nous pourrait se développer. Vous connaissez la controverse qui est née à propos de la préservation de cordons ombilicaux à des fins individuelles : une telle préservation est tout à fait inutile, une collection de 30 000 à 60 000 cellules souches issues de cordons suffirait pour couvrir les besoins de la population.
Deux intervenants au moins ont souligné que la recherche et les essais cliniques souffraient d’un manque de moyens malgré, à l’origine, de bonnes intentions et une volonté de protéger les personnes. Lorsqu’on instaure des réglementations, il faut en prévoir les conditions d’application matérielles et « morales ». Ce qui s’est passé au Royaume-Uni en témoigne : Des couples, d’accord pour donner un embryon surnuméraire pour la recherche, ont refusé de le faire quand ils ont su quel type de recherche serait mené sur les cellules souches issues de cet embryon. Les problèmes d’information peuvent induire des blocages.
M. Jacques Remacle. Exception faite des kératinocytes qui sont très importants pour développer de la peau, il est très difficile de pouvoir isoler les cellules souches adultes, de les cultiver et d’en avoir suffisamment vu leur rareté, pour intervenir au niveau thérapeutique.
Mme Michèle Martin. Leur rareté est contrebalancée par leur potentiel extraordinaire. Par exemple, les greffes ne permettent pas la reconstitution des annexes épidermiques chez les grands brûlés. Toutefois, on peut tout à fait imaginer, compte tenu des avancées enregistrées, qu’on saura faire des greffons complexes dans les années qui viennent. C’est absolument à notre portée, et il faut donc soutenir les essais.
M. Daniel Louvard. Nicole Le Douarin a évoqué ce matin le tube digestif. À cet égard, il convient de souligner les travaux exceptionnels de notre collègue Hans Clevers aux Pays-Bas, qui a isolé l’une des cellules souches de l’intestin. Il a su, à partir d’une matrice extracellulaire appropriée, faire proliférer cette cellule qui est rare, régénérer les quatre types cellulaires principaux, et faire, ce qui est encore plus surprenant, toute la morphogenèse de la crypte villositaire, soit une structure en trois dimensions ; il a pu produire en très grande quantité ce qu’il appelle des « mini guts », des mini intestins. Chaque crypte possède16 cellules souches, ce qui fait à peu près 10 7 à 10 8 cellules souches dans un intestin humain et offre la possibilité, en culture, de fabriquer des intestins reconstitués.
Mme Nicole Le Douarin. Le travail de Hans Clevers est spectaculaire, et l’article sur ce mini intestin, qu’il a publié récemment dans Nature, est extraordinaire. Ces cellules souches ont été découvertes, il n’y a pas très longtemps, par un Français, A Leblond, en utilisant comme marqueur de la thymidine tritiée. Il en avait injecté à des souris et vu que certaines cellules, dans les cryptes de l’intestin, conservaient le marquage, alors que la plupart des autres cellules le perdaient. Le marqueur était maintenu dans ces cellules souches qui se divisent très peu, tandis qu’il se diluait au moment de la resynthétisation du DN1 dans les cellules qui se multiplient beaucoup. On s’était rendu compte que ces cellules souches possédaient un pouvoir prolifératif considérable, sans pour autant parvenir à les cultiver comme on cultive des cellules souches hématopoïétiques. C’est donc un des grandes acquisitions de l’année 2009 que d’y être arrivé.
Mme Laure Coulombel. Je tiens à faire deux remarques pour tempérer ce qui vient d’être expliqué. Premièrement, il est très difficile d’amplifier les cellules souches adultes. On ne peut pas obtenir 100 cellules souches hématopoïétiques à partir d’une seule.
Deuxièmement, il faut faire très attention aux propriétés que l’on prête aux cellules souches mésenchymateuses, qui peuvent être actuellement amplifiées et isolées des tissus. Il convient d’interpréter avec une grande prudence les résultats obtenus, qu’il s’agisse de leur prolifération ou de leur potentiel.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie, M. Fabrice Claireau, directeur des affaires juridiques et internationales de l’Institut national de la propriété industrielle va évoquer les questions de brevetabilité.
M. Fabrice Claireau, directeur des affaires juridiques et internationales de l’Institut national de la propriété industrielle (INPI). Vingt-six dépôts de brevets français portant sur les cellules souches adultes et embryonnaires ont été déposés auprès de l’INPI durant la période 1999-2008. Cela correspond à une moyenne oscillant entre zéro et 5 dépôts de brevets par an, ce qui est assez peu. Sur ce total de 26, 7 brevets ont été délivrés par l’Institut et sont en vigueur. Les autres ont été soit rejetés, soit déchus, ou se trouvent encore en cours d’examen.
Ces statistiques doivent être relativisées. Les déposants peuvent également déposer directement leurs brevets à l’Office européen des brevets (OEB). Il y a davantage de brevets à l’OEB qu’à l’INPI pour les cellules souches. Par ailleurs, il ressort des bases de données de l’OEB que, sur les 200 dépôts de brevets relatifs à des cellules souches humaines, l’Office n’en a délivré pour l’instant que 48, lesquels sont essentiellement d’origine américaine ou anglaise. Parmi ces 48 brevets délivrés, aucun n’a été déposé par un Français ni ne désigne un inventeur français.
Dans le cadre de la révision des lois de bioéthique, nous avions transmis des statistiques portant sur l’ensemble des brevets en matière biotechnologique : les proportions étaient les mêmes.
M. Alain Claeys, rapporteur. Vous confirmez qu’aucun brevet d’origine française n’a été déposé auprès de l’OEB ?
M. Fabrice Claireau. Parmi les 48 délivrés, aucun. C’est en tout cas ce qui résulte des recherches que nous avons effectuées sur les bases de données. Toutefois, il faudrait interroger directement l’Office pour le vérifier.
M. Alain Claeys, rapporteur. C’est un constat dramatique !
M. Fabrice Claireau. Sur de tels sujets, les déposants ont intérêt à s’assurer une protection géographique maximale dès le dépôt de leur brevet. Certes, il est possible de faire un premier dépôt français et de l’étendre, soit au niveau européen, soit au niveau international. Mais les déposants choisissent plutôt de faire un dépôt européen et de désigner ensuite les différents États membres sur les territoires desquels ils souhaitent être protégés. En tout cas, en tant que directeur juridique de l’INPI, je me garderai d’établir un lien entre le régime juridique et les données que je viens de vous fournir concernant les dépôts français et les dépôts européens.
En ce qui concerne le régime juridique des brevets portant sur des cellules souches humaines, il est important de souligner que les brevets ne peuvent pas porter sur la matière vivante elle-même, telle qu’elle existe dans la nature. Un principe général du droit des brevets exclut en effet les simples découvertes du domaine de la brevetabilité – articles L.611-10 du Code de la propriété intellectuelle (CPI) et L. 611-18 du même code pour les éléments du corps humain.
Les cellules souches, telles qu’elles existent au sein d’un embryon ou dans le corps humain, ne peuvent donc pas être brevetées. En revanche, le fait d’extraire ces cellules, de les purifier puis de les multiplier en dehors du corps humain ou de l’embryon nécessite des procédés techniques extrêmement pointus. Ces procédés conduisent à un résultat différent de celui présent dans le corps, puisque l’élément obtenu est isolé, purifié, parfois modifié et rendu de la sorte utilisable dans un cadre thérapeutique.
La directive de 1998 sur la brevetabilité des inventions biotechnologiques permet de breveter les inventions portant sur « un élément isolé du corps humain ou autrement produit par un procédé technique ». Sont brevetables, aux conditions habituelles de nouveauté, d’activité inventive et d’application industrielle, les inventions portant sur un produit constitué en totalité ou en partie de manière biologique, c’est-à-dire de la matière contenant des informations génétiques et capables de se reproduire ou d’être reproduite dans un système biologique.
M. Alain Claeys, rapporteur. Une lignée de cellules souches embryonnaires peut-elle être brevetée ?
M. Fabrice Claireau. Non, alors que cela est possible pour des cellules adultes.
M. Alain Claeys, rapporteur. Mais ça l’a été ?
M. Fabrice Claireau. À l’Office américain des brevets (l’USPTO, United States Patent and Trademark Office), mais ni à l’Office français ni à l’Office européen des brevets. Les cellules souches ne peuvent faire l’objet d’un dépôt de brevet que pour autant qu’elles sont isolées du corps, c’est-à-dire extraites et reproduites artificiellement in vitro, dans le cadre de procédés techniques conduits par l’homme. Les brevets sont également soumis à diverses exclusions.
La première est relative aux utilisations d’embryons humains à des fins industrielles ou commerciales. Même si une telle exclusion est sujette à interprétation, elle peut, dans une acception large, interdire tout dépôt de brevet portant sur des cellules souches embryonnaires humaines, de quelque type que ce soit : des cellules souches totipotentes, mais aussi pluripotentes. Sur ce fondement, l’INPI demande aux déposants d’exclure expressément les cellules souches embryonnaires humaines du texte de la demande de brevet déposée.
À l’échelon européen, l’OEB a pratiqué de la même manière. En effet, la directive européenne de 1998, directive 98/44/CE, a été intégrée dans le règlement d’exécution de la convention sur le brevet européen et constitue donc un corpus de règles applicable aux brevets européens.
La décision WARF (Wisconsin Alumni Research Foundation), G0002/6 de la grande chambre de recours de l’OEB du 25 novembre 2008 a précisé l’interprétation que l’Office devait donner de cette exclusion : doit être refusé tout brevet portant sur des cellules souches embryonnaires qui, au jour du dépôt de la demande, en l’occurrence en 2003, ne peuvent être obtenues que par destruction initiale d’un embryon. L’exclusion s’applique quand bien même la méthode d’obtention des cellules souches, et donc de destruction de l’embryon, n’est pas revendiquée par le brevet.
Cette décision confère donc une portée large à l’exclusion et interdit tout dépôt de brevet portant sur des cellules souches embryonnaires humaines, à moins que la technique ne permette, au jour du dépôt de la demande de brevet, l’obtention de cellules souches embryonnaires sans destruction de l’embryon.
La pratique de l’office américain USPTO, est très différente : la brevetabilité du vivant y est très largement admise, y compris en ce qui concerne les cellules souches humaines, embryonnaires comme adultes. Une décision de la Cour suprême de 1980 a défini la pratique de l’office américain en matière de brevetabilité, lequel s’y réfère toujours dans ses directives. Contrairement à l’OEB, il a délivré trois brevets portant sur des cellules souches embryonnaires au profit de la WARF (Wisconsin Alumni Research Foundation). La seule limite que l’on trouve dans les directives publiées par l’office américain concerne les inventions qui peuvent être raisonnablement interprétées comme englobant l’être humain dans sa totalité, ce qui est flou et difficile à interpréter.
L’office britannique, quant à lui, a récemment modifié sa pratique, pour tirer les conséquences de la décision précitée de la grande chambre des recours de l’OEB. Avant cette décision, il acceptait de délivrer des brevets portant sur des cellules souches pluripotentes isolées. Désormais, il n’accepte de tels brevets qu’à la condition que les cellules puissent être obtenues à partir de méthodes n’impliquant pas la destruction d’un embryon humain, par exemple, à partir de lignées déjà établies et déposées dans une banque cellulaire reconnue. Par ailleurs, il refuse de délivrer des brevets sur des procédés d’obtention de cellules souches embryonnaires humaines, ainsi que sur des cellules souches totipotentes.
L’office allemand a, pour l’instant, une pratique équivalente à celle de l’office britannique. Suite à une décision de la Cour fédérale des brevets, il refuse de délivrer des brevets portant sur des cellules souches embryonnaires humaines.
Toutefois, cette décision de la Cour fédérale des brevets a fait l’objet d’un recours devant la Cour suprême fédérale, laquelle a décidé de saisir la Cour de justice de l’Union européenne (CJUE) d’une question préjudicielle quant à l’interprétation qu’il convient de donner à la directive 98/44/CE, notamment à la disposition qui exclut de la brevetabilité les utilisations d’embryons humains à des fins industrielles et commerciales.
Dans dix-huit à vingt-quatre mois, délai moyen de réponse à une question : nous devrions connaître l’interprétation que donne la CJUE aux termes « embryon » et « utilisation », ainsi qu’à l’expression « fins industrielles et commerciales ». Quels stades de développement de l’œuf le terme « embryon » vise-t-il ? Couvre-t-il également le stade du « blastocyste », à partir du cinquième jour après la fécondation, stade au cours duquel il n’y a plus de cellules souches totipotentes, susceptibles de reconstituer un organisme entier ? L’extraction de cellules souches constitue-t-elle nécessairement une « utilisation » de l’embryon ? Une utilisation à des fins de recherche ou dans un but thérapeutique constitue-t-elle une exploitation industrielle et commerciale?
Pour l’INPI, la réponse à cette question préjudicielle est fondamentale. C’est d’ailleurs la raison pour laquelle l’Institut a décidé de suspendre la procédure de délivrance des brevets français portant sur des cellules souches embryonnaires humaines et a demandé aux déposants d’exclure ces cellules du texte du brevet. Il attend la décision de la CJUE pour se prononcer définitivement sur les brevets qui sont en cours d’examen, notamment sur les brevets qu’il envisageait de rejeter, les déposants ayant refusé de limiter leurs revendications quant au champ de leur brevet.
Une deuxième exclusion, celle du corps humain aux différents stades de sa constitution et de son développement qui figure à l’article 5 de la directive de 1998 et à l’article L.611-18 du code de la propriété intellectuelle(CPI), conduit à écarter de la brevetabilité les cellules souches embryonnaires humaines totipotentes. Si elles sont réintroduites in vivo, ces cellules ont en effet la capacité de reconstituer un organisme entier : elles peuvent ainsi être considérées comme le corps humain au premier stade de son développement.
La troisième exclusion porte sur les procédés de clonage des êtres humains : cette exclusion figure à l’article 6.2 a) de la directive de 1998 et à l’article L.611-18 du code de la propriété intellectuelle. Les procédés permettant d’obtenir des cellules souches embryonnaires à partir de transferts nucléaires ne sont pas brevetables, de même que les cellules souches ainsi obtenues.
Par ailleurs, la portée des brevets délivrés en matière de cellules souches humaines est limitée. Comme en matière de biotechnologie, le brevet voit sa portée limitée par rapport à ceux délivrés dans d’autres secteurs technologiques. La loi du 6 août 2004 a précisé que « seule une invention constituant l’application technique d’une fonction d’un élément du corps humain peut être protégée par brevet. Cette protection ne couvre l’élément du corps humain que dans la mesure nécessaire à la réalisation et à l’exploitation de cette application particulière.»
Cette disposition s’analyse comme permettant, sous certaines réserves, de déposer des brevets revendiquant les cellules souches isolées en tant qu’éléments isolés du corps humain et leur procédé d’obtention. Toutefois, le brevet ne couvre les cellules souches isolées que dans la mesure nécessaire à la fonction précisément identifiée dans la demande de brevet et à l’application technique correspondante. Dans ce domaine, les brevets sont donc restreints à une fonction et à une application technique précises.
Si un procédé d’obtention ou une lignée de cellules souches adultes, isolées du corps humain, peut faire l’objet d’un dépôt de brevet, c’est à la condition d’indiquer précisément l’application qui en est faite. Comme l’explique le rapport d’information établi au nom de la Mission d’information sur la révision des lois de bioéthique, si une nouvelle application de cette lignée de cellules venait à être identifiée, elle pourrait faire l’objet d’un second brevet. Ce nouveau brevet ne serait pas dépendant du premier ; son titulaire n’aurait pas à demander l’autorisation du titulaire du premier brevet, ni à lui verser des redevances.
Cette restriction aux fonctions, opérée par la loi française, repose sur la marge de souplesse laissée par la directive 98/44/CE sur la protection juridique des inventions biotechnologiques. Dans son rapport « Évolution et implications du droit des brevets dans le domaine de la biotechnologie et du génie génétique du 14 juillet 2005 », la Commission européenne a indiqué qu’elle ne souhaitait pas pour l’instant se prononcer sur la validité des transpositions nationales qui ont choisi une protection limitée aux fonctions et aux applications comme la France et l’Allemagne. Elle a admis que certaines dispositions de la directive pouvaient être lues en ce sens.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie beaucoup. Mme Hélène Gaumont-Prat, qui est professeur de droit à l’université Paris VIII, directrice du laboratoire de droit médical et de droit de la santé, et ancien membre du Comité national consultatif d’éthique, a la parole
Mme Hélène Gaumont-Prat, professeur de droit à l’université Paris VIII, directrice du laboratoire de droit médical et de droit de la santé, ancien membre du Comité national consultatif d’éthique. Le développement de la recherche sur les cellules souches adultes et embryonnaires offre d’importantes promesses thérapeutiques. Les investisseurs potentiels dans le domaine des biotechnologies veulent avoir la certitude d’une protection juridique des inventions par le brevet, comme cela a été le cas dans le domaine de la recherche sur les séquences géniques. Pour autant la spécificité de l’origine des cellules embryonnaires interroge l’éthique.
L’avis n°16 sur les aspects éthiques de la brevetabilité des inventions impliquant des cellules souches humaines du 7 mai 2002 du Groupe européen d’éthique des sciences et des nouvelles technologies auprès de la Commission européenne (GEE), a établi un état des lieux de l’époque. Selon cet avis dans le monde plus de 2 000 demandes de brevets ont été déposées pour des cellules souches humaines et non humaines dont un quart pour des cellules souches embryonnaires.
Des recherches plus récentes montrent qu’en 2005, une enquête britannique avait recensé plus de 18 000 brevets dans le monde ; au niveau de l’Office européen des brevets quelques centaines de demandes de brevets sur les cellules souches humaines ont été déposées, tandis qu’un peu plus d’une vingtaine ont été déposées devant l’INPI, quelques brevets ayant été accordés. Ces brevets portent soit sur des procédés, soit sur des produits. Il peut s’agir de procédés d’isolement de cellules souches à partir d’embryons ou de tissus, de procédés d’enrichissement en cellules souches de mélanges de cellules, de procédés de culture de cellules souches, de procédés de modification génétique de cellules souches, de procédés d’induction de la différenciation de cellules souches, de procédés d’induction de cellules souches adultes pour les soumettre à la rétrodifférentiation ou la transdifférenciation, de procédés de transformation de cellules somatiques en cellules souches.
Les demandes de brevets sur des produits portent sur des cellules souches, des compositions comprenant des cellules humaines et un additif des lignées de cellules souches, des cellules souches différenciées, et des cellules souches génétiquement modifiées. Les inventions peuvent également porter sur des utilisations de cellules souches (usage thérapeutique notamment).
S’agissant du cadre juridique que disent les textes en droit français et européen? Il y a deux niveaux de réponse concernant les conditions d’obtention et les conditions de la brevetabilité.
En France, en amont de toute demande de brevet, les conditions d’obtention des cellules souches humaines adultes sont encadrées par les dispositions des articles 16-1 et suivants du Code civil, issus des lois de bioéthique de 1994, révisées en 2004. Ils exigent le consentement de la personne soumise au prélèvement et le don en vertu du principe de gratuité découlant de la règle de non patrimonialité inscrite à l’article 16-1 précité. Les règles concernant la recherche sur l’embryon sont visées aux articles L. 2151-5 et suivants, et L.2414-1 du Code de la santé publique.
Quant à la brevetabilité des inventions issues de cellules souches, les règles applicables découlent de la directive (CE) 98/44 du 6 juillet 1998 (articles 3, 5 et 6) et de la loi de transposition n° 2004-800 du 6 août 2004 relative à la bioéthique. En 2004, lors de la transposition de la directive, c’est principalement l’article 5 de la directive qui a posé problème. En voici la teneur :
« Le corps humain, aux différents stades de sa constitution et de son développement, ainsi que la simple découverte d’un de ses éléments, y compris la séquence ou la séquence partielle d’un gène, ne peuvent constituer des inventions brevetables.
« Un élément isolé du corps humain ou autrement produit par un procédé technique, y compris la séquence ou la séquence partielle d’un gène, peut constituer une invention brevetable, même si la structure de cet élément est identique à celle d’un élément naturel.
« L’application industrielle d’une séquence ou d’une séquence partielle d’un gène doit être concrètement exposée dans la demande de brevet. »
L’article L. 611-18 du CPI a été rédigé de manière plus restrictive quant à la portée du brevet, pour répondre aux critiques portant sur les conséquences de la brevetabilité du vivant: « Seule une invention constituant l’application technique d’une fonction d’un élément du corps humain peut être protégée par brevet. Cette protection ne couvre l’élément du corps humain que dans la mesure nécessaire à la réalisation et à l’exploitation de cette application particulière. Celle-ci doit être concrètement et réellement exposée dans la demande de brevet. »
Cependant les dispositions de la directive 98/44 sont appliquées au plan européen par l’Office Européen du Brevet (OEB) puisqu’en juin 1999, le conseil d’administration de l’OEB avait décidé d’incorporer les dispositions de la directive dans le règlement d’exécution de la convention de Munich.
La plupart des brevets en ce domaine étant délivrés par l’OEB et non pas par l’INPI, ils ne sont pas affectés par la différence de rédaction, et aucun contentieux n’a vu le jour à cette date. Pour autant on ne peut écarter cette possibilité. Cette modification aurait des conséquences si un brevet délivré par l’OEB venait à être contesté en France devant une juridiction française, car celle-ci s’appuierait sur les textes communautaire et français. La directive primant sur le texte français, la juridiction devrait interpréter les dispositions de l’article L. 611-18 du CPI à la lumière du texte communautaire et en cas de contradiction entre les deux, elle aurait l’obligation légale de préférer le texte communautaire. Le problème serait résolu.
L’article 3.1 de la directive n°98/44 précise que : « sont brevetables les inventions nouvelles, impliquant une activité inventive et susceptibles d’application industrielle même lorsqu’elles portent sur un produit composé de matière biologique ou en contenant ou sur un procédé permettant de produire de traiter ou d’utiliser de la matière biologique ».
L’article 3.2 précise : « une matière biologique isolée de son environnement naturel ou produite à l’aide d’un procédé technique peut être l’objet d’une invention, même lorsqu’elle préexistait à l’état naturel ».
Rien ne s’oppose à la brevetabilité des inventions issues de cellules d’origine humaine. Ces dispositions juridiques doivent être ensuite appréciées au regard de l’article 6.1 de la directive qui précise que « les inventions dont l’exploitation commerciale serait contraire à l’ordre public ou aux bonnes mœurs sont exclues de la brevetabilité, l’exploitation ne pouvant être considérée comme telle du seul fait qu’elle est interdite par une disposition légale ou réglementaire ».
Chaque État membre de l’Union européenne interprète la notion d’exploitation « contraire à l’ordre public et aux bonnes mœurs ». Toutefois, la brevetabilité des cellules souches embryonnaire soulève des questions éthiques du fait même de leur origine. Si l’article 5 de la directive exclut de la brevetabilité « le corps humain, aux différents stades de sa constitution et de son développement, … », cela exclut alors l’embryon dans sa forme de totipotence car l’embryon peut se développer en un être humain, et ses cellules ne peuvent pas au regard de ce texte être brevetables. En revanche cela n’exclut pas automatiquement les cellules dans leur forme de pluripotence, et la question demeure.
Toutefois l’article 6 §2 de la directive, transposé à l’identique par la loi du 6 août 2004 à l’article L. 611-17 du CPI. prévoit que « Au titre du § 1, ne sont notamment pas brevetables (…) les utilisations d’embryons humains à des fins industrielles ou commerciales ». Une réponse vient d’être donnée par la Grande chambre de recours de l’Office européen des brevets. Celle ci a fixé, dans sa décision du 25 novembre 2008 l’interprétation de la règle 23d(c) du Règlement d’exécution de la Convention sur le brevet européen (CBE), tirée de l’article 6.2 de la directive n° 98/44 du 6 juillet 1998 sur la protection des inventions biotechnologiques : « Une invention dont les revendications ne portent pas sur l’utilisation d’embryons humains, mais dont la mise en œuvre rend indispensable une telle utilisation se concluant par leur destruction ne saurait être brevetée en raison de l’exclusion visant « les utilisations d’embryons humains à des fins industrielles ou commerciales »
La Grande chambre de recours de l'Office européen des brevets (OEB) a rejeté, le 27 novembre 2008, une requête d'un institut de recherche américain, la Wisconsin Alumni Research Foundation (WARF), tendant à la protection par un brevet européen de sa méthode permettant d'entretenir pendant une longue période des cellules souches dérivées d'un embryon. Cette méthode est déjà brevetée aux États-Unis.
Une autre décision est maintenant attendue : celle de la Cour de justice des communautés européennes (CJCE) qui vient d’être saisie d’une question préjudicielle par la Cour suprême allemande à ce sujet : l'affaire concerne un brevet portant sur une méthode de fabrication de cellules neuronales à partir de cellules souches embryonnaires. La CJCE devra donner son interprétation de la directive 98/44/CE, et notamment répondre aux questions déjà énumérées par M Fabrice Claireau.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie et ouvre maintenant le débat
M. Anselme Perrier. L’exception de destruction de l’embryon a-t-elle déjà été appliquée pour breveter une lignée ES? Comment est définie la non destruction, si l’on considère qu’une biopsie d’une cellule peut affecter en partie l’embryon ? Si l’embryon est recongelé, comment savoir qu’il y a une application, qu’il a été détruit ou qu’il est inutilisable ?
M. Fabrice Claireau. L’exception de destruction n’a pas été appliquée. Mais ce sera l’un des sujets de la prochaine réunion entre offices européens de propriété industrielle. Il s’agit d’un nouveau critère issu de la jurisprudence de la Grande chambre de recours de l’Office européen des brevets. Mais nous sommes encore dans l’expectative pour savoir ce qu’il recouvre très précisément. C’est la raison pour laquelle la question préjudicielle posée à la CJUE par la Cour suprême allemande sera déterminante sur la portée de ce critère et sur ce que l’on peut en tirer dans le cadre de nos pratiques de brevetabilité. Mais pour l’instant, nous n’avons pas d’éléments plus précis car c’est un critère très nouveau.
M. Arnaud de Guerra, responsable de l’unité de recherche, direction médicale et scientifique de l’Agence de biomédecine. Comment envisageriez-vous, au niveau français ou européen, la brevetabilité de lignées de cellules différenciées à partir de cellules souches embryonnaires ? Il y a bien une destruction d’embryons à l’origine, mais on arrive assez loin de la cellule souche embryonnaire, et ce sont les cellules de ce type, les cellules différenciées qui donneront lieu à des essais cliniques quand il le faudra.
M. Fabrice Claireau. À ce stade, nous aurions plutôt tendance à les rejeter. Mais, encore une fois, nous étudierons la décision de la Cour de justice de l’Union européenne.
M. Hervé Chneiweiss. Qu’entendez-vous par « restriction à l’utilisation » car l’imagination des chercheurs ou des offices est sans limites ? Au moment du dépôt de la demande de brevet, quel degré de preuve ou de démonstration demandez-vous pour que cette restriction soit réelle et ne se traduise pas seulement par quelques pages de plus à écrire ?
M. Fabrice Claireau. Elle doit se traduire plutôt par quelques pages de moins que par quelques pages de plus. Vous connaissez comme moi le goût des déposants à déposer des brevets dont la portée est très large, ce qui se traduit par des pages entières de revendications. Dans le domaine des biotechnologies et des cellules souches humaines, nous avons tendance à leur demander de réduire la portée des revendications, et donc le nombre de pages. Dans un dialogue avec le déposant, nous identifions la fonction et nous vérifions que le brevet correspond bien à une application particulière, et non à des revendications couvrant des applications multiples.
La séance est levée à treize heures dix.
TABLE RONDE : THÉRAPIE DU FUTUR : QUELLES PERSPECTIVES ?
M. Alain Claeys, rapporteur. Nous en venons à la troisième table ronde dont le thème est « Thérapie du futur : quelles perspectives ? » M. Marc Peschanski, directeur scientifique de l’Institut des cellules souches pour le traitement et l’étude des maladies monogéniques (I-Stem) vous avez la parole.
M. Marc Peschanski, directeur scientifique de l’Institut des cellules souches pour le traitement et l’étude des maladies monogéniques (I-Stem). Concernant les cellules embryonnaires, je centrerai ma présentation sur des points moins classiquement abordés que celui de la thérapie cellulaire. Certes, pour de nombreux spécialistes, dont je partage l’avis, celle-ci demeurera le premier grand domaine d’utilisation de ces cellules. Mais elles serviront à bien davantage encore dans d’autres domaines, et c’est ce que je me propose d’illustrer.
Les cellules souches présentent les deux qualités de s’auto-renouveler et de pouvoir se différencier. Les cellules souches embryonnaires, issues du blastocyste entre cinq jours et demi et sept jours et demi de développement, sont à la fois immortelles, c’est-à-dire capables de proliférer de façon absolument illimitée, et pluripotentes. Les cellules souches adultes, elles, ont une capacité de prolifération et de différenciation plus limitée.
Pour les médecins qui, comme moi, pratiquent la thérapie cellulaire depuis près de vingt ans, pouvoir accéder facilement à des cellules que l’on obtiendrait en laboratoire était, dans les années quatre-vingt, un rêve inaccessible. Il n’a commencé de se concrétiser que dans les années quatre-vingt-dix pour les cellules souches embryonnaires, à l’étranger du moins puisque cela était interdit en France. L’intérêt majeur que nous y avons vu était de pouvoir les amplifier à volonté. Encore fallait-il disposer des technologies permettant d’« industrialiser » leur production, puis leur utilisation.
Un bioréacteur permet aujourd’hui de cultiver non plus quelques centaines de milliers ou quelques millions de cellules, mais jusqu’à un milliard de cellules en une quinzaine de jours. Ce changement d’échelle majeur ouvre de nouvelles perspectives, bien au-delà des besoins des laboratoires de recherche académique. Une telle production industrialisée permet d’envisager une utilisation elle-même industrielle de ces cellules, des robots permettant de trier des dizaines de milliers de composés et d’en tester en parallèle les effets sur des populations cellulaires.
Au-delà de leurs multiples utilisations en thérapie cellulaire, les cellules souches embryonnaires peuvent donc servir à un criblage à haut débit des molécules. Ce procédé industriel qui existe depuis un peu plus de vingt ans est né entre autres de la possibilité de mettre au point une quantité considérable de produits potentiellement utiles en thérapeutique, grâce à la chimie combinatoire qui s’est substituée à la chimie extractive et s’est beaucoup sophistiquée. Cette chimie combinatoire a permis aux grands laboratoires pharmaceutiques de constituer des chimiothèques comportant aujourd’hui plusieurs centaines de milliers, voire millions, de composés différents. Les tester en parallèle, pour évaluer à la fois leur efficacité et leur innocuité, prendrait un temps considérable et exigerait un très grand nombre d’animaux avec les techniques traditionnelles. La miniaturisation des essais et la robotisation des manipulations, auxquelles est parvenue l’industrie pharmaceutique, ont permis de surmonter ces obstacles. C’est ainsi qu’au début des années quatre-vingt-dix, par criblage systématique de composés issus de chimiothèques, testés à l’époque sur des cibles chimiques, les laboratoires ont pu mettre très rapidement sur le marché les antirétroviraux utilisés dans le traitement du sida.
Les cellules souches embryonnaires permettent d’avoir accès à des quantités de cellules assez importantes pour envisager, grâce à la miniaturisation et à la robotisation, de remplacer les cibles chimiques par des cibles biologiques, c'est-à-dire du vivant. Dans ce criblage à haut débit qu’elles autorisent, c’est sur des cellules vivantes que sont testées les molécules thérapeutiques. Il est du plus haut intérêt de passer ainsi du modèle nécessairement réductionniste que représentait le modèle chimique à celui de la biologie de système, utilisant des cibles biologiques. Grâce aux cellules souches embryonnaires humaines, on peut mieux explorer l’humain puisqu’on peut les différencier en n’importe quel type cellulaire de l’organisme. Dans les faits, on a accès aujourd’hui à plusieurs dizaines de phénotypes différents.
Pour les applications en thérapie cellulaire, les premières auxquelles on ait pensé, il est important de pouvoir disposer de cellules ainsi préparées à large échelle dans des plates-formes en laboratoire. Quel que soit le nombre de patients à traiter, des plates-formes industrielles permettent de multiplier à volonté des cellules souches embryonnaires, de les différencier comme on le souhaite puis de les tester. Ce changement d’échelle est très important car jusqu’à présent, pour des raisons logistiques, seul un très petit nombre de patients pouvait bénéficier d’une thérapie cellulaire, celle-ci étant pratiquée à partir de cellules souches adultes ou de tissus prélevés sur donneur.
Maintenant que ces cellules peuvent être préparées en laboratoire en quantité suffisante pour n’importe quelle maladie, il est envisageable de traiter par thérapie cellulaire le diabète de type I, maladie qui affecte des centaines de milliers de patients en France et des dizaines de millions dans le monde. Une industrialisation du procédé n’en est pas moins encore nécessaire : plusieurs laboratoires dans le monde travaillent à l’élaboration des protocoles.
De nouvelles applications de la thérapie cellulaire sont également envisageables. Ainsi le traitement des accidents vasculaires cérébraux (AVC), jusqu’à présent inaccessible par cette voie, n’est-il plus une utopie. Pour traiter les lésions résultant d’une AVC, il faut en effet implanter diverses populations hétérogènes de cellules, impossibles à obtenir à partir de donneurs. On peut aujourd’hui envisager, et c’est ce que font certains laboratoires, de mélanger des populations cellulaires obtenues par différenciation de cellules souches embryonnaires humaines cultivées dans des boîtes de Pétri ou dans des bioréacteurs. La société californienne Geron, qui a obtenu l’autorisation de la FDA (Food and Drug Administration) pour ce faire, réalisera prochainement le premier essai clinique de réparation de traumatismes de la moelle épinière par des cellules souches embryonnaires. Elle envisage également d’autres applications.
Il en est une à laquelle Geron n’a pas pensé mais à laquelle nous travaillons dans mon équipe, à savoir la production d’épiderme. Cela permettrait de traiter par thérapie cellulaire non seulement les lésions cutanées des grands brûlés, indication majeure où le nombre de bénéficiaires potentiels est toutefois limité, mais aussi les ulcérations cutanées des patients atteints de drépanocytose ou de diabète, des dizaines de millions de personnes étant là potentiellement concernées.
Pour l’industrie pharmaceutique, demandeuse de nouveaux modèles, les cellules souches embryonnaires constituent un nouveau moyen de tester les molécules, plus proche de la réalité physiologique. Son objectif est tout d’abord de diminuer le coût de l’innovation, donc le prix des médicaments, et d’une manière générale ses coûts de production. Le coût de la recherche de l’efficacité d’un traitement semble, lui, incompressible, représentant de 25% à 30% du prix d’un médicament ; il conduit d’ailleurs parfois à abandonner certaines recherches.
Les études de toxicité sont elles aussi coûteuses. Elles sont pourtant indispensables dans le cas des médicaments, comme d’ailleurs des ingrédients cosmétiques, alors que la cosmétique est aujourd’hui exclue du champ d’études pour lequel peuvent être utilisées des cellules souches embryonnaires. On se demande d’ailleurs pourquoi, car, si une crème cosmétique provoque des allergies, les victimes auraient sans doute été heureuses que la toxicité du produit fût testée correctement.
Or, à compter de 2012, il sera totalement interdit par la réglementation européenne de tester les substances cosmétiques sur les animaux. Il serait donc intéressant de pouvoir le faire sur des cellules humaines. J’estime pour ma part, qu’il devrait être possible d’utiliser des cellules souches embryonnaires humaines aussi bien pour tester les éventuels effets allergisants d’une mousse à raser que la toxicité gastrique d’un médicament. Dans tous les cas, la toxicologie prédictive vise à éviter des effets indésirables sur la santé et je ne pense pas qu’il faille traiter de manière différentes substances médicamenteuses et cosmétiques. Les tests doivent être autorisés là où ils sont utiles et nécessaires.
Les cellules souches embryonnaires sont également très utiles pour la modélisation des maladies génétiques. C’est ce que nous avons fait sur des lignées cellulaires obtenues par l’équipe de Stéphane Viville, à Strasbourg, à partir d’embryons issus de diagnostics pré-implantatoires (DPI). Nous avons pu tester directement divers traitements sur des lignées dont le génome comportait l’anomalie responsable d’une pathologie catastrophique. Ainsi avons-nous observé dans les noyaux de cellules provenant d’une lignée porteuse du gène de la dystrophie myotonique de type I une accumulation d’ARN, à l’origine de la maladie. Nous recherchons les traitements permettant de réduire cette accumulation intra-nucléaire, dans l’espoir d’atténuer les effets pathologiques chez les patients. La banque d’I-Stem comporte aujourd’hui 25 lignées porteuses d’une vingtaine de pathologies différentes, toutes d’origine génétique.
Les maladies génétiques ne sont pas les seules à pouvoir être étudiées de cette façon. On peut préparer des cellules-tests porteuses d’une anomalie et y tester, grâce à la miniaturisation et aux essais en parallèle, plusieurs dizaines ou centaines de milliers de composés, pour repérer individuellement, de façon parfaitement stochastique, ceux qui ont un effet normalisateur et seront donc des molécules candidates à l’élaboration de traitements futurs. On mesure l’ampleur de la tâche lorsqu’on sait qu’on ne retient en moyenne que trois molécules candidates sur dix mille testées avec lesquelles on peut créer des modèles!
Ces trois dernières années, I-Stem a beaucoup publié, déposé de nombreux brevets et démarré de multiples essais. Cela progresse très vite, tant en matière de connaissances que de technologies et de possibilités d’applications et de brevets. Nous espérions, et c’est arrivé plus tôt que prévu, lancer les criblages demandés par le laboratoire Roche concernant diverses pathologies non monogéniques du système nerveux central. I-Stem a ainsi criblé un million de composés pour tenter d’identifier de possibles traitements, demain, de la dépression ou de la maladie d’Alzheimer.
Les grands laboratoires pharmaceutiques investissent massivement dans ce domaine, hélas, pas en France, car la loi de bioéthique a interdit les recherches sur les cellules souches embryonnaires tout en assortissant cette interdiction d’un moratoire. De plus l’épée de Damoclès du principe d’une révision de cette loi tous les cinq ans a conduit nombre de grands laboratoires à choisir d’investir outre Manche ou outre Quiévrain, où ils ne craignent pas que leurs très lourds investissements puissent être remis en cause, ou que leurs recherches soient arrêtées du jour au lendemain. GlaxoSmithKline (GSK) a déjà investi à Shanghai plus d’une centaine de millions de dollars dans la recherche sur les cellules souches pluripotentes.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie de cette présentation et donne la parole à M. Hervé Chneiweiss qui est directeur de recherches à l’INSERM, membre du conseil scientifique de l’OPECST et rédacteur en chef de Médecine Science. Nous ouvrirons le débat ensuite.
M. Hervé Chneiweiss, directeur de recherches à l’INSERM, Unité de plasticité gliale, INSERM, membre du conseil scientifique de l’OPECST, rédacteur en chef de Médecine Science. Les maladies neurodégénératives comme la maladie de Parkinson, neuro-inflammatoires comme la sclérose en plaques et les maladies psychiatriques représentant dans notre pays un tiers des dépenses de santé, tant elles sont invalidantes, on imagine l’enthousiasme que peut susciter chez le responsable d’un laboratoire de neurosciences comme moi, l’espoir d’un traitement par les cellules souches. Cet enthousiasme doit néanmoins être tempéré. Plusieurs défis demeurent en effet, certains d’ordre scientifique, d’autres ayant trait à l’organisation de notre recherche, d’autres encore à sa mise en cohérence.
L’un des premiers défis réside dans la biosécurité. Si l’on souhaite arrêter la dégénérescence des gaines de myéline chez les malades atteints de sclérose en plaques, par exemple en aidant les oligodendrocytes à remyéliniser les axones, ou bien encore « réparer » des motoneurones chez des personnes ayant subi un traumatisme de la moelle épinière, comme la société Geron en a le projet, il faut s’assurer que les cellules utilisées pour cette médecine régénérative soient fiables et que leur phénotype demeure durablement stable, non seulement in vitro mais in situ aussi, car on traite essentiellement des patients jeunes. Il faut inventer des systèmes pour valider les protocoles et pas seulement chez la souris. Il convient aussi modéliser suffisamment l’interaction observée in vitro entre un tissu et les cellules qui y sont greffées, pour pouvoir simuler ce qui se passera dans le temps. C’est ainsi que l’on en vient à ce que l’on appelle une biologie de système.
On doit également de s’assurer que le phénotype des cellules greffées demeure efficace dans le temps, que par exemple dans le cas de la maladie de Parkinson, elles continuent de sécréter durablement la dopamine, car l’arrêt de production de la dopamine par les neurones dopaminergiques du locus niger est responsable de la maladie. On doit atteindre une stabilité à dix ans.
Il faut aussi éviter tout risque de toxicité, non seulement celui éventuellement présenté par la greffe de cellules, mais aussi d’autres, liés à l’apparition de nouvelles maladies, pas encore nécessairement connues et qui pourraient se développer dans les cellules greffées. Toujours dans le cas de la maladie de Parkinson, l’on sait que des corps de Lewy s’accumulent dans les neurones dopaminergiques. Or, on a observé chez des animaux auxquels avaient été greffées des cellules souches, qu’après un certain temps, des corps de Lewy s’étaient accumulés dans les cellules greffées. Cela appelle à la prudence : non seulement, les cellules greffées doivent être stables mais le processus morbide lui-même ne doit pas détruire au fur et à mesure les cellules greffées.
Il faut de plus éviter tout risque de transformation et de développement tumoral. On connaît les problèmes qu’ont rencontrés les pionniers de la thérapie génique suite à l’insertion inadéquate dans le génome de certains gènes de réparation. Les séquenceurs de nouvelle génération ont mis en évidence que notre génome était particulièrement sensible, tant au niveau épigénétique que de sa structure même. On vient de découvrir qu’il existe dans le génome des mammifères, comme dans celui des invertébrés, pour lesquels on le sait depuis longtemps, des micros régions instables, présentant d’importants risques de duplication ou de délétion. Il est donc particulièrement important de trouver les moyens de garantir la stabilité à long terme du génome des cellules modifiées ou cultivées.
Autre défi : loin de s’opposer, pharmaco génomique et phénomique cellulaire doivent aller de pair. Il faut mener l’effort en parallèle sur les deux fronts. Pour beaucoup de maladies humaines, nous ne disposons pas de modèles animaux, ou seulement de mauvais modèles. Comme le faisait observer Sydney Brenner, Prix Nobel de médecine 2002 avec deux autres chercheurs pour leurs travaux de biologie moléculaire, l’an dernier lors d’un congrès de cancérologie: « We need no more models, we are the model. » Il est des domaines dans lesquels le seul modèle ne peut être que l’humain.
Bien que Philippe Menasché et Laure Coulombel aient émis des doutes à ce sujet ce matin, je suis, pour ma part, convaincu que l’on s’oriente vers la personnalisation des traitements, surtout si les séquenceurs annoncés de cinquième génération, qui pourraient être au point dans trois à cinq ans, permettent, comme on l’annonce, de séquencer un génome humain dans son entier en deux minutes seulement. Il sera alors possible de tester la toxicité et la tolérance des traitements sur les cellules du patient lui-même pour une grande variété de traitements. Encore faut-il parvenir à modéliser cela.
Les cellules souches pourront aussi être utilisées comme vecteurs de traitement, permettant d’ailleurs d’associer ainsi thérapie cellulaire et thérapie génique. Les cellules souches comme les cellules mésenchymateuses ont par exemple, un tropisme particulier pour détecter les lésions et les sites tumoraux. On pourrait donc les charger en molécules thérapeutiques et les vectorisées afin qu’elles aillent réparer des lésions ou détruire des cellules tumorales. Pas plus que la science fondamentale, la thérapeutique ne peut se compartimenter. Aujourd’hui, la plupart des essais en cours combinent différentes stratégies. Thérapie génique, thérapie cellulaire et modélisation ne s’excluent pas : il faut trouver les moyens intellectuels et matériels de mener ces recherches de front.
Dernier défi: quels sont les enjeux ? La France et l’Union européenne seront-elles en mesure de dégager des moyens à la hauteur des enjeux ? Le plan de relance que le président Obama a fait adopter l’année dernière incluait 10 milliards de dollars supplémentaires sur la seule année fiscale 2009 au bénéfice du National Health Institute, dont un milliard pour les recherches sur les cellules souches, cela n’est pas une simple promesse, c’est un fait. L’État de Californie a de même lancé un emprunt de 3 milliards de dollars destiné à financer des recherches sur ces cellules. Le premier appel d’offres a été lancé en octobre 2009 par le CIRM (Californian Institute for Regenerative Medicine). Cet institut créé en 2004 après votation populaire a commencé de travailler en 2006 sur 14 projets thérapeutiques pour un montant total de 230 millions de dollars, auxquels s’ajoutent 43 millions de dollars alloués par des instituts de recherche anglais et canadiens. Ces chiffres donnent une idée des montants nécessaires pour passer du travail en laboratoire aux essais thérapeutiques ! Sur ces 14 projets, 4 portaient sur des cellules souches embryonnaires et 10 sur des cellules souches de type hématopoïétiques ou mésenchymateuses transformées, plusieurs étant menés en collaboration avec des sociétés de biotechnologies.
De même, au Japon, où j’ai visité au printemps dernier le laboratoire du professeur Okano à l’institut Keio à Tokyo, avec lequel nous collaborons, le gouvernement a lancé un programme prioritaire de recherche sur les iPS, auquel il a consacré une première tranche de 17 millions de dollars pour la seule année 2009 au profit des laboratoires des professeurs Yamanaka et Okano. Tout un étage du centre de biologie de l’Institut Keio a été réaménagé pour y installer un laboratoire aux normes GMP (Good Manifacturing Practice) de production de cellules de qualité clinique, c’est-à-dire autorisant à les administrer chez l’homme à titre thérapeutique, avec deux trieurs spécifiquement dédiés. Alors même qu’il n’a pas encore été démontré que les iPS pourront un jour être utilisées en thérapeutique, cet ensemble est prêt à fonctionner.
J’en conclus qu’il ne nous suffit pas en France d’être de bons scientifiques, nous nous y efforçons chaque jour, il nous faut aussi mettre en cohérence notre recherche, la doter des moyens nécessaires et être bien plus proactifs que nous ne l’avons été par le passé.
M. Alain Claeys, rapporteur. Y a-t-il des questions après ces deux interventions ?
Mme Michèle Martin, directrice de recherche au CEA, laboratoire de génomique et de radiobiologie de la kératinopoïèse. Comment pensez-vous, Monsieur Peschanski, éviter le rejet des cellules greffées dans le traitement des ulcérations cutanées liées au diabète ?
M. Marc Peschanski. La réponse est à la fois de l’ordre d’un investissement scientifique et technique. Dans le cas de ces ulcérations cutanées, il semble que l’on ait besoin d’un pansement temporaire de quelques semaines ou quelques mois permettant la cicatrisation, la réépithélisation de la peau du patient à partir de cellules. On sait d’ores et déjà le faire aujourd’hui avec les cellules qu’on utilise. Ce qu’il faut, c’est éviter les mismatchs entre les cellules greffées et le système immunitaire du patient. Sur ce plan, les cellules souches embryonnaires mais surtout les iPS offrent de nouvelles opportunités surtout si les iPS ressemblent autant aux cellules souches embryonnaires qu’on l’espère. On pourrait établir d’avance des « catalogues » de lignées cellulaires préparées aux normes GMP dans le cadre de ce qu’on appelle des haplo banques, où les donneurs seraient classés par haplo type immunitaire.
Pour faire face à l’extrême diversité du système immunitaire humain, l’idée qui prévaut aujourd’hui au niveau international est de recourir massivement à des donneurs présentant la particularité d’être triples homozygotes pour les typages HLA-A, HLA-B, et HLA-DR, systèmes d’histocompatibilité déterminants dans le rejet des greffes. Ces haplo types homozygotes, bien que rares, environ 1 015, représentent quand même 0,6% des donneurs figurant sur le registre de l’Agence de la biomédecine. Il serait ainsi plus facile de créer une banque comportant les 12 000 à 15 000 donneurs nécessaires, repérés dans les registres déjà constitués ou identifiés dans ceux à constituer.
Dès lors, la greffe de cellules souches pluripotentes ou de dérivés de ces cellules ne sera plus inaccessible sur le plan scientifique et technique. Cela nous amène à penser qu’il faut dès maintenant élargir le recours à la thérapie cellulaire, en remplaçant pour certaines indications les cellules que nous utilisons actuellement, par des cellules pouvant être produites en quantité suffisante en laboratoire; actuellement les quantités insuffisantes dont nous disposons ne nous permettent pas de traiter tous les patients qui en auraient besoin. La constitution d’une haplo banque dont les éléments pourraient être diffusés partout dans le monde afin de toucher l’ensemble des receveurs potentiels, pourrait représenter pour les dix ans à venir l’équivalent de la grande ambition que fut le programme Génome des années quatre-vingt-dix. On exclut bien sûr de cela les greffes de cellules immunitaires elles-mêmes, c’est-à-dire les greffes de moelle, qui posent un problème différent.
M. Alain Claeys, rapporteur. Je vous remercie de ces présentations et donne la parole au Pr José-Alain Sahel, qui est le directeur scientifique de l’Institut de la vision et membre de l’Académie des sciences
M. José-Alain Sahel, professeur des universités, directeur scientifique de l’Institut de la vision, membre de l’Académie des sciences. Je traiterai des perspectives d’utilisation thérapeutique des cellules souches rétiniennes, à partir du travail réalisé à l’Institut de la vision par l’équipe dirigée par Olivier Goureau, en étroite collaboration avec celle de Marc Peschanski.
Au-delà des techniques actuelles de greffe de cellules souches dans la cornée, provenant en général des patients eux-mêmes et pour lesquelles les essais cliniques donnent des résultats relativement prometteurs, l’enjeu dans les années à venir est de traiter les maladies rétiniennes. La rétine, tissu qui tapisse le fond de l’oeil, provient du même feuillet embryonnaire que le cerveau : c’est un tissu cérébral, contenant des milliards de neurones et de synapses. C’est d’ailleurs la raison pour laquelle on a pendant longtemps pensé qu’il était aussi fou d’envisager une transplantation de rétine qu’une transplantation de cerveau !
L’enjeu principal est de traiter les maladies responsables de la majorité des cécités actuelles, parmi lesquelles un grand nombre de maladies génétiques. Les plus connues sont les rétinopathies pigmentaires, qui touchent de 40 000 à 50 000 personnes en France, la dégénérescence maculaire liée à l’âge (DMLA), dont le nombre de cas devrait doubler dans les quinze ans à venir du fait du vieillissement de la population, et qui, affectant la rétine centrale, est très invalidante. Elle entraîne une perte de la vision centrale.
Pour les maladies génétiques, nous n’avons aujourd’hui que quelques espoirs liés à la thérapie génique correctrice et à la vision artificielle : c’est dire combien nous sommes encore démunis sur le plan thérapeutique, quelques essais cliniques sont néanmoins en cours. S’agissant de la dégénérescence maculaire, des progrès très récents ont permis de retarder la survenue de la baisse de la vision chez 10% à 15% des patients mais le nombre de personnes malvoyantes ou aveugles à cause de cette maladie ne diminue pas, et ne fera même qu’augmenter dans le futur en raison du vieillissement de la population. C’est pourquoi il est urgent de trouver comment remplacer le tissu rétinien endommagé. Pendant très longtemps, on a eu l’idée d’y substituer du tissu rétinien, soit embryonnaire, soit adulte.
Parmi les stratégies possibles, si l’on vise une restauration fonctionnelle, on peut envisager la vision artificielle, une thérapie génique correctrice, utilisables à condition qu’il reste du tissu neuronal à stimuler, ou bien une thérapie cellulaire régénératrice par des cellules souches. Si l’on vise une stabilisation fonctionnelle, on peut envisager une autre approche de thérapie cellulaire s’apparentant à une neuroprotection pharmacologique, avec l’effet paracrine par lequel des cellules transplantées larguent dans le tissu hôte des molécules trophiques lui permettant de survivre. Dans ce cas, ce n’est pas la cellule transplantée elle-même qui est fonctionnelle mais les molécules qu’elle fabrique sur place qui auraient un effet thérapeutique. Notre équipe a beaucoup travaillé sur le sujet, essentiellement avec des cellules souches adultes. Il nous est apparu que l’approche régénératrice ne devait pas pour autant être éliminée.
Les sources de cellules transplantables ont longtemps été :
-soit des progéniteurs rétiniens : ils sont obtenus à partir de rétines embryonnaires, très facilement chez l’animal, bien moins, vous vous en doutez, et c’est fort heureux, chez l’homme,
-soit des cellules souches neurales adultes : on a longtemps pensé qu’il n’en existait pas alors qu’il s’est avéré qu’on en trouve en très petit nombre en périphérie de la rétine avec une capacité de régénération très limitée, et en tout état de cause en quantité insuffisante pour qu’il soit envisageable d’en prélever à des fins de greffes, en outre nombre de publications sur ce thème on été invalidées,
-soit des cellules souches hématopoïétiques,
-soit des cellules de l’œil lui-même cornée et tissu irien.
Hélas, aucune de ces approches n’a apporté la preuve d’une efficacité thérapeutique chez l’animal. Il était toujours impossible de parvenir à la fabrication de photorécepteurs, cellules principales de la vision, les premières de la rétine à recevoir la lumière et à la transformer en signal électrique. Or en 2006, une équipe anglo-américaine a implanté chez la souris des cellules à un stade très déterminé de précurseurs de photorécepteurs à une période très précise de la gestation. Quelques-unes sont alors parvenues à s’intégrer dans la rétine, entraînant une amélioration fonctionnelle. Cela a bien sûr suscité beaucoup d’espoirs mais en examinant à quel stade comparable de développement de l’embryon ce qui était possible chez la souris, le serait chez l’homme, il est apparu qu’il faudrait prélever des cellules fœtales au cours du deuxième trimestre de grossesse, ce qui est totalement exclu chez l’homme. C’est de là que procède l’idée d’implanter, non pas des précurseurs de photorécepteurs, mais des cellules que l’on aurait amenées au stade de prédifférenciation en photorécepteurs, qu’elles proviennent de cellules souches embryonnaires ou d’iPS.
Avec les cellules souches embryonnaires, plusieurs équipes ont essayé d’obtenir du tissu rétinien. Plusieurs publications attestent qu’in vitro, on peut obtenir des marqueurs s’apparentant à ceux des photorécepteurs. Ont ainsi été décrits dans d’excellentes revues des protocoles sophistiqués, chaque fois prometteurs, dans lesquels on arrive à obtenir, au moins en partie, un développement rétinien à partir de ces cellules et à le modéliser partiellement. Mais les photorécepteurs ainsi obtenus ne permettent d’obtenir qu’un petit bénéfice fonctionnel (some visual function), à peine mesurable sur l’électrorétinogramme.
En outre, il existe un écart important entre les résultats obtenus in vitro et ceux obtenus in vivo chez l’animal, je n’évoque même pas ce qu’il en serait chez l’homme, et je partage l’avis d’Hervé Chneiweiss sur la pertinence limitée du modèle animal, lequel demeure pourtant incontournable. Les quelques bénéfices enregistrables chez la souris, dont font état certaines publications, ouvrent-ils une voie d’avenir ?
D’une part, le rendement de cette approche est très faible, les protocoles actuels sont longs et aboutissent à un nombre relativement limité de cellules exprimant des marqueurs rétiniens. Ils n’ont pas été standardisés. La standardisation en cours à I-Stem et dans des laboratoires anglais, pour s’assurer qu’il ne s’agit pas d’artefacts et que la différenciation cellulaire sera reproductible, montre que l’on ne connaît pas encore parfaitement les protocoles permettant d’aboutir au stade exact de différenciation nécessaire. D’autre part, quelques publications dans des revues différentes, plus rares car leurs conclusions sont bien sûr moins porteuses, néanmoins tout aussi intéressantes, indique que la greffe de ces cellules souches embryonnaires a pu provoquer des tératomes, voire des tumeurs.
Les risques ne sont donc pas négligeables puisque l’on ne maîtrise pas parfaitement les paramètres de différenciation, de migration et de prolifération de ces cellules. Se pose enfin le problème éthique du recours à des cellules souches embryonnaires, que je ne détaillerai pas mais qui est encore mal résolu.
M. Alain Claeys, rapporteur. Pourriez-vous précisément nous éclairer un peu plus sur ce point ?
M. José-Alain Sahel. Lorsque le cadre de leurs recherches est trop contraint, déterminé davantage par les peurs que par la réalité, les chercheurs ne peuvent pas travailler correctement. La loi française de 2004 a institué un cadre très contraignant pour les recherches sur les cellules souches embryonnaires, l’ensemble de la loi étant lui-même révisable tous les cinq ans ce qui est un dangereux et dommageable couperet.
Pour ma part, pour avoir essayé de pratiquer des greffes de rétine adulte, j’ai travaillé dans le cadre de la première loi sur les prélèvements de tissus qui devait être révisée en 1998 mais ne l’a été que bien plus tard, et qui, de fait, interdisait tout prélèvement de tissu rétinien hors du cadre d’un prélèvement multi-organes à cœur battant, ce qui est un non-sens puisqu’il a été démontré que le tissu rétinien survit jusqu’à deux jours après la mort du donneur. N’ayant jamais pu obtenir que ce texte soit modifié, nous avons abandonné cette voie de recherche, dans laquelle nous avions pourtant été leaders pendant des années, et nous sommes orientés vers la biologie moléculaire.
Une triste affaire à Amiens avait suscité de vives inquiétudes dans le grand public concernant l’utilisation de tissus oculaires, suscitant une réaction immédiate des pouvoirs publics. Les dispositions prises sous le coup de l’émotion et de la peur n’ont, hélas, pas été corrigées ultérieurement, tuant tout un pan de recherches. Il semble que l’on n’ait voulu faire confiance ni aux chercheurs, ni aux mécanismes de contrôle.
M. Alain Claeys, rapporteur. Mme Emmanuelle Prada-Bordenave, directrice générale de l’Agence de la biomédecine souhaite apporter un éclairage sur ce point.
Mme Emmanuelle Prada-Bordenave, directrice générale de l’Agence de la biomédecine. Je partage votre avis. Toute affaire du genre de celle d’Amiens, si modeste fût-elle en réalité, provoque des effets telluriques sur l’opinion publique, induisant en retour des réactions de la part du législateur. Le prix payé pour cette affaire sur les prélèvements de tissus, et les prélèvements à fin de recherches en général, a été beaucoup trop élevé.
M. José-Alain Sahel. J’en ai discuté à l’époque avec Didier Houssin, qui dirigeait alors l’établissement français du sang, ensuite, il y a eu les problèmes liés aux prions. Nos premiers travaux datant de 1994-1995, nous avions obtenu un premier financement par le PHRC (Programme hospitalier de recherche clinique) en 1997. Nous n’avons, hélas, jamais pu obtenir les tissus nécessaires pour valider une approche thérapeutique qui avait pourtant fait ses preuves chez l’animal. Nous avons alors réorienté nos recherches. Constatant qu’il y avait un effet paracrine de certaines cellules greffées qui fabriquaient sur place des protéines, nous avons cherché à identifier ces protéines et sommes passés à l’étude des protéines recombinantes. Notre choix était en partie scientifique, en partie lié aux contraintes législatives.
M. Alain Claeys, rapporteur. Cet éclairage précis est important pour les législateurs que nous sommes.
M. José-Alain Sahel. Chaque fois qu’on légifère sous le coup de l’émotion, après un scandale, sans réflexion en aval ni à moyen ni à long terme, on fait du mauvais travail.
M. Alain Claeys, rapporteur. Jean-Sébastien Vialatte et moi partageons totalement cet avis.
Mme Emmanuelle Prada-Bordenave. Encore aujourd’hui, des chercheurs nous font part de leurs difficultés à obtenir des tissus à partir de prélèvements sur donneurs. Ces difficultés tiennent à une méconnaissance du cadre juridique. Beaucoup pensent encore que de tels prélèvements sont interdits et un climat de méfiance continue de prévaloir, très dommageable pour la recherche, alors que la législation a évolué.
M. José-Alain Sahel. Aujourd’hui, nous importons nos tissus à fins de recherche en provenance de banques étrangères qui disposent de toutes les autorisations pour faire de la recherche. Avant de pouvoir utiliser des cellules souches embryonnaires en thérapie cellulaire rétinienne chez l’homme, il faudra définir les conditions précises d’obtention et de différenciation de ces cellules vers le phénotype souhaité (rendement, temps de culture), dans le cadre d’un processus quasi-industriel avec une approche systématique, savoir purifier les précurseurs de photorécepteurs et contrôler leur prolifération pour éviter la formation de tumeurs, tous aspects qui exigent de la recherche fondamentale. Or il est de peu d’intérêt de distinguer recherche fondamentale et recherche thérapeutique, tant elles sont ici intriquées.
Il faut comprendre les mécanismes qui régulent la différenciation des progéniteurs rétiniens. Il s’agit d’une part de modifier le potentiel de différenciation des cellules obtenues, par infection/transfection avec des gènes régulateurs (facteurs de transcription, facteurs de croissance), ou suivant des conditions de culture définies et d’autre part de définir l’identité transcriptionnelle (gene array) des types cellulaires suivant les conditions: prolifération, différenciation.
De nombreux chercheurs essaient de comprendre comment de la morula on aboutit, au travers du développement du tube neural, au tissu rétinien et à ses photorécepteurs. On est arrivé à faire pousser un œil sur une patte de mouche en utilisant un seul facteur de transcription. Chez l’homme, c’est bien entendu plus compliqué et c’est sans doute heureux car il faut savoir s’arrêter avant d’avoir fait naître Frankenstein…
Il est possible de contrôler les facteurs de différenciation. En étroite collaboration avec l’Institut I-Stem, nous essayons de caractériser les différents paramètres de différenciation et de prolifération des cellules de différentes sources, en particulier des iPS. Celles-ci ouvrent une voie très prometteuse, pas nécessairement en thérapeutique aujourd’hui, bien plus en pharmaco-génomique et biologie de système. Il est aujourd’hui possible de dédifférencier une cellule somatique comme un fibroblaste puis de la reprogrammer en vue de fabriquer un type de tissu précis. L’intérêt des iPS est non seulement de pouvoir obtenir un très grand nombre de donneurs, et donc de limiter les risques de rejet, mais aussi d’utiliser les propres fibroblastes des patients pour étudier ce qui se passe au niveau moléculaire dans différentes approches thérapeutique, pharmacologique et génétique pour reconstruire certains tissus.
À la suite de quelques travaux d’équipes japonaises et américaines, nous pratiquons systématiquement chez nos patients qui veulent bien l’accepter, un prélèvement de peau afin d’obtenir de telles cellules iPS. Entre la culture de cellules isolées in vitro, l’utilisation chez l’animal et bien sûr la transposition chez l’homme, un pas considérable reste certes à faire. C’est tout le problème de la modélisation.
Les iPS nous permettent de développer un modèle nouveau d’analyse des maladies et d’envisager, dans le domaine qui est le nôtre, de pouvoir à l’avenir greffer des précurseurs de photorécepteurs. C’est une recherche extrêmement importante qui ne pose pas de problèmes éthiques particuliers, puisqu’il suffit de prélever un peu de peau chez les patients, avec leur consentement éclairé. Il y en a suffisamment qui acceptent pour que nous puissions constituer une véritable banque des différentes mutations, et disposer d’un modèle biologique humain, indépendant du modèle animal, corrélé avec le phénotypage humain puisque élaboré à partir du vrai modèle qui est le patient. On peut suivre à la trace le devenir de ces lignées de ces cellules en y injectant des colorants spécifiques, et notamment voir comment elles se comportent lors de la reconstruction des tissus.
Le recours aux iPS, qui ne pose pas de problèmes éthiques, ouvre de vastes perspectives importantes. Cependant on manque de recul. Tant que ces cellules n’auront pas été validées pour une utilisation thérapeutique, il faudra continuer de travailler avec les cellules souches embryonnaires et les prélèvements de cellules adultes post mortem, ce qui n’est pas encore facile pour les chercheurs, et ce dont pâtissent indirectement les malades.
M. Alain Claeys, rapporteur. Je vous remercie de cette présentation très précise, je donne la parole à M. Jean-Jacques Lataillade, qui est professeur de médecine au laboratoire de recherche et de thérapie cellulaire du Centre de transfusion sanguine des armées.
M. Jean-Jacques Lataillade, professeur de médecine au laboratoire de recherche et de thérapie cellulaire du Centre de transfusion sanguine des armées. Je vous présenterai ce qui intéresse aujourd’hui mon service, à savoir l’utilisation des cellules souches mésenchymateuses en médecine régénérative, en particulier pour la réparation cutanée après brûlure. Comme cela a été expliqué ce matin, parmi les cellules souches adultes, figurent les cellules souches hématopoïétiques à l’origine de tous les cellules différenciées du sang.
L’hématopoïèse a lieu dans la moelle osseuse au sein de « niches » hématopoïétiques, où des cellules dites stromales produisent des facteurs trophiques orchestrant cette production. Parmi ces cellules stromales, les cellules souches mésenchymateuses semblent être le chef d’orchestre principal. Elles sont multipotentes, capables de se différencier notamment en cellules de la lignée osseuse, cartilagineuse, stromale. Elles ont aussi une activité dite paracrine, fabriquant des protéines à effet anti-inflammatoire et antiseptique, mais aussi des chimiokines attirant vers les lésions des cellules endogènes favorisant la réparation des tissus. Elles induisent également une immuno- tolérance qui rend possible de les utiliser de manière allogénique. Toutes ces propriétés les rendent très intéressantes pour la réparation tissulaire.
Nous nous intéressons à leur utilisation dans le traitement des brûlures graves, thermiques ou radio induites. Jusque récemment, on ne savait pas traiter les brûlures radio induites, résultant le plus souvent d’accidents industriels. L’exérèse ordinairement pratiquée, associée à une autogreffe d’épiderme, était inefficace et ne pouvait éviter l’amputation du membre car les lésions faisaient l’objet de réactions inflammatoires locales en chaîne, que l’on ne savait pas arrêter.
En 2005, pour la première fois au monde, après avoir bien entendu testé le procédé chez l’animal et obtenu l’autorisation de l’AFSSAPS, nous avons utilisé ces cellules souches mésenchymateuses chez un patient, victime d’un accident de gammagraphie industrielle. Nous lui avons prélevé de la moelle osseuse de laquelle nous avons isolé des cellules souches, que nous avons mises en culture de façon à en obtenir le plus grand nombre possible le plus vite possible. Nous les lui avons ensuite injectées au niveau de la lésion, en complément d’une exérèse classique et d’une autogreffe d’épiderme. La lésion a alors guéri de manière spectaculaire : la greffe d’épiderme a réussi, sans aucune récidive inflammatoire encore constatée quatre ans plus tard. Cela a confirmé notre idée que les cellules souches mésenchymateuses ont un effet anti-inflammatoire et trophique, facilitant une réparation tissulaire endogène. Depuis, trois autres patients ont été traités de la même façon, avec le même succès.
Un article publié en 2008 a démontré que l’injection au niveau de lésions cutanées chez l’animal d’un « milieu de culture » dans lequel ces cellules ont relargué des facteurs de croissance, favorise la cicatrisation, tout autant que l’injection de ces cellules elles-mêmes. Essayant in vitro d’activer la production de facteurs de croissance par ces cellules, nous avons démontré qu’elles déployaient un schéma de production de ces facteurs, spécifique à chaque mode d’activation. Nous avons confirmé chez la souris que l’administration sur la brûlure radio induite de facteurs produits par ces cellules suffit à diminuer significativement la taille des lésions par rapport aux souris non traitées ou traitées avec des cellules « fraîches ». C’est la preuve que ce sont bien les facteurs de croissance qui sont efficaces, plus que les cellules elles-mêmes par leur différenciation.
Pour les brûlures thermiques profondes de grande étendue, évoquées par Michèle Martin, on recourt aujourd’hui à des greffes d’épiderme autologues. On pratique des biopsies dans des zones riches en follicules pileux, de façon à obtenir le maximum de kératinocytes souches, pour les isoler, les cultiver et obtenir de grandes surfaces d’épiderme greffable. Le problème aujourd’hui est que cette technique, si elle permet de sauver de grands brûlés, ne permet pas de régénérer le derme, si bien que les patients conservent des cicatrices effroyables et ne peuvent pas supporter le moindre frottement sur leur peau, ce qui les oblige à porter en permanence des sous-vêtements compressifs. Cela tient à l’immaturité de la jonction dermo épidermique. Nous nous intéressons donc au moyen de reconstituer une peau totale, avec derme et épiderme.
Notre idée est d’associer à l’épiderme de culture un derme avec une matrice extra cellulaire contenant différentes fractions de différents types de cellules souches, cellules souches mésenchymateuses de la moelle osseuse, cellules souches issues de la gencive et de tissus périnataux. Travaillant en collaboration avec le laboratoire de Michèle Martin et le laboratoire L’Oréal, nous espérons obtenir rapidement une application thérapeutique. Compte tenu de l’extrême difficulté de produire en urgence des cellules souches mésenchymateuses injectables de grade clinique, surtout pour des greffes autologues, nous avons dû mettre au point en laboratoire des conditions de culture spécifiques permettant d’obtenir très vite un très grand nombre de ces cellules souches mésenchymateuses. Il s’agit là d’une véritable course contre la montre.
Nous réfléchissons à une autre source de cellules souches mésenchymateuses, allogéniques cette fois, issues en particulier de la paroi du cordon ombilical et de la membrane placentaire (gelée de Wharton). Diverses expériences préliminaires montrent qu’à partir de ces tissus néonataux, il est possible d’isoler des cellules souches mésenchymateuses ayant des propriétés identiques à celles de la moelle osseuse en matière de production de facteurs de croissance et même supérieures en matière de prolifération, présentant de surcroît de par leur « naïveté », d’intéressantes propriétés immunologiques.
M. Alain Claeys, rapporteur. Je vous remercie de cette présentation. Y a-t-il des questions ?
M. Marc Peschanski. Les recherches sur les cellules souches embryonnaires et sur les cellules souches adultes ne s’opposent pas et ne doivent pas être opposées. Notre objectif est de parvenir à refaire à partir de cellules souches embryonnaires, ce que ces équipes sont depuis longtemps capables de faire à partir de kératinocytes souches prélevés sur donneurs. L’intérêt des cellules souches embryonnaires, c’est qu’on peut les fabriquer en laboratoire, en s’affranchissant totalement de la disponibilité des donneurs. C’est en quelque sorte un outil industriel. Nous visons à obtenir par ce biais de l’épiderme et du derme, éventuellement en mélangeant les deux techniques pour obtenir rapidement une peau totale greffable chez les patients. Ces recherches sont intriquées.
M. Jean-Jacques Lataillade. La thérapie cellulaire sur grands brûlés demeure exceptionnelle. À l’hôpital Percy, qui est pourtant un centre de référence en Europe, nous ne traitons ainsi pas plus de deux à trois patients par an.
M. Jean-Sébastien Vialatte, rapporteur. Les cellules issues du cordon ombilical sont-elles assez « naïves » pour être utilisables de façon allogénique ? Si oui, cela ne nous créerait-il pas obligation de constituer des banques ?
M. Jean-Jacques Lataillade. La littérature fait état de données sur cette « naïveté ». Cela demande à être confirmé, nous travaillons sur le sujet pour obtenir des précisions.
M. Arnaud de Guerra, responsable de l’unité de recherches à la direction médicale et scientifique de l’Agence de la biomédecine. Je suis vraiment désolé, Monsieur Sahel, que vous ayez eu des difficultés à obtenir des prélèvements de tissus post mortem, dans la mesure où le protocole de recueil est très précisément défini dans la loi de bioéthique de 2004, complétée par un décret de 2007. Il n’est besoin que d’une déclaration à l’Agence de la biomédecine. La procédure a été très simplifiée. Le seul impératif est que la récupération des tissus n’interfère pas avec la greffe thérapeutique.
M. José-Alain Sahel. Je suis heureux d’apprendre que tout cela a été simplifié, car ce que nous vivons au quotidien dans les laboratoires est moins simple.
M. Alain Claeys, rapporteur. Notre réunion est donc utile.
Mme Michèle Martin. Monsieur Lataillade, progresse-t-on dans la compréhension des facteurs (cytokines, facteurs de croissance et autres) qui permettent à des cellules souches mésenchymateuses d’accélérer la cicatrisation ? Ce serait important notamment pour dériver à partir d’iPS des cellules présentant les mêmes caractéristiques.
M. Jean-Jacques Lataillade. Nous menons actuellement un important programme de recherche, conjointement avec l’Institut de sûreté et de radioprotection nucléaire, sur des modèles animaux, et nous progressons. C’est en effet important pour l’avenir.
M. Jean-Sébastien Vialatte, rapporteur. Si j’ai bien compris, vous utilisez « le bouillon de culture » produit par ces cellules souches mésenchymateuses plutôt que ces cellules elles-mêmes ?
M. Jean-Jacques Lataillade. C’est ce que nous étudions chez l’animal. Chez l’homme, nous avons étudié les cellules « fraîches ». Mais notre idée est en effet de nous intéresser aux substances fabriquées par la cellule plus qu’à la cellule elle-même.
Mme Laure Coulombel. La terminologie ayant son importance, il convient de lever une ambiguïté : quelle définition exacte donnez-vous au terme « souche » dans l’expression « cellule souche mésenchymateuse » ? C’est troublant. Il faut bien distinguer une cellule souche embryonnaire, capable de se différencier in vivo en un tissu, et une cellule souche mésenchymateuse dont il n’est pas certain qu’elle survive bien longtemps après avoir délivré ses facteurs trophiques.
M. Jean-Jacques Lataillade. Vous avez raison, utiliser les termes « cellules souches mésenchymateuses » est sans doute un abus de langage. Ces cellules meurent en effet très vite au site d’injection. C’est d’ailleurs en mourant qu’elles exercent leur effet paracrine et libèrent leurs substances. Il vaudrait peut-être mieux ne pas les appeler « cellules souches ».
M. Jacques Remacle, conseiller scientifique à la direction générale de la recherche, unité génomique et systèmes biologiques, de la Commission européenne. Si vous ne traitez par ces techniques que deux ou trois grands brûlés par an, est-ce pour des raisons techniques ou financières ? Quel e peut en être l’impact sur la société ? Peut-on espérer que la recherche rende ces traitements plus accessibles, notamment sur le plan financier, pour les patients ou pour notre système de sécurité sociale ?
M. Jean-Jacques Lataillade. Le traitement des grands brûlés par autogreffe d’épiderme se heurte clairement à un problème de coût aujourd’hui. À Percy, nous faisons réaliser nos cultures d’épiderme par une société américaine car actuellement ses produits sont les plus efficaces.
M. José-Alain Sahel. Les difficultés que nous avons rencontrées pour obtenir des prélèvements de tissus post mortem nous ont conduits à réorienter nos recherches, et c’est d’ailleurs ainsi que nous avons découvert l’effet paracrine. Un obstacle sur une voie permet parfois de découvrir d’autres voies !
M. Marc Peschanski. La question du coût est très importante. S’il a été possible de traiter de très grands brûlés par thérapie cellulaire, c’est que les patients concernés étaient peu nombreux. D’une manière générale, la plupart des indications de thérapie cellulaire expérimentale ces quinze ou vingt dernières années concernaient très peu de patients, car on ne pouvait pas faire plus avec les moyens disponibles. Aux problèmes techniques d’accès aux cellules, s’ajoutait un problème économique et logistique, totalement insoluble.
Depuis une vingtaine d’années, l’arrivée des protéines thérapeutiques s’est traduite par un investissement considérable au niveau industriel qui a permis d’élargir les indications envisageables pour ces médicaments, dont le prix demeure élevé, comme celui de tous les produits issus de biotechnologies, mais qui va néanmoins diminuant au fur et à mesure des économies d’échelle et devient accessible à nos systèmes de santé pour des pathologies lourdes, jusqu’à présent sans traitement.
La médecine régénératrice par thérapie cellulaire pourra se pratiquer à grande échelle, à condition de mener un double travail : scientifique tout d’abord, d’industrialisation ensuite. Ce n’est qu’ainsi qu’on pourra passer du traitement de quelques dizaines de grands brûlés par an à celui de plusieurs millions de malades atteints de diabète ou de drépanocytose, dont les lésions cutanées altèrent profondément la qualité de vie.
Mme Michèle Martin. Ces applications thérapeutiques des cellules souches mésenchymateuses sont très intéressantes. Mais une fois qu’elles circulent dans le corps, les cellules souches, qu’elles soient hématopoïétiques ou mésenchymateuses, y sont attirées aussi bien par les sites de lésions à réparer que par les tumeurs. Comment remédier à cette difficulté ?
M. Jean-Jacques Lataillade. C’est en effet un problème important à prendre en compte. Nous sommes vigilants.
M. Alain Claeys, rapporteur. Je vous remercie de ces précisions. M. Jacques Caen, qui est professeur émérite des universités, membre de l’Académie nationale de médecine et de l’Académie des technologies, a maintenant la parole.
M. Jacques Caen, professeur émérite des universités, membre de l’Académie nationale de médecine et de l’Académie des technologies. En 2008, l’Académie de médecine m’a chargé, avec Jean-Noël Fiessinger, d’examiner si les cellules souches pouvaient avoir un avenir dans le traitement des pathologies cardio-vasculaires. Lors d’une réunion en mars 2009, en présence de Philippe Menasché et Joseph Emmerich de l’hôpital Georges-Pompidou, quelques résultats nous ont été communiqués relatifs à des pathologies vasculaires périphériques. Mais force a été de constater qu’ils n’étaient pas nombreux. À cette réunion, assistaient également Laure Coulombel et Georges Uzan qui avaient travaillé sur les cellules vasculaires du sang de cordon ombilical. Dans le dernier exposé, qui ne fut pas le moindre, l’un de mes anciens élèves qui avait travaillé huit ans à l’Institut des vaisseaux et du sang à Lariboisière puis était retourné en Chine, nous a expliqué que dans la gelée de Wharton, c’est-à-dire dans le cordon ombilical lui-même, et non dans le sang de cordon, il y avait des cellules souches mésenchymateuses, en tout cas à coup sûr des cellules mésenchymateuses, qui pouvaient être utilisées en pathologie cardio-vasculaire.
Après nous être rendus, avec Jean-Jacques Lataillade, en Chine où nous avons vu des diabétiques traités par ce type de cellules dans un important hôpital militaire de Shanghai, nous nous sommes demandés si la technique serait transposable en France.
Nous avons alors constitué un groupe de travail associant Pierre Jouannet, Jean-Pierre Cazenave, Alexandre Mignon et Georges Uzan. Nous avons entendu divers spécialistes, parmi lesquels Eliane Glückman, qui avait été, en 1988, la première à greffer des cellules de sang de cordon à un patient atteint de la maladie de Franconi. À partir de cela, l’Académie a adopté hier les recommandations que je vous livre.
« Considérant que les résultats déjà obtenus dans l’étude des cellules souches du cordon permettent de conclure que cette voie de recherches est très prometteuse et susceptible de fournir un nouvel outil utile dans le traitement de nombreuses maladies, l’Académie préconise
- de promouvoir les recherches sur les cellules souches mésenchymateuses du cordon et du placenta, tant dans le domaine fondamental que préclinique ;
- d’organiser la collecte, la conservation, la distribution des cordons, des placentas et de leurs dérivés, en créant des centres de ressources biologiques spécifiquement dédiés à ces missions ;
- d’informer largement les parents dans les maternités de l’utilité du don de cordon et de placenta pour poursuivre et amplifier la recherche sur les cellules souches humaines avant de leur demander l’autorisation de procéder à la collecte. »
Il nous semblait déjà alors temps de conduire des recherches très sérieuses dans ce domaine. Je ne rapporterai pas, pour ma part, de résultats, me contentant de citer un article publié en décembre 2009 par Bruno Péault, chercheur français qui travaille aux États-Unis, indiquant qu’il existe dans le cordon ombilical des milliards de cellules assez bien caractérisées, au phénotype stable, possédant une importante capacité de prolifération et indépendantes du système HLA, ce qui ouvre une perspective de greffes allogéniques. Cela n’a pu que nous conforter dans l’idée qu’il fallait mener des recherches approfondies dans ce domaine. En tant qu’hématologue, j’ai moi aussi étudié dans mon laboratoire le cordon ombilical, notamment les cellules de sa paroi veineuse.
Dès 1973, nous avons étudié des cultures de cellules endothéliales. Puis sont venues les premières greffes de sang de cordon en 1988, ensuite en 2009 les découvertes concernant la gelée de Wharton. Dans ce contexte, je ne vois aucune contre-indication à ce qu’on essaie de développer les recherches sur les cellules mésenchymateuses de cordon ombilical et de placenta, aujourd’hui jetés comme déchets.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie de cette présentation. M. Charles Durand qui est maître de conférences des universités et directeur de la formation doctorale en biologie des cellules souches à l’université Paris VI a maintenant la parole.
M. Charles Durand, maître de conférences des universités, directeur de la formation doctorale en biologie des cellules souches à l’université Paris VI. Ma présentation, intitulée « Des cellules souches pluripotentes à l’embryologie humaine et vice versa », est le fruit des échanges passionnants et passionnés que j’entretiens avec deux collègues et amis, le Dr Vincent Mouly et le Dr Thierry Jaffredo. Notre problématique concerne à la fois les cellules souches embryonnaires, dont la pluripotence est naturelle, les cellules iPS, dont la pluripotence est induite, et l’embryon humain. Ces trois champs de recherche soulèvent des problèmes différents, mais il faut travailler dans les trois pour espérer parvenir à modéliser le développement embryonnaire, cribler les nouvelles molécules thérapeutiques, pratiquer les tests de toxicité indispensables et, éventuellement, utiliser des cellules dérivées de cellules souches embryonnaires ou de cellules iPS en thérapie cellulaire. Dans le cas des premières, il faut étudier les mécanismes impliqués dans la pluripotence ; dans le cas des secondes, ceux impliqués dans la reprogrammation.
Il est essentiel de soutenir en amont tous les efforts de recherche afin de comprendre les mécanismes de différenciation cellulaire tels que ceux observés au cours du développement embryonnaire. Il faut donc laisser cohabiter et interagir le plus possible, ces trois modèles, de l’amont des recherches cognitives jusqu’à l’aval des développements thérapeutiques. Il faut également prendre en considération les limites chez l’homme de l’extrapolation du modèle animal.
Je prendrai l’exemple de mon sujet privilégié de recherche, qui est de comprendre l’origine chez l’embryon des cellules souches du sang qui, chez l’adulte, s’auto-renouvellent et sont capables de donner naissance à toutes les cellules sanguines. Si elles se trouvent dans la moelle osseuse, ce n’est pas là qu’elles sont produites par l’embryon. Sur un embryon de souris à mi-gestation, soit 11 jours sur 21, alors que celui-ci est encore dans son sac vitellin, on distingue une petite région qui contient l’aorte.
On sait de manière certaine que c’est là qu’apparaissent les premières cellules souches du sang qui iront coloniser le foie fœtal puis la moelle osseuse. La manifestation physiologique de cette émergence, aussi bien chez l’embryon de souris que chez l’embryon humain, est l’apparition de petits foyers, de bourgeonnements de cellules rondes sur la paroi ventrale de l’aorte. Ce qui suscite de nombreuses recherches aujourd’hui est de comprendre les facteurs de l’environnement (niche, cellules stromales) qui permettent de soutenir l’émergence de ces premières cellules souches du sang et régulent leur activité.
De telles recherches sont essentielles pour deux raisons. La première est qu’une fois prélevées, les cellules souches du sang issues de la moelle osseuse meurent très vite. Le Graal pour les hématologues, dans le cadre des protocoles de transplantation, est de parvenir à amplifier ex vivo ces cellules souches hématopoïétiques, ce qui, à ce jour, demeure particulièrement délicat.
La seconde raison est qu’il est impossible à ce jour de dériver des cellules souches transplantables, capables de reconstituer le système hématopoïétique, à partir de cellules souches embryonnaires ou d’iPS. Nous pensons que, si on parvenait à découvrir les mécanismes moléculaires impliqués pendant le développement embryonnaire dans l’émergence et l’amplification des cellules souches hématopoïétiques, cela aurait des répercussions transversales sur la culture et la différenciation des cellules souches embryonnaires comme des iPS en cellules souches du sang.
Autre point important : il ne faut jamais perdre de vue qu’on ne peut pas extrapoler à l’homme les données recueillies sur la souris. Il est donc impératif de conduire des recherches sur les cellules embryonnaires humaines et l’embryon humain.
Enfin, ne négligeons jamais le principe de «fortuité », à savoir qu’on peut découvrir par hasard, par chance ou accident, quelque chose d’important qu’on ne cherchait pas. Il est impossible de prévoir le résultat d’une expérience et toute recherche peut aboutir à des résultats un jour exploitables. Après le débat lancé en son temps en Grande-Bretagne lors de la naissance de Dolly, la première brebis clonée, dont le Pr Ian Wilmut était le « père » scientifique, s’est engagé aujourd’hui un débat sur les cybrides, produits du transfert d’un noyau de cellule somatique humaine dans un ovocyte énucléé d’animal. Cette dernière expérience a suscité un débat vigoureux outre-Manche, ce qui fait cruellement défaut en France. Dans le cadre de la révision des lois de bioéthique, il serait sans doute intéressant de diffuser plus largement l’information sur tous ces sujets et de lancer des débats citoyens, de façon que chacun puisse, en connaissance de cause, s’exprimer.
M. Alain Claeys, rapporteur. Il y a eu un début de commencement de débat citoyen avec les États généraux de la bioéthique. Le rapporteur de la Mission d’information sur la révision des lois de bioéthique recommande l’organisation de tels débats, proposition à laquelle Jean-Sébastien Vialatte et moi-même souscrivons totalement. Mais il faut être très prudent sur ce qu’on entend par « débat citoyen ». Un débat citoyen s’organise, exige une méthode et une durée suffisante. Au Royaume-Uni, l’équivalent de notre Agence de la biomédecine organise opportunément tout au long de l’année de tels débats citoyens.
Il ne faut pas non plus que ces débats prennent le pas sur l’expression de la représentation nationale, faisant fi de la démocratie représentative. Une dérive vers de purs débats d’opinion serait extrêmement dommageable. Il faut trouver un juste équilibre. Et s’il est vrai que le débat citoyen devrait être plus développé en France, la presse a aussi son rôle à jouer. La presse écrite le joue bien.
Cependant je suis effaré par ce qu’on entend parfois à la télévision ou à la radio – je pense notamment à la façon dont ont été présentés hier soir au journal télévisé de France 3, les travaux du professeur Etienne-Emile Beaulieu sur une fameuse protéine « anti» Tau. Je ne les remets nullement en cause mais dans la mesure où les malades potentiellement concernés sont très nombreux, il faut faire preuve de la plus grande prudence et veiller à ne pas susciter de faux espoirs. Certes, il était dit dans le reportage qu’il faudrait « encore un peu de temps » mais on laissait clairement entendre qu’un traitement avait été trouvé pour la maladie d’Alzheimer ! Les chercheurs, les politiques et les journalistes doivent réfléchir ensemble à la bonne manière de travailler.
Mme Laure Coulombel. Je m’interroge sur l’utilisation des cellules « souches » mésenchymateuses. Celles-ci ont en effet été dérivées de moelle osseuse ou de sang de cordon depuis maintenant quelques années. Mais peuvent-elles avoir une utilisation thérapeutique ? Peuvent-elles contribuer, ne serait-ce que chez l’animal, à la construction d’un tissu fonctionnel ? Des expériences probantes ont-elles été réalisées ? J’ignore où en sont les recherches en Chine depuis 2004. Je suis pour ma part, perplexe quant à l’intérêt thérapeutique de ces cellules souches mésenchymateuses, je ne mentionne pas leurs propriétés trophiques, avérées, dont a parlé Jean-Jacques Lataillade.
M. Jacques Caen. C’est la question centrale que nous nous posons. Les cellules mésenchymateuses du sang sont-elles équivalentes aux cellules mésenchymateuses de la moelle osseuse ou de la gelée de Wharton ? Je l’ignore. Je dois me rendre en Chine en mars et rencontrer le ministre de la santé chinois, qui est l’un de nos anciens élèves du CHU Saint-Louis/Lariboisière. Il me dira exactement où on en est concernant les cellules, je ne dis plus « souches » mésenchymateuses de la gelée de Wharton. Les études faites me semblent correctes, mais il existe encore peu de publications. Nous ignorons si elles sont strictement équivalentes.
M. Pierre Jouannet. Bien qu’ayant participé au groupe de travail animé par Jacques Caen, je ne suis pas, comme Laure Coulombel, un spécialiste des cellules souches, mais je ne comprends pas très bien pourquoi elle émet des doutes, sinon une suspicion, chaque fois que l’on mentionne les cellules souches mésenchymateuses. Ces cellules souches mésenchymateuses, issues non pas du sang de cordon mais de la paroi du cordon, ont fait et font l’objet de nombreuses recherches fondamentales, peut-être discutables, néanmoins il semble que l’on s’accorde à juger que la paroi du cordon présente un très grand intérêt en raison de la grande quantité de matériel à partir duquel procéder à des différenciations cellulaires. Alors qu’à partir du sang de cordon, on a seulement une chance sur trois d’obtenir des cellules souches mésenchymateuses susceptibles de se différencier, à partir de la paroi du cordon un très grand nombre de cellules auraient cette potentialité.
Ces cellules présenteraient également l’avantage d’être mieux tolérées sur le plan immunitaire grâce à l’absence d’antigènes HLA. Des questions demeurent certes à régler, comme pour toutes les autres cellules souches, en termes de stabilité, de sécurité et de capacité de différenciation. A-t-on déjà apporté la preuve que les iPS, qu’on évoque tant, pourraient être utilisées en thérapeutique ? Pas que je sache, et les recherches se poursuivent activement dans ce domaine. Pour les cellules souches mésenchymateuses, on n’est pas au même stade de la recherche, mais il existe incontestablement un potentiel.
Une publication rapporte que, grâce à l’injection de cellules souches mésenchymateuses du cordon chez des souris aveugles, on a pu obtenir que des cellules se différencient en cellules de cornée, permettant de rétablir, au moins partiellement, une vision chez ces animaux. Une publication récente annonce, d’autre part, que des cellules souches mésenchymateuses du cordon ont pu être différenciées en cellules s’apparentant à des cellules germinales. Il y a certes encore loin de là à considérer qu’on pourra fabriquer un jour des spermatozoïdes ou des ovocytes à partir de ces cellules. Mais pourquoi refuser a priori les recherches sur ces cellules souches mésenchymateuses ? Le doute et l’esprit critique font partie de la démarche scientifique mais je ne comprends pas pourquoi vous êtes si dubitative sur ces cellules là particulièrement…
Mme Laure Coulombel. Je doute tout autant des possibilités d’utilisation thérapeutique des iPS et je souhaite que les recherches soient conduites de manière équivalente dans toutes les voies. Mon doute sur les cellules mésenchymateuses provient du fait qu’on a pu lire que des cellules mésenchymateuses de la moelle osseuse, dont je ne suis pas certaine qu’elles diffèrent fondamentalement des cellules souches issues de la gelée de Wharton ou du sang de cordon, avaient pu se différencier en neurones, en cellules pancréatiques, en cellules ayant une fonctionnalité tissulaire déterminée.
Sur la différenciation de cellules souches mésenchymateuses en cellules à fonctionnalité tissulaire précise, ma prudence naturelle me pousse à dire que l’efficacité clinique in vivo n’est peut-être pas absolument démontrée. On peut obtenir une expression de marqueurs tissulaires dans une boîte de Pétri ou chez la souris pendant quelques jours ou quelques semaines, qui ne peut pas nécessairement être extrapolée pour une utilisation chez l’homme.
Je ne mets pas en doute en revanche les propriétés trophiques ou immuno modulatrices des cellules souches mésenchymateuses, mais il s’agit d’une tout autre application clinique puisque les cellules ne sont pas ici greffées et ne perdurent pas dans l’organisme. Il est très difficile pour la presse et les non-spécialistes, le public de s’y retrouver. C’est pourquoi, concernant les divers types de réparation tissulaire, il convient de distinguer nettement ce qui est possible in vitro de ce qui l’est fonctionnellement in vivo.
M. Pierre Jouannet. Nous sommes d’accord et l’Académie nationale de médecine est du même avis, soulignant dans son rapport que ne sont envisageables aujourd’hui que des recherches fondamentales et précliniques. Mais pour pouvoir développer des recherches sur les cellules du cordon, il faut disposer de cordons, donc en organiser la collecte dans les maternités, dans des conditions techniques, médicales et éthiques satisfaisantes.
Mme Emmanuelle Prada-Bordenave. Je ne devrais pas prendre part à ce débat entre scientifiques, mais je souhaite faire observer que l’on ne peut pas faire totalement abstraction de l’écho que le rapport de l’Académie de médecine aura inévitablement dans le grand public. L’Agence de la biomédecine ne peut que se réjouir de toute recherche permettant d’envisager, à plus ou moins long terme, un recours plus large aux thérapies cellulaires. Mais nous savons tous que le combat a été rude ces derniers mois, autour de la seule thérapie cellulaire développée à large échelle dans notre pays à savoir, la greffe de cellules hématopoïétiques, pour éviter dans les maternités le démarchage commercial de certaines sociétés étrangères à but lucratif, opérant au nom d’intérêts scientifiques et dans des conditions sanitaires inacceptables chez nous. La ministre de la santé a dénoncé sans ambiguïté ces pratiques, tant devant la Mission d’information sur la révision des lois de bioéthique que vous présidiez, Monsieur Claeys, qu’au Sénat en novembre dernier. Je tiens à le mentionner car si je ne le faisais pas, on pourrait me le reprocher.
Nous sommes totalement d’accord avec le professeur Caen et le professeur Jouannet : il faut que des recherches fondamentales puissent être conduites dans tous les domaines, mais il ne faudrait pas qu’au prétexte de l’intérêt de certaines recherches, les jeunes mamans soient sollicitées de façon agressive dans les maternités par des sociétés commerciales. Les outils juridiques actuels sont suffisamment robustes ; ils assurent aux chercheurs les ressources biologiques dont ils ont besoin, grâce notamment aux prélèvements de tissus effectués à l’hôpital. Si des problèmes demeuraient, il faudrait nous les signaler afin que le législateur y remédie mais, en l’état, il n’existe aucune justification au démarchage des jeunes mères, en leur faisant miroiter des promesses encore bien lointaines.
M. Hervé Chneiweiss. On pourrait être tenté de dire : « Peu importe le flacon, pourvu qu’on ait l’ivresse », en l’espèce, pourvu que l’on parvienne à mettre au point une thérapeutique. Cependant, s’il faut mener des recherches sur toutes les thérapies cellulaires, en espérant que toutes marchent, il faut se garder de parler de traitements par les cellules souches, de thérapies fussent-elles opérées à partir de cellules ayant des capacités de différenciation comme semblent en avoir les cellules mésenchymateuses, qu’elles soient issues de la moelle osseuse ou du cordon.
Les cellules souches ont la capacité de se différencier et de s’auto-renouveler, cette dernière propriété étant visiblement difficile à mettre en évidence pour les cellules mésenchymateuses une fois celles-ci extraites de leur milieu. Il existe la même controverse autour des cellules souches tumorales. Dans certaines tumeurs, comme les glioblastomes, on retrouve régulièrement des cellules présentant ces deux caractéristiques des cellules souches. Or il a été démontré que, s’il était possible d’extraire de toutes les tumeurs de l’enfant des cellules capables de se différencier, la capacité d’auto-renouvellement faisait défaut dans la plupart des cas ou bien s’épuisait au bout de quelques divisions. Cela signifie que nous sommes en face de deux mécanismes différents. Il est donc important, à la fois sur le plan scientifique et vis-à-vis du grand public, de ne pas assimiler toute multiplication et toute différenciation cellulaire aux propriétés d’une cellule souche. Mais il va de soi qu’il faut encourager la recherche sur la thérapie cellulaire, combinée à d’autres méthodes thérapeutiques, et bien entendu la plus large collaboration avec les chercheurs étrangers, en particulier chinois puisque ce domaine de recherche est en pleine expansion dans leur pays.
La discussion sémantique masque ici des questions scientifiques, et n’est d’ailleurs pas sans incidence sur nos conceptions, y compris de la plasticité du génome et de l’épigenèse de certaines cellules.
M. Jean-Sébastien Vialatte, rapporteur. Si j’ai bien compris, on ne peut probablement pas qualifier les cellules mésenchymateuses de cellules souches ?
M. Hervé Chneiweiss. Ceci est exact.
M. Jean-Sébastien Vialatte, rapporteur. M. Vincent Mouly, qui est directeur de recherches au CNRS, souhaite apporter des précisions.
M. Vincent Mouly, directeur de recherches au CNRS, Institut de myologie à l’hôpital de la Pitié-Salpêtrière. Le message délivré au public est extrêmement important, car nous sommes, nous, ensuite confrontés à la demande des patients, très forte quand on a suscité certains espoirs.
Je voudrais insister enfin sur un point auquel nous nous intéressons de plus en plus dans mon laboratoire, et dans de nombreux autres aussi sans doute. Il est certainement utopique de rechercher en thérapie cellulaire un type cellulaire parfait, répondant exactement au phénotype qu’on souhaiterait. L’exemple des cellules souches mésenchymateuses est éclairant. Il est important de disposer de cellules de grade clinique, pouvant communiquer entre elles et ensemble, de démultiplier leurs effets, y compris en associant thérapie cellulaire et thérapie génique. Cependant même au sein de la thérapie cellulaire seule, cette inflexion de perspective est importante.
Pour le muscle, organe sur lequel je travaille, il est évident que les progéniteurs musculaires sont inefficaces utilisés seuls en thérapie cellulaire. Or plusieurs études récentes montrent que les résultats peuvent être largement améliorés s’ils sont mélangés à d’autres types cellulaires comme des cellules souches mésenchymateuses de par leur effet paracrine, ou des cellules dites side population ou d’autres cellules de types tissulaires différents.
TABLE RONDE : QUELLE RÉGULATION ?
M. Jean-Sébastien Vialatte, rapporteur. Nous en arrivons à notre quatrième table ronde qui porte sur les régulations. Je donne la parole à M. Jean Claude Ameisen qui préside le comité d’éthique de l’INSERM, qui est membre du Comité consultatif national d’éthique et professeur des universités.
M. Jean Claude Ameisen, professeur des universités, président du comité d’éthique de l’INSERM, membre du Comité consultatif national d’éthique. Je m’exprimerai à titre personnel, ne pouvant préjuger de l’avis que rendra le Comité consultatif national d’éthique sur ce sujet.
Je voudrais d’abord aborder, dans le contexte de la loi relative à la bioéthique de 2004, la question de la recherche sur des cellules embryonnaires issues d’embryons humains détruits in vitro après avoir été créés dans le cadre de l’assistance médicale à la procréation (AMP).
La question éthique principale me semble se poser en amont de la recherche, et indépendamment de toute recherche : c’est la question de la destruction de l’embryon in vitro après sa création par fécondation in vitro (FIV) dans le cadre de l’AMP, lorsqu’il y a eu décision de ne pas le transférer dans le corps de sa mère. Je pense qu’il est important de se souvenir que cette question s’est posée longtemps, avant toute possibilité de recherche sur les cellules souches embryonnaires. Il y a, aujourd’hui, au moins trois circonstances dans le cadre de l’AMP qui vont conduire à une décision de ne pas transférer un embryon créé in vitro et par conséquent à sa destruction : la détection d’une anomalie majeure du développement in vitro; la détection au cours d’un diagnostic pré-implantatoire (DPI) de l’anomalie génétique familiale en cause dans une maladie actuellement incurable et d’une particulière gravité dont la recherche a motivé la réalisation du DPI; et enfin le cas des embryons surnuméraires, conservés par cryopréservation, pour lesquels il y a eu abandon du projet parental, et pour lesquels il n’est pas envisagé d’accueil d’embryon par un autre couple. Dans ces trois cas, il y aura destruction des embryons. Mais ce n’est pas l’éventuelle décision ultérieure de réaliser une recherche qui sera la cause de la destruction de l’embryon : la cause de la destruction de l’embryon est le fait qu’il ne sera pas transféré. La décision éventuelle de réaliser la recherche viendra donc après la décision de la destruction, et n’aura en rien influencé cette décision.
Or, la loi de 2004 me paraît présenter à cet égard une contradiction. La loi autorise, dans les trois circonstances que j’ai mentionnées, la destruction d’un embryon humain créé in vitro dans le cadre de l’AMP et qui ne sera pas transféré ; mais interdit, sauf dérogation, toute recherche sur des cellules isolées à partir de ces embryons détruits. En d’autres termes, c’est l’utilisation à visée de recherches de cellules issues de cet embryon après sa destruction qui constituerait une transgression majeure. L’interdit, semble donc concerner ici non pas la conduite – la destruction – mais le fait que cette conduite puisse ou non devenir source de recherche de connaissances nouvelles. Cette approche suggère que le refus de recherche de connaissances nouvelles à partir d’une conduite pourrait être considérée comme un garant rétrospectif du caractère éthique de cette conduite. Il me semble que cela pose un problème majeur en ce qui concerne la conception que notre société peut se faire des relations entre éthique et recherche.
Cette interdiction, sauf dérogation, de la recherche sur des cellules issues d’embryons humains détruits pour des raisons sans rapport avec l’éventualité d’une recherche a un caractère tout à fait exceptionnel : à titre de comparaison, la recherche sur des cellules issues d’embryons ou de fœtus détruits après interruption médicale ou volontaire de grossesse fait l’objet non pas d’une interdiction sauf dérogation, mais d’une autorisation. Et cette autorisation est sous condition non pas d’un consentement libre et informé du couple, mais d’une simple absence d’opposition de la mère. Plus généralement, le caractère exceptionnel de l’interdiction sauf dérogation de la recherche sur des cellules d’origine embryonnaire apparaît aussi dans le fait que cette interdiction concerne aussi les lignées de cellules d’origine embryonnaire déjà isolées et cultivées in vitro (par exemple, après une première recherche qui a été autorisée par dérogation et qui est maintenant achevée). L’interdiction sauf dérogation de toute recherche sur ces cellules déjà isolées et cultivées in vitro ne peut manquer de suggérer l’idée que c’est la recherche sur ces cellules qui présente, en elle-même, un caractère transgressif. Ce n’est le cas pour aucune autre lignée de cellule humaine, y compris des lignées de cellules d’origine fœtale.
Non seulement cette interdiction avec dérogation est de nature exceptionnelle, mais les conditions mêmes de la dérogation le sont aussi. La nécessité que le projet de recherche soit « susceptible de permettre des progrès thérapeutiques majeurs », par exemple, n’existe pour aucune autre recherche sur des cellules humaines. Il y a là l’idée que les seules recherches éthiquement acceptables seraient non pas les plus originales, celles qui posent, avec la plus grande qualité, les questions les plus importantes, mais celles dont on pense qu’on pourrait dès aujourd’hui prévoir les applications thérapeutiques. Pourtant, François Jacob a écrit qu’on peut « mesurer l’importance d’un travail scientifique au degré de surprise qu’il provoque. »
En conclusion, sur ce point, il me semble qu’on a voulu faire porter sur une éventuelle recherche qui débuterait après la destruction des embryons le poids d’une question éthique qui se pose en amont, et indépendamment de cette dernière : la question de la destruction des embryons. A partir du moment où cette destruction fait l’objet d’une autorisation sous conditions, il me semble qu’il devrait en être de même pour la recherche sur des cellules isolées après la destruction de ces embryons.
Je voudrais maintenant aborder, toujours dans le même cas des embryons créés dans le cadre de l’AMP, et pour lesquels il y a eu décision de destruction, la question de la recherche sur un embryon humain in vitro avant sa destruction. Cette recherche me paraît poser des questions éthiques autres, parce que toute entité vivante est toujours différente des éléments qui la composent. Pourtant, la loi de 2004 a considéré de la même manière, et soumis au même régime juridique la recherche sur les cellules issues d’un embryon après sa destruction et la recherche sur un embryon vivant avant sa destruction. Pour cette raison, probablement, parce qu’elle ne fait aucune différence entre des cellules et un embryon vivant en train de se développer, la loi n’a prévu aucune limite temporelle aux recherches qui pourraient être entreprises sur un embryon humain vivant avant sa destruction. De telles recherches pourraient donc a priori être poursuivies aussi longtemps que le développement d’un embryon in vitro est, ou sera à l’avenir techniquement possible. Rien dans la loi actuelle n’interdit cette éventualité. En revanche, la Grande Bretagne interdit la poursuite de toute recherche sur l’embryon après un délai maximal de quinze jours de développement in vitro de l’embryon, qui correspond au stade auquel apparaissent les premières cellules nerveuses. (La réflexion éthique en Grande Bretagne a été la suivante : parce que c’est l’arrêt de toute activité cérébrale détectable – la mort cérébrale – qui définit actuellement au niveau légal la mort, et donc la disparition, de la personne humaine, l’absence d’émergence de cellules nerveuses définirait l’absence de début de la personne humaine. On peut ne pas approuver ce raisonnement, mais l’important est qu’il conduit à imposer une limite temporelle au développement de l’embryon avant sa destruction). Il m’apparaît important qu’une limite temporelle maximale au développement in vitro de l’embryon avant sa destruction soit fixée par le législateur, étant donné qu’il me semble s’agir là d’une marque minimale de respect pour l’embryon en tant qu’être en devenir.
J’en viens à la question de la création d’embryons in vitro en dehors de l’AMP, à seules fins de recherche (qui est autorisée dans certains pays). C’est là me semble-t-il que se pose le problème éthique majeur : celui de la de réification de l’embryon humain.
Mais il y a un cas particulier qui me semble mériter attention : le souci éthique de ne pas créer un embryon in vitro à seule visée de recherche peut entrer en conflit avec un souci d’éthique médicale : celui d’agir au mieux pour éviter de faire courir un danger à un enfant à naître, dans le cadre de l’utilisation d’une nouvelle technique visant à améliorer l’AMP. Je pense que cette question, qui pose des problèmes éthiques complexes, mérite attention et réflexion.
Un dernier point : les avancées des recherches sur les cellules souches du corps adulte ont été présentées, de manière probablement un peu naïve, comme une réponse de nature scientifique aux problèmes éthiques posés par les recherches sur les cellules souches embryonnaires. En rendant l’impossible possible, les avancées de la science peuvent apporter des réponses à des problèmes éthiques, mais elles créent souvent aussi de nouveaux problèmes éthiques.
La révolution récente des recherches sur les cellules iPS (ou cellules souches pluripotentes induites) permettant la transformation de cellules du corps adultes, par exemple de cellules de la peau, en cellules aux propriétés semblables à celles des cellules souches embryonnaires pluripotentes, poseront peut-être à l’avenir des problèmes éthiques que l’on gagnerait à évoquer dès maintenant.
La dédifférenciation des cellules iPS s’interrompt actuellement au stade pluripotent, avant le stade totipotent qui peut donner naissance à un embryon. Mais rien, d’un point de vue scientifique n’interdit la possibilité que la dédifférenciation se poursuive jusqu’au stade de la cellule totipotente. Que conviendrait-il alors de décider, en matière d’autorisation ou d’interdiction des recherches ?
Un autre problème éthique est posé par des travaux récents qui suggèrent que l’on pourrait dériver des spermatozoïdes, et probablement des ovocytes, à partir de cellules iPS dérivées de cellules de la peau. Le seul moyen de savoir s’il s’agit vraiment d’un spermatozoïde ou d’un ovocyte serait de déterminer si ces cellules sont capables de fécondation, c’est-à-dire de participer à la création d’un embryon in vitro. Peut-on envisager de faire de telles recherches ?
Un problème additionnel est lié au fait que les chercheurs qui mènent ces travaux soulignent que l’intérêt médical potentiel de telles recherches est qu’elles pourraient permettre à des personnes stériles d’avoir des gamètes. Peut-on envisager de concevoir, par AMP, et de faire naître un enfant à partir de cellules de la peau d’un adulte ?
(De plus, se poserait le problème, comme pour le clonage reproductif, de la possibilité de créer un embryon, voire de faire naître un enfant, à partir de spermatozoïde et d’ovocytes dérivés à partir de cellules de peau d’une même personne.)
En 1994, alors que des lignées de cellules souches embryonnaires avaient été isolées depuis plus d’une dizaine d’années à partir d’embryons de souris, mais pas encore à partir d’embryons humains, le législateur n’avait pas estimé utile d’anticiper cette éventualité pourtant très probable, et avait interdit sans dérogation toute recherche sur les cellules embryonnaires humaines. En 1998, les cellules souches embryonnaires humaines ont été isolées. Et en 2004, la loi a été modifiée : l’interdiction a été transformée en interdiction sauf dérogation…
La société gagnerait probablement à s’inscrire dans une réflexion prospective qui lui donnerait le temps à la réflexion et permettrait aux débats de se développer en réduisant les effets de sidération, qui risquent d’entraîner soit une forme de panique, soit des réactions d’enthousiasme excessif et inapproprié.
M. Jean-Sébastien Vialatte, rapporteur. Je partage nombre de vos réflexions, mais je ne puis vous suivre en ce qui concerne la notion de limite temporelle, ni approuver votre parallèle entre l’embryon dépourvu de cellules nerveuses et l’être humain en état de mort cérébrale. Il est difficile de l’admettre de manière abrupte.
M. Jean Claude Ameisen. Je ne faisais qu’exposer la réflexion éthique conduite en Grande Bretagne pour souligner le problème causé, selon moi, par la confusion que fait notre législation entre la recherche sur les cellules isolées à partir d’un embryon détruit, et la recherche sur un embryon vivant qui se développe, avant sa destruction.
Il me semble important, d’un point de vue éthique, de considérer que ce n’est pas parce qu’on a autorisé la destruction d’un embryon surnuméraire, et qu’on a autorisé par dérogation une recherche sur cet embryon avant sa destruction (ce que la loi de 2004 prévoit), qu’on doit laisser cet embryon se développer in vitro sans aucune limite temporelle autre que celle que l’état d’avancement de la science permet (2 semaines, 1 mois, demain 3 mois peut-être ?) avant de le détruire. La notion de la limite temporelle oblige à penser le développement embryonnaire, et à penser qu’un embryon en développement ne peut être confondu avec une culture de lignées de cellules souches. Penser une limite temporelle, dans ce contexte, c’est pour moi l’expression minimale d’un respect pour l’embryon.
M. Jean-Sébastien Vialatte, rapporteur. Nombre d’entre nous, je pense, conviennent de la nécessité de retirer de la loi le mot « thérapeutique ».
S’agissant de l’utilisation des lignées cellulaires sans contrôle, doit-on selon vous s’abstenir d’en créer en se bornant à exploiter celles qui ont déjà été obtenues, en fermant les yeux sur les conditions d’obtention de ces lignées ?
M. Jean Claude Ameisen. La question des conditions d’obtention des lignées de cellules souches embryonnaires est pour moi la question éthique majeure. Mais à partir du moment où on autorise la destruction des embryons surnuméraires en cas d’abandon du projet parental ou au cours d’un DPI ; où le couple à l’origine de la création de l’embryon dans le cadre de l’AMP a librement autorise la recherche sur les cellules issues de cet embryon détruit ; et où on s’est assuré, comme pour toute recherche sur des cellules humaines, que cette recherche ne pose pas de problème éthique particulier, je ne comprends pas, sur un plan éthique, que l’on interdise la recherche sur ces cellules (même si cette interdiction comporte la possibilité d’une dérogation).
M. Alain Claeys, rapporteur. Au fond, vous reprochez au législateur et je partage ce point de vue, d’introduire une hiérarchie éthique parmi les différentes recherches autorisées. Cela peut avoir, en effet, une influence dévastatrice sur le grand public.
M. Jean Claude Ameisen. Je pense en effet que l’idée selon laquelle, pour des raisons éthiques, seule une recherche dont on croit déjà connaître les applications serait envisageable, et qu’une recherche dite fondamentale et cognitive ne le serait pas, pose un problème majeur qui a des conséquences sur la perception que la société peut avoir de la recherche, et des relations entre éthique et recherche.
M. Marc Peschanski. Jean Claude Ameisen a défendu brillamment un avis largement partagé dans la communauté scientifique et il l’a fait à l’adresse des auteurs du rapport de la Mission d’information du bureau de l’Assemblée nationale relative à la révision des lois de bioéthique, présenté la semaine dernière.
M. Alain Claeys, rapporteur. Ce rapport est le reflet de la position majoritaire des membres de cette Mission.
M. Marc Peschanski. Sans vouloir agresser personne, je considère que cette Mission a mal fonctionné en préservant des éléments qui ne correspondent en rien à ce qu’on attend d’une réflexion éthique et réglementaire dans ce pays. La loi continuera d’interdire toute recherche sur l’embryon pour aussitôt autoriser à la transgresser, par dérogation. Cela rend totalement illisible le rapport entre la société et la recherche puisqu’on transgresse une loi.
Les scientifiques ne peuvent plus travailler qu’en s’exposant en permanence à un questionnement éthique dont vous considérez par ailleurs qu’il n’a pas lieu d’être là où vous le posez. C’est plus que gênant : insupportable. Vous nous demandez d’explorer des terrains inconnus en nous chargeant de chaînes, vous nous permettez « quand même » de travailler, mais sous l’épée de Damoclès d’un questionnement éthique.
M. Alain Claeys, rapporteur. Je partage votre point de vue, mais la Mission du bureau n’a pas mal fonctionné : elle a choisi à la majorité de maintenir l’interdit, en ménageant une exception. Jean-Sébastien Vialatte et moi ne sommes pas d’accord avec cette position : nous considérons que, l’encadrement sur le vivant étant en France parfaitement satisfaisant, les recherches doivent être autorisées.
Cependant il faut mener la réflexion jusqu’au bout: certaines démarches peuvent poser des problèmes éthiques. Ainsi, en 2004, des propositions de loi ont été déposées en faveur du transfert nucléaire, ce à quoi je ne suis pas forcément hostile, mais, dans leurs exposés des motifs, leurs auteurs le justifiaient par les applications possibles dans le traitement des maladies d’Alzheimer et de Parkinson. Cela m’a autant choqué que les propositions du rapporteur de la Mission relative à la révision des lois de bioéthiques auxquelles vous faites allusion. Il convient d’être cohérent.
Il n’est pas convenable que des responsables politiques s’abritent à l’excès derrière le mot « thérapeutique ». Le terme a été utilisé à toutes les sauces, par des politiques, par certains chercheurs, par les médias, et c’est inadmissible, surtout quand on s’adresse à nos concitoyens malades. Il faut être vigilant : expliquer qu’il s’agit de recherche fondamentale, n’est pas dire un gros mot ! Il faut reconnaître la recherche fondamentale en tant que telle dans la loi.
M. Pierre Jouannet, professeur des universités, praticien hospitalier consultant en biologie de la reproduction à l’hôpital Cochin, membre de l’Académie nationale de médecine. Je soutiens ce qui vient d’être expliqué. Dans un État laïc, il est des considérations qui ne devraient pas avoir leur place quand on traite d’éthique, et nous en avons là une bonne illustration. Ce qui semble importer dans cette affaire est moins d’interdire ou d’autoriser que de culpabiliser. Le représentant de l’Église catholique, cité dans le rapport paru il y a quelques jours, a clairement affirmé que la recherche sur l’embryon ne pouvait être qu’une transgression. Autrement dit, tous ceux qui s’y livrent ne peuvent être, au mieux, que suspects et, au pire, coupables. Cet opprobre pèse de tout son poids et semble déterminer les choix de la société.
Je me souviens qu’au début des années quatre-vingt-dix, le rapporteur de la première loi de bioéthique au Sénat, que je rencontrerais pour m’entretenir avec lui de la procréation par don de sperme, m’a accueilli en me traitant de monstre, car pour lui, je promouvais l’insémination artificielle avec donneur anonyme! Il s’apprêtait néanmoins à défendre le projet qui prévoyait ce don de gamètes, ne pouvant faire autrement, mais il considérait que c’était très mal. Quand un législateur en est réduit à un tel comportement, quelque chose qui ne fonctionne pas bien dans notre démocratie. L’éthique, c’est opérer des choix. Les Italiens sont plus cohérents : ils se bornent à interdire. Cependant, si l’on considère que les recherches sur les embryons présentent un intérêt pour la santé publique, pour la société et pour les valeurs que l’on défend on ne doit pas culpabiliser les chercheurs en évoquant une transgression.
M. Jean-Sébastien Vialatte, rapporteur. Cela va même plus loin que ce que vous expliquez : c’est le législateur lui-même qui organise la transgression de ce qu’il a édicté, ce qui est facteur de complications !
M. Alain Claeys, rapporteur. Il est rare que le président d’une mission s’abstienne sur le vote du rapport et soit obligé de présenter une contribution, comme l’a d’ailleurs fait Jean-Sébastien Vialatte, car le clivage n’était pas politique. Nous croyions que ce problème de la transgression était derrière nous, mais il a ressurgi. Nous avons un combat difficile à mener.
M. Jacques Remacle, conseiller scientifique, direction générale de la recherche, unité génomique et systèmes biologiques, de la Commission européenne. Le problème est certainement idéologique et religieux. J’ai rencontré des scientifiques iraniens qui m’ont expliquer qu’ils pouvaient mener des recherches sur l’embryon parce que, en Iran, celui-ci n’est considéré comme un être vivant qu’à partir du moment où l’âme vient l’habiter. C’est la conception d’Aristote et ce fut celle de l’Église catholique jusqu’au concile Vatican I, en 1870. Ce n’est qu’alors qu’elle a modifié sa pensée et posé un dogme qu’elle refuse aujourd’hui de remettre en cause.
L’exemple américain doit nous conduire à être très prudent quand on légifère sur ce sujet. Pendant la présidence de Georges Bush, les recherches n’étaient autorisées et ne pouvaient être financées sur des fonds fédéraux que sur onze ou douze lignées de cellules souches embryonnaires. Aux termes de la loi adoptée depuis l’élection du Président Obama, ces recherches ne sont plus possibles sur ces lignées : la loi a été assouplie mais elle a introduit l’obligation de recueillir le consentement des donneurs ce qui n’avait pas été systématisé sur ces lignés. Prenons garde aux effets de l’alternance quand on veut poser des barrières éthiques !
M. Jean-Sébastien Vialatte, rapporteur. Ce n’est pas un problème de clivage politique gauche ou droite, en France, la position de l’Église catholique est aussi celle d’autres confessions.
Si il n’y a plus d’autre question je donne la parole à Mme Emmanuelle Prada-Bordenave, directrice générale de l’Agence de la biomédecine.
Mme Emmanuelle Prada-Bordenave, directrice générale de l’Agence de la biomédecine. L’Agence de la biomédecine n’étant qu’un établissement public de l’État, elle n’a pas vocation à prendre part à un débat préparatoire à l’élaboration d’une législation et elle n’a, non plus, aucune compétence pour apprécier la qualité d’une recherche. Son rôle défini par les articles L. 2151-5 et suivant du Code de la santé publique est de délivrer, pour une durée de cinq ans, des autorisations, par dérogation, pour l’utilisation à des fins de recherche de cellules issues d’embryons détruits.
C’est le législateur qui lui a assigné cette mission, également pour une période de cinq ans à compter du décret d’application de la loi de 2004, pris en date du 6 février 2006. J’appelle fortement votre attention sur ce point : sans modification de la loi, l’Agence de la biomédecine ne pourra plus accorder de nouvelles autorisations à partir du 5 février 2011, et tout s’arrêtera donc le 5 février 2016. Vos travaux revêtent donc un certain caractère d’urgence.
M. Alain Claeys, rapporteur. Nous le savons, mais nous ne maîtrisons pas l’ordre du jour. La ministre nous a annoncé que le projet de loi viendrait avant les vacances. S’il en était autrement, il faudra aviser.
Mme Emmanuelle Prada-Bordenave. Cela étant, nous pouvons délivrer des autorisations jusqu’au 5 février 2011, et nous inviterons les chercheurs à ne pas trop tarder.
L’Agence délivre des autorisations de recherches concernant l’embryon et les cellules souches embryonnaires. C’est la mission que lui a confiée le législateur Cependant, elle voudrait mettre en garde contre la tentation de la saisir ex ante dès qu’il est question de cellules souches au prétexte que la société y perçoit un risque (création cellules germinales, thérapie cellulaire). N’ayant pas de compétences en la matière, elle n’a pas vocation à surveiller ex ante tout un pan de recherches sur le vivant.
Autant elle a assumé loyalement la mission que lui a confiée le législateur en essayant de donner tout leur sens aux dispositions de la loi de bioéthique, autant elle refuse qu’au prétexte de la défiance manifestée par la société à l’égard de thérapies nouvelles, on se laisse aller à soumettre à autorisation préalable toutes les recherches susceptibles de présenter un risque éthique. Nos laboratoires, nos hôpitaux et nos instituts de recherche ont été dotés de comités de protection des personnes : c’est là que la réflexion éthique doit avoir lieu.
M. Alain Claeys, rapporteur. Nous en sommes bien d’accord : il ne faut pas, à travers vous, faire jouer le principe de précaution à tort et à travers.
Mme Emmanuelle Prada-Bordenave. Nous avons toujours travaillé, je crois, en bonne intelligence avec les chercheurs, en essayant d’entraver le moins possible leurs projets par des exigences purement procédurales. M. Arnaud de Guerra qui est responsable de l’unité de recherches à la direction médicale et scientifique de l’Agence de la biomédecine va vous exposer comment les choses se déroulent dans la pratique.
M. Arnaud de Guerra, responsable de l’unité de recherches, direction médicale et scientifique de l’Agence de la biomédecine. Je tenterai également de décrire les difficultés que nous avons rencontrées, dans l’espoir que vous, parlementaires, pourrez lever ces blocages.
Au cours de trois mois par an, janvier, mars et septembre, les chercheurs peuvent déposer des demandes dont la pertinence est examinée par un collège scientifique extérieur à l’Agence. Puis elles sont soumises pour avis au Conseil d’orientation, composé également de personnalités extérieures, avant que la directrice générale ne se prononce.
Aux termes de la loi, la durée totale de la procédure ne doit pas dépasser quatre mois. Les autorisations portent, bien sûr, sur le protocole de recherche, mais sont également requises pour l’importation ou l’exportation de lignées de cellules souches embryonnaires et de cellules et tissus embryonnaires ou foetaux, ainsi que pour leur conservation. Les autorisations d’importation ou de conservation ne peuvent être données qu’à des équipes titulaires d’une autorisation de protocole de recherche, ou ayant passé une convention avec une telle équipe. Une équipe souhaitant travailler sur des cellules importées doit donc déposer trois demandes, de façon simultanée.
Au total, depuis la loi de 2004, 48 protocoles de recherche ont été autorisés, étant précisé qu’une même équipe peut être titulaire de plusieurs autorisations. Celles-ci ont majoritairement été accordées à des laboratoires d’Île-de-France, l’institut I-Stem de Marc Peschanski n’y est pas pour rien, avec ses dix équipes. Ces protocoles concernent, pour cinq, des recherches sur le seul embryon ; pour cinq ou six, des recherches visant à dériver des cellules souches embryonnaires et, pour la majorité, des études sur les mécanismes de pluripotence et de différenciation de ces cellules. En outre, quelques-uns concernent des modélisations de pathologie, des screenings pharmacologiques, ou bien sont d’ordre plus technique. On compte en outre 39 autorisations d’importation, 20 autorisations de conservation, 11 autorisations de modification substantielle, 7 refus, 1 prorogation.
L’Agence a parfois été contrainte d’interpréter la loi pour lever certains blocages. C’est ainsi qu’elle a simplifié les procédures d’examen lorsqu’une équipe se voyait obligée, au bout d’un ou deux ans, de procéder à des modifications non substantielles de son protocole. Le régime des demandes d’importation a également été simplifié, le système de « fenêtres » se révélant excessivement contraignant en l’espèce. Le Conseil d’orientation a en outre émis un avis sur les règles de cession de composants cellulaires ou de cellules différenciées issues de cellules souches. Notre pratique au jour le jour nous a conduits à identifier plusieurs points sur lesquels il nous paraît nécessaire de faire évoluer la loi.
En premier lieu, mais je crois que tout le monde ici en conviendra, nous pensons qu’il n’y a pas grand sens à opposer recherche sur les cellules souches embryonnaires et recherche sur les cellules souches adultes, même si certaines pathologies doivent être traitées de préférence par les unes plutôt que par les autres. Or c’est un problème qui se pose à nous de façon récurrente, en raison de l’obligation qui nous est faite de vérifier, pour chaque protocole, qu’il n’existe pas d’alternative d’efficacité comparable. Cette contrainte oblige les chercheurs à prendre parti de façon artificielle, ce à quoi contribue aussi la pression médiatique, d’ailleurs. Nous proposons de ne plus opposer scientifiquement et dans les débats les recherches sur les CSEh et celles sur les cellules souches adultes. Tous les débats au sein de l’Agence et de ses instances plaident en faveur d’une synergie de ces deux types de recherche suivant la pathologie considérée.
M. Alain Claeys, rapporteur. On en a observé aussi l’effet dans l’affaire du transfert nucléaire, que j’évoquais tout à l’heure : il y a un engrenage éthiquement discutable qui conduit à abuser du terme « thérapeutique ».
Mme Emmanuelle Prada-Bordenave. Si la recherche sur l’embryon ou sur les cellules souches embryonnaires doit n’être que l’étape ultime d’une recherche, parce que la plus difficile et parce qu’elle suppose la maîtrise préalable de toutes les autres étapes, il appartient au collège d’experts scientifiques de vérifier l’absence d’alternative à ce stade. C’est peut-être à ce moment en effet qu’il y a un sens à demander aux chercheurs sur quoi ils ont travaillé. Mais il n’y en a pas à demander à chaque fois s’ils sont bien passés par la case « cellules adultes ».
M. Alain Claeys, rapporteur. Il est heureux que l’Agence de la biomédecine ait interprété de façon lucide la loi, mais je suis persuadé que nous serons unanimes pour supprimer cette disposition.
M. Arnaud de Guerra. En attendant, nous maintenons cette première proposition. La deuxième proposition tend à clarifier les règles qui concernent les cellules différenciées à partir de cellules souches embryonnaires. Il existe à cet égard une ambiguïté de la loi, qui utilise tantôt les termes de « cellules embryonnaires », tantôt ceux de « cellules souches embryonnaires ». Or une cellule différenciée à partir d’une cellule souche embryonnaire est une cellule embryonnaire, mais n’est plus une cellule souche embryonnaire. Il faut donc revoir les termes utilisés dans la loi et ne couvrir que les cellules souches embryonnaires. La question se pose de savoir s’il faut maintenir intégralement le régime d’autorisation pour utiliser ce type de cellules. De plus, leur définition scientifique, à partir de marqueurs membranaires ou géniques, est appelée à évoluer et à être révisée à intervalles réguliers. Le Conseil d’orientation, sur avis de scientifiques, a fait des propositions à ce sujet, qui ne relève d’ailleurs pas de la loi. Enfin, s’agissant toujours de ces cellules différenciées, rien n’a été prévu quant au régime d’autorisation des essais cliniques utilisant de telles cellules.
Avec nos collègues de l’AFFSAPS, nous avons élaboré une proposition prévoyant une autorisation de thérapie cellulaire délivrée par l’AFSSAPS avec avis de l’Agence de la biomédecine. Cette proposition a été envoyée au ministère de la santé, lequel n’a pas émis d’opposition pour l’instant, mais rien n’interdirait au législateur de se pencher sur la question, en tout cas pour clarifier les termes.
Mme Emmanuelle Prada-Bordenave. Comme le relevait le Pr Ameisen à l’instant, la loi est à peu près muette sur ce qu’on ne voyait pas venir en 2004. C’est le cas des essais cliniques. Il faudrait que le législateur précise maintenant le vocabulaire car, si on en est encore au stade de la recherche fondamentale, on va bientôt en arriver à l’aval, qui nécessitera un encadrement, soit que vous le fassiez rentrer dans le rang de la recherche biomédicale, soit que vous assigniez à ces recherches une orientation spécifique. Faute d’une clarification juridique, notre recherche risque d’éprouver des handicaps très sérieux.
M. Arnaud de Guerra. Il convient de faciliter l’échange des lignées de cellules souches embryonnaires entre les équipes françaises et les équipes étrangères. S’agissant de l’importation de cellules, nous proposons que ne soit soumise à autorisation que celles des lignées qui n’ont jamais été importées en France. En effet, on peut considérer que, pour les autres, le Conseil d’orientation a procédé à toutes les vérifications nécessaires quant aux conditions de leur obtention les exigences éthiques ayant déjà été vérifiées, une simple déclaration suffit. Pour l’exportation, l’article L. 2151-6 du Code de la santé publique dispose qu’elle est « subordonnée en outre à la condition de la participation d’un organisme de recherche français au programme de recherche international.». De l’avis général, cette disposition peu claire ignore totalement la pratique scientifique et peut conduire à limiter de façon significative la diffusion des travaux de recherche français (distribution de lignées, mais aussi publication).
En 2004, quand nous avons dû importer des lignées de cellules souches embryonnaires, les instituts de recherche étrangers qui nous les ont procurées n’ont pas demandé une collaboration avec nos laboratoires, ni le partage des résultats de nos recherches. Dès qu’elle est publiée, une lignée doit en effet être à la disposition de la communauté scientifique internationale et, même si les choses ne sont pas aussi simples, toute demande de communication venant d’une équipe étrangère doit recevoir satisfaction.
M. Alain Claeys, rapporteur. Pour être honnête, je dois avouer que la mission relative à la révision des lois de bioéthique n’a pas évoqué ce point.
Mme Emmanuelle Prada-Bordenave. En 2004, la France n’avait pas encore produit de lignées et l’on s’est donc contenté de poser un verrou, par mesure de prudence, pour éviter d’avoir, le jour venu, à mettre ces matériaux entre les mains de n’importe qui. Cependant la pratique scientifique mondiale est bien celle d’une mutualisation des connaissances et, aujourd’hui que nos laboratoires disposent notamment de lignées mutées d’un grand intérêt, cette disposition pourrait nuire à la réputation de nos équipes, alors même que le risque qu’elle était censée prévenir n’a guère de réalité.
M. Arnaud de Guerra. Quatrième difficulté à laquelle nous nous sommes heurtés et nous heurterons de plus en plus, les protocoles qui nous sont soumis ne sont pas que des protocoles de recherche. L’Agence a reçu des demandes d’autorisation pour des manipulations à caractère technologique dont la pertinence scientifique qui est une des conditions d’autorisation est difficile à établir. La nouvelle loi devrait donc faire une place à de tels projets de manipulation de cellules. Certains ont un caractère essentiellement technologique, concernant par exemple la sécurité virale des lignées. Ce problème se posera de façon de plus en plus aigüe à l’approche des premiers essais cliniques. Donc il faudra définir d’une manière plus large les projets contenant des manipulations de cellules souches embryonnaires, et les conditions de leur autorisation. Cinquièmement, il convient de définir plus précisément les conditions dans lesquelles le couple donneur consent à l’utilisation d’un embryon à des fins de recherche. La loi dispose que ce consentement peut être révoqué « à tout moment », ce qui n’apparaît guère réaliste : imaginez qu’il le soit au moment où l’on s’apprête à utiliser ces cellules en thérapeutique ! Il convient donc de limiter cette révocabilité. Nous proposons en outre que l’Agence de la biomédecine soit chargée d’émettre et de faire évoluer des recommandations sur ce sujet, en tenant compte de la pratique nationale et internationale.
Comme l’a indiqué Mme Prada-Bordenave, l’Agence n’a pas vocation à réguler tout un pan de la recherche. Cependant les recherches sur les cellules souches connaissent un développement très rapide faisant émerger des technologies imprévisibles quelques années à l’avance, et pouvant poser des problèmes éthiques.
Il est impossible de définir un cadre à l’avance sans bloquer aveuglément les recherches. En revanche, on pourrait conforter son rôle de veille et lui donner un rôle de donneur d’alerte. Au cas où elle détecterait au niveau mondial l’apparition de recherches susceptibles de poser un problème éthique, elle avertirait le législateur, à charge pour celui-ci de déterminer s’il doit ou non intervenir. Tel est le sens de notre sixième et dernière proposition.
M. Jean-Sébastien Vialatte, rapporteur. On a évoqué la nécessité d’un débat public, mais un débat parlementaire s’impose également, ne serait-ce que pour mieux informer nos collègues de ces questions. Et non seulement l’Agence doit avoir un rôle de veille éthique, mais j’ai aussi proposé dans ma contribution qu’elle soit entendue une fois par an, de façon un peu solennelle, soit par notre Office, soit par la commission compétente, afin qu’elle rende compte publiquement de cette mission, qu’on en débatte et que la presse puisse reprendre l’information.
Mme Laurence Brunet, juriste, chargée d’enseignement à l’Université Paris I-Panthéon-Sorbonne. Aux termes de l’article 16 du code civil, la loi « garantit le respect de l'être humain dès le commencement de sa vie », ce qui est d’ailleurs quelque peu en retrait par rapport à la loi Veil, où il était écrit : « dès le commencement de la vie ».
Je me demande si ce n’est pas l’existence de cet article qui a conduit le législateur de 2004 à ne pas traiter la question du statut de l’embryon et de la protection qui lui est due, ce qui serait pourtant indispensable, de l’avis de tous les juristes, et permettrait de répondre aux inquiétudes exprimées par une partie de la population, pour des raisons qui ne sont pas uniquement religieuses. Reconnaître la valeur symbolique et anthropologique de l’embryon, ce serait faire en quelque sorte application du principe de précaution. Peut-être faudrait-il modifier la rédaction de cet article 16, ou le changer de place.
M. Jean-Sébastien Vialatte, rapporteur. Je vous remercie de ces informations et suggestions. La parole est à M. Raymond Ardaillou, qui est secrétaire adjoint de l’Académie nationale de médecine et professeur de médecine.
M. Raymond Ardaillou, secrétaire adjoint de l’Académie nationale de médecine, professeur de médecine. Dès le mois de mai 2002, l’Académie nationale de médecine et l’Académie des sciences ont publié conjointement un communiqué de tonalité très libérale sur l’utilisation des cellules souches embryonnaires humaines en médecine régénératrice.
Elles approuvaient et encourageaient « l’utilisation thérapeutique des cellules souches extraites d’organismes adultes ou fœtaux». Elles donnaient leur accord à « l’obtention de lignées cellulaires à partir de blastocystes humains qui ne font plus l’objet de projet parental, dont la création de lignées de cellules souches », ainsi qu’à « la création de lignées cellulaires provenant de blastocystes humains obtenus par transfert intra-ovocytaire d’un noyau somatique », à condition que cette recherche soit encadrée pour éviter le trafic d’ovocytes ».
La direction générale de la santé ayant demandé à l’Académie nationale de médecine sa position sur la création de banques de sang de cordon autologue, j’ai rédigé en novembre 2002, la même année, avec Michel Bourel, un rapport adopté par l’Académie où nous nous prononcions contre la création de banques privées, mais en faveur du développement de banques de sang publiques pour greffes allogéniques extra et intra familiales. Nous proposions de favoriser la collecte de sang de cordon dans les maternités.
L’an passé, la Mission d’information de l’Assemblée nationale a auditionné le président et le secrétaire perpétuel de l’Académie nationale de médecine, MM. Lasfargues et Binet, qui n’ont guère traité des cellules souches, mais qui ont donné leur accord pour la levée du moratoire sur l’utilisation de cellules souches embryonnaires humaines, avec maintien du contrôle de l’Agence de la biomédecine, et ont eux aussi appelé à un développement des banques de sang de cordon. Les trois membres de l’Académie ici présents, MM. Jacques Caen, Pierre Jouannet et moi-même, nous sommes réunis avant cette rencontre pour définir une position commune dont je vais maintenant vous faire part, en précisant qu’il s’agit de notre opinion personnelle et qu’elle ne correspond pas obligatoirement à celle de l’Académie nationale de médecine.
Nous nous prononçons unanimement pour le maintien de l’interdiction des banques privées de sang placentaire autologue. Nous sommes en revanche favorables à la création de nouvelles banques publiques pour greffes allogéniques extra ou intra familiales, la France ne dispose que de 7 000 à 8 000 unités alors qu’il en faudrait 20 000. S’agissant des banques dites solidaires, nous sommes extrêmement réservés, il faut examiner les résultats à l’étranger. Une unité de sang de cordon suffit tout juste pour une greffe chez un enfant, en réserver une moitié pour un usage ultérieur serait se condamner à l’impuissance! Conformément aux exigences définies pour les centres de ressources biologiques, nous demandons que ces banques soient à visée à la fois, thérapeutique et de recherche, alors qu’elles se limitent actuellement au stockage.
S’agissant des prélèvements à des fins scientifiques de tissus embryonnaires ou fœtaux après interruption de grossesse, nous pensons qu’il convient de modifier le décret du 10 août 2007 et que l’Agence de la biomédecine devrait pouvoir autoriser tout protocole de recherche utilisant ces tissus, en réponse à une simple déclaration ; l’autorisation finale par le ministère de l’enseignement supérieur et de la recherche serait alors supprimée.
Quelles modifications apporter aux lois de bioéthique ? Pour les cellules souches embryonnaires provenant d’embryons surnuméraires ou non, transférables ou soumis à diagnostic préimplantatoire, il conviendrait de supprimer le régime dérogatoire et d’en autoriser l’utilisation à des fins de recherche, sous le contrôle de l’Agence de la biomédecine, en remplaçant l’expression « finalité thérapeutique » par celle de « finalité médicale ou scientifique » et en supprimant la référence à l’absence d’alternative. Il faudrait également supprimer les entraves à l’importation et à l’exportation de lignées en dérivant, et créer des centres de ressources biologiques dédiés à la collecte des embryons surnuméraires ainsi qu’à la culture, au stockage et à la distribution de cellules souches embryonnaires, avec constitution d’un réseau de banques locales ou d’une structure centralisée, sur le modèle de la UK Stem Cell Bank. Il apparaît nécessaire d’interdire les embryons transgéniques ou chimériques. En revanche, il convient de permettre la réimplantation dans l’utérus d’embryons ayant fait l’objet d’une recherche, après justification.
Pour ce qui est des cellules souches obtenues par transfert nucléaire dont les indications sont plus limitées depuis l’utilisation des iPS, le problème éthique de savoir s’il s’agit d’un amas de cellules ou de la création d’un embryon n’est toujours pas résolu. Nous pensons qu’il faut permettre les cultures de cellules souches en dérivant, sous le contrôle de l’Agence de la biomédecine, interdire les cybrides, c’est-à-dire les embryons résultant du transfert d’un noyau humain dans un ovocyte d’animal. Il convient de veiller à ce qu’il ne puisse pas y avoir trafic d’ovocytes et d’encadrer de façon contraignante le don d’ovocytes pour la recherche.
Il est évident que les cellules pluripotentes induites (iPS) provenant de cellules adultes et manipulées, par introduction de gènes et de rétrovirus, ne peuvent remplacer les cellules souches embryonnaires. Leur utilisation peut poser aussi, dans l’avenir, des problèmes éthiques en particulier si l’on obtenait des cellules germinales par reprogrammation. L’utilisation des iPS chez l’homme doit être contrôlée par l’Agence de la biomédecine.
De façon plus générale, nous préconisons de mettre le public en garde contre le tourisme des cures « régénératrices » par utilisation de cellules souches pour soigner des maladies chroniques diverses et notamment contre les offres de cures « régénératrices » publiées sur Internet depuis l’étranger par des établissements privés. Cela relève de l’escroquerie pure et simple.
S’agissant enfin de la commercialisation et de la brevetabilité des lignées de cellules souches, une large réflexion nous paraît indispensable. N’étant pas juristes, nous nous garderons de formuler des recommandations précises, mais il faut probablement étendre la brevetabilité des procédures aux lignées elles-mêmes.
M. Alain Claeys, rapporteur. Je vous remercie de cette présentation. M. Jacques Remacle, qui est conseiller scientifique à la direction générale de la recherche, «Unité génomique et systèmes biologiques» de la Commission européenne, a maintenant la parole.
M. Jacques Remacle, conseiller scientifique à la direction générale de la recherche, unité génomique et systèmes biologiques, de la Commission européenne. Ces questions ont été débattues au niveau de l’Union européenne, notamment en rapport avec le septième programme-cadre, financé par la Commission européenne à hauteur de 50 milliards d’euros d’investissements. Couvrant la période 2007-2013, ce programme-cadre repose sur quatre piliers : la coopération (recherche collaborative), le programme de recherche fondamentale «Idées», géré par le Conseil européen de la recherche; le programme « People Marie Curie» de formation par la recherche à l’étranger ; et le programme « Capacités », qui concerne avant tout les infrastructures de recherche.
Le débat sur les cellules souches, au niveau européen, a été très tendu, au point que le vote de ce septième programme-cadre a été retardé de six mois uniquement à cause de cette question. Toute la recherche européenne sur les technologies de l’information, le nucléaire ou la physique en a été affectée, alors même que ce secteur ne mobilise, lui, qu’une fraction minime des financements. Et, quand on est enfin parvenu à débloquer la situation, ce fut pour conclure un compromis qui ne fait que calquer celui du programme-cadre précédent !
La Commission tenant à conserver ce programme, il a fallu en effet trouver les voies et moyens d’un accord entre des pays comme l’Autriche et Malte, où l’utilisation des cellules souches embryonnaires est totalement interdite, et d’autres comme la Belgique, le Royaume-Uni et la Suède, où on l’autorise tout en l’encadrant éthiquement. Reste qu’on a conclu le 31 décembre 2006 pour un programme qui commençait le 1er janvier 2007 !
Aux termes de l’accord, sont exclues du financement les recherches visant au clonage humain à des fins reproductives, les activités de recherche visant à modifier le patrimoine génétique d'êtres humains et qui pourraient rendre cette altération héréditaire, la création d’embryons humains uniquement à des fins de recherche ou pour l’approvisionnement en cellules souches, y compris par transfert de noyaux de cellules somatiques.
Nous ne financerons pas non plus des programmes qui ne sont pas autorisés par l’État membre concerné et, en ce sens, nous sommes dépendants des législations nationales. Or nous devons passer par des comités qui doivent se prononcer à la majorité qualifiée des États membres et il arrive qu’un pays vote contre un projet de recherche sur les cellules souches embryonnaires bien qu’il ne le concerne pas, c’est notamment le cas, systématiquement, de l’Autriche ce qui complique encore la situation. Il faut bien s’en accommoder et, fort heureusement, il ne s’est pas jusqu’ici rencontré de cas où un projet aurait été refusé faute de cette majorité qualifiée.
Les activités de recherche sur les cellules souches humaines, adultes ou embryonnaires, peuvent être financées en fonction à la fois du contenu de la proposition scientifique et du cadre juridique de(s) l'État(s) membre(s) intéressé(s).Toute demande de financement de la recherche sur les cellules souches embryonnaires humaines doit, le cas échéant, indiquer en détail les mesures qui seront prises en matière de licence et de contrôle par les autorités compétentes des États membres, ainsi que l'approbation qui sera donnée en matière d'éthique. S'agissant du prélèvement de cellules souches embryonnaires humaines, les institutions, organismes et chercheurs sont soumis à un régime de licence et de contrôle strict conformément au cadre juridique des États intéressés.
La Commission soutient tous les projets de recherche sur les cellules souches, qu’elles soient adultes, embryonnaires, fœtales ou iPS. Au 1er mai dernier, le septième programme-cadre avait permis d’en financer 101, soit un investissement de 187 millions d’euros. La plupart portaient sur des cellules souches adultes. Sur ces 101 projets, 16 projets utilisent des cellules souches embryonnaires humaines soit la même proportion que dans le sixième programme-cadre ; ils représentent un investissement européen de 48 millions d’euros.
Pour la plupart, ces projets consistaient en études comparatives des différents types de cellules souches, et ne se limitaient donc pas aux cellules souches embryonnaires. Ces projets visaient à une meilleure compréhension des processus biologiques fondamentaux contrôlant les fonctions de « Stemness », de différentiation et de reprogrammation. Certains visaient au remplacement des animaux dans les études de toxicité des médicaments ; d’autres projets tendaient à développer les premières étapes pour la mise en oeuvre de tests cliniques en médecine régénérative (maladie de Parkinson, Huntington, réparation du myocarde, réparation de system auditif, diabète); certains portaient sur l’amélioration des conditions de culture et au développement de biomatériaux, en nanotechnologie notamment.
Sur quels critères ces projets impliquant l’utilisation de cellules souches embryonnaires humaines sont-ils sélectionnés ? Le premier est bien sûr la qualité scientifique, mais le projet doit aussi viser à faire avancer les connaissances fondamentales ou à augmenter la connaissance médicale, pour le développement de nouvelles méthodes de diagnostic ou de nouvelles méthodes thérapeutiques pour l’homme. Enfin, ses auteurs doivent démontrer en s’appuyant sur des arguments scientifiques qu’ils ne peuvent atteindre leurs objectifs en recourant à d’autres types de cellules souches, la pression de certains pays nous obligeant à conserver cette limitation sur laquelle vous souhaitez, vous, revenir. Cette évaluation scientifique est réalisée par des experts indépendants de haut niveau.
Ensuite, on procède à l’évaluation éthique des projets ayant démontré une excellence scientifique. La proposition ne peut pas inclure des activités de recherche menant à la destruction d’embryons humains, en particulier pour générer de nouvelles lignées de cellules souches embryonnaires humaines. En d’autres termes, seuls les travaux utilisant des lignées déjà existantes (en culture) peuvent recevoir des fonds européens. Les demandeurs doivent démontrer qu’ils sont en accord avec les lois, régulations, règlements éthiques et codes de conduite en place dans le pays où la recherche sera effectuée.
Cette évaluation éthique est réalisée par des experts éthiques indépendants de haut niveau. Les critères sont les suivants. Les donneurs d’embryons doivent avoir donné librement leur consentement écrit en accord avec leur législation nationale avant la dérivation des cellules souches à partir des embryons dont ils ont fait don. Les embryons qui ont été utilisés pour la dérivation de lignées cellules souches embryonnaires humaines résultent d’embryons surnuméraires provenant de programme de fécondation assistée in vitro qui ne seront plus utilisés à cet effet. La protection des données du donneur doit être assurée. Les chercheurs doivent présenter les données obtenues de manière à assurer l’anonymat du donneur.
La procédure de sélection continue de la façon suivante. Une fois les projets retenus au terme des deux phases d’examen, la Commission commencera la préparation du contrat de recherche et demandera les autorisations éthiques nationales/régionales avant de signer ce contrat. Elle ne financera pas un projet qui n’est pas autorisé dans l’État membre dans lequel cette recherche est programmée. Avant la signature du contrat, la Commission européenne soumettra l’approbation du projet au Comité réglementaire constitué des représentants des divers États membres qui vote à la majorité qualifiée. Une fois l’accord du comité réglementaire obtenu, la Commission signe le contrat et le projet peut commencer. Si des soupçons de malversations existent, la Commission peut demander un audit éthique afin de s’assurer de l’utilisation des bonnes pratiques.
Cette procédure est indéniablement longue et contraignante, mais c’était la seule qui permette aux États membres de maintenir leur contrôle et éventuellement de refuser un projet, ne serait-ce que pour faire valoir cette opposition auprès de leur opinion publique.
Par ailleurs, dans l’accord sur le septième programme-cadre, la Commission européenne a pour mission d’une part, de soutenir les actions et initiatives qui contribueront à la coordination et rationalisation des lignées de cellules souches embryonnaires humaines en Europe, et d’autre part,.de créer un «répertoire-banque» de cellules souches embryonnaires humaines, en vue d’optimiser l’exploitation des lignées existantes, en sorte qu’il soit moins nécessaire d’en dériver de nouvelles, par destruction d’embryons. Je pense que cette mesure est conforme à l’une des recommandations de l’Académie nationale de médecine, telle quelle a été énoncée à l’instant, à cette réserve près que certaines lignées ne sont plus très stables et finissent par devenir impropres à une utilisation thérapeutique.
M. Alain Claeys, rapporteur. Je vous remercie de ces informations. Mme Laurence Brunet, qui est juriste, chargée d’enseignement à l’Université Paris I-Panthéon-Sorbonne, a la parole.
Mme Laurence Brunet, juriste, chargée d’enseignement à l’Université Paris I-Panthéon-Sorbonne. Si différents soient-ils, les rapports successifs, en particulier ceux de l’OPECST, de l’Agence de la biomédecine et du Conseil d’État, ont en commun d’appeler à réformer le dispositif actuel en vue d’autoriser les recherches sur l’embryon et les cellules souches embryonnaires, et à ne se priver d’aucune possibilité de recherche, et donc à utiliser aussi bien les cellules souches embryonnaires que les cellules souches adultes et les iPS. Dans ce concert, le rapport de la Mission du bureau de l’Assemblée nationale relative à la révision des lois de bioéthique introduit toutefois une dissonance dans la mesure où il se prononce pour le maintien du régime dérogatoire, afin de préserver la valeur symbolique de l’embryon.
Cependant, à y regarder de plus près, cela n’est pas aussi simple. On constate des divergences parmi ceux qui veulent lever l’interdit, et certaines convergences entre eux et cette mission parlementaire. La proposition de cette dernière, plus restrictive sur le principe, est en effet, curieusement, celle qui se révèle la plus ouverte quant aux modalités, dans la mesure où elle tend à supprimer l’exigence d’une absence de solution alternative et à remplacer « finalité thérapeutique » par « finalité médicale ».
M. Alain Claeys, rapporteur. Cela se trouve aussi dans le rapport de l’OPECST.
Mme Laurence Brunet. Si les options avancées sont d’une grande variété, ces différences n’ont finalement pas un grand impact pratique. On l’a relevé, malgré la grande complexité du régime français, alliant interdit et dérogation, tout le monde « s’en sortait » assez bien, grâce à la procédure mise en place par l’Agence de la biomédecine.
Pour conclure, je voudrais avancer une proposition inspirée des travaux de cette Agence, mais dont M. de Guerra n’a pas fait état, peut-être parce que le rapport de la Mission a rejeté cette perspective. Il me semble que toutes les catégories et distinctions utilisées jusqu’à ce jour par les juristes ne suffisent plus.
Jusqu’en 2004 en tout cas, on a, à une définition ontologique de l’embryon, préféré une définition téléologique en mettant l’accent sur le projet parental. L’avantage était d’avoir le même critère pour l’assistance médicale à la procréation et pour l’interruption volontaire de grossesse, mais on maintenait ainsi une définition de l’embryon comme entité insécable, alors que la recherche sur les cellules souches a fait éclater cette unité : manifestement, les lignées de cellules souches embryonnaires ne sont pas équivalentes à l’embryon, même s’il y a continuité ontologique, physiologique entre la cellule-œuf et ces cellules. Seule la première est totipotente, les secondes étant pluripotentes car dérivées du blastocyste ; elles peuvent se transformer en toute partie d’un organisme, elles peuvent même reconstituer cet organisme dans son entier, mais elles ne pourraient pas donner naissance à un enfant parce qu’elles ne permettent pas de reconstituer les parties annexes qui seraient nécessaires pour cela.
Ne devrait-on pas recourir davantage à une distinction, routinière dans la pratique scientifique, et l’inscrire dans la loi, de manière à ne pas soumettre au même régime l’embryon et les lignées de cellules souches embryonnaires ? Celles-ci, supposant la destruction de l’embryon, sont la manifestation qu’on a dérogé à la protection accordée à l’embryon. Que protéger quand il n’y a plus d’embryon intact ? Au reste, cette distinction est déjà opératoire en droit comparé, en droit anglais et même dans une loi très frileuse, la loi allemande, qui n’a autorisé que l’importation de lignées cellulaires justement parce qu’elle a interdit toute recherche sur l’embryon.
Dans la décision, évoquée ce matin, de la Grande chambre des recours de l’Office européen des brevets, en date du 25 novembre 2008, on perçoit également cette distinction, en filigrane, si on en fait une lecture a contrario : l’interdiction est limitée aux « produits qui, à la date du dépôt de brevet, ne pouvaient être obtenus sans la destruction des embryons ». Se limitant prudemment aux circonstances de l’espèce, la chambre des recours laisse toutefois en suspens ce qu’aurait été sa décision si ces produits avaient été obtenus à partir de lignées de cellules souches embryonnaires déjà dérivées, qui n’auraient pas supposé la destruction de l’embryon. J’ajoute qu’elle fait également référence au septième programme-cadre de l’Union européenne qui, comme M. Remacle vient de l’expliquer, fait la distinction entre les recherches qui supposent la destruction de l’embryon et celles qui exploitent des lignées déjà disponibles. Seules les secondes peuvent recevoir des financements européens.
Concrètement, pour faire prospérer cette idée, on pourrait peut-être, dans la loi, limiter le champ de l’interdiction, assortie d’une dérogation sous conditions, aux recherches sur l’embryon stricto sensu qui supposent la destruction de celui-ci. C’est en effet une façon de rappeler que l’embryon a été créé dans le cadre d’un projet parental, ayant pour finalité une naissance. L’interdiction (avec dérogations) témoigne ainsi de la transformation anthropologique majeure, selon les mots de la sociologue Simone Bateman, qu’entraîne la fécondation in vitro : la possiblité, pour un embryon cryoconservé d’un destin autre que celui de développer sa potentialité d’enfant. On exonérerait du champ de l’interdiction les recherches sur les lignées déjà dérivées, voire importées qui sont dans le « commerce » scientifique depuis un certain temps. La suggestion peut paraître de portée pratique limitée, mais, elle pourrait favoriser la recherche, en facilitant l’échange de lignées de cellules souches embryonnaires, tout en préservant les représentations culturelles et symboliques attachées à l’embryon.
Enfin, comme l’a dit Pierre Jouannet, et contrairement à ce qu’a fait la mission parlementaire, il me semble difficile d’évacuer la question de la recherche sur les embryons en vue de l’amélioration des techniques de procréation médicale assistée. On ne peut, comme le propose la mission parlementaire, s’en remettre à l’expertise d’équipes étrangères pour importer ces techniques sans les avoir nous-mêmes éprouvées.
M. Alain Claeys, rapporteur. Je vous remercie tous. Voilà une journée qui nous aura permis de dresser un état complet de ces recherches. Il nous appartient maintenant, à nous, députés, de convaincre nos collègues : il en va des progrès que nos équipes peuvent réaliser. Ce débat, madame Brunet, n’est en rien un débat purement formel, surtout au moment où l’on s’apprête à décider que la loi ne sera plus « revisitée » tous les cinq ans. Le moment est venu, s’agissant des recherches sur le vivant, d’adopter un comportement véritablement adulte. Dans la sphère privée, toutes les convictions sont respectables, mais le législateur doit aller au-delà. Dès lors que, grâce à l’Agence de la biomédecine, elles sont encadrées de façon satisfaisante, ces recherches doivent être libres. Tel est le message que nous devons porter.
M. Jean-Sébastien Vialatte, rapporteur. Il est faux de prétendre qu’il y aurait consensus pour que les recherches sur les embryons soient autorisées, madame Brunet. C’est sans doute le cas au sein de la mission de l’OPECST, mais ce ne l’est pas au sein de nos deux assemblées. Il se trouve des parlementaires qui vont encore tenter d’opposer recherches menées sur les cellules souches embryonnaires et aux recherches menées sur les souches adultes ou les iPS. Le débat, qu’on avait pu croire clos, va donc se poursuivre et il faudra user de toute notre force de conviction, avec votre appui à tous, pour convaincre que vos recherches, qui se fertilisent mutuellement, sont toutes nécessaires.
Mme Laurence Brunet. Pour moi, la question des représentations qu’on associe à l’embryon n’est pas de forme, tant s’en faut. J’ai conscience de proposer un dispositif à deux tiroirs, qui ne simplifie pas le régime d’autorisation de la recherche sur l’embryon. Mais la simplification doit-elle être absolument recherchée ? N’est-ce pas plutôt l’équilibre entre la libre recherche sur l’embryon et le respect des représentations (encore) communes de l’embryon comme objet de respect qui doit être visé. Il est vrai, par ailleurs, que rien n’est acquis, mais les états généraux ont tout de même montré que des citoyens convenablement formés pouvaient être convaincus que les recherches sur l’embryon n’avaient pas à être diabolisées. On peut en tirer partie.
M. Alain Claeys, rapporteur. N’exagérons pas la portée de ces états généraux, et des positions prises par trois groupes d’une quinzaine de personnes.
Mme Laurence Brunet. Ce n’est sans doute qu’un élément parmi tous ceux que nous avons à prendre en considération, mais il s’agissait là de voix différentes de celles qu’on entend habituellement, qu’il s’agisse de parlementaires ou de spécialistes de la bioéthique.
M. Jean-Sébastien Vialatte, rapporteur. À mon tour, je vous remercie tous.
La séance est levée à dix-huit heures dix.
1 Rapport n° 262, Sénat
2 Rapport sur l’application de la loi n° 94-654 du 20 juillet 1994 présenté par M. Alain Claeys, député, et M. Claude Huriet, sénateur. n° 1407 Assemblée nationale.
3 Rapport Assemblée nationale n° 2198, présenté par M. Alain Claeys, député.
4 Rapport Assemblée nationale n° 3502, présenté par M. Alain Claeys, député.
5 Rapport Assemblée nationale n° 1325, présenté par MM. Alain Claeys et Jean-Sébastien Vialatte, députés.
6 Rapport Assemblée nationale n° 3498 sur le fonctionnement des cellules humaines présenté par M. Alain Claeys
7 Rapport « Cellules souches et choix éthiques » remis au Premier Ministre
8 Constituée à l’initiative de la Conférence des Présidents de l’Assemblée nationale
9 Rapport d’information Assemblée nationale n° 2235 « Favoriser le progrès médical, respecter la vie humaine »
10 Audition publique du 27 janvier 2010
11 Agence de la biomédecine, rapport au Parlement et au Gouvernement, avril 2010
12 Audition publique du 27 janvier 2010
13 Audition publique du 27 janvier 2010 et des rapporteurs du 18 mai 2010
14 Audition des rapporteurs du 30 juin 2010
15 Audition publique du 27 janvier 2010
16 Audition publique du 27 janvier 2010
17 Audition publique du 27 janvier 2010
18 Audition publique du 27 janvier 2010
19 Audition publique du 27 janvier 2010
20 Audition publique du 27 janvier 2010
21 Médecine-Science – octobre 2009
22 Audition publique du 27 janvier 2010
23 Audition publique du 27 janvier 2010
24 Audition publique du 27 janvier 2010
25 Audition publique du 27 janvier 2010
26 Entretien lors de la mission aux États-Unis (voir annexe)
27 Entretien lors de la mission au Royaume-Uni (voir annexe)
28 Audition publique du 27 janvier 2010
29 Entretien lors de la mission en Israël (voir annexe)
30 Audition publique du 27 janvier 2010
31 Audition publique du 27 janvier 2010
32 Audition publique du 27 janvier 2010
33 Audition publique du 27 janvier 2010
34 Entretien lors de la mission aux États-Unis (voir annexe)
35 Entretien lors de la mission au Royaume-Uni (voir annexe)
36 Audition publique du 27 janvier 2010
37 Audition publique du 27 janvier 2010
38 Entretien lors de la mission au Royaume-Uni (voir annexe)
39 Audition publique du 27 janvier 2010
40 Audition publique du 27 janvier 2010
41 Audition des rapporteurs du 30 juin 2010
42 Audition publique du 27 janvier 2010
43 Mission au Royaume-Uni (voir annexe)
44 Mission en Israël (voir annexe)
45 Audition publique du 27 janvier 2010
46 Audition publique du 27 janvier 2010
47 La recherche sur les cellules souches aux États-Unis, décembre 2008
48 Entretiens lors de la mission en Israël (voir annexe)
49 Entretien lors de la mission en Israël (voir annexe)
50 Entretien lors de la mission au Royaume-Uni (voir annexe)
51 Audition publique du 27 janvier 2010
52 Audition publique du 27 janvier 2010
53 Audition des rapporteurs du 15 mai 2010
54 Rapport du groupe de travail de l’Académie nationale de médecine du 26 janvier 2010
55 Audition des rapporteurs du 11 mai 2010
56 Audition publique du 27 janvier 2010
57 Audition publique du 27 janvier 2010
58 Mission aux États-Unis (voir annexe)
59 Audition publique du 27 janvier 2010
60 Entretien lors de la mission en Israël (voir annexe)
61 Entretien lors de la mission en Israël (voir annexe)
62 Audition publique du 27 janvier 2010
63 Entretien lors de la mission en Israël (voir annexe)
64 Audition publique du 27 janvier 2010
65 Audition publique du 27 janvier 2010
66 Audition publique du 27 janvier 2010
67 Mission des rapporteurs au Royaume-Uni (voir annexe)
68 Article 5 paragraphe 2 : « Un élément isolé du corps humain ou autrement produit par un procédé technique, y compris la séquence ou la séquence partielle d’un gène, peut constituer une invention brevetable, même si la structure de cet élément est identique à celle d’un élément naturel ».
69 Audition publique du 27 janvier 2010
70 Audition publique du 27 janvier 2010
71 Lignes directrices pour l’application en clinique des cellules souches
72 Audition des rapporteurs du 17 novembre 2010
73 Audition des rapporteurs du 30 juin 2010
74 Retour de la diaspora chinoise pour leur presque totalité.
75 350 millions d’euros de 2006 à 2010 mis à disposition par le MOST, auxquels s’ajoutent 25 millions d’euros par an mis à disposition par l’Académie des Sciences de Chine pour ses laboratoires.
76 Rapport précité présenté par M. Alain Claeys, député.
77 Entretiens lors de la mission en Israël (voir annexe)
78 Mission au Royaume-Uni (voir annexe)
79 Entretien lors de la mission au Royaume-Uni (voir annexe)
80 Entretiens lors de la mission au Royaume-Uni (voir annexe)
81 Entretien au Congrès lors de la mission aux États-Unis (voir annexe)
82 Mission au États-Unis (voir annexe)
83 Annexe n°2
84 Audition des rapporteurs du 8 juin 2010
85 Mission aux États-Unis (voir annexe)
86 Audition des rapporteurs le 8 juin 2010
87 Audition publique du 27 janvier 2010
88 Audition publique de l’OPECST du 10 juin 2008 et audition par la mission d’information du 25 novembre 2008
89 Leçons d’expérience – 20 juin 2008
90 Leçon d’expérience – Juin 2008
91 Rapport précité n° 3502, Assemblée nationale
92 Rapport n° 1325, Assemblée nationale
93 Rapport d’information de l’Assemblée nationale, n° 2235
94 Etude du Conseil d’État : la révision de la loi de bioéthique- mai 2009
95 Etude du Conseil d’état : la révision de la loi bioéthique – mai 2009
96 Audition publique du 27 janvier 2010
97 Audition publique du 27 janvier 2010
98 Rapport au nom d’un groupe de travail « réflexions relatives au rapport d’information n° 2235 de la mission parlementaire sur la révision des lois de bioéthique », présenté le 22 juin 2010.
99 Audition de la Mission d’information de l’Assemblée nationale du 1er avril 2009
100 Audition de la mission d’information du 11 février 2009
101 Audition publique du 27 janvier 2010
102 Audition publique du 27 janvier 2010
103 Bull.Acad. Natle Med., 1995, n°179 ; Bull. Acad. Natle Med., 1996, n° 180
104 Bull. Acad. Natle. Med., 2002,186 n°1 et n° 5
105 Audition par la Mission d’information le 5 novembre 2008
106 Le Monde 20 mai 2010
107 Audition publique du 27 janvier 2010
108 Audition publique du 27 janvier 2010
109 Rapport d’information n°2235 AN
110 Audition publique du 27 janvier 2010
111 Audition publique du 27 janvier 2010
112 « Les cellules souches, porteuses d’immortalité » - Ed. Odile Jacob
113 Audition de la Mission d’information du 5 novembre 2008
114 Mission au Royaume-Uni (voir annexe)
115 Audition devant la Mission d’information 5 novembre 2008
116 Audition publique du 27 janvier 2010
117 Un type bien ne fait pas cela (NIL, 2010)
© Assemblée nationale