


N° 2849
______
ASSEMBLÉE NATIONALE
CONSTITUTION DU 4 OCTOBRE 1958
TREIZIÈME LÉGISLATURE
Enregistré à la Présidence de l'Assemblée nationale le 7 octobre 2010
RAPPORT D’INFORMATION
DÉPOSÉ
en application de l’article 145-7, alinéa 1, du Règlement
PAR LA COMMISSION DES AFFAIRES ÉCONOMIQUES
sur le contrôle de l’application de la loi n° 2008-595 du 25 juin 2008 relative aux organismes génétiquement modifiés
ET PRÉSENTÉ
PAR MM. Antoine HERTH et Germinal PEIRO,
Députés.
——
SOMMAIRE
___
Pages
INTRODUCTION 5
I.— DEUX ANS APRÈS L’ADOPTION DE LA LOI, LA MAJORITÉ DE SES DISPOSITIONS NE SONT PAS APPLICABLES 9
A.— UNE PRIORITÉ DONNÉE AU VOLET EXPERTISE DE LA LOI 9
1. Les textes publiés 9
2. Un bilan négatif 10
B.— LE HAUT CONSEIL DES BIOTECHNOLOGIES, UNE INSTANCE ENCORE EN DEVENIR 13
1. Les textes 13
2. Le fonctionnement interne du HCB 18
a) Le comité scientifique 18
b) Le comité économique, éthique et social 20
3. La communication du HCB 23
II.— DE NOMBREUSES INTERROGATIONS SUR LES TEXTES D’APPLICATION EN COURS D’ÉLABORATION 27
A.— LA TRANSPARENCE ET L’INFORMATION DU PUBLIC 27
B.— LE DÉCRET « SANS OGM » 30
C.— LA COEXISTENCE ET LE RÉGIME DE RESPONSABILITÉ 35
D.— L’UTILISATION DES OGM EN MILIEU CONFINÉ 37
III.— DES DISPOSITIONS LÉGISLATIVES BIENTÔT OBSOLÈTES ? 39
A.— LES CONCLUSIONS DU CONSEIL EUROPÉEN DU 4 DÉCEMBRE 2008 39
B.— LA NOUVELLE STRATÉGIE DE LA COMMISSION EUROPÉENNE 40
1. La relance du processus d’autorisation avec un dossier emblématique, la pomme de terre Amflora 41
2. Coexistence et interdiction de mise en culture : de nouvelles marges de manœuvre pour les États membres mais à quel prix ? 43
a) La proposition législative de la Commission du 13 juillet 2010 43
b) Les nouvelles lignes directrices en matière de coexistence 45
C.— LA DÉFINITION D’UN SEUIL DE PRÉSENCE FORTUITE D’OGM NON AUTORISÉS DANS LES PRODUITS IMPORTÉS 46
EXAMEN EN COMMISSION 49
LISTE DES PERSONNES AUDITIONNÉES 67
TABLEAU DE SUIVI DE L'APPLICATION DE LA LOI 71
Mesdames, Messieurs,
Si la loi du 25 juin 2008 relative aux organismes génétiquement modifiés (OGM) a procédé à une nécessaire mise en conformité de notre ordre juridique avec le droit communautaire, elle a surtout été le premier texte à contribuer à la mise en œuvre du Grenelle de l’environnement. Sur un sujet particulièrement polémique, cette loi était porteuse d’une grande ambition démocratique : réaffirmer les principes de transparence et de responsabilité, fonder le processus de décision publique sur un nouveau modèle d’expertise, reposant à la fois sur un examen scientifique et sur une évaluation socio-économique, consacrer enfin la liberté de chacun de produire et de consommer avec ou sans OGM.
En dépit de l’examen du texte dans un climat tendu, à peine apaisé par la décision du Gouvernement de prendre une clause de sauvegarde sur le maïs MON 810, le Parlement est parvenu à élaborer un texte équilibré permettant la création d’une instance d’expertise unique en son genre et arrêtant les grands principes de la politique de notre pays vis-à-vis des OGM :
– évaluation préalable indépendante et transparente des risques,
– respect de conditions techniques de coexistence, protection des cultures traditionnelles et de qualité et surveillance biologique du territoire,
– réparation du préjudice économique résultant de la présence accidentelle d’OGM dans d’autres productions,
– information et participation du public,
– soutien à la recherche.
Ces grands principes, pour s’incarner et se traduire en actes, nécessitent un certain nombre de mesures d’application. La loi du 25 juin 2008 fait en effet la part belle aux textes réglementaires pour sa mise en œuvre, y compris sur des points aussi sensibles que la définition du « sans OGM », la détermination des conditions techniques de coexistence ou encore l’information et la participation du public. L’importante latitude laissée au pouvoir réglementaire sur ce dernier volet a d’ailleurs été censurée par le juge constitutionnel (1) et par le juge administratif (2) au regard de l’article 7 de la charte de l’environnement(3).
Face à l’importance des enjeux, la déception est donc grande à la lecture du maigre bilan de l’application de la loi. Deux ans après sa publication, seuls 9 textes réglementaires sur 19 ont été publiés. Sur la plupart des points cruciaux de la loi, vos rapporteurs n’ont donc pas été en mesure d’apprécier la portée concrète donnée aux principes définis par le législateur ni de vérifier que l’esprit du texte avait bien été respecté. Plus de la moitié des décrets ou des arrêtés sont en effet encore à l’état de projets, soumis à concertation, voire en attente.
Si le bilan chiffré est sans appel, vos rapporteurs comprennent néanmoins que le Gouvernement ait voulu prendre son temps pour se prononcer sur des sujets à la fois délicats et tous plus ou moins liés (4), et qu’il ait notamment attendu la mise en place du Haut conseil des biotechnologies (HCB) pour recueillir son avis, comme cela est d’ailleurs formellement prévu par la loi dans certains cas. Il est en outre impossible faire abstraction du contexte particulier dans lequel s’inscrit la mise en œuvre de cette loi, dont une grande partie des dispositions ne trouvent tout simplement pas à s’appliquer en l’absence d’OGM cultivé sur notre territoire. Or, depuis 2008, aucune culture commerciale d’organismes génétiquement modifiés n’est autorisée sur le sol français et, depuis la destruction pour la seconde fois au mois d’août dernier de l’essai mené par l’INRA à Colmar, il n’y a plus qu’une seule expérimentation en milieu ouvert qui subsiste en France. Dans ce contexte, il n’est pas à exclure que le Gouvernement ait pu considérer que les questions de coexistence ou de responsabilité ne revêtaient pas un caractère prioritaire…
A contrario, la rapidité avec laquelle la réforme de notre dispositif d’expertise a été mise en œuvre est à saluer : le Haut conseil des biotechnologies a ainsi pu commencer à travailler moins d’un an après le vote de la loi. La création de cette instance est aujourd’hui unanimement saluée et son fonctionnement scruté par l’ensemble de nos voisins européens, qui pourraient être amenés à s’en inspirer. Le bilan de la première année d’activité du HCB est en outre fort honorable avec un nombre très important d’avis rendus et un rythme de travail soutenu. Ce bilan positif, on le doit avant tout à l’engagement de ses membres et à l’action dévouée de sa présidente et des présidents des deux comités qui le composent. Car si cette instance a su trouver un modus vivendi, prouvant que les critiques soulevées lors du débat parlementaire, notamment sur son architecture, étaient en grande partie infondées, elle reste encore fragile et n’est pas à l’abri d’éventuels dérèglements ou dissensions. Au sein du comité économique, éthique et social (CEES), le pari d’un dialogue constructif et ouvert entre toutes ses composantes est ainsi loin d’être gagné : de l’avis de toutes les personnes auditionnées, les conditions de travail y sont éprouvantes, la sérénité des débats n’y est pas garantie et la recherche d’un consensus s’avère extrêmement difficile.
Les tensions au sein du CEES ne font toutefois que refléter celles de la société. Alors que la contestation anti-OGM reste vive, y compris à travers des actes de fauchage, voire s’étend à d’autres types de méthodes de sélection, telle la mutagénèse, on ne peut que prendre acte de l’échec le plus patent de la loi : réconcilier la science et la société, encourager la recherche et maintenir une expertise vivante dans le domaine des OGM. Même si le texte législatif contenait au final peu de dispositions opérationnelles sur ce volet, son esprit n’est aujourd’hui pas respecté.
Espérons que cet échec ne soit que provisoire. Il participe cependant à une menace plus globale, qui est de se retrouver dépassé, non seulement du point de vue scientifique, mais également juridique et économique. En effet, alors que la France tarde à mettre en œuvre les dispositions de la loi du 25 juin 2008 qui, s’agissant de la transposition de la directive 2001/18/CE, intervenaient avec près de six ans de retard (5), la Commission européenne, prenant acte de son impuissance à obtenir la levée des clauses de sauvegarde sur le MON 810 et consciente des réticences de l’opinion publique concernant la culture des OGM, propose désormais de modifier cette même directive afin d’accorder aux États membres la faculté de restreindre voire d’interdire la mise en culture des OGM sur leur territoire sur la base de simples considérations socio-économiques. Celle-ci admet en outre désormais dans ses nouvelles lignes directrices sur la coexistence (juillet 2010) ce qu’elle avait jusqu’alors toujours rejeté : la création de zones sans OGM. Cette nouvelle opportunité sera-t-elle saisie par la France et selon quelles modalités. La question est aujourd’hui ouverte. Enfin, alors que le débat se focalise sur la mise en culture des OGM, l’Europe continue de dépendre massivement de l’importation de protéines végétales pour l’alimentation du bétail, protéines provenant pour leur écrasante majorité de plantes génétiquement modifiées. Incohérence ou réalisme économique ?
Le débat sur les OGM, on le voit, est aujourd’hui loin d’être clos, tant au niveau européen qu’au niveau national. La loi du 25 juin 2008, considérée comme fondatrice, n’aura finalement été qu’une étape : il n’en est que plus urgent qu’elle soit rapidement mise en œuvre dans toutes ses composantes.
I.— DEUX ANS APRÈS L’ADOPTION DE LA LOI, LA MAJORITÉ DE SES DISPOSITIONS NE SONT PAS APPLICABLES
A.— UNE PRIORITÉ DONNÉE AU VOLET EXPERTISE DE LA LOI
19 textes d’application (6) ont été recensés comme étant nécessaires à la mise en œuvre de la loi du 25 juin 2008 relative aux organismes génétiquement modifiés (7) : un peu plus de deux ans après la promulgation de la loi, seuls 9 d’entre eux sont parus, dont 4 décrets sur les 10 attendus (8).
La majorité de ces textes concernent la mise en œuvre du volet « expertise » de la loi avec la création, d’une part, du Haut conseil des biotechnologies et, d’autre part, du comité de surveillance biologique du territoire.
Trois textes sont ainsi consacrés à la mise en place du HCB :
– tout d’abord le décret n° 2008-1273 du 5 décembre 2008 relatif au Haut conseil des biotechnologies, qui a été pris en application de l’article 3 de la loi (article L. 531-5 du code de l’environnement) qui renvoie à un décret en Conseil d’État le soin de fixer la composition, les attributions ainsi que les règles de fonctionnement, de saisine et de déontologie du Haut Conseil des biotechnologies ;
– est ensuite paru le décret du 30 avril 2009 portant nomination du président du Haut Conseil des Biotechnologies, du président et des membres du comité scientifique et du président et des membres du comité économique, éthique et social. Signalons à cet égard que certaines organisations représentées au CEES ayant demandé à changer de représentants et le besoin s’étant par ailleurs fait sentir au sein du CS d’élargir le champ de compétences de ses membres (9), un nouveau décret portant nomination au comité scientifique et au comité économique, éthique et social a été publié au Journal officiel du 4 septembre 2010 ;
– enfin, l’arrêté du 9 juin 2010 a fixé les indemnités susceptibles d’être allouées aux membres du Haut Conseil des biotechnologies et aux experts désignés par celui-ci.
Au-delà des textes réglementaires stricto sensu, on notera que le Haut conseil des biotechnologies a adopté son règlement intérieur le 9 juillet 2009. Sa Présidente a par ailleurs indiqué à vos rapporteurs que les locaux où siège actuellement le HCB ont été mis à sa disposition à compter de novembre 2009 et que l’équipe administrative du Haut Conseil a été au complet à partir de mars 2010. Au-delà de la parution relativement rapide des textes d’application, la « mise en route » effective du HCB a donc nécessité un peu de temps.
Il en va de même pour le Comité de surveillance biologique du territoire (CSBT). Si le décret portant création du CSBT a été publié dès décembre 2008 (10), la nomination de ses membres, au nombre de vingt (article D. 251-1-3 du code de l’environnement), a nécessité plus d’un an : après l’échec de l’appel à candidatures organisé au printemps 2009, faute de candidats, celui-ci a dû être prolongé. L’arrêté portant nomination au comité n’est ainsi paru au Journal officiel que le 25 février 2010 (11) et sa première réunion devait être organisée le 9 septembre dernier. Rappelons à cet égard que les compétences du CSBT ne se limitent pas aux OGM.
Trois des textes parus ont par ailleurs trait à l’utilisation confinée d’OGM mais ne concernent qu’un aspect particulier de la loi : les conditions d’étiquetage des OGM mis à la disposition de tiers à l’occasion d’une utilisation confinée. Il s’agit du décret n° 2009-45 du 13 janvier 2009 et de deux arrêtés du 26 août 2009.
Enfin, un arrêté du 3 mars 2010 a fixé le montant de la taxe sur les demandes d’autorisation de dissémination volontaire d’organismes génétiquement modifiés comme suit :
– 2 000 euros pour une demande d’autorisation d’essai ;
– 10 000 euros pour une demande d’autorisation de mise sur le marché ;
– 5 000 euros pour une demande de renouvellement d’autorisation de mise sur le marché.
On suppose néanmoins que Bercy n’a pas budgété de ressources correspondantes pour l’État s’agissant de l’année en cours, voire de l’année prochaine.
A l’exception des textes relatifs au Haut Conseil des Biotechnologies, l’ensemble des décrets d’application des dispositions qui se trouvent au cœur du dispositif mis en place par la loi du 25 juin 2008 sont ainsi toujours en attente, qu’il s’agisse de la définition du « sans OGM », des conditions techniques de coexistence, de l’information du public, du régime de responsabilité sans faute des exploitants mettant en culture des OGM ou encore de l’étiquetage des semences.
On ne peut en conséquence que tirer un bilan négatif de la mise en œuvre de la loi.
Il convient cependant de tenir compte du contexte particulier dans lequel cet exercice s’inscrit dans la mesure où, depuis que la France a fait valoir la clause de sauvegarde sur le maïs MON 810 en février 2008, plus aucune culture commerciale d’OGM n’est autorisée sur le territoire national. A l’exception de deux essais de l’INRA, dont un récemment saccagé, aucune expérimentation au champ n’est menée sur le territoire français et aucune demande en ce sens n’a été déposée depuis l’arrêt des activités de la commission du génie biomoléculaire (CGB) en 2007, en raison tout d’abord du délai nécessaire à la mise en place du Haut conseil des biotechnologies mais également de l’impossibilité aujourd’hui de délivrer des autorisations d’essai en l’absence de dispositions législatives permettant d’organiser la consultation publique sur les demandes susceptibles d’être déposées (12). On comprend dans ce cas que les questions de coexistence, de déclaration des cultures d’OGM ou encore de responsabilité en cas de présence accidentelle dans d’autres productions n’aient pas figuré au rang des priorités du Gouvernement, contrairement à l’installation du Haut conseil des biotechnologies. Cette situation n’en est pas moins regrettable.
Et ce d’autant plus que la majorité des textes attendus sont encore en cours d’élaboration et/ou de consultation : il paraît ainsi fort improbable qu’ils soient tous publiés avant la mi-2011, c’est-à-dire trois ans après le vote de la loi. En outre, si vos rapporteurs ont bon espoir que l’ensemble des textes soit effectivement opérationnel l’an prochain, ils doutent néanmoins que le calendrier prévisionnel de publication arrêté par le Gouvernement puisse être respecté. Prenons l’exemple du décret définissant le « sans OGM » : sa publication est aujourd’hui programmée pour le début de l’année 2011. Or, cet objectif apparaît quelque peu irréaliste si l’on considère qu’une étude socio-économique sur le sujet est attendue pour la fin du mois de novembre 2011 et que le projet de texte, une fois définitivement arrêté, doit être envoyé pour avis au HCB (13) ainsi qu’à l’ANSES (14) avant d’être notifié à la Commission européenne (15) puis soumis au Conseil d’État (16). Si les consultations nationales peuvent être réalisées en parallèle, les saisines de la Commission européenne et du Conseil d’État relèvent d’un stade ultérieur et doivent avoir lieu successivement. Aucune de ces étapes ne peut en outre être considérée comme une simple formalité, en particulier la notification à la Commission au titre de la directive 98/34/CE du Parlement européen et du Conseil du 22 juin 1998 prévoyant une procédure d’information dans le domaine des normes et réglementations techniques : celle-ci est en effet susceptible de déboucher sur des demandes de modifications du texte proposé par la France, modifications devant ensuite être suivies d’une nouvelle notification.
Enfin, parmi les sujets dont la mise en œuvre a été délibérément mise en attente, seule une disposition de la loi a été identifiée comme problématique : il s’agit du troisième alinéa de l’article L. 531-2-1 du code de l’environnement (article 2) qui dispose que « les études et les tests sur lesquels se fonde cette évaluation [des risques pour l’environnement et la santé publique] en vue des autorisations prévues aux articles L. 533-3 et L. 533-5 [demandes d’autorisation de dissémination] sont réalisés par des laboratoires agréés par les pouvoirs publics ». En effet, dans la mesure où les pétitionnaires ne recourent pas uniquement à des laboratoires situés sur le sol français, de nombreuses questions se posent sur la possibilité de mettre en œuvre cette disposition. Comment soumettre unilatéralement des laboratoires étrangers privés à un agrément des pouvoirs publics français sans prévoir de système de reconnaissance mutuelle au niveau européen ? La Commission européenne ne validerait vraisemblablement pas un tel dispositif et, si celui-ci ne devait finalement s’appliquer qu’aux laboratoires français, il aboutirait à un traitement inégal de ces derniers. La solution est donc à rechercher plus largement au niveau européen, ce qui complique grandement l’application de cette mesure, qui est donc pour l’heure laissée en suspens. Il est toutefois intéressant de noter que les représentants de l’ANSES (17) auditionnés par vos rapporteurs ont indiqué que le respect de référentiels de bonnes pratiques, soumis à certification, s’imposait déjà aux laboratoires qui réalisent les tests figurant dans les dossiers des pétitionnaires. Il convient donc de vérifier si les dispositifs existant peuvent être considérés comme satisfaisants car équivalents à une obligation d’agrément et si, partant, la mise en œuvre du dispositif prévu par la loi est aujourd’hui réellement nécessaire.
Vos rapporteurs tiennent également à signaler que l’article 1er de la loi, qui prévoit la transmission au Parlement, dans les six mois suivant la publication du texte, d’un rapport relatif aux possibilités de développement d’un plan de relance de la production de protéines végétales, n’a toujours pas trouvé de traduction concrète. Aucun rapport n’a pour l’heure été déposé sur le bureau des assemblées. Signalons toutefois que, dans le cadre du bilan de santé de la politique agricole commune (PAC), un plan de soutien à la filière des protéagineux doté d’une enveloppe de 40 millions d’euros a été mis en place pour la période 2010-2012. D’après les informations recueillies auprès du ministère chargé de l’agriculture, la mise en œuvre de ce plan aurait déjà permis une augmentation de plus de 60 % des surfaces cultivées en France. Par ailleurs, le ministre de l’alimentation, de l’agriculture et de la pêche a finalement confié cet été au Conseil général de l’alimentation, de l’agriculture et des espaces ruraux (CGAAER) la responsabilité de préparer le rapport prévu par la loi : ses conclusions devraient être disponibles d’ici la fin de l’année.
B.— LE HAUT CONSEIL DES BIOTECHNOLOGIES, UNE INSTANCE ENCORE EN DEVENIR
• Composition
Placé à la fois auprès des ministres chargés de l’environnement, de la consommation, de l’agriculture, de la santé et de la recherche (article R. 531-7 du code de l’environnement), le Haut conseil des biotechnologies est composé de deux comités : le comité scientifique (CS), doté de quarante membres maximum, et le comité économique, éthique et social (CEES) doté de 26 membres titulaires (articles R. 531-9 et R. 531-12). Le mandat des membres du Haut conseil ainsi que celui de son président et des présidents de ses deux comités est de cinq ans renouvelable.
La présidente du Haut conseil des biotechnologies est Mme Catherine Bréchignac, le président du comité scientifique est M. Jean-Christophe Pagès et la présidente du comité économique, éthique et social Mme Christine Noiville. Conformément aux articles R. 531-11 et R. 531-13 du code de l’environnement, chaque comité a élu un vice-président : il s’agit de M. Jean-Jacques Leguay pour le CS et de M. André Jacquemart pour le CEES.
Signalons que le CEES comporte autant de membres suppléants que de membres titulaires, mais ils ne sont pas autorisés à siéger en même temps, point qui a fait l’objet de contestations, à la fois pour des questions pratiques – il ne permet pas au titulaire et au suppléant d’avoir la même maîtrise des dossiers – et de représentation. Certains suppléants n’appartiennent pas en effet à la même organisation que leurs titulaires : ainsi, les personnes désignées par le décret du 30 avril 2009 comme suppléantes des représentants des associations de consommateurs CLCV et UFC sont en fait des membres d’associations familiales (Familles de France et Familles rurales). Le décret du 30 avril 2009 n’a pas non plus permis à l’ensemble des organisations syndicales agricoles d’être représentées au sein du CEES, ce que conteste notamment la Coordination rurale.
• Attributions
Le décret du 5 décembre 2008 reprend la liste des missions du HCB figurant à l’article L. 531-3 du code de l’environnement, ainsi que la répartition des compétences respectives du CS et du CEES prévue à l’article L. 531-4 du même code. Si le décret n’évoque pas la possibilité dont dispose le HCB, en vertu du dernier alinéa de l’article L. 531-4 de se réunir en formation plénière afin d’aborder toute question de portée générale à la demande de son président et de la moitié de ses membres, il prévoit expressément que les questions de surveillance biologique du territoire sont traitées en séance plénière (article R. 531-16).
• Règlement intérieur
L’article R. 531-7 du code de l’environnement confie au président du HCB la responsabilité d’élaborer le règlement intérieur, qui est ensuite adopté à la majorité des deux tiers des membres réunis en séance plénière. Le règlement intérieur du HCB a été adopté le 9 juillet 2009. Il rappelle les missions du Haut conseil et arrête son fonctionnement (chapitre 1) ainsi que le fonctionnement de ses deux comités (chapitre 2), il fixe les règles à respecter en matière de publicité des débats et de déontologie (chapitre 3) et enfin, liste les moyens alloués au HCB (chapitre 4).
Le règlement intérieur prévoit ainsi les dispositions relatives aux déclarations d’intérêts auxquelles ses membres sont soumis, ainsi que les engagements de confidentialité qu’ils doivent respecter à l’égard des informations qu’ils sont amenés à connaître dans le cadre de leurs travaux. Enfin, il impose aux membres du HCB une obligation de réserve : tant que l’avis du Haut conseil n’est pas rendu public, les positions exprimées lors des débats ne sont pas destinées à être communiquées au public ; une fois l’avis rendu public, les membres du HCB peuvent s’exprimer, mais uniquement en leur nom propre et en respectant l’anonymat des positions exprimées par les autres membres.
• Bureau
L’article R. 531-18 du code de l’environnement a doté le Haut conseil des biotechnologies d’un bureau, constitué de son président et des présidents et vice-présidents des deux comités. Si le décret se borne à préciser que le bureau décide des modalités de traitement de chaque saisine adressée au Haut conseil, sa tâche est en réalité beaucoup plus vaste. Cette instance, qui n’était pas prévue par la loi, est chargée de l’organisation de l’emploi du temps du Haut conseil mais également du budget et de la communication : elle assiste de fait la présidente dans toutes les composantes de sa mission. Le règlement intérieur précise à cet égard que le bureau :
– élabore le programme annuel de travail, le projet annuel de budget et la demande annuelle d’études et d’expertises ;
– donne son avis sur la suite à donner aux saisines et aux propositions d’auto-saisines et, lorsqu’une suite leur a été donnée par le président, décide des modalités de traitement de ces saisines et auto-saisines ;
– peut décider de la mise en place de groupes de travail réunissant des membres appartenant aux deux comités ;
– organise, avec l’appui du secrétariat, la circulation des informations au sein du HCB ;
– met en place des modalités de documentation et de veille nécessaires au travail de ses membres ;
– assure, avec l’appui du secrétariat, la gestion financière du Haut conseil.
• Moyens de fonctionnement
L’article R. 531-28 du code de l’environnement prévoit que le Haut conseil dispose des moyens financiers et humains propres nécessaires à son fonctionnement. Le budget pour 2010 du HCB est de 1 million d’euros, inscrits sur le budget de la mission Ecologie du MEEDDM.
Le Haut conseil des biotechnologies est en outre doté d’un secrétariat composé de trois ETP. De mai 2009 à fin janvier 2010, le HCB a tout d’abord fonctionné grâce à un secrétariat provisoire composé de trois agents du MEEDM, de deux agents du MESR et d’un agent du MAAP, qui ont accompli cette mission tout en continuant à exercer leurs fonctions au sein de leurs ministères respectifs. Le secrétaire général du HCB a été recruté en novembre 2009 et depuis avril 2010, le HCB fonctionne avec son propre secrétariat composé, outre le secrétaire général, de trois chargés de mission et d’une assistante. Le rapport d’activité 2009-2010 souligne à cet égard qu’ « un soutien administratif important est indispensable pour le bon fonctionnement des comités » et estime que l’effectif actuel se révèle « sous-critique » pour la tâche à accomplir.
Un an de fonctionnement du Haut conseil des biotechnologies *
Après une première année d’existence, la Présidente du Haut conseil des biotechnologies considère ainsi que le HCB présente un « bilan plus que satisfaisant » (18). Lors de son audition par vos rapporteurs, elle a souligné que dans le cadre de saisines relatives à des dossiers de demandes d’autorisation soumises au HCB, 515 avis avaient été rendus par le CS, essentiellement sur des dossiers d’utilisation d’OGM en milieu confiné (19). Le CEES a pour sa part eu à connaître de 7 dossiers, dont une demande relative à un essai en plein champ correspondant à l’essai de l’INRA de Colmar aujourd’hui détruit. Par ailleurs, en dehors de ces saisines, le HCB a été saisi par le Gouvernement sur la définition du « sans OGM », sur la révision des lignes directrices de l’Agence européenne de sécurité des aliments (AESA) ainsi que sur les protocoles d’évaluation de l’OCDE. Il a également été saisi par le député François Grosdidier et s’était autosaisi sur la question de l’évaluation socio-économique. Enfin, plusieurs journées d’étude ont été organisées : sur les herbicides (11 mai 2010), les rétrovirus (9 juin) ou encore la toxicologie (29 septembre). La Présidente a regretté de ne pas avoir pu traiter les saisines relatives à des dossiers de demandes d’importation, eu égard à la priorité accordée aux dossiers d’autorisation de commercialisation à des fins de mise en culture. Elle considère toutefois que le HCB devrait prochainement se pencher sur ces questions, par exemple au travers du cas des œillets.
• Saisines et premières contributions du HCB
Lors de sa première année d’existence, le HCB a traité :
- 3 questions transversales : une demande d’avis sur la définition des filières dites « sans OGM » ; une demande d’avis dans le cadre d’une consultation de la Commission européenne relative à un questionnaire socio-économique ; enfin une dernière demande dans le cadre d’une consultation de l’AESA (autorité européenne de sécurité des aliments) relative à la révision des lignes directrices sur l’évaluation environnementale des plantes génétiquement modifiées ;
- 6 demandes de mise sur le marché d’OGM inscrites dans le cadre de la directive 2001/18/CE relative à la dissémination volontaire d'OGM dans l'environnement et du règlement CE 1829/2003 concernant les denrées alimentaires et aliments pour animaux contenant des organismes génétiquement modifiés ou produits à partir de tels organismes ;
- 489 demandes d'avis de classement pour les utilisations confinées d'OGM ;
- 6 demandes d'avis pour des essais de thérapie génique, déposés par l'AFSSAPS (Agence française de sécurité sanitaire des produits de santé) en application de l'article R.1125-2 du code de la santé publique ;
- 1 demande d'expérimentation en champ ;
- 1 question ponctuelle émanant d'un parlementaire (François Grosdidier) au sujet des conclusions de l'article de J. Spiroux de Vendômois et alii (2009) ;
- 3 demandes d'avis sur l'habilitation d'agents de contrôle du MAAP (ministère de l'agriculture, de l'alimentation et de la pêche) conformément à l'article R..536-7 du code de l'environnement.
• Activité du comité scientifique
→ Dossiers d’OGM en milieu confiné
Depuis mai 2009, 489 dossiers ont été examinés, représentant 1 139 projets, la majorité provenant du secteur public (62 %). Comme c'était le cas à la commission du génie génétique, les dossiers de biologie animale et de microbiologie sont plus nombreux que les dossiers concernant le monde végétal (Figure 1). Cette situation a amené le CS à faire une demande d'experts supplémentaires en biologie animale et microbiologie.
Les dossiers de plantes, animaux et microorganismes à usage confiné traités par le HCB en 2009-2010 ont été en majorité des demandes d'agrément de recherche (Figure 1). Une petite proportion de ces dossiers représente des demandes d'avis de classement pour la production industrielle (vaccins et protéines recombinantes chez les animaux et microorganismes, additifs alimentaires chez les plantes), auxquels s'ajoutent six dossiers de thérapie génique et un avis de classement pour un dossier d'importation (Figure 1).
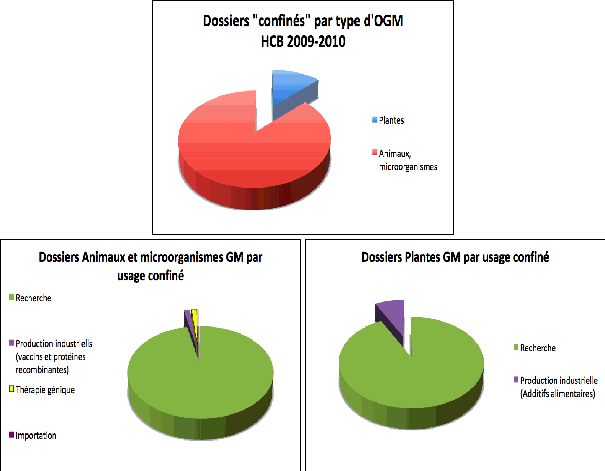
Figure 1 : Répartition des dossiers confinés traités par le CS du HCB en 2009-2010 par catégorie d’OGM, et au sein de chaque catégorie, par usage.
→ Dossiers d’OGM en milieu ouvert
- Le CS a repris les activités de la CGB (commission du génie biomoléculaire), qui avait vu son activité suspendue courant 2007. L'interruption prolongée de l'examen des différents types de demande a entraîné l'accumulation d'un grand nombre de dossiers non expertisés. L'origine de ces demandes est majoritairement communautaire.
Les dossiers en attente concernent l'importation de produits issus de plantes génétiquement modifiées ainsi que des dossiers de mise en culture, dont celui du MON810. Seize dossiers ont été traités au cours de cet exercice : majoritairement des dossiers de mise en culture (6) et de thérapie génique (6), un essai en champ et trois autres dossiers d'une nature particulière (Figure 2).
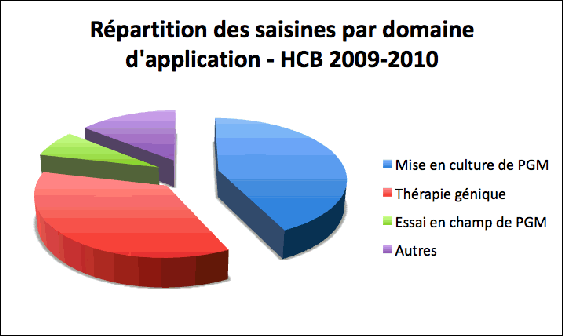
Figure 2 : Répartition des saisines relatives aux OGM en milieu ouvert, traitées par le CS du HCB en 2009-2010, selon les domaines d’application.
• Activité du comité économique, éthique et social
→ Dossiers relatifs à des plantes génétiquement modifiées
1) Essais en champ : porte-greffe de vigne (INRA)
2) Mises en culture :
- Maïs MON810 (Monsanto)
- Maïs NK603 (Monsanto)
- Betterave H7-1 (Monsanto)
- Maïs MON89034 x NK 603 (Monsanto)
- Maïs Btl 1 (Syngenta)
- Maïs 1507 (Pioneer/Mycogen)
→ Dossiers de thérapie génique
- Adénovirus recombinant pour l'interféron-g (Transgene / CHU Nantes) ;
- Virus de la vaccine recombinant pour l'interleukine 2 et les protéines E6 et E7 du papillomavirus (Roche / CHU Bordeaux) ;
- Cellules hématopoiétiques du patient/modification par vecteur lentiviral recombinant pour le gène WASP (Généthon / Necker) ;
- Cellules hématopoiétiques du patient/modification ex vivo par vecteur rétroviral recombinant pour le gène g-c (AP-HP / Necker) ;
- Plasmide recombinant pour une protéine antiangiogénique (Bioalliance Pharma / IGR) ;
- Virus de la vaccine recombinant pour trois protéines du virus de l'hépatite C (Transgène).
→ Saisines transversales
- Recommandation relative à la définition des filières dites "sans OGM" ;
- Réaction au questionnaire de la Commission européenne sur l'évaluation socio-économique des OGM.
* Source : Rapport d’activité du HCB 2009-2010
2. Le fonctionnement interne du HCB
Au-delà de ce qui est prévu par les textes, vos rapporteurs ont souhaité s’intéresser au fonctionnement concret du Haut conseil des biotechnologies, notamment en auditionnant sa présidente et plusieurs membres du CEES. Rappelons que l’organisation interne de cette nouvelle instance avaient fait l’objet de nombreux débats lors de l’examen du projet de loi, de même que la question de la communication du HCB et de ses membres sur les avis rendus par celui-ci. Sur ces deux points, les choix qui ont été faits dans le cadre de la discussion parlementaire (séparation des deux comités, d’une part, et absence de règles fixées dans la loi en matière de déontologie et de prise de parole des membres) semblent aujourd’hui confortés par la première année d’existence du Haut conseil. Un modus vivendi a été trouvé entre les deux comités et, en dépit d’un « incident » lié à la diffusion cet été d’un communiqué de presse sur la destruction de l’essai de Colmar, qui depuis a donné lieu à une mise au point en séance plénière, il n’apparaît pas nécessaire de fixer des règles plus contraignantes en matière de communication que celles qui figurent aujourd’hui dans le règlement intérieur.
Le comité scientifique du HCB a hérité des prérogatives préalablement dévolues à la CGB (commission du génie biomoléculaire) et à la CGG (commission du génie génétique) en matière d’évaluation des risques sanitaires et environnementaux liés à l’utilisation des OGM en milieu ouvert et en milieu confiné. La loi du 25 juin 2008 précise que les membres du CS sont nommés en raison de leur compétence scientifique et technique reconnue par leurs pairs, dans les domaines se rapportant notamment au génie génétique, à la protection de la santé publique, aux sciences agronomiques, aux sciences appliquées à l’environnement, au droit, à l’économie et à la sociologie (articles L. 531-4-1 du code de l’environnement). La composition du CS permet ainsi de mettre en œuvre une expertise pluridisciplinaire. Toutefois, afin de traiter de manière plus efficace les nombreuses demandes relatives à des utilisations confinées, un sous-ensemble d’experts a été constitué au sein du CS, dénommé « collège confiné », rassemblant les spécialistes de ces questions. Deux nouveaux membres les ont rejoint récemment afin de renforcer l’expertise du CS en biologie animale et microbiologie, qui constituent l’essentiel des dossiers de demandes d’utilisation confinée d’OGM (décret du 2 septembre 2010). Le rapport d’activité 2009-2010 souligne en outre qu’il est impératif pour les membres du CS de se tenir informés des évolutions techniques en cours et d’adapter leurs procédures en conséquence. Dans cette perspective, deux réflexions ont été lancées au sein du CS, d’une part, sur les protocoles d’analyse les plus adaptés aux empilements de gènes résultant de croisement de plantes ayant déjà fait l’objet d’une évaluation, et, d’autre part, sur les nouvelles technologies de modification génétique.
La Présidente du HCB considère que le CS a produit jusqu’à aujourd’hui un travail équilibré : rappelant que les avis du CS reposent sur un vote de ses membres, elle a indiqué que dans le cadre des évaluations relatives à des utilisations d’OGM en milieu ouvert, celui-ci avait ainsi pu rendre aussi bien des avis positifs (maïs) que négatifs (betterave). Le président du CS note pour sa part que, dans le cadre de ces dossiers, le CS accorde une importance particulière aux plans de surveillance (20). Quant au dossier d’utilisation confinée, les représentants des pétitionnaires que vos rapporteurs ont pu auditionner (21) se sont plutôt félicités du travail menée au sein du CS, soulignant l’absence de rupture avec la CGG dans l’examen et le traitement des demandes d’autorisation (22). Ils s’estiment donc satisfaits de l’organisation mise en place, même si des points particuliers pourraient selon eux être améliorés afin de fluidifier les relations administratives avec le HCB et améliorer la prise en compte des réalités du terrain. Les interlocuteurs auditionnés par vos rapporteurs considèrent en effet qu’en l’absence de membre issu du monde de l’industrie, le CS n’a pas une connaissance suffisante de la production industrielle et des contraintes techniques afférentes aux installations classées. Toutefois, suite à une première rencontre en juillet, des échanges formels devraient être organisés une à deux fois par an entre pétitionnaires et membres du CS. L’élaboration d’un document établissant un cadre pour les échanges entre le HCB et les pétitionnaires, sur le modèle du guide préalablement rédigé par la CGG, devrait également à contribuer à faciliter leurs rapports.
La seule interrogation soulevée relative au fonctionnement du CS concerne l’articulation entre son expertise et celle des autres agences d’évaluation compétentes. Rappelons en effet que l’article L. 531-3 du code de l’environnement précise que le HCB remplit sa mission « sans préjudice des compétences exercées par les agences visées aux articles L. 1323-1 et L. 5311-1 du code de la santé publique », en l’occurrence l’AFSSA (aujourd’hui ANSES) et l’AFSSAPS. D’après le MEEDDM, le terme « sans préjudice » signifie que l’existence du HCB ne remet pas en cause les procédures existantes de consultation obligatoire des autres agences mais n’a pas pour effet d’interdire au HCB de traiter des mêmes questions, celui-ci pouvant être amené à produire des « analyses complémentaires » à celles, par exemple, de l’ANSES. Si le risque est faible que les deux organismes produisent des évaluations contradictoires, les experts étant souvent les mêmes, cette interprétation ne paraît ni très logique (pourquoi réaliser deux fois une même expertise ?) ni totalement conforme à l’esprit de la loi. Il semblerait d’ailleurs qu’à l’occasion de la saisine du HCB sur des dossiers déjà examinés par l’AFSSA, l’ANSES ait insisté auprès du CS pour que l’analyse sanitaire ne soit pas refaite.
Enfin, s’agissant des liens entre le comité scientifique et le comité économique, éthique et social, il apparaît que les procédures de communication et d’information mises en place fonctionnent. Rappelons à cet égard que le règlement intérieur prévoit :
– conformément à l’article R. 531-20 du code de l’environnement, que le CEES peut saisir le CS de toute question qui lui paraît pertinente ;
– que dans le cadre de l’examen des dossiers dont sont saisis conjointement les deux comités, les membres du CEES peuvent à tout moment solliciter la convocation du président et d’un membre du CS « dans un but de compréhension des dossiers, de transparence et d’efficacité » ;
– que des groupes de travail communs peuvent être créés (23) ;
– enfin, en application de l’article R. 531-21, qu’un observateur du CEES est chargé de suivre les séances du CS relatives à l’agrément des dossiers d’utilisation confinée.
Le rapport d’activité 2009-2010 du HCB souligne qu’une des complexités de l’exercice demandé au CS est d’expliciter sa démarche et le sens de ses analyses : à cet égard, les échanges avec le CEES sont considérés comme très importants pour les membres du comité scientifique. D’un point de vue pratique toutefois, une meilleure coordination des travaux des deux comités serait souhaitable, notamment, comme nous allons le voir ci-dessous, afin que le CEES puisse disposer d’un temps correct d’examen des dossiers.
b) Le comité économique, éthique et social
La présence d’un comité économique, éthique et social au sein du Haut conseil des biotechnologies, chargé de formuler des recommandations à l’intention du Gouvernement, parallèlement aux avis rendus par le comité scientifique, constitue l’innovation majeure de la loi du 25 juin 2008. Le CEES a été conçu comme le lieu du débat public sur les OGM, le lieu du dialogue entre la science et la société et le lieu où les questions éthiques et socio-économiques doivent être posées. Dans cette perspective, le CEES est composée de personnalités issues de la société civile que l’on peut pour la plupart qualifier de « parties prenantes ». Cette composition fait à la fois la richesse et la complexité du CEES. Quant à l’analyse économique, éthique et sociale que le CEES doit mener, elle n’a pour l’heure pas encore été formalisée et constitue elle aussi une démarche nouvelle. En outre, le CEES ne bénéficie pas, contrairement au CS, de l’expérience d’une instance d’évaluation qui l’aurait précédé. Tout est à inventer au CEES. On ne s’étonnera pas en conséquence que le premier bilan tiré de son existence ne soit pas complètement positif, en dépit des efforts consentis par ses membres et par sa présidente, dont les qualités de dialogue et d’écoute ont été unanimement saluées par les personnes auditionnées par vos rapporteurs. Christine Noiville se montre elle-même lucide dans le rapport d’activité 2009-2010 du HCB expliquant franchement : « Pour qui en attendait la formation rapide d’un consensus et la production de recommandations clairement conclusives et directement opérationnelles, il faut rappeler que le type de travail demandé au CEES et la diversité de ses membres, ne permettent pas raisonnablement de satisfaire cette ambition, au moins dans l’immédiat ». Le CEES en sera-t-il progressivement capable. Telle est la question qui se pose aujourd’hui.
L’ensemble des membres du CEES rencontrés par vos rapporteurs ont en effet témoigné de la difficulté à organiser des débats sereins et constructifs au sein du comité, en raison notamment des prises de position radicales auxquelles l’examen des dossiers est susceptible de donner lieu. Une personne ayant siégé précédemment au sein de la CGG a ainsi estimé que les difficultés des membres à travailler ensemble étaient bien plus grandes au sein du CEES. Certaines personnes n’ont pas hésité à mettre en cause devant vos rapporteurs la légitimité de la présence d’autres membres ; d’autres se sont interrogés sur les modalités de nomination au sein du CEES, qui rendraient le dialogue impossible en désignant des personnes qui, pour la plupart, appartiennent à des mouvements défendant des positions idéologiques opposées. Une personne auditionnée a ainsi estimé que les débats au sein du CEES tournaient fréquemment à la « guerre de tranchées ». Cette même personne a également fait part de ses craintes que le CEES ne soit instrumentalisé par ceux de ses membres qui souhaitent entretenir « une psychose et un catastrophisme disproportionnés » sur les OGM. Un autre interlocuteur s’est clairement interrogé sur la poursuite de sa participation au CEES. Certains ont cependant fait preuve d’un peu plus d’optimisme : tout en reconnaissant que les échanges étaient parfois durs, ils ont considéré qu’il restait néanmoins possible de débattre au sein du CEES, notamment grâce au travail accompli par sa présidente. Enfin, comme l’a fait remarquer une personne auditionnée, « le fait que des gens, qui ne se parlaient pas, se parlent constitue déjà une expérience positive ».
Le dialogue au sein du CEES n’a en outre pas été facilité par un certain nombre de conditions matérielles qui ont rendu l’année 2009-2010 particulièrement difficile. La participation au CEES demande en effet un engagement, en temps et en travail, conséquent. A cet égard, la présidente du HCB a regretté lors de son audition le turn-over important des membres appelés à siéger au CEES (24) et a considéré que cela était dommageable pour le fonctionnement du comité en termes de connaissance des dossiers, de compréhension des sujets et de dialogue entre les membres. Quant aux critiques émises par les membres du CEES eux-mêmes, elles se sont concentré sur le rythme et les conditions de travail, qui sont jugés par tous éprouvantes. Le CEES a ainsi dû, à plusieurs reprises, se prononcer dans l’urgence. Il semblerait en effet qu’il y ait une grosse pression des ministères de tutelle, pour que le HCB rende ses avis dans des délais très courts. Par ailleurs, l’absence de coordination entre les travaux des deux comités n’a pas permis au CEES de travailler dans de bonnes conditions : le comité ne bénéficie en effet d’aucun délai minimum pour se prononcer à compter de la réception du rapport du CS, le règlement intérieur se bornant à prévoir que le Président du HCB transmet au CEES l’avis du CS « et ce, dans les meilleurs délais de telle sorte que le CEES dispose d’un laps de temps raisonnable pour travailler ». En outre, si le dossier du pétitionnaire est bien mis à la disposition des rapporteurs du CEES ab initio, il semble néanmoins logique que ceux-ci attendent l’avis du CS pour bâtir leur argumentation. Plusieurs personnes auditionnées, qui avaient déjà été rapporteurs sur des dossiers, nous ont ainsi confié n’avoir pu disposer de plus de quatre ou cinq jours entre la réception de l’avis du CS et la date à laquelle ils devaient rapporter devant le CEES. Ils ont ainsi été confrontés à l’impossibilité, par exemple, de mener des auditions pour éclairer leurs travaux. Un de nos interlocuteurs a parlé de « travail à la chaîne ». Face à ces délais très resserrés, le manque de moyens pour approfondir les dossiers, en personnel et en fonds documentaire, a également été pointé du doigt à plusieurs reprises. Plus généralement, l’absence de « marche à suivre » pour l’évaluation des risques et des bénéfices, l’absence de méthodologie applicable, a été considérée par les rapporteurs comme l’aspect le plus troublant et le plus inconfortable de leur tâche.
En effet, le CEES s’est retrouvé saisi des premiers dossiers de demandes d’autorisation d’OGM alors même qu’il n’avait pas structuré et formalisé le périmètre et la méthode de l’analyse économique, éthique et sociale à laquelle il est censé procéder. Le rapport d’activité 2009-2010 fait désormais état d’une grille d’indicateurs mise en place dans le cadre de l’analyse des dossiers de demande de mise en culture, correspondant à une liste de questions que les CEES estime devoir se poser pour alimenter sa réflexion et éclairer la décision publique. Une démarche analogue est en cours pour les dossiers d’importation. Sur le fond, le champ de l’analyse retenu par le CEES laisse parfois perplexe (25) ; sur la forme, on aurait pu penser que s’accorder sur la méthode de réflexion soit un préalable à la réflexion et à la production de recommandations.
Les premières recommandations du CEES témoignent donc d’une certaine improvisation et d’un tâtonnement dans l’analyse. La structure de ces recommandations n’a pas toujours été la même et leur mode d’adoption a également évolué au fil du temps. Alors que sur le MON 810, deux questions avaient été posées, donnant lieu à un vote, cette procédure, source de clivages, a été abandonnée : il est désormais fait état d’une position majoritaire et de positions divergentes, voire, en l’impossibilité de faire autrement, d’un éventail de positions divergentes. La présidente du CEES, Mme Noiville, note à cet égard dans le rapport d’activité 2009-2010 que sur de nombreux points, il s’agit moins de « recommandations » stricto sensu que d’une mise en regard de différents points de vue représentatifs des intérêts et sensibilités qui existent dans le corps social.
Ce même rapport d’activité précise que le CEES doit prochainement définir l’ensemble de ses grilles d’analyse : ensuite, il les publiera et les explicitera dans un guide à l’usage des pétitionnaires et de toutes les parties prenantes. En termes de méthodologie, il serait également question de faire appel à des groupes d’experts extérieurs, notamment pour analyser certaines questions récurrentes que le CEES se pose. Enfin, il semblerait qu’une réflexion soit en cours pour rationaliser les méthodes de travail et adopter des grilles d’analyse par famille d’OGM, tout en continuant, évidemment, de se prononcer au cas par cas. Une des personnes auditionnées a souligné qu’un tel travail permettrait peut-être à l’avenir au CEES de ne pas se prononcer de manière opposée sur des OGM aux propriétés identiques comme ce fut le cas sur 3 maïs résistant soit au glyphosate soit au glufosinate (MON 810, Bt 11 et 1507). Il permettrait surtout de fournir une grille de lecture des recommandations du CEES au public comme aux pétitionnaires. Rappelons que ces derniers ne disposent, dans le cadre des procédures de demande d’autorisation d’essais ou de mise sur le marché, d’aucune ligne directrice ni d’aucune procédure formalisée pour échanger avec le CEES, alors que le comité serait lui-même désireux que les pétitionnaires lui fournissent les éléments nécessaires à l’évaluation qu’il doit mener.
Conformément à la loi, les avis du HCB sont rendus publics ; ils sont pour l’heure disponibles sur le site internet www.ogm.gouv.fr mais un site internet propre au HCB devrait également voir le jour.
La transparence sur les avis du HCB est donc totale. En revanche, nombre de personnes auditionnées, qu’il s’agisse de représentants des pétitionnaires ou de membres du CEES, regrettent de ne pas être tenus informés des suites données aux avis du HCB par le Gouvernement. Bien que le règlement intérieur du HCB prévoit que le président de chaque comité, assisté du Secrétariat, informe périodiquement le comité qu’il préside des suites que les autorités compétentes ont réservé aux avis, les membres du CEES entendues par vos rapporteurs ne semblent pas avoir eu de retour sur les recommandations émises par le comité. Il est vrai que la multiplicité des cas de saisine peut rendre cet exercice compliqué. Rappelons que, s’agissant de dossiers de mise sur le marché, les saisines du Gouvernement peuvent intervenir à tous les stades de la procédure nationale et communautaire :
– en amont, au moment où l’AESA demande des commentaires sur les dossiers aux États membres, ou lorsque l’évaluation est réalisée par un autre État membre ;
– en aval, une fois que l’AESA a rendu un avis, et ce afin d’éclairer la décision de vote du Gouvernement à Bruxelles (soit en comité réglementaire, soit au Conseil) ;
– voire après autorisation de mise sur le marché, afin d’éventuellement activer une clause de sauvegarde.
Il n’en demeure pas moins que les entreprises semencières se sentent aujourd’hui quelque peu démunis face au nouveau dispositif d’expertise et de décision publique en matière d’OGM. En effet, en l’absence d’avis unique et univoque remis au Gouvernement, la position de ce dernier sur les dossiers apparaît plus difficile à prévoir. Le lien entre évaluation et décision et, plus globalement, le processus de décision leur paraissent ainsi plus opaques qu’au préalable. Ils jugent plus difficile de savoir sur quelle base se fonde la décision du Gouvernement et d’anticiper sur la position que celui-ci transmettra à Bruxelles, ce qui pose à leurs yeux à la fois un problème de prévisibilité et de transparence.
S’agissant maintenant de la communication du HCB stricto sensu, signalons que les avis du HCB sont également susceptibles de faire l’objet de communiqués de presse. Sur le site internet précité, on peut ainsi retrouver un communiqué de presse pour la plupart des avis rendus par le HCB en matière d’utilisation d’OGM en milieu ouvert. Ces communiqués de presse sont publiés directement par le Haut conseil. Ils sont uniquement factuels : rappelant l’objet de chaque saisine et le rôle de chacun des comités, ils mettent en évidence les points saillants de l’avis du CS et des recommandations du CEES tout en faisant état des éventuelles opinions divergentes.
Le seul communiqué de presse du HCB qui a pu faire débat n’avait d’ailleurs pas trait à un avis : il visait à réagir à la destruction de l’essai de Colmar en août dernier. Le texte en lui-même demeurait factuel et rappelait que le HCB avait donné un avis positif à la poursuite de l’essai ; le titre, en revanche, par la suite contesté par certains membres du CEES appartenant à des syndicats agricoles ou des associations environnementalistes solidaires des actes de fauchage ou des faucheurs membres de leurs organisations respectives (26), utilisait le verbe « déplorer » s’agissant de la destruction de l’essai. Fut également remise en cause la procédure d’adoption de ce communiqué de presse qui émanait du bureau du HCB qui y était favorable à l’unanimité moins une voix. Cette procédure paraît néanmoins conforme au règlement intérieur qui précise que « le bureau du Haut conseil des biotechnologies décide des modalités de diffusion et/ou de publication des documents autres que ceux cités précédemment (27) et réalisés sous son autorité ». L’évènement a néanmoins donné lieu à un « psychodrame » au sein du HCB, selon l’expression utilisée par un membre du CEES, obligeant la présidente à faire une mise au point début septembre. Rappelant que le HCB « peut mener des actions d’information se rapportant à ses missions » (article L. 531-3 du code de l’environnement), la Présidente a estimé que si le HCB devait, pour des raisons de crédibilité, s’abstenir de trop communiquer sur des sujets d’actualité, il ne pouvait pas établir comme principe de s’interdire de communiquer, sans compter que son avis serait vraisemblablement sollicité par les médias. Elle a en outre fermement établi que le bureau, en tant qu’instance dirigeante du HCB, était habilité à communiquer en son nom et qu’en l’absence de compromis en son sein, la règle majoritaire s’imposait ; en revanche, l’absence d’unanimité sera à l’avenir signalée selon une formule ad-hoc et, autant que faire se peut, les projets de communiqués de presse seront diffusés en interne avant communication à la presse. Au-delà de la question de la communication du HCB, cet incident a soulevé un questionnement de fond au sein du HCB sur l’appartenance de certains de ses membres à des organisations prônant des actions illégales contre les OGM. Mais ce questionnement dépasse le seul cadre du Haut conseil des biotechnologies et amène à s’interroger plus globalement sur l’opportunité de soumettre la participation à des instances dont la vocation est de conseiller le Gouvernement à des règles générales d’éthique ayant pour socle minimal le respect de la loi et l’absence de soutien à des actions illégales.
II.— DE NOMBREUSES INTERROGATIONS SUR LES TEXTES D’APPLICATION EN COURS D’ÉLABORATION
A.— LA TRANSPARENCE ET L’INFORMATION DU PUBLIC
Suite à deux arrêts du Conseil d’État du 24 juillet 2009 (28), les dispositions des décrets n° 2007-358 (29) et n° 2007-359 (30) du 19 mars 2007 concernant l’information et la participation du public dans le cadre de demandes d’autorisation de dissémination d’OGM (expérimentation et mise sur le marché) ont été annulées pour cause de non conformité à la Constitution, et plus précisément à l’article 7 de la Charte de l’environnement.
Rappelons que cet article dispose que « toute personne a le droit, dans les conditions et les limites définies par la loi, d’accéder aux informations relatives à l’environnement détenues par les autorités publiques et de participer à l’élaboration des décisions publiques ayant une incidence sur l'environnement ». Le Conseil constitutionnel a estimé qu’il résultait de ces dispositions qu’il n’appartenait « qu’au législateur de préciser ‘les conditions et les limites’ dans lesquelles doit s’exercer le droit de toute personne à accéder aux informations relatives à l’environnement détenues par les autorités publiques » (31). Le Conseil d’État, reprenant cette analyse, a donc logiquement annulé, dans une première décision, les dispositions du e) et du treizième alinéa de l’article 2 (32), du I de l’article 11 (33), de l’article 13 (34) et de l’article 17 (35) du décret n° 2007-359 et, dans une seconde, celles de l’article 5 (36), du I de l’article 6 (37), des articles 10 (38) et 13 (39), et du premier alinéa de l’article 16 (40) du décret n° 2007-358. L’annulation immédiate étant toutefois, de nature à méconnaître l’exigence de transposition des directives communautaires et à entraîner des conséquences manifestement excessives, le Conseil d’État a décidé de ne prononcer l’annulation de ces dispositions qu’à compter du 30 juin 2010, permettant ainsi au Gouvernement de « prendre les initiatives nécessaires pour remédier à l’irrégularité constatée » (41).
Suite au constat selon lequel cette question dépassait le simple cadre des OGM mais s’appliquait à tous les cas d’information du public en matière environnementale, le Gouvernement a décidé de prendre un texte général. Cette initiative s’est concrétisée dans le cadre de la loi n° 2010-788 du 12 juillet 2010 portant engagement national pour l’environnement, dont l’article 244 (article L. 120-1 du code de l’environnement) définit désormais les conditions et limites dans lesquelles le principe de participation du public défini à l’article 7 de la Charte de l’environnement est applicable aux décisions réglementaires de l'État et de ses établissements publics.
|
Article L. 120-1 du code de l’environnement créé par la loi n° 2010-788 du 12 juillet 2010 – article 244 « Le présent article définit les conditions et limites dans lesquelles le principe de participation du public défini à l'article 7 de la Charte de l'environnement est applicable aux décisions réglementaires de l'État et de ses établissements publics. « I. – Sauf disposition particulière relative à la participation du public prévue par le présent code ou par la législation qui leur est applicable, les décisions réglementaires de l'État et de ses établissements publics sont soumises à participation du public lorsqu'elles ont une incidence directe et significative sur l'environnement. Elles font l'objet soit d'une publication préalable du projet de décision par la voie électronique dans des conditions permettant au public de formuler des observations, selon les modalités fixées par le II, soit d'une publication du projet de décision avant la saisine d'un organisme consultatif comportant des représentants des catégories de personnes concernées par la décision en cause, selon les modalités fixées par le III. « II. – Le projet de décision, accompagné d'une note de présentation, est rendu accessible au public pendant une durée minimale de quinze jours francs. Le public est informé de la date jusqu'à laquelle les observations présentées sur le projet seront reçues. Le projet ne peut être définitivement adopté avant l'expiration d'un délai de deux jours francs à compter de cette date. Lorsque le volume ou les caractéristiques des documents ne permettent pas leur publication par voie électronique, l'information mise en ligne comprend un résumé du dossier ainsi qu'une indication des lieux et heures où l'intégralité du dossier peut être consultée. « III. – Le projet de décision fait l'objet d'une publication, éventuellement par voie électronique, avant transmission à un organisme consultatif comportant des représentants des catégories de personnes concernées par la décision en cause, dont la consultation est obligatoire en vertu d'une loi ou d'un règlement. La publication du projet est accompagnée d'une note de présentation. Le projet ne peut être définitivement adopté avant l'expiration d'un délai de quinze jours francs à compter de la date de publication du projet. |
« IV. – Le I ne s'applique pas lorsque l'urgence justifiée par la protection de l'environnement, de la santé publique ou de l'ordre public ne permet pas l'organisation d'une procédure de participation du public. Les délais visés aux II et III peuvent être réduits lorsque l'urgence, sans rendre impossible la participation du public, le justifie. « V. – Les modalités de la participation du public peuvent être adaptées en vue de respecter les intérêts mentionnés au 1° du I de l'article L. 124-4. « VI. – Les modalités d'application du présent article sont définies par décret en Conseil d'État. » |
Cet article ne constitue toutefois que le socle de la législation applicable, et doit ensuite être décliné pour chaque procédure particulière. Ainsi, la question de l’information et de la participation du public dans le cadre des procédures relatives aux OGM, mais aussi dans le cadre des procédures afférentes aux installations classées, ou encore s’agissant des décisions relevant non pas de l’État mais des collectivités locales, n’a pas été réglée. En l’absence de texte déposé par le Gouvernement, il semblerait que M. Bertrand Pancher, qui fut notamment rapporteur de la Commission du développement durable sur le projet de loi portant engagement national pour l’environnement, travaille actuellement à la rédaction d’une proposition de loi.
En attendant, cette situation a des conséquences très concrètes. Ainsi, depuis le 30 juin, l’absence dans notre corpus législatif et réglementaire de dispositions concrètes organisant l’information et la participation du public rend de fait impossible de mener à bien l’instruction d’une demande d’autorisation d’essai en plein champ, comme nous l’a confirmé le MAAP lors des auditions, mais également d’autorisation de mise sur le marché.
Pour s’en tenir au seul domaine de l’expérimentation, rappelons qu’il n’y a plus eu de nouvelle autorisation d’essai ni même de nouvelle demande d’autorisation d’essai depuis 2007 en France (42), à l’exception de l’autorisation donnée par le ministre chargé de l’agriculture à la reprise de l’essai de Colmar au mois de mai 2010. Avec la destruction de cet essai le 15 août dernier, il ne reste plus qu’un seul essai en plein champ sur le territoire français, celui mené par l’INRA sur le peuplier à Orléans. A cet égard, bien qu’aucune disposition de portée normative très concrète ne figure dans la loi, celle-ci a bel et bien failli à son objectif de soutenir la recherche et de concilier transparence et sérénité des travaux des chercheurs. La destruction de l’essai de Colmar, une première fois en septembre 2009 assortie d’une condamnation très légère pour l’auteur des faits (43), puis une deuxième fois cet été alors que l’essai avait bénéficié d’une nouvelle autorisation après un avis positif du Haut Conseil des Biotechnologies, est à ce titre exemplaire et montre bien les limites de la transparence et de la concertation locale. Cet acte de fauchage volontaire nous permettra cependant de vérifier si la loi est effectivement appliquée par les juges : rappelons en effet qu’en vertu de l’article L. 671-15 du code rural, est désormais puni de trois ans d’emprisonnement et de 150 000 euros d’amende le fait de détruire ou de dégrader une parcelle de culture OGM autorisée à titre d’essai. Si on peut supposer que ces dispositions n’avaient pas été appliquées à l’occasion de la condamnation de l’auteur de la première destruction de l’essai, en raison de la décision préalable du tribunal de Strasbourg d’annuler l’autorisation dont bénéficiait cet essai (qui ne pouvait donc être regardé comme autorisé au moment de la commission des faits), la loi devrait cette fois-ci être considérée comme pleinement applicable.
Néanmoins, quelle que soit l’issue de la procédure, il n’est pas certain que les chercheurs de l’INRA décident de relancer une troisième fois l’expérimentation mise en œuvre à Colmar. La Présidente de l’INRA comprend d’autant moins le geste des « faucheurs » que l’institut de recherche public s’est doté depuis 2007 d’une politique scientifique très stricte vis-à-vis des biotechnologies, imposant que les innovations poursuivies visent uniquement des cibles d’intérêt collectif répondant à des défis décisifs pour l’agriculture, l’alimentation et l’environnement, que la transgénèse ne soit envisagée que sur la base d’une évaluation comparative par rapport aux autres innovations possibles et que les recherches menées contribuent à renforcer les capacités nationales d’expertise publique (44). Le risque de déperdition de nos capacités d’expertise a été également souligné par la présidente du HCB ainsi que par les représentants de l’AESA qui craignent qu’en l’absence d’essais et d’observations concrètes réalisées sur le territoire européen, il ne devienne impossible d’évaluer les dossiers de demandes d’autorisation soumis par les pétitionnaires.
La loi du 25 juin 2008, dès son article 2, reconnaît la « liberté de consommer et de produire avec ou sans organismes génétiquement modifiés ». Plus précisément, le premier alinéa de l’article L. 531-2-1 du code de l’environnement dispose que les OGM ne peuvent être « cultivés, commercialisés ou utilisés que dans le respect (…) des filières de production et commerciales qualifiées ‘sans organismes génétiquement modifiés’ ». Tout en indiquant que la définition du « sans organismes génétiquement modifiés » se comprend nécessairement par référence à la définition communautaire, cet article renvoie à un décret pris après avis du Haut conseil des biotechnologies le soin de définir le seuil correspondant, dans l’attente d’une définition au niveau européen.
Il appartient donc au Gouvernement en application de cet article de proposer un seuil permettant d’identifier les produits dits « sans OGM », c'est-à-dire d’élaborer des règles de reconnaissance et d’étiquetage de ces produits. Déjà éclairé par l’avis du Conseil national de la consommation (CNC) du 19 mai 2009 relatif à la valorisation des filières n’utilisant pas d’OGM, le Gouvernement a, conformément à la loi, saisi le HCB de cette question en juin 2009 et l’avis de celui-ci a été rendu public le 3 novembre 2009. Il préconise l’identification de trois catégories de produits selon les modalités décrites dans le tableau ci-après.
Produits végétaux |
Produits animaux |
Produits issus de l’apiculture |
Etiquetage « sans OGM » en-dessous de 0,1 % de présence fortuite (seuil de quantification) |
Deux étiquetages « sans OGM » possibles : - en-dessous de 0,1 % de présence fortuite d’OGM dans l’alimentation animale - entre 0,1 % et 0,9 % de présence fortuite d’OGM dans l’alimentation animale (zone grise) |
Etiquetage « sans OGM » dans un rayon de X kilomètres du rucher (en fonction du type de cultures environnantes et de la distance) |
Rappelons qu’aujourd’hui, en application d’une jurisprudence constante de la DGCCRF, la mention sur l’étiquetage d’un produit d’une allégation du type « sans OGM » ne s’applique qu’aux produits dans lesquels la présence d’OGM est effectivement vérifiable et implique l’absence de toute trace d’OGM dans le produit ainsi que l’interdiction d’utiliser des OGM, sous quelque forme que ce soit, dans l’élaboration de ce produit (45).
Le comité économique, éthique et social du HCB propose d’assouplir quelque peu cette doctrine soulignant que l’importation des OGM et la possibilité d’une présence accidentelle techniquement inévitable obligent à « dépasser la définition qu’évoque intuitivement la notion ‘sans OGM’ (comme absence totale d’ADN transgénique) au profit d’une définition techniquement réalisable et socialement acceptable ». Sous réserve de confirmation par une analyse économique portant sur les coûts liés à la production « sans OGM » et sur leur répartition (46), cette démarche conduit le CEES à fixer les seuils suivants :
– moins de 0,1 % pour les produits végétaux « sans OGM » ;
– et moins de 0,1 % également dans l’alimentation animale pour les produits issus d’animaux, comme le lait, la viande ou encore les œufs, qui seraient alors étiquetés « nourri sans aliments OGM » ou « issu d’animaux nourris sans aliments OGM ». Mais le CEES va plus loin en estimant qu’ « il serait également justifié d’étendre la possibilité d’étiquetage à la ‘zone grise’ comprise entre le seuil de 0,1 % et le seuil de 0,9 % ». Cette possibilité est toutefois affichée comme transitoire « tant que l’Union européenne ne sera pas autonome en matière de production de protéines pour l’alimentation animale », objectif louable dont il n’est cependant pas certain qu’il soit jamais atteint. D’après la présidente du CEES, un plan de progrès devrait être mis en place dès la parution du décret pour aller vers un seuil moindre afin de « ne pas faire du 0,9 % une norme dans laquelle on s’installe » (47). Notons à titre de comparaison qu’en Allemagne, la mention « nourri sans aliment OGM » s’applique aux produits issus d’animaux dont l’alimentation est considéré comme « sans OGM » à hauteur du seuil communautaire de présence fortuite, c’est-à-dire 0,9 % ; s’agissant des produits carnés, cette garantie d’alimentation sans OGM ne s’applique en outre dans certains cas qu’aux trois derniers mois précédant l’abattage. Le CEES a pour sa part considéré que les animaux devaient avoir été nourris sans OGM toute leur vie, à l’exception des animaux achetés à l’extérieur de l’exploitation et, en cas de « non-disponibilité » d’animaux nourris sans OGM, des volailles, et enfin des animaux reproducteurs, qui doivent avoir été nourris sans OGM au minimum pendant les périodes fixées par le règlement communautaire relatif à l’agriculture biologique (48). Par ailleurs, le HCB reprend sur plusieurs points l’avis précité du CNC notamment en recommandant que les mentions « sans OGM » ne puissent être apposées que sur les denrées et produits alimentaires susceptibles d’être génétiquement modifiés. Il fait en revanche une exception pour les produits d’animaux nourris à l’herbe qui devraient quand même pouvoir être étiquetés « nourris sans OGM ». Enfin, contrairement au CNC, il donne son aval à l’utilisation d’auxiliaires technologiques ou supports d’additifs ou d’arômes en l’absence de produits de substitution disponible.
En distinguant deux seuils de présence fortuite d’OGM dans l’alimentation animale, le HCB n’a pas choisi la facilité ni la simplicité. Comment le consommateur peut-il appréhender cette « zone grise » entre 0,1 % et 0,9 % susceptible d’ouvrir droit à une allégation d’absence d’OGM, alors même qu’il existe une autre mention « sans OGM » à un taux de présence fortuite inférieur, mais pas nul ? Est-ce parce que le CEES considère qu’il sera impossible d’avoir des filières à 0,1 % que la possibilité a été laissée de valoriser l’absence d’OGM entre 0,1 % et 0,9 % ? Apparemment pas puisqu’il considère que l’étiquetage « sans OGM » en zone grise pourrait n’être que transitoire, le temps que les structures de production s’adaptent à l’objectif du « sans OGM » à 0,1 %, le plafond de 0,9 % s’abaissant ainsi progressivement pour atteindre ce seuil. Cette vision n’est cependant pas partagée par tous et notamment pas par la FNSEA et les JA qui font valoir qu’entre 0,1 % et 0,9 %, on est simplement en présence de produits issus de l’agriculture conventionnelle et qu’il n’y a donc pas lieu de recourir à quelque mention « sans OGM » que ce soit.
Enfin, se pose très concrètement la question de la formulation de ces deux mentions. L’UFC, lors de son audition, a évoqué la possibilité d’utiliser les termes : « nourri sans aliments OGM » pour les produits en dessous du seuil de 0,1 % et « nourri sans utilisation d’OGM » pour les produits sous le seuil de 0,9 %. La distinction est subtile et présente vraisemblablement le risque d’être totalement opaque et non signifiante pour le consommateur. Les modalités d’information sur le seuil doivent également être tranchées : doit-on s’en tenir à la notion de présence fortuite inférieure à 0,1 % ou 0,9 % ou, sur le modèle des publicités diffusées actuellement par une marque de viande de volaille, mettre en valeur une alimentation garantie sans OGM à 99,1 % ? Enfin, la possibilité de cumuler ces nouvelles mentions avec les allégations existantes ou les signes de qualité pose également la question du risque de surinformation dans l’étiquetage des produits et donc de confusion pour le consommateur. Or, toujours d’après l’UFC, les organismes de défense et de gestion d’un certain nombre de produits sous signes de qualité seraient effectivement intéressés par la possibilité de bénéficier d’une mention « sans OGM » au niveau de la zone grise. Les représentants de l’agriculture biologique, autre signe d’identification de l’origine et de la qualité, viseraient plutôt quant à eux l’obtention de la mention « sans OGM » correspondant au seuil de 0,1 % (49).
On comprend donc que la rédaction du décret « sans OGM » ait soulevé un certain nombre de difficultés. La DGCCRF, qui est chef de file pour la mise au point du texte, en a ainsi indiquées au moins trois devant vos rapporteurs :
– s’est posée tout d’abord la question de la base juridique sur laquelle devait reposer le décret : bien que découlant de l’article L. 531-2-1 du code de l’environnement, le décret sur l’étiquetage « sans OGM » ne pouvait se contenter d’y référer dans la mesure où l’article L. 531-2-1 n’est pas visé à l’article L. 536-1 de ce même code concernant la constatation des infractions et l’habilitation des agents (50). Un décret pris sur cette seule base aurait pour conséquence que seuls les officiers et agents de police judiciaire seraient habilités à contrôler le respect de ces dispositions. Pour que les agents des fraudes puissent intervenir, il convenait en effet de se référer au code de la consommation ;
– ensuite, l’avis du HCB laisse une latitude assez importante au Gouvernement, notamment en raison des incertitudes liées aux résultats de l’analyse économique des filières sans OGM et tout particulièrement à la répartition des coûts de production avant/après en fonction des différents scenarii envisagés. Un appel d’offre a donc été lancé et un cabinet a été choisi pour procéder à cette étude dont les résultats devraient être disponibles au mois de novembre 2010. Vos rapporteurs tiennent à cet égard à indiquer que plusieurs personnes auditionnées au sein du monde agricole, qui avaient mis en place des filières tracées sans OGM en réponse à une demande de la grande distribution (viande, lait) ont signalé avoir été contraints d’arrêter pour des questions de coût et d’indisponibilité de la matière première. Lors de leur déplacement en Alsace en octobre 2009, vos rapporteurs ont également pu constater les efforts demandés par la préservation d’une filière maïs destinée à 80 % à l’alimentation humaine garantie sans OGM au seuil de détection. Leurs interlocuteurs de la coopérative céréalière Comptoir agricole de Hochfelden (51) ont notamment insisté sur la difficulté de réaliser les analyses nécessaires, leur coût, aussi bien en temps qu’en argent, et les limites inhérentes aux différentes méthodes de détection. Enfin, les extrapolations qu’ils ont présentées à vos rapporteurs en cas d’introduction d’une filière OGM en Alsace leur ont permis d’avoir une idée des investissements nécessaires pour assurer une collecte, un transport et un stockage séparés des produits avec et sans OGM à l’échelle d’une région : le coût annuel supplémentaire est ainsi estimé à 2,2 millions d’euros soit 2,75 euros par tonne collectée, à répercuter ensuite intégralement sur les clients de la filière conventionnelle ou « sans OGM » (52) ;
– enfin, la rédaction et la structuration du texte ainsi que le choix de la formulation des mentions « sans OGM » soulèvent un certain nombre de difficultés non seulement conceptuelles, comme nous l’avons vu précédemment, mais également juridiques, eu égard aux principes même de l’étiquetage. Rappelons à cet égard que les informations y figurant doivent être complètes, loyales et vérifiables. Toute mention mettant en évidence l’absence d’OGM dans la composition d’un produit ou dans l’alimentation de l’animal à l’origine du produit doit donc être explicite et claire. Mais elle ne doit pas non plus être formulée de manière à jeter le discrédit sur les produits ne bénéficiant pas de cette mention. A l’occasion des travaux menés dès 2008 dans le cadre du CNC sur la création d’une mention « sans OGM », l’industrie agroalimentaire, par la voix de l’ANIA, avait d’ailleurs clairement mis en garde contre les risques de pénalisation des produits non étiquetés « sans OGM » que cette initiative pouvait susciter. Enfin, la question de la coexistence au sein de l’Union européenne de plusieurs mentions « sans OGM » pose également la question de l’étiquetage des produits importés : les règles fixées dans le décret ne s’appliqueront-elles qu’aux denrées produites et commercialisées sur le territoire national ou également aux denrées produites dans d’autres pays et commercialisées en France ? Quid par exemple des produits « sans OGM » allemands importés ?
Enfin, dernier obstacle à la parution de ce décret : celui-ci doit être notifié à Bruxelles au titre de la directive 98/34/CE prévoyant une procédure d’information dans le domaine des normes et des réglementations techniques susceptibles de constituer une entrave aux échanges. Rappelons que la Commission européenne a déjà eu à connaître du projet allemand d’étiquetage sans OGM. A cet égard, les interlocuteurs rencontrés par vos rapporteurs au sein de la DG SANCO (53) ont pu leur apporter les précisions figurant dans le tableau suivant. En résumé, la ligne directrice appliquée par les services de la Commission consiste à admettre qu’un étiquetage du type « sans OGM » est possible à condition qu'il reflète bien la composition et la qualité réelle du produit. Cette position générale ne nous permet donc pas d’augurer de la position que pourrait prendre la Commission sur le projet de décret français et notamment sur l’existence de deux mentions « sans OGM » pour les produits animaux.
L’étiquetage « sans OGM » n’est pas interdit par la législation de l’Union européenne sous réserve d’être conforme aux dispositions de la directive 2000/13/CE concernant l’étiquetage et la présentation des denrées alimentaires.
Cette directive prévoit en son article 2 (1) que l'étiquetage ne doit pas être de nature à induire l’acheteur en erreur notamment :
– (a) sur les caractéristiques de la denrée alimentaire et notamment sur la nature, l’identité, les qualités, la composition (...) ;
– (b) en attribuant à la denrée alimentaire des effets ou des propriétés qu’elle ne posséderait pas ;
– (c) en lui suggérant que la denrée alimentaire possède des caractéristiques particulières, alors que toutes les denrées alimentaires similaires possèdent cette même caractéristique ;
Sur la base de ces considérations, il est généralement admis par la Commission :
– qu’étiqueter un produit « sans OGM » alors qu’il n’y a aucun équivalent génétiquement modifié du même produit est trompeur ;
– qu’étiqueter un produit « sans OGM » alors qu’il contient une présence d’OGM, même fortuite, est trompeur ;
– qu’étiqueter « sans OGM » un produit d’origine animale risque d’induire le consommateur en erreur en lui laissant penser qu'il existe des animaux génétiquement modifiés sur le marché de l’Union européenne. La Commission a ainsi suggéré à l’Allemagne de lui préférer une mention faisant référence au fait que l’animal n’avait pas été nourri avec des OGM.
Ainsi, pour un étiquetage du type « produit à partir d’animaux nourris sans OGM » s’agissant de produits provenant d’animaux nourris avec des aliments non étiquetés OGM (qui suppose que l'animal peut avoir été nourri avec des aliments contenant jusqu'à 0,9 % de présence accidentelle) la position la plus généralement admise au sein des services de la Commission est que nourrir les animaux sans aucun recours à des aliments pour animaux étiquetés OGM représente un effort financier important pour un éleveur par rapport à celui qui nourrit ses animaux avec des produits étiquetés OGM et que cet effort justifie une certaine flexibilité dans l’approche précédemment décrite. Un étiquetage du type « nourri sans OGM » alors que l’animal peut avoir consommé des aliments ayant une teneur de présence fortuite d’OGM jusqu’à 0,9 % est donc admis.
C.— LA COEXISTENCE ET LE RÉGIME DE RESPONSABILITÉ
Le chapitre II de la loi du 25 juin 2008 comprend l’ensemble des dispositions relatives à la responsabilité et à la coexistence des cultures, dont aucune n’a pour l’heure été mise en œuvre. On signalera cependant que la chambre d’agriculture de l’Ardèche s’est saisie de la possibilité offerte par l’article 4 en s’engageant le 18 septembre 2009 à ne pas cultiver d’OGM sur le territoire du Parc naturel régional des Monts d’Ardèche. Notons toutefois qu’il faudra attendre la révision de la charte de ce parc afin que cette exclusion soit entérinée conformément à l’article L. 335-1 du code de l’environnement.
S’agissant des conditions techniques de coexistence prévues à l’article 6 de la loi auxquelles sont soumises la mise en culture, la récolte, le stockage et le transport des OGM, rappelons que celles-ci doivent faire l’objet d’un arrêté du ministre chargé de l’agriculture pris après avis du comité scientifique du HCB et du ministre chargé de l’environnement. D’après les informations recueillies auprès du MAAP le 15 septembre dernier, la saisine officielle du comité scientifique du Haut conseil sur le projet d’arrêté était imminente. Signalons en outre que le comité économique, éthique et social s’est autosaisi de cette question. A cet égard, nombre de personnes auditionnées se sont interrogées devant vos rapporteurs sur la responsabilité de la mise en œuvre des conditions de coexistence et de la répartition de leur coût entre filières OGM et non OGM. Or, l’article L. 663-2 du code rural précise très clairement que les conditions techniques « doivent permettre que la présence accidentelle d’organismes génétiquement modifiés dans d’autres productions soit inférieure au seuil établi par la réglementation communautaire ». Il semblerait en conséquence logique que le coût supplémentaire induit par des conditions techniques plus strictes visant notamment à obtenir un taux de présence fortuite limité à 0,1 % soit à la charge des filières qui souhaitent atteindre cet objectif et peuvent ensuite le valoriser par une mention spécifique « sans OGM » apposée sur leurs produits. Ce n’est toutefois pas l’avis des représentants de l’agriculture biologique et d’autres syndicats agricoles auditionnés par vos rapporteurs qui plaident en faveur d’une prise en charge du coût du « sans OGM » par la filière OGM.
La question de la coexistence pose également celle du taux de présence fortuite dans les semences. Il semblerait cependant que, dans l’attente de la définition du seuil « sans OGM », les travaux sur le décret prévu à l’article 21 de la loi n’aient pas commencé. Signalons qu’aucune saisine du HCB n’est prévue par la loi pour ce décret. Quant au décret précisant les modalités d’application de l’article L. 663-4 du code rural s’agissant de la réparation du préjudice économique résultant de la présence accidentelle d’OGM dans d’autres productions, qui relève de la responsabilité du ministère de l’économie, il est en cours de rédaction.
Enfin, sur une question relevant du chapitre « transparence » mais qui n’est pas sans lien avec la coexistence, signalons que le projet de décret prévu pour l’application de l’article L. 663-1 du code rural relatif à la déclaration des cultures OGM auprès de l’autorité administrative a été transmis pour avis au Haut conseil des biotechnologies. D’après les informations dont disposent vos rapporteurs, le délai retenu devrait vraisemblablement être 15 jours avant les semis. S’agissant en revanche de l’information des exploitants voisins préalablement aux semis, le projet de texte est encore en discussion au niveau interministériel : il devrait fixer des modalités d’information par culture et à date fixe. D’aucuns plaident pour que l’information intervienne le plus tôt possible et corresponde peu ou prou à la période d’achat des semences pour chaque type de culture concerné.
D.— L’UTILISATION DES OGM EN MILIEU CONFINÉ
L’ensemble des dispositions de la loi relative à l’utilisation confinée des OGM doivent faire l’objet d’un décret unique, élaboré par le ministère de la recherche. Le projet de décret est à l’heure actuelle encore soumis à consultation. Les représentants des entreprises de biotechnologies concernées ont indiqué à vos rapporteurs avoir fait remonter dans le cadre de cette consultation un certain nombre d’interrogations concernant les modalités d’application de la loi.
Leur premier sujet de préoccupation concerne les dispositions relatives à la transparence et à l’information du public. Il s’agit en effet d’un aspect nouveau s’agissant de l’utilisation confinée d’OGM, dans la mesure où, auparavant, de telles modalités n’étaient pas prévues. Or, l’application de ce principe à des utilisations susceptibles d’entrer directement dans le champ du secret industriel et commercial voire à des utilisations d’OGM non encore protégés par un brevet suscite quelques inquiétudes de leur part. Rappelons cependant que des dispositions ont été précisément introduites dans la loi pour couvrir ce dernier cas de figure, le quatrième alinéa de l’article L. 531-2-1 du code de l’environnement précisant que « les conclusions de toutes les études et tests (…) sont mises à la disposition du public sans nuire (…) à la protection de la propriété intellectuelle lorsque l’organisme génétiquement modifié ne fait pas encore l’objet d’une protection à ce titre ». Il s’agit toutefois d’une disposition de portée générale dont la mise en œuvre dans les cas évoqués par les personnes auditionnées pourrait nécessiter d’être explicitée au niveau réglementaire, bien que cela ne soit pas directement prévu par la loi. Plus généralement, les conditions de divulgation des informations et notamment le contenu des dossiers d’information, le lieu de consultation de ceux-ci et les modalités d’affichage en mairie, devront permettre à la fois de respecter le principe de transparence et la protection des intérêts légitimes de ces entreprises.
L’attention de vos rapporteurs a également été attirée sur certaines incohérences qui pourraient se faire jour lors de l’entrée en application de la loi. Les personnes auditionnées ont notamment indiqué qu’il pourrait y avoir des incohérences entre la réglementation applicable à l’utilisation des OGM en milieu confiné et la réglementation applicable aux ICPE (installations classées pour la protection de l’environnement), dans lesquelles ont lieu ces utilisations. Il serait notamment question d’un risque d’incompatibilité entre les procédures de déclaration et d’agrément prévues par chacune de ses réglementations ainsi qu’entre les durées de validité des autorisations délivrées dans chacun des cas. Enfin, une harmonisation des procédures administratives serait souhaitable afin de réduire les délais d’examen.
III.— DES DISPOSITIONS LÉGISLATIVES BIENTÔT OBSOLÈTES ?
A.— LES CONCLUSIONS DU CONSEIL EUROPÉEN DU 4 DÉCEMBRE 2008
Sous la Présidence française de l’Union européenne, le Conseil des ministres de l’environnement a adopté, le 4 décembre 2008, des conclusions sur les organismes génétiquement modifiés constituant en quelque sorte un programme d’actions ou d’inflexions à mettre en œuvre par la Commission afin d’améliorer la mise en œuvre du cadre juridique européen d’autorisation, et ce afin de mieux répondre aux objectifs de protection de l’environnement et de la santé humaine et animale.
Cinq axes d’intervention sont ainsi proposés :
– un renforcement de l’évaluation environnementale. Dans ce cadre, mandat a été donné à l’AESA pour entamer à partir de mars 2008 un travail de révision du volet de ses lignes directrices relatif à l’évaluation des risques environnementaux, qui doit s’achever en 2010. Les États membres sont invités à participer à ce processus par le biais d’une consultation de leurs organismes scientifiques compétents ;
– une évaluation des avantages et des risques socioéconomiques. La Commission européenne est chargée de collecter les informations pertinentes sur les conséquences socioéconomiques de la mise sur le marché des OGM en recueillant les expériences et les avis des États membres. Sur cette base, un rapport doit être présenté au Parlement européen et au Conseil afin de servir de base à des discussions ultérieures. Ce rapport doit être produit par la Commission en principe d’ici la fin de l’année 2010 ;
– un recours accru à l’expertise des États membres. Une plus grande participation des États membres dans le processus d’évaluation mis en œuvre par l’AESA a été encouragée, suite notamment à la proposition de l’agence européenne d’associer directement à l’évaluation d’autres États membres en plus de celui auquel l’évaluation des risques environnementaux est déléguée ;
– la fixation d’un seuil européen d’étiquetage pour les semences. Le Conseil s’est prononcé en faveur de la fixation de seuils établis à des niveaux « réalistes, proportionnés et fonctionnels » les plus bas possible. S’il a encouragé la Commission à adopter des seuils appropriés « dans les plus brefs délais », aucune date butoir n’a été précisée ;
– la prise en compte des zones sensibles et/ou protégées. Le Conseil a souligné la nécessité de tenir pleinement compte des spécificités régionales et locales des États membres. Il indique qu’en application du principe de précaution, les régions qui présentent des caractéristiques agronomiques et environnementales particulières peuvent nécessiter « l’adoption de mesures de gestion ou de restriction spécifiques pour chaque cas, y compris des mesures d’interdiction en matière de culture d’OGM ». Cette pétition de principe ne débouche toutefois pas sur une orientation opérationnelle pour la Commission.
S’agissant du renforcement de l’expertise, les interlocuteurs de l’AESA rencontrés à Bruxelles ont indiqué à vos rapporteurs que l’agence européenne s’était saisie d’un certain nombre de questions méthodologiques afin d’améliorer sa propre expertise mais aussi, le cas échéant, de faire évoluer les critères d’évaluation imposés aux pétitionnaires. Sept groupes de travail sont ainsi à pied d’œuvre sur la question des statistiques, des tests sur les rats à 90 jours ou encore sur les lignes directrices relatives à l’évaluation environnementale. La révision de ces lignes directrices devrait d’ailleurs aboutir au mois de novembre 2010. Une valeur normative pourrait ensuite leur être donnée, permettant, par le biais de la comitologie, d’associer pleinement les États membres à la démarche de révision.
Enfin, bien que cette question n’ait pas été abordée dans les conclusions du Conseil du 4 décembre 2008, la révision du volet sanitaire de l’évaluation, et notamment des protocoles d’analyse toxicologique, fait partie, au même titre que les points soulevés dans les conclusions du Conseil de décembre 2008, des sujets que la France souhaite voir régler préalablement à toute autre évolution du cadre législatif ou réglementaire européen. Sur le fond, le Gouvernement français dénonce la faiblesse de l’analyse toxicologique réalisée par l’AESA. Les lignes directrices appliquées par l’agence européenne en la matière ne prévoient pas systématiquement de mener à bien des tests à 90 jours sur les rats et ces tests, lorsqu’ils sont mis en œuvre, ne sont pas réalisés à partir de la totalité de la plante génétiquement modifiée. L’ANSES estime que la conception même de ces tests ne permet pas une extrapolation statistique satisfaisante. L’agence française a donc préparé une proposition d’amélioration dans une note diffusée au mois de juin, et un rapport complet sur le sujet doit sortir prochainement et être transmis à l’AESA. Cette question est toutefois compliquée par le fait que les lignes directrices suivies par l’AESA correspondent aux lignes directrices de l’OCDE (54), ce qui impliquerait soit de s’en éloigner soit d’obtenir la révision de celles-ci , sujet qui dépasse la seule problématique scientifique pour entrer dans la sphère diplomatique (55).
B.— LA NOUVELLE STRATÉGIE DE LA COMMISSION EUROPÉENNE
Le dossier des OGM a plus d’une fois embarrassé la première commission Barroso qui a été régulièrement contrainte de se prononcer sur des demandes d’autorisation à la place des États membres, incapables de constituer des majorités qualifiées pour prendre des décisions, puis qui a été confrontée à une fronde plus ouverte des États membres à la fin de son mandat, avec la multiplication des clauses de sauvegarde.
Il est à cet égard révélateur de constater que dès la prise de fonction du Président Barroso en février 2010, les OGM ont été un des premiers sujets de travail évoqués. On peut également considérer que l’affaiblissement de la Direction générale de l’Environnement, avec le départ du commissaire Stavros Dimas et la création d’une Direction générale de l’Action pour le climat, ainsi que la réorganisation des compétences en matière d’OGM au sein des services de la Commission témoignent d’une volonté de reprise en main du sujet. La Direction générale de la Santé et des Consommateurs (DG SANCO) est ainsi désormais seule compétente sur l’ensemble des questions ayant trait aux OGM, alors qu’auparavant celles-ci relevaient soit de cette même direction pour tous les sujets ayant trait à l’alimentation humaine et animale, soit de la DG Environnement pour ce qui était des autorisations de dissémination des OGM soit de la DG Agriculture pour les questions de coexistence (56). Cette triple compétence avait en effet mis à jour des tensions, voire des différences de vues et de gestion des dossiers au sein de la Commission, qui n’avaient pas facilité le traitement serein de ces questions. Ainsi, c’est aujourd’hui le commissaire John Dalli qui est officiellement en charge du dossier des OGM au sein de la Commission, même si les commissaires Dacian Ciolos, à l’agriculture, et Janez Potočnik, pour l’environnement, ne se désintéressent évidemment pas de ces questions.
Sur le fond du dossier, on peut considérer que la Commission a tiré les leçons des revers qu’elle a subis dans ses tentatives pour obtenir la levée des clauses de sauvegarde instaurées par les États membres (57) en élaborant une stratégie consistant, d’une part, à laisser plus de marges de manœuvre aux États membres pour interdire la mise en culture des OGM, et ce sans recourir au mécanisme des clauses de sauvegarde, tout en réaffirmant, d’autre part, sa volonté de relancer, au niveau communautaire, le processus d’autorisation de mise sur le marché des OGM, en commençant par un dossier emblématique : la pomme de terre Amflora.
1. La relance du processus d’autorisation avec un dossier emblématique, la pomme de terre Amflora
Comme l’a souligné le représentant permanent adjoint de la France auprès de l’Union européenne rencontré par vos rapporteurs à Bruxelles, la Commission européenne a choisi, pour mettre un terme au moratoire de fait qui depuis 1998 s’appliquait aux demandes d’autorisation de mise en culture de nouveaux OGM, le dossier le plus consensuel possible. Sur le papier, la pomme de terre Amflora présente en effet les meilleures références :
– elle n’est pas destinée à l’alimentation humaine ;
– elle a été mise au point par une entreprise de biotechnologies européenne (BASF) ;
– et elle constitue un atout pour la compétitivité des industries européennes (58).
Le 2 mars 2010, la Commission a ainsi annoncé son intention d’autoriser la culture en plein champ de la pomme de terre Amflora, en réponse à une demande déposée en 2003 et suite à un long processus d’évaluation ayant donné lieu à deux avis de l’AESA ainsi qu’à une évaluation de l’Agence européenne du médicament. Les États membres, consultés à plusieurs reprises, au niveau des experts puis des ministres, n’ont en revanche jamais été capables de trancher la question de savoir s’il convenait ou non d’autoriser la culture en plein champ d’Amflora et de constituer une majorité qualifiée pour ou contre cette autorisation. Ainsi, le 18 février 2008, les ministres des Vingt-sept s’étaient montrés largement divisés : 10 d’entre eux votant pour, 13 contre et 4 s’abstenant, dont la France et l’Allemagne (59).
Le 3 mars 2010, le commissaire John Dalli indiquait au collège des commissaires, les deux directions dans lesquelles il comptait travailler en accord avec le Président Barroso :
– d’une part, combiner un système d’autorisation européen basé sur la science avec la liberté de choix pour les États membres ;
– d’autre part, faire progresser les décisions d’autorisation en suspens en matière de culture, de denrées alimentaires et d’aliments pour animaux laissées par le précédent collège (60).
Bien qu’elle se défende de lier les deux sujets, la Commission a donc bien l’intention de « céder » aux États membres sur la mise en culture des OGM tout en relançant parallèlement le processus d’autorisation de ceux-ci au niveau européen. Si, finalement, le choix d’Amflora n’a pas fait l’unanimité, plusieurs États membres, comme la Hongrie, l’Autriche ou l’Italie, annonçant leur intention de déposer des clauses de sauvegarde et, en France, le comité économique, éthique et social du Haut conseil des biotechnologies concluant au manque d’intérêt de l’OGM en question, la Commission européenne ambitionne néanmoins de s’attaquer prochainement au dossier de renouvellement de l’autorisation du maïs MON 810 pour lequel l’AESA a émis un avis favorable le 30 juin dernier. Notons à cet égard que si l’autorisation du MON 810 était effectivement renouvelée, elle entraînerait de facto la caducité de la clause de sauvegarde française : l’arrêté du 7 février 2008 suspendant la mise en culture des variétés de semences de maïs génétiquement modifié MON 810 indique en effet que « la mise en culture, en vue de la mise sur le marché, des variétés de semences de maïs issues de la lignée de maïs génétiquement modifié MON 810 mentionnée dans l’arrêté du 3 août 1998 est interdite sur le territoire national jusqu’à ce qu’il ait été statué sur la demande de renouvellement de l’autorisation de mise sur le marché de cet organisme ».
2. Coexistence et interdiction de mise en culture : de nouvelles marges de manœuvre pour les États membres mais à quel prix ?
a) La proposition législative de la Commission du 13 juillet 2010
Le 13 juillet dernier, la Commission européenne a proposé une modification de la directive 2001/18/CE visant à permettre aux États membres de restreindre voire d’interdire sur leur territoire la culture d’OGM autorisés à la mise sur le marché dans l’Union européenne sur la base d’arguments socio-économiques.
La proposition de la Commission prend la forme d’un règlement introduisant dans la directive 2001/18/CE un article 26 ter dont le texte suit :
Article 26 ter
Culture
Les États membres peuvent adopter des mesures visant à restreindre ou à interdire, sur tout ou partie de leur territoire, la culture de tous les OGM, ou de certains d’entre eux, autorisés en vertu de la partie C de la présente directive ou du règlement (CE) n° 1829/2003 et consistant en des variétés génétiquement modifiées mises sur le marché conformément à la législation de l’UE applicable à la commercialisation des semences et des matériels de multiplication végétale, sous réserve que ces mesures :
a) soient fondées sur des motifs autres que ceux qui ont trait à l’évaluation des incidences négatives sur la santé et l’environnement susceptibles de résulter de la dissémination volontaire ou de la mise sur le marché d’OGM ;
et
b) soient conformes aux traités.
Par dérogation à la directive 98/34/CE, les États membres qui entendent adopter des mesures motivées en vertu du présent article portent celles-ci à la connaissance des autres États membres et de la Commission, à titre d'information, un mois avant leur adoption.
Un groupe de travail ad hoc a d’ores et déjà été crée par le Conseil des ministres pour travailler sur cette proposition et plusieurs échanges de vues ont été programmés aussi bien entre les ministres chargés de l’environnement qu’entre les ministres de l’agriculture, qui sont associés aux discussions sur ce dossier. La Commission a émis le souhait d’aller vite sur ce dossier qu’elle espère voir aboutir dès l’année prochaine. Ces plans risquent cependant d’être contrariés. La Présidence belge a en effet annoncé suite au premier échange de vues, qui a eu lieu au sein du Conseil des ministres de l’agriculture le 27 septembre dernier, que ce n’est pas en un ou deux mois que les États membres parviendront à un compromis sur la proposition de la Commission, qui suscite pour l’heure l’opposition d’une majorité d’États membres, y compris de ceux qui s’étaient initialement positionnés en faveur d’une subsidiarité accrue sur le dossier des OGM (61). Un prochain échange de vues est prévu, cette fois au sein du Conseil des ministres de l’environnement, le 14 octobre prochain. Et le Parlement européen est également appelé à se prononcer : la commission de l’environnement, de la santé publique et de la sécurité alimentaire a ainsi désigné Mme Corinne Lepage pour rapporter sur la proposition de la Commission (62).
Cette proposition soulève de nombreuses interrogations, qui relèvent, globalement, de trois ordres :
– tout d’abord, elle pose question du point de vue du principe de l’unicité du marché intérieur, qui connaîtrait une exception importante si les États membres étaient autorisés à restreindre la commercialisation de produits sur leur territoire de manière quasi discrétionnaire. Mais la politique agricole commune pourrait également se voir menacée « par ricochet », d’une part, parce que les partisans d’une renationalisation des politiques agricoles se trouveraient confortés par un tel précédent et, d’autre part, parce qu’une absence d’harmonisation entre États membres se traduit toujours par des distorsions de concurrence entre acteurs économiques. La France, l’Italie, l’Allemagne et l’Espagne se disent ainsi préoccupés par un risque de renationalisation des politiques communes européennes. « Le chacun pour soi mine les fondements de la politique agricole commune » a ainsi déclaré le ministre italien de l’agriculture, Giancarlo Galan, à la sortie du Conseil des ministres du 27 septembre ;
– la deuxième série de questions que pose la proposition de la Commission est d’ordre juridique : en l’absence de risque pour la santé publique ou l’environnement démontré scientifiquement, l’Organisation mondiale du commerce (OMC) n’admet pas de restriction aux échanges. Ainsi, les États membres qui décideraient individuellement d’interdire la culture, et donc le commerce des OGM destinés à la mise en culture, sur leur territoire pourraient donc se voir attaqués devant l’OMC. C’est notamment un point soulevé par l’Allemagne, auquel la Grande-Bretagne devrait également être sensible, les États-Unis et le Canada ayant d’ores et déjà émis des réserves sur la proposition de la Commission, en particulier eu égard au fait que celle-ci ne leur semblait pas reposer sur des normes scientifiques régulièrement admises (63) ;
– enfin, la proposition de la Commission intervient alors que les conclusions du Conseil européen du 4 décembre 2008 adoptées sous présidence française n’ont pas encore toutes trouvé de traduction concrète. La France notamment considère que la priorité n’est pas de modifier la législation en vigueur mais de renforcer l’expertise au niveau européen et de permettre la prise en compte de facteurs socio-économiques dans le processus d’autorisation, conformément aux conclusions précitées. On peut à cet égard s’interroger sur le calendrier choisi par la Commission pour lancer sa proposition alors que sont attendus très prochainement : la révision des lignes directrices de l’AESA en matière environnementale, les résultats de l’enquête réalisée auprès des États membres sur l’évaluation socio-économique, un rapport de la Commission sur le fonctionnement global du dispositif mis en place par la directive 2001/18/CE ainsi qu’une révision de la liste des manipulations génétiques soumises à la législation communautaire relative aux OGM (64). Dans ce contexte, on comprend mal l’empressement de la Commission à faire passer son projet de modification de la directive 2001/18/CE alors que les États membres seraient plutôt en droit d’attendre une proposition de réforme plus globale portant à la fois sur le champ de la directive 2001/18/CE, sur la place de l’évaluation socio-économique au sein du dispositif voire sur le processus de décision qui a manifestement échoué à faire émerger des positions claires sur le dossier des OGM.
b) Les nouvelles lignes directrices en matière de coexistence
Parallèlement à la proposition de modification de la directive 2001/18/CE, la Commission a publié de nouvelles lignes directrices relatives à la coexistence (65). La Commission y reconnaît « la nécessité pour les États membres de disposer d’une marge de manœuvre suffisante pour tenir compte de leurs spécificités régionales et nationales et des besoins particuliers, au niveau local, des cultures et produits biologiques, conventionnels et autres. ». A ce titre, alors qu’elle avait établi une jurisprudence constante condamnant la création de zones « sans OGM », considérant que celles-ci ne pouvaient relever que d’une démarche volontaire des agriculteurs présents sur les territoires concernés, la Commission concède désormais que « dans certains cas, en fonction des conditions économiques et physiques, il peut être nécessaire d’interdire la culture des OGM dans de vastes zones. ». Certes, la Commission précise que démonstration doit être faite qu’aucune autre mesure n’est suffisante pour empêcher les disséminations et que les mesures de restriction prises doivent être proportionnées à l’objectif poursuivi. Il n’en demeure pas moins qu’il s’agit là d’un revirement spectaculaire de sa doctrine (66), et ce d’autant plus que la Commission se fonde sur l’article 26 bis non modifié de la directive 2001/18/CE pour justifier la création de zones sans OGM qu’auparavant elle récusait.
Ainsi, quand bien même la proposition législative de la Commission ne serait pas adoptée par les États membres, ces derniers n’en seraient pas moins désormais autorisés à créer des zones sans OGM au titre des mesures de coexistence. A l’occasion de la notification à Bruxelles des mesures qui seront prises par les États membres dans ce cadre, la Commission sera vraisemblablement amenée à préciser les critères, notamment en termes de parcellaire et d’importance locale des filières « sans OGM », susceptibles d’ouvrir effectivement droit à la création de telles zones. En l’absence de critères opérationnels, il est en effet difficile d’apprécier la portée de cette nouvelle possibilité et de savoir dans quelle mesure certains territoires sur le sol français pourraient en bénéficier. Des demandes en ce sens ne vont cependant pas manquer de se faire jour, y compris dans le cadre de la publication de l’arrêté relatif aux conditions techniques de coexistence. Il conviendrait donc que le Gouvernement se penche sur cette question dès à présent.
C.— LA DÉFINITION D’UN SEUIL DE PRÉSENCE FORTUITE D’OGM NON AUTORISÉS DANS LES PRODUITS IMPORTÉS
Bien que la Direction générale de l’Agriculture de la Commission européenne ne soit plus compétente en matière d’OGM, elle continue de suivre de près ce dossier et plus particulièrement la question des importations susceptibles de contenir des traces d’OGM non autorisés par l’Union européenne. Comme votre rapporteur l’avait déjà constaté lors du déplacement à Bruxelles qu’il avait effectué pendant la préparation du projet de loi relatif aux OGM, ce sujet constitue la préoccupation majeure de la DG AGRI qui craint, à moyen et long terme, que l’approvisionnement des élevages européens en protéines végétales ne soit compromis par le rythme de décision de la Commission en matière d’autorisation d’importation d’OGM. En effet, alors que les surfaces, par exemple, de soja transgénique, cultivées dans le monde progressent à un rythme rapide, les autorisations octroyées au niveau communautaire avancent au compte-gouttes. 150 variétés d’OGM seraient ainsi aujourd’hui en attente d’une autorisation d’importation. Il y a donc une probabilité de plus en plus importante que des cargaisons de soja non OGM ou, plus vraisemblablement de soja OGM autorisé à l’importation qui arrivent sur le sol européen avec des traces d’OGM en cours d’autorisation au niveau communautaire mais non encore autorisés. Dans ce cas, les lots correspondants ne peuvent être acceptés et sont refoulés. Il s’agit là d’une procédure tout à fait normale et légale ; elle risque néanmoins de poser un réel problème économique si les cas de refus se multiplient et concernent des quantités importantes d’aliments. La DG AGRI redoute à cet égard que le flux des exportations ne se réduise et n’entraîne une crise importante dans les secteurs du porc et de la volaille, voire du lait. Les organisations professionnelles agricoles européennes, le COPA et la COGECA mais également la Confédération des industries agroalimentaires de l’Union européenne (CIAA) et les fédérations de commerce de la viande (UECBV) et des céréales (Coceral) militent également en faveur d’une prise en compte urgente de ce problème, s’estimant dans une « position d’extrême précarité » face aux cargaisons de soja refoulées en raison de la présence non quantifiable d’OGM non autorisés (67).
En réponse, le commissaire John Dalli a indiqué le 16 septembre dernier qu’une « solution technique » était à l’étude reposant avant tout sur une harmonisation des méthodes d’échantillonnage, d’analyse et d’interprétation des résultats utilisés par les services de contrôle officiels des États membres. D’après lui, « cette solution technique ne modifierait pas l’approche de la tolérance zéro pour les OGM non autorisés mais la rendrait plus opérationnelle. Elle préciserait la limite la plus basse à partir de laquelle on peut assurer que les contrôles soient assez solides, et fournissent ainsi la sécurité juridique nécessaire » (68). On comprend toutefois qu’au-delà d’une harmonisation des méthodes de détection aux frontières de l’Europe, il s’agit bien de définir un seuil de présence fortuite d’OGM non autorisé dans les lots de produits conventionnels ou de produits OGM autorisés. Cette tolérance serait évidemment très strictement encadrée. D’après les informations recueillies par vos rapporteurs auprès de la DG SANCO, elle ne concernerait que les produits uniquement destinés à l’alimentation animale (69) et ne s’appliquerait qu’aux OGM pour lesquels une demande a été déposée et qui ont reçu une évaluation positive de l’AESA. Quant à la question du seuil, la DG AGRI a estimé que celui-ci pourrait être fixé entre 0,1 % et 0,3 %.
Pour vos rapporteurs, ce dossier pose la question de la cohérence de la politique européenne en matière d’OGM : celle-ci autorise en effet largement l’importation d’organismes génétiquement modifiés pour l’alimentation animale qui ne sont pas autorisés à la culture et pourrait bientôt, peut-être, tolérer dans ces mêmes importations la présence d’OGM non encore formellement autorisés, alors que parallèlement elle ouvre de plus en plus clairement la possibilité pour les États membres d’interdire les cultures d’OGM sur leur territoire.
Derrière cette apparente confusion, la politique européenne semble néanmoins faire preuve de réalisme économique : en effet, si aujourd’hui l’Europe peut encore choisir de ne pas cultiver d’OGM, elle ne peut déjà plus se passer d’en importer pour l’alimentation animale ! L’Europe est dans une situation de dépendance quasi-totale en matière d’approvisionnement en protéines végétales pour l’alimentation du bétail. Situation jugée irréversible par la DG AGRI qui considère que, quelles que soient les nouvelles aides qui pourraient être accordées dans le cadre de la PAC de 2013 en faveur de la production de protéines végétales en Europe, notamment au travers des soutiens accordés à la rotation des cultures (70), celles-ci ne permettront pas de concurrencer les importations de soja constituées aujourd’hui à plus de 90 % d’OGM (71). Seules 30 millions de tonnes de protéines végétales sont produites en Europe, pour lesquelles la marge de progression est estimée par la DG AGRI à tout au plus 10 %. Ainsi, sauf à relancer la production de farines animales, l’Europe est bel et bien dépendante du soja OGM qu’elle importe et la compétitivité de l’agriculture européenne – à tout le moins celle de ses secteurs porcin et avicole – dépend bien de la continuité de cet approvisionnement (72).
La commission a examiné le rapport d’application de la loi n° 2008-595 du 25 juin 2008 relative aux OGM (MM. Antoine Herth et Germinal Peiro, rapporteurs).
Le président Ollier. Nous allons aujourd’hui nous livrer à un exercice auquel je tiens particulièrement et dans lequel notre Commission a été pionnière, puisqu’elle l’a initié avant même qu’il ne soit rendu obligatoire par notre règlement : il s’agit du suivi de l’application de la loi. Le rôle de contrôle du Parlement me semble aussi important que son rôle de législateur.
Chacun se souvient des débats qui avaient enflammé l’hémicycle au moment de la discussion de la loi sur les organismes génétiquement modifiés (OGM) : il n’est pas question aujourd’hui de rouvrir le débat mais de vérifier si les grands principes arrêtés par le législateur ont bien été mis en œuvre.
Le rapporteur, M. Herth, et le co-rapporteur, M. Peiro, sont allés interroger les ministères, se sont déplacés à Bruxelles et ont auditionné plusieurs membres du Haut conseil des biotechnologies. Vous avez fait un excellent travail de recherche, dont vous allez nous exposer le résultat.
M. François Brottes. Au nom de mon groupe, je souhaiterais faire un rappel au règlement. Je me félicite que la réunion de la commission soit publique et ouverte à la presse. Nous acceptons de participer au contrôle de la loi mais nous ne cautionnons pas cette loi que nous n’avons pas votée. Non seulement les débats ont été vifs lors de l’examen du projet de loi, mais nous avions même trouvé une majorité pour le rejeter, et nous souhaitions d’ailleurs une motion référendaire pour que l’ensemble du peuple français puisse se prononcer sur une question qui va bousculer les générations futures. Contrôler une loi que nous n’avons pas votée, c’est faire notre travail de parlementaires, mais non pas cautionner le texte. Monsieur le Président, je pense que vous en êtes d’accord sur le principe.
Le président Ollier. Une fois de plus, nous sommes tout à fait d’accord. Ce n’est pas parce que vous ne participez pas au vote d’une loi que vous n’avez pas le droit d’en contrôler la bonne application. Il s’agit d’un exercice de contrôle de l’application de la loi, et il est bien évident que nous n’avons pas à juger du fond et de la nature mêmes du texte. Loin d’avoir à prendre parti, les co-rapporteurs n’ont à juger que de la manière dont le texte est appliqué par l’administration et les différents partenaires. La remarque de François Brottes est frappée au coin du bon sens et s’inscrit parfaitement dans le bon fonctionnement de nos institutions.
M. Antoine Herth. A titre liminaire, je tiens à rappeler que nos travaux avaient initialement débuté en septembre 2009, mais le Haut conseil des biotechnologies (HCB) venait juste d’être mis en place et ne s’était pas encore prononcé sur la définition du « sans OGM » : c’est pourquoi il nous avait paru préférable de prolonger, avec l’autorisation du Président Ollier, la mission de suivi afin d’avoir un peu plus de recul sur la mise en œuvre de la loi.
Deux ans maintenant après l’adoption du texte, nous ne sommes toutefois pas beaucoup plus avancés.
Si le HCB est effectivement opérationnel, il reste une instance encore jeune et, à plus d’un titre, fragile. Quant aux autres sujets majeurs sur lesquels la loi renvoyait au pouvoir réglementaire pour en définir les modalités d’application (le « sans OGM », les conditions de coexistence, l’information du public), ils n’ont pas encore abouti, loin s’en faut. Vous disposez en annexe du rapport du tableau de suivi de la parution des textes d’application et vous pouvez constater que nombre d’entre eux sont encore en cours de rédaction ou de consultation.
Plusieurs facteurs peuvent expliquer cette situation : tout d’abord, ces textes portent tous sur des sujets complexes et délicats à traiter, qui nécessitent du temps pour mener à bien les consultations nécessaires ; ensuite, dans la mesure où il n’y a plus d’OGM cultivé sur le territoire français depuis que la France a pris une clause de sauvegarde sur le MON 810, le traitement des questions de coexistence et de responsabilité a vraisemblablement dû apparaître moins urgent.
Aux yeux du législateur, le résultat est cependant le même : la loi n’est aujourd’hui pas applicable.
Elle l’est d’autant moins que de nouvelles dispositions législatives sont désormais nécessaires pour que les procédures d’autorisation d’utilisation des OGM en milieu ouvert définies dans le cadre de la loi du 25 juin 2008 puissent effectivement être mises en œuvre.
Le Conseil d’État, dans deux arrêts du 24 juillet 2009, a en effet annulé à compter du 30 juin 2010 les dispositions réglementaires relatives à l’information et à la participation du public au motif qu’elles n’étaient pas conformes à l’article 7 de la Charte de l’environnement qui confie au seul législateur le soin de fixer les conditions et limites du droit d’information du public en matière environnementale.
Cette jurisprudence allant bien au-delà du sujet des OGM, le Gouvernement a introduit un cadre législatif général dans la loi Grenelle II : toutefois ce cadre général nécessite d’être décliné pour chaque procédure particulière d’information prévue par les textes. C’est notamment le cas des installations classées, mais également des OGM.
En conséquence, il est aujourd’hui strictement impossible d’accorder une autorisation d’essai ou de mise sur le marché en France. Faute de texte proposé par le Gouvernement, une proposition de loi, portée par notre collègue de la commission du développement durable Bertrand Pancher, serait en cours de préparation.
M. Germinal Peiro. S’agissant des textes d’application les plus attendus, il convient d’évoquer le cas du décret définissant le « sans OGM » ou plus précisément définissant les conditions d’un étiquetage « sans OGM ».
Ce décret a été rédigé par la DGCCRF sur la base des recommandations que le comité économique, éthique et social (CEES) du Haut conseil des biotechnologies a rendues en novembre 2009, mais celui-ci doit encore être de nouveau soumis pour avis au Haut conseil puis à l’Agence nationale de sécurité sanitaire avant d’être notifié à Bruxelles puis de passer devant le Conseil d’État. Il semble donc assez improbable que ce texte soit publié avant le printemps 2011.
Sur le fond, nous n’avons pas eu le projet de décret en main mais nous avons été instruits sur son contenu à l’occasion de différentes auditions : il semblerait ainsi que le texte suive assez fidèlement les orientations du CEES et notamment sa proposition consistant à prévoir deux possibilités d’étiquetage pour les produits d’origine animale selon que l’alimentation des animaux est garantie sans OGM en dessous de 0,1 % ou sans OGM entre 0,1 % et 0,9 %. Les premiers produits pourraient être identifiés par la mention « nourri sans aliments OGM » et les seconds par l’expression « nourri sans utilisation d’OGM ».
Ce choix paraît cependant discutable, non seulement du point de vue de la clarté de l’information fournie au consommateur mais aussi de la signification de la « zone grise », située entre 0,1 % et 0,9 %, sauf à considérer, comme semble le faire le CEES, que la possibilité d’étiquetage « sans OGM » entre 0,1 % et 0,9 % ne serait accordée que provisoirement et accompagnée d’un « plan de progrès » pour atteindre le 0,1 %. Le CEES reconnaît cependant que son analyse nécessite d’être étayée par une véritable évaluation socio-économique des filières sans OGM : or cette étude, qui a été commandée par le Gouvernement à un cabinet, ne devrait pas être disponible avant la fin du mois de novembre. Il n’est donc pas exclu que les lignes puissent encore bouger d’ici la fin de l’année. En conclusion, sur le « sans OGM » aussi, la loi est vouée à rester inappliquée encore un moment.
Sur la coexistence, le comité scientifique du HCB a été saisi du projet d’arrêté rédigé par le ministère de l’alimentation, de l’agriculture et de la pêche (MAAP) et le comité économique, éthique et social s’est pour sa part autosaisi de la question. Le décret d’application du régime de responsabilité est encore en cours de rédaction et le décret relatif au seuil d’étiquetage des semences a été mis en attente le temps que le décret « sans OGM » soit publié.
Pour en venir maintenant aux dispositions de la loi effectivement mises en œuvre, il faut signaler que les décrets d’application relatifs au Haut Conseil des Biotechnologies et au Comité de surveillance biologique du territoire ont été publiés dès le mois décembre 2008, moins de six mois après la publication de la loi. Comme vous vous en souvenez sans doute, les Commission des affaires économiques de l’Assemblée Nationale et du Sénat ont ensuite été saisies pour avis sur une première puis une seconde candidature à la présidence du Haut conseil, qui a finalement été confiée à Mme Catherine Bréchignac. Les membres du HCB ont ensuite été officiellement nommés au mois d’avril 2009 et ceux du comité de surveillance biologique du territoire en février 2010. Le Haut conseil s’est doté d’un règlement intérieur en juillet 2009 et a tout de suite commencé à fonctionner alors même qu’il n’avait ni locaux ni secrétariat propres.
M. Antoine Herth. Pour sa première année de fonctionnement, le HCB présente un bilan plutôt flatteur avec environ 500 avis rendus. Vous trouverez dans le rapport un encadré avec des statistiques sur l’activité du Haut conseil tiré de son premier rapport d’activité. 489 avis ont ainsi été rendus par le comité scientifique concernant des utilisations confinées d’OGM. D’une manière générale, le travail du comité scientifique n’appelle pas de remarque particulière ;
Le comité économique, éthique et social, dont nous avons auditionné plusieurs membres, suscite en revanche quelques inquiétudes. Il était clair d’emblée qu’avec sa composition sur le modèle du Grenelle, avec des membres qui sont en fait des parties prenantes, le dialogue et la recherche de consensus ne serait pas aisé. Il semblerait toutefois que la situation soit pire que ça : une personne membre du CEES a en effet parlé de « guerre de tranchées » et tous les membres auditionnés se sont accordés à dire que les conditions de travail au sein du CEES étaient particulièrement éprouvantes, en dépit des efforts de sa présidente, Mme Christine Noiville, pour apaiser les débats.
Le travail du CEES n’a en outre pas été facilité par la nécessité de traiter certains dossiers en urgence et par la mise à disposition parfois tardive de l’avis du comité scientifique. Mais le plus gênant reste néanmoins l’absence de méthodologie applicable dans le domaine de l’évaluation socioéconomique. Le CEES s’est ainsi retrouvé à produire des recommandations sans même s’être doté au préalable d’une grille d’analyse des dossiers ! Cette situation évolue progressivement, probablement dans la bonne direction, mais la démarche paraît pour le moins étonnante.
La combinaison de ces différents handicaps contribue à faire de certaines recommandations du CEES plus des catalogues de positions divergentes que des orientations opérationnelles pour l’action du Gouvernement.
Enfin, le CEES a été récemment ébranlé à l’occasion de la destruction, pour la seconde fois, de l’essai de l’INRA de Colmar, cette fois-ci par des faucheurs volontaires. La publication par le bureau du HCB d’un communiqué de presse « déplorant » cette destruction, alors que le Haut conseil avait remis trois mois plus tôt un avis positif au Gouvernement pour autoriser la poursuite de l’essai, a déclenché de vives protestations de la part des membres du CEES appartenant à des organisations solidaires des actes de fauchage ou des faucheurs. Parallèlement, d’autres membres du CEES ont été choqués d’apprendre que certains d’entre eux soutenaient des actions illégales et ont commencé à questionner la légitimité de la présence de ceux-ci au sein du Haut conseil voire à s’interroger sur leur propre participation à cette instance. Cet épisode résume à lui seul la fragilité de l’édifice construit par la loi du 25 juin 2008, dont l’initiative est certes saluée par tous mais dont la mise en œuvre, là encore, semble très compliquée.
M. Germinal Peiro. Enfin, ce tour d’horizon de la situation des OGM ne serait pas complet si l’on n’abordait pas l’évolution du dossier au niveau européen, car tandis que l’on peine à mettre en œuvre les dispositions de la loi du 25 juin 2008, dont certaines sont la transposition, avec six ans de retard, de la directive 2001/18/CE, la Commission européenne en est déjà au coup d’après. Ainsi, sans attendre d’avoir mis en œuvre les conclusions du Conseil européen du 4 décembre 2008 qui plaidaient en faveur d’un renforcement de l’évaluation environnementale des OGM et de la prise en compte de critères socio-économiques, la Commission propose désormais de modifier la directive 2001/18/CE en vue d’autoriser les États membres à restreindre voire interdire la culture des OGM autorisés au niveau européen sur leur territoire, sur la base de simples considérations socio-économiques. En laissant plus de latitude aux États membres sur le terrain, la Commission espère de son côté avoir plus de marges de manœuvre pour faire avancer les demandes d’autorisations, comme elle a d’ailleurs commencé à le faire avec la pomme de terre Amflora.
Cette proposition qui, pour le moment, est loin de susciter l’adhésion des États membres, pour des raisons à la fois politiques, juridiques et économiques, s’accompagne en outre de nouvelles lignes directrices en matière de coexistence dans lesquelles la Commission reconnaît désormais la possibilité de créer des zones « sans OGM », ce qu’elle avait toujours refusé jusqu’alors. Cette évolution questionne directement les dispositions de la loi du 25 juin 2008 qui risquent de paraître désormais obsolètes, s’agissant notamment des dispositions relatives aux parcs naturels ou aux signes de qualité, voire aux conditions techniques de coexistence.
Enfin, le dernier projet de la commission, qui ne s’est pas encore concrétisé sous la forme d’un texte, concerne les importations d’OGM destinés à l’alimentation animale et vise à autoriser un seuil de présence fortuite d’OGM non autorisés afin d’éviter de refouler des quantités trop importantes d’aliments en raison de la présence de traces dans les lots. Cette initiative met en évidence le niveau de dépendance de l’Europe en matière d’alimentation animale. Elle est également révélatrice de la duplicité ou du moins de l’incohérence de l’attitude de l’Europe sur le dossier des OGM avec des États qui, dans leur grande majorité, se montrent réticents vis-à-vis de la mise en culture voire de l’expérimentation des OGM sur leur territoire mais acceptent sans broncher l’importation de quantités énormes de soja transgénique pour l’alimentation animale. Cette remarque nous renvoie d’ailleurs directement à l’article 1er de la loi qui appelait de ses vœux la mise en place d’un plan de relance de la production de protéines végétales et demandait le dépôt d’un rapport au Parlement sur le sujet. Cette mission vient juste d’être confiée par le MAAP au Conseil général de l’alimentation, les résultats sont attendus pour la fin de l’année, soit deux ans et demi après le vote de la loi.
Le Président Ollier. Le bilan de l’application de cette loi est donc négatif, ou pour le moins mitigé. Je vous remercie pour votre sincérité.
M. Serge Poignant. Il faut se féliciter de la décision de contrôler l’application de cette loi. Vous pointez le fait que sur les 19 textes d’applications nécessaires seuls 9 ont été publiés parmi lesquels 4 décrets sur les 10 attendus, ces retards sont ils souvent liés à des dispositions d’origine parlementaire ? Il est clair que les expertises requièrent des délais importants mais peut être n’ont-elles pas été lancées suffisamment tôt ? En ce qui concerne le HCB on peut s’interroger sur les suites qui sont apportées ou non à ses avis. Enfin, le soutien à la recherche est fondamental, pouvez vous nous indiquez ce qui a été réalisé dans ce domaine ?
Une proposition de loi est en cours d’élaboration au sein de la commission du développement durable, cette initiative apparaît encore plus nécessaire à la lumière des conclusions de votre rapport. Je ne peux que constater que la France prend du retard sur la question des autorisations de culture d’OGM. Mais est-ce lié à un problème juridique ou à un manque de volonté ?
M. François Brottes. Tout en soulignant la qualité du travail mené par nos collègues sur ce sujet délicat, je ne peux que rappeler que le groupe SRC n’a eu de cesse lors de la discussion du projet de loi de dénoncer l’absence de protection mise en œuvre pour les cultures sans OGM et pour les consommateurs qui souhaitent être rassurés. Il n’est dès lors pas étonnant de constater l’existence de difficultés d’application.
Il convient de s’interroger sur la fonction exacte du HCB qui est un organe de concertation permettant l’expression des différents points de vue et dont la productivité ne peut être mise en doute, 500 avis rendus en un an c’est impressionnant ! Pour autant ces avis sont-ils pris en compte d’une manière quelconque ?
Cette loi est en fait inapplicable, d’une part parce que nous ne disposons pas des expertises scientifiques permettant l’édiction de mesures d’application et, d’autre part, car elle n’est pas conforme avec les orientations qui pourraient être prises ans le cadre d’une prochaine directive européenne. Aussi serait-il judicieux de questionner le gouvernement sur cette situation inextricable afin notamment de savoir quelle sera la position française défendue à Bruxelles. Il faut répondre aux attentes très fortes de la société sur ces questions.
Mme Anny Poursinoff. Ce rapport pose beaucoup de questions auxquelles il n’est pas apporté de réponses. Nous sommes face à un projet de société puisque l’on constate que l’opinion est à la fois très défavorable aux OGM et attirée par les produits issus de l’agriculture biologique. Sans doute cette situation explique-t-elle sans doute pour beaucoup les difficultés d’application de la loi.
Le fait que l’Europe donne davantage de latitude aux États pour déclarer des zones sans OGM pourrait avoir des effets positifs si notre pays décidait de se définir comme tel.
La recherche encourt un certain nombre de critiques, notamment en raison de l’orientation pro-OGM de l’INRA et le choix de ne pas avoir recours a des cultures confinées.
Il apparaît très difficile d’appliquer une loi qui n’a pas défini d’orientation claire et sur une question aussi sensible le choix de s’abstenir serait sans doute préférable. Il apparaît en revanche urgent de travailler sur la question de l’autonomie pour l’alimentation des animaux puisque là aussi le rapport demandé n’a pas été déposé.
M. Claude Gatignol. Je tiens tout d’abord à préciser que je fais partie du HBC. Je souhaite poser les questions suivantes :
– quand cette loi sera-t-elle modifiée pour prendre en compte le remplacement, voté dans le cadre de la LMA, du terme de dissémination volontaire qui comporte une connotation négative par l’expression de culture autorisée de semence modifiée ?
– quand la loi s’appuiera-t-elle sur des définitions scientifiques des cultures sans OGM, des autres types d’agriculture raisonnées et des risques pour la santé de l’utilisation d’OGM ?
– est-il possible pour la commission d’auditionner l’INRA qui dispose d’une expertise incontestable sur ces questions ?
Je voudrais en outre souligner que le HCB ne travaille aujourd’hui que sur le sujet de la transgénèse et n’aborde pas celui des biotechnologies en général.
M. Jean Gaubert. Je ferai tout d’abord remarquer que le concept de « faucheur volontaire » est assez étrange car il semble bien que les faucheurs sont toujours volontaires ! On ne peut, bien entendu, que condamner de telles pratiques qui constituent la négation pure et simple de l’expérimentation encadrée qui est pourtant nécessaire à une meilleure connaissance.
Je voudrais ensuite souligner que le renvoi de l’Union européenne vers les États du soin de définir la réglementation de la mise en culture des OGM est un mauvais signal dans la mesure ou il s’apparente à un aveu d’impuissance de l’Europe à se saisir des sujets majeurs. Par ailleurs, le problème principal concerne la réglementation de l’importation de produits OGM en Europe et dans ce domaine c’est bien Bruxelles qui est compétent.
M. Patrick Ollier, président. Je vous rappelle que le Bureau de la commission se rendra à Bruxelles le 8 décembre prochain pour rencontrer différents commissaires européens et obtenir des réponses aux questions évoquées dans nos débats.
M. Jean-Pierre Nicolas. En écho aux conclusions très claires du rapport qui vient de nous être présenté, je fais le double constat de la rapidité de publication des premiers décrets d’application et d’une mise en oeuvre délicate et pourtant nécessaire de ce texte. Le rapport montre aussi que la présence de parties prenantes au sein d’organes décisionnels pose question.
Quant à la position de la commission européenne consistant à se défausser sur les États membres, elle m’apparaît négative car il s’agit à l’évidence d’une compétence communautaire. Il est également nécessaire de renforcer la recherche pour lever les incertitudes avant de décider s’il y a lieu ou non de légiférer à nouveau, à cet égard l’avis de l’INRA serait particulièrement éclairant.
Mme Frédérique Massat. Je voudrais tout d’abord revenir sur l’article 1er de la loi qui prévoit que six mois après sa publication, le Gouvernement remet au Parlement un rapport relatif aux possibilités de développement d'un plan de relance de la production de protéines végétales alternatif aux cultures d'organismes génétiquement modifiés afin de garantir l'indépendance alimentaire de la France. Le fait que cette disposition figure en tête du texte témoigne de son importance, or ce rapport n’a toujours pas été déposé près de trois ans plus tard.
Je déplore ensuite que la composition du Comité de surveillance biologique du territoire fasse totalement l’impasse sur les associations de protection de l’environnement alors que celles-ci disposent à l’évidence de compétences avérées dans ce domaine.
Si l’activité du HCB est incontestable, il est toutefois regrettable qu’il n’ait pas publié de rapport d’activité depuis sa création en avril 2009. La surveillance biologique du territoire qui a pour objet de s'assurer de l'état sanitaire et phytosanitaire des végétaux et de suivre l'apparition éventuelle d'effets non intentionnels des pratiques agricoles sur l'environnement aurait également dû donner lieu à un rapport. Je souhaite enfin disposer d’informations sur le décret en cours d’élaboration au sujet de l’utilisation des OGM en milieu confiné.
M. Jean-Louis Léonard. Je m’interroge tout d’abord sur la pertinence du délai d’un an pour juger de l’application d’un texte aussi complexe que celui-ci. Quant à la composition du HCB elle apparaît clairement comme un facteur de blocage de l’application de la loi. Je suis particulièrement choqué par la situation dans le domaine de la recherche ou le dogme semble avoir pris le pas sur l’expérimentation avec la circonstance aggravante de voir les faucheurs impunis. Cette évolution est très préjudiciable dans de nombreux domaines, tel celui de la sylviculture pour lequel la recherche d’essences nouvelles pouvait fournir une réponse aux évolutions climatiques.
Mme Marie-Lou Marcel. J’interviens sur le sujet de l’identification des produits « sans OGM ». Le HCB a préconisé d’identifier trois catégories de produits suivant des modalités décrites dans le rapport. Je voudrais savoir comment il sera possible da faire respecter cette réglementation dans la mesure où l’alimentation des animaux provient pour une large part de soja importé des États-Unis qui comprennent le plus souvent des OGM et comment identifier la présence d’OGM dans les produits alimentaires qui seront issus de ces animaux.
M. Jean-Charles Taugourdeau. Je souhaite pousser un véritable cri d’alarme à la suite des conclusions de ce rapport. Il faut absolument que la loi soit appliquée et que des correctifs lui soient, le cas échéant, appliqués. S’il est légitime de s’intéresser à la situation des consommateurs, il est également important de se pencher sur l’avenir de la filière semencière qui représente un nombre considérable d’emplois. Il est préoccupant de constater que la crédibilité de la recherche n’est plus assurée en raison de l’impunité des faucheurs. Pas plus qu’une France sans onde, sans nucléaire, sans chemin de fer, sans autoroutes, il n’est possible d’imaginer une France sans OGM ? Il en va de la compétitivité de notre pays dans le contexte mondial.
M. Philippe Tourtelier. Je tiens à rappeler que le groupe socialiste s’était prononcé en faveur d’une recherche publique en plein champ, seule méthode pour obtenir des éléments probants sur l’éventuelle nocivité des cultures OGM. Dans un rapport sur le principe de précaution que j’ai réalisé avec notre collègue Alain Gest, nous rappelons que le seul exemple qui ait été cité pour l’application de ce principe en 2005, c’est celui des OGM. Ce rapport développe l’idée selon laquelle il convient de mesurer la balance risques/avantages et pour cela disposer aussi bien d’experts scientifiques que d’experts en sciences humaines. Le problème est qu’à l’heure actuelle on demande à des personnalités de la société civile d’intervenir en qualité d’experts ce qui n’est pas satisfaisant. Il convient en effet de distinguer deux phases, une première phase d’expertise suivie d’une phase de débat public au sein d’instances ad hoc comme le CEES ou de l’Office des choix scientifiques.
Mme Annick Le Loch. Je m’interroge sur la publication au Journal officiel du 25 juillet dernier d’un arrêté autorisant l’inscription au Catalogue officiel des espèces et variétés de plantes cultivées en France de plusieurs variétés de maïs MON 810 et T 25 en dépit de la clause de sauvegarde prise en 2008, n’y a-t-il pas là une contradiction ?
Le Président Ollier. D’abord, je souhaiterais répondre à M. Brottes, car je ne suis pas d’accord avec lui sur l’interprétation qu’il fait de la loi appliquée ou applicable. La loi n’est certes pas suffisamment appliquée, vous avez raison, et nous sommes là pour le constater. De là à dire qu’elle n’est pas applicable, nous ne sommes pas d’accord. J’interroge ici les rapporteurs : si j’ai bien saisi, la loi n’est pas encore appliquée parce que certains textes n’ont toujours pas été publiés.
Vous dites qu’il n’existe pas de réponse scientifique à certains sujets : sur ce point, ce sont les rapporteurs qui vont vous répondre.
S’agissant de la question européenne, vous avez raison : nous devons être capables de nous adapter à l’évolution de l’Europe. C’est pour cela que le 8 décembre, nous allons passer une journée complète à Bruxelles pour nous imprégner du sujet.
Quant à la définition du « sans OGM », le texte est actuellement examiné à Matignon : il y a donc des évolutions, et le texte devrait être envoyé assez rapidement au Haut conseil des biotechnologies et à l’Agence française de sécurité sanitaire.
S’agissant de la définition des conditions techniques de coexistence, le ministère de l’Agriculture travaille sur le sujet, sur la base du texte de loi, qui prévoit la consultation du Comité scientifique du HCB. Nous sommes donc dans un processus de mise en œuvre, même s’il est tardif.
Eu égard à l’idée qu’il était trop tôt pour contrôler l’application de loi : bien au contraire ! Nous faisons notre travail. Le délai de contrôle est normalement de six mois après la publication de la loi. Or nous avons laissé deux ans au Gouvernement. Je vous rappelle que pour la loi de modernisation de l’économie, nous avons constaté que le Gouvernement n’avait pas fait son travail. C’est pourquoi nous avons déposé une proposition de loi relative à l’urbanisme commercial que nous avons fait voter dans un esprit de consensus. Pour cette loi-ci, je n’ai pas commis d’erreur dans l’exercice de mes responsabilités. J’ai même été très patient par rapport à celles du Gouvernement.
Concernant la définition des modalités d’information et de participation du public, il y a un problème qui ne relève pas de nous. Le Conseil d’État a annulé des dispositions qui avaient été prises, entraînant un vide juridique. D’où l’impossibilité d’appliquer la loi, qu’il nous revient désormais de compléter. M. Bertrand Pancher travaille sur une proposition de loi, et j’ai demandé à M. Antoine Herth de s’y associer. Nous sommes donc dans le contrôle de l’application de la loi et dans l’élaboration de dispositifs pour l’heure inexistants, ou qu’il faut changer. C’est un nouvel aspect de notre fonction, et je suis heureux que nous puissions l’exercer ainsi.
Je remercie M. Philippe Tourtelier car je suis tout à fait d’accord avec son propos. Mélanger le mandat « sociétal », quel qu’il soit, et la qualité d’expert, crée une confusion problématique. On pourra y réfléchir en engageant éventuellement une mission d’information relative au Haut Conseil des Biotechnologies.
En conclusion, je tiens à féliciter les deux rapporteurs pour leur excellent rapport qui a été rédigé dans la plus grande indépendance. Ce texte a une grande valeur pour moi et nous permettra – une fois que vous aurez répondu aux questions de nos collègues – d’engager la phase suivante. On ne peut pas s’arrêter là !
M. Germinal Peiro. Il nous faut rappeler que notre mandat consistait à évaluer l’application de la loi et absolument pas à la commenter ou à refaire le débat. Les remarques qui ont été faites étaient parfois hors sujet mais vous avez eu raison de les faire, car elles nous ont ramenés au fond du problème. Quant à Antoine Herth et moi-même, nous avons essayé de faire notre travail le plus fidèlement possible et de concert. Si nous avons pris la parole à tour de rôle, c’est parce que nous étions totalement en phase sur ce que nous avons observé quant à l’application de la loi.
Ce texte illustre la difficulté de légiférer. L’idéal serait de légiférer de façon suffisamment simple et claire, évitant ainsi le recours aux décrets d’application, qui, pour certains textes, ne sont jamais publiés. On est toujours surpris lorsque l’on voit les statistiques relatives aux textes d’application des lois que nous avons votées. Cependant, il ne faut pas désespérer, car la loi sera appliquée une fois que tous ses textes d’application auront été publiés. Il y a cependant quelques problèmes. En matière d’information du public, le Conseil d’État a considéré qu’on ne pouvait recourir au décret mais qu’il fallait légiférer. Un de nos collègues a donc déposé une proposition de loi sur le sujet, donc on en re-débattra.
Cela étant, une initiative européenne vient de modifier la donne et la loi sur les OGM pourrait être remise en question, alors même qu’elle visait à transposer, avec plusieurs années de retard, la directive 2001/18/CE. Il n’en reste pas moins qu’une fois les décrets publiés, la loi votée par le Parlement sera applicable.
Le Président Ollier. Je remercie Germinal Peiro car je suis sur la même ligne. Si les évolutions européennes nous y conduisent, il faudra modifier la loi, mais il s’agit pour l’instant de l’appliquer. Et je reconnais la difficulté que représente l’élaboration d’une loi, que l’on soit de droite ou de gauche.
M. Antoine Herth. En réponse à M. Serge Poignant, concernant les décrets, si l’on regarde le tableau fourni en dernière partie du rapport, on s’aperçoit que le problème majeur réside dans la définition du « sans OGM ». A partir de cette définition, la publication de tous les décrets va s’enchaîner. Qu’il s’agisse des conditions de coexistence ou de l’étiquetage des semences, tout dépend de cette définition. Actuellement, nous utilisons la référence européenne qui fixe un seuil de 0,9 %. Une concertation a été organisée avec l’ensemble des parties prenantes. Je salue en particulier la contribution du Conseil national de la Consommation qui est essentielle dans cette discussion, à côté de celle du Haut Conseil des Biotechnologies. A partir du moment où on impose à toute une filière de production un niveau de traces acceptable ou de traces autorisées pour pouvoir apposer l’allégation « sans OGM », cela implique – par ricochet – d’imposer des conditions techniques dans la fabrication du produit mais, en amont également, dans le transport des matières premières et, éventuellement, dans la mise en culture des productions agricoles, y compris, comme c’est le cas en France pour l’ensemble de la production agricole, s’il ne s’agit pas de plantes génétiquement modifiées. D’où la sensibilité du problème.
Nous avons d’ailleurs noté des différences d’approche, sur ce point, entre ce qui a été retenu en Allemagne et ce qui est à l’étude en France. Cela pose donc le problème des distorsions de concurrence éventuelles entre des produits de différents pays européens sur lesquels serait apposée l’allégation « sans OGM » sans respecter nécessairement des règles aussi strictes qu’au niveau français. Nous avons déjà eu ce type de débat sur d’autres sujets tels que l’agriculture biologique.
Dès lors que la rédaction du décret sur le « sans OGM » sera clairement stabilisée, les autres décrets pourront être rédigés en cohérence avec celui-ci.
L’essentiel des décrets prévoient l’application de dispositions issues du projet de loi du Gouvernement. S’agissant des décrets d’application de dispositions issues d’amendements parlementaires, celui qui concerne l’agrément des laboratoires pose plusieurs problèmes. Tout d’abord, ces laboratoires font déjà l’objet d’un contrôle : faut-il aller plus loin ? En outre, l’ensemble des procédures d’analyse font l’objet de normalisations qui seront reconnues au niveau international : la France doit-elle s’engager, à titre unilatéral, dans un processus de modification de toutes les normes d’analyse ? Ce système d’agrément des laboratoires pourrait être superfétatoire.
En matière de recherche, vous trouverez en page 40 du rapport l’état des discussions sur le sujet au niveau européen : elles concernent la réforme des procédures d’analyse et d’expertise scientifique de l’Agence européenne de sécurité des aliments. Or, si cette amélioration repose sur les contributions des États membres, en l’état actuel des choses, la France aura beaucoup de mal à participer de façon proactive à cette discussion en l’absence d’essais permettant des observations concrètes. Cela est apparu à plusieurs reprises dans les interventions de nos interlocuteurs.
Par ailleurs, François Brottes suggère d’attendre que le débat ait été suffisamment clarifié et soit stabilisé au niveau européen pour prendre en conséquence des dispositions nationales. Or nous nous trouvons dans une situation où l’un attend l’autre et où l’Europe attend également que les États membres apportent leur contribution à la discussion. A cet égard, une grande partie de l’activité du Haut Conseil des Biotechnologies a consisté à répondre à des saisines du Gouvernement afin que celui-ci prenne position dans la discussion européenne. En d’autres termes, une partie importante des travaux du HCB ne porte pas sur des problèmes franco-français mais sur une interrogation européenne à laquelle le Gouvernement français se doit de répondre.
En réponse à Mme Anny Poursinoff, j’ai bien compris que vous vous interrogiez sur la pertinence de l’essai de Colmar. Germinal Peiro et moi-même avons eu la chance de nous entretenir longuement avec le Président de l’INRA de Colmar ainsi qu’avec des personnes parties prenantes du comité de suivi qui a été mis en place. Ce comité a également travaillé en amont de l’essai, dans le cadre d’une co-construction avec les scientifiques du protocole de l’essai. La volonté d’auditionner la présidente de l’INRA a été évoquée à plusieurs reprises. Il serait également intéressant d’auditionner M. Jean Masson, président de l’INRA de Colmar : il a beaucoup à dire, au-delà de la question des OGM, sur la manière dont le chercheur peut travailler en interface avec la société civile et les autres acteurs du domaine scientifique concernés, en réunissant autour d’une table des producteurs agricoles et des militants associatifs pour que la communication s’établisse entre les uns et les autres. Ainsi, le scientifique s’oblige à expliciter sa réflexion scientifique afin qu’elle réponde aux attentes de la population.
S’agissant des conditions techniques de mise en œuvre de l’essai, vous remettez en cause l’absence de confinement. Or nous avons visité le site : c’est un essai sur le court noué de la vigne. Il porte sur le porte-greffe, c’est-à-dire les racines, dans le sol, qui supportent un greffon, qui est à l’air libre. D’après le protocole de l’essai qui a été co-construit avec le monde associatif, il a été décidé que l’ensemble des inflorescences, c’est-à-dire toute la partie aérienne, allaient être détruites, que les feuilles allaient êtres détruites dès lors que le cycle végétatif toucherait à sa fin, à l’automne, et qu’en ce qui concerne tout ce qui est en contact avec le sol, c’est-à-dire les racines, il y aurait une reconstitution du sol. On a en effet creusé le sol, posé une bâche étanche, remis de la terre et replanté. Le terrain est entouré d’une clôture - qui n’est certes pas infranchissable puisqu’un certain nombre de personnes ont réussi à la franchir. La question du confinement a donc été étudiée et intégrée en amont, lors la réalisation du protocole. Visiblement, celui-ci a donné satisfaction à l’ensemble des parties prenantes – y compris celles dont les représentants nationaux revendiquent aujourd’hui le soutien aux actes de destruction qui ont été commis. Il y a donc clairement une différence de point de vue entre les représentants au niveau national, qui ont accordé la priorité à des considérations de stratégie politique, dans une posture de communication, et ceux qui sont partie prenante d’un débat au niveau du terrain, qui voient les choses avec réalisme, et sans doute davantage d’objectivité.
Le comité de suivi de l’essai avait également pour vocation d’accompagner l’analyse des résultats des essais. Aujourd’hui, ce n’est plus possible puisque l’essai a été détruit. Il semblerait cependant que l’on puisse en tirer des enseignements très intéressants, qui ne pourront probablement pas faire l’objet d’une publication scientifique car les conclusions sont pour l’instant parcellaires. Nous pourrons interroger la présidente de l’INRA à ce sujet. Ces enseignements indiquent qu’il semblerait que le transgène ait pu communiquer avec la micro-faune du sol. Dans les débats que nous avons eus, cette question a été posée. Or, nous avons ici un essai qui nous fournit une indication sur le sujet. C’est extrêmement important et cela peut conduire la France à prendre une position dans le débat au niveau européen sur l’expertise scientifique européenne. Cependant, cet essai a été détruit.
Cet essai a aussi montré que ce qui fonctionnait sous serre ne semblait pas fonctionner dans les conditions d’un essai en semi-confinement, avec exposition aux conditions climatiques normales. En d’autres termes, la résistance attendue n’a pas été aussi évidente que prévu.
Un dernier élément doit enfin être connu : cet essai avait été mis « en concurrence » avec d’autres expérimentations portant sur des méthodes alternatives, jachère, cultures biologiques … Il s’agissait donc bien d’examiner toutes les possibilités techniques pour lutter contre une maladie de la vigne.
Vous voyez que c’est tout un processus qui a été détruit. Ce processus n’avait pas vocation à produire une plante génétiquement modifiée en vue de sa commercialisation dans la production agricole. Autrement, les vignerons alsaciens n’auraient jamais accepté que ces essais soient faits en Alsace, car il n’est pas question de recourir aux OGM pour le vignoble alsacien.
Il s’agissait donc clairement de faire le pont entre :
– la recherche fondamentale que j’ai pu voir dans le cadre de mes auditions sur le projet de loi, par exemple à l’université de Strasbourg ou à l’institut de biologie moléculaire des plantes, où l’on essaye de comprendre le fonctionnement du génome,
– et la recherche en début d’application, telle qu’elle est faite à l’INRA.
Ces enjeux sont extrêmement importants et méritent d’être exposés devant l’Assemblée nationale. Il en va de la capacité de la France à être partie prenante au débat scientifique et aux enjeux économiques que cela représente.
M. Germinal Peiro. M. Serge Poignant nous a interrogés sur ce qu’il en est du soutien à la recherche. La loi prévoit que les pouvoirs publics favorisent la mobilité des chercheurs qui s’engagent dans l’expertise scientifique et mentionne la recherche publique. Si la loi affiche cette bonne intention, nous n’avons pas eu d’élément concret d’évaluation sur ce point. Le mieux serait d’auditionner Marion Guillou, directrice de l’INRA.
Sur la question de savoir si la mise en culture relève d’un problème de volonté ou s’il faut légiférer : nous avons légiféré et la loi sera mise en œuvre dès lors que les décrets s’appliqueront.
En réponse à Mme Frédérique Massat, il est vrai que la loi prévoyait que nous disposerions du rapport sur les protéines végétales, ce qui n’est pas le cas. Nous l’indiquons donc dans le rapport. Il faut néanmoins noter que le bilan de santé de la PAC a permis de souligner le déficit français en matière de protéines végétales et de réorienter notre politique. Cela étant, nous avons été saisi d’effroi lorsqu’il nous a été dit à Bruxelles qu’il serait très difficile de résorber ce déficit. Je pensais naïvement qu’il suffisait que l’on se mette à produire du soja pour y arriver. Ce n’est pas le cas : le handicap est en réalité beaucoup plus sérieux qu’on ne le pense. C’est un sujet sur lequel nous devons nous concentrer parce qu’il est à peu près sûr que suivant l’évolution d’aujourd’hui, il n’y aura quasiment plus de soja non-OGM en provenance d’Amérique du Sud dans quelques années. La tendance est telle qu’on enregistre désormais un taux de 70 % de soja OGM. Il est de plus en plus difficile de trouver des filières non OGM.
Mme Frédérique Massat nous a interrogés sur un décret relatif aux utilisations en milieu confiné. Nous en parlons dans le rapport mais nous n’avons pas émis d’avis car le décret est encore en cours de préparation – au stade de la consultation. Nous avons recueilli les avis des pétitionnaires dont nous faisons état.
M. Jean-Louis Léonard nous demande si le HCB ne constitue pas un facteur de blocage. Ce n’est pas notre avis. Il a été instauré par la loi pour émettre des avis, et non pour prendre des décisions : ni à la place des parlementaires qui légifèrent ni à la place du Gouvernement. Il est composé d’un comité scientifique et d’un comité économique, éthique et social. Cette composition relève d’une volonté de trouver le consensus. Il faut également noter que le HCB n’a pu commencer à fonctionner qu’un an après le vote de la loi, car il a eu besoin de temps pour s’installer. Mais suivant l’avis de tous, il a beaucoup travaillé depuis un an.
En réponse à Mme Marie-Lou Marcel, pour garantir un soja sans OGM, il faut une traçabilité. Nous n’avons pas d’autre solution que d’exercer des contrôles, soit à l’arrivée des bateaux dans les ports européens – et non seulement français – soit grâce à la traçabilité des documents. Tous nos interlocuteurs ont affirmé que ce serait plus difficile à l’avenir.
En réponse à M. Jean-Charles Taugourdeau, c’est la loi qui permet d’assurer la sécurité des essais. Ceux qui ont détruit les essais de Colmar se sont mis hors-la-loi. Ils le savent et certains, même, le revendiquent.
Je rappellerai ce qu’a indiqué M. Philippe Tourtelier : le parti socialiste est favorable à la recherche publique et aux essais, y compris en plein champ si nécessaire. Nous condamnons ce qui s’est passé à Colmar car il y a un an, avec Antoine Herth, nous avons eu l’occasion de rencontrer le président de l’INRA après le premier arrachage. Nous avons fait un travail d’investigation et avons rencontré des personnes qui avaient réussi à établir le consensus sur le plan local, y compris avec certaines associations environnementales, pour mener à bien ces essais. Après le premier arrachage, les faucheurs ont été découragés pour un temps. Puis il y en a eu un deuxième.
Mme Annick Le Loch nous interroge sur l’arrêté pris en juillet autorisant l’inscription de plusieurs variétés de maïs transgénique sur le catalogue. C’est le Conseil d’Etat qui a invité le Gouvernement à prendre cet arrêté car il s’agissait de variétés déjà autorisées.
La difficulté réside dans le temps de latence entre les autorisations accordées dans l’Union européenne et le processus de mise en culture de plantes OGM en Amérique. Aujourd’hui, ce décalage est tel que nous allons nous retrouver un jour avec l’arrivée de bateaux dans des ports comme Rotterdam, contenant des produits non autorisés en Europe. Cela mettra en péril l’alimentation du bétail. Tous les élevages, en particulier les porcs et la volaille, sont nourris de protéines qui arrivent d’outre-Atlantique. Cela nous ramène à la question de notre auto-suffisance en matière de protéines végétales. De ce point de vue, il est évident que l’Europe a failli.
M. Antoine Herth, rapporteur. Je voudrais apporter une précision complémentaire au sujet de la traçabilité des OGM en prenant l’exemple non du soja mais de la filière maïs alsacienne. Cette filière présente l’originalité d’être destinée à 80 % à l’alimentation humaine. Un effort de traçabilité a été mis en place par les filières céréalières, avec un surcoût destiné à garantir un maïs sans OGM. En effet, si le maïs OGM n’est pas autorisé à la culture en France, on peut quand même retrouver des traces d’OGM dans le maïs cultivé sur notre territoire, du fait notamment des semences importées, ce qui justifie les efforts de traçabilité engagés.
S’agissant de l’industrie semencière, je signalerai à M. Taugourdeau que le débat essentiel aujourd’hui est le suivant : où s’arrêtent et où commencent les OGM ? Cet été, nous avons assisté à la destruction de tournesols qui n’étaient pas obtenus par transgénèse mais par mutagénèse, procédé qui est désormais considéré par certaines associations comme une modification génétique.
Je voudrais également compléter la réponse de M. Peiro à la question sur les variétés autorisées. Si elles sont autorisées au niveau européen, la France a obligation de les inscrire dans son catalogue. En pratique, cette obligation n’autorise pas pour autant la culture des OGM sur le territoire français dès lors qu’avec la clause de sauvegarde, il n’y a pas d’autorisation de mise en culture au niveau national. En revanche, cette inscription simplifie l’importation de maïs car l’importation de produits dans lesquels on retrouve des traces des variétés inscrites est autorisée. Les cargaisons de produits dans lesquels on retrouve des traces de variétés non autorisées seraient, elles, rejetées.
Pour finir, M. le Président, je rappellerai les conséquences de l’annulation par le Conseil d’État de la possibilité de préciser par voie de décret les conditions d’information du public, et de la nécessité de réemprunter la voie législative sur ce sujet. Il est pour l’instant impossible de cultiver des OGM ou bien de mettre en place des expérimentations, ce qui représente le seul blocage à l’application de la loi sur les organismes génétiquement modifiés, sous réserve de la parution des décrets d’application pour les autres dispositions. A court terme, il est gênant de ne pas pouvoir autoriser de nouveaux essais en France. Tant que le Parlement n’aura pas de nouveau légiféré, la recherche ne pourra pas reprendre.
M. Patrick Ollier, président. Je crois que l’on peut féliciter et remercier nos deux co-rapporteurs pour l’excellent travail qu’ils ont réalisé. Avant de procéder au vote sur la publication du rapport, MM. François Brottes et Jean-Charles Taugourdeau désireraient intervenir.
M. François Brottes. Je m’étonne du fait que le Conseil d’État ait fait une observation sur un point du texte adopté qu’il n’avait pas relevé lors de son examen préalable sur le projet de loi.
M. Antoine Herth, rapporteur. Le décret qui a été annulé date de 2007 et anticipait donc sur l’adoption de la loi du 25 juin 2008. En effet, la France était en retard dans la transposition de directives européennes – elle a d’ailleurs été condamnée à une amende forfaitaire de dix millions d’euros pour ce retard – et avait dans un premier temps entrepris de transposer par voie de décret.
M. François Brottes. Grâce à vos explications, je comprends mieux comment nous en sommes arrivés à une telle situation. J’estime cependant que le Gouvernement doit s’exprimer rapidement à la suite de ce rapport pour que la loi ne reste pas inapplicable. Il est de votre ressort de convoquer le Gouvernement, M. le président.
M. Patrick Ollier, président. Malgré tout le respect que je porte à votre fonction et l’amitié que j’éprouve pour votre personne, je vous signalerai qu’il n’est pas du vôtre de me dicter la conduite à suivre. Néanmoins, je vous informe qu’il est prévu que le ministre compétent soit interrogé sur les suites à donner à ce rapport, à une date restant à déterminer. Par ailleurs, le partage des compétences entre la Commission du développement durable et notre commission est particulièrement problématique s’agissant de décrets qui peuvent comporter jusqu’à sept ministres signataires. Cette loi a été adoptée avant la scission en deux parties de la Commission des affaires économiques. Nous conservons notre compétence car nous parlons d’organismes cultivés, donc d’agriculture, sujet que nous avons conservé dans notre portefeuille. Fort de cette compétence, je ferai en sorte de convoquer les ministres de l’agriculture et de l’écologie, de manière à ce que nous ayons les réponses à nos interrogations.
M. Jean-Charles Taugourdeau. Je voudrais signaler à quel point je trouve extrêmement grave d’entendre les propos tenus par certains au sujet des OGM, mais aussi des produits phytosanitaires. Nous avons affaire à des personnes dogmatiques, voire même fanatiques, qui manipulent des collectifs au mépris le plus souverain de l’intérêt général. Ces personnes sont, selon moi, aussi condamnables que celles qui prônent l’arrêt des recherches sur le génome humain pour lutter contre la mucoviscidose ou la myopathie par exemple, ou encore les transfusions sanguines.
Mme Anny Poursinoff. Je trouve au contraire extrêmement graves les propos qui viennent d’être tenus. Les personnes qui se posent des questions ne sont pas forcément archaïques.
La question que vous avez soulevée, M. Herth, est fort intéressante : où commencent les OGM ? Ne serait-il pas intéressant que nous puissions bénéficier d’auditions de scientifiques qui nous éclairent sur le sujet ?
M. Patrick Ollier, président. Après avoir entendu l’ensemble des interventions, qui ont constitué un débat riche et approfondi, nous allons procéder au vote sur la publication de ce rapport.
La Commission autorise à l’unanimité la publication du rapport.
LISTE DES PERSONNES AUDITIONNÉES
● En septembre et octobre 2009 :
– Ministère de l'écologie, de l'énergie, du développement durable et de l’aménagement du territoire : Mme Dominique Dron, conseiller auprès du ministre d’État
– Ministère de l’agriculture et de la pêche : Mme Elodie Galko, conseiller auprès du ministre
– Coopérative céréalière Comptoir Agricole de Hochfelden : MM. Eugène Schaeffer, président, André Schuhler, directeur général, Laurent Thiaucourt, directeur de l’alimentation du bétail et Denis Fend, responsable céréales
– INRA de Colmar : M. Jean Masson, président
● En septembre 2010 :
– Ministère de l'écologie, de l'énergie, du développement durable et de la mer en charge des technologies vertes et des négociations sur le climat : Mme Dominique Dron, conseiller auprès du ministre d’État
– Haut conseil des biotechnologies : Mme Catherine Bréchignac, présidente, M. Maurice Gross
– Organibio : M. Jean Lunel, Mme Annie Pignard (Syngenta), Mme Marie-Christine Bergot (Sanofi-Aventis), Mme Corinne Le-Caer (Sanofi-Aventis)
– Orama : M. Christophe Terrain, président de l’AGPM et vice-président d’ORAMA, Mme Céline Duroc, responsable Environnement
– Plateforme des biotechnologies végétales : M. Philippe Gracien, directeur général du GNIS, M. Yann Fichet, directeur des affaires institutionnelles et industrielles de Monsanto, Mme Marie-Cécile Lebas, directrice des affaires publiques de Syngenta, Mme Annie Pignard, chargée des affaires réglementaires pour l’Union française des semenciers
– Direction générale de la concurrence, de la consommation et de la répression des fraudes (DGCCRF) : Mme Nathalie Homobono, directeur général, M. Claude Duchemin, chef du bureau C3 Loyauté
– France Nature Environnement : M. Lylian Le Goff, administrateur de FNE et co-pilote de la mission biotechnologies de FNE, M. Frédéric Jaquemart, administrateur de FNE, co-pilote de la mission biotechnologies de FNE, vice-président du comité économique, éthique et social du Haut conseil des biotechnologies, Mme Morgane Piederriere, chargée du suivi législatif et des relations institutionnelles
– UFC-Que Choisir : Mme Sylvie Pradelle, vice-présidente nationale, membre du comité économique, éthique et social du Haut conseil des biotechnologies, M. Olivier Andrault, chargé de mission alimentation
– Fédération nationale d’agriculture biologique (FNAB) : M. Dominique Marion, président, Mme Juliette Leroux, chargée de mission, Mme Stéphanie Pageot, administrateur
– Confédération paysanne : M. Guy Kastler, membre du comité économique, éthique et social du Haut Conseil des Biotechnologies, Mme Roxanne Mitralias, animatrice chargée du dossier OGM
– Coordination rurale : M. François Lucas, président
– Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) : Mme Valérie Baduel, directrice générale adjointe, Mme Marie Favrot, directrice de l’évaluation santé alimentation
– Confédération nationale des syndicats d’exploitants familiaux (MODEF) : Mme Estelle Royer, secrétaire nationale, M. Jean-Claude Lajous, secrétaire national
– Institut national de la recherche agronomique (INRA) : Mme Marion Guillou, présidente, Mme Bénédicte Herbinet, conseillère de la présidente
– Ministère de l’alimentation, de l’agriculture et de la pêche : Mme Élodie Galko, conseillère technique chargée du développement durable et du changement climatique, M. Robert Tessier, adjoint de la sous-directrice qualité et protection des végétaux
– Jeunes Agriculteurs : M. Arnaud Tachon, membre du bureau, membre du comité économique, éthique et social du Haut conseil des biotechnologies, M. Aurélien Vaucelle, Service économique - Conseiller productions végétales, M. Julien Marie, membre du conseil d’administration
– Représentation permanente de la France auprès de l’Union européenne : M. Philippe Leglise-Petit, représentant permanent adjoint
– Direction Générale de l’Agriculture et du Développement rural de la Commission européenne : M. Jean-Luc Demarty, directeur général
– Agence européenne de sécurité alimentaire (AESA) : M. Christophe Wolff, chargé des relations institutionnelles, Mme Karine Lheureux, expert scientifique
– Direction générale de la Santé et des Consommateurs de la Commission européenne : M. Eric Poudelet, directeur Sécurité de la chaîne alimentaire, Mme Dorothée André chef de l’unité Biotechnologies et santé des plantes
– Confédération Consommation, logement et cadre de vie (CLCV) : M. Charles Pernin, membre du comité économique, éthique et social du Haut conseil des biotechnologies
– Fédération nationale des syndicats d’exploitants agricoles (FNSEA) : M. Pascal Ferey, président de la Commission Environnement, membre titulaire du comité économique, éthique et social du Haut conseil des biotechnologies, Mme Catherine Lion, directrice générale adjointe, membre suppléant du comité économique, éthique et social du Haut conseil des biotechnologies, Mme Nadine Normand, chargée des relations avec le Parlement
TABLEAU DE SUIVI DE L’APPLICATION DE LA LOI
suivi de l’application de la loi n° 2008-595 du 25 juin 2008 relative aux organismes génétiquement modifiés (mise à jour : septembre 2010) | |||||||
Objet |
Direction / bureau responsable |
Article de la loi |
Base juridique |
Nature du texte |
Consultations obligatoires |
Publication |
Commentaires |
Rapport gouvernemental relatif aux possibilités de développement d’un plan de relance de la production de protéines végétales |
MAAP |
1 |
Remise du rapport au Parlement prévue dans les six mois suivant la publication de la loi. Saisine du CGAAER à l’été 2010 : rapport attendu pour l’automne. | ||||
Définition du « sans OGM » |
MEIE (DGCCRF) |
2 |
Art. L. 531-2-1 du code de l'environnement + Art. L. 214-1, L. 214-2 et L. 215-1 et suivants du code de la consommation |
Décret en CE |
Haut Conseil des biotechnologies : avis rendu le 3 novembre 2009 |
Un projet de texte a été rédigé en concertation entre les services du MAAP et du MEEDDM. Une RIM a été organisée le 2/09/10 mais le projet de texte serait toujours examiné par les services du Premier ministre. Une étude sur les conséquences socio-économiques de la mise en place d’une filière « sans OGM » est en outre attendue pour mi-novembre 2010. Le projet doit ensuite : - être de nouveau soumis au HCB ; - être notifié à la Commission européenne au titre de la directive 98/34/CE ; - passer devant le CE. | |
Agrément des laboratoires où sont réalisés les études et tests sur lesquels se fonde l’évaluation des risques |
2 |
Art. L. 531-2-1 du code de l’environnement |
Pas de texte d’application prévu pour le moment. La définition des modalités d’agrément des laboratoires se heurte à un problème juridique résultant du fait que les études et tests ne sont pas nécessairement menés sur le territoire français | ||||
Haut Conseil des Biotechnologies |
MEEDDM (DGPR) |
3 |
Art. L.531-5 du code de l'environnement |
Décret en CE |
Décret n° 2008-1273 du 5 décembre 2008 |
||
Nomination des membres du Haut Conseil des Biotechnologies |
MEEDDM (DGPR) |
3 |
Art. L.531-4 et L. 531-4-1 du code de l'environnement |
Décret simple |
Commissions parlementaires compétentes Cf. avis négatif rendu par la Commission des affaires économiques de l’AN sur la candidature de M. Jean-Luc Darlix le 17/12/2009 et avis positif rendu sur la candidature de Mme Catherine Bréchignac le 01/04/2010. |
Décret du 30 avril 2009 + Décret du 2 septembre 2010 |
Nomination de nouveaux membres suite à des démissions au sein du CEES et à des besoins supplémentaires au sein du CS en septembre 2010 |
Indemnités allouées aux membres du HCB et aux experts désignés par le HCB |
MEEDDM |
Art. R. 531-27 du code de l’environnement |
Arrêté |
Arrêté du 9 juin 2010 |
|||
Conditions techniques de coexistence |
MAAP |
6 |
Art. L.663-2 du code rural |
Arrêté du ministre chargé de l’agriculture |
Comité scientifique du Haut Conseil des Biotechnologies Ministre chargé de l’environnement |
En cours de rédaction. Saisine du CS du HCB en cours de finalisation entre MAAP et MEEDDM Autosaisine du CEES du HCB | |
Contrôle du respect des conditions techniques de coexistence |
MAAP |
6 |
Art. L.663-3 du code rural |
Arrêté du ministre chargé de l’agriculture |
En attente de la définition des conditions techniques de coexistence | ||
Garanties financières |
MEIE (DGTPE) |
8 |
Art. L. 663-4 du code rural |
Décret en CE |
En cours de rédaction | ||
Comité de surveillance biologique du territoire |
MAAP |
9 |
Art. L.251-1du code rural |
Décret simple |
Décret n° 2008-1282 du 8 décembre 2008 |
||
Nomination des membres du comité de surveillance biologique du territoire |
MAAP |
9 |
Art. L.251-1du code rural |
Arrêté du ministre chargé de l’agriculture |
Arrêté du 16 février 2010 |
Première réunion du CSBT prévue en septembre 2010 | |
Possibilité de prendre toutes mesures destinées à collecter les données et informations relatives à la mise sur le marché, la délivrance et l’utilisation des OGM |
MAAP |
9 |
Art. L.251-1du code rural |
Arrêté du ministre chargé de l’agriculture |
Les dispositions permettant la collecte des données nécessaires dans le cadre du suivi des cultures seront arrêtées au cas par cas, lorsque les mise en culture seront effectives. | ||
Déclaration de culture d'OGM |
MAAP |
10 |
Art. L.663-1du code rural |
Décret simple |
RIM d’arbitrage le 22/03/2010, qui a décidé d’une saisine du HCB. Saisine réalisée par le MAAP le 20/07/10 | ||
Utilisation confinée d’OGM |
MESR |
11 et 13 |
Art. L.532-1 à L.532-4 et Art. L.515-13 du code de l'environnement |
Décret en CE |
Haut Conseil des Biotechnologies |
Cinq renvois au décret sont mentionnés dans les articles 11 et 13, mais un seul décret devrait être publié Arbitrage en RIM le 21/05/2010 Consultation publique lancée par le MESR achevée le 30/09/2010 Saisine du HCB en cours | |
Modification de la rubrique 2680 de la nomenclature des installations classées (OGM) |
MEEDDM |
13 |
Art. L. 532-1 du code de l’environnement |
Décret en CE |
Haut Conseil des biotechnologies Conseil supérieur des installations classées (CSIC) |
Projet de décret rédigé. Consultations publiques et ministérielles réalisées. En attente du décret relatif à l’utilisation confinée, les deux décrets étant liés. | |
Conditions d'étiquetage des OGM mis à la disposition de tiers à l'occasion d'une utilisation confinée et modifiant le code de l'environnement |
MEEDDM |
13 |
Art. L.532-2 du code de l'environnement |
Décret en CE |
Décret n° 2009-45 du 13 janvier 2009 |
||
Abrogation des dispositions étiquetage de l’arrêté du 2 juin 1998 (rubrique 2680-1) |
MEEDDM |
Arrêté |
Arrêté du 26 août 2009 modifiant l’annexe I de l’arrêté du 2 juin 1998 relatif aux prescriptions générales applicables aux installations classées pour la protection de l’environnement soumises à déclaration sous la rubrique no 2680-1 + Arrêté du 26 août 2009 modifiant l’arrêté du 2 juin 1998 relatif aux règles techniques auxquelles doivent satisfaire les installations soumises à autorisation au titre de la rubrique no 2680-2 de la nomenclature des installations classées pour la protection de l’environnement |
||||
Montant de la taxe pour la demande d'agrément pour l'utilisation confinée d’OGM |
MESR |
13 |
Art. L.532-5 du code de l'environnement |
Arrêté |
En cours de rédaction | ||
Montant de la taxe pour la demande d'autorisation de dissémination d’OGM |
MEEDDM |
14 |
Art. L.535-4 du code de l'environnement |
Arrêté |
Arrêté du 3 mars 2010 |
||
Étiquetage des semences (définition d’un seuil de présence fortuite d’OGM) |
MEIE |
21 |
Décret simple |
RIM du 18/01/2010, qui a conclu à l’attente du texte relatif à la définition du « sans OGM » Le projet de texte devra ensuite être notifié à la Commission européenne au titre de la directive 98/34/CE | |||
1 () Décision du Conseil constitutionnel n° 2008-564 DC du 19 juin 2008 déclarant non conformes à la Constitution les dispositions des articles L. 532-4-1 et L. 535-3 du code de l’environnement renvoyant à un décret en Conseil d’État pour fixer les listes des informations contenues dans les dossiers d’information mis à la disposition du public qui ne peuvent en aucun cas rester confidentielles. Ces listes ont ensuite été introduites au sein des articles L. 532-4-1 et L. 535-3 par l’article 15 de la loi n° 2008-757 du 1er août 2008 relative à la responsabilité environnementale.
2 () Arrêt du Conseil d’État du 24 juillet 2009.
3 () « Toute personne a le droit, dans les conditions et les limites définies par la loi, d'accéder aux informations relatives à l'environnement détenues par les autorités publiques et de participer à l'élaboration des décisions publiques ayant une incidence sur l'environnement. ». Il résulte de ces dispositions « qu’il n’appartient qu’au législateur de préciser ‘les conditions et les limites’ dans lesquelles doit s’exercer le droit de toute personne à accéder aux informations relatives à l’environnement détenues par les autorités publiques » (extrait de la décision n° 2008-564 DC).
4 () De la définition du « sans OGM » découlent en effet un certain nombre de conséquences en matière, par exemple, de conditions techniques de coexistence ou d’étiquetage des semences.
5 () La directive aurait en effet dû être intégralement transcrite en droit interne au plus tard en octobre 2002. La France a, en raison du retard pris, été condamnée au paiement d’une somme forfaitaire de 10 millions d’euros.
6 () Voir tableau en annexe.
7 () Rappelons cependant qu’avant même l’adoption de la loi, trois décrets et trois arrêtés publiés au Journal officiel le 20 mars 2007 étaient intervenus afin de transposer, du moins partiellement, les dispositions de la directive 2001/18/CE en droit interne.
8 () Notons à cet égard que les articles 11 et 13 de la loi, relatifs à l’utilisation des OGM en milieu confiné, renvoient à cinq reprises au décret : un seul décret étant toutefois en préparation, la liste des textes d’application nécessaires n’en comptabilise qu’un seul.
9 () Le décret permet en effet au CS de s’adjoindre les compétences d’un spécialiste en thérapie génique, d’un expert en virologie animale, d’un agronome et d’un écologue.
10 () Décret n° 2008-1282 du 8 décembre 2008.
11 () Arrêté du 16 février 2010 portant nomination au comité de surveillance biologique du territoire.
12 () En raison de l’annulation par le Conseil d’État des dispositions réglementaires relatives à l’information et à la consultation du public à compter du 30 juin 2010 (arrêt du 24 juillet 2009) et de l’absence de dispositions législatives, aucune autorisation ne peut plus être délivrée depuis cette date.
13 () Durée estimée de la consultation : deux mois.
14 () Durée estimée de la consultation : un mois.
15 () Durée estimée de la consultation : six mois, avec renouvellement possible en cas de remarques de la Commission.
16 () Durée estimée de la consultation : un à trois mois.
17 () Agence nationale de sécurité sanitaire.
18 () Citation extraite du rapport d’activité du HCB.
19 () Ce chiffre est supérieur à celui figurant ensuite dans le tableau où sont reprises les données relevées dans le rapport d’activité 2009-2010 du Haut conseil , qui ne comptabilisent pas les derniers avis rendus.
20 () Le président du CS indique à cet égard dans le rapport d’activité 2009-2010 qu’ « en l’absence d’un risque majeur identifié, qui nous inviterait simplement à recommander de ne pas autoriser la mise en milieu ouvert de l’OGM analysé, il convient de mettre en place des structures d’appréciation de dérives éventuelles que l’on n’est pas nécessairement en mesure d’anticiper avec précision. »
21 () Organibio, audition du 14 septembre 2010.
22 () Rappelons que le CS est seul compétent sur ces dossiers, en application de l’article L. 531-4 du code de l’environnement.
23 () Sur la saisine du CEES relative à la définition du « sans OGM », un travail préliminaire a ainsi été réalisé par un groupe inter-comités CS/CEES.
24 () Elle a notamment pu constater qu’il était fréquent que les changements au sein des organigrammes des associations ou organisations représentées au CEES entraînent une demande de nouvelle nomination.
25 () Par exemple, retenir comme critère d’analyse des dossiers d’importation les effets de la culture de l’OGM concerné dans le pays exportateur ou, s’agissant des mises en culture, estimer nécessaire d’entreprendre une réflexion sur des « aspects plus généraux et d’ordre supérieur pour dépasser l’analyse éthique de chaque OGM pris individuellement afin de s’interroger plus globalement sur les sens et les effets des biotechnologies ».
26 () Confédération paysanne, France Nature Environnement, Amis de la Terre, Greenpeace.
27 () Rapport annuel et avis et recommandations.
28 () Décisions n° 305314 et n° 305315.
29 () Décret relatif à la dissémination volontaire à toute autre fin que la mise sur le marché de produits composés en tout ou partie d’organismes génétiquement modifiés.
30 () Décret relatif à la procédure d'autorisation de mise sur le marché de produits non destinés à l'alimentation composés en tout ou partie d'organismes génétiquement modifiés.
31 () Extrait de la décision n° 2008-564 DC.
32 () Contenu du plan de surveillance.
33 () Possibilité pour l'autorité administrative de décider quelles sont les informations qui restent confidentielles.
34 () Adaptation du plan de surveillance par l’autorité administrative.
35 () Informations rendues publiques dans un registre accessible par la voie électronique et auprès de l'autorité administrative compétente pour délivrer les autorisations.
36 () Définition du contenu de contenu de la fiche d’information destinée au public : celle-ci reprend la liste des informations qui ne peuvent en aucun cas rester confidentielles, liste dont la loi du 25 juin 2008 prévoyait qu’elle soit fixée par décret, disposition jugée non conforme à la Constitution par le Conseil constitutionnel dans la décision précitée. Cette liste a depuis été réintégrée dans l’article L. 535-3 du code de l’environnement.
37 () Possibilité pour l'autorité administrative de décider quelles sont les informations qui restent confidentielles.
38 () Consultation du public par voie électronique.
39 () Mise à disposition du public des fiches d'information destinées au public et du registre des localisations des disséminations par voie électronique.
40 () « Si l'autorité administrative compétente dispose d'informations sur des éléments nouveaux susceptibles d'avoir des conséquences significatives du point de vue des risques pour la santé publique et l'environnement, elle fait procéder à une nouvelle évaluation des risques et rend ces éléments accessibles au public ».
41 () Extrait de la décision n°305315.
42 () Il y aurait bien eu une demande d’essai privée en 2009 mais le pétitionnaire y aurait renoncé faute d’instance d’évaluation.
43 () Deux mille euros d’amende. Le coût pour relancer l’expérience a été estimé à 1,2 millions d’euros par l’INRA.
44 () Décision du Conseil d’administration de l’INRA du 27 juin 2007.
45 () Note d’information n° 2004-113 de la Direction générale de la concurrence, de la consommation et de la répression des fraudes.
46 () Cette étude a été commandée par le Gouvernement à un cabinet d’experts qui devrait rendre ses conclusions au mois de novembre.
47 () Citation reprise dans Agra Presse Hebdo n° 3225, du 9 novembre 2009.
48 () En application de l’article 17 paragraphe 1 point c du règlement 834/2007/CE, des périodes de conversion spécifiques sont définies par type de culture ou de production animale.
49 () Rappelons à cet égard que les produits issus de l’agriculture biologique ne peuvent être qualifiés de « sans OGM » du seul fait de leur mode de production, comme l’a confirmé Mme Homobono lors de son audition.
50 () Il n’y a pas d’habilitation de corps de contrôles spécifiques pour rechercher et constater les infractions au non-respect des conditions pour alléguer l’absence d’OGM qui seraient définies uniquement sur la base du code de l’environnement.
51 () Audition de MM. Eugène Schaeffer, président, André Schuhler, directeur général, Laurent Thiaucourt, directeur de l’alimentation du bétail et Denis Fend, responsable céréales.
52 () Sur la base d’une répartition 50/50 entre filière OGM et reste de la production, les auteurs de l’étude arrivent ainsi à un coût supplémentaire de 5,50 euros la tonne pour les filières en dessous du seuil de 0,9 %.
53 () Audition du 16 septembre 2010 à Bruxelles.
54 () Protocole standard pour l’étude de toxicité sub-chronique chez les rongeurs.
55 () Signalons à cet égard que les lignes directrices de l’OCDE découlent elles-mêmes des lignes directrices arrêtées par la FDA, Food and Drugs Administration américaine.
56 () Notons cependant que l’ensemble des questions ayant trait à la directive 2001/18/CE continuent d’être abordées entre États membres au sein du Conseil Environnement.
57 () En mars 2009, le Conseil s’est en effet prononcé pour la première fois contre la levée des mesures de sauvegarde prises par l’Autriche et la Hongrie sur le MON 810 conduisant la Commission à renoncer à poursuivre les procédures qu’elle avait lancées à l’encontre d’autres États membres, comme la France, dont les clauses de sauvegarde avaient pourtant été jugées sans fondement par l’AESA.
58 () Amflora est enrichie en amidon pour répondre aux besoins de l’industrie papetière.
59 () Agra Presse Hebdo, n° 3242, du 8 mars 2010.
60 () 17 demandes d’autorisation ou de renouvellement d’autorisation de mise en culture sont actuellement en attente : quatorze concernant du maïs, une sur le soja, une sur la betterave sucrière et une sur la pomme de terre.
61 () Lors du Conseil des ministres de l’environnement du 25 juin 2009 à Luxembourg, l’Autriche avait ainsi plaidé en faveur d’une renationalisation de la procédure d’autorisation d’OGM et obtenu le soutien des Pays-Bas, mais également de la Bulgarie, de Chypre, de la Grèce, de la Hongrie, de l’Irlande, de la Lettonie, de la Lituanie, du Luxembourg, de Malte, de la Slovénie et de la Pologne.
62 () M. George Lyon a quant à lui été nommé rapporteur pour avis au nom de la Commission de l’agriculture du PE.
63 () Agra Presse Hebdo, n° 3265, 6 septembre 2010.
64 () Un groupe de scientifiques a travaillé sur le sujet qui doit ensuite être transmis au Joint research committee de la Commission européenne mais aucune information n’a été donnée sur la date à laquelle ces travaux sont censés aboutir.
65 () Recommandation de la Commission du 13 juillet 2010 établissant des lignes directrices pour l’élaboration des mesures nationales de coexistence visant à éviter la présence accidentelle d’OGM dans les cultures conventionnelles et biologiques.
66 () Voir dans le rapport n° 846 sur le projet de loi, adopté avec modifications par le Sénat en deuxième lecture, relatif aux organismes génétiquement modifiés (n° 819), l’encadré relatif aux positions prises par la Commission européenne et la Cour de justice des communautés européennes sur les mesures nationales de coexistence.
67 () Agra Presse Hebdo, n° 3214, du 3 août 2009.
68 () Citation reprise dans Agra Presse Hebdo n° 3268, du 27 septembre 2010.
69 () Par exemple, un lot de soja destiné à la fois à la production d’huile pour l’alimentation humaine et de tourteaux pour l’alimentation animale serait refusé.
70 () Rappelons en effet que les accords de Blair House ont figé les surfaces éligibles à des aides au titre de la culture de protéines végétales.
71 () D’après John Dalli, 85 à 90 % de l’alimentation animale est étiquetée comme génétiquement modifiée et jusqu’à 95 % des importations de soja le sont (cité par Agra Presse Hebdo, n° 3268, du 27 septembre 2010).
72 () Le ministre Bruno Le Maire n’en a pas moins déclaré lors de son récent voyage aux États-Unis que la compétitivité du secteur agricole ne dépendait pas des OGM (« I think it would be a mistake to make a strong connection between GM and the competitiveness of the agricultural sector”) propos du 10 septembre 2010 rapportés par Dow Jones International News.
© Assemblée nationale