


N° 2377
______
ASSEMBLÉE NATIONALE
CONSTITUTION DU 4 OCTOBRE 1958
QUATORZIÈME LÉGISLATURE
Enregistré à la Présidence de l’Assemblée nationale le 19 novembre 2014.
RAPPORT
FAIT
AU NOM DE LA COMMISSION DES AFFAIRES SOCIALES SUR LA PROPOSITION DE LOI relative au financement de la recherche oncologique pédiatrique par l’industrie pharmaceutique,
PAR M. Jean-Christophe LAGARDE,
Député.
——
Voir le numéro :
Assemblée nationale : 1187.
___
Pages
INTRODUCTION 5
I. L’ONCOLOGIE PÉDIATRIQUE, UNE PRIORITÉ NATIONALE 7
1. La prise en charge des enfants et mineurs atteints de cancer 7
2. Des progrès considérables qu’il convient d’intensifier 9
a. Le financement public de la recherche oncologique 9
b. Les plans cancer 11
c. Les médicaments orphelins et le dispositif AcSé 12
II. LA PROPOSITION DE LOI PEUT FAVORISER DES PROGRÈS SUBSTANTIELS 15
1. L’évolution des méthodes de recherche ouvre des champs considérables pour la recherche oncologique pédiatrique 15
2. Une ressource nouvelle pour soutenir et élargir le travail de recherche 16
TRAVAUX DE LA COMMISSION 19
Article 1er (art. L. 245-6-1 [nouveau] du code de la sécurité sociale) : Instauration d’une contribution finançant la recherche pédiatrique 37
Article 2 (art. L. 6162-4 du code de la santé publique) : Protocole particulier en faveur des enfants ou adolescents de moins de 18 ans atteints d’un cancer 47
Article 3 (art. 575 et 575A du code général des impôts) : Compensation des pertes des éventuelles pertes de recette pour les organismes de sécurité sociale 49
ANNEXE N° 1 : LISTE DES PERSONNES AUDITIONNÉES PAR LE RAPPORTEUR 53
ANNEXE N° 2 : LISTE DES CANCERS PÉDIATRIQUES (TOUCHANT LES PATIENTS DE MOINS DE 14 ANS) : 55
Trop souvent encore en France des parents d’enfants atteints de cancers dits « orphelins » sont confrontés au désarroi des équipes médicales. Celles-ci leur annoncent qu’il n’existe pas de traitement à la maladie de leur enfant et qu’il n’y a pas d’espoir du côté de la recherche sur ce type de cancer, celui-ci étant jugé trop rare pour permettre d’amortir un investissement significatif de l’industrie. Si chacun comprend que la science n’ait pas trouvé de traitement à tous les types de cancers, nul ne saurait se résigner à l’absence d’effort spécifique pour telle ou telle pathologie faute d’un intérêt commercial à la traiter. C’est pourquoi, en coordination avec les industriels, le financement public doit pourvoir au financement des recherches jugées non rentables.
C’est dans ce sens que ce texte propose d’instaurer un prélèvement de faible niveau, de près de 30 millions d’euros, sur les bénéfices de l’industrie pharmaceutique en France : ce mécanisme permettra de financer les recherches non rentables en mettant modestement à contribution les profits réalisés dans le domaine médical. Cette ressource financerait des programmes de recherche touchant spécifiquement à la recherche oncologique pédiatrique afin de ne laisser aucune de ces affections vierge de recherches scientifiques. C’est l’objet de l’article premier. De plus, pour un traitement le plus individualisé possible des cancers orphelins, la proposition de loi prévoit, dans son article 2, d’inscrire dans le code de la santé publique la faculté que doit avoir chaque enfant ou adolescent de moins de dix-huit ans de bénéficier d’un protocole particulier pour le traitement de sa pathologie.
Ainsi, cette proposition de loi porte une démarche complète et cohérente, en phase avec le 3e plan Cancer (2014-2019) qui fait du traitement des cancers pédiatriques une priorité. Cet effort est particulièrement attendu par les familles mais aussi par les chercheurs qu’il faut encourager dans ce domaine spécifique. Il n’est pas inutile de rappeler que la recherche oncologique pédiatrique bénéficie à tous ; le développement de cellules cancéreuses observé et traité chez l’enfant peut en effet, par analogie, être directement utile au traitement des pathologies de l’adulte.
C’est donc à peu de frais que cette proposition de loi permettra à notre pays de franchir une nouvelle étape dans la prise en charge des cancers pédiatriques, tant sur le plan scientifique que sur le plan humain.
La France enregistre près de 350 000 cas de cancers chaque année. Parmi eux, 1 700 concernent des enfants (âgés de moins de 14 ans) – avec 287 décès constatés en 2010 – et 700 cas nouveaux par an chez les adolescents (âgés de 14 à 19 ans). La moitié des cancers de l’enfant survient avant l’âge de 5 ans.
L’âge compte parmi les principaux facteurs de risque oncologique et, selon son stade de développement, le corps d’un patient peut être atteint de cancers de types différents. Certains cancers sont communs à l’adulte et l’enfant, telle la leucémie ; ils se développent cependant selon des types et des modalités différentes et nécessitent des traitements spécifiques. D’autres ne se manifestent que chez les enfants, par exemple le rétinoblastome – un cancer de l’œil dont le seul traitement connu aujourd’hui implique l’ablation de l’organe et donc le handicap de l’enfant.
L’épidémiologie met en évidence une très forte proportion de leucémies parmi les cancers dont les enfants et jeunes sont victimes (650 cas détectés en 2012). Les progrès de la médecine ont permis en un peu plus de 20 ans d’inverser le taux de mortalité des enfants face à cette pathologie : d’environ 80 % de décès, c’est désormais le taux de guérison qui avoisine les 80 %, seules deux signatures de leucémie ne pouvant être traitées en l’état de la science. Vient ensuite la liste de cancers caractérisés par une épidémiologie plus faible et dont les plus fréquents sont décrits en annexe II. On y compte notamment les tumeurs cérébrales pédiatriques (environ 50 décès par an) ou encore les cancers du foie (20 à 25 cas par an en France). Au total, une soixantaine de cancers sont recensés chez l’enfant et l’adolescent, soit autant que chez l’adulte.
Le taux de guérison des enfants a fortement progressé au cours des dernières décennies pour atteindre depuis les années 2000 un palier supérieur à 80 % à 5 ans et proche de 70 % à 10 ans. Il est cependant plus faible, avoisinant les 40 à 50 % en ce qui concerne les adolescents. Ces avancées sont imputables aux progrès de la médecine, mais ont également trait aux spécificités des cancers pédiatriques : contrairement à ceux touchant les adultes, ces cancers résultent beaucoup moins d’une accumulation de dérèglements génétiques indirects (qui interviennent au long de la vie adulte, par exemple du fait du tabagisme) ; en outre, dans la phase de traitement, les enfants peuvent supporter des doses de chimiothérapie jusqu’à 100 fois supérieures à celle des adultes. On notera enfin que les enfants et jeunes mineurs guérissant du cancer demeurent souvent fragiles : 40 % souffrent de séquelles parfois très lourdes et une proportion comparable présente un risque de développer un deuxième cancer.
Les cancers pédiatriques sont des maladies rares, c’est-à-dire concernant une faible proportion de la population, et nécessitent donc des traitements bien spécifiques. Ils sont dits pour la plupart « orphelins », c’est-à-dire sans traitement validé permettant d’administrer une molécule bénéficiant d’une autorisation de mise sur le marché (AMM). Ce type de situation résulte d’un état d’avancement insuffisant de la recherche, de l’absence de perspectives de commercialisation ou encore tout simplement de l’absence de programme de recherche public sur cette pathologie.
La France compte sept organisations interrégionales disposant d’un circuit spécifique de prise en charge et de suivi des cancers pédiatriques. En plus des huit canceropôles en charge des adultes, le 3e plan cancer (2014-2019) finance un réseau unique de sept centres permettant des essais cliniques en phase précoce de pédiatrie (Centres labellisés d’essais cliniques de phases précoces dits « CLIPP » ou « CLIP² »). Ces infrastructures placent la France parmi les pays en pointe dans ce domaine. Ils maillent le territoire comme décrit ci-après :
MAILLAGE TERRITORIAL DES CLIPP
La prise en charge de l’enfant donne lieu à des réunions cancer pluridisciplinaires (RCP) régionales ou interrégionales réunissant au moins trois disciplines, permettant de procéder à la détermination histologique de la tumeur et l’examen au cas par cas de la possibilité d’appliquer les protocoles existants ou de l’opportunité de procéder à des essais cliniques.
Les jeunes patients sont généralement pris en charge dans le cadre de « protocoles de soins », organisant la prescription d’une molécule. Ces protocoles sont définis par le corps médical, notamment dans le cadre de sociétés savantes internationales (telles que la Société internationale d’oncologie pédiatrique). Ainsi, la leucémie, le cancer le plus répandu, peut généralement être traitée par des protocoles standards, la recherche et la pratique médicale ayant permis d’identifier les types de médicaments efficaces face à la mutation et, sur cette base, bénéficiant finalement d’une AMM.
Lorsqu’il n’existe pas de molécule bénéficiant de l’AMM, l’équipe pluridisciplinaire peut préconiser le recours à une molécule au stade de l’essai clinique, bénéficiant d’une recommandation temporaire d’utilisation (RTU, un statut administratif plus souple à mettre en place, existant depuis 2011) dans le cadre d’un « protocole de recherche », défini après avis d’un comité de protection des personnes qui examine l’intérêt pour le patient et pour la science de sa mise en œuvre. Les recherches sont enregistrées et leurs résultats ont vocation à être publiés. L’absence de protocole, fût-il d’essai, signifie que rien ne peut être tenté en l’état des connaissances scientifiques (des cas extrêmement rares).
L’Institut national du cancer (INCa) est délégataire de l’essentiel des crédits gouvernementaux dévolus à la recherche sur le cancer. Il agit en tant qu’agence de coordination et de financement de l’ensemble des projets de recherche en cancérologie en France. Son comité d’experts retient environ 170 programmes chaque année, qu’ils soient français ou constituent la participation française à un programme international.
En 2013, le budget prévisionnel de cet organisme s’élevait à 104 millions d’euros. Le financement de l’institut, illustré par le diagramme ci-après, était principalement assuré par le ministère de la santé et des affaires sociales (50 %) ainsi que par le ministère de la recherche et de l’enseignement supérieur (38 %).
RECETTES 2013
(En millions d’euros)
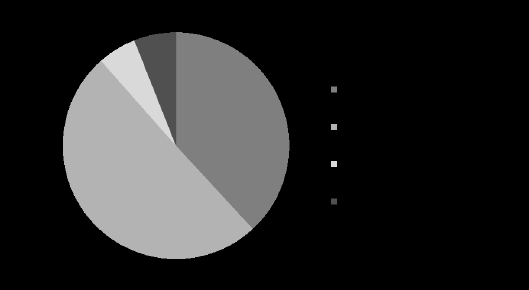
Source : e-cancer.fr.
Les dépenses d’appui à la recherche de l’INCa représentent la quasi-totalité de son budget. Le tableau ci-après illustre la répartition prévisionnelle des dépenses de l’année en cours, pour un montant d’environ 97 millions d’euros.
DÉPENSES PRÉVISIONNELLES 2014 DE L’INCa
(En euros)
Personnel |
Autres charges |
Intervention |
Investissement |
Total | |
Observation et évaluation en santé publique |
1 052 647 |
514 500 |
4 892 296 |
6 459 443 | |
Prévention/Dépistage |
1 748 195 |
1 708 000 |
2 097 854 |
5 554 049 | |
Organisation et qualité des soins |
2 675 395 |
1 167 500 |
2 030 143 |
5 873 038 | |
Innovations thérapeutiques |
491 764 |
237 300 |
8 084 348 |
8 813 412 | |
Recherche translationnelle et clinique |
832 304 |
737 900 |
12 044 935 |
13 615 139 | |
Recherche en sciences humaines et sociales, épidémiologie et santé publique |
401 829 |
223 000 |
7 791 089 |
8 415 918 | |
Recherche fondamentale et intégrée |
942 216 |
2 732 400 |
25 960 335 |
29 634 951 | |
Information des publics |
1 601 331 |
6 641 600 |
43 000 |
15 000 |
8 300 931 |
Autres fonctions d'appui aux métiers |
991 190 |
506 000 |
196 000 |
1 693 190 | |
Fonctions de pilotage et de support |
3 357 129 |
5 387 800 |
221 500 |
8 966 429 | |
Total des dépenses décaissées |
14 094 000 |
19 856 000 |
63 140 000 |
2 36 500 |
97 326 500 |
Source : EPRD remis au conseil d’administration de l’INCa en décembre 2013.
Les dépenses sont consacrées pour moitié à la recherche (30 % du budget pour la recherche fondamentale et 20 % pour la recherche appliquée en clinique ou en épidémiologie/santé publique). La ressource que votre rapporteur propose de lever représenterait donc un apport considérable pour l’institut.
Les plans cancer 2003-2007 et 2009-2013 ont permis de soutenir l’effort de recherche français selon plusieurs axes parmi lesquels on trouve notamment la mise en place de registres spécialisés des cancers de l’enfant intervenus depuis 1995. Ils disposent de financements de l’INCa et de l’Institut national de veille sanitaire de plus de 400 000 euros par an.
Autre avancée majeure, la mise en place d’une Plateforme d’observation des cancers de l’enfant (dite « HOPE-EPI », gérée par l’Inserm), soutenue par l’INCa depuis décembre 2010 avec un budget de 1,3 million d’euros et un financement alloué dans le cadre des investissements d’avenir de 6 millions d’euros.
Enfin, un effort particulier a été consenti en faveur de l’analyse des attributions de crédits dans le cadre d’appels à projets financés par l’INCa et l’Inserm, se traduisant par un financement de 38 millions d’euros entre 2007 et 2011, sur un total de 350 millions dédiés à des problématiques de pédiatrie dans les champs suivants : recherche en biologie, épidémiologie, sciences humaines et sociales, soutien aux cohortes, étude des facteurs de risques environnementaux et génétiques, essais cliniques et thérapeutiques.
Le troisième Plan qui a commencé cette année doit mobiliser près de 1,5 milliard d’euros sur cinq ans, dont la moitié sera consacrée au financement de nouvelles mesures, l’objectif étant notamment de doubler le nombre d’essais cliniques – qui concernent actuellement 25 000 personnes – d’ici à 2018.
La prise en charge des cancers pédiatriques a été érigée en priorité du nouveau Plan. Les axes retenus sont les suivants :
– Favoriser la prise en charge des enfants et adolescents en s’attachant au maintien de leurs liens sociaux ;
– Mettre en place un dispositif de double lecture des tumeurs solides malignes de l’enfant ;
– Identifier et labéliser des centres de référence au niveau national pour les prises en charge des enfants présentant des tumeurs rares.
Il s’agit de mesures bienvenues, mais qui portent essentiellement sur l’amélioration qualitative de la prise en charge et de l’accompagnement des jeunes malades. Les mesures dévolues spécifiquement à la recherche oncologique pédiatrique sont rares, hormis le financement du séquençage de tous les génomes tumoraux pédiatriques à l’horizon 2019, cet objectif s’intégrant dans le cadre d’un projet international. La participation française porterait sur sept tumeurs, dont trois pédiatriques : le rétinoblastome, le sarcome d’Ewing et les sarcomes conjonctifs. Il est prévu d’y affecter 5 millions d’euros (cf. supra).
Le traitement des cancers pédiatriques est d’autant plus difficile qu’ils touchent une très faible proportion de la population : comme cela a été souligné au début de ce rapport, il n’existe pas un marché suffisant pour amortir un effort de recherche spécifique. Les autorités européennes comme françaises se sont donc efforcées d’appuyer les efforts de recherche et développement en faveur des médicaments dits « orphelins ».
Les médicaments orphelins.
Le site du ministère de la santé en donne la définition. Ainsi, un médicament est désigné orphelin lorsqu’il est destiné :
« – soit, au diagnostic, à la prévention ou au traitement d’une affection entraînant une menace pour la vie ou une invalidité chronique ne touchant pas plus de cinq personnes sur 10 000 dans la Communauté, au moment où la demande de désignation d’un médicament comme médicament orphelin est introduite ;
– soit, au diagnostic, à la prévention ou au traitement, dans la Communauté, d’une maladie mettant la vie en danger, d’une maladie très invalidante ou d’une affection grave et chronique, et qu’il est peu probable que, en l’absence de mesures d’incitation, la commercialisation de ce médicament dans la Communauté génère des bénéfices suffisants pour justifier l’investissement nécessaire. Et, d’autre part, il n’existe pas de méthode satisfaisante de diagnostic, de prévention ou de traitement de cette affection ayant été autorisée dans la Communauté, ou, s’il en existe, que le médicament en question procurera un bénéfice notable à ceux atteints de cette affection. »
Le ministère rappelle en outre qu’« un médicament peut être désigné orphelin à n’importe quel moment de son développement. L’utilisation revendiquée doit cependant être justifiée scientifiquement. La désignation de médicament orphelin n’est pas une autorisation de commercialisation. Cela ne signifie pas que le médicament satisfera aux critères de tolérance, d’efficacité et de qualité indispensables à l’octroi d’une AMM. » (1)
Au niveau communautaire, le règlement (CE) n° 141/2000 du Parlement européen et du Conseil du 16 décembre 1999 concernant les médicaments orphelins a notamment pour objectifs d’établir une procédure commune de désignation des médicaments orphelins et d’encourager leur recherche, leur développement et leur mise sur le marché. C’est ainsi par exemple que, pour obtenir l’AMM d’une molécule, les industriels doivent systématiquement assortir leur documentation d’informations de nature pédiatrique. Pour orienter leurs travaux, tous doivent en outre adopter un plan de développement pédiatrique.
Si ce règlement présente des faiblesses (peut-être faudrait-il mieux cibler les informations pédiatriques attachées à la demande d’AMM ?), il a néanmoins permis le développement plus de 1 300 plans d’investigation pédiatrique ainsi que la mise à disposition 52 médicaments.
En France, le programme dénommé « Accès sécurisé à des thérapies ciblées innovantes », plus connu sous son acronyme « AcSé » a été initié par l’INCa en 2013. Il permet notamment aux enfants de bénéficier de l’accès sécurisé à de nouvelles molécules en se fondant sur la présence d’anomalies génétiques ciblées par le médicament mis à disposition.
Il repose sur un partenariat original avec les industriels, qui mettent à disposition gratuitement une molécule en cours de développement ou disposant par ailleurs d’une AMM (ainsi, le plus souvent, que des données pré-cliniques) pour qu’elle soit testée cliniquement au profit d’enfants pour lesquels aucun protocole standard n’existe dans le cadre de centres spécialisés CLIPP (essais en phases 1 et 2 de cancer), offrant toutes les garanties de sécurité et de suivi pour les essais de molécules. Les frais de recherche liés à ces essais sont pris en charge par la puissance publique. En cas de succès, c’est-à-dire de mise en évidence d’une identité phénoménologique entre l’adulte et l’enfant, l’organisme prêteur de la molécule « rachète » les droits liés à la découverte scientifique en remboursant la puissance publique de son investissement, dans la perspective (non obligatoire certes) de déposer à terme une demande d’AMM à défaut, la molécule reste utilisable sous RTU. Les industriels s’engagent en outre à livrer gratuitement en molécule et sous 48 heures tout centre français, parmi les 250 qui ont été identifiés. Un programme a été conduit en 2013 et un autre est actuellement en cours.
C’est à ce titre qu’AcSé a permis une avancée notoire dans le domaine du cancer cérébral. Ainsi, la molécule CRIZOTINIB, utilisée dans la lutte contre le cancer du poumon, a été mise à disposition par le laboratoire Pfeizer pour conduire des recherches sur son utilisation contre le cancer du cerveau chez l’enfant, avec des résultats concluants.
Ces progrès sont remarquables et l’objectif du présent texte est précisément de les encourager et de parfaire le dispositif : un surcroît de ressources, modeste au regard des bénéfices de l’industrie pharmaceutique, permettra en effet de garantir un niveau de recherche maximal sur tous les types de cancers pédiatriques, quelle que soit leur épidémiologie.
La proposition de loi intervient à un moment clé pour la recherche oncologique pédiatrique. Son adoption permettra de dynamiser des initiatives particulièrement prometteuses dans ce domaine.
1. L’évolution des méthodes de recherche ouvre des champs considérables pour la recherche oncologique pédiatrique
Les progrès dans le traitement des cancers pédiatriques intervenus ces vingt dernières années sont incontestables. Ils sont imputables aux progrès de la recherche et à l’amélioration de l’organisation de la prise en charge des jeunes malades. Sans prétendre à l’exhaustivité, ils portent notamment sur plusieurs axes :
– la promotion de thérapies de plus en plus ciblées ;
– le développement des inhibiteurs de la tyrosine-kinase ;
– des avancées de méthodes, dans la façon de doser et d’administrer les molécules connues ;
– la mise en place de centres spécialisés dans le traitement des cancers et l’approche pluridisciplinaire ;
– la mise en commun de données sur le plan international et notamment européen, une démarche indispensable à la constitution de séries épidémiologiques fiables dans le cas de cancers rares.
Surtout, la communauté scientifique conduit un travail considérable dans le séquençage génomique tumoral : on recherche désormais davantage non plus sur le cancer d’un organe en tant que tel, mais plutôt en essayant d’identifier l’environnement génomique dans lequel naît la tumeur, les facteurs permettant son développement ainsi que les canaux par lesquels elle se diffuse. C’est ainsi que l’effort se concentre le séquençage ADN (acide désoxyribonucléique), le support génétique « de base », et ARN (acide ribonucléique), un support génétique intermédiaire.
Cette méthode permet d’identifier des anomalies puis de « transformer l’essai » : soit cette anomalie a déjà été identifiée par ailleurs et il reste à adapter la molécule à l’enfant ; soit elle ne l’a pas été et il faut alors mener – et financer ! – un travail de ciblage, dit de « filiation moléculaire » qui, à moyen terme, doit déboucher sur l’identification d’une nouvelle molécule puis, à plus long terme, permettre sa mise sur le marché. C’est l’objet du programme de séquençage génétique prévu par le plan cancer dans le cadre du programme international ICGC.
Le programme international ICGC
Initié en 2008, le programme international ICGC (International Cancer Genome Consortium) a pour objectif de mettre à la disposition de la communauté scientifique le séquençage complet du génome de 50 types et/ou sous-types de tumeurs différents qui ont une importance clinique et sociale à travers le monde. L’INCa coordonne et soutient la participation française à ce programme.
Dans cette perspective, l’institut a déposé une lettre d’intention à l’appel d’offres européen « Horizons 2020 » afin de développer la médecine personnalisée, reposant notamment sur le séquençage du génome pour deux types de pathologies (cancers des enfants et cancers du poumon) et pour un financement global qui devrait être de l’ordre de 25 millions d’euros sur quatre ans.
Nous savons désormais qu’un mécanisme moléculaire peut se retrouver quel que soit l’organe et donc tous les travaux peuvent potentiellement concerner les enfants : il s’agit donc d’homologuer les mécanismes d’action moléculaire et d’examiner les développements pathologiques au cas par cas, ce qui laisse augurer des progrès considérables dans le traitement du cancer pédiatrique. D’où le risque toutefois que le fait d’espérer une solution « par incidence » – c’est-à-dire découlant du traitement d’un cancer de l’adulte – limite l’effort de recherche spécifique sur certains cancers pédiatriques très rares.
La solution par incidence ne peut constituer une réponse suffisante : il n’est plus possible d’expliquer à des familles dont l’enfant est atteint d’un cancer rare que certains programmes de recherche spécifiques ne sont pas conduits faute de moyens. Évaluées à 10 % du budget annuel de l’INCa (soit une dizaine de millions d’euros chaque année), les ressources spécifiques dévolues à la recherche oncologique pédiatriques doivent donc être renforcées. C’est ce que propose votre rapporteur.
La proposition de loi vise à générer des ressources nouvelles afin de financer des mesures complémentaires de celles actuellement financées en France dans le domaine de la recherche. La ressource envisagée, assise sur 0,15 % du chiffre d’affaires de l’industrie pharmaceutique réalisé en France, générerait entre 30 et 35 millions d’euros chaque année.
La mise en place du troisième plan cancer est intervenue depuis le dépôt de cette proposition de loi. Il prévoit le financement du séquençage tumoral de trois cancers pédiatriques. Si cela répondrait pour partie aux ambitions de votre rapporteur, son financement est aujourd’hui incertain puisqu’il suppose que le projet français soit retenu par la Commission européenne dans le cadre du projet Horizon 2020. C’est pourquoi, pour la fraction concernant le financement de ce projet, le rapporteur proposera en commission un dispositif permettant d’adapter la ressource à l’évolution de cette variable.
Sans attendre la résolution de cette question, d’autres mesures peuvent être financées afin de contribuer significativement à l’avancée de la recherche oncologique pédiatrique.
Les auditions qu’il a conduites lui ont permis d’identifier un certain nombre de projets précis qui permettraient à la communauté scientifique de progresser et d’espérer apporter des réponses adaptées le plus systématiquement possible. Ils touchent tous les segments de la recherche oncologique pédiatrique, qu’elle soit fondamentale, épidémiologique, translationnelle, ou encore préclinique et clinique. Il propose ainsi d’allouer cette ressource selon six axes.
• Premier axe : améliorer les connaissances sur le ciblage moléculaire en oncologie pédiatrique
C’est le volet décrit dans le cadre du plan cancer. La communauté scientifique française devra veiller à ce que le projet Horizon 2020 corresponde aux objectifs du plan cancer : tous les cancers pédiatriques doivent avoir été séquencés sur le plan ADN comme ARN d’ici à 2019.
Si les financements ou le périmètre de l’appel d’offres ne permettaient pas d’y répondre complètement, les ressources générées par cette proposition de loi permettraient d’y pallier immédiatement.
• Deuxième axe : favoriser les programmes de recherche pédiatrique en finançant des offres spontanées
Compte tenu de ses spécificités, le secteur de la recherche oncologique pédiatrique présente souvent des perspectives insuffisantes pour les chercheurs, qui peuvent être incités à basculer vers la recherche sur le cancer de l’adulte. Une enveloppe spécifique permettant de financer davantage de programmes « de niche », en encourageant la recherche publique dans des domaines encore insuffisamment explorés.
D’une utilisation souple, cette enveloppe permettrait de valoriser l’investissement des chercheurs en France et notamment dans le champ universitaire. Ainsi, au cours des auditions menées par votre rapporteur, des besoins dans la recherche en immunothérapie pédiatrique ont été mis en avant, il est nécessaire de les financer. De même, des programmes de recherche fondés sur la modélisation pourraient être utilement soutenus.
• Troisième axe : développer le concept de médecine personnalisée en soutenant la recherche translationnelle
C’est l’objet à la fois de l’article 1er, pour le financement, ainsi que de l’article 2 qui prévoit la définition de protocoles particuliers pour tous les enfants et jeunes atteints de cancers. Cet objectif pourrait être concrétisé en finançant la mise en place plus systématique d’analyses précliniques en laboratoire.
La modélisation à partir des cellules du patient constitue une étape intermédiaire entre le diagnostic et le traitement : elle permet de regarder en laboratoire si le patient est sensible ou non à un traitement (patient « répondeur » ou « non répondeur ») et si un traitement fonctionne mieux qu’un autre. Or, lorsqu’une personne est atteinte d’un cancer, et singulièrement d’un cancer orphelin, il est parfois envisageable de prélever des tissus cancéreux et de les « développer » sur des modèles animaux, tels que les embryons de poulet, afin de créer un chimiogramme. Lorsqu’elle est possible, cette démarche contribue ainsi au traitement le plus adapté possible de chaque patient.
Des expériences sont en cours sur le territoire national et leur développement nécessite des infrastructures importantes. Votre rapporteur propose donc de mobiliser des ressources pour favoriser la généralisation de ces procédés dans le cas des cancers pédiatriques : compte tenu du nombre de patients concernés, l’objectif paraît accessible.
• Quatrième axe : favoriser la compilation de l’information
Compte tenu de la rareté de survenance de certains cancers pédiatriques, votre rapporteur préconise de regrouper en un seul centre les prélèvements aujourd’hui dispersés dans 29 « tumeurothèques » afin de permettre aux chercheurs d’accéder plus facilement à une plus grande variété d’échantillons pour leurs travaux.
• Cinquième axe : financer une campagne d’accompagnement des familles
Il est important de faciliter la participation des familles d’enfants atteints d’un cancer ou décédés à des études épidémiologiques et, dans la mesure du possible, de favoriser et d’encourager les prélèvements. Il s’agit évidemment d’un sujet sensible, qui doit être abordé en partenariat avec les praticiens, les chercheurs et les associations de familles. Ces dernières se sont montrées intéressées au cours des auditions, relevant par exemple le besoin d’être informées sur la nature « génétique » des cancers rares et, par exemple, sur le risque que les frères et sœurs puissent développer des pathologiques similaires.
Encourager un travail plus systématique d’analyse épidémiologique pourrait présenter une grande utilité pour les chercheurs comme pour les familles ne serait-ce que pour les rassurer et favoriser la prévention.
• Sixième axe : soutenir l’effort d’équipement des équipes travaillant sur le cancer pédiatrique
Les besoins en équipement sont multiples et l’INCa pourra soutenir davantage les acquisitions dans ce domaine afin de personnaliser davantage encore les prises en charge. Cela concernerait, notamment, les matériels de séquençage à haut débit ainsi que le recrutement des spécialistes de haut niveau nécessaires à leur mise en œuvre.
Au cours de sa séance du 19 novembre 2014, la Commission des affaires sociales examine la présente proposition de loi, sur le rapport de M. Jean-Christophe Lagarde (n° 1187).
Mme la présidente Catherine Lemorton. Je souhaite la bienvenue à M. Jean-Christophe Lagarde, qui a rejoint notre commission pour cette occasion. J’en profite pour le féliciter d’être devenu le président de l’UDI.
Avant de lui donner la parole, je rappelle que cette proposition de loi fait appel à l’humain. Tous, nous avons reçu des messages très poignants sur ces cancers qui touchent des enfants, même si, évidemment, la mort n’a pas de prix, quel que soit l’âge de la personne.
C’est pourquoi je souhaite que nos débats se tiennent dans le calme : toute parole doit être respectée. N’oublions pas que les Français nous regardent en direct aujourd’hui sur ce sujet éprouvant qui suscite beaucoup d’émotion.
M. Jean-Christophe Lagarde, rapporteur. Mes chers collègues de la Commission des affaires sociales, permettez-moi tout d’abord de vous dire mon plaisir d’être accueilli aujourd’hui au sein de votre commission pour vous soumettre ma proposition de loi.
Il s’agit d’un texte auquel je suis particulièrement attaché, compte tenu des raisons que vous avez évoquées, madame la présidente : né sur le constat de situations difficiles en services d’oncopédiatrie, il a été construit en partenariat avec des associations de parents et des chercheurs.
Je remercie le groupe UDI d’avoir permis son inscription à l’ordre du jour et je vous remercie de l’attention que vous portez à ce sujet.
Je souhaite tout d’abord évoquer la situation des enfants touchés par le cancer dans notre pays. Je décrirai ensuite l’organisation et les moyens de la recherche oncologique pédiatrique en France avant de vous démontrer en quoi le dispositif que je propose permettra des avancées significatives dans ce domaine, au point, je l’espère, de vous convaincre de l’adopter.
Le cancer pédiatrique se caractérise par ses nombreuses particularités. Près de 2 500 enfants et jeunes de moins de dix-huit ans sont touchés par un cancer chaque année. Si le taux de guérison est élevé chez les enfants – de l’ordre de 80 % après cinq ans –, il est bien plus faible chez les adolescents, proche de 50 %. De plus, 40 % des jeunes ayant guéri de leur cancer en conserveront des séquelles toute leur vie. Il s’agit toujours, évidemment, de situations terribles pour les familles. Près de la moitié des cancers de l’enfant interviennent avant l’âge de cinq ans.
En dehors des leucémies, dont le traitement explique l’essentiel des guérisons – la leucémie est le cancer le plus aisé à guérir chez l’enfant –, les cancers pédiatriques concernent un très faible pourcentage de la population mais dans bien des cas, il n’existe pas de traitement par une molécule mise sur le marché. Nous sommes face à des maladies rares, pour le traitement desquelles le développement et la commercialisation de médicaments ne sont pas rentables pour les industries pharmaceutiques.
Il revient donc à la collectivité de favoriser et, surtout, de financer directement la recherche sur ces pathologies particulières : la puissance publique le fait déjà, il est vrai, mais insuffisamment encore. D’où la proposition de loi que je vous soumets.
À l’article 1er, le texte propose d’instaurer une contribution assise sur les bénéfices de l’industrie pharmaceutique en France pour financer la recherche oncologique pédiatrique : en deux mots, une taxe sur les bénéfices tirés des produits rentables permettrait de financer la recherche sur des produits qui ne le sont pas.
À l’article 2, il vise à renforcer la personnalisation des traitements des enfants et des adolescents. Je le reconnais volontiers, la France consent déjà des efforts substantiels pour financer la recherche contre le cancer. L’Institut national du cancer (INCa) finance, pour plus de 100 millions d’euros, des programmes de recherche de grande qualité, déclinant les orientations des plans cancer successifs. L’INCa estime allouer à la recherche oncologique pédiatrique près de 10 % de ses ressources annuelles, ce qui est honorable par rapport au pourcentage de la population concernée, mais finalement assez peu au regard de la complexité de ces pathologies et surtout du faible intérêt industriel qui résulte de leur rareté.
Le Plan cancer en cours, qui couvre la période 2014-2019, revendique la prise en charge des cancers pédiatriques comme une priorité. Toutefois, l’essentiel des mesures tient à l’accompagnement et à la prise en charge des malades, non à la recherche de médicaments.
Certes, notre pays participe activement aux programmes internationaux de séquençage génomique des tumeurs, en insistant sur la nécessité de porter une attention particulière à celles affectant les enfants. Comme je le rappelle dans mon rapport, la France s’est portée candidate pour assurer le séquençage de sept tumeurs, dont trois sont particulières aux enfants. L’ambition est de bénéficier, à cette fin, d’un financement européen, dans le cadre du programme Horizon 2020, en cohérence avec le troisième Plan cancer qui vise le séquençage complet des cancers pédiatriques d’ici à 2019.
L’INCa a également mis en place le programme, appelé AcSé – accès sécurisé aux thérapies ciblées innovantes –, qui permet des partenariats avec des industriels qui mettent à disposition une molécule qui a l’autorisation de mise sur le marché ou en est encore au stade du développement. La puissance publique prend en charge les tests cliniques pour l’adaptation de cette molécule au cancer pédiatrique, dans le cadre des centres labellisés d’essais cliniques de phases précoces (CLIPP) et, en cas de réussite, l’industriel rachète le coût de ces développements et s’engage à fournir la molécule aux centres français qui en feraient la demande. Il s’agit d’un partenariat gagnant-gagnant très positif.
Là encore, la démarche que je propose consiste non pas à nier les efforts déjà consentis – bien au contraire, je les salue ! – mais à souligner qu’avec un peu de moyens supplémentaires nous pouvons accompagner la logique du plan cancer et la parachever en ce qui concerne les enfants et les adolescents.
D’autant que le moment est propice pour l’adopter.
En effet, ce texte injecterait des fonds au profit d’une recherche oncologique qui a beaucoup évolué et semble particulièrement prometteuse : c’est donc maintenant qu’il faut l’irriguer.
Ce travail sur le financement de la recherche oncologique pédiatrique m’a donné l’occasion de rencontrer nombre de chercheurs, d’institutions et d’associations. Tous ont décrit les formidables avancées de ces deux dernières décennies, permises par l’introduction de nouvelles méthodes de traitement et les perspectives ouvertes par le séquençage génétique. Ces travaux permettent en particulier d’identifier le mode de développement et de diffusion de cellules cancéreuses sur le fondement d’anomalies non pas d’un organe que l’on soignerait en tant que tel de son cancer, mais du paysage génétique. Schématiquement, des découvertes sur le cancer du poumon chez les adultes permettent ainsi, par analogie, d’identifier des voies de traitement du cancer pédiatrique du cerveau. Cette révolution est fascinante ! Mais précisément, nous devons l’accompagner, afin de tenir compte spécifiquement de la situation des enfants et adolescents.
Pourquoi ? Tout d’abord parce que le contexte de progrès généralisés dans la lutte contre les cancers rend encore plus insupportable l’absence de solution ou de progression significative sur tel ou tel cancer particulièrement rare. Ensuite, parce que ces avancées analogiques ne doivent pas faire de la recherche sur le cancer adulte la voie d’entrée essentielle pour la recherche pédiatrique. Nous ne devons pas nous contenter d’attendre des découvertes chez les adultes pour espérer des résultats chez les enfants. Il faut concentrer des moyens nouveaux au profit de la recherche pédiatrique. L’INCa le fait : avec un peu plus de ressources, il pourrait faire davantage encore.
La proposition de loi que je vous présente aujourd’hui permettra de lever environ 30 millions d’euros par an. Compte tenu des avancées du Plan cancer, je vous proposerai par amendement d’en réduire le montant à quelque 10 millions.
Grâce à cette ressource supplémentaire, chaque année, l’INCa pourra financer des programmes particulièrement attendus, visant notamment à favoriser la réponse à des appels à projets scientifiques afin de couvrir tout le spectre oncologique pédiatrique. L’absence de ces appels à projet empêche aujourd’hui les équipes de chercheurs de s’intéresser à ces cancers pédiatriques. Ces programmes tendraient également à systématiser la recherche translationnelle individuelle, afin de permettre le recours le plus large possible à des essais de traitement in vitro sur des cellules cancéreuses du patient cultivées en laboratoire en vue de renforcer l’individualisation des traitements, à soutenir l’équipement pour le séquençage à haut débit de cellules cancéreuses et à mieux accompagner les familles qui souhaitent participer à des travaux de recherche épidémiologique aujourd’hui inexistants.
Ce sont autant de projets majeurs qui avanceraient considérablement avec l’adoption de cette proposition de loi.
Mme Michèle Delaunay. Chacun est concerné par la cancérologie pédiatrique. Nous sommes toutefois conduits à émettre quelques réserves sur le texte
Sa rédaction contient trois impropriétés. La fréquence des cancers pédiatriques est en réalité à peu près stable : les études très anciennes ne pouvant être considérées comme fiables, on ne saurait conclure à une augmentation notable de la fréquence des cancers pédiatriques. De plus, comme vous l’avez vous-même rappelé, monsieur Lagarde, les progrès thérapeutiques sont réguliers, voire spectaculaires, alors que la rédaction du texte pourrait laisser à penser le contraire. Enfin, beaucoup est fait en matière de cancers pédiatriques et le troisième Plan cancer – vous l’avez noté – incite à les inclure plus largement dans des essais thérapeutiques labellisés.
Trois raisons médicales président à nos réserves. Premièrement, cette proposition de loi oppose la recherche pédiatrique en oncologie à la recherche générale en oncologie, alors que chacun sait que les lisières sont floues et que, vous l’avez remarqué, ce qui profite à la recherche pédiatrique peut profiter à la recherche chez l’adulte et inversement. C’est notamment le cas des recherches aux plans moléculaire et fondamental.
Il nous paraît d’autant moins opportun d’opposer les deux recherches que – et nous avons également consulté des chercheurs et des spécialistes – la part de financement mise dans la recherche oncopédiatrique est égale ou supérieure à la fréquence de ces cancers.
Deuxièmement, la notion d’individualisation prête à discussion : les cliniciens qui ont lu le texte ont tenu à souligner que tous leurs traitements sont individualisés. Les protocoles thérapeutiques sont adaptés à la constitution de chaque enfant et tiennent compte de chaque paramètre. L’individualisation véritable ne peut être atteinte qu’à l’échelon génétique – vous l’avez noté –, c’est-à-dire par séquençage : or les études sur les thérapies ciblées, qui sont en cours et dont on attend de grands progrès, sont correctement soutenues.
Troisièmement, le texte laisse entendre que la cancérologie pédiatrique souffrirait d’une insuffisante collaboration avec l’étranger. Ce n’est pas vrai. En oncologie, tout essai thérapeutique concluant est immédiatement partagé par la communauté scientifique internationale au sein des centres européens et mondiaux.
De plus, le texte nous paraît mettre en cause la communauté oncopédiatrique, alors que son investissement est énorme, compte tenu des drames vécus par les familles, qu’il convient d’accompagner.
Je tiens enfin à rappeler que l’industrie pharmaceutique participe déjà à la recherche, sous la forme d’une taxation de 1,6 % de son chiffre d’affaires net. Si nous créons une nouvelle taxe, je redoute que les industries pharmaceutiques ne se sentent dédouanées de leur contribution habituelle. Par ailleurs, ce sont, dans la plupart des cas, les industries pharmaceutiques qui introduisent dans les essais thérapeutiques de nouvelles molécules, dont un petit nombre seulement est issu de la recherche publique. Je crains, alors que la recherche des industries pharmaceutiques est déjà bridée par la rareté relative de ces tumeurs, qu’une nouvelle taxe ne les incite à ralentir leurs efforts en la matière, ce qui serait contraire à l’objectif poursuivi par le texte.
Tout en partageant le sens profond de cette proposition de loi, c’est donc avec des réserves que nous l’avons abordée : chaque cas de cancer pédiatrique représente un drame considérable. Loin de nous l’idée de montrer du doigt les familles qui, prêtes à tout pour sauver leur enfant malade, se tournent vers l’étranger où on leur fait miroiter de nouvelles thérapies : que chacun sache que si celles-ci ne sont pas reprises par la communauté scientifique, c’est que leur efficacité n’est pas démontrée.
M. Jean-Pierre Door. Les cancers pédiatriques constituent un sujet particulièrement grave qui dépasse les frontières politiques et concerne tous nos concitoyens : c’est le cas général des grandes questions de santé publique, comme l’indique le succès des collectes qui sont organisées par les différentes associations qui se consacrent à ces questions.
En matière de cancers pédiatriques, comme Mme Delaunay l’a rappelé, des progrès indéniables ont été accomplis. La prise en charge des cancers des enfants et des adolescents s’est structurée depuis une dizaine d’années via une trentaine de centres spécialisés régionaux et la mise en place d’organisations hospitalières interrégionales dans le domaine de l’oncologie pédiatrique.
Monsieur Lagarde, vous avez également évoqué les différents appels à projet référencés par l’INCa qui visent à améliorer la prise en charge des cancers des jeunes enfants, dont le plan cancer 2014-2019 fait une priorité.
Ces progrès ne sont pas suffisants, c’est sûr : il faut aller plus loin.
Votre proposition d’une meilleure individualisation des traitements, afin d’améliorer les chances de survie, semble intéressante. Vous proposez également la mise en place d’un fonds destiné à la recherche sur les cancers pédiatriques. Alors qu’une contractualisation est proposée aux laboratoires pour les inciter à prendre toute leur part dans cette recherche, la création, à l’article 1er du texte, d’une taxe sur l’industrie pharmaceutique n’est pas sans nous interroger. Comme Mme Delaunay l’a rappelé, celle-ci est déjà soumise à près de onze taxes, contre une moyenne de trois dans les autres pays. La création d’une nouvelle taxe pourrait avoir un effet contreproductif, surtout dans une période de croissance quasiment nulle, et affaiblir aux yeux des industriels du secteur pharmaceutique l’attractivité de la France.
Ne conviendrait-il pas, plutôt que de créer une nouvelle taxe sèche, d’envisager un dispositif incitatif à effet constant, prévoyant, par exemple, une baisse, au bénéfice des industriels qui favoriseraient la recherche en oncologie pédiatrique, des autres taxes qui les affectent ? Une telle démarche gagnante-gagnante inciterait l’industrie pharmaceutique à investir dans le domaine de l’oncologie pédiatrique.
Si nous sommes favorables à l’objectif d’un texte grave, qui nous touche tous, nous nous interrogeons en revanche sur la taxation supplémentaire qu’il prévoit, surtout en cette période difficile au plan économique : il ne faut pas affaiblir, je le répète, l’attractivité industrielle de la France en matière pharmaceutique.
À la fin de son examen, je formulerai la position du groupe UMP sur le texte.
M. Arnaud Richard. Aux yeux du groupe UDI, ce texte permettra d’apporter une réponse forte à la lutte contre les inégalités face au cancer, une priorité, comme l’a rappelé notre collègue Jean-Pierre Door, mise en avant par le Président de la République lors de la présentation du Plan cancer 2014-2019.
Chacun sait que l’excellence de notre système de santé se mesure à sa capacité à garantir un accès équitable à des soins de qualité et à l’innovation thérapeutique, afin d’améliorer la qualité de vie des personnes atteintes de maladies et de les guérir.
Nous avons tous conscience de l’impérieuse nécessité d’enrayer une spirale négative dramatique : le taux de mortalité des enfants victimes du cancer ne baisse plus depuis le milieu des années 1990 alors même que le taux de cancers des enfants augmente de 1 % à 3 % chaque année.
C’est pourquoi, je tiens à le dire sans détours à nos collègues socialistes : leurs amendements de suppression ne sont pas à la hauteur du débat que nous avons souhaité susciter en déposant cette proposition de loi.
Le texte de Jean-Christophe Lagarde vise en effet à apporter une réponse à une triple carence en matière de recherche oncologique pédiatrique et de prise en charge des enfants et des adolescents atteints de cancer.
Il s’agit tout d’abord de pallier une mobilisation insuffisante de la recherche en matière d’oncologie pédiatrique en développant un fonds de financement spécifiquement destiné à une recherche indépendante en faveur des enfants victimes du cancer.
En effet, comme le rapporteur l’a souligné lors de son intervention, l’Institut national du cancer alloue à la recherche oncologique pédiatrique 10 % de ses ressources annuelles. C’est un effort budgétaire significatif de la recherche publique mais insuffisant eu égard à la complexité des pathologies concernées et du désintérêt – le mot est fort, c’est vrai – du secteur privé pour ces maladies, qui ne peut s’expliquer, malheureusement, que par l’absence de rentabilité.
Il s’agit ensuite d’améliorer les chances de guérison des enfants atteints de cancers rares faisant partie des maladies dites « orphelines », pour lesquels les traitements sont inadaptés, en favorisant l’individualisation des traitements des cancers pédiatriques.
Enfin, si la lutte contre les cancers pédiatriques est érigée en priorité par le troisième Plan cancer 2014-2019, nous déplorons que les mesures dévolues spécifiquement à la recherche oncologique pédiatrique se résument au seul financement du séquençage de tous les génomes tumoraux pédiatriques.
En instaurant une taxe sur le chiffre d’affaires des laboratoires, trente-deux fois moins élevée que les taxes inscrites dans le PLFSS 2014, cette proposition de loi permettrait de recueillir 10 millions d’euros par an, une somme essentielle pour accompagner la logique du Plan cancer et permettre à la recherche sur les cancers pédiatriques de profiter du formidable mouvement de progrès réalisé en matière de lutte contre le cancer.
Oui, la recherche sur les cancers pédiatriques doit être davantage soutenue sans attendre 2019 et le prochain Plan cancer.
Les perspectives de progrès thérapeutiques sont prometteuses et l’enjeu est immense pour les enfants et les adolescents touchés par cette maladie : c’est pourquoi notre groupe soutiendra sans réserve cette excellente proposition de loi.
M. Jean-Louis Roumegas. Les dispositions du texte appellent plusieurs remarques.
Le retard en termes de médicaments dont souffre le traitement des cancers des enfants a plusieurs causes, notamment le manque d’intérêt des laboratoires pharmaceutiques à les développer pour des raisons de rentabilité et l’absence d’essais cliniques pédiatriques – les enfants ne sont pas prioritaires. Nous avions déjà observé une inégalité entre les hommes et les femmes s’agissant des tests médicamenteux qui sont essentiellement effectués sur des sujets masculins. Il existe une inégalité similaire entre les enfants et les adultes.
Toutefois, la solution proposée par le texte nous paraît insatisfaisante. La contribution de l’industrie pharmaceutique est fixée de façon globale : si nous sommes favorables à son augmentation, nous ne le sommes pas, en revanche, à la création d’une nouvelle contribution qui ne serait pas lisible tout en étant inefficace à orienter la recherche de l’industrie pharmaceutique.
Le principe même d’une contribution fléchée créerait un précédent : d’aucuns demanderaient bientôt pourquoi la loi n’oriente les taxes que vers les cancers pédiatriques et non vers les maladies orphelines en général. L’INCa, du reste, n’est pas favorable à cette contribution spéciale, dont il serait pourtant le bénéficiaire. La définition de la place des enfants dans la recherche sur le cancer doit s’inscrire dans les plans cancer qui ont vocation à définir la stratégie nationale en la matière et au sein desquels il est effectivement important de s’assurer de la place réservée aux cancers des enfants.
Il faut donc inscrire la question dans une réflexion plus globale sur la façon d’inciter les laboratoires pharmaceutiques à orienter leur recherche vers les thérapies non rentables. Certains pays ont mis en place des prix à l’innovation qui pourraient remplacer la politique des brevets en rendant attractive la recherche pour les laboratoires, sans les rendre complètement dépendants une fois les solutions trouvées.
Enfin, il faut s’interroger sur les causes de l’émergence de cancers de plus en plus précoces chez l’enfant.
J’ai rendu un rapport d’information sur les perturbateurs endocriniens : la communauté scientifique a mis en évidence le risque de cancers précoces chez les populations vulnérables – femmes enceintes et enfants en bas âge – exposées à ces toxiques. Ne faut-il pas mener une politique de précaution et éviter l’exposition des populations les plus vulnérables à ces toxiques qui sont sans doute une des causes de l’émergence de cancers précoces ?
Le groupe écologiste ne peut soutenir ce texte en l’état.
Mme Isabelle Le Callennec. La prise en charge des cancers pédiatriques est annoncée comme une priorité du Plan cancer 2014-2019. Parmi les axes d’action figurent l’accompagnement global par-delà les soins et la continuité de vie pour l’enfant et ses proches. Je tiens à souligner, à cet égard, le travail formidable réalisé par les associations qui entourent les familles.
Un autre axe d’action – c’est l’objet de cette proposition de loi – est l’amélioration de l’accès des enfants et des adolescents à l’innovation et à la recherche, amélioration qui exige des moyens financiers importants et de la méthode.
Le texte propose de taxer l’industrie pharmaceutique : monsieur Lagarde, avez-vous exploré d’autres voies ? En effet, la taxe prélevée sur le chiffre d’affaires des laboratoires pharmaceutiques, dont les effectifs sont en baisse depuis cinq ans, pèsera pour 42 millions d’euros par an sur ces laboratoires.
S’agissant de la méthode, imaginez-vous une recherche à l’échelle européenne ? Nous nous sommes tous réjouis de l’exploit de la mission Rosetta : est-il possible d’espérer une collaboration aboutie sur la recherche et donc une mutualisation des moyens au plan européen ?
M. Michel Issindou. Chacun a été peu ou prou concerné par ce sujet sensible. Qui n’a pas rencontré des parents en plein désarroi, touchés par la maladie de leur enfant ?
Mme Delaunay a évoqué les réserves que nous inspire ce texte : non seulement la recherche progresse, mais, de plus, l’industrie pharmaceutique a déjà été largement taxée – argument que l’UMP a repris. Il est donc délicat de nous demander de voter en faveur d’une proposition de loi qui instaure une nouvelle taxe alors qu’on nous reproche sans cesse de taxer l’industrie pharmaceutique. Toutefois, ce qui me gêne le plus, est le « saucissonnage » de la recherche que le texte entraîne. Bien que n’étant pas un spécialiste de ces questions, j’ai la faiblesse de penser que la recherche sur le cancer est un tout qui suscite chez les chercheurs la même volonté d’aboutir, que les malades soient jeunes ou adultes : les chercheurs ne les trient pas. Il faut conserver à la recherche son caractère universel. Le cancer est combattu avec la même force, quel que soit l’âge de ceux qui en sont atteints.
Telles sont les raisons pour laquelle notre groupe ne souhaite pas voter en faveur de ce texte.
Mme la présidente Catherine Lemorton. Je tiens à rappeler que nous avons trouvé l’UDI à nos côtés pour voter un amendement au PLFSS pour 2015 favorisant les génériques aérosols – les industries pharmaceutiques y étaient opposées.
C’était courageux de sa part.
M. Arnaud Robinet. Je tiens à remercier M. Lagarde de s’être penché sur un sujet important qui concerne un grand nombre de nos concitoyens. Toutefois, plusieurs points du texte suscitent des interrogations de notre part.
Pourquoi, tout d’abord, avoir déposé votre texte en plein milieu du débat sur le PLFSS ? Il eût été plus judicieux de l’introduire dans le cadre de celui-ci ou dans celui du projet de loi Santé, dont nous serons saisis au mois de janvier prochain.
Vous ciblez la question du financement de la recherche en France. Chacun peut regretter les baisses de crédits qui affectent la recherche publique. Les chercheurs des laboratoires labellisés, et, plus particulièrement, des centres de recherche que sont l’INSERM et le CNRS, sont inquiets.
S’agissant de la taxe instaurée par le texte, M. Richard a fait observer que, n’étant que de 0,15, elle est trente-deux fois inférieure aux taxes déjà mises en place dans le cadre des différents PLFSS. La droite et la gauche ayant considéré, depuis de trop nombreuses années, l’industrie pharmaceutique comme la variable d’ajustement des recettes de la caisse d’assurance maladie, il me paraît dangereux de rajouter une taxe supplémentaire, même modique, à celles qui pèsent déjà sur l’industrie pharmaceutique.
Je partage les propos de M. Door, sur la stratégie du gagant-gagnant, qui entre dans le cadre des discussions organisées au sein du Comité interassociatif sur la santé (CISS) entre l’État et l’industrie pharmaceutique. Cette stratégie, qui repose notamment sur des mesures d’ordre fiscal, vise à permettre aux différents acteurs de partager les moyens de parvenir ensemble aux objectifs fixés.
Il ne faut pas non plus écarter la question du financement européen : les États membres doivent avancer ensemble sur ces questions.
La question du prix du médicament est également posée – nous l’avons vu dans le cadre de l’examen du PLFSS. Il faut savoir que l’industrie pharmaceutique ne refuse pas de s’engager dans des recherches uniquement pour des raisons de rentabilité. C’est pourquoi le groupe UMP a demandé la création d’une mission d’information sur le prix du médicament, en vue de prendre en compte la recherche et les investissements réalisés par les différents laboratoires.
Ce texte nous permet en tout cas de souligner la qualité de l’expertise de nos équipes de recherche en matière oncologique.
Mme Françoise Dumas. Le texte ne nous paraît pas apporter des réponses pertinentes à la question, réelle, du manque de financement de la recherche oncologique générale et pédiatrique en particulier.
Un enfant qui est atteint d’un cancer souffre d’une pathologie qui, en dépit des progrès considérables réalisés par la science médicale, continue d’être mortelle, quelles que soient les générations qui en sont atteintes.
La dignité et le niveau d’implication des patients, des familles et des équipes médicales sont remarquables. Nous ne pouvons que les en féliciter et nous montrer dignes de leur combat – du reste, nombreux sont les Français membres d’associations nationales ou internationales spécialisées sur ces sujets.
La force des communicants ne doit pas primer sur la cohérence dans la lutte ni l’émotion suscitée par les cas individuels sur la coordination nationale et globale de la recherche. Il n’est pas pertinent d’opposer la recherche pédiatrique à la recherche générale. Rien ne nous dit que les traitements de demain ne seront pas issus de recherches complètement différentes. Seule une vision d’ensemble de la recherche médicale et oncologique permettra de réaliser de réels progrès en la matière. Les orientations fiscales ne peuvent ni ne doivent être les principaux outils d’une politique de recherche, car ce serait prendre le risque d’un désengagement des laboratoires.
C’est pourquoi le troisième plan cancer, qui est une des priorités du Président de la République, répond à une vision d’ensemble et comprend des mesures qui, bien qu’insuffisantes, contribueront fortement à lutter contre le cancer, notamment chez les enfants. Des partenariats européens et les centres de recherche et d’essais au sein d’un dispositif national spécifique de lutte contre les cancers rares de l’enfant sont les instruments d’une politique cohérente et efficace. C’est ainsi que nous parviendrons à réaliser le séquençage complet du génome des tumeurs de l’enfant, peut-être avant la fin du plan.
C’est en apportant une vision claire, en assurant un environnement stable et en favorisant la collaboration internationale que nous y parviendrons.
M. Fernand Siré. Les enfants sont différents des adultes : on a fait d’ailleurs du traitement des enfants une spécialité – la pédiatrie.
De plus, lorsqu’un enfant est atteint d’une pathologie, il n’est pas malade seul : son environnement est atteint, qu’il s’agisse de sa famille ou de ses camarades d’école. La prise en charge est donc particulière.
Le simple fait d’évoquer la question est important.
Il faut toutefois se montrer réaliste : les laboratoires n’ont pas les moyens, pour des raisons de rentabilité, de faire de la recherche sur les médicaments destinés spécifiquement aux enfants.
Si ce texte n’apporte pas toutes les solutions, il constitue une avancée. Je tiens cependant à préciser que je suis favorable non pas à une taxation supplémentaire mais à une détaxation des laboratoires qui s’engagent à procéder à des recherches sur les médicaments oncologiques et généraux destinés aux enfants.
M. Bernard Accoyer. Nous ne pouvons que réserver un accueil positif à une proposition de loi soutenue par des familles cruellement touchées. Nous ne pouvons qu’encourager la recherche en oncologie et en oncologie pédiatrique. En la matière, il convient de rendre hommage à la communauté scientifique française particulièrement active qui met constamment en œuvre les avancées thérapeutiques de la communauté de la recherche internationale.
Il n’en reste pas moins que l’instauration d’une nouvelle taxe et son affectation à une pathologie oncologique particulière ouvre la voie à une sorte de compétition des financements entre les différents cancers, les diverses pathologies, les malades eux-mêmes, et les familles de malades, ce qui pose un sérieux problème éthique.
Compte tenu de la « surtaxation » subie aujourd’hui par l’industrie pharmaceutique française par rapport à ses concurrentes européennes, la nouvelle contribution ne constitue pas une solution et menace même l’avenir de la recherche en France. Alors que notre pays était en pointe dans ce secteur, je rappelle qu’il enregistre désormais des délocalisations.
Grâce au séquençage des génomes tumoraux prévu par le troisième Plan cancer, nous détiendrons la clef du traitement d’un grand nombre d’affections tumorales malignes et par conséquent de nombreux cancers de l’enfant. Le sujet est donc d’ores et déjà pris en compte.
À vrai dire, nous avons surtout besoin d’un débat sur l’accès durable à l’innovation médicamenteuse en France. Le dernier PLFSS n’a pas permis d’en discuter alors même que nous sommes engagés dans des mécanismes qui, à terme, pourraient restreindre cet accès. Le débat a eu lieu concernant le traitement de l’hépatite C ; il devra se tenir au sujet des médicaments biotechnologiques. Nous devons concentrer nos efforts sur ce sujet.
Mme la présidente Catherine Lemorton. Monsieur Accoyer, pour la première fois, le PLFSS pour 2015 aborde la question de l’accès à l’innovation dans plusieurs de ses articles.
M. Élie Aboud. Contrairement à ce que j’ai entendu, la mortalité et la morbidité augmentent aujourd’hui en matière d’oncologie pédiatrique alors que, globalement, la recherche publique française, autrefois classée parmi les premières du monde, ne figurera bientôt plus dans les quinze premières de ce palmarès. De son côté, la recherche privée ne s’est jamais intéressée à l’oncologie pédiatrique parce que le secteur n’est tout simplement pas rentable.
Monsieur le rapporteur deux éléments me gênent dans votre proposition de loi.
Si je suis heureux de constater aujourd’hui que mes collègues socialistes et écologistes déclarent leur solidarité avec l’industrie pharmaceutique confrontée à de nombreuses difficultés, je regrette que l’alinéa 3 de l’article 1er exclue de l’assiette de la nouvelle taxe le chiffre d’affaires réalisé au titre des spécialités génériques. Certains laboratoires ne font aucune recherche et se contentent de faire des affaires avec des molécules existantes. Ces entreprises ne consentent aucun effort en matière de recherche, et elles seraient dispensées de payer la nouvelle contribution : c’est un peu fort de café ! Pourquoi leur faire ce véritable cadeau ?
L’alinéa 4 de l’article 1er prévoit par ailleurs le taux de la contribution due au titre du chiffre d’affaires réalisé en 2013 et 2014. Je suis troublé par le fait que la taxe puisse s’appliquer à l’activité d’années passées et que vous lui donniez ainsi un effet rétroactif.
Il reste que, hormis ce qui concerne ces deux remarques de fond, je suis pleinement solidaire de cette proposition de loi.
Mme la présidente Catherine Lemorton. Monsieur Aboud, je me permets de vous signaler que les laboratoires qui ne produisent que des médicaments génériques et qui n’investissent pas dans l’innovation ne bénéficient pas du crédit impôt recherche.
M. Jean-Sébastien Vialatte. Des problèmes nous sont aujourd’hui posés qui dépassent largement ceux des cancers infantiles. Nous vivons en effet une véritable révolution de l’industrie du médicament et du financement par cette dernière de la recherche et du développement.
La médecine de demain subdivisera les patients, notamment en cancérologie, en une multitude de groupes et de sous-groupes de plus en plus réduits pour choisir les traitements les plus efficaces et les moins toxiques. Cette évolution se produit alors que l’on constate un recul de l’innovation et des bénéfices de l’industrie pharmaceutique – la plupart des médicaments les plus vendus tombent en effet dans le domaine public. M. Aboud a eu raison de souligner qu’il serait paradoxal d’exonérer de la nouvelle contribution les laboratoires produisant des médicaments génériques, car ils ne font que bénéficier de la recherche des autres. L’industrie pharmaceutique met aujourd’hui sur le marché un nombre insuffisant de médicaments nouveaux pour compenser les pertes liées au transfert dans le domaine public de ses produits qui se vendent le mieux.
Plutôt que d’envisager la mise en place d’une nouvelle taxe, sachant qu’une partie importante sera affectée à sa collecte et servira à contrôler son utilisation, mieux vaudrait s’interroger sur les freins au développement de nouvelles molécules destinées à des populations peu nombreuses. Il faudrait par exemple réfléchir avec les instances de régulation afin qu’elles adoptent des critères d’essais moins exigeants et permettent qu’il soit possible, pour certaines pathologies, de bénéficier des dérogations accordées aux médicaments orphelins.
Nous devrions aussi nous interroger sur la question des brevets. Contrairement à ce qui se passe aux États-Unis, l’Office européen des brevets ne permet pas de breveter des méthodes de traitement ; or ces médicaments ciblés sont de plus en plus souvent prescrits après recours à des tests compagnons. L’on devrait également se poser des questions sur la durée de protection des brevets. Elle est aujourd’hui limitée à vingt ans à compter du dépôt alors que dix ans passent en général entre le dépôt du brevet et l’autorisation de mise sur le marché. Autrement dit, la protection n’est effective que durant dix ans ce qui est totalement insuffisant pour amortir les frais de recherche et de développement, sauf à accepter des prix du médicament insupportables pour l’assurance maladie.
M. Jean-Pierre Barbier. Sur le fond, nous sommes évidemment tous favorables à cette proposition de loi déposée en 2013. Malheureusement, entre 2013 et aujourd’hui, deux PLFSS ont été adoptés qui ont eu des conséquences dramatiques pour l’industrie pharmaceutique. On peut donc craindre que l’instauration d’une nouvelle taxe ait aujourd’hui l’effet inverse de celui recherché : l’industrie risque de renoncer à la recherche et au développement encore plus qu’elle ne le fait déjà.
Je regrette également vivement que le futur projet de loi de santé publique que nous devons examiner au début de l’année 2015 n’aborde à aucun moment la question des maladies orphelines ou de l’oncopédiatrie. Il faut réparer cet inconcevable oubli.
Afin que les taxes soient mieux fléchées vers l’oncopédiatrie, la proposition de loi doit absolument être reprise, soit à l’occasion d’un projet de loi de financement de la sécurité sociale rectificative, soit lors du PLFSS pour 2016 ?
Comme M. Jean-Pierre Door, je souhaite que nous opérions à taxation constante pour l’industrie pharmaceutique tout en assurant une meilleure orientation des crédits vers l’oncopédiatrie et les maladies orphelines.
M. Dominique Dord. Si je ne puis que compatir et comprendre la souffrance des enfants concernés et de leurs parents, je dois aussi dire mon malaise. En effet, je ne vois pas comment il serait possible d’individualiser une cause aussi douloureuse soit-elle. Il existe beaucoup d’autres affections médicales à travers le monde auxquelles une réponse médicale suffisante n’est pas apportée. Dès lors, comment cibler une seule cause et opérer le découpage auquel procède la proposition de loi ?
Nous devons en conséquence à la fois remercier M. Jean-Christophe Lagarde de porter ce sujet sur la place publique, et probablement nous abstenir de voter ce texte.
M. Bernard Perrut. Si les progrès dans la lutte contre le cancer sont constants, si l’espérance de vie moyenne des enfants atteints s’améliore quelque peu, les résultats ne sont pas au rendez-vous.
Je ne sais pas si la solution de financement proposé par notre collègue est la meilleure mais, en tout état de cause, il faut agir. Le Plan cancer 2014-2019 qui a fait des cancers pédiatriques une priorité est-il insuffisant alors que ces maladies demeurent la deuxième cause de mortalité chez les enfants et la troisième pour les adolescents ? Dans une société telle que la nôtre, bouleversée par les progrès scientifiques et technologiques, nous devons nous donner les moyens d’avancer sur ce sujet. S’il ne s’agit pas nécessairement d’adopter immédiatement la solution financière proposée, nous devons, quoi qu’il en soit, marquer notre volonté de faire des progrès sur une véritable question de société au cœur de l’humain.
M. le rapporteur. À ceux qui ont relevé que la proposition de loi ajoutait une taxe à une autre, je rappelle que ce texte a été rédigé en 2013, c’est-à-dire avant l’adoption du dernier PLFSS, mais que le calendrier propre aux « niches » parlementaires n’a pas permis de l’examiner avant ce mois de novembre.
J’insiste sur le fait que je n’ai pas prétendu que le Plan cancer n’abordait pas le sujet des cancers pédiatriques. Je constate cependant qu’un certain nombre de ces cancers ne sont aujourd’hui pas ou peu traités ou explorés.
Madame Delaunay, je note que la plupart des réserves que vous avez exprimées portent plus sur l’exposé des motifs de la proposition de loi que sur son dispositif même. Si l’on enregistre une fréquence stable des cancers pédiatriques, je constate qu'en ce qui concerne les cancers pédiatriques, pas une molécule nouvelle n’a été mise sur le marché au cours de ces dernières années, ce qui relativise la notion de progrès scientifique en la matière.
Je n’ai en rien cherché à opposer la recherche menée au profit des adultes et celle appliquée aux enfants. J’ai au contraire indiqué que la première pouvait bénéficier à la seconde. Néanmoins, il me paraît regrettable qu’il n’existe quasiment pas de recherche spécifique en oncologie pédiatrique. Cela s’explique car les laboratoires pharmaceutiques ne se mobilisent que lorsqu’ils envisagent la production de médicaments qui pourraient être rentabilisés, ce qui est parfaitement compréhensible.
Je souhaite rendre systématique la recherche translationnelle individuelle : il s’agit de mener des recherches in vitro sur des cellules malades. Des équipes de chercheurs sont intéressées, mais les financements manquent. Des résultats permettraient de faire avancer la recherche fondamentale et la capacité de soigner individuellement les malades.
Pour ce qui concerne la collaboration avec l’étranger, madame Delaunay, vous avez raison, mais l’exposé des motifs a été rédigé en 2013.
À aucun moment, je ne mets en cause les oncopédiatres auxquels je souhaite seulement donner des perspectives et des moyens. Les familles sont confrontées à des drames, mais que dire des médecins qui doivent leur expliquer qu’on ne peut offrir à un enfant autre chose que des soins palliatifs parce qu’il n’existe pas de recherches sur un cancer spécifique ?
Monsieur Jean-Pierre Door, les moyens manquent pour l’oncologie pédiatrique en particulier, c’est la raison pour laquelle je présente cette proposition de loi. La contribution que je souhaite mettre en place constitue bien une taxe supplémentaire, mais si nous trouvons un autre moyen de financement, je ne m’y opposerai pas. En 2013, il ne me paraissait pas anormal de prélever une taxe sur des activités rentables pour financer une activité qui ne l’était pas. Il est vrai que, depuis la rédaction de la proposition de loi, a été créée la contribution additionnelle au taux de 1,6 %. Que l’on procède en faisant des économies ou en incluant la contribution nouvelle dans une autre taxe, il faut en tout état de cause flécher des crédits sans quoi les cancers pédiatriques resteront orphelins. Je note qu’une fraction du produit de 320 millions d’euros attendu de la contribution additionnelle doit par exemple participer au financement de l’organisme de gestion du développement professionnel continu. Cela me semble à tout le moins constituer un objectif plus éloigné de l’industrie du médicament que le financement de la recherche en oncologie pédiatrique. J’ajoute que les découvertes effectuées par la recherche profiteront à l’industrie pharmaceutique qui tirera en conséquence profit la nouvelle taxe.
Monsieur Richard, je vous remercie d’avoir souligné les carences du système actuel. Nous avons l’occasion d’y remédier d’une manière ou d’une autre. Aujourd’hui, nous ne faisons des progrès que sur les cancers que nous savons déjà soigner, et leur taux de guérison augmente. En revanche, rien n’évolue concernant certains cancers pour lesquels nous n’avons pas de réponse thérapeutique. Ainsi, nous enregistrons un taux de survie proche de 0 % concernant la tumeur maligne des tissus mous chez l’enfant, autrement appelée rhabdomyosarcome, ou le gliome malin infiltrant du tronc cérébral, ou encore certaines formes de leucémies.
Monsieur Roumegas, l’essentiel reste bien le fléchage des crédits sans lequel il n’y aura pas d’appel à projets et pas de fonds disponibles c’est-à-dire pas d’équipes qui se consacrent au sujet. Le fléchage n’est pas une innovation ; il se pratique déjà pour d’autres priorités comme la maladie d’Alzheimer, le sida…
Vous avez également à juste titre évoqué la précocité des cancers. Ce phénomène mérite que l’on s’y penche. Or il n’existe pas aujourd’hui d’étude épidémiologique systématique en la matière. On n’interroge pas les familles pour savoir si leur mode de vie ou d’autres éléments ont favorisé le développement de la pathologie.
Mme Isabelle Le Callennec. Par exemple au sujet des lignes à haute tension !
M. le rapporteur. Évidemment, le séquençage génétique constitue une priorité et une urgence, mais il ne peut être le seul volet d’action. Or dans le Plan cancer, en matière pédiatrique, c’est l’unique élément retenu jusqu’en 2019. Un financement dans le cadre d’Horizon 2020, le programme européen pour la recherche et l’innovation permettrait toutefois de faire avancer les études épidémiologiques ou par exemple l’immunothérapie, un champ qui doit encore être exploré concernant les enfants.
Monsieur Issindou, la guérison est en effet de plus en plus certaine pour plusieurs types de cancers peu nombreux mais qui touchent un grand nombre d’enfants. Le taux de létalité des autres cancers reste stable faute de moyens thérapeutiques appropriés.
Monsieur Robinet, j’avais déposé des amendements visant à introduire les dispositions de la proposition de loi dans le PLFSS. Pour des raisons que je ne parviens toujours pas à comprendre, ils ont été déclarés irrecevables en application de l’article 40 de la Constitution.
Madame Dumas, je ne réagis pas dans l’émotion, et je ne cherche pas à répondre à une émotion. Il me semble cohérent de vouloir que la recherche travaille dans un domaine dans lequel elle n’a pas les moyens de s’aventurer aujourd’hui. Peut-être le dispositif que je vous propose n’est-il pas le plus pertinent ? Je ne suis habituellement pas membre de votre commission, et vous saurez mieux que moi améliorer le texte qui vous est soumis. Je souhaite seulement que nous entamions sur ce sujet une réflexion collective et que les choses progressent. Rien ne nous dit que la recherche concernant les adultes aboutira à des résultats concernant les cancers pédiatriques. La recherche est par nature incertaine ; gardons-nous de ne chercher que dans une seule voie !
M. Siret a rappelé qu’il était intellectuellement insatisfaisant de laisser croire que la recherche relative au cancer des adultes permettrait de résoudre tous les problèmes des cancers des enfants. Il existe une médecine généraliste et une médecine pédiatrique : ce n’est pas pour rien. Les spécificités liées à l’enfant sont nombreuses : elles ne concernent pas seulement le dosage d’une molécule mais aussi, par exemple, la génétique. Monsieur le député, vous proposez de détaxer plutôt que de taxer. J’adhère de façon générale à ce raisonnement, mais vous ne parviendrez pas à financer par la détaxation une équipe de recherche qui ne se trouve pas dans un laboratoire.
Monsieur Accoyer, si nous bénéficions des crédits du plan Horizon 2020, nous parviendrons à financer le séquençage génétique. Sans cela, nous n’en aurons pas les moyens, et il n’y aura pas de séquençage – nous ne saurons ce qu’il en est qu’au mois de janvier prochain. Si ce financement intervient, la contribution que je propose peut se faire à un taux moindre. J’ai en conséquence déposé un amendement en ce sens, et un autre afin que la taxe n’entre en vigueur qu’en janvier 2016.
Monsieur Aboud, l’un de mes amendements prévoit que la taxe ne portera plus sur les chiffres d’affaires de 2013 et de 2014. Je suis partagé concernant votre remarque sur la contribution des entreprises produisant des génériques. Une logique consiste à ne pas reprocher à ceux qui ne font aucune recherche de ne pas en faire sur l’oncologie pédiatrique. Une autre consiste à considérer essentiellement le fait qu’ils ne font aucune recherche. Nous pourrons en débattre.
Monsieur Barbier, la taxe porte sur le chiffre d’affaires, et non sur la recherche elle-même. Il est préférable d’être au clair sur ce point. J’espère que notre débat permettra d’appeler l’attention sur un sujet qui mériterait de se retrouver dans la future grande loi de santé.
Monsieur Dominique Dord, l’individualisation d’une cause est possible parce que cette dernière a été oubliée jusqu’à aujourd’hui et qu’elle n’a bénéficié d’aucuns crédits. La société se doit de répondre à ce problème spécifique.
M. Perrut a raison : nous pouvons amender le Plan cancer. C’est bien cela que je cherche à faire. Plus globalement, nous sommes confrontés à un problème de société. Je ne conçois pas que nous renoncions à soigner parce ce que la production de médicaments ne sera pas rentable. Une famille peut entendre qu’une maladie ne se soigne pas parce que l’on n’a pas découvert de remède ; comment lui expliquer que l’on est démuni parce que l’on en a jamais cherché ? Si la solution que j’ai ébauchée pour mieux guérir nos enfants confrontés à une maladie mortelle n’est pas satisfaisante, je vous invite à l’amender afin que nous trouvions ensemble une réponse satisfaisante.
Mme la présidente Catherine Lemorton. Je rejoins M. Roumegas sur la création d’une nouvelle taxe : je n’ai rien contre son principe, mais nous ouvrons une porte qui pourrait être utilisée pour d’autres maladies. Nous le savons, les industries privées ne s’engagent pas sans certitude d’un retour rapide sur investissement. Pour citer un exemple très récent, le test rapide de diagnostic du virus Ebola a été élaboré par le Commissariat à l’énergie atomique et aux énergies alternatives (CEA) avant d’être développé dans le secteur privé.
En matière de recherche, je veux rappeler que la majorité actuelle est loin d’être restée inactive. Je citerai deux mesures importantes.
Nous avons permis la recherche sur les cellules souches embryonnaires. Quelques parlementaires de l’opposition nous ont d’ailleurs rejoints sur le sujet, notamment M. Vialatte.
En juin 2014, la procédure d’accès aux essais cliniques a été simplifiée. Le délai d’attente qui pouvait atteindre mille jours a été réduit à soixante jours. La convention signée par Mme Geneviève Fioraso, secrétaire d’État chargée de l’enseignement supérieur et de la recherche, M. Arnaud Montebourg, alors ministre de l’économie, du redressement productif et du numérique, et Mme Marisol Touraine, ministre des affaires sociales, de la santé et des droits des femmes, profitera aussi aux enfants. Elle était très attendue par les établissements de santé publics et privés, et par les industries du secteur. En la matière, n’oublions pas cependant les parents qui peuvent légitimement hésiter devant une innovation thérapeutique.
J’ajoute que le troisième Plan cancer contient également des mesures favorisant la recherche contre les cancers pédiatriques. Je pense au programme d’accès sécurisé à des thérapies ciblées innovantes (AcSé) lancé en 2013, ou aux Centres labellisés INCa de phase précoce (CLIPP).
Monsieur Lagarde, vous souhaitez la mise en place d’un protocole particulier pour les enfants ou les adolescents âgés de moins de dix-huit ans. Cette barrière de l’âge me gêne, même si elle correspond à la majorité légale. La lecture de l’article 2 me paraît tout simplement douloureuse parce que nous regrettons de la même façon qu’un protocole particulier ne soit pas mis en place lorsqu’il s’agit d’un malade de dix-huit ans et six mois ou lorsqu’il s’agit d’un autre qui atteindra sa majorité dans quelques mois.
Pour conclure, permettez-moi de rappeler que ce sujet nous touche tous profondément, que nous choisissions de nous abstenir ou de voter pour ou contre ce texte.
La Commission en vient à la discussion des articles.
Article 1er
(art. L. 245-6-1 [nouveau] du code de la sécurité sociale)
Instauration d’une contribution finançant la recherche pédiatrique
Premier des trois articles de la proposition de loi, l’article 1er instaure une nouvelle contribution destinée à financer la recherche contre les cancers touchant spécifiquement les enfants.
Le dispositif s’inspire de la contribution sur le chiffre d’affaires des entreprises exploitant une ou plusieurs spécialités pharmaceutiques, instaurée par la loi de financement de la sécurité sociale (LFSS) pour 2014. Il prévoit l’affectation de la ressource à l’institut national du cancer (INCa) ainsi qu’un mécanisme de contrôle de son utilisation.
1. Le financement de la recherche contre le cancer pédiatrique
Si les progrès dans la lutte contre le cancer sont constants, l’espérance de vie moyenne des enfants qui en sont atteints ne s’est malheureusement pas améliorée au cours des dernières années, tendant plutôt à se stabiliser. C’est dans ce contexte que le troisième plan Cancer (2014-2019) a fait du traitement du cancer pédiatrique une priorité. Notre pays porte cet objectif sur le plan international, à l’appui il est vrai d’un effort de recherche conséquent.
En France, l’INCa est chargé de distribuer l’essentiel des fonds publics consacrés à la recherche contre le cancer. Ces ressources sont complétées par un effort privé significatif, fourni par l’industrie et ses structures de recherches, mais aussi par des démarches à but non lucratif visant le grand public à travers des associations telles que l’ARC ou la Ligue contre le cancer. Sur les 350 millions d’euros que l’institut a alloués à la recherche entre 2007 et 2011, près de 10 % auraient été consacrés aux cancers touchant les enfants et adolescents. Il s’agit d’une estimation, les données disponibles sur cette question étant relativement variables : l’évaluation dépend des programmes en cours et initiés chaque année et le traitement de l’oncologie pédiatrique peut correspondre à une démarche directe (tel un programme de recherche sur le rétinoblastome, un cancer de l’œil touchant les enfants) ou bien à une démarche indirecte (dans le cas où, par exemple, des travaux sur le cancer des poumons chez l’adulte permettent de façon complémentaire de progresser dans le traitement de celui touchant le cerveau chez les enfants).
Malgré ces investissements, les travaux conduits par votre rapporteur ont mis en lumière l’absence de réponse scientifique à la situation de certains enfants, atteints de cancers dits orphelins. Il est compréhensible que la science n’ait pas encore trouvé de traitement à tel ou tel cancer. Il est en revanche inacceptable de constater que dans certains cas cette absence de résultats découle de la non-existence d’un programme de recherche dédié, faute d’un marché en perspective ou d’un financement public.
C’est pourquoi une très faible partie des bénéfices que génère l’activité de l’industrie pharmaceutique en France pourrait être affectée à l’effort de recherche intéressant spécifiquement ce segment de la population. Il s’agirait d’une mesure de cohérence, le chiffre d’affaires de cette industrie étant largement alimenté par les prises en charge de l’assurance maladie. En outre, cette contribution aurait le mérite de conduire tous les acteurs, français et étrangers, à participer à l’effort de recherche sur des segments peu étudiés, faute de perspectives commerciales.
2. La contribution sur le chiffre d’affaires des entreprises exploitant une ou plusieurs spécialités pharmaceutiques versée au profit de l’assurance maladie
Dans une démarche de simplification, la loi de financement de la sécurité sociale (LFSS) pour 2014 a supprimé deux taxes portant sur l’industrie pharmaceutique : la contribution sur le chiffre d’affaires et la taxe annuelle sur les spécialités pharmaceutiques et dont le produit en 2012 s’est élevé à 397 millions d’euros. Elle les a remplacées à compter du 1er janvier 2014 par une contribution sur le chiffre d’affaires des entreprises exploitant une ou plusieurs spécialités pharmaceutiques.
Cette contribution est assise sur le chiffre d’affaires hors taxes réalisé en France métropolitaine et dans les départements d’outre-mer (DOM) au cours de l’année civile, au titre des médicaments bénéficiant d’un enregistrement, d’une autorisation de mise sur le marché délivrée par l’Agence nationale de sécurité du médicament (ANSM) ou par l’Union européenne, ou d’une autorisation d’importation parallèle.
Sous certaines conditions, le chiffre d’affaires relatif aux spécialités génériques, aux médicaments orphelins et les médicaments dérivés du sang respectant les critères du don éthique est exclu de l’assiette.
Cette contribution se compose de deux volets :
– une cotisation de base de 0,17 %, due par toute entreprise assurant l’exploitation d’une ou plusieurs spécialités pharmaceutiques et portant sur la totalité du chiffre d’affaires hors taxes réalisé en France ou dans les DOM ;
– une cotisation additionnelle de 1,6 %, due par les seuls exploitants de spécialités pharmaceutiques prises en charge par les caisses d’assurance maladie ou inscrites sur la liste des médicaments agréés à l’usage des collectivités, portant sur le chiffre d’affaires hors taxes réalisé en France ou dans les DOM.
Depuis 2014, ces cotisations sont versées de manière provisionnelle le 1er juin de l’année au titre de laquelle elles sont dues, pour un montant correspondant à 95 % du produit du chiffre d’affaires défini pour chacune d’elles, et régularisées au 1er mars de l’année suivante. Les unions de recouvrement des cotisations de sécurité sociale et d’allocations familiales d’Île-de-France et de Rhône-Alpes assurent leur recouvrement et leur contrôle. Ces contributions sont affectées à la Caisse nationale de l’assurance maladie des travailleurs salariés.
L’annexe « Voies et moyens I » au projet de loi de finances pour 2015 décrit une ressource dynamique : un produit attendu à 361 millions d’euros pour 2014 et à 379 millions d’euros l’année suivante (2).
C’est sur la base de ce produit que peut être évaluée la ressource que générerait la contribution instaurée par cette proposition de loi.
3. Financer la recherche sur le cancer grâce à une contribution assise sur les profits de l’industrie pharmaceutique
L’article 1er de la proposition de loi instaure une taxe prélevée sur le chiffre d’affaires des laboratoires pharmaceutiques assurant l’exploitation en France de médicaments remboursés par l’assurance maladie, selon les mêmes modalités que la cotisation additionnelle. Cette taxe s’élèverait à 0,15 % et serait affectée à l’Institut national du cancer (INCa) afin de financer des actions spécifiques de recherche indépendante dans la lutte contre les cancers pédiatriques. Le produit attendu de cette nouvelle contribution s’élèverait à environ 32 millions d’euros en 2015.
Le dispositif proposé insère un article L. 245-6-1 nouveau au code de la sécurité sociale qui est composé de cinq alinéas.
Son premier alinéa instaure la contribution destinée au financement de la recherche oncologique pédiatrique. Il est prévu qu’elle soit versée à l’Institut national du cancer afin de financer des actions spécifiques de recherche indépendante dans la lutte contre le cancer pédiatrique. Le même alinéa définit la base de cette contribution. Elle sera versée par les entreprises assurant l’exploitation en France :
– d’une ou plusieurs spécialités pharmaceutiques dans le cadre défini à l’article L. 5124-1 du code de la santé publique (qui encadre la fabrication, l’importation, l’exportation et la distribution en gros de produits médicaux) et donnant lieu à remboursement par les caisses d’assurances maladie (ce que prévoient, dans le code de la sécurité sociale, les premier et deuxième alinéas de l’article L. 162-17) ;
– ou bien celle des spécialités inscrites sur la liste des médicaments agréés à l’usage des collectivités.
Cette base reproduit celle retenue par le législateur pour la cotisation additionnelle définie à l’article L. 245-6 du code de la sécurité sociale : ce sont les mêmes acteurs qui seraient imposés par ce dispositif.
L’alinéa 3 définit l’assiette de cette contribution. Elle reprend le modèle de la cotisation additionnelle sur le chiffre d’affaires des entreprises exploitant une ou plusieurs spécialités pharmaceutiques : il s’agit du chiffre d’affaires hors taxes des entreprises mentionnées au précédent alinéa.
Ce chiffre d’affaires correspond à celui réalisé au cours de l’année civile en France métropolitaine et dans les départements d’outre-mer et généré au titre des médicaments bénéficiant d’une autorisation de mise sur le marché et inscrits sur certaines listes précisément définies :
– celles mentionnées aux premiers et deuxièmes alinéas de l’article L. 162-17 du code de la sécurité sociale précité (cf. développements sur la base de la contribution) ;
– celle mentionnée à l’article L. 5123-2 du code de la santé publique (cf. supra).
Est logiquement exclu de l’assiette le chiffre d’affaires lié à la mise sur le marché de certains produits :
– les spécialités génériques remboursées sur la base d’un tarif fixé en application de l’article L. 162-16 du code de la sécurité sociale, article qui permet de limiter les remboursements de l’assurance maladie pour certaines molécules délivrables sous la forme « générique » ;
– les médicaments orphelins désignés comme tels dans le cadre de la réglementation européenne (Règlement CE n° 141/2000 du Parlement européen et du Conseil du 16 décembre 1999 concernant les médicaments orphelins). Ces médicaments étant mis sur un marché étroit afin de soigner les cancers orphelins, la fiscalité doit en effet impérativement conserver son caractère incitatif.
La proposition de loi ayant été enregistrée en juin 2013, le taux est proposé à 0,15 % pour les années 2013 et 2014 (alinéa 3). Compte tenu du calendrier d’examen de la proposition de loi et de la perspective d’un abondement de crédits communautaire (la décision est attendue dès 2015), votre rapporteur entend proposer un ajustement du dispositif par voie amendement afin de ne faire débuter ce dispositif qu’au 1er janvier 2016 et de ramener ce taux à 0,05 %.
La proposition de loi prévoit que l’INCa gère de façon autonome cette nouvelle ressource. C’est pourquoi votre rapporteur a jugé indispensable d’assurer une information régulière du Parlement sur l’emploi de ces fonds. L’alinéa 4 de l’article L. 245-6-1 nouveau prévoit donc la remise d’un rapport annuel.
Enfin, aux termes du sixième et dernier alinéa, un décret en Conseil d’État permettra de préciser les modalités d’application de cet article.
*
* *
La Commission est saisie d’un amendement AS1 de Mme Michèle Delaunay, de suppression de l’article.
Mme Michèle Delaunay. En l’état, pour des raisons d’ordre médical et parce que nous sommes réticents à la création d’une nouvelle taxe, nous ne sommes pas favorables à la proposition de loi. Mais ne vous méprenez surtout pas : comme Mme la présidente l’a dit, nous souhaitons évidemment soutenir et accompagner la recherche en oncologie pédiatrique.
Monsieur Lagarde, vous n’avez bien sûr pas voulu opposer la recherche en oncologie pédiatrique à la recherche oncologique générale, mais c’est ce qui résulte de votre proposition de loi puisqu’un seul des deux secteurs recevrait le produit de la nouvelle taxe. Pourtant les tumeurs orphelines existent aussi chez l’adulte, et certaines sont ignorées de la recherche. En tant qu’oncologue, j’ai personnellement pris en charge le mélanome : pendant trente ans, aucune molécule nouvelle n’a été découverte pour le guérir. Aujourd’hui, seules les thérapies ciblées font légèrement frémir les courbes de survie.
Dans les unités d’oncopédiatrie, des essais thérapeutiques sont proposés à quasiment tous les enfants. Il ne s’agit pas systématiquement de tester des molécules nouvelles : il peut s’agir de mixer radiothérapie et chimiothérapie classique, de choisir entre radiothérapie et abstention, entre chirurgie seule et chirurgie plus radiothérapie… Les cocktails peuvent être très différents.
Vous nous avez parlé des cas où il n’y avait pas de traitement du tout. La plupart du temps, il s’agit de cas où le diagnostic est posé à un stade auquel tout traitement deviendrait délétère voire létal. Le traitement de référence du gliome du tronc cérébral est par exemple la radiothérapie même si le taux de guérison est faible et que les risques existent. On peut citer le cas très récent d’une enfant qui, à la demande des parents, a été opérée par un médecin australien – au Luxembourg, cependant, ce qui interroge. Le rhabdomyosarcome se traite uniquement par la chirurgie qui, chez l’adulte, est complétée par la chimiothérapie utilisée très prudemment chez l’enfant en raison de ses conséquences sur un organisme en développement. Il n’est pas possible de considérer qu’il existe plus de situations sans traitement en oncopédiatrie qu’en oncologie en général. La thérapeutique peut être dépassée dans les deux cas ; il s’agit d’une expérience malheureuse que vivent tous les oncologues.
Nous proposons la suppression de l’article 1er pour tous les arguments déjà développés.
M. Dominique Dord. La mécanique de notre commission va conduire à rejeter l’article 1er, ce qui reviendra à « jeter à la poubelle » la proposition de loi de M. Lagarde. Il me semble que cette conclusion brutale ne reflète pas la teneur du débat qui vient de se tenir.
Nous ne devons pas donner le sentiment que la question posée par M. Lagarde ne nous intéresse pas. Peut-être pourrait-il revenir devant nous d’une manière ou d’une autre afin que nous puissions au moins lancer un appel à projets afin d’apporter une solution ? En réalité, un consensus fort existe bien parmi nous ; il faudrait qu’il se manifeste d’une manière ou d’une autre.
M. Jean-Pierre Door. Je l’ai rappelé : des progrès sont intervenus dans le traitement des cancers pédiatriques. Des appels à projet ont été lancés par l’INCa, dans le cadre du Plan cancer 2009-2013, et le Plan cancer 2009-2014 présente le traitement du cancer des enfants comme une priorité. Il faut néanmoins aller plus loin. C’est pourquoi je suis choqué par la première phrase de l’exposé des motifs de cet amendement, aux termes de la laquelle la proposition de loi ne serait « pas opportune ». Celle-ci me semble très opportune, au contraire, et je me réjouis que nous en débattions. Je demande donc à mes collègues de repousser l’amendement.
En l’espèce, c’est le financement qui pose problème. Taxer le chiffre d’affaires des laboratoires revient à taxer tout le monde, même les nombreux laboratoires français et internationaux qui ne mènent aucune recherche dans le domaine oncologique et pédiatrique. Il faut s’adresser à l’industrie pharmaceutique et à la recherche publique spécialisées pour trouver des fonds. Nous pouvons formuler des propositions en ce sens.
Mme la présidente Catherine Lemorton. Ne vous arrêtez pas à la première phrase de l’exposé des motifs de l’amendement. Les suivantes expliquent les raisons pour lesquelles on peut juger la proposition de loi peu opportune.
M. Jean-Louis Roumegas. L’amendement, qui tend à supprimer l’article, invite à prendre une position brutale, qui ne reflète pas la réalité de nos débats. D’un autre côté, la rédaction de la PPL n’est pas satisfaisante. La meilleure solution serait que Mme Delaunay retire son amendement et que le rapporteur propose avant la séance publique une rédaction plus consensuelle, au terme d’un travail auquel nous sommes prêts à participer. À défaut, nous nous abstiendrons tant sur l’amendement que sur la PPL.
M. Élie Aboud. Madame Delaunay, je m’étonne que vous proposiez de supprimer l’article, alors que vos analyses rejoignent quasiment celles du rapporteur. À vous entendre, il n’existe aucune différence, en matière d’oncologie, entre le monde adulte et celui de la pédiatrie.
Mme Michèle Delaunay. Ce n’est pas du tout ce que j’ai dit !
M. Élie Aboud. Vous savez comme moi que beaucoup d’enfants malades, qui ne sont pas traités dans des centres universitaires ou des instituts de cancérologie, bénéficient d’une solidarité associative mais non des progrès de la recherche médicale.
Je pense, comme M. Door, qu’on entre dans un cercle vicieux si l’on taxe les laboratoires qui ne mènent pas de recherche pédiatrique, pour aider ceux qui s’y consacrent. Mieux vaut initier un cercle vertueux, en engageant l’industrie pharmaceutique à s’impliquer dans cette recherche.
M. Arnaud Richard. L’exposé sommaire de l’amendement est maladroit. La première phrase paraît particulièrement violente, quand on songe aux difficultés que rencontrent les familles. Sur le sujet, Mme Delaunay m’a paru aussi docte que mal à l’aise. Il est regrettable que la majorité n’entende pas le signal qu’a envoyé M. Lagarde en déposant la PPL.
Une solution serait de détaxer les laboratoires menant une recherche offensive en matière d’oncologie pédiatrique. On peut aussi engager une démarche européenne sur les maladies orphelines, afin de constituer des cohortes plus importantes.
Enfin, je rappelle que, même si ces amendements de suppression sont adoptés, le texte sera examiné en séance publique.
Mme la présidente Catherine Lemorton. Est opportun ce qui vient à propos. Dès lors que la recherche pédiatrique avance, ce dont le rapporteur est convenu lui-même, il me paraît moins violent de juger que des dispositions ne viennent pas à propos, que de prévoir dans la loi une limite à l’âge de dix-huit ans.
M. Jean-Pierre Barbier. L’amendement de suppression est brutal, car il ferme la porte à toute discussion, exclut toute ouverture et n’envisage aucune solution. Pourquoi le groupe socialiste ne formule-t-il pas des propositions, par exemple sur le mode de taxation ? Dès lors qu’il est majoritaire, il sait que celles-ci peuvent aboutir, et apporter du réconfort et de l’espoir aux familles.
M. Michel Issindou. Nous ne sommes pas mal à l’aise sur ce sujet. Sur le fond, la proposition de M. Lagarde est bonne, mais, dès lors que nous écrivons la loi, nous sommes contraints d’effectuer un choix binaire. Nos collègues de l’UMP reconnaissent qu’il serait malvenu de taxer l’industrie pharmaceutique. Il faut résoudre le problème autrement. C’est pourquoi je suggère à M. Largarde de retirer son texte et de poursuivre sa réflexion.
Mme Chaynesse Khirouni. Il est difficile de se positionner sur un sujet aussi délicat, ce que M. Door a exprimé en termes plus mesurés que M. Richard. Comme M. Issindou, je pense que le rapporteur doit retirer le texte et revenir à ce sujet dans un autre cadre.
Mme Michèle Delaunay. En aucun cas, je n’ai cherché à être docte. Simplement, je ne veux pas laisser dire qu’un enfant atteint d’un gliome du tronc cérébral a été laissé sans proposition thérapeutique, ce qui ne se produit qu’en raison d’une extension de la tumeur ou de l’endroit où elle se situe.
Je ne suis pas mal à l’aise à l’égard de la proposition de loi qui porte sur un sujet auquel nous sommes évidemment tous sensibles. Le médecin que je suis partage le désarroi des parents. Je conviens aussi qu’il y a une brutalité intrinsèque au fait de répondre par oui ou par non à une proposition.
À mon sens, le débat doit se poursuivre, mais, outre les réserves médicales que j’ai formulées, je ne crois pas qu’il faille ajouter à la taxe existant un montant fléché vers la recherche sur les tumeurs pédiatriques, alors que l’industrie pharmaceutique est à l’origine de toutes les propositions de molécules.
Si la proposition de loi était retirée, je serais heureuse d’envisager d’autres options, pour avancer sur un sujet qui dépasse les clivages partisans.
Mme la présidente Catherine Lemorton. Même si nous votons l’amendement, le groupe UDI pourra présenter ce texte dans sa niche parlementaire.
M. le rapporteur. Le groupe UDI a la possibilité de présenter des textes une fois par an, en novembre. Si vous repoussez le texte, nous devrons attendre un an avant d’en proposer un autre. Je rappelle en outre que, la proposition induisant un risque de dépense, le président de la commission des finances m’oppose systématiquement depuis 2013 les dispositions de l’article 40. C’est dire que mon groupe ne dispose pas d’une marge de manœuvre importante.
Quoi qu’il en soit, je ne revendique aucune paternité sur cette PPL, dont je ne fais pas une affaire politique. Je ne suis pas spécialiste du sujet. Je ne suis pas membre de votre commission. Je n’ai contesté ni le premier Plan cancer, lancé par Jacques Chirac, ni le deuxième, dont l’initiative revient à Nicolas Sarkozy. Je constate seulement que, dans le troisième Plan, le sujet n’est toujours pas traité, en dépit de certaines avancées.
Mme la présidente Catherine Lemorton. Même si nous rejetons la proposition de loi, le groupe UDI pourra la maintenir, dans sa niche parlementaire du 27 novembre, auquel cas elle sera discutée en séance publique.
L’autre solution, si la Commission décide qu’il faut la retravailler, serait que son auteur la retire en vue de l’intégrer à un meilleur véhicule législatif, comme la loi de santé.
M. Élie Aboud. Si le groupe UDI présente la PPL en séance publique, elle ne sera pas adoptée. Il faut donc trouver une solution médiane. Je propose que le groupe maintienne le texte et que nous chercherions à amender.
Mme la présidente Catherine Lemorton. Si M. Lagarde ne retire pas la PPL, nous devrons nous prononcer sur l’amendement de suppression, qui a de fortes chances d’être adopté. La proposition de loi sera donc supprimée en commission.
Le plus simple serait d’aller au bout de la démarche législative. Lorsque la ministre sera dans l’hémicycle, nous pourrons lui poser toutes les questions nécessaires. Nous lui demanderons notamment quel est le véhicule législatif le plus approprié pour inscrire des propositions relatives à l’oncologie pédiatrique.
M. le rapporteur. Je n’ai pas dit qu’il n’y avait pas d’avancées – l’AcSé et les CLIPP en font partie –, mais celles-ci sont limitées à certaines situations.
Je pense aussi, Madame Delaunay, qu’il faut éviter de personnaliser le débat et de mettre l’émotion en avant. Je ne l’ai fait en aucune façon. On peut toutefois s’interroger sur les raisons – probablement de sécurité juridique – qui peuvent amener un médecin à intervenir au Luxembourg plutôt qu’en France mais ce débat doit être tenu par ailleurs.
À aucun moment, je n’ai dit qu’il n’existait pas de traitement de référence. On peut recourir à la radiothérapie pour traiter le gliome, mais, dans ce cas, on atteint, à l’issue du traitement, un taux de létalité proche de 100 %. Un tel échec impose de rechercher d’autres voies. De même, c’est parce qu’on est désarmé face aux tumeurs malignes des tissus mous, qu’on se penche sur d’autres solutions que le séquençage génétique.
Je ne discerne nulle brutalité dans le processus législatif, puisque personne n’est obligé de voter en faveur de la suppression de l’article 1er. Le plus simple serait de formuler d’autres propositions.
Si, avant le 27 novembre, certains d’entre vous trouvent un dispositif plus adapté et plus consensuel – en proposant des économies dans d’autres domaines, une addition à la taxe de 1,6 % ou une modification du Plan cancer –, je m’en réjouirai. Mais nous ne pouvons pas nous abriter derrière l’argument selon lequel la recherche privée, seule à même de trouver des thérapies, n’a pas à s’exercer si elle n’est pas rentable.
J’ai entendu la proposition de M. Richard tendant à détaxer les laboratoires qui travailleraient sur certains sujets. Nous partageons les mêmes interrogations face au fait qu’une partie des problématiques spécifiques aux cancers pédiatriques ne soit pas prise en compte, bien que 10 % de la recherche oncologique soit consacrée à la pédiatrie. Le problème va bien au-delà des messages de parents ou des demandes d’associations que vous avez pu recevoir. Il s’agit de savoir quelle réponse la société apporte à une question de santé.
Si vous adoptez l’amendement de suppression, vous renoncerez du même coup aux amendements tendant à régler la question de la rétroactivité ou à diviser le montant de la taxe par trois. Nous cherchons actuellement 10 millions. Mais il en faudra davantage si nous ne sommes pas retenus dans le programme Horizon 2020.
Si, comme je le crains, le texte n’est pas adopté en commission, nous le soutiendrons néanmoins dans l’hémicycle, car la discussion doit se poursuivre, tant que nous n’aurons pas trouvé de solution. Il nous reste une semaine pour chercher des réponses consensuelles.
Je suis prêt, cependant, à retirer ma PPL, après avoir consulté le président de mon groupe, si la conférence des présidents propose d’inscrire un texte sur ce sujet en février ou mars.
Mme la présidente Catherine Lemorton. La conférence des présidents ne crée pas de jurisprudence de ce type. Lorsque le texte sera examiné dans l’hémicycle, nous aurons tout loisir de nous entretenir avec la ministre, mais je suggère au rapporteur de se mettre d’ores et déjà en rapport avec elle.
M. Arnaud Richard. Une autre solution serait que la Commission vote le texte à l’unanimité pour obliger le Gouvernement à prendre position.
M. Jean-Pierre Door. Tous les groupes sont d’accord pour que le débat ait lieu. Des propositions ont été faites de part et d’autre. Mme Delaunay considère qu’on peut faire avancer la recherche oncologique pédiatrique. De notre côté, nous avons formulé des propositions en matière de financement. La ministre nous répondra dans l’hémicycle. En attendant, pour éviter que la suppression de l’article 1er soit mal interprétée, je demande à Mme Delaunay de retirer son amendement.
M. le rapporteur. Je me suis rapproché du ministère de la santé, ce qui était mon rôle. J’ai demandé – en vain – à auditionner le directeur général de la santé. À mon sens, l’administration sous-estime l’importance du problème.
Même si une PPL n’est pas adoptée, elle peut donner lieu à une déclaration du Gouvernement. En tout cas, je juge indispensable que les parlementaires marquent leur volonté d’avancer sur un sujet resté trop longtemps au point mort.
J’ai rencontré en revanche les représentants de l’INCa, qui m’ont semblé ouverts au fléchage. Quoi qu’il en soit, nous ne pouvons pas laisser les choses en l’état. Nous avons tous été sensibles à cette cause. Il faut agir vite.
La Commission adopte l’amendement AS1.
L’article 1er est ainsi supprimé.
En conséquence, les amendements AS6, AS4 et AS5 du rapporteur sont désormais sans objet.
Article 2
(art. L. 6162-4 du code de la santé publique)
Protocole particulier en faveur des enfants ou adolescents
de moins de 18 ans atteints d’un cancer
Cet article vise à améliorer les conditions de prise en charge médicale des enfants et jeunes de moins de 18 ans en inscrivant dans le code de la santé publique la faculté de bénéficier d’un protocole relatif au traitement de la pathologie dont sont atteints ces enfants ou adolescents.
1. Compléter le code de la santé publique
Dans sa rédaction actuelle, le code de la santé publique comprend un chapitre relatif aux centres de lutte contre le cancer (chapitre II du titre IV du livre Ier de la sixième partie du code). Personnes morales de droit privé, ces centres concentrent les moyens scientifiques permettant la prise en charge et le suivi des malades atteints de cancer. En particulier, l’alinéa unique de l’article L. 6162-4 prévoit que chaque centre dispose « d’une organisation pluridisciplinaire garantissant une prise en charge globale du patient et comprenant au moins des moyens en chirurgie, oncologie médicale, radiothérapie et anatomo-cyto-pathologie ».
Ces dispositions concernent tous les patients relevant de ces centres, quel que soit leur âge. Si elles garantissent l’examen et le suivi de leur situation par une équipe disciplinaire, la définition d’un protocole de prise en charge s’adressant notamment aux patients souffrant de cancers orphelins n’est pas strictement garantie. La démarche motivant cet article 2 vise précisément à conférer une valeur législative à la définition de ces protocoles.
2. Les protocoles de prise en charge
Lorsqu’un patient est atteint d’un cancer, la prise en charge médicale dont il bénéficie varie selon la pathologie détectée et l’environnement dans lequel elle s’est développée, s’agissant notamment de l’âge du patient. Dans la plupart des cas, il existe des traitements standards que dosent et adaptent les équipes médicales.
Cependant, il arrive aussi que le traitement du patient nécessite une prise en charge ne correspondant pas aux « cases » à dispositions. C’est le cas notamment des enfants souffrant de cancers dits « orphelins », l’état d’avancement des connaissances scientifiques, lié il est vrai au faible nombre de cas détectés chaque année, n’ayant pas toujours permis d’identifier et de valider un traitement standard. Dans ces cas, la France a fait le choix de prévoir la définition de protocoles adaptant l’état de la science au cas médical. Il s’agit d’administrer des molécules non encore mises sur le marché pour cet usage mais ayant fait leurs preuves par ailleurs compte tenu notamment des données épidémiologiques récoltées au niveau national par les centres de lutte contre le cancer, mais également au niveau européen, les équipes médicales échangeant régulièrement leurs données et analyses.
Ces protocoles sont définis au cas par cas, le plus souvent possible, sans toutefois que cette démarche réponde à une obligation légale définie sur le plan national et soit donc systématisée.
3. Garantir la définition d’un protocole pour chaque patient âgé de moins de 18 ans
Cet article propose de compléter la rédaction de l’article L. 6162-4 du code de la santé publique en y insérant un deuxième alinéa. La rédaction proposée vise à garantir par la loi la définition d’un protocole « particulier », garantissant la plus grande individualisation possible de la prise en charge.
Il s’agit de prendre en compte les spécificités des publics mineurs (« un enfant ou un adolescent âgé de moins de 18 ans »). Concrètement, lorsque l’un d’entre eux sera hospitalisé, lui ou sa famille pourrait opposer aux centres cette faculté. Si, statistiquement, peu de personnes devraient être concernées (la plupart des malades traités pour un cancer rare étant l’objet dans les faits d’un tel protocole), cette disposition bénéficiera à tous les patients atteints de cancer, fût-ce dans des situations où l’avancement de la recherche laisse les équipes médicales relativement démunies.
Le jeune mineur et ses responsables légaux seront ainsi informés des protocoles en vigueur et pourront demander aux équipes médicales de définir un protocole de prise en charge le plus individualisé possible.
*
* *
La Commission en vient à l’amendement AS2 de Mme Michèle Delaunay.
Mme Michèle Delaunay. Défendu.
M. le rapporteur. Avis défavorable.
La Commission adopte l’amendement AS2.
En conséquence, l’article 2 est supprimé.
Article 3
(art. 575 et 575A du code général des impôts)
Compensation des pertes des éventuelles pertes de recette
pour les organismes de sécurité sociale
Cet article vise à prévoir un mécanisme de compensation d’éventuelles pertes de recettes pour les organismes de sécurité sociale. Il répond au cadre défini à l’article 40 de la Constitution.
Le dispositif proposé repose sur une augmentation à due concurrence des droits pesant sur les tabacs mentionnés aux articles 575 et 575 A du code général des impôts et qui concernent : les cigarettes, cigares, cigarillos, tabacs fine coupe destinés à rouler les cigarettes ainsi que les autres tabacs à fumer, priser et mâcher.
Il est très néanmoins peu probable que la mise en place d’une contribution d’un niveau faible sur les bénéfices de l’industrie pharmaceutique ait réellement un impact sur les recettes de l’assurance maladie. Si cela devait néanmoins se vérifier, il semble logique et cohérent de faire peser la compensation sur une activité contribuant significativement aux dépenses de prise en charge des pathologies cancéreuses.
*
* *
La Commission aborde l’amendement AS3 de Mme Michèle Delaunay.
Mme Michèle Delaunay. Défendu.
M. le rapporteur. Avis défavorable.
La Commission adopte l’amendement AS3.
En conséquence, l’article 3 est supprimé.
Mme la présidente Catherine Lemorton. Je rappelle que le texte sera examiné en séance publique le 27 novembre.
___
Dispositions en vigueur ___ |
Texte de la proposition de loi ___ |
Texte adopté par la Commission ___ |
Proposition de loi relative au financement de la recherche oncologique pédiatrique par l’industrie pharmaceutique |
Proposition de loi relative au financement de la recherche oncologique pédiatrique par l’industrie pharmaceutique | |
Article 1er |
Article 1er | |
Après l’article L. 245-6 du code de la sécurité sociale, il est inséré un article L. 245-6-1 ainsi rédigé : |
Supprimé Amendement AS1 | |
« Art. L. 245-6-1. – Il est institué au profit de l’Institut national du cancer, aux fins de financer des actions spécifiques de recherche indépendante dans la lutte contre les cancers pédiatriques, une contribution versée par les entreprises assurant l’exploitation en France, au sens de l’article L. 5124-1 du code de la santé publique, d’une ou plusieurs spécialités pharmaceutiques donnant lieu à remboursement par les caisses d’assurance maladie en application des premier et deuxième alinéas de l’article L. 162-17 du présent code ou des spécialités inscrites sur la liste des médicaments agréés à l’usage des collectivités. |
||
« La contribution est assise sur le chiffre d’affaires hors taxes réalisé en France métropolitaine et dans les départements d’outre-mer au cours d’une année civile au titre des médicaments bénéficiant d’une autorisation de mise sur le marché et inscrits sur les listes mentionnées aux premier et deuxième alinéas de l’article L. 162-17 précité ou sur la liste mentionnée à l’article L. 5123-2 du code de la santé publique, à l’exception des spécialités génériques définies à l’article L. 5121-1 du même code, hormis celles qui sont remboursées sur la base d’un tarif fixé en application de l’article L. 162-16 du présent code et à l’exception des médicaments orphelins désignés comme tels en application des dispositions du règlement (CE) n° 141/2000 du Parlement européen et du Conseil, du 16 décembre 1999 concernant les médicaments orphelins. |
||
« Le taux de la contribution due au titre du chiffre d’affaires réalisé au cours des années 2013 et 2014 est fixé à 0,15 %. |
||
« Un rapport est remis chaque année au Parlement sur l’affectation et l’utilisation du produit de cette contribution par l’Institut national du cancer. |
||
« Les modalités d’application du présent article sont définies par décret en Conseil d’État. ». |
||
Code de la santé publique |
Article 2 |
Article 2 |
Art. L. 61624. – Chaque centre doit disposer d’une organisation pluridisciplinaire garantissant une prise en charge globale du patient et comprenant au moins des moyens en chirurgie, oncologie médicale, radiothérapie et anatomo-cyto-pathologie. |
L’article L. 6162-4 du code de la santé publique est complété par un alinéa ainsi rédigé : |
Supprimé Amendement AS2 |
« Lorsqu’un enfant ou un adolescent âgé de moins de dix-huit ans est traité pour un cancer, chaque cas peut faire l’objet d’un protocole particulier. » |
||
Article 3 |
Article 3 | |
La perte de recettes pour les organismes de sécurité sociale est compensée à due concurrence par la majoration des droits mentionnés aux articles 575 et 575 A du code général des impôts. |
Supprimé Amendement AS3 | |
Ø Ministère des affaires sociales, de la santé et des droits des femmes –Direction générale de la santé – Mme Catherine Choma, sous-directrice de la qualité des pratiques et des produits de santé, et M. Gilles Bignolas, chef du bureau des maladies chroniques somatiques à la sous-direction de la promotion de la santé et la prévention des maladies chroniques
Ø Table ronde associations cancer
– Institut national du cancer (INCa) – Pr Agnès Buzyn, présidente, Dr. Guy-Robert Auleley, directeur adjoint du pôle recherche & innovation, et Dr Natalie Hoog-Labouret, en charge du dossier oncopédiatrie
– Ligue contre le cancer – Mme Jacqueline Godet, présidente
– Fondation ARC pour la recherche sur le cancer – Mme Axelle Davezac, directrice générale
Ø Table ronde médecins et associations enfants
– Association Aidons Marina – Mme Stéphanie Ville, président
– Association EVA pour la vie – M. Stéphane Vedrenne, président, et M. Pascal Alt, président de l’association Cent pour sang la vie
– Dr Martin Hagedorn
– Dr Christophe Grosset
Ø Les entreprises du médicament (LEEM) (*) – M. Patrick Errard, président, M. Philippe Lamoureux, directeur général, Mme Muriel Carroll, directeur des affaires publiques, et Mme Catherine Lassale, directeur des affaires scientifiques
* Ce représentant d’intérêts a procédé à son inscription sur le registre de l’Assemblée nationale, s’engageant ainsi dans une démarche de transparence et de respect du code de conduite établi par le Bureau de l’Assemblée nationale.
ANNEXE N° 2 :
LISTE DES CANCERS PÉDIATRIQUES
(TOUCHANT LES PATIENTS DE MOINS DE 14 ANS) :
Les données ci-après sont fournies à titre d’illustration à partir des éléments publiés sur le site e-cancer.fr de l’INCa.
– Leucémie : C’est le cancer le plus courant chez les enfants en France. Cette affection des globules sanguins représente près du tiers des cancers pédiatriques (29 %) en Europe, en Amérique et en Asie. Le type prédominant est la leucémie lymphoblastique aiguë (80 % des cas) qui affecte les cellules de la moelle osseuse produisant les lymphocytes. On en dénombre environ 450 nouveaux cas par an.
– Tumeurs du système nerveux central : Ces tumeurs, qui touchent le cerveau et la moelle épinière, sont la deuxième forme de cancer pédiatrique la plus courante dans les pays développés (24 % des cas).
– Lymphomes : Les lymphomes sont des tumeurs des ganglions lymphatiques. Ils représentent le troisième type de cancer le plus courant chez l’enfant dans les pays développés (11 % des cas). Le lymphome hodgkinien y est plus courant, alors que le lymphome de Burkitt représente la moitié de tous les lymphomes en Afrique.
– Neuroblastome : Le neuroblastome est une tumeur maligne développée au niveau du système nerveux sympathique. Cette forme de cancer survient plus chez le nourrisson et le très jeune enfant, dans les pays développés.
– Rétinoblastome : Survenant dès les premières années de la vie, le rétinoblastome est une tumeur maligne de la rétine, le tissu nerveux de l’œil. La moitié environ des cas sont à caractère héréditaire. En Europe, en Amérique du Nord et en Australie, ce cancer représente près de 4 % de toutes les formes de tumeurs chez l’enfant.
– Cancer du rein : Chez l’enfant, le type de cancer du rein le plus fréquent est la tumeur de Wilms (95 %), qui touche essentiellement l’enfant de moins de cinq ans.
– Tumeurs des os : Les tumeurs des os recouvrent notamment l’ostéosarcome (50 %), le chondrosarcome et le sarcome d’Ewing (35 %). Ces cancers représentent environ 3 à 5 % des cancers pédiatriques.
– Sarcomes des tissus mous : Le rhabdomyosarcome est une tumeur maligne du muscle strié (les muscles reliant les os et permettant le mouvement). C’est un sarcome des tissus mous typique chez l’enfant, avec deux tiers des cas survenant avant l’âge de dix ans. Autre cancer, le sarcome de Kaposi provoqué par le virus de l’herpès se caractérise par des lésions multiples principalement sur la peau.