

Document mis en distribution le 1er octobre 2003 N° 1092 (3ème partie) ______ ASSEMBLÉE NATIONALE CONSTITUTION DU 4 OCTOBRE 1958 DOUZIÈME LÉGISLATURE Enregistré à la Présidence de l'Assemblée nationale le 25 septembre 2002. RAPPORT FAIT AU NOM DE LA COMMISSION DES AFFAIRES CULTURELLES, FAMILIALES ET SOCIALES SUR LE PROJET DE LOI (n° 877) relatif à la politique de santé publique, PAR M. Jean-Michel DUBERNARD Député. -- Santé et protection sociale. NTRODUCTION I.- LA POLITIQUE DE SANTÉ PUBLIQUE, LE RETOUR D'UNE POLITIQUE PUBLIQUE DÉLAISSÉE ? A. L'HISTOIRE DE LA POLITIQUE DE SANTÉ PUBLIQUE EN FRANCE A ÉTÉ MARQUÉE PAR UN RÉCENT RENOUVEAU B. LES PARTICULARITÉS FRANÇAISES DEMEURENT II. - LA DÉFINITION DE LA POLITIQUE NATIONALE DE SANTÉ PUBLIQUE : PLUS SIMPLE, PLUS EFFICACE, PLUS TRANSPARENTE A. LA SANTÉ PUBLIQUE EST UN DEVOIR D'ÉTAT B - UNE NOUVELLE ORGANISATION RÉGIONALE EST MISE EN PLACE : EN ATTENDANT L'AGENCE RÉGIONALE DE SANTÉ ? III.- LE CAP DE LA POLITIQUE DE SANTÉ PUBLIQUE EST FIXÉ POUR 2004-2008 A. LES PROGRAMMES DE SANTÉ POUR 2004 - 2008 FORMERONT LE CADRE DE L'ACTION PUBLIQUE EN MATIERE DE SANTÉ PUBLIQUE 1. Les objectifs de santé publique sont inscrits au rapport annexé au projet de loi B. LES OUTILS ÉTATIQUES DE LA SANTÉ PUBLIQUE DOIVENT ÊTRE MODERNISÉS ET LA PRÉVENTION ENCOURAGÉE C. LA FORMATION DES ACTEURS EN SANTÉ EST RÉNOVÉE IV.- LE RÉGIME DES RECHERCHES BIOMÉDICALES EST MODERNISÉ A. UN DOUBLE IMPÉRATIF INSPIRE LA RÉFORME B. le cadre juridique est plus protecteur TRAVAUX DE LA COMMISSION I.- AUDITION DU MINISTRE III.- EXAMEN DES ARTICLES TITRE 1ER : POLITIQUE DE SANTÉ PUBLIQUE CHAPITRE IER : Champ d'application et conditions d'élaboration CHAPITRE II : Objectifs et plans régionaux de santé publique TITRE II : INSTRUMENTS D'NTERVENTION CHAPITRE IER : Institutions et organismes CHAPITRE II : Programmes de santé et dispositions de prévention CHAPITRE III : Prévention et gestion des menaces sanitaires graves CHAPITRE IV : Systèmes d'information TITRE III : OBJECTIFS ET MISE EN œUVRE DES PLANS NATIONAUX Chapitre 1er : Rapport d'objectifs CHAPITRE II : Cancer et consommation à risque 3EME PARTIE DU RAPPORT CHAPITRE III Santé et environnement 5 Article additionnel avant l'article 20 6 Après l'article 20 9 Article additionnel avant l'article 21 9 Article additionnel après l'article 21 11 Article additionnel après l'article 21 11 Article additionnel après l'article 23 14 Article additionnel après l'article 23 14 Article additionnel avant l'article 31 23 Article additionnel après l'article 32 26 Après l'article 32 26 Article 33 27 Article 34 29 Article 35 31 Article 36 32 Article 37 33 Article 38 (article L. 1334-12, articles L. 1336-1 à L. 1336-9, articles L. 1337-1 à L. 1337-9, articles L. 1335-3-1 à L. 1335-3-5, articles L. 1336-1 à L. 1336-5 du code de 39 la santé publique) 39 Article 39 40 TITRE IV RECHERCHE ET FORMATION EN SANTÉ 40 Chapitre Ier Ecole des hautes études en santé publique 40 Chapitre II Recherches biomédicales 43 Article 42 44 L'article L. 1123-9 du code de la santé publique, réécrit par le IX de cet article, précise qu'après le commencement de la recherche, toute modification substantielle de celle-ci à l'initiative du promoteur est soumise au préalable à l'avis favorable du comité et à l'autorisation de l'autorité compétente. Il s'agit essentiellement de transposer les dispositions prévues par l'article 10 de la directive n° 2001-20 précitée. 69 Les articles L. 1123-10 et L. 1123-11 du code de la santé publique, insérés par le X de cet article, visent à renforcer le suivi des recherches biomédicales, qui constitue un élément essentiel de la protection des personnes. 69 Actuellement, le promoteur est tenu d'informer l'autorité administrative compétente, dès qu'il en a connaissance, de : 69 - tout effet ayant pu contribuer à la survenue d'un décès, provoquer une hospitalisation ou entraîner des séquelles organiques ou fonctionnelles durables et susceptibles d'être dues à la recherche ; 69 - de transmettre toute information relative à un fait nouveau concernant le déroulement de la recherche lorsque ce fait nouveau est susceptible de porter atteinte à la sécurité des personnes qui se prêtent à la recherche ; 69 - et l'informer enfin de tout arrêt prématuré de la recherche en indiquant le motif de cet arrêt. 69 L'article L. 1123-12 du même code, inséré par le XI de cet article, a pour objet de préciser la réparation des compétences entre l'AFSSAPS et le ministre chargé de la santé, qui demeure inchangée. 70 Enfin, le XII de cet article modifie par cohérence les dispositions prévues par l'actuel article L. 1123-11 du code de la santé publique - devenu l'article L. 1123-14 nouveau du même code - qui renvoie à un décret le soin de fixer les modalités d'application de ce chapitre. 70 Article additionnel après l'article 45 73 Article additionnel après l'article 45 73 Article 46 73 CHAPITRE III Formation médicale continue 79 Article 51 79 Après l'article 51 83 TABLEAU COMPARATIF TABLEAU COMPARATIF (SUITE) ANNEXE AU TABLEAU COMPARATIF AMENDEMENTS NON ADOPTÉS PAR LA COMMISSION ANNEXES LISTES DES PERSONNES AUDIONNÉES GLOSSAIRE Article 19 (articles L. 1312-1 et L. 1312-2 du code de la santé publique) Plan national de prévention des risques pour la santé liés à l'environnement Cet article propose la mise en place d'un plan national d'action aux fins de prévenir les risques sanitaires liés à l'environnement. L'absence d'anticipation et de planification des actions pour lutter contre les pollutions, notamment de l'eau de l'air et de certains milieux professionnels, ayant un impact sur la santé, a été dénoncée par le rapport annuel 2003 de l'IGAS (1). Par ailleurs la France, à l'instar de 51 autres pays européens dans le cadre de la conférence de Londres en 1999 sur la santé et l'environnement, s'est engagée à développer des plans de santé environnementale. L'un des mérites attendus d'une telle démarche devrait être le renforcement des relations entre les acteurs de la santé et de l'environnement. La pertinence du niveau régional pour traiter les problèmes de santé publique est particulièrement évidente en matière de risques environnementaux. Les priorités à définir et les outils à mettre en place peuvent varier d'une région à l'autre en fonction du niveau d'urbanisation, de la nature et de l'intensité des activités industrielles, agricoles et des transports. Un relais régional de la planification interministérielle est donc nécessaire. Le I de l'article vise à déplacer les actuelles dispositions du chapitre II (« Dispositions pénales ») du titre Ier du livre III intitulé « Protection de la santé et environnement » de la première partie du code de la santé publique, vers un nouveau chapitre III du même titre. Les dispositions des articles L. 1312-1 et L. 1312-2 de l'actuel chapitre II deviennent les articles L. 1313-1 et L. 1313-2 du chapitre III. Le II de l'article introduit les dispositions relatives au plan de santé environnementale au chapitre II du titre Ier du livre III de la première partie du code de la santé publique. Il est proposé d'intituler le chapitre II : « Plan national de prévention des risques pour la santé liés à l'environnement ». L'article L. 1312-1 du code la santé publique, tel que proposé, prévoit que le plan national d'action est élaboré et révisé tous les cinq ans. L'article L. 1312-2 organise la déclinaison du plan national en matière de prévention des risques pour la santé liés à l'environnement, au niveau régional. Les modalités des actions au niveau régional se dérouleront selon la procédure instaurée à l'article 2 du présent projet de loi pour les plans régionaux de santé publique, en application des nouveaux articles L. 1411-11 et L. 1411-12 du code de la santé publique. Le représentant de l'Etat dans les régions et dans les collectivités territoriales de Corse et de Saint-Pierre-et-Miquelon arrête, après consultation du comité régional de santé publique, et met en œuvre le programme d'actions pluriannuel propre à son territoire. Pour la mise en œuvre des programmes le préfet s'appuie sur le groupement régional de santé publique, organe de coordination des nombreux acteurs régionaux dans le champ de la santé, créé par l'article 5 du présent projet (article L. 1411-14 du code de la santé publique). Il peut également, par voie de convention, faire appel à tout organisme compétent pour mettre en œuvre des actions particulières. Les plans régionaux de prévention des risques pour la santé liés à l'environnement devront faire l'objet d'une évaluation. Le comité régional de santé publique visé à l'article L. 1411-12 nouveau, qui remplace à la fois le comité régional des politiques de santé et le conseil régional de santé, sera tenu régulièrement informé de l'état d'avancement du plan régional en matière de prévention des risques environnementaux pour la santé et des évaluations qui en sont faites. * La commission a adopté un amendement de cohérence présenté par le rapporteur ainsi qu'un amendement de renumérotation du même auteur. La commission a examiné un amendement du rapporteur et de M. Denis Jacquat visant à mettre en place des plans locaux de solidarité renforçant la veille sanitaire locale. M. Denis Jacquat a précisé que cet amendement résulte des travaux de la mission d'information sur la canicule. M. René Couanau, président, s'est interrogé sur les conditions de prise en charge financière de cette proposition et a souligné la nécessité de prévoir des transferts de recettes pour sa mise en œuvre. En outre, cette proposition ne semble pas cohérente avec les compétences actuelles des communes. M. Jean-Marie Le Guen s'est également déclaré défavorable à cet amendement, qui semble en contradiction avec la philosophie générale de la loi. Reconnaissant la nécessité d'approfondir la question, le rapporteur a retiré son amendement. La commission a adopté l'article 19 ainsi modifié. Article additionnel avant l'article 20 (article L 1413-2 du code de la santé publique) Missions de l'Institut national de veille sanitaire La commission a rejeté un amendement de M. Maxime Gremetz, visant à mettre en place un plan national de prévention des risques pour la santé liés au travail. La commission a adopté un amendement de Mme Martine Billard tendant à inclure dans les missions de l'InVS la centralisation des statistiques en matière d'accidents du travail et de maladies professionnelles, le rapporteur ayant exprimé un avis favorable. La commission a rejeté un amendement de M. Jean-Marie Le Guen visant à créer une Agence nationale de la santé au travail, organisme indépendant. Article 20 (article L. 1413-4 du code de la santé publique) Renforcement de la surveillance épidémiologique dans les milieux du travail La spécificité et la complexité de la prévention des risques sanitaires au travail nécessitent l'organisation d'un dispositif de connaissance de ces risques qui n'est pas actuellement à la hauteur des enjeux. Dans son rapport annuel 2003, l'IGAS parle d'un mur qui sépare la santé au travail de la santé publique. Outre la faiblesse de la recherche dans le domaine de la prévention des risques professionnels, les liens entre les services de la médecine du travail et les pôles d'expertise et de surveillance épidémiologique sont ténus. L'évolution accélérée des processus de travail et l'apparition permanente de nouveaux produits nécessitent la mise en place d'un système coordonné de veille scientifique, sanitaire et sociale. L'efficacité de la prévention en matière de risques professionnels dépend de leur repérage précoce et donc de la possibilité d'obtenir de très larges informations de terrain. Le Haut comité de la santé publique (HCSP), dans un document de synthèse (2) de décembre 2002, relève de façon préoccupante une sous-reconnaissance globale des maladies professionnelles, notamment en ce qui concerne les cancers d'origine professionnelle. Le HCSP considère que l'une des conséquences de cette sous-estimation des étiologies professionnelles est l'insuffisance de la prévention en milieu du travail. Le présent article propose de compléter l'article L. 1413-4 du code de la santé publique consacré au fonctionnement de l'Institut de veille sanitaire (InVS), afin de faciliter ses moyens d'accès aux informations sanitaires concernant les entreprises publiques ou privées. L'InVS dispose d'un département « santé-travail » dont les programmes en cours portent sur l'amiante, les troubles musculo-squelettiques (lombalgies) et les maladies professionnelles (notamment les cancers). Ce département a besoin pour développer ses activités d'une grande coopération avec les différents acteurs du champ de la santé au travail et aussi avec les acteurs en entreprise. Il aurait besoin également de voir ses moyens humains et matériels renforcés. La rédaction actuelle de l'article L. 1413-4 comporte un second alinéa qui mentionne que les services de médecine du travail fournissent à l'InVS les informations nécessaires à l'exercice de ses missions. Si cette disposition permet à l'institut d'accéder aux données sanitaires détenues par la médecine du travail, elle laisse de côté les données relatives aux facteurs de risques (physiques, chimiques, organisationnels...) et à l'exposition des salariés à ces risques. Une réelle surveillance épidémiologique dans les milieux du travail suppose évidemment de disposer de l'ensemble des informations permettant de faire le lien entre les pathologies constatées et les facteurs de risques susceptibles d'en être la cause. La modification consiste à insérer un alinéa donnant à l'institut un accès direct aux informations détenues par les entreprises publiques et privées, nécessaires à l'amélioration de la connaissance et de la prévention des risques en milieu de travail. Les entreprises devront désormais fournir à l'InSV les « informations nécessaires à l'exercice de ses missions ». De son coté l'institut devra contribuer à la mise en place dans les entreprises de surveillances épidémiologiques. Il convient de s'interroger sur la nature exacte des informations que les entreprises devront fournir à l'institut, selon quelle procédure et quelle périodicité. Le code du travail (art. L. 230-2 III a) met a la charge du chef d'établissement l'obligation d'évaluer les risques pour la santé et la sécurité des travailleurs inhérents aux procédés de fabrication, aux équipements de travail, aux substances manipulées ainsi qu'à l'aménagement et au réaménagement des lieux et des postes de travail. La mise en œuvre de cette obligation prend la forme d'un document unique décrit à l'article R. 230-1 du code du travail qui contient l'inventaire des risques identifiés dans chaque unité de travail de l'entreprise, mis à jour annuellement. Ce document est tenu à la disposition du comité d'hygiène, de sécurité et des conditions de travail de l'entreprise, des délégués du personnel, du médecin du travail et de l'inspecteur du travail. Afin de ne pas alourdir la tâche des entreprises, il est souhaitable que ce document unique constitue la base des informations qui devront être fournies à l'InSV. Mais c'est probablement insuffisant pour la mise en place d'une véritable surveillance épidémiologique. Le rôle de l'institut devrait se situer en amont de l'établissement du document relatif à l'évaluation des risques pour la santé des travailleurs, aux fins d'améliorer et d'harmoniser la collecte des données susceptibles d'orienter la surveillance et de prévenir les pathologies. L'évaluation des risques en entreprise est une démarche très récente initiée par une directive européenne(3). Le document unique visé ci-dessus, introduit par un décret du 5 novembre 2001 (4), fait encore l'objet de beaucoup d'interrogations de la part de nombre d'entreprises. Ce contexte justifie largement l'apport méthodologique et scientifique de l'InVS. Un décret pourrait utilement préciser et délimiter le rôle et la place de l'institut dans l'élaboration du document unique relatif à l'évaluation des risques pour la santé des travailleurs qui doit obligatoirement être établi par les entreprises. * La commission a rejeté un amendement de M. Jean-Luc Préel prévoyant que les entreprises fournissent à l'InVS le document unique relatif à l'évaluation des risques pour la santé et la sécurité des travailleurs prévu à l'article R. 230-1 du code du travail, le rapporteur ayant indiqué que ce document n'est pas suffisamment détaillé pour une véritable surveillance épidémiologique. La commission a rejeté un amendement de Mme Jacqueline Fraysse visant à confier aux comités d'hygiène de sécurité et des conditions de travail (CHSCT) la surveillance épidémiologique en milieu de travail. La commission a ensuite adopté l'article 20 sans modification. La commission a rejeté neuf amendements de Mme Martine Billard tendant à introduire dans le code du travail diverses dispositions relatives à la politique de santé au travail ainsi qu'un amendement de même nature de Mme Jacqueline Fraysse, le rapporteur ayant estimé qu'il n'appartient pas au présent projet de loi de modifier le droit du travail. Article additionnel avant l'article 21 (article L. 1321-1 du code de la santé publique) Interdiction d'utiliser de l'eau impropre à la consommation dans la chaîne alimentaire La commission a adopté un amendement du rapporteur visant à interdire l'utilisation d'eau « impropre à la consommation » plutôt que l'utilisation d'eau « non potable » dans les préparations destinées à la consommation humaine. Article 21 (article L. 1321-2 du code de la santé publique) Protection des captages d'eau destinée à l'alimentation des collectivités humaines Le présent article vise à accélérer et à généraliser la mise en œuvre de la protection des captages d'eau potable, d'une part en allégeant, dans certains cas, les conditions d'établissement de périmètres de protection autour des captages, d'autre part en supprimant la contrainte de la publication aux hypothèques des servitudes afférentes à ces périmètres. L'article L.1321-2 du code la santé publique assure la protection de la qualité des eaux destinées à l'alimentation des collectivités humaines en créant des périmètres de protection autour des captages, afin d'écarter du point d'eau les sources potentielles de pollution chronique ou accidentelle. Il a été modifié à deux reprises. La loi du 16 décembre 1964 (5) a rendu obligatoire un acte déclaratif d'utilité publique pour les nouveaux travaux de prélèvement d'eau destinée à l'alimentation humaine et la détermination de trois niveaux de protection (immédiate, rapprochée et éloignée) autour du point de prélèvement, associés à des contraintes spécifiques. La loi du 3 janvier 1992 (6) a étendu cette obligation aux ouvrages existant avant la loi de 1964, sauf pour les captages bénéficiant d'une protection naturelle efficace, et fixé un délai de cinq ans pour la mise en œuvre des procédures d'autorisation. La procédure d'établissement des périmètres de protection des captages désignés dans l'acte déclaratif d'utilité publique, s'est avérée longue et lourde. Dans son rapport d'évaluation de la politique de préservation de la ressource en eau destinée à la consommation humaine(7), le Conseil national de l'évaluation constate un retard considérable dans la mise en place des périmètres de protection. En 1997, c'est-à-dire à l'expiration du délai fixé par la loi de 1992, 30,8% seulement des captages avaient des périmètres de protection déterminés par un arrêté déclaratif d'utilité publique. Parmi les autres, il y en avait moins de la moitié pour lesquels la procédure était engagée. Le Conseil national d'évaluation attribue ce retard à un alourdissement excessif des procédures dans lesquelles nombre de maires hésitent à s'engager. Les améliorations proposées prennent en compte la grande diversité des situations des lieux de captage en fonction de l'importance des prélèvements, du contexte géologique et de la présence ou non dans l'environnement d'activités polluantes, pour introduire des procédures simplifiées et limiter les prescriptions. Le I de l'article propose d'introduire, après le premier alinéa de l'article L. 1321-2 du code la santé publique, deux alinéas visant à améliorer la protection des captages. Le premier alinéa propose, lorsque les conditions hydrologiques et hydrogéologiques le permettent, le recours à une procédure simplifiée ne prescrivant qu'un périmètre de protection immédiate. La décision de limiter ainsi les mesures de protection appartiendra au préfet, auteur de la déclaration d'utilité publique, après avis d'experts hydrogéologues agréés. Rappelons que le périmètre de protection immédiate s'étend généralement dans un rayon de quelques dizaines de mètres autour du point de captage. Les terrains concernés doivent obligatoirement être acquis en pleine propriété par la commune et les seules activités autorisées sur ce périmètre sont celles liées au prélèvement de l'eau. Le second alinéa a pour objet la généralisation du système de protection des lieux de prélèvements sur l'ensemble du territoire. En effet, la seconde loi sur l'eau de 1992 impose l'obligation d'une protection immédiate et rapprochée à tous les captages y compris ceux antérieurs à 1964, à l'exception de ceux bénéficiant d'une « protection naturelle ». Cette caractéristique plutôt floue, dépendant de critères géologiques et hydrologiques, a comme principale conséquence de maintenir hors du champ d'application des normes de protection un certain nombre de captages anciens. La disposition proposée consiste donc à étendre l'obligation d'instituer un périmètre de protection immédiate aux captages existant à la date de publication de la première loi sur l'eau (18 décembre 1964) qui bénéficient d'une protection naturelle. Un délai de cinq ans à compter de la publication du présent projet est accordé pour l'aboutissement de la procédure de régularisation. Le II de l'article s'efforce de lever un autre obstacle à la mise en œuvre des périmètres de protection. Il introduit, après le deuxième alinéa devenu le quatrième de l'article L. 1321-2 du code la santé publique, un alinéa visant à supprimer la publication au bureau des hypothèques des servitudes qui grèvent les terrains compris dans les périmètres de protection. Le texte proposé indique qu'un décret en Conseil d'Etat précisera le mode de publication qui s'appliquera désormais aux arrêtés de déclaration d'utilité publique déterminant les périmètres de protection. La lourdeur de la publication des servitudes aux hypothèques a été dénoncée tant par le Conseil national d'évaluation que par l'Office parlementaire d'évaluation des choix scientifiques et technologiques dans son rapport sur la qualité de l'eau (8). Cette lourdeur et le coût, souvent prohibitif pour les communes, de cette formalité contribuent à paralyser les procédures d'autorisation de captages. Il convient de préciser que les servitudes d'utilité publique font d'ores et déjà l'objet d'une publicité en mairie et sont annexées aux plans locaux d'urbanisme. Par ailleurs le Conseil d'Etat a jugé (9) que la non-publication au bureau des hypothèques d'une servitude grevant un immeuble est sans incidence sur l'opposabilité de l'arrêté la prescrivant. * La commission a rejeté deux amendements de Mme Martine Billard tendant respectivement à inscrire le principe de prévention des risques dans les dispositifs de protection des captages d'eau dans les cas où existe une vulnérabilité spécifique et à supprimer le délai prévu pour établir les périmètres de protection des captages bénéficiant d'une protection naturelle. La commission a ensuite adopté l'article 21 sans modification. Article additionnel après l'article 21 (article L. 1321-3-1 du code de la santé publique) Dérogations au statut de fermage dans les périmètres de protection rapprochée des captages d'eau La commission a adopté un amendement du rapporteur visant à autoriser des dérogations au statut de fermage dans les périmètres de protection rapprochée des captages d'eau et à accorder aux collectivités un droit de préemption sur les terrains concernés. La commission a ensuite rejeté deux amendements de Mme Martine Billard le premier visant à encadrer de manière restrictive le champ d'application des servitudes de protection après que le rapporteur a indiqué que cette préoccupation est satisfaite par le texte, le second dotant le préfet de pouvoirs réglementaires élargis ce qui relève davantage du futur projet de loi sur l'eau. Article additionnel après l'article 21 (article L. 1321-3-1 du code de la santé publique) Réalisation d'un bilan de l'effectivité des périmètres de protection La commission a en revanche adopté un amendement de Mme Martine Billard donnant compétence au préfet pour faire réaliser aux frais de la collectivité territoriale un bilan de l'effectivité des périmètres de protection. Article 22 (article L. 411-2 du code rural) Inapplicabilité du statut du fermage sur les terrains situés dans les périmètres de protection des captages d'eau Le présent article complète le précédent dans le renforcement de la protection des captages d'eau destinée à l'alimentation des collectivités humaines. Il s'agit de limiter ou de mieux encadrer les activités agricoles sur les terrains inclus dans les périmètres de protection déterminés par un arrêté déclaratif d'utilité publique. Rappelons que, si dans le périmètre de protection immédiate toute activité autre que l'entretien du point de captage est interdite, dans le périmètre de protection rapprochée ou de protection éloignée les activités économiques peuvent être réglementées mais pas nécessairement interdites. En l'état actuel du droit, la collectivité qui souhaite imposer, par convention spécifique à un exploitant agricole installé dans un périmètre de protection, des conditions restrictives à son activité qui iraient au-delà des servitudes instaurées par la déclaration d'utilité publique ne peux le faire car le statut de fermage est une disposition d'ordre public qui prévaut sur toute convention particulière. Il semble donc justifié de prévoir que les dispositions du statut du fermage ne seront pas applicables aux conventions portant sur l'utilisation des terrains acquis par les collectivités au voisinage des captages d'eau. Il est en conséquence proposé d'ajouter cette exception à l'article L.411-2 du code rural qui énumère les conventions auxquelles le statut du fermage n'est pas applicable. * La commission a adopté un amendement de suppression de cet article présenté par le rapporteur. En conséquence un amendement de Mme Martine Billard est devenu sans objet. La commission a donc supprimé l'article 22. Article 23 (article L. 1321-4 du code de la santé publique) Surveillance et obligations relatives à la qualité des eaux destinées à la consommation humaine Le présent article propose de réécrire l'article L. 1321-4 du code de la santé publique en énumérant avec précision les obligations auxquelles sont tenues les responsables de la production et de la distribution de l'eau destinée à la consommation humaine. Par ailleurs, il confère au préfet le pouvoir d'intervenir pour faire cesser un risque grave pour la santé publique localisé dans une installation privée. L'actuel article L. 1321-4 met à la charge du concessionnaire responsable de la distribution d'eau potable une simple obligation générale de vérification de la qualité de l'eau. De surcroît, cette obligation incombe au seul concessionnaire et donc la responsabilité de la collectivité concédante, en cas de pollution, n'est pas mentionnée même si le concessionnaire peut se retourner contre elle en cas de négligence ayant provoqué un dommage. Un jugement du tribunal administratif de Rennes du 2 mai 2001 a ainsi reconnu que la responsabilité de l'Etat était engagée pour la mauvaise qualité de l'eau distribuée par un concessionnaire. Par ailleurs, le décret 2001-1220 du 20 décembre 2001 qui a transposé la directive du 3 novembre 1998 (10) renforce et précise de façon très détaillée, mais un peu confuse, les exigences relatives à la distribution d'eau potable, les modalités de la surveillance et les références de qualités requises. L'actuelle rédaction de l'article L. 1321-4 du code de la santé publique n'est pas en phase avec le décret visé ci-dessus, le texte de loi se trouvant très en retrait, tant en ce qui concerne le champ des obligations dont l'inobservation peut entraîner de graves conséquences pour la santé qu'en ce qui concerne les personnes responsables. De plus le présent projet de loi propose (article 31) d'incriminer le manquement à certaines obligations relatives au traitement de l'eau et d'aggraver les sanctions pénales se rapportant à l'ensemble des infractions visées. Une clarification législative des obligations et des personnes responsables s'impose donc. Le I de l'article L. 1321-4 nouveau du code de la santé publique précise d'abord le champ des responsabilités. Toute personne privée ou publique responsable d'une production ou d'une distribution d'eau au public, quelle que soit la nature du réseau, est concernée. Ensuite l'alinéa énumère six obligations, explicitées par le décret du 20 décembre 2001, à la charge de ces responsables : 1°) Surveiller la qualité de l'eau qui doit rester conforme aux critères réglementaires de consommation. 2°) Se soumettre au contrôle sanitaire organisé par les articles 11 à 18 du décret. 3°) Prendre toutes mesures correctives pour rétablir la qualité des eaux et en informer les consommateurs. Des mesures de restrictions d'utilisation ou d'interruption de distribution peuvent s'avérer nécessaires. 4°) N'employer que des produits et des procédés de traitement de l'eau et de nettoyage des installations qui ne sont pas susceptibles d'altérer la qualité de l'eau. Ces produits et ces procédés sont préalablement soumis à diverses autorisations, notamment du ministre chargé de la santé après avis de l'Agence française de sécurité sanitaire des aliments. 5°) Respecter les règles de conception et d'hygiène applicables aux installations de production et de distribution. Ces règles sont longuement énumérées par le décret du 20 décembre 2001. 6°) Se soumettre aux règles de restriction ou d'interruption en cas de risque sanitaire et assurer l'information et les conseils aux consommateurs. La personne privée ou publique responsable de la distribution doit, en cas de non-conformité de la qualité de l'eau, avertir le maire et le préfet territorialement compétent. Le II de l'article L.1321-4 introduit une disposition entièrement nouvelle qui répond, notamment, au risque sanitaire majeur lié à la présence de légionelles dans les réseaux de distribution d'eau. Cet alinéa permettra au préfet de faire cesser, par voie d'injonction, un risque grave pour la santé publique ayant pour origine une installation intérieure d'un domicile privé ne distribuant pas d'eau au public. En l'absence de ce pouvoir d'injonction, les services de l'Etat ne disposent d'aucun moyen juridique pour pénétrer dans les domiciles ou les locaux privés sans l'autorisation des propriétaires ou des occupants. * La commission a adopté un amendement du rapporteur soumettant aux mêmes obligations que les distributeurs d'eau au public les personnes privées responsables d'une production ou d'une distribution privée d'eau destinée à la consommation. La commission a ensuite rejeté un amendement rédactionnel de Mme Martine Billard et adopté un amendement du même auteur, précisant que l'obligation de restriction ou d'interruption en cas de risque sanitaire doit intervenir dans un délai proportionné à ce risque, ainsi qu'un amendement rédactionnel du rapporteur. La commission a adopté l'article 23 ainsi modifié. Article additionnel après l'article 23 (article L. 1321-5 du code de la santé publique) Coordination La commission a adopté un amendement de cohérence du rapporteur tendant à abroger l'article L. 1321-5 du code de la santé publique. En conséquence un amendement de Mme Martine Billard tendant à modifier cet article est devenu sans objet. Article additionnel après l'article 23 (article L. 1321-6 du code de la santé publique) Sanctions administratives La commission a adopté un amendement de Mme Martine Billard élargissant aux délégataires du service public de l'eau, le dispositif prévoyant la déchéance de la délégation en cas de condamnation pénale, le rapporteur ayant donné un avis favorable. Article 24 (article L. 1321-7 du code de la santé publique) Régime d'autorisation et de déclaration en matière d'eau potable Le décret 2001-1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine à l'exclusion des eaux minérales naturelles, mentionne que l'utilisation d'eau prélevée dans le milieu naturel en vue de la consommation humaine, par une personne privée ou publique est soumise à l'autorisation du préfet. Le décret décline par ailleurs les procédures d'autorisation. Le même décret prévoit également une obligation d'autorisation préfectorale pour les installations de conditionnement d'eau destinée à la consommation humaine. L'actuel article L. 1321-7 du code de la santé publique prévoit que l'embouteillage de l'eau destinée à la consommation publique ainsi que le captage et la distribution par un réseau d'adduction privé sont soumis à l'autorisation du représentant de l'Etat dans le département. Mais curieusement il n'existe en l'état actuel des textes, aucune base légale fixant un principe général d'autorisation pour toutes les formes d'opérations (captage, production, distribution, conditionnement...) en matière d'eau destinée à la consommation humaine. Le présent article propose de réécrire l'article L. 1321-7 afin d'harmoniser la diversité des situations constatées en leur appliquant une norme unique sous la forme d'une autorisation qui permettra de s'assurer que les installations de fabrication, d'emballage, d'entreposage, et de transport sont en mesure d'éviter tout risque de contamination. Le I de l'article L. 1321-7 proposé rappelle en premier lieu, qu'en application de la loi sur l'eau du 3 janvier 1992 (article L. 214-1 du code de l'environnement), une autorisation administrative est requise pour effectuer toutes les sortes de prélèvements ou de détournements sur les eaux superficielles ou souterraines. En second lieu, il propose de soumettre au même principe d'autorisation administrative toutes les formes d'utilisation de l'eau en vue de la consommation humaine à l'exception de l'eau minérale naturelle. Cette autorisation doit être obtenue, quelle que soit la qualité de l'opérateur (personne privée ou personne publique) pour les activités suivantes : 1°) La production. 2°) La distribution au public sous quelque forme que ce soit y compris la glace alimentaire. Le texte exclut de ces dispositions la distribution alimentée par un réseau de distribution « public ». Il s'agit d'une erreur d'écriture qui devra être rectifiée par amendement. L'exception visée est en réalité la distribution d'eau effectuée en bout de chaîne par des réseaux particuliers, comme c'est le cas pour les hôpitaux ou les complexes hôteliers. 3°) Le conditionnement et notamment l'embouteillage. Le II de l'article L. 1321-7 prévoit : 1°) une simple déclaration à l'autorité administrative compétente en cas d'extension ou de modification de faible importance des installations ayant fait préalablement l'objet de l'autorisation prévue au I de l'article. 2°) Une déclaration de même nature concernant la distribution d'eau par des réseaux particuliers alimentés par un réseau de distribution public, visée au 2°) du I de l'article, qui n'est pas soumise à autorisation mais doit faire l'objet d'une déclaration à l'autorité administrative, lorsque ces réseaux particuliers peuvent présenter un risque pour la santé publique. * Mme Martine Billard a retiré un amendement de réécriture de cet article. La commission a adopté deux amendements du rapporteur de cohérence et rédactionnel. La commission a ensuite adopté l'article 24 ainsi modifié. Article 25 (article L. 1321-10 du code de la santé publique) Modalités d'application des dispositions relatives à la sécurité sanitaire de l'eau destinée à l'alimentation humaine Le présent article vise à actualiser l'article L. 1321-10 du code de la santé publique compte tenu des modifications proposées aux articles L. 1321-2, L. 1321-4 et L. 1321-7. Les dispositions proposées prévoient qu'un décret en Conseil d'Etat déterminera les mesures d'application des obligations s'imposant aux distributeurs d'eau potable et les moyens de contrôler leur exécution. De même, les conditions dans lesquelles les dépenses du contrôle sanitaire seront à la charge de la personne publique ou privée responsable de la production, de la distribution ou de toute forme d'opération relative à l'eau potable seront fixées par décret. Il convient de rappeler que conformément à l'article L. 1321-9 du code la santé publique, les données sur la qualité de l'eau et les résultats des analyses réalisées dans le cadre du contrôle sanitaire sont publiques et communicables aux tiers. De plus, il appartient au préfet du département de communiquer régulièrement aux maires les données relatives à la qualité de l'eau distribuée. * La commission a adopté l'article 25 sans modification. Article 26 (article L. 1322-1 du code de la santé publique) Exploitation et commercialisation des eaux minérales naturelles L'eau minérale naturelle est une eau de source, conditionnée, qui doit répondre à des caractéristiques précises qui ont été fixées par la directive du 15 juillet 1980 (11) relative au rapprochement des législations des États membres concernant l'exploitation et la mise dans le commerce des eaux minérales naturelles. Outre son origine souterraine qui doit la mettre à l'abri de tout risque de pollution, l'eau minérale doit receler des propriétés favorables à la santé. Selon la directive européenne, l'eau minérale naturelle se distingue nettement de l'eau de boisson ordinaire par sa nature, caractérisée par sa teneur en minéraux, oligo-éléments ou autres constituants, le cas échéant par certains effets thérapeutiques et par sa pureté originelle. L'exploitation et la commercialisation de ces eaux sont soumises à un régime d'autorisation particulier que le projet de loi propose de modifier et d'alléger afin d'établir un parallélisme avec la production et la distribution d'eau potable et de transposer dans la loi les dispositions de la directive du 15 juillet 1980. Le I de l'article propose de consacrer intégralement le chapitre II du titre II du livre III du code de la santé publique aux eaux minérales naturelles en intitulant ce chapitre « Eaux minérales naturelles » au lieu de « Thermo-climatisme et sources d'eaux minérales naturelles ». Le II de l'article propose de modifier les conditions d'exploitation et de mise en circulation des eaux minérales naturelles qui figurent à l'article L. 1322-1 du code de la santé publique. Il harmonise les conditions d'exploitation de l'eau potable et de l'eau minérale et comble un certain vide juridique dans le mesure ou le décret 2001-1220 du 20 décembre 2001 relatif aux eaux destinées à la consommation humaine ne s'applique pas aux eaux minérales. Le I de l'article L. 1322-1 propose de reproduire, dans la forme et partiellement dans le fond, les dispositions de l'article L. 1221-7 relatif au régime d'autorisation de l'eau potable, évoqué dans le commentaire de l'article 24 du projet de loi. Il est tout d'abord rappelé que, en application de la loi sur l'eau du 3 janvier 1992 (article L. 214-1 du code de l'environnement), l'autorisation administrative requise pour effectuer des prélèvements sur les eaux superficielles ou souterraines s'applique en matière d'eau minérale naturelle. Une seconde autorisation pour l'exploitation d'une source d'eau minérale doit être accordée et sur ce point le projet apporte une modification notable. L'actuel article L. 1322-2, que le projet de loi propose par ailleurs de modifier, prévoit que l'autorisation d'exploiter une source d'eau minérale est délivrée par le ministre de la santé. La nouvelle rédaction de l'article L. 1322-1 propose d'attribuer cette compétence au préfet. Cette modification complète le processus général de déconcentration des décisions administratives individuelles d'autorisation d'exploiter l'eau à des fins de consommation humaine. On notera qu'un arrêté préfectoral d'autorisation est également requis pour l'exploitation des simples eaux de source. La directive de 1980 prévoit que la qualité d'eau minérale naturelle doit faire l'objet d'une reconnaissance par l'autorité responsable de l'État membre, c'est pourquoi le projet d'article préconise un acte de reconnaissance et d'autorisation de la part de l'autorité administrative. La liste des eaux minérales naturelles reconnues comme telles est publiée au Journal officiel des Communautés européennes, conformément à la directive. Les opérations soumises à l'autorisation administrative, portent sur toutes les formes d'intervention des différents opérateurs en amont de la consommation : 1°) L'exploitation de la source. 2°) le conditionnement. Cette formule vise, au-delà des industries d'embouteillage, les briques en carton, boites métalliques, bonbonnes... dont les matériaux ne doivent pas altérer la qualité de l'eau. 3°) L'utilisation à des fins thérapeutiques dans un établissement thermal. 4°) La distribution non conditionnée, souvent gratuite, d'eau minérale à proximité de la source ou dans le cadre d'un établissement thermal. Le II de l'article L.1322-1 prévoit que toute modification notable des caractéristiques de l'eau minérale ou tout changement notable des conditions d'exploitation de la source doivent faire l'objet d'une demande de révision de l'acte de reconnaissance de la qualité d'eau minérale naturelle ou de l'autorisation d'exploitation. * La commission a adopté un amendement rédactionnel du rapporteur. La commission a ensuite adopté l'article 26 ainsi modifié. Article 27 (article L. 1322-2 du code de la santé publique) Surveillance et obligations relatives à la qualité des eaux minérales naturelles En harmonisation avec les dispositions relatives à l'eau potable (cf commentaire de l'article 23 du projet de loi), le présent article définit les obligations légales mises à la charge des exploitants d'eaux minérales naturelles. Il supprime, en cohérence avec les dispositions proposées par l'article 26 du projet de loi, l'autorisation ministérielle d'exploiter une source d'eau minérale naturelle mentionnée dans l'actuelle rédaction de l'article L. 1322-2 du code qui fait l'objet d'une réécriture. Les obligations prescrites s'inscrivent dans le cadre de la directive 80-777 du 15 juillet 1980 relative à l'exploitation et à la commercialisation des eaux minérales naturelles dans les Etats membres. Elles serviront de base légale à la qualification pénale et à la répression des infractions relatives à la protection et aux exigences de qualité de l'eau destinée à la consommation humaine y compris les eaux minérales. Le I de l'article L. 1322-2 proposé fait obligation à toute personne qui offre au public de l'eau minérale, à titre onéreux ou à titre gratuit et sous quelque forme que ce soit, de s'assurer que cette eau est propre à l'usage qui en est fait. La directive de 1980 énumère de façon très précise les caractéristiques chimiques et microbiologiques auxquelles doivent répondre les eaux minérales naturelles. Le II de l'article L. 1322-2 énumère les obligations qui pèsent sur les personnes publique ou privée autorisées à exploiter et à commercialiser une source d'eau minérale. Ces obligations reproduisent pour une large part celles imposées par le projet d'article L. 1321-4 du code de la santé publique en matière d'eau potable, mais tiennent compte également des prescriptions spécifiques découlant de la directive européenne. Les deux premières obligations sont celles posées par le paragraphe I l'article L. 1321-4 : 1°) Surveiller la qualité de l'eau minérale naturelle. 2°) Se soumettre au contrôle sanitaire. L'obligation de prendre des mesures correctives afin de rétablir la qualité de l'eau potable, mentionnée au 3°) du paragraphe I de l'article L. 1321-4 ne peut être prescrite pour l'eau minérale puisque l'une des caractéristiques de cette eau, spécifiée par la directive est précisément de ne pouvoir « faire l'objet d'aucun traitement ou adjonction autre que la séparation des éléments instables, tels que les composés du fer et du soufre, par filtration ou décantation, éventuellement précédée d'une oxygénation, pour autant que ce traitement n'ait pas pour effet de modifier la composition de cette eau dans ses constituants essentiels lui conférant ses propriétés ». Les deux obligations qui suivent transposent des prescriptions communautaires, notamment celle qui interdit tout traitement de désinfection par quelque moyen que ce soit et l'adjonction d'éléments bactériostatiques ou tout autre traitement de nature à modifier le microbisme de l'eau minérale naturelle. 3°) N'employer que des produits et procédés de nettoyage et de désinfection des installations qui ne sont pas susceptibles d'altérer la qualité de l'eau minérale naturelle distribuée. 4°) N'employer que des produits et procédés de traitement qui ne modifient pas la composition de cette eau dans ses constituants essentiels et n'ont pas pour but d'en modifier les caractéristiques microbiologiques. Les 5°) et 6°) de l'article reprennent exactement les obligations qui figurent aux 5° et 6° du paragraphe I de l'article L. 1321 du projet de loi (cf. article 23 du projet). * La commission a adopté l'article 27 sans modification. Article 28 (articles L. 1322-9, L. 1322-13 du code de la santé publique) Article de cohérence Le présent article actualise certaines dispositions relatives aux eaux minérales, notamment en fonction des nouvelles mesures proposées dans le projet de loi. Le I de l'article propose d'abroger l'article L. 1322-9 du code de la santé publique, texte très ancien qui confère un droit particulier aux grands minéraliers qui déroge aux nouvelles réglementations sur l'eau. Les dispositions concernées se rapportent au droit du propriétaire d'une source d'eau minérale naturelle déclarée d'intérêt public d'exécuter sur son terrain des travaux de captage d'eau et d'aménagement de cette source pour sa conservation et son exploitation. La notion d'eau minérale d'intérêt public est prévue à l'article L. 1322-3 du code de la santé publique. Une eau minérale naturelle peut bénéficier d'une protection spéciale grâce à l'attribution d'un périmètre de protection autour de la source. Cette appellation et cette protection ne peuvent être octroyés que si l'eau a été préalablement reconnue d'intérêt public. La demande de déclaration d'intérêt public associée au périmètre de protection est instruite par la DRIRE et sanctionnée par un décret ministériel. Les droits conférés au propriétaire par l'actuel article L. 1322-9 sont contraires aux dispositions de l'article L. 214-1 du code de l'environnement, introduites par la loi sur l'eau du 3 janvier 1992. Cet article exige, comme cela est rappelé dans plusieurs dispositions du présent projet de loi (articles 24 et 26), que toute personne physique ou morale, publique ou privée, qui effectue des travaux entraînant des prélèvement sur les eaux superficielles ou souterraines ou une modification du mode d'écoulement des eaux sollicite et obtienne une autorisation de l'autorité administrative compétente. En l'état actuel du droit, le propriétaire d'une source d'eau minérale naturelle déclarée d'intérêt public peut, sans autorisation et sans contrôle à l'intérieur du périmètre de protection qui peut être très étendu, procéder à tous les travaux de captage et d'aménagement qu'il juge nécessaire. Le II de l'article modifie l'article L. 1322-13 du code de la santé publique pour permettre l'entrée en application des nouvelles dispositions proposées par le projet de loi en matière d'eau minérale naturelle. L'article L. 1322-13, dans la nouvelle rédaction proposée, prévoit qu'un décret en Conseil d'Etat déterminera la mise en œuvre des dispositions relatives aux conditions d'exploitation des eaux minérales : 1°) En ce qui concerne les modalités d'instruction des demandes de reconnaissance et d'autorisation prévues par le paragraphe I de l'article L. 1322-1, le contrôle du respect des obligations attachées à l'autorisation et la prise en charge des dépenses correspondantes. Dans une perspective de simplification des formalités de demande d'autorisation, il est souhaitable que le décret d'application permette le regroupement dans un document unique, des trois demandes visant à la reconnaissance de la qualité d'eau minérale, à la demande d'autorisation sanitaire de l'article L. 1322-1 nouveau du code de la santé publique et à la demande d'autorisation requise par l'article L. 214-1 du code de l'environnement. 2°) En ce qui concerne les eaux minérales déclarées d'intérêt public définies à l'article L. 1322-3 du code de la santé publique, le décret d'application déterminera les modalités de la procédure d'enquête publique devant aboutir au décret ministériel et à la détermination du périmètre de protection. * La commission a adopté l'article 28 sans modification. Article 29 (article L. 1324-1 du code de la santé publique) Constat des infractions aux dispositions protectrices de l'eau Le présent article et les deux suivants proposent de renforcer le dispositif répressif en matière de sécurité sanitaire de l'eau destinée à la consommation humaine. La modification proposée ici vise à étendre à un grand nombre d'agents le pouvoir de rechercher et de constater les infractions aux mesures de protection des sources d'eau minérale naturelle et aux situations identiques relatives aux captages d'eau potable. C'est pourquoi il convient de modifier l'actuelle rédaction de l'article L. 1324-1 du code de la santé publique qui prévoit que seuls les officiers de police judiciaire et les ingénieurs des mines sont autorisés à relever les infractions. Cette modification vise à établir un parallèle avec les dispositions contenues dans le code de l'environnement en matière de protection de la nature et des installations classées à risques. La nouvelle rédaction de l'article L. 1324-1 mentionne deux nouvelles catégories d'agents, outre les officiers de police judiciaire : 1°) Les fonctionnaires et les agents du ministère de la santé ou des collectivités territoriales habilités et assermentés dans des conditions fixées par décret en Conseil d'Etat, dont la compétence est déjà retenue par l'article L. 1312-1 du code de la santé publique en matière d'infractions aux règles sanitaires liées à l'environnement. 2°) Plusieurs catégories d'agents chargés de la police de l'eau énumérées par l'article L. 216-3 du code de l'environnement ainsi que les gardes champêtres des communes qui seront commissionnés et habilités dans des conditions déterminées par décret. Les fonctionnaires concernés appartiennent aux services de l'Etat chargés de l'environnement, de l'agriculture, de l'industrie, de l'équipement, des transports, de la mer, de la santé, de la défense, de la concurrence, de la consommation et de la répression des fraudes. Il s'agit également des agents mentionnés à l'article L. 514-5 du code de l'environnement, c'est-à-dire des personnes chargées de l'inspection des installations classées. Enfin, peuvent également être habilités les agents assermentés de l'Office national de la chasse et de la faune sauvage et du Conseil supérieur de la pêche, les ingénieurs en service à l'Office national des forêts et les agents assermentés de cet établissement ainsi que les agents assermentés et commissionnés des parcs nationaux et des réserves naturelles. S'agissant des infractions qui portent spécifiquement atteinte aux périmètres de protection désignés dans la déclaration d'utilité publique qui protège un captage d'eau potable (article L. 1321-2 du code de la santé publique) ou ceux associés à la déclaration d'intérêt public d'une eau minérale naturelle (articles L. 1322-3 à L. 1322-7), elles pourront être constatées par les agents des services déconcentrés du ministère de l'industrie, assermentés et commissionnés qui sont souvent en charge, par ailleurs, de l'instruction des procédures d'utilité publique. * La commission a rejeté un amendement de Mme Martine Billard après que le rapporteur a indiqué que sa préoccupation est déjà prise en compte dans le code de la santé publique. La commission a ensuite adopté un amendement de cohérence du rapporteur. La commission a adopté l'article 29 ainsi modifié. Article 30 (article L. 1324-2 du code de la santé publique) Procédures judiciaires Le présent article a pour objet la mise en cohérence des procédures judiciaires relatives aux infractions en matière de protection sanitaire de l'eau potable et de l'eau minérale avec celles relatives à la police de l'eau et des installations classées pour la protection de l'environnement. Il est proposé de réécrire l'article L. 1324-2, du code de la santé publique en ce sens. Les procès-verbaux constatant les infractions sont dressés en double exemplaire dont l'un est adressé au préfet et l'autre au procureur de la République. Ils font foi jusqu'à preuve du contraire. Par analogie avec les prescriptions de la loi du 19 juillet 1976 sur les installations classées et la loi du 3 janvier 1992 sur l'eau, on peut considérer que les procès-verbaux dressés en application du présent projet de loi devront sous peine de nullité être adressés à leurs destinataires dans les cinq jours qui suivent leur clôture. Toujours en se référant à l'application des deux textes visés ci-dessus, d'autres modes de preuve devraient être admissibles. Les officiers de police judiciaire, les agents de l'Etat assermentés et commissionnés désignés par l'article 29 du présent projet de loi, ainsi que les gardes champêtres sont compétents pour établir ces procès-verbaux. * La commission a adopté l'article 30 sans modification. Article additionnel avant l'article 31 (article L. 1324-1-A et L. 1324-1 B du code de la santé publique) : Introduction de sanctions administratives en matière de sécurité sanitaire de l'eau La commission a adopté un amendement du rapporteur introduisant des sanctions administratives en matière de sécurité sanitaire de l'eau. Article 31 (article L. 1324-3 du code de la santé publique) Infractions et sanctions pénales Le présent article propose d'actualiser la définition des infractions en matière d'atteinte à la législation sur la protection de l'eau destinée à la consommation humaine y compris les eaux minérales, de prévoir des cas de responsabilité pénale de personnes morales et de renforcer les sanctions. Les dispositions pénales actuellement en vigueur de l'article L. 1324-3 du code la santé publique, prévoient et répriment d'un an d'emprisonnement et de 4 500 euros d'amende, six catégories d'infractions découlant des obligations existantes en matière d'eau potable et opposables aux différents opérateurs. La nouvelle rédaction reproduit trois infractions existantes et en introduit cinq nouvelles. Le I de l'article L.1324-3 prévoit de maintenir la peine d'emprisonnement actuelle et de porter à 15.000 euros d'amende les sanctions à l'encontre des faits suivants : 1°) Le fait d'offrir ou de vendre au public de l'eau en vue de l'alimentation humaine, y compris la glace alimentaire, sans s'être assuré que cette eau ou cette glace est propre à la consommation ou à l'usage qui en est fait. Cette infraction n'est pas nouvelle, elle figure au 1°) de l'ancienne rédaction de l'article mais son fondement juridique est renforcé par la clarification des obligations mises à la charge de toute personne responsable de la production ou de la distribution d'eau potable par les articles L. 1321-4 et L. 1321-7 (paragraphes I, 2°) du projet de loi (cf. commentaires des articles 23 et 24 du projet). 2°) Le fait d'utiliser de l'eau impropre à la consommation pour la préparation et la conservation de toutes denrées et marchandises destinées à l'alimentation humaine. Cette infraction figure au 2°) de l'actuelle rédaction de l'article modifié. 3°) Le fait de ne pas détenir les autorisations administratives requises pour produire, distribuer ou conditionner l'eau potable conformément aux dispositions nouvelles de l'article L. 1321-7 du code de la santé publique (cf. commentaire de l'article 24 du projet de loi) ; le fait de ne pas détenir l'autorisation d'exploiter une source d'eau minérale de la conditionner et de la distribuer notamment à des fins thérapeutiques, en contradiction avec les exigences de l'article L. 1322-1 nouveau du code (voir le commentaire de l'article 26) ; Le défaut d'autorisation administrative pour l'exploitation et la commercialisation de l'eau potable et de l'eau minérale naturelle constitue une infraction nouvelle et clairement identifiable. 4°) Le fait de ne pas se conformer aux dispositions protectrices des captages d'eau potable contenues dans la déclaration d'utilité publique qui préside à toute forme de travaux de captage d'eau destinée à la consommation humaine. L'incrimination vise toutes les formes de violation des servitudes afférentes aux périmètres de protection désignées dans la déclaration d'utilité publique, dans toutes les configurations énumérées par l'article L. 1321-2 du code de la santé publique complété par le présent projet de loi. Ces infractions ne visent pas les exploitants autorisés à effectuer les travaux de prélèvements d'eau, mais les tiers autorisés par la déclaration d'utilité publique à maintenir ou à introduire une activité dans le périmètre de protection et auxquelles sont opposables les servitudes. 5°) Le fait de ne pas respecter les interdictions et la réglementation des activités, des travaux et des sondages énumérés par les articles L. 1322-3 à L. 1322-7 du code de la santé publique et qui protègent les eaux minérales naturelles d'intérêt public désignées par décret ministériel, que l'acte déclaratif d'intérêt public soit assorti ou non d'un périmètre de protection. Cette infraction devrait s'avérer très protectrice des intérêts des grandes sources d'eau minérale, face aux risques de pollution et aux conséquences de travaux souterrains qui pourraient être pratiqués à l'intérieur du périmètre de protection qui peut être très étendu. Dans son rapport sur la qualité de l'eau, l'Office parlementaire d'évaluation des choix scientifiques et technologique note que la société Vittel bénéficie d'un périmètre de protection de 4.000 hectares et que la société Evian a demandé de porter l'extension du sien à 1 600 hectares. 6°) Le fait pour les exploitants d'eau potable ou d'eau minérale naturelle de ne pas respecter les obligations visées à l'article L. 1321-4 nouveau pour les premiers et L. 1322-2 nouveau pour les seconds, qui exigent l'utilisation de produits et de procédés pour le traitement de l'eau et le nettoyage des installations ne risquant pas d'altérer la qualité de l'eau. Le contenu exact de cette infraction pourra être difficile à interpréter. 7°) Le fait de ne pas se soumettre à la nouvelle disposition introduite par le projet de loi qui confère au préfet un pouvoir d'injonction lui permettant de constater et de prendre les mesures nécessaires face à un risque grave pour la santé publique dont l'origine est située dans une installation privée ne distribuant pas d'eau au public. Le fondement de cette infraction réside dans le paragraphe II du nouvel article L. 1321-4. L'occupant ou le propriétaire qui refuserait de prendre les mesures prescrites pour faire cesser le risque pourra donc faire l'objet de poursuites. 8°) Le fait d'amener par canaux à ciel ouvert de l'eau destinée à l'alimentation humaine en violation des dispositions de l'article L. 1321-8. Cette infraction figure au 8°) de l'actuelle rédaction de l'article modifié. Le II de l'article L. 1324-3 introduit la possibilité de retenir la responsabilité pénale des personnes morales pour le compte desquelles ou au nom desquelles les infractions énumérées au I du présent article ont été commises. Conformément à l'article 131-41 du code pénal, les personnes morales encourent une amende dont le taux maximum est égal au quintuple de celui prévu pour les personnes physiques. La responsabilité pénale des personnes morales n'exclut pas celle des personnes physiques auteurs ou complices des mêmes faits. Il convient de rappeler que l'article 121-2 du code pénal écarte la responsabilité de l'Etat en toutes circonstances ainsi que celle des collectivités territoriales sauf pour les infractions commises dans le cadre d'une délégation de service public. * La commission a adopté un amendement de clarification rédactionnelle du rapporteur puis a rejeté un amendement de cohérence de Mme Martine Billard. La commission a adopté l'article 31 ainsi modifié. Article 32 (articles L. 1334-6 et L. 1334-7 du code de la santé publique) Renumérotation de certains articles L'article 37 du présent projet de loi propose d'insérer six nouveaux articles au chapitre IV, intitulé « lutte contre la présence de plomb ou d'amiante », du titre III du livre III de la première partie du code de la santé publique. Afin d'en tenir compte et pour améliorer la lisibilité du chapitre IV, le présent article propose d'en modifier la structure en procédant à une renumérotation. Les actuels articles L. 1334-6 et L. 1334-7 seraient déplacés en fin de chapitre et pour cela renumérotés. L'article L. 1334-6 deviendrait l'article L. 1334-12 et l'article L. 1334-7 deviendrait l'article L. 1334-11. * La commission a adopté un amendement du rapporteur corrigeant une erreur de référence. La commission a adopté l'article 32 ainsi modifié. Article additionnel après l'article 32 Rapport sur l'opportunité de mentionner dans le carnet de santé l'intoxication au plomb La commission a adopté un amendement de M. Claude Leteurtre visant à demander au Gouvernement le dépôt sur le bureau de l'Assemblée nationale d'un rapport sur l'opportunité de mentionner dans le carnet de santé l'intoxication au plomb afin de permettre un suivi médical. Elle a rejeté deux amendements du même auteur prévoyant le dépôt d'un rapport sur l'évaluation des conditions de formation des opérateurs chargés du diagnostic et du contrôle d'exposition au plomb et le dépôt d'un rapport sur l'évolution du saturnisme et de son dépistage. (article L. 1334-1 du code de la santé publique) Institution d'une enquête sur l'environnement du mineur visant à déterminer l'origine de l'intoxication au plomb Cet article a pour principal objet d'instituer une enquête sur l'environnement du mineur à la suite d'un signalement d'un cas de saturnisme, afin d'étendre le champ du diagnostic prévu par l'article L. 1334-1 du code de la santé publique et rechercher ainsi plus efficacement les sources d'intoxication au plomb. On rappellera tout d'abord les principales mesures d'urgence de lutte contre le saturnisme instituées par l'article 123 de la loi n° 98-567 du 29 juillet 1998 relative à la lutte contre les exclusions (codifié aux articles L. 1334-1 à L. 1334-7 du code de la santé publique). Mesures d'urgence de lutte contre le saturnisme · Tout médecin qui dépiste un cas de saturnisme12 chez une personne mineure est tenu, après information de la personne exerçant l'autorité parentale, de procéder, sous pli confidentiel à son signalement auprès de l'autorité sanitaire (signalement obligatoire). En outre, toute personne peut signaler au préfet un risque d'accessibilité au plomb, qui se définit par la présence de peintures dégradées susceptibles de contenir du plomb (signalement spontané). · Le préfet doit alors faire procéder à un diagnostic de l'immeuble habité ou fréquenté régulièrement par le mineur afin de déterminer rapidement s'il existe un risque d'intoxication au plomb (article L. 1334-1). · Si le diagnostic est positif, le préfet notifie au propriétaire son intention de faire réaliser, à ses frais, les travaux nécessaires pour supprimer le risque constaté. Dans un délai de dix jours à compter de la notification de la décision du préfet, le propriétaire peut soit contester la nature des travaux envisagés, soit s'engager à les réaliser dans un délai maximum d'un mois (article L. 1334-2). · Si la réalisation des travaux requiert la libération temporaire des locaux, le préfet est tenu de prendre toutes les dispositions nécessaires pour assurer l'hébergement provisoire des occupants. Le coût de la réalisation des travaux, et le cas échéant, celui de l'hébergement provisoire des occupants sont mis à la charge du propriétaire (article L. 1334-4). · Enfin, si le propriétaire s'est engagé à réaliser les travaux, le préfet procède un mois après la notification de sa décision, à un contrôle des lieux afin de vérifier que l'accessibilité au plomb est supprimée (article L. 1334-3). 1. Les insuffisances des procédures actuelles de diagnostic et de signalement a) Le diagnostic de l'immeuble : un champ trop restreint En application de l'article L. 1334-1 du code de la santé publique, lorsqu'un cas de saturnisme chez un mineur est signalé au préfet, celui-ci doit immédiatement faire procéder à un diagnostic sur « l'immeuble ou la partie d'immeuble habité ou fréquenté régulièrement par le mineur », c'est-à-dire sur les revêtements et peintures dégradés du domicile de l'enfant susceptibles de contenir du plomb. Ce diagnostic constitue une étape essentielle du dispositif de lutte contre le saturnisme dans la mesure où, s'il est positif, il permet ensuite au préfet de prescrire les travaux nécessaires pour supprimer le risque constaté, voire d'assurer l'hébergement provisoire des occupants. Or, si les revêtements représentent encore la principale source des fortes intoxications au plomb chez les jeunes enfants, il existe de nombreux autres facteurs d'exposition que le diagnostic ne permet pas aujourd'hui de repérer. Il peut s'agir par exemple de l'alimentation, de l'environnement industriel, de l'activité professionnelle des parents ou encore de la présence de canalisations en plomb13. b) Le signalement spontané : un champ trop large Conformément à l'article L. 1334-1 précité, le préfet doit également procéder au diagnostic de l'immeuble dès lors qu'un risque d'accessibilité au plomb « pour les occupants » est porté à sa connaissance, soit en raison de la connaissance de résultats d'analyse de plomb, soit en raison de la date de construction de l'immeuble antérieure à 1948 (date à laquelle les peintures au plomb ont été interdites). En 2001, selon le rapport réalisé conjointement par les directions générales de la santé et de l'urbanisme14, près de 620 logements ou parties communes d'immeubles présentant des peintures dégradées (dont près des deux tiers en Ile-de-France) ont ainsi été signalés spontanément aux services de l'Etat. En outre, sur 3531 diagnostics réalisés en 2001, 1707 faisaient suite à un signalement de risque d'accessibilité au plomb. Toutefois, parmi les occupants de l'immeuble, les enfants constituent la véritable population à risque, du fait de leur comportement d'exploration orale en bas âge et du goût sucré présenté par les peintures au plomb. De ce fait, le champ du signalement spontané apparaît en définitive trop large au regard des moyens limités dont disposent les services déconcentrés de l'Etat pour faire réaliser les diagnostics. 2. Les modifications proposées par le projet de loi Le paragraphe I clarifie tout d'abord la rédaction du premier alinéa de l'article L. 1334-1 du code de la santé publique en remplaçant les termes « médecin du service de l'Etat dans le département en matière sanitaire et sociale » - auprès de qui tout médecin est tenu de signaler un cas de saturnisme chez une personne mineure - par ceux de « médecin inspecteur de la santé publique de la direction départementale des affaires sanitaires et sociales ». En outre, le paragraphe II, qui remplace le deuxième alinéa de l'article L. 1334-1 précité par trois nouveaux alinéas, propose de substituer au diagnostic réalisé à la suite du signalement d'un cas de saturnisme, une « enquête sur l'environnement du mineur », qui peut inclure un diagnostic portant sur les revêtements des immeubles concernés, afin de permettre aux services de l'Etat d'appréhender les différentes sources d'intoxication au plomb. S'agissant du signalement spontané, le dernier alinéa de l'article L. 1334-1 tel que modifié par le même paragraphe permet enfin de recentrer les moyens et les investigations des services de l'Etat sur les situations qui le nécessitent réellement, en prévoyant la possibilité pour le préfet de prescrire un diagnostic des revêtements dès lors qu'un « risque d'exposition au plomb pour un mineur » est porté à sa connaissance. * La commission a rejeté deux amendements de Mme Jacqueline Fraysse visant à renforcer la législation en matière de prévention des risques sanitaires liée à l'amiante et à étendre à l'amiante le champ du diagnostic prévu par cet article. Puis, elle a adopté un amendement rédactionnel du rapporteur. La commission a adopté l'article 33 ainsi modifié. (article L. 1334-2 du code de la santé publique) Délais de réalisation des travaux Cet article remplace le premier alinéa de l'article L. 1334-2 du code de la santé publique par quatre nouveaux alinéas, en conséquence des modifications apportées à L.1334-1 par l'article 33 du présent projet de loi. Surtout, cet article propose d'aménager les délais de réalisation des travaux visant à supprimer le risque d'intoxication au plomb. · Le premier alinéa a pour objet de préciser les obligations qui incombent au préfet lorsque l'enquête environnementale prévue par l'article L. 1334-1 met en évidence la présence d'une source d'exposition au plomb susceptible d'être à l'origine d'un cas de saturnisme chez un mineur. Il pose tout d'abord plus clairement le principe de l'information des familles et des professionnels de santé concernés, qui relève de la responsabilité du préfet de département. En outre, le préfet doit désormais inviter « la personne responsable » - c'est-à-dire le propriétaire, mais également, selon la source d'exposition au plomb identifiée par l'enquête, l'industriel ou la collectivité locale (pour la distribution de l'eau) - à prendre « les mesures appropriées » pour réduire ce risque, ce qui permettra de renforcer la protection des occupants en luttant plus efficacement contre les causes du saturnisme. · Le deuxième alinéa propose, d'autre part, d'aménager les délais de réalisation des travaux visant à supprimer le risque d'intoxication au plomb. Actuellement, en cas de diagnostic positif, le préfet est tenu de notifier au propriétaire ou au syndicat de propriétaires s'il s'agit des parties communes, son intention de faire réaliser les travaux nécessaires pour supprimer le risque constaté. Si le propriétaire n'a pas fait connaître son engagement de procéder à leur réalisation à l'issue d'un délai de dix jours après la notification, il incombe au préfet de les faire exécuter d'office. En tout état de cause, les travaux doivent être réalisés dans un délai maximum d'un mois à compter de la notification. Or, ce délai très court se révèle quasiment impossible à respecter dans la pratique, et ce pour au moins trois raisons : - l'indisponibilité des entreprises, en raison notamment de leur faible intérêt financier pour ce type de travaux et du fait que leur responsabilité est engagée sur la durabilité des travaux (selon le principe de la garantie biennale des travaux de second œuvre posé par l'article 1792-3 du code civil) ; - la forte implication financière de l'Etat requise pour les avances pour travaux et la lourdeur des procédures de mise en concurrence des entreprises par appels d'offre ; - enfin et surtout, la difficulté de trouver un hébergement provisoire pour les occupants, ce qui peut s'avérer nécessaire dans certains cas, en particulier pour les logements exigus ou pour certains types de travaux susceptibles de contaminer l'intérieur du logement. Cette situation explique ainsi l'écart important entre les travaux notifiés par le préfet et leur réalisation effective, comme l'indique le graphique suivant. Notification et réalisation des travaux d'urgence en 2001 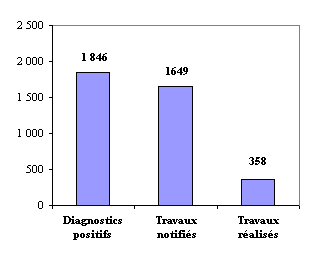 Source : Rapport de la DGS et de la DUHC sur le suivi et l'application des mesures de lutte et de prévention contre le saturnisme, mai 2002. C'est pourquoi, lorsque des revêtements dégradés contenant du plomb à des concentrations supérieures aux seuils définis par les ministres chargés de la santé et de la construction sont susceptibles d'être à l'origine de l'intoxication du mineur, le troisième alinéa de cet article prévoit désormais le dispositif suivant : - le délai maximum de réalisation des travaux est maintenu à un mois en règle générale ; - en cas d'hébergement des occupants, ce délai est porté à trois mois. · Le troisième alinéa prévoit par ailleurs que lorsque l'adresse du propriétaire n'est pas connue, ou à défaut de pouvoir l'identifier, la notification le concernant est effectuée par affichage à la mairie de la commune ou de l'arrondissement où est situé l'immeuble, ainsi que par affichage sur la façade de l'immeuble. · Enfin, par cohérence avec l'article L. 1334-1, le quatrième alinéa prévoit que la procédure de travaux prévue au deuxième alinéa du présent article puisse également être déclenchée par le préfet lorsque que le diagnostic fait apparaître la présence de revêtements constituant un risque d'exposition au plomb pour un mineur. * La commission a adopté un amendement du rapporteur visant à préciser, dans la notification des travaux par le préfet, les exigences requises en matière d'hébergement des occupants pendant la durée des travaux. Elle a ensuite rejeté trois amendements de Mme Jacqueline Fraysse visant à renforcer la législation en matière de prévention des risques liés à l'amiante et au plomb. La commission a adopté un amendement rédactionnel du rapporteur. Elle a rejeté un amendement de Mme Jacqueline Fraysse visant à étendre à l'amiante les mesures de lutte contre le saturnisme, puis adopté un amendement de cohérence du rapporteur. La commission a adopté l'article 34 ainsi modifié. (article L. 1334-3 du code de la santé publique) Contrôle des travaux Aujourd'hui, en application de l'article L. 1334-3 du code de la santé publique, dès lors que le propriétaire s'est engagé à réaliser les travaux nécessaires pour supprimer l'accessibilité au plomb, le préfet doit procéder à un contrôle des lieux un mois après la notification de sa décision. En outre, si les travaux n'ont pas été réalisés ou s'ils ont été mal faits et que le risque d'accessibilité au plomb subsiste, le préfet est tenu de déclencher à nouveau la procédure de travaux prévue par l'article L. 1334-2 et de procéder à un contrôle des lieux à l'issue des travaux. Afin d'introduire davantage de souplesse dans ce dispositif, l'article 35 du projet de loi procède à une réécriture de l'article L. 1334-3 afin que les modalités du contrôle des travaux soient désormais définies au niveau réglementaire. * La commission a rejeté un amendement de Mme Jacqueline Fraysse visant à maintenir la possibilité, pour le préfet, de prescrire les travaux nécessaires à la suppression du risque d'exposition au plomb, suite à un contrôle des lieux. La commission a examiné un amendement du rapporteur visant à rétablir la procédure en vigueur en matière de contrôle des travaux ayant pour finalité de supprimer le risque d'exposition au plomb. M. Jean-Luc Préel a présenté un sous-amendement rédactionnel substituant aux mots : « préfet de département », les mots : « représentant de l'Etat ». La commission a adopté le sous-amendement puis l'amendement ainsi modifié. Puis elle a adopté l'article 35 ainsi modifié. (article L. 1334-4 du code de la santé publique) Obligations du propriétaire en matière de financement des travaux et d'hébergement provisoire des occupants Cet article, qui procède à une réécriture de l'article L. 1334-4 du code de la santé publique, vise à préciser les obligations du propriétaire en matière d'hébergement provisoire des occupants et de financement des travaux. _ Aujourd'hui, lorsque la réalisation des travaux visant à supprimer le risque d'intoxication au plomb nécessite la libération temporaire des locaux, le préfet est tenu de prendre toutes les dispositions nécessaires pour assurer l'hébergement provisoire des occupants. Le premier alinéa de cet article propose de confier désormais au propriétaire la responsabilité de rechercher d'urgence un hébergement pour les occupants pendant les travaux, le préfet n'intervenant qu'en cas de défaillance de celui-ci. Cela permettra tout à la fois de responsabiliser davantage les propriétaires et de rapprocher ce dispositif de la procédure prévue par l'article L. 1331-31 du code de la santé publique15 pour les travaux d'insalubrité. _ Le deuxième alinéa - inchangé - du même article prévoit, d'autre part, que le coût de réalisation des travaux, et le cas échéant celui de l'hébergement provisoire des occupants sont mis à la charge du propriétaire. Toutefois, le troisième alinéa prévoit désormais une exception à ce principe lorsque les locaux font l'objet d'une occupation sans titre et que le propriétaire a obtenu à son profit un jugement d'expulsion, non suivi d'exécution du fait du refus du concours de la force publique. Dans ce cas en effet, le préfet doit faire réaliser les travaux d'office, sans que le coût puisse en être imputé aux propriétaires. Enfin, le cinquième alinéa du même article maintient le dispositif d'agrément par le préfet des opérateurs chargés de réaliser les travaux et diagnostic. * La commission a adopté un amendement du rapporteur visant à rapprocher les mesures de relogement des occupants de la procédure prévue en matière de lutte contre l'insalubrité, ainsi que deux amendements du même auteur, l'un de précision, l'autre de clarification rédactionnelle. La commission a également adopté un amendement du rapporteur visant à préciser que les propriétaires sont exonérés de leur responsabilité financière en cas d'occupation des locaux par des personnes occupant ces locaux par voie de fait. La commission a rejeté un amendement de coordination de M. Claude Leteurtre. Elle a adopté l'article 36 ainsi modifié. (articles L. 1334-5 à L. 1334-11 du code de la santé publique) Constat de risque d'exposition au plomb Outre le dispositif d'urgence de lutte contre le saturnisme (articles L. 1334-1 à L. 1334-4 du code de la santé publique), la loi n° 98-567 du 29 juillet 1998 relative à la lutte contre les exclusions a également institué des mesures de prévention lors des transactions immobilières (codifiées à l'article L. 1334-5 du même code), en organisant l'information de l'acquéreur d'un logement sur le risque d'accessibilité au plomb. Afin de renforcer l'efficacité de ce dispositif, en agissant plus en amont sur les sources d'exposition au plomb, le présent article procède à une réécriture de l'article L. 1334-5 du code de la santé publique et insère après celui-ci six nouveaux articles dans le même code (articles L. 1334-6 à L. 1334-11 nouveaux). 1. La portée limitée de l'obligation actuelle de réaliser un état des risques d'accessibilité au plomb (ERAP) lors des transactions immobilières a) Un champ d'application restreint Les immeubles concernés L'article L. 1334-5 institue l'obligation d'annexer un état des risques d'accessibilité au plomb (ERAP) au contrat de vente d'un immeuble, dès lors que les trois conditions cumulatives suivantes sont remplies : - l'immeuble est affecté en tout ou partie à l'habitation ; - il a été construit avant 1948 ; - il est situé dans une zone à risque d'exposition au plomb délimitée par le préfet. Sont donc soustraits à cette obligation les immeubles affectés à un usage collectif, ceux qui ne font généralement pas l'objet de cessions (notamment les HLM), ainsi que ceux qui ne seront pas mis en vente à court terme. Les surfaces diagnostiquées De même que le diagnostic prévu par l'actuel article L. 1334-1 - remplacé par une enquête sur l'environnement du mineur par l'article 33 du projet de loi -, le diagnostic opéré lors de la réalisation de l'ERAP se limite aux revêtements et peintures de l'immeuble concerné. De surcroît, la circulaire n° 2001-1 du 16 janvier 2001 relative aux ERAP a précisé, du fait des difficultés d'interprétation de l'article L. 1334-5, que lorsque le bien immobilier mis en vente relève d'un régime de copropriété, l'ERAP ne porte que sur les parties privatives. Pourtant, de nombreux travaux - et en particulier le rapport précité d'expertise collective de l'INSERM - ont souligné l'importance des risques d'intoxication au plomb dans les parties communes des immeubles construits avant 1949. a) Un suivi lacunaire des ERAP positifs Les conditions de déclenchement de l'action publique lorsqu'un ERAP est positif - c'est-à-dire lorsqu'il « révèle une accessibilité au plomb » - s'avèrent par ailleurs insatisfaisantes. Dans ce cas, le vendeur est en effet tenu d'en informer le préfet, lequel peut alors mettre en œuvre, « en tant que de besoin », les dispositions prévues par les articles L. 1334-2 à L. 1334-4 du même code (notification des travaux visant à supprimer le risque constaté et contrôle des lieux dans un délai maximum d'un mois). Or, dans la pratique, les services déconcentrés de l'Etat rencontrent de réelles difficultés à traiter l'ensemble des ERAP qui affluent dans les préfectures en raison de l'absence de critères de transmission réellement discriminants. En effet, la notion très large d' « accessibilité au plomb » ne permet pas de qualifier le niveau de danger d'un logement à la lecture d'un ERAP. L'action des pouvoirs publics s'en trouve de ce fait dispersée. 2. Les améliorations proposées par le projet de loi a) L'extension du champ d'application de l'ERAP, renommé constat de risque de d'exposition au plomb (CREP) L'extension du diagnostic aux facteurs de dégradation du bâti : l'article L. 1334-5 Le I du présent article, qui procède à une réécriture de l'article L. 1334-5 du code de la santé publique, propose de remplacer l'ERAP par un constat de risque d'exposition au plomb (CREP) visant à repérer les revêtements contenant du plomb, comme c'est le cas actuellement, mais également les « facteurs de dégradation du bâti ». Les habitats dégradés constituent en effet un facteur d'aggravation important des risques d'intoxication (peinture écaillée laissant apparaître la peinture sous-jacente au plomb, humidité favorisant la dégradation des revêtements...). Cet élargissement du champ du diagnostic opéré présente également l'avantage de permettre de repérer les logements insalubres à l'occasion des mesures de prévention contre le saturnisme, et donc d'engager si nécessaire la procédure d'insalubrité prévue par l'article L. 1331-26 du même code. Le II a, d'autre part, pour objet d'insérer six nouveaux articles après l'article L. 1334-5 précité (article L. 1334-6 à L. 1334-11 nouveaux du code de la santé publique). La généralisation des mesures de prévention à l'ensemble du territoire : l'article L. 1334-6 Alors que l'obligation actuelle de réaliser un ERAP est limitée aux immeubles situés dans les zones à risque délimitées par le préfet, près de la moitié des départements n'ont toujours pas procédé au zonage de leur territoire près de quatre ans après l'entrée de la vigueur de la loi du 29 juillet 1998 précitée. De plus, la très grande majorité des préfets ayant appliqué ces dispositions ont choisi de retenir l'intégralité du territoire départemental comme zone à risque, du fait notamment : - du mitage entre les habitats anciens et récents ; - des inévitables répercussions sur les transactions immobilières dans les zones à risques ; - du risque, enfin, de donner une fausse impression de sécurité aux acquéreurs qui ne bénéficieraient pas d'un ERAP. En conséquence, l'article L. 1334-6 nouveau propose de généraliser les mesures de prévention contre le saturnisme à l'ensemble du territoire national. En contrepartie, il prévoit également que, lorsque le constat conclut à l'absence de plomb dans les revêtements ou à des concentrations inférieures à des seuils définis par arrêtés des ministre de la santé et de la construction, il n'y a pas lieu de procéder à un nouveau constat à chaque mutation. Enfin, le dernier alinéa de cet article vise à lever une ambiguïté du dispositif actuel, en précisant que l'obligation de réaliser un CREP ne s'applique qu'aux parties privatives des immeubles relevant du régime de la copropriété, défini par la loi n° 65-557 du 10 juillet 1965. L'extension des mesures de prévention aux nouveaux baux de logements construits avant le 1er janvier 1949 : l'article L 1334-7 Cet article vise à étendre l'obligation de réaliser un CREP aux nouveaux baux de location des logements construits avant le 1er janvier 1949. Il s'agit d'un renforcement important du dispositif de prévention contre le saturnisme, dans la mesure où près de 800 000 logements construits avant 1949 sont mis en location chaque année (contre 240 000 mis en vente). Toutefois, le constat ne sera à renouveler que tous les six ans et uniquement en cas de changement de locataire. En outre, ces dispositions ne seront applicables qu'à l'expiration d'un délai de quatre ans à compter de l'entrée en vigueur de la future loi, afin de permettre au marché de s'organiser. Le troisième alinéa de cet article prévoit enfin que l'absence dans le contrat de location du CREP, lorsque celui-ci est requis, constitue un manquement aux obligations particulières de sécurité et de prudence susceptible d'engager la responsabilité pénale du propriétaire bailleur. L'institution d'une obligation d'établir un CREP lors de travaux réalisés sur les parties communes : l'article L. 1334-8 L'article L. 1334-8 nouveau du même code a pour objet de prescrire la réalisation d'un CREP préalablement à tous travaux sur les parties à usage commun des immeubles collectifs construits avant le 1er janvier 1949 et « de nature à provoquer une altération substantielle des revêtements ». Il permettra ainsi de procéder progressivement au contrôle des parties communes des immeubles, dans lesquels de nombreux cas de contamination d'enfants ont été enregistrés au cours de ces dernières années. a) L'amélioration de la procédure engagée en cas de CREP positif L'institution d'une obligation du propriétaire de réaliser des travaux en cas de risque d'exposition au plomb : l'article L 1334-9 Lorsque le CREP met en évidence la présence de revêtements dégradés contenant du plomb à des concentrations supérieures à des seuils définis par voie réglementaire (CREP positif), l'article L. 1334-9 nouveau du code de la santé publique dispose que le propriétaire est désormais tenu d'en informer les occupants ainsi que les personnes amenées à faire des travaux dans l'immeuble. Surtout, les propriétaires devront réaliser immédiatement des travaux pour supprimer le risque d'exposition au plomb, sans attendre l'avis des services de l'Etat. La définition de critères plus sélectifs de transmission des CREP au préfet : l'article L. 1334-10 Afin de recentrer les interventions des services de l'Etat sur les situations les plus graves, l'article L. 1334-10 nouveau du même code prévoit que seront seuls transmis au préfet les CREP faisant apparaître la présence de « facteurs de dégradation » précisés par arrêté des ministres chargés de la santé et de la construction seront désormais transmis au préfet. La protection des populations lors de chantiers entraînant un risque significatif d'exposition au plomb : l'article L. 1334-11 Cet article vise à remédier à une carence du dispositif actuel, en permettant au préfet de prescrire toutes mesures conservatoires, y compris l'arrêt du chantier, dès lors que les travaux entraînent un risque d'exposition au plomb pour les occupants d'un immeuble ou la population environnante. * Article L. 1334-5 du code de la santé publique La commission a rejeté deux amendements de Mme Jacqueline Fraysse visant à intégrer dans le diagnostic du risque d'exposition au plomb les éléments de bâti et de canalisations et à renforcer la législation en matière de prévention des risques sanitaires liés à une exposition à l'amiante. La commission a adopté un amendement de portée rédactionnelle du rapporteur. Article L. 1334-6 du code de la santé publique La commission a ensuite adopté un amendement du rapporteur visant à préciser la désignation des actes auxquels doit être annexé un constat du risque d'exposition au plomb. La commission a examiné un amendement de M. Claude Leteurtre visant à rétablir les zones à risque d'exposition au plomb, délimitées par le préfet. M. Claude Leteurtre a précisé qu'il est inutile de généraliser à l'ensemble du territoire les mesures de prévention contre le saturnisme, dans la mesure où l'habitat concerné est très localisé et le plus souvent bien connu. M. Jean-Marie Le Guen a précisé que dans ce type de situation les préfets agissent plutôt dans une logique de précaution que dans une logique de besoin sanitaire. Le rapporteur s'est déclaré défavorable à l'amendement en soulignant les difficultés d'application de la réglementation par zones à risque, du fait notamment du mitage entre les habitats anciens et nouveaux. La commission a rejeté cet amendement. La commission a adopté deux amendements du rapporteur, l'un rédactionnel, l'autre visant à étendre aux parties privatives des immeubles en monopropriété l'obligation de réaliser un constat de risque d'exposition en cas de vente d'un immeuble. Article L. 1334-7 du code de la santé publique La commission a adopté un amendement de M. Claude Leteurtre visant à limiter le champ de l'obligation de réaliser un constat de risque d'exposition au plomb aux zones à risque délimitées par le préfet. La commission a rejeté un amendement de Mme Jacqueline Fraysse visant à limiter la durée de validité du certificat de constat de risque d'exposition au plomb à un an et elle a adopté un amendement rédactionnel du rapporteur. La commission a ensuite rejeté un amendement de Mme Jacqueline Fraysse visant à étendre à l'amiante les mesures de prévention prévues contre le saturnisme. La commission a adopté un amendement du rapporteur visant à étendre aux parties privatives des immeubles en monopropriété l'obligation d'annexer au contrat de location un constat de risque d'exposition au plomb. Article L. 1334-8 du code de la santé publique La commission a adopté un amendement du rapporteur visant à préciser que les bâtiments concernés par cette obligation sont ceux qui sont affectés en tout ou partie à l'habitation et un amendement de coordination de M. Claude Leteurtre, ainsi qu'un amendement rédactionnel du rapporteur. La commission a rejeté un amendement de cohérence de Mme Jacqueline Fraysse. La commission a examiné l'amendement n° 3 du Gouvernement, prévoyant que les parties communes des immeubles construits avant le 1er janvier 1949 devront avoir fait l'objet d'un constat de risque d'exposition au plomb avant le 31 décembre 2010. Le rapporteur s'est déclaré favorable à l'amendement du gouvernement et la commission l'a adopté. Article L. 1334-9 du code de la santé publique La commission a adopté un amendement du rapporteur rectifiant une erreur de numérotation. La commission a rejeté un amendement de cohérence de Mme Jacqueline Fraysse et a adopté un amendement du rapporteur ayant pour objet d'encadrer l'obligation de travaux imposée aux propriétaires en introduisant une condition relative à la sécurité des occupants. Article L. 1334-10 du code de la santé publique La commission a adopté un amendement rédactionnel du rapporteur et rejeté un amendement de cohérence de Mme Jacqueline Fraysse. Puis la commission a adopté l'article 37 ainsi modifié. Article 38 Dispositions de cohérence et modalités d'application Cet article comporte, d'une part, plusieurs dispositions de cohérence et précise, d'autre part, les modalités d'application du présent projet de loi. Le 1° du paragraphe I a pour objet de modifier la rédaction de l'article L. 1334-12 nouveau du code de la santé publique (ancien article L. 1134-6 du même code) par cohérence avec les modifications apportées à l'article L. 1334-1 par l'article 33 du projet de loi. Le 2° du même paragraphe vise pour sa part à remédier à l'insuffisance des conditions requises pour réaliser les états de risque d'accessibilité au plomb (ERAP), soulignées notamment par le rapport Moissonier et par le rapport conjoint de la DGS et de la DUHC précités. Ce dernier a en effet estimé que « la très forte hétérogénéité dans la qualité des ERAP transmis aux préfets (...) résulte de l'absence d'encadrement des auteurs d'ERAP par la réglementation, qui n'exige aucune compétence technique particulière », en ajoutant que « la méthodologie que les auteurs d'ERAP sont censés respecter ne leur est pas opposable dans la mesure où elle relève d'une simple circulaire ». En conséquence, le 2° remplace le quatrième alinéa de l'article L. 1334-12 (3°) relatif aux conditions de publicité du zonage - devenu sans objet du fait de la généralisation des mesures de prévention dans les zones à risque à l'ensemble du territoire (voir sur ce point le commentaire sous l'article 37 du projet de loi) - par un nouvel alinéa prévoyant que le contenu et les modalités de réalisation du constat de risque d'exposition au plomb, ainsi que les conditions auxquelles doivent satisfaire leurs auteurs seront déterminées par voie réglementaire. Ces dispositions permettront ainsi de renforcer la qualité des expertises réalisées. De même, le paragraphe II insère à la fin de l'article L. 1334-12 précité un cinquième alinéa (4°) disposant que les modalités d'établissement du relevé sommaire des facteurs de dégradation du bâti, mentionné à l'article L. 1334-5 du même code, seront précisées par décret en Conseil d'Etat. Les paraphes III et IV procèdent par ailleurs à une renumérotation des articles L. 1335-3-1 à L.1336-9 du code de la santé publique (devenus articles L. 1336-1 à L. .1337-9 nouveaux du même code), le chapitre V-1 relatif à l'Agence française de sécurité sanitaire environnementale devenant le chapitre VI du même titre. Enfin, le paragraphe V organise la transition entre le dispositif actuel de prévention et de lutte contre le saturnisme et celui proposé par le présent projet de loi, en prévoyant qu'à titre transitoire les articles L. 1334-1 à L.1334-6 actuels du code de la santé publique restent applicables jusqu'à la publication des décrets pris en application des articles L. 1334-1 à L. 1334-12 du même code, dans leur rédaction issue de la future loi. * La commission a adopté trois amendements de correction d'erreurs matérielles présentés par le rapporteur. Puis elle a adopté l'article 38 ainsi modifié. (article 3 de la loi n° 89-462 du 6 juillet 1989 tendant à améliorer les rapports locatifs et portant modification de la loi n° 86-129 du 23 décembre 1986) Coordination Cet article a pour objet de modifier l'article 3 de la loi n°89-462 du 6 juillet 1989 tendant à améliorer les rapports locatifs et portant modification de la loi n° 86-129 du 23 décembre 1986, afin de mettre ses dispositions en cohérence avec l'article L. 1334-5 du code de la santé publique, tel que modifié par l'article 37 du projet de loi. L'article 37 prévoit en effet l'annexion du constat de risque d'exposition au plomb (CREP) à tout nouveau contrat de location d'un immeuble affecté en tout partie à l'habitation construite avant le 1er janvier 1949. * La commission a adopté l'article 39 sans modification. RECHERCHE ET FORMATION EN SANTÉ ECOLE DES HAUTES ÉTUDES EN SANTÉ PUBLIQUE Article 40 (article L. 756-2 nouveau du code de l'éducation) Création d'un établissement public d'Etat d'enseignement et de recherche en santé publique Le présent article crée un nouvel établissement public de l'Etat chargé d'assurer l'enseignement et de contribuer à la recherche en matière de santé publique et d'action et de protection sociales. L'exposé des motifs du projet précise que le nouvel établissement aura pour dénomination l' « Ecole des hautes études en santé publique » (EHESP). - L'EHESP disposera d'un statut de « grand établissement » au statut fixé par le code de l'éducation Le statut de l'ENSP était déterminé par l'article L. 1415-1 du code de la santé publique (cf. infra, commentaire de l'article 41). Le texte propose que le statut du nouvel organisme soit inscrit au livre VII du code de l'éducation, livre intitulé « Les établissements d'enseignement supérieur ». Dans le titre V intitulé « Les établissements d'enseignement supérieur spécialisés », l'EHESP s'insèrera dans le chapitre VI consacré aux écoles sanitaires et sociales. Il est proposé que l'article L. 756-2 nouveau du code de l'éducation confère à l'EHESP un statut d'établissement public à caractère scientifique, culturel et professionnel (EPSCP). Ce statut, conformément à l'article L. 711-1 du code de l'éducation, est de nature à lui garantir l'autonomie juridique, administrative, pédagogique et financière. Par respect de ce principe d'autonomie, les relations avec l'Etat sont conclues sur une base contractuelle. Les missions, l'organisation et le fonctionnement de cet organisme seront fixés par un décret en Conseil d'Etat, « dans les conditions prévues à l'article L. 717-1 [du code de l'éducation]». L'article L. 717-1 du code de l'éducation dispose : « Des décrets en Conseil d'Etat fixent les règles particulières d'organisation et de fonctionnement des grands établissements dans le respect des principes d'autonomie et de démocratie définis par le présent titre ». L'EHESP disposera donc d'un statut de « grand établissement », qui est une catégorie juridique dérogatoire au statut générique d'EPSCP. L'article L. 717-1 du code de l'éducation dispose également que les décrets en Conseil d'Etat fixant les règles d'organisation des grands établissements peuvent déroger à une série de dispositions du code de l'éducation, dont les articles L. 711-1 (principe d'autonomie) et L. 711-4 (qui prévoit que les décrets créant les EPSCP sont pris après avis du Conseil national de l'enseignement supérieur et de la recherche). Cela signifie que le pouvoir réglementaire disposera d'une grande liberté pour déterminer le statut, le fonctionnement et l'organisation de l'Ecole des hautes études en santé publique. L'exposé des motifs du présent article précise que « l'établissement bénéficiera de la triple tutelle éducation nationale, recherche et santé », ce qui indique que la contractualisation entre l'Etat et l'établissement pourrait concerner les trois ministres considérés. Les modalités de financement de l'organisme restent à préciser. - Les missions de l'EHESP Concernant le champ thématique des missions de l'EHESP, la rédaction de l'article reprend la formulation de l'article 18 de la loi n° 85-772 du 25 juillet 1985 portant diverses dispositions d'ordre social (Journal officiel du 26 juillet) qui modifie l'article L. 1415-1 du code de la santé publique : les domaines d'intervention de l'EHESP concernent la santé publique d'une part et l'action et la protection sociales d'autre part. Sur ces deux thèmes ainsi définis, l'EHESP doit remplir deux missions relatives à l'enseignement et à la recherche. D'abord, l'école « assure les enseignements pluridisciplinaires ». L'aspect pluridisciplinaire de l'enseignement délivré à l'ENSP est donc conservé. Il est en effet important que les formations en santé publique fassent intervenir les enseignements tirés de la recherche en sciences humaines, qu'il s'agisse de la psychosociologie, de la sociologie, de l'anthropologie ou de l'économie. S'agissant de la formation en santé publique, une mission supplémentaire incombe à l'école : « l'animation d'un réseau national de formation en santé publique destiné à favoriser la mise en commun des ressources et des activités des différents organismes publics et privés compétents en la matière ». La formulation utilisée précise bien la vocation de l'EHESP : l'établissement constituera une tête de réseau destinée à coordonner l'action des différents opérateurs existants en matière d'enseignement et de recherche en santé publique. Ensuite, le texte confie à L'EHESP une mission de recherche en santé publique. Le texte propose que l'EHESP « contribue à la recherche en santé publique et dans le domaine de l'action et de la protection sociales ». L'utilisation du verbe « contribuer », à la portée moindre que « assurer », indique que la recherche en santé publique ne sera pas exclusivement assurée par et établissement. Selon les informations communiquées au rapporteur, la compétence en matière de recherche de l'EHESP ne conduira pas à ôter aux organismes existants (en particulier l'INSERM) leurs propres programmes de recherche en santé publique. * La commission a examiné deux amendements de M. Claude Evin visant à inscrire la nouvelle Ecole des Hautes études en santé publique, établissement public à caractère scientifique, culturel et professionnel, dans le code de la santé publique et non dans celui de l'éducation. Le rapporteur, après avoir indiqué que le souhait de M. Claude Evin est satisfait par un amendement qu'il a déposé à l'article 41, s'est déclaré défavorable à ces amendements. La commission a rejeté les amendements. La commission a adopté un amendement du rapporteur visant à inscrire la dénomination de l'Ecole des hautes études en santé publique dans la loi, à préciser qu'elle relève de la tutelle des ministres chargés de la santé, des affaires sociales, de l'éducation nationale et de la recherche et mieux identifier ses trois missions : formation à la gestion, enseignement en santé publique et recherche. La commission a adopté l'article 40 ainsi modifié. Article 41 Suppression des dispositions législatives relatives à l'Ecole nationale de santé publique dans le code de la santé publique Cet article vise, en coordination avec le précédent, à supprimer les dispositions du code de la santé publique relatives à l'Ecole nationale de la santé publique. Ces dispositions sont inscrites au chapitre V intitulé « Enseignement et recherche », qui comporte un article L. 1415-1 unique, dont la rédaction est issue de l'article 1er de la loi n° 60-732 du 28 juillet 1960 portant création de l'Ecole nationale de la santé publique, modifiée par l'article 18 de la loi n° 85-772 portant diverses dispositions d'ordre social du 25 juillet 1985. L'article concerné dispose que l'ENSP est un établissement public national placé sous l'autorité du ministre chargé de la santé et que ses missions consistent à assurer des formations et des recherches dans trois domaines : santé publique, action sociale et protection sociale. * La commission a examiné un amendement du rapporteur visant à maintenir dans le code de la santé publique la mention de l'Ecole des hautes études en santé publique. M. Claude Evin a présenté un sous-amendement pour placer le ministre de la santé en tête de l'énumération des ministres chargé d'exercer la tutelle sur cet établissement. La commission a adopté ce sous-amendement puis l'amendement ainsi modifié. Puis la commission a adopté l'article 41 ainsi modifié. La loi n°88-1138 du 20 décembre 1998, dite « loi Huriet-Sérusclat », a permis de définir les conditions de participation des personnes qui se prêtent à des recherches biomédicales, soit les essais et expérimentations organisés et pratiqués sur l'être humain en vue du développement des connaissances biologiques et médicales, qu'ils soient ou non menés dans un but thérapeutique. La révision de l'ensemble de ce dispositif s'impose aujourd'hui par une double nécessité. En premier lieu, de nombreux acteurs de la recherche biomédicale et plusieurs travaux et rapports officiels16 ont permis d'identifier un certain nombre de dysfonctionnements, et en particulier : - l'opacité de la distinction entre les recherches avec ou sans bénéfice individuel direct (dans ce dernier cas, la loi prévoit un régime de protection renforcée, qui semble peu adapté et inutilement contraignant pour certaines recherches qui ne comportent que peu de risques et de contraintes) ; - la lourdeur de la procédure réglementaire (notamment l'autorisation préalable des lieux de recherches sans bénéfice individuel direct), de nature à décourager le développement de ces recherches ; - la composition (manque d'indépendance) et le fonctionnement (très hétérogène) des comités consultatifs de protection des personnes dans la recherche biomédicale (CCPPRB), chargés de donner leur avis sur les conditions de validité de la recherche au regard de la protection des personnes. Ces difficultés traduisent, pour une large part, le fait que le champ de la loi Huriet initialement conçue pour les essais de médicaments, en particulier ceux portant sur des volontaires sains en phase I17, n'a été que tardivement élargi à l'ensemble de la recherche biomédicale. Son architecture n'a cependant pas été modifiée de façon à intégrer les contraintes propres à d'autres types de recherches, telles que celles portant sur les thérapeutiques non médicamenteuses et les recherches génétiques, épidémiologiques et physiopathologiques. En second lieu, la directive n° 2001-20 du 4 avril 2001 relative aux essais cliniques de médicaments doit être transposée en droit national avant le 1er mai 2003. Celle-ci prévoit un ensemble de dispositions concernant notamment le rôle du comité d'éthique (en France, le CCPPRB), l'autorisation des recherches par l'autorité compétente et les règles de participation et de consentement des participants. C'est pourquoi le présent chapitre propose de modifier l'ensemble du titre II du livre Ier de la première partie du code de la santé publique afin de réformer l'ensemble du régime juridique des recherches biomédicales. Ce faisant, il ne se limite pas à la seule transposition de la directive n° 2001-20 précitée, afin notamment de pas instaurer des régimes différents de protection des personnes, de nature à porter atteinte au principe d'égalité. (articles L. 1121-1 à L. 1121-17 du code de la santé publique) Principes généraux de protection des personnes qui se prêtent à la recherche biomédicale Cet article, qui comporte dix-sept paragraphes, procède à une réécriture complète du chapitre premier, relatif aux principes généraux des recherches biomédicales, du titre II du livre Ier de la première partie du code de la santé publique. Les principales modifications proposées par cet article concernent : - les règles générales de participation des personnes à la recherche biomédicale (articles L. 1121-1 à L. 1121-4 du code de la santé publique) ; - les règles particulières de participation des personnes vulnérables (articles L. 1121-5 à L. 1121-8) ; - les conditions de réalisation des recherches, en conséquence de la suppression de la distinction entre les recherches avec ou sans bénéfice individuel direct (articles L. 1121-9 à L. 1121-17). 1. Les règles générales de participation des personnes à la recherche biomédicale Le I de cet article procède tout d'abord à une renumérotation des articles L. 1121-1 et L. 1121-8 du code de la santé publique, qui deviennent les articles L. 1121-10 et L. 1221-11. a) La suppression de la distinction entre les recherches avec ou sans bénéfice individuel direct L'ensemble du régime juridique des recherches biomédicales repose aujourd'hui sur la distinction entre les recherches avec ou sans bénéfice individuel direct (BID) pour la personne qui s'y prête. Dans le cas des recherches sans BID, les participants bénéficient d'un régime de protection particulier, qui prévoit notamment : - l'obligation d'un examen médical préalable (article L. 1124-1 du code de la santé publique) ; - la possibilité de verser une indemnisation en compensation des contraintes subies (article L. 1124-2) ; - l'affiliation obligatoire à un régime de sécurité sociale (article L. 1124-3) ; - la définition d'une période d'exclusion des participants à d'autres recherches et leur recensement dans un fichier national (article L. 1124-4) ; - l'obligation d'autorisation préalable des lieux de recherches (article L. 1124-6) ; - la responsabilité sans faute du promoteur (article L. 1121-7). Dans la pratique, cette distinction complexe, voire trompeuse, soulève de nombreuses difficultés. En premier lieu, il paraît souvent difficile d'apprécier le bénéfice « direct » que peut attendre une personne de la réalisation de la recherche. De plus, parce qu'elle procède à une confusion entre les notions de recherches et de soins, cette distinction peut conduire les patients, notamment cancéreux, à accepter de prendre des risques inconsidérés. Il est d'ailleurs remarquable que la recherche avec BID (responsabilité pour faute présumée) jouisse d'un régime de responsabilité moins protecteur que les recherches sans BID, dans la mesure où elle présente souvent davantage de risques pour les patients qui s'y soumettent. Enfin, comme l'a souligné le rapport de M. François Lemaire précité, la recherche sans BID, « privée de l'alibi de la nécessité thérapeutique, s'en trouve par contrecoup tenue en haute suspicion ». Or, la lourdeur du régime réglementaire des recherches sans BID paraît mal adaptée à certaines recherches, telles que la recherche cognitive sur les malades déjà hospitalisés, la recherche épidémiologique ou génétique. De ce fait, les dispositions prévues par la loi Huriet sont bien souvent contournées, de nombreuses recherches étant abusivement qualifiées de recherches avec BID. C'est pourquoi le II de cet article supprime le deuxième alinéa de l'article L. 1121-1 du code de la santé publique, qui définit les recherches avec ou sans BID. L'article 44 du projet de loi propose de substituer à cette distinction l'appréciation plus fine de la balance « bénéfice-risque » pour chaque protocole par le comité de protection des personnes, c'est-à-dire l'évaluation des risques et inconvénients prévisibles, d'une part, et du bénéfice attendu pour la personne ou l'intérêt pour la santé publique, d'autre part. b) La définition des intervenants de la recherche (article L. 1121-1 du code de la santé publique) _ Le premier alinéa de l'article L. 1121-1 du code de la santé publique, tel que réécrit par le II de cet article, propose de remplacer les termes « essais ou expérimentations de nouvelles techniques ou de nouveaux produits » - auxquels s'appliquent les dispositions du livre premier précité du code de la santé publique relatif à la protection de personnes en matière de santé - par celui de « recherche ». Ce terme correspond mieux, en effet, au champ d'application de la loi, qui porte également sur les recherches à visée cognitive. En outre, l'article L. 1121-1 nouveau modifie les définitions de l'investigateur et du promoteur ainsi que le champ des recherches soumises au régime des recherches biomédicales, afin de transposer les articles 1.1, 2-a et 2-c de la directive n° 2001/20 précitée. _ Le deuxième alinéa de l'article L. 1121-1 précise tout d'abord que les dispositions du titre II relatif aux recherches biomédicales ne s'appliquent pas aux recherches « dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle et lorsque aucune procédure supplémentaire ou inhabituelle de diagnostic ou de surveillance n'est appliquée » (essais « non-interventionnels » au sens de la directive). _ Le troisième alinéa complète la définition du promoteur - qui désigne actuellement la personne, physique ou morale, qui prend l'initiative de la recherche - en précisant que le promoteur doit également assurer la gestion de la recherche. Outre la transposition de la directive précitée, cette disposition permet ainsi de remédier aux difficultés posées par la définition actuelle du promoteur dans certains domaines, notamment pour les recherches conduites par des établissements publics à caractère scientifique ou technique ou des universités, dans lesquelles l'initiative de la recherche est souvent prise par l'investigateur. _ En application du dernier alinéa de l'actuel article L. 1121-1, lorsque la réalisation de la recherche est confiée à plusieurs investigateurs, le promoteur doit désigner parmi eux un « investigateur coordonnateur », responsable d'un site ou de plusieurs sites et qui a notamment pour rôle de saisir le CCPPRB. Si la directive prévoit la désignation d'un « investigateur principal » lorsque le promoteur confie la réalisation de la recherche à plusieurs investigateurs sur un même lieu, elle ne comporte cependant pas de dispositions particulières pour les recherches portant sur plusieurs sites. De ce fait, le dernier alinéa de l'article L. 1121-1 transpose la définition de l'investigateur principal et maintient le notion d'investigateur coordonnateur pour les recherches réalisées sur plusieurs sites en France. b) Les objectifs de la recherche (article L. 1121-2 du code de la santé publique) Le III de cet article complète l'article L. 1121-2 du code de la santé par trois nouveaux alinéas visant à : - introduire le principe de minimisation de la douleur, des désagréments, de la peur ou d'autres contraintes pour les personnes qui se prêtent à des recherches ; - reprendre le principe de primauté de la personne sur les seuls intérêts de la science et de la société, qui est posé par la directive pour les mineurs et les majeurs hors d'état d'exprimer leur consentement et étendu à l'ensemble des recherches biomédicales ; - préciser que les conditions définies par cet article sont cumulatives et que leur respect doit être constamment maintenu. c) Les conditions de réalisation de la recherche (article L. 1121-3 du code de la santé publique) Le IV de cet article complète l'article L. 1121-3 du code de la santé publique par deux nouveaux alinéas précisant les conditions dans lesquelles les recherches biomédicales doivent être réalisées. _ Reprenant les dispositions votées par le Sénat lors de l'examen du projet de loi relatif à la bioéthique, le sixième alinéa nouveau de l'article L. 1121-3 permet tout d'abord de déroger à l'obligation de direction ou de surveillance de la recherche par un médecin pour « les recherches ne portant pas sur les produits mentionnés à l'article L. 5311-1 et ne comportant que des risques négligeables ». Dans ce cas, la recherche pourra en effet être réalisée sous la direction ou la surveillance d'une personnalité qualifiée, ce qui permettra d'assouplir cette procédure pour certaines recherches, notamment les recherches cognitives ou de biologie médicale. _ Le septième alinéa nouveau du même article pose le principe des bonnes pratiques cliniques dans le domaine du médicament, qui sont obligatoires - fixées par arrêté du ministre chargé de la santé sur proposition de l'AFSSAPS - conformément à l'article premier de la directive. Pour les autres recherches, seules des recommandations de bonnes pratiques d'application volontaire sont fixées par arrêté du ministre chargé de la santé, afin notamment de tenir compte de la diversité des domaines concernés. d) L'institution d'un régime d'autorisation (article L. 1121-4 du code de la santé publique Le premier alinéa de l'article L. 1121-4 du code de la santé publique, tel que réécrit par le V de cet article, introduit les deux principales modifications du régime des recherches biomédicales rendues nécessaires par la transposition de la directive n° 2001-20 précitée : - l'avis obligatoirement favorable d'un « comité d'éthique », c'est-à-dire des comités consultatifs de protection des personnes dans la recherche biomédicale (CCPPRB) (sur l'organisation et les missions des comités, voir le commentaire sous l'article 44 du projet de loi) ; - l'autorisation de l'autorité compétente, soit l'AFSSAPS pour les médicaments, les produits cosmétiques et d'hygiène corporelle, ou le ministre chargé de la santé dans les autres cas. En outre, le deuxième alinéa du même article prévoit que la saisine du comité de protection des personnes et la demande d'autorisation par l'autorité compétente peuvent se dérouler de façon séquentielle, comme c'est le cas aujourd'hui, ou simultanément, conformément à la directive. 2. Les règles particulières de participation à la recherche biomédicale des personnes vulnérables Les articles L. 1121-5 à L. 1125-9 du code de la santé publique, tels que modifiés par l'article 42 du projet de loi, précisent les conditions de participation des personnes vulnérables à une recherche biomédicale, afin de prendre en compte les conséquences de la suppression de la distinction entre les recherches avec ou sans bénéfice individuel direct (BID), mais également de clarifier le dispositif actuel et transposer certaines dispositions de la directive n° 2001-20 précitée. a) Les femmes enceintes, les parturientes et les mères qui allaitent (article L. 1121-5 du code de la santé publique) L'article L. 1121-4 du code de la santé publique ne prévoit actuellement de mesures particulières de protection pour les femmes enceintes, les parturientes et les mères qui allaitent que dans le cas des recherches sans bénéfice individuel direct (BID). Ces recherches ne sont en effet admises que si « elles ne présentent aucun risque sérieux prévisible pour leur santé ou celle de leur enfant, si elles sont utiles à la connaissance des phénomènes de la grossesse, de l'accouchement ou de l'allaitement et si elles ne peuvent être réalisées autrement ». En conséquence, les femmes enceintes sont soumises aux conditions de droit commun lorsqu'il s'agit de recherches avec BID. Compte tenu de la suppression de la distinction entre les recherches avec ou sans BID, l'article L. 1121-5 du code de la santé publique, réécrit par le VI de cet article propose d'étendre à l'ensemble des recherches biomédicales, en les adaptant, les dispositions protectrices prévues pour les femmes enceintes18. Les recherches sur ces personnes ne peuvent désormais être réalisées que dans les conditions suivantes : - soit l'importance du bénéfice escompté pour elles-mêmes ou pour l'enfant est de nature à justifier le risque prévisible encouru ; - soit un bénéfice pour d'autres femmes se trouvant dans la même situation peut en être attendu, mais uniquement si des recherches d'une efficacité comparable ne peuvent être effectuées sur d'autres catégories de personnes. Dans ce cas les risques et les contraintes de la recherche ne doivent présenter qu'un caractère minimal19. b) Les personnes privées de liberté, hospitalisées sans consentement et admises dans un établissement sanitaire et social à d'autres fins que la recherche (article L. 1121-6 du code de la santé publique) Compte tenu de la situation de dépendance dans laquelle ils se trouvent, l'actuel article L. 1121-5 du code de la santé publique prévoit un régime protecteur particulier pour les personnes privées de liberté, les malades en situation d'urgence et les personnes hospitalisées sans consentement. Ces personnes ne peuvent se prêter à une recherche biomédicale que si l'on peut en attendre « un bénéfice direct et majeur pour leur santé ». Le VI de cet article regroupe à l'article L. 1121-6 du même code les règles applicables aux personnes privées de liberté et hospitalisées sans consentement ainsi que les personnes admises dans un établissement sanitaire ou social à d'autres fins que celle de la recherche (cette dernière catégorie est l'une de celles mentionnées à l'actuel article L. 1121-6). En outre, la référence aux personnes en situation d'urgence est supprimée, puisque il s'agit de personnes hors d'état d'exprimer leur consentement, auxquelles s'appliquent les dispositions prévues par l'article L. 1121-8 nouveau du même code. Les exigences posées pour ces catégories de personnes sont analogues à celles qui sont prévues pour les femmes enceintes par l'article L. 1121-5 du même code. c) Les mineurs (article L. 1121-7 du code de la santé publique) L'actuel article L. 1121-6 du code de la santé publique dispose que les recherches biomédicales ne peuvent être réalisées sur les mineurs et les majeurs protégés par la loi que si l'on peut en attendre « un bénéfice direct et majeur pour leur santé », ou si les trois conditions suivantes sont réunies : l'absence de risque sérieux prévisible pour leur santé, l'utilité des recherches pour des personnes présentant les mêmes caractéristiques d'âge, de maladie ou de handicap et si ces recherches ne peuvent être réalisées autrement. La directive n° 2001/20 prévoyant des dispositions différentes pour les mineurs (article 4) et les majeurs hors d'état d'exprimer leur consentement (article 5), l'article L. 1121-7, réécrit par le VIII de cet article (qui reprend les dispositions de l'actuel article L. 1121-6) ne s'applique plus désormais qu'aux mineurs. Les exigences posées pour les mineurs sont analogues à celles qui sont énoncées dans les articles précédents. Toutefois, cet article prévoit que, pour les mineurs, l'impossibilité de mener des recherches d'efficacité comparable est requise dans tous les cas - et non plus seulement pour les recherches qui se justifient au regard du bénéfice escompté pour d'autres mineurs. Il s'agit donc d'un régime plus protecteur. d) Les majeurs protégés par la loi et les personnes hors d'état d'exprimer leur consentement (article L. 1121-8 du code de la santé publique) L'article L. 1121-8 du code de la santé publique, réécrit par le IX de cet article prévoit des mesures de protection particulières pour les majeurs sous tutelle (prévues par l'actuel article L. 1121-6), les personnes en situation d'urgence (actuel article L. 1121-5) et les personnes qui ne sont pas de fait en état d'exprimer un consentement, sans être sous tutelle ni en situation d'urgence. Les dispositions prévues par l'article 5 de la directive n° 2001-20 s'appliquent à ces catégories de personnes, dans la mesure où elles sont toutes hors d'état d'exprimer leur consentement, au moins temporairement. Les mesures de protection particulières prévues pour ces personnes sont les mêmes que celles instituées pour les mineurs par l'article L. 1121-7 nouveau du même code. Enfin, l'article L. 1121-9 du code de la santé publique, tel que réécrit par le X de cet article, prévoit l'application des dispositions les plus protectrices dans le cas où une personne appartient à plusieurs catégories mentionnées aux articles précédents. 3. Les conditions de réalisation des recherches et les conséquences de la suppression de la distinction entre les recherches avec ou sans BID a) L'unification du régime de responsabilité du promoteur (article L. 1121-10 du code de la santé publique) Actuellement, en application de l'article L. 1121-7 du code de la santé publique, il existe deux régimes distincts de responsabilité du promoteur, selon qu'il s'agit d'une recherche avec ou sans bénéfice individuel direct (BID) : - Lorsque les recherches sont réalisées sans BID, le promoteur assume, même sans faute, l'indemnisation des conséquences dommageables de la recherche (régime de responsabilité sans faute). - Lorsque les recherches sont réalisées avec BID, le promoteur assume l'indemnisation des dommages, « sauf preuve à sa charge que le dommage n'est pas imputable à sa faute20» (régime de responsabilité pour faute présumée). Du fait de la suppression de la distinction entre les recherches avec ou sans BID, l'article L. 1121-10, modifié par le XI de cet article, propose de généraliser le régime de responsabilité pour faute présumée, celui-ci paraissant, comme l'indique l'exposé des motifs du projet de loi, mieux adapté pour s'appliquer à l'ensemble des recherches biomédicales. b) L'indemnisation des contraintes subies, l'examen médical préalable et l'obligation d'affiliation à un régime de sécurité sociale (article L. 1121-11 du code de la santé publique) Le XII de cet article, qui modifie l'article L. 1121-11 du code de la santé publique, a pour objet de regrouper, en les modifiant, plusieurs dispositions prévues par l'actuel article L. 1121-8 et par trois articles figurant dans le chapitre IV actuel du même titre relatif aux recherches sans BID. · L'article L. 1121-11 reprend tout d'abord les dispositions de l'actuel article L. 1121-8, qui pose le principe de l'interdiction de contreparties financières, à l'exception notamment du remboursement des frais. Il généralise, d'autre part, à l'ensemble des recherches biomédicales la possibilité pour le promoteur- actuellement réservée aux recherches sans BID - de verser une indemnité en compensation des contraintes subies, dans la limite d'un montant maximum fixé par le ministre chargé de la santé. En effet, dans certains cas (maladies chroniques notamment), il peut sembler injustifié d'exclure la possibilité de verser une indemnisation des contraintes subies, sous prétexte qu'il s'agit d'essais thérapeutiques dont les personnes pourraient éventuellement bénéficier. Toutefois, l'indemnisation des contraintes subies reste interdite pour toutes les catégories de personnes vulnérables, à l'exception des femmes enceintes, puisque elles conservent leur entière capacité à consentir. · L'obligation d'examen médical préalable adapté à la recherche, actuellement limité aux recherches sans BID, est désormais étendue à toutes les catégories de recherches. Toutefois, reprenant une dérogation adoptée par le Sénat lors de l'examen du projet de loi relatif à la bioéthique, le septième alinéa de cet article prévoit que cette obligation ne s'applique pas aux recherches ne portant pas sur les produits de santé mentionnés à l'article L. 5311-1 (essentiellement les médicaments) et ne comportant que des risques négligeables. · Enfin, l'obligation d'affiliation à un régime de sécurité sociale (actuellement limitée aux recherches sans BID) est désormais étendu à tous les participants à des recherches biomédicales. c) La période d'exclusion des recherches (article L. 1121-12 du code de la santé publique) En application de l'actuel article L. 1124-4 du code de la santé, pour les recherches sans BID, le protocole soumis à l'avis du consultatif du CCPPRB doit déterminer une période d'exclusion au cours de laquelle la personne ne peut participer à une autre recherche sans BID. Le XIII de cet article insère un article L. 1121-12 dans le code de la santé publique, qui reprend ces dispositions en les adaptant. Ainsi, le comité doit déterminer « si nécessaire » une période d'exclusion de la recherche, dont la durée varie désormais en fonction de la nature de la recherche. d) L'autorisation des lieux de recherches (article L. 1121-13 du code de la santé publique) En vertu de l'actuel article L. 1124-6 du code de la santé publique, les recherches sans BID ne peuvent être réalisées que dans des lieux préalablement autorisés par l'autorité administrative compétente. Or, dans la pratique, cette obligation s'avère quasiment impraticable en dehors des centres hospitaliers - notamment en médecine de ville ou lors des études épidémiologiques de terrain - conduisant de fait à empêcher la réalisation des ces recherches. De plus, cette obligation ne permet pas d'assurer efficacement la protection des personnes, dans la mesure où les autorisations sont données a priori, sans procédure de renouvellement et indépendamment des projets qui seront réalisés. Le XIII de cet article, qui insère un article L. 1121-13 nouveau dans le code précité, propose donc de limiter l'autorisation préalable des lieux de recherches aux deux cas suivants : - les recherches réalisées en dehors des lieux de soins (il s'agit essentiellement de certains centres d'essais de phase I) ; - les recherches réalisées dans des services hospitaliers ou des lieux d'exercice des professionnels de santé lorsque les actes pratiqués ne relèvent pas de la pratique usuelle de ces professionnels, ou lorsque la recherche porte sur des personnes dont la condition clinique ne correspond pas à la compétence du service. Il s'agit ainsi de limiter l'autorisation des lieux de recherches aux seules situations qui nécessitent réellement un contrôle a priori des moyens humains, organisationnels, matériels et techniques mis en œuvre. En conséquence, la dérogation à l'obligation d'autorisation des lieux de recherches, prévue par l'actuel article L. 1124-621, issu de la loi du 4 mars 2002 relative aux droits des malades, est supprimée. e) Les recherches portant sur des personnes en état de mort cérébrale (article L. 1121-14 du code de la santé publique) L'article L. 1121-14 nouveau du code de la santé publique, inséré par le XIV de cet article reprend, en les adaptant, les dispositions prévues par l'actuel article L. 1124-5 du même code, aux termes duquel « aucune recherche biomédicale ne peut être effectuée sur une personne en état de mort cérébrale sans son consentement exprimé directement ou par le témoignage de sa famille ». L'article L. 1121-14 prévoit désormais que ces recherches doivent respecter les conditions prévues par l'article L. 1232-3, issu de la loi n° 94-653 du 29 juillet 1994, dite « loi bioéthique ». Ce dernier précisant les conditions de consentement en cas de prélèvement à des fins scientifiques autres que la recherche des causes du décès, il paraît en effet logique de prévoir les mêmes conditions pour les recherches sur les personnes en état de mort cérébrale. f) L'institution d'un répertoire de données pour les recherches autorisées (article L. 1121-15 du code de la santé publique) En premier lieu, le premier alinéa de l'article L. 1121-15 nouveau du code de la santé publique, inséré par le XV de cet article prévoit l'institution d'une base de données nationale pour l'ensemble des recherches biomédicales. Selon l'exposé des motifs du projet de loi, celle-ci comporterait toutes les informations essentielles du dossier de demande d'autorisation à l'autorité compétente. Transposant l'article 11-1 de la directive n° 2001-20 précitée, cet article précise que pour les recherches portant sur le médicament, l'autorité compétente est tenue de transmettre à l'organisme gestionnaire de la base de données européenne les informations figurant sur une liste fixée par décret en Conseil d'Etat. Le deuxième alinéa de l'article L. 1121-15 prévoit, en second lieu, que l'autorité compétente doit mettre la disposition du public des répertoires des recherches biomédicales autorisées. Ceux-ci permettront en effet de faciliter la constitution des cohortes, notamment pour les recherches portant sur des maladies rares, et d'éviter les recherches redondantes. Le promoteur pourra cependant s'opposer, par un refus motivé, à l'inclusion des informations relatives à la recherche qu'il dirige dans ces répertoires. g) La limitation du champ du fichier national des participants à une recherche biomédicale (article L. 1121-16 du code de la santé publique) L'article L. 1121-16 nouveau du code de la santé publique, inséré par le XVI de cet article, maintient le fichier national actuellement prévu pour les recherches sans bénéfice individuel direct par l'article L. 1121-4, en le limitant au recensement des « personnes qui ne présentent aucune affection et se prêtent volontairement à ces recherches ainsi que les personnes malades pour lesquelles les bénéfices escomptés sont sans rapport avec l'état pathologiques ». Il s'agit de recentrer ce fichier sur les catégories de recherche pour lesquelles il paraît réellement justifié et susceptible d'être efficace. Enfin, le XVII de cet article modifie par cohérence les dispositions prévues par l'actuel article L. 1121-10 du code de la santé publique, reprises à l'article L. 1121-17 nouveau, qui précise les conditions d'application de ce chapitre. * Article L. 1121-1 du code de la santé publique La commission a examiné un amendement de M. Olivier Jardé visant à instaurer une distinction entre les recherches biomédicales avec ou sans bénéfice individuel potentiel. Le rapporteur et M. Pierre-Louis Fagniez se sont déclarés opposés à l'amendement. La commission a rejeté l'amendement et examiné un amendement de M. Claude Evin visant à préciser que le promoteur d'une recherche biomédicale doit en assurer le financement. Le rapporteur et M. Pierre-Louis Fagniez se sont déclarés favorables à l'amendement. La commission a adopté l'amendement. La commission a ensuite adopté un amendement de précision de M. Claude Evin. Elle a examiné un amendement de M. Claude Evin visant à préciser la notion d'investigateur coordonnateur et à supprimer la notion de responsable de l'équipe. M. Pierre-Louis Fagniez a présenté un sous-amendement désignant un investigateur principal sur le site et en gardant l'investigateur coordonnateur lorsqu'il y a plusieurs sites. Le rapporteur s'est déclaré favorable au sous-amendement. La commission a adopté le sous-amendement, puis l'amendement ainsi modifié. Article L. 1121-2 du code de la santé publique La commission a examiné un amendement de M. Claude Evin tendant à préciser que les inconvénients prévisibles mentionnés par cet article étaient liés à la recherche, et non à la maladie. M. Pierre-Louis Fagniez a précisé que la formulation retenue par le projet de loi reprenait les dispositions prévues par la directive du 4 avril 2001. La commission a rejeté l'amendement. La commission a ensuite rejeté un amendement de précision de M. Claude Evin. Article L. 1121-3 du code de la santé publique La commission a adopté un amendement du rapporteur permettant l'accès à des données individuelles aux personnes chargées du contrôle de qualité d'une recherche biomédicale. M. Claude Evin a retiré deux amendements visant à supprimer la possibilité de confier à une personne qualifiée la direction d'une recherche ne comportant que des risques négligeables. La commission a adopté un amendement du rapporteur visant à limiter le champ de cette procédure allégée aux recherches qui n'ont aucune influence sur la prise en charge médicale de la personne qui s'y prête. Article L. 1121-5 du code de la santé publique La commission a rejeté un amendement de M. Olivier Jardé visant à maintenir le régime actuel de protection des femmes enceintes, des parturientes et des mères qui allaitent dans le cas de recherches biomédicales. La commission a rejeté un amendement de M. Claude Evin visant à préciser la notion de recherche dont les risques et les contraintes doivent présenter un caractère national, après que le rapporteur a relevé que la rédaction proposée est particulièrement floue. Article L. 1121-6 du code de la santé publique La commission a rejeté un amendement de M. Olivier Jardé disposant que les personnes privées de liberté et les personnes hospitalisées sans consentement ne peuvent être sollicitées pour se prêter à des recherches biomédicales que s'il en est attendu un bénéfice potentiel pour leur santé. Elle a rejeté un amendement de M. Claude Evin précisant la notion de risques et contraintes minimales et adopté un amendement de précision du même auteur sur avis favorable du rapporteur. La commission a rejeté un amendement de M. Olivier Jardé visant à maintenir le régime de protection des mineurs se prêtant à une recherche biomédicale, issu de la loi Huriet. Elle a rejeté un amendement de coordination de M. Claude Evin. Article L. 1121-8 du code de la santé publique La commission a rejeté un amendement de M. Olivier Jardé visant à maintenir, dans le cas de recherches biomédicales, le régime de protection des majeurs protégés par la loi et des personnes hors d'état d'exprimer leur consentement issu de la loi du 20 décembre 1988. La commission a adopté un amendement de précision du rapporteur et rejeté un amendement de M. Claude Evin de coordination sur la notion de risques et de contraintes minimales. Article L. 1121-10 du code de la santé publique La commission a examiné un amendement du rapporteur précisant qu'en matière de recherches biomédicales la prise en charge des assureurs est limitée aux réclamations intervenant pendant la durée de la recherche et jusqu'à l'expiration d'une période de dix ans suivant la fin de cette recherche. M. Pierre-Louis Fagniez a expliqué que cet amendement se justifie par l'évolution de la réglementation en matière d'assurance. La commission a adopté l'amendement. Article L. 1121-11 du code de la santé publique La commission a ensuite adopté un amendement de correction de M. Claude Evin et rejeté trois amendements de coordination de M. Olivier Jardé. La commission a rejeté un amendement de M. Claude Evin supprimant la disposition exonérant d'examen médical préalable les personnes participant à des recherches ne portant pas sur des médicaments. La commission a adopté un amendement de coordination du rapporteur. Article L. 1121-12 du code de la santé publique La commission a rejeté un amendement de M. Olivier Jardé visant à définir un régime spécifique applicable aux essais sans bénéfice individuel. La commission a adopté un amendement de précision rédactionnelle du rapporteur, rétablissant explicitement l'impossibilité de participer simultanément à une autre recherche. Article L. 1121-13 du code de la santé publique La commission a examiné un amendement de M. Claude Evin supprimant la notion de lieux de soins. M. Claude Evin a expliqué que cette notion est dépourvue de toute portée juridique. M. René Couanau, président, a approuvé cet amendement, tandis que M. Pierre-Louis Fagniez a considéré qu'il s'agit d'un terme générique recouvrant des lieux tels qu'un cabinet médical ou encore une antenne mobile de prélèvement. Après que le rapporteur s'en est remis à la sagesse de la commission, celle-ci a rejeté l'amendement. La commission a adopté un amendement du rapporteur harmonisant les procédures d'autorisation des lieux de recherche. Article L. 1121-14 du code de la santé publique La commission a examiné un amendement de M. Claude Evin modifiant les dispositions encadrant les recherches biomédicales sur les personnes en état de mort cérébrale, d'une part en remplaçant le mot « personne » par le mot « sujet » et d'autre part en précisant les conditions d'expression du consentement. M. Claude Evin a expliqué que le mot : « personne » ne peut être utilisé juridiquement pour un individu en état de mort cérébrale. M. Pierre-Louis Fagniez a suggéré de se référer à la notion d'être humain, déjà retenue dans d'autres dispositions du projet de loi, plutôt qu'à celle de sujet. M. Claude Evin a accepté de rectifier son amendement en ce sens. La commission a adopté l'amendement ainsi rectifié. Article L. 1121-16 du code de la santé publique La commission a rejeté un amendement de coordination de M. Olivier Jardé. La commission a adopté deux amendements du rapporteur, le premier visant à préciser dans la loi la finalité du fichier national des volontaires et le second de portée rédactionnelle. Elle a ensuite adopté l'article 42 ainsi modifié. Article 43 (articles L. 1122-1 et L. 1122-2 du code de la santé publique) Règles de consentement de la personne se prêtant à une recherche biomédicale Cet article a pour objet de modifier le chapitre II relatif au consentement de la personne du titre deuxième du livre premier du code de la santé publique, afin : - d'une part, d'améliorer l'information délivrée aux personnes qui envisagent de se prêter à une recherche biomédicale ; - d'autre part, d'aménager les règles de recueil du consentement, s'agissant notamment des personnes vulnérables ou qui sont hors d'état d'exprimer leur consentement. 1. Les règles actuelles de consentement de la personne se prêtant à une recherche biomédicale a) Le principe : la nécessité d'un consentement libre, éclairé et exprès Conformément à l'article L. 1122-1 du code de la santé publique, la participation d'une personne à une recherche biomédicale requiert au préalable son consentement « libre » (elle accepte, refuse ou retire son consentement à tout moment, sans avoir à se justifier, ni encourir de responsabilité), « éclairé » (elle doit bénéficier d'informations lui permettant de décider en toute connaissance de cause) et « exprès » (elle doit donner son consentement de manière explicite et formelle). Afin de garantir la réalité de ce consentement, cet article précise le contenu minimal de l'information qui doit lui être délivrée par l'investigateur, ou le médecin qui le représente, c'est-à-dire principalement : - l'objectif, la méthodologie et la durée de la recherche ; - les bénéfices attendus, les contraintes et les risques prévisibles, y compris en cas d'arrêt de la recherche avant son terme ; - l'avis du CCPPRB, consulté au préalable ; - le cas échéant, son inscription dans le fichier national mentionné à l'article L. 1123-6 du même code ; - son droit de refuser de participer à une recherche ou de retirer son consentement à tout moment « sans encourir aucune responsabilité ». b) Un régime dérogatoire très encadré en cas d'urgence Dans des situations d'urgence ne permettant pas de recueillir le consentement préalable de la personne, le protocole de recherche soumis à l'avis du CCPPRB peut prévoir, conformément à l'article L. 1122-1 précité, que le consentement de celle-ci ne sera pas recherché et que seul sera sollicité : - celui des membres de sa famille, s'ils sont présents ; - et, uniquement à défaut, l'avis de la « personne de confiance », mentionnée par l'article L. 1111-6 du même code, tel qu'issu de loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé. Cette personne, qui peut être un parent, un proche ou le médecin traitant, doit être désignée par écrit par le patient. c) Un régime particulier pour les mineurs et les majeurs protégés par la loi En vertu de l'article L. 1122-2 du même code, lorsqu'une recherche biomédicale est effectuée sur des mineurs non émancipés, le consentement doit être recueilli auprès des titulaires de l'autorité parentale. S'agissant des mineurs ou des majeurs protégés par la loi, celui-ci doit être donné par : - le représentant légal pour les recherches avec bénéfice individuel direct ne présentant pas un risque prévisible sérieux ; - le représentant légal autorisé par le conseil de famille ou le juge des tutelles dans les autres cas. En outre, l'enfant ou le majeur protégé par la loi doit être consulté lorsqu'il est apte à exprimer sa volonté. On rappellera à cet égard qu'en application des articles 490 et suivants du code civil, les majeurs « protégés par la loi » désignent les personnes dont les facultés mentales sont altérées par une maladie, une infirmité ou un affaiblissement dû à l'âge, et qui sont de ce fait placées sous l'un des régimes de protection suivants : - la curatelle, lorsqu'un majeur, sans être hors d'état d'agir lui-même, a besoin d'être conseillé ou contrôlé dans les actes de la vie civile ; - La sauvegarde de justice, lorsque celui-ci a besoin d'être protégé dans les actes de la vie civile ; - La tutelle, lorsque que le majeur besoin d'être représenté d'une manière continue dans les actes de la vie civile. En conséquence, il est actuellement impossible de réaliser des recherches biomédicales sur des personnes qui sont hors d'état d'exprimer leur consentement et qui ne sont pas protégées par la loi, comme c'est notamment le cas des personnes atteintes de formes graves de la maladie d'Alzheimer. 2. L'amélioration de l'information des participants et l'aménagement des règles générales de consentement de la personne : l'article L. 1122-1 Le paragraphe I, qui modifie la rédaction de l'article L. 1122-1 du code de la santé publique, a tout d'abord pour objet d'améliorer l'information préalable des participants éventuels à une recherche biomédicale. Il propose également d'aménager les règles générales de recueil du consentement, dans le cas notamment des situations d'urgence. a) L'amélioration de l'information préalable des participants _ Les cinquième (2°) et neuvième (3°) alinéas du I visent, tout d'abord, à compléter la liste des informations qui doivent être communiquées au participant, préalablement à sa participation à la recherche, par : - les éventuelles alternatives médicales, ce qui, selon l'exposé des motifs du projet de loi, vise à s'assurer qu'il est délivré une information loyale au participant sur les possibilités de prise en charge de sa pathologie, en dehors de la recherche, sans pour autant exiger un inventaire exhaustif et à bien lui faire comprendre la place de la recherche par rapport à celle du soin ; - le cas échéant, les modalités de prise en charge médicale prévues en fin de recherche (y compris en cas d'arrêt prématuré à la demande de la personne participant à la recherche) ; - enfin, l'autorisation de l'autorité compétente mentionnée à l'article L. 1123-12 du même code (cf le commentaire de l'article 44 du projet de loi). _ En outre, le douzième alinéa (5°) du I prévoit que la personne est informée de son droit de refuser de participer à une recherche ou de retirer son consentement à tout moment sans encourir « aucun préjudice de ce fait », ce qui permettra d'offrir une protection plus large aux participants. _ Enfin, le treizième alinéa (6°) du même paragraphe vise à modifier les règles d'information des participants à l'issue de la recherche. En effet, le neuvième alinéa de l'article L. 1122-1 actuel du même code, issu de la loi du 4 mars 2002 précitée, institue l'obligation d'informer le participant sur « les résultats globaux de la recherche ». Or, certaines personnes peuvent ne pas souhaiter cette information, qui peut les renvoyer à un passé douloureux, et ce d'autant plus que les résultats de l'étude ne sont parfois connus que très tardivement. C'est en particulier le cas des recherches en oncologie22, notamment pédiatrique. C'est pourquoi le 6° prévoit que la personne « a le droit », et non l'obligation, « d'être informée », selon des modalités précisées dans le document résumant les informations qui lui sont communiquées avant le commencement de la recherche. b) L'aménagement des règles générales de recueil du consentement _ Dans le cas des personnes admises dans un établissement sanitaire ou social à d'autres fins que celles de la recherche, et qui se trouvent de ce fait dans une situation de dépendance, le quatorzième alinéa (7°) du I prévoit que l'information est désormais délivrée et le consentement recueilli par un médecin indépendant de l'équipe hospitalière qui assure la prise en charge du patient. _ Le dispositif dérogatoire actuellement prévu dans les situations d'urgence par le dernier alinéa de l'article L. 1122-1 semble a priori incompatible avec une interprétation restrictive de l'article 3.2.b de la directive n° 2001-20 précitée23. Toutefois, compte tenu de l'intérêt présenté par ces recherches en termes de santé publique, mais également des adaptation juridiques annoncées par la Commission européenne, le 8° du I maintient globalement le dispositif actuel et propose simplement de mettre sur le même plan la famille et la personne de confiance. Dans la mesure où cette dernière est désignée par un acte exprès du participant à la recherche, il n'y a pas lieu en effet que son consentement ne soit recueilli que de façon subsidiaire. 3. L'aménagement des règles particulières de recueil du consentement des personnes vulnérables : l'article L. 1122-2 Le paragraphe II du présent article procède à une réécriture complète de l'article L. 1122-2 du code de la santé publique, qui regroupe désormais les modalités de consentement concernant : - les mineurs non émancipés (premier alinéa) ; - les mineurs et majeurs sous tutelle (deuxième alinéa) ; - les personnes hors d'état de facto de donner leur consentement et ne faisant pas l'objet d'une mesure de protection légale (troisième alinéa) ; - les personnes sous curatelle et sauvegarde de justice (quatrième alinéa). a) Les mineurs ou majeurs sous tutelle Le deuxième alinéa de cet article vise tout d'abord à réserver aux personnes sous tutelle les modalités particulières de recueil du consentement prévues par l'actuel article L. 1122-1, et non plus à l'ensemble des personnes protégées par la loi. De ce fait, dans le prolongement des dispositions issues de la loi du 4 mars 2002 précitée concernant le consentement aux soins, les personnes sous curatelle ou sauvegarde de justice conservent leur capacité à consentir en matière de recherche. S'agissant des mineurs ou majeurs sous tutelle, du fait de la suppression de la distinction entre les recherches avec ou sans bénéfice individuel direct, le critère de distinction entre les cas où l'autorisation est donnée par le représentant légal et ceux où il est donné par le juge des tutelles ou le conseil de famille repose désormais sur l'éventualité que la recherche puisse « porter atteinte au respect de la vie privée ou à l'intégrité du corps humain ». b) Les personnes hors d'état d'exprimer leur consentement et qui ne sont pas sous tutelle L'article L. 1121-8 du code de la santé publique, tel que modifié par l'article 42 du projet de loi, définit les conditions de participation à des recherches biomédicales des personnes hors d'état d'exprimer leur consentement et qui ne sont pas sous tutelle. Afin de promouvoir le développement des connaissances et des thérapeutiques dans ce domaine, s'agissant en particulier de la maladie d'Alzheimer, le troisième alinéa de l'article L. 1222-2 prévoit des règles spécifiques de recueil du consentement pour ces personnes. Ainsi, l'autorisation de participer à la recherche pourra désormais être donnée par la personne de confiance ou, à défaut, par la famille ou ,à défaut, par un proche de l'intéressé entretenant avec celui-ci des liens étroits et stables. En outre, l'avis du juge des tutelles devra être recueilli pour les recherches « susceptibles de porter atteinte au respect de la vie privé ou à l'intégrité du corps humain ». c) Les personnes sous curatelle ou sauvegarde de justice Le quatrième alinéa de l'article L. 1122-2 prévoit que lorsqu'une recherche biomédicale est effectuée sur des personnes majeures sous curatelle ou sauvegarde de justice, le consentement est donné par l'intéressé, assisté selon les cas par son curateur ou par le mandataire spécial qui lui a été désigné. Toutefois, si la personne est sollicitée en vue de sa participation à une recherche susceptible de porter atteinte au respect de la vie privée ou à l'intégrité du corps humain, l'avis du juge des tutelles doit être nécessairement recueilli. Enfin, le cinquième alinéa concerne l'assistance apportée aux personnes se prêtant à une recherche biomédicale. Il prévoit l'obligation, pour les personnes, organes ou autorités qui sont habilités à donner un consentement à la recherche, en application des trois premiers alinéas du même article, de donner à la personne une information adaptée à sa capacité de compréhension, sans préjudice de celle qui doit lui être délivrée par l'investigateur. * La commission a examiné un amendement de M. Claude Evin intitulant le chapitre II du titre II du livre I de la première partie du code de la santé publique : « Information de la personne qui se prête à une recherche biomédicale et recueil de son consentement ». M. Claude Evin a précisé que cet amendement précise plusieurs autres amendements proposant une nouvelle rédaction de l'article 43 afin de distinguer le temps de l'information et le temps du recueil du consentement. Il s'agit de prévoir, comme le faisait la loi du 4 mars 2002, d'une part un article précisant les informations à donner à la personne qui se prête à une recherche, et, d'autre part, un article précisant les conditions d'expression du consentement. Après que le rapporteur a donné un avis favorable, la commission a adopté l'amendement. Article L. 1122-1 du code de la santé publique La commission a examiné un amendement de M. Claude Evin proposant une nouvelle rédaction de l'article L. 1122-1 du code de la santé publique pour préciser les modalités d'information de la personne qui se prête à une recherche biomédicale. M. Claude Evin a souligné que l'amendement apporte également plusieurs modifications au texte initial afin de mieux transposer le texte de la directive du 4 avril 2001. M. Pierre-Louis Fagniez, tout en considérant que le contenu de l'amendement est acceptable, s'est interrogé sur la nécessité de détailler, à ce point, le contenu de l'information délivrée au participant. Le rapporteur s'en est remis à sa sagesse de la commission. La commission a adopté l'amendement. En conséquence, trois amendements, le premier de M. Olivier Jardé et les deux suivants du rapporteur sont devenus sans objet, M. René Couanau, président, invitant leurs auteurs à les présenter en sous-amendements lors de la réunion que la commission tiendra en application de l'article 88 du Règlement. La commission a examiné un amendement de M. Claude Evin introduisant un nouvel article L. 1122-3 dans le code de la santé publique. M. Claude Evin a expliqué que cet amendement poursuit la logique de réécriture de l'article 43 exposée précédemment. M. René Couanau, président, a observé que les amendements suivants de M. Claude Evin ne permettent pas de donner un contenu à l'article L. 1122-3 visé par le présent amendement. Il serait donc préférable de revoir ultérieurement la suite du dispositif. La commission a rejeté l'amendement. Article L. 1122-2 du code de la santé publique Elle a également rejeté un amendement de M. Claude Evin proposant une nouvelle rédaction de l'article L. 1122-2 du code de la santé publique et précisant les conditions d'expression du consentement de la personne qui se prête à une expérimentation. La commission a rejeté un amendement de M. Claude Evin limitant les cas où les recherches biomédicales portant sur des personnes sous tutelle sont soumises à autorisation du conseil de famille ou du juge des tutelles. La commission a adopté un amendement de M. Pierre-Louis Fagniez précisant que pour les recherches biomédicales portant sur une personnes mineure ou majeure sous tutelle, l'avis du conseil de famille ou du juge des tutelles n'est sollicité que lorsque cette recherche comporte, par l'importance des contraintes ou par la spécificité des interventions auxquelles elle conduit, un risque sérieux d'atteinte à la vie privée ou à l'intégrité du corps humain. La commission a rejeté un amendement de conséquence de M. Claude Evin puis a adopté un amendement de conséquence de M. Pierre-Louis Fagniez. La commission a rejeté trois amendements de M. Claude Evin : le premier limitant les cas où les recherches biomédicales portant sur une personne sous curatelle ou faisant l'objet d'une mesure de sauvegarde de justice sont soumises à autorisation du juge des tutelles, le deuxième de précision, le troisième remplaçant, pour les recherches dans des situations d'urgence, l'obligation de recueillir le consentement d'un membre de la famille ou de la personne de confiance par l'absence d'avis contraire émis par ces personnes. La commission a ensuite adopté l'article 43 ainsi modifié. Article 44 (articles L. 1123-1 à L. 1123-3 et L. 1123-6 à L. 1123-12 du code de la santé publique) Comités de protection des personnes (CPP) Les comités consultatifs de protection des personnes dans la recherche biomédicale (CCPPRB) constituent la pierre angulaire du dispositif mis en place par la loi « Huriet-Sérusclat » (loi n° 88-1138 du 20 décembre 1988 relative à la protection des personnes qui se prêtent à des recherches biomédicales). En effet, avant de réaliser une recherche sur l'être humain, tout investigateur est tenu d'en soumettre le projet à l'avis de l'un des comités compétents dans la région où il exerce son activité. Les projets ayant fait l'objet d'un avis défavorable sont directement communiqués par le comité à l'autorité administrative compétente (l'agence française de sécurité sanitaire des produits de santé - AFSSAPS- pour les produits mentionnés à l'article L. 5311-1 du code de la santé publique24 ou le ministre chargé de la santé dans les autres cas. Ces derniers ne peuvent être mis en oeuvre avant un délai de deux mois à compter de leur réception par l'autorité administrative, qui seule peut en interdire la réalisation (articles L. 1123-1 et suivants du même code). Outre la lourdeur de la procédure réglementaire (voir le schéma présenté ci-après), le régime actuel de déclaration présente de nombreux inconvénients, parmi lesquels : la faiblesse de l'évaluation scientifique des projets par les comités, le manque d'indépendance de leurs membres ou encore le suivi lacunaire des recherches par l'autorité compétente, s'agissant notamment des effets indésirables graves. Cet article modifie et complète l'ensemble du chapitre III du titre II du livre Ier de la première partie du code de la santé publique relatif aux CCPPRB, afin, tout d'abord, de réformer le fonctionnement et les missions des comités, rebaptisés « comités de protection des personnes ». Transposant les dispositions prévues par la directive n° 2001-20 du 4 avril 2001 relative aux essais cliniques de médicaments, il substitue d'autre part, au régime déclaratif actuel un régime d'autorisation, et permet, enfin d'améliorer le suivi des recherches biomédicales.  1. L'amélioration de l'organisation et du fonctionnement des comités de protection des personnes (CPP) Le I de cet article modifie tout d'abord l'intitulé du chapitre III du titre II du livre Ier de la première partie du code de la santé publique - devenu « comité de protection des personnes et autorité compétente » - afin de prendre en compte l'obligation nouvelle d'un avis favorable obligatoire des comités (prévue par l'article 42 du projet de loi), qui ne sont donc plus « consultatifs ». a) Les modalités de constitution des comités : l'article L. 1123-1 Aujourd'hui, en application de l'article L. 1123-1 du code de la santé publique, le ministre chargé de la santé agrée dans chaque région, un ou, selon les besoins, plusieurs CCPPRB et fixe par arrêté leur nombre dans chaque région. Les comités sont compétents au sein de la région où ils ont leur siège, mais leur champ de compétence territoriale peut être étendu à plusieurs régions. Le II de cet article, qui réécrit les deux premiers alinéas de l'article L. 1123-1, propose que les comités soient désormais agréés « pour une durée déterminée », ce qui vise à assurer un meilleur suivi de l'activité des comités en permettant, soit de ne pas renouveler l'agrément du comité au terme de cette période, soit d'adopter le champ de compétence territoriale du comité. En outre, le II supprime le deuxième alinéa de cet article, qui prévoit la détermination par le ministre de la santé du nombre de comités dans chaque région. Cette disposition est en effet inutile, dans la mesure où le ministre détermine déjà le nombre de comités dans chaque région à travers la procédure d'agrément. Le premier alinéa nouveau de l'article L. 1123-1 prévoyant que le ministre fixe désormais la compétence territoriale de chaque comité, le II de cet article supprime également la disposition du deuxième alinéa actuel du même article, précisant que le champ de compétence territoriale d'un comité peut être étendu à plusieurs régions. Enfin, reprenant les dispositions votées par le sénat lors de l'examen du projet de loi relatif à la bioéthique, le II de cet article prévoit la possibilité de créer des comités spécialisés à compétence nationale, dont les membres sont nommés par arrêté du ministre chargé de la santé. En effet, pour les recherches qui nécessitent une vigilance renforcée dans la protection des personnes, et surtout pour des recherches très spécialisées, ces comités spécialisés présenteraient l'avantage d'apporter une expertise particulière permettant de mieux évaluer les risques prévisibles encourus. b) L'assouplissement des règles de nomination: l'article L. 1123-2 Les CCPPRB sont actuellement composés « de manière à garantir leur indépendance et la diversité des compétences dans le domaine biomédical et à l'égard des questions éthiques, sociales, psychologiques et juridiques » (article L. 1123-2 du même code). Leurs membres25, nommés par le préfet, sont choisis parmi les personnes figurant sur une liste établie sur proposition d'organismes ou d'autorités habilités à le faire, dans des conditions déterminées par décret (par exemple les directeurs d'UFR de la région, le directeur général de l'INSERM, les directeurs des principaux établissements ou organismes compétentes en matière de formation ou de recherche biomédicale). Afin de simplifier cette procédure, le III de cet article propose de supprimer l'obligation de consultation préalable, qui explique pour partie les difficultés rencontrées pour la nomination et le renouvellement des membres des comités. c) Le renforcement de l'indépendance des membres : l'article L. 1123-3 Si l'indépendance de leurs membres constitue le fondement de la crédibilité et de la légitimité des CCPPRB, dans la pratique, celle-ci parait souvent mal assurée. En effet, de nombreux membres des institutions (hôpitaux, collectivités territoriales..) siègent au sein de ces comités et connaissent bien les promoteurs, et pour ces recherches. En outre, pour des recherches très spécialisées, les consultants compétentes sont très peu nombreux et peuvent appartenir parfois à des équipes de recherches concurrentes. C'est pourquoi le IV de cet article, qui insère un nouvel alinéa après le premier alinéa de l'article L. 1123-3 du code de la santé publique, institue l'obligation, pour les membres des CPP, de transmettre au préfet de région, ou, le cas échéant, au ministre de la santé, une déclaration mentionnant leurs liens, directs ou indirects, avec les promoteurs et les investigateurs de recherches. Cette déclaration est rendue publique et est actualisée à leur initiative dès qu'une modification intervient concernant ces liens. d) La saisine du comité par le promoteur : l'article L. 1123-6 Actuellement, en application des articles L. 1123-6 du code de la santé publique, le protocole de recherche doit être soumis au CCPPRB par l'investigateur, c'est-à-dire la personne physiques qui dirige et surveille la réalisation de la recherche. Afin d'harmoniser ces dispositions avec la procédure d'autorisation par l'autorité compétente (saisine par le promoteur), le 1° du V de cet article modifie le premier alinéa de l'article L. 1123-6 du code de la santé, afin de confier au promoteur la responsabilité de soumettre le projet de recherche à l'avis de l'un des CPP compétents dans sa région, ou, le cas échéant, à un comité spécialisé à compétence nationale. En conséquence, le 2° du V abroge le deuxième alinéa du même article, qui porte actuellement sur les recherches confiées à plusieurs investigateurs. 2. L'extension du rôle des CPP : l'article L. 1123-7 a) L'évaluation scientifique des projets de recherche et l'appréciation de la balance « bénéfice-risque » En application de l'article L. 1123-7 précité, les comités rendent leur avis sur les conditions de validité des recherches au regard de la protection des personnes et notamment sur : la pertinence générale du projet, l'adéquation entre les objectifs poursuivis et les moyens mis en œuvre, la qualification de l'investigateur, la protection des participants, les modalités de l'information et de recueil du consentement des personnes ainsi que les indemnités éventuellement versées par le promoteur. Le 1° du VII de cet article, qui modifie l'article L. 1123-7 du code de la santé publique, modifie les critères d'évaluation des protocoles de recherche par les comités de protection des personnes. · Il prévoit tout d'abord que le comité se prononce sur la nécessité éventuelle d'un délai de réflexion entre l'information des personnes et le recueil de leur consentement, ce qui permettra de renforcer la protection des participants, en particulier lorsqu'il existe des alternatives médicales. · Afin de transposer les dispositions prévues par l'article 6.3 de la directive n° 2001-20 précitée, le comité doit désormais rendre son avis son avis au regard notamment de « la pertinence générale de la recherche et de sa conception scientifique, notamment méthodologique ». L'évaluation scientifique des projets constitue en effet un des temps majeurs de la procédure d'autorisation, dans la mesure où elle permet d'apprécier la réalité des risques encourus et renforcer de ce fait la protection des participants. · Enfin, le CPP est tenu apprécier « le caractère satisfaisant de l'évaluation des bénéfices et des risques attendus », qui constitue le critère essentiel de l'évaluation d'une recherche, se substituant ainsi à la distinction complexe entre les recherches avec ou sans bénéfice individuel direct. b) Le délai de l'avis des CPP Le 2° du VI prévoit que le délai dans lequel le comité doit rendre son avis sur le projet de recherche, actuellement fixé à 5 semaines par l'article L. 1123-7 précité, soit désormais déterminé par voie réglementaire, afin de pouvoir aménager celui-ci selon les spécificités de certaines recherches. L'exposé des motifs du projet de loi précise toutefois que le délai actuel de 5 semaines sera maintenu dans de nombreux cas. 2. L'institution d'un régime d'autorisation plus protecteur a) Avant le commencement de la recherche : l'article L. 1123-8 Aujourd'hui, le promoteur est tenu de transmettre à l'autorité administrative compétente -l'AFSSAPS ou le ministre chargé de la santé- une lettre d'intention décrivant les données essentielles de la recherche, accompagnée de l'avis du comité. Afin de transposer les dispositions prévues par l'article 9 de la directive, le VII de cet article réécrit l'article L. 1123-8 du code de la santé publique. · Le premier alinéa institue tout d'abord une obligation d'autorisation préalable, en remplacement du régime déclaratif actuel. · De plus, le deuxième alinéa de l'article L. 1123-8 prévoit que lorsque l'autorité a des objections à la mise en œuvre de la recherche, le promoteur peut modifier une fois le contenu de son projet de recherche, à défaut de quoi la demande est considérée comme rejetée. · Le troisième alinéa prévoit enfin que le CPP soit tenu informé des modifications apportées au protocole de recherche à l'initiative de l'autorité compétente. Le VIII de cet article procède par ailleurs à une renumérotation des articles L. 1123-10 et L. 1123-11 du code de la santé publique, devenus les articles L. 1123-13 et L. 1123-14 du même code. b) Après le commencement de la recherche : l'article L. 1123-9 L'article L. 1123-9 du code de la santé publique, réécrit par le IX de cet article, précise qu'après le commencement de la recherche, toute modification substantielle de celle-ci à l'initiative du promoteur est soumise au préalable à l'avis favorable du comité et à l'autorisation de l'autorité compétente. Il s'agit essentiellement de transposer les dispositions prévues par l'article 10 de la directive n° 2001-20 précitée. 3. L'amélioration du suivi des recherches biomédicales Les articles L. 1123-10 et L. 1123-11 du code de la santé publique, insérés par le X de cet article, visent à renforcer le suivi des recherches biomédicales, qui constitue un élément essentiel de la protection des personnes. a) La déclaration des effets indésirables graves : l'article L. 1123-10 Actuellement, le promoteur est tenu d'informer l'autorité administrative compétente, dès qu'il en a connaissance, de : - tout effet ayant pu contribuer à la survenue d'un décès, provoquer une hospitalisation ou entraîner des séquelles organiques ou fonctionnelles durables et susceptibles d'être dues à la recherche ; - de transmettre toute information relative à un fait nouveau concernant le déroulement de la recherche lorsque ce fait nouveau est susceptible de porter atteinte à la sécurité des personnes qui se prêtent à la recherche ; - et l'informer enfin de tout arrêt prématuré de la recherche en indiquant le motif de cet arrêt. Or, actuellement 30 à 40 000 effets indésirables sont déclarés à l'AFSSAPS chaque année, d'où la difficulté à traiter cette masse d'informations. Transposant les dispositions prévues par l'article 17 de la directive n° 2001-20 précitée, l'article L. 1123-10 nouveau du code de la santé publique prescrit, en premier lieu, à l'investigateur de notifier au promoteur tout événement indésirable grave et impose la déclaration à l'autorité compétente et au comité des effets susceptibles d'être dus à la recherche. Les caractéristiques de ceux-ci seront précisées par voie réglementaire, ce qui permettra de définir les mesures de vigilance particulières aux différentes catégories de produits de santé. De plus, en cas de fait nouveau susceptible de porter atteinte à la sécurité des personnes qui se prêtent à la recherche, le promoteur et l'investigateur sont tenus de prendre des mesures urgentes de sécurité appropriées afin de protéger les participants contre un danger immédiat. Le promoteur doit en informer immédiatement l'autorité compétente et le comité de protection des personnes. b) Les conditions de modification, de suspension et d'interdiction de la recherche : l'article L. 1123-11 L'article L. 1123-8 du code de la santé précise actuellement les conditions dans lesquelles l'autorité compétente peut demander qu'une recherche soit modifiée, la suspendre ou l'interdire en cas d'absence de réponse du promoteur à une demande d'informations complémentaires, de risque pour la santé publique, de non respect des dispositions par le livre premier du code de la santé publique. Transposant l'article 12 de la directive précitée, l'article L. 1123-11 nouveau du même code de la santé publique, prévoit que l'autorité compétente peut également demander qu'une recherche soit modifiée, la suspendre ou l'interdire, si « les conditions de mise en œuvre ne sont plus conformes à la demande d'autorisation ou contreviennent à la loi ». En outre, le promoteur doit être mis à même de présenter ses observations sauf en cas de risque imminent. L'article L. 1123-12 du même code, inséré par le XI de cet article, a pour objet de préciser la réparation des compétences entre l'AFSSAPS et le ministre chargé de la santé, qui demeure inchangée. Enfin, le XII de cet article modifie par cohérence les dispositions prévues par l'actuel article L. 1123-11 du code de la santé publique - devenu l'article L. 1123-14 nouveau du même code - qui renvoie à un décret le soin de fixer les modalités d'application de ce chapitre. * Article L. 1123-1 du code de la santé publique La commission a examiné un amendement de M. Claude Evin supprimant la possibilité de créer des comités spécialisés à compétence nationale. M. Claude Evin a expliqué que les comités de protection de personnes doivent demeurer des organismes dont la mission est d'apprécier les conditions de respect des droits des personnes qui se prêtent à une recherche biomédicale. Ils n'ont donc pas besoin d'être spécialisés. M. Pierre-Louis Fagniez a rappelé que ces dispositions reprenaient celles votées par le Sénat lors de l'examen du projet de loi relatif à la bioéthique. La commission a rejeté l'amendement. Article L. 1123-2 du code de la santé publique La commission a adopté, sur avis favorable du rapporteur, l'amendement n° 2 du gouvernement prévoyant la participation des représentants des malades et des usagers du système de santé aux comités de protection des personnes. La commission a rejeté un amendement de conséquence de M. Claude Evin. Article L. 1123-6 du code de la santé publique Elle a adopté un amendement du rapporteur de rectification d'erreurs matérielles. Article L. 1123-7 du code de la santé publique La commission a adopté un amendement de M. Claude Evin visant à préciser le contenu des avis des comités de protection des personnes, conformément à la directive du 4 avril 2001, le rapporteur s'étant interrogé sur l'opportunité d'une définition aussi détaillée des missions des centres. En conséquence, deux amendements de M. Claude Evin et de M. Olivier Jardé sont devenus sans objet. La commission a adopté trois amendements du rapporteur : le premier disposant que le comité de protection des personnes doit s'assurer que le lieu de déroulement de la recherche répond à des exigences de sécurité adaptées et en particulier qu'il est, si nécessaire, autorisé ; le deuxième prévoyant que le comité de protection des personnes est informé des modifications apportées au protocole de recherche, à la demande de l'autorité compétente ; le troisième précisant le régime de responsabilité du comité de protection des personnes. En conséquence, deux amendements de M. Claude Evin et de M. Olivier Jardé sont devenus sans objet. Article L. 1123-8 du code de la santé publique La commission a adopté un amendement du rapporteur procédant à la rectification d'une erreur matérielle. Article L. 1123-9 du code de la santé publique La commission a adopté un amendement présenté par le rapporteur visant à permettre de prendre en compte toutes les modifications apportées à un protocole de recherche, quelle que soit la personne à l'origine de cette modification, lesquelles doivent faire l'objet d'un avis favorable du comité de protection des personnes et d'une autorisation par l'autorité compétente. La commission a adopté un amendement présenté par le rapporteur visant à exiger, en cas de modification substantielle du protocole après le commencement de la recherche, qu'un nouveau consentement de la personne soit demandé si le comité de protection des personnes le juge nécessaire. Article L. 1123-10 du code de la santé publique La commission a adopté un amendement présenté par le rapporteur visant à informer l'ensemble des parties prenantes des évènements et effets indésirables, définis au niveau réglementaire pour chaque type de recherche et à obtenir le cas échéant un nouveau consentement des participants. La commission a adopté un amendement rédactionnel présenté par le rapporteur. Article L. 1123-11 du code de la santé publique La commission a adopté un amendement de rectification d'une erreur matérielle présenté par le rapporteur. Article L. 1123-14 du code de la santé publique La commission a adopté trois amendements de cohérence rédactionnelle présentés par le rapporteur afin de tenir compte de la nouvelle dénomination des comités de protection des personnes. La commission a adopté trois amendements de cohérence rédactionnelle présentés par le rapporteur concernant les évènements et effets indésirables pouvant survenir à l'occasion d'une recherche biomédicale, tenant compte de la nouvelle dénomination des comités de protection des personnes et concernant les informations transmises aux autorités compétentes de l'Union européenne. Puis elle a adopté l'article 44 ainsi modifié. Article 45 (articles L. 1124-1 à L. 1127-7 du code de la santé publique) Cet article a pour objet d'abroger le chapitre IV, relatif aux recherches sans bénéfice individuel direct, du titre II du livre premier de la première partie du code de la santé publique (articles L. 1124-1 à L. 1127-7), en conséquence de la suppression de la distinction entre les recherches avec ou sans bénéfice individuel direct. Plusieurs dispositions de ce chapitre sont modifiées et transférées, par l'article 42 du projet de loi, aux articles L. 1121-11 à L. 1121-14 nouveaux du code de la santé publique. Celles-ci concernent : l'examen médical préalable à la recherche (actuel article L. 1124-1), l'indemnisation en compensation des contraintes subies (article L. 1124-2), l'obligation d'affiliation à un régime de sécurité sociale (article L. 1124-3), la période d'exclusion au cours de laquelle la personne ne peut se prêter à une autre recherche (article L. 1121-4), les recherches sur les personnes en état de mort cérébrale (article L. 1124-5) et l'autorisation des lieux de recherches (article L. 1124-6). * La commission a adopté l'article 45 sans modification. Article additionnel après l'article 45 (article L. 1125-4 du code de la santé publique) Recherches sur l'évaluation de soins courants La commission a adopté un amendement présenté par le rapporteur visant à faciliter la réalisation de recherches, hors médicaments, portant sur l'évaluation des soins courants. Article additionnel après l'article 45 (article 40-2 de la loi n°78-17 du 6 janvier 1978 relative à l'informatique, aux fichiers Intervention de la CNIL La commission a ensuite adopté un amendement présenté par le rapporteur visant, pour ces recherches à soumettre directement à la CNIL les demandes de mises en œuvre de traitements de données nominatives. (articles L. 1125-1 à L. 1125-5 du code de la santé publique) Dispositions particulières à certaines recherches biomédicales Le présent article, qui comporte trois paragraphes, a pour objet de modifier le chapitre V, relatif aux dispositions particulières à certaines recherches, du titre II du livre Ier de la première partie du code de la santé publique. _ L'article L. 1125-1 du code de la santé publique prévoit actuellement que les protocoles d'essais cliniques portant sur les produits mentionnés à l'article L. 1261-1 de ce code, c'est-à-dire les produits de thérapie génique et de thérapie cellulaire, ne peuvent être réalisées que dans des établissements de santé ou de transfusion sanguine. Le I de cet article, qui réécrit l'article L. 1125-1 précité, et reprend pour partie les dispositions de l'article L. 1125-4 relatives aux essais cliniques concernant les cellules issues du corps humain, propose d'étendre le champ d'application de cette obligation à « la greffe, l'administration ou la transfusion effectuées dans le cadre d'une recherche biomédicale portant sur les organes, les tissus ou les cellules d'origine humaine » et « les produits sanguins labiles », qui comprennent les concentrés de globules rouges et de plaquettes ainsi que le plasma. Le deuxième alinéa de l'article L. 1125-1 prévoit, d'autre part, que ces recherches ne peuvent être mises en oeuvre qu'après autorisation expresse de l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS). _ L'actuel article L. 1125-2 du code de la santé publique, qui prévoit que l'utilisation des organes ou des tissus d'origine animale ou de cellules n'est possible que dans le cadre de recherches biomédicales. L'article L. 1125-2 nouveau prévoit que les recherches portant sur l'utilisation thérapeutique de ces organes chez l'être humain sont soumises, préalablement à leur mise en œuvre, à une autorisation expresse qui est désormais délivrée par l'AFSSAPS - et non plus par le ministre de la santé-, après avis de l'Etablissement français des greffes. _ Afin de transposer l'article 9.5 de la directive n° 2001-20 du 4 avril 2001 précitée, le III de cet article, qui réécrit l'article L. 1125-3 du code de la santé publique, prévoit que sont soumises à une autorisation explicite (écrite) de l'autorité compétente26 les recherches portant sur des médicaments qui n'ont pas d'autorisation de mise sur le marché et qui sont visés à la partie A de l'annexe du règlement communautaire n° 2309/9327 ainsi que d'autres médicaments répondant à des caractéristiques particulières, tels que les médicaments dont les ingrédients actifs sont des produits biologiques d'origine humaine ou animale ou dont la fabrication nécessite de tels composants. Ces dispositions s'appliquent également aux dispositifs médicaux, non visés par la directive précitée. Enfin, par cohérence avec les modifications apportées aux articles précédents, le IV de cet article modifie l'article L. 1125-4 du code de la santé publique, afin de renvoyer à un décret en Conseil d'Etat le soin de préciser les modalités d'application de ce chapitre. En conséquence, l'actuel article L. 1125-5 du même code, devenu sans objet, est abrogé par le V de cet article. * Article L. 1125-1 du code de la santé publique La commission a adopté un amendement présenté par le rapporteur visant à limiter à la durée de la recherche l'équivalence entre l'autorisation de recherche biomédicale délivrée par l'AFSSAPS et l'autorisation de lieu de recherche mentionnée à l'article L. 1121-13 lorsqu'elle est nécessaire. Article L. 1125-3 du code de la santé publique La commission a adopté un amendement de correction d'une erreur matérielle présenté par le rapporteur. La commission a examiné un amendement présenté par le rapporteur visant à distinguer le cas des recherches portant sur l'ensemble des produits de santé et des produits cosmétiques contenant des organismes génétiquement modifiés, qui nécessitent toujours une autorisation expresse de l'autorité compétente, de celui des recherches portant sur des produits cosmétiques contenant des ingrédients d'origine animale. Après que le rapporteur a précisé que, pour ces dernières, l'autorisation n'est expresse que si ces ingrédients sont susceptibles de présenter des risques, la commission a adopté cet amendement. La commission a adopté un amendement de correction d'une erreur matérielle présenté par le rapporteur. Puis, la commission a adopté un amendement présenté par le rapporteur visant, dans un souci de simplification administrative, à réintroduire l'équivalence entre l'autorisation de recherche biomédicale, délivrée par l'autorité compétente, et l'autorisation de dissémination des produits lorsqu'ils comportent des OGM, délivrée par le ministre de l'environnement. La commission a adopté l'article 46 ainsi modifié. Article 47 Cet article a pour objet de modifier les dispositions pénales prévues par le chapitre VI du titre II du livre premier de la première partie du code de la santé publique, par cohérence avec les dispositions prévues par les articles 42 à 45 du projet de loi. Le I procède en premier lieu à une renumérotation des articles mentionnés par l'article L. 126-3 du code de la santé publique. Le II modifie pour sa part la rédaction de l'article L. 1126-5 du même code, en conséquence du remplacement de l'actuel régime de déclaration des recherches biomédicales par un régime d'autorisation, conformément aux dispositions prévues par le directive n° 2001-20 précitée. Pour la même raison, le III abroge le deuxième alinéa de l'article L. 1126-6 et procède à une renumérotation des articles mentionnés dans celui-ci. * Article L. 1126-5 du code de la santé publique La commission a adopté deux amendements présentés par le rapporteur, le premier rédactionnel, le second corrigeant une erreur matérielle. Puis, la commission a adopté l'article 47 ainsi modifié. Article 48 Cet article a pour objet de modifier l'article 223-8 du code pénal relatif aux peines encourues lorsque une recherche biomédicale est réalisée sans avoir recueilli « le consentement libre, éclairé et exprès de l'intéressé, des titulaires de l'autorité parentale ou du tuteur » (trois ans d'emprisonnement et 45000 euros d'amende). Par cohérence avec les dispositions prévues par les articles L. 1222-1 et L. 1222-2 du code de la santé publique, tels que modifiés par l'article 43 du projet de loi, concernant les règles de recueil du consentement, le présent article complète la rédaction de cet article par les mots « ou d'autres personnes, autorités ou organes désignés pour consentir à la recherche ou pour l'autoriser ». * La commission a adopté l'article 48 sans modification. Article 49 (article L. 1142-3 du code de la santé publique) Réparation des dommages liés à la réalisation d'une recherche biomédicale Cet article propose de modifier le régime de réparation des dommages liés la réalisation d'une recherche biomédicale, en conséquence, d'une part, de la suppression de la distinction entre les recherches avec ou sans bénéfice individuel direct et, d'autre part, de l'unification du régime de responsabilité du promoteur, sur le fondement de la faute présumée (cf. article 42 du projet de loi). 1. Les conditions actuelles de réparation des dommages liés à la réalisation d'une recherche biomédicale L'article L. 1142-3 du code de la santé publique, issu de la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, précise l'articulation entre le régime de droit commun de l'indemnisation des accidents médicaux (régime des aléas thérapeutiques) et le régime spécial d'indemnisation des conséquences dommageables d'une recherche biomédicale. Il convient, en effet, de distinguer les trois cas suivants : - Lorsque les recherches sont réalisées sans bénéfice individuel direct, le promoteur assume, même sans faute, l'indemnisation des dommages, en application de l'article L. 1121-7 du code de la santé publique (régime de responsabilité sans faute). - Lorsque les recherches sont réalisées avec bénéfice individuel direct, le promoteur assume en principe l'indemnisation des conséquences dommageables de la recherche, « sauf preuve à sa charge que le dommage n'est pas imputable à sa faute28» (régime de responsabilité pour faute présumée). - Enfin, lorsque les recherches sont réalisées avec bénéfice individuel direct et que la responsabilité du promoteur n'est pas engagée - si celui-ci parvient à prouver son absence de faute - les victimes peuvent être indemnisées, au titre de la solidarité nationale, par l'office national d'indemnisation, institué par L. 1142-22 du même code (régime des aléas thérapeutiques29). Dans ce dernier cas, le dommage, pour être indemnisé, doit répondre aux deux conditions posées par l'article L. 1142-1 du même code : - il doit être sans lien avec l'état de santé initial du patient et son évolution prévisible ; - il doit présenter un caractère de gravité excédant un seuil défini par un taux d'incapacité permanente (IPP) d'au moins 25 %. 2. Le dispositif proposé par le projet de loi L'article 42 du projet de loi supprime la distinction entre les recherches avec ou sans bénéfice individuel direct et généralise le régime de responsabilité du promoteur pour faute présumée (article L. 1121-10 nouveau du code de la santé publique). En conséquence, lorsque le promoteur parvient à prouver son absence de faute, l'application de ces dispositions conduirait à priver de toute réparation les participants qui ont subi des dommages ne présentant pas un caractère de gravité suffisant (taux d'IPP inférieur à 25 %). C'est pourquoi le présent article, qui réécrit l'article L. 1142-3 du code de la santé publique, prévoit que, dans ce cas, l'indemnisation des participants n'est pas subordonnée au caractère de gravité prévu par l'article L. 1142-1, afin d'éviter toute régression dans la protection des victimes. * La commission a adopté l'article 49 sans modification. Article 50 (articles L. 5121-1, L. 5124-1, L. 5126-1 et L. 5126-5 du code de la santé publique) Cet article, qui comporte quatre paragraphes, a pour objet de modifier le chapitre premier, relatif aux médicaments à usage humain, du titre II du livre premier de la cinquième partie du code de la santé publique. Il s'agit principalement de transposer les dispositions de la directive n°2001-20 du 4 avril 2001 relative aux essais cliniques de médicaments. _ Le paragraphe I complète l'article L. 5121-1 du code de la santé publique par un nouvel alinéa qui définit la notion de médicament expérimental. Conformément à l'article 2.d de la directive précitée, ce terme désigne « tout principe actif sous une forme pharmaceutique ou placebo expérimenté ou utilisé comme référence dans un essai clinique, y compris les médicaments bénéficiant déjà d'une autorisation de mise sur le marché, mais utilisés ou présentés ou conditionnés différemment de la spécialité autorisée, ou utilisés pour une indication non autorisée ou en vue d'obtenir de plus amples informations sur la forme de la spécialité autorisée ». Afin de tenir compte de l'introduction de cette notion, le paragraphe II modifie la terminologie utilisée par l'article L. 5124-1 du même code, qui porte actuellement sur les « médicaments destinés à être expérimentés sur l'homme ». _ Les paragraphes III et IV précisent, les conditions de fonctionnement des pharmacies à usage intérieur des établissements de santé. Dans le cadre d'une recherche biomédicale et sur autorisation de l'Agence française de sécurité sanitaire des produits de santé (AFSSAPS), l'article L. 5126-1 du code de la santé publique leur permet actuellement de distribuer à d'autres pharmacies à usage intérieur les produits, substances ou médicaments faisant l'objet de la recherche. Dans la mesure où l'activité d'une pharmacie est normalement limitée au seul usage des patients de l'établissement de santé dans lequel elle est constituée, le paragraphe III propose de modifier la rédaction de cet article afin de préciser que cette possibilité n'est offerte qu' « à titre exceptionnel ». _ Enfin, le paragraphe IV modifie l'article L. 5126-5 du même code, qui précise les missions des pharmacies à usage intérieur, afin de leur permettre d'approvisionner les établissements de santé en médicaments expérimentaux, ce qui facilitera les recherches. * Article L. 5126-1 du code de la santé publique La commission a adopté un amendement de cohérence rédactionnelle présenté par le rapporteur. Puis, la commission a adopté l'article 50 ainsi modifié. (articles L. 4133-1, L. 133-4, L. 133-5, L. 133-6, L. 133-7, L. 133-8, L. 6155-3 et L. 155-5 du code de la santé publique) Formation médicale continue (FMC) L'article 59 de la loi du 4 mars 2002 relative aux droits des malades a institué une obligation de formation médicale continue (FMC), en remplacement du dispositif prévu par l'ordonnance du 25 avril 1996 - qui n'avait jamais été appliqué, ses décrets d'application ayant été annulés par le Conseil d'Etat. Cette obligation s'impose désormais à l'ensemble des médecins : - qui sont tenus de s'inscrire à l'ordre des médecins (articles L. 133-1 et suivants du code de la santé publique) ; - ainsi qu'aux médecins, biologistes, odontologistes et pharmaciens qui exercent dans un établissement de santé, qu'il soit public ou privé, participant au service public hospitalier (articles L. 155-1 et suivants du même code). A partir de juillet 2002, une concertation a été engagée avec les professionnels de la santé sur l'organisation de l'ensemble de la FMC (formation professionnelle prévue par le code du travail, formation conventionnelle prévue par le code de la sécurité sociale et formation obligatoire prévue par le code de la santé publique). Cette concertation ainsi que le rapport « Laurent » sur la formation médicale continue des médecins libéraux30 ont permis d'identifier un certain nombre de dysfonctionnements, parmi lesquels la complexité de l'organisation et du financement de la FMC ainsi que la rigidité et le manque d'efficacité des sanctions disciplinaires prévues en cas de manquement à cette obligation. C'est pourquoi le présent article propose de réformer l'ensemble du dispositif obligatoire de FMC, afin de permettre aux médecins d'adapter leurs pratiques à l'évolution des connaissances et des technologies et d'améliorer la qualité des soins délivrés aux patients. 1. La portée de l'obligation de formation médicale continue : l'article L. 4133-1 du code de la santé publique Le I de l'article 51 du projet procède à une réécriture de l'article L.4133-1 du code de la santé publique, qui définit les objectifs et les conditions de validation de l'obligation de FMC. a) Le recentrage des objectifs de la FMC sur l'amélioration de la qualité des soins Reprenant les dispositions prévues par l'article 11 du code de déontologie31, l'article L. 4133-1 dispose actuellement que la FMC a pour objectif « l'entretien et le perfectionnement des connaissances, y compris dans le domaine des droits de la personne, ainsi que l'amélioration des priorités de santé publique ». Cette définition ne précise cependant pas la finalité ultime de la FMC - l'amélioration des connaissances n'étant en effet qu'un moyen - hormis l'amélioration des priorités de santé publique. En conséquence, le I du présent article modifie la rédaction du premier alinéa de l'article L. 4133-1 afin de recentrer la FMC sur sa finalité essentielle, à savoir « l'amélioration de la qualité des soins, notamment dans le domaine de la prévention ». b) L'assouplissement des conditions de validation de l'obligation de FMC Actuellement, le médecin peut satisfaire à l'obligation qui lui incombe selon l'une des trois modalités suivantes, exclusives l'une de l'autre : - soit en participant à une action de formation agréée ; - soit en se soumettant à une procédure adaptée d' « évaluation des connaissances » réalisée par un organisme agréé ; - soit, enfin, en présentant oralement un dossier devant le conseil régional de la formation médicale continue (CRFMC) compétent. Afin de remédier aux rigidités présentées par ce dispositif, le présent article, qui modifie le troisième alinéa de l'article L. 1334-1 précité, propose d'assouplir les conditions de validation de l'obligation de FMC: - en supprimant, d'une part, la notion de présentation orale du dossier, ce qui permettra d'alléger la charge des conseils régionaux de FMC ; - en prévoyant, d'autre part, la mise en place d'une « procédure adaptée d'évaluation », laquelle ne sera donc plus limitée aux seules connaissances médicales des praticiens, mais pourra désormais inclure l'évaluation des pratiques professionnelles ; - en ouvrant, enfin, la possibilité aux médecins de « panacher » l'un ou l'autre des trois modes de formation prévue. c) L'abandon des sanctions disciplinaires Conformément aux dispositions prévues par les articles L. 4133-1-1 et L. 4133-4 du code de la santé publique, tout manquement à l'obligation de FMC est aujourd'hui susceptible d'entraîner des sanctions disciplinaires. En effet, les conseils régionaux de la FMC sont chargés de valider tous les cinq ans le respect de l'obligation de formation et, à défaut, d'engager une procédure de conciliation avec le médecin. En cas d'échec de cette dernière, les conseils peuvent saisir la chambre disciplinaire de l'ordre des médecins. Ce dispositif a toutefois fait l'objet de nombreuses critiques, relayées notamment par le rapport Laurent précité. Celui-ci a en effet estimé que « les sanctions prévues par la loi et qui peuvent aller jusqu'à des interdictions d'exercice de la profession ne sont pas apparues opportuns et surtout peu efficaces ». Dans ce sens, on peut relever que dans la plupart des pays développés où la FMC est obligatoire, les systèmes de sanction n'existent pas ou restent sans objet (moins de 3/1000 dans certains Etats nord-américains). C'est pourquoi le I du présent article propose de supprimer le troisième alinéa de l'article L. 4133-1 posant le principe des sanctions disciplinaires. Par cohérence, le II de l'article 51 du projet de loi abroge les dispositions de l'article L. 4133-4 du même code relatives à la procédure de conciliation. Ce paragraphe prévoit, d'autre part, la possibilité pour les conseils régionaux de formuler des observations et recommandations en cas de non respect de cette obligation. En contrepartie, l'exposé des motifs du projet de loi propose de substituer aux sanctions un mécanisme d'incitation et de valorisation professionnelle. Celui-ci pourrait emprunter l'une des voies préconisées par le rapport Laurent, par exemple : la délivrance d'un label spécifique sur les ordonnances du médecin, l'accès à des fonctions de formation universitaire, la prise en charge supplémentaire des cotisations au régime d'assurance vieillesse ou encore l'attribution de points permettant de réduire le montant des primes d'assurance. 2. La simplification de l'organisation régionale de la FMC : l'article L. 4133-4 du code de la santé publique La loi du 4 mars 2002 précitée a prévu l'institution de trois conseils nationaux de la formation continue pour les médecins libéraux, les médecins salariés non hospitaliers et les personnels médicaux exerçant dans des établissements de santé. Ces conseils sont chargés de fixer les grandes orientations, d'agréer les organismes formateurs et prestataires de programmes d'évaluation et d'évaluer la FMC. Ce système tripolaire est décliné au niveau régional par la mise en place de trois conseils pour chaque catégorie concernée, qui ont pour mission de valider, tous les cinq ans, le respect de l'obligation de formation. Afin de simplifier l'organisation régionale de la FMC mais également de promouvoir la coopération de l'ensemble des professionnels de santé, le II du l'article 51 du projet, qui modifie la rédaction de l'article L. 4133-4 du code de la santé publique, propose de remplacer par un conseil unique les trois conseils régionaux de la FMC. Le cinquième alinéa de l'article L. 4133-4 nouveau permet par ailleurs au conseil régional de déléguer ses pouvoirs à des sections spécialisées constituées en son sein. Par cohérence, le III de l'article 51 du projet modifie la rédaction de l'article L. 4133-5 du même code compte tenu de la création d'un conseil unique dans chaque région. 3. La suppression du Fonds national de la formation médicale continue, institué par l'article L. 4133-6 du code de la santé publique Le IV de l'article 51 du projet propose de supprimer le fonds national de la formation médicale continue, prévu par l'actuel article L. 4133-6 du code de la santé publique et chargé de participer au financement des conseils nationaux et régionaux et des actions de formation. La mise en place de ce fonds aurait tout d'abord requis d'importantes ressources financières. Surtout, sa suppression permettra d'alléger et de simplifier le dispositif de la FMC. L'exposé des motifs du projet de loi précise à cet égard que la participation aux actions de formation pourra éventuellement être assurée par le fonds d'assurance formation de la profession médicale (FAF-PM), qui prélève une cotisation obligatoire sur chaque médecin à hauteur de 0,15 % de son revenu annuel. Compte tenu de l'institution d'un conseil régional unique, le V modifie la rédaction de l'actuel article L. 4133-8 du code de la santé publique - devenu l'article L. 4133-7 - qui renvoie à un décret en conseil d'Etat le soin de préciser les modalités d'application de ce chapitre. Le VI abroge en conséquence l'article L. 4133-8 du même code. Pour la même raison, les VII et VIII modifient la rédaction des articles L. 6155-3 et L. 6155-5 du code de la santé publique relatifs à la formation médicale continue des personnels médicaux exerçant dans les établissements de santé publics ou privés participant au service public hospitalier. * Avant l'article L. 4133-1 du code de la santé publique La commission a ensuite examiné deux amendements présentés par M. Claude Evin visant à instaurer une nouvelle obligation d'évaluation périodique des compétences professionnelles, de l'entretien et du perfectionnement des connaissances de chaque médecin. Le rapporteur s'est déclaré défavorable, en indiquant que le projet de loi permet déjà l'évaluation des compétences professionnelles. M. Claude Evin a convenu que la rédaction de son amendement peut être améliorée, mais a estimé que le rapporteur n'a pas répondu aux préoccupations soulevées par cet amendement. La commission a rejeté ces deux amendements. Puis, la commission a adopté un amendement rédactionnel présenté par le rapporteur. Article L. 4133-4 du code de la santé publique La commission a examiné un amendement présenté par M. Jean-Luc Préel visant à indiquer explicitement que cette obligation de formation continue incombe également aux médecins exerçant dans les établissements de santé. Après que le rapporteur a émis un avis défavorable au motif que cette précision est déjà contenue dans le texte, la commission a rejeté cet amendement. La commission a ensuite adopté l'article 51 ainsi modifié. La commission a examiné un amendement présenté par M. Jean-Marie Le Guen rétablissant le Fonds national de la formation médicale continue, créé par la loi du 4 mars 2002 relative aux droits des malades et supprimé par l'article 51 du projet de loi. M. Jean-Marie Le Guen a déclaré que la formation des médecins devait être indépendante et non financée, comme c'est déjà le cas aujourd'hui, par différents organismes privés. Cette situation constitue un problème majeur qui ira en s'aggravant dans les prochaines années. Après avoir a rappelé les propos tenus sur cette question par le ministre de la santé, de la famille et des personnes handicapées, M. Jean-François Mattei, lors de son audition, le rapporteur lui a répondu que le ministre s'est déclaré défavorable à cet amendement. La commission a rejeté cet amendement. La commission a rejeté un amendement de M. Jean-Luc Préel visant à étendre l'obligation de formation médicale continue à l'ensemble des professionnels de santé. Puis, la commission a adopté l'ensemble du projet de loi ainsi modifié. * En conséquence et sous réserve des amendements qu'elle propose, la commission des affaires culturelles, familiales et sociales demande à l'Assemblée nationale d'adopter le projet de loi relatif à la politique de santé publique - n° 877. 1 () Rapport annuel 2003 « Santé, pour une politique de prévention durable » 2 () Recueil des principaux problèmes de santé en France (contribution du HCSP à l'élaboration de la loi de programmation en santé publique) 3 () Directive 89/391 CE du 12 décembre 1989 4 () décret n° 2001-1016 du 5 novembre 2001 5 () loi n° 64-1245 du 16 décembre 1964 6 () loi n° 92-3 du 3 janvier 1992 7 () Conseil national de l'évaluation, commissariat général du plan, documentation française septembre 2001 8 () Rapport n° 705 de M. Gérard Miquel, sénateur (18 mars 2003): La qualité de l'eau et de l'assainissement en France 9 () CE 29 janvier 1988, ministère du logement / Delle de Taisne 10 () directive 98//83/CE relative à la qualité des eaux destinées à la consommation humaine 11 () directive CEE n° 80-777 12 En l'état actuel des connaissances, le cas de saturnisme est défini par une plombémie supérieure ou égale à 100 microgrammes de plomb par litre de sang. 13 Voir notamment sur ce point, le rapport d'expertise collective de l'INSERM, « Plomb dans l'environnement : quels risques pour la santé ? », janvier 1999. 14 Rapport de la direction générale de la santé et de la direction de l'urbanisme, de l'habitat et de la construction sur « le suivi et l'application des mesures de lutte et de prévention contre le saturnisme », mai 2002 15 Aux termes duquel « lorsque les locaux sont frappés d'une interdiction définitive ou temporaire d'habiter et d'utiliser les lieux ou lorsque l'insalubrité est remédiable mais que les travaux nécessaires pour remédier à l'insalubrité rendent temporairement inhabitable un logement, le propriétaire est tenu à l'égard des occupants (...) d'assurer leur relogement ou leur hébergement dans les conditions prévues aux articles L. 521-1 à L. 521-3 du même code. » 16 En particulier, le rapport de M. François Lemaire au ministre de la santé sur la protection des personnes qui se prêtent à la recherche médiale (novembre 2002) et le rapport d'information de M. Claude Huriet, sénateur, sur le fonctionnement des CCPPRB (avril 2001). 17 C'est-à-dire lorsque le médicament est administré pour la première fois à l'homme. 18 Si la directive n° 2001-20 ne comporte pas de dispositions spécifiques pour les femmes enceintes, son article 3.1 autorise les Etats membres à prévoir des dispositions plus protectrices s'ils le souhaitent. 19 Ces dispositions reprennent les dispositions prévues par le projet de protocole additionnel à la Convention sur les droits de l'Homme et la biomédecine relatif à la recherche biomédicale. 20 Il ne peut cependant invoquer le fait d'un tiers, ni le retrait volontaire du participant. 21 Aux termes duquel « les recherches sans bénéfice individuel direct en épidémiologie, génétique, physiologie, physiopathologi epeuvent être réalisées par des professionnels de santé, dans leurs lieux d'exercice habituel lorsque ces recherches ne nécessitent pas d'actes autres que ceux qu'ils pratiquent usuellement dans le cadre de leur activité médicale. Le comité consultatif de protection des personnes dans la recherche biomédicale s'assure alors, avant de rendre son avis, que les conditions du présent article sont satisfaites. » 22 Soit l'étude des tumeurs cancéreuses. 23 Aux termes duquel « un essai clinique ne peut être entrepris que si, notamment : (...) le sujet participant à l'essai ou, lorsque cette personne n'est pas en mesure de donner son consentement éclairé, son représentant légal a eu la possibilité, par le biais d'un entretien préalable avec l'investigateur ou un membre de l'équipe d'investigation, de comprendre les objectifs de l'essai, ses risques et ses inconvénients, ainsi que les conditions dans lesquelles il sera réalisé, et a, en outre, été informé de son droit de se retirer des essais à tout moment ». 24 Soit les produits à finalité sanitaire destinés à l'homme et à finalité cosmétique, notamment les : médicaments, contraceptifs et contragestifs, biomatériaux et les dispositifs médicaux, les dispositifs médicaux de diagnostic in vitro, les produits sanguins labiles, les organes, tissus, cellules et produits d'origine humaine ou animale, les produits de thérapie génique et cellulaire, les produits destinés à l'entretien ou à l'application des lentilles de contact, les produits insecticides, acaricides et antiparasitaires à usage humain, les produits thérapeutiques annexes, les aliments diététiques destinés à des fins médicales spéciales qui, du fait de leur composition, sont susceptibles de présenter un risque pour les personnes auxquelles ils ne sont pas destinés, les lentilles oculaires non correctrices et les produits cosmétiques. 25 En application de l'article R. 2001 du même code, ceux-ci comprennent : quatre personnes, dont au moins trois médecins, ayant une qualification et une expérience approfondie en matière de recherche médicale, un médecin généraliste, deux pharmaciens dont l'un au moins exerce dans un établissement de soins, une infirmière ou un infirmier, un psychologue et trois personnes qualifiées (en raison respectivement de leur compétence à l'égard des questions d'éthique, de son activité dans le domaine social et de sa compétence en matière juridique). 26 La directive prévoit en effet un régime général d'autorisation tacite par l'autorité compétente à l'expiration d'un délai maximum de 60 jours. Ces dispositions seront transposées par voie réglementaire, en application de l'article 22 de loi n°2000-321 du 12 avril 2000 relative aux droits des citoyens dans leurs relations avec les administrations. 27 Règlement (CEE) n° 2309/93 du Conseil, du 22 juillet 1993, établissant des procédures communautaires pour l'autorisation et la surveillance des médicaments à usage humain et à usage vétérinaire et instituant une agence européenne pour l'évaluation ds médicaments 28 Il ne peut cependant invoquer le fait d'un tiers, ni le retrait volontaire du participant. 29 Les « aléas thérapeutiques » peuvent désigner un accident médical (c'est-à-dire un événement imprévu causant un dommage accidentel ayant un lien de causalité certain avec un acte médical, mais dont la réalisation est indépendante de toute faute établie), une affection iatrogène (lorsque le dommage subi par le patient est lié au traitement délivré), voire une infection nosocomiale (si l'hôpital apporte la preuve d'une cause étrangère). 30 Rapport au ministre de la santé, de la famille et des personnes handicapées de Mme Dominique Laurent, Conseiller d'Etat, sur la formation médicale continue des médecins libéraux, novembre 2002. 31 Aux termes duquel « tout médecin doit entretenir et perfectionner ses compétences ; il doit prendre toutes dispositions nécessaires pour participer à des actions de formation continue ». © Assemblée nationale |