OFFICE PARLEMENTAIRE D'ÉVALUATION DES CHOIX SCIENTIFIQUES ET TECHNOLOGIQUES ________________________ RAPPORT sur Les recherches sur le fonctionnement des cellules humaines Par M. Alain CLAEYS, Député
_______________________________________________________________________ Composition de l'Office parlementaire d'évaluation des choix scientifiques et technologiques Président M. Henri REVOL Premier Vice-Président M. Claude BIRRAUX Vice-Présidents M. Claude GATIGNOL, député M. Jean-Claude ÉTIENNE, sénateur M. Pierre LASBORDES, député M. Pierre LAFFITTE, sénateur M. Jean-Yves LE DÉAUT, député M. Claude SAUNIER, sénateur
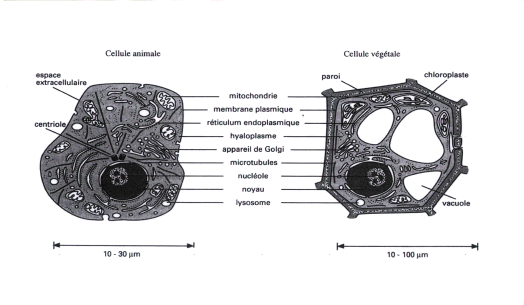
SOMMAIRE Première partie : Où en est la « révolution » génomique ? 1313 1 - Les fonctions des gènes ne sont pas élucidées 1616 2 - Le concept d'épigénétique 1717 Deuxième partie : la cellule est l'unité élémentaire de la vie 2323 Troisième partie : les cellules souches représentent un enjeu majeur de la biologie 2929 1 - Les cellules souches totipotentes 3030 2 - Les cellules souches pluripotentes 3030 1 - L'existence des cellules souches adultes 3131 2 - La difficulté d'identifier et de caractériser les cellules souches adultes 3232 1 - Présentation des cellules souches embryonnaires 4141 2 - Les caractéristiques des cellules souches embryonnaires 4343 3 - L'obtention des cellules souches embryonnaires 4444 4 - Les problèmes de la culture des cellules souches embryonnaires 4444 a - Guérir tout de suite grâce aux cellules souches 4646 b - L'obligation de donner des perspectives à court terme à la recherche 4848 c - L'opposition cellules souches adultes/cellules souches embryonnaires 4949 d - La tumorigénécité des cellules souches embryonnaires 5151 a - Les applications déjà existantes de la thérapie cellulaire 5353 b - L'ouverture d'autres voies de recherche 5454 c - Mêler les approches de la thérapie cellulaire et de la thérapie génique 5757 b - La technique de la transposition nucléaire chez l'homme et ses perspectives 6262 c - Les perspectives de cette technique 6464 d - Les tentatives pour obtenir des cellules souches embryonnaires humaines sans devoir détruire le blastocyste. 6868 e - La transposition nucléaire est tout à fait différente du clonage reproductif. 7171 Quatrième partie : une recherche à poursuivre absolument 7575 a - Les principales voies à explorer 7676 b - Les liens possibles entre cellules souches et cancer 7676 1 - Le problème posé par l'article 18 de la Convention du Conseil de l'Europe sur les droits de l'Homme et la biomédecine dite Convention d'Oviedo 8080 a - Le principe de l'interdiction de la recherche sur l'embryon, assortie de la possibilité de dérogations 8181 b - Les modalités de cette recherche : l'intervention de l'Agence de la biomédecine 8282 c - Le retard dans l'application de la loi : le régime transitoire 8383 3 - Le décret n° 2006-21du 6 février 2006 relatif à la recherche sur l'embryon et sur les cellules embryonnaires et modifiant le code de la santé publique 8585 a - L'autorisation des recherches 8686 b - L'autorisation des échanges extérieurs 8787 6 - Changer la législation concernant la recherche sur l'embryon et légaliser la transposition nucléaire 9191 1 - Le sixième Programme cadre de recherche et de développement 9393 2 - La difficile élaboration du septième P.C.R.D. en matière de recherche sur les cellules souches embryonnaires 9595 a - Le cadre réglementaire 111111 b - L'organisation de la recherche : l'action des National Institutes of Health et des Universités 113113 Cinquième partie : Les défis à affronter 129129 a - Eviter l'utilisation d'ovocytes humains 134134 b - Les risques du don d'ovocyte 134134 a - Un marché encore immature 139139 b - Un secteur déserté par le capital risque et les grandes entreprises 140140 a - La genèse de ces brevets 142142 b - L'étendue de ces brevets 143143 c - Le développement d'un mouvement de contestation de ces brevets 144144 a - Les dispositions de la directive 98/44/CE 145145 b - La position de l'Office européen des brevets (O.E.B.) 146146 Examen du rapport par l'Office le 5 décembre 2006 159159 Composition du comité de pilotage 169169 Liste des personnes auditionnées 170170 Audition publique du 22 novembre 2005 177177 Annexe 1 : Article 25 de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique 307307 Annexe 2 : Décret n° 2006-121 du 6 février 2006 relatif à al recherche sur l'embryon et sur les cellules embryonnaires et modifiant la code de la santé publique 311311 Annexe 3 : Article 19 du projet de loi relatif à la bioéthique adopté par l'assemblée nationale en première lecture le 22 janvier 2002 319319 Les biotechnologies sont souvent présentées comme le troisième étage de la révolution technologique de l'après-guerre après le développement du nucléaire des années 1950 et 1960 et des nouvelles technologies de l'information des années 1970 et 1980. Ces biotechnologies sont nées avec la grande aventure de la génétique qui a culminé avec le décryptage du génome, essentiellement celui de l'Homme. Ce décryptage du génome a permis de commencer à appréhender la structure du vivant, sans cependant donner la compréhension du fonctionnement de la vie et encore moins sa maîtrise. Cette connaissance viendra peut-être lorsque nous saurons comment fonctionne exactement cet espace délimité par une membrane qui obéit aux lois de la physique et de la chimie et commun à tous les êtres vivants : la cellule. Cette cellule a fait l'objet d'une véritable redécouverte à l'occasion de la naissance de Dolly, premier mammifère cloné à partir de cellules adultes. L'intérêt pour la biologie cellulaire ne devait pas faiblir depuis cette époque, toute proche de nous puisqu'à peine dix ans ont passé. Les réalisations de M. James Thomson, qui est parvenu à créer les premières lignées de cellules souches embryonnaires humaines en 1998, allaient donner un nouvel essor à la biologie cellulaire. Elle est vraiment depuis cette époque au cœur de l'actualité avec ses avancées, ses échecs, ses scandales, ses polémiques, ses espoirs et, aussi, ses craintes. Ce domaine est très controversé car on sent combien il est susceptible de transformer notre vie. D'un côté se trouvent les bénéfices espérés : nouvelles méthodes de diagnostic et nouvelles thérapies. De l'autre, les nouvelles menaces avec les possibilités de réémergence de l'eugénisme. Le débat sur les cellules souches embryonnaires a réactivé le débat sur l'embryon qui est présenté comme le principal problème éthique et comme un obstacle dirimant à l'utilisation des cellules souches embryonnaires. Je n'aborderai pas cette question dans ce rapport car j'estime qu'elle est d'abord et avant tout du ressort de la sphère la plus intime de chacun. Comme je l'avais déjà indiqué en décembre 2003, lors de l'examen, en deuxième lecture, du projet de loi relatif à la bioéthique, la protection de l'Homme est au cœur de la législation bioéthique. Celle-ci doit être confrontée aux réalités des recherches et des connaissances en devenir. Elle doit être au service d'une société et d'une recherche vivantes. Afin de respecter la dignité de la personne humaine, elle doit avoir comme impératif de concilier trois principes : - la liberté de pensée, c'est-à-dire la liberté du chercheur qui doit savoir quelles limites la société entend fixer à son activité, - les droits des malades et des personnes handicapées à voir atténuer leurs souffrances et accroître leurs espoirs ce guérison, ce qui nécessite recherche et expérimentation, - le respect de la personne et du corps humain. Ces principes s'appliquent d'autant plus aux cellules souches que celles-ci sont les éléments de base de notre vie. Deux problèmes éthiques seront abordés car ils sont au cœur des débats : le problème du don d'ovocytes pour la recherche et la marchandisation. J'ajoute, même si c'est marginal, la fraude scientifique qui doit être combattue car elle est de nature à faire perdre aux citoyens la confiance en la science. Le présent rapport consacré au fonctionnement des cellules vivantes sera centré sur la question des cellules souches adultes et embryonnaires. J'ai fait ce choix car j'ai voulu exposer avec le maximum de clarté, sans fard et sans a priori, la situation réelle de ce domaine qui est l'objet trop souvent de présentations ou trop louangeuses ou trop critiques. Je l'ai fait aussi pour préparer les travaux du Parlement. Celui-ci devra en effet, au plus tard en 2009 comme cela est prévu dans la loi de bioéthique de 2004, se saisir à nouveau de la question de la recherche sur l'embryon et décider si la transposition nucléaire peut être autorisée en France. Il s'agit en effet de « transposition nucléaire » car j'ai banni de ce rapport une expression qui est employée par facilité mais aussi de façon fallacieuse : « le clonage thérapeutique ». C'est une expression trompeuse. Pour ses adversaires, l'accent est mis sur le mot « clonage » et cette technique est assimilée au clonage reproductif humain qu'aucune personne sensée ne défend. Pour ses partisans, l'accent est mis sur « thérapeutique » et est de nature à faire croire que nous sommes à la veille d'utiliser cette technique pour soigner, notamment, de terribles maladies malheureusement encore incurables. Nul ne sait en fait à l'heure actuelle si cette technique sera un jour utilisable et, si elle l'est, si elle permettra d'obtenir ce que, théoriquement, on peut en espérer. J'ai effectué cet état des lieux du domaine des cellules souches en me faisant aider d'un groupe de pilotage dont la composition se trouve en annexe durapport. Que ses membres soient remerciés. Je souhaite aussi exprimer ma gratitude à l'ensemble des personnes qui ont bien voulu répondre favorablement à ma demande de les entendre en audition publique, dont le compte-rendu constitue le deuxième tome de ce rapport. Cette méthode m'a semblé être une des plus efficaces pour, au-delà du rapporteur, informer l'opinion publique des principaux enjeux de ce domaine. Contrairement à l'usage, le compte-rendu de cette audition publique a été publié avant la parution des conclusions du rapporteur. Je l'avais souhaité ainsi car nous nous trouvions alors « en plein » dans ce qu'on a appelé l'« affaire Hwang ». Il importait de faire entendre la voix des chercheurs, alors que l'on commençait fortement à suspecter l'un d'entre eux d'avoir très gravement enfreint la déontologie scientifique. J'étais en Corée, après être allé au Japon, quand cette « affaire Hwang » a éclaté et j'ai pu mesurer le désappointement de ses concitoyens devant la révélation de la fraude. Mon souhait de faire un point aussi exact que possible sur cette question m'a également conduit aux Etats-Unis, en Grande-Bretagne, à Bruxelles et à Munich, auprès de l'Office européen des brevets. Ce furent des déplacements très denses et passionnants. J'ai souhaité, dans les deux premières parties de ce rapport, faire le point sur ce qu'on a appelé « la révolution génomique » et présenter rapidement la cellule, élément fondamental de la vie. J'aborde ensuite, dans la troisième partie, la problématique des cellules souches en les présentant tout d'abord avec leurs applications potentielles. Je souligne la nécessité de poursuivre la recherche dans la quatrième partie en faisant le point sur l'organisation actuelle de la recherche, en France et dans différents pays, avant d'insister, dans la cinquième partie, sur les défis à affronter dans ce domaine. Première partie : La description pionnière de la structure en double hélice de l'acide désoxyribonucléique (A.D.N.) en 1953 par James Watson et Edward Crick a levé le voile sur la nature physico-chimique du gène. A partir de cette découverte, s'est développé un important mouvement de recherche et de cartographie d'un certain nombre de génomes parmi lesquels ceux de la souris, de la vache, du porc, du riz, ainsi que de la fausse arabette (Arabidopsis thaliana). Ces cartographies ont permis d'établir de manière précise les corrélations pouvant exister entre la présence d'un gène sous une forme particulière, et une affection héréditaire ou une propriété biologique ou agronomique intéressante. Cette connaissance permet ainsi de procéder de manière rapide et précise à une sélection des individus portant la forme du gène responsable de la propriété biologique recherchée. Des programmes de sélection végétale et animale fondés sur l'utilisation de ces marqueurs génétiques, sont ainsi maintenant exploités à grande échelle. Cela a abouti aux fameux organismes génétiquement modifiés (O.G.M.). Parallèlement, depuis le début des années 1990, a commencé la grande aventure du décryptage du génome humain, qui s'est achevé en 2003. Mais, au fur et à mesure de son avancement, un grand enthousiasme a progressivement saisi le monde scientifique ainsi que médiatique pour ce qui a été appelé la « révolution génomique ». Cette « révolution génomique » semblait porteuse de grandes promesses mais elles ne se sont pas réalisées. Cette « révolution génomique » s'est bâtie sur l'hypothèse que le gène était le fondement de la vie, ce qui a entraîné le développement d'un certain nombre de perspectives fondées sur le « tout gène ». 1 - Le gène comme fondement de la vie Cette hypothèse s'est développée à la suite des travaux effectués aux Etats-Unis à la fin des années 1930 et au début des années 1940, quand a été posée l'équation : « un gène - une enzyme1 ». La découverte de la double hélice de l'A.D.N. a permis de donner une signification nouvelle à cette hypothèse. On peut en effet la comprendre comme l'établissement d'une correspondance directe entre la séquence d'un nucléotide d'un gène et celle d'un acide aminé d'une protéine. Par le jeu de la succession des bases azotées, l'information peut alors être portée sur cette molécule et être transmise de génération en génération de façon inchangée. Le gène peut alors passer d'une entité conceptuelle à une entité matérielle. On aboutit ainsi à un schéma simple : l'A.D.N. est la molécule qui non seulement, recèle les « secrets » de la vie, mais qui exécute aussi ses propres instructions cryptées. C'est à partir de cette époque que l'A.D.N. de la cellule est conçu comme le programme génétique, comme la langue originelle. Les bases de l'A.D.N. sont assimilées à des lettres, les gènes devenant alors des mots. Avec ces mots on forme alors le texte, c'est-à-dire la séquence génétique. La métaphore de l'A.D.N. « livre de la vie » a été alors forgée. Elle a rencontré un grand succès et a été reprise à l'envi, notamment par les média. Il y a eu ainsi le développement d'une vision réductionniste de la biologie qui a été très importante au cours du développement du programme de décryptage du génome humain. L'attribution d'un rôle central et presque exclusif à l'A.D.N. dans le fonctionnement des organismes a alimenté les perspectives du « tout gène ». 2 - Les perspectives du « tout gène » Ces perspectives, qui retenaient alors l'attention, résidaient dans les espoirs de soigner par l'introduction dans l'organisme d'un ou plusieurs gènes. De nombreux gènes en cause dans de nombreuses affections ont été découverts. Il en a été ainsi, notamment, pour le diabète, certaines maladies cardio-vasculaires, le cancer du sein, la myopathie de Duchenne ou la mucoviscidose... Ces progrès tout à fait réels et substantiels dans la connaissance des mécanismes d'un certain nombre d'affections se sont immédiatement accompagnés de l'idée de « corriger » ces dysfonctionnements génétiques par la thérapie génique. La thérapie génique est l'opération consistant à introduire un gène fonctionnel dans les cellules d'un organisme à des fins préventives, curatives ou diagnostiques. La loi du 28 mai 1996 a défini les produits de thérapie génique comme « des produits biologiques à effet thérapeutique visant à transférer du matériel génétique de façon à obtenir in vivo, l'expression d'un ou plusieurs gènes d'intérêt, dans une cellule cible, dans un but thérapeutique, diagnostic ou de marquage ». Le ou les gènes ainsi introduits peuvent, soit remplacer la fonction d'un gène défectueux, soit commander la synthèse, dans l'organisme d'une protéine thérapeutique. Parmi ses indications pourraient figurer, outre des maladies monogéniques comme la mucoviscidose, de nombreuses affections acquises comme les cancers, la maladie d'Alzheimer, l'athérosclérose... Deux approches de cette thérapie génique peuvent être distinguées : la thérapie génique germinale et la thérapie génique somatique. Cette dernière ne touche que l'individu traité alors que l'autre, en modifiant les cellules germinales (spermatozoïdes, ovocytes) produit un effet permanent sur tous les descendants de l'organisme traité. Pour des raisons évidentes d'éthique, elle est limitée aux animaux. Cette idée d'introduire un ou des gènes dans un organisme à des fins thérapeutiques apparaissait alors d'autant plus séduisante qu'elle permettait ainsi d'éviter les difficultés et les retards de la mise au point des traitements classiques. Ces derniers, comme le note M. Bertrand Jordan2, impliquent en effet généralement une compréhension détaillée de l'affection puis la découverte d'agonistes ou d'antagonistes agissant sur les éléments-clés des régulations affectées par la maladie. Le ou les gènes introduits étaient considérés comme des médicaments. L'expression « A.D.N. médicament », qui fit alors florès, l'exprimait de façon fort expressive. Les programmes de décryptage des génomes ont alors mobilisé des moyens très importants avec notamment l'utilisation de techniques informatiques très performantes et très sophistiquées. On notera que les financements privés, notamment dans les jeunes pousses (start-up), ont été très conséquents. Les promesses d'applications thérapeutiques étaient, déjà, très fortement mises en avant. Comme le rappelle M. Bertrand Jordan dans l'article cité, en 1995 la brochure de présentation du programme américain de thérapie génique s'intitulait « des cartes à la médecine ». En France, c'est le Téléthon qui a, pour la première fois, fait surgir la thérapie génique hors de l'ombre des laboratoires pour l'installer dans l'espace public. Les perspectives du chiffre d'affaires du secteur étaient à l'unisson des espoirs : ainsi, en 1994, estimait-on celui-ci à vingt milliards de dollars pour l'année 2006... Les revues scientifiques n'étaient pas en reste : « La Recherche » titrait en 1985 : « Traitement des maladies génétiques : le compte à rebours » ; « Science » publiait en 1990 un article : « Thérapie génique : le but en vue ». Force est de reconnaître que l'enthousiasme déclenché alors par le décryptage du génome est resté hors de toute proportion avec la modestie des bénéfices qui ont pu en être retirés par les patients. Ainsi le séquençage du génome du V.I.H. a été réalisé en 1985 sans que la solution pour le combattre ait pu être mise au point depuis vingt ans. De ce point de vue, les promesses de la « révolution » génomique ne se sont pas réalisées. Ces promesses ne se sont pas réalisées car la génétique s'est focalisée sur l'identification des génomes et sur la description du réseau des interactions moléculaires, sans faire avancer la compréhension du fonctionnement de l'organisme. Il y a encore un abyme entre ce que l'on espérait et ce qui est actuellement réalisé. Ne l'oublions pas quand nous aborderons la problématique des cellules souches embryonnaires. C'est ainsi que les fonctions des gènes ne sont pas encore pas élucidées, et qu'un certain nombre de difficultés ont entravé le développement de la thérapie génique. Ces obstacles imposent en réalité d'aller au-delà du gène, vers l'étude de la cellule. 1 - Les fonctions des gènes ne sont pas élucidées Dans mes précédents rapports présentés à l'Office3, j'avais déjà largement abordé ce problème. Je rappellerai simplement que, dans la grande majorité des cas, les gènes ne font que permettre la fabrication des composants élémentaires du vivant qui, en s'associant en réseaux complexes, engendrent les caractéristiques de ces organismes. Chaque gène a une fonction élémentaire utilisée par l'organisme pour accomplir de multiples fonctions complexes et différentes, chaque fonction complexe résultant de la participation de centaines ou de milliers de gènes. Il est nécessaire d'abandonner un réductionnisme consistant à faire dépendre les structures complexes des organismes vivants de quelques gènes. On a ainsi progressivement découvert que les mêmes gènes se retrouvent dans des espèces différentes avec des fonctions différentes. Le même gène peut se trouver dans le même organisme, avec des rôles différents, suivant le type de cellule et le stade de développement. La génétique doit donc tenir compte de l'environnement intracellulaire des gènes, c'est-à-dire non seulement des autres gènes, mais aussi des protéines et des autres molécules. Il s'agit de considérer l'activité de l'ensemble des gènes comme une activité intégrée en liaison étroite avec leur environnement, car la séquence de l'A.D.N ne suffit pas à expliquer la diversité des cellules et des organismes. De cette approche nouvelle est né un nouveau concept important : celui d'épigénétique. Le terme « épigénétique », créé par le généticien britannique Conrad Waddington au début des années 1940, signifie littéralement « hors de la génétique habituelle ou classique ». Cette dernière a formalisé l'hérédité à l'aide de deux concepts : le phénotype, l'apparence, l'ensemble des caractères individuels hérités, et le génotype, l'ensemble des unités de l'hérédité, les gènes. La biologie moléculaire avait expliqué de façon apparemment satisfaisante le problème de la transmission des caractères en désignant la molécule d'A.D.N. comme seule et unique porteuse de l'hérédité. Mais une contradiction demeurait : comment en effet expliquer que tous les organismes ou toutes les cellules ayant hérité des mêmes chromosomes ou gènes ne présentent pas nécessairement un phénotype similaire ? Un certain nombre d'explications peuvent être avancées dont l'une est l'existence de différences épigénétiques, c'est-à-dire des différences au niveau du mode d'expression du génome. En effet, l'A.D.N. n'est pas présent sous forme de molécules nues dans la cellule. Il est associé à des protéines appelées histones pour former une substance complexe, la chromatine. Toute modification chimique de l'A.D.N. ou des histones altère la structure de la chromatine sans modifier la séquence nucléotidique de l'A.D.N. La variation épigénétique est donc une modulation de l'expression de gènes ou de groupes de gènes qui, contrairement à la mutation, n'implique pas de modification de structure de l'A.D.N. Cette variation épigénétique existe aussi chez les plantes et est étudiée sous le nom de « paramutation ». Elle est caractérisée par sa propriété d'être non seulement stable au cours du développement d'un organisme au niveau somatique mais d'être transmise à la descendance lors du croisement sur plusieurs générations au niveau germinal, avec des distributions différentes de celles prédites par les lois de Mendel. Ces modifications sont encore assez mal connues et sont fonction de l'environnement du génome au sens large. L'important est, comme le mentionne M. Michel Morange4, que ces mécanismes épigénétiques concernent la différenciation cellulaire et le développement embryonnaire : cette régulation épigénétique est conservée de manière stable lors de la division cellulaire, la mitose. Cependant il ne faut pas passer du « tout génétique » au « tout épigénétique » car, comme le souligne cet auteur, « on peut déconstruire à plaisir le gène » mais il ne faut pas oublier « que les structures et les fonctions des êtres vivants reposent sur les propriétés des macromolécules complexes », les organismes ayant créé un mécanisme sophistiqué et précis pour reproduire leur structure primaire. Il considère donc que « l'idée d'un programme génétique était une extension indue de ce mécanisme de reproduction des constituants macromoléculaires à l'organisme entier : la notion de programme génétique ne subsiste plus aujourd'hui que sous la forme d'une vague métaphore ». Il faut donc, sans rejeter tous les acquis de la génomique, la dépasser pour y intégrer les possibles variations épigénétiques qui vont venir de son environnement au sens large. Cela sera important en matière de culture de lignées cellulaires où, notamment, les conditions de leur culture pourront être déterminantes. Cet élargissement des perspectives est d'autant plus nécessaire face aux difficultés de la thérapie génique. 3 - Les difficultés de la thérapie génique L'engouement pour la thérapie génique s'est heurté à sa complexité car elle est devenue plus un principe général qu'une technique précise. En effet les méthodes utilisées sont devenus extrêmement diverses. Ainsi celles-ci diffèrent-elles selon qu'il s'agit d'obtenir la production d'une protéine active remplaçant une protéine manquante ou inactive pour les affections héréditaires ou de lutter contre des maladies comme le cancer ou le sida. Les techniques de transport du gène à l'intérieur des cellules sont aussi très variées et sont susceptibles d'être couplées à d'autres stratégies, notamment vaccinales, ce qui complique encore la démarche. Les difficultés rencontrées sont, de façon schématique, de plusieurs ordres : - difficultés de cibler les cellules malades et risques de rejet par l'organisme des produits de thérapie génique ; - difficulté d'élaboration des vecteurs viraux qui risquent de s'attaquer à une multitude de cellules-cibles ; - problème de l'efficacité des vecteurs non viraux, tels les liposomes, qui doivent être employés à de telles quantités que des problèmes de toxicité peuvent se poser ; - difficulté pour obtenir la régulation correcte du gène qui risque de s'intégrer dans une région chromosomique non adéquate ; - obstacles financiers dus à la lourdeur des investissements nécessaires pour la recherche, pour la production de vecteurs ainsi que pour les établissements accueillant les patients. En juillet 20065, il y avait dans le monde 1192 essais de thérapie génique en cours dont les objectifs étaient les suivants : . traitement de cancers : 797 (66,9%) . maladies vasculaires : 106 (8,9%) . maladies monogéniques : 102 (8,6%) . maladies infectieuses : 78 (6,5%) . marquage génétique : 50 (4,2%) . volontaires sains : 19 (1,6%) . autres : 40 (3,3 %) L'état d'avancement, en juillet 2006, de ces 1192 essais en cours, montre bien le caractère encore largement balbutiant de cette thérapie génique : . Phase I : 743 (62,3%) . Phase I/II : 242 (20,3%) . Phase II : 169 (14,2%) . Phase II/III : 12 (1%) . Phase III : 26 (2,2%) Selon M. Bertrand Jordan6, les problèmes techniques ont été « aggravés par la hâte avec laquelle on a parfois procédé en raison de la compétition entre équipes et (surtout) entre entreprises pressées de prendre leur place dans un marché prometteur.» M. Bertrand Jordan estime cependant qu'« il ne faudrait pas pour autant en conclure que la thérapie génique se trouve aujourd'hui dans une impasse ». Il cite en effet un certain nombre de progrès, et, notamment, les nouvelles possibilités de transférer un gène de façon à ce qu'il s'intègre dans un endroit prédéfini du génome et l'exploitation des micro-A.R.N. Il faut aussi, et cela est capital, garder à l'esprit le succès de la thérapie génique mise en œuvre par M. Alain Fischer et Mme Marina Cavazzana-Calvo concernant le syndrome de l'immunodéficience combinée sévère (SCID-X1). Ce grave déficit immunitaire obligeait les enfants atteints à vivre dans une enceinte stérile (« bébés bulles ») pour éviter d'exposer leur système immunitaire immature aux germes de l'environnement. Le gène introduit a permis au système immunitaire de ces enfants de se développer et a rétabli son fonctionnement normal. Certes trois leucémies et un décès ont été à déplorer mais une vingtaine d'enfants mènent, grâce à ce traitement, une vie normale. Pour d'autres affections, telles l'hémophilie et la mucoviscidose, les essais se sont heurtés à des difficultés immunitaires et ne sont pas couronnés de succès. Les techniques de la thérapie génique ne doivent cependant pas être abandonnées mais être améliorées en dépassant ce que certains auteurs ont appelé le « paradigme du gène », c'est-à-dire l'explication de tout le mécanisme de la vie par la génétique. M. Jean-Claude Ameisen7 a fait de façon très éclairante ce lien entre génétique et biologie cellulaire : « Une dimension essentielle de la complexité du vivant est due au fait que les cellules et les corps peuvent utiliser leurs gènes de manières très différentes, et que, à génome identique, différentes potentialités vont s'ouvrir dans différents environnements. Toutes les cellules de notre corps, à quelques rares exceptions près, possèdent tout au long de notre existence exactement les mêmes gènes. Leur capacité à devenir et à demeurer des cellules souches, ou à se transformer dans l'une des deux cents familles de cellules différenciées de notre corps, est due au fait que chaque cellule n'utilise pas ses gènes de la même manière. Les interactions, pour partie aléatoires, que chaque cellule établira avec ses voisines vont entraîner des modifications plus ou moins réversibles de l'accessibilité de certains de leurs gènes, et donc des modalités différentes d'utilisation de ces gènes. En d'autres termes, l'environnement externe de la cellule influera sur l'élaboration de son environnement interne, qui lui-même influera à son tour sur les possibilités qu'a la cellule avec son environnement externe. On distingue là toute l'ambiguïté de la notion répandue de « programme génétique ». Les gènes ne déterminent pas l'avenir : ils donnent aux cellules un certain nombre de contraintes et de potentialités - un champ des possibles - dont l'actualisation dépendra de l'histoire particulière des interactions de la cellule avec son environnement »8. Il faut donc dépasser le niveau du gène pour aller vers l'étude de la cellule. 4 - Au-delà du gène : aller vers l'étude de la cellule Les limites actuelles de la génomique fonctionnelle ainsi que l'intérêt croissant accordé aux cellules souches me semblent marquer un important regain d'intérêt en faveur de la biologie cellulaire. On assiste en effet à un véritable renouveau de problèmes dont la société se préoccupe de manière croissante, comme les questions de la reproduction et du développement, de la vieillesse et aussi du fonctionnement du cerveau. L'actualité montre aussi que des problèmes considérés comme résolus refont surface comme, par exemple, les questions liées à l'étude des agents infectieux. Ceux-ci ont été beaucoup négligés du fait de l'existence des antibiotiques, cette remarque prenant toute sa force devant les nouvelles menaces, comme la persistance de la grippe aviaire ou le développement d'épidémies comme celle du chikungunya. Ainsi reprennent toute leur actualité un certain nombre de notions. Restent ainsi largement inconnues les questions se rapportant aux défenses de l'organisme, et ce que l'on appelle, selon un terme très ancien, la « virulence ». On doit constater que ce dernier terme recouvre des mécanismes très peu connus comme, par exemple, la pénétration d'agents pathogènes dans les cellules de l'organisme. Toutes ces questions, reproduction, vieillissement, cognition, équilibre entre l'homme et les microbes ne sont évidemment pas récentes, mais il faut bien reconnaître qu'elles ont été quelque peu marginalisées par le génie génétique et la génomique. Il faut certainement en revenir à l'étude du vivant complexe et au fonctionnement de la cellule dans ses différentes dimensions. Deuxième partie : Dans cette deuxième partie seront esquissés l'organisation de la cellule vivante et son fonctionnement. La cellule est l'unité de base du vivant. Tout organisme, du plus simple au plus perfectionné, est constitué de cellules, d'une seule à plusieurs milliards dans un ensemble très coordonné. Ce sont les cellules qui donnent aux organismes leurs capacités, que ce soit tout d'abord leur maintien en vie et leur reproduction ou, chez les animaux par exemple leur possibilité de se déplacer grâce à leurs possibilités de déformation. Nous évoquerons l'organisation de la cellule vivante et son fonctionnement. C'est l'invention du microscope, à la fin du XVIIe siècle, qui a ouvert la voie à l'exploration de la structure des organismes vivants à une échelle inaccessible à l'œil nu. L'observation des tissus des plantes a permis, pour la première fois, de discerner l'organisation en cellules. Il fallut ensuite attendre le début du XIXe siècle et le perfectionnement de l'optique des microscopes pour que l'accumulation des observations faites chez les animaux et les végétaux forme la base d'une théorie unificatrice : la théorie cellulaire. Celle-ci est exprimée en 1839 par le physiologue allemand Theodor Schwann selon lequel tout être vivant est formé à partir de cellules et uniquement de cellules. Cette théorie a été établie de façon définitive par le célèbre axiome de Rudolf Virchow en 1858 : « Omnis cellula e cellula » : toute cellule est issue d'une autre cellule. Les cellules sont de minuscules compartiments qui existent chez tous les êtres vivants, animaux ou végétaux. C'est d'ailleurs l'organisation cellulaire qui détermine les deux grandes familles d'êtres vivants : les procaryotes et les eucaryotes. Les procaryotes ont été vraisemblablement les premiers êtres vivants sur la terre. Ce sont des organismes unicellulaires caractérisés par l'absence d'un vrai noyau. Leurs descendants actuels sont les bactéries dont on connaît deux catégories différentes : les archéobactéries et les eubactéries. Les archéobactéries, abondantes dans la nature actuelle, peuplent des milieux très inhospitaliers : eaux très salées, sources thermales à la température dépassant 70°C, eaux très acides. Les eubactéries sont bien plus communes et comprennent, entre autres, les bactéries Gram positives, les spirochètes, les myxobactéries, les cyanobactéries... Les eucaryotes sont des organismes dont la ou les cellules sont composées d'un véritable noyau délimité par une membrane nucléaire, de plusieurs chromosomes, d'un nucléole et d'organites intracytoplasmiques de structure complexe. Les eucaryotes comprennent des espèces pluricellulaires (animaux, végétaux, champignons) et des espèces unicellulaires (protistes : paramécie, algues unicellulaires, levure de boulanger...). Les cellules des eucaryotes, bien que possédant de très importantes analogies, présentent des différences chez les animaux et les végétaux comme le montre le schéma suivant :
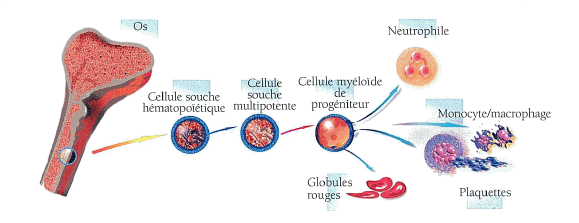
Source : Le dictionnaire des sciences (Hachette) La cellule est l'unité de base de tous les organismes vivants. Un être humain en possède plus de cent mille milliards dont il existe environ deux cents types différents. La cellule se nourrit, produit de l'énergie, échange des informations avec son entourage, se multiplie et meurt au bout d'un certain temps. Comme on le voit sur le schéma précédent, les cellules animales et végétales présentent un certain nombre de différences que nous allons évoquer successivement. _ Les cellules animales Elles se présentent en général comme de petits sacs d'une dimension de 10 à 30 μm9. Cependant certaines d'entre elles peuvent atteindre des dimensions importantes. C'est par exemple le cas des cellules nerveuses dont les prolongements peuvent dépasser un mètre de long ou des œufs qui sont constitués d'une seule cellule. Les cellules sont délimitées par une membrane avec en leur cœur un noyau. Le noyau est une petite poche souple contenant l'acide désoxyribonucléique (A.D.N.) qui est porteur du matériel génétique et qui contrôle toute l'activité de la cellule. Les cellules sont isolées de l'extérieur par la membrane plasmique qui laisse passer certaines substances et barre le passage à d'autres. D'autres systèmes membranaires internes, formant le cytoplasme, délimitent des compartiments, ou organites intracellulaires, ayant chacun un rôle spécialisé : - les mitochondries : elles fournissent l'énergie nécessaire au fonctionnement de la cellule. Leur nombre, de quelques-unes à plusieurs dizaines de milliers, dépend de l'intensité de l'activité de la cellule, une cellule musculaire en possédant par exemple un très grand nombre, - le réticulum endoplasmique : il joue un rôle important dans les processus de sécrétion, de synthèse des protéines, des stéroïdes et des lipides ainsi que pour le transport intracytoplasmique de différentes substances, - l'appareil de Golgi est constitué de vésicules et de saccules. Il joue un rôle important dans le métabolisme cellulaire en assurant la glycosilation des protéines, la concentration des substances élaborées par le réticulum endoplasmique et leur transformation en produits de sécrétion, - les lysosomes assurent la dégradation et le recyclage des structures cellulaires, - le noyau est le centre vital de la cellule. Il comprend le nucléole et les chromosomes. Le nucléole est un corpuscule sphérique homogène et dense. Il porte les chromosomes se composant chacun d'une très longue molécule d'A.D.N. porteuse des gènes, de molécules, de protéines et d'acide ribonucléique (A.R.N.). Les chromosomes ne sont en réalité observables à un instant donné que dans un petit nombre de cellules. Ils n'existent sous cette forme très particulière que pendant la phase précédant immédiatement la division des cellules. Dans toutes les autres phases, le contenu des chromosomes apparaît diffus dans le noyau. Il est alors appelé chromatine, - le hyaloplasme est un gel constituant le cytoplasme fondamental et servant de support au noyau et aux organites cytoplasmiques. C'est le siège de la synthèse et de la dégradation des diverses molécules nécessaires à la cellule, - le centriole est un organite jouant un rôle important au cours de la mitose, division cellulaire normale aboutissant à deux cellules semblables à la cellule mère, - les microtubules sont des cylindres creux formés de polymères linéaires qui sont des constituants essentiels du cytosquelette10. Elles sont impliquées dans de nombreuses fonctions cellulaires comme la division cellulaire, le trafic intracellulaire ou la croissance des neurones. _ Les cellules végétales Les cellules végétales présentent des caractères particuliers par rapport aux cellules animales. Ainsi leur membrane plasmique est doublée extérieurement par une paroi cellulosique fabriquée par la cellule. Elles possèdent de grandes cavités, les vacuoles, qui sont des dilatations du réticulum endoplasmique et où se trouve le liquide vacuolaire. Elles possèdent des organites particuliers, les plastes, limités par une double membrane. Chez les végétaux chlorophylliens, ce sont les chloroplastes qui captent l'énergie lumineuse et sont le siège de la photosynthèse. L'activité cellulaire consiste en des mouvements, des échanges et des transformations : - de matière, pour se nourrir et croître, - d'informations, pour connaître le milieu extérieur et pour communiquer avec d'autres cellules, - d'énergie, pour se maintenir en vie. Dans le cytoplasme de la cellule existe ainsi une véritable « usine biologique » avec de nombreux « ateliers », les organites, consacrés à des tâches différentes. Nous esquisserons rapidement le fonctionnement du métabolisme cellulaire ainsi que celui de la division cellulaire. _ Le fonctionnement du métabolisme cellulaire Les organites assurent la réalisation d'un certain nombre de réactions biochimiques qui, considérées dans leur ensemble, constituent le métabolisme cellulaire. Celui-ci se déroule, schématiquement, de la façon suivante. Des nutriments entrent dans la cellule, soit par transport actif à travers des canaux spécialisés s'il s'agit de petites molécules, soit par invagination membranaire pour des corps plus importants. Les éléments ayant pénétré dans la cellule sont digérés dans des corps riches en enzymes, notamment les lysosomes. La dégradation en molécules de taille de plus en réduite se poursuit dans le cytoplasme grâce à un ensemble de réactions comme la glycolyse11 et la fermentation. Ces réactions aboutissent au transfert d'une partie de l'énergie chimique du glucose dans le vecteur énergétique essentiel de la cellule qui est l'une des substances les plus importantes de la cellule : l'adénosine triphosphate (A.T.P.). Ce transfert d'énergie est poursuivi et amplifié dans les mitochondries par la respiration cellulaire qui produit la plus grande partie de cette adénosine triphosphate. L'énergie et les petites molécules produites lors des processus de dégradation sont le point de départ des réactions d'assemblage des macromolécules spécifiques de la cellule, selon les instructions données par son matériel génétique. L'ensemble de cette activité est organisé en un réseau complexe finement régulé, afin de répondre aux besoins de la cellule et aux modifications de son environnement. _ La division cellulaire La multiplication des cellules est une nécessité vitale car elle permet la croissance des organismes et assure leur entretien en remplaçant les cellules qui meurent. La multiplication des cellules doit assurer le transfert de l'A.D.N. de la cellule-mère à ses cellules-filles. La division cellulaire, appelée mitose, commence par une accumulation des protéines de la cellule. Ensuite a lieu la réplication complète de l'A.D.N. Celle-ci s'effectue par la séparation locale des deux brins de la double hélice et une enzyme, l'A.D.N. polymérase, copie chacun des deux brins complémentaires. A la fin de cette opération, la cellule contient une quantité double d'A.D.N. La chromatine se condense alors massivement pour former les chromosomes. La membrane du noyau disparaît et le cytosquelette prend en charge les chromosomes. Il se déforme de telle manière que le contenu de la cellule mère soit exactement réparti entre les deux cellules filles. Chacune de celles-ci hérite donc d'un jeu complet de chromosomes qui se condensent alors pour redonner de la chromatine dans un noyau reformé jusqu'à la prochaine division. Ces évènements ne s'accompagnent en principe que de très rares modifications de la structure de l'A.D.N. et de celle des chromosomes homologues. Il y a donc conservation à l'identique, dans les cellules-filles, du matériel génétique de la cellule-mère. Ce mécanisme permet que toutes les cellules d'un même individu aient le même contenu en A.D.N. Les seules exceptions sont les cellules sexuelles et certaines cellules du système immunitaire, les lymphocytes, qui fabriquent les molécules capables de reconnaître des substances étrangères. La cellule est vivante (elle naît, elle vit, elle meurt) et elle est un lieu d'échanges et d'interactions avec le milieu extérieur. Elle apparaît donc comme une unité centrale du monde vivant. Les cellules humaines sont, dans leur grande majorité, des cellules différenciées, c'est-à-dire capables de remplir une mission précise : globules rouges transportant l'oxygène dans le sang, cellules de l'intestin absorbant les nutriments, etc. Une autre caractéristique des cellules différenciées est qu'elles ne se divisent pas. Cependant à chaque seconde, plus de vingt millions de cellules de notre organisme se divisent pour maintenir constant le nombre de cellules et donc remplacer celles qui disparaissent par vieillissement ou par lésion. C'est ainsi que le seul maintien du nombre de globules rouges nécessite deux millions de divisions cellulaires par seconde. Ces cellules qui se divisent sont des cellules souches. Elles représentent un enjeu majeur de la biologie. Troisième partie : L'intérêt porté aux cellules souches remonte au début du siècle dernier. En effet, dès 1920, l'existence de cellules précurseurs à l'origine de toutes les cellules sanguines était suggérée chez le poulet. Le concept précis a émergé au cours des années 1950 - 1960 quand a été déterminé le principe de renouvellement des cellules sanguines. Celles-ci ont une durée de vie courte, car un globule rouge humain ne vit que 120 jours, et doivent être remplacées pendant toute la durée de la vie. Le renouvellement est assuré par des cellules résidentes de la moelle osseuse. Celles-ci sont capables de s'autorenouveler. Elles produisent en même temps, par division asymétrique, des cohortes de cellules à prolifération rapide qui s'engagent dans les voies de différenciation les conduisant à produire toute la variété des cellules du sang circulant. Une cellule souche est une cellule pouvant se renouveler indéfiniment, souvent durant toute la vie de l'organisme, par division cellulaire en conservant à la fois ses propriétés propres et la possibilité de donner naissance à des cellules-filles plus spécialisées. Dans des conditions normales ou à partir d'un signal adéquat, les cellules souches donnent ainsi naissance (se différencient) aux différents types cellulaires constituant l'organisme. Elles peuvent se développer en cellules matures qui ont des fonctions spécialisées comme des cellules cardiaques, de la peau ou des cellules nerveuses. Tous les organismes pluricellulaires possèdent des cellules souches. Le concept de cellule souche est plutôt employé à propos des animaux mais les méristèmes des plantes en sont aussi constitués. On peut distinguer les cellules souches selon leurs capacités de différenciation ou selon leur origine : cellules souches adultes et cellules souches embryonnaires. On distingue plusieurs types de cellules souches selon leur capacité de différenciation, c'est-à-dire selon l'apparition et le développement progressif de propriétés ou de caractères distinctifs dans des cellules qui étaient jusqu'alors équivalentes ou qui, du moins, le paraissaient. Il s'agit là d'un changement qualitatif de phénotype, par exemple l'apparition de nouvelles protéines membranaires, dû à l'activation de l'expression d'un gène donné. Les quatre types de cellules souches ainsi distinguées sont les cellules souches totipotentes, les cellules souches pluripotentes, les cellules souches multipotentes et les cellules souches unipotentes. 1 - Les cellules souches totipotentes Elles sont issues des premières divisions de l'œuf fécondé jusqu'au quatrième jour (morula de 2 à 8 cellules). Elles sont les seules à pouvoir conduire à la formation d'un individu complet. Elles ont donc la capacité d'induire la formation de tous les tissus humains, y compris ceux de la lignée germinale. 2 - Les cellules souches pluripotentes Elles ont issues de la masse cellulaire interne du blastocyste, au stade de 40 cellules. Elles ne peuvent pas produire un organisme entier mais elles peuvent se différencier en cellules issues de n'importe lequel des trois feuillets embryonnaires (mésoderme, endoderme, ectoderme). 3 - Les cellules souches multipotentes Présentes dans l'organisme adulte, elles sont à l'origine de plusieurs types de cellules différenciées mais qui conservent leur capacité à s'autorenouveler. Elles peuvent donner naissance à plusieurs types de cellules, mais elles sont déjà engagées dans une certaine direction. C'est ainsi, par exemple, que les cellules hématopoïétiques des mammifères donnent des globules rouges, des lymphocytes T ou B, des macrophages, mais pas des cellules musculaires. 4 - Les cellules souches unipotentes Elles ne peuvent produire qu'un seul type cellulaire comme les cellules de la peau, du foie, de la muqueuse intestinale... La distinction par origine conduit à évoquer les cellules souches adultes et les cellules souches embryonnaires. S'il est certain que les cellules souches adultes existent, il est difficile de les identifier et de les caractériser. Si la question de la plasticité des cellules souches adultes est discutée, trois catégories particulières de ces cellules souches commencent à être bien connues. 1 - L'existence des cellules souches adultes12 Les cellules souches adultes présentent au moins deux caractères : - elles peuvent fournir des copies identiques à elles-mêmes pendant de longues périodes, - elles peuvent donner naissance à des cellules matures ayant des caractères morphologiques et des fonctions spécialisées. On ne connaît pas, à l'heure actuelle, leur origine. Des chercheurs ont proposé l'hypothèse qu'elles représentaient des cellules fœtales demeurées non différenciées. Les cellules souches adultes sont, selon un certain nombre d'avis, rares : entre 1 sur 10 000 et 1 sur 15 000 dans la moelle osseuse et seulement 1 sur 100 000 dans le sang13. Il convient de signaler que M. Daniel Louvard14 s'est inscrit en faux contre cette rareté, estimant qu'en réalité on ne le savait pas et que « pour certains tissus, c'est faux ». Les cellules souches adultes ont été identifiées dans de nombreux tissus humains et animaux. Elles sont localisées soit dans des tissus à renouvellement rapide, soit dans des tissus à renouvellement plus lent. Dans trois tissus à renouvellement rapide les cellules souches fonctionnent en permanence : - l'épiderme : renouvellement des cellules de la peau et du système pileux tous les 30 jours, - l'intestin : production de 108 cellules par jour, - la moelle osseuse : production de 1012 cellules par jour. Dans les tissus quiescents15 des cellules souches sont présentes mais leur localisation est moins précise et leurs fonctions moins bien définies. On en distingue ainsi deux types dans le muscle ainsi que dans le foie. Dans le cerveau des cellules souches ont été localisées en deux endroits. Des cellules souches seraient également présentes dans la pulpe dentaire, la cornée et la rétine. Des cellules souches présentes dans le pancréas seraient également capables de produire les cellules des îlots de Langerhans qui synthétisent l'insuline. Ce dernier résultat semble encore controversé et illustre une difficulté majeure : comment identifier et caractériser ces cellules souches adultes ? 2 - La difficulté d'identifier et de caractériser les cellules souches adultes Il est difficile d'identifier et de caractériser les cellules souches adultes car elles ne semblent porter aucun marqueur spécifique. Comme le souligne Mme Laure Coulombel16, acquérir la preuve qu'une cellule est « souche » nécessite de caractériser sa descendance, in vitro et/ou in vivo. Il s'agit donc d'une identification indirecte et rétrospective. Pour cela il faut répondre à deux exigences. La première est de placer cette cellule dans des conditions qui permettent l'expression de toutes ses capacités de prolifération et de différenciation. Cela entraîne des difficultés compte tenu de la différence, de la spécificité et des incompatibilités des environnements nécessaires pour chaque voie de différenciation. La seconde nécessité est d'analyser les cellules de façon individuelle par la manipulation de cellules uniques ou le suivi d'un marqueur de clonalité. Cette analyse clonale est imposée par l'hétérogénéité des tissus de départ et par l'impossibilité d'une purification à homogénéité des cellules souches car un phénotype n'est pas le reflet fidèle d'une fonction. Mme Laure Coulombel souligne dans cette étude que si ces contraintes ne sont pas satisfaites - et elles le sont rarement - il est impossible de définir avec certitude le potentiel des cellules analysées. Elle estime donc qu'il est nécessaire d'être prudent dans les conclusions qui accordent le statut de cellule souche à une cellule. Mme Laure Coulombel a réitéré ces conseils de prudence lors de l'audition publique du 22 novembre 2005. Une des principales difficultés est donc l'identification des « vraies » cellules souches, c'est-à-dire celles qui n'ont pas encore commencé à s'engager dans une voie de différenciation. Car on ne connaît pas encore les facteurs qui contrôlent le caractère « souche », ceux qui garantiraient le maintien des propriétés de ces cellules. On estime que plusieurs voies de signalisation sont vraisemblablement impliquées, certaines étant induites par la stimulation de récepteurs situés à la surface des cellules, d'autres faisant intervenir des facteurs de croissance. L'expression de tous les gènes d'une cellule souche a été étudiée dans l'espoir d'identifier ceux qui commandent le caractère « souche ». C'est ainsi que les profils d'expression des gènes de cellules souches embryonnaires, de cellules souches hématopoïétiques et de cellules souches neurales ont été comparés. Il semble que jusqu'à présent on n'ait pu déterminer l'empreinte génétique spécifique du caractère « souche » de ces cellules. Il semble qu'on ne sache même pas si cette absence de résultat reflète des difficultés techniques encore non ou mal maîtrisées ou des différences intrinsèques entre les types de cellules. D'autres difficultés demeurent. Ainsi on ignore encore comment une cellule souche entretient sa quiescence ou sa réplication à bas bruit ou commence à proliférer et à se différencier. On pense actuellement que les cellules souches sont contrôlées par l'activité conjuguée de nombreux facteurs créant un véritable réseau de signalisation, celui-ci pouvant changer avec le temps et avec le lieu. Ces signaux peuvent aussi avoir des effets dissemblables sur des types différents de cellules souches. Mais on ignore comment une cellule souche intègre tous ces signaux et comment l'ensemble des réseaux de signalisation contrôle son fonctionnement moléculaire. Ces difficultés auront de l'importance quand il s'agira, comme cela sera évoqué dans un autre chapitre de ce rapport, d'applications thérapeutiques dans la mesure où la différenciation doit être contrôlée de façon parfaite. La connaissance des caractéristiques des cellules souches adultes est donc tout à fait imparfaite. M. Daniel Louvard17 a souligné à ce propos qu'« on compte sur les doigts d'une main, peut-être de deux, le nombre de cellules souches adultes qui ont aujourd'hui été caractérisées », c'est-à-dire celles dont « on a identifié des marqueurs qui permettent de les trier et d'identifier leur origine et leurs propriétés ». La question de la plasticité des cellules souches adultes est également discutée. 3 - La plasticité des cellules souches adultes Après avoir défini et constaté la difficulté de cette question, on évoquera les arguments scientifiques qui en font un phénomène controversé. a - Définition et difficulté de la question La plasticité des cellules souches adultes est le phénomène selon lequel une cellule souche adulte transplantée peut être à l'origine de cellules différenciées d'autres tissus. C'est la capacité éventuelle d'un type cellulaire d'une lignée tissulaire particulière issue d'un des trois feuillets embryonnaires (endoderme, mésoderme, ectoderme) de se différencier dans des cellules des deux autres. Ce serait par exemple la possibilité de la transformation de cellules souches neurales en cellules souches sanguines ou de cellules souches sanguines en cellules musculaires, etc. Cette possibilité serait, comme l'indique Mme Laure Coulombel18, une « transgression des dogmes selon lesquels une cellule souche nichée dans un tissu donné n'engendre que les seules cellules spécialisées de ce tissu et ne peut adopter dans sa descendance le destin de deux feuillets embryonnaires différents ». On emploie également, dans les textes scientifiques, un autre terme, la « transdifférenciation ». En résumé, ce phénomène de plasticité ne peut être possible que sous certaines conditions : . les cellules transplantées doivent survivre après la transplantation, . elles doivent ensuite migrer vers la lésion, . elles doivent donner le type cellulaire qu'il faut remplacer et ce type seulement afin qu'elles ne soient pas à l'origine de tumeurs, . enfin les cellules qui se différencient à partir des cellules transplantées doivent s'intégrer au tissu endommagé pour que l'organe lésé retrouve son fonctionnement normal. Depuis quelques années, la controverse sur cette question n'a pas cessé et les chercheurs entretiennent un débat extrêmement vif, pour ne pas dire quelquefois passionnel sur ce sujet. b - Un phénomène très controversé Je vais exposer les principaux éléments de cette controverse sans la possibilité naturellement de la trancher. En 1999, un article de la revue américaine Science relate l'observation de cellules souches adultes issues du cerveau de souris ayant induit la production de cellules sanguines fonctionnelles lorsqu'elles étaient injectées par voie intraveineuse à une souris irradiée. L'irradiation ayant pour effet de tuer certaines populations cellulaires, et notamment les cellules souches hématopoïétiques, la reconstitution du capital sanguin ne pouvait s'expliquer que par l'action des nouvelles cellules. C'était ainsi la première fois qu'était rapporté l'engagement, in vivo, de cellules souches adultes dans une voie de différenciation (les cellules sanguines) que ne laissait pas présager leur origine (le cerveau). Une certaine plasticité existerait donc pour quelques cellules souches adultes : les cellules souches de la moelle osseuse, du muscle, de la peau, du tissu adipeux ainsi que certaines cellules souches neurales. Deux hypothèses ont été avancées pour expliquer ce phénomène : l'existence d'une cellule souche embryonnaire qui serait préservée à l'âge adulte dans tous les tissus et l'existence d'un phénomène de transdifférenciation. Il faut cependant noter que plusieurs tentatives pour reproduire ces résultats ont échoué. A partir de cette publication, plusieurs rapports scientifiques ont ainsi suggéré que des cellules souches adultes de la moelle osseuse peuvent subir un phénomène de transformation en types de cellules complètement différents comme, par exemple, des cellules de muscle cardiaque ou des cellules du cerveau. A ma connaissance, aucun résultat expérimental objectivement vérifiable et renouvelable n'a encore été enregistré de ce phénomène. Lors de l'audition publique du 22 novembre 2005, une controverse s'est ainsi établie entre Mme Marina Cavazzana-Calvo qui estime « qu'on peut dire sans trop de crainte de se tromper qu'il n'y a pas de plasticité [des cellules souches adultes] » et M. Daniel Louvard qui pense « qu'on ne peut pas répondre à cette question car nous n'avons pas pu l'étudier ». Une autre controverse concernant des cellules souches adultes pouvant éventuellement être à l'origine de cellules des trois lignages embryonnaires s'est élevée dans les dernières années. L'origine de celle-ci est la description en 2002 par une équipe de chercheurs de l'Université du Minnesota dirigée par Mme Catherine Verfaillie de cellules souches de la moelle osseuse, dites M.A.P.C. (pour Multipotent adult progenitor cells). Selon cette étude, celles-ci auraient le pouvoir de se différencier in vitro et in vivo dans tous les types de cellules constituant les tissus et les organes du corps où elles avaient été prélevées. Cette équipe avait démontré que ces M.A.P.C. pouvaient engendrer les lignées de l'endoderme, du mésoderme et de l'ectoderme. Des embryons chimériques avaient été obtenus, certains constitués de 40% de cellules étrangères distribués dans tous les tissus, faisant ainsi penser que ces cellules étaient fonctionnelles. Aucune formation de tumeur n'avait été constatée et un potentiel de développement très important avait été constaté sans que des signes de vieillissement n'ait été constaté. Cette découverte avait été saluée à l'époque comme marquant une étape fondamentale. Mais, depuis, l'enthousiasme est retombé. En effet outre le fait que ces cellules seraient extrêmement rares - on en compterait moins de 2 000 dans une souris - elles n'ont pas été identifiées in vivo. Depuis, les expériences originelles n'ont pas pu être reproduites, ce qu'a confirmé M. Jacques Hatzfeld19, en soulignant que « tous les travaux qui ont été faits sur les M.A.P.C. sont actuellement totalement inreproductibles ». M. Daniel Louvard a d'ailleurs reconnu que « dans un tissu adulte, nous savons bien qu'il y a des cellules souches qui dérivent des différents feuillets embryonnaires, et qu'on n'a pas pu explorer exactement, en dehors du tissu dans lequel elles existent, ou de l'organe dans lequel elles existent, si elles récapitulent ou non l'ensemble des propriétés des cellules du feuillet dont elles dérivent. » Enfin il convient de signaler les travaux de MM. Douglas Melton et Kevin Eggan de l'Institut des cellules souches de l'Université Harvard sur la fusion cellulaire. Nous évoquerons plus complètement ce travail dans la partie de ce rapport sur la transposition nucléaire. Un certain nombre de cellules souches adultes sont maintenant bien connues. 4 - Quelques cellules souches adultes bien connues Nous évoquerons les cellules souches hématopoïétiques, les cellules souches mésenchymales et les cellules souches du sang de cordon ombilical. a - Les cellules souches hématopoïétiques Ce sont probablement les cellules souches adultes les mieux connues à l'heure actuelle. Elles sont principalement issues de la moelle osseuse et elles sont à l'origine des cellules sanguines nécessaires pour le renouvellement quotidien du sang et pour la lutte contre les infections comme le montre le schéma suivant :
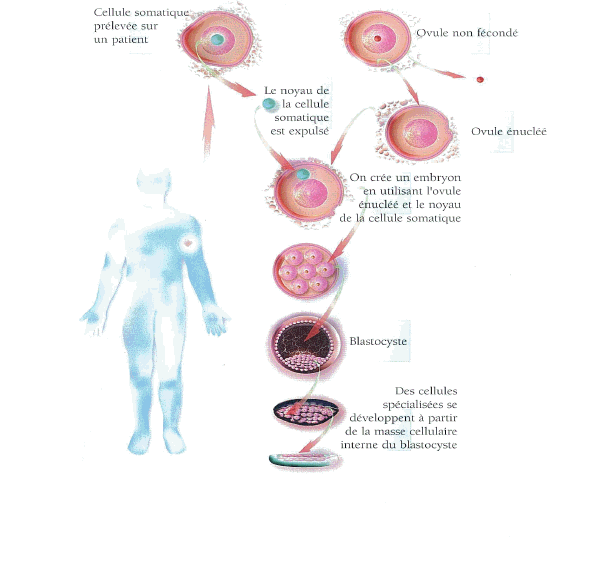
Source : Le Courrier de L'UNESCO 2004 Numéro spécial « Le Clonage humain » Comparativement aux autres cellules souches adultes d'autres tissus, les cellules souches hématopoïétiques sont faciles à obtenir à partir soit de la moelle osseuse, soit du sang périphérique. Ces cellules souches ont été étudiées depuis très longtemps et sont les premières cellules souches à avoir été utilisées avec succès dans diverses thérapies. Par contre, le potentiel de ces cellules souches pour produire des cellules autres que des cellules du sang est devenu un sujet d'importants débats. Il n'est notamment pas encore déterminé avec précision si elles peuvent être utilisées pour restaurer des tissus et des organes autres que le sang et le système immunitaire même si, de façon régulière, des annonces sont faites dans ce sens. Mme Laure Coulombel a ainsi estimé que la transdifférenciation qui tendrait à ce qu'une cellule souche hématopoïétique soit capable de faire autre chose que des cellules hématopoïétiques n'est à l'heure actuelle pas démontrée expérimentalement en notant qu'« avec une seule cellule chez la souris, rien ne se produit d'autre que des cellules souches hématopoïétiques ». Par contre, elle a observé que certains dérivés de ces cellules souches hématopoïétiques peuvent fusionner dans un tissu malade avec une cellule malade et lui conférer alors la capacité de redevenir « normale ». Elle a souligné qu'on était alors devant un cas, différent, de reprogrammation nucléaire somatique. Elle a aussi attiré l'attention sur le fait qu'il était possible de constater parfois l'expression de certains marqueurs d'autres tissus par des cellules souches hématopoïétiques mais qu'il pouvait s'agir d'artefact de culture. b - Les cellules souches mésenchymateuses Les cellules souches mésenchymateuses sont une autre catégorie de cellules souches adultes qui commencent à être bien connues. Ces cellules ont été isolées dans les années 1960 à partir de moelle osseuse animale. Elles ont donc la même origine que les cellules souches hématopoïétiques. Les cellules souches mésenchymateuses possèdent de nombreuses propriétés intéressantes du point de vue thérapeutique. Elles produisent ainsi de nombreux facteurs de croissance hématopoïétiques et un facteur permettant aux cellules hématopoïétiques de s'établir dans la moelle. Elles sont très peu immunogènes20 et ont même tendance à inhiber les réactions immunes. Enfin elles possèdent des propriétés plastiques leur permettant de se différencier en de nombreux types cellulaires et donner en laboratoire des chondrocytes21, des myoblastes22, des adipocytes23 et même des cellules neurales. Les techniques de leur isolation en cultures sont maintenant bien établies et, bien qu'elles soient peu nombreuses, il est possible de les multiplier en quantités assez importantes in vitro. Elles peuvent ainsi être maintenues et propagées pendant de longues périodes de temps en laboratoire sans perdre leurs qualités. Ces caractéristiques en font de bonnes candidates pour être utilisées en thérapie cellulaire. c - Les cellules souches du sang de cordon ombilical Les cellules souches de sang de cordon ombilical ont fait irruption dans l'actualité l'été dernier avec l'information donnée par la presse britannique selon laquelle un certain nombre de sportifs avaient fait stocker le sang de cordon ombilical de leur enfant. Ce prélèvement aurait été effectué non seulement pour soigner éventuellement celui-ci mais aussi pour traiter leurs propres problèmes de cartilage ou de ligaments. Cet intérêt pour les capacités des cellules hématopoïétiques du sang de cordon ne représente pas une nouveauté. En effet la première greffe mondiale de sang de cordon a été effectuée par Mme Eliane Gluckman à l'hôpital saint Louis de Paris en 1988, sur un petit garçon atteint d'une maladie du sang héréditaire. Depuis cette époque, environ 6 000 greffes de sang de cordon ont été effectuées de par le monde. Le premier intérêt de ce sang est qu'il est particulièrement riche en cellules souches hématopoïétiques que l'on pensait trouver uniquement dans la moelle osseuse. Mais il recèle d'autres avantages par rapport à la moelle osseuse : - le prélèvement ne présente pas de difficultés particulières dans la mesure où le sang est prélevé quand le cordon ombilical a été coupé. Cela n'entraîne aucune contrainte et aucun risque pour la mère et l'enfant, - la congélation est possible pour une utilisation éloignée du prélèvement, - les cellules ont des capacités de prolifération et d'expansion supérieures à celles de la moelle osseuse ou du sang périphérique d'un adulte, - les cellules sont immatures. Elles doivent donc entraîner une moindre réaction de rejet du greffon de la part de l'organisme du receveur du fait que les caractéristiques immunitaires des cellules souches et les anticorps du nouveau-né ne sont pas encore pleinement développés, - les ressources peuvent être considérées comme illimitées, notamment par rapport aux difficultés du prélèvement de la moelle osseuse qui nécessite une anesthésie générale du donneur. L'utilisation du sang de cordon est aujourd'hui bien maîtrisée et très utile notamment pour soigner certaines maladies graves du sang comme les leucémies aiguës. Mais leur utilisation thérapeutique se heurte encore à la petite taille des greffons, insuffisante pour pouvoir traiter des adultes. Depuis les années 1990, la plupart des pays développés ont commencé à constituer des banques publiques de sang de cordon ombilical. Il existerait à l'heure actuelle une cinquantaine de banques publiques de sang de cordon dans le monde entier. Les banques actuellement constituées conservent ce sang pour des utilisations principalement allogéniques même si existe la possibilité d'une utilisation autologue en faveur de l'enfant donneur. Mais depuis plusieurs années des sociétés privées se sont créées notamment aux Etats-Unis et en Grande-Bretagne, en offrant la possibilité de congeler, contre rémunération, le sang de ce cordon des nouveaux-nés en vue d'une utilisation future en cas de besoin. Ces annonces publicitaires et les annonces prématurées d'un certain nombre de publications évoquant la possibilité de guérir par ce moyen un grand nombre d'affections jouent sur l'angoisse des parents. Elles insistent ainsi sur les éventuelles possibilités de transdifférenciation des cellules souches hématopoïétiques pour, dans le futur, soigner le diabète, les maladies de Parkinson ou d'Alzheimer, réparer un cœur endommagé..., tous objectifs qui restent du domaine spéculatif. Saisi par le directeur général de la santé en 2002 de la question de la conservation de sang de cordon (ombilical ou placentaire), le Comité consultatif national d'éthique (C.C.N.E.) dans son avis du 12 décembre 2002 soulignait, entre autres, les trois dangers majeurs de la conservation autologue du sang placentaire : « 1) Le danger le plus grave est pour la société dans la mesure où l'instauration de telles banques est de nature à s'opposer au principe de solidarité, sans lequel il n'y a pas de survie possible pour une société quelle qu'elle soit, 2) De telles banques suscitent des utopies et déguisent un but mercantile sous prétexte de rendre service à l'enfant, 3) Elles mettent en cause la justice et l'équité. Si des indications raisonnables existaient, il conviendrait que la proposition devînt systématique et soit organisée sous la responsabilité publique ; là intervient le coût et la notion de grande échelle [...] ». En conclusion, le Comité consultatif national d'éthique s'était prononcé en faveur du stockage public pour les greffes, et opposé au stockage privé à vocation personnelle. Il invitait également les pouvoirs publics à promouvoir un important développement des banques publiques de sang de cordon plutôt que de souscrire à la constitution de banques privées. J'approuve cette position qui se trouve aujourd'hui toujours pleinement justifiée. Cependant, il y a aujourd'hui dans le monde une très grande disproportion entre le nombre de banques de sang cordon privées et les banques publiques : une cinquantaine contre plus de cent trente. Les banques privées sont en pleine expansion aux Etats-Unis, en Grande-Bretagne, en Belgique, en République fédérale d'Allemagne, en Asie. La France doit, face à ce mouvement, développer les banques publiques de sang de cordon à travers l'Agence de la biomédecine. Notre pays doit également mettre en garde les organisations internationales sur ce développement des banques privées. Il convient donc de réactiver la recommandation du Comité consultatif national d'éthique pour le développement de banques publiques de sang de cordon. Ce sera une recommandation de ce rapport. Les cellules souches adultes sont actuellement l'objet d'un débat important dans la mesure, notamment, où elles sont comparées aux cellules souches embryonnaires. Après avoir présenté les cellules souches embryonnaires, on évoquera leurs caractéristiques, leur obtention et les problèmes de leur culture. 1 - Présentation des cellules souches embryonnaires L'ovocyte fécondé, le zygote, qui est monocellulaire, s'engage dans une série de divisions. Les cellules souches embryonnaires sont les cellules issues des premières divisions du zygote. Elles sont qualifiées de totipotentes, c'est-à-dire qu'elles sont capables de recréer un organisme entier si elles sont isolées. Très vite, cette propriété est perdue mais les cellules de l'embryon précoce restent capables de donner naissance à n'importe quelle cellule de l'organisme. Quatre ou cinq jours après la fécondation, ces cellules embryonnaires pluripotentes subissent une première spécialisation. L'embryon de cinq jours, est appelé alors blastocyste. C'est une petite sphère creuse à l'intérieur de laquelle saille un petit amas de cellules, le « bouton embryonnaire », composé d'une masse cellulaire interne et d'une masse cellulaire externe. Le déroulement de ce cycle est le suivant :
Source : Le Courrier de L'UNESCO 2004 Numéro spécial « Le Clonage humain » Les cellules constituant la masse cellulaire externe formeront, avec des cellules de la mère au cours de la gestation, le placenta. Les cellules de la masse cellulaire interne vont s'engager dans la formation du tissu germinal et des trois feuillets embryonnaires somatiques d'où sont issus les tissus organiques du futur individu. Le feuillet externe, ou ectoderme, sera à l'origine de la peau, des neurones, des yeux et des oreilles. Le feuillet moyen, ou mésoderme, sera à l'origine de la moelle osseuse, des muscles, du sang et des vaisseaux sanguins. Enfin le feuillet interne, ou endoderme, donnera naissance, quant à lui, au pancréas, au foie, à la glande thyroïde, aux poumons, à la vessie. Lorsque les cellules s'engagent ainsi dans ces voies de différenciation, elles perdent leur pluripotence. La découverte des cellules souches embryonnaires humaines est récente puisque c'est en 1981 que, simultanément aux Etats-Unis et en Grande-Bretagne, deux chercheurs montrèrent que les cellules du bouton embryonnaire d'un embryon de souris mises en culture dans des conditions spécifiques, ont commencé à se diviser et ont pu se propager de manière indéfinie sans se différencier, figées à ce stade précoce de l'embryogenèse. Ces chercheurs se sont rendus compte que, même après la formation, en culture, de nombreuses générations, ces cellules souches embryonnaires « se souvenaient » de ce pourquoi elles étaient programmées. Elles gardaient ainsi la capacité de se différencier en n'importe quel type cellulaire spécialisé de l'organisme. En effet si de telles cellules étaient réintroduites dans un blastocyste, elles le coloniseraient et leurs descendantes seraient retrouvées dans tous les tissus du souriceau nouveau-né. Les cellules murines différant en bien des points de leurs homologues humaines, il a fallu attendre 1998 pour que des cellules embryonnaires humaines soient isolées à partir de blastocystes humains par M. James Thomson et ses collaborateurs de l'Université du Wisconsin. 2 - Les caractéristiques des cellules souches embryonnaires Elles ont trois caractéristiques principales qui les distinguent des autres types de cellules souches : - elles expriment des facteurs qui les rendent pluripotentes, - ce sont des cellules non spécialisées qui se renouvellent elles-mêmes au cours de nombreuses divisons cellulaires. Une population proliférant pendant plusieurs mois en laboratoire peut ainsi se compter en millions. Un défi important pour la recherche est de comprendre pourquoi une population de cellules souches demeure non spécialisée et continue à proliférer, - elles peuvent induire, sous certaines conditions, des cellules spécialisées. Il semble24 que ces cellules pourraient posséder un privilège immun. En effet, elles n'expriment que peu d'antigènes d'histocompatibilité et ne sont pas la cible des lymphocytes T. Elles pourraient sécréter un facteur immunosuppresseur local et induire un phénomène de tolérance. Enfin, elles pourraient posséder une neutralité immunologique et des facultés d'adaptation à l'environnement d'un tissu hôte. 3 - L'obtention des cellules souches embryonnaires La source de ces cellules souches embryonnaires est donc un blastocyste qui peut être obtenu: - à partir d'embryons dits « surnuméraires » recueillis lors d'une tentative de fécondation in vitro (F.I.V.) et dont les caractéristiques ne sont pas compatibles avec une congélation. Les lignées de cellules souches embryonnaires actuelles ont été isolées à partir de blastocystes d'embryons surnuméraires issus de F.I.V. Le rendement varie entre 35 et 50 %, soit une lignée pour deux ou trois blastocystes, - à partir d'embryons résultant d'un diagnostic préimplantatoire, - à partir d'embryons congelés, pour lesquels il n'y a plus de projet parental, - à partir d'embryons créés par transposition nucléaire. Celle-ci sera étudiée dans le chapitre suivant. 4 - Les problèmes de la culture des cellules souches embryonnaires Trois problèmes se posent : les milieux de culture, le contrôle de la différenciation cellulaire et le problème de l'instabilité génomique. Depuis 1998, les lignées de cellules souches embryonnaires humaines étaient cultivées sur un substrat contenant du sérum de veau fœtal et une couche de cellules nourricières, des fibroblastes d'embryon de souris. Ces fibroblastes avaient été irradiés afin de les empêcher de se diviser tout en restant capables de sécréter les facteurs de croissance nécessaires. De telles conditions de culture représentaient naturellement des dangers potentiels de contamination par des virus murins ou par des prions d'origine bovine. Des progrès ont été enregistrés de ce point de vue. En effet, l'équipe de M. James Thomson du WiCell Research Institute associé à l'Université du Wisconsin a mis au point l'année dernière un nouveau milieu de culture ne comportant aucun élément animal. Cependant si les deux lignées créées par cette équipe, à partir d'embryons surnuméraires après une F.I.V., ont survécu plus de sept mois, elles ont présenté des anomalies chromosomiques. Il n'a pu être déterminé si ces anomalies étaient ou non liées à l'emploi du nouveau support nutritif. Mme Jane Lebkowski m'a indiqué que de nouvelles lignées de cellules souches embryonnaires ont été dérivées dans les laboratoires de l'entreprise Geron sans jamais avoir été exposées à des produits animaux. b - Le contrôle de la différenciation cellulaire Afin de pouvoir orienter de façon spécifique les cellules souches embryonnaires vers des lignages tissulaires définis, il est nécessaire de pouvoir disposer de facteurs contrôlant la différenciation cellulaire in vitro. Actuellement, lorsque les cellules souches embryonnaires sont séparées des cellules nourricières et disposées dans un milieu de culture liquide, elles ont tendance à se regrouper en agrégats appelés « corps embryonnaires » à l'intérieur desquels la différenciation se fait de façon anarchique et très aléatoire. La réinjection de ces corps embryonnaires dans des souris immuno-déficientes conduit dès lors souvent à la formation de tumeurs bénignes (tératomes). c - Le problème de l'instabilité génomique Dans un article récent25, un certain nombre de chercheurs ont démontré que des anomalies génétiques apparaissent dans des lignées de cellules embryonnaires humaines cultivées in vitro de façon prolongée. Ils ont ainsi montré que des changements importants avaient eu lieu : pertes ou amplification de certaines parties de l'A.D.N., mutations de l'A.D.N. mitochondrial, modification de l'expression des gènes. Les auteurs notent qu'on ne connaît pas encore l'impact de ces mutations génétiques sur le comportement des cellules souches ou sur leur capacité à se différencier. Il semble que les cellules qui accumulent ainsi des modifications de leur A.D.N., que celles-ci soient d'origine génétique ou épigénétique, acquièrent un avantage en matière de duplication, par rapport aux cellules non affectées par ces phénomènes. Les raisons de cette situation demeurent inconnues. Les auteurs ont ainsi souligné que sur les 22 lignées de cellules souches autorisées pouvant ouvrir droit aux financements fédéraux aux Etats-Unis, 10 sont affectées par ces mutations. Ce phénomène d'instabilité génétique des cultures de lignées de cellules souches m'a été confirmé par tous mes interlocuteurs. Les cellules souches embryonnaires présentent, donc comme les cellules souches adultes, un grand nombre de difficultés. Mais ces deux catégories de cellules souches paraissent posséder un grand nombre de qualités et la réflexion s'est développée sur leurs applications potentielles. L'idée la plus immédiate est que ces cellules souches permettront de développer des traitements, la thérapie cellulaire, pour de très nombreuses maladies. Cependant avant d'évoquer celle-ci, il faut insister d'abord sur quelques idées fausses. Enfin nous envisagerons la question de la transposition nucléaire. Nous assistons depuis quelques années au développement d'un certain nombre d'idées fausses : guérir tout de suite grâce aux cellules souches, obligation de donner des perspectives thérapeutiques à court terme à la recherche, opposition entre cellules souches adultes et cellules souches embryonnaires, tumorigénicité des cellules souches embryonnaires humaines. a - Guérir tout de suite grâce aux cellules souches Cette idée s'est développée de façon importante depuis quelques années et les évènements de Corée ont été l'occasion de l'amplifier de façon importante. Un certain nombre de média, heureusement isolés, ont joué un grand rôle dans cette affaire. Ils ne se contentaient pas en effet de suggérer mais affirmaient qu'il allait devenir possible, dans un délai extrêmement rapide, de guérir des terribles affections aujourd'hui incurables comme les maladies de Parkinson et d'Alzheimer. Il s'agissait alors, comme me l'avait dit un de mes interlocuteurs, de « donner de l'espoir »! Heureusement un certain nombre de journalistes sont conscients de cette situation. Ainsi M. Jean-Yves Nau26 note-t-il que « [...] les publications scientifiques relatives à la création de mammifères par la technique du clonage ont toujours eu un large écho dans les media, assurant à leurs auteurs une renommée et une aura que jalousent nombre de leurs pairs. Une course à la notoriété qui entraîna des dérapages répétés, tant de la part des chercheurs que des médias [...] ». Mais songe-t-on, ce faisant, à la situation des personnes souffrant de ces affections et à qui on fait miroiter ainsi un espoir d'échapper aux conséquences de ces terribles maladies ? Songe-t-on ainsi à leurs proches et à leur douleur de voir un être aimé frappé par une terrible épreuve ? Il semble que, malheureusement, la nécessité de faire de grands et beaux titres de couverture l'ont emporté sur l'honnêteté intellectuelle. Comme je l'ai déclaré lors de l'audition publique du 22 novembre dernier, je trouve scandaleux de dire qu'aujourd'hui, la recherche sur les cellules souches embryonnaires trouvera, demain, des applications thérapeutiques. J'espère de toutes mes forces que ces recherches déboucheront en effet un jour sur des applications thérapeutiques majeures mais, aujourd'hui, l'honnêteté intellectuelle oblige à dire qu'il n'en est encore rien. Tous les scientifiques entendus le 22 novembre 2005 ont, unanimement, souligné ce point de vue. Il ne s'agit évidemment pas pour moi de faire le procès des médias qui ont un véritable rôle à jouer en matière de diffusion de la culture scientifique, afin de collaborer à la nécessaire formation des citoyens sur des sujets qui sont, il faut le reconnaître, très difficiles à appréhender. Ils le font, dans un grand nombre de cas, avec pertinence et avec une grande rigueur. Les journalistes et, notamment, ceux de la presse généraliste sont en effet tributaires des articles parus dans les publications scientifiques. Ils n'ont naturellement pas la possibilité de vérifier l'authenticité et l'exactitude de ces articles. Il est d'autant moins dans mes intentions de faire porter la responsabilité de cette situation aux journalistes qu'il existe un certain nombre de membres de la communauté scientifique dont l'attitude a été pour le moins très discutable. Il en a été ainsi de certains professeurs de médecine très connus, non spécialistes du domaine, qui, pour faire la promotion de leurs livres, ont émis des jugements tendant à laisser croire que la guérison de ces terribles maladies étaient pour demain. Un certain nombre de chercheurs ont pu tenir aussi des propos imprudents, ou insuffisamment nuancés sur les possibilités ouvertes par ces cellules souches - tant adultes qu'embryonnaires - en matière de thérapies. Ces imprudences sont dues à la compétition entre scientifiques pour l'accès à la notoriété qui conditionne, de fait, l'attribution des financements. Il faut certainement aussi, par souci d'honnêteté, mettre en cause les hommes politiques qui, faute de temps, ne peuvent consacrer toute l'attention nécessaire à effectuer un suivi précis de tous les travaux qui évoluent avec une extrême rapidité dans ce domaine. Il leur faudrait, à chaque annonce dans ce domaine, le nécessaire recul critique qui leur permettrait de distinguer les faits avérés des annonces sans lendemain. M. Marc Peschanski27 a résumé le devoir des chercheurs, s'agissant des cellules souches embryonnaires, en soulignant qu'« il y a là [...] quelque chose qui est à haut risque et qui ne peut être promis aujourd'hui, tout ce que nous pouvons promettre étant de travailler [pour] déboucher sur une thérapie ». b - L'obligation de donner des perspectives à court terme à la recherche Je pense que l'on touche là un domaine très sensible qui a, malheureusement, reçu une consécration législative. En effet l'article 25 de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique prévoit que « les recherches peuvent être autorisées sur l'embryon et les cellules embryonnaires lorsqu'elles sont susceptibles de permettre des progrès thérapeutiques majeurs [...] ». J'avais combattu cette disposition lors de la discussion en deuxième lecture du projet de loi. Elle revient en effet à nier la nécessité de la recherche fondamentale : il faudra nécessairement avoir une perspective de thérapies pour pouvoir engager des recherches dans ce domaine. Je n'avais malheureusement pas pu convaincre, à l'époque, ni le rapporteur, ni le ministre, ni une majorité de mes collègues. Cette manière de procéder peut être potentiellement extrêmement dangereuse. Elle pourrait pousser des scientifiques à justifier ainsi des demandes de crédit pour leurs activités. Cela a pu renforcer la dérive qui vient d'être évoquée concernant d'hypothétiques possibilités prochaines de guérison grâce aux cellules souches. Je ferai des propositions dans la quatrième partie de ce rapport sur la politique qui me semble devoir être suivie en France. Si on revient vingt ans en arrière, jamais la perspective de « progrès thérapeutiques majeurs » n'a été imposée pour autoriser les recherches en matière de thérapie génique. Si cela avait été le cas, on peut penser que personne ne se serait engagé dans ce domaine. Généraliser cette attitude dissuaderait les chercheurs de toute démarche de recherche fondamentale pour les confiner uniquement dans des démarches de type utilitariste. Nous prendrions le risque d'engendrer un système où plus aucun protocole de recherche fondamentale ne serait possible. C'est M. Hervé Chneiweiss28 qui a le mieux résumé cette situation : « [...] nous sommes dans un courant utilitariste qui est né avec la génomique et la biologie à grande échelle, lorsque nos collègues américains ont lancé en 1969 le grand programme génome humain comme nouveau rêve après que l'homme ait mis un pied sur la Lune. Ils ne l'ont pas vendu en tant que connaissance du génome humain mais comme nouvelle frontière pour guérir le cancer. A partir de ce moment a eu lieu une sorte d'entraînement qui a fait que dans tout article scientifique, les auteurs commencent ou terminent en justifiant leur travail par une pathologie29. Il y a également un jeu par rapport aux différentes représentations publiques, les médias ou les politiques, pour essayer de justifier cette idée sous-jacente qui traverse tous les partis politiques que la connaissance scientifique pure est quelque chose de noble mais qui ne mérite pas [un] combat vis-à-vis de croyances morales profondément enracinées dans l'histoire d'un pays. Il est parfois apparu à certains plus aisé de défendre des positions utilitaristes [...]. » En première lecture, l'Assemblée nationale avait adopté l'autorisation de la recherche sur l'embryon et les cellules embryonnaires s'inscrivant « dans une finalité médicale », ce qui était toute autre chose. Il convient donc d'en revenir à ce texte et de supprimer ces termes contenus dans la loi de 2004. Ce sera une recommandation de ce rapport qui proposera la révision de l'article 25 de la loi 2004-800 du 6 août 2004 relative à la bioéthique. Il est indispensable de réhabiliter la notion de recherche fondamentale car elle est la condition du progrès des connaissances. c - L'opposition cellules souches adultes/cellules souches embryonnaires Comme on peut le voir dans le compte rendu de l'audition publique du 22 novembre 2005, une certaine vivacité a entouré le débat sur les mérites respectifs des deux types de cellules souches. Il apparaît que les spécialistes des cellules souches adultes ressentent parfois avec un certain malaise que l'on présente les cellules souches embryonnaires comme étant parées de tous les avantages. Ils ont l'impression que les qualités des cellules souches adultes sont négligées. C'est un fait que les cellules souches embryonnaires bénéficient quelquefois, d'une attention plus grande de la part d'un certain nombre de médias compte tenu, notamment, de leur plus grande nouveauté. Il est juste aussi de souligner que celles-ci avaient bénéficié, à l'époque, de toute l'effervescence qui s'était progressivement développée autour des « réalisations » de l'équipe coréenne de M. Hwang Woo-suk. Cette dissymétrie ressentie au détriment des cellules souches adultes n'est en fait qu'une sorte de « trompe-l'œil » car les moyens de recherche sont massivement en leur faveur. C'est le cas en France où M. Christian Bréchot30 a indiqué par exemple que les crédits de l'Inserm étaient, à la fin de 2005, de façon immensément majoritaires, du fait de la loi, consacrés aux cellules souches adultes. La situation est semblable au Japon où M. Norio Nakatsuji a souligné que l'effort sur les cellules souches adultes est dix fois plus importants en matière de fonds et de chercheurs que sur les cellules souches embryonnaires. J'ai montré que les incertitudes de ces deux types de cellules souches demeuraient très grandes. Aucune de ces deux catégories ne doit donc être privilégiée. C'est aussi ce qu'ont déclaré un certain nombre des participants de la journée d'auditions publiques. Ainsi M. Philippe Ménasché a-t-il noté que « dans l'état d'ignorance où nous nous trouvons [...] cela n'a aucun sens d'opposer les cellules adultes aux cellules embryonnaires. Les deux pistes doivent être explorées en parallèle [...], il n'est pas impossible que les deux types de cellules trouvent finalement leur place dans des pathologies différentes. Pour donner un exemple, on sait aujourd'hui que si l'on veut remplacer une cellule du cœur, il est peu probable dans l'état actuel des connaissances que l'on puisse y parvenir avec des cellules adultes. Les cellules embryonnaires en sont semble-t-il capables. A contrario, s'il s'agit simplement d'amener des cellules qui peuvent sécréter de l'insuline, des îlots de Langerhans, des cellules adultes prélevées chez des sujets en coma dépassé font très bien l'affaire. [...] l'opposition qui existe parfois entre les cellules adultes et embryonnaires n'a aucun sens sur le plan clinique31. Il faut explorer les deux, ce qui signifie ne pas couper la piste des cellules embryonnaires [...]. Allant au-delà, M. Jacques Hatzfeld a souligné le caractère complémentaire du travail sur les cellules souches embryonnaires et adultes dans le cadre du projet européen Genostem sur les cellules souches adultes : « C'est grâce aux cellules souches embryonnaires que je [peux] trouver les marqueurs des cellules souches adultes, non pas en partant par l'aval, comme on le faisait auparavant, mais en partant par l'amont, en dérivant, à partir des cellules souches embryonnaires, des cellules souches mésenchymateuses, ce qui me permet d'en avoir en quantité, et d'étudier tous les marqueurs les plus primitifs. Si l'on ne travaille pas sur les cellules souches embryonnaires, on ne comprendra jamais les cellules souches adultes». Mme Laure Coulombel a, quant à elle, insisté sur le fait qu'il est essentiel de ne pas opposer les deux types de cellules pour deux raisons : - il est probable que les mécanismes moléculaires gouvernant l'amplification des cellules souches embryonnaires soient semblables à ceux des cellules souches adultes, notamment ceux régissant leur diversification, - les cellules souches embryonnaires permettent une accessibilité en termes de nombre impossible à obtenir avec les cellules souches adultes, sauf en ce qui concerne les cellules souches hématopoïétiques. Je suis toutefois inquiet de la tournure que prend quelquefois ce débat sur les différents types de cellules souches en France. En effet, il me semble que deux camps sont toujours peu ou prou sur le point de s'opposer sur les mérites respectifs de ces deux types de cellules avec des accents tout à fait excessifs. Je comprends tout à fait que les chercheurs travaillant sur les cellules souches adultes soient irrités par le fait que les cellules souches embryonnaires sont parfois présentées comme l'alpha et l'oméga de la recherche cellulaire et que les gros titres leur soient réservés. Je suis tout à fait convaincu que les spécialistes des cellules souches embryonnaires et ceux des cellules souches adultes travaillent tous à trouver des traitements qui soulageront les souffrances des êtres humains. Je suivrai donc, pour l'appliquer aux cellules souches adultes et aux cellules souches embryonnaires, l'opinion de M. Claude Huriet32 qui écrit33: « [...] on doit souligner le danger, dans toute démarche scientifique, d'une attitude par trop manichéenne. [...] Il faut [...] mettre un terme à des querelles où, trop souvent, des présupposés idéologiques l'emportent sur la démarche scientifique ». Il me semble donc essentiel de ne pas opposer les deux catégories de cellules souches. d - La tumorigénécité des cellules souches embryonnaires Cette question est débattue depuis un certain nombre d'années. Elle a été abordée lors de l'audition publique du 22 novembre 2005. M. Daniel Aberdam a noté que pour démontrer qu'une cellule souche embryonnaire est pluripotente, on injecte ces cellules chez une souris immunodéficiente, c'est-à-dire dont le système immunitaire a été détruit. Il a mentionné qu'on obtient alors des tératocarninomes mais qu'on ne les obtient que parce qu'il s'agit d'une souris immunodéficiente et que son système immunitaire ne peut s'en débarrasser. Il a souligné qu'il « est clairement établi que lorsqu'on différencie les cellules souches embryonnaires, on n'obtient plus ces tumeurs. [...] Si l'on arrive à purifier des cellules différenciées à partir de cellules souches embryonnaires, toutes les expériences publiées, non publiées ou commentées, montrent qu'il y a absence de tumeur. » M. Philippe Ménasché a acquiescé à ces propos en notant qu' « on n'a jamais observé, à partir du moment où les cellules sont pré-différenciées correctement, la moindre tumeur. » Il reste néanmoins des difficultés de ce point de vue car il semble qu'on ne sait pas avec exactitude jusqu'à quel point il faut que ces cellules soient différenciées. La thérapie cellulaire est définie par les textes comme l'administration à un patient de produits biologiques à effets thérapeutiques issus de préparations de cellules vivantes humaines ou animales dans un but préventif ou curatif. La thérapie cellulaire peut s'inscrire, comme l'écrit M. Axel Kahn34 dans le « rêve multi-centenaire de la médecine » de réparer pièce par pièce les éléments défectueux ou usés de la machine humaine. Ce sont les premières greffes d'organes réalisés voilà maintenant une cinquantaine d'années qui ont ouvert la voie à la possibilité d'une médecine régénératrice. Ces greffes d'organes sont aujourd'hui pratiquées avec succès dans un certain nombre de domaines grâce à l'amélioration des méthodes chirurgicales et à la mise au point de médicaments immunosuppresseurs efficaces. Cependant un facteur limitant important tient au nombre insuffisant de greffons par rapport à la demande. Si les xénogreffes pourraient retenir l'attention, leurs difficultés sont importantes compte tenu des problèmes immunologiques posés et des risques de transmission à l'homme de virus ou de rétrovirus animaux. Cette situation explique l'intérêt porté à la thérapie cellulaire. Celle-ci est basée sur l'utilisation de cellules vivantes prélevées soit chez le patient à traiter soit chez un donneur. Selon le degré de transformation des cellules, elle peut s'apparenter d'abord à une simple greffe de cellules prélevées chez un donneur puis administrées à un receveur. Elle peut aussi nécessiter des techniques plus élaborées dans la mesure où les cellules administrées peuvent avoir subi un processus complexe de conservation, de sélection et de transformation qui leur confère des propriétés nouvelles. Ces modifications peuvent aller jusqu'à la modification de leur patrimoine génétique, faisant ainsi de ces cellules un produit combinant thérapie cellulaire et thérapie génique. Des applications de thérapie cellulaire existent déjà tandis que d'autres voies de recherche s'ouvrent et qu'il est possible d'envisager une approche mêlant thérapie génique et thérapie cellulaire. a - Les applications déjà existantes de la thérapie cellulaire Les applications de la thérapie cellulaire concernent actuellement la régénération des cellules du sang et celles de la peau par utilisation de cellules souches adultes. Les perspectives de l'utilisation thérapeutique des cellules souches embryonnaires seront examinées dans le cadre de la partie suivante de ce rapport consacrée à la transposition nucléaire. _ La régénération des cellules du sang La régénération des cellules du sang s'est faite à l'origine par les cellules souches de la moelle osseuse, tandis que d'autres techniques ont commencé actuellement à être appliquées. . Les cellules souches de la moelle osseuse Celles-ci ont été les premières cellules souches connues et elles ont été greffées chez l'homme dès la fin des années 1950. Cette greffe permet de traiter des maladies auto-immunes35, des déficits immunitaires, des leucémies mais aussi un certain nombre de cancers « solides ». Afin d'éviter les réactions contre les greffons, il est pratiqué, à chaque fois que cela est possible, une autogreffe. Dans la mesure où ces cellules ne permettent pas de restaurer la totalité des cellules sanguines, la perspective est de les combiner avec les cellules souches mésenchymateuses qui offrent le micro-environnement nécessaire à la bonne activité des cellules hématopoïétiques. Ces cellules souches de la moelle osseuse peuvent aussi se différencier en os et en cartilage permettant la réparation des lésions osseuses ou cartilagineuses. . Les autres techniques Depuis une dizaine d'années, on utilise du sang de cordon ombilical pour régénérer les cellules du sang. Celles-ci ont déjà été évoquées précédemment. _ La régénération des cellules souches de la peau Celle-ci se fait de façon classique par l'utilisation des kératinocytes, mais une autre technique vient d'être employée de façon expérimentale. . L'utilisation des kératinocytes La peau se régénère dans sa totalité toute les trois semaines environ grâce à l'action des kératinocytes de l'épiderme. Ils sont fabriqués dans sa couche la plus profonde, se multiplient et migrent peu à peu vers la surface cutanée. Depuis plus de vingt ans, ils sont couramment cultivés en vue de greffer, notamment, les grands brûlés. Il suffit de prélever quelques centimètres carrés de peau saine chez le patient avant de les ensemencer sur une couche nourricière de cellules du derme, les fibroblastes. Quelques semaines suffisent pour obtenir une grande surface d'épiderme qui fera l'objet d'une greffe autologue. . Une nouvelle technique expérimentale Au mois de mars dernier, une brûlure par irradiation de la peau a été traitée, avec succès à l'heure actuelle, en France, par une greffe autologue de cellules souches de moelle osseuse. Il s'agissait de la première application d'un traitement qui, jusqu'ici, n'avait été mis en œuvre que chez l'animal. Ce sont les propres cellules souches mésenchymateuses du malade qui ont été isolées, prélevées et cultivées en laboratoire avec des facteurs de croissance. _ Le respect de certaines conditions Mais la réussite des thérapies cellulaires utilisant les cellules souches adultes nécessitent, sauf en cas de greffe autologue, que les donneurs et les receveurs aient des génomes les plus semblables possibles. Il faut, au minimum, qu'ils aient les mêmes groupes tissulaires pour éviter les rejets de greffe. Comme pour toute greffe hétérologue, des traitements immunosuppresseurs permettent de diminuer les défenses immunitaires du receveur. Cela facilite les greffes mais la personne traitée devient alors très sensible aux infections. b - L'ouverture d'autres voies de recherche On évoquera les travaux réalisés par l'utilisation des cellules neuronales fœtales, le traitement des affections cardiaques et le traitement des affections neuronales. _ L'utilisation des cellules neuronales fœtales Deux exemples de thérapie cellulaire employant des cellules neuronales fœtales ont récemment retenu l'attention : le traitement de la chorée de Huntington et le traitement de la maladie de Batten . Le traitement de la chorée de Huntington Une équipe de chercheurs français sous la direction de Mme Anne-Catherine Bachoud-Lévi et de M. Marc Peschanski a publié en mars dernier les premiers résultats expérimentaux de ses recherches sur le traitement de la maladie de Huntington par la greffe intracérébrale de cellules neuronales fœtales. La maladie, ou chorée, de Huntington est une maladie héréditaire incurable qui se traduit par une dégénérescence neuronale affectant les fonctions motrices et cognitives. Elle aboutit à une démence. Ces manifestations psychiatriques de la maladie s'accompagnent de troubles neurologiques engendrant des gestes incohérents et anormaux et des troubles de l'équilibre. Après la mise au point d'un modèle expérimental sur un singe, un essai a été effectué sur cinq malades dans le cerveau desquels ont été greffées des cellules neuronales fœtales. Le bilan de cette expérimentation, six ans après son début, a montré, pour une partie de l'échantillon, des rémissions des symptômes moteurs et des troubles intellectuels durant quatre à cinq ans. Par contre, dans d'autres régions cérébrales, la greffe n'a pas permis d'enrayer la progression des altérations caractéristiques de la maladie. Comme me l'a indiqué M. Marc Peschanski, il ne s'agit pas d'un traitement curatif à proprement parler mais d'une atténuation des symptômes. Il a souligné qu'il ne serait possible actuellement de greffer que cinquante patients au maximum par an et qu'il faudrait donc plutôt employer des cellules souches embryonnaires. Ce type d'essai doit être poursuivi à l'échelon européen. . Le traitement de la maladie de Batten La maladie lysosomale ou maladie de Batten est une maladie neurodégénérative rare touchant environ 2 000 enfants dans le monde. Elle associe les syndromes de la maladie d'Alzheimer, de la maladie de Parkinson, de l'épilepsie, de la schizophrénie et de l'autisme. La société américaine StemCells a obtenu le 20 octobre 2005 l'accord de la Food and Drug Administration (F.D.A.) pour commencer un essai de phase 1 de sécurité et de première efficacité, en utilisant des cellules souches neuronales fœtales. Comme l'a rappelé Mme Ketty Schwartz36, le premier objectif de cette société a été d'établir la faisabilité de cette thérapie régénératrice à partir de cellules fœtales. Après avoir mené des tests in vivo sur des modèles murins de la pathologie, un procédé a été mis au point pour purifier à un très haut degré les cellules neuronales fœtales. Il a été mis en évidence qu'elles repeuplaient le tissu cible, cette repopulation étant cependant faible, inférieure à 10 %. Mais elle est considérée comme suffisante pour produire une amélioration fonctionnelle. Mme Ketty Schwartz a considéré que la possibilité d'une réaction immunologique contre des cellules neuronales allogéniques est relativement faible, probablement à court terme, sans doute à cause du confinement particulier du système nerveux. Aucun tératome n'a été constaté sur plus de trois mille animaux qui ont été traités pendant des périodes allant jusqu'à plus de soixante semaines. La validation de cette approche devrait conduire cette entreprise à la développer dans des maladies neurodégénératives plus fréquentes, comme la maladie de Parkinson, d'Alzheimer, les traumatismes médullaires, ou la sclérose en plaques. Mme Ketty Schwartz a estimé que c'était une étape très importante pour l'utilisation thérapeutique des cellules souches. _ Le traitement des affections cardiaques Les affections cardiaques et, notamment, l'insuffisance cardiaque après la survenance d'un infarctus font l'objet de tentatives de traitement par utilisation de cellules souches. L'objectif est de faire récupérer une certaine contractilité aux zones du myocarde touchées par l'infarctus en leur administrant des cellules souches contractiles. Celles-ci pourraient être des cellules souches de la moelle osseuse qui, dans certaines conditions, seraient capables de produire des cardiomyocytes. M. Philippe Ménasché et ses collaborateurs ont effectué le choix de greffer des cellules de muscle squelettique. Un petit fragment de muscle de la cuisse du patient a été prélevé et mis ensuite en culture afin d'obtenir plusieurs centaines de millions de cellules musculaires. Celles-ci ont ensuite été injectées en de multiples endroits de la cicatrice non contractile de l'infarctus au cours d'une intervention classique de pontage coronarien. A la suite de cette opération, certaines des zones du myocarde qui ont reçu cette greffe autologue ont pu récupérer une certaine contractilité. _ Le traitement des affections neuronales En 1998 a été démontrée, pour la première fois, l'existence de cellules souches dans le cerveau capables de produire de nouveaux neurones. En 2003, M. Pierre-Marie Lledo et son équipe de l'Institut Pasteur/C.N.R.S. ont montré que des neurones immatures se trouvaient dans la partie profonde du cerveau, autour des ventricules latéraux. En 2004, cette équipe a découvert que ces neurones immatures pouvaient migrer vers la partie antérieure du cerveau, au niveau de l'épithélium du bulbe olfactif. Ils y étaient attirés par une molécule sécrétée par ce dernier. Cela pourrait ainsi permettre à ces neurones immatures de se transformer en neurones adultes pouvant établir de nouvelles connexions. Il était donc peut-être devenu possible de faire se diriger ces neurones vers des parties lésées du cerveau afin de pouvoir éventuellement participer à leur réparation. Mais les premières expériences dans ce sens chez la souris et le singe ont montré que des difficultés importantes existaient encore. Celles-ci n'ont cependant pas empêché, très récemment, une équipe britannique de greffer chez des patients des précurseurs de neurones issus de cet épithélium olfactif. On peut également mêler les approches de la thérapie cellulaire et de la thérapie génique. c - Mêler les approches de la thérapie cellulaire et de la thérapie génique La thérapie génique peut être mise en œuvre soit, comme on l'a vu, par le transfert direct de gène soit par l'utilisation de cellules vivantes comme vecteurs des gènes d'intérêt. Nous évoquerons dans ce paragraphe l'utilisation de cellules vivantes comme vecteur de gènes d'intérêt37. Cette voie est relativement plus complexe que celle du transfert direct de gène. Elle peut être divisée en trois étapes : ∙ Les cellules du patient ou issues d'autres origines sont d'abord isolées et multipliées en laboratoire, ∙ Le gène d'intérêt est ensuite introduit dans ces cellules. Les gènes peuvent être introduits dans les cellules par l'utilisation de deux méthodes : la transfection ou la transduction. La transfection utilise des méthodes physiques ou chimiques. De petites molécules, comme, notamment, les liposomes, sont employés pour faciliter l'entrée de l'A.D.N. codant le gène d'intérêt dans les cellules. De brefs chocs électriques peuvent faciliter cette entrée. Cependant il est difficile de contrôler la destination de cet A.D.N. Dans la plupart des cas, il disparaît après quelques jours ou quelques semaines. Dans des cas encore rares, il s'intègre au hasard dans l'A.D.N. de l'hôte. La transduction utilise des vecteurs viraux pour le transfert de l'A.D.N. De par leur nature les virus introduisent l'A.D.N. ou l'A.R.N.38 de façon très efficace dans les cellules. Des virus modifiés génétiquement peuvent être utilisés pour introduire à peu près n'importe quelle information génétique. Dans la plupart des cas l'information génétique introduite par vecteur viral s'intègre de façon stable dans le génome de la cellule hôte. ∙ Les cellules ainsi modifiées sont introduites dans l'organisme du patient. Un problème encore difficilement contrôlable à ce niveau est le risque d'une introduction non maîtrisée dans le génome de l'hôte, ce qui peut entraîner des désordres entraînant soit des tumeurs malignes, soit des dysfonctionnements génétiques. Si les cellules introduites ne sont pas autologues, le système immunitaire du patient peut les rejeter. Cette technique présente un certain nombre d'avantages. Parmi ceux-ci, on peut noter la facilité et la précision de la modification in vitro plutôt qu'in vivo et la faculté de multiplier les cellules, compte tenu du fait qu'elles continuent de se diviser dans les conditions du laboratoire. Les inconvénients tiennent au fait qu'on introduit une complexité biologique supplémentaire du fait du caractère vivant de ces cellules. De surcroît, l'isolation de cellules spécifiques nécessite non seulement de connaître leurs marqueurs biologiques mais aussi les conditions dans lesquelles elles resteront vivantes in vitro et continueront à se diviser. Malheureusement les marqueurs biologiques spécifiques d'un grand nombre de types de cellules ne sont pas connus et les cellules ne peuvent pas, comme on l'a vu, être maintenues in vitro pendant de longues périodes sans muter. Ces réalisations et ces avancées sont donc très encourageantes. Mais comme l'a souligné M. Philippe Ménasché39 « [...] il faut dire [...] que dans le domaine des essais cliniques de la thérapie cellulaire, si l'on met de côté les greffes de moelle, qui existent depuis longtemps, l'expérience à ce jour est très limitée. Que ce soit dans le domaine du cerveau, du pancréas, ou du cœur, peu de patients ont bénéficié aujourd'hui de la thérapie cellulaire et l'honnêteté oblige à dire que l'on est incapable à ce jour de dire si l'efficacité de la thérapie cellulaire va être limitée, très importante ou nulle40. Personne ne peut le savoir, même si un certain nombre d'indices sont encourageants. [...] les premiers essais qui ont été faits sont des essais de phase 1 qui testent la faisabilité, la tolérance, et pas vraiment l'efficacité. On va rentrer maintenant dans la phase d'essais cliniques conçus pour démontrer l'efficacité, celle-ci restant à démontrer. Il faut donc rester prudents, en particulier vis-à-vis des patients, ne pas susciter des espoirs qui ne seraient pas fondés2. » 3 - La transposition nucléaire Le 5 juillet 1996, un coup de tonnerre éclatait dans le ciel de l'actualité avec l'annonce, par les chercheurs du Roslin Institute d'Edimbourg, de la naissance de la brebis Dolly, premier mammifère cloné à partir de cellules adultes. Cet évènement a considérablement accéléré le développement de la biologie cellulaire... ainsi que les polémiques. Il convient d'abord d'évoquer sur le clonage animal, d'exposer la technique de la transposition nucléaire chez l'homme et de faire le point sur sa réalisation. Les perspectives de cette technique seront ensuite abordées, avant d'évoquer les tentatives pour obtenir des cellules souches embryonnaires sans détruire le blastocyste. On insistera enfin sur la nécessité de ne pas confondre cette transposition nucléaire avec le clonage reproductif. Les débuts du clonage animal remontent à 1952 avec les travaux des biologistes américains Robert Briggs et Thomas King. On connaissait, avant cette date, des phénomènes de clonage naturel chez certaines formes d'invertébrés. Mais le clonage des invertébrés par une intervention humaine semblait beaucoup plus complexe. Robert Briggs et Thomas King débutèrent leurs travaux sur des grenouilles en utilisant le « transfert de noyau de cellule somatique ». Cette méthode avait été théorisée sous une forme assez rudimentaire, dans les années 1930 par l'embryologue allemand Hans Spemann, à partir de ses expériences sur les salamandres. Le clonage animal par transposition nucléaire se déroule de la façon suivante :
Source : Le Courrier de L'UNESCO 2004 Numéro spécial « Le Clonage humain » Cette méthode nécessite de retirer le noyau d'une cellule somatique41. Ce noyau est ensuite inséré dans une cellule énuclée provenant d'un ovule non fécondé. Le noyau transplanté commence alors à se diviser comme dans une cellule normale. Robert Briggs et Thomas King réussirent ainsi à obtenir des têtards par clonage en transférant des noyaux de cellules d'embryon dans des œufs énucléés. Mais des difficultés apparurent quand des transferts furent effectués à partir de noyaux provenant de cellules plus avancées. Il semblait alors que les gènes issus de cellules à la différenciation plus avancée changeaient de façon irréversible et ne pouvaient être réactivés. Le clonage d'un animal adulte à partir d'une de ses cellules somatiques, paraissait dès lors impossible. Mais, au début des années 1970, le biologiste britannique John Gurdon a réussi à cloner un têtard à partir d'une cellule somatique. Cependant l'application de cette méthode aux mammifères semblait devoir être beaucoup plus problématique qu'avec les amphibiens. Il faut en effet d'abord disposer d'ovocytes de mammifère qui ne sont pas très nombreux et qu'il faut se procurer par des méthodes invasives. Il faut ensuite transférer les embryons clonés dans un utérus de « mère porteuse » pour pouvoir aboutir à une gestation. Compte tenu de toutes ces difficultés, on pensait que le clonage des mammifères resterait pour longtemps une possibilité éloignée. Aussi la naissance de Dolly, selon une version modernisée des techniques de Robert Briggs et Thomas King et John Gurdon, a-t-elle été un évènement considérable. Elle ouvrait en effet des perspectives de nouvelles techniques médicales. Il convient cependant de rappeler qu'il avait été nécessaire de pratiquer 277 transpositions nucléaires pour qu'un fœtus viable atteigne le terme de la gestation et survive après sa naissance. Cet évènement a, aussi, été à la source d'un bouleversement éthique sans précédent. Le clonage de nombreuses espèces de mammifères a abouti, depuis, à de nombreuses naissances viables : porcins, ovins, bovins, chats, rongeurs, équidés, lapins. Un chien a aussi été créé pour la première fois, il y a un peu plus d'un an, en avril 2005, par l'équipe coréenne de M. Hwang Woo-suk. L'objectif principal de ces recherches et des ces réalisations est de maîtriser le génie génétique des animaux. L'intérêt commercial est de disposer d'animaux semblables pour pouvoir notamment produire des aliments (viande, lait) de qualité constante. D'autres perspectives sont évoquées, comme la production de produits d'intérêt pharmaceutique dans le lait de vache ou de chèvre. Ces résultats ont naturellement été très médiatisés mais il semble que l'on est encore loin de maîtriser parfaitement cette technique chez les mammifères. Tout d'abord, il convient de noter qu'un tel clone pourrait ne pas être un clone parfait. En effet, l'ovocyte dans lequel est insérée la cellule somatique, possède des mitochondries contenant un tout petit A.D.N. codant pour quelques protéines qui seraient ainsi apportées à l'embryon. Mais c'est un sujet de discussion entre les scientifiques, certains considérant que cet apport est tout à fait marginal et sans aucune conséquence. Le taux de réussite de la production d'embryons clonés est encore très faible. Ainsi M. Bertrand Jordan indique-t-il42 que « pour la souris, il faut traiter généralement une centaine d'ovules pour obtenir un seul clone, soit un rendement de 1%. Le chiffre est comparable pour la vache, tout comme pour le mouton et la chèvre. Le porc semble plus difficile à cloner, avec des valeurs de 0,1% à 0,2% ». Le taux de succès ne semble pas s'être amélioré. En effet pour créer le chien déjà cité, l'équipe coréenne a collecté en moyenne 12 ovocytes de 123 femelles pour créer près de 1 500 embryons. 1 095 de ces derniers ont été transférés dans les 123 femelles. Trois débuts de gestation ont été enregistrés et deux ont abouti à une naissance, l'un des deux chiots étant mort de pneumonie au bout de vingt-deux jours. On voit ainsi que le taux de réussite est particulièrement bas. Enfin, il convient de signaler la discussion en cours entre scientifiques sur le problème de l'état de santé des animaux clonés qui présenteraient, dans certains cas, des anomalies. La connaissance des mécanismes du clonage animal à partir de cellules somatiques est donc encore parcellaire. b - La technique de la transposition nucléaire chez l'homme et ses perspectives La transposition nucléaire a comme objectif de pouvoir obtenir, par dérivation, des lignées de cellules souches embryonnaires. La transposition nucléaire chez l'homme suit le schéma suivant :
Source : D'après Le Courrier de L'UNESCO 2004 Numéro spécial « Le Clonage humain » Le processus de la transposition nucléaire comprend trois étapes. Il faut d'abord enlever l'A.D.N. nucléaire de l'ovocyte en faisant attention à l'endommager le moins possible. Il faut ensuite faire fusionner l'ovocyte énucléé avec une cellule somatique. L'ovocyte doit normalement donner le signal permettant la reprogrammation de l'A.D.N. de la cellule somatique. Enfin, il faut isoler le groupe de cellules de la masse interne du blastocyste et les faire croître sur des substrats de culture. Tout le monde a encore en mémoire le retentissant scandale provoqué par la falsification des données par l'équipe de M. Hwang Woo-suk qui avait prétendu avoir créé des embryons humains, et dérivé des lignées de cellules souches embryonnaires par cette technique. A l'heure actuelle, seule l'équipe de Mme Alison Murdoch et de M. Miodrag Stojkovic, de l'Université de Newcastle upon Tyne, au Royaume-Uni, a réussi à créer un blastocyste humain. Mais aucune lignée de cellules souches embryonnaires n'a pu en être dérivée. Cette création a fait l'objet d'une publication43 qui n'a pas été contestée. D'après un article de Science44, les équipes étant ou allant s'engager dans la création de lignées de cellules souches embryonnaires humaines par transposition nucléaire seraient les suivantes : Grande-Bretagne : outre l'équipe de Mme Alison Murdoch, M. Ian Wilmut, maintenant à l'Université d'Edimbourg, bénéficie d'une autorisation pour effectuer des expériences de transposition nucléaire humaine. Mais ce dernier ne dispose pas d'ovocytes. D'après celui-ci, une nouvelle équipe britannique de King's College allait faire une demande d'autorisation de transposition nucléaire humaine. Etats-Unis : trois équipes devraient s'engager dans cette voie, au Harvard Stem Cell Institute, à l'Université de Californie à San Francisco (U.C.S.F.) et au Memorial Sloan-Kettering Cancer Center de New-York. En Europe, M. Miodrag Stojkovic a quitté l'Université de Newcastle et s'est installé en Espagne où la législation devrait évoluer en la matière. Enfin, il est indiqué dans cet article qu'une équipe de l'Institut des sciences biologiques de Shangaï avait sollicité les autorisations pour effectuer des travaux sur la transposition nucléaire humaine. c - Les perspectives de cette technique La création de lignées de cellules souches embryonnaires par transposition nucléaire pourrait avoir quatre domaines d'application : la possibilité de mieux connaître les maladies humaines, la meilleure compréhension des mécanismes de l'embryogenèse, l'élaboration de nouveaux instruments de recherche et la thérapie cellulaire. _ La possibilité de mieux connaître les maladies humaines Beaucoup de mes interlocuteurs ont souligné que travailler sur les cellules souches animales, et parmi celles-ci, sur les cellules de souris, était très important pour les aspects fondamentaux de la biologie et de l'embryologie. Ces travaux permettent ainsi de construire des modèles de maladies humaines. Mais ils ont aussi noté que les rats et les souris sont différents des humains et que, même si les phénomènes sont similaires, il y a des différences importantes. Ainsi, le système nerveux d'un rat est beaucoup moins compliqué que celui d'un être humain et les résultats acquis sur un tel modèle ne peuvent en aucun cas être directement extrapolés aux humains. De même, on peut, par exemple, induire un cancer à des souris, mais ce n'est pas le même qui affecte les êtres humains. L'obtention de matériels humains malades et le suivi, au niveau cellulaire, du développement d'une maladie sont très difficiles. Les cellules souches embryonnaires seraient très utiles de ce point de vue. En effet, il serait possible de produire des cellules embryonnaires à partir desquelles on pourrait développer des cellules différenciées caractéristiques de différents états pathologiques. Comme ces cellules se développent très rapidement, il pourrait être ainsi possible de suivre, en accéléré, le développement des affections. De véritables modèles de maladies seraient ainsi créés en laboratoire. On pourrait ainsi créer des cellules souches embryonnaires parkinsoniennes ou des cellules souches pancréatiques diabétiques _ La meilleure compréhension des mécanismes de l'embryogenèse Le travail de recherche sur la transposition nucléaire me semble devoir aussi conduire à une meilleure compréhension des mécanismes de l'embryogenèse. En effet, quand le noyau se place dans le cytoplasme d'un ovule, des gènes sont alors réduits au silence pendant que d'autres entrent en action. De même quand l'embryon devient un blastocyste, des erreurs peuvent alors survenir et arrêter cette croissance. Ces étapes cruciales sont aussi celles du développement d'un futur enfant. Les études sur la transposition nucléaire devraient donc pouvoir nous amener à mieux comprendre, et, partant, à mieux prévoir tous les problèmes qui aboutissent à des avortement spontanés et à des fausses couches. _ L'élaboration de nouveaux instruments de recherche Les cellules souches humaines pourraient constituer un instrument extrêmement utile pour tester de nouveaux médicaments. Comme l'a rappelé M. Marc Peschanski45, aujourd'hui les médicaments et les cosmétiques sont essayés sur des modèles plus ou moins éloignés de la situation humaine, et il est difficile de tester tous les effets des molécules sur tous les tissus de l'organisme humain. Grâce à la grande variété de tissus et de cellules qui se développent dans les cultures de cellules souches embryonnaires, on dispose là d'un système reproduisant une grande partie des interactions complexes entre tissus et cellules de l'organisme. Cet outil serait sans doute fort utile pour tester, en utilisant le criblage à haute densité, les milliers de molécules détenues notamment par les grandes entreprises pharmaceutiques dans leurs chimiothèques. On pourrait ainsi trouver de nouveaux candidats médicaments et évaluer leur efficacité et leur toxicité. C'est une des lignes d'action stratégique du nouvel Institut des cellules souches pour le traitement des maladies monogéniques, I-Stem installé à Evry et principalement soutenu par l'A.F.M., l'Inserm et Généthon. Cette démarche permettrait de réduire le nombre des tests nécessaires chez l'animal dont la physiologie est différente de celle de l'homme. Cela aiderait à faire diminuer les coûts de développement des nouvelles molécules. Il y aurait aussi la possibilité d'identifier de nouvelles cibles dans les cellules humaines sur lesquelles agir à des fins thérapeutiques. _ La thérapie cellulaire Il s'agirait de l'emploi de cellules souches embryonnaires obtenues par transposition nucléaire, aux lieu et place de cellules souches adultes qui ont déjà été évoquées. Deux voies s'offrent dans ce domaine : la transplantation de cellules allogéniques et celle de cellules autologues. ∙ La transplantation de cellules souches embryonnaires allogéniques La transplantation de cellules souches embryonnaires allogéniques entraîne des problèmes de rejet immunitaire comme une greffe classique. Il y alors la nécessité d'employer des médicaments immunosuppresseurs, avec tous leurs possibles effets indésirables. Mme Anne McLaren considère qu'il ne sera pas envisageable de créer des lignées de cellules souches pour chaque patient. Elle estime donc qu'il faut faire des recherches sur les propriétés antigènes de ces cellules souches, le rejet étant dû, selon elle, à la présence de petites protéines sur la membrane cellulaire. On pourrait envisager la création de banques de cellules souches embryonnaires dans lesquelles on puiserait pour traiter les patients. Se poserait alors le problème, comme pour les actuelles banques d'organes, de la compatibilité avec les receveurs. La Grande-Bretagne vient d'installer une banque nationale de cellules souches sous l'égide du Medical Research Council. ∙ La transplantation de cellules souches embryonnaires autologues Ces cellules souches seront produites par transposition nucléaire à partir des cellules somatiques du malade à traiter. Elles en possèderont donc le même génome et ne seront pas, de ce fait, soumises au rejet immunologique déclenché par les hétérogreffes. Ces utilisations reposent sur un certain nombre d'expériences réalisées, notamment, sur des souris. Diverses études ont ainsi montré que des cardiomyocytes développées à partir de cellules souches embryonnaires murines sont capables de coloniser le tissu cardiaque endommagé. Des résultats concernant des rats traités par injection de telles cellules souches et qui ont retrouvé une mobilité m'ont ainsi été présentés par MM. Jeffray Rothstein et Douglas Kerr. De nombreux usages ont été proposés pour l'utilisation de ce type de cellules. Elles pourraient être ainsi utilisées dans toutes les maladies dégénératives, dans la réparation des lésions, ou dans la reconstitution d'organes abîmés : maladie de Parkinson, diabète, lésions traumatiques de la moelle épinière, dégénérescence des cellules de Purkinje, dystrophie musculaire de Duchenne de Boulogne, infarctus du myocarde. La maladie d'Alzheimer, d'après M. William Lensch, ne serait pas concernée par ce type de traitement dans la mesure où on en ignore encore les causes. Il convient cependant de souligner que ces indications ne sont que des possibilités qui restent aujourd'hui complètement incertaines. De ce point de vue on peut citer le cas du diabète insulino-dépendant. Si on arrive actuellement à différencier des cellules souches embryonnaires en cellules pancréatiques sécrétrices d'insuline, celles-ci fonctionnent très mal sans que l'on sache pourquoi. Ces traitements me semblent d'autant plus lointains qu'aucun essai clinique, ne serait-ce que de phase 1, n'est actuellement en cours. M. Marc Peschanski m'a cependant confirmé que Geron allait entreprendre des essais de ce type. Ils devraient consister en l'injection de cellules souches embryonnaires dans la moelle épinière afin d'obtenir des oligodendrocytes pour la remyélinisation de fibres nerveuses, que l'on est incapable actuellement d'obtenir d'une autre façon. Ces essais devaient avoir lieu à la fin de 2005 mais ont dû être repoussés. Ils devraient commencer soit à la fin de cette année 2006 soit au début de 2007. Cependant au fur et à mesure que le nombre d'essais augmente, les difficultés commencent à apparaître. Ainsi, dans une publication très récente46, des chercheurs américains ont rendu compte d'une tentative de traitement de la maladie de Parkinson par des greffes de cellules souches embryonnaires. Ils ont injecté à des rats parkinsoniens des cellules souches embryonnaires transformées capables de produire de la dopamine. Le comportement des rats traités s'est amélioré de façon notable par rapport au groupe d'animaux non traités. Mais leur autopsie a montré que si les cellules souches embryonnaires transformées se sont bien développées, des amas de cellules indifférenciées en voie de multiplication, et donc potentiellement cancéreuses ont été découvertes. Une autre difficulté tient au fait qu'il semble qu'au bout d'un certain temps, le nombre de neurones secrétant de la dopamine diminue. La conclusion de cette étude est qu'il est impératif de ne travailler qu'avec des cellules complètement différenciées. La thérapie cellulaire avec des cellules souches embryonnaires n'est certainement pas au point et on ignore quand elle pourra l'être, si elle est possible un jour. La transposition nucléaire aboutit à créer un blastocyste, « précurseur » d'un embryon, dont on extrait des cellules. Des tentatives ont été faites pour obtenir des cellules souches embryonnaires humaines sans devoir détruire le blastocyste. d - Les tentatives pour obtenir des cellules souches embryonnaires humaines sans devoir détruire le blastocyste. Ces tentatives peuvent se regrouper tout d'abord autour des techniques de l'«embryon altéré» et de la fusion cellulaire, avant d'évoquer les deux plus récentes tentatives dans ce domaine. _ La technique de l'«embryon altéré» Différentes tentatives ont été menées pour permettre de créer des lignées de cellules souches embryonnaires sans être amené à détruire un embryon. La première technique a été développée en utilisant des souris par l'équipe de M. Robert Lanza de la société américaine Advanced Cell Technology en 2005. En utilisant la méthode du diagnostic préimplantatoire, une cellule a été prélevée chez un embryon de souris à un stade où celui-ci en comptait huit. A partir de cette cellule, il a été possible de produire des lignées de cellules souches embryonnaires. L'embryon d'origine, dont il restait sept cellules, a été implanté dans l'utérus d'une souris et aurait, selon les déclarations de cette équipe, poursuivi normalement sa croissance jusqu'à son terme. La deuxième tentative a été celle de M. William Hurlbut qui a proposé une technique de « transfert nucléaire altéré ». Ce concept du « transfert nucléaire altéré » repose sur l'inactivation d'un gène essentiel pour le développement du trophectoderme, ce qui empêche la formation de la barrière fœto-maternelle. Cette technique produit donc des blastocystes incapables de s'implanter dans la paroi utérine, tout en laissant les masses cellulaires internes intactes. La troisième méthode est celle qui a été développée par MM. Rudolf Jaenisch et Alexander Meissner. Elle a consisté à créer un embryon de clone de souris incapable de s'implanter dans l'utérus en transférant l'A.D.N., préalablement altéré, d'une cellule adulte dans un ovocyte énucléé. L'embryon ainsi obtenu n'est pas viable mais permet de cultiver des lignées de cellules souches embryonnaires. Mais cette approche ne pourrait pas être appliquée à l'homme. Enfin une autre tentative a été récemment effectuée, en août dernier, de nouveau par l'équipe d'Advanced Cell Technology de M. Robert Lanza. La méthode décrite dans la revue Nature consiste à extraire une cellule sur les huit à dix d'un embryon de trois jours. Des cellules souches embryonnaires sont obtenues après une série de manipulations. Selon la publication, l'embryon n'aurait pas été détruit alors que, jusqu'à présent, il était impossible d'extraire ces cellules sans détruire l'embryon. Nous reviendrons sur cette affaire. Sur la foi de cet article de Nature, la grande presse a repris cette information en insistant sur le fait que des cellules souches embryonnaires avaient été créées sans destruction d'embryon. La difficulté est que cette annonce était en réalité trompeuse. En effet les embryons ont bel et bien été détruits lors de cette expérience. _ La fusion cellulaire Cette technique a été mise au point et publiée au mois d'août 2005 par l'équipe de MM. Chad Cowan, Douglas Melton et Kevin Eggan, de l'Institut des cellules souches de l'Université Harvard. Ces chercheurs ont réussi à faire fusionner des cellules somatiques, des cellules de peau, avec des cellules souches embryonnaires. Ils ont ainsi obtenu des cellules hybrides tétraploïdes contenant deux fois plus de chromosomes que la normale. Ils ont montré que cette fusion cellulaire entraînait une forme de déprogrammation du génome des cellules cutanées. Ces dernières retrouvaient, en partie, leur stade embryonnaire en exprimant les gènes caractéristiques des cellules souches embryonnaires. Les scientifiques connaissaient depuis plusieurs années le fait que les cellules souches embryonnaires pouvaient fusionner avec des cellules somatiques pour produire des hybrides analogues à des cellules souches. L'apport de cette équipe a été de montrer, en analysant génétiquement les lignées de cellules hybrides, qu'elles présentaient le même profil d'expression génétique que des cellules souches embryonnaires normales et qu'elles étaient très différentes des cellules cutanées de départ. La difficulté majeure de cette technique est que les cellules obtenues comportent 92 chromosomes au lieu de 46. Elles ne pourraient naturellement pas être utilisées en l'état, notamment à des fins thérapeutiques. Toutes ces tentatives sont en fait propres au contexte américain qui interdit le financement public de recherches impliquant la destruction d'embryon. _ Les tentatives récentes dans ce domaine Il s'agit de travaux d'une équipe japonaise et de celle de M. Miodrag Stojkovic. ∙ Le travail de l'équipe japonaise Une équipe japonaise dirigée par MM. Kazutoshi Takahashi et Shinya Yamanaka de l'Université de Kyoto a annoncé, à la fin du mois d'août 2006, qu'il avait réussi à induire, grâce à l'introduction de quatre facteurs de transcription, dans des cultures de fibroblastes de souris, un caractère pluripotent ressemblant à celui des cellules souches. Ces quatre facteurs injectés ensemble se sont révélés capables de transformer des cellules souches adultes en cellules pouvant se différencier en tissus dissemblables. Le caractère pluripotent de ces cellules a été notamment confirmé par la formation de tératomes. L'origine de ces cellules pluripotents induites reste également à déterminer dans la mesure où elles pourraient provenir des quelques rares cellules souches multipotentes existant dans les cultures de fibroblastes. Il faut cependant noter que deux des quatre facteurs de transcription sont des oncogènes, dont l'un est central dans la genèse des tumeurs chez l'être humain. ∙ Le travail de l'équipe de M. Miodrag Stojkovic Selon un travail publié le 21 septembre dernier, des chercheurs ont étudié 161 embryons qui avaient été donnés par une clinique de fécondation in vitro avec le consentement des parents. Treize de ces embryons ont atteint le stade de 16 ou 24 cellules avant de s'arrêter. Les chercheurs ont pu extraire une lignée de cellules souches embryonnaires à partir d'un seul de ces embryons morts. Pour M. Miodrag Stojkovic, le but de la recherche était plus de montrer que ces embryons pouvaient fournir une source supplémentaire de cellules en plus de celles fournies par des embryons sains, que de nourrir une compétition entre elles. Un certain nombre de spécialistes ont fait part de leurs craintes suscitées par ce type de recherche tenant à la possibilité d'anomalies non détectées sur des cellules souches provenant d'embryons morts. Toutes ces tentatives sont intéressantes et pourraient avoir des applications dans le futur car aucune voie de recherche n'est à négliger mais on peut se demander, avec M. Hervé Chneiweiss47, s'il y a besoin de ce type d'artifice technique pour ne pas affronter la question de la transposition nucléaire. Celle-ci ne doit pas être envisagée à la légère car il faut prendre en compte un certain nombre de questions, notamment éthiques, mais aussi d'autres comme ses répercussions possibles sur les systèmes de protection sociale. Nous évoquerons celles-ci dans le dernier chapitre de ce rapport consacré aux défis éthiques. Je pense que la controverse autour de la transposition nucléaire s'est installée avec tant d'acuité dans nos sociétés à cause de sa proximité avec la question du clonage reproductif alors qu'elle en est tout à fait différente. e - La transposition nucléaire est tout à fait différente du clonage reproductif. Le clonage reproductif est l'opération consistant à créer un embryon portant la même information génétique, à l'A.D.N. mitochondrial près, que le progéniteur, d'implanter cet embryon dans un utérus pour déclencher une grossesse, afin de donner naissance à un être humain. C'est la transposition à l'être humain du procédé qui a abouti à la naissance de Dolly. Je condamne très fortement et absolument ce clonage reproductif. Le clonage reproductif est interdit en France par l'article 21 de la loi 2004-800 du 6 août 2004 relative à la bioéthique. Cet article est ainsi rédigé : « Est interdite toute intervention ayant pour but de faire naître un enfant génétiquement identique à une autre personne vivante ou décédée » Cette pratique est réprimée de trente ans de réclusion criminelle et de 7 500 000 d'euros d'amende par l'article 28 de cette loi. J'approuve sans aucune réserve ces dispositions. Je rappelle que le Comité consultatif national d'éthique (C.C.N.E.) a considéré, en conclusion de son avis n° 54 « Réponse au Président de la République française au sujet du clonage reproductif » du 22 avril 1977, que «le remplacement dans l'espèce humaine de la procréation par une méthode de reproduction faisant appel aux techniques du clonage constituerait, sur le plan biologique, symbolique et philosophique, une rupture considérable portant gravement atteinte à la dignité de la personne humaine.» Un certain nombre de textes internationaux interdisent ce clonage reproductif. La 29ème Conférence de l'U.N.E.S.C.O. avait adopté en 1997, six mois après la naissance de Dolly, la Déclaration universelle sur le génome humain et les droits de l'homme que les Nations Unies ont reprise en 1998. Cette Déclaration prévoit dans son article 11 que « des pratiques qui sont contraires à la dignité humaine, telles que le clonage à des fins de reproduction d'êtres humains ne doivent pas être permises ». En avril 1997, le Conseil de l'Europe a promulgué la « Convention pour la protection des droits de l'homme et de la dignité de l'être humain à l'égard des applications de la biologie et de la médecine : Convention sur les droits de l'Homme et de la médecine » plus connue sous le nom de « Convention d'Oviedo ». On examinera celle-ci et le problème qu'elle peut poser dans le chapitre consacré à l'organisation de la recherche en France. Le 8 mars 2005, l'Assemblée générale des Nations Unies a été appelée à se prononcer sur une Déclaration interdisant le clonage humain. Cette Déclaration était issue d'une initiative franco-allemande prise au 78ème sommet franco-allemand sur la bioéthique, qui avait eu lieu à Nantes le 23 novembre 2001. A cette occasion, la France et la République fédérale d'Allemagne avait lancé une proposition d'interdiction du clonage humain à des fins de reproduction dans le cadre de l'Assemblée générale des Nations Unies. Cette initiative avait recueilli une large approbation, un comité spécial de cette organisation ayant été ensuite chargé d'étudier la possibilité d'élaborer une convention internationale sur l'interdiction du clonage humain à des fins de reproduction. Mais le sens de l'initiative franco-allemande originelle a été détourné par un certain nombre de pays. En effet un alinéa de ce texte est ainsi rédigé : «[...] Les États Membres sont invités à interdire toutes les formes de clonage humain dans la mesure où elles seraient incompatibles avec la dignité humaine et la protection de la vie humaine [...] ». Cette formulation a abouti, de ce fait, à faire exprimer à cette Déclaration non seulement une condamnation du clonage humain à des fins de reproduction mais aussi celle de la transposition nucléaire en adoptant cette position volontairement ambiguë sur la défense de la vie humaine. Finalement, cette Déclaration, sans valeur juridique contraignante, a été adoptée par 84 voix contre 34 et 37 abstentions. Toutes les délégations ont condamné sans équivoque le clonage reproductif humain, un nombre important d'entre-elles défendant la transposition nucléaire. La France s'est prononcée contre ce texte. Ce vote m'est apparu à l'époque quelque peu paradoxal car, à New-York, la France votait contre une résolution visant à l'interdiction de la transposition nucléaire, alors que les dispositions de la loi de 2004 maintenaient le principe de son interdiction. Je rappelle, comme je l'avais fait lors de la discussion en deuxième lecture du projet de loi portant révision des lois « bioéthique », que la transposition nucléaire est tout à fait différente du clonage reproductif. En effet, il n'y a aucune ambiguïté : la transposition nucléaire a comme seule finalité de créer une ou des lignées de cellules souches embryonnaires et non pas de donner naissance à un être humain. La transposition nucléaire possède certes en commun le transfert de noyau, mais elle s'en différencie par le fait que l'embryon obtenu in vitro n'est pas réimplanté dans l'utérus. Je regrette profondément la confusion qui a été entretenue beaucoup trop longtemps entre les deux termes par l'emploi trop répandu de l'expression « clonage thérapeutique ». Ce débat entre transposition nucléaire et clonage reproductif est en quelque sorte victime de l'accélération de l'acquisition des connaissances. En effet avant la naissance de Dolly, personne ne pensait à condamner le clonage reproductif humain, tout simplement parce qu'on estimait que celui-ci était sinon impossible, du moins parfaitement inenvisageable sur le plan scientifique! C'était un sujet qui était laissé aux auteurs de science fiction. Les péripéties de l'«affaire Hwang» ont semblé nous rapprocher de sa réalisation mais ont aussi montré ses difficultés de réalisation. Certes, et cela est abondamment souligné par les adversaires de cette technique, les premières étapes des processus menant à la transposition nucléaire et au clonage reproductif sont communes. M. Alain Fischer a développé48 une argumentation en réponse à cet amalgame, que je fais mienne sans restrictions : « [L']argument consiste à dire que cette technique est potentiellement dangereuse car, à côté de bénéfices éventuels de nature scientifique ou médicale, elle est susceptible d'être utilisée pour le clonage reproductif. On peut discuter cet argument car je pense que sur le plan scientifique, il y a aujourd'hui des notions connues sur les problèmes d'empreintes qui font que cela est loin d'être évident. Même si l'on acceptait cet argument, je pense qu'il n'est pas raisonnable de le mettre en avant. Par définition, un développement scientifique est neutre : il n'est ni positif, ni négatif. Il faut ensuite réglementer de telle manière que l'on favorise le développement socialement « utile » et en évitant un développement que la société, à juste titre, ne souhaite pas49 [...] ». Le même jour, Mme Anne Fagot-Largeault a affirmé de façon semblable que « la technique du transfert ou de la transposition du noyau est en soi moralement neutre. Tout dépend de ce que l'on en fait ». On pourrait noter, dans la ligne de ces avis, qu'il existe beaucoup de techniques qui peuvent être détournées d'une utilisation « socialement utile ». Je pense notamment à l'énergie nucléaire qui, comme chacun le sait, peut être utilisée de façon destructrice ou pleinement pacifique. Et pourtant les mêmes phénomènes sont mis en œuvre. Quatrième partie : Cette recherche doit être poursuivie dans de nombreux domaines, et nous évoquerons les cadres actuels de son organisation en France, avant de nous intéresser à l'Union européenne, puis à chacun de ses Etats. Cette recherche sur les cellules souches a une dimension planétaire et deux grands pôles émergent : les Etats-Unis et l'Asie, au sein de laquelle la République de Corée a occupé une place particulière jusqu'à la fin de l'année dernière. Cette recherche doit être poursuivie dans de nombreux domaines et a besoin de durée, car le temps médiatique n'est pas le temps long de la recherche. La thérapie cellulaire n'est encore qu'à ses balbutiements mais elle sera peut-être un jour une réalité. Si demain elle doit se développer, chaque type de cellule souche, adulte et embryonnaire, aura son utilité en fonction du type d'affection à traiter. De nombreux pays ont entamé un effort important de recherche. La France ne peut rester à l'écart de ce champ de recherche au risque de perdre ses meilleurs chercheurs en sciences de la vie. On risque aussi, comme me l'a rappelé Mme Alison Murdoch, que les chercheurs de pays interdisant la transposition nucléaire s'expatrient vers ceux qui l'autorisent. De ce point de vue ce mouvement a sans doute déjà commencé, à l'intérieur des Etats-Unis d'abord, vers la Californie notamment. C'est aussi le cas pour un certain nombre de chercheurs américains vers des pays comme la Grande-Bretagne, Singapour ou Israël. Ce mouvement est encore très faible notamment après la révélation de l'échec coréen en la matière. Mais il pourrait se renforcer si des résultats importants devaient être acquis dans les années à venir. 1 - Poursuivre la recherche dans de nombreux domaines a - Les principales voies à explorer Il est difficile de faire un état exhaustif des domaines scientifiques qui doivent être explorés mais, cependant, beaucoup reste à faire en termes de recherche fondamentale. Si on veut se risquer à donner quelques exemples de domaines à étudier, on citera : - l'isolement des cellules souches (comment les reconnaître), - leur caractérisation et leur purification, - leur culture, - leur différenciation, qui est une question majeure, - leur fonctionnement dans leur environnement, - leur insertion, autologue ou hétérologue, dans un organisme receveur, - leur fonctionnement dans ce nouvel environnement ... b - Les liens possibles entre cellules souches et cancer Les affections50 cancéreuses résultent d'une série d'accidents génétiques se produisant par étapes. Des anomalies s'accumulent sur des gènes régulant les processus vitaux de la cellule : division, différenciation, réparation, apoptose51. La perte de contrôle de la division cellulaire est l'une des caractéristiques essentielles des cellules cancéreuses. Comme l'indiquent M. Daniel Louvard et Mme Sylvie Robine52, « le processus de cancérogenèse peut en effet se résumer comme une perte successive des propriétés des cellules qui vont jusqu'à oublier le « travail » spécialisé pour lequel elles ont été programmées. Les cellules tumorales retournent ainsi à un état relativement indifférencié. Elles font, en quelque sorte, le cheminement inverse de celui des cellules souches qui se différencient au fil des divisions. L'étude de ce « miroir inversé » peut ainsi permettre d'améliorer la compréhension de la cancérogenèse ». Lors de l'audition publique du 22 novembre 2005, M. Daniel Louvard a évoqué la question des relations entre cellules souches et cancer. Il a rappelé que le concept de cellule souche cancéreuse, dont l'existence avait été postulée dès la fin du XIXème siècle et qui avait retrouvé un regain de vigueur dans les années 1930, était de nouveau étudié actuellement. L'idée que les cellules cancéreuses possèdent les mêmes propriétés que les cellules souches est admise en effet depuis plusieurs années. Mais ce n'est que récemment que des techniques, notamment des marqueurs, ont été développées pour identifier la présence des cellules souches dans des tumeurs. C'est ainsi qu'en 1997, des cellules souches cancéreuses ont été identifiées dans certains types de leucémies. M. Daniel Louvard a souligné qu'on réexamine actuellement la question de savoir si ce qui assure la pérennité et la croissance d'une tumeur ne serait pas une sous-population minoritaire de cellules qu'on appelle actuellement « cellules souches tumorales ». Il a noté qu'on les appelle ainsi, sans bien savoir en réalité si ce sont vraiment des cellules souches ou des cellules dérivées de « cellules progénitrices » qui seraient, « elles-mêmes, issues de cellules souches ». Cependant quelques certitudes commencent à être bien établies. On sait ainsi, notamment pour les tumeurs cérébrales ou du sein, isoler et purifier les sous populations en question. M. Daniel Louvard a souligné le caractère minoritaire de ces populations en indiquant que pour induire une tumeur expérimentale chez une souris, il suffisait d'injecter quelques dizaines ou moins d'une dizaine de ces cellules. En outre, il a attiré l'attention sur le fait que l'on n'arrive pas aujourd'hui à éradiquer les tumeurs, même après une efficacité apparente des traitements. On se trouve ainsi dans une impasse « simplement parce qu'on s'est trompé de cible, qu'on tue les cellules qui prolifèrent et se différencient et que l'on ne tue pas efficacement les 1 à 2% de cellules souches tumorales qui peuplent une tumeur ». Dans leur activité de recherche, les équipes de MM. Daniel Louvard et Spyros Artavanis-Tsakonas ont enregistré en 2005 un succès important en parvenant à développer un modèle qui devrait permettre d'étudier plus précisément l'implication de ces « cellules progénitrices » et des cellules souches des villosités intestinales dans le développement des cancers colo-rectaux. Ces recherches paraissent très intéressantes et les cultures à long terme de cellules tumorogéniques ayant des propriétés de cellules souches pourraient offrir un modèle in vitro pour l'étude des cellules initiatrices de différentes formes de cancer. A terme, cela permettrait de constituer des outils permettant de développer des médicaments spécifiques et des stratégies thérapeutiques visant à éradiquer les cellules souches cancéreuses des tumeurs. Ces recherches devront bénéficier de la durée nécessaire et ne doivent pas adopter un rythme qui ne peut être le leur. Car le temps médiatique n'est pas le temps long de la recherche. 2 - Temps médiatique et temps long de la recherche Actuellement face à la science, le public oscille entre fascination et méfiance. Fascination car chacun sait que le mode de vie actuel de la plus grande partie de la population d'un pays développé dépend essentiellement des progrès scientifiques, notamment en matière de santé. Méfiance aussi, surtout dans le domaine de la santé, dans la mesure où les grandes crises récentes concernaient ce domaine et où une inquiétude latente existe toujours. Cependant, malgré cette méfiance, nos concitoyens restent très intéressés par les faits scientifiques car la science apporte des connaissances souvent nécessaires à la compréhension de problèmes qui engagent leur avenir politique, économique, social et culturel. La culture scientifique est donc un enjeu important pour notre société. Sa diffusion passe par divers outils dont les média généralistes. C'est l'étape de la médiation journalistique. Celle-ci s'inscrit juste après la production de l'information dans les revues scientifiques spécialisées qui ne peuvent atteindre le grand public. C'est le travail du journaliste d'être ainsi un intermédiaire entre la production du savoir et sa réception par le public. Cette étape est la plus visible dans la mesure où elle se concrétise par la présence, ou l'absence, de sujets scientifiques dans les colonnes des journaux, dans les émissions de radio ou de télévision. Je suis persuadé que les média généralistes sont un support favorable à la diffusion du savoir scientifique et qu'ils jouent un grand rôle dans ce domaine. Cependant les relations entre la science et les médias sont parfois difficiles dans la mesure où leurs « temps » respectifs peuvent être fort différents. Par nature la science est peu adaptée aux exigences des grands moyens de communication : - elle a d'abord un contenu complexe. Les média doivent effectuer un travail de simplification qui pousse à gommer un grand nombre de difficultés au risque de dénaturer l'information initiale. La science a besoin de temps, d'explication, de discours articulé : elle démontre les résultats par de longues démonstrations, par des explications rationnelles et complexes. Les média modernes, et la télévision en particulier, exigent de la rapidité, et, souvent « montrent » la science sans l'expliquer. - la science produit peu de faits spectaculaires : elle évolue lentement, par découvertes successives, souvent techniques et non immédiatement applicables. Elle est soumise aux faits et un nouveau résultat doit d'abord être reproduit avant d'être considéré comme acquis. La presse a tendance à vouloir annoncer un remède miracle alors que la science ne peut offrir que des avancées demandant confirmation et des promesses incertaines, - la science produit peu de personnalités « médiatiques » car elle est essentiellement un travail collectif, les média étant plutôt friands de personnes hautes en couleur et « sachant parler », - la science produit du doute et est ouverte à la critique : les chercheurs savent en effet que leurs résultats peuvent être infirmés par d'autres. Les média ont, souvent, tendance à négliger ces doutes pour rendre plus séduisants les résultats présentés. Le grand danger de cette situation est de créer une « science spectacle » qui pourrait aboutir à faire exercer sur les chercheurs une pression médiatique difficilement compatible avec la nécessaire sérénité de la démarche scientifique. Il ne faudrait pas que les chercheurs soient ainsi poussés à se départir de leur esprit de doute pour en arriver à confondre leurs résultats réels avec ceux qu'ils souhaiteraient obtenir. Il sera sans doute toujours impossible de faire coïncider parfaitement les « temps » de la science et des média, surtout à une époque qui voit à la fois la concurrence s'exacerber entre eux et l'arrivée de nouveaux compétiteurs sur Internet. Mais il me semble nécessaire de plaider pour une meilleure adéquation entre science et média, afin que ces derniers ne perdent pas leur crédibilité dans ce domaine. Il faut noter qu'une compétition se déroule de plus en plus entre les revues scientifiques mondiales, comme l'ont montré différentes affaires récentes. Nous évoquerons d'abord le problème posé par la Convention d'Oviedo, avant d'examiner les dispositions de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique et le décret du 6 février 2006. Il conviendra ensuite de faire le point sur l'activité de recherche en France dans le domaine des cellules souches adultes et embryonnaires. 1 - Le problème posé par l'article 18 de la Convention du Conseil de l'Europe sur les droits de l'Homme et la biomédecine dite Convention d'Oviedo a - Le texte de l'article 18 de la Convention d'Oviedo L'article 18 de cette Convention est ainsi rédigé : « 1 - lorsque la recherche sur les embryons in vitro est admis par la loi, celle-ci assure une protection adéquate de l'embryon. 2 - la constitution d'embryon aux fins de recherche est interdite ». Le Protocole additionnel à cette Convention du 12 janvier 1998 interdit dans son article 1er « toute intervention ayant pour but de créer un être humain génétiquement identique à un autre être humain vivant ou mort ». La France n'a pas encore ratifié ni la Convention ni son Protocole additionnel. Le premier alinéa de cet article 18 ne pose pas de difficulté particulière, soulignant seulement la nécessité pour la loi d'assurer une protection adéquate de l'embryon quand la recherche sur l'embryon in vitro est autorisée. Par contre, le 2ème alinéa, comme le souligne le « Rapport explicatif53 » de cette Convention, « interdit la constitution d'embryons humains dans le but d'effectuer une recherche sur eux ». Cette disposition ne me paraît pas suffisamment claire dans la mesure où elle pourrait interdire la transposition nucléaire. Il conviendrait que ce point soit clairement précisé avant que la France ne ratifie éventuellement cette Convention. La disposition de l'article 1er du Protocole additionnel interdisant le clonage humain doit également être précisée. C'est ce qu'ont fait les Pays-Bas dans une note du 29 avril 1998 en déclarant qu'ils interprétaient le terme « être humain » comme se référant exclusivement à un individu humain né. Il est donc tout à fait souhaitable que cette disposition soit également débattue en France et, le cas échéant, interprétée dans le même sens que les Pays-Bas. Ce sera une recommandation de ce rapport. 2 - L'article 25 de la loi n° 2004 - 800 du 6 août 2004 relative à la bioéthique Cet article 25, dont le texte se trouve en annexe, prévoit, outre l'interdiction du clonage reproductif, que : « la conception in vitro d'embryon ou la constitution par clonage d'embryon humain à des fins de recherche est interdite, un embryon humain ne peut être conçu, ni constitué par clonage, ni utilisé à des fins commerciales ou industrielles est également interdite toute constitution par clonage d'un embryon humain à des fins thérapeutiques » L'article 28 de la loi, qui avait été soutenu par le rapporteur du projet de loi en deuxième lecture, prévoit que l'inobservation de ces trois dispositions est, chacune, sanctionnée de sept ans d'emprisonnement et de 100 000 euros d'amende. Il pose également le principe de l'interdiction de la recherche sur l'embryon, assortie de possibilité de dérogations, et prévoit l'intervention de l'Agence de la biomédecine créée par l'article 2 de la loi. Le retard dans l'application de cette loi a imposé le recours à un régime transitoire. a - Le principe de l'interdiction de la recherche sur l'embryon, assortie de la possibilité de dérogations La recherche sur l'embryon est interdite, mais assortie de possibilités de dérogations. Les recherches sur l'embryon et les cellules embryonnaires peuvent être autorisées par dérogation pour une période limitée à cinq ans si : - elles sont susceptibles de permettre des progrès thérapeutiques majeurs, - à condition de ne pouvoir être poursuivies par une méthode alternative d'efficacité comparable, en l'état des connaissances scientifiques. A la différence de la législation de 1994, qui interdisait formellement toute recherche sur l'embryon humain, la loi de 2004 prévoit, à titre dérogatoire, pour une période de cinq ans, la possibilité de mener des recherches sur les embryons humains et les cellules souches embryonnaires. La critique que j'avais faite de la notion de « progrès thérapeutiques majeurs » le 9 décembre 2003, à l'Assemblée nationale, lors de la seconde lecture du projet de loi, reste trois ans après toujours valable. En effet, on peut interpréter strictement cette notion et elle restreint alors de façon considérable la portée de l'autorisation éventuelle, compte tenu de l'ampleur des connaissances fondamentales qui restent à acquérir dans ce domaine. Au contraire si on retient une interprétation large de cette disposition, il n'est alors guère possible de discriminer entre les recherches pouvant être autorisées et les autres. Ces dispositions me semblent toujours être très fortement teintées d'hypocrisie car on ne sait s'il s'agit finalement de permettre ou de refuser la recherche sur l'embryon. J'estime que cela entretient un certain flou autour de cette question et est de nature à décourager et à démotiver les chercheurs. La seconde condition nécessaire pour autoriser ces recherches sur l'embryon est également très critiquable. En effet elle laisse beaucoup trop de champ à l'interprétation. S'il devait s'avérer, au moment du bilan, qu'en pratique, cette restriction n'était pas finalement appliquée, cela ne pourrait qu'affaiblir l'autorité de la loi. Selon la loi, cette recherche ne peut être effectuée « que sur les embryons conçus in vitro dans le cadre d'une assistance médicale à la procréation qui ne font plus l'objet d'un projet parental » après consentement écrit du couple dont ils sont issus. Il convient de souligner qu'il est maintenant possible, après accord de l'Agence de la biomédecine de dériver des lignées des embryons écartés par un DPI dans la mesure où ils sont devenus, de ce fait, surnuméraires. C'est une application positive de la loi qui permettra aux chercheurs de disposer de lignées de cellules anormales. Elles seront, comme on l'a déjà signalé, très précieuses pour procéder à l'étude de l'évolution de nombreuses maladies. b - Les modalités de cette recherche : l'intervention de l'Agence de la biomédecine Ce type de recherche ne peut être entrepris que si leur protocole a été autorisé par l'Agence de la biomédecine créée par la loi. Cette Agence de la biomédecine ne peut autoriser ces recherches qu'en fonction de leur pertinence scientifique et de leur condition de mise en œuvre au regard des principes éthiques et de leur intérêt pour la santé publique. Cette Agence doit aussi autoriser de manière préalable les importations de cellules souches embryonnaires ou de tissus fœtaux ainsi que leur exportation. La conservation de ces produits est également soumise à son autorisation. Les ministres chargés de la santé et de la recherche sont les instances d'appel des décisions de l'Agence. Ils peuvent en effet interdire ou suspendre la réalisation d'un protocole en cas de non pertinence scientifique ou de non respect des principes éthiques. Ils peuvent aussi demander à l'Agence un nouvel examen d'un protocole refusé par celle-ci. La loi prévoyait dans le dernier alinéa de cet article 25, qu'un décret fixerait les conditions d'autorisation et de mise en œuvre de ces recherches sur les embryons humains. En attendant la parution de ce décret, l'article 37 de la loi prévoyait un régime transitoire. Ce régime transitoire devait ainsi durer jusqu'au 6 février 2006, soit dix-huit mois. Ce retard dans l'application de la loi a imposé le recours au régime transitoire. c - Le retard dans l'application de la loi : le régime transitoire Les dispositions de l'article 37 de la loi de 2004 se sont donc appliquées. Celles-ci prévoient que les autorisations, dont la délivrance est du ressort de l'Agence de la biomédecine (utilisation à des fins d'études et de recherche, conservation, importation et exportation), sont, à titre transitoire, délivrées conjointement par les ministres chargés de la recherche et de la santé après avis d'un comité ad hoc. Ses membres, experts scientifiques et membres non scientifiques, ont été désignés par l'arrêté du 28 octobre 2004, et sa première réunion s'est tenue le 25 novembre 2005. De septembre 2004 à février 2006, 40 autorisations ont été délivrées par les ministres compétents, permettant ainsi à une dizaine d'équipes de démarrer des recherches. Lors de l'audition publique du 22 novembre 2005, un certain nombre des chercheurs présents ont fait part de leur regret quant à la durée pour obtenir une autorisation et au manque de souplesse des procédures. La durée pour obtenir une autorisation a été de l'ordre d'environ quatre mois. Cela me semble raisonnable compte tenu de la nouveauté des procédures et comparé à la situation en Grande-Bretagne, où ce délai est de l'ordre de six mois d'après Mme Alison Murdoch et M. Ian Wilmut. Le manque de souplesse des procédures a dû être réel, mais l'Agence de la biomédecine a tenu compte de cette expérience. Ce comité a donc dû examiner les dossiers en fonction des critères posés par la loi. Il est intéressant d'examiner comment, d'après le rapport d'activité du Comité ad hoc, ont été envisagés, respectivement, les critères relatifs aux « progrès thérapeutiques majeurs » et à « l'absence de méthode alternative d'efficacité comparable ». _ le critère relatif aux « progrès thérapeutiques majeurs » Le rapport d'activité note à ce propos : « Le comité considère que la finalité thérapeutique ne se limite pas aux recherches sur les applications thérapeutiques et que la recherche fondamentale comme préalable indispensable vers des applications thérapeutiques est incluse dans cette finalité. Il estime donc que des recherches dont les applications thérapeutiques sont lointaines peuvent être considérées comme susceptibles de permettre des progrès thérapeutiques majeurs dans la mesure où elles constituent un préalable à des projets aux applications thérapeutiques plus directes. Le comité exige toutefois des demandeurs, même si aucun résultat ne peut être attendu à court terme, qu'ils précisent les applications thérapeutiques sur lesquelles leur projet pourrait déboucher [...].» Le comité a ainsi refusé une autorisation à un dossier faisant uniquement référence à des recherches en cosmétologie. On constate que le comité s'est ainsi trouvé obligé d'avoir une conception extensive des « progrès thérapeutiques majeurs » pour pouvoir autoriser des demandes. Cela rend les termes de la loi, comme je l'avais noté en décembre 2003, inopérants. Il est donc nécessaire de les supprimer. _ Le critère relatif à « l'absence de méthode alternative d'efficacité comparable » Le comité considère de ce point de vue : « Le comité examine les renseignements fournis par l'équipe sur les méthodes alternatives reposant, notamment sur l'utilisation de cellules souches adultes. Il s'attache, en particulier, à vérifier si des recherches ont déjà été menées sur des cellules souches embryonnaires d'animaux mais il n'exige pas que ces recherches aient déjà produit des résultats concluants sur l'animal. L'absence de résultat sur des cellules animales ne le conduit pas à refuser que des recherches soient entreprises sur ces cellules souches embryonnaires humaines [...]. » Là encore le comité est obligé d'appliquer de façon très large les dispositions de la loi. Celles-ci ne doivent pas non plus être conservées. Nous verrons à la fin de ce chapitre que je propose de remplacer ces dispositions qui n'ont pas fait la preuve de leur efficacité par celles qui avaient été prévues dans le texte voté en première lecture par l'Assemblée nationale en janvier 2002. En permettant à une dizaine d'équipes de démarrer des recherches à partir de lignées de cellules souches d'origine étrangère, le comité ad hoc a eu une action très positive dans le démarrage en France de la recherche sur les cellules souches embryonnaires. L'ensemble des intervenants de la journée d'auditions publiques l'ont tous reconnu. Cependant, j'estime que ce retard dans l'application de la loi a été tout à fait excessif et qu'il a été très pénalisant pour les chercheurs et l'organisation de la recherche de notre pays. A la suite de la parution du décret du 6 février 2006, l'Agence de la biomédecine a pris son relais 3 - Le décret n° 2006-21du 6 février 2006 relatif à la recherche sur l'embryon et sur les cellules embryonnaires et modifiant le code de la santé publique54 Le premier alinéa de ce décret tente de préciser les « progrès thérapeutiques majeurs ». Il est ainsi rédigé : « Sont notamment susceptibles de permettre des progrès thérapeutiques majeurs, au sens de l'article L. 2151-5, les recherches sur l'embryon et les cellules embryonnaires poursuivant une visée thérapeutique pour le traitement de maladies particulièrement graves ou incurables, ainsi que le traitement des affections de l'embryon ou du fœtus.» On voit que la perspective thérapeutique est « visée », ce qui donne un champ assez large aux recherches et ne devrait pas les entraver. Cela rejoint ainsi l'appréciation du comité ad hoc sur ce point. Ce décret permet donc aux chercheurs de créer et de travailler sur des lignées de cellules souches embryonnaires humaines issues d'embryons surnuméraires, conçus in vitro dans le cadre d'une assistance médicale à la procréation sur le territoire français, et sur des lignées de cellules importées créées dans les mêmes conditions. Trois types de recherches sont autorisés en employant : ∙ des embryons surnuméraires ne faisant plus l'objet de projet parental. Les parents doivent consentir par écrit au don de l'embryon pour la recherche, sans aucune contrepartie financière. Ce consentement, donné une première fois, doit être renouvelé à l'issue d'un délai de réflexion de trois mois ; ∙ des embryons dont l'état ne permet pas la réimplantation ou la conservation à des fins de grossesse, sous réserve de l'autorisation des parents ; ∙ des embryons porteurs de l'anomalie recherchée dans le cadre d'un diagnostic préimplantatoire, sous réserve de l'autorisation des parents. Le décret précise les modalités d'autorisation des recherches sur l'embryon humain et les cellules souches embryonnaires. Ces autorisations sont désormais délivrées par l'Agence de la biomédecine. 4 - L'Agence de la biomédecine Créée par l'article 2 de la loi n° 2004-800, l'Agence de la biomédecine est un établissement public administratif de l'Etat placé sous la tutelle du ministre chargé de la santé. Prenant la suite de l'Etablissement français des greffes, elle réunit donc les quatre domaines que sont le prélèvement et la greffe, la procréation, l'embryologie et la génétique. L'Agence de la biomédecine intervient au niveau de l'autorisation des recherches et des échanges extérieurs, de la traçabilité, du suivi et du contrôle des recherches. a - L'autorisation des recherches Elle examine et autorise les protocoles de recherche proposés par les équipes scientifiques françaises. Les demandes sont déposées auprès de l'Agence selon un dossier-type à l'intérieur d'un calendrier de « fenêtres de dépôt » arrêté par le directeur général. En 2006, par exemple, ces « fenêtres » ont été les suivantes : 1er mars - 30 mars ; 15 mai - 15 juin ; 1er octobre - 30 octobre. Si le dossier est recevable, la décision du directeur général doit intervenir dans un délai de quatre mois suivant la clôture de la fenêtre de dépôt des dossiers, tout demande d'information complémentaire prorogeant ce délai. Chaque projet de recherche est évalué par deux experts scientifiques désignés par le directeur général de l'Agence. Un débat a ensuite lieu au sein d'un collège d'experts. Il est par la suite étudié par deux rapporteurs, membre du conseil d'orientation de l'Agence, qui le présentent devant cette instance. Le conseil d'orientation émet un avis. Ce conseil réunit des experts scientifiques et médicaux, des experts en sciences humaines, des représentants d'associations et de diverses institutions, des parlementaires. Il veille à la cohérence de l'action de l'Agence ainsi qu'au respect des principes réglementaires et éthiques applicables à ces activités. Le directeur général arrête ensuite sa décision qui est communiquée aux ministres chargés de la santé et de la recherche. Ceux-ci peuvent, en cas de décision négative, éventuellement demander un nouvel examen du protocole par l'Agence. En cas de décision positive, ils peuvent interdire ou suspendre la réalisation du protocole lorsque sa pertinence scientifique n'est pas établie ou quand le respect des principes éthiques n'est pas assuré. b - L'autorisation des échanges extérieurs Tout organisme souhaitant importer des tissus fœtaux ou des cellules embryonnaires doit obtenir une autorisation de recherche ou de conservation. Il doit s'assurer que ces tissus ou cellules ont été obtenus dans le respect des principes éthiques inscrits dans la loi et, notamment avec le consentement du couple parental et en l'absence de rémunération. L'Agence est également compétente pour autoriser les exportations de ces tissus et cellules. L'Agence tient un registre national des embryons et des cellules embryonnaires humaines, les informations étant transmises par les organismes autorisés à créer ou importer de telles lignées. Ils doivent également tenir un registre du matériel biologique détenu. Les systèmes d'identification assurent ainsi la traçabilité des embryons et des cellules qui en sont dérivées, tout en garantissant l'anonymat des personnes à l'origine des embryons. Après l'approbation du protocole, la personne responsable de la recherche doit adresser à l'Agence un rapport annuel sur l'avancement des travaux et un rapport final au terme de l'autorisation. Si le protocole fait l'objet de modifications en cours de recherche, celles-ci doivent être soumises à l'Agence qui les examine selon le même processus que la demande initiale. e - Le contrôle des recherches L'Agence peut effectuer des inspections avec son personnel. Mme Carine Camby m'a ainsi indiqué qu'une inspection sera diligentée dans les 18 mois d'une autorisation. En cas d'infraction aux dispositions législatives ou réglementaires, ou de non respect du cadre de l'autorisation, la recherche peut être suspendue pour une durée maximale de trois mois par le directeur général qui en informe le conseil d'orientation. Il est certes trop tôt pour faire un bilan de ce dispositif mais il m'apparaît tout à fait satisfaisant. Il semble que la communauté des chercheurs ait aussi un a priori favorable. L'Agence a déjà autorisé 10 projets de recherche sur l'embryon. 5 - Quel engagement de la France en matière de cellules souches ? La situation de notre pays est caractérisée par une faiblesse des moyens financiers et humains qui rend nécessaire une intervention publique. a - La faiblesse des moyens humains et financiers _ Les moyens humains Il y a un contraste très important entre le nombre d'équipes travaillant sur les cellules souches embryonnaires et les cellules souches adultes. En effet, si une dizaine d'équipes travaillent - ou, pour certaines d'entre elles, vont travailler - sur les cellules souches embryonnaires, plusieurs dizaines d'équipes mènent une recherche sur les cellules souches adultes. J'ai mentionné un certain nombre de ces équipes dans les développements consacrés aux cellules souches adultes. Cependant, s'il n'y a pas de difficulté pour connaître les activités faisant intervenir les cellules souches embryonnaires, compte tenu de l'autorisation nécessaire, il n'en est pas de même concernant les cellules souches adultes. En effet, il semble régner une grande imprécision quant au nombre exact d'équipes impliquées dans la recherche sur les cellules souches adultes. Les équipes de recherche sont ainsi appréhendées par la finalité thérapeutique de leurs études, par exemple les maladies neurologiques, plutôt que par les moyens employés, par exemple la thérapie cellulaire. Il serait cependant tout à fait utile que soit effectué un recensement précis de toutes les activités conduites en France concernant ces cellules souches adultes. Ce sera une recommandation de ce rapport. Cette disproportion de l'activité entre cellules souches embryonnaires et adultes est tout à fait normale, compte tenu du fait que jusqu'à l'intervention de la loi de 2004, il était interdit en France de travailler dans le domaine des cellules souches embryonnaires. La conséquence est toutefois actuellement une absence importante de compétences dans cette spécialité qu'on n'avait pas le droit d'exercer dans notre pays. La constitution d'un nombre important d'équipes compétentes en la matière sera sans doute assez longue. Une façon de pouvoir disposer assez rapidement de ces compétences serait de pouvoir faire revenir en France un certain nombre de « post-docs », actuellement en poste à l'étranger et, notamment, aux Etats-Unis. Au cours de ma mission dans ce pays, j'ai ainsi pu rencontrer un nombre important de ces « post doc » français. Certains d'entre eux m'ont fait part de leur souhait de pouvoir rentrer en France, mais avouaient leur inquiétude de ne pas pouvoir y trouver des conditions de travail très favorables. Quelques-uns sont quand même revenus. Certains ont pu trouver des conditions de travail tout à fait satisfaisantes, mais le problème de leur rémunération demeure important. Il n'a souvent été résolu que par leur acceptation d'un sacrifice financier non négligeable. _ Les moyens financiers Il faut souligner l'effort financier et la très importante action de l'Inserm dans ce domaine. En effet, M. Christian Bréchot a indiqué55 que « l'Inserm a, depuis plusieurs années, engagé des moyens importants dans ce domaine. [...] L'Inserm dépense ainsi 15 millions d'euros en coût global pour les unités qui travaillent dans ce secteur.» Jusqu'à maintenant les dépenses de l'Inserm ont été très majoritairement axées sur les cellules souches adultes, compte tenu de la législation en vigueur. Outre ces sommes, «depuis 2001, l'Inserm a, avec plusieurs partenaires, en particulier l'A.F.M., la Juvenile Diabetes Research Foundation, (J.D.R.F.), l'association « Vaincre la mucoviscidose » (V.L.M.), le ministère de la recherche, etc., soutenu des programmes à hauteur de 8 à 10 millions d'euros au total sur projets, conduisant à près de quatre-vingts projets de recherche déposés ». Dans le cadre de ces actions menées depuis 2001, l'Inserm a lancé trois appels d'offres à la création et au soutien de projets et de réseaux de recherche à visées thérapeutiques sur les cellules souches adultes : - appel d'offres 2001 (A.F.M. et Inserm) : soutien à quinze projets financés sur deux ans : 1,22 million d'euros, dont 300 000 euros par an fournis par l'Inserm ; - appel d'offres 2002 (V.L.M., A.F.M., Ministère de la recherche, Inserm) : soutien à seize projets financés sur dix-huit mois : 1,77 million d'euros, dont 366 000 euros fournis par l'Inserm ; - appel d'offres 2003 (Ministère de la recherche, A.F.M/J.D.R.F., Inserm, « programme de recherche sur les cellules souches adultes » : treize projets financés pour trois ans : 3,9 millions d'euros, dont 260 000 euros par an sur trois ans fournis par l'Inserm. Les domaines de recherche principalement concernés par ces appels d'offres sont l'hématologie, la dermatologie, la cardiologie, la neurologie et l'hépatologie. Enfin, M. Christian Bréchot a rappelé l'importance des projets européens basés sur l'utilisation des cellules souches, dont le programme Genostem sur les cellules souches mésenchymateuses, issu du 6ème Programme cadre de recherche et de développement (P.C.R.D.), doté de 8,7 millions d'euros, et prévu pour une durée de quatre ans, de 2004 à 2008, lequel sera présenté dans le chapitre consacré à l'organisation de la recherche dans l'Union européenne. M. Michel Van der Rest a indiqué56 quant à lui que la thématique « cellules souches » concernait environ 10% du potentiel de recherche du département du « Vivant » du Centre national de la recherche scientifique (C.N.R.S.). Il a précisé que les sommes en jeu devaient représenter au C.N.R.S. de l'ordre de 7 millions d'euros. Ces sommes ne sont pas négligeables, mais elles ne sont pas à la mesure de l'enjeu, ni à celle de l'effort entrepris dans ce domaine par d'autres pays comme la Grande-Bretagne. b - La nécessité d'une intervention publique Tous mes interlocuteurs français et étrangers ont particulièrement insisté sur la nécessité de l'intervention publique dans ce secteur de recherche, dans la mesure où, pour des raisons que nous examinerons dans la dernière partie de ce rapport, l'investissement des entreprises privées y est actuellement pratiquement complètement absent. L'intervention publique est nécessaire car, comme on l'a vu, les cellules souches sont encore un domaine de recherche fondamentale qui doit être développé pour pouvoir entraîner, à terme, l'investissement privé. M. Philippe Pouletty a ainsi souligné que « si les Etats ne fournissent pas un très gros effort de financement de la recherche pour ce type d'innovation, les entreprises et les investissements privés ne pourront pas prendre le relais ». De ce point de vue, la politique française actuelle me semble totalement inadaptée dans la mesure où aucun financement public n'est affecté de façon visible à ce domaine. Ainsi, aucun appel d'offres n'a été effectué par la nouvelle Agence nationale de la recherche (A.N.R.) en matière de cellules souches, aussi bien adultes qu'embryonnaires. Il m'a été expliqué que les programmes de l'A.N.R. sont organisés par finalité thérapeutique et non pas par moyens. Il est donc possible que les cellules souches soient concernées par la recherche sur tel ou tel type de maladie. Je pense qu'il est nécessaire qu'il y ait un affichage de la recherche sur ce thème des cellules souches adultes et embryonnaires. L'Etat doit indiquer ses priorités à travers les appels d'offres de l'A.N.R. qui pourront ainsi exercer un effet de levier sur le secteur. Ils pourraient aussi conduire à regrouper les équipes en pôles d'excellence. Ce seront des recommandations de ce rapport. L'effort public ainsi aisément repérable doit aussi être pérenne, à l'échelle de ce secteur qui implique des recherches de longue haleine. Un certain nombre de structures pouvant servir de modèle à ces regroupements en pôles d'excellence commencent à exister. C'est le cas du pôle d'Evry où se trouvent déjà Génopole et la jeune structure I-Stem. I-Stem est l'institut des cellules souches pour le traitement des maladies monogéniques, soutenu et financé par l'A.F.M., l'Inserm, l'Université d'Evry Val d'Essonne et Génopole. Le Conseil général de l'Essonne participe également au financement de différents matériels. Il ne semble cependant pas utile de réunir physiquement toutes les équipes travaillant sur ces cellules souches. Il s'agirait plutôt de créer une structure de « laboratoire sans mur », réunissant les compétences publiques et privées en matière de cellules souches embryonnaires et adultes, afin d'aboutir à une fertilisation croisée de tous les travaux. Ce type de structure aurait aussi le très grand avantage d'éviter le « saupoudrage » des moyens publics et privés, ceux-ci étant essentiellement d'origine associatif. 6 - Changer la législation concernant la recherche sur l'embryon et légaliser la transposition nucléaire a - Changer la législation concernant la recherche sur l'embryon Le changement de cette législation conduira à la suppression des dispositions de l'article 25 de la loi du 6 août 2004 portant rédaction des quatre premiers alinéas de l'article L 2151-5 du code de la santé publique. Par contre, seront maintenues les dispositions concernant le rôle de l'Agence de la biomédecine, qui a été conçue de manière équilibrée et dont le fonctionnement donne, jusqu'à maintenant, satisfaction. Je propose que les dispositions supprimées soient remplacées par celles des deux premiers alinéas de l'article 2151-3 du code de la santé publique, dans la rédaction donnée par l'article 19 du projet de loi relatif à la bioéthique voté en première lecture par l'Assemblée nationale en janvier 2002 dont le texte se trouve en annexe. Ce sera une recommandation de ce rapport. Le premier alinéa de ce texte prévoit qu' « est autorisée la recherche menée sur l'embryon humain et les cellules embryonnaires qui s'inscrit dans une finalité médicale, à la condition qu'elle ne puisse être poursuivie par une méthode alternative d'efficacité comparable, en l'état des connaissances scientifiques ». Ce texte me semble plus équilibré et exempt de l'hypocrisie des dispositions adoptées en 2004. b - Autoriser la transposition nucléaire Cette autorisation me semble devenue maintenant indispensable pour permettre à la France de rester dans le concert des grandes nations scientifiques. Celle pourrait aussi inciter un certain nombre de nos « post docs » à revenir. Ce sera une recommandation de ce rapport. Cette législation devra être précédée d'un important débat public, qui pourrait être organisé par l'Agence de la biomédecine. Celle-ci devrait être chargée par la future loi d'un rôle important en matière de mise en œuvre de cette nouvelle législation qui devra en prévoir un contrôle rigoureux. Ces deux modifications législatives ne devront pas attendre le terme fixé par la loi de 2004, c'est-à-dire 2009, mais commencées à être discutées dès 2007, après les échéances électorales. Ce sera une recommandation de ce rapport. Je souhaite très fortement que nous profitions de ces échéances pour discuter de ces questions dans le cadre d'un très large débat démocratique. Je ne suis pas hostile à la transposition nucléaire, sous la réserve du problème que représente le don d'ovocyte. Je pense qu'autoriser cette technique est nécessaire, d'une part, pour la recherche fondamentale et, d'autre part, compte tenu du contexte international, afin d'éviter que la France et l'Europe perdent pied dans ce domaine essentiel. J'estime que la situation a évolué depuis 2004 et qu'il est probablement possible d'arriver à un accord politique sur l'autorisation de cette technique. J'ai ainsi pu constater avec beaucoup d'intérêt que des opposants à cette mesure en 2004 avaient publiquement changé d'opinion. J'en suis très heureux car cela confortera les chances de la recherche française dans la compétition internationale. Cela passe par un préalable absolu : déterminer les conditions éthiques du don d'ovocyte. Je traiterai cette question dans la dernière partie de ce rapport. L'Union européenne intervient dans la recherche sur les cellules souches par l'intermédiaire des programmes cadres de recherche et de développement (P.C.R.D.). Les Programmes cadres sont les principaux outils financiers d'intervention de l'Union européenne en matière de recherche et de développement dans presque toutes les disciplines scientifiques. Un programme cadre est proposé par la Commission européenne et adopté par le Conseil des ministres et le Parlement européen suivant une procédure de co-décision. Les Programmes cadres existent depuis 1984 et couvrent une période de cinq ans, commençant la dernière année du programme précédent et se terminant la première année du programme suivant. L'actuel Programme-cadre, le sixième, a débuté en 2002 et doit se terminer à la fin de cette année 2006. Le septième Programme cadre doit, lui, commencer le 1er janvier 2007 pour s'achever en 2013, soit une durée exceptionnelle de sept ans. 1 - Le sixième Programme cadre de recherche et de développement L'Union européenne a financé, au cours de ce Programme cadre, des projets de recherche collective concernant les cellules souches. Ces projets concernent les cellules souches soit comme sujets d'étude elles-mêmes, soit comme moyens, soit comme outils biologiques de projets plus vastes. Par contre, les projets utilisant les cellules souches comme outils non spécifiques, par exemple pour créer des modèles animaux, n'y sont pas inclus dans la mesure où ce sont des usages de routine employés par tous les laboratoires. Ces programmes de recherche sont rangés sous sept chapitres57 : - Comprendre, connaissance fondamentale sur la santé humaine 14 programmes, dotation : 107 893 900 euros - Développer des outils pour de nouvelles thérapies 14 programmes, dotation : 83 278 920 euros - Réparer, études précliniques et cliniques des maladies et des handicaps 5 programmes, dotation : 18 057 200 euros - Traiter, progrès de la greffe de cellules souches hématopoïétiques 3 programmes, dotation : 15 500 000 euros - Construire, ingénierie tissulaire 14 programmes, dotation : 69 076 405 euros - Essayer, alternatives à l'essai animal en toxicologie 2 programmes, dotation : 11 359 754 euros - Evaluer, aspects éthiques, juridiques et sociétaux 5 programmes, dotation : 4 834 514 euros Ces programmes de recherche concernent les cellules souches adultes. Etaient totalement exclues de financement, dans le cadre de ce 6ème Programme cadre, les recherches ayant comme but : - la création d'êtres humains par clonage reproductif ; - la modification du génome humain pouvant être transmissible ; - la création d'embryons humains aux fins de recherche ou aux fins de création de lignées de cellules souches embryonnaires, c'est-à-dire la transposition nucléaire. En matière de cellules souches embryonnaires humaines, les financements européens étaient réservés aux projets concernant la dérivation et l'utilisation des cellules issues d'embryons surnuméraires destinés à être détruits et dont les parents avaient autorisé le don à la recherche. Mais ce type de cellules souches n'était admis que dans des cas spécifiques car aucun appel d'offres ne les concernait directement et uniquement. La priorité était donnée en toutes circonstances à la recherche sur les cellules souches adultes. Cependant quatorze programmes comportant au moins un composant de recherche impliquant des cellules souches embryonnaires humaines ont été tout de même financés par ce P.C.R.D. Seul un de ces programmes était entièrement consacré aux cellules souches embryonnaires humaines. Il s'agit du programme ESTOOLS, consacré à la caractérisation de 52 lignées de cellules souches embryonnaires humaines. Il bénéficie d'un budget de 12 millions d'euros et rassemble vingt participants de dix pays différents. Avant d'aborder le 7ème Programme Cadre, il paraît intéressant d'évoquer rapidement le projet Genostem qui est un projet majeur coordonné par l'Inserm. Genostem a comme but le développement de la recherche sur les cellules souches adultes pour la réparation du tissu conjonctif dans les maladies inflammatoires. Ce programme bénéficie d'un budget de 8,752 millions d'euros et rassemble 23 partenaires issus de 9 pays européens et Israël. Genostem a trois objectifs : ∙ la recherche fondamentale : caractérisation phénotypique et génétique des cellules souches mésenchymateuses, grâce à de nouveaux outils développés au sein de plates-formes technologiques en génomique et protéomique, ∙ les essais pré-cliniques chez l'animal, ∙ le traitement des maladies inflammatoires par recherche des méthodes pour délivrer des facteurs de croissance et permettre la régénération de cartilage, de tendons et d'os. Une découverte récente est à mettre à l'actif de ce projet. En effet l'équipe israëlienne faisant partie de ce projet a obtenu, chez le rat, la réparation d'un tendon lésé par la transplantation de cellules mésenchymateuses modifiées. La prochaine étape de cette recherche sera la réalisation d'essais chez un animal plus important. Les premiers bilans de ce 6ème P.C.R.D. seront effectués dans les mois à venir, alors que l'application du 7ème P.C.R.D. devrait débuter. Celui-ci a donné lieu à une élaboration difficile dans le domaine de la recherche sur les cellules souches embryonnaires. 2 - La difficile élaboration du septième P.C.R.D. en matière de recherche sur les cellules souches embryonnaires La discussion préalable à l'élaboration de ce septième P.C.R.D. en matière de recherche sur les cellules souches a donné lieu à certaines difficultés. Celles-ci tiennent à l'approche différente existant en Europe, en matière de cellules souches embryonnaires, comme nous le verrons en détail dans le chapitre suivant, pays par pays. En effet certains de ces pays européens sont hostiles aux recherches sur les cellules souches embryonnaires humaines, soit qu'ils l'interdisent purement et simplement, comme par exemple l'Autriche, soit qu'ils aient une attitude plus ambiguë comme la République fédérale d'Allemagne qui en interdit la création mais en autorise l'importation. Tout au long de la préparation de ce Programme, l'opposition au financement communautaire de cette recherche est restée vive tant au sein du Conseil des ministres qu'au Parlement européen. Mais des évolutions se sont produites ces derniers mois. Ainsi, le 15 juin dernier, le Parlement européen émettait un vote décisif dans ce domaine en faveur de la possibilité explicite d'un soutien du P.C.R.D. à ce type de recherches dans les Etats membre où elles sont autorisées. Au sein du Conseil des ministres, c'est la nouvelle majorité récemment élue en Italie qui a décidé de ne plus s'opposer au soutien communautaire à ces recherches. La conséquence importante était que les pays souhaitant l'interdiction de ces recherches ne disposaient plus de la minorité de blocage au Conseil des ministres. Le 24 juillet dernier, le financement de recherches sur les cellules souches embryonnaires était finalement approuvé par le Conseil des ministres de l'Union européenne. Cet accord prévoit d'autoriser, sous conditions, le financement sur fonds communautaire d'activités de recherche impliquant des cellules souches embryonnaires d'origine humaine. Ce seront des recherches très encadrées. Elles concerneront uniquement les projets utilisant des lignées de cellules souches embryonnaires déjà existantes et ne seront mises en œuvre que dans les états membres où elles sont autorisées. C'est à ces conditions qu'un compromis a pu être obtenu bien que cinq états membres aient refusé de signer le texte final : la Pologne, l'Autriche, Malte, la Slovaquie et la Lituanie. Le Parlement européen devrait être en mesure de voter le texte à sa prochaine session des 29-30 novembre 2006. Le Conseil des ministres devrait, lui, pouvoir se prononcer définitivement le 5 décembre 2006. C'est donc à cette date que le 7ème PCRD devait être adopté, ainsi que les programmes spécifiques et les règles de participation. Les premiers appels à proposition devraient être lancés à la fin du mois de décembre ou au début du mois de janvier 2007. Sous la pression de la République fédérale d'Allemagne, les ministres ont ajouté une déclaration de la Commission s'engageant à ne pas présenter, devant le comité des Etats membres qui doit donner son accord au cas par cas, de programmes de recherche impliquant la destruction d'embryons humains, y compris le prélèvement de cellules souches. Seuls des projets sur des lignées déjà établies pourront être financés. Cette situation risque de porter un préjudice certain à la recherche européenne en encourageant les chercheurs à se diriger là où existent autorisation de travailler et financements importants. Cela risque encore d'accentuer la diversité des situations des pays de l'Union européenne. Nous présenterons brièvement la situation des divers pays de l'Union européenne en matière de cellules souches embryonnaires humaines, les cellules souches adultes ne posant pas de problèmes spécifiques. Les principales lois relatives aux cellules souches embryonnaires sont la loi sur les techniques génétiques et la loi sur la procréation médicalement assistée. Le premier texte, datant de 1994 et modifié en 1998, traite des analyses génétiques sur l'homme, des thérapies géniques et des organismes génétiquement modifiés. Le second date de 1992 et a été modifié en 2001 et 2004. Il est consacré à l'insémination artificielle et au transfert d'embryon. Selon cette dernière loi, les cellules capables de se développer, c'est-à-dire les ovocytes fécondés et les cellules souches embryonnaires en dérivant, ne peuvent servir qu'à la procréation médicalement assistée. Leur utilisation thérapeutique et la recherche à leur propos sont interdites. La transposition nucléaire est donc en conséquence prohibée. Ce texte interdit également toute intervention sur les cellules germinales. L'Autriche a refusé de signer la Convention du Conseil de l'Europe sur les droits de l'Homme et la Biomédecine (Convention d'Oviedo) et son protocole additionnel, jugeant les réglementations autrichiennes plus sévères et plus explicites. La recherche sur les embryons et les cellules souches embryonnaires est régie par la loi du 11 mai 2003. Selon l'article 3 de cette loi, la recherche sur les embryons humains in vitro est autorisée si, notamment, : - elle a un objectif thérapeutique ou vise l'avancement des connaissances en matière de fertilité, de stérilité, de greffes d'organe ou de tissus, de prévention ou de traitement des maladies, - elles est basée sur les connaissances scientifiques les plus récentes et satisfait aux exigences d'une méthodologie correcte de la recherche scientifique, - elle est effectuée dans un laboratoire agréé, - elle est exécutée sur un embryon au cours des 14 premiers jours du développement, période de congélation non incluse, - il n'existe pas de méthode alternative ayant une efficacité comparable. L'article 4 de cette loi autorise la transposition nucléaire en interdisant la constitution d'embryon in vitro à des fins de recherche sauf si l'objectif de la recherche ne peut être atteint par la recherche sur les embryons surnuméraires. Il est très intéressant de noter que le second alinéa de cet article 4 essaie de régler le problème du don d'ovocyte en prévoyant que « la stimulation des ovules est autorisée si la femme concernée est majeure, donne son accord par écrit et si cette stimulation est scientifiquement justifiée ». Enfin l'article 6 de cette loi interdit le clonage reproductif. D'après le service scientifique de notre ambassade, la recherche sur les cellules souches embryonnaires ne semble pas être un sujet de débat politique. Il n'y a actuellement dans ce pays aucune législation spécifique dans ce domaine. La loi du 12 mai 2006 dispose qu'on ne peut pas créer des embryons humains pour poursuivre des recherches (interdiction de la transposition nucléaire). Par contre, il est possible d'effectuer des recherches sur les embryons surnuméraires provenant de la procréation assistée, qu'ils soient tchèques ou importés. Cette loi autorise la création de nouvelles lignées de cellules souches embryonnaires. La recherche ne peut être réalisée que sur des lignées créées nationalement ou importées de pays respectant les lois et règlements de la République tchèque ou sur des embryons surnuméraires provenant de la procréation assistée. Cette recherche ne peut être poursuivie que si elle conduit au développement du diagnostic et au progrès thérapeutique, une fois épuisées les ressources classiques de l'expérimentation sur des animaux. A l'Université Masaryk de Brno, le département de biologie de la faculté de médecine regroupe une cinquantaine de personnes travaillant sur les cellules souches embryonnaires et adultes humaines et sur les cellules souches embryonnaires animales. 5 - La République fédérale d'Allemagne La loi sur la protection de l'embryon du 13 décembre 1990 et entrée en vigueur le 1er janvier 1991 interdit notamment : · la création d'embryons humains à des fins de recherche, · toute utilisation d'embryons humains à des fins autres que leur conservation, · le transfert génétique dans des cellules germinales humaines, · l'extraction de cellules totipotentes d'un embryon humain, par exemple à des fins de recherche ou de diagnostic, · le clonage, · la création de chimères et d'êtres hybrides à partir d'animaux ou d'humains [...]. La loi du 28 juin 2002 autorise cependant les chercheurs allemands à travailler sur des lignées de cellules souches embryonnaires humaines importées à condition qu'elles aient été établies avant le 1er janvier 2002. Cette date a été fixée avant l'entrée en vigueur de la loi pour éviter que l'autorisation d'importation n'incite à la création d'embryons surnuméraires à l'étranger. Seules les cellules produites à partir d'embryons surnuméraires initialement créées à des fins reproductives et ne faisant plus l'objet d'un projet parental peuvent être importées mais sans contrepartie financière. Enfin cette importation de cellules souches embryonnaires et l'utilisation des embryons ne doivent pas violer les réglementations des pays de provenance des cellules et la loi allemande du 13 décembre 1990. Les projets de recherche doivent être examinés et évalués par la Commission centrale d'éthique de recherche sur les cellules souches, afin de déterminer s'ils correspondent aux exigences légales et sont justifiables d'un point de vue éthique. En R.F.A., comme en France, seules sont autorisées les recherches sur les cellules souches embryonnaires humaines susceptibles de permettre des progrès thérapeutiques majeurs et ne pouvant être menées par une méthode alternative d'efficacité comparable. Actuellement 19 projets de recherche à partir de cellules souches embryonnaires humaines sont autorisés. Les différences de législation entre la France et la R.F.A. rendent très difficiles les coopérations franco-allemandes dans ce domaine. Il n'y en a aucune actuellement. Comme on le voit, la loi allemande est très restrictive. C'est la réglementation de la date d'importation des cellules souches qui est au centre du débat. Les scientifiques critiquent notamment les sanctions que risquent les chercheurs allemands participant à des projets de recherche internationaux sur les cellules souches embryonnaires établies après le 1er janvier 2002. D'un point de vue scientifique, ils estiment que la qualité des cellules souches embryonnaires humaines disponibles en R.F.A. se détériore avec le temps. Il semble que le gouvernement allemand ne souhaite pas modifier l'état actuel de la législation applicable notamment en ce qui concerne la date limite de fabrication des cellules souches. On a vu que nombre de difficultés dans la négociation du 7ème P.C.R.D. étaient dues à l'attitude allemande dans ce domaine. Nombre de scientifiques allemands redoutent que leur pays accumule un retard considérable dans ce domaine et craignent de ce fait une fuite des cerveaux. La loi danoise de 1997 sur la procréation médicale assistée a été amendée le 1er septembre 2003, permettant ainsi la recherche sur les cellules souches embryonnaires humaines, afin uniquement d'acquérir de nouvelles connaissances en vue d'améliorer les possibilités de soigner des maladies. La transposition nucléaire est actuellement interdite. La création de lignées de cellules souches embryonnaires est possible à partir d'embryons surnuméraire, uniquement pour un projet de recherche approuvé par le Comité national danois de l'éthique biomédicale, et après consentement du couple de donneurs. 7 - L'Estonie, la Lituanie, la Lettonie Les recherches sur les cellules souches embryonnaires humaines n'ont pas atteint de niveau significatif dans ces pays. Les autorités de ces pays n'ont pas encore légiféré sur cette question. La loi du 23 décembre 2002 autorise l'utilisation des embryons surnuméraires à des fins thérapeutiques et de recherche, avec le consentement préalable et informé des personnes concernées. Cette loi interdit de façon explicite la transposition nucléaire. Jusqu'en 2003, la loi sur la reproduction assistée interdisait la création ainsi que l'utilisation d'embryons sains à des fins de recherche scientifique. La loi du 21 octobre 2003 a autorisé la recherche, à partir de cellules souches provenant d'embryons congelés surnuméraires et ne faisant plus l'objet d'un projet parental. Cette législation avait été précédée de deux initiatives menées en Andalousie et dans la communauté autonome de Valence. En effet, dans ces deux régions, plusieurs lignées de cellules souches embryonnaires humaines avaient été créées à partir d'embryons humains, avant la légalisation de cette pratique au niveau national. Avec le retour au pouvoir du P.S.O.E., ces initiatives locales ont été incorporées dans un réseau national décentralisé des cellules souches. En septembre dernier, le gouvernement espagnol a annoncé avoir préparé un projet de loi autorisant la transposition nucléaire, qui sera soumis au vote des députés espagnols. La Finlande est dans une situation un peu ambivalente. En effet, la loi ne permet pas de façon explicite la transposition nucléaire, mais il est admis que cette technique, n'étant pas interdite de façon explicite, est « admise » seulement dans le cadre de recherches cliniques. La loi sur la recherche de 1999 autorise la création de lignées de cellules souches embryonnaires humaines, à partir d'embryons surnuméraires issus de fertilisation in vitro et dont la date de conservation est arrivée à expiration, en principe trois ans. Le consentement des deux donneurs de gamètes est nécessaire avant de commencer toute recherche, et une approbation préalable du Comité d'éthique est indispensable. Compte tenu de cette réglementation souple, des centres de recherche se sont développés en Finlande dans ce domaine à Helsinki et à Tampere. La législation de ce pays date du milieu des années 1990 et est semblable à celle de la R.F.A., c'est-à-dire que le clonage reproductif est naturellement interdit mais aussi la transposition nucléaire. Un certain nombre de centres de recherche sont une activité dans le domaine des cellules souches embryonnaires humaines. Les lignées utilisées sont celles figurant dans le registre des N.I.H. et viennent des Etats-Unis, de Suède, de Grande-Bretagne et de Singapour. La constitution d'Irlande garantit le droit à la vie mai ne donne pas de définition légale du « non - né ». Cette situation crée un vide juridique pour un certain nombre de questions et notamment sur la recherche en matière de cellules souches embryonnaires humaines. Le Medical Council of Ireland, organisme réglementant la profession médicale, a fait des recommandations éthiques interdisant explicitement les recherches et les expérimentations sur les embryons. Mais celles-ci ne concernent que les médecins et non les chercheurs. Le service de coopération culturelle et scientifique de notre ambassade note que « techniquement les chercheurs irlandais pourraient travailler sur des cellules souches embryonnaires ou des lignées de cellules souches mais il est difficile de savoir s'ils le font effectivement ; en tout cas, ils ne l'admettent pas publiquement ». Le clonage reproductif et l'expérimentation sur l'embryon sont interdits. La recherche clinique et l'expérimentation sur l'embryon sont admises uniquement à des fins thérapeutiques et diagnostiques, en vue de garantir sa santé et son développement, seulement en l'absence de méthodes alternatives. La transposition nucléaire, ainsi que la production de lignées de cellules souches embryonnaires à partir d'embryons surnuméraires issus de fécondation in vitro, sont interdites selon la loi n° 40 du 19 février 2004. Il est par contre possible d'isoler des lignées de cellules souches embryonnaires à partir de fœtus issus d'interruptions volontaires de grossesse. Cette loi prévoit la possibilité d'importer et de travailler sur des lignées de cellules souches embryonnaires produites avant juillet 2001. Il est interdit d'utiliser des lignées produites après cette date. Compte tenu de cette situation, un seul groupe de chercheurs travaille, à l'Université de Milan, en collaboration avec des laboratoires étrangers, sur des lignées produites avant juillet 2001. Par contre, une dizaine d'institutions publiques et privées font de la recherche sur les cellules souches adultes, aucune restriction n'affectant ce domaine. Un projet de loi est actuellement en cours de débat au Luxembourg. Selon celui-ci, il n'y aura la possibilité ni de créer des lignées de cellules souches embryonnaires humaines ni de les importer. Il existe seulement une petite activité en matière de cellules souches adultes. Il n'y a aucune législation dans ce domaine à Malte. La recherche sur les embryons surnuméraires est autorisée par la loi sur l'embryon de juin 2002. En revanche, il est interdit de créer des embryons uniquement à des fins de recherche, le but de la création d'embryons devant aboutir à un être vivant. L'utilisation des embryons surnuméraires est possible à des fins de recherche, l'accord préalable des parents ayant demandé la F.I.V. étant nécessaire. Trois institutions effectuent des recherches sur les cellules souches embryonnaires, tandis que plus d'une dizaine travaillent sur les cellules souches adultes. La loi polonaise interdit les recherches sur les cellules souches embryonnaires humaines, dont la culture et l'importation sont prohibées, et la transposition nucléaire. L'interruption volontaire de grossesse étant interdite, il n'y a pas de possibilité de recherche sur les embryons surnuméraires. Quelques laboratoires conduisent des recherches sur les cellules souches adultes. Aucune législation n'encadre les recherches sur les cellules souches embryonnaires humaines. Aucune disposition ne donne aux chercheurs la possibilité de créer des lignées de cellules souches embryonnaires humaines ou d'importer de telles lignées de cellules. Actuellement, se pose dans ce pays le problème du devenir des embryons surnuméraires issus de la procréation médicale assistée, non autorisée au Portugal, mais pratiquée depuis vingt ans par certaines cliniques privées. La Suède a très tôt eu conscience de l'intérêt et du potentiel des cellules souches embryonnaires humaines. Les autorités de ce pays ont toujours adopté des positions très ouvertes sur cette question, privilégiant le débat éthique à l'établissement d'une législation trop stricte. La Suède fait partie des premiers pays européens à avoir légiféré en matière de recherche sur les cellules souches : la recherche sur les ovocytes fécondés d'origine humaine est en effet autorisée depuis 1991. Cette loi fut établie afin de limiter la recherche sur les embryons humains à l'amélioration des techniques de fécondation in vitro. Mais elle n'interdisait pas explicitement les recherches sur les cellules souches embryonnaires humaines, qui pouvaient être menées afin d'accroître les connaissances sur le développement embryonnaire. En 2001, le cadre de recherche sur ces cellules souches fut précisé par des lignes directrices qui autorisaient l'utilisation d'embryons humains s'il n'existait pas d'autre alternative pour obtenir des résultats correspondants et si le projet était jugé nécessaire à l'avancée de la recherche sur les cellules souches embryonnaires. Ces lignes directrices prévoyaient ainsi que : ∙ les embryons humains utilisés doivent être soit inutilisables pour une fécondation in vitro, soit surnuméraires au terme de leur durée légale de conservation (cinq ans) et après consentement des parents, ∙ la production de cellules souches embryonnaires est limité aux 14 jours suivants, ∙ les activités de recherche liées à la transposition nucléaire sont subordonnées à la délivrance d'un permis de recherches émis par un comité d'éthique. La transposition nucléaire n'était donc pas interdite mais était soumise aux mêmes limitations éthiques que les recherches sur les ovocytes fécondés. La production d'une lignée de cellules souches embryonnaires humaines doit respecter la loi sur les banques de tissus humains qui reconnaît au donneur le droit de refuser leur utilisation. La recherche sur les cellules souches obtenues à partir d'embryons surnuméraires est autorisée après consentement des donneurs. L'importation de lignées de cellules souches est autorisée. La législation suédoise, certainement une des plus avancées du monde en la matière, a permis à la recherche de se développer de façon remarquable. La recherche sur les cellules souches embryonnaires humaines est principalement concentrée dans les Universités et les institutions d'enseignement supérieur : ∙ l'Université de Lund abrite le Centre de biologie des cellules souches et de thérapie cellulaire. Il réunit plus de 130 chercheurs, ∙ l'Institut Karolinska est le plus grand centre de recherches sur les cellules souches de Suède. Il a été le premier centre en Europe à être autorisé à faire des recherches sur les cellules souches embryonnaires humaines. Cet institut a mis au point six lignées de cellules souches embryonnaires humaines qui sont répertoriées au N.I.H. ∙ L'Académie Sahlgrenska regroupe les activités en sciences de la santé de l'Université de Göteborg et de l'Université de technologie de Chalmers. Elle possède deux lignées de cellules souches embryonnaires inscrites au N.I.H. Enfin l'entreprise privée Cellartis, installée à Göteborg, est la plus grande source mondiale de cellules souches répertoriées : elle en entretient trente, toutes n'ayant pas été cependant produites par elle. Les laboratoires de recherche suédois bénéficient de crédits directs alloués par les universités ou instituts de recherche dont ils dépendent et aussi de bourses de recherches attribuées sur une base concurrentielle. Mais ils attirent également des crédits étrangers, en provenance notamment des Etats-Unis : N.I.H., Juvenile diabetes research foundation (5,5 millions d'euros en 2002), Ministère de la Défense des Etats-Unis (240 000 dollars en 2004). La recherche sur les cellules souches adultes est libre et est effectuée dans les trois établissements universitaires précités. Enfin il faut noter que la Suède est engagée dans des collaborations européennes (Danemark, Royaume-Uni, programmes européens), mais aussi avec les Etats-Unis et l'Asie et, notamment, l'Inde. Il n'existe pas dans ce pays de loi nationale sur les cellules souches embryonnaires mais la loi sur la fécondation biomédicalement assistée contient un certain nombre de dispositions pouvant être appliquées à celles-ci. Ainsi l'article 38 de cette loi stipule-t-il que « la recherche scientifique sur les embryons précoces (défini comme l'embryon se développant hors de l'utérus durant les 14 premiers jours) créés dans le but d'une fécondation biomédicalement assistée est autorisée exclusivement dans l'objectif de protéger et d'améliorer la santé humaine » et « seulement si la recherche ne peut être effectuée avec une efficacité comparable sur les embryons non humains ou par d'autres méthodes ». La création d'embryons génétiquement identiques à un autre être humain est explicitement interdite par l'article 33 de la loi, ce qui exclut la transposition nucléaire. Il n'y a pas de recherches en matière de cellules souches embryonnaires humaines en Slovénie, alors qu'il existe quelques activités dans le domaine des cellules souches adultes. En Slovaquie, la transposition nucléaire ainsi que la création de lignées de cellules souches embryonnaires humaines sont interdites. Quelques recherches sont effectuées dans le domaine des cellules souches adultes en hématologie et en cardiologie. Le Royaume-Uni possède une solide tradition de recherche en embryologie humaine depuis la naissance de Louise Brown, premier enfant issu d'une fertilisation in vitro, le 25 juillet 1978, et en matière de clonage, avec la naissance de Dolly en 1997. Ce pays est aujourd'hui, avec la Suède, un des plus avancés du monde dans ce domaine. Le cadre mis en place en 1991 a permis le développement de la recherche. En 1982, le gouvernement britannique commandait un rapport à Mme Mary Warnock pour étudier les problèmes soulevés par les nouvelles possibilités de créer des embryons humains hors des mécanismes naturels, qui a été publié en 1984. Ce rapport concluait que l'embryon humain a un statut spécial et que les recherches le concernant devrait être seulement entreprise faute d'autres alternatives. Mais il estimait aussi qu'un embryon de moins de 14 jours était suffisamment différent d'un être humain pour pouvoir être utilisé au profit du bien-être général. Cette référence aux 14 jours est maintenant couramment accepté dans les milieux de la recherche internationale. En 1990 était voté The Human Fertilisation and Embryology Act pour encadrer la pratique de la fécondation in vitro et la création, l'utilisation et le stockage des embryons produits par cette voie. Cette loi réglemente l'utilisation des embryons humains à des fins de recherche ayant pour objectifs : - d'améliorer les traitements contre la stérilité, - d'accroître les connaissances relatives aux causes des maladies et malformations congénitales et d'avortements spontanés, - de développer de meilleures techniques de contraception, - de développer des méthodes de détection d'anormalités génétiques ou chromosomiques avant implantation. En 1991, a été créée la Human Fertilisation and Embryology Authority (H.F.E.A.), Haute autorité chargée de la régulation des activités d'assistance médicale à la procréation et de la recherche en embryologie. Cette Autorité est la seule habilitée à délivrer des autorisations de recherche. La H.F.E.A. est un organisme public placé sous la tutelle du Ministère de la santé. Celui-ci supervise ses activités, mais n'intervient pas dans ses décisions. Notamment le gouvernement ne peut pas revenir sur une décision de la H.F.E.A., il peut seulement donner son avis. L'ensemble des membres, dont le nombre n'est pas fixé, est actuellement de 19. Ceux-ci sont nommés par le ministre chargé de la santé. En 2000, était publié un rapport sur les nouveaux développements en matière de recherche sur les cellules souches. A la suite de celui-ci et après un très large débat parlementaire, il a été procédé, en 2001, à une révision de The Human Fertilisation and Embryology Act de 1990 visant à autoriser la transposition nucléaire et à : - accroître les connaissances relatives au développement des maladies graves, - renforcer les connaissances des maladies graves, - permettre à ces connaissances d'être appliquées dans le développement de nouveaux traitements pour des maladies graves. En 2001, le gouvernement britannique a également fait voter une loi interdisant le clonage reproductif. La procédure devant la H.F.E.A. est la suivante en matière de recherche, publique et privée, sur les cellules souches embryonnaires: - les chercheurs expliquent d'abord le but de leurs recherches puis font une demande écrite après accord du comité d'éthique de leur établissement, - cette demande doit préciser : la composition de l'équipe qui va effectuer la recherche, le nombre de gamètes employées, l'objectif des recherches et comment cet objectif respecte la législation, - trois experts internationaux étudient la demande qui est ensuite examinée par le conseil de recherche, - finalement intervient la décision du comité d'octroi de la licence de recherche. Il m'a été indiqué que si la demande porte sur un domaine où les possibilités des cellules souches adultes n'ont pas été explorées, la H.F.E.A. recommande d'utiliser celles-ci. En effet la recherche sur l'embryon doit être nécessaire et indispensable pour être autorisée. La licence de recherche est donnée pour un an. Une évaluation est effectuée à ce moment. La H.F.E.A. a accordé à l'heure actuelle : - neuf licences sur les cellules souches embryonnaires, - deux autorisant la transposition nucléaire, - deux sur la parthénogenèse. Les deux autorisations de transposition nucléaire ont été conférées à Mme Alison Murdoch de l'Université de Newcastle upon Tyne et à M. Ian Wilmut de l'Université d'Edimburgh. Seule Mme Alison Murdoch a effectué une transposition nucléaire sans toutefois réussir à en dériver des lignées cellulaires. M. Ian Wilmut, m'a indiqué qu'il ne dispose pas d'ovocytes pour débuter son activité. De ce point de vue, la H.F.E.A. vient de lancer en septembre dernier une consultation publique sur le don d'ovocyte pour la recherche. J'évoquerai cette consultation dans le chapitre consacré aux questions éthiques. Les réactions que j'ai recueillies concernant l'action de la H.F.E.A. sont assez mitigées. En effet, des chercheurs comme Mme Alison Murdoch et M. Ian Wilmut estiment que ses décisions d'autorisation sont un peu laborieuses et sont beaucoup trop longues à être prises, le délai étant, comme on l'a déjà noté, d'environ six mois. Ils estiment également que cette Autorité a tendance à aller au-delà de ses pouvoirs et à empiéter sur la responsabilité des politiques. C'est également le point de vue de M. Ian Gibson qui a en effet considéré que si la H.F.E.A. a un rôle positif dans le débat public, elle a tendance à s'occuper de trop de choses et, notamment, de l'éthique. Ce faisant, elle outrepasse, selon lui, les droits du Parlement. Il a considéré que ce rôle en matière d'éthique pourrait être mieux rempli par le Nuffield Council on Bioethics, structure privée qui avait participé aux rapports préparatoires à la révision de 2001 du The Human Fertilisation and Embryology Act. b - Le développement de la recherche Le Royaume-Uni a consacré58 en 2003 - 2004 21,8 millions de £ (soit environ 32, 5 millions d'euros) et en 2004 - 2005 31,2 millions de £ (soit environ 46,5 millions d'euros) à la recherche sur les cellules souches, embryonnaires et adultes, tous financements confondus, publics et privés. Les fonds publics sont notamment alloués par le ministère du commerce et de l'industrie et celui de la santé. Ces fonds transitent aussi par les Research Councils, qui sont des organismes indépendants financés par le gouvernement britannique et responsables devant le Parlement. En matière de recherche sur les cellules souches, c'est le Medical Research Council qui intervient de façon principale. Les financements sont très majoritairement alloués aux travaux sur les cellules souches adultes. Il faut aussi souligner que les régions anglaises se sont lancées dans le financement de cette recherche et ont créé des réseaux régionaux comme le East of England Stem Cell Network ou le Scottish Stem Cell Network. Un certain nombre de mes interlocuteurs se sont d'ailleurs alarmés de ce développement de réseaux locaux dans la mesure où une concurrence a tendance à s'installer entre eux, notamment pour attirer les chercheurs les plus prestigieux. En décembre 2005, le gouvernement britannique a annoncé que 100 millions de livres (soit environ 148 millions d'euros) seront consacrés dans les deux années à venir à la recherche sur les cellules souches, des travaux les plus fondamentaux aux applications médicales. Enfin il faut noter l'action très importante dans ce domaine du Wellcome Trust, fondation caritative créée en 1936 pour le financement de la recherche biomédicale. Ses apports sont très importants, de l'ordre de 5 à 6 millions de livres pendant les années 2003 - 2005. La recherche est principalement menée dans quatre structures centrées autour des Universités de Cambridge, de Sheffield, de Newcastle upon Tyne et d'Edinburgh. La recherche britannique a maintenant à sa disposition une banque de cellules souches, l'UK Stem Cell Bank. Sa création remonte à juin 2003 et a bénéficié de la part du Medical Research Council de 9 millions de livres sur cinq ans. Cette banque est en fonctionnement depuis le 18 septembre dernier. Elle rassemble actuellement 24 lignées de cellules embryonnaires humaines de « qualité recherche », dont 12 ont été importées des Etats-Unis. Une politique d'accès à ces lignées va être définie, seules les entreprises privées payant le coût réel des lignées. Enfin, il faut noter que la ville d'Edinburgh vient d'annoncer la création d'un Institut de recherches sur les cellules souches qui devrait bénéficier d'un investissement de 3 millions d'euros. Cet institut à but non lucratif a comme objectif de produire, dans quelques années, des cellules souches embryonnaires « en série » selon un processus industriel homologué et stabilisé. Ces cellules seront ensuite proposées aux laboratoires de recherche. La recherche britannique sur les cellules souches est donc bien structurée et bénéficie de financements très importants. Cependant cette situation ne s'est pas encore traduite en résultats importants puisque, si un transfert nucléaire a abouti, il n'a pu en être dérivé de lignées de cellules souches. La priorité affirmée par le plan de décembre 2005 va conforter, voire augmenter, son avance. Il faut souligner l'approche pragmatique de l'ensemble de ces questions par la Grande-Bretagne. Ce pays est susceptible d'attirer dans l'avenir un nombre croissant de chercheurs non seulement de pays européens mais aussi du monde entier compte tenu des facilités offertes. Ce « tour d'Europe » montre la situation très contrastée dans laquelle se trouve l'Union européenne face à cette question des cellules souches embryonnaires. Seuls deux pays font des efforts importants : la Suède et la Grande-Bretagne à côté desquels la France fait pâle figure. Ces pays montrent la voie à suivre pour relever le défi des cellules souches. Ils rivalisent avec deux autres ensembles qui font des efforts significatifs dans ce domaine : les Etats-Unis et l'Asie. La politique fédérale restrictive laisse le champ libre à l'initiative privée et aux Etats, parmi lesquels la Californie fait un effort très important. Il n'y pas aux Etats-Unis de cadre réglementaire pour les cellules souches comparable à ce qui existe notamment en Europe. En effet aucun texte n'interdit, au niveau fédéral, la transposition nucléaire et le clonage reproductif. Le seul encadrement existant à ce niveau est celui procuré par les possibilités de financement fédéral des recherches. Contrairement à ce que l'on croit parfois, l'encadrement financier des recherches sur les cellules souches embryonnaires humaines n'a pas été établi par l'Administration Bush. Il remonte en effet à 1995, et au vote par le Congrès de l'amendement « Dickey » qui interdit l'utilisation des fonds fédéraux pour financer la recherche impliquant la création ou la destruction d'embryons humains. En conséquence, les travaux ayant mené à la dérivation de lignées de cellules souches humaines à l'Université du Wisconsin par James Thomson, et publiés en novembre 1998, furent-ils financés par la société Geron. A partir de cette époque, une certaine incertitude régna car, en janvier 1999, l'Administration américaine estimait que l'amendement Dickey ne pouvait pas s'appliquer à une recherche utilisant des cellules souches, celles-ci n'étant pas un embryon. Mais, le 25 août 2000, les lignes directrices (guidelines) des N.I.H. concernant la recherche sur les cellules souches embryonnaires excluaient de financer toute recherche impliquant la dérivation de lignées cellules souches à partir d'embryons. Le 9 août 2001, le Président Bush annonça que les fonds fédéraux permettraient de financer la recherche sur les cellules souches embryonnaires humaines mais que ce financement serait limité aux « lignées de cellules souches existantes pour lesquelles la décision de vie ou de mort avait déjà été prise ». Le Président justifia ce choix qui « permet d'explorer le potentiel des cellules souches sans outrepasser une frontière morale fondamentale, en assurant les contribuables que ces financements n'encourageront pas de futures destructions d'embryons humains qui ont la capacité de vivre ». Les critères d'éligibilité suivants furent donc établis : . les cellules souches doivent avoir été dérivées, avant le 9 août 2001, d'un embryon créé à des fins de reproduction, . si l'embryon n'a pas été utilisé à ces fins, . si un consentement éclairé a dû avoir été obtenu de la part des donateurs, . si aucune rétribution n'a été donnée. En conséquence de ces critères, les fonds fédéraux ne peuvent être utilisés pour financer des travaux portant sur : . la dérivation ou l'utilisation de cellules souches dérivées d'embryons nouvellement détruits, . la création d'embryons pour la recherche, . le clonage d'embryons humains pour quelque usage que ce soit. Pour faciliter l'utilisation des cellules souches, les N.I.H. ont créé une base de données (Human Embryonic Stem Cell Registry). Celle-ci liste les lignées, à des stades de développement variables, remplissant les critères d'éligibilité et pouvant donc faire l'objet de financements fédéraux. Il y, à l'heure actuelle, 22 lignées disponibles, provenant soit des Etats-Unis soit de l'étranger (Corée du sud, Inde, Israël, Singapour, Suède). Ces lignées sont appelées « présidentielles » aux Etats-Unis. Depuis cette époque, le débat est récurrent aux Etats-Unis sur la possibilité de faire financer par les fonds fédéraux les recherches sur les cellules souches embryonnaires. Cette problématique a été très débattue lors de la campagne pour les élections présidentielles de 2004. Elle pourrait de nouveau être évoquée au cours de la prochaine campagne de 2008. Ce débat a pris de l'ampleur dans la mesure où les lignées « éligibles » sont affectées, comme on l'a vu, d'un certain nombre de phénomènes qui les rendent de moins en moins impropres à la recherche et qu'elles ont été en contact avec des produits animaux. Des membres du Congrès ont manifesté à plusieurs reprises leur souhait que soit desserrée la contrainte pesant ainsi sur la recherche financée sur fonds publics. Le 18 juillet dernier, le Sénat américain a approuvé, de façon bipartisane, une proposition de loi déjà votée auparavant en juin 2005 à la Chambre des Représentants (Stem Cell Research Enhancement Act of 2005) tendant à étendre le financement par les fonds fédéraux aux lignées de cellules souches embryonnaires nouvellement dérivées. Comme on le sait, le Président Bush a opposé son veto le 19 juillet dernier à ce texte de loi. Il faut noter que le clivage traditionnel aux Etats-Unis entre Démocrates, plutôt partisans d'une ouverture vers plus de possibilités de financement public de cette recherche et Républicains, plutôt opposés à ces extensions, s'est modifié. En effet un certain nombre de Républicains ont abandonné les positions traditionnelles de leur parti en la matière, comme le montre l'action du Gouverneur de Californie, M. Arnold Schwarzenegger. Le résultat des dernières élections pourrait, selon des observateurs, relancer ce débat. b - L'organisation de la recherche : l'action des National Institutes of Health et des Universités _ Les National Institutes of Health (N.I.H.) Les N.I.H. financent la recherche sur les cellules souches adultes et sur les cellules souches embryonnaires humaines issues uniquement des lignées « présidentielles ». Les N.I.H. conduit une politique très active de mise en oeuvre de la politique fédérale, insistant sur le potentiel thérapeutique des cellules souches embryonnaires humaines. C'est ainsi qu'une « N.I.H. Stem Cell Task Force », présidée par M. James Battey, a été créée pour : . faciliter et accélérer les recherches sur les cellules souches en identifiant les facteurs qui limitent les recherches actuelles, . obtenir des conseils de scientifiques experts dans le domaine pour surmonter les freins actuels. Un des objectifs est d'élaborer un réseau scientifique de compétences qui permettra d'évaluer la stabilité génétique à long terme des lignées. La « NIH Stem Cell Unit » a été créée pour caractériser précisément les lignées humaines existantes et, comme on l'a vu, établir un registre à la disposition des chercheurs. Les N.I.H. financent à la fois des programmes (projets de recherche, études pilotes, études de faisabilité), des bourses post-doctorales ainsi que des ateliers de formation. Les financements ont été les suivants (en millions de dollars) :
Source : N.I.H. On voit que le total des sommes investies dans ce domaine de recherches croît régulièrement depuis 2002 de même que les sommes affectées aux cellules souches embryonnaires humaines. On note aussi que les cellules souches adultes se taille la part du lion des financements. _ Les Universités Un très grand nombre d'Universités conduisent des recherches dans ce domaine, à la fois sur les cellules souches adultes et embryonnaires. En matière de recherche sur les cellules souches humaines embryonnaires, les Universités ne peuvent bénéficier de financements fédéraux que si elles travaillent avec les lignées « présidentielles ». Il leur est possible de travailler sur des lignées « non présidentielles » mais uniquement avec des financements privés. Mais pour les laboratoires qui poursuivent en même temps des travaux bénéficiant de financements fédéraux et des activités n'y ouvrant pas droit, il est obligatoire de séparer très soigneusement, de façon physique, les matériels affectés à l'une et l'autre de ces deux catégories. Les N.I.H. font en effet des visites régulières pour s'assurer de cette séparation. La conséquence que j'ai pu observer dans ces laboratoires est une ubuesque séparation entre matériels destinés aux recherches « présidentielles » et les autres. Cette contrainte a un coût qui peut-être important. Ainsi, l'Université de Californie (San Francisco) est-elle en train de dépenser plus de 5 millions de dollars pour construire un laboratoire dupliquant un grand nombre d'installations déjà existantes pour se conformer à cette règle. L'Université Harvard a dû faire établir par des juristes un document établissant les règles de séparation des activités et du temps des chercheurs en fonction de leurs financements. Du fait de l'absence d'interdiction de la transposition nucléaire, deux Universités ont récemment fait part de leur intention d'y recourir, sur fonds privés, pour créer des lignées de cellules souches embryonnaires humaines à partir de cellules somatiques de personnes atteintes de diverses maladies. L'Université de Californie (San Francisco) va ainsi reprendre un programme qu'elle avait abandonné en 2001. L'Université Harvard va, quant à elle, essayer de créer des lignées de cellules souches embryonnaires affectées par le diabète juvénile, des maladies sanguines et la sclérose amyotrophique latérale. c - L'organisation de la recherche : Les Etats Un certain nombre d'Etats se sont engagés dans cette recherche. Du fait de la structure fédérale des Etats-Unis, les situations peuvent varier de façon extrêmement large. L'éventail des situations59 va, avec beaucoup de degrés intermédiaires, des Etats de Californie, du Connecticut, du Maryland, du New-Jersey, du Massachusetts, du New-Jersey et de l'Illinois, qui encouragent la recherche sur les cellules souches embryonnaires avec, généralement, l'autorisation de la transposition nucléaire, à celui du Dakota du Sud, qui interdit strictement toute recherche sur les embryons quelle que soit leur provenance. Les sommes fournies par les différents Etats peuvent grandement varier60 : . Connecticut : 10 millions de dollars par an pendant 10 ans, . Illinois : 10 millions de dollars pour une seule année (2005). En août dernier 5 millions de dollars supplémentaires seront affectés en 2007 au programme de recherche sur les cellules souches, . New-Jersey, premier Etat à avoir affecté, en 2004, des fonds pour cette recherche : 5 millions de dollars pour la création d'un nouvel institut de recherche. 23 millions de dollars sont prévus durant les années 2005 et 2006 pour le New Jersey Stem Cell Institute, . Maryland : 15 millions de dollars pour un nouveau fonds de recherche pour les cellules souches. Tous les Etats autorisant la recherche sur les cellules souches embryonnaires ont établi des règles de bonne pratique, la référence restant les principes (National Guidelines) de la National Academy of Science. Ces principes, largement admis et respectés par la communauté scientifique, sont des recommandations et non des obligations. Mais la Californie est l'Etat emblématique dans ce domaine. d - Le cas emblématique de la Californie Le 2 novembre 2004, les électeurs de Californie adoptaient, à près de 60% la Proposition 71 prévoyant la création d'un institut public de recherche sur les cellules souches embryonnaires doté de 300 millions de dollars par an sur 10 ans. Cette Proposition autorise l'Etat de Californie à vendre pour 3 milliards de dollars d'obligations sur dix ans pour financer la recherche sur les cellules souches en Californie. Elle institue le California Institute for Regenerative Medicine (C.I.R.M.), organisme qui distribuera des bourses et des prêts en faveur de la recherche sur les cellules souches. Cet institut est géré par une organisation appelée Independant Citizen's Oversight Committee (I.C.O.C.) composé de 29 membres : représentants des Universités californiennes, d'institutions de recherche, d'entreprises développant des thérapies médicales et d'associations de malades. Aussitôt après son adoption, des opposants à ce projet, des associations spécialisées d'une part dans la lutte contre l'avortement et, d'autre part, dans la défense des intérêts financiers des contribuables, ont interjeté des recours. Les plaintes portaient sur le fait que l'adoption de la Proposition 71 va à l'encontre des intérêts des contribuables et violerait la Constitution de l'Etat de Californie. Selon ces associations, les financements seraient distribués par un organisme peu contrôlé par l'Etat californien et trop proche de l'industrie des biotechnologies. Un certain nombre d'élus californiens que j'ai rencontrés, m'ont fait part, tout en étant favorables à cette Proposition, de leur souci que l'Etat de Californie exerce un meilleur contrôle sur le dispositif financier qui va être mis en place. Le 24 avril dernier les plaignants ayant été déboutés de leur demande de déclarer la Proposition inconstitutionnelle, ont fait part de leur intention de saisir la Cour Suprême de Californie. Cependant le C.I.R.M. a présenté, le 10 octobre dernier, à l'I.C.O.C. son projet de plan stratégique. Ce plan fixe les objectifs à long terme pour les dix ans à venir. Il propose de financer 25 mesures en matière de cellules souches et d'y affecter les financements suivants : 823 millions de dollars pour développer la recherche fondamentale en biologie cellulaire, 899 millions de dollars pour la recherche et le développement pré-clinique, et 656 millions de dollars pour les essais cliniques, 273 millions étant alloués pour la rénovation et la construction de laboratoires de recherches. Ce plan fixe des objectifs à cinq et dix ans pour permettre de mesurer les progrès accomplis. Malgré les difficultés et les retards engendrés par les procès, de nombreuses initiatives sont prises par les Universités et les Instituts californiens pour créer de nouveaux centres de recherches afin de bénéficier des fonds issus de la Proposition 71. La Californie présente à l'heure actuelle aux Etats-Unis une attractivité indéniable sur les chercheurs en biologie cellulaire. Nombre d'autres Etats ont perçu cette attractivité, ce qui les a sans doute stimulés pour offrir à leur tour des financements attrayants pour la recherche en matière de cellules souches. L'action menée en Californie et dans un nombre croissant d'Etats permettra peut-être de contrebalancer la portée négative des mesures prises par le Président Bush le 9 août 2001. En effet, beaucoup d'observateurs estimaient que ces décisions avaient eu des conséquences plutôt négatives comme le montre la diminution, ces deux dernières années, du nombre de publications américaines dans ce domaine de recherches. Un phénomène d' « exode des cerveaux » avait aussi commencé avec, notamment, le départ de M. Roger Pedersen, ancien chercheur à l'Université de Californie (San Francisco) qui avait isolé les premières cellules souches embryonnaires murines. M. Roger Pedersen est devenu, en 2001, le directeur du centre de biologie et de médecine des cellules souches de l'Université de Cambridge (Grande-Bretagne). L'Asie m'a été présentée par beaucoup de mes interlocuteurs comme le continent où les recherches sur les cellules souches et, spécialement les cellules souches embryonnaires humaines, pourraient connaître des succès importants. En effet, les biotechnologies et les sciences médicales sont au cœur de la stratégie de développement de beaucoup de pays asiatiques. La recherche sur les cellules souches semble d'autant plus intéressante qu'aucune percée fondamentale n'a encore été effectuée et que beaucoup de nations importantes sur le plan scientifique, je pense notamment à l'Europe, sont très réticentes à s'engager dans ce domaine. Certains spécialistes pensent même que la thématique des cellules souches pourrait constituer pour l'Asie la première occasion de dominer un domaine de recherche en biologie. Ces pays me semblent être potentiellement particulièrement compétitifs dans ce domaine des cellules souches, compte tenu de l'excellent niveau de leurs scientifiques et de l'adhésion très large de leurs populations aux objectifs de la science. Un certain nombre de questions éthiques ne sont pas abordées non plus de la même façon que dans les pays occidentaux, dans la mesure où les conceptions morales sont très différentes. De ce fait, ces pays paraissent très attractifs à un certain nombre de chercheurs occidentaux. La recherche est soutenue dans ces pays par des scientifiques de très bonne qualité qui ont été formés surtout aux Etats-Unis. De ce point de vue il ne faudrait cependant pas penser que tout souci éthique est banni. Ainsi la Chine, Singapour, Taïwan et la Corée du sud ont-ils, par exemple, interdit le clonage reproductif. Cependant cette attirance va peut-être diminuer, compte tenu de la mise en place du programme californien de recherche sur les cellules souches. J'évoquerai seulement la situation à Singapour et au Japon, la Corée du sud faisant l'objet du prochain chapitre. Depuis 2000, Singapour a placé les domaines des sciences biomédicales et des biotechnologies au centre de sa stratégie de développement. Les cellules souches ont été reconnues comme étant un domaine à fort potentiel économique, et Singapour se positionne aujourd'hui comme un centre de recherches de niveau international. Une réglementation a été mise en place, et des financements importants ont été apportés pour soutenir les acteurs de la recherche. _ La réglementation Un cadre légal et éthique a été défini en 2000 pour la recherche sur les cellules souches. Singapour entend tirer parti de la politique restrictive des Etats-Unis, et attirer davantage de chercheurs, en leur offrant un cadre législatif attractif pour développer la recherche dans ce domaine. La législation est celle instituée par le « Human Cloning and Other Prohibited Practices Act ». Le clonage humain reproductif est formellement interdit, ainsi que l'exportation et l'importation d'embryons clonés, et la commercialisation d'embryons, d'ovocytes et de sperme humains. La transposition nucléaire est autorisée. Elle permet la recherche sur les embryons humains, tant que ceux-ci n'ont pas plus de 14 jours. Un certain nombre de règles sont également posées parmi lesquelles on peut relever : . l'information des donneurs d'embryons et de gamètes, ainsi que leur consentement sont requis, . l'utilisation et la dérivation de cellules souches embryonnaires doivent être justifiées par un enjeu scientifique et un bénéfice potentiel, .une autorité spécifique délivre les licences et assure le suivi et le contrôle de recherche sur les cellules souches humaines. Les investissements suivants ont été effectués dans ce domaine61 : . La dépense annuelle de Singapour, en matière de recherche sur les cellules souches est estimée à 40 - 45 millions de dollars de Singapour, soit environ 20 - 22,5 millions d'euros, dont environ 7,5 millions d'euros pour le secteur public, et 12,5 - 15 millions d'euros pour le secteur privé, . 70 millions de dollars Singapour, soit environ 35 millions d'euros ont été investis dans le « Singapore Stem Cell Consortium», . l'Economic Development Board, qui est chargé de la stratégie visant à faire de Singapour un lieu de passage obligé pour les affaires et l'investissement, y compris en matière de recherche privée, a investi 37 millions de dollars de Singapour, soit environ 18,5 millions d'euros dans la société ES Cell International. Un nombre assez important d'acteurs intervient dans ce domaine. Parmi ces organismes, on relève, en matière de recherche publique, outre l'Université de Singapour et l'Hôpital Général de Singapour, la création en 2005 du Singapore Stem Cell Consortium. Celui-ci a été créé pour coordonner et développer la recherche en cellules souches à Singapour. Il est en particulier chargé de mettre en place les ressources communes dans le domaine, comme un laboratoire d'étude des cellules souches, une banque de cellules souches et un complexe de procédés de thérapies cellulaires. Il permet de rassembler les différents groupes de recherche fondamentale et clinique dans des projets communs. La recherche privée est représentée par quatre sociétés, dont la plus importante est ES Cell International, créée en 2000 pour vendre les produits et les technologies issus de la recherche sur les cellules souches. Comme toutes les sociétés comparables, celle-ci n'a actuellement rien à vendre. Mais elle détient la propriété intellectuelle de plusieurs lignées de cellules souches, dont six sont enregistrées par le N.I.H. Stem Cell Registry, et de techniques de culture. Singapour fait donc preuve d'une politique volontariste dans ce domaine. Un niveau scientifique incontestable a été atteint aussi bien dans le secteur public que privé. Des implantations étrangères se sont développées, comme, depuis 1998, une division de recherche biomédicale et un centre clinique de l'Université John Hopkins, et la signature d'un accord de recherche sur les cellules souches avec l'U.S. Juvenile Diabetes Research Foundation International. Le cadre réglementaire a été défini relativement tôt au Japon, ce qui a permis le développement d'une recherche publique dynamique. _ Le cadre réglementaire Le cadre réglementaire de la recherche sur les cellules souches s'est élaboré depuis 2000. En 2000, le Japan's Council for Science and Technology publiait un rapport sur la recherche sur les cellules souches humaines qui : . approuvait la recherche sur les cellules souches humaines en utilisant les embryons surnuméraires issus de processus de fécondation in vitro, . proscrivait le clonage reproductif humain, . faisait des recommandations sur l'approbation des recherches menées dans le cadre de projets soutenus par les fonds publics. En 2001, la loi « concernant les techniques de clonage et autres techniques similaires appliquées à l'Homme » : . prohibait de façon expresse le clonage humain reproductif, . rendait nécessaire la publication par le ministère de l'Education, qui a la tutelle des recherches, de publier des principes directeurs (guidelines) nationaux pour la création d'embryons à des fins de recherche. Cette loi n'interdisait pas la transposition nucléaire, des instructions du Gouvernement la déconseillant fortement par ailleurs à cette époque. Par contre cette loi autorisait la création de cellules souches embryonnaires humaines à des fins thérapeutiques sous contrôle du gouvernement. Les centres de recherches étaient habilités par le Council for Science and Technology qui doit donner son aval au début des programmes de recherche et peut décider de l'interrompre à n'importe quel moment. Enfin en 2004, la transposition nucléaire était autorisée après un avis favorable du Japan's Council for Science and Technology mais nécessite encore l'établissement de règles de bonnes pratiques. _ La recherche Dans le cadre du Millenium Project de 2000, le Japon a fait de la médecine régénératrice, notamment dans le cadre de la lutte contre les effets du vieillissement, l'une de ses priorités en matière de science de la vie. Il a été décidé de concentrer tous les efforts du pays dans ce domaine sur un seul pôle localisé dans la région du Kansaï autour d'Osaka, Kyoto et Kobé. La recherche japonaise met l'accent sur le développement de la recherche biologique fondamentale et le développement des techniques utilisant des modèles animaux. Elle s'appuie sur une synergie bien articulée entre les établissements de recherche fondamentale, des centres de développement de technologies industrielles, des hôpitaux pour la recherche appliquée et une industrie émergente. Deux centres dominent cette recherche : le RIKEN Centre for Developmental Biology et le Frontier Institute of Biomedical Research de l'Université de Kyoto. Le RIKEN Centre forDevelopmental Biology, créé en 2002, se consacre à deux thèmes fondamentaux : la biologie du développement et la médecine régénératrice dans le cadre du soutien à la population vieillissante du Japon. Il a un programme très important dans le domaine des cellules souches : marqueurs moléculaires, facteurs de différenciation, maintien dans le stade indifférencié, induction en cellules nerveuses... Trois projets utilisant les cellules souches embryonnaires humaines ont été approuvés en 2005. Il rassemble 30 équipes de recherche réunissant 400 chercheurs et 160 techniciens. Son budget annuel est d'environ 50 millions d'euros. L'Université de Kyoto, quant à elle, travaille sur l'isolement et la caractérisation de lignées de cellules souches embryonnaires humaines. Ce travail s'effectue au sein de l'Institut de recherche sur la médecine régénératrice, qui a été créé en 1998 et où a été établi en 2002 le Centre de recherche sur les cellules souches. Actuellement, seul le laboratoire de M. Norio Nakatsuji de l'Université de Kyoto est autorisé à créer des lignées de cellules souches au Japon. C'est un ensemble important de 13 laboratoires regroupés en trois divisions rassemblant 300 personnes dont 40 professeurs. La recherche qui y est menée est intermédiaire entre la recherche fondamentale et les applications cliniques. Trois lignées de cellules souches y ont été créées en utilisant des embryons congelés. Pour 2006, M. Norio Nakatsuji m'a indiqué qu'il était envisagé de créer une dizaine de nouvelles lignées. Il est prévu que celles-ci seront transférées à l'ensemble des laboratoires japonais afin de favoriser les recherches au sein de l'industrie pharmaceutique. Un certain nombre de projets existent dans ce domaine et, notamment, celui de la création d'une banque de cellules souches embryonnaires. Si le bilan de la recherche japonaise est ainsi très positif, un certain nombre de difficultés existent. Selon M. Norio Nakatsuji, il y a d'abord le problème du retard de la publication des règles de bonne pratique nécessaires pour l'application de législations concernant la transposition nucléaire. Il a aussi souligné la longueur de l'attente (un an) des approbations gouvernementales et scientifiques pour utiliser les cellules souches embryonnaires humaines. Enfin se posent au Japon les questions de la définition de l'embryon, de l'utilisation des cellules souches des embryons créés à l'occasion des fécondations in vitro, de celles des embryons recueillis à l'occasion des I.V.G., du problème du don d'ovocytes, de la marchandisation possible en cas de succès de ces techniques... Je pense qu'il faut retenir de la situation japonaise, outre la qualité de la recherche qui est menée, l'existence d'une forte volonté des pouvoirs publics de soutenir ce domaine et le choix de concentrer géographiquement les moyens qui s'avère tout à fait positif. La Corée du sud et les développements de l' « affaire Hwang » été à la une de tous les journaux pendant une bonne partie de l'année 2005. Chacun connaît le dénouement de cette affaire mais il est utile de revenir sur son déroulement. J'esquisserai ainsi un historique de l'affaire centrée autour de M. Hwang Woo-suk, de l'ascension à la chute, avant d'en envisager les conséquences. 1 - L'ascension de M. Hwang Woo-suk Il y a certainement au départ de toute cette affaire la volonté du gouvernement de faire de la Corée le pays le plus en pointe dans le domaine des cellules souches. On peut penser qu'il y a eu aussi le souhait de profiter de la situation créée aux Etats-Unis par la décision du 9 août 2001. Le ministère chargé de la science et de la technologie a lancé en 1999 un programme (21st Century Frontier R&D Programme) pour développer la compétitivité scientifique et technologique de la Corée dans le secteur des sciences émergentes. Un centre de recherche sur les cellules souches embryonnaires est établi en juillet 2002. Il est prévu que les sommes qui y seront affectées jusqu'en 2012 seront de l'ordre de 150 millions de dollars, 122 millions étant fournis par le secteur public, le reste par le privé. L'objectif est de découvrir, à l'horizon 2012, plus de 100 sortes de facteurs induisant la différenciation cellulaire et plus de 10 sortes de voies de différenciation cellulaire. Le président de ce centre est M. Moon Shin-yong de l'Université de Séoul, M. Hwang Woo-suk participant aussi à ce travail. En février 2004, M.Hwang Woo-suk et l'équipe de M. Moon Shin-yong annoncent la création d'embryons humains par transposition nucléaire à partir desquels, pour la première fois dans l'histoire, des cellules souches embryonnaires sont obtenues. Cette « première » fait l'objet d'une publication dans la revue Science du 12 mars 2004. Entre temps, le cadre législatif de ces recherches a été précisé par la loi du 29 janvier 2004 sur la sécurité et la bioéthique, mais qui entre en vigueur le 1er janvier 2005. Ce texte interdit strictement le clonage reproductif. La recherche sur la transposition nucléaire est autorisée compte tenu des règles de bonne pratique édictées par le Comité national d'éthique. Il est prévu que le don d'ovocyte ne doit pas être rémunéré. Après la publication de février 2004, M.Hwang Woo-suk devient une personnalité surmédiatisée. Les financements affluent. Outre des dons privés qui atteignent la somme de 1,2 million de dollars, les deux ministères chargés de la santé et de la recherche et de la technologie financent, en 2005, les projets suivants : - Frontier Program : Centre de recherche sur les cellules souches : 9,8 millions de dollars - Université Nationale de Séoul (Laboratoire de M. Hwang Woo-suk) : 2,95 millions de dollars - Institut des cellules souches et de thérapie génique : 1,4 million de dollars Des financements complémentaires vont être alloués à M. Hwang Woo-suk par le ministère de la science et de la technologie : 2,95 millions de dollars par an pendant cinq ans. D'autres sommes lui sont attribuées par ce ministère, notamment 2,45 millions de dollars pour la réalisation d'un porc transgénique cloné utilisable pour la xénotranplantation. Le 17 juin 2005 la revue Science publie un nouvel article. Celui élaboré en mai 2005 est signé par M. Hwang Woo-suk et vingt-quatre autres personnes, dont M. Gerald Schatten de l'Université de Pittsburgh, dernier signataire, et donc garant scientifique de l'article. Les auteurs exposent qu'ils ont réussi à produire 11 lignées de cellules souches embryonnaires humaines immunologiquement compatibles avec les patients auxquels elles sont destinées. C'est alors la célébrité mondiale. Les chercheurs que j'ai rencontrés m'ont tous dit avoir été persuadés d'avoir affaire à une percée fondamentale. Personne n'a eu alors de doutes quant à la réalisation effective des résultats décrits dans les articles successifs de Science. Un grand nombre de chercheurs étrangers vont alors en Corée pour rencontrer M. Hwang Woo-suk et visiter son laboratoire. Beaucoup sont très impressionnés. Ainsi M. Marc Peschanski m'a indiqué qu'à son avis il y avait un savoir faire évident de la part d'un personnel très habile. Même si M.Hwang Woo-suk n'avait pas élaboré de concept original, il était alors crédité d'une vraie technicité. En août 2005, M. Hwang Woo-suk attire de nouveau l'attention en annonçant la naissance du premier chien créé par transposition nucléaire à partir de cellules souches adultes. Cette nouvelle fait la « une » de la revue Nature du 4 août 2005. Sur la lancée des résultats obtenus en mai et août 2005, un centre mondial de recherches sur les cellules souches (World Stem Cell Hub) est inauguré le 19 octobre 2005. M. Hwang Woo-suk en est nommé président. Il est alors prévu que ce centre aura des implantations en Grande-Bretagne et aux Etats-Unis. A cette occasion, le Président de la Corée affirme le soutien du gouvernement aux efforts de recherche sur les cellules souches pour augmenter la qualité des services médicaux et faire de l'industrie médicale coréenne une industrie stratégique. La création d'une banque internationale de cellules souches est également envisagée. M. Hwang Woo-suk est alors au faîte de sa gloire. Mais la chute sera rapide. 2 - La chute de M. Hwang Woo-suk Ces évènements sont encore très récents et assez largement connus tant la presse les a relatés, aussi les résumerai-je assez brièvement62. A partir du 12 novembre 2005, les évènements se succèdent à un rythme rapide. Le 12 novembre 2005, M. Gerald Schatten annonce qu'il interrompt toute collaboration avec M.Hwang Woo-suk ayant appris que des manquements à l'éthique entachait l'article de 2004. Le 21 novembre 2005, M. Sun Il Roh, co-signataire de l'article de Science de 2005, reconnaît qu'une partie des donneuses des ovocytes nécessaires pour le travail de 2004 ont été rémunérées. Une chaîne de télévision coréenne confirme que des étudiantes du laboratoire de M.Hwang Woo-suk ont bien donné des ovocytes. Le 24 novembre 2005, M. Hwang Woo-suk reconnaît que les ovocytes utilisés avaient été en partie fournis par des étudiantes de son laboratoire et que d'autres femmes avaient été rémunérées pour leurs ovocytes. Il démissionne de son poste de président du World Stem Cell Hub. Au début de décembre 2005, deux commissions d'enquête de l'Université de Séoul et du ministère de la santé blanchissent M.Hwang Woo-suk des accusations de manquement à l'éthique. Par contre, des rumeurs commencent à circuler sur la nature des photos des articles de 2004 et 2005 qui sont examinées. Une commission d'enquête de l'Université Nationale de Séoul est mise en place. Le 13 décembre 2005, M. Gerald Schatten demande à Science de retirer sa signature de l'article de 2005, estimant que des éléments de celui-ci ont été fabriqués de toutes pièces. Dans les jours suivants, M.Hwang Woo-suk démissionne de toutes ses fonctions officielles et reconnaît progressivement un certain nombre d'« erreurs » dans les publications successives. Le 16 décembre 2005, M.Hwang Woo-suk reconnaît que son laboratoire ne possédait que huit lignées de cellules souches quand il a soumis son article de 2005 à Science. Il déclare qu'il a demandé à Science de le retirer. Il a prétendu que certaines cellules souches ont été interverties. Le 20 décembre 2005, un premier rapport de la commission d'enquête révèle que les résultats de l'article de 2005 ont été délibérément falsifiés et que seulement deux lignées de cellules souches existent sur les 11 revendiquées. Le 23 décembre 2005, l'Université Nationale de Séoul révèle qu'au moins neuf des onze lignées cellulaires revendiquées sont fausses. Une investigation est lancée sur les autres principaux articles de M.Hwang Woo-suk qui démissionne de son poste de professeur. Le 29 décembre 2005, l'enquête universitaire déclare que les deux lignées restantes sont également fausses. Les cellules souches revendiquées ont été obtenues à partir d'embryons produits par fécondation in vitro. Le 10 janvier 2006, l'Université Nationale de Séoul affirme que M.Hwang Woo-suk a falsifié les données de l'article de 2004, en prétendant avoir obtenu des cellules souches embryonnaires humaines par transposition nucléaire. Par contre elle confirme le caractère cloné du chien. Le même jour, la direction de Science annonçait qu'elle retirait officiellement les deux études signées par M. Hwang Woo-suk. Enfin, en juin 2006, M. Hwang Woo-suk était inculpé par la justice coréenne de fraude, détournement de fonds et violation des lois sur la bioéthique. Comme je l'avais indiqué dans un communiqué du 11 janvier 2006, « l'affaire Hwang » est un problème d'honnêteté scientifique qui doit être traité en tant que tel, de façon complètement indépendante du domaine considéré. Elle ne doit donc pas jeter l'opprobre sur tout ce secteur de la recherche fondamentale que constituent les cellules souches embryonnaires humaines. Présent à ce moment en Corée, je peux témoigner de l'effervescence que produisait cette affaire dans ce pays où beaucoup de gens voulaient croire que des progrès extraordinaires étaient en train d'être accomplis, dans leur pays, pour pouvoir guérir des maladies aujourd'hui incurables. J'ai pu mesurer combien cet évènement a bouleversé la société coréenne qui « croyait » véritablement en M. Hwang Woo-suk. Il est indéniable que celui-ci a été l'objet de pressions très importantes de la part des pouvoirs publics coréens. Ceux-ci, outre la renommée internationale pour le pays, espéraient pouvoir mettre en place un secteur biotechnologique très important qui aurait pu être la source d'un pouvoir économique considérable. La possibilité de détenir un grand nombre de brevets sur les techniques de la transposition nucléaire et sur la dérivation de lignées de cellules souches embryonnaires humaines a certainement joué un rôle très important. Les Coréens, à l'époque de la « splendeur » de M. Hwang Woo-suk, avaient revendiqué le brevetage des techniques présentées comme mises au point. Il semblerait d'ailleurs que le problème de l'appropriation des brevets de ces techniques aurait joué un rôle important dans la rupture des relations entre M. Gerald Schatten et ses partenaires coréens. Il règne en effet dans le domaine des cellules souches embryonnaires une compétition considérable. Une situation analogue existait à l'époque de la « course » au décryptage du génome humain, compte tenu des enjeux que représentaient les brevets. Par contre, les situations ne sont pas entièrement comparables. La différence la plus importante est la position de retrait de l'Etat fédéral aux Etats-Unis qui a engendré une sorte de « vide » permettant ainsi aux « petits pays » de s'engouffrer dans cette brèche. Ce type de recherche n'a pas besoin de l'infrastructure massive qu'a requis le décryptage du génome notamment en moyens informatiques. Il nécessite surtout des moyens intellectuels qui peuvent se déplacer sur tous les points de la planète, pourvu que l'offre soit attrayante. C'est le pari des autorités de Singapour ou de la Californie. Cela a certainement aussi été la volonté des autorités de Corée du sud. Le pays qui aura su attirer les meilleures équipes pourrait devenir une grande puissance dans ce domaine. Cette affaire a aussi jeté un éclairage cru sur la médiatisation à outrance de la science, ce que M. Jacques Testart a appelé la « science spectacle63 », situation qui a déjà été évoquée dans ce rapport. Autre différence avec le décryptage du génome, cette affaire coréenne a mis l'accent sur le problème éthique des dons d'ovocytes pour la recherche. C'est en effet l'un des défis que devra affronter la recherche sur les cellules souches. Cinquième partie : La poursuite de la recherche sur les cellules souches nécessite d'apporter des réponses à quatre grandes questions : un défi éthique, une question sociale, un défi économique, la question de la brevetabilité des cellules souches et ses possibles conséquences. Deux questions importantes se posent ici : le problème de la fraude scientifique et celle des ovocytes humains pour la recherche. 1 - Les publications scientifiques La fraude scientifique n'est pas un problème récent et elle n'est pas apparue à l'occasion de l' « affaire Hwang ». La définition adoptée par l'Office of Research Integrity dépendant du ministère de la santé des Etats-Unis (US Department of Health and Human Services) distingue trois cas différents de fraude scientifique: . la fabrication de données ou de résultats conduisant à l'invention pure et simple de résultats scientifiques, . la falsification de données et de résultats entraînant la rectification ou la sélection de résultats expérimentaux afin de « mieux » faire coïncider résultats et prédiction d'une théorie, . le plagiat. Historiquement des fraudes scientifiques ont toujours existé. Le cas le plus célèbre est certainement celui de Gregor Mendel qui a découvert les lois de l'hérédité en, c'est l'opinion la plus couramment admise, « arrangeant » les résultats de ses expériences en fonction de la théorie dont il avait eu l'intuition. On rappellera aussi l'affaire de la « mémoire de l'eau », expérience publiée dans la revue Nature, mais jamais prouvée. Un autre cas, non de fraude, mais d'appropriation indue des mérites d'autrui est l'aveu récent de M. Ian Wilmut que le principal travail ayant abouti à la naissance de la brebis Dolly n'a pas été effectué par lui mais par un autre chercheur. On peut également citer la supercherie élaborée aux laboratoires Bell, aux Etats-Unis, par Jan Hendrick Schön qui avait publié des articles dans Nature et Science en présentant des résultats contrefaits qui avaient pour conséquence de révolutionner la supraconductivité et l'électronique. Il semble que ces comportements frauduleux soient assez répandus comme le montrent les résultats de l'enquête menée anonymement par trois chercheurs américains auprès de 3247 de leurs collègues des N.I.H. et publiée dans Nature64. Selon celle-ci, il s'avère que 0,3% des chercheurs admettent avoir inventé de toutes pièces des données, 1,7% reconnaissent avoir plagié des collègues, 6% admettant n'avoir pas publié les données contredisant leurs recherches. Une autre réponse inquiétante est le fait que 15,5% ont déclaré avoir modifié leur protocole expérimental sous la pression de leurs sources de financement. Ce problème de la fraude scientifique devient préoccupant. La raison est connue de tout le monde. Selon une formule devenue banale mais qui en contient toute l'explication, les chercheurs doivent « publier ou périr ». Faute en effet de faire paraître des articles dans les revues spécialisées, les chercheurs se condamnent à l'obscurité vis-à-vis tant du grand public que de leurs pairs qui ne les citeront pas dans la bibliographie toujours plus abondante accompagnant chaque article. Ces bibliographies sont en effet devenues, au fil du temps, un des principaux indices de notoriété des chercheurs ou des organismes de recherche et, partant, une des bases des comparaisons internationales de l'efficacité des politiques de recherche des différents pays. Cette notoriété basée sur les articles de revue est devenue la condition non seulement de la reconnaissance mais aussi, et surtout, des avancements hiérarchiques et des attributions de crédits. Au-delà de la fraude caractérisée, l'arrangement des résultats ou leur annonce biaisée devient aussi préoccupant. La dernière affaire en la matière est celle concernant M. Robert Lanza, que j'ai déjà évoquée. Cette affaire vient de connaître un rebondissement très récent. L'équipe de la société Advanced Cell Technology dirigée par M. Robert Lanza avait en effet annoncé avoir réussi à dériver des lignées de cellules souches embryonnaires à partir d'une seule cellule prélevée sur 16 embryons sans les détruire. Ces résultats avaient été publiés le 23 août dernier par la revue Nature. Ce même jour, une première rectification indiquait que plusieurs cellules, et non pas une, avaient, en réalité, été extraites des embryons. Le 25 août, un deuxième rectificatif indiquait que « les embryons n'étaient pas restés intacts. » En effet, il s'est avéré que les 16 embryons avaient été détruits pour en extraire 91 cellules. Le 23 novembre dernier, Nature a publié une version corrigée de cette publication dans laquelle M. Robert Lanza et ses collaborateurs ont reconnu d'une part avoir prélevé plusieurs cellules sur les embryons et, d'autre part, la destruction des embryons. Deux lignées ont été créées. Cette affaire n'est pas une fraude au sens de celle de M. Hwang Woo-suk mais est, au moins, un mensonge. Elle appelle un certain nombre de commentaires. Tout d'abord, il ne s'agit pas d'une percée, car prélever une seule cellule sur un embryon humain sans le détruire n'est plus un exploit. En effet c'est tout simplement la technique du prélèvement pour effectuer un diagnostic préimplantatoire. Ensuite, c'est une affaire qui doit être resituée dans le contexte des Etats-Unis. En effet les fonds fédéraux ne pouvant pas financer des recherches impliquant la destruction d'embryons, un succès, tel que celui revendiqué, pourrait permettre la création de nouvelles lignées de cellules souches embryonnaires avec des fonds publics. Il faut cependant observer que le même raisonnement pourrait s'appliquer au niveau européen compte tenu des réticences existant dans l'Union européenne envers la dérivation de lignées impliquant la destruction d'embryons. On a pu, à la fin du mois d'août, noter l'enthousiasme avec lequel la nouvelle du succès de ces travaux avait été accueillie par la presse généraliste. Cependant, il me semble nécessaire de garder sa confiance aux revues scientifiques et j'approuve la position de M. Jean-Yves Nau qui écrit65 : « Quel crédit faut-il accorder au sérieux des travaux publiés dans les revues scientifiques de réputation internationale et leurs capacités d'expertise ? Une totale confiance dans la majorité des cas. » Il n'en reste pas moins que ces revues sont confrontées à une situation difficile, comme nous le verrons dans le paragraphe suivant. Enfin cette affaire, survenant après d'autres, révèle à quel point ces cellules souches embryonnaires sont l'objet d'une compétition internationale intense car les enjeux économiques sont considérables. C'est souligner la nécessité, pour la France et pour l'Europe, d'effectuer un effort considérable dans ce domaine. Elle fait aussi percevoir à quel point il y a un danger à laisser les entreprises privées faire l'essentiel de cette recherche. Car ces entreprises, n'ayant rien à vendre, doivent pouvoir réunir des capitaux et soutenir le cours de leurs actions : elles en sont d'autant plus incitées à annoncer des résultats qui n'existent pas, ou des résultats biaisés. b - La validation des publications scientifiques La première étape après l'acquisition d'un résultat paraissant intéressant par un chercheur est la rédaction d'un article soumis tout d'abord à ses collègues et à sa hiérarchie. Il est ensuite adressé à une revue qui fera procéder, en principe, à une relecture et à une évaluation par des spécialistes de haut niveau (les referees) qui doivent être capables de déceler les erreurs ou les aberrations. Il existe un nombre très élevé de revues scientifiques et techniques, de l'ordre de 200 000, publiant environ 25 millions d'articles. Naturellement elles ont une notoriété différente et, sans conteste, ce sont Nature et Science qui sont les plus renommées. Ce sont elles qui ont ce qu'on appelle le « facteur d'impact » le plus élevé : ce sont leurs articles qui sont le plus généralement cités et aussi celles qui sont les canaux d'information majeurs de la presse généraliste, notamment à travers leurs sites électroniques. Ces revues sont des entreprises privées et sont en réalité engagées dans une très forte concurrence. Elles sont, de ce fait, parfois tentées d' « accélérer » le processus de relecture afin de bénéficier d'une publication plus rapide, au risque de ne pas détecter des anomalies. Les relecteurs peuvent aussi être de bonne foi en laissant passer des erreurs. En effet, ils doivent toujours se contenter d'examiner la cohérence des résultats avec les données qui leur sont communiquées et celle des conclusions. Ils ne peuvent en effet accéder, ni à l'intégralité des données et des résultats primaires, ni aux méthodes utilisées pour les obtenir. Comme l'a indiqué Mme Debra JH Mathews, le 7 mars 2006, lors d'une audition au Congrès américain consacrée à ces problèmes d'éthique dans la recherche : « la revue par les pairs peut déceler la mauvaise science et la mauvaise fraude, mais pas la « bonne » fraude. Si quelqu'un veut tromper de façon intentionnelle et le fait habilement, il est très difficile de le découvrir ». L' « affaire Hwang» a parfaitement illustré cet état de fait, malgré un redoublement d'attention de la part de la revue Science. C'est ainsi que M. Donald Kennedy, rédacteur en chef de cette publication, a admis66 que, dans l' « affaire Hwang», la « procédure [de relecture] a été intensifiée comme nous le décidons dès lors que l'objet de la publication est soit de nature controversée, soit peut avoir des conséquences aussi importantes qu'imprévues ». c - Comment lutter contre les fraudes ? Dans l'intérêt de la science et de la confiance du public envers elle des mesures doivent être instaurées pour dissuader de telles fraudes. La difficulté est d'imposer des contraintes aux revues, organismes privés, qui demeurent libres de publier. On peut suggérer qu'elles rendent obligatoires à tous les auteurs d'une étude (l'article de Science de 2005 était cosigné par M. Hwang Woo-suk et 24 personnes !) d'indiquer quelle est la contribution respective de chacun. C'est déjà la politique de la revue The Lancet. La validation absolue d'une expérience nouvelle étant sa reproduction par un laboratoire indépendant, il pourrait être très utile de faire part également, dans ces revues, de la réussite ou de l'échec de la reproduction de l'expérience. Un certain nombre de propositions pourraient permettre de lutter contre cette fraude scientifique. Ainsi M. Marc Peschanski a suggéré de développer des forums de publications en ligne en accès libre (open access), sur Internet, pratique déjà ancienne en physique et en mathématiques. C'est ainsi que M. Harold Varmus a créé, il y a deux ans, le site Public Library of Science (PLoS) en accès libre. Les chercheurs publiant sur ce site s'exposent ainsi directement à la critique de leurs pairs. Je suggère que tout auteur d'une publication s'avérant fausse ou reposant sur des bases sciemment erronées ou truquées, ou pour toute autre raison démontrant une volonté de fraude, soit sanctionné par la suppression des subventions publiques, nationales ou européennes, dont il pourrait bénéficier. Ce sera une recommandation de ce rapport. Je pense aussi qu'il est indispensable d'instaurer, au cours de la formation de tous les étudiants, par exemple au niveau du master, quelle que soit leur spécialité, un enseignement de l'éthique de la recherche. Ce sera également l'une de mes recommandations. 2 - Les ovocytes humains pour la recherche Le succès éventuel de la transposition nucléaire nécessitera la disposition d'ovocytes humains. Tous mes interlocuteurs ont insisté sur cette question et ont reconnu qu'il serait difficile d'en disposer en grande quantité. Un certain nombre de tentatives ont été faites pour éviter l'utilisation d'ovocytes humains compte tenu des risques liés au don et surmonter les problèmes éthiques. Les règles pour éventuellement autoriser ce type de don devront être soigneusement examinées. a - Eviter l'utilisation d'ovocytes humains Un certain nombre de chercheurs ont déjà essayé de trouver des substituts à ces ovocytes. Actuellement ces tentatives n'ont pas été couronnées de succès. Une étude parue dans Science67 a rapporté le succès de la dérivation d'ovocytes à partir de cellules souches embryonnaires de souris. Malheureusement ce résultat n'a pu jamais pu être reproduit. Cette voie devrait faire l'objet de recherches intensives. Ce sera une recommandation de ce rapport. La cryoconservation des ovocytes est aussi envisagée. Mais cette technique se trouve encore en phase expérimentale car il est difficile de les congeler. Une autre possibilité résiderait dans l'utilisation des cellules générant les ovocytes. Ces derniers, à l'état immature, seraient prélevés sur des embryons, des fœtus issus d'avortements ou dans des fragments d'ovaires notamment à l'occasion d'opérations. Ils seraient ensuite amenés à maturation in vitro. Mais ceci est actuellement irréalisable. Une autre voie qui pourrait être explorée est celle de la création, à des fins de recherche, de chimères en fusionnant par exemple des cellules humaines avec des ovocytes animaux. Cette opération aurait été déjà réalisée en Chine. Un journal britannique68 a récemment fait état d'une demande d'autorisation qui aurait été faite à la Human Fertilisation and Embryology Authority par trois équipes de recherches pour créer cette sorte de chimère. Mais aucune confirmation de ces demandes n'a pu être donnée. b - Les risques du don d'ovocyte Ces risques ont été étudiés dans le cadre du don pour effectuer une fécondation in vitro. Si les ovaires sont très riches en ovocytes, ceux-ci sont immatures de même que les follicules ovariens dans lesquels ils se trouvent. Si l'on veut en obtenir plus d'un par mois, il faut provoquer la croissance de plusieurs follicules à la fois. Celle-ci est rendue possible par l'utilisation d'un certain nombre d'hormones pour bloquer les sécrétions hormonales de la patiente, pour déclencher la stimulation ovarienne et enfin pour entraîner l'ovulation au cours de laquelle une dizaine d'ovocytes peuvent être recueillis. Une surveillance de la donneuse est nécessaire et un certain nombre de contrôles sont indispensables. C'est dans l'ensemble une opération assez lourde. Au-delà des risques de l'opération, il faut évoquer les effets possibles sur la santé des donneuses. Il semble que l'on ne sache pas encore très bien quels sont les risques à long terme dus aux produits utilisés pour l'hyperstimulation ovarienne. Et ce malgré le développement important de cette pratique depuis 25 ans lié à celui de la procréation médicalement assistée. A court terme, la plus fréquente des conséquences est ce qu'on nomme le « syndrome d'hyperstimulation ovarienne » qui n'est pas défini de façon très précise puisque pouvant aller de simples nausées jusqu'à, très rarement, des problèmes rénaux ou même le décès. Les éventuels problèmes à long terme sont peu documentés. Des études faites au cours des années 1990 avaient suggéré un lien possible entre les médicaments pris à cette occasion et les cancers de l'ovaire et du sein, bien qu'on ne sache pas encore très clairement comment ces types de cancer pourraient apparaître. Il paraît évident que si les dons d'ovocytes pour la recherche devaient être développés, ces risques pourraient se développer de façon très importante. Il est donc indispensable que soit entreprise une étude épidémiologique sur ces conséquences, à court terme et à long terme, de l'hyperstimulation ovarienne qui pourrait d'ailleurs se faire dans le cadre européen. Ce sera une recommandation de ce rapport. Si des risques existent ainsi au niveau physique pour le don d'ovocyte, un problème éthique considérable se pose. c - Le problème éthique du don d'ovocyte C'est une situation qui s'est brutalement imposée à moi lors de ma mission aux Etats-Unis. En feuilletant les journaux distribués dans les universités, j'ai été atterré par les publicités faisant des offres financières pour des jeunes femmes acceptant de donner contre rémunération leurs ovocytes pour des fécondations in vitro. Ces pratiques sont complètement banalisées aux Etats-Unis, notamment dans le milieu estudiantin. C'est de cette façon que beaucoup de jeunes femmes paient leurs études universitaires. Un rapide survol des sites de recherche Internet a ainsi donné des dizaines de liens vers des officines organisant ces ventes et ces achats. Les rémunérations sont de l'ordre en moyenne de 5 000 dollars, soit environ 4 000 euros. Des sommes plus importantes sont proposées pouvant aller jusqu'à 15 000 ou 20 000, dollars selon le profil de la jeune femme souhaitée. Il s'agit d'un véritable marché où les caractéristiques non seulement physiques des donneuses sont détaillées, mais aussi leurs aptitudes particulières comme, par exemple, la musique ou le dessin. Il n'existe aucun contrôle ni régulation de ce «marché », ce qui peut pousser un certain nombre de jeunes femmes à subir plusieurs fois de suite des hyperstimulations ovariennes. L'autorisation de la transposition nucléaire entraînera une forte hausse de la demande d'ovocytes, en l'état actuel de la recherche. Il est primordial que la commercialisation des ovocytes soit strictement écartée. C'est un débat éthique majeur qui devient très important aux Etats-Unis. Ainsi, M. David Magnus et Mme Mildred K. Cho69 proposent-ils de créer une nouvelle catégorie de « donneurs pour la recherche », pour qualifier ces femmes s'exposant à des risques physiques uniquement pour le bénéfice d'autrui. Le problème de la rémunération éventuelle de ces donneuses donne aussi lieu à débat. En France, M. René Frydman70 vient de proposer que le don d'ovocyte, pour des fins de fécondation in vitro, mais qui peut concerner demain le don pour la recherche, ne soit plus fait à titre gratuit. Il suggère donc qu'« un dédommagement solidaire de cet acte de générosité pourrait être calculé de telle sorte qu'il ne devienne pas un objet de lucre » et que cette « compensation financière » soit gérée par un organisme public comme l'Agence de la biomédecine. En Californie, les donneuses d'ovocytes qui participeront au programme de recherche sur les cellules souches seront uniquement défrayées de leurs dépenses de façon à ne pas encourager les femmes dans le besoin à recourir à cet expédient. Il convient aussi de noter qu'une loi californienne proposée par la sénatrice californienne, Mme Deborah Ortiz, vient d'être promulguée, prévoyant également le remboursement des éventuels des frais médicaux en cas de complications dues à ce don. En Grande-Bretagne, la H.F.E.A. vient de donner l'autorisation aux femmes n'ayant pas les moyens financiers d'entreprendre une F.I.V. de donner des ovocytes en échange d'un traitement de F.I.V. à prix réduit (egg sharing). C'est l'équipe de Mme Alison Murdoch à Newcastle qui a reçu cette autorisation. Cette décision a cependant fait l'objet d'un certain nombre de commentaires défavorables. La H.F.E.A. vient également de lancer une consultation publique sur le don d'ovocytes pour la recherche. Cette institution a établi sur son site Internet un dossier complet sur cette question en demandant au public son avis sur les questions suivantes : . pertinence du don d'ovocyte pour la recherche, . pertinence de la pratique de l'egg sharing, . garanties à déterminer en cas d'autorisation de ce don, . commentaires additionnels. Je pense que cette question finira par se poser également en France. Un débat devrait donc être organisé dans notre pays et pourrait l'être par l'Agence de la biomédecine sur le modèle de l'action entreprise en Grande-Bretagne. Ce sera une recommandation de ce rapport. Je suis, en la matière, partagé entre deux positions : - une femme, comme un homme, doit être libre de faire don de tissus humains car elle (il) doit avoir la libre disposition de son corps, - il y a, par contre, un risque d'exploitation si grand qu'il faut réglementer ce don de façon stricte. Il faut cependant avoir à l'esprit que si une interdiction totale est instituée, des trafics naîtront immanquablement, s'ils n'existent déjà, notamment par le biais d'Internet. Il ne serait alors pas possible d'éviter l'exploitation de la misère d'un grand nombre de femmes. Il vaut donc mieux réglementer de façon stricte qu'interdire complètement. d - Réglementer ce don de façon stricte Je donnerai ci-après quelques principes me paraissant essentiels. Ce sera une recommandation de ce rapport que je souhaite voir soumise à la discussion publique qui serait organisée : . interdiction à une mineure de faire un tel don, . consentement préalable et éclairé, . gratuité du don (interdiction de la rémunération), . remboursement des frais occasionnés pour effectuer le don, . compensation des salaires non perçus, . suivi médical post don remboursé à 100 %, . recueil des ovocytes uniquement dans des centres publics, . séparation totale des centres de recueil et des laboratoires de recherches, . anonymat total des donneuses pour les laboratoires de recherches. Il conviendra que les femmes soient considérées comme des « donneuses » et non pas comme des « vendeuses » d'ovocytes. Il ne faut absolument pas que les détestables pratiques américaines en la matière deviennent la règle au niveau mondial. Une procédure de don respectueuse des droits des femmes devrait aussi être instaurée au niveau international. Je propose également que les publications scientifiques concernant des recherches nécessitant des ovocytes humains doivent obligatoirement mentionner leur origine afin d'éviter l'exploitation des femmes, spécialement de celles habitant dans les pays en développement. Ce seront des recommandations de ce rapport. Les cellules souches posent un certain nombre de défis sociaux et une question économique. Autant les problèmes éthiques des cellules souches sont abordés de façon détaillée, autant les problèmes sociaux qui risquent de se poser en cas de développement des thérapies cellulaires ne sont quasiment jamais envisagés. Certains de mes interlocuteurs ont estimé qu'il leur semblait prématuré de lancer des études sur les conséquences de ces thérapies sur les systèmes de protection sociale, compte tenu de l'incertitude sur le devenir des expériences actuelles. Je considère, tout au contraire, qu'il est temps de commencer à se saisir de ces thèmes avant d'y être contraints par l'avancée de la science qui sera peut-être plus rapide que prévu. Il conviendrait donc de commencer à réfléchir sur un certain nombre de sujets : - qui seront les bénéficiaires éventuels de ce type de médecine ? Normalement, tout au moins dans notre pays, chacun serait à même de pouvoir en profiter. Il faudrait alors examiner les conséquences financières pour le système collectif de protection sociale compte tenu du fait que les coûts seront sans doute très importants. - quelles seront les modalités de financement d'un traitement par thérapie cellulaire d'un individu ? Les éventuelles futures thérapies cellulaires seront des traitements strictement individualisés. Cette situation ne risquera-t-elle pas d'entraîner un financement individuel, compte tenu des sommes en jeu et, donc, une logique d'assurance individuelle, source d'inégalités devant la santé ? Enfin, il serait aussi nécessaire de prendre en compte la fracture qui ne manquera pas de s'approfondir au niveau mondial entre les pays qui pourraient bénéficier de ces techniques et les pays en voie de développement qui n'y auraient évidemment pas accès. Ce ne sont là que des pistes de recherches qui demandent à être ouvertes et étudiées. Ce sera une recommandation de ce rapport. Le marché des cellules souches est encore un marché immature qui n'a pas attiré le capital risque et les grandes entreprises. Généralement les découvertes médicales suscitent de grandes espérances en matière de guérison des maladies mais aussi en matière de gains économiques potentiels. Il n'y a, à l'heure actuelle, que très peu de prévisions concernant l'importance économique future des cellules souches. Les prévisions malheureuses concernant la thérapie génique sont certainement encore bien présentes dans bien des esprits, ce qui explique sans doute la prudence qui est de mise dans ce nouveau domaine. Au-delà de certaines estimations semblant complètement irréelles, prévoyant par exemple un marché de 10 milliards de dollars pour les cellules souches en 2010, on peut citer l'étude parue dans The Economist71. Selon cette publication, ce marché serait de l'ordre de 100 millions de dollars pour les thérapies cellulaires en 2010, avec la possibilité d'atteindre 2 milliards de dollars en 2015. Il est noté dans cette étude qu'il y a environ 140 produits cellulaires en développement pour des affections diverses : cancer, maladies du foie et autres. Mais plus des quatre cinquièmes de ces produits en sont toujours au stade des études cliniques qui peuvent encore déboucher sur des échecs. De toute évidence un marché potentiel très important existe pour les produits de thérapie cellulaire. Mais les incertitudes scientifiques et réglementaires sont actuellement tellement importantes que les projections de chiffre d'affaires sont certainement très fragiles. Ce secteur est ainsi tellement incertain qu'il est déserté par le capital risque et les grandes entreprises. b - Un secteur déserté par le capital risque et les grandes entreprises Une comparaison entre le secteur du décryptage du génome il y a dix ans et celui actuel des cellules souches est tout à fait frappante. A cette époque, un nombre très important de start-up composaient leur actionnariat en mettant en avant leurs brevets. Elles engrangeaient ainsi des millions de dollars même si, et c'était le plus souvent le cas, elles n'avaient absolument aucun produit à mettre sur le marché. Et pourtant les investisseurs affluaient à leurs tours de table. Ils étaient attirés par l'espoir que les brevets allaient permettre de vendre des produits à des millions d'exemplaires, leur assurant ainsi de confortables retours sur investissements. Des déconvenues très importantes ont très souvent été le lot de ces investissements imprudents. Il est évident que la leçon a été retenue par le milieu des affaires. Car le capital risque est absent du secteur des cellules souches, que ce soit en France, aux Etats-Unis ou en Grande-Bretagne. Ce domaine des cellules souches souffre, comme l'a rappelé M. Jean-Thomas Vilquin72, d'un manque de visibilité à court terme car on ne sait pas encore ce que pourraient rapporter des produits de thérapie cellulaire. Des difficultés supplémentaires existent certainement car, finalement, les perspectives de la thérapie génique n'étaient guère plus claires il y a dix ou quinze ans. Les implications morales et éthiques de ces recherches sont, ici, certainement un facteur essentiel de frein. Il faut se souvenir que la thérapie génique ne faisait pas, à l'époque, l'objet de telles controverses. Les perspectives de retour sur investissement sont évidemment encore très incertaines et M. Philippe Pouletty juge la thérapie cellulaire « comme un des domaines à haut risque et à long terme ». Actuellement les grandes entreprises pharmaceutiques ne s'intéressent pas à ce secteur sauf, comme l'a noté M. Philippe Pouletty, certaines comme Genzyme, Baxter et un peu GlaxoSmithKlein. Il a estimé qu'en fait ce domaine n'est pas très attractif pour un groupe pharmaceutique ou une société de biotechnologies. En effet, l'ingénierie tissulaire pose des problèmes importants de logistique, de coûts de production, de traçabilité, de contrôle et d'assurance qualité. Un inconvénient important est que ces thérapies cellulaires sont destinées à un seul malade. Il a ainsi donné l'exemple d'une petite société suisse fabriquant des valves cardiaques à partir de cellules de sang de cordon ombilical : les valves sont individualisées pour chaque malade, ce qui entraîne des coûts de production très importants. Pour une entreprise pharmaceutique qui produit une molécule en millions d'exemplaires avec un emballage et un contrôle de qualité assez simple, l'ingénierie tissulaire apparaît donc extrêmement compliquée. M. Christian Pinset a résumé la situation en notant que « l'industrie pharmaceutique travaille pour avoir un produit qui puisse soigner des millions de personnes », alors que pour la thérapie cellulaire c'est « totalement [l']inverse : un produit soigne une seule personne ». M. Philippe Pouletty considère que les grandes entreprises pharmaceutiques risquent d'éprouver des difficultés au moment où ces thérapies cellulaires seraient au point, dans la mesure où elles n'auront pas alors réalisé tout le travail d'amont nécessaire. Je pense que cette difficulté ne sera que relative car on peut prévoir que les petites entreprises qui auront effectué la recherche seront alors tout simplement rachetées par les grandes. C'est le modèle qui a prévalu dans le domaine de la génomique qui s'appliquera. L'inconvénient de la situation actuelle est que la recherche sur les cellules souches ne bénéficie pas des moyens financiers et intellectuels des grands groupes pharmaceutiques. Cette situation implique donc que le travail d'amont de recherche fondamentale devra être effectué par la recherche publique. La brevetabilité des cellules souches est d'ores-et-déjà une réalité. Ainsi une recherche73 sur les brevets américains identifie plus de 1 400 brevets dans ce domaine, tandis qu'une enquête britannique de 2005 en recensait près de 18 000 dans le monde. Le domaine est dominé par les brevets détenus par l'Université du Wisconsin, tandis que la pratique européenne se cherche encore. Les conséquences de ces appropriations conduisent à refuser la brevetabilité des cellules souches. 1 - Les brevets de l'Université du Wisconsin Après avoir évoqué la genèse de ces brevets, nous verrons que leur étendue est en train de faire naître un mouvement de contestation de leur validité. L'Université du Wisconsin a obtenu de l'Office des brevets américains (U.S.P.T.O.) successivement trois brevets, les n° 5 843 780 du 1er décembre 1998, n° 6 200 806 du 13 mars 2001 et, très récemment, n° 7 029 913 du 18 avril 2006. Les deux premiers concernent la préparation, la purification et la production, respectivement, de cellules souches de primates et de cellules souches embryonnaires humaines. Le troisième a trait à : - une préparation purifiée de cellules souches de primates caractérisée par des marqueurs de surface spécifiques, ainsi qu'une méthode d'isolation, - une méthode d'isolation de lignée de cellules souches de primates. La situation de ces brevets, et notamment des deux premiers, est assez compliquée. En effet les travaux ayant abouti au brevet n° 5 843 780 du 1er décembre 1998 ont été financés par les N.I.H., ce qui rend ces derniers titulaires de droits sur ce premier brevet. Les travaux ayant abouti au brevet n° 6 200 806 du 13 mars 2001, par contre, n'ont pas été financés par les N.I.H., compte tenu de l'amendement « Dickey ». Le financement a été fourni par la société Geron qui a obtenu en contrepartie un certain nombre d'avantages. C'est W.A.R.F. (Wisconsin Alumni Research Foundation, Fondation pour la recherche des anciens élèves du Wisconsin) qui détient la propriété de ces brevets. L'Université du Wisconsin a créé une filiale, WiCell, pour assurer la gestion des demandes de cellules souches. Il y eu un litige entre WARF et Geron en 2000 sur l'étendue des droits de Geron qui a été résolu en 2002 par un accord donnant, notamment, à Geron : - des droits exclusifs pour développer des produits de diagnostic et thérapeutiques à partir de trois types de cellules souches embryonnaires humaines : cellules neurales et pancréatiques, cardiomyocites. Ce sont d'ailleurs les types de cellules souches qui auront probablement le plus d'avenir d'un point de vue clinique. Tout chercheur qui souhaite utiliser ces lignées pour faire de la recherche doit obtenir une licence de la part de Geron, - des droits non exclusifs pour développer les mêmes types de produits à partir des cellules hématopoïétiques, des ostéoblastes et des chondrocytes. Des accords ont été conclus entre W.A.R.F. et les N.I.H. Ils assurent aux chercheurs de cet Institut et à ceux bénéficiant d'une de ses bourses la possibilité d'utiliser les lignées de cellules pour la recherche, contre le paiement d'une somme de 5 000 dollars. En 2005, plus de 200 institutions de recherches américaines avaient pu bénéficier de ce type d'accord. Par contre, si les lignées sont utilisées à des fins commerciales, un accord différent doit être signé avec W.A.R.F., l'exclusivité des droits commerciaux restant en principe couverte par ces brevets. C'est le cas des contrats qui ont été signés avec un certain nombre de compagnies privées à but commercial. D'après un article de Nature74, ces tarifs seraient de l'ordre de 100 000 dollars pour l'accès aux lignées, assortis d'une redevance de 25 000 dollars par an. Ces brevets sont valables, pour l'instant, uniquement aux Etats-Unis et au Canada, l'Office européen des brevets ayant réservé sa décision sur les demandes de W.A.R.F. L'étendue de ces brevets et, surtout celle du n° 6 200 806, communément appelé « brevet 806 », constitue un problème très préoccupant. Comme l'a souligné M. Hervé Chneiweiss75, « Le problème est le même que celui que nous avons déjà rencontré pour les gènes. Ces brevets, à travers les revendications, couvrent le produit, la matière brevetée76. En l'occurrence, il s'agit ici des cellules souches embryonnaires humaines. En particulier, le brevet 806 revendique comme produits les cellules souches humaines mésodermales, endodermales et ectodermales, c'est-à-dire toutes les cellules initiales du corps humain77 A partir du moment où il s'agit d'un brevet de produit, il donne droit à tous les produits dérivés du produit initial et à toutes les manières d'obtenir ces produits dérivés à partir du produit initial ». Autre difficulté très préoccupante, si les brevets de W.A.R.F. ne sont à l'heure actuelle valables qu'aux Etats-Unis ou au Canada, que se passerait-il si une entreprise extérieure, européenne par exemple voulait commercialiser un produit de thérapie cellulaire humaine ? M. Hervé Chneiweiss a également répondu : « Si une société européenne, après avoir dérivé une lignée de cellules souches embryonnaires humaines européennes, essayait d'en commercialiser un produit aux Etats-Unis, elle tomberait alors sous le coup des deux brevets de W.A.R.F. et aurait à trouver un accord de licence ou de brevet secondaire pour commercialiser son produit. Sur le territoire américain et [dans] les pays comme le Canada qui reconnaissent les brevets américains, l'entreprise aurait à trouver un accord d'agrément avec Geron et W.A.R.F. pour pouvoir commercialiser ses produits. [...] Comme je l'ai indiqué, le brevet 806 couvrant les trois feuillets embryonnaires, il paraît difficile dans l'état actuel des choses d'imaginer un produit issu d'une cellule souche embryonnaire humaine ne tombant pas d'une façon ou d'une autre sous le coup de ce brevet78 ». Comme le note finalement M. Hervé Chneiweiss, « en prenant ce brevet, W.A.R.F. s'octroie un droit sur toute cellule souche embryonnaire, quelle qu'elle soit, d'où qu'elle provienne, et pour les 15 ans à venir ! » C'est donc une situation très préoccupante. Cela commence à être le cas également aux Etats-Unis où se développe un mouvement de contestation de ce monopole triangulaire, W.A.R.F.- Geron- N.I.H. c - Le développement d'un mouvement de contestation de ces brevets Ce mouvement est issu d'une contestation d'un certain nombre de chercheurs et de petites entreprises de recherche. La contestation des chercheurs trouve son origine dans l'interdiction absolue qui leur est faite par W.A.R.F de partager les lignées acquises au prix de 5 000 dollars avec d'autres chercheurs, y compris du même laboratoire. Les petites entreprises de recherche qui ont pu développer des produits commercialisables à partir des lignées de cellules souches doivent acquérir une licence supplémentaire et se trouvent très souvent incapables de réunir la somme de 100 000 dollars. Ce mouvement de contestation de l'étendue de ces brevets semble gagner de l'ampleur, comme l'atteste l'augmentation du nombre d'articles publiés sur ce thème dans plusieurs revues scientifiques anglo-saxonnes. Une contestation s'est également élevée en Californie à la suite du vote de la Proposition 71. L'offensive est menée par une organisation à but non lucratif, la Foundation for Taxpayer and Consumer Rights, association de protection des droits des contribuables et des consommateurs. Cette organisation estime que les contribuables de Californie risquent de devoir payer deux fois la commercialisation d'éventuelles découvertes dans ce domaine : une au titre des dépenses de l'Etat de Californie suite au vote de la Proposition 71 et une autre au titre des brevets détenus par W.A.R.F. Une autre organisation sans but lucratif, la Public Patent Foundation, association luttant contre les brevets abusifs, a également contesté la validité de ces brevets. Ces deux organisations ont choisi d'attaquer ces brevets sur la nouveauté. Ils estiment avoir des preuves que des revendications de ces brevets s'appuient sur des faits publiés antérieurement. Selon eux, ces brevets ne remplissent donc pas une des conditions nécessaires de la brevetabilité, la nouveauté. Les recours ont été déposés le 3 octobre dernier devant l'U.S.P.T.O. qui a accepté de les recevoir. On peut donc s'attendre maintenant à une bataille juridique qui va sans doute durer assez longtemps. Pendant ce temps, l'Europe est en attente d'une décision sur ces brevets de W.A.R.F. Dans l'Union européenne, la Directive 98/44/CE du Parlement européen et du Conseil du 6 juillet 1998 relative à la protection juridique des inventions biotechnologiques pose les principes appliqués par l'Office européen des brevets (O.E.B.). a - Les dispositions de la directive 98/44/CE Une distinction doit être faite entre les cellules souches adultes et les cellules souches embryonnaires . Les cellules souches adultes Les dispositions de cette directive concernant les cellules souches adultes ne semblent pas poser, pour les juristes, de difficultés particulières. En effet sous réserve des limitations des dispositions de l'article 5 - 1 (inappropriation du corps humain en tant que tel) celles-ci, conçues comme des produits, pourront faire l'objet de brevets si elles remplissent les conditions classiques de la brevetabilité : nouveauté, activité inventive et application industrielle. . Les cellules souches embryonnaires La question des cellules souches embryonnaires est plus difficile à apprécier. Tout d'abord selon l'article 6 - 1, ne sont pas brevetables les inventions dont l'exploitation commerciale serait contraire à l'ordre public ou aux bonnes mœurs. La suite de cet article prévoit les applications de ce principe : ne sont pas brevetables, notamment, les procédés de clonage des êtres humains (article 6 - 2a) et les utilisations d'embryons humains à des fins industrielles ou commerciales (article 6-2c). Dans son rapport du 14 juillet 2005 au Conseil et au Parlement européen sur l'évolution et les implications du droit des brevets dans le domaine de la biotechnologie et du génie génétique, la Commission a fait le point sur ces questions. Elle a ainsi reconnu que « les dispositions sont claires en ce qui concerne les cellules souches totipotentes ». En effet chacune de ces cellules peut se développer elle-même en un être humain. Compte tenu des dispositions de l'article 5 - 1, elles ne peuvent pas être brevetables. Par contre, concernant les cellules souches embryonnaires pluripotentes, elle a repris l'analyse d'un groupe d'experts, selon lesquels « la question de la brevetabilité était étroitement liée [d'une part] à la définition de ce qui constitue un embryon et [d'autre part] au domaine de recherche autorisé qui est déterminé par la législation nationale.» La Commission a donc estimé qu'il était actuellement prématuré de poursuivre l'harmonisation dans ce domaine. Elle s'est cependant proposée de suivre l'évolution de cette question en tenant compte de ses aspects éthiques et de son impact potentiel sur la compétitivité. b - La position de l'Office européen des brevets (O.E.B.) Les dispositions de la Directive 98/44/CE ont été incorporées dans le Règlement d'exécution de la Convention sur le brevet européen par le Conseil d'administration de l'O.E.B. Les cellules souches adultes et les méthodes ou compositions les utilisant sont normalement brevetables par l'O.E.B., comme l'a confirmé Mme Siobhán Yeats79. Il n'en est pas de même des cellules souches embryonnaires. L'article 6-2c a été transposé dans la règle 23 quinquies (c) de la Convention sur le brevet européen. Dans deux affaires, le brevet de l'Université d'Edinburgh et la demande de W.A.R.F. pour obtenir un brevet européen, l'O.E.B. a adopté une interprétation large de la règle 23 quinquies (c). Il a ainsi refusé les demandes de brevet portant sur les procédés d'extraction des cellules souches d'un blastocyste, entraînant de ce fait la destruction d'un embryon humain. Il a également repoussé les demandes concernant des lignées de cellules souches embryonnaires déjà établies. Comme l'a souligné en substance Mme Siobhán Yeats, il a été nécessaire à l'O.E.B., face à ces demandes, de faire une interprétation des dispositions de la directive 98/44/CE car, à l'époque de son intervention, les cellules souches humaines n'avaient pas été isolées, au contraire des cellules de primates. Pour l'instant, l'O.E.B. considère donc que les cellules souches embryonnaires humaines ne sont pas susceptibles d'être brevetées pour des raisons éthiques. Mais W.A.R.F. a fait appel de cette décision en première instance. La chambre de recours saisie a décidé d'envoyer la question à la Grand chambre de recours de l'O.E.B. qui prend les décisions fondamentales d'interprétation. La décision de la Grande chambre de recours devrait intervenir vers la fin de l'année 2007, la chambre de recours saisie de l'opposition au brevet d'Edinburgh attendant vraisemblablement cette décision pour statuer à son tour. Mme Siobhán Yeats a indiqué que toutes les demandes de brevet portant sur ce domaine étaient de ce fait bloquées par l'O.E.B. La conséquence de ces affaires en attente devant l'O.E.B. est que chaque pays européen applique sa propre politique en la matière. Ainsi l'Office anglais des brevets a-t-il adopté une règle selon laquelle les cellules souches embryonnaires humaines pluripotentes qui résultent des divisions des cellules totipotentes n'ont pas le potentiel de se développer en un corps humain complet. Il estime donc que des brevets peuvent être accordés pour des inventions comprenant des cellules souches pluripotentes à la condition quelles satisfassent par ailleurs aux critères classiques de la brevetabilité. Mme Siobhán Yeats a souligné que des entreprises peuvent donc demander un brevet en Grande-Bretagne, obtenir celui-ci et ensuite faire une demande à l'O.E.B. 3 - Refuser la brevetabilité des cellules souches Je pense que toutes ces affaires doivent inciter plus que jamais à refuser la brevetabilité des cellules souches comme j'avais plaidé dans un autre rapport pour l'interdiction de la brevetabilité des gènes. La démonstration de M. Hervé Chneiweiss sur l'étendue des brevets de W.A.R.F. montre bien où est, une fois de plus, le véritable danger : le brevetage de la connaissance. Comme je l'avais déjà souligné dans mes précédents rapports, le système des brevets, institué pour favoriser le progrès et accroître le bien-être collectif, peut complètement s'opposer à la poursuite de ces deux objectifs. Cette situation est peut être due, au moins en partie, au refus de financer sur des fonds publics cette recherche. Cela a ainsi laissé le champ libre au financement privé et à son corollaire inévitable, une volonté d'extension maximale des revendications pour bénéficier du retour sur investissement le plus important possible. C'est un argument supplémentaire pour justifier que ce type de recherche fondamentale soit financé sur fonds publics. On ne peut évidemment préjuger de la décision de la Grande chambre de recours de l'O.E.B. Mais, pour encourager le développement de la recherche sur les cellules souches et la diffusion des connaissances, il faut introduire dans la Convention sur la délivrance de brevets européens (C.B.E.) une disposition précisant que les cellules souches ne sont pas brevetables et que la brevetabilité s'applique exclusivement, dans ce domaine, aux procédés et aux applications. Afin que cette disposition puisse entrer réellement en vigueur, je souhaite que le gouvernement français engage une action auprès de ses homologues du conseil d'administration de l'O.E.B. visant à modifier la C.B.E. dans ce sens. Le Règlement d'exécution de la C.B.E. serait ensuite modifié en conséquence. Ce sera une recommandation de ce rapport. Je réitère ma proposition, déjà faite dans mes rapports précédents, de limiter la brevetabilité aux procédés et aux produits d'application. Ce sera une recommandation de ce rapport. La brevetabilité des cellules souches est liée à l'objectif de les rendre commercialisables comme n'importe quel produit. Il faut refuser la marchandisation des cellules souches. 4 - Refuser la marchandisation des cellules souches On retrouve là le débat sur la marchandisation du génome que j'ai déjà abordée au cours de mes deux précédents rapports. Concernant les cellules souches, le Comité consultatif national d'éthique (C.C.N.E.) vient de publier un avis (avis n°93), sur « La commercialisation des cellules souches humaines et autres lignées cellulaires ». Il aborde les « difficultés éthiques que soulève, ou soulèverait, une éventuelle commercialisation des cellules souches humaines, embryonnaires et non embryonnaires, et autres lignées cellulaires ». Il relève que les investisseurs potentiels dans ce domaine des cellules souches veulent disposer d'une protection juridique par le brevet pour pouvoir tirer profit de leur commercialisation. Il souligne, de façon intéressante, que la recherche biomédicale soulève un conflit d'intérêts entre les malades, les investisseurs, les personnes sources du matériel biologique, la recherche, et la société. La question cruciale est, dès lors, la suivante : « jusqu'à quel stade la cellule souche reste-t-elle, à strictement parler un élément du corps humain ? Les transformations, qu'elle doit subir pour être conservée et utilisée, changent-elles son statut jusqu'à la transformer en produit thérapeutique ? » Un principe fondamental est que des éléments ou des produits du corps humain, détachés à la suite d'une intervention médicale, sont l'objet de don gratuit et volontaire, ce qui ne les empêche pas, d'avoir, ensuite, un prix de cession, voire un statut de médicament, comme les produits élaborés à partir du sang. Un lien est ainsi créé entre l'importance des transformations subies par un produit issu du corps humain et la possibilité de le commercialiser. C'est celui qui est fait par les partisans de la brevetabilité et de la commercialisation des gènes. Les cellules souches, devant être prélevées, conditionnées, cultivées, multipliées et, le cas échéant, modifiées, pourraient de ce fait devenir commercialisables. Serait ainsi commercialisé, non un produit du corps humain, interdite par l'article 16-1 du Code civil80 que rappelle cet avis, mais un simple produit biologique dérivé. Dans la recommandation n° 9 de cet avis, le C.C.N.E. estime ainsi que « la possibilité de breveter les cellules souches en tant que produits du corps humain violerait le principe de non commercialisation de produits du corps humain, à moins que de tels produits soient devenus des produits dérivés, n'ayant plus les caractéristiques d'un produit biologique. » Mais la difficulté de cette question est reconnue car le C.C.N.E. note qu'« à partir de quand ces éléments cellulaires pourront-ils être considérés comme suffisamment détachés et différents du corps humain pour faire l'objet d'un commerce ? » La réponse est alors la suivante : « Toute ligne de séparation, tout critère paraît impossible à fixer. » Cependant, il préconise dans sa recommandation n° 3 que lorsque «une activité humaine ingénieuse a suffisamment modifié la cellule pour en faire un produit qui a perdu les caractéristiques phénotypiques et fonctionnelles de la cellule, la question d'une éventuelle commercialisation du produit obtenu devrait être soumise à une Agence comme l'Agence de la biomédecine, citée à titre d'exemple.» Je pense que cette dernière suggestion est très critiquable car je ne suis pas sûr qu'une agence comme l'Agence de la biomédecine soit capable, sans contestation, d'indiquer cette limite, nonobstant les recours qui ne manqueraient pas d'être interjetés contre de telles décisions. Nous sommes devant le même problème qui se pose en matière de gènes et que j'avais développé dans mes deux rapports précédents. Nous sommes de nouveau devant l'assimilation du vivant à un simple produit chimique. Il faut continuer à s'élever avec vigueur contre ces tentatives de marchandisation du vivant. Après l'avoir déjà proposé dans un rapport précédent81, je réitère donc que soit organisée une réflexion sur le statut du vivant dans notre société. Ce sera une recommandation de ce rapport. Les sciences de la vie sont sans doute à l'heure actuelle à un tournant. En effet le succès du séquençage de génomes de plus en plus nombreux, dont celui de l'homme, n'a pas abouti à déchiffrer le mystère de la vie comme on avait pu parfois l'espérer. Cet espoir a été inspiré par la prédominance croissante de la génétique qui s'est focalisée sur un des composants de la cellule vivante, l'A.D.N. Mais la difficulté récurrente, malgré de très nombreux efforts, pour définir de façon précise les fonctions du gène amène à dépasser l'approche du « tout génétique ». Il ne s'agit évidemment pas de renoncer à toutes les avancées que celle-ci a permis de réaliser depuis cinquante ans. Il faut la replacer dans une optique plus physiologique, dans le vivant concret. Cette perspective plus concrète, plus vivante, ne peut être retrouvée que si on revivifie la recherche sur l'environnement de l'A.D.N. dans la cellule, sur tous les composants de la cellule. Une attention très importante devra être apportée aux cellules souches, tant adultes qu'embryonnaires dont j'ai essayé de montrer toutes les possibilités dans ce rapport qui se veut avant tout comme un état des lieux. Il n'est certes pas exhaustif, mais il a essayé de présenter toutes les questions importantes qui se posent avec leurs évolutions les plus récentes. Il a aussi mis l'accent sur les problèmes éthiques que ne posaient pas la génomique. Je pense ici essentiellement au problème du don d'ovocyte, qu'il faudra absolument régler si on veut poursuivre la recherche sur les cellules souches embryonnaires humaines. Je souhaite très vivement que ce rapport soit considéré comme une introduction au débat public que j'appelle de tous mes vœux sur les cellules souches avec toutes leurs impressionnantes virtualités, mais aussi toutes les questions difficiles qu'elles nous posent. Cela permettrait de discuter collectivement de l'éventuelle autorisation de la transposition nucléaire, à laquelle je suis favorable, à condition que le très difficile problème posé par le don d'ovocyte et le risque réel de marchandisation du corps des femmes soit réglé de façon rigoureuse. Ce débat sur la possibilité du don d'ovocyte devrait être lancé au plus vite en France, par l'Agence de la biomédecine, comme il vient de l'être en Grande-Bretagne. Au-delà de la situation de la France, je pense qu'il sera certainement nécessaire que des sauvegardes soient le plus rapidement possible instituées au niveau mondial. Un tel dispositif aurait pour objectif d'éviter qu'une exploitation de la détresse des femmes de pays pauvres ne s'organise. Il serait absolument condamnable du point de vue de l'éthique que la santé des populations des pays riches repose sur une telle situation. Ce débat me paraît d'autant plus opportun à organiser rapidement qu'il pourrait ainsi s'insérer dans la préparation de la révision de la loi de bioéthique de 2004 qui devra avoir lieu, au plus tard, en 2009. Je souhaite que celle-ci ait lieu dès 2007. Cela est nécessaire pour redonner des perspectives claires à la recherche française dans ce domaine. Il faut en effet essayer de rattraper le temps perdu par deux fois, par la révision tardive de la loi de 1994, et la parution retardée du décret d'application de l'article 25 de la loi de 2004. L'impression que je retire de l'état de la recherche dans ce domaine est que les incertitudes et les ignorances dominent. Il a y donc encore un très grand besoin de recherche fondamentale dans ce domaine. Les deux catégories de cellules souches apparaissent tout à fait complémentaires et je souhaite que ne se développe pas une sorte de guerre de religion entre les spécialistes des unes et des autres. Je suis tout à fait persuadé que tout progrès dans l'un des deux domaines aura, nécessairement, des retombées positives dans l'autre. La situation de notre pays devra être améliorée par une action vigoureuse des pouvoirs publics au travers de l'Agence nationale de la recherche (A.N.R.) qui devra faire de ce domaine une importante priorité et équilibrer ses appels d'offres entre les deux catégories de cellules souches. Cette intensification de la recherche fondamentale appellera donc une augmentation des financements publics, afin de se préserver du développement des brevets sur la connaissance. Ces financements publics devront aussi être engagés au niveau européen afin d'obtenir un effet de masse qui permettrait à l'Europe de pouvoir soutenir la concurrence des Etats-Unis qui va s'amplifier et celle, grandissante, de l'Asie. La situation européenne est assez inquiétante, compte tenu des divergences fondamentales existant entre les Etats membres, qui se sont cristallisées à l'occasion de la préparation du 7ème P.C.R.D. La recherche sur les cellules souches ne remplacera pas les efforts effectués dans le domaine du génome, mais les complétera afin de permettre de pénétrer toujours plus avant dans la connaissance des mécanismes fondamentaux de la vie, éternelle aspiration de l'être humain. La protection de l'Homme est au cœur de la législation bioéthique. Celle-ci doit être confrontée aux réalités des recherches et des connaissances en devenir. Elle doit être au service d'une société et d'une recherche vivantes. Afin de respecter la dignité de la personne humaine elle doit avoir comme impératif de concilier trois principes : - la liberté de pensée, c'est-à-dire la liberté du chercheur qui doit savoir quelles limites la société entend fixer à son activité, - les droits des malades et des personnes handicapées à voir atténuer leurs souffrances et accroître leurs espoirs ce guérison, ce qui nécessite la recherche et l'expérimentation, - le respect de la personne et du corps humain. I - La loi de 2004 Les recommandations de cette partie concernant la loi de 2004 devront être examinées lors de l'évaluation de cette loi par l'Office et l'Agence de la biomédecine 1 - Réviser dès 2007 l'article 25 de la loi du 6 août 2004-800 du 6 août 2004 relative à la bioéthique La révision de cet article 25 s'impose dès 2007, sans attendre 2009, afin que le régime d'interdiction, même assorti de dérogation, concernant la recherche sur l'embryon, soit supprimé au profit d'un régime d'autorisation contrôlée. 2 - Autoriser la recherche sur l'embryon Toutes les dispositions de l'article 25 de cette loi portant rédaction des quatre premiers alinéas de l'article L 2151-5 du code de la santé publique, concernant la recherche sur l'embryon doivent être supprimées. Par contre, devraient être maintenues les dispositions concernant le rôle de l'Agence de la biomédecine. Les dispositions supprimées seraient remplacées par celles des deux premiers alinéas de l'article L 2151-3 du code de la santé publique, dans la rédaction donnée par l'article 19 du projet de loi relatif à la bioéthique voté par l'Assemblée nationale en première lecture le 22 janvier 2002. 3 - Autoriser la transposition nucléaire La transposition nucléaire devrait être autorisée par la loi relative à la bioéthique, qui devrait prévoir un dispositif rigoureux de contrôle de l'Agence de la biomédecine. 4 - Organiser un débat de l'Agence de la biomédecine sur le don d'ovocytes pour la recherche Ce débat devra être organisé dès 2007 sur le modèle de celui qui vient d'être engagé par la H.F.E.A. britannique. Il pourrait proposer à la discussion les principes suivants : . interdiction à une mineure de faire un tel don, . consentement préalable et éclairé, . gratuité du don (interdiction de la rémunération), . remboursement des frais occasionnés pour effectuer le don, . compensation des salaires non perçus, . suivi médical post don remboursé à 100 %, . recueil des ovocytes uniquement dans des centres publics, . séparation totale des centres de recueil et des laboratoires de recherches, . anonymat total des donneuses pour les laboratoires de recherches. La synthèse de ce débat servira de base, s'agissant des conditions selon lesquelles ce type de don sera autorisé, à la révision de la loi relative à la bioéthique. 5 - Examiner le problème posé par la ratification éventuelle de la Convention du Conseil de l'Europe sur les droits de l'Homme et la biomédecine (« Convention d'Oviedo ») Il s'agit d'examiner la compatibilité du second alinéa de l'article 18 de cette Convention avec la transposition nucléaire qui serait autorisée par la révision de la loi de 2004 relative à la bioéthique. La disposition de l'article 1er du Protocole additionnel de cette Convention interdisant le clonage humain devrait être précisée. La France se doit réaffirmer son opposition au clonage reproductif humain. II - Ethique 6 - Proposer une action internationale en faveur de la réglementation du don d'ovocytes pour la recherche Une telle action est indispensable pour empêcher l'exploitation du corps des femmes, notamment des pays en voie de développement. Il s'agit de lutter ainsi contre la création et le développement du trafic d'ovocytes qui ne manquerait pas de s'organiser si le recours à la transposition nucléaire devait s'amplifier. 7 - Proposer au niveau international que les auteurs de publications ayant trait à des recherches impliquant l'utilisation d'ovocytes humains soient obligés d'en indiquer la provenance Cette proposition complète la précédente pour lutter contre le développement d'un trafic international d'ovocytes. 8 - Refuser la brevetabilité des cellules souches adultes et embryonnaires par l'introduction dans la directive 98/44/CE du 6 juillet 1998 de dispositions interdisant formellement cette brevetabilité. Elle ne peut concerner que les procédés et les produits d'application. Par l'intermédiaire de son Règlement d'exécution, ces dispositions s'imposeraient à l'Office européen des brevets. Il s'agit de s'opposer ainsi à la dérive de plus en plus forte vers la brevetabilité du vivant. Il faut écarter la menace de brevets, tels ceux détenus par W.A.R.F., qui peuvent s'opposer au progrès scientifique. Les brevets doivent être réservés aux méthodes, aux procédés et aux produits d'application. 9 - Supprimer, à vie, la possibilité pour un chercheur, convaincu d'avoir enfreint la déontologie scientifique, d'obtenir des fonds publics nationaux, européens et internationaux Cette recommandation vise à lutter contre la fraude scientifique qui porte atteinte au renom de la science. 10 - Instituer dans le cursus de formation des étudiants de toute discipline un enseignement de l'éthique de la recherche Cette formation pourrait se faire au niveau du mastère. III - Politique de la recherche 11 - Organiser une réflexion sur le statut du vivant dans notre société Je réitère une recommandation déjà exprimée dans mon rapport sur « La brevetabilité du vivant ». Les pressions qui se sont déjà exercées pour la brevetabilité et la commercialisation des gènes vont certainement se renouveler pour les cellules souches. Ce débat s'impose donc d'autant plus avant de prendre des mesures qui pourraient se révéler hâtives. 12 - Développer les banques publiques de sang de cordon ombilical dans la continuité de la recommandation du C.C.N.E. du 12 décembre 2002 et engager une action auprès des organisations internationales pour leur développement au niveau mondial de préférence aux banques privées Compte tenu des possibilités remarquables de ces cellules pour le traitement de nombre de maladies, il est opportun de développer en France les banques de cellules de sang de cordon ombilical. Il est nécessaire d'attirer l'attention des organisations internationales sur les dangers présentés par le développement de banques privées. Celles-ci risquent en effet de s'opposer au principe de solidarité et de poursuivre des intérêts mercantiles sous prétexte de rendre service aux enfants. 13 - Effectuer au plus vite un recensement de toutes les activités de recherche conduites en France en matière de cellules souches adultes et embryonnaires, humaines et animales. Cette recommandation vise à établir un état précis des lieux, indispensable pour l'élaboration d'une politique de développement de la recherche dans ce domaine. 14 - Effectuer au plus vite un recensement précis de tous les financements, publics (nationaux, européens) et privés, affectés à ce domaine de recherche Il s'agit ici de compléter la recommandation précédente. 15 - Présenter chaque année au Parlement un rapport public évaluant les résultats acquis, tant en France qu'à l'étranger, en matière de recherche sur les cellules souches adultes et embryonnaires. Ce rapport permettrait, d'une part, de faire le point sur l'avancement des connaissances dans ce domaine et, d'autre part, d'infléchir éventuellement la politique publique en la matière. 16 - Afficher les priorités de la puissance publique en matière de recherche sur les cellules souches adultes et les cellules souches embryonnaires au travers d'appels d'offres spécifiques de l'Agence nationale de la recherche (A.N.R.) Cet affichage est de nature à rendre visibles les efforts qui seront effectués par les pouvoirs publics en faveur de ce secteur. L'A.N.R. doit afficher de façon spécifique ses appels d'offre. Cette visibilité sera une aide pour les chercheurs dans la mesure où elle pourra signifier une pérennité de l'effort public. 17 - Engager une réflexion sur la création en France d'un ou deux pôles d'excellence sur les cellules souches Cette (ou ces) création(s) devrai(en)t prendre la forme d'un « laboratoire sans mur ». Elle(s) permettrai(en)t la concentration des moyens publics en évitant leur « saupoudrage ». Les exemples du RIKEN au Japon ou de Cambridge en Grande-Bretagne pourraient inspirer cette (ces) création(s). IV - Quelques domaines de la recherche à explorer 18 - Engager un programme de recherches sur la dérivation d'ovocytes à partir de cellules souches embryonnaires Cela permettrait, à terme, de pouvoir se dispenser de l'utilisation d'ovocytes humains. 19 - Développer une étude épidémiologique européenne sur les conséquences à court, moyen et long terme de l'hyperstimulation ovarienne Cette étude est indispensable si le don d'ovocytes pour la recherche est autorisé. Elle disposerait d'une base de départ importante, constituée par les femmes qui se sont soumises depuis plus de vingt ans à cette hyperstimulation pour effectuer des fécondations in vitro. 20 - Engager des études sur les conséquences sociales de l'introduction possible des thérapies cellulaires Ces études devraient, entre autres, examiner les questions suivantes : - qui seront les bénéficiaires éventuels de ce type de médecine ? - quelles seront les modalités financières des traitements par thérapie cellulaire ? - quelles seraient les mesures devant être prises pour éviter le développement de la logique de l'assurance individuelle dans ce domaine ? Examen du rapport par l'Office L'Office a procédé à l'examen du rapport de M. Alain Claeys, député, sur « les recherches sur le fonctionnement des cellules vivantes ». M. Alain Claeys, député, rapporteur, après avoir noté le caractère complexe de cette question, a exposé la méthodologie suivie pour la préparation du rapport. Une journée d'auditions publiques a été organisée en novembre 2005 avec des chercheurs français travaillant sur les cellules souches adultes et les cellules souches embryonnaires humaines. Par dérogation à ses usages, l'Office a accepté que le compte rendu de cette journée soit publié avant même l'adoption du rapport, de manière à rassurer les chercheurs, qui avaient été troublés par l'« affaire Hwang ». Les ministres chargés de la santé et de la recherche et un grand nombre de chercheurs ont été auditionnés par le rapporteur, qui a également conduit des missions au Japon et en Corée, pendant l'« affaire Hwang », aux Etats-Unis, en Grande-Bretagne, à l'Office européen des brevets (O.E.B.) de Munich, ainsi qu'à Bruxelles. Les recommandations du rapport touchant à d'éventuelles modifications de la loi de 2004 relative à la bioéthique pourront être examinées lors de l'évaluation de cette loi par l'Office et l'Agence de la biomédecine. M. Alain Claeys a ensuite souligné la pleine actualité de son rapport, compte tenu des toutes récentes et très positives déclarations du Président de la République en faveur du Téléthon. Il a indiqué que son étude n'abordait pas, conformément à la lettre de saisine, le très sérieux problème éthique de l'origine de la vie, lequel dépend de la conviction intime de chacun et non du législateur. Trois principes, qui recueillent un très large assentiment, doivent être conciliés : - la liberté du chercheur qui doit savoir quelles limites la société entend fixer à son activité, - les droits des malades et des personnes handicapées à voir atténuer leurs souffrances et accroître leurs espoirs de guérison, - le respect de la personne et du corps humain. Le rapporteur a considéré que l'opinion publique oscille en permanence entre la fascination, car la santé dépend des progrès scientifiques, et la méfiance, due aux crises récentes qui ont secoué la recherche en ce domaine. Face à cette situation, il faut favoriser le développement de la culture scientifique. Mais la science avance lentement, produit peu de personnalités médiatiques, engendre des doutes et des critiques et est soumise aux faits, alors que la presse a, elle, tendance à annoncer des découvertes et des remèdes pour tout de suite. Cette contradiction est durement ressentie par les malades quand les espoirs suscités se révèlent infondés. Il est donc irresponsable de dire des choses contraires à la réalité, il faut dire la vérité. Abordant la question des thérapies génique et cellulaire, le rapporteur a relevé que le décryptage du génome humain, réalisé entre 1990 à 2003, a permis de mieux connaître les gènes et leurs liaisons avec les affections héréditaires. Cela a conduit au concept de thérapie génique, qui correspond à l'introduction d'un gène fonctionnel dans les cellules d'un organisme. Le grand enthousiasme du début n'a pas été suivi de bénéfices importants pour les patients car on n'a pas élucidé la fonction des gènes et on a découvert l'importance de leur environnement, l'épigénétique. Un certain nombre de difficultés sont apparues, liées notamment au ciblage des cellules malades ou à la régulation des gènes introduits. Mais la thérapie génique n'est pas une impasse, comme le montre la réussite, malgré trois échecs, du traitement du syndrome de l'immunodéficience acquise (syndrome des « bébés bulles») par M. Alain Fischer et Mme Marina Cavazzana-Calvo. Les efforts de recherche doivent donc être poursuivis. La thérapie cellulaire, quant à elle, vise à implanter chez un malade des cellules qui vont recréer, en se diversifiant, les organes ou les fonctions lésés. M. Alain Claeys a insisté sur le fait que le rapport traite à la fois des cellules souches adultes et embryonnaires. Les recherches sur ces deux types de cellules doivent être poursuivies en parallèle, les cellules souches adultes ne posant cependant pas les mêmes problèmes éthiques que les cellules souches embryonnaires. Il y a encore beaucoup de recherche fondamentale à effectuer dans ce domaine, notamment sur l'isolement des cellules souches, leur purification, leur culture et leur différenciation. Le rapporteur a ensuite abordé l'état de a recherche dans le monde. La situation des pays européens est très diverse. Trois pays (Grande-Bretagne, Suède et Belgique) autorisent la transposition nucléaire, alors que d'autres soit interdisent toute recherche en la matière (Autriche, Pologne, Irlande), soit sont dépourvus de toute législation (Malte, Chypre, Estonie). La Grande-Bretagne est l'un des pays les plus actifs dans ce domaine grâce à la souplesse de sa législation et à l'efficacité de son autorité de régulation en matière d'éthique et de protocoles de recherches. Cette Autorité, parfois critiquée comme trop tatillonne, vient de lancer une consultation publique sur le don d'ovocytes. La Suède, quant à elle, est l'un des premiers pays d'Europe à avoir autorisé, dès 1991, la recherche sur les ovocytes humains fécondés. Cette disparité en Europe a suscité des difficultés lors de l'élaboration du 7ème Programme cadre de recherche et de développement (P.C.R.D.), car certains pays nouvellement entrés dans l'Union européenne sont hostiles aux cellules souches embryonnaires humaines. Un accord a néanmoins pu être trouvé. Aux Etats-Unis, ne sont interdits ni le clonage reproductif humain ni la transposition nucléaire. Par contre, les fonds fédéraux ne peuvent pas financer la recherche impliquant la création ou la destruction d'embryons humains. La décision du président Bush du 9 août 2001 a limité la possibilité de financement fédéral aux lignées de cellules souches embryonnaires existant à cette date. Mais celles-ci posent des problèmes, notamment de dégénérescence génomique. Une récente tentative, bipartisane, du Sénat d'élargir les possibilités de financement fédéral des cellules souches embryonnaires s'est heurtée au veto du Président Bush le 19 juillet 2006. Les fonds privés peuvent financer tous les types de recherches qui commencent également à être soutenus par un certain nombre d'Etats. C'est le cas, emblématique, de la Californie qui va, suite au vote le 2 novembre 2004 de la Proposition 71 consacrer à ces recherches 3 milliards de dollars sur dix ans. Cet Etat deviendra très attractif pour un grand nombre de chercheurs américains qui auraient pu être tentés de s'expatrier en Asie. L'Asie est le continent où la recherche sur les cellules souches embryonnaires pourrait connaître des succès importants dans l'avenir. Les biotechnologies et les techniques médicales sont en effet au cœur de la stratégie de développement de beaucoup de pays, et ils pourraient bénéficier des réticences européennes et américaines. Ils disposent également de scientifiques d'un excellent niveau. Singapour fait preuve d'une politique très volontariste, avec des investissements très conséquents dans la recherche publique et privée. L'objectif est d'attirer les scientifiques de renom international par d'excellentes conditions de travail, ainsi que les investissements étrangers. Le Japon a développé une recherche publique dynamique, en concentrant ses moyens dans la région de Kyoto. La transposition nucléaire est autorisée mais aucune équipe n'y travaille. La Corée du sud a été, l'année dernière, au cœur de l'actualité avec l' « affaire Hwang », qui a été une gigantesque supercherie. Abordant la situation de la France, M. Alain Claeys a rappelé que la loi de bioéthique de 2004 avait été discutée sous deux législatures à majorité différente. Les recommandations concernant les propositions de modification de la loi de 2004 relative à la bioéthique devront être examinées par l'Office et par l'Agence de la biomédecine lors de l'évaluation de cette loi. Après avoir souligné qu'on ne devrait pas attendre 2009 pour réviser la loi, il a évoqué différentes questions. - La Convention du Conseil de l'Europe sur les droits de l'Homme et la biomédecine, dite Convention d'Oviedo Deux dispositions de cette Convention, adoptée le 19 novembre 1996, doivent être précisées avant que la France puisse ratifier ce texte. L'une, au deuxième alinéa de l'article 18, prévoyant que « la constitution d'embryons humains aux fins de recherche est interdite », pourrait être considérée comme interdisant la transposition nucléaire. L'autre, à l'article 1er du Protocole additionnel de cette Convention, prévoit que le clonage d'un être humain est interdit. L'interprétation des Pays-Bas, considérant le terme « être humain » comme se référant exclusivement à un individu humain non né, doit, selon le rapporteur, être adoptée. - L'article 25 de la loi relative à la bioéthique Un apport positif de la deuxième lecture de cette loi a été la création de l'Agence de la biomédecine qui répond aux exigences éthiques d'encadrement des recherches sur le vivant. Cette agence a fait la preuve de son efficacité sous la direction de Mme Carine Camby. Par contre, les modalités de la recherche sur les embryons adoptées en première lecture en janvier 2002 étaient plus satisfaisantes que celles prévues par le texte final de la loi. Le texte de 2002 autorisait en effet la recherche sur l'embryon à partir d'embryons surnuméraires issus d'un processus de fécondation in vitro, sous réserve de l'abandon du projet parental et de la non-réimplantation. Ces embryons étaient, auparavant, voués à la destruction. Les dispositions de la loi sont ambiguës car elles interdisent la recherche sur l'embryon, tout en prévoyant des possibilités de dérogation pendant une période de cinq ans. Une dérogation n'est possible que lorsque les recherches sont susceptibles de « permettre des progrès thérapeutiques majeurs et à condition de ne pouvoir être poursuivies par une méthode alternative d'efficacité comparable ». Il est nécessaire d'avoir des dispositions plus claires et moins complexes car il n'est pas possible de prévoir les applications thérapeutiques dès le stade de la recherche fondamentale. Le rapporteur a conclu cette partie de son exposé en se félicitant de l'évolution des esprits sur ce point. - La transposition nucléaire et le don d'ovocytes L'expression « clonage thérapeutique » a été bannie car elle trompeuse. Ses adversaires mettent l'accent sur clonage, cette technique étant alors assimilée au clonage reproductif que personne de sensé ne défend. Ses partisans insistent sur thérapeutique, ce qui pourrait faire croire qu'elle est prête à guérir des maladies aujourd'hui encore incurables. En fait, on ne sait pas encore s'il sera possible de l'utiliser et si elle donnera les résultats escomptés. Ce n'est pas une technique neutre car elle pose le problème du don d'ovocytes. M. Alain Claeys a alors souligné combien il avait été frappé, lors de sa mission aux Etats-Unis, par les publicités des journaux d'universités et par les sites Internet offrant d'acheter les ovocytes des étudiantes pour des fécondations in vitro. Il a exprimé sa crainte que cette marchandisation ne se développe. Il faut donc ouvrir un débat public sur cette question, qui devrait proposer à la discussion les principes suivants : interdiction à une mineure de faire un tel don, consentement préalable et éclairé, gratuité du don (interdiction de la rémunération), remboursement des frais occasionnés pour effectuer le don, compensation des salaires non perçus, suivi médical post don remboursé à 100 %, recueil des ovocytes uniquement dans des centres publics, séparation totale des centres de recueil et des laboratoires de recherches et anonymat total des donneuses pour les laboratoires de recherches. - La faiblesse des moyens humains et financiers en France La France accuse un retard important dans ce domaine. L'Etat doit donc afficher ses priorités en matière de recherche sur les cellules souches adultes et embryonnaires à travers les appels d'offres de l'Agence nationale de la recherche (A.N.R.). La presse traite beaucoup plus souvent des cellules souches embryonnaires que des cellules souches adultes mais, comme dans tous les pays, il y a, en France, beaucoup plus d'équipes engagées sur celles-ci que sur celles-là. - Les publications scientifiques Les affaires « Hwang » et « Lanza » ont attiré l'attention sur les publications scientifiques qui sont en nombre très important : environ 200 000 publiant 25 millions d'articles. Ces entreprises privées sont engagées dans une très forte concurrence qui s'est aggravée avec l'apparition de publications électroniques sur Internet. Elles sont parfois tentées d' « accélérer » le processus de relecture afin de bénéficier d'une publication plus rapide, au risque de ne pas détecter des anomalies. Ces revues constituent les sources essentielles de la presse généraliste. Des publications insuffisamment contrôlées entraînent ainsi la propagation d'erreurs. Cela a été le cas dans ces deux affaires. Le rapporteur a émis la suggestion que chaque auteur, en cas de copublication d'un article, indique sa part réelle dans le travail publié. Au niveau des politiques publiques, il a recommandé que tout chercheur convaincu de fraude scientifique soit définitivement exclu du bénéfice de subventions publiques, nationales ou européennes. - La brevetabilité et la marchandisation du vivant Les brevets facilitent l'innovation et la diffusion de la connaissance. Il a rappelé qu'il s'était déjà opposé au fait de breveter le gène et son application, ce qui revient à breveter la connaissance, et qu'il était partisan de n'autoriser que les brevets d'application. Les mêmes difficultés se retrouvent avec les cellules souches où les brevets de l'Université du Wisconsin dominent tout ce domaine. L'Office européen des brevets (O.E.B.) ne délivre pas de brevet sur les lignées de cellules souches embryonnaires, sa grande chambre de recours étant actuellement saisie de cette affaire. Après avoir évoqué le caractère confus de l'avis du Comité consultatif national d'éthique (C.C.N.E.) sur « La commercialisation des cellules souches et autres lignées cellulaires », il a recommandé qu'on ne puisse pas breveter les cellules souches, éléments du corps humain, mais uniquement les produits d'application. - Les défis sociaux et économiques Avant d'y être contraint par l'avancée de la science, il faut réfléchir aux défis sociaux et notamment : - qui seront les bénéficiaires éventuels de ce type de médecine ? - quelles seront les modalités de financement d'un traitement par thérapie cellulaire ? - les éventuelles futures thérapies cellulaires, traitements strictement individualisés, ne risquent-elles pas d'entraîner une logique d'assurance individuelle ? Economiquement, la génomique avait permis aux start up de drainer des sommes considérables. Les cellules souches ne sont financées que par les fonds publics et les associations de malades. Il est compréhensible que celles-ci recherchent des résultats immédiats, mais cela ne doit pas entraîner des relations ambiguës avec les pouvoirs publics. M. Pierre-Louis Fagniez, député, a félicité le rapporteur pour la qualité de son travail. Il a estimé que celui-ci arrive de façon opportune au moment où le Téléthon vient d'être très fortement soutenu par le Président de la République. Après avoir rappelé la première greffe de moelle osseuse réussie par M. Georges Mathé en 1959, il a considéré que le rapport de M. Alain Claeys, tout comme celui qu'il a lui-même remis récemment au gouvernement, montrait que ce problème devait être revu régulièrement tous les cinq ans. Il s'est donc déclaré partisan de respecter le délai de cinq ans fixé par la loi de 2004 pour son réexamen. Par contre, il a adhéré à la proposition de M. Alain Claeys de revoir l'article 25 de cette loi en estimant qu'il était sans doute temps de soumettre la recherche sur l'embryon à un régime d'autorisation. Il s'est félicité des propos du rapporteur soulignant la qualité de l'action de l'Agence de la biomédecine, dont il est membre du conseil d'orientation. S'agissant de la Convention d'Oviedo, il a approuvé la proposition du Rapporteur de suivre l'exemple des Pays-Bas dans leur interprétation de l'article 1er du Protocole additionnel. Il a conclu son intervention en estimant que le transfert nucléaire devrait être envisagé en tenant compte du problème central que posent les ovocytes et qu'il devrait être possible de trouver une solution sans exploiter les femmes. M. Alain Claeys, député, rapporteur, a évoqué à cet égard la recommandation 18 qui prévoit d'engager un programme de recherches sur la dérivation d'ovocytes à partir de cellules souches embryonnaires. Au-delà, il a considéré que le principe de gratuité et d'anonymat est peut-être menacé comme le montrent certaines déclarations dans la presse. Il a estimé que le législateur devait être très ferme sur ce principe et qu'il ne fallait surtout pas s'engager dans la voie de la rémunération pour les produits du corps humain. M. Claude Birraux, député, premier vice-président, a félicité à son tour le rapporteur pour son travail, en soulignant que les louanges adressées par M. Pierre-Louis Fagniez avaient d'autant plus de poids qu'elles émanaient d'un praticien hospitalier professeur d'université. Il a estimé que le thème abordé dans le cadre du rapport constituait un des sujets sur lesquels l'Office se doit exercer une évaluation permanente, et dont il doit être saisi régulièrement. Après avoir rappelé que, lors de l'examen de la loi bioéthique de 2004, M. Jean-François Mattei avait indiqué que le clonage n'avait pas été encadré dans les premières lois bioéthiques, car on pensait alors que cette perspective était trop lointaine, il a considéré que la rapidité avec laquelle les évolutions se produisent dans ce domaine justifie un suivi de la question, allant au-delà d'une simple veille technologique. Il a par ailleurs remarqué que les recommandations émises par le rapporteur suscitaient des interrogations, dans la mesure où, à côté de recommandations générales liées à l'actualité du sujet, étaient formulées des propositions tendant à réviser la loi du 7 août 2004 relative à la bioéthique. Il a rappelé à ce propos que cette loi confie à l'OPECST un double travail d'évaluation selon un calendrier précis, d'une part en 2008, une évaluation globale de ladite loi, prévue par son article 40 et, d'autre part, conformément à son article 26, quatre ans et demi après l'intervention du décret en Conseil d'Etat du 6 février 2006, soit en 2010, une évaluation de l'application des dispositions relatives aux recherches sur l'embryon et aux cellules souches embryonnaires, laquelle est parallèlement confiée à l'Agence de biomédecine. Concluant qu'il ne faudrait pas trop anticiper sur les travaux d'évaluation que l'Office doit réaliser en application de la loi, ni restreindre démesurément la marge d'appréciation des évaluateurs désignés après 2007, il a exprimé sa préférence pour un classement et une présentation différents des recommandations. Sur la proposition 5, relative à la Convention d'Oviedo, il a suggéré, recueillant sur ce point l'assentiment du rapporteur, de corriger la rédaction de l'exposé des motifs, jugeant préférable de s'en tenir à une opposition stricte au clonage reproductif, sans lancer de nouvelles polémiques, dans un contexte marqué par une forte pression des extrêmes : d'un côté, ceux qui veulent restreindre le cadre légal actuel ou nient la légitimité éthique des recherches effectuées dans le respect de celui-ci, de l'autre, ceux qui demandent de l'assouplir exagérément. Enfin, il a souhaité obtenir des précisions sur la proposition 18 relative à la dérivation d'ovocytes à partir de cellules souches embryonnaires, censée permettre de se dispenser de l'utilisation d'ovocytes humains. M. Alain Claeys a précisé que la transposition nucléaire nécessite beaucoup d'ovocytes humains, comme l'a montré l' « affaire Hwang », et que des recherches étaient en cours pour dériver des ovocytes à partir de cellules souches embryonnaires, ce qui permettrait de ne pas instrumentaliser la femme. M. Daniel Raoul, sénateur, a souligné le caractère très pédagogique de la présentation du Rapporteur et a suggéré que le titre du rapport mentionne les cellules « humaines » plutôt que les cellules « vivantes », qui ont une acception plus large. Il a ensuite insisté sur le fait qu'il ne fallait pas autoriser la brevetabilité du gène et de sa fonction. M. Alain Claeys a approuvé la suggestion de M. Daniel Raoul concernant le titre du rapport. M. Henri Revol, sénateur, président, a souhaité qu'un glossaire soit adjoint au rapport afin d'en faciliter la lecture. Il a ensuite proposé d'approuver ce rapport, qui a été adopté à l'unanimité. Composition du comité de pilotage Le Comité de pilotage de ce rapport était composé de : M. Michel Caboche, directeur de recherche à l'I.N.R.A., membre de l'Académie des sciences, M. Hervé Chneiweiss, directeur de recherche au C.N.R.S., professeur au Collège de France, membre du Conseil scientifique de l'Office, M. Axel Kahn, directeur de recherche à l'I.N.S.E.R.M., membre correspondant de l'Académie des sciences, membre du Conseil scientifique de l'Office, M. Daniel Louvard, directeur de recherche au C.N.R.S., directeur de la section de recherche de l'Institut Pasteur, membre de l'Académie des sciences. Liste des personnes auditionnées France Auditions privées - M. Xavier Bertrand, ministre de la santé et des solidarités - M. François Goulard, ministre délégué à l'enseignement supérieur et à la recherche - M. Gilles Bloch, directeur de l'Agence nationale de la recherche - M. Gérard Bréart, conseiller technique au cabinet de M. Xavier Bertrand, ministre de la santé et des solidarités - Mme Carine Camby, directrice général de l'Agence de la biomédecine - M. Cédric Grouchka, directeur adjoint du cabinet de M. Xavier Bertrand, ministre de la santé et des solidarités - M. Gabriel Keller, ambassadeur chargé de la bioéthique - Mme Anne -Marie Masquelier, directrice générale de Généthon - M. Marc Peschanski, directeur de recherche à l'Inserm, coordonateur du projet I-Stem - M. Anselme Perrier, attaché de recherche à l'Inserm, chargé de recherche à I-Stem - M. David Sourdive, directeur général délégué de Cellectis - Mme Laurence Tiennot-Herment, présidente de l'Association française contre les myopathies Auditions publiques du 22 novembre 2005 - M. Daniel Aberdam, directeur de recherche à l'Inserm - M. Jean-Claude Ameisen, professeur des universités, praticien hospitalier, président du Comité d'éthique de l'Inserm, membre du Comité consultatif national d'éthique - M. Christian Bréchot, directeur général de l'Inserm - Mme Marina Cavazzana-Calvo, professeur des universités, chef du service du département de biothérapie de l'hôpital Necker-Enfants malades, coordinatrice du Centre d'investigation clinique intégré en biothérapie du CHU Necker-Enfants malades - M. Hervé Chneiweiss, directeur de recherche à l'Inserm, professeur au Collège de France, membre du Comité de pilotage - Mme Laure Coulombel, directeur de recherche à l'Inserm - Mme Anne Fagot-Largeault, philosophe et médecin, professeur au Collège de France, membre de l'Académie des sciences - M. Alain Fischer, professeur de médecine, directeur de l'Unité 429 de l'Inserm (hôpital Necker-Enfants malades), membre de l'Académie des sciences - M. René Frydman, professeur des universités et gynécologue, - M. Jacques Hatzfeld, directeur de recherche au CNRS - M. André Hovine, président de France Parkinson - M. Bertrand Jordan, directeur de recherche au CNRS, conseiller à Marseille-Nice Génopole - Mme Evelyne Jouvin-Marche, directrice scientifique adjointe du département du vivant du CNRS - M. Axel Kahn, directeur de recherche à l'Inserm, membre du Comité de pilotage - M. Daniel Louvard, directeur de la section de recherche de l'Institut Curie, membre de l'Académie des sciences, membre du Comité de pilotage - M. Philippe Ménasché, professeur de chirurgie thoracique et cardiovasculaire à l'université de Paris V, chirurgien cardiaque à l'hôpital Georges-Pompidou, directeur d'unité Inserm - Mme Marianne Minkowski, directrice adjointe du département biologie du cancer à l'Institut national du cancer - Mme Marie-Odile Ott, responsable du secteur « Recherche » et des programmes internationaux de l'Agence de la biomédecine - M. Marc Peschanski, directeur de recherche à l'Inserm - M. Roger Picard, porte-parole de l'Alliance maladies rares - M. Christian Pinset, fondateur et président-directeur général de Celogos - M. Philippe Pouletty, président de France Biotech - Mme Ketty Schwartz, vice-présidente du Conseil d'administration de l'Inserm, ancienne directrice de la recherche au ministère de la Recherche - M. Didier Sicard, président du Comité national consultatif d'éthique - M. Claude Sureau, président honoraire de l'Académie nationale de médecine, membre du Comité consultatif national d'éthique - M. David Sourdive, directeur général délégué de Cellectis - Michel Van der Rest, directeur du département du vivant du CNRS - Jean-Thomas Vilquin, fondateur de l'entreprise Myoxis - Mme Siobhán Yeats, directrice « Biotechnologies » à l'Office européen des brevets - M. Bernard Zalc, directeur de recherche à l'Inserm Belgique - M. Jean-Michel Baer, directeur à la Direction générale « Recherche » de la Commission européenne - M. Thomas Brégeon, conseiller à la Direction générale « Santé et protection des consommateurs » de la Commission européenne - Mme Bénédicte Caremier, conseillère au cabinet du commissaire à la recherche de la Commission européenne - Mme Jacqueline Minor, directrice à la Direction générale « Marché intérieur » de la Commission européenne - M. Jean-Philippe Müller, conseiller (propriété industrielle) à la Direction générale « Marché intérieur » de la Commission européenne - M. Fabien Raynaud, maître des requêtes au Conseil d'Etat, conseiller juridique de la Représentation permanente de la France auprès de l'Union européenne - M. Nicolas Rossignol, responsable des projets scientifiques et techniques à la Direction générale « Industrie » de la Commission européenne - Mme Caroline Trouet, conseillère à la Direction générale « Santé et protection des consommateurs » de la Commission européenne Corée - M. Philippe L. Bernstein, chargé des affaires scientifiques et des relations internationales de l'Institut Pasteur de Corée - M. Régis Grailhe, coordonnateur de la recherche de l'Institut Pasteur de Corée - Mme Kim Jung-hee, directrice générale du Bureau d'évaluation de la technologie au ministère de la science et de la technologie - Mme Lee Soo-young, présidente d'une association de donneuses d'ovocytes - M. Moon Shin-yong, directeur du Centre de recherche national sur les cellules souches - M. Ulf Nehrbass, directeur de l'Institut Pasteur de Corée - Mme Park Ki-young, ancienne conseillère scientifique du président Roh Moo-hyun - M. Park Kook-in, directeur du laboratoire de recherches de thérapie génique et cellulaire de l'université Yonsei - Mme Park Young-wook, chef du cabinet de Mme Kim Myung-ja, députée à l'Assemblée nationale coréenne - M. Yang Sam-sung, ancien président du Comité national d'éthique - Mme Suh Hae-suk, députée à l'Assemblée nationale coréenne - Mme Yoon Jeung-huh, directrice politique du comité politique du parti Uri Etats-Unis - M. Roscoe Bartlett, membre de la Chambre des Représentants des Etats-Unis - M. James F. Battey, directeur aux National Institutes of Health - M. Louis Casteilla, professeur (plasticité tissulaire et cellulaire) à l'université de Toulouse, détaché à l'Université de Pittsburgh - M. Nicolas Charles, post doctorant aux National Institutes of Health - M. Linzhao Cheng, professeur associé de gynécologie/obstétrique et d'oncologie à l'Université Johns Hopkins - M. Tao Cheng, directeur du département de biologie des cellules souches de l'Institut du cancer de l'Université de Pittsburgh - M. Michaël Clarke, directeur adjoint de l'Institut de recherche sur les cellules souches de l'Université Stanford - M. George Q. Daley, professeur de pédiatrie, de chimie biologique et de pharmacologie moléculaire au Children's General Hospital de Boston - Mme Laure Croisille-Péault, professeur de pathologie à l'Institut du cancer de l'Université de Pittsburgh - M. Djibril V. Diop, assistant de Mme Carole Midgen, membre du Sénat de Californie - M. Albert D. Donnenberg, professeur de médecine, directeur de l'Institut du cancer de l'Université de Pittsburgh - Mme Vera S. Donnenberg, professeur de chirurgie et de pharmacie à l'Université de Pittsburgh - M. Kevin C. Eggan, professeur assistant de biologie moléculaire à Harvard Medical School - M. Lino S. Ferreira, attaché de recherche au Massachusetts Institute of Technology - M. Thomas F. Finneran, président du Massachusetts Biotechnology Council - M. Don Gibbons, vice-doyen chargé des relations publiques de Harvard Medical School - M. Armand de Gramont, post doctorant aux National Institutes of Health - M. Henry T. Greely, professeur de droit à l'Université Stanford - M. Louis M. Guenin, professeur de bioéthique à Harvard Medical School - M. Peter Hansel, membre de l'Office de recherche du Sénat de Californie - M. Robert G. Hawley, professeur d'anatomie et de biologie cellulaire à l'Université George Washington - M. Johnny Huard, professeur associé de chirurgie orthopédique et de génétique moléculaire à l'école de médecine de l'Université de Pittsburgh - M. Rudolf Jaenisch, professeur de biologie au Massachusetts Institute of Technology, membre fondateur du Whitehead Institute - M. James C. Kennedy, directeur de la recherche à la Chambre des Représentants du Massachusetts - M. Douglas Kerr, professeur associé de neurologie à l'Université Johns Hopkins - M. Robert Klein, président du IndependantCitizens' Oversight Committe - M. Eric Lagasse, professeur associé au département de pathologie de l'Université de Pittsburgh - Mme Jane S. Lebkowski, vice-présidente de Geron, chargée de la médecine régénérative - Mme Annie LeGuern, responsable des licences au Bureau de la propriété intellectuelle du Children's General Hospital de Boston - M. William Lensch, attaché de recherche au Children's General Hospital de Boston - M. Paul Lerou, attaché de recherche au Children's General Hospital de Boston - M. Arthur S. Levine, premier Vice-chancelier de l'Université de Pittsburgh, Doyen de l'école de médecine de l'Université de Pittsburgh - M. Bernard Lo, professeur de médecine, directeur du programme d'éthique médicale à l'Univrsité de Californie (San Francisco) - M. David C. Magnus, professeur de pédiatrie à l'Université Stanford - Mme Debra JH Mathews, directrice des programmes scientifiques de l'Institut de bioéthique Phoebe R. Berman (Université Johns Hopkins) - Mme Margaret C. McDonald, vice chancelière de l'Université de Pittsburgh, chargée des affaires de recherche - M. Alexandre Méjat, post doctorant aux National Institutes of Health, administrateur du Centre d'étude des cellules souches (C.E.C.S/I-Stem) - M. Eran Meshorer, chercheur à l'Institut national du cancer (National Institutes of Health) - M. Gene Mullin, membre de la Chambre des Représentants de Californie - Mme Pearl O'Rourke, directrice de la recherche à Parners Healthcare system Inc. - M. Amit N. Patel, professeur de chirurgie cardiaque au Presbyterian Hospital de l'Université de Pittsburgh - M. Bruno Péault, professeur de biologie cellulaire et de physiologie de l'école de médecine de l'Université de Pittsburgh - Mme Lucilia Pereira-Mouries, post doctorante aux National Institutes of Health - M. Brock Reeve, directeur exécutif du Harvard Stem Cell Institute - M. Jeffray D. Rothstein, directeur du Centre de recherche Robert Packard de l'Université Johns Hopkins - M. George Runner, membre du Sénat de Californie - M. Jeffray Sanchez, membre de la Chambre des Représentants du Massachusetts - M. Andrew W. Siegel, professeur de gynécologie/obstétrique, directeur des programmes de recherche de l'Institut de bioéthique Phoebe R. Berman (Université Johns Hopkins) - Mme Sonia S. Sutter, professeur de droit à l'Université George Washington - M. Robert E. Travaglini, président du Sénat du Massachusetts - M. Rocky S. Tuan, directeur du laboratoire de biologie du cartilage et d'orthopédie (National Institutes of Health) - Mme Nicole Vasquez, consultante au Comité de la santé du Sénat de Californie - Mme Monique Yoakim-Turk, responsable des produits pédiatriques au Bureau de la propriété intellectuelle du Children's General Hospital de Boston Grande-Bretagne - M. Geoffrey Boulton, professeur à l'Université d'Edinburgh - Mme Jane Bower, professeur à l'Université de Dundee, présidente du Scottish Stem Cell Network - M. Ian Gibson, député, ancien président du Science and Technology Committee de la Chambre des Communes - Mme Petra Hajkova, post doctorante au Wellcome Trust/Cancer Research UK Gurdon Institute - Mme Anne McLaren, directrice de recherche au Wellcome Trust/Cancer Research UK Gurdon Institute - Mme Angela McNab, directrice exécutive de la Human Fertilisation and Embryology Authority - Mme Alison Murdoch, professeur de médecine de la reproduction au Newcastle Fertility Center at Life - Mme Christine O'Toole, directrice du département de la réglementation et de la recherche de la Human Fertilisation and Embryology Authority - M. Mark Pitman, directeur du programme scientifique et des affaires internationales du Medical Research Council - M. Harald Schmidt, directeur adjoint du Nuffield Council of Bioethics - Mme Alison Stewart, directrice de recherche au Cambridge Genetics Knowledge Park - Mme Sandy Thomas, directrice du Nuffield Council of Bioethics - M. Matthew Wakelin, directeur du programme de biologie du développement du Medical Research Council - Mme Susan Wallace, directrice de recherche au Cambridge Genetics Knowledge Park - M. Ian Wilmut, professeur de science de la reproduction à l'Université d'Edinburgh Japon - M. Hideo Funabashi, directeur adjoint du Centre pour le développement de la biologie (RIKEN) - M. Ryuichi Ida, professeur à la faculté de droit de Kyoto, ancien président du Comité de bioéthique de l'U.N.E.S.C.O. - M. Hiroo Imura, président de la Fondation pour la recherche biomédicale et l'innovation - Mme Yoko Matsubara, professeur d'histoire des sciences à l'Université Ritsummeikan de Kyoto - M. Takahido Mori, président du Comité de bioéthique de la Société japonaise de fertilisation et de fécondation - M. Yoshiharu Morimoto, président de la Société japonaise de fertilisation et de fécondation - M. Kenzo Nakajima, président de Stem Cell Science KK - M. Norio Nakatsuji, directeur du Centre de recherche sur les cellules souches de l'Université de Kyoto - M. Yoshiko Sasai, directeur du groupe d'organogenèse et de neurogenèse du Centre pour le développement de la biologie (RIKEN) - M. Masatoshi Takeichi, directeur du Centre pour le développement de la biologie (RIKEN) Organisation des Nations Unies pour l'éducation, la science et la culture (U.N.E.S.C.O.) - M. Henk ten Have, directeur à la division de l'éthique des sciences et des technologies (sciences sociales et humaines) République fédérale d'Allemagne - M. Manuel Desantes, vice-président de la Direction générale 5 de l'Office européen des brevets - M. Alain Pompidou, professeur de médecine, député européen honoraire, président de l'Office européen des brevets - M. Pierre Treichel, juriste à la Direction du droit des brevets de l'Office européen des brevets - Mme Siobhán Yeats, directrice « Biotechnologies » à l'Office européen des brevets Audition publique du 22 novembre 2005 Sommaire Avant-propos par M. Alain Claeys 181 Ouverture de la séance 185 Introduction : les cellules souches dans l'évolution de la biologie 187 Table ronde n° 1 : les caractéristiques des cellules souches 197 Table ronde n° 2 : les enjeux pour la recherche. La position de la France 211 Table ronde n° 3 : quelles utilisations des cellules souches : l'enjeu de la santé 229 Table ronde n° 4 : les enjeux économiques 257 Table ronde n° 5 : le clonage scientifique : quelles perspectives ? 285 Avant-propos Madame, Monsieur, Dans le cadre de la préparation de mon rapport concernant « Les recherches sur le fonctionnement des cellules vivantes », demandé à l'Office par le Bureau de l'Assemblée nationale, j'ai souhaité organiser une journée d'auditions publiques ouvertes à la presse sur le problème particulier des cellules souches adultes et embryonnaires. L'audition de spécialistes du sujet s'avérait absolument nécessaire pour au moins deux raisons majeures. D'une part l'extrême rapidité des travaux menés dans ce domaine rend difficile un suivi précis et un recul critique permettant de distinguer les faits avérés des annonces sans lendemain. D'autre part les retards ont été pris dans l'application de la loi d'août 2004 et il y a des dangers d'amalgame entre les cellules souches embryonnaires et la transposition nucléaire. Cette nécessité s'est aussi imposée à moi compte tenu du véritable déferlement médiatique qui a accompagné, tout au long de l'année 2005, les nouvelles en provenance de Corée. En effet, on s'en souvient, une équipe coréenne avait revendiqué la production de plusieurs lignées de cellules souches embryonnaires humaines en utilisant la technique de la transposition nucléaire. Aussitôt le pas avait été allègrement franchi : la possibilité de guérison d'affections encore incurables, telles les maladies de Parkinson et d'Alzheimer, était en vue, était à la portée de la main, était là ! Cette attitude n'était d'ailleurs pas l'apanage de certains média mais aussi d'éminents professeurs de médecine qui distillaient, de façon irresponsable, de faux espoirs aux malades et à leurs proches. Il était donc nécessaire de faire un point très précis sur l'état d'avancement des recherches dans ce domaine des cellules souches. Il m'est apparu qu'il était indispensable que cet état des lieux soit fait publiquement afin que, au-delà du rapporteur, l'opinion publique soit informée des principaux et véritables enjeux de ce domaine. J'ai aussi souhaité que s'instaure un échange de vues public, de préférence aux classiques auditions privées pour susciter un débat sur ce sujet. J'espère que cette discussion sera reprise de façon très large au niveau national comme cela a eu déjà lieu dans un certain nombre de pays comme les Etats-Unis lors de l'élection présidentielle de 2004 et en Suisse à l'occasion du référendum du 28 novembre 2004. J'ai donc réuni les chercheurs français les plus compétents sur ce sujet à l'Assemblée nationale le 22 novembre 2005. Je les remercie d'avoir bien voulu accepter de venir rendre compte de leurs travaux et de leurs analyses des recherches effectuées dans leur domaine au niveau international. Qu'ils acceptent toute ma gratitude pour leur présence ce jour. Le débat a été passionnant et très dense de bout en bout. Il a été parfois très animé mais est toujours resté d'une grande courtoisie. Que disent les chercheurs ? Leur message principal est que la France prend actuellement du retard par rapport à ses concurrents européens et mondiaux. Les chercheurs posent en effet très clairement la question de l'introduction de l'autorisation de la transposition nucléaire dans la loi du n° 2004-800 du 6 août 2004 relative à la bioéthique. Cependant, comme ils le reconnaissent eux-mêmes, des problèmes devront être résolus en cas de modification de cette loi. La difficulté la plus importante réside dans la nécessité de disposer d'ovocytes en grandes quantités pour réaliser une transposition nucléaire, compte tenu du faible taux de réussite de celle-ci. Cette situation fait planer une menace très réelle de commercialisation des ovocytes et, partant de leur marchandisation, à laquelle il faut très résolument s'opposer. Les chercheurs ont aussi adressé d'autres reproches à la loi. Ils lui ont ainsi reproché d'avoir instauré des procédures trop complexes et donc pénalisantes pour leur travail. J'examinerai cette question dans mon rapport notamment en évaluant les pratiques de l'Agence de la biomédecine qui se met juste en place. A ce propos, il faut souligner que plus d'un an et demi après l'entrée en vigueur de la loi, le décret d'application sur les conditions d'autorisation et mise en œuvre des recherches menées sur les embryons humains vient juste d'être publié, soit dix-huit mois après la publication de la loi. Ce retard a certainement désavantagé la recherche française. Cette situation est d'autant plus dommageable que la concurrence mondiale s'exacerbe dans ce domaine comme j'ai pu le constater lors d'une récente mission en Asie. Pour élaborer mon rapport, j'ai en effet pris le parti de me rendre dans quelques-uns des pays les plus en pointe dans ce domaine afin d'évaluer très précisément leur situation. J'estime en effet qu'un tel sujet ne peut pas être abordé et traité dans l'urgence et la précipitation certainement nuisibles à une réflexion approfondie, documentée et équilibrée.
Ce travail sur les cellules souches embryonnaires est encore du domaine de la seule recherche fondamentale. Pour avoir voulu sans doute brûler les étapes, l'équipe coréenne qui a défrayé la chronique en 2005 s'est fourvoyée dans une fraude scientifique de grande ampleur. Néanmoins cette affaire, qu'il convient d'apprécier seulement sur le plan de l'honnêteté scientifique, ne doit absolument pas jeter l'opprobre sur tout le secteur de la recherche sur les cellules souches embryonnaires et adultes. La recherche sur la transposition nucléaire ne doit pas non plus être victime de sa proximité avec le clonage reproductif que je condamne très fermement. J'apprécie tout à fait le point le point de vue de M. Alain Fischer sur ce point. En effet celui-ci indiquait au cours de cette audition publique, qu'il ne faut pas condamner la transposition nucléaire car « par définition, un développement scientifique est neutre : il n'est ni positif, ni négatif. Il faut [le] réglementer de telle manière que l'on favorise le développement socialement « utile » et en évitant un développement que la société, à juste titre, ne souhaite pas. »
Il faut donc qu'une nouvelle sérénité soit aujourd'hui retrouvée sur ce sujet. Cela remet certainement en cause la précipitation qui, cette dernière année, a trop souvent tenu obscurci le débat sur ce sujet d'une grande complexité. Une fois de plus il s'avère que le temps scientifique ne doit être, en aucune façon, être asservi au temps médiatique. Il faut assurément dans ce domaine « laisser du temps au temps ». J'ai la conviction que les cellules souches, aussi bien adultes qu'embryonnaires, ont certainement un immense potentiel. Cela permettra d'abord de mieux connaître les formidables secrets de la Vie. Dans un avenir qui reste aujourd'hui incertain, se lèveront peut-être des espoirs pour un certain nombre d'affections aujourd'hui incurables. Je serai amené à faire des recommandations très concrètes sur l'utilisation des cellules souches dans le rapport que j'élaborerai dans les prochains mois. Au-delà des problèmes scientifiques, cette question soulève d'immenses questions éthiques dont le débat public doit s'emparer. Comme le soulignait M. Jacques Chirac, Président de la République, dans la lettre qu'il m'a adressée le 15 décembre dernier, dans ce domaine, « il convient d'agir avec discernement afin que soit exclue toute conception utilitariste de l'être humain ». Je souscris naturellement à ce souci qui doit être primordial dans ce domaine. Pour autant il faut aussi, dans le même temps que nos chercheurs se sentent fermement encouragés à aller dans de l'avant pour « faire reculer la souffrance, la maladie, le handicap » comme le notait encore le Président de la République dans la même missive. Alain Claeys Député de la Vienne La séance est ouverte à 9 heures sous la présidence de Monsieur Alain Claeys, député de la Vienne, rapporteur. Ouverture par M. Alain Claeys, Député de la Vienne, rapporteur Mesdames et Messieurs, je vous remercie d'avoir répondu à mon invitation. Je vais dire quelques mots sur cette journée et quelle a été ma démarche. Député de la Vienne, je précise tout d'abord que je ne suis ni médecin ni chercheur. J'ai eu l'occasion de m'intéresser à tous ces sujets de bioéthique dès 1997, lorsque l'Office parlementaire d'évaluation des choix scientifiques et technologiques a réalisé l'évaluation de la loi bioéthique de 1994. Le législateur avait décidé que cette loi devait être évaluée au bout de cinq ans par l'Office parlementaire. C'est dans le cadre de cet Office que j'ai fait cette évaluation avec Claude Huriet qui était à l'époque sénateur. C'est à partir de cette date que j'ai commencé à m'intéresser à la bioéthique. Nous avons fait deux rapports, puis j'ai animé, à l'Assemblée nationale, la mission d'information préparatoire au projet de loi de révision des lois « bioéthique » de 1994. En première lecture, j'ai été le rapporteur du projet de loi « bioéthique ». Après le changement de majorité, le projet de loi a été adopté en deuxième lecture en août 2004. Parallèlement, à la demande de l'Office, j'ai fait deux rapports sur la propriété intellectuelle et les brevets. Le premier avait trait à l'analyse de la directive européenne 98/44/CE du 6 juillet 1998 relative à la protection juridique des inventions biotechnologiques qui a été transposée en droit français. Le deuxième abordait la propriété intellectuelle dans le domaine du vivant. Nous aurons l'occasion d'y revenir cet après-midi, plus particulièrement dans la quatrième table ronde. Cette audition d'aujourd'hui entre dans le cadre d'une nouvelle étude que le Bureau de l'Assemblée nationale a demandée à l'Office, concernant la recherche cellulaire. Nous aborderons à travers ce sujet la problématique des cellules souches et ce que l'on appelle le clonage à visée thérapeutique, scientifique, mais d'autres expressions doivent être utilisées. Si l'on pouvait aujourd'hui clarifier ces notions, ce serait une bonne chose. Je souhaite que dans cette journée, tout puisse être dit, à la fois sur votre appréciation de la loi de 2004, sa mise en œuvre, sur les enjeux en termes de recherche, de santé, et pour faire un point assez précis sur ce sujet du clonage, la situation à l'étranger, les résultats aujourd'hui et les problèmes éthiques. Tout cela est nécessaire pour une bonne compréhension de ce sujet et pour ne pas rester dans des annonces journalistiques, parfois sensationnelles, qui cachent dans une certaine mesure la réalité. Je voudrais excuser un des intervenants prévus qui ne pourra, à mon regret, être présent. En effet, Mme Carine Camby, directrice générale de l'Agence de la biomédecine, va quitter ses fonctions dans les jours qui viennent. Elle m'a indiqué qu'elle ne pouvait pas malheureusement, de ce fait, représenter l'Agence aujourd'hui. Elle devait participer à la deuxième table ronde. Nous allons commencer. Je voudrais avant cela remercier Mme Ketty Schwartz d'avoir accepté mon invitation et d'ouvrir nos débats. La tâche n'est pas simple. La première question que j'ai envie de lui poser est qu'elle nous explique en quoi ce qui se passe aujourd'hui, sur les cellules souches, constitue une révolution dans la recherche et comment nous abordons en France cet enjeu, ainsi que sa vision de ce qui se passe à l'étranger. Nous pouvons ainsi poser le débat, ce qui nous permettra au fur et à mesure des différentes Tables rondes d'approfondir les sujets. Introduction : Mme Ketty Schwartz, vice-présidente du Conseil d'administration de l'Inserm, ancienne directrice de la recherche au ministère de la Recherche Monsieur le Député, Mesdames et Messieurs, c'est un très grand honneur pour moi de tenter de répondre aux questions simples, évidentes, que vous avez posées, surtout devant un parterre aussi prestigieux de scientifiques, de politiques et de représentants de la société civile de notre pays. Je voudrais également vous dire combien nous vous sommes reconnaissants d'avoir accepté la lourde tâche de préparer un nouveau rapport concernant les recherches sur le fonctionnement des cellules vivantes. Si nous voulons faire avancer la législation de notre pays, ce rapport ne pouvait être confié à de meilleures mains que les vôtres. La thématique d'aujourd'hui, les cellules souches, est probablement un des domaines de la biologie dont l'évolution, depuis quelques années, est parmi les plus spectaculaires. Vous avez parlé de révolution, et le terme n'est pas trop fort. Cette révolution est portée à la fois par l'expansion sans précédents de nos connaissances sur les séquences des génomes des organismes vivants depuis même pas une dizaine d'années, sur la structure et sur la fonction des gènes, sur la façon dont nous avons appris à modifier les organismes vivants, en particulier des petits modèles animaux, tels que la souris, par transfert ou remplacement de gènes, et par le développement depuis une dizaine d'années de la biologie à grande échelle et des nanotechnologies. L'intérêt des cellules souches aujourd'hui est considérable, à la fois sur les plans cognitif, thérapeutique et économique. Dans un domaine aussi évolutif que celui-là et suscitant autant de questions éthiques, il est bon que le temps de la réflexion éthique et du débat démocratique s'harmonise avec celui de la recherche, afin que puissent être définis des mécanismes de contrôle et de décision qui soient complètement transparents, adaptés à l'évolution des acquis scientifiques et qu'ils permettent à nos chercheurs d'explorer, en toute légalité, les nouvelles voies et les nouveaux chemins qui mèneront à la connaissance. Pour recadrer un peu le débat, que signifie et qu'entend-on sous le vocable « cellules souches » ? Les cellules souches sont caractérisées par trois propriétés fondamentales, quelle que soit leur origine ou le stade de développement auquel on les trouve. D'une part, ce sont des cellules indifférenciées, c'est-à-dire qu'elles n'ont aucun caractère spécifique d'un tissu, et elles ne sont pas capables d'exprimer une fonction spécifique. Ainsi, elles ne peuvent pas s'associer avec leur voisine, pomper du sang, comme le font les cellules adultes du tissu cardiaque, et elles ne peuvent pas transporter de l'oxygène dans le courant sanguin. Ce sont des cellules capables, dans des conditions particulières, à la fois in vivo, mais également ex vivo, dans des tubes de culture, de se diviser et de proliférer à l'état indifférencié. Enfin, ce sont des cellules qui sont capables de se différencier en cellules spécialisées, ce qui signifie que les quelque deux cents types cellulaires qui constituent notre organisme proviennent tous à l'origine de cellules souches. Quelles sont les étapes de cette différenciation, différenciation des tissus humains et des tissus des mammifères en général ? Au départ, il y a l'œuf, le zygote, l'œuf fécondé, qui est dit cellule totipotente, parce qu'il peut donner tous les types cellulaires. Au fur et à mesure des divisions, les spectres de différenciation des cellules filles s'amenuisent, c'est-à-dire que dans les blastocytes, d'où sont issues les lignées de cellules souches embryonnaires humaines, dans cette masse interne, les cellules sont dites pluripotentes parce qu'elles vont être à l'origine des trois grandes lignées (ectoderme, mésoderme et endoderme), qui commencent à perdre un éventail de possibilités de différenciations et qui deviennent multipotentes. On parle ensuite de cellules précurseurs, comme celles du muscle squelettique, qui sont des cellules qui n'ont plus que deux choix de différenciation : devenir cellules du muscle squelettique rapide ou du muscle squelettique lent. Les cellules précurseurs se trouvent dans les tissus adultes. C'est ce que l'on appelle les cellules souches adultes. Depuis quelques années, l'existence de cellules souches multipotentes dans les tissus adultes a été le sujet d'un certain nombre de travaux. Il semble clair qu'il en existe aussi dans ces tissus. Au xxe siècle, l'étude de ces cellules était incluse dans le grand champ de la biologie du développement et notre pays s'était particulièrement illustré dans ce domaine. J'en veux pour preuve la première diapositive qui nous avait été présentée à Mme Judith Melki, à M. Guy Fuhrmann et à moi-même, par M. John Gearhart qui nous exposait l'état d'avancement de ses travaux, à l'université Johns Hopkins, à Baltimore lors d'une mission aux États-Unis. Cette diapositive montrait Mme Nicole Le Douarin, rendant ainsi hommage à ses travaux sur les chimères et la crête neurale. Les thérapies issues des cellules souches, ou leurs possibilités thérapeutiques, datent de la seconde partie du XXe siècle, au travers des greffes de moelle osseuse dans les leucémies et les lymphomes où des cellules souches hématopoïétiques allogéniques ont été largement utilisées pour remplacer les cellules souches du patient. Les premières lignées de cellules souches embryonnaires qui ont été considérées comme telles, provenaient en réalité de tératocarcinomes, chez la souris et datent de 1960. La vraie première souche embryonnaire de souris date de 1981. Cela a été découvert par Evans, Kaufman et Martin, c'est-à-dire il y a vingt-cinq ans à peine. Les premières lignées de cellules souches embryonnaires de primates non humains datent du milieu des années 1990. Mais c'est en 1998 que les premières lignées de cellules souches embryonnaires humaines ont été obtenues, soit à partir de la masse interne de blastocystes, par Thomson et collaborateurs, soit à partir de cellules germinales extraites de fœtus humains de cinq à neuf semaines. C'est à partir de ce moment-là, parce qu'il y avait la possibilité d'obtenir des lignées de cellules souches embryonnaires humaines, que la biologie des cellules en général, quel que soit leur stade de différenciation, a été projetée sur le devant de la scène médiatique et scientifique, et qu'elle est devenue un champ à part entière de la biologie. Cela fait sept à huit ans à peine. Les raisons de cet essor sont simples. Ce sont de nouveaux objets d'étude, extraordinaires d'une part pour comprendre les mécanismes du développement et de l'évolution, pour comprendre les mécanismes des pathologies humaines, pour soigner, et peut-être guérir. Comprendre les mécanismes du développement et de l'évolution, c'est comprendre quelles sont les signatures moléculaires et les signaux de différenciation qui conduisent au maintien d'une cellule souche à un état indifférencié, ou, au contraire, à sa différenciation. C'est finalement l'exploration de toute la façon dont notre organisme se constitue à partir d'une cellule et s'est constitué au cours de l'évolution. Dans ce contexte, une voie extrêmement rapide de recherche a été développée au début des années 2000, avec l'apparition des outils qui permettaient d'analyser globalement l'expression des gènes. En 2002, les premières études montrant l'ensemble des produits des gènes, les transcriptomes, sont parues à partir de cellules souches embryonnaires, de cellules souches neurales ou hématopoïétiques. Elles avaient été accueillies avec un grand enthousiasme. Depuis, malgré quelques pistes, il faut reconnaître que les résultats sont relativement décevants. Il semble que ce que l'on voulait prouver, donner une signature moléculaire à un état, qui, en anglais, se dit stemness (traduit en français par « souchitude »), n'a pas été atteint. On s'attendait à trouver une signature génétique commune à toutes les cellules souches. En fait, quelques gènes ont été trouvés (oct4, nanog), mais c'est à peu près tout et il semble plus clair maintenant qu'il n'y a pas de programme génétique unique caractérisant les cellules souches. Une autre voie de recherche suivie à l'heure actuelle, en particulier pour les cellules souches adultes est celle des interactions qui existent entre les cellules souches et leur environnement immédiat. Cet environnement immédiat a d'une certaine façon rendu hommage à la France, puisque cela s'appelle des « niches ». Je vous présente un schéma très récent qui développe une voie de recherche montrant comment, à partir d'une cellule totipotente, la cellule se différencie petit à petit pour arriver à l'état adulte, en cellule différenciée. L'hypothèse est que, à la surface, à l'interaction entre la partie embryon et adulte, la cellule est maintenue à un état indifférencié par son interaction très forte avec la niche, autour de cette cellule. Les signaux qui sont émis et l'interaction entre la cellule et la niche conditionnent l'accessibilité des gènes à la transcription. La caractéristique commune des cellules souches serait donc d'être arrêtées dans leur progression vers un état différencié par leur environnement immédiat. On arrive peut-être à une hypothèse d'une logique moléculaire des cellules souches qui serait quantitative, ouvrant un accès à différents programmes génétiques, plutôt que qualitative, avec un programme transcriptionnel commun. Pour étudier tout cela, ce n'est qu'un exemple, il faut pouvoir avoir accès aux lignées des différentes espèces. Une souris n'est pas un primate non humain, un primate non humain n'est pas un homme, et l'on sait déjà qu'il existe des différences majeures d'expression entre une cellule souche embryonnaire humaine et une cellule souche embryonnaire de souris. Comprendre les mécanismes des pathologies humaines : le séquençage du génome humain a permis depuis dix ans de trouver les gènes responsables de très nombreuses maladies. Si l'on interroge la Human gene mutation database de Cardiff, qui est une des mieux documentées à l'heure actuelle, on trouve plus de quarante-sept mille mutations qui ont été décrites et publiées et qui correspondent à près de mille huit cents gènes à l'origine de maladies humaines. Il faut donc comprendre les mécanismes pathogènes de toutes ces mutations. Vous savez tous qu'il y a eu une floraison de modèles murins qui ont été créés. Ce sont des modèles génétiquement modifiés et ils ont apporté des informations tout à fait majeures sur ces maladies. Il ne fait nul doute qu'un meilleur modèle expérimental que les souris permettrait d'étudier les mécanismes avec le même fonds génétique que celui du patient. Cela peut se faire en dérivant des lignées à partir d'embryons porteurs de la mutation et non réimplantés après diagnostic préimplantatoire. L'autorisation d'importation d'une de ces lignées porteuse de mutations de la mucoviscidose a été donnée dans notre pays le mois dernier, le 24 octobre, et l'autorisation pour deux autres lignées porteuses d'une extension dans le gène de la huntingtine, responsable de la maladie de Huntington, est en attente depuis plus d'un mois. Une autre façon de faire, pour obtenir le même fonds génétique que celui des patients, est de créer des lignées par transfert nucléaire (somatic cell nuclear transfer) ou clonage thérapeutique, qui était le terme utilisé autrefois, que je n'aimais pas, ou encore clonage scientifique, qui est également utilisé. La terminologie internationale tend plutôt vers le terme de transfert nucléaire ou transfert de noyau. M. Alain Claeys, député de la Vienne : Je voudrais dire un mot à ce sujet. Ce terme de « transfert nucléaire » est-il pour tous les présents la bonne définition ? Même si ce n'est pas celle ressentie le plus explicitement par le plus grand public... On peut donc retenir ce terme pour la journée. M. Claude Sureau, président honoraire de l'Académie nationale de médecine, membre du Comité consultatif national d'éthique : le terme de « transposition » est souvent utilisé par des chercheurs étrangers, pour une simple raison pratique. Le transfert est un terme qui est également utilisé pour le transfert d'un embryon dans l'utérus maternel. Il existe donc deux acceptions du terme transfert, ce qui peut être un peu gênant. Mme Ketty Schwartz : En effet. Le terme de transplantation cellulaire avait aussi été donné, mais on a celui de « transposition nucléaire ». Je serais d'accord a priori. Cette voie de transposition nucléaire me paraît être très prometteuse parce qu'elle ouvre une nouvelle ère de modèles animaux qui pourraient être obtenus par transplantation de ces cellules humaines porteuses de mutation dans des souris immunodéficientes. Pour soigner et guérir, les greffes de moelle osseuse dans les cancers se pratiquent comme vous le savez depuis le milieu du siècle dernier, avec des effets secondaires non négligeables, en particulier la foudroyante réaction de l'hôte contre le greffon. De nombreuses avancées ont été réalisées depuis, et le champ de la régénération du système hématopoïétique est aujourd'hui en plein développement. D'autres champs émergent, en termes de médecine régénératrice. Permettez-moi de citer deux exemples. Le premier concerne l'insuffisance cardiaque, caractérisée par une destruction des cellules musculaires cardiaques. C'est un problème majeur de santé publique. Au milieu des années 90, avec Philippe Ménasché, et d'autres, nous avions exploré la possibilité d'autogreffe dans le tissu cardiaque de cellules précurseurs du muscle squelettique. Ceci a conduit, en 2000, au premier essai de phase 1, premier essai mondial dans le domaine de la thérapie régénératrice de l'insuffisance cardiaque. Depuis deux ans, on a mis sur pied un essai mondial en double aveugle de phase 2. Philippe Ménasché l'évoquera sans doute tout à l'heure dans une des tables rondes. Transplanter des cellules précurseurs squelettiques dans un muscle cardiaque n'est probablement pas la voie idéale, mais elle a largement ouvert dans le monde la voie à la thérapie régénératrice du tissu cardiaque. L'autre exemple que je voudrais citer est celui d'une maladie rare neurodégénérative, qui est la maladie lysosomale, dite maladie de Batten. Elle est due à des mutations de gènes, qui codent des enzymes, des thioestera ou des peptidases. Le 20 octobre 2005, aux États-Unis, la société StemCells a obtenu l'accord de la FDA, pour commencer un essai de phase 1 à la fois de sécurité et de première efficacité, qui utilise des cellules souches humaines neuronales fœtales. La démarche suivie par cette petite société est tout à fait exemplaire. Elle a bénéficié des transferts de savoir-faire de scientifiques prestigieux dans le domaine de la différenciation et de la biologie du développement. Les scientifiques ici reconnaîtront les noms d'Irving Weissman, de Fred Gage ou de David Anderson. Le premier objectif de cette société a été d'établir la faisabilité de cette thérapie régénératrice à partir de cellules fœtales. Ils ont choisi la maladie de Batten comme maladie modèle. Ils ont mené des tests in vivo, sur des modèles murins de la pathologie et ils ont mis au point un procédé pour purifier à un très haut degré ces cellules neuronales fœtales. Ils ont montré qu'elles repeuplaient le tissu cible. Cette repopulation est faible, inférieure à 10 %, mais elle est suffisante pour produire une amélioration fonctionnelle. Il est clair que la possibilité d'une réaction immunologique contre des cellules neuronales allogéniques est relativement faible, probablement à court terme, sans doute à cause du confinement particulier du système nerveux. Ils n'ont observé aucun tératome sur plus de trois mille animaux qui ont été traités pendant des périodes allant jusqu'à plus de soixante semaines. La validation de cette approche les conduira ensuite à la développer dans des maladies neurodégénératives plus fréquentes, comme la maladie de Parkinson, d'Alzheimer, les traumatismes médullaires, ou la sclérose en plaques. En termes de mise au point de thérapie et d'acquis concernant la possibilité d'utilisation de ces cellules souches c'est une étape très importante qui a été franchie par les autorités régulatrices aux États-Unis voici moins d'un mois. Soigner et guérir, c'est aussi la mise au point de tests qui permettent de cribler à haut débit des chimiothèques, qu'elles soient privées ou publiques. C'est la possibilité de mettre au point des tests qui permettent d'évaluer la toxicité potentielle des chefs de file ou des drogues qui ont été sélectionnés, sans avoir, ou en complément, des modèles animaux. Soigner et guérir, c'est aussi trouver de nouvelles classes de médicaments qui agiraient sur de nouvelles cibles qui auraient été mises en évidence au travers de la recherche fondamentale portant sur les voies de différenciation de ces cellules souches. Soigner et guérir, dans un monde idéal, c'est aussi pouvoir régénérer les tissus détruits avec des cellules dont le génome nucléaire serait identique à celui du patient. Pour tout cela, les possibilités de recherche ouvertes par l'utilisation de lignées cellulaires obtenues après transposition nucléaire paraissent extrêmement prometteuses. Comme vous le souhaitiez, Alain Claeys, je vais terminer cette brève introduction en essayant de situer notre législation aujourd'hui sur les cellules souches humaines dans le contexte européen et international. Je vous présente deux diapositives qui sont très récentes (novembre 2005), qui m'ont été confiées par la Commission européenne. On peut observer les pays qui ont la législation la plus restrictive par rapport à ceux qui ont la législation la plus permissive. Aucune recherche n'est autorisée en Autriche, en Pologne et en Lituanie. En Allemagne et en Italie, on ne peut pas créer de nouvelles lignées, mais on peut importer des lignées préparées ailleurs. La douzième autorisation d'importation et de recherche a été accordée en Allemagne il y a à peine un mois à l'Institut Robert-Koch. Ces lignées doivent correspondre aux lignées américaines, sauf pour l'Allemagne, où elles correspondent à la mise en œuvre de la loi de 2002. Dans les autres pays (Finlande, Danemark, France, Estonie, Hongrie, Tchécoslovaquie, Slovénie, Espagne), l'importation et la dérivation de nouvelles lignées à partir d'embryons surnuméraires sont autorisées. Je tiens cependant à souligner que chez nous, il ne s'agit pas d'une autorisation, mais d'une interdiction, sous réserve dérogatoire, et uniquement pour une durée de cinq ans. D'une certaine façon, je trouve donc qu'ils sont très « gentils » de nous avoir situés dans ce peloton. Par ailleurs, en ce qui concerne l'autorisation de dérivation de nouvelles lignées à partir d'embryons surnuméraires, les décrets d'application ne sont pas parus, et ce n'est donc toujours pas autorisé. Nous devrions être situés beaucoup plus à droite dans le graphique. Permettez-moi de signaler le cas de la Suisse, qui est tout à fait particulier et intéressant, car c'est le seul pays au monde aujourd'hui où il a été demandé aux citoyens par référendum si la recherche sur les cellules souches embryonnaires pouvait être autorisée, et 66 % des votants ont répondu affirmativement il y a quelques mois. En Australie, au Brésil, au Canada, au Japon, à Taiwan, c'est la même situation que les pays situés au-dessus. Enfin, en Belgique, en Suède, en Grande-Bretagne, en Israël, aux États-Unis sur des fonds non fédéraux, en Chine, en Inde, à Singapour, en Corée du Sud, la transposition nucléaire est autorisée. Une analyse globale de toutes ces données montre que les pays qui ont soit une politique permissive, qui autorise la transposition nucléaire, soit plus flexible, qui autorise la création de nouvelles lignées de cellules souches à partir d'embryons surnuméraires, constituent aujourd'hui plus de la moitié de la population mondiale. Étant donné la situation aujourd'hui en France, en novembre 2005, nous ne sommes pas tout à fait aujourd'hui dans cette moitié. J'espère très vivement et profondément, et je me permets de m'adresser aux décideurs présents, et à Alain Claeys en particulier, que la législation de notre pays va évoluer très vite, et que non seulement les décrets autorisant la création de nouvelles lignées à partir d'embryons surnuméraires vont enfin être promulgués, mais qu'il y aura une révision de la loi de bioéthique, même si la proposition de loi de Roger-Gérard Schwartzenberg, n'a pas été pour le moment retenue. J'ai été l'une des dix signataires de la pétition, afin de demander à la fois la levée de l'interdiction et de transformer cette levée d'interdiction en autorisation, avec bien évidemment un encadrement strict, et avec une autorisation des transpositions nucléaires. Il faut que cela soit encadré de façon stricte. Je me permets d'ajouter que la recherche aujourd'hui, dans tous les pays, sur les lignées de cellules souches embryonnaires humaines, est la plus encadrée en termes législatifs. Même dans les pays où la transposition est autorisée, il faut près de quinze cachets avant de pouvoir autoriser et effectuer une telle recherche. L'Académie nationale américaine a promulgué, il y a quelques mois, en avril 2005, des cell guidelines qui sont très complètes et qui peuvent servir de cadre en tant que guides pour autoriser et encadrer ces recherches. M. Alain Claeys : Merci beaucoup, Ketty Schwartz, de votre exposé, à travers lequel vous avez répondu à un certain nombre de questions. Je voudrais apporter une précision. Les décrets de la loi d'août 2004 ne sont pas de la compétence du Parlement. C'est l'exécutif qui doit prendre ce décret. J'avais attiré, à l'époque, l'attention du ministre Philippe Douste-Blazy. J'ai l'impression qu'un certain nombre de décrets, les principaux, prennent du retard, et l'on fonctionne actuellement uniquement « par dérogation » en quelque sorte. Mme Ketty Schwartz : Si vous me permettez, on fonctionne par dérogation, puisque la loi indique l'interdiction, sauf dérogation, et pour une durée seulement de cinq ans en ce qui concerne l'importation de lignées. Mais la création de nouvelles lignées à partir d'embryons surnuméraires est pour le moment suspendue à la promulgation de ces décrets d'application. Nous ne sommes donc même pas dans ce contexte. Les scientifiques, médecins et chercheurs français ne peuvent travailler qu'avec des lignées provenant de l'étranger. Ils dépendent donc très lourdement aujourd'hui des apports venant de l'étranger. C'est, je crois, extrêmement important. M. Alain Claeys : Nous allons y revenir, y compris sur la rédaction de la loi, telle qu'elle nous est revenue de nos collègues sénateurs. J'aurai des questions assez précises au cours de la journée pour voir quel est le mode opérationnel. N'est-ce pas une contrainte supplémentaire pour des autorisations éventuelles ? Cet exposé était utile, pour nous, parlementaires, afin de faire un point, notamment de vocabulaire, ce qui n'est pas inutile dans notre société de communication, mais aussi pour bien distinguer aujourd'hui ce qui est de la recherche fondamentale de ce que sont les premières applications. En tant que responsables politiques, nous devons avoir cette honnêteté intellectuelle et cette rigueur pour parler à bon escient. Nous allons passer à la première table ronde. Je voudrais vous présenter Mme Anne Fagot-Largeault, philosophe et médecin, professeur au Collège de France et membre de l'Académie des sciences. A côté de vous, Jean-Claude Ameisen, professeur des universités, praticien hospitalier, président du Comité d'éthique de l'Inserm. Table ronde n° 1 : Mme Anne Fagot-Largeault, philosophe et médecin, professeur au Collège de France, membre de l'Académie des sciences : Vous m'avez demandé, Monsieur le Député, de faire un survol historique et philosophique de la question. M. Alain Claeys : Je pense qu'il n'est pas inutile, en ce début de journée, d'avoir aussi cette vision. Mme Anne Fagot-Largeault : Je voulais dire pour commencer que je partage complètement la position de Mme Schwarz en ce qui concerne la réforme de la loi. Il conviendrait d'envisager au minimum la dépénalisation et, au mieux, l'autorisation et l'encadrement du clonage à visée thérapeutique, comme on l'appelle couramment. Je ne vais pas poser cette question, mais faire un certain nombre de considérations historiques afin de remettre en perspective le problème. Je ferai cela en cinq points. 1) On a observé pour la première fois à la loupe, au microscope composé, que la matière vivante avait une structure alvéolaire ou cellulaire au xviie siècle. A partir de 1830, quand le microscope a fait un progrès décisif, avec des microscopes achromatiques, les noyaux de cellule ont apparu aux yeux des observateurs. Cela a été l'occasion de la formulation du début de ce que l'on appelle la théorie cellulaire par Schleiden et Schwann (1838-1839). Cette première formulation dit : « Tous les organismes vivants sont constitués de cellules. » Vingt ans plus tard, Virchow a complété la théorie cellulaire en posant que toute cellule naît d'une cellule. C'est donc seulement au xixe siècle que l'on a pris conscience que les êtres vivants sont tous formés de cellules. Dans la seconde partie du xixe siècle, en 1868, Haeckel divise les vivants en monocellulaires et pluricellulaires et il conjecture que les êtres pluricellulaires dérivent des monocellulaires. Un peu plus tard, en 1875, pour la première fois, Hertwig observe au microscope la fécondation d'un œuf d'oursin, c'est-à-dire la pénétration du spermatozoïde dans l'ovule et la conjugaison des noyaux. C'est seulement depuis cette période, la fin du xixe siècle, que l'on sait ce qu'est la fécondation et que l'on a élucidé son mystère. 2) On sait donc depuis à peine plus d'un siècle que tous les organismes vivants proviennent d'une seule cellule. En ce qui concerne les pluricellulaires que nous sommes, c'est le zygote, c'est-à-dire l'ovule fécondé par le spermatozoïde. On a appris depuis un peu plus d'un siècle, les stades de la division progressive de cette cellule initiale, qui se partage en deux, en quatre, en huit, en seize, etc., qui passe par des états de différenciation successive, jusqu'à donner, comme l'a signalé Mme Schwarz, environ deux cents types différents de cellules qui constituent notre organisme. Les stades de la différenciation ont reçu des noms. On a dit que la première cellule est totipotente, elle peut faire toutes les cellules. Ensuite, on passe par des stades de pluripotence, de multipotence, et les dernières cellules qui vont donner des cellules complètement spécialisées sont appelées progénitrices. Le propre des cellules souches est qu'elles peuvent à la fois se diviser pour redonner des cellules souches, c'est-à-dire se multiplier à l'identique, et qu'elles peuvent en même temps se diviser pour donner des cellules plus spécialisées qu'elles. Au cours du xxe siècle, l'étude des cellules souches a ébranlé un dogme qui figure à peu près dans tous les manuels de biologie du xxe siècle, à savoir que la différenciation d'une cellule normale n'est pas réversible. En fait, les cellules souches peuvent semble-t-il présenter des phénomènes de transdifférenciation. Au laboratoire, il a été montré que des cellules hématopoïétiques de souris, qui normalement donnent naissance aux cellules sanguines, peuvent sous certaines conditions donner des cellules de foie, de muscle ou de poumon. Il a été montré également que des cellules souches neurales cultivées avec des cellules endothéliales formant la paroi des vaisseaux peuvent changer leur destin et devenir des cellules endothéliales. Le cours de la différenciation n'est donc pas entièrement déterminé, semble-t-il. C'est ce que l'on a appelé la plasticité des cellules souches, mais cette plasticité est aujourd'hui controversée et en partie mal connue. 3) On sait donc depuis le début du xxe siècle qu'il existe dans nos organismes des cellules souches qui sont les précurseurs de cellules différenciées. Ces cellules souches sont la source de la régénération permanente de notre organisme. On peut prendre l'exemple des cellules du sang. Chaque jour, 1 % de nos globules rouges, 10 % de nos plaquettes et 100 % de nos globules blancs sont éliminés de la circulation, détruits, et remplacés par des cellules formées dans la moelle osseuse à partir de précurseurs issus de la différenciation des cellules souches hématopoïétiques. Il en est de même pour les cellules musculaires, intestinales, cutanées, et même la plupart des cellules du système nerveux central. Elles sont sans cesse détruites et remplacées par des cellules neuves, dérivées des cellules souches que nous avons en réserve. Ce turn-over cellulaire est l'un des aspects d'un phénomène connu depuis très longtemps, appelé « circulus vital », « tourbillon vital » ou métabolisme. On peut dire que nos cellules souches sont la concrétisation du potentiel biologique que nous avons de nous individuer constamment tout en assurant la continuité de notre être. Il est connu aujourd'hui que, chez l'adulte, les cellules souches conservent et transmettent un potentiel que l'on peut qualifier d'embryonnaire, car la greffe du noyau d'une cellule souche dans un ovocyte peut donner un embryon susceptible de se développer comme un clone de l'organisme donneur du noyau. Si l'on connaît l'existence des cellules souches et si l'on a appris à analyser leurs propriétés dans le courant du xxe siècle, c'est seulement à la fin de ce siècle que l'on a appris à cultiver des lignées de cellules souches embryonnaires, d'abord de souris, depuis les années 1980, puis de cellules souches humaines, depuis la fin des années 1990. On s'est également exercé à contrôler leur différenciation et c'est alors qu'on a entrevu les perspectives thérapeutiques qu'elles offrent et qui mènent à la médecine dite régénératrice. 4) Les propriétés régénératrices des êtres vivants sont connues depuis longtemps. Au xviiie siècle, Réaumur étudiait la régénération des pattes chez l'écrevisse, Spallanzani a montré que l'escargot régénère même sa tête et Tremblay a découvert que les polypes d'eau douce se laissent bouturer comme des plantes, à savoir qu'un morceau de polype redonne un polype entier. Au xixe siècle, Claude Bernard, puis Paul Bert, ont anticipé la possibilité de mettre des tissus en culture et les techniques de la culture des tissus ont été mises au point vers 1910. L'ingéniosité extraordinaire des chercheurs, dans toute la première partie du xxe siècle, s'est exercée sur les végétaux, les animaux et sur l'homme, pour cultiver les tissus et greffer des tissus cultivés. Au milieu du xxe siècle, la vogue était aux greffes de tissus embryonnaires car on avait observé que les tissus des embryons sont moins souvent rejetés que les tissus adultes. On cite un certain nombre de cas, par exemple de greffes de thyroïde chez la souris, ou du tissu thyroïdien chez les souris ou des rats. Sur des êtres humains ces greffes étaient réalisées avec prélèvement de tissu thyroïdien sur des enfants mort-nés et la transplantation sur ceux que l'on appelait des crétins myxœdémateux, c'est-à-dire des enfants nés sans thyroïde. Les greffes de cellules souches ou de cellules dérivées de cellules souches embryonnaires présentent des avantages évidents par rapport à ces tentatives de greffes de tissus prélevés sur des vivants ou des morts. Les cultures de cellules permettent la conservation des cellules dans des banques. Ainsi, on n'est pas obligés de prélever sur un mort, ou, au moment où l'on a besoin de la greffe, de prélever sur un vivant. Par ailleurs, les propriétés des cellules souches embryonnaires, la capacité d'être dérivées et orientées, différenciées vers toutes les cellules de l'organisme, permettent d'avoir à disposition des greffes de tous les tissus possibles. L'inconvénient a été signalé par Mme Schwarz : les greffes de cellules dérivées de cellules souches embryonnaires sont sujettes aux rejets de greffe même si les rejets sont moins violents que dans le cas de greffes de tissus adultes. 5) Intervient alors la technique du transfert de noyau. Celle-ci permettrait des greffes qui ne seraient pas rejetées par l'organisme, à l'aide de cellules compatibles avec l'organisme. Il convient de remarquer que le clonage a été condamné sévèrement avant que l'on sache s'il était possible. Dans les années 1980 déjà, le Conseil de l'Europe a émis plusieurs mises en garde et interdictions au moins verbales à l'égard du clonage chez l'homme. Comme on l'a dit, la technique du clonage consiste à remplacer le noyau d'un ovocyte qui est à N chromosomes par celui d'une cellule somatique, à 2N chromosomes, qui peut être une banale cellule du corps. On constate que le noyau ainsi transféré est reprogrammé. Il retrouve ses potentialités embryonnaires. J'ai signalé précédemment que l'on peut considérer que toutes nos cellules ont d'une certaine manière une potentialité embryonnaire car elles ont toutes le même génome. La technique du transfert ou de la transposition du noyau est en soi moralement neutre. Tout dépend de ce que l'on en fait. Le clonage à visée reproductive prend pour objectif de faire par cette technique un enfant, dont le génome soit identique à celui du donneur du noyau transféré. Un clone de son père, si l'on peut dire. En revanche, le clonage à visée thérapeutique cherche à obtenir par cette technique une lignée cellulaire qui puisse fournir un greffon destiné à soigner le donneur du noyau, par exemple des cellules pancréatiques qui fabriquent de l'insuline, destinées à soigner un malade souffrant de diabète insulinodépendant. Si l'on a utilisé un noyau provenant de son propre corps, la greffe sera immunocompatible avec lui. L'avantage de ce type de greffe est donc l'immunocompatibilité. Le caractère très récent de la technique et de ses succès fait qu'elle est encore mal évaluée, peu évaluée ou pas évaluée du tout. Il faut réaliser que la brebis Dolly est née il y a moins de dix ans. L'embryon avait été obtenu par transfert d'un noyau de cellules du pis de la brebis dans un ovocyte de brebis. C'était le premier succès de clonage reproductif, qui a ensuite réussi dans d'autres espèces. On a cru observer chez les animaux résultant de clonages des malformations ou des difficultés de développement. J'ai récemment parlé avec Jean-Paul Renard qui a une grande habitude des clonages de ces difficultés de développement. Il m'a signalé que les clones qui survivent aux difficultés de la gestation ont une vie tout à fait normale, vivent très bien et se reproduisent normalement. Un certain nombre de craintes concernant la viabilité des clones est aujourd'hui surmonté semble-t-il. Mais l'événement important, qui est en partie à l'origine de notre réunion d'aujourd'hui, c'est qu'au début de l'année 2004, puis en 2005, une équipe coréenne a publié des résultats tout à fait convaincants, éblouissants, dans le domaine du clonage humain. M. Alain Claeys : Je me permets d'intervenir sur ce point précis. Tous les présents sont-ils d'accord sur la pertinence scientifique et le fait incontestable des résultats de cette équipe coréenne, ou y a-t-il débat dans la communauté scientifique ? Mme Anne Fagot-Largeault : C'est un résultat inachevé. L'équipe de M. Hwang a précisé qu'elle ne vise pas le clonage reproductif mais qu'elle se place dans des conditions où la reproduction par cette méthode est exclue. M. Alain Claeys : Quelles sont ces conditions ? Mme Anne Fagot-Largeault : Cela signifie qu'ils ne réimplantent pas dans un utérus. Ce qu'ils ont visé, et réussi, a été de prélever des cellules de la peau chez trois types de malades, des malades atteints d'une interruption de la moelle épinière, de diabète insulinodépendant et d'une maladie congénitale de l'immunité. Ils ont transféré le noyau de ces cellules de la peau de malades dans des ovocytes préalablement énucléés. A partir de ces ovocytes, où le noyau du malade avait été transféré, ils ont réussi à dériver des lignées cellulaires dans les trois directions qui correspondent aux trois couches de la différenciation de l'embryon, au début du développement. L'expérience s'arrête là. Ils ont montré la possibilité d'obtenir des cellules qui commencent à se différencier dans la direction qu'ils souhaitent pour obtenir éventuellement des cellules que l'on puisse greffer, à titre thérapeutique, chez le malade qui était le donneur du noyau. Cela a suscité un grand enthousiasme et de grands espoirs, en particulier chez les associations de malades. Nous en sommes là. La preuve que cela peut être une véritable thérapeutique n'est pas donnée, mais on sait qu'en Grande-Bretagne par exemple, au moins une équipe travaille déjà activement sur la même ligne, à obtenir des cellules pancréatiques qui fabriquent de l'insuline pour le traitement du diabète insulinodépendant. On en est au stade de l'espoir qui, d'après les résultats cohérents, paraît sérieux. M. Alain Claeys : Merci, madame. Je voudrais poser une question. D'un point de vue éthique, la recherche sur les cellules souches nécessite-t-elle des précautions particulières selon vous ? Au niveau international, devrait-on adopter une législation, et quelle est la grille de lecture qui pourrait guider le législateur pour avoir toutes les garanties ? Mme Anne Fagot-Largeault : J'ai été déconcertée par le fait que la loi française autorise, même sous conditions, avec vérification sérieuse des conditions dans lesquelles cela se fait, l'utilisation de cellules souches embryonnaires qui résultent d'un projet parental, et qui ont été prélevées sur des embryons conservés au congélateur, initialement pour faire un bébé. La loi française autorise l'engagement de la recherche sur cette voie et elle pénalise lourdement la recherche sur des cellules qui sont comparables à celles-là, mais qui sont fabriquées en laboratoire par transfert de noyau. Il me semble qu'a priori, on doit plus d'égards à des cellules qui sont le résultat d'un projet parental, qui initialement n'étaient donc pas faites pour la recherche. La loi le prévoit, puisque l'on demande le consentement du couple. On doit plus de respect à ces cellules qu'à des cellules qui ne sont pas faites pour faire des bébés, qui sont fabriquées artificiellement en laboratoire. M. Alain Claeys : Vous voulez dire que dans le cadre de la loi française, sur ce qui a été décidé, à partir d'embryons surnuméraires, l'encadrement ou les précautions ne sont pas suffisantes ? Mme Anne Fagot-Largeault : Je pense que l'encadrement est très strict et qu'il est suffisant, mais que l'on a raison d'imposer des égards, en particulier l'autorisation du couple donneur de l'embryon. Mais il me paraît tout à fait paradoxal que la loi considère qu'il est acceptable de faire cela et que c'est un délit de fabriquer des embryons artificiellement par transfert de noyau. On n'a pas de respect particulier pour l'ovocyte perdu par chaque femme tous les mois. Le noyau de peau, dont on extrait le noyau, on ne le respecte pas non plus. Nous perdons tous les jours des cellules de notre peau. M. Alain Claeys : Pour être très court, le paradoxe est de dire que l'on autorise la recherche sur embryons à partir d'embryons surnuméraires, et concernant la transposition nucléaire, on la refuse, alors qu'elle pose moins de problèmes éthiques. On aura l'occasion de revenir sur ce problème de don d'ovocyte, sur lequel il convient de réfléchir. Mme Ketty Schwarz : Je partage tout à fait cette vision concernant le déséquilibre qui existe entre l'autorisation et la pénalisation en France. Je rappelle que nous n'avons pas encore l'autorisation de dériver ces lignées. Mme Anne Fagot-Largeault : On peut maintenant dériver les ovocytes de cellules souches embryonnaires. M. Alain Claeys : Nous allons revenir sur ce sujet tout au long de la journée. Merci beaucoup, madame. Je vais tout de suite donner la parole à Jean-Claude Ameisen. M. Jean-Claude Ameisen, professeur des universités, praticien hospitalier, président du Comité d'éthique de l'Inserm, membre du Comité consultatif national d'éthique : Mes travaux de recherche ne concernent pas directement les cellules souches. Mais ils concernent les mécanismes de renouvellement cellulaire, car ils ont pour objet l'étude de la mort cellulaire, et plus précisément, les phénomènes d'autodestruction cellulaire, une forme de différenciation terminale qu'on appelle mort cellulaire programmée, ou apoptose. Depuis une quinzaine d'années, on a découvert que ces processus d'autodestruction cellulaire jouent un rôle essentiel, non seulement dans le développement de l'embryon, mais aussi après la naissance, chez l'enfant et l'adulte, dans les phénomènes de déconstruction et de reconstruction permanentes de nos corps, ainsi que de développement de nombreuses maladies. La révolution qu'a connue la recherche dans le domaine des cellules souches a accompagné, comme une image en miroir, la révolution qu'a connue la recherche dans le domaine de l'autodestruction cellulaire. Mais il ne s'agit pas seulement de concomitance. Il existe aussi un lien étroit entre ces deux processus, car une cellule capable de se renouveler est, par définition, une cellule capable de réprimer le déclenchement de son autodestruction. La capacité à empêcher ou à retarder l'autodestruction joue donc sans doute un rôle important dans la capacité d'une cellule à devenir et à demeurer une cellule souche. Ketty Schwarz soulignait que les recherches sur les cellules souches permettaient de poser un certain nombre de questions fondamentales concernant les mécanismes du développement embryonnaire, et, plus généralement, l'évolution du vivant. Qu'est-ce qu'une cellule souche ? Les cellules qui constituent les organismes unicellulaires, que ce soient les levures, apparues il y environ un milliard d'années, ou les bactéries, apparues il y a trois à quatre milliards d'années, sont en fait toutes des cellules souches. Elles sont capables de se renouveler et de se différencier, non pas en deux cents familles cellulaires, comme les cellules souches embryonnaires, mais en au moins trois ou quatre familles de cellules. Ces phénomènes de différenciation sont souvent réversibles, c'est-à-dire que la cellule peut repasser d'un état différencié à un état de cellule souche, sauf, bien entendu, quand cette différenciation prend la forme irréversible de l'autodestruction. L'émergence des organismes multicellulaires, il y a environ un milliard d'années, semble donc s'être accompagnée d'une restriction progressive des capacités de renouvellement et de différenciation des cellules à mesure qu'elles construisent la complexité d'un corps. Mais on retrouve, dans nos cellules souches, au début du développement embryonnaire, certaines des propriétés ancestrales des premières cellules qui nous ont, il y a longtemps, donné naissance. Une question qui me paraît importante concerne la notion répandue d'« auto » renouvellement et d' « immortalité » potentielle des cellules souches. Une idée longtemps prédominante en biologie a été que les organismes unicellulaires, les cellules souches ancestrales, se divisent à l'identique, de manière symétrique, et s'autorenouvellent sans vieillir, en étant donc dotées d'une éternelle jeunesse. Depuis quelques années, des travaux réalisés chez la levure et certaines espèces bactériennes, ont montré qu'il s'agissait d'une illusion. La pérennité d'une colonie de levures n'est pas due à une éternelle jeunesse des cellules qui la composent, mais aux enfantements successifs de cellules éphémères. Chaque cellule-mère se divise de manière asymétrique, produisant une dizaine à une vingtaine de cellules filles, qui naissent avec un potentiel de fécondité et de jeunesse identique à celui qu'avait originellement leur cellule mère. Mais chaque cellule-mère, au fur et à mesure qu'elle « fait des petits », vieillit, devient stérile et disparaît. Qu'en est-il des cellules souches de notre corps ? De nombreux travaux suggèrent qu'elles se divisent de manière asymétrique, produisant une cellule ayant les mêmes potentialités que la cellule mère, et une autre cellule qui va s'engager dans un processus de différentiation. Alors qu'on tente de comprendre et de manipuler les cellules souches embryonnaires et adultes, je pense qu'il est important de se demander si ces notions de renouvellement, de plasticité, et de jeunesse ne devraient pas être pensées et explorées en termes de populations cellulaires, de générations successives de cellules éphémères qui naissent, enfantent, vieillissent, deviennent stériles et meurent. Il est possible que l'illusion d'une division à l'identique, d'un « auto » renouvellement, ne soit due le plus souvent qu'à notre incapacité à distinguer les phénomènes discrets, mais cruciaux, de brisure de symétrie qui permettent de donner naissance à ce phénomène encore mystérieux d'un point de vue moléculaire, auquel nous donnons le nom de jeunesse. La deuxième question importante à laquelle Ketty Schwarz et Anne Fagot-Largeault ont fait allusion concerne le rôle de plus en plus grand accordé à l'épigénétique dans la biologie. M. Alain Claeys : Pouvez-vous développer sur ce sujet, par rapport à ce nouveau concept qui rentre dans la biologie ? M. Jean-Claude Ameisen : Il s'agit des relations entre les gènes et leur environnement. Une dimension essentielle de la complexité du vivant est due au fait que les cellules et les corps peuvent utiliser leurs gènes de manières très différentes, et que, à génome identique, différentes potentialités vont s'ouvrir dans différents environnements. Toutes les cellules de notre corps, à quelques rares exceptions près, possèdent tout au long de notre existence exactement les mêmes gènes. Leur capacité à devenir et à demeurer des cellules souches, ou à se transformer dans l'une des deux cents familles de cellules différenciées de notre corps, est due au fait que chaque cellule n'utilise pas ses gènes de la même manière. Les interactions, pour partie aléatoires, que chaque cellule établira avec ses voisines vont entraîner des modifications plus ou moins réversibles de l'accessibilité de certains de leurs gènes, et donc des modalités différentes d'utilisation de ces gènes. En d'autres termes, l'environnement externe de la cellule influera sur l'élaboration de son environnement interne, qui lui-même influera à son tour sur les possibilités qu'a la cellule avec son environnement externe. On distingue là toute l'ambiguïté de la notion répandue de « programme génétique ». Les gènes ne déterminent pas l'avenir : ils donnent aux cellules un certain nombre de contraintes et de potentialités - un champ des possibles - dont l'actualisation dépendra de l'histoire particulière des interactions de la cellule avec son environnement. On sait depuis longtemps que deux cellules d'œuf d'abeille, génétiquement identiques, peuvent, en fonction de l'environnement extérieur dans lequel elles sont plongées, donner naissance soit à une ouvrière, qui sera stérile et vivra deux mois, ou à une reine, qui sera féconde et vivra dix ans. Cette notion d'épigénétique est ancienne. Mais son importance, et son caractère universel n'ont commencé à être réellement envisagés que depuis une quinzaine d'années. Jusqu'à quel point les phénomènes de différenciation, qui résultent des modifications d'accessibilité des gènes à l'intérieur des cellules, sont-ils réversibles ? Chez les plantes, contrairement aux animaux, des cellules souches somatiques peuvent spontanément se retransformer, dans certains environnements, en cellules souches embryonnaires, et donner ainsi naissance à un embryon sans passer par des cellules germinales ni par la fécondation. La même transformation est-elle possible, spontanément ou artificiellement, pour des cellules animales et humaines ? Cette question fait actuellement l'objet à la fois de travaux et de controverses. Vous savez sans doute qu'il y a quelques mois, des travaux publiés dans la prestigieuse revue Cell, mais non encore confirmés par d'autres équipes, ont suggéré que des cellules souches de la moelle osseuse pourraient spontanément se transformer en ovocytes lorsqu'elles migrent dans l'ovaire, sans que l'on sache s'il s'agit de vrais ovocytes, ou de cellules qui ressemblent à des ovocytes mais qui seraient incapables d'être fécondées et de donner naissance à un embryon. Quelles sont les frontières de la plasticité cellulaire ? Qu'est-ce qui détermine l'accessibilité, ou l'inaccessibilité, de certains gènes ? C'est, par exemple, l'activité de certaines enzymes cellulaires qui modifient l'ADN, par un mécanisme que l'on appelle la méthylation, ou qui modifient la structure des protéines qui entourent l'ADN, par un mécanisme que l'on appelle l'acétylation. On ne sait pas actuellement quelles sont les modifications dans la composition ou la structure moléculaire du corps cellulaire - le cytoplasme - qui permettent à un ovocyte fécondé de donner naissance à des cellules souches embryonnaires, alors qu'une cellule de la peau, possédant les mêmes gènes, en est incapable. L'illustration la plus spectaculaire de cet effet de l'environnement sur les gènes a été apportée par le transfert de noyau : le noyau d'une cellule de peau transplanté dans un cytoplasme d'ovocyte va permettre une utilisation des gènes qui pourra aboutir à la formation d'un embryon. L'importance de l'environnement est illustrée, à un autre niveau, par la notion de «niche», évoquée par Ketty Schwarz. Une cellule souche embryonnaire pluripotente d'un blastocyte va, dans l'environnement de ce blastocyte, spontanément et progressivement perdre ses potentialités de pluripotence. Si cette cellule est isolée et cultivée in vitro de manière appropriée, elle va les conserver. Si l'on injecte cette cellule dans un autre blastocyte, elle va participer au développement de l'embryon. Mais si on l'injecte dans un autre environnement, dans une autre « niche », par exemple sous la peau d'une souris immunodéficiente adulte, elle peut entraîner une forme de tumeur. La même cellule souche embryonnaire, en fonction de l'environnement, de la niche écologique dans laquelle elle est plongée, va donc utiliser ses gènes de manières différentes. Cette notion de niche est cruciale. Elle pose, comme dans beaucoup d'autres domaines de la biologie, la question des liens entre l'intérieur et l'extérieur, entre les gènes et les cellules, entre les cellules et d'autres cellules... La cellule souche participe à la formation et au maintien de sa niche, et la niche participe à la formation et au maintien de la cellule souche. Ces effets de causalité rétroactifs, cette idée apparemment très moderne de causalité en spirale, correspondent, en fait, à ce qu'évoquait Pascal lorsqu'il parlait de « choses à la fois causantes et causées » La notion d'environnement peut se décliner de nombreuses manières. Un premier niveau d'environnement, pour les gènes, est constitué par l'ADN qui les entoure. Les 98 % de notre ADN qui ne sont pas des gènes, c'est-à-dire qui ne permettent pas la fabrication de protéines, ont reçu le nom d'ADN « poubelle ». Depuis trois ou quatre ans, il a été découvert qu'une partie importante de cet ADN « poubelle » permet la fabrication de petits ARN qui régulent l'expression de certains gènes, et qui semblent jouer un rôle important dans le maintien et la transformation des potentialités des cellules souches. Il y a donc l'apparition d'un autre niveau de régulation, qui jusqu'alors était inconnu. En ce qui concerne les implications médicales des recherches sur les cellules souches, elles concernent probablement la plupart - si ce n'est la totalité - des domaines de la santé et des maladies. Leurs applications thérapeutiques potentielles sont aujourd'hui imprévisibles, mais pourraient dépasser de très loin les approches de médecine régénératrice au sens strict du terme, fondées sur l'idée d'injecter aux malades des cellules souches pour remplacer des cellules disparues. Par exemple, les maladies neurodégénératives pourraient ne pas être uniquement des maladies liées à la mort excessive des neurones, mais aussi des maladies du renouvellement, liées à la mort de cellules souches neuronales et à l'altération des niches qui sont indispensables à leur survie. Serait-il possible, un jour, de reconstituer ces niches et de permettre ainsi l'émergence et le renouvellement de ces cellules souches ? De manière apparemment paradoxale, les recherches sur les cellules souches conduiront peut-être un jour à des découvertes permettant des approches de médecine régénératrice qui ne nécessiteront pas le recours à des cellules souches embryonnaires pour remplacer les cellules disparues. Un autre point qui me paraît essentiel concerne les cancers. Les cancers apparaissent de plus en plus comme des maladies des cellules souches. Premièrement, les cancers émergent à partir de cellules souches normales du corps : plus le potentiel de survie et de renouvellement d'une population de cellules souches normales est important et plus est grande la probabilité que la survenue de certaines anomalies génétiques dans ces cellules fasse apparaître un cancer. Deuxièmement, des travaux très récents suggèrent que la plupart des cellules cancéreuses, comme la plupart des cellules normales du corps, n'auraient qu'une très faible capacité de renouvellement : les capacités de renouvellement, de propagation et de résistance aux traitements des cancers seraient dues à la présence de cellules souches cancéreuses. La compréhension des mécanismes qui régulent la survie et le renouvellement des cellules souches normales et anormales a donc des implications importantes pour la compréhension et le traitement des cancers, indépendamment de toute utilisation des cellules souches embryonnaires à visée thérapeutique. Une autre notion émergeante qui me paraît importante concerne les relations entre les cellules souches, notre vieillissement, et notre longévité. Des travaux récents indiquent par exemple que l'une des manifestations du vieillissement, le fait que les cheveux deviennent gris et blancs, est dû à la disparition des cellules souches qui donnent naissance aux mélanocytes, les cellules qui produisent les pigments des cheveux. D'autres travaux récents concernant les cellules souches musculaires, indiquent que lorsque une souris âgé reçoit du sérum, le liquide sanguin d'une souris jeune, ses cellules souches musculaires réexpriment les mêmes gènes que les cellules souches musculaires d'une souris jeune, et acquièrent, in vitro tout du moins, les mêmes capacités de renouvellement. Là encore, l'environnement extérieur des cellules souches, l'environnement du corps, semble exercer une influence importante sur les capacités fonctionnelles de ces cellules. Dans ce contexte, il est important de noter que la loi de bioéthique de 2004 interdit toute recherche sur les cellules souches embryonnaires, sauf si cette recherche est susceptible de permettre « des progrès thérapeutiques majeurs ». Cette restriction risque de freiner les avancées de la recherche dans la mesure où il est très probable que des recherches sur les cellules souches embryonnaires qui n'auraient pas, aujourd'hui, d'applications thérapeutiques prévisibles, pourraient bouleverser les connaissances et conduire, dans l'avenir, à des progrès thérapeutiques complètement imprévus. Le risque, comme cela a été évoqué tout à l'heure à propos de l'utilisation inappropriée du terme « clonage thérapeutique », est de focaliser les recherches sur les seules applications immédiatement prévisibles. Vouloir orienter la recherche biomédicale vers des applications médicalement utiles est une nécessité lorsque les connaissances s'y prêtent déjà ; vouloir systématiquement substituer à l'exploration de l'inconnu une recherche qui serait a priori utile parce qu'on saurait déjà ce que l'on veut trouver, pourrait s'avérer catastrophique à terme pour la recherche. A titre d'exemple, il suffit d'essayer d'imaginer ce qui aurait pu se produire, au niveau de la biologie et de la médecine, si l'on avait restreint, il y a 50 ans, pour des raisons d'ordre éthique ou économique, la recherche sur les gènes aux seules applications prévisibles de thérapie génique : on aurait probablement perdu l'essentiel des acquis de la révolution de la génétique. M. Alain Claeys : Je voudrais vous interrompre sur ce sujet, qui est à mon sens central, et que l'on va revoir avec une autre table ronde. Cette inscription dans la loi de dire que l'on interdit, avec un moratoire sur cinq ans, sous réserve que les projets de recherche déposés à l'Agence de la biomédecine aient des visées thérapeutiques m'a toujours étonné. Qu'est-ce que cela veut dire concrètement de façon opérationnelle pour un chercheur ? Comment peut-il arriver avec son projet de recherche en expliquant la visée thérapeutique ? M. Jean-Claude Ameisen : Cela pourrait restreindre tous les projets aux seules recherches à visées d'application thérapeutique qui ont montré leur efficacité chez la souris, du type transfert de cellules souches embryonnaires pour réparer un tissu malade. Il y a un risque important à vouloir limiter a priori le champ des recherches dans un domaine nouveau au développement des applications qui paraissent les plus prévisibles et les plus utiles à un moment donné. D'une manière plus générale, il y a un risque à favoriser dans la société l'idée que les recherches dites appliquées, à visée de développements thérapeutiques à court terme, sont intrinsèquement prioritaires. Toute la dimension véritable de la recherche - l'exploration de l'inconnu, la remise en cause des connaissances, et la découverte de connaissances véritablement nouvelles - risque d'être oubliée et abandonnée. M. Alain Claeys : Dans cet esprit, si l'on prolonge un peu l'étude de texte, que veut dire « pertinence scientifique » ? M. Jean-Claude Ameisen : A mon sens, il devrait s'agir de recherches d'une grande originalité, d'une grande qualité scientifique, et posant des questions importantes concernant la santé ou les maladies. Mais je voudrais aborder la question de la raison d'être de cette restriction particulière des recherches, qui semble liée à un problème d'ordre éthique. Je reviens à ce qu'a dit Anne Fagot-Largeault. Il me semble que la recherche sur des cellules isolées à partir d'embryons surnuméraires qui ont été détruits, après abandon du projet parental, et sous condition d'accord des parents, ne pose pas de problème éthique spécifique. Il me semble que cela pose les mêmes problèmes que la recherche sur des cellules extraites d'un foetus mort, ou du corps d'une personne morte, à n'importe quel stade de la vie. M. Alain Claeys : C'est ce que prévoyait la loi de 1994 qui n'a jamais été appliquée. Toute recherche était interdite, mais au bout de cinq ans, les embryons devaient être détruits. M. Jean-Claude Ameisen : A partir du moment où il y a destruction, il semblerait étrange de considérer que, après la destruction, on donne un statut de protection à l'embryon qui serait, en ce qui concerne les conditions de recherche sur des cellules isolées après la mort, différent du statut de protection que l'on donne à un fœtus mort ou au corps d'une personne morte. Je voudrais maintenant aborder la question du transfert nucléaire. Et il me semble qu'il y a là au moins deux questions. La première est : qu'est-ce ce qui est de l'ordre de la fécondation, c'est à dire qui se rattache à la conception d'un enfant, et qu'est-ce qui pourrait n'être que de l'ordre d'une simple manipulation cellulaire in vitro ? Tout ce qui aurait pour effet de dissocier les deux notions me semblerait simplifier le problème éthique. Des travaux réalisés chez la souris suggèrent que l'on peut dériver in vitro des ovocytes à partir de cellules embryonnaires. Si, à partir d'une cellule souche embryonnaire humaine, isolée d'un embryon qui a été détruit, l'on obtenait un ovocyte, que l'on transférait un noyau d'une cellule de la peau dans cet ovocyte et que l'on obtenait une nouvelle cellule souche embryonnaire, il me semble que l'on s'éloignerait de plus en plus de la notion de fécondation, et que l'on se rapprocherait de plus en plus de la notion de manipulation cellulaire in vitro. En revanche, la création, à visée de recherche, d'embryons par fécondation in vitro me paraît poser des problèmes éthiques d'une autre nature. La deuxième question concerne le don d'ovocytes. Tant que la source de cellules receveuses pour le transfert de noyaux est un ovocyte, il faudrait établir une différence très claire, en matière d'information et de protection des donneuses, entre le don d'ovocytes qui est actuellement fait à visée de reproduction, et un don d'ovocytes qui s'inscrirait dans une visée de recherche. Ce sont à mon sens les deux questions qui, dans le contexte d'une éventuelle révision de l'interdiction actuelle de transfert de noyau à visée de recherche, méritent une réflexion sereine et un débat ouvert, qui soient à la mesure des implications éthiques. Peut-on distinguer clairement ce qui est de l'ordre de la fécondation et du projet parental, de ce qui apparaît de plus en plus comme une manipulation cellulaire in vitro ? Le jour où il serait possible de transformer in vitro une cellule de la moelle osseuse en ovocyte ou en cellule embryonnaire, on se retrouverait confronté, de manière radicalement différente, à la question de savoir où commence et où s'arrête la notion de différenciation cellulaire. Plus on entre dans le domaine des manipulations cellulaires, en dehors de tout projet de reproduction, et plus se modifie, à mon sens la problématique éthique. M. Alain Claeys : Merci beaucoup. Sur le don d'ovocytes, nous y reviendrons en cours de journée. Il faut l'aborder car j'ai besoin de vous entendre sur ce sujet et voir, si demain on autorisait la transposition nucléaire en France, quel encadrement serait nécessaire pour ce don d'ovocyte. Table ronde n° 2 : M. Alain Claeys : Nous allons passer maintenant à un débat franco-français en examinant les enjeux des cellules souches pour la recherche et la position et l'état des lieux en France. Il est utile que la représentation nationale, ainsi que les citoyens, aient la connaissance la plus juste possible de ce qui se fait en France, des problèmes qui peuvent s'y poser, des crédits qui sont mobilisés, de l'articulation (j'interpellerai le directeur de l'Inserm à ce sujet) entre les organismes de recherche comme l'Inserm et l'Agence de la recherche sur des projets. Nous devons avoir un état des lieux précis sur ces questions. Vont participer à cette table ronde, et je les en remercie, Christian Bréchot, directeur général de l'Inserm, j'ai excusé pour les raisons que j'ai indiquées Mme Carine Camby, qui ne sera pas présente aujourd'hui, René Frydman, professeur des universités et gynécologue, Mme Evelyne Jouvin-Marche, directrice scientifique adjointe du département du vivant du CNRS, Daniel Louvard, directeur de la section de recherche de l'Institut Curie, membre de l'Académie des sciences, et qui m'a fait le plaisir d'être dans notre Comité de pilotage pour préparer l'étude que nous faisons. Enfin, Michel Van der Rest, directeur du département du vivant du CNRS. M. Christian Bréchot, directeur général de l'Inserm : Je vais donner le point de vue d'un organisme de recherche dont la mission est la recherche biomédicale et en santé. Nous nous plaçons dans un enjeu majeur qui a été largement rappelé auparavant, avec un besoin de connaissances, de recherche fondamentale (ce point a été soulevé mais je voudrais insister) et un besoin de transfert de connaissances à des applications cliniques. Avant d'avancer, je voudrais d'abord indiquer les programmes de recherche en cours et les enjeux pour nous dans les années qui viennent, pour ensuite aborder la question, qui rejoindra la discussion qui a déjà eu lieu, sur l'aspect adapté ou inadapté de la législation en cours vis-à-vis des ambitions dont nous parlons. L'Inserm a, depuis plusieurs années, engagé des moyens importants dans ce domaine. Sans détailler les chiffres, l'Inserm dépense environ 15 M€ en coût global pour les unités qui travaillent dans ce secteur. Point très important par rapport à la question que vous avez posée sur l'Agence nationale de la recherche, depuis 2001, l'Inserm a, avec plusieurs partenaires, en particulier l'AFM, la Juvenile Diabetes Research Foundation, l'association Vaincre la mucoviscidose, le ministère de la Recherche, etc., soutenu des programmes à hauteur de 8 à 10 M€ au total sur projets, conduisant à près de quatre-vingts projets de recherche déposés. Je cite ce chiffre pour signaler qu'il existe un vrai besoin de clarification de la situation et une vraie demande de la part d'un grand nombre d'équipes. L'Inserm s'est engagé sur les cellules souches adultes au même titre qu'embryonnaires. M. Alain Claeys : Vous dites que vous consacrez 15 M€ à la recherche sur les cellules souches adultes et embryonnaires, et parallèlement, vous avez des programmes sur projets pour 10 M€ avec un certain nombre d'organismes. Comment ce deuxième poste va s'articuler avec l'Agence nationale pour la recherche ? M. Christian Bréchot : C'est ce que j'aimerais savoir. Ce n'est pas au Directeur de l'Inserm de préjuger des décisions qui seront prises sur l'ANR. Dans la demande de l'Inserm, ainsi que de beaucoup d'autres partenaires qui ont été proposés la semaine dernière au conseil d'administration de l'ANR, une action spécifique de celle-ci a été clairement discutée de façon générale sur la médecine régénérative, en liaison avec ce que font les organismes. Ce que nous souhaitons, cela fait partie de nos demandes, et c'est majeur pour 2006, c'est qu'il y ait une action de l'ANR sur projet, qui soit complémentaire des actions faites dans les organismes. Avant d'avancer, je voudrais signaler un point qui me semble fondamental. Un certain nombre de ces actions incitatives conduisent à des projets européens. Il est fondamental que la France, de façon concrète, et pas seulement dans les mots, s'inscrive dans des projets européens. Ainsi, le projet GENOSTEM sur les cellules souches adultes mésenchymateuses, est venu de ces actions incitatives pour un programme de 8,6 M€ qui inclut vingt-cinq équipes au niveau européen. Il existe actuellement au moins six projets européens qui sont basés sur l'utilisation de ces cellules souches. Enfin, l'Inserm, dans le cadre législatif sur lequel nous reviendrons, a participé à l'importation de vingt-trois lignées de cellules souches embryonnaires (ES), soulignant par là le besoin réel, puisque depuis la mise en place du Comité ad hoc un grand nombre de lignées ont été importées. Ce qui nous paraît très important, ce sont les besoins de recherche fondamentale, et les conséquences thérapeutiques, en particulier pour des pathologies comme le cancer, les maladies neurodégénératives, et aussi beaucoup d'autres pathologies. J'ai insisté sur l'aspect européen. Notre demande est l'intégration de la France dans les actions de constitution de banques de cellules internationales. C'est un point fondamental, qui ne pourra être obtenu que s'il y a une clarification de nos possibilités en termes de type de recherche. M. Alain Claeys : De quelle clarification s'agit-il ? M. Christian Bréchot : Je vais y venir, mais c'est ce qui a déjà été dit concernant les décrets d'application réellement pris, les modalités d'utilisation réellement définies. M. Alain Claeys : Aujourd'hui, avec la législation en place et les dérogations possibles, les équipes peuvent-elles participer sans problème aux appels d'offres européens ? M. Christian Bréchot : La réponse est clairement négative. Nous sommes en négociation perpétuelle. Il nous paraît également essentiel de pouvoir disposer de centres de recherche et de référence sur les cellules souches. Ce sont des actions menées sur plusieurs sites en France. Enfin, cette application à la clinique des pistes potentielles passe par le développement des centres d'investigation clinique, en particulier en biothérapie, avec l'ensemble des partenaires. Un ensemble d'actions peut être réalisé. Au niveau national, il y a une occasion réelle de développer des actions ambitieuses avec les partenaires majeurs que sont les autres organismes en partenariat avec l'ANR. Elles peuvent s'appuyer encore une fois sur la participation à ces banques internationales. Je voudrais citer une action très importante qui pose clairement la question de la situation de la France actuellement. Il s'agit de ce que l'on appelle l'International Stem Cell Forum. C'est un forum mis en place à l'initiative du Royaume-Uni, qui consiste à la fois à évoluer vers des banques de cellules souches embryonnaires, mais également, et c'est au moins aussi important, à en définir la qualité, les modalités d'utilisation, et à éviter que ne circulent au niveau international des lignées dont les qualités et les possibilités d'utilisation sont quelquefois un peu douteuses. L'Inserm s'est trouvé, comme ses autres partenaires français, dans une situation un peu délicate, dans la mesure où nous avons été présents dès le début dans ces actions. Il est clair que si nous souhaitons continuer à participer à ces forums, et cela rejoint votre question sur les programmes européens, nous avons besoin de montrer rapidement que nous pouvons effectivement travailler sur ce type de cellules. Je voudrais également dire que nous considérons également comme très important, et de la responsabilité de l'Inserm, d'animer un certain nombre de forums, de discussions, d'euro-conférences sur cette thématique. Le comité HERMES joue un rôle important. Pour terminer, et c'est fondamental du point de vue de notre organisme, le cadre actuel nous permet-il de répondre réellement à ces ambitions ? La réponse est seulement partiellement positive. La « demande » de l'Inserm, est la mise en place la plus rapide possible des textes d'application. Le Comité ad hoc a permis, ce dont il faut le remercier, de gérer une situation transitoire. J'ai mentionné le fait que vingt-trois lignées avaient été importées. Sans aucune polémique, mais simplement pour analyser, je voudrais rappeler que l'Inserm a beaucoup poussé pour la mise en place de ce Comité ad hoc. À l'époque, certaines personnes nous objectaient que ce n'était pas la peine, parce que les décrets d'application allaient être pris de façon instantanée. Je crois que c'était mieux de faire ce Comité ad hoc. Il faudra suivre avec attention les propositions qui sont faites concernant l'utilisation de cellules souches générées par transfert nucléaire, en tenant compte de tous les éléments du débat, mais ce n'est pas mon rôle d'intervenir sur le sujet. Pour terminer, quelles que soient les dispositions, ce qui a été dit tout à l'heure me paraît fondamental : ne pas lier uniquement ces recherches à la notion de progrès thérapeutique majeur. Pour un organisme de recherche comme l'Inserm, cela nous paraît tout à fait fondamental. M. Alain Claeys : Monsieur le Directeur, je voudrais vous poser une question qui nous est souvent posée. Sur les crédits consacrés aux cellules souches par l'Inserm, quelle est la part des programmes de recherche sur les cellules souches adultes et embryonnaires ? M. Christian Bréchot : Elle est de façon immensément majoritaire sur les cellules souches adultes, pour des raisons qui relèvent simplement de la loi. M. Alain Claeys : Je donne la parole à René Frydman. M. René Frydman, professeur des universités, gynécologue-obstétricien : Je vais donner le point de vue d'un médecin de base, et non pas d'un directeur d'organisme comme mon voisin, et évoquer les colloques qui se tiennent sur le plan international, au sein desquels, effectivement, la position française est très mauvaise. J'ai assisté dernièrement à un colloque rassemblant cinq mille personnes aux États-Unis autour des développements des travaux réalisés à partir des cellules souches embryonnaires, domaines dans lesquels nous ne sommes que spectateurs, et en difficulté. Il faut avoir aujourd'hui dans ce domaine une vision mondiale comme l'a déjà souligné Ketty Schwarz. Concernant les centres de fécondation in vitro, on peut rappeler quelques chiffres : il y a en Chine deux cents centres de fécondation in vitro, il y en a soixante-dix au Pakistan et un peu partout dans le monde. Je ne dis pas qu'ils sont tous bien gérés sur le plan des lois bioéthiques, puisque la plupart n'en ont pas. Mais cela donne des occasions pour progresser dans la connaissance, ce que, malheureusement, nous ne sommes pas en droit de faire malgré nos acquis, compte tenu de notre réglementation. Je voudrais insister sur un premier point qui concerne les embryons surnuméraires, pour redire que la situation française est un peu paradoxale. Lorsqu'on avait pu enfin avoir un état des lieux sur les embryons congelés en France, tout le monde avait été effrayé par leur nombre élevé. Ceci est lié à vingt ans de stockage. Les congélations embryonnaires datent en France de 1985-1986 et les équipes ont attendu la loi de 1994 avant de savoir ce qu'il fallait faire. En 1994, on avait une autorisation de détruire les embryons qui étaient conçus jusqu'à cette date, mais on ne se prononçait pas sur les embryons qui rentraient dans la prochaine législature, dite de cinq ans, mais qui en fait a duré dix ans. Comme il y avait une incertitude sur les embryons avant 1994 et après cette date, la plupart des équipes ont préféré ne rien faire en attendant d'avoir l'information qui aurait dû intervenir en 1999, mais qui est arrivée en 2004, avec des décrets qui ne sont toujours pas parus. Finalement, la plupart des embryons sont toujours conservés, d'où l'importance du stock. Selon l'idéologie que l'on soutient, on peut mettre en avant ces chiffres en soulignant un aspect un peu effrayant par rapport à une situation qu'il faut expliciter. Par ailleurs, je crois savoir, mais d'autres chercheurs sont sans doute plus à même que moi d'en parler, que finalement, pour la constitution des lignées, il y a besoin de beaucoup moins d'embryons qu'on ne le pense, à partir du moment où il s'agit d'embryons ayant la capacité de se développer. Il y a donc une balance entre ce nombre très élevé d'embryons qui sont dans les cuves des laboratoires français, dont une part (environ 20 à 25 %) est en principe destinée à la recherche, selon la volonté des géniteurs. Ces embryons ne sont donc pas utilisés, mais leur nombre, pour l'établissement des lignées, est sûrement largement suffisant, et même trop. M. Alain Claeys : A combien leur nombre peut-il être établi? M. René Frydman : Le dernier recensement comptabilisait autour de soixante-dix mille embryons congelés, dont la moitié est en cours d'attente, et l'autre moitié se divise entre le don à autrui, la destruction pure et simple et la destruction avec recherche, puisque l'on a introduit très récemment cette différence. Aujourd'hui, avec l'environnement, la médiatisation, les réflexions qui ont lieu, et même le référendum suisse, pour ne faire référence qu'à celui-ci, lorsqu'on pose la question à des couples qui n'ont plus de projet parental ou qui n'acceptent pas le don à autrui, la destruction s'accompagne pour beaucoup, plus qu'auparavant, d'une possibilité de recherche au cours même de cette destruction. M. Alain Claeys : Vous êtes la deuxième personne à évoquer le référendum suisse. En tant que chercheur et scientifique, mais aussi en tant que citoyen, s'agit-il d'une procédure sur un tel sujet qui vous paraît correcte ? M. René Frydman : Aujourd'hui, nous sommes en France dans une situation théoriquement d'autorisation selon la loi, mais de non-application dans la réalité compte tenu de la non publication des décrets. Nous avons déjà connu cela pour le diagnostic préimplantatoire. Plutôt qu'un référendum qui va encore repousser les choses, on souhaite que les décrets sortent et qu'on puisse les appliquer, au moins pour une part. Quitte à revoir les points qui sont soulevés sur, peut-être, d'autres modifications. Une des particularités que l'on peut avoir, parmi d'autres équipes, qui sont justement liées aux diagnostics génétiques préimplantatoires, concerne le plan cognitif. Je rejoins en cela mes collègues sur la nécessité d'employer des mots plus larges comme la recherche scientifique dont une des finalités sera de proposer des thérapeutiques. Une visée cognitive est extrêmement importante, c'est le premier but de la démarche scientifique. Il faut d'abord comprendre pour pouvoir utiliser. Dans le domaine de la reproduction, puisque les autres chercheurs pourront parler des thèmes plus généraux, il existe trois thématiques qui sont très intéressantes, sur la formation du tissu trophoblastique du placenta, qui est une source de connaissance très importante, et que l'on pourrait aborder par ces techniques. Il y a également la création de cellules germinales, qui a été évoquée chez l'animal, la création d'ovocytes ou de spermatozoïdes, dont il faudrait vérifier la pertinence et l'efficacité. Outre le fait qu'elles pourraient s'inscrire dans un programme à visée thérapeutique, elles pourraient également être une source d'ovocytes, comme cela a été évoqué, ce qui court-circuiterait le problème du don. Cela reste encore des questions sans réponse mais mérite une réflexion. On peut citer également les embryons qui présentent des altérations génétiques, chromosomiques ou géniques. Certains laboratoires ont, du fait de la possibilité du diagnostic génétique préimplantatoire, une source cognitive très importante. En effet, on n'attend pas pour détruire ces embryons, puisqu'on les détruit chaque jour. Lorsqu'il s'agit d'embryons atteints, nous les détruisons, nous ne les conservons pas, puisqu'ils n'ont aucune destinée. Une des questions serait de savoir si dès aujourd'hui, on ne peut pas considérer que ce sont des déchets opératoires et, en tant que tels, on pourrait pratiquer, au moins sur ceux-là, des recherches qui sont fort intéressantes, et pour lesquelles je signalais qu'au congrès du mois d'octobre plusieurs communications avaient été faites. On a le sentiment qu'il y a une évolution, et la réunion d'aujourd'hui en est la preuve. Il existe une tendance à espérer d'une part l'application de ces décrets et d'autre part le soutien des organismes de recherche. Du fait du retard de la loi, il existe encore un manque de lisibilité entre tous les participants qui pourraient donner un soutien à la création d'unités. Celles-ci se doivent d'être de niveau international et non pas saupoudrées car la convergence d'un certain nombre de talents est nécessaire pour pouvoir avancer et être transparents. On serait tentés de dire qu'avec ces décrets qui s'annoncent, cette immense possibilité que l'on voit, il faudrait qu'émergent des efforts pour concentrer les moyens.
Un des points fondamentaux que nous devrons examiner concerne la création de postes d'accueil, de postes fléchés, quels que soient les organismes ou les moyens. Nous voyons actuellement avec une certaine tristesse des chercheurs français qui se consacrent à ce domaine de recherche émigrer, justement parce qu'ils n'ont pas la possibilité de travailler sur les cellules souches, en particulier embryonnaires. Tout récemment, une chercheuse française vient d'être engagée à Harvard, et nous ne pouvons pas le faire ici. Il faudrait véritablement, et très rapidement, prévoir une sorte de plan d'urgence, comme il y en a eu beaucoup en santé. Cela n'a pas ici la même importance que les grands plans de type cancer, mais plus que les moyens en matériel, et plus que les idées qui circulent, ce qui va nous manquer ce sont pour commencer dans des espaces bien définis, une poignée d'hommes et de femmes qu'il faut attirer, voire réattirer, car ils ne sont plus là. Il faudrait dans ce sens créer une école de formation sur ce qui s'annonce être quelque chose de très prometteur. M. Alain Claeys : Merci beaucoup. Avant de continuer, je voudrais que l'on apporte une précision. Mme Camby est absente, mais je voudrais que l'on soit clair sur la loi et sur les difficultés que vous rencontrez aujourd'hui. L'article 37 de la loi prévoyait des mesures dans l'attente des décrets. Il était indiqué : « A titre transitoire, et jusqu'à la date où seront publiés les décrets en Conseil d'Etat, le ministre chargé de la Santé et le ministre chargé de la Recherche peuvent autoriser conjointement par arrêté l'importation à des fins de recherche des cellules souches embryonnaires, des protocoles d'étude et de recherche sur ces cellules souches embryonnaires importées dans le respect des conditions suivantes. » Sur l'importation et sur l'accord de protocole d'étude, ceci est possible aujourd'hui. L'Agence de la biomédecine est-elle opérationnelle sur ce point aujourd'hui ? Mme Evelyne Jouvin-Marche, directrice adjointe du département du vivant du CNRS : Une réunion du conseil d'administration a lieu demain et ce point sera soulevé. M. Alain Claeys : Concrètement, lorsqu'une équipe veut importer ou déposer un protocole de recherche, comment cela se passe-t-il ? Mme Marie-Odile Ott, responsable du secteur « Recherche » et des programmes internationaux de l'Agence de la biomédecine : L'Agence de la biomédecine n'est pas encore à même de délivrer ces autorisations. Elle attend également la publication du décret concernant la recherche sur l'embryon. Pour le moment, le Comité ad hoc transitoire est toujours piloté par le ministère de la Recherche et il siège ce matin même. M. Alain Claeys : Depuis que la loi a été promulguée, combien de projets de recherche ou de demandes d'autorisation d'importation ont été déposés ? Mme Marie-Odile Ott : Environ treize équipes ont déposé des dossiers de demandes d'autorisation d'importation, de conservation et de projets de recherche. Le nombre de projets doit être de dix-sept, certains chercheurs ayant déposé quatre projets, d'autres deux et d'autres un. M. Alain Claeys : Ces projets ont-ils été validés ? Mme Marie-Odile Ott : Certains sont encore en cours d'examen. M. Alain Claeys : Pour quelles raisons, s'il existe ce Comité ad hoc, des équipes ne peuvent-elles pas concourir à des appels d'offres européens ? M. René Frydman : Nous avons rencontré une difficulté, que nous avons résolue en partie, du point de vue de la législation européenne au moment de la mise en place des appels d'offres du Sixième PCRDT. Celle-ci était liée au caractère transitoire du Comité ad hoc. Nous avons dû travailler de façon approfondie avec la Commission pour que la participation des équipes françaises soit admise. C'était simplement une demande de clarification de la part de la Commission. M. Philippe Ménasché : Mme Ott a répondu. Il faut d'abord rendre hommage au Comité ad hoc, qui a beaucoup travaillé. Il faut aussi souligner le décalage auquel Ketty Schwarz faisait allusion, entre le temps scientifique et le temps administratif. Dans un exemple précis, il a fallu dix mois pour obtenir l'autorisation d'importation. Ce délai, dans un domaine qui évolue aussi vite, représente indiscutablement une perte de temps et une perte de chance. Il y a là cet amour de la complexification administrative et réglementaire, alors qu'on est dans un domaine où il faudrait aller rapidement, ce qui n'est pas le cas. M. Alain Claeys : Je veux bien croire que l'on est un pays où la complexité administrative est forte, mais il faudra m'expliquer pourquoi il a fallu plus de quatre ans entre la loi et le décret d'application pour que le diagnostic préimplantatoire puisse voir le jour dans notre pays. Quand on nous a demandé, avec Claude Huriet, d'évaluer la loi de 1994, à la fin 1997, les décrets d'application, entre autres celui-là, n'étaient pas sortis. Cela pose un problème sur le rôle du législateur. Mme Evlyne Jouvin-Marche : Je suis également directrice de recherche à l'Inserm, où je dirige une équipe dans une unité Inserm/CEA sur le pôle scientifique de Grenoble. J'interviendrai davantage au niveau de la biologie et je risque de répéter les propos de Christian Bréchot. A ce niveau, le soutien à la recherche fondamentale est indispensable. Nous avons besoin d'accroître les connaissances et de mieux connaître les processus biologiques qu'a évoqués Jean-Claude Ameisen. C'est de ces efforts qui seront faits en recherche fondamentale que viendront le progrès et l'espoir d'utiliser les cellules souches en thérapie. Plus concrètement, les efforts du département, c'est un soutien aux équipes. Il y a une trentaine d'équipes travaillant sur les cellules souches et la différenciation cellulaire soutenues par département du vivant. Ce sont des équipes pour la plupart mixtes, composées de chercheurs du CNRS, de l'Inserm, voire de professeurs des universités. Nous avons ouvert cette année un poste « cellules souches » dans la section 30 pour le recrutement d'un chercheur CRA, de façon à ce que les bons chercheurs, qui sont souvent formés à l'étranger, puissent revenir en France et développer les thématiques que l'on souhaite. Au niveau européen, nous avons également un soutien de nos équipes. Pour répondre à toutes les questions d'utilisation de cellules souches, adultes ou embryonnaires, une personne au département peut être consultée pour toutes les demandes. Elle répond de façon efficace à tous les projets de recherche sur les cellules embryonnaires et adultes dès qu'un chercheur CNRS souhaite faire partie de ce projet. Au niveau de la recherche fondamentale, je vais me limiter à résumer le brillant exposé de Jean-Claude Ameisen, en indiquant les points qu'il faut absolument franchir et ceux où les équipes françaises ont un très bon niveau pour le faire. Il s'agit d'identifier de nouvelles souches dans d'autres tissus que ceux actuellement connus. Ceci nécessitera d'avoir des marqueurs pour pouvoir les différencier, car c'est là un point d'achoppement de la recherche. En effet on n'a pas toujours les moyens d'identifier les cellules souches. Un autre point qui a été largement exposé concerne le fait de connaître les aspects moléculaires du maintien de ces cellules souches, c'est-à-dire d'étudier les plasticités tissulaires, comment ces cellules souches vont proliférer, comment elles vont être maintenues dans l'organisme et comment assurer leur autorenouvellement. Je ne reviens pas sur un point largement abordé concernant l'étude de leur potentiel de différenciation, mais j'insisterai sur leur potentiel de migration. Si l'on sait maintenant qu'il existe des cellules souches dans les tissus, il faut encore que ces cellules souches puissent migrer là où elles peuvent être fonctionnelles. C'est un objectif qui n'est pas encore atteint. Ces questions sont posées non seulement par les équipes françaises, mais également au niveau international. Le point le plus important, comme cela a déjà été souligné, est qu'il faut examiner leur évolution pour être sûr que ces cellules souches vont être fonctionnelles, c'est-à-dire assurer les fonctions pour lesquelles elles vont être rééduquées. Il faut également vérifier les caryotypes, le fait qu'elles n'auront pas une division anormale des chromosomes, qu'elles ne vont pas développer des caractères tumorigènes et s'engager sur une voie maligne. Surtout, il faut qu'elles soient admises par l'organisme de façon à ne pas développer des réactions immunitaires. Ce sont de larges programmes dans lesquels l'ensemble des équipes soutenues actuellement par le CNRS sont engagées. Si ces progrès sont acquis, on pourra alors répondre aux espoirs qui sont actuellement fondés par des associations de malades et utiliser ces cellules souches pour guérir. Je pense que d'autres personnes interviendront sur ce point. M. Alain Claeys : Concernant le CNRS, on y reviendra plus tard, mais quels sont les montants engagés ? Mme Evelyne Jouvin-Marche : L'estimation est difficile, car les montants ne sont pas énormes et la majorité de nos équipes fonctionnent généralement grâce à des appels d'offres nationaux ou européens. Il est évident que l'on soutiendra l'ANR dans la mise au point de projets sur les cellules souches, car nous avons nous-mêmes des difficultés à maintenir l'effort de recherche de nos équipes. Cependant, celles-ci publient bien. Si vous lisez la presse internationale, vous constaterez que de nombreuses équipes françaises, Inserm, CNRS, Institut Pasteur, ont souvent des travaux qui sont cités dans les meilleures revues. On ne démérite pas mais on a besoin de plus d'argent. M. Alain Claeys : Nous allons continuer avec M. Michel Van der Rest. M. Michel Van der Rest : Je voudrais simplement donner une indication par rapport au nombre d'équipes mentionnées par Evelyne Jouvin-Marche. Environ 10 % du potentiel de recherche du département du vivant est impliqué dans ce type de thématique. Tout dépend où l'on situe la limite et si dans ce calcul on remonte jusqu'à la notion de différenciation cellulaire. Il est évident aujourd'hui qu'à peu près tous ceux qui travaillent sur la différenciation cellulaire dans le règne animal et sur l'homme, sont concernés par cette problématique. Le CNRS s'associe pleinement aux remarques qui ont été faites précédemment, que je ne reprendrai pas, notamment au niveau de l'importance des études sur les cellules souches et toute la recherche amont, qui est le cœur de métier du CNRS. Il y a dans le dispositif actuel des obstacles pour rester compétitif au niveau mondial. Notamment, l'un des éléments qui est très important dans la recherche est la notion de temps, qui a deux mesures. D'une part, comme cela a été dit tout à l'heure, il est difficile de rester compétitif lorsqu'on est retardé de près d'un an pour obtenir le matériel indispensable. D'autre part, les projets se déroulent sur des durées relativement longues. Il est difficile, si l'on a des limites de temps (je pense à la dérogation de cinq ans de 2004), de faire des projets scientifiques suivant un tel échéancier, notamment par rapport à nos partenaires. Il est donc difficile de se positionner pour des projets qui vont souvent durer cinq ou dix ans, lorsqu'on ne sait pas si dans trois ans on pourra continuer. Il y a là un réel problème. M. Alain Claeys : Pouvez-vous chiffrer ce que consacre votre direction sur ce programme spécifique ? M. Michel Van der Rest : Cela doit tourner autour de 7 M€ sur l'ensemble des laboratoires travaillant sur la problématique telle que je l'ai définie. M. Alain Claeys : Je suppose que vous avez la même approche que le directeur de l'Inserm concernant la relation ANR/CNRS. M. Michel Van der Rest : Tout à fait. Je voulais ajouter que le CNRS doit envisager tout ce qui concerne les aspects non seulement éthiques, mais, en amont, la notion de représentation du vivant. J'ai essayé, pour la réunion d'aujourd'hui, d'obtenir des chiffres de mon collègue responsable du département « hommes et sociétés », mais je n'ai pas pu les avoir à temps pour vous donner un aperçu de ce type de réflexion. Cependant, j'ai moi-même été impliqué dans des groupes de réflexion qui se coordonnaient avec des équipes notamment sur la représentation des sciences, et en particulier du vivant. Dans un travail législatif, il est finalement très important de savoir ce que l'on met derrière les mots. Lorsqu'on parle d'embryon, qu'est-ce qu'on entend par là ? Il y a dans ce sens tout un travail qui demande encore à être approfondi. J'ai saisi le département « hommes et sociétés » de ce problème, et je sais que des travaux se font. J'ai moi-même été impliqué dans des travaux réalisés à Lyon sur certains aspects. Un groupe de travail a été créé sur les cellules souches, animé par le professeur Jacques Samarut. Mais c'est encore très imparfait et embryonnaire, et un effort doit encore être accompli dans ce sens. Cela pourrait contribuer de façon importante au débat, en éclairant nos perceptions en tant que société par rapport à ce type de problématique. Voilà les quelques éléments que je voulais ajouter. Je souligne bien que je m'associe pleinement à ce qui a été dit, en particulier par M. Bréchot. M. Alain Claeys : Je reviens sur les propos qui ont été tenus car je voudrais avoir des précisions. Tout d'abord, sur les difficultés que l'on aurait à participer à la création d'une banque de cellules souches au niveau international. Quels sont les freins aujourd'hui pour que la France participe avec une équipe de chercheurs ? En supposant que les décrets d'application soient publiés, en quoi notre législation vous interdit de participer à la création de cette banque ? M. Christian Bréchot : Il y a deux éléments de réponse. Un élément rationnel et objectif, et un autre de perception de l'effort du pays et de son engagement. Ce que j'ai surtout voulu dire concerne essentiellement le second point. Actuellement, à un forum tel que celui auquel j'ai fait allusion, on peut difficilement prétendre jouer un rôle de leader, ou en tout cas d'élément participant à un niveau important, dans une situation où la législation n'est pas clarifiée. Mais il n'y a pas d'impossibilité, et nous l'avons prouvé, puisque nous avons réussi à nous maintenir dans cet effort. Ainsi, c'est l'Inserm qui va organiser la prochaine édition de ce forum début janvier. J'ai voulu dire qu'il est difficile de jouer un rôle auquel nous autorise la compétence des équipes, comme cela a été souligné pour le CNRS, dans une situation encore aujourd'hui intermédiaire. Le second point est qu'il est maintenant plus difficile, pour des raisons plus rationnelles, de participer de façon efficace, dans une situation où nous ne sommes pas capables par nous-mêmes de créer de nouvelles lignées. Et il est difficile d'arriver dans un forum, où il s'agit de caractériser de nouvelles lignées et d'en démontrer l'utilité, alors que nous n'avons pas droit de les générer. Nous avons donc des difficultés de perception et des difficultés rationnelles. M. Jacques Hatzfeld, directeur de recherche au CNRS : René Frydman a indiqué tout à l'heure qu'on est prêt à utiliser des déchets opératoires (je crois que c'est le terme qu'il a utilisé) provenant de DPI. On pourrait faire des lignées immédiatement, mais la loi nous l'interdit. On pourrait gagner beaucoup de temps. Avec l'Agence de la biomédecine, cela va prendre encore des mois avant d'avoir des autorisations. Il m'a fallu neuf mois, avec huit allers-retours et un dialogue de sourds, avec pourtant un comité qui essayait de faire du mieux qu'il pouvait. Je crois qu'on va perdre encore beaucoup de temps, et j'aimerais qu'il y ait une réponse du législateur. Qu'est-ce qui nous empêche d'utiliser ces cellules, qui n'ont plus l'état d'embryon, et avec lesquelles on peut faire des lignées immédiatement ? On peut même faire mieux que l'étranger. D'habitude on fait ces lignées sur des cocultures avec des cellules animales. On peut le faire non seulement sans coculture, mais avec uniquement des molécules humaines. Ce serait une première. Si on attend encore quelques mois, il est sûr que cela ne sera pas fait en France. C'est vraiment une question de mois. Il faut que nous ayons l'autorisation au 1er janvier. M. Hervé Chneiweiss : Peut-être nos invités compétents pourraient-ils nous préciser pourquoi il est absolument nécessaire de créer de nouvelles lignées. On pourrait se poser la question d'utiliser d'autres matériels. Jacques Hatzfeld vient d'y faire allusion, mais une précision serait utile. Il convient également de préciser que le temps, dont M. Van der Rest nous a parlé, c'est aussi du savoir-faire et de la compétence qui n'est pas acquise ou que d'autres acquièrent à notre place. M. Alain Claeys : Il faut évacuer tous les problèmes concernant cet article 25 de la loi. Il existe trois contraintes. La première, c'est l'autorisation limitée à cinq ans. La deuxième contrainte, c'est qu'il faut présenter des programmes de recherche à visée thérapeutique. Même moi, non scientifique, je ne comprends pas très bien ce que cela veut dire. La troisième, est que le programme de recherche sera accepté, car tout peut être bloqué s'il n'y a pas d'autres techniques possibles pour aboutir à la même recherche. Le texte indique la chose suivante : « Les recherches peuvent être autorisées sur l'embryon et les cellules embryonnaires lorsqu'elles sont susceptibles de permettre des progrès thérapeutiques majeurs et à la condition de ne pouvoir être poursuivies par une méthode alternative d'efficacité comparable. » En tant que parlementaire, et cela a expliqué mon vote à un moment donné, je n'ai toujours pas compris ce que cela voulait dire. Ou j'ai peut-être trop bien compris, car avec ce type de rédaction, on peut tout bloquer. M. Daniel Louvard, directeur de recherche au CNRS, directeur de la section recherche de l'Institut Curie, membre de l'Académie des sciences, membre du Comité de pilotage : Je ne crois pas pouvoir vous éclairer sur ce point. Beaucoup de choses ont été dites, très intéressantes, et je ne vais pas les redire, mais je reprendrai certaines d'entre elles sur quelques affirmations ou commentaires. Je vais essayer de donner un point de vue complémentaire, voire contradictoire, pour d'abord dire que, bien sûr, en tant que chercheur, je m'associe à ce qui a été dit. On met en avant les aspects thérapeutiques qui génèrent le débat éthique que nous connaissons, mais il y a avant tout besoin de soutenir la recherche fondamentale sur la meilleure connaissance des cellules souches. D'une certaine manière, le débat éthique est légitime mais il a terriblement fait glisser le débat en faveur du problème posé par les cellules souches embryonnaires. Je me suis réjoui d'entendre Christian Bréchot signaler que l'Inserm consacre la majorité des moyens sur ce programme de cellules souches adultes. Il me semble très important aujourd'hui d'essayer de répondre scientifiquement à des questions que posent les cellules embryonnaires et adultes. J'entends parfois certains cercles d'experts les opposer les unes aux autres. Ce débat ne m'intéresse pas mais il pose des questions scientifiques fondamentales. Lorsqu'on oppose les deux, les cellules souches adultes sont peu nombreuses. Qu'en sait-on ? Pour certains tissus, c'est faux. Les cellules souches adultes ont un nombre de divisions limitées. C'est faux. On n'en sait rien. Les cellules souches adultes ont une potentialité limitée. Certes, par définition, les cellules souches embryonnaires sont totipotentes, alors que les cellules somatiques adultes sont probablement pluripotentes. Mais quelle est leur pluripotentialité, comment doit-on les comparer aux cellules embryonnaires dont elles dérivent et qui ont permis de former ces tissus adultes ? On n'en sait rien. On dit que les cellules embryonnaires peuvent donner des tumeurs. C'est très vraisemblable et c'est démontré expérimentalement. C'est possible aussi pour les cellules souches adultes, mais on n'en sait rien. Il y a deux cent trente-cinq familles de cellules identifiées aujourd'hui chez les métazoaires que sont les mammifères que nous sommes. On compte sur les doigts d'une main, peut-être de deux, le nombre de cellules souches adultes qui ont aujourd'hui été caractérisées. Certes, ce sont deux cent trente-cinq familles qui dérivent de sous-familles et de cellules souches communes, mais toutes ces questions concernent la biologie fondamentale et elles ont besoin d'être posées. Lorsqu'on dit « connu », cela signifie que l'on a caractérisé ces cellules souches adultes, qu'on a identifié des marqueurs qui permettent de les trier et d'identifier leur origine et leurs propriétés. Un grand travail reste donc à faire et j'espère que la communauté scientifique ne va pas rester divisée dans le cadre de ce débat éthique. Un travail de comparaison devrait être fait entre une cellule souche embryonnaire et une cellule souche adulte, pour arriver à des questions sur le niveau de plasticité d'une cellule souche adulte. Les grandes questions ont été évoquées, et je salue l'intervention de Jean-Claude Ameisen sur les grandes questions de biologie. La mitose d'une cellule souche n'est pas la même que celle d'une cellule germinale qui s'engage dans une voie de différenciation. C'est une mitose asymétrique. C'est une question fondamentale en biologie, mais malheureusement trop peu d'équipes travaillent sur ces mécanismes moléculaires de la division asymétrique. Il y a certes des travaux sur la drosophile et sur les organismes simples, mais on aimerait savoir comment cette division et cette mitose asymétrique se passent dans d'autres tissus, en particulier dans les cellules souches de nos tissus. L'épigénétique est un vaste problème remis à la mode, et l'on sait aujourd'hui que tout n'est pas dans la séquence du génome et qu'il va falloir trouver d'autres solutions. Les petits ARN évoqués par Jean-Claude Ameisen montrent la vanité d'une certaine génération d'avoir cru qu'on avait tout expliqué, alors que tout restait sans doute à expliquer. Les cellules souches, par l'organisation de la chromatine particulière qu'elles ont adoptée compte tenu de l'inaccessibilité de leurs gènes indispensable à la protection de leur génome, restent un vaste domaine à explorer. Comme je dirige un centre de recherche sur le cancer, et qu'on a évoqué les capacités et les possibilités d'utilisation des cellules souches, qu'elles soient embryonnaires ou adultes, à des fins réparatrices, je pense qu'une grande question se pose également sur les problèmes d'approche thérapeutique dans différents tissus. Quelques mots sur le cancer. Le concept de cellule souche cancéreuse refait surface aujourd'hui. A la fin du xixe siècle, cette hypothèse existait déjà. Au cours des années 1930, on en parlait également. Une autre période a suivi, où les concepts darwinistes, que je ne remets pas en cause, auront largement favorisé le principe de sélection et de pression de sélection au sein des tumeurs, oubliant que celles-ci sont non seulement hétérogènes sur le plan génomique, face aux altérations génétiques au cours de la progression tumorale, mais qu'elles sont aussi hétérogènes sur le plan cellulaire. Certaines questions sont connues depuis les années 1950 ou 1960 : par exemple, pourquoi faut-il un million de cellules tumorales injectées à une souris immunodéficiente pour faire une tumeur ? On a écarté le problème en répondant que pour cloner des cellules, il en faut un certain nombre pour que cela marche. Néanmoins, on est capable avec une cellule, si elle a la possibilité de se développer dans un environnement approprié, de fabriquer des clones et donc de grandes populations cellulaires. On voit aujourd'hui réémerger le concept qu'il est probable que dans une tumeur, ce qui a assuré sa pérennité et sa croissance, c'est une sous-population minoritaire de cellules, qui ont quelque chose en commun, sans que l'on sache très bien quoi. On les appelle cellules souches tumorales, mais sont-elles vraiment des cellules souches ou sont-elles dérivées de cellules progénitrices, elles-mêmes issues de cellules souches ? La réponse n'est pas complètement claire. Néanmoins, on a aujourd'hui quelques certitudes. C'est le cas par exemple des tumeurs cérébrales ou du sein car ce sont des groupes que l'on a réussi à mieux caractériser, à mieux isoler, à purifier presque jusqu'à l'homogénéité des sous-populations de cellules peuplant ces tumeurs. On a en effet constaté que ce n'est pas alors un million de cellules porteuses des marqueurs de cellules souches tumorales qui sont nécessaires pour créer une tumeur dans une souris mais l'injection de quelques dizaines, ou moins d'une dizaine, de cellules ayant cette propriété. Ceci a des conséquences fondamentales. En ce qui concerne la thérapie, et je me tourne vers Marianne Minkowski qui représente ici le président de l'INCA, je souhaite vivement que l'INCA comble cette lacune qui existe dans le plan cancer, par rapport à la priorité de recherche sur les cellules souches à des fins thérapeutiques pour le cancer. C'est quelque chose que j'ai indiqué alors que j'étais vice-président de la commission qui a établi le plan cancer et cela n'a pas été entendu jusqu'à présent, ni dans les textes ni dans les actions. Pourquoi ne réussissons-nous pas aujourd'hui en effet à éradiquer les tumeurs ? Pourquoi y a-t-il une croissance des tumeurs après une efficacité apparente ? Peut-être tout simplement parce qu'on s'est trompés de cible, qu'on tue les cellules qui prolifèrent et qui différencient, et que l'on ne tue pas efficacement les 1 à 2 % de cellules souches tumorales qui peuplent une tumeur. Ceci m'apparaît fondamental car il est possible, comme pour les cellules souches normales, comme pour les cellules souches embryonnaires, que la pharmacologie à laquelle sont sensibles ces cellules soit différente. Il est possible, parce que les mécanismes moléculaires au cours de la division, de la signalisation cellulaire, qui est un grand sujet de biologie, que ces cellules souches aient, parce qu'elles sont différentes, des propriétés différentes que nous ne connaissons pas. Je dirais à nouveau : place à la science et place à la recherche. M. Alain Claeys : Merci, Monsieur Louvard. On ne va pas ouvrir le débat sur les cellules souches adultes et les cellules souches embryonnaires mais je crois que votre intervention était utile. Mme Marina Cavazzana-Calvo, professeur de médecine, chef du service du département de biothérapie de l'hôpital Necker-Enfants malades, coordinatrice du Centre d'investigation clinique intégré en biothérapie du CHU Necker-Enfants malades : Je remercie Monsieur Louvard pour cette intervention sur les bases scientifiques, que l'on a besoin de connaître, mais je ne peux pas vous laisser soutenir certaines affirmations qui ne sont pas tout à fait correctes... M. Alain Claeys : Il peut tout dire et vous pouvez tout dire... Mme Marina Cavazzana-Calvo : Oui, mais il faudrait que les collègues qui travaillent un peu moins sur les cellules souches aient des idées claires. Il n'y a pas aujourd'hui de plasticité des cellules souches adultes. On ne peut pas vous laisser dire cela. M. Daniel Louvard : Qu'en savez-vous ? On ne peut pas répondre à cette question car nous n'avons pas pu l'étudier. Citez-moi le nombre de cellules souches qui ont été isolées. Mme Marina Cavazzana-Calvo : Le débat a été conduit par les principales revues dont nous nous servons, Nature, Science, avec des personnes qui ont travaillé dans le monde entier sur les cellules souches adultes et sur les cellules embryonnaires. On peut dire aujourd'hui, sans trop craindre de se tromper, qu'il n'y a pas de plasticité. On entend par plasticité la possibilité pour une cellule souche adulte de se transformer dans un autre foyer embryonnaire. Pour les cellules souches hématopoïétiques et de la moelle osseuse, cela a été prouvé. M. Daniel Louvard : Je crois qu'on appelle plasticité deux choses différentes. Mme Marina Cavazzana-Calvo : C'est possible, mais on doit travailler à l'intérieur des contraintes d'une loi selon laquelle on doit demander l'autorisation de travailler sur des cellules avec des caractéristiques, bien définies. Il faut parler de celles-ci, les définir, et il est nécessaire de travailler en parallèle, sans des conflits sans intérêt, aussi bien sur les cellules souches adultes que sur les cellules souches embryonnaires. Il n'y a pas actuellement dans la communauté scientifique de conflits sur ce point. Je me permets également de saluer le travail fait à l'Inserm sur cette question, même en période de vide juridique, car il a su rassembler les chercheurs pour que l'on puisse bénéficier des connaissances aussi bien du monde de la cellule souche adulte que de celui de la cellule souche embryonnaire. M. Jacques Hatzfeld : Tous les travaux qui ont été faits sur les MAPC - ces soi-disant cellules souches adultes qui ont des propriétés de cellules souches embryonnaires -, sont actuellement totalement inreproductibles. Ceux-ci ont été faits avec certaines lignées de souris (dites inbred) et ne marchent pas du tout avec d'autre et encore moins avec la souris sauvage. Il y a beaucoup à dire sur tous les travaux sur la souris. Chez l'homme, c'est hors de question. Des gens comme Ron McKay, qui sont des scientifiques internationaux reconnus, ont dit à Catherine Verfaillie, que lorsqu'elle leur donnerait ces cellules, ils pourraient y travailler. Pour l'instant, ils ne peuvent rien faire. Catherine est rentrée en Belgique et elle ne dirige plus cet Institut du Minnesota où on travaillait sur les MAPC. Il faut arrêter de raconter des choses qui sont fausses, de dire qu'avec le sang du cordon on va faire du cœur qui bat, etc. J'ajoute que je fais partie du projet européen GENOSTEM sur les cellules souches adultes. C'est grâce aux cellules souches embryonnaires que je permets à ce projet de trouver les marqueurs des cellules souches adultes, non pas en partant par l'aval, comme on le faisait auparavant, mais en partant par l'amont, en dérivant, à partir des cellules souches embryonnaires, des cellules souches mésenchymateuses, ce qui me permet d'en avoir en quantité, et d'étudier tous les marqueurs les plus primitifs. Si l'on ne travaille pas sur les cellules souches embryonnaires, on ne comprendra jamais les cellules souches adultes. Au cours de mon intervention, je parlerai de la génomique fonctionnelle, qui me semble quelque chose de très important. M. Daniel Louvard : Je m'étonne car s'il n'y a pas de controverse, l'intervention que tu viens de faire montre qu'il y en a une. Les cellules souches embryonnaires sont totipotentes, comme je l'ai rappelé, et les cellules souches adultes sont pluripotentes. M. Jacques Hatzfeld : Nous n'avons pas les mêmes définitions. Mme Laure Coulombel, directeur de recherche à l'Inserm : Il existe un consensus international sur le fait que la cellule souche totipotente, c'est le zygote et les premières divisions cellulaires, que les cellules souches pluripotentes sont les lignées de cellules ES qui sont dérivées de la masse interne du blastocyste, et que le consensus veut, à l'heure actuelle, mais il peut être remis en question, que chez l'adulte on parle de cellules souches multipotentes. C'est un consensus international. M. Daniel Louvard : Nous sommes d'accord. Ce que je voulais dire, c'est que dans un tissu adulte, nous savons bien qu'il y a des cellules souches qui dérivent des différents feuillets embryonnaires, et qu'on n'a pas pu explorer exactement, en dehors du tissu dans lequel elles existent, ou de l'organe dans lequel elles existent, si elles récapitulent ou non l'ensemble des propriétés des cellules du feuillet dont elles dérivent. Excusez-moi pour le lapsus, car ce n'est pas pluripotentes, mais multipotentes qu'il aurait fallu dire. M. Alain Claeys : Y compris à l'Assemblée, on peut se parler. Je donne la parole à René Frydman, puis nous suspendrons le débat pendant cinq minutes, pour reprendre ensuite la troisième table ronde. M. René Frydman : J'ai le sentiment que les gens qui travaillent ou voudraient travailler sur les cellules embryonnaires en France ne sont pas du tout opposés, au contraire, au fait qu'un travail s'effectue sur les cellules adultes. On a le sentiment qu'il y a un certain groupe de personnes qui ne souhaitent que travailler sur les cellules adultes, sans voir le bénéfice que l'on pourrait trouver. La position scientifique a toujours été « que le meilleur gagne », que les études se fassent. Si l'on peut tirer des éléments de l'une ou de l'autre, on verra à ce moment-là, mais on ne peut pas avoir des a priori. La position a priori est très négative pour la recherche scientifique. M. Alain Claeys : Le parlementaire que je suis en est resté au rapport qui avait été commandé par le ministre de l'époque, le rapport Gros, signalant qu'il fallait mener de front les deux types de recherches. Mme Laure Coulombel : Le terme de l'alternative a été soulevé, et c'est quelque chose qu'il faut expliquer, ne serait-ce que pour la question d'Hervé Chneiweiss. Il s'agit de l'alternative entre les lignées actuellement disponibles et de nouvelles, et de la complémentarité cellules souches adultes versus cellules souches embryonnaires. Je pense que ce terme d'alternative est très important. Il s'agit du problème posé par les anciennes lignées de cellules embryonnaires. Le problème des lignées importées est qu'elles ont été dérivées il y a longtemps, qu'elles sont à de multiples passages, qu'elles n'ont fait l'objet d'aucune standardisation de culture, et qu'elles sont cultivées dans des laboratoires indépendants et donc dans des conditions très hétérogènes. La deuxième chose, c'est que ces lignées ont été dérivées initialement dans des conditions avec des molécules de type animal et qu'il est exclu de les utiliser en thérapeutique. Pour toutes ces raisons, il est essentiel d'avoir accès à de nouvelles lignées dérivées dans des conditions standardisées et surtout dans des conditions qui seront applicables « cliniquement », ou dans des modèles précliniques animaux. C'était pour répondre à la question qui avait été posée. Une autre question concerne la complémentarité entre les cellules souches embryonnaires et les cellules souches adultes. J'aborderai rapidement tout à l'heure le problème des cellules souches adultes car il y a d'énormes limitations à leur utilisation thérapeutique. On revient actuellement sur des choses autrefois artefactuelles et mal interprétées. Il est essentiel de ne pas les opposer, pour deux raisons. Les mécanismes moléculaires qui gouvernent le fait que ces cellules embryonnaires peuvent être amplifiées de façon illimitée sont probablement assez proches en termes moléculaires des mécanismes qui sont utilisés par les cellules souches adultes, y compris par les mécanismes qui font qu'une cellule souche va décider à un moment donné de s'engager dans une voie de différenciation versus une autre. Par ailleurs, les cellules souches embryonnaires nous donnent une accessibilité en termes de nombre qui est absolument impossible à obtenir avec les cellules souches adultes. Toute étude, qu'elle soit biochimique ou moléculaire, a besoin d'avoir une accessibilité en nombre, ce qui est actuellement impossible avec les cellules souches adultes, car elles ne s'autorenouvellent que très peu, et surtout, il faut les sortir d'un tissu et les purifier - c'est à l'heure actuelle très difficile, sauf dans le cas des cellules souches hématopoïétiques. Table ronde n° 3 : M. Alains Claeys : Le débat sur lequel s'est terminée notre deuxième table ronde va peut-être trouver des prolongements dans cette troisième table ronde. Nous allons aborder plus précisément l'aspect thérapeutique, mais nous allons également revenir sur des questions évoquées depuis le début de la matinée. Je présente les intervenants : Mme Marina Cavazzana-Calvo, professeur des universités, chef du service du département de biothérapie de l'hôpital Necker-Enfants malades, coordinatrice du Centre d'investigation clinique intégré en biothérapie du CHU Necker-Enfants malades ; Mme Laure Coulombel, directeur de recherche à l'Inserm ; M. Jacques Hatzfeld, directeur de recherche au CNRS ; M. André Hovine, président de France Parkinson ; M. Philippe Ménasché, professeur de chirurgie thoracique et cardiovasculaire à l'université de Paris V, chirurgien cardiaque à l'hôpital Georges-Pompidou, directeur d'unité Inserm ; Mme Marianne Minkowski, directrice adjointe du département biologie du cancer à l'Institut national du cancer ; M. Roger Picard, porte-parole de l'Alliance maladies rares et M. Bernard Zalc, directeur de recherche à l'Inserm. Mme Marina Cavazzana-Calvo : Je tiens à vous remercier à deux titres. D'abord, parce que vous nous avez donné la possibilité de discuter entre autorités de santé, instituts de recherche, directeur de l'Inserm, directeurs d'instituts scientifiques et représentants des entreprises de biotechnologie. Ensuite, j'ai l'impression que sous les lumières d'une actualité très lourde d'un point de vue social, les pouvoirs publics ont oublié de continuer ce débat, important pour nous et de premier plan, sur les cellules souches et les décrets d'application. En utilisation thérapeutique, on peut aller très vite ou très lentement. Si on pouvait concentrer l'attention sur l'utilisation des thérapeutiques et des cellules souches embryonnaires, on pourrait aller très vite mais il n'y a pas aujourd'hui d'essais en cours utilisant ces cellules. On peut élargir le débat et introduire ce parallélisme qui existe avec les cellules souches adultes. M. Alain Claeys : Sur les applications thérapeutiques, pouvez-vous préciser quelle est la situation exacte aujourd'hui en France et dans le monde ? Mme Marina Cavazzana-Calvo : Les essais se concentrent sur l'utilisation thérapeutique des cellules souches de type adulte. Je voudrais donner une définition, pour savoir de quoi on parle. Ce sont des cellules dérivées de tissus différenciés. Il n'y a pas de notion d'individu adulte, mais du tissu différencié. Si l'on utilise des cellules dérivées d'un liquide amniotique, et si l'on considère que les annexes placentaires sont des tissus différenciés, on va définir cela comme des cellules souches de type adulte, dérivées d'un tissu complètement différencié. Mme Ketty Schwarz : Si je peux me permettre, j'ai évoqué ce matin l'autorisation qui a été donnée voici trois semaines à peine d'un essai de phase 1 qui utilise des cellules souches fœtales neuronales. Mme Marina Cavazzana-Calvo : Ce sont des cellules fœtales et non embryonnaires. Mme Ketty Schwarz : Tout à fait, mais cela modère un peu. Mme Marina Cavazzana-Calvo : C'est pour cette raison que je voulais diviser cette catégorie de cellules souches en trois grands chapitres, même si du point de vue du développement, on pourrait effectuer la division autrement. Nous avons les cellules souches dérivées des tissus différenciés, où l'on peut intégrer les cellules amniotiques, les cellules de type fœtal, et les cellules souches embryonnaires. Il n'y a pas aujourd'hui, à ma connaissance, d'essais thérapeutiques en cours utilisant des cellules souches embryonnaires. En revanche, il existe de nombreux essais qui utilisent la cellule souche de type adulte, avec cette précision que j'ai donnée, et qui intéressent essentiellement les cellules souches de type hématopoïétique. Il s'agit donc des cellules souches multipotentes nichées dans la moelle osseuse, capables aujourd'hui de donner naissance à des cellules matures du centre périphérique et utilisées en thérapeutique à cet effet. On sait aujourd'hui vaguement et grossièrement les isoler, car les critères phénotypiques ne sont pas suffisants pour les définir, et l'on les utilise en routine pour faire par exemple de la greffe de moelle osseuse. Je me permets de rappeler que dans le monde, quarante-cinq mille personnes bénéficient de ce type de traitement. On sait isoler ces cellules du mieux que l'on peut, même si les critères que nous avons à notre disposition sont incertains, et ne définissent pas nécessairement une cellule homogène mais hétérogène en termes de capacité de division cellulaire, de différenciation et d'autorenouvellement. On sait les manipuler, on sait les faire multiplier mais on ne sait pas les faire retourner à l'état souche (cellules souches hématopoïétiques). On sait les manipuler d'un point de vue génétique ex vivo, à savoir, introduire de façon intégrative ou non intégrative des gènes médicaments pour diminuer ou atténuer, ou dans le meilleur des cas guérir, les symptômes d'une maladie. Ce sont les essais thérapeutiques les plus largement conduits dans le monde. Il faut saluer un travail pionnier qui a été fait en France d'utilisation des cellules souches autres que les cellules souches adultes hématopoïétiques, par l'équipe de Philippe Ménasché, avec l'emploi de cellules du muscle adulte pour traiter l'insuffisance cardiaque. L'équipe de Marc Peschanski fait aussi partie de ces pionniers par l'utilisation de cellules fœtales neuronales visant à atténuer les syndromes de cette maladie du système nerveux central qu'est la maladie de Huntington. On reste pionniers en France pour l'utilisation clinique des cellules souches manipulées génétiquement. Des essais prometteurs, même si l'on a rencontré quelques effets toxiques, ont été faits dans les déficits immunitaires combinés sévères, avec l'aide de l'Inserm. Celui-ci joue un rôle fondamental dans l'innovation thérapeutique et dans le soutien qu'il apporte à la seule institution qui a continué à soutenir les cellules souches, malgré le vide dans lequel on s'est trouvé. Grâce à l'intervention massive de cette institution deux autres essais thérapeutiques sur des cellules modifiées génétiquement et des cellules souches hématopoïétiques vont voir le jour en 2006. L'un portera sur la leucodystrophie liée à l' « X », première maladie neurodégénérative de l'enfant, et l'autre sera un essai beaucoup plus restreint dans le domaine de l'hémoglobinopathie (thalassémie majeure et drépanocytose). C'est le contexte dans lequel on est aujourd'hui, pour ce qui concerne les essais d'utilisation thérapeutique sur les cellules souches. Concernant les cellules souches embryonnaires, je ne vais pas répéter tout ce qui a déjà été dit très clairement ce matin. On aimerait que quelques points soient résolus, que les autorités apportent des définitions notamment sur le statut de l'embryon, la protection des dons d'ovocytes, les méthodes que l'on peut utiliser pour les dérivations des cellules souches embryonnaires. Car on sait aujourd'hui que l'on pourrait les dériver à un stade plus précoce, sans toucher à l'intégrité de l'embryon, comme nos collègues généticiens et gynécologues font pour les DPI, les diagnostics préimplantatoires. Je voudrais mettre l'accent sur les contraintes auxquelles on doit faire face aujourd'hui en France, même s'il existe des équipes phares qui figurent en très bonne place dans la compétition internationale. Ces contraintes sont législatives. A vous, Mesdames et Messieurs de l'Assemblée nationale, d'arriver à les lever. Ce sont des contraintes de création et de caractérisation de cellules ES. Hervé Chneiweiss nous a permis de signaler, avec sa question très précise, que l'on est dans l'obligation, si l'on veut rester dans la compétition internationale, de créer de nouvelles lignées de cellules souches embryonnaires humaines et de les caractériser. Dans le cas contraire, on n'aura pas notre place aux côtés des autres partenaires internationaux dans les forums consacrés aux cellules souches. Il existe également des contraintes liées aux chercheurs. On doit se donner les moyens, comme cela a été évoqué par M. Frydman, de rappeler des chercheurs partis à l'étranger et de leur assurer de bonnes conditions de travail en France, où ils pourraient créer des équipes et former de nouveaux chercheurs. Je me permets de rappeler que nous avons également des contraintes matérielles. Dans un pays développé comme la France, je suis étonnée que l'on n'ait pas su créer dans les derniers dix ans un institut de recherche digne de ce nom sur les cellules souches. On pourrait très vite, et avec les moyens existants, faire travailler ensemble des chercheurs sur les cellules souches adultes et embryonnaires, qui pourraient aller beaucoup plus vite avec des conditions de travail autres que celles dans lesquelles on opère tous les jours. M. Alain Claeys : Est-ce que cette coopération existe ? Mme Marina Cavazzana-Calvo : Heureusement qu'elle existe. Encore une fois, l'intervention de l'Inserm a été unique sur le territoire national, car il a rassemblé des chercheurs qui travaillent sur les cellules souches embryonnaires et adultes, des muscles, de l'intestin, du pancréas, hématopoïétiques. Nous avons des réunions en commun, mais ce n'est pas suffisant. L'Inserm a mis les moyens qu'il pouvait, mais nous avons besoin de beaucoup plus. Il faudrait un institut digne de ce nom, comme il en existe en Belgique, au Royaume-Uni, en Suède, aux États-Unis. Je ne comprends pas que dans un pays comme la France, on ne puisse pas libérer des moyens matériels pour cette recherche d'une façon un peu plus rapide que ce qui se fait actuellement. M. Alain Claeys : Pouvez-vous nous faire un point sur les travaux de Robert Lanza, concernant la possibilité, à partir d'un embryon comptant huit cellules, de prendre une cellule sans que cela porte atteinte à l'intégrité à l'embryon ? Où en sont ses recherches ? Mme Marina Cavazzana-Calvo : Je ne sais pas exactement où en sont les recherches de ce groupe. D'autres ici les connaissent peut-être mieux que moi. Ce travail ouvre une possibilité de production de cellules souches embryonnaires à partir d'un stade précoce, sans toucher à l'intégrité de l'embryon, ce qui pourrait faire tomber certains obstacles éthiques sur cette question. M. Daniel Aberdam : Effectivement, des expériences ont été tentées, dont certaines réussies, et peu ont été publiées. On peut isoler des cellules de la masse interne avant même la formation du blastocyste sans véritablement détruire l'embryon. C'est encore au stade très expérimental. D'autres expériences sont également très intéressantes de fusion de cellules ES avec des noyaux pour augmenter le cytoplasme. La cellule souche a en effet un rapport noyau/cytoplasme qui est en faveur du noyau. Pour essayer de remplacer l'ovocyte, ce qui pose un problème du fait de la nécessité du don notamment, des travaux sérieux à l'heure actuelle montrent que l'on peut utiliser la cellule souche embryonnaire comme alternative, d'ovocyte, comme d'autres alternatives. M. Jacques Hatzfeld : Dans le cas des DPI, c'est encore plus simple, car on arrive à un déchet opératoire et l'on est capable de faire une lignée avec celui-ci. M. Daniel Aberdam : Je voudrais réagir sur cette terminologie de tumeur en parlant de cellules souches embryonnaires. Ce terme revient régulièrement depuis près de six ou sept ans, il affole le public, les médias, sur une notion qui est fausse. Pour démontrer qu'une cellule souche embryonnaire est pluripotente, une des expériences que l'on fait est que l'on injecte ces cellules en sous-cutané chez la souris immunodéficiente. On obtient alors des tératocarcinomes, qui sont des tumeurs bénignes, mais qu'on ne peut obtenir que sur des souris immunodéficientes, c'est-à-dire lorsque le système immunitaire ne peut pas s'en débarrasser. Il est clairement établi que lorsqu'on différencie les cellules souches embryonnaires, on n'obtient plus ces tumeurs. Il faut donc arrêter d'avancer cette terminologie de tumeur en parlant de cellules souches embryonnaires. Si l'on arrive à purifier des cellules différenciées à partir de cellules souches embryonnaires, toutes les expériences publiées, non publiées ou commentées, montrent qu'il y a absence de tumeur. Je ne sais pas si Philippe Ménasché a un recul sur les cellules qu'il a pu injecter, mais je ne pense pas qu'il ait obtenu de tumeur. M. Philippe Ménasché : Je suis tout à fait d'accord avec les propos de Daniel Aberdam. On a injecté des cellules souches embryonnaires préorientées pour devenir des cellules cardiaques aussi bien chez des petits animaux comme des rats, que chez des moutons ou des singes. On n'a jamais observé, à partir du moment où les cellules sont pré-différenciées correctement, la moindre tumeur. Je pense qu'il y a un élément d'affolement qu'il faut calmer. M. Daniel Aberdam : Je souhaiterais que les journalistes présents puissent le noter pour qu'une fois pour toutes on ne revienne pas régulièrement sur le sujet. M. Hervé Chneiweiss : Avant de laisser la parole à Laure Coulombel, car elle va sans doute y revenir, je voudrais que l'on souligne l'extrême prudence que Marina Cavazzana-Calvo a montrée vis-à-vis des essais cliniques qui sont menés et le lien entre la recherche fondamentale et les essais cliniques pour tout ce qui concerne ces cellules souches, qu'elles soient embryonnaires ou adultes. Je voudrais le mettre en parallèle avec un autre paradoxe qui émerge actuellement dans la littérature médicale internationale. En effet, certaines cellules hématopoïétiques, sous prétexte qu'elles ont un antigène CD 34, qu'elles sont caractérisées comme un des progéniteurs, voire des cellules souches hématopoïétiques employées depuis une longue période pour les greffes de moelle, sont utilisées, chez l'homme, dans des essais cliniques tous azimuts (accidents vasculaires cérébraux aigus, infarctus cardiaques aigus) qui font frémir au regard de nos règles éthiques. Je voudrais que l'on mette en parallèle ce paradoxe. René Frydman a évoqué la mondialisation. On voit se multiplier aujourd'hui certains essais cliniques humains avec certaines cellules souches adultes. Parallèlement, on fait preuve d'une extrême prudence et on freine des essais extrêmement bien menés sur des cellules souches, au prétexte qu'elles seraient embryonnaires. Mme Laure Coulombel : Je voudrais revenir sur les définitions précises de ce que l'on appelle des cellules souches adultes, qui sont ce que je connais le mieux. En premier lieu, on n'arrive pas jusqu'à maintenant à purifier jusqu'à homogénéité ces cellules souches. A ma connaissance, il n'y a pas possibilité chez l'homme d'avoir un tube avec 100 % de cellules souches, ce qui est totalement différent avec les cellules souches embryonnaires. La complémentarité commence là. Par ailleurs, il faut s'entendre sur une définition, et jusqu'à présent tout le monde est à peu près d'accord. Pour une cellule souche, il faut avoir une fonction, et donc un système expérimental pour la mettre en évidence. C'est tout le problème. J'insiste sur le fait qu'il est très important en recherche de développer des modèles, en particulier in vivo, qui permettent de mettre en évidence cette fonction, que ce soit pour les cellules souches embryonnaires ou pour les cellules souches adultes. La définition d'une cellule souche est la suivante : c'est une cellule qui va reformer in vivo et à long terme la diversité d'un tissu. Je pense que tout le monde est à peu près d'accord sur cette définition, avec la diversité par la production de cellules différenciées. Il est important d'avoir un système expérimental pour le mettre en évidence. Il n'y a pas d'autres moyens à l'heure actuelle. C'est en soi une voie de recherche qu'il ne faut pas oublier. Je voudrais insister également en ce qui concerne les cellules souches adultes, en rejoignant l'aspect thérapeutique, sur le fait qu'il y a une très grande diversité entre ces cellules souches. Il convient de faire des distinctions au sein des cellules souches tissulaires spécialisées dans la mesure où, à l'intérieur même de ce groupe, il existe une diversité, avec des tissus qui se renouvellent en permanence, parce que des cellules meurent (la peau, les intestins, le système hématopoïétique). De ce fait, ces tissus sont déjà utilisés en thérapeutique, puisque l'on sait que ces cellules souches sont fonctionnelles in vivo. Par ailleurs, il existe une autre catégorie de tissus qui spontanément ne se renouvellent pas, mais on peut encore subdiviser, entre ceux qui vont être capables de répondre à une lésion, et pourvoir à sa réparation par activation des cellules souches et d'autres tissus où, même si les cellules souches sont présentes, elles ne sont pas capables pour l'instant de réparer. C'est une distinction importante, parce que les applications thérapeutiques et la recherche à ce propos ne sont alors pas les mêmes. Ainsi, la question en thérapeutique est de savoir comment on peut essayer de réparer un tissu qui spontanément ne le fait pas efficacement. De ce point de vue, on peut formuler trois stratégies. On peut trouver des molécules qui vont stimuler les cellules souches présentes dans le tissu. C'est une voie de recherche qui ne concerne pas la cellule mais la molécule qui va stimuler, ce qui est très important. Là aussi, des cellules souches embryonnaires peuvent peut-être nous servir de crible pour ce type de molécules. Il existe un va-et-vient permanent entre ces deux types de tissus. On peut également travailler sur les salamandres, avec des molécules qui peuvent être présentes également chez l'homme. Il y a donc un travail sur la définition des cellules et sur la définition des molécules qui peuvent les stimuler. On peut peut-être stimuler des cellules qui sont dans le tissu, mais qui ne font pas leur travail, ou bien on peut essayer de purifier ces cellules, de les amplifier en laboratoire, et de les réinjecter dans le tissu. On peut également prendre les cellules qui sont dans un tissu, et faire ce que l'on fait dans une greffe de moelle, c'est-à-dire une transplantation immédiate. J'évoque immédiatement ce qui a été décrit au cours des deux dernières années, c'est-à-dire le fait que dans cette fameuse moelle osseuse, il pourrait y avoir plein de cellules souches capables de réparer l'ensemble des tissus. Il faut être très clair à l'heure actuelle. Les cellules souches médullaires, cela ne veut rien dire. Dans la moelle osseuse, il y a des cellules souches hématopoïétiques, dont a parlé Marina Cavazzana-Calvo, il y a des cellules souches dont le terme souche est peut-être totalement inapproprié et qui sont des cellules qui adhèrent quand on les met en culture, et que j'appellerais volontiers des cellules stromales multipotentes, qui vont faire de l'os, de la graisse et du cartilage. Il y a une autre catégorie de cellules, qui sont des progéniteurs, qui vont faire éventuellement des vaisseaux, de l'endothélium, et qui ne sont peut-être pas stricto sensu des cellules souches. Enfin, il y a un énorme point d'interrogation concernant les cellules souches multi-tissulaires, isolées par deux ou trois équipes mais dont les travaux ne sont pas pour le moment reproductibles, qui sont des cellules qui seraient capables, in vitro, dans des conditions expérimentales (j'insiste, car on ne connaît pas du tout leur signification in vivo, si elles existent), de refaire plusieurs tissus. La première question est de savoir, tout d'abord, ce qu'il en est de ces cellules in vivo : existent-elles et que font-elles ? Il n'y a aucune réponse. Deuxièmement, cela n'est pas reproductible et l'on est donc peut-être devant un événement qui est survenu dans une cellule ayant proliféré pendant de multiples divisions, voire parfois plusieurs mois et qui est un artefact de « culture », même si l'observation expérimentale est juste. Il faut donc être très clair. Actuellement, la source de cellules thérapeutiques à partir de moelle osseuse concerne les maladies hématologiques et l'utilisation des cellules souches hématopoïétiques, éventuellement pour aider à une reconstruction d'un dégât osseux dans le cas des cellules osseuses. Il n'existe pas pour le moment d'autres applications pour les progéniteurs endothéliaux, éventuellement dans le cas d'une réparation vasculaire. Cette notion sur laquelle j'arrive de « transdifférenciation » n'est à l'heure actuelle absolument pas démontrée. Elle tendait à montrer qu'une cellule souche hématopoïétique était capable de faire autre chose que des cellules hématopoïétiques. Il n'y a pas de démonstration expérimentale valable à l'heure actuelle. Avec une seule cellule chez la souris, rien ne se produit d'autre que des cellules souches hématopoïétiques. En revanche, certains dérivés de ces cellules souches hématopoïétiques peuvent fusionner dans le tissu malade avec une cellule malade et lui conférer alors la capacité de redevenir « normale ». Dans ce cas, on est devant un cas de reprogrammation nucléaire somatique. Il faut bien différencier ces deux choses. D'un point de vue thérapeutique, il n'y a pas à l'heure actuelle à ma connaissance une quelconque application de cette fusion, mais cela peut être éventuellement envisagé dans l'avenir, et l'on peut y réfléchir. Il n'y a pas à l'heure actuelle d'utilisation de la moelle osseuse d'un point de vue thérapeutique efficace pour des pathologies musculaires, nerveuses ou autres. Dans nos laboratoires, on peut faire exprimer certains marqueurs d'autres tissus par des cellules souches hématopoïétiques, mais on est alors peut-être à nouveau dans l'artefact de culture. D'un point de vue thérapeutique, la moelle osseuse est à peu près bien cadrée aujourd'hui, mais des progrès peuvent être faits. Je me permets d'insister sur la notion d'accessibilité que j'ai évoquée. Pour les cellules souches adultes, il existe un grand problème d'accessibilité. Il faut d'abord avoir le tissu et aller les y chercher et il faut pouvoir les purifier, ce qui est souvent très difficile car elles meurent souvent très rapidement lorsqu'on les sort de leur contexte. De toute façon, on aura des « fifrelins ». De ce point de vue, les cellules souches embryonnaires humaines sont un apport absolument considérable pour décrypter les mécanismes. Comme cela est vrai pour les cellules souches embryonnaires, on peut envisager que les cellules souches adultes que l'on cultive dans les laboratoires puissent faire des choses dans les boîtes de culture qu'elles ne font pas dans l'organisme. Quelle peut être l'application thérapeutique de cela ? Il faut être prudent pour les réutiliser en termes de remplacement substitutif d'un tissu, mais on peut utiliser ces cellules que l'on a amplifiées en laboratoire dans une application de criblage moléculaire. Je reviens à la recherche sur les molécules capables de modifier ou de moduler le comportement des cellules souches. Il ne faut certainement pas l'oublier. M. Alain Claeys : Merci beaucoup. Monsieur Louvard, sur la dernière remarque concernant les cellules adultes... M. Daniel Louvard : Je suis tout à fait d'accord. M. Alain Claeys : Jacques Hatzfeld, vous avez été la première équipe qui a eu l'autorisation, sur dérogation d'un ministre précédent, pour importer des cellules souches. A quelle date était-ce ? M. Jacques Hatzfeld : C'était en 2002. Nous entrons donc dans la quatrième année de travail sur les cellules souches embryonnaires. M. Alain Claeys : Administrativement, comment cela s'est-il passé ? M. Jacques Hatzfeld : C'était à l'époque où Mme Ketty Schwartz était directeur de la recherche et M. Schwarzenberg, ministre. On m'a demandé de faire un dossier assez complet, qu'on m'a prié d'améliorer trois fois. Il était totalement faux de prétendre que ce dossier a été fait à la va-vite, juste avant des élections présidentielles de 2002. Un travail extrêmement complet a été fait par la direction du ministère. Un comité de sages a revu tout le dossier, et je n'étais pas du tout content lorsque, le lendemain, un sénateur a dit qu'on se moquait d'eux, qu'une autorisation avait été donnée « par-dessus la jambe ». C'était inacceptable. Je regrette d'avoir été le seul à avoir pu travailler sur les cellules souches. M. Alain Claeys : Si vous me permettez, sur cette période, j'ai affirmé ma position au ministre. Hervé Chneiweiss devrait s'en souvenir. Je n'étais pas contre ces dérogations, mais je souhaitais que préalablement, au moins en première lecture, le Parlement autorise la recherche sur les embryons surnuméraires. En effet, je trouve paradoxal (c'est la situation de l'Allemagne) que l'on n'autorise pas la recherche dans un pays où on accepte l'importation de cellules souches. Cela me posait un problème éthique et cela me pose toujours un problème. M. Jacques Hatzfeld : Par la suite, il y a eu le Comité ad hoc. Nous avons demandé de nouvelles lignées, et nous avons travaillé pendant trois ans avec deux lignées provenant d'Australie. Récemment, nous avons eu l'autorisation d'importer trois autres lignées. Je voudrais que l'on fasse très attention à ce que l'Agence de la biomédecine ne s'empêtre pas dans un système certes administrativement correct mais ingérable. On va perdre un temps faramineux pour avoir des autorisations qui pourraient être obtenues très rapidement dans des cas où l'on connaît le laboratoire, l'institut où cela se passe. Il faut arrêter de passer des mois à faire des allers-retours avec des experts que l'on ne connaît pas. On a l'impression d'être considérés comme des gens susceptibles d'être malhonnêtes. On est vraiment considérés comme des chercheurs qui ont l'intention de frauder avec la loi. Cette attitude est inacceptable. M. Alain Claeys : La directrice de l'Agence de la biomédecine n'est pas présente, mais si Mme Ott souhaite intervenir, qu'elle n'hésite pas. Quels sont les délais actuels ? M. Jacques Hatzfeld : J'ai discuté avec plusieurs personnes de l'Agence de la biomédecine, dont Mme Ott. On m'a dit que pour faire de nouvelles lignées, il faut d'abord attendre que cela passe au Journal officiel, qu'il faudra au minimum quatre mois, après que nous aurons reçu les informations sur la façon dont nous devons faire notre présentation, car nous ne savons pas encore sous quelle forme nous devons présenter notre dossier. Ensuite, ce sont quatre mois minimum. S'il y a le moindre problème, on devra attendre quatre mois supplémentaires. Par ailleurs, on ne nous informera pas s'il y a un obstacle qu'au bout des quatre mois, alors que l'expert pourrait, en cas de difficultés, nous demander directement des précisions nécessaires avant ce délai. Je rappelle ce problème du DPI, où l'on pourrait faire des lignées tout de suite. Il est urgent que nous ayons une réponse rapidement dans ce domaine car nous pourrions rattraper tout ce temps que nous perdons en ce moment. Mme Marie-Odile Ott : Je laisserai ensuite la parole à M. Picard pour son expérience du Comité ad hoc, qui a fait un « essuyage de plâtre », comme on dit dans le langage courant, de ces procédures. Concernant l'Agence de la biomédecine, nous avons prévu des fenêtres d'autorisation qui prendraient au maximum quatre mois, qui sont des fenêtres d'ouverture de dépôt de dossier. À partir du temps 0 jusqu'au temps final, il y a un maximum de quatre mois. Cela peut aller plus vite si les dossiers ne posent pas de problème. Il faut soumettre ces dossiers à des experts scientifiques, qui soumettent leur rapport à un conseil d'orientation, puis la directrice générale prend la décision. Entre le moment de l'examen des dossiers, de l'envoi et de l'obtention d'une expertise correcte, où il faut réunir les gens au même moment, il y a tout de même des contraintes difficiles à réduire. Il y aura une liste de recevabilité, mais en cas de pièces manquantes ou d'informations complémentaires, le temps sera suspendu. Des mesures sont prévues également dans le décret, que nous attendons tous. M. René Frydman : Je voudrais dire quelques mots sur le délai. On sait bien qu'il peut être raccourci, voire allongé ou devenir indéterminé dans le temps. J'insiste sur l'expérience vécue autour du diagnostic préimplantatoire. Je dois dire très solennellement que je viens d'apprendre que la responsable de l'Agence de la biomédecine, à peine nommée, vient d'être apparemment remplacée. Si elle l'a été par la personne dont le nom est cité, on est vraiment dans la situation la plus difficile. En effet, elle est connue par ses positions rétrogrades par rapport aux progrès scientifiques, puisque nous avons déjà eu affaire à elle sur les mêmes thèmes. On peut tout imaginer, tout en restant dans le cadre de la loi. Toutes les procédures peuvent être extrêmement allongées et ne pas aboutir. Nous avons manifesté, avec un certain nombre de chercheurs, notre inquiétude. Alors qu'une agence se met en place, nous souhaitons avoir des informations sur les raisons de ce remplacement et sur la confirmation de la ligne proposée, qui est manifestement idéologique, et sur laquelle nous ne pouvons qu'être très inquiets. Cela devra sans doute aboutir dans les milieux scientifiques à une prise de position très claire, en ce qui me concerne en tout cas et pour certains d'entre nous, car on ne va pas dans le bon sens. M. Alain Claeys : Merci. Daniel Aberdam M. Daniel Aberdam : Je voulais ajouter aux propos de Jacques Hatzfeld un témoignage personnel, puisque je fais partie des laboratoires qui ont obtenu l'autorisation du Comité ad hoc d'importer et de travailler sur les cellules souches embryonnaires humaines. Nous avons dû attendre des mois, mais je voudrais préciser deux choses. Il a fallu trois autorisations, une d'importation, une autre de travail sur les cellules embryonnaires humaines, et une autre de stockage. Je n'ai pas besoin de commenter mais je pense qu'il y a une exagération. M. Alain Claeys : Cela concerne le niveau réglementaire. Ce n'est pas la loi qui dicte cela. M. Daniel Aberdam : Je ne crois pas. Depuis des années, nous stockons des lignées de partout. Mais les conditions de stockage pour ces lignées les font suspecter d'être très dangereuses. Elles pourraient très bien sortir du laboratoire pour se transformer en « monstres », ou l'inverse... Encore une fois, on n'a peut-être pas confiance en nous, et l'on pense qu'on peut les donner et qu'il faut qu'elles soient enfermées avec des cadenas, car c'est la réalité. A Nice, nous n'avons pas encore de centre de thérapie cellulaire génique, qui est en fin de construction, et j'ai donc eu l'autorisation d'importer les lignées, celle également de les travailler, mais pas celle de les stocker à Nice. Je les stocke donc à Montpellier et vous pouvez imaginer la facilité de travail. M. Alain Claeys : Sur ce cas particulier, pouvez-vous m'indiquer, dans une note, toutes ces difficultés qui peuvent être gigantesques pour vos recherches ? Cela me sera utile. M. Daniel Aberdam : Pour terminer, j'ai le sentiment qu'il existe une suspicion permanente face aux scientifiques. Nous sommes évalués, nous, laboratoires Inserm, par l'Inserm. Pourquoi y a-t-il besoin d'une réévaluation de ces projets de recherche, qui sont acceptés par les instances évaluatrices de l'Inserm ? Pourquoi ajouter encore des procédures, et faire des « mille-feuilles » ? C'est un problème de confiance, et je considère que le législateur doit commencer à faire confiance aux chercheurs. Arrêtons de rajouter des agences sur des agences. C'est un témoignage personnel. M. Alain Claeys : Monsieur Picard, vous souhaitiez intervenir sur ce sujet. M. Roger Picard, porte-parole de l'Alliance maladies rares : J'étais également membre du Comité ad hoc qui se réunissait ce matin sur les dernières demandes d'importation de lignées de cellules souches. Je comprends ces critiques. Je suis représentant d'association, je ne suis donc pas un scientifique. J'ai participé à beaucoup d'études sur trente-cinq ou trente-six dossiers qui nous sont parvenus et j'ai été co-rapporteur avec un scientifique sur une vingtaine de dossiers. Le problème ne se situe pas au niveau de la suspicion, mais au niveau des contraintes, du carcan qui nous a été imposé par le législateur, ou l'interprétation qui a été faite, au niveau des décrets d'application. On nous a demandé de statuer sur des demandes d'importation, de conservation et de recherche. On ne nous a pas demandé notre avis sur le fait de savoir si c'était légitime ou pas. C'était le cadre qui nous était imposé dans ce comité, et nous avons essayé de remplir cette mission au mieux. M. Alain Claeys : Vous considérez que c'est une procédure lourde. M. Roger Picard : Pour répondre à M. Hatzfeld, dès qu'il y avait une demande complémentaire, elle était transmise immédiatement. M. Daniel Aberdam : Cela n'a jamais été le cas. M. Roger Picard : Ensuite, il y a la réunion du comité, et une implication administrative qui n'était plus du ressort des membres du Comité, car toute l'administration travaille derrière. Je me suis élevé contre le fait que le délai passe à quatre mois, ce qui me semble totalement anormal. M. Alain Claeys : Merci de votre témoignage, Monsieur Picard. Je redonne la parole à Jacques Hatzfeld, mais c'était utile de faire le point sur le sujet. M. Jacques Hatzfeld : Le sujet de notre table ronde concerne l'utilisation des cellules souches et les enjeux pour la santé. On parle beaucoup de thérapie cellulaire, mais on parle très peu de la génomique fonctionnelle. Je voudrais expliquer de quoi il s'agit pour les journalistes qui ne sont pas au courant. Lorsqu'on travaille avec les cellules souches adultes, et que l'on cherche quels sont les gènes, ce que l'on appelle les stemness genes en anglais (en français j'ai entendu le mot « souchitude » », mais il vaut mieux utiliser l'anglais) c'est-à-dire les gènes qui contrôlent les cellules souches, on n'arrive à aucun consensus entre les différents laboratoires, même si, quelquefois, le consensus concerne un gène. Lorsqu'on prend les cellules souches embryonnaires, et que l'on compare plusieurs lignées (une étude récente a été faite sur sept lignées), on a trouvé pour l'autorenouvellement de ces cellules quatre mille deux cents gènes qui étaient des EST, c'est-à-dire des gènes dont on ne connaît pas encore la fonction. Il y avait consensus entre les laboratoires, entre les lignées. Pour l'autorenouvellement, on sait qu'il existe quatre mille deux cents gènes, et je pense qu'il y en a autant pour les parties de différenciation. Il y a donc près d'un tiers du génome humain dont on ne connaît pas la fonction, mais dont on sait qu'il contrôle le développement, et que ces gènes sont exprimés sur les cellules souches embryonnaires. Si l'on a des lignées de cellules souches embryonnaires, on va pouvoir connaître la fonction de ces gènes. Les biotechnologies anglo-saxonnes ont tout de suite compris. Avant de connaître exactement la fonction de ces gènes, ils ont compris qu'il fallait faire les protéines et les anticorps correspondant à ces protéines. On peut trouver maintenant, correspondant à tous ces gènes, toutes ces protéines qui vont être les médicaments de demain. En effet, on connaît la séquence de ces gènes, et l'on sait qu'ils correspondent à des récepteurs, à des facteurs de croissance, à des hormones, à des facteurs de transcription, qui peuvent interagir dans le développement humain. Il faut absolument arrêter d'opposer les cellules ES humaines aux cellules souches adultes. Je continue à travailler beaucoup, beaucoup plus vite sur les cellules souches adultes depuis que je travaille sur les cellules ES. Je vous ai donné l'exemple où nous cherchons à caractériser les cellules souches mésenchymateuses à travers le projet européen GENOSTEM, mais nous ne partons pas de cellules souches adultes, qui sont très rares, une pour 107 cellules, et qui, lorsqu'on les met en culture, ont déjà perdu leur propriété de cellules souches. On ne peut donc pas travailler avec elles. Les lignées de cellules mésenchymateuses obtenues à partir de lignées de cellules souches embryonnaires nous permettent d'avoir beaucoup de cellules souches et on peut les caractériser. On est en train de trouver des marqueurs sur les cellules souches mésenchymateuses, que l'on ne trouvait pas avant, et on va pouvoir en trouver beaucoup plus. Ce que l'on appelle la génomique fonctionnelle, c'est la possibilité d'étudier la fonction de tous ces gènes dont on ne connaissait rien jusqu'à présent et qui représentent un tiers du génome humain. Lorsqu'on aura tous ces gènes qui contrôlent le développement et la thérapie cellulaire, les cellules souches adultes seront repensées totalement différemment. On aura des facteurs, des hormones, qui nous permettront d'aller beaucoup plus vite. On peut faire dans certains cas des études de thérapie cellulaire tout de suite, ce qui a été cité tout à l'heure. C'est en effet très important, mais je pense qu'on ira beaucoup plus vite lorsqu'on aura fait toute cette génomique fonctionnelle. Je voudrais citer un exemple de situations aberrantes. Au CNRS, à l'Institut de chimie des substances naturelles, des substances permettraient par exemple de travailler sur la mucoviscidose, mais on ne peut travailler dans l'état actuel que sur des malades. Cela complique considérablement l'étude de ces nouvelles molécules alors qu'on pourrait actuellement faire ces études grâce aux cellules provenant de DPI. On préfèrerait avoir immédiatement de très nombreuses lignées correspondant à différents malades. Cela nous permettrait d'avoir des lignées de cellules souches embryonnaires que l'on pourrait développer vers tous les tissus et voir ce qui se passe pour tel gène de la mucoviscidose à chaque niveau de différenciation et comment les molécules sont susceptibles d'intervenir sur ces cellules. Il faut changer d'optique, en particulier au CNRS. Je suis heureux de l'arrivée d'un nouveau directeur du département du vivant, autrefois appelé les sciences de la vie. J'espère que M. Van der Rest va nous aider dans ce sens. En effet, en ce moment, et je reprends ce qui a été dit, beaucoup de chercheurs partent à la retraite (dans mon équipe c'est le cas de deux directeurs de recherche) et on n'a personne pour les renouveler. Ce sont des équipes qui vont s'écrouler. On a besoin d'embryologistes, et on ferme Nogent, l'Institut d'embryologie. Va-t-on remplacer toutes ces personnes qui partent à la retraite ? La pyramide des âges actuelle fait que dans les six à huit prochaines années, la moitié des chercheurs du CNRS va partir à la retraite. Je pense que le minimum serait de remplacer immédiatement ceux qui travaillaient sur les cellules souches par un poste fléché dans le domaine. M. Michel Van der Rest : J'enregistre le message, mais il est certain que l'objectif n'est pas de voir diminuer le nombre de chercheurs dans les années à venir, bien au contraire. Le domaine des cellules souches est évidemment un domaine dans lequel nous devons poursuivre des recherches très en amont, comme on l'a dit plusieurs fois ce matin. M. Jacques Hatzfeld : Je souhaite une réponse rapide sur la possibilité d'utiliser les DPI. Ce ne sont plus des embryons, mais des déchets opératoires, et on pourrait travailler tout de suite. Ou bien on veut bloquer la situation et nous empêcher de travailler, mais c'est alors un acte politique, ou politicien. M. Alain Claeys : Dans le cadre de la loi aujourd'hui, l'autorisation n'est pas possible. Cela suppose une modification de la loi. Je ne pense pas que cela puisse être décidé à travers une mesure réglementaire. M. René Frydman : Dans le cadre de la loi, on va voir ce qui concerne la recherche sur l'embryon dans le décret. Jacques Hatzfeld, et je ne peux que le suivre, signale que ce ne sont pas des embryons surnuméraires en attente d'une solution selon la volonté des géniteurs, mais des embryons qui sont détruits à l'instant même. Cette destruction est imposée du fait de la maladie, et c'est même le bien-fondé du diagnostic préimplantatoire. Il faut que les textes suivent et les gens doivent prendre les décisions qui s'imposent. M. Alain Claeys : Concrètement, pour la proposition qui est faite, ce n'est pas un décret qu'il faut. M. René Frydman : La proposition qui est faite consiste à savoir, malgré ce que l'on vient d'apprendre concernant la nomination de ce matin, si on est amenés à aller de l'avant, quel sera le courant de pensée et si on sera soutenus ou pas. On a déjà connu cela pour un certain nombre de phénomènes de société. Mme Ketty Schwarz : Dans la mesure où l'on n'a pas aujourd'hui, sans les décrets, l'autorisation de dériver de nouvelles lignées, ce qui est proposé par Jacques Hatzfeld ne pourra pas être mis en application. Cela ne pourrait-il pas être tout de même mis en application ? M. René Frydman : Selon les interprétations, on peut rester dix ans là-dessus ou passer très vite. M. Roger Picard : Je voudrais préciser que parmi les autorisations de recherche sur les cellules souches qui ont été données par le Comité ad hoc, on trouve deux lignées importées issues de DPI malades. Du moment que l'on autorise de la recherche sur des lignées d'importation, je ne vois pas pourquoi on ne pourrait pas le faire. Ce serait totalement illogique. M. Alain Claeys : Parallèlement au travail que je fais, je vais saisir les ministres sur ce sujet, et en particulier sur les décrets. M. Hervé Chneiweiss : Il faut être très clair, comme vient de le faire René Frydman. Les faits qui sont du domaine du réel sont là et l'interprétation sociale ou législative qui en est faite est différente. Les lignées de cellules dont nous parlons, ce sont des cellules qui ne peuvent donner que d'autres cellules. Il se trouve qu'il y a référence à leur origine. Mais dans l'interprétation qui avait été faite en 2002, et qui avait abouti à l'autorisation donnée à Jacques Hatzfeld d'importer, il avait été considéré qu'il s'agissait de lignées de cellules humaines, et que la législation et la réglementation qui s'appliquait à ces cellules étaient la réglementation et la législation de lignées de cellules humaines, soumises à différentes règles d'importation. De la même façon, dans le cas d'embryons à propos desquels a été fait un diagnostic d'une maladie génétique particulièrement grave, nous sommes devant des cellules qui ne pourront en aucun cas donner lieu à implantation ou à future vie. Comme plusieurs intervenants l'ont signalé, au sens médical du terme, on est devant (il faut utiliser des mots cruels) un déchet opératoire. On se trouve donc comme devant une tumeur que l'on retire, comme devant une vésiculaire biliaire avec des calculs que l'on retire. On est devant un tissu humain, certes, mais qui n'a plus de fonction vitale ou de possibilité de développement vital. Les faits étant les faits, la loi ou le règlement, aura à en donner une interprétation, qui sera de toute façon une interprétation de faits qui restent les faits. M. Alain Claeys : J'ai bien compris ce que vous dites. Je pense qu'on va arriver à un équilibre, que l'on pourra juger mauvais ou bon, ce n'est pas à moi de le dire ici. J'ai pris mes responsabilités au Parlement, d'autres collègues ont fait un autre choix. Mais c'est la loi qui s'impose à nous tous. Il y a deux problèmes par rapport à cette loi. D'abord, les décrets d'application qui ne sortent pas. Dans ce cas, le législateur a un droit de regard car les décrets doivent suivre et il n'est pas acceptable que cela prenne autant de temps. L'autre sujet qui est l'objet de ce rapport, c'est comment faire évoluer cette loi. Cette journée d'aujourd'hui nous apporte toute une série d'éléments qui seront utiles au législateur. Celui-ci a souhaité que l'actualisation de la loi ne soit pas une actualisation rigide, tous les cinq ans, mais qu'il puisse y avoir des actualisations plus rapides. Je crois aux faits et à la pédagogie pour faire avancer les choses. Monsieur Hovine, vous êtes président de l'association France Parkinson. Vous pouvez peut-être nous expliquer comment votre association de malades s'intègre dans cette réflexion, dans ce dispositif, comment vous êtes consultés, et voir quels sont les thèmes auxquels vous êtes plus particulièrement attaché aujourd'hui et quel regard vous portez sur cette loi. M. André Hovine, président de France Parkinson : L'association France Parkinson est une des associations de malades dans le domaine des maladies neurodégénératives. Tout en m'exprimant pour le cas spécifique de Parkinson, se profilent en arrière-plan les problèmes de la maladie d'Alzheimer, de la sclérose en plaques, de la sclérose latérale amyotrophique, de la maladie de Huntington, qui sont d'autres maladies neurodégénératives. Ceci représente un enjeu crucial en termes de santé publique et en termes de finances publiques, compte tenu du nombre de personnes concernées par ces maladies. En effet, on dépasse aujourd'hui le million de personnes qui sont directement touchées par ces affections, sans parler de leur entourage, pour qui c'est également un drame au quotidien, de vivre ces maladies qui sont à la fois incurables et évolutives. Si je prends le cas de Parkinson, il n'y a pas de remède à la maladie et il n'y a même pas aujourd'hui, sauf quelques espoirs à court terme, de moyens de protection neuronale qui permettraient de stopper l'évolution de la maladie. Il existe des thérapies médicamenteuses, dans le cas de Parkinson la chirurgie cérébrale profonde, avec la stimulation du corps noir. Il y a des progrès mais pas de remède définitif ou de suspension de l'évolution. Tout ce qui concerne de nouvelles approches pour la thérapie de la maladie fait l'objet d'une attente immense de la part des malades. Attente immense qu'il ne faut pas décevoir, sous plusieurs aspects. Le premier est celui de ne pas donner d'espoirs prématurés et inconsidérés. Ceci est très important, et je me tourne plus spécialement vers la presse et les journalistes car le « scoop » qui intéresse le journaliste peut conduire à des erreurs d'interprétation, de faux espoirs, et le mouvement en retour est généralement très brutal. On se dit qu'on parle encore de cela mais que finalement il ne se passe rien et qu'on n'a rien trouvé. Du point de vue des malades, il est important d'avoir une information qui soit à la fois objective et mesurée, pour ne pas donner des espoirs inconsidérés. J'ai écouté avec beaucoup d'intérêt Mme Schwarz parler d'un essai qui doit démarrer aux États-Unis sur la maladie de Batten. Je crois que c'est à propos de nouvelles comme celle-là qu'il faut s'essayer à développer une information qui soit suffisamment prospective et objective, mais aussi mesurée, et qui puisse être relayée ensuite par les différents organes d'information que constituent au premier chef les revues d'information internes aux différentes associations de malades. Je voudrais aussi, au-delà du point de vue strict des malades, parler en tant qu'association et non pas de mon expérience en tant que président d'association dans le domaine de la thérapie cellulaire, puisque nous n'avons pas été associés aux commissions ou travaux qui sont en cours. Je l'ai été cependant dans un autre domaine, en étroite collaboration avec Hervé Chneiweiss, sur un autre sujet important voici quelques années, et qui l'est toujours, concernant la création de banques de tissus. L'association est impliquée dans la création de banques de tissus cérébraux ou de tissus en relation avec l'évolution des maladies neurodégénératives et nous nous sommes souvent heurtés à des problèmes de compréhension et d'interprétation des textes législatifs et réglementaires. Partant de cette expérience, je crois que la transposition est aisée dans le domaine qui nous intéresse aujourd'hui. Je me permets d'attirer l'attention du législateur et de ceux qui sont responsables de la parution des textes réglementaires, sur la nécessité d'avoir des textes clairs recelant le minimum d'ambiguïté et développant le maximum de cohérence, ce qui malheureusement n'est pas toujours le cas. M. Alain Claeys : Je suis tout à fait d'accord avec vous, mais on peut mieux faire. M. André Hovine : Je le note avec beaucoup de satisfaction, car nous en sommes, surtout en l'absence de décrets d'application, à la recherche de l'interprétation de la pensée du législateur et nous n'avons pas d'accès direct à ce qui nous permettrait de la saisir pleinement. Lorsqu'on essaie de solliciter un corps éminent comme le Conseil d'État, celui-ci se réfugie prudemment sur le fait que la saisine, pour l'interprétation du législateur, passe par des procédures très complexes. Je profite de l'occasion qui m'est donnée ici, partant encore une fois d'un autre domaine qui ne concerne pas directement la discussion d'aujourd'hui, mais dont je sens bien à travers les différentes interventions qu'elle est sous-jacente à de nombreux problèmes rencontrés par les scientifiques. Il est très important qu'il y ait une cohérence, une absence d'ambiguïté, et une précision dans les décrets d'application, pour que l'on puisse intégrer des préoccupations opérationnelles au moment de la réflexion. Non pas seulement des préoccupations éthiques, qui sont indispensables, mais opérationnelles, à savoir comment cela peut marcher sur le terrain. On a une parfaite illustration sur la loi sur la bioéthique telle qu'elle est sortie des textes de 2004, où le prélèvement de tissu est subordonné à l'existence d'un projet de recherche. Étant un financier à l'origine, j'ai toujours appris que dans les banques, on commençait par collecter l'argent avant de faire des prêts. Malheureusement, dans le domaine scientifique, s'il faut en croire la loi, il faut commencer par avoir une maison à construire avant de commencer à collecter des dépôts. C'est un peu paradoxal. M. Alain Claeys : On vous demande de guérir avant de vous autoriser à avoir un projet de recherche... M. Jacques Hatzfeld : Nous avons absolument besoin de ces tissus. Vous n'avez pas besoin de projets. C'est précisément lorsqu'on aura cette génomique fonctionnelle, qui nous donnera toutes ces protéines, que l'on pourra, grâce aux coupes qu'on peut faire avec vos tissus, voir quels sont les gènes impliqués. D'office, vos banques sont importantes. M. André Hovine : C'est bien la raison pour laquelle nous n'avons pas reculé devant l'obstacle et que nous les avons créées, mais en tant que responsables à un titre ou à un autre, dans cette banque de tissus, nous nous sentons parfois en position « bancale » par rapport à la loi, ce qui n'est pas confortable, surtout si on lit les derniers chapitres consacrés aux dispositions pénales... À titre informatif, je voudrais signaler que les préoccupations que vous avez aujourd'hui, en ce qui concerne le sentiment des usagers sur la question, seront reprises à l'échelle européenne, à Bruxelles, dans un mois, lors d'une conférence qui est soutenue en particulier par la Fédération européenne des associations de maladies neurologiques, et dont le thème pendant deux jours sera précisément le positionnement des usagers par rapport à la thérapie cellulaire et tous ces travaux scientifiques que nous avons entendus ce matin. M. Alain Claeys : Merci, Monsieur Hovine. Je donne la parole à M. Philippe Ménasché pour qu'il nous explique concrètement ce que l'on fait aujourd'hui. M. Philippe Ménasché : Je vais faire trois remarques concrètes, puisque nous sommes dans le champ de la thérapeutique. La première chose qu'il faut dire, c'est que dans le domaine des essais cliniques de la thérapie cellulaire, si l'on met de côté les greffes de moelle, qui existent depuis longtemps, l'expérience à ce jour est très limitée. Je fais écho à ce que vient de dire M. Hovine. Que ce soit dans le domaine du cerveau, du pancréas, ou du cœur, peu de patients ont bénéficié aujourd'hui de la thérapie cellulaire et l'honnêteté oblige à dire que l'on est incapable à ce jour de dire si l'efficacité de la thérapie cellulaire va être limitée, très importante ou nulle. Personne ne peut le savoir, même si un certain nombre d'indices sont encourageants. Si ce n'était pas le cas, on ne continuerait pas. C'est d'ailleurs complètement normal, puisque les premiers essais qui ont été faits sont des essais de phase 1 qui testent la faisabilité, la tolérance, et pas vraiment l'efficacité. On va rentrer maintenant dans la phase d'essais cliniques conçus pour démontrer l'efficacité, celle-ci restant à démontrer. Il faut donc rester prudents, en particulier vis-à-vis des patients, ne pas susciter des espoirs qui ne seraient pas fondés. Le deuxième point, c'est que dans l'état d'ignorance où nous nous trouvons (je fais écho à ce qui a déjà été dit), cela n'a aucun sens d'opposer les cellules adultes aux cellules embryonnaires. Les deux pistes doivent être explorées en parallèle et on verra bien. Je ne vais pas rentrer dans les détails médicaux, mais il n'est pas impossible que les deux types de cellules trouvent finalement leur place dans des pathologies différentes. Pour donner un exemple, on sait aujourd'hui que si l'on veut remplacer une cellule du cœur, il est peu probable dans l'état actuel des connaissances que l'on puisse y parvenir avec des cellules adultes. Les cellules embryonnaires en sont semble-t-il capables. A contrario, s'il s'agit simplement d'amener des cellules qui peuvent sécréter de l'insuline, des îlots de Langerhans, des cellules adultes prélevées chez des sujets en coma dépassé font très bien l'affaire. Pour prolonger ce qui a été dit concernant l'absence d'a priori, l'opposition qui existe parfois entre les cellules adultes et embryonnaires n'a aucun sens sur le plan clinique. Il faut explorer les deux, ce qui signifie ne pas se couper la piste des cellules embryonnaires et l'on en revient à tout ce qui a été dit jusqu'à présent. Enfin, je voudrais dire quelques mots sur un dernier point. On a toujours tendance à se lamenter sur tout ce qui nous arrive, mais la France a des atouts réels dans ce domaine, qui sont totalement sous-exploités. Elle a des atouts de par la qualité scientifique de ses équipes et parce que, plus qu'on ne le croit, on a la capacité dans ce pays à faire tomber les cloisons et à faire en sorte que des hospitalo-universitaires, des chercheurs, des biotech, se mettent autour d'une table et travaillent. Il y en a des exemples. On s'aperçoit que ce n'est pas toujours le cas dans les pays étrangers, y compris aux États-Unis, où les structures sont souvent plus rigides, peut-être à cause des dimensions. Nous avons par ailleurs des atouts « financiers ». Il est vrai qu'on n'a jamais assez d'argent, mais des efforts importants ont tout de même été consentis par le CNRS. L'Assistance Publique a créé un fonds d'amorçage pour les biothérapies. L'expérience prouve que même si cela prend du temps, lorsque le projet est bon, il est financé. Je ne pense pas que ce soit l'élément bloquant. En outre, la France a un atout assez spécifique, qui n'est sans doute pas suffisamment reconnu, et qui est lié à l'expérience d'un certain nombre d'équipes comme celles de Marina Cavazzana-Calvo ou de Marc Peschanski, notamment. C'est ce que l'on appelle la recherche translationnelle. Il est très important de faire de la recherche fondamentale, mais notre travail est de soigner des malades et non pas des rats. À un moment donné, il faut passer des procédures développées en laboratoire à des procédures qui sont applicables chez l'homme. C'est un vrai métier. On est très aidés par l'AFSSAPS, qui fait un travail remarquable. Jean-Thomas Vilquin, qui a participé avec nous à l'aventure de la thérapie cellulaire, sait que ce travail translationnel est quelque chose d'important et un certain nombre d'équipes françaises ont acquis une réelle expertise en la matière. Il est d'ailleurs amusant de voir qu'à l'étranger, c'est souvent sur ces aspects de translation qu'on nous interroge. En face de ces atouts, la frustration n'en est que plus grande, de voir ce capital peu valorisé et sous-exploité du fait des difficultés législatives auxquelles il a été fait allusion. Autoriser l'importation et interdire la création de lignées, c'est tout de même une hypocrisie extraordinaire, sans parler des difficultés de type purement réglementaire. Je sais que le Comité ad hoc a très bien travaillé, mais je me fais l'écho de ce qui a été dit. Dans un domaine où les choses vont vite, les délais imposés sont parfaitement inacceptables. Ce n'est pas la responsabilité de ceux qui sont dans la commission. S'il y avait une seule chose concrète qu'on vous demande, qu'on vous supplie, c'est de faire en sorte que les procédures puissent être allégées et que le temps administratif se cale un peu plus sur le temps scientifique. Je termine en indiquant qu'on a des raisons aujourd'hui d'être très inquiets de ce point de vue et cela plus aujourd'hui qu'avant-hier, car on attend d'abord la parution des décrets d'application. Une fois que ces décrets vont enfin sortir, il va falloir les « mettre en musique », ce qui est le travail de l'Agence de la biomédecine. De ce point de vue, la décapitation honteuse de cette agence, du fait du départ de Carine Camby, est catastrophique. En effet, chacun a reconnu ses mérites et son implication, mais cela va bien au-delà d'un problème de personnes. Ce n'est pas simplement un fonctionnaire que l'on déplace pour le mettre ailleurs. C'est un coup d'arrêt, au mieux de six mois et sans doute d'un an, indépendamment des lignes politiques car je ne connais pas la personne qui lui succède. On met en place une agence, une équipe performante, qui travaille, qui fait du bon travail, et l'on change tout le monde. Au moment où les décrets vont sortir, le départ honteux de Carine Camby est un « mauvais coup » porté à la recherche sur la cellule souche. Vous m'excuserez de ma brutalité chirurgicale, mais vous savez que les chirurgiens sont des gens qui vont droit au but, et je pense me faire l'écho de ce que pensent Marc Peschanski, René Frydman et les autres. Au-delà d'un problème de personnes, c'est vraiment un coup d'arrêt à la recherche sur les cellules souches, et on n'en avait pas besoin. M. Alain Claeys : Je vous remercie de la clarté de vos propos. M. Philippe Ménasché : Je voudrais ajouter à ce qu'a dit René Frydman, qu'on espère avoir quelques explications et quelques indications sur ce que va être la politique dans les mois à venir. M. Alain Claeys : Vous pourrez réintervenir au cours des deux autres tables rondes de cet après-midi. Mme Marianne Minkowski, je crois qu'il est important d'écouter votre intervention. Vous êtes directrice adjointe du département biologie du cancer à l'Institut national du cancer. Mme Marianne Minkowski, directrice adjointe du département biologie du cancer, à l'Institut national du cancer : C'est la raison pour laquelle je vais plutôt parler de biologie que de thérapeutique, même si le sujet abordé est principalement lié à la thérapeutique. Pour l'Institut du cancer, c'est aussi une biologie qui va vers la thérapeutique. Une grande majorité des propos que je voulais tenir a été évoquée par plusieurs intervenants avant moi, concernant la recherche sur la biologie des cellules souches dites normales, pour faire la distinction avec les cellules souches des tumeurs, qui permet d'obtenir des connaissances essentielles, et en particulier des connaissances nécessaires à la compréhension du processus de cancérogenèse. Le deuxième volet est l'identification et la caractérisation des cellules souches des tumeurs, dont on semble maintenant admettre l'existence, et qui devrait permettre l'élaboration de nouvelles approches dans le traitement du cancer. Mais ce n'est pas dans l'immédiat, car avant cela, il faut les caractériser réellement. Il est actuellement accepté et démontré dans certains cas, qu'il existe au sein des tumeurs diverses populations cellulaires qui ont des pouvoirs ou des capacités d'autorenouvellement et de prolifération qui sont différentes. Parmi ces cellules tumorales, il existe une sous-population qui possède des propriétés d'autorenouvellement et la capacité d'initier et de maintenir la croissance de la tumeur. C'est cela que l'on appelle aujourd'hui les cellules souches tumorales ou cellules souches des tumeurs, sur lesquelles les travaux commencent réellement à être importants. Je reviens d'un congrès sur la recherche translationnelle dans le cancer, où il est clair que l'aspect « cellule souche » des tumeurs apparaît maintenant comme quelque chose qui peut expliquer un certain nombre de difficultés, notamment dans les thérapeutiques standards. Il est essentiel que l'on soutienne l'étude de ces cellules souches, c'est-à-dire leur caractérisation phénotypique moléculaire et fonctionnelle, par comparaison avec les cellules souches dites normales. Il ne faut pas faire un travail à moitié, mais faire ces études en comparant les différences et les similitudes de ces deux types de cellules souches. Cela permettra de mieux comprendre le processus d'initiation des tumeurs et surtout d'identifier de nouveaux marqueurs et de nouvelles cibles pour une meilleure efficacité thérapeutique. En effet, les chimiothérapies standards s'adressent à des cellules en division et les cellules souches, par définition, sont quiescentes. Ces chimiothérapies standards ne sont pas efficaces sur les cellules souches des tumeurs et la compréhension de celles-ci, de leur fonctionnement, de leur raison d'être permettra sans doute d'améliorer les thérapeutiques des différents types de cancer. J'avais pensé à vous parler de thérapie génique et cellulaire, mais je ne crois pas que cela se fasse dans le domaine du cancer avec des cellules souches actuellement. Daniel Louvard me corrigera si je me trompe. Il existe un certain nombre d'essais de thérapie génique et cellulaire dans le cancer. Un essai de phase 3 va commencer aux États-Unis sur un adénovirus porteur de P53 qui a été développé en Chine, qui devrait prochainement recevoir une autorisation de mise sur le marché. Il existe également un certain nombre d'essais de phase 2 et ce que l'on appelle l'immunothérapie, qui consiste à se servir du système immunitaire pour se débarrasser des cellules cancéreuses. Le souvenir que j'en ai est très lointain, puisqu'à une époque, j'étais membre d'une association qui prônait beaucoup la thérapie génique. Il existe en effet des essais qui sont faits au niveau du cancer, qui consistent à prendre des cellules tumorales, à les manipuler pour y introduire un gène tueur, la thymidine kinase, ensuite à réinjecter ces cellules chez les patients et à leur donner du Ganciclovir, ce qui permettait de déclencher le phénomène de mortalité des cellules cancéreuses. Pour répondre à l'injonction de Daniel Louvard, l'Institut du cancer a la forte détermination dans les prochains appels d'offres qui vont être lancés d'ici la fin de l'année, d'en faire un sur les cellules souches. M. Alain Claeys : Justement, comment s'inscrit l'Institut national du cancer, nouvel organisme, dans ces programmes de recherche ? Comment coordonnez-vous vos propres programmes de recherche avec les autres organismes de recherche ? Mme Marianne Minkowski : Le rôle de l'Institut du cancer et de la mission qu'on lui a donnée est de coordonner tout ce qui se fait au niveau du cancer, pas seulement au niveau de la recherche, mais au niveau de la recherche clinique, des soins, de l'épidémiologie, etc. Au département biologie de l'Institut du cancer, nous lançons des appels d'offres vers les scientifiques des différents organismes. M. Alain Claeys : Comment cela se coordonne-t-il par rapport aux programmes de recherche des organismes ? Il y a l'Agence de la biomédecine, les organismes, l'Institut du cancer... Au niveau de ces programmes sur les cellules souches, comment cela s'articule-t-il, qui est le pilote ? Mme Marianne Minkowski : Au niveau du programme sur les cellules souches que nous voudrions lancer, il est évident que nous ne le ferons pas sans savoir ce que l'ANR va faire de son côté, et ce que les organismes font du leur. Nous devons être complémentaires, incitatifs, et ne pas répéter deux fois les mêmes types d'appels d'offres. M. Alain Claeys : J'ai le sentiment que les équipes de recherche vont être confrontées à des tâches administratives considérables pour répondre à tous ces appels d'offres. Mme Marianne Minkowski : Il faut l'éviter, ce qui n'a pas été forcément fait jusqu'à maintenant, mais l'Institut du cancer existe seulement depuis mai 2005. M. Alain Claeys : Ce n'est pas un reproche que je vous fais. Mme Marianne Minkowski : On a essayé d'initier une forme de coordination, notamment au niveau des cancéropôles qui existent depuis un peu plus longtemps. M. Alain Claeys : Que représentent les cancéropôles en termes de recherche dans la réalité, des équipes Inserm, le CNRS ? Cela s'inscrit donc dans des programmes de recherche. Mme Marianne Minkowski : Ce sont également des équipes hospitalières. M. Alain Claeys : L'Institut national du cancer est-il prêt à participer à ces programmes de recherche, et ne pas recréer de nouveaux appels d'offres ? Mme Marianne Minkowski : Les projets de recherche au sein des cancéropoles ont été initiés et sélectionnés à la suite d'un appel d'offres du ministère. On ne fait que continuer, prendre le relais de ce qui a été fait, pour essayer de continuer cette structuration, à la fois par la création des cancéropoles et les projets de recherche dits structurants qui y sont menés. M. Alain Claeys : Je pense qu'une clarification doit être faite par rapport à tous ces organismes et dispositifs. Monsieur Picard, vous êtes le porte-parole de l'Alliance maladies rares, mais vous avez été aussi acteur du Comité ad hoc qui a permis d'instruire des dossiers. Sur ce dernier point, avez-vous des choses à ajouter par rapport à ce que vous avez indiqué ? M. Roger Picard : On nous a assuré lors de la dernière réunion du Comité, ce matin, que les décrets d'application de l'Agence de la biomédecine sont sur le bureau du ministre et devraient être signés pour la fin de ce mois. M. Alain Claeys : J'ai une autre information que je ne vous avais pas donnée. J'avais proposé à M. Xavier Bertrand, ministre de la Santé de conclure ces travaux. Il m'a fait savoir qu'il ne pouvait pas être présent aujourd'hui car il revient demain matin de Chine. Si je comprends bien, l'Agence de la biomédecine est maintenant à la recherche d'un directeur ou d'une directrice. M. Roger Picard : On ne nous a pas parlé de cela. Je sais seulement que deux dossiers sont arrivés pour étude ce matin au Comité ad hoc, et qu'ils seront traités par l'Agence de la biomédecine. On est donc normalement partis a priori dans le circuit de l'Agence de la biomédecine. M. Alain Claeys : Vous annoncez aujourd'hui que le Comité ad hoc ne siégera plus et que ce sera donc l'Agence de la biomédecine qui va instruire les dossiers. M. Roger Picard : A condition que toutes les conditions soient réunies à l'Agence de la biomédecine. J'ignore ce qu'il en est. M. Philippe Ménasché : Je ne sais pas qui sont les deux malheureux demandeurs mais il faut d'un point de vue concret savoir que cela signifie sans doute pour eux que leurs travaux de recherche sont décalés d'au moins un an. M. Alain Claeys : Par rapport à cette information et en tant que rapporteur, je m'occuperai de cela. Il y aura une démarche auprès des ministres concernés, santé et recherche. M. Roger Picard : Je ne peux pas vous répondre sur l'identité de ces deux demandeurs car ces dossiers ne nous ont pas été communiqués. Je sais simplement que dans les deux demandes il y en avait une, et c'était la première, d'un laboratoire privé. M. Alain Claeys : Nous allons demander des précisions pour les jours qui viennent. En effet, s'il faut autant de temps pour le reste, on risque de perdre un an. M. Roger Picard : En effet. J'ai répondu à votre invitation en tant que porte-parole de l'Alliance maladies rares, et je suis par ailleurs président de la Fédération Huntington Espoir, qui représente les malades atteints de maladie de Huntington. J'ai été sollicité par le ministère de la Recherche lors de la mise en place du Comité ad hoc en tant que représentant des associations et non en tant que spécialiste des cellules souches, bien que dans le cas de la maladie de Huntington on est assez informé de ces procédures. J'ai accepté non pas par conviction par rapport à la loi, car ce n'est un secret pour personne de dire qu'elle ne me convient pas forcément, mais par démocratie. A partir du moment où l'on est sollicité pour participer à quelque chose, j'estime que le mieux est d'être impliqué pour comprendre ce qui se passe plutôt qu'être dehors et de critiquer. J'ai été globalement assez satisfait de participer à ce Comité, avec toutes ses lourdeurs et contraintes que cela a pu apporter. Je pense que cela ne va pas forcément être mieux à l'avenir. En ce qui concerne la loi, nous aurons sans doute deux demandes au niveau des associations. D'une part, que la révision de la loi de 2004, qui devrait se faire normalement au bout de cinq ans, ne prenne pas le même chemin que celle de 1994, pour laquelle cela a pris dix ans et dont les décrets ne sont encore pas sortis, ce qui va faire douze ans. Cela nous pose des problèmes. Par rapport à l'évolution de la recherche et de la science, c'est dramatique. Il faut que cela « colle » beaucoup plus près à la réalité scientifique et à l'évolution. M. Alain Claeys : Je vous rappelle, dans l'esprit du législateur, le rôle de l'Agence de la biomédecine qui devrait remettre chaque année un rapport pour adapter et faire des propositions. Cela devrait être beaucoup plus rapide, sans attendre de faire un nouveau balayage tous les cinq ans. C'est l'idée que j'ai, en fonction des conclusions du rapport, pour faire avancer les choses. M. Roger Picard : Cela se passera comme cela à condition que les instances dirigeantes de l'Agence de la biomédecine soient des moteurs et non pas des freins. Je n'ai pas l'impression que cela prenne le bon chemin dans ce domaine. Une réflexion a été faite, lorsque nous avons dû traiter tous les dossiers, à savoir qu'on ne fera peut-être pas l'économie de la mise en place d'une ou plusieurs banques de cellules souches en France. Des demandes viennent d'un peu partout. Il est évident que la médecine traditionnelle a atteint ses limites, malgré les recherches sur les médicaments dits orphelins, très soutenus au niveau européen, mais qui restent l'exception. Les cellules souches sont porteuses d'immenses espoirs pour les patients et leurs familles, tant au niveau des traitements que de la connaissance de la maladie. Le travail sur les cellules souches est donc très important pour nous pour traiter les maladies. Mais il l'est aussi pour comprendre comment cette maladie fonctionne en exploitant les résultats des DPI et en étudiant les lignées de cellules souches malades. Je suis tout à fait d'accord sur le fait qu'il faut prendre garde de ne pas donner de faux espoirs à court terme ou de faire des promesses qui ne seraient ni réalistes ni éthiquement recevables. L'attente des malades est très grande. Dans le monde, les maladies rares, ce sont sept mille pathologies, et ce sont en France trois millions de malades, soit une personne sur vingt, atteints de maladies rares. C'est énorme. L'attente des malades n'est pas forcément de soigner ou de guérir la maladie, mais de faire en sorte qu'on puisse la soulager, la prendre en charge et tendre vers une vie quasi « normale » qui intègre la maladie, et ce qui en découle très souvent, le handicap, qui ne peut pas être dissocié de la maladie. En ce qui concerne la maladie de Huntington, qui me touche plus personnellement, il s'agit d'une maladie neurodégénérative, qui touche six mille malades et vingt mille personnes à risque. Il existe depuis 1993 un test génétique prédictif, qui permet à partir de la majorité (c'est interdit avant, ce qui est une bonne chose) de savoir si l'on est porteur de la maladie, et si l'on sera malade un jour, soit en moyenne aux alentours de quarante ans. Il est remarquable de constater que 90 % des personnes à risque ne font pas ce test. En effet, il n'y a pas de perspective de guérison ou d'espoir de guérison à court terme ou d'un traitement quelconque. Toutes les personnes à risque vivent donc dans une angoisse permanente, développent des pathologies que l'on pourrait caractériser de collatérales, suivant un terme à la mode. On espère que les cellules souches vont donner à terme des espoirs raisonnables de traitement, ce qui aura pour effet que les malades déclarés non seulement vont être dépistés mais que tous ceux qui sont dans la chaîne, la fratrie, les enfants et les petits-enfants, vont pouvoir se faire dépister puisqu'il y aura un espoir de guérison. La problématique pourra alors s'inverser. Des solutions seront peut-être apportées pour traiter les malades, pour prévenir la maladie, utiliser beaucoup plus le DTN, les DPI, ce qui n'est pas fait aujourd'hui. On perpétue la maladie sans arrêt. Voilà ce que je voulais dire, au niveau de l'attente des patients. M. Alain Claeys : Merci. Je vous rappelle que vous pourrez intervenir également dans le cadre des tables rondes de cet après-midi. M. Bernard Zalc, vous avez la parole. M. Bernard Zalc, Directeur de recherche à l'Inserm : Je serai bref. Je pense que je suis ici parce que je suis coordonnateur, avec Laure Coulombel, du réseau d'utilisation des cellules souches neurales à visée thérapeutique. C'est un réseau que nous avons créé il y a quelque temps et qui est très fortement soutenu par l'Inserm, le ministère de la Recherche et quelques associations caritatives. Je voudrais faire quelques rappels sur le système nerveux, essentiellement constitué de deux grands groupes de cellules, les neurones et les cellules gliales. Parmi celles-ci, je mets un peu à part l'oligodrendocyte, qui est la cellule myélinisante du système nerveux central. Dans les maladies neurodégénératives, il s'agit de maladies où une population cellulaire est décimée, qu'il s'agisse des neurones dopaminergiques dans la maladie de Parkinson, de neurones cholinergiques dans la maladie d'Alzheimer, de motoneurones dans la sclérose latérale amyotrophique ou des oligodendrocytes dans la sclérose en plaques. Jusqu'à il y a une dizaine d'années, on vivait avec l'idée qu'on avait nos cellules dans le cerveau, qu'elles étaient formées à la naissance et qu'au-delà de vingt ans, on subissait une perte progressive de ces cellules. Voici une dizaine d'années, on a découvert les cellules souches neurales qui ont créé un espoir de thérapeutique sans doute démesuré avec l'idée que l'on pouvait peut-être régénérer certaines cellules de notre cerveau. Le premier mouvement, vers la simplicité, a été de remplacer ces cellules par des approches chirurgicales. Non seulement c'est une stratégie simple, on prend des cellules souches pour les introduire dans le cerveau et elles viennent remplacer la population décimée, mais de plus, et il y a là sans doute un problème d'éthique du chercheur, avec le fantasme de la greffe de cerveau. Si ces approches ont été très médiatisées, c'est aussi parce que les chercheurs y ont participé, avec notamment cette notion qu'on va changer notre cerveau et qu'on va prendre le cerveau de quelqu'un d'autre. On imagine facilement tout ce que cela peut animer comme fantasmes dans la population, qu'elle soit bien-portante ou qu'il s'agisse de patients. D'autres alternatives existent. Dans certaines pathologies, cette approche chirurgicale ne s'applique pas. Si l'on observe l'illustration de cette coupe d'un cerveau de patient qui a une sclérose en plaques, chaque zone blanche est une lésion. Sur l'exemple montré, le patient a vingt-huit lésions. On peut estimer que dans tout son cerveau, il y en a près de cinquante, en oubliant la moelle épinière, qui en comporte environ une vingtaine. Le patient a donc près de soixante-dix lésions. Un chirurgien qui est prêt à mettre soixante-dix aiguilles dans un cerveau de patient, ce n'est plus un chirurgien, et j'appelle cela un acupuncteur. Il existe un autre élément qu'il ne faut pas oublier dans une affection comme la sclérose en plaques : les lésions bougent. Sur ce patient, le chirurgien devrait passer son temps à introduire des aiguilles et à injecter des cellules. Ce n'est pas possible. D'autres approches sont donc envisagées. C'est là que la recherche fondamentale est cruciale. On sait qu'autour des ventricules il y a des cellules souches, qu'on doit pouvoir les mobiliser et comprendre comment non seulement il faut les mobiliser et les amener à se multiplier, mais aussi comment les amener à se différencier sur une certaine voie. Si on veut obtenir des neurones dopaminergiques comme dans la maladie de Parkinson, ce n'est pas la peine de générer des oligodrendocytes. En revanche, si l'on génère des neurones dopaminergiques, on n'aidera en rien un patient qui a une sclérose en plaques. C'est ce genre d'approche qu'il convient de soutenir, et qui est déjà soutenu au sein du réseau cellules souches neurales à visée thérapeutique. Il faut poursuivre dans cette voie. M. Alain Claeys : Merci beaucoup. Vous pourrez également intervenir à nouveau cet après-midi. Merci d'être restés toute la matinée. Nous reprendrons à 15 heures. Table ronde n° 4 : M. Alain Claeys : Nous abordons un sujet qui est parfois un peu négligé, mais qui pourtant paraît essentiel et pose un certain nombre de problèmes éthiques : je veux parler des enjeux économiques. Madame Siobhán Yeats, de l'Office européen des brevets, est présente cet après-midi et je souhaiterais qu'elle transmette toutes mes amitiés à Alain Pompidou. Nous avons la joie de vous accueillir aujourd'hui, et je pense que votre intervention est importante. J'irai vous rendre visite à l'Office européen des brevets à Munich dans les semaines qui viennent. Je salue Monsieur Hervé Chneiweiss, directeur de recherche à l'Inserm, professeur au Collège de France et membre du Comité de Pilotage. Je salue également Messieurs Christian Pinset, fondateur et président-directeur général de l'entreprise Celogos, Philippe Pouletty, président de France Biotech, David Sourdive, directeur général délégué de Cellectis, et Jean-Thomas Vilquin, fondateur de l'entreprise Myoxis, qui participent également à cette table ronde. Je ferai tout d'abord intervenir Monsieur Pouletty, suivi de Monsieur Chneiweiss et de Madame Yeats. Compte tenu de ce que nous avons évoqué ce matin, y a-t-il un intérêt économique ? Si oui, est-il compatible avec l'intérêt scientifique et thérapeutique ? Pouvez-vous nous dire ce qui se passe aujourd'hui en France, et comparer la situation de la France avec celle qui existe au niveau international ? Je donne la parole à Monsieur Philippe Pouletty. M. Philippe Pouletty, président de France Biotech : Merci Monsieur le Président. Si vous le permettez, je parlerai plus globalement d'ingénierie tissulaire, et pas seulement de cellules souches. L'intérêt économique sera considérable dans les trente années à venir. Il faut être patient : si l'on examine l'histoire des biotechnologies et de l'ingénierie tissulaire, ce type de développement ne se fait ni en trois ans, ni en cinq ans. Pourquoi l'intérêt sera-t-il considérable ? Si l'on examine le nombre de pathologies qui seront traitées - de façon très schématique - par une molécule, le rêve de la génomique consistant à dire que nous aurons de plus en plus de cibles et que nous développerons de plus en plus de molécules qui résoudront toutes nos pathologies, est un mirage. Si l'homme est fait de cellules et de tissus, et pas simplement d'une collection de petites molécules ou de protéines, c'est parce que la physiologie normale est très complexe. De nombreuses maladies vont au-delà de la simple administration d'une seule molécule. Une autre raison est que la barrière pour développer des thérapeutiques plus efficaces augmente avec les progrès technologiques : certains sont ainsi déçus qu'il n'y ait pas davantage de médicaments approuvés par exemple par la FDA. En effet, il ne suffit pas d'avoir de nouvelles molécules : elles doivent également être plus efficaces et/ou moins toxiques que celles qui existent actuellement. Si l'on se penche sur l'histoire des biotechnologies et de l'ingénierie tissulaire, les grands succès ont consisté à reproduire ou imiter la nature. Ce dont nous parlons aujourd'hui, avec les cellules souches et l'ingénierie tissulaire, consiste bien à reproduire ou imiter la nature. La substitution ne date pas d'aujourd'hui, qu'il s'agisse des dérivés plaquettaires du sang, des diverses transplantations, des greffes de moelle, mais également des anticorps monoclonaux et polyclonaux, des protéines recombinantes, ou encore des vaccins. Tout cela représente plus de 70 % du chiffre d'affaires des biotechnologies actuelles. Il est donc aisé de parier que l'ingénierie tissulaire sur les trente prochaines années connaîtra un développement considérable. On peut citer des chiffres « prévisionnels », en se basant sur des besoins médicaux et les malades présentant des insuffisances hépatiques, cardiaques, rénales, pancréatiques ou souffrant de diabète, voire en faisant des projections sur les transplantations d'organes : en 2020 ou 2030, ces technologies représenteront entre 5 et 50 milliards d'euros de chiffre d'affaires - sous réserve que les progrès technologiques continuent et que la réglementation s'adapte. Pour que ce genre de technologies arrive sur le marché, dans la mesure où il y a énormément de recherches fondamentales à faire, l'effort ne pourra pas être réalisé par les seuls groupes pharmaceutiques, les investisseurs ou les entreprises de biotechnologie. Nous avons souvent discuté de ce thème : si les Etats ne fournissent pas en amont un très gros effort de financement de la recherche nécessaire pour ce type d'innovation, les entreprises et les investissements privés ne pourront pas prendre le relais. Celui-ci ne peut être pris que si le travail d'amont a été réalisé. Où se place la France dans ce domaine ? Elle se situe à peu près au même niveau qu'elle occupe dans les autres domaines des biotechnologies ou des sciences de la vie. Nous retrouvons les mêmes problèmes chroniques de la recherche académique en sciences de la vie qui est sous-dimensionnée en France. Compte tenu de ses moyens financiers et de sa qualité - comparés à des pays qui ont pris davantage d'initiatives comme l'Angleterre et les Etats-Unis -, la France est peut-être troisième en Europe. Elle a un fort potentiel à condition d'y mettre les moyens et la volonté. Quels sont les enjeux pour la France ? Dans ce domaine, la recherche est totalement mondialisée et les chercheurs vont là où les universités leur offrent les meilleurs moyens de recherche, tant en salaire, qu'en personnel, qu'en équipe de recherche et qu'en collègues de même niveau. Dans le monde, il y a environ 200 entreprises de biotechnologie qui ont une activité majeure dans le domaine de l'ingénierie tissulaire et des cellules souches. Il y a environ 3 500 entreprises de biotechnologie tous azimuts : cela représente 5 à 7 % de l'activité de la biotechnologie mondiale. La plupart de ces entreprises travaillent en amont, perdent bien sûr de l'argent et consomment beaucoup de capital. Le nombre d'entreprises et leur taille relativement modeste pourraient considérablement augmenter dès lors que la recherche d'amont aura progressé et que les indications et les produits développés ne seront pas simplement de la greffe de peau ou les applications les plus simples de l'ingénierie tissulaire. M. Alain Claeys : Quel est le nombre d'entreprises de biotechnologie en France ? M. Philippe Pouletty : Il y a en France deux ou trois entreprises de biotechnologie dont l'activité est dominante et qui sont correctement financées. Je ne suis pas certain qu'il y ait plus de trois entreprises qui passent la barre de la visibilité. M. Alain Claeys : Quelles sont les relations avec les organismes de recherche et les laboratoires ? Comment naissent les collaborations et comment est traitée la question de la propriété intellectuelle ? M. Philippe Pouletty : Il y a schématiquement deux manières de créer une entreprise de biotechnologies. D'une part, il peut s'agir d'un essaimage à partir d'un organisme de recherche ou d'une université, avec en général un ou deux chercheurs qui en ont assez de « ronronner », ou qui ont d'excellentes idées et qui souhaitent sauter le pas en créant une entreprise. D'autre part, il peut s'agir d'essaimage de groupes pharmaceutiques pour lesquels cette activité ne fait pas partie de leur cœur de métier. Pour la thérapie cellulaire et l'ingénierie tissulaire, il n'y a pas d'essaimage dans ce domaine, car les groupes pharmaceutiques y ont très peu d'activité. M. Alain Claeys : Actuellement, les groupes pharmaceutiques ne s'y intéressent donc pas ? M. Philippe Pouletty : Non, à part peut-être certaines grosses entreprises de biotechnologies comme Genzyme, historiquement Baxter avec son activité de transfusion sanguine et de dérivés sanguins, un peu GlaxoSmithKlein. Il n'y a pas plus anti-biotechnologies que Sanofi-Aventis, notre groupe pharmaceutique national qui est par ailleurs remarquable, car il considère qu'il y a encore beaucoup de choses à faire en pharmaceutique classique et en petites molécules, et que la biotechnologie pose énormément de problèmes. Ce domaine n'est pas très attractif pour un groupe pharmaceutique ou pour une société de biotechnologies car l'ingénierie tissulaire pose d'énormes problèmes logistiques, de coûts de production, de traçabilité, de contrôle de qualité, d'assurance-qualité, car elle est souvent individualisée. Une petite société suisse, Symetis, essaie de fabriquer des valves cardiaques à partir des cellules du cordon ombilical du fœtus qui présente une pathologie cardiaque. Cela signifie qu'il faut fabriquer une valve cardiaque sur 6 à 8 semaines, individualisée pour ce malade. La logistique et le coût de production sont donc très lourds. Pour une entreprise pharmaceutique habituée à produire une molécule en tonnes ou en millions d'exemplaires, avec un emballage et un contrôle de qualité assez simples et dix lots de production par an, l'ingénierie tissulaire est effroyablement compliquée. La simplification consiste à considérer des cellules dites « universelles » pour permettre de fabriquer un produit pour les différents malades. Néanmoins, cette séquence nécessite pour les dirigeants d'un groupe pharmaceutique une transition considérable. Cette transition est plus facilement réalisée par certaines entreprises de biotechnologie comme Genzyme, car elle a été la pionnière de traitements de maladies rares - donc chers - pour un petit nombre de malades. Une société comme Genzyme peut donc beaucoup mieux intégrer l'idée de développer des médicaments extrêmement chers pour un petit nombre de malades avec une logistique lourde - Philippe Ménasché en a peut-être parlé précédemment. Si l'on se projette 20 ou 30 ans en avant, le risque pour les groupes pharmaceutiques de ne pas se lancer à temps dans ce domaine est qu'ils éprouveront des difficultés à réaliser au dernier moment tout le travail d'amont qui aura été fait par d'autres. Les unités de production de ces biotechnologies n'ont strictement rien à voir avec celles des produits pharmaceutiques classiques. M. Alain Claeys : Lorsque vous dites qu'il s'agit d'un marché de plusieurs milliards de dollars, le thème des cellules souches est-il une « stupidité » ? M. Philippe Pouletty : Non. Je citais une fourchette allant de 5 à 50 milliards d'euros. Si l'on se base sur des exemples actuels comme les insuffisances cardiaques, rénales ou hépatiques, ou encore les greffes de moelle, il y a environ 25 000 transplantations d'organes et 50 000 greffes de moelle entre l'Amérique du Nord et l'Europe de l'Ouest. Le nombre de patients inscrits sur les listes d'attente répertoriées est environ dix fois plus important que le nombre de transplantations ou de greffes annuel. Ce sont les malades très avancés qui sont inscrits sur ces listes d'attente. Plus les approches thérapeutiques seront accessibles, plus le nombre de malades inscrits sur les listes d'attente sera large. Aujourd'hui, le candidat à la transplantation cardiaque est un malade « au bout du rouleau », qui a moins de 70 ans. Si Philippe Ménasché réussit, ce qu'on lui souhaite, à traiter plus facilement les insuffisances cardiaques à partir de thérapies cellulaires, un plus grand nombre des malades, qui aujourd'hui ne sont pas inscrits comme candidats à la transplantation et qui suivent des thérapeutiques plus classiques, bénéficieront de ces traitements. Le nombre de malades ayant une insuffisance d'organe parmi celles que j'ai citées est de plusieurs millions par an dans le monde. Il restera à voir si les traitements développés sont suffisamment simples, efficaces et peu toxiques pour qu'ils touchent 5 % ou 80 % de ces candidats potentiels. Il est certain que plus l'on mène de recherches dans ce domaine, plus l'on a de chance de développer les traitements qui bénéficieront de manière large à ces malades. Monsieur le député, je suis toujours effaré par le fait que nous sommes très doués pour organiser des tables rondes, mais qu'année après année, nous continuons à nous poser des questions dont la réponse devrait pourtant être évidente depuis 10 ou 20 ans ! Quand Arnold Schwarzenegger qui n'est pas un grand scientifique mais qui a une vue simple de l'avenir, a décidé de mettre 3 milliards de dollars sur 10 ans en fonds d'Etat pour la recherche californienne dans la Silicon Valley là où elle est déjà très forte en biotechnologies, il n'a pas fait table ronde après table ronde ! M. Alain Claeys : Je vous remercie de vos conseils, mais je ne pense pas que ce soit mon modèle. M. Philippe Pouletty : Je souhaiterais néanmoins que nous en reparlions. M. Alain Claeys : Philippe Ménasché, travaillez-vous avec des entreprises de biotechnologies ? Comment se passe votre collaboration ? M. Philippe Ménasché, professeur de chirurgie thoracique et cardio-vasculaire à l'Université Paris V, chirurgien cardiaque à l'hôpital Georges Pompidou, directeur d'Unité Inserm Jean-Thomas Vilquin est certainement plus compétent que moi pour le dire. Comme il est très modeste, je vais toutefois vous raconter brièvement une histoire qui illustre mes précédents propos sur les potentialités qui existent dans ce pays, à condition qu'on ne passe son temps à y mettre des freins. Lorsque nous avons commencé à travailler sur l'utilisation de cellules souches musculaires pour traiter les patients insuffisants cardiaques, une importante phase a été menée sur l'animal, puis nous sommes arrivés à la recherche dite « translationnelle ». Avec l'AFSSAPS, nous avons discuté de la manière dont nous pourrions adapter nos procédures à un usage humain. Ce sont Jean-Thomas Vilquin et Jean-Pierre Marolleau de l'hôpital Saint-Louis qui ont mené cette recherche translationnelle à bien, au point de déposer un brevet portant spécifiquement sur la technique utilisée pour pouvoir greffer ces cellules musculaires humaines dans un cœur humain. C'est Genzyme, qui est une grosse société de biotechnologie américaine, qui est venue trouver Jean-Thomas Vilquin ! Lorsque nous avons greffé les premiers patients et que cela a suscité un certain intérêt, Genzyme a immédiatement repéré qu'il y avait là une ouverture intéressante. Alors que la démarche se fait généralement dans le sens France / Etats-Unis, ce sont les Américains qui ont débarqué à l'Hôpital Saint-Louis et qui l'avaient même acheté à l'époque en estimant qu'il était beau et qu'il leur donnerait de l'espace pour cultiver les cellules. Au-delà de l'anecdote, ils sont venus trouver Jean-Thomas Vilquin et Jean-Pierre Marolleau qui étaient détenteurs du brevet Assistance Publique Hôpitaux de Paris et Inserm. J'aime raconter cette histoire, car elle montre qu'il y a des potentialités qui sont bridées par le mille-feuille administratif que nous subissons tous les jours. Ce sont les techniciennes de l'Hôpital Saint-Louis et de l'APHP et l'équipe de Jean-Thomas Vilquin qui sont allées à Boston présenter leur technique à leurs collègues américains. Dans l'essai international en cours, il y a deux sites de production avec des techniques parfaitement harmonisées et standardisées : l'un à l'hôpital Saint-Louis et l'autre à Boston. Il y a véritablement une potentialité, à condition que l'on laisse les gens travailler ! M. Alain Claeys : Cette histoire est très intéressante. Pouvez-vous nous expliquer les freins que vous avez rencontrés ? Qu'est-ce qui ne fonctionne pas en France pour que ce processus aille jusqu'à son terme et se développe ? M. Jean-Thomas Vilquin, fondateur de l'entreprise Myosix : Je remercie Philippe Ménasché d'avoir raconté cette histoire. Lorsque nous avons réussi la culture de ces cellules, nous nous sommes rendus compte qu'il pouvait y avoir un potentiel, et nos institutions nous ont poussés à faire une demande de brevet, ce que nous avons fait. M. Alain Claeys : Qu'avez-vous breveté ? M. Jean-Thomas Vilquin : Nous avons breveté la production de cellules musculaires - et éventuellement leur usage dans les pays où cela est possible - et les populations de cellules que l'on peut extraire du muscle dans un temps assez court. Ceci était assez nouveau et n'avait à ma connaissance pas été fait ailleurs dans le monde. M. Alain Claeys : Vous avez breveté le processus de production ou quelque chose de plus large ? M. Jean-Thomas Vilquin : Nous avons essentiellement breveté le processus et les populations. Nous avons donc créé une petite société afin de valoriser tout cela. Nous étions quatre au départ. Genzyme est venu nous voir au bout de quelques mois : nous n'avons pas tout de suite conclu avec eux car nous cherchions des investisseurs sur place. Nous avons rencontré des difficultés, peut-être parce que notre entreprise n'était pas suffisamment grande mais aussi parce que le marché était absolument considérable. A l'époque, on nous avait parlé aux Etats-Unis d'un marché de 12 milliards de dollars par an pour le traitement de l'insuffisance cardiaque post-ischémique. Il fallait donc que nous ayons immédiatement une structure très importante, ce qui effrayait les capitaux-risqueurs et les investisseurs que nous avions rencontrés. En étudiant le dossier de Genzyme, nous nous sommes rendus compte que cette société avait une tradition de culture cellulaire, de logistique et de préparation des produits, et qui savait comment recevoir les biopsies et renvoyer des cellules de bonne qualité avec une bonne démarche d'assurance qualité. Nous nous sommes donc associés à eux, pour les développements cardiaques, en essayant toutefois de rester indépendants pour les autres développements que nous pourrions réaliser à partir des cellules musculaires. A l'origine, Philippe Ménasché est venu nous trouver au laboratoire parce qu'il avait besoin de myoblastes ; je travaille sur les myopathies avec l'Association française contre les myopathies. Nous avons beaucoup bénéficié des connaissances que nous détenions sur les myopathies, sur la fabrication des cellules et sur les injections. Nous en avons fait bénéficier Philippe Ménasché. Cette plate-forme de production de cellules a été créée, et nous nous en servons à présent avec Myosix pour essayer de retourner vers d'autres essais cliniques, non pas vers des maladies fréquentes mais des maladies rares voire orphelines. M. Alain Claeys : Quelles sont les difficultés que vous avez rencontrées en France ? Sont-elles d'ordre législatif, juridique ? M. Jean-Thomas Vilquin : Il s'est essentiellement agi de difficultés d'ordre administratif. Entre le dépôt de la demande et la réception du document, il nous a fallu quasiment un an pour obtenir une licence exclusive de ce brevet, pour des raisons qui me sont inconnues. Ceci a été un frein face aux investisseurs qui regrettaient que nous n'ayons pas de brevet. A l'époque, il manquait certains fonds comme les fonds d'amorçage de l'Assistance Publique qui existent à présent et qui auraient permis de réaliser plus rapidement quelques essais. Nous nous sommes surtout heurtés à un problème d'échelle, en passant de 10 à 300 patients dans le monde entier. Cet essai coûte 15 à 20 millions d'euros. M. Alain Claeys : Vous soulevez un premier problème administratif pour obtenir la licence exclusive et un second problème lié au tour de table financier. Aujourd'hui en 2005, est-il plus difficile sur cette thématique des cellules souches de réaliser des tours de table financiers et de mobiliser du capital-risque ? M. Jean-Thomas Vilquin : Je manque d'expérience actuellement. Je crois que c'est peut-être un peu plus difficile, car en 2000 c'était le moment des bulles spéculatives qui se sont rapidement dégonflées par la suite. A un certain moment, il a été très difficile de trouver de l'argent. M. Alain Claeys : Le mouvement repart aujourd'hui. Vous n'avez donc pas vécu ce que le domaine de l'informatique a par exemple connu ? M. Jean-Thomas Vilquin : Non, nous n'avons pas eu le temps de connaître cela. M. Philippe Pouletty : En ce qui concerne le capital-risque, il y a actuellement 150 à 200 millions d'euros investis en France sur les biotechnologies. Ceci est peu élevé et le domaine de la thérapie cellulaire sera jugé comme un des domaines à haut risque et à long terme. Si la masse de capital-risque est restreinte, le pourcentage qui aboutira dans le domaine des cellules souches sera assez modeste car la plupart des fonds répartissent leurs investissements entre des projets à court terme ayant des produits déjà identifiés et des projets d'amorçage à long terme. Pour qu'il y ait suffisamment d'argent allant dans les cellules souches ou vers d'autres technologies d'amont, la courbe de Gauss n'est pour le moment pas suffisamment développée. Je souhaite faire un point rapide sur la décision de plafonnement à 8 000 € de cette loi de finances, dont on peut annoncer avec certitude que s'il est maintenu, il réduira la levée des FCPI à partir de 2007. Il s'agit des fonds communs de placement pour l'innovation créés avec un avantage fiscal pour le souscripteur, qui pourra déduire de son impôt sur le revenu 25 % de son investissement jusqu'à un maximum de 12 000 €. Ces FCPI représentent 50 % du capital risque français : sans eux, ce dernier s'effondrerait. Le plafonnement à 8 000 € fera passer l'employé de maison devant et les leveurs de FCPI disent qu'à partir de 2007, l'amputation des FCPI sera de 50 à 75 %, ce qui est très ennuyeux pour toute la biotechnologie française, et bien sûr pour les cellules souches. M. Alain Claeys : Vous avez évoqué le montant consacré aux biotechnologies en France. A titre de comparaison, pouvez-vous nous indiquer celui d'autres pays ? M. Philippe Pouletty : Aujourd'hui, en capital risque, en levée d'introduction en bourse et en offre secondaire (c'est-à-dire toute la chaîne de financement des quinze premières années d'une entreprise de biotechnologie), l'Europe au sens large représentait en 2004 17 % des Etats-Unis, soit 1/6ème, ce qui est très faible. En Europe, l'Angleterre se situe loin devant, l'Allemagne en deuxième position et la France en troisième position. L'Allemagne, qui avait bien démarré en 1995, a beaucoup souffert depuis 2000. L'Angleterre pèse 4 à 5 fois la France en taille, nombre des sociétés et investissements en capital-risque. L'Europe est très en retard, alors qu'elle en a les moyens. En effet, ce sont l'épargne et les fonds de pension qui alimentent le capital dans le monde, et l'on sait que les Européens sont de gros épargnants. Très peu de l'épargne ou de l'assurance-vie française va vers les investissements en PME, et encore moins dans les PME technologiques à cause de la culture et de la perception du risque de la diversification des investissements. Si l'on poussait les investissements en capital risque sur toute la chaîne de financement, l'on assisterait à d'énormes progrès en France et en Europe, car la matière grise, le management et les entrepreneurs existent, de même que les besoins ! M. Christian Pinset, fondateur et président-directeur général de l'entreprise Celogos : En ce qui concerne la question du financement, il n'y a en France quasiment pas de fonds d'amorçage, en particulier pour les entreprises de thérapies cellulaires, car il est difficile de saisir quel est le produit. Lorsque l'on fait de la thérapie cellulaire autologue, on prélève les cellules d'un patient, on effectue un process et on les réinjecte ensuite. Pour beaucoup de gens, il est difficile de savoir où est le produit. Cela les oblige à totalement modifier leur mentalité, car l'industrie pharmaceutique travaille pour avoir un produit qui puisse soigner des millions de personnes. L'image de la thérapie cellulaire est totalement inverse : un produit soigne une seule personne. En ce qui concerne les licences dont parlait Jean-Thomas Vilquin, il est relativement difficile d'obtenir des licences en France lorsqu'on discute avec le CNRS ou n'importe quelle université. Dans une université que je ne citerai pas, nous avions un accord de collaboration avec un partenaire et nous travaillions ensemble. Nous avons finalement dû renoncer après un et demi à cause d'un changement dans notre direction. La situation n'était plus gérable. M. Alain Claeys : On me dit que dans les grands organismes de recherches, on mutualise ces choses. M. Christian Pinset : Peut-être y a-t-il cette volonté de mutualiser, mais le temps est long entre le moment où l'on choisit cette orientation et celui où ce genre de pratique est mis en œuvre. Nous sommes confrontés à des problèmes administratifs complètement ubuesques. Dans le cas précédent, nous avions quasiment signé, mais la direction a changé et tout a dû être recommencé. Nous avons donc abandonné et avons changé de projet. M. Alain Claeys : M. Ménasché, confirmez-vous cela ? M. Philippe Ménasché : Je n'ai pas été en prise directe avec ces problèmes, car je ne fais pas partie d'une entreprise, mais il est certain que la multiplicité des partenaires en cause, en l'occurrence l'Assistance publique, l'université et les organismes de recherche (Inserm et CNRS), complexifie d'une manière effroyable la situation. Chacun veut sa part et cela rend les histoires difficiles. M. Alain Claeys : Que chacun veuille sa part se fait également aujourd'hui aux Etats-Unis ! L'exception universitaire est terminée. La complexité administrative est un autre point. M. Philippe Ménasché : Le fait qu'un travail comme celui dont nous parlons puisse bénéficier à la fois à un organisme de recherche comme l'Inserm et à un organisme de soin comme l'Assistance publique paraît complètement normal. Une fois de plus, c'est la « mise en musique » qui pose problème, car elle prend un an. M. Alain Claeys : Nous reviendrons sur les différents sujets abordés. Hervé Chneiweiss, vous êtes chercheur : comment abordez-vous l'aspect économique du sujet qui nous concerne ? Quelles sont les questions que devraient se poser les responsables publics ? En d'autres termes, le système de propriété intellectuelle qui existe aujourd'hui au niveau international est-il adapté à ce type de recherche ? Cette propriété intellectuelle permet-elle l'innovation ou comme certains le pensent sert-elle à constituer des rentes de situation et à freiner la recherche ? M. Hervé Chneiweiss, directeur de recherche à l'Inserm, professeur au Collège de France et membre du Comité de Pilotage : Je tiens tout d'abord à vous remercier de me faire intervenir dans cette table ronde. Je n'interviendrai pas directement sur les questions de création d'entreprise, mais j'ai le sentiment qu'en abordant la question de la brevetabilité du vivant, sur laquelle Mme Yeats reviendra également, nous nous retrouvons face des difficultés déjà rencontrées avec la brevetabilité des gènes, et qui sont encore plus aigues. Nous avons en effet rappelé précédemment le faible nombre de cellules différenciées (235 pour le tissu adulte), qui est encore plus faible pour les cellules souches embryonnaires sur lesquelles je vais davantage insister. La brevetabilité, quand elle concerne un brevet de produit, peut produire un effet d'instabilité, voire de mettre en danger des entreprises existantes et d'entraîner des difficultés à créer des entreprises nouvelles, y compris à apporter du capital-risque. M. Alain Claeys : Afin que les esprits soient clairs, que représentent les dépôts de brevets sur les lignées de cellules souches au niveau européen et américain ? Sont-ils un risque potentiel ou une réalité ? M. Hervé Chneiweiss : Je ne dispose pas des chiffres européens mais Mme Yeats les connaît certainement. En ce qui concerne l'USPTO (l'Office des brevets américain), une recherche dans la base de données trouve 2 000 brevets dans lesquels le mot « cellule souche » apparaît. J'insiste notamment sur deux brevets qui eux portent sur les cellules souches embryonnaires, déposés par l'Université du Wisconsin à la suite des travaux de caractérisation des cellules souches embryonnaires humaines par l'équipe de James Thomson, et qui d'une certaine façon confèrent un monopole complet à un triangle formé par l'Université du Wisconsin (représentée par sa filiale WARF), la firme de biotechnologie Geron et les NIH qui participent à ce triangle sur l'aspect de la régulation. Deux brevets ont été accordés à l'Université du Wisconsin. Ils sont détenus et développés par WARF : ces brevets 780 et 806 portent sur la préparation, la purification, la caractérisation et la production de cellules souches de primates pour l'un et de cellules souches embryonnaires humaines pour l'autre. A partir de là, l'Université du Wisconsin a délivré une procédure à WARF qui s'articule avec les réglementations de 2001 mise en place par l'administration américaine au niveau du NIH, avec une liste de cellules souches humaines approuvées. Celles-ci peuvent faire l'objet de financement par des fonds fédéraux américains et une liste de cellules souches non approuvées qui restent utilisables et développables par des financeurs privés mais ne sont pas éligibles. Tout cela repose donc sur un Human Embryonic Stem Cells Register se trouvant au NIH. La société Geron, qui avait en partie financé les travaux de James Thomson, se trouve propriétaire de la licence exclusive des trois premières lignées de cellules souches qui portent en particulier vers des différenciations possibles vers des lignées neurales, des lignées d'îlots pancréatiques pour traiter le diabète et vers des cardiomyocytes. L'accord entre WARF et Geron porte également sur d'autres lignées, mais de façon non exclusive. Tout cela est complété par un memorandum of understatement entre Wicell et les NIH pour s'accorder sur la réglementation et la distribution à travers le monde de licences autorisant ou non les équipes à travailler sur les cellules souches embryonnaires humaines. D'autres sociétés internationales ont rejoint l'accord : Bresagen, ES Cell International (une société de Singapour) et the Regents of the University of California. Nous reviendrons sur la question d'Arnold Schwarzenegger et de la proposition 71 car ce sont les citoyens californiens qui ont voté ce crédit de 3 milliards de dollars. Aujourd'hui, la mise en œuvre de cette proposition 71 connaît des difficultés à cause de ce système des brevets obtenus par WARF. On distingue deux catégories d'usage. Tout d'abord, les usages scientifiques à but non lucratif : 132 licences ont été accordées par WARF à différentes équipes à travers le monde pour utiliser les cellules souches embryonnaires humaines. Toutes ces licences sont accordées à un laboratoire ou une équipe précis pour une série d'usages et tous les droits commerciaux sont réservés à WARF. Ensuite, un certain nombre d'accords a été signé avec des compagnies privées. On sait qu'il y a au moins sept compagnies privées à but commercial qui ont signé ces accords, mais on n'en connaît pas le contenu exact. En tout état de cause, l'exclusivité des droits commerciaux sur ces cellules embryonnaires humaines reste en principe couverte par ces deux brevets 780 et 806. Le problème est le même que celui que nous avons déjà rencontré pour les gènes. Ces brevets, à travers les revendications, couvrent le produit, la matière brevetée. En l'occurrence, il s'agit ici des cellules souches embryonnaires humaines. En particulier, le brevet 806 revendique comme produits les cellules souches humaines mésodermales, endodermales et ectodermales, c'est-à-dire toutes les cellules initiales du corps humain. A partir du moment où il s'agit d'un brevet de produit, il donne droit à tous les produits dérivés du produit initial et à toutes les manières d'obtenir ces produits dérivés à partir du produit initial. M. Alain Claeys : Ces revendications ont été acceptées ? M. Hervé Chneiweiss : Oui, par l'USPTO dans ces deux brevets, en particulier pour le brevet 806. Le problème sera le même que celui rencontré pour les gènes, à savoir la possibilité de contester sur le terrain même du droit des brevets la validité de ces revendications. La contestation peut se faire sur la nouveauté s'il est possible de trouver une publication antérieure à celle du groupe de Thomson et rapportant la même chose, sur l'inventivité si la méthode utilisée pour les produire peut être démontrée comme évidente pour quelqu'un de l'art, sur la faisabilité, et en particulier sur l'extension des revendications. Une des faiblesses du brevet 806 est la largeur de ses revendications : il n'est pas clairement prouvé dans ces revendications que toutes les cellules revendiquées ont vraiment été produites ou s'il était vraiment possible de les produire au moment où le brevet a été revendiqué. Je pense que nous devrons prendre conscience qu'il y a une menace lourde qui pèse sur tout un champ des biotechnologies dont nous avons dit l'importance. Le fait qu'un certain nombre de brevets de produits ait été pris sur les cellules les plus originelles par ce triangle WARF-Geron-NIH doit nous faire nous interroger sur la manière d'envisager la propriété intellectuelle pour le développement des biotechnologies et non pas pour conférer à tel ou tel groupe un privilège de rente. M. Alain Claeys : Je crois que nous devons nous arrêter quelques instants sur ce sujet, qui est un des sujets centraux de notre réflexion. Aujourd'hui, le brevet produit tel qu'il est défini est-il adapté au vivant, et en particulier à la recherche sur les cellules souches ? A l'inverse, ce brevet produit peut-il constituer un frein, y compris à la recherche et au développement ? Nous savons très bien ce qui se passera : si ces brevets produits continuent à être acceptés, le contentieux sera tranché par la justice. Si le législateur veut réduire cette notion de brevet produit à des brevets d'application, ces derniers seront-ils un handicap majeur pour la recherche développement ? En quoi un brevet produit peut être aujourd'hui un élément de développement de la recherche ? N'est-il pas plutôt une rente de situation ? M. Philippe Pouletty : A quelle date ce brevet a-t-il été déposé ? M. Hervé Chneiweiss : Il a été publié en 2001. M. Philippe Pouletty : L'expiration aura donc lieu dans 15 ans. Chaque fois que nous sommes du mauvais côté de la barrière, nous trouvons qu'il est inadmissible d'avoir des brevets si larges. Lorsque l'on est du bon côté, on est fier des découvertes de nos organismes, comme la découverte du HIV par l'Institut Pasteur. Il faut rappeler que la durée de ces brevets est limitée. Mme Yeats me corrigera si je me trompe : en Europe, nous avons le droit de faire de la recherche et du développement pendant la durée du brevet, alors qu'aux Etats-Unis, la jurisprudence peut permettre d'attaquer les gens qui le font pendant le brevet. Sur des technologies qui demandent beaucoup d'années de développement, je ne suis pas certain qu'il s'agisse d'un tel frein à la commercialisation de produits, qui prendra pas mal de temps. Pour justifier les investissements massifs par les investisseurs, l'absence de brevets très large représente un frein à la prise de risque de l'investissement. Je ne fais pas partie de ceux qui critiquent les brevets très larges lorsqu'ils existent. M. Alain Claeys : Y a-t-il beaucoup de brevets produits en Europe ? M. Philippe Pouletty : Il y en a certainement moins qu'aux Etats-Unis. Les brevets européens sont nombreux mais ils sont très souvent plus étroits. De gros brevets existent, comme celui lié au HIV : cet exemple de brevet produit extrêmement large a permis à l'Institut Pasteur d'encaisser plus de 100 millions d'euros de redevance. M. Alain Claeys : Madame Yeats, la directive européenne a été transposée dans le droit français. Bien avant qu'elle le soit, elle avait été introduite dans le règlement de l'Office européen des brevets. Vous avez donc un certain recul par rapport à ce sujet : quelle est la réflexion sur le vivant que vous menez au sein de l'Office européen des brevets et quelles sont les évolutions que l'on peut attendre ? Mme Siobhán Yeats : Je vous remercie. Je ne crois pas que ce soit à l'Office européen des brevets de défendre ou d'attaquer les brevets. Certains les ont attaqués, d'autres les ont défendus. Le rôle de l'Office est de représenter la loi telle qu'elle. Les lois européennes des brevets stipulent que les éléments humains, y compris les cellules sont brevetables, selon certaines conditions bien sûr, et avec les limites du constat éthique. Cela signifie que les cellules souches sont en principe brevetables s'il n'y a pas de considérations éthiques spéciales. Il faut donc distinguer les différents types de cellules souches. Les cellules adultes et fœtales peuvent être obtenues à partir de sang ou de moelle épinière cédées pour la recherche par des volontaires. Il n'y a donc là pas de problème éthique. Ces cellules sont brevetables sans limitation. La situation est différente concernant les cellules embryonnaires. Leur utilisation est controversée pour les mêmes raisons qui font que la recherche est controversée en Europe car elles sont dérivées d'embryons humains. Déterminer si ces cellules peuvent être brevetées fait bien sûr l'objet d'un très vif débat en Europe. Un nouveau développement sur le brevet WARF a eu lieu la semaine dernière, concernant le brevet 780 sur les cellules de primates. Une disposition particulière existant dans la loi européenne stipule que l'utilisation d'embryons humains à des fins industrielles ou commerciales est exclue de la brevetabilité car contraire à la moralité. La raison de cette exclusion n'est pas tout à fait claire. La directive a été rédigée en 1998, voire avant. A cette époque, les cellules souches humaines n'avaient pas encore été isolées, au contraire des cellules de primates. Il est difficile de savoir pour quelles raisons la Commission européenne a inclus cette disposition dans la règle. C'est un problème pour les examinateurs de l'Office européen des brevets car il faut l'interpréter. L'opinion publique est divisée, ce qui ne rend pas la tâche facile pour les examinateurs de l'OEB. Une des positions serait que l'utilisation d'embryons humains en tant que tels serait exclue de la brevetabilité. Ceci correspondrait par exemple à la vente d'embryons humains destinés à la reproduction ou au clonage. Une indication du Comité d'éthique de la Commission semble dire que les personnes qui ont fait le texte avaient ces idées en tête. Dans cette première interprétation, on pourrait considérer que les embryons tels quels ne sont pas brevetables, mais que les cellules dérivées des embryons ne sont pas des embryons tels quels et seraient donc brevetables. La seconde interprétation serait bien sûr plus large : toute recherche mettant en jeu des cellules souches embryonnaires humaines implique à un moment ou à un autre la destruction d'embryons humains. Il peut donc être plaidé que ces recherches sur les cellules embryonnaires sont fondées sur l'utilisation à des fins commerciales d'embryons humains, et que le résultat de ces recherches n'est pas brevetable. Il faut rechercher un consensus sur le sujet, bien qu'il n'y en ait pas : doit-on ou non breveter ces cellules ? Jusqu'à maintenant, les premières instances de l'Office européen des brevets confrontées à ce type de décision ont considéré que les cellules souches embryonnaires humaines ne pouvaient pas être brevetées. Non seulement les cellules elles-mêmes, qu'elles soient dérivées ou non des lignées cellulaires, mais également toutes leurs utilisations ainsi que les méthodes pour les isoler et les cultiver ne seraient pas brevetables. M. Alain Claeys : Donc aujourd'hui, à l'Office européen des brevets, les cellules elles-mêmes et les procédés pour les cultiver ne sont pas brevetables. Mme Siobhán Yeats : C'est ce qu'ont décidé les examinateurs dans trois cas qui ont été traités jusqu'à maintenant, dont le cas de WARF. Les trois demandeurs ont posé un recours contre la décision de première instance et nous avons eu vendredi dernier une procédure orale. La chambre de recours a décidé d'envoyer la question à la Grande chambre de recours de l'OEB qui prend des décisions sur les questions fondamentales pour interpréter la loi. Nous allons demander comment nous devons interpréter cette stipulation selon laquelle l'utilisation des embryons n'est pas brevetable et si on peut breveter ces cellules ou non. M. Alain Claeys : Pour le moment, cette question est donc transmise à votre plus haute juridiction pour arbitrage. Cela vous différencie donc de l'Office américain des brevets. Quelle est la position de l'Office japonais des brevets ? Mme Siobhán Yeats : Je crois qu'ils sont assez stricts aussi mais la question des embryons au Japon est un peu différente. M. Alain Claeys : Y a-t-il une différence entre la position de l'Office européen des brevets et l'Office anglais des brevets ? Mme Siobhán Yeats : L'Office anglais des brevets donne des brevets pour les cellules et leur utilisation, mais ni pour les méthodes pour les isoler de l'embryon ni pour les embryons tels quels. M. Alain Claeys : Mais donnent-ils des brevets pour les lignées cellulaires ? Mme Siobhán Yeats : Ils ont une interprétation assez étroite ; ils indiquent que l'utilisation elle-même n'est pas brevetable. Les cellules qui sont isolées plus tard ne sont pas une utilisation telle qu'elle, et sont brevetables. Chaque entreprise peut donc aller demander en Grande-Bretagne un brevet, obtenir un brevet anglais et déposer parallèlement une demande en Europe. Plusieurs entreprises suivent cette stratégie. Nous devrons attendre un à deux ans pour obtenir la réponse de la Grande chambre de recours. Jusqu'à ce moment, nous ne continuerons pas à traiter les cas relatifs aux cellules embryonnaires : nous attendrons cette décision. M. Alain Claeys : Pour le moment, toutes les demandes de brevets qui vous sont soumises ne sont pas analysées, dans l'attente de la décision ? Mme Siobhán Yeats : Nous allons attendre cette décision. Cet évènement est très récent, puisqu'il s'est passé voici quatre jours. Jusqu'à maintenant, nous continuions à les traiter, mais nous n'avions pris de décision que dans trois cas seulement. M. Alain Claeys : Avez-vous des questions sur ce sujet ? M. Jacques Hatzfeld : Au CNRS, nous avons déposé une demande de brevet et nous avons effectivement reçu cette réponse. Il s'agit plutôt d'une lignée qui fabrique un facteur permettant de différencier les cellules ES. Cela n'est-il pas brevetable en Europe ? Il ne s'agit pas d'une lignée ES mais d'une lignée qui est un facteur, que nous souhaitons analyser. Si ce que vous dites est vrai, il n'y a plus aucune entreprise privée qui va investir dans ce genre de recherche ! Mme Siobhán Yeats : Vous avez raison, c'est un problème que l'on voit clairement à l'OEB. Mais nous sommes coincés entre les deux positions. Une partie nous dit que nous mettons en danger toute l'industrie européenne car nous ne donnons pas de brevet, et une autre estime qu'il va absolument contre l'éthique de donner des brevets parce que cette recherche est immorale. Nous n'avons pas encore trouvé ce consensus en Europe : nous recherchons l'opinion de la majorité. M. Jacques Hatzfeld : Vous confirmez donc que pour ce genre de demande de brevet, il n'y a pas de réponse pour l'instant ? Mme Siobhán Yeats : Pour l'instant, il n'y a pas de réponse. M. Jacques Hatzfeld : L'Office des brevets m'a indiqué que la réponse de Bruxelles était négative. Mme Siobhán Yeats : C'est Bruxelles qui a fait la loi. Bruxelles n'a pas de réponse, car je leur ai personnellement demandé ce qu'ils voulaient obtenir avec cette loi et ils m'ont répondu qu'ils ne le savaient pas. M. Alain Claeys : La directive européenne qui a été adoptée ne répond pas concrètement à la question que vous posez. Mme Siobhán Yeats : C'est cela. Mme Marina Cavazzana-Calvo : Je découvre enfin au niveau de la législation la relation entre état européen et l'Office européen des brevets. Est-ce que les Etats peuvent à titre individuel prendre les brevets et les passer en deuxième instance à l'Office ? Ne serait-ce pas une manière de contourner cette législation ? Mme Siobhán Yeats : Non, mais on peut déposer chaque demande de brevet séparément dans tous les Etats en Europe - en Grande-Bretagne, en France, en Allemagne, au Danemark, etc. - et obtenir des brevets qui sont valables seulement pour le pays concerné. M. Daniel Aberdam : Nous avons breveté la fabrication de peau à partir de cellules ES murines, et le brevet portait sur les cellules de mammifères. Le terme « mammifères » retenu par les instances de brevets en France, a visiblement été rejeté par la communauté européenne et a été accepté par la communauté américaine. Cela signifie qu'un brevet qui peut tenir aux Etats-Unis, et éventuellement en Belgique et en France ne peut vraisemblablement pas tenir en Europe. Cela ne veut rien dire. M. Alain Claeys : La représentation nationale avait donc eu raison de s'interroger sur la transposition de la directive européenne. Ce qui avait été évacué avec les gènes se pose à présent très concrètement sur les cellules souches. Il a été décidé au niveau de l'Office européen des brevets que, concernant la brevetabilité des cellules souches ou des lignées de cellules souches, la plus haute autorité de l'Office européen des brevets serait saisie pour arrêter une position, dans la mesure où Bruxelles ne pouvait pas donner d'interprétation. Depuis quatre jours, il a été décidé que ce type de revendication ne pouvait pas être examiné à l'Office européen des brevets. Mme Siobhán Yeats : Il s'agit plutôt d'une bonne nouvelle, car cela signifie que nous aurons enfin une décision définitive, même si cela prend un ou deux ans. Je considère cela comme un progrès. Jusqu'à présent, l'examinateur était obligé de chercher quasi lui-même quoi faire. M. Jacques Hatzfeld : C'est une bonne chose en ce sens que nous pourrons utiliser toutes les inventions américaines en Europe : cela signifie-t-il que nous nous moquons de leurs brevets ? Mme Siobhán Yeats : Nous ne nous moquons pas de leurs brevets, mais un brevet américain n'est pas valable en Europe. M. Jacques Hatzfeld : Nous pourrons donc appliquer ces brevets sans avoir à payer de royalties ? Mme Siobhán Yeats : C'est votre interprétation, pas la mienne. M. Jacques Hatzfeld : C'est une question. Mme Siobhán Yeats : Cela dépend de la situation. M. Philippe Ménasché : Prenons l'exemple suivant : si demain, ces fameux décrets d'application finissent par sortir, et une fois que l'Agence de la biomédecine aura donné son feu vert, même si ce n'est sans doute pas demain, et qu'un laboratoire français dérive une lignée de cellules souches embryonnaires « françaises » et propose un procédé nouveau, par exemple de prédifférenciation des cellules ou de sélection des cellules prédifférenciées, en bref quelque chose qui n'a rien à voir avec la lignée à proprement parler, mais avec les procédés de préparation dans une perspective clinique. Pour la société en question, le procédé est-il brevetable ? Mme Siobhán Yeats : Malheureusement, je ne peux pas vous donner de réponse exacte : il faut vraiment attendre ce que décidera la chambre de recours de l'OEB sur la portée de cette directive. La loi évolue avec le consensus dans la société. Selon moi, il n'est pas imaginable qu'en continuant à réfléchir, à discuter, à faire des tables rondes, et à développer l'opinion européenne, on finisse par décider qu'on ne peut pas du tout breveter les résultats de cette recherche importante. M. Hervé Chneiweiss : Je souhaite apporter plusieurs petits points de précisions. Tout d'abord, jusqu'à présent, WARF accorde aux institutions de recherche des licences exclusives pour un usage donné, mais toujours de manière gratuite. Cela fait partie de l'accord pour la recherche. A partir du moment où il s'agit d'un laboratoire à but non lucratif, l'accord existant avec le NIH stipule qu'il n'y a aucun droit : il doit y avoir un material transfer agreement, et tous les droits commerciaux restent attachés à WARF. C'est sans redevances et sans frais que la licence est accordée à l'institution à but non lucratif. De ce point de vue, NIH et WARF ont établi un accord dans lequel la spécificité « recherche » est accordée. Deuxièmement, aux Etats-Unis, des juristes se sont déjà penchés sur la question suivante. Si une société européenne, après avoir dérivé une lignée de cellules souches embryonnaires humaines européennes, essayait d'en commercialiser un produit aux Etats-Unis, elle tomberait alors sous le coup des deux brevets de WARF et aurait à trouver un accord de licence ou de brevet secondaire pour commercialiser son produit. Sur le territoire américain et les pays comme le Canada qui reconnaissent les brevets américains, l'entreprise aurait à trouver un accord d'agrément avec Geron et WARF pour pouvoir commercialiser ses produits. Sur le sol américain, ce sont les deux brevets WARF qui s'appliquent jusqu'à contestation éventuelle devant la chambre de recours de l'USPTO du champ de revendication. Comme je l'ai indiqué, le brevet 806 couvrant les trois feuillets embryonnaires, il paraît difficile dans l'état actuel des choses d'imaginer un produit issu d'une cellule souche embryonnaire humaine ne tombant pas d'une façon ou d'une autre sous le coup de ce brevet. En réponse à la remarque de Philippe Pouletty, on est certes heureux lorsqu'on a des brevets larges - et les redevances sur les tests liés au SIDA ont été importantes - mais Pasteur n'a pas pris une propriété intellectuelle sur toutes les maladies sexuellement transmissibles utilisant un rétrovirus, ou encore sur tout moyen de test diagnostic impliquant l'usage des lymphocytes ! Nous sommes ici sur des niveaux d'extension qui ne tiennent pas compte de la multiplicité des gènes. Pour en revenir aux cellules souches embryonnaires humaines, en ce qui me concerne il ne s'agit pas d'un problème moral lié à l'origine de ces cellules - nous en avons longuement discuté ce matin -, mais du fait qu'en prenant ce brevet, WARF s'octroie un droit sur toute cellule souche embryonnaire, quelle qu'elle soit, d'où qu'elle provienne, et pour les 15 ans à venir ! Si cela n'est pas une limitation majeure à tout développement biotechnologique... Mme Siobhán Yeats : C'est un peu plus compliqué que cela, car nous avons toujours des principes de système de brevet, avec des brevets très larges, puis des brevets plus étroits au fur et à mesure que l'on développe une matière. De la même manière que l'on pèle un oignon, qui devient plus petit au fur et à mesure que l'on en retire les couches. Dans l'exemple des gènes, nous avions en Europe un brevet sur l'expression d'un gène quelconque dans une cellule de mammifère. Cela ne signifie pas que tout le monde a cessé de travailler sur l'expression des gènes. Un deuxième brevet a ensuite été déposé sur par exemple l'expression des facteurs de croissance, puis ensuite sur d'autres gènes et d'autres promoteurs. On continue à développer le principe général contenu dans le premier brevet large. Même si c'est un brevet large qui couvre en principe l'isolement des cellules souches embryonnaires, c'est effectivement WARF qui a réalisé ce travail de pionnier, qui a obtenu ce brevet et qui a également demandé un brevet en Europe. Si vous avez une grande innovation, vous aurez un brevet large. Ensuite, si vous isolez des cellules de souches particulières, qui ne sont pas spécifiquement couvertes par ce brevet et qui ne sont pas exprimées dans ce brevet, vous obtiendrez un deuxième brevet. Le processus se poursuivra. Bien sûr, vous êtes en quelque sorte dépendants de WARF ou des autres, mais vous avez néanmoins quelque chose à offrir. Si les uns et les autres possèdent chacun leurs cellules, ils peuvent décider de travailler ensemble et de faire une licence. En principe, ce système a toujours fonctionné dans l'industrie pharmaceutique et il fonctionne déjà dans l'industrie biotechnologique. Théoriquement WARF contrôle tout le monde mais il n'a finalement pas grand intérêt à le faire car il en souffrira également, en ne pouvant plus utiliser les découvertes de ses concurrents. Un accord sera trouvé : c'est de cette façon que le système fonctionne. M. Alain Claeys : Il y a deux pratiques possibles. Soit il s'agit de la pratique du juge, qui va arbitrer à partir de brevets larges, ce qui permettra d'arriver progressivement à un point d'équilibre. Soit une autre démarche existe selon laquelle le législateur prend une position sur ce type de brevet en considérant que les brevets produits ne sont pas acceptés et qu'il faut en rester aux brevets d'application. C'est là le débat qui doit être mené. L'Office européen des brevets a besoin d'une réflexion, y compris dans le cadre de son règlement intérieur. Ceci prouve que la directive européenne, en terme d'interprétation, a ses propres limites. M. David Sourdive, Directeur général délégué de Cellectis, a également son point de vue à donner. Nous donnerons ensuite la parole à M. Christian Pinset de l'entreprise Celogos. M. David Sourdive, directeur général délégué de Cellectis : Je vous remercie. Je souhaiterai apporter un peu d'optimisme dans la discussion : depuis ce matin, j'entends beaucoup de propos sur les problèmes qui se posent, sur les difficultés rencontrées, sur le fait que l'on se pose des questions dans le monde entier. Je centrerai mon propos sur deux choses. Tout d'abord, il s'agit d'essayer de vous donner la mesure de la très large potentialité des cellules souches et sur l'enjeu important qu'elles représentent notamment en matière d'ingénierie du vivant. Ensuite, il s'agit de témoigner de l'occasion particulière que nous avons aujourd'hui en France de prendre une position forte et pérenne dans ce domaine et de voir à quel point il peut être important pour nous d'aller dans cette direction. La société Cellectis est née au début de l'année 2000 d'un essaimage industriel de l'Institut Pasteur. En réponse à la question posée précédemment « est-il difficile d'obtenir des licences des instituts académiques en France ? », la réponse est oui, mais il existe néanmoins des méthodes qui fonctionnent. Il se trouve que nous sommes dépositaires d'une propriété intellectuelle extrêmement forte et de brevets très larges sur l'ingénierie du génome, le knock-in et le knock-out. Cela représente 6 familles de brevets et 75 brevets dans le monde, ce qui est énorme. Nous avons mis quelques mois à négocier avec l'Institut Pasteur, qui est co-propriétaire avec l'Institut Curie, le CNRS et l'Inserm. Comment faisons-nous ? Nous mandatons un seul interlocuteur et nous nous donnons 14 jours pour répondre à toute proposition et contre-proposition. Ce sont des méthodes simples qui fonctionnent, et qui aboutissent à une ratification. Je ferme cette parenthèse en répondant que l'obtention de licences des instituts académiques est difficile mais que des méthodes existent. Il faut simplement se mettre d'accord. Il est vrai que l'empilement de co-propriétés peut rendre les choses extrêmement difficiles. Cellectis a été fondée sur la base de la vision suivante : au XXe siècle, la chimie a connu une révolution. Dans les années vingt, nous sommes passés de l'empirisme et de quelques réactions isolées à quelque chose de beaucoup plus systématique. Nous sommes devenus capables d'agencer le carbone, l'hydrogène, l'azote, l'oxygène de manière très savante et systématique. La chimie envahit tous les compartiments : la vie, le textile, la pharmacie, les engrais, etc. Le vivant va connaître la même évolution au XXIe siècle. Nous nous sommes donc positionnés dès le début sur cet axe de l'ingénierie génomique, et en particulier l'ingénierie des cellules en général et des tissus en particulier. Pour quelles raisons s'agit-il d'un domaine stratégique ? Parce qu'il s'agit d'un des principaux gisements de croissance des années à venir. Il est tout à fait stratégique pour la thérapie, je n'y reviendrai pas car nous en avons beaucoup parlé, car il s`agit d'être capable de réparer des séquences malades dans des cellules isolées de patient, qu'elles soient malades de défauts génétiques innés ou acquis, comme des virus. Démonstration a été faite qu'on pouvait guérir des cellules d'infection virale, ce qui est une approche rare. Ce domaine est également stratégique car son application dans l'industrie est énorme : j'axerai mon propos sur ce point. Les bio-industries sont très nombreuses en Europe et le vivant est présent dans un très grand nombre de domaines. Cependant, l'obtention d'une souche nécessite un grand nombre de processus industriels. Tout ce qui se passe en aval (purification...) est assez bien maîtrisé. Néanmoins, l'obtention d'une souche industrielle est un cauchemar, que ce soient pour les personnes qui font du criblage pour valider des molécules, pour les personnes qui font des modèles animaux, ou encore qui font de la production de molécules recombinantes (anticorps...) ou complexes (antibiotiques). Je ne parle évidemment pas des personnes qui travaillent sur les plantes, qui sont aujourd'hui condamnées à faire de la transgenèse et qui aimeraient bien faire autre chose. Il y a donc aujourd'hui un enjeu énorme dans l'ingénierie du vivant et en particulier dans l'ingénierie génomique. C'est sur ce créneau que nous nous sommes positionnés et que nous sommes devenus une réalité industrielle et, depuis, une réalité sectorielle. Où se situe l'enjeu ? L'opportunité vient du fait que le moment est le bon : la génomique est passée par-là. Nous avons les moyens de connaître le contenu des séquences des génomes d'un certain nombre d'organismes et de microorganismes qui sont d'un intérêt immédiat, pour l'industrie ou la thérapie. Deuxièmement, des sauts technologiques existent. Aujourd'hui, on sait cibler très précisément un endroit dans un génome et le réécrire. Nous ne savons pas aller jusqu'à la base près, mais nous n'en sommes pas loin. C'est une affaire de mois ou de quelques années. Le saut technologique est là et les preuves de concept sont déjà en route. Nous avons donc l'antériorité. Troisièmement, nous avons les acteurs : comme cela a été dit et répété, nous avons de très grands chercheurs et de grands cliniciens en France, et une capacité à agir avec les acteurs industriels qui existent. Nous avons également des outils, comme les pôles de compétitivité, comme Méditech dans lequel Cellectis est impliquée. Nous avons pu démontrer que nous savions travailler ensemble et nous organiser. Je peux témoigner qu'un certain nombre de mes partenaires sont autour de cette table et que nous réussissons à développer des projets collaboratifs et structurants et qui produisent à la fois une recherche et des applications performantes. Aujourd'hui, comment faire pour saisir cette occasion et prendre une position forte et dominante, pérenne sur ce domaine ? Effectivement, le brevet n'est qu'une arme d'interdiction. Il ne permet pas de faire quelque chose mais interdit aux autres de le faire. C'est une monnaie d'échange, et ce n'est pas parce que quelqu'un a pris un brevet très large que pour autant tout est perdu. Je peux en témoigner dans mon travail quotidien : nous sommes nous-mêmes dépositaires d'un brevet très large, et je vois ce qui se passe autour de nous et comment nous avons à poursuivre la compétition face à des gens qui ont très bien compris qu'ils pouvaient bloquer en aval telle ou telle application et avoir une monnaie d'échange avec nous. M. Alain Claeys : Je suis d'accord avec vous, mais au-delà de cela, à travers ces brevets, nous passons tout de même à des brevets de la connaissance. M. David Sourdive : Je vais y venir immédiatement. Dans notre cas, il s'agit d'un brevet de procédé. Nous ne sommes pas dans le cas d'un brevet de produit. Il faut être clair. Nous contrôlons l'utilisation tout à fait artificielle de mécanismes dont les fondements sont effectivement naturels, comme la recombinaison homologue induite, ciblant un endroit particulier dans un génome (mammifère ou non, en fonction des territoires). Nous contrôlons l'utilisation de ces ciseaux moléculaires extrêmement précis permettant de déclencher cette recombinaison-là, qui eux aussi sont naturels. Ces brevets avec des revendications extrêmement larges aujourd'hui ne portent pas sur de la connaissance en tant que telle. Nous ne brevetons pas de connaissance mais un procédé matériel impliquant la mise en œuvre de molécules bien précises et bien décrites. Ce matin, nous avons beaucoup parlé de la puissance normative et de la difficulté qui résultait de l'empilement de règles, qu'elles soient dans la loi, le règlement ou la procédure, pour obtenir telle ou telle autorisation. Il y a un deuxième axe important sur lequel je souhaite vous interpeller : celui de votre aptitude à débloquer des moyens. Il faut ouvrir des lignes budgétaires sur ces thématiques et notamment sur l'ingénierie du vivant - sur lequel nous sommes assez bons en France. Nous allons atteindre un stade où c'est la gestion de la complexité qui fera la différence. La complexité vient de la montagne d'informations que nous donnent la génomique et toutes ces biopuces : traditionnellement, la France possède de bons mathématiciens et de bons théoriciens de l'information pour arriver à extraire du sens de tout cela. Je ne suis pas certain que nous ayons gagné voire mené cette première bataille sur les biopuces et le génome : en revanche, nous serons présents pour la prochaine, et nous avons vraiment des chances de la gagner ou en tout cas de prendre une position très forte dans ce domaine. L'ouverture de lignes budgétaires sur cet axe et la reconnaissance de ces thématiques d'ingénierie du vivant et d'ingénierie génomique, ne serait-ce qu'en la faisant apparaître dans la nomenclature, me paraît être la première chose que vous pouvez faire. Cette action peut paraître symbolique, mais elle ne l'est pas car elle amène à sa suite des conséquences budgétaires extrêmement importantes. C'est un phénomène de levier. La seconde chose est que le soutien doit être fort et pérenne. Un certain nombre de mesures structurelles visant à favoriser l'investissement dans notre société est essentiel. Ce qui a été dit est malheureusement très vrai : aujourd'hui, le carburant des sociétés de biotechnologie est bien l'investissement en capital. Nous sommes sur des projets à risques, à long terme, et qui nécessitent un investissement d'une grande intensité et qui doit être sur une période de temps à l'échelle de ce que sont les essais cliniques. Tout ce qui peut être de nature à mobiliser l'épargne - la France a le deuxième taux d'épargne derrière les Japonais - sera favorable. Mais aujourd'hui cette épargne ne va pas dans les PME innovantes françaises. Je peux témoigner d'un certain nombre d'exemples : notre principal concurrent - pour une fois, les Français sont en avance et les Américains nous suivent - lève de l'argent pour nous rattraper. Il s'agit entre autre d'argent venant de l'assurance-vie française ! Notre concurrent vient donc en Europe, rachète des entreprises, les détruit et les délocalise en Californie. Nous résisterons mais un certain nombre d'acteurs européens vivent cela : les épargnants de leur pays préfèrent donner de l'argent aux Américains qui vont délocaliser les industries de ce pays. Nous devons nous interroger sur les moyens de mobiliser cette épargne. Voici quelques années, un engagement formel avait été pris devant le ministre de l'industrie et des finances de l'époque (M. Sarkozy) par les dépositaires de l'assurance-vie de placer 4 % dans les PME innovantes. Il n'en est rien aujourd'hui et pourtant ces gens bénéficient d'un privilège fiscal énorme, qui profite essentiellement aux industriels américains et chinois - des statistiques sauront mieux que moi étayer ce propos. Du point de vue de l'industriel que je suis aujourd'hui, je dois vous dire que vous avez une occasion devant vous, que nous avons une quantité d'atouts, et que nous sommes en position de mener quelques-unes - pas toutes - des batailles importantes qui vont se présenter. Nous avons besoin que ce soutien soit fort, efficace et surtout pérenne. Vous avez dans vos mains deux leviers : celui de la ligne budgétaire, et la possibilité de mobiliser l'épargne. M. Alain Claeys : Avez-vous eu des contacts avec l'Agence pour l'innovation ? M. David Sourdive : Je vais être très franc avec vous. L'Agence pour l'innovation est aujourd'hui composée de trois personnes qui répondent très difficilement au téléphone, qui signalent que l'agence est en train de se structurer, et qui, constatant que nous sommes une PME, indiquent que cela tombe bien dans la mesure où l'agence s'est engagée à mettre quelques fractions de % de son argent pour les PME, mais qu'il faut venir avec un très grand groupe. Comme M. Pouletty l'a dit précédemment, il n'y a plus qu'un très grand groupe dans la santé en France, qui n'est pas très favorable aux biotechnologies. Nous essayons de trouver un moyen de structurer quelque chose de la dimension qui conviendrait à l'A2I à travers les pôles de compétitivité. C'est l'outil que nous allons utiliser. M. Alain Claeys : Etes-vous intégré dans un pôle de compétitivité ? M. David Sourdive : Cellectis est non seulement intégrée mais fait partie des fondateurs de Meditech, dont elle est administrateur et membre du bureau exécutif. Il n'empêche qu'aujourd'hui, les interactions avec l'A2I sont complexes. Le dispositif que l'A2I veut mettre en œuvre n'est même pas encore approuvé par Bruxelles, où il est seulement déposé pour examen. Si j'ai bien compris, il s'agit de très gros projets, or dès qu'il y a plus de 25 millions d'euros mis sur la table, le traitement se fait au cas par cas et il faut retourner à Bruxelles. On nous envoie donc des signaux extrêmement confus et pas très positifs aujourd'hui pour des PME innovantes. Je rappelle que l'innovation dans la santé se fait pour une part significative dans les entreprises de biotechnologie, une part très importante des médicaments aujourd'hui en développement clinique est issue des biotechnologies - pour ne pas dire la majorité. Alors, dire que l'A2I réserve une « petite part » de son argent aux PME est paradoxal. M. Alain Claeys : Merci M. Sourdive. Je donne la parole à M. Christian Pinset. M. Christian Pinset : Je vous remercie de m'avoir invité et je remercie M. Sourdive d'avoir essayé de donner un élan d'enthousiasme, que je vais tenter d'illustrer. M. Alain Claeys : Je n'ai pas trouvé les chercheurs pessimistes ce matin. M. Christian Pinset : Peut-être est-ce comme la météo : « variable » ! Je vais vous raconter l'histoire d'un scientifique qui « ronronnait » et qui a décidé de construire une entreprise de biotechnologie, avec l'idée sous-jacente d'essayer de trouver le meilleur moyen de faire la preuve du concept que la thérapie cellulaire est non seulement quelque chose de possible mais que cela peut être possible industriellement. D'une certaine manière, cela oblige à une réflexion différente de celle menée dans la recherche académique, et qui consiste à essayer de trouver la conjonction entre une pathologie pour laquelle on pourrait entrevoir une thérapie cellulaire, un produit qui puisse soigner cette pathologie et une alternative au produit qui existe déjà. Cela est relativement délicat. Je vais essayer de vous montrer que l'on peut construire des produits de thérapie cellulaire pour des indications auxquelles on ne pense pas immédiatement. En terme de thérapie cellulaire, on pense souvent aux maladies rares ou qui mettent en jeu le pronostic vital. Ce qui nous intéresse est de développer la thérapie cellulaire pour des maladies qui ne mettent pas en jeu le pronostic vital mais le pronostic au sens de la dignité de l'être humain. Nous sommes en train de lancer un produit dont nous avons commencé l'essai clinique en mai avec quatre patients traités contre l'incontinence urinaire. Pourquoi avons-nous choisi cette pathologie ? Lorsque nous avons fait des tours auprès des investisseurs, tous étaient effarés de nos propositions et s'étonnaient que nous proposions une thérapeutique innovante et très chère dans une indication qui ne menaçait pas le pronostic vital. Nous avons essuyé de la surprise et parfois du dédain de la part de ces investisseurs. Nous avons gardé le cap en particulier grâce aux aides de l'Etat, que je remercie à cette occasion, pour essayer de construire cette preuve du concept. Le marché de l'incontinence urinaire est extrêmement important - il y a environ 3 millions d'incontinents urinaires en France, et la gravité de cette incontinence est très variable. C'est une affection pour laquelle il y a peu d'alternatives thérapeutiques, en particulier chez l'homme. Chez ce dernier, cette pathologie fréquente représente 20 % des suites du cancer de la prostate. Lorsque j'ai examiné les histoires cliniques de nos quatre premiers patients, j'ai été moi-même surpris du fait qu'il s'agissait de personnes qui allaient relativement bien et qui se sont soudainement retrouvées incontinentes. Pour ces patients, les seules alternatives sont les couches ou le sphincter artificiel : l'éventail thérapeutique est donc réduit. Dans ce contexte, nous avons pensé que nous pouvions réparer le sphincter de manière relativement simple. Il s'agit d'une thérapeutique autologue : un morceau de muscle du patient prélevé au niveau de l'épaule est traité en culture selon un procédé semblable à celui de Myosix, caractérisé et réinjecté par une intramusculaire simple en péridurale. C'est relativement simple à mettre en place et cela peut fonctionner. J'espère que cela pourra rapporter pour notre société. A votre question sur les endroits où nous avons rencontré des soucis, je vous répondrai que nous nous attendions à certains problèmes d'ordre technique : cela fait partie de notre métier de scientifique. Je pensais rencontrer des soucis réglementaires et, là, j'ai été très surpris. Je crois que c'est M. Pouletty qui disait que les choses se passaient bien avec l'AFSSAPS. En effet, en discutant et en avançant ensemble, nous faisons la réglementation avec l'AFSSAPS. Cette agence est une bonne spécificité française, car si elle est un frein, elle nous impose des normes qui sont très importantes pour aller ensuite sur le marché. Nous avons surtout rencontré des soucis d'ordre économique. Il est relativement difficile de trouver des investissements en France, en particulier dans le premier tour. Nous avons réussi une opération miraculeuse. Si cette présente réunion s'était tenue voici un an, je n'y aurais pas assisté car nous étions dans une situation extrêmement délicate et je me demandais si nous n'allions pas devoir licencier le personnel. Nous avions les autorisations et nous pouvions commencer les essais cliniques, mais nous n'avions absolument pas les moyens de le mettre en œuvre. Ceci était un drame car les gens travaillant avec moi risquaient de perdre leur emploi et parce que cela était désespérant du point de vue du montage du projet. Parce que nous étions proches d'un essai clinique, parce que nous commencions à penser qu'il pourrait y avoir un produit et que le marché de l'incontinence urinaire était important, nous avons réussi à mettre des contacts en place, et en particulier à faire une alliance avec une petite société française très intéressée à l'innovation et qui est notre partenaire HRA Pharma. Cette société a mis sur le marché la pilule du lendemain (Norlevo). Cette alliance nous a permis d'obtenir des fonds et également toute la richesse technique (direction médicale, construction d'essais cliniques) permettant d'entrevoir cet essai sous un autre angle et avec un autre type de compétences. Nous sommes beaucoup plus « heureux » maintenant. Nous sommes dans une situation où nous devons mêler deux dimensions, l'économie sur laquelle je ne reviendrai et l'essai clinique. Faire un essai clinique consiste à la fois à vouloir être audacieux en proposant des choses qui n'ont pas été faites, et dans le même temps à être vigilant. Le fait de gérer ces deux capacités n'est pas forcément facile. Je me suis « jeté dans la mare » sans avoir aucune expérience industrielle. J'ai mené sereinement ma carrière de scientifique jusqu'à ce que je n'aie plus envie de ronronner en tant que directeur de recherche. C'est cette expérience que j'essaie de vous faire partager : si on vous donne les moyens de pouvoir être audacieux tout en restant vigilant, il y a vraiment un avenir, et pas simplement en France pour la thérapie cellulaire. Je pense très sincèrement que nous avons un des meilleurs modèles pour montrer que l'on peut faire la preuve d'un concept dans une pathologie extrêmement répandue et handicapante. Depuis que nous avons établi cette alliance industrielle, nous sommes dans des conditions satisfaisantes pour pouvoir entrevoir l'avenir, non seulement en terme de thérapie autologue mais aussi en terme de réflexion sur les thérapies cellulaires du futur, notamment pour disposer de produits allogéniques de thérapie cellulaire. M. Alain Claeys : M. Vilquin ? M. Jean-Thomas Vilquin : Ma remarque ne porte pas directement sur les brevets mais sur le fait qu'il faut harmoniser les conceptions de brevets. Il faudra également harmoniser la réglementation au niveau européen pour la thérapie cellulaire. Nous avons actuellement de la chance en France avec l'AFSSAPS, qui est une des agences qui réalise le travail le plus fouillé et le plus approfondi. Lorsque l'on a obtenu une validation de l'AFSSAPS, on peut l'avoir plus facilement dans les autres pays européens. Néanmoins, à chaque fois que l'on veut aller dans un autre pays, on doit passer par une agence réglementaire. Une harmonisation est donc nécessaire : peut-être est-elle en cours. Dans notre cas, avec Philippe Ménasché, nous avons un essai international en cours. Nous avons pu réaliser immédiatement des cellules en France parce que cela était déposé à l'AFSSAPS, mais nous avons dû repasser devant toutes les agences des pays européens. Par ailleurs, c'est le manque de visibilité à court terme qui fait reculer les investisseurs. Ils ont peu d'indication de fiabilité et d'efficacité mais ils ne savent pas non plus ce que va leur rapporter le produit. Il serait important de mener une réflexion sur le mode de remboursement de l'utilisation des produits de thérapie cellulaire, qu'ils soient seuls ou associés à des prothèses ou des produits d'ingénierie tissulaire. C'est cela qui va leur permettre d'investir. Ma troisième remarque est optimiste : ce qui intéresse Philippe Ménasché est de pouvoir injecter des cellules dans le cœur à l'aide d'une seringue. A la limite, le contenu de la seringue sur le plan clinique ne l'intéresse pas : il est intéressé sur le plan scientifique de savoir à quoi correspondent ces cellules. Tous les développements périphériques sont communs aux cellules ES et aux cellules adultes. On fera un cathéter pour injecter des cellules de la même façon, qu'il s'agisse de cellules ES modifiées, devenues adultes et différenciées, ou de cellules souches adultes directement. Il y a une complémentarité. Les développements tournant autour des cellules ES ou des cellules souches adultes sont les mêmes pour les types cellulaires. Ce qui profite à l'un peut profiter à l'autre. C'est ce qui se passe également entre nous, n'est-ce pas ? M. Philippe Ménasché : Je sais tout de même ce qu'il y a dans la seringue ! M. David Sourdive : Il faut clairement insister sur un aspect : les technologies d'ingénierie de cellules et d'ingénierie du vivant ont des applications à long terme en thérapie régénérative, mais elles n'ont pas que ces débouchés. C'est ce qui a permis à des investisseurs de s'impliquer dans des projets où il y a un marché immédiat. L'opportunité dont je vous ai parlé se trouve dans les applications industrielles : Marc Peschanski pourra vous donner un exemple concret de ce que l'on peut faire aujourd'hui dans ce domaine. Il ne faut pas se limiter en considérant que le problème se posera dans 10 ou 20 ans : le problème existe aujourd'hui. Nous avons des parts importantes de ce potentiel de croissance à saisir immédiatement ! Le vivant est présent dans bien des compartiments ! Nous n'allons pas attendre, comme la révolution chimique au XXème siècle, que les occasions soient passées pour nous décider à utiliser du vivant pour arrêter de faire de la chimie ou faire quelque chose que la chimie ne sait pas faire. Il y a une application immédiate et les investisseurs peuvent y aller. Cellectis correspond à une levée de 16 millions d'euros avec des investisseurs danois et français. En la matière, il faut élargir le champ et non se limiter aux seules visions de la médecine régénérative. Mme Siobhán Yeats : Je voudrais seulement dire que le système de brevets n'est pas là pour faire plaisir aux fonctionnaires de l'Office européen des brevets ! Il est là pour rendre service au public et aux entreprises et pour trouver cet équilibre entre les demandes du public et les demandes des entreprises. Nous vous écoutons : s'il y a des problèmes avec la loi, nous menons bien sûr une réflexion. Si je peux me permettre, c'est également le devoir des politiciens de faire des lois claires et acceptables pour tout le monde. Le fait de réfléchir sur des questions fondamentales de la société ne devrait pas être le travail de l'Office européen des brevets. Il faudrait faire la loi et ensuite inclure ces questions dans la loi. Nous allons poursuivre ces réflexions dans l'Office et en dehors de l'Office, et nous allons écouter tous ceux qui discutent avec nous. Ce travail est difficile, nous essayons de travailler avec la loi dont nous disposons. Si elle est incorrecte, il faut la modifier, et ce n'est pas aux Offices de faire cela. Il vaut mieux conserver une loi assez générale : nous avons une loi générale des brevets qui date de plus de 100 ans et qui a bien servi à la communauté. M. Alain Claeys : Nous n'allons pas vous faire supporter les hésitations des politiques parfois sur des textes législatifs. S'il n'y a plus d'interventions, je vous propose d'aborder la dernière table ronde. Avant cela, je voudrais pour ceux qui nous rejoignent résumer en quelques mots ce qu'ont été nos débats depuis ce matin, dont je me félicite de la richesse. Tout d'abord, il y a une demande unanime - et je crois compréhensible - pour que les décrets d'application de la loi puissent être publiés le plus rapidement possible, d'autant que j'ai appris hier qu'il y avait des bouleversements à l'Agence de la biomédecine. Sa directrice devait être présente aujourd'hui, et elle m'a indiqué hier qu'étant sur le départ elle ne pouvait pas assister aux débats. Le Comité ad hoc terminant ses travaux, il n'instruira plus de dossier. L'Agence de la biomédecine doit donc être le plus rapidement possible opérationnelle. Vous êtes tous d'accord sur ce constat. La deuxième chose évoquée porte sur la possible ambiguïté dans la rédaction de l'article 25 de la loi de bioéthique. Je l'ai entendu, sans porter de jugement sur le fond : interdiction de recherche sur l'embryon, moratoire de cinq ans, analyse des programmes de recherche en fonction de leur vocation thérapeutique « sous réserve que d'autres techniques ne le permettent pas ». Des clarifications sont nécessaires, et je pense que les décrets d'application devront être les plus clairs possibles. A travers vos interventions, le législateur s'est rendu compte de ce qui relevait aujourd'hui du stade de la recherche fondamentale et des perspectives thérapeutiques. Je crois qu'il y a une confusion parfois dramatique pour nos concitoyens, car on leur laisse croire des choses fausses. C'est le rôle du législateur d'éviter le sensationnel et d'être très scrupuleux sur l'avancée des recherches. Vos interventions successives nous ont permis d'y voir beaucoup plus clair. L'autre chose qui a été dite, et qui a je crois été le nœud de la discussion en fin de la matinée, est de ne pas opposer un centre de recherches travaillant sur des cellules souches adultes et un centre travaillant sur des cellules souches embryonnaires. Les uns et les autres ont été très clairs là-dessus. Un point ne concerne pas directement le débat qui nous occupe aujourd'hui, mais qui est important pour la mobilisation des moyens. C'est la complexité des procédures dans ce domaine. Le directeur général de l'Inserm et le responsable du CNRS des sciences du vivant qui étaient présents ce matin nous ont expliqué ce qu'était leur budget dans le domaine des cellules souches. Ils nous ont bien indiqué qu'il fallait trouver une articulation avec la nouvelle agence qui a été créée : c'est un sujet de réflexion et de préoccupation que doivent examiner les responsables publics. Ceci est également vrai avec l'Institut du Cancer : si ce dernier, à travers des canceropôles, met des moyens sur telle ou telle équipe, il faut qu'il y ait une articulation car cette équipe est très certainement liée à l'Inserm ou au CNRS. D'autre part, l'aspect européen a été évoqué, et j'insiste beaucoup sur la difficulté rencontrée aujourd'hui par nos équipes pour participer activement ou utilement à des appels d'offres européens. Nous devons avoir cela en tête. En tant que rapporteur de cette étude, je ne manquerai pas de le mentionner fortement. Nous avons également abordé en fil conducteur ce que certains appellent le clonage à visée scientifique, le clonage à visée thérapeutique ou, pour reprendre l'expression de M. Claude Sureau, la transposition nucléaire. Quelles sont les perspectives ? La tendance dominante ce matin, pour les différents intervenants, a été de dire, tout en expliquant - et je crois que cela est important - ce qui se passe réellement dans le monde et non pas en fantasmant sur telle ou telle découverte qui aurait lieu, que cette technique devra à un moment ou à un autre être autorisée en France. Vous avez bien fait de mentionner, en tant que chercheurs, que la condamnation dans la loi actuelle du clonage dit « thérapeutique », mis presque sur le même plan que le clonage dit « reproductif », pose un certain nombre de difficultés. Nous allons consacrer cette dernière table ronde au clonage scientifique (ou au clonage thérapeutique), en mentionnant un sujet d'actualité que plusieurs intervenants ont abordé, à savoir le don des ovocytes. Table ronde n° 5 Le clonage scientifique : quelles perspectives ? M. Alain Claeys : Je vais présenter les derniers intervenants : Messieurs Daniel Aberdam, directeur de recherche à l'Inserm, Alain Fischer, professeur de médecine, directeur de l'Unité 429 de l'Inserm (hôpital Necker-Enfants malades) et membre de l'Académie des sciences, Bertrand Jordan, directeur de recherche au CNRS, conseiller à Marseille-Nice Génopole, Axel Kahn, directeur de recherche à l'Inserm et membre du Comité de Pilotage de cette étude, Marc Peschanski, directeur de recherche à l'Inserm, Didier Sicard, président du Comité national consultatif d'éthique, et Claude Sureau, président honoraire de l'Académie nationale de médecine, membre du Comité consultatif national d'éthique. Je donne la parole à Daniel Aberdam. M. Daniel Aberdam, directeur de recherche à l'Inserm : J'ai déjà fait part de quelques notions que je considère comme importantes, et je vais reprendre celles qui ont été dites au cours de la journée. Il faut absolument, impérativement ne pas prendre davantage de retard supplémentaire comme nous l'avons fait dans le passé : il ne faut pas avoir d'a priori, et considérer que les techniques qui sont impossibles aujourd'hui, ne le seront pas forcément demain. Cela ne doit pas être une raison pour freiner une décision législative. Nous l'avons bien vu lorsque dans les années 2001-2002 on a opposé les cellules somatiques aux cellules souches embryonnaires. Certains ont estimé que les cellules souches adultes pouvaient faire au moins aussi bien que les cellules souches embryonnaires et que l'on pouvait laisser de côté ces dernières. Un retard a été pris dans la décision de légiférer et les décrets ne sont toujours pas appliqués pour la dérivation des nouvelles lignées. Je crois que Jacques Hatzfeld a suffisamment insisté sur les non-raisons de retarder encore la dérivée de lignées à partir de diagnostics préimplantatoires. Comme le disait René Frydman, il s'agit de déchets opératoires et a priori la discussion est très différente du statut de l'embryon. Le débat sur le statut de l'embryon a toujours lieu et nous n'en parlerons pas. Tout ce qui a trait au clonage ou à ce que l'on appelle à présent la transposition nucléaire - je pense que ce terme est davantage correct - sera évidemment extrêmement utile comme modèle cellulaire. Nous avons suffisamment insisté aujourd'hui pour éviter systématiquement de donner de faux espoirs à court et moyen terme en matière de thérapie. La transposition nucléaire est indispensable pour avoir des modèles cellulaires qui permettront de comprendre des mécanismes et d'avoir des modèles de pathologie, dont nous ignorons les bases moléculaires et génétiques et les causes des dysfonctionnements. Je suis davantage concerné par les maladies auto-immunes directement liées à la biologie cutanée pour lesquelles des modèles cellulaires seraient très importants à partir de transposition nucléaire. C'est naturellement encore plus vrai pour les maladies neurodégénératives ou autres. Je pense que des spécialistes interviendront sur ce sujet. Je préfère laisser la parole à ceux qui sont directement concernés par cette évolution de la loi. M. Alain Fischer, professeur de médecine, directeur de l'Unité 429 de l'Inserm (hôpital Necker-Enfants malades), membre de l'Académie des sciences : Je ne suis pas certain qu'il y ait encore beaucoup de choses à dire. Vous avez largement abordé les questions qui concernent la transplantation nucléaire - qui est mon terme personnel : je suis d'accord pour ne pas utiliser le terme de clonage thérapeutique. Aujourd'hui, nous pouvons raisonnablement dire qu'il y a un intérêt potentiel à cette technique. Daniel Aberdam vient à l'instant de rappeler la génération de cellules souches à partir du transfert nucléaire et provenant de matériel de cellules pathologiques. Un fibroblaste de la peau de n'importe quel individu est potentiellement susceptible d'être utilisé. M. Alain Claeys : Pouvez-vous nous donner votre vision de ce qui se passe au niveau international, par rapport aux pays où le « clonage thérapeutique » est autorisé ? M. Alain Fischer : Je ne suis pas certain d'être le mieux placé pour donner cette image. Laissez-moi ne pas répondre tout à fait à votre question. Je suis certain que d'autres intervenants savent mieux que moi quelle est la situation internationale dans le domaine de la recherche sur la transplantation nucléaire. Il y a un intérêt majeur autour de la génération de cellules pathologiques embryonnaires à partir de laquelle on peut mener des travaux absolument fondamentaux au sens propre du terme, mais également au sens figuré car il s'agit de modèles de développement thérapeutique ultérieur. Nous avons besoin de ce matériel dans d'énormes champs de la médecine des maladies génétiques et pas uniquement celle qui a été évoquée à l'instant. Il y a également l'éventualité que ces cellules présentent un jour un intérêt thérapeutique, même s'il faut être honnête et dire que cela est plus qu'incertain et très lointain. Il y a tout de même la notion de compatibilité pour les antigènes majeurs d'histocompatibilité. La question sur laquelle nous devons nous arrêter n'est pas « pourquoi êtes-vous finalement arrivés à la conclusion qu'il faudra l'autoriser ? », mais « dans la mesure où il faudra l'autoriser dans l'avenir, qu'est-ce qui empêche de ne pas l'autoriser aujourd'hui ? ». Y a-t-il des freins objectifs ? Pendant longtemps, un des freins - qui à mon avis était partiellement acceptable - était de considérer que ce n'était en gros pas faisable. Dans ce cas, pourquoi autoriser quelque chose qui n'est pas faisable ? Aujourd'hui, nous savons que c'est clairement réalisable, dans des conditions encore difficiles et avec une efficacité relativement faible, qui s'est apparemment améliorée de manière sensible en l'espace d'un petit nombre d'années et qui va probablement encore s'améliorer. Cet argument tombe donc à mon avis. Le deuxième argument est de dire que l'on génère des cellules qui ont une potentialité de vie ce qui fait revenir sur le débat classique qui n'est pas propre aux transferts nucléaires. Ce même débat a eu lieu à propos des embryons, aussi je ne pense pas qu'il faille l'évoquer spécifiquement à ce niveau. Le troisième argument consiste à dire que cette technique est potentiellement dangereuse car à côté de bénéfices éventuels de nature scientifique ou médicale, elle est susceptible d'être utilisée pour le clonage reproductif. On peut discuter cet argument car je pense que sur le plan scientifique, il y a aujourd'hui des notions connues sur les problèmes d'empreintes qui font que cela est loin d'être évident. Même si l'on acceptait cet argument, je pense qu'il n'est pas raisonnable de le mettre en avant. Par définition, un développement scientifique est neutre : il n'est ni positif, ni négatif. Il faut ensuite réglementer de telle manière que l'on favorise le développement socialement « utile » et en évitant un développement que la société, à juste titre, ne souhaite pas. Je pense qu'il s'agit d'une discussion d'un autre niveau. Le quatrième argument, évoqué ce matin, et qui à mon avis est le seul à mériter une attention sérieuse sur cette question, porte sur le don d'ovocyte. Il y a un vrai problème qui mérite réflexion et régulation. Dans la mesure où il existe déjà des circonstances médicales aujourd'hui, où des dons d'ovocytes sont autorisés, on doit pouvoir trouver un cadre réglementaire strict permettant ce don, en évitant, au moins dans notre pays, les risques de dérive vers des pratiques inacceptables de pression morale, de pression financière, de commerce... Il me semble que cette question est la seule qui mérite vraiment une attention importante, mais ne paraît pas insoluble. J'ai donc envie de dire qu'il faut autoriser le transfert nucléaire, et le plus rapidement possible, évidemment dans des conditions d'encadrement très strictes. En ce qui concerne votre question sur l'international, je ne suis sûrement pas le mieux placé pour y répondre. Au-delà de ce qui se passe en Corée avec les aléas actuels qui jettent probablement une ombre sur cette situation, je fais allusion aux questions d'éthique sur le don des ovocytes, sur lesquelles je n'ai pas d'information particulière. Je crois qu'une activité de recherche avance en Grande-Bretagne. Des équipes américaines - notamment à Boston - travaillent sur ces sujets avec des fonds privés et avancent assez sérieusement. Je ne suis pas capable de faire une liste exhaustive, mais des équipes de recherche travaillent sur ce sujet et ont ou auront à court terme le savoir-faire pour développer des lignées de diverses natures et qui seront très utiles à un très grand nombre de domaines de la rechercM. Bertrand Jordan, directeur de recherche au CNRS, conseiller à Marseille-Nice Génopole Je vous remercie de me donner l'occasion de m'exprimer. Je ne suis pas intervenant dans le domaine de la transposition nucléaire ou du clonage scientifique, mais plutôt observateur et vulgarisateur. Je vais essayer de prendre un peu plus de recul. Deux choses me paraissent frappantes dans ce domaine. Tout d'abord, la progression rapide et dans le même temps l'imprévisibilité des recherches. Il y a dix ans, si on nous avait posé la question de savoir si le clonage reproductif de mammifère était possible, on aurait probablement presque tous répondu non. Un an après, Dolly est née ! Voici deux ou trois ans, après le clonage reproductif d'un certain nombre d'animaux, nous avons eu des résultats publiés dans d'excellentes revues qui montraient qu'apparemment, le clonage de primates serait beaucoup plus difficile que le clonage d'autres mammifères, et que vraisemblablement, le spectre du clonage reproductif ou éventuellement « thérapeutique » humain s'éloignait, ou qu'en tout cas nous avions plus de temps pour y réfléchir. Un peu plus d'un an après ces articles, le premier article de l'équipe de Hwang montrait qu'elle arrivait bel et bien par transfert ou transposition nucléaire à obtenir des blastocystes humains et dans un cas à dériver des lignées de cellules ES. Un an plus tard, des travaux beaucoup plus avancés ont été publiés : cette équipe était cette fois partie de cellules de malades et avait obtenu 11 lignées à partir de blastocystes. Nous avons donc été démentis plusieurs fois sur des avancées qui paraissaient exclues et qui se sont réalisées. Cela ne signifie pas que tout ce que nous considérons comme impossible aujourd'hui deviendra possible demain. Il y a des contre-exemples : des avancées médicales ont paru à portée de main et ont mis beaucoup plus de temps qu'on ne le pensait à se réaliser. C'est le cas de la thérapie génique que l'on imaginait à portée de main il y a 20 ans. Elle a été beaucoup plus longue à déboucher qu'on ne le pensait et elle ne concerne encore pour le moment que quelques cas. Tout ce domaine est extrêmement mouvant et cela a bien sûr beaucoup d'implications sur les aspects législatifs et sur la nécessité d'une réactivité rapide de la législation par rapport à l'avancée des recherches. C'est un point qui me paraît frappant dans ce domaine. L'autre point, et nous l'avons vu tout au long de la journée, est de constater à quel point il y a une interférence entre la recherche, l'éthique, la politique et l'industrie, qui sont extraordinairement mêlées dans ce secteur, plus que dans beaucoup d'autres. Par exemple, le problème de l'origine des ovocytes est réel. Il me semble que, probablement, le bruit créé autour de la provenance des ovocytes dont s'est servie l'équipe coréenne n'est pas uniquement motivé par les questions éthiques que cela peut poser. Il semble que cette équipe ait utilisé les ovocytes d'au moins une personne participant à l'équipe de recherche et signataire de l'article. Ceci paraît incorrect car cette personne peut avoir été mise sous pression de participer au travail de recherche. Si l'histoire se limite à cela, ce n'est quand même pas un scandale, scientifique et moral de toute première grandeur qui justifie que l'on mette M. Hwang au pilori. Derrière cela, il semble qu'il y ait des aspects économiques, politiques et de concurrence scientifique qui incitent sans doute à donner à cette affaire plus d'importance qu'elle n'en a. Un autre exemple est celui de la question des cellules souches adultes. Nous en avons discuté ce matin de façon un peu vive, mais finalement tout à fait équilibrée, en s'écoutant et en se comprenant. Si l'on examine la presse américaine, la question des cellules souches adultes est devenue complètement politique. Dans l'état actuel des choses, l'affirmation selon laquelle on peut leur faire faire tout ce que l'on peut espérer faire faire aux cellules souches embryonnaires est fausse. Elle est pourtant largement utilisée dans des débats politiques sur la discussion de telle ou telle loi à la Chambre des représentants ou au Sénat. Dans ce secteur de la transposition nucléaire, il me paraît extrêmement important d'essayer de bien séparer ce qui relève du domaine de la réalité scientifique et ce qui relève du domaine de la politique, de l'industrie. Il faut essayer d'avoir une législation et des modes de réglementation qui tiennent compte de l'état de l'opinion à un moment donné, qui peuvent éventuellement restreindre les possibilités de recherches, et qui, dans le même temps, soient capables de prendre en compte les développements et de s'adapter à l'avancée de la recherche. M. Axel Kahn, directeur de recherche à l'Inserm, membre du Comité de pilotage : Selon le vieux principe qu'il vaut mieux tout d'abord rappeler l'état des lieux avant que de porter un jugement éthique ou moral sur ce qu'il s'agit de faire, je vais rappeler l'état des lieux au niveau national et au niveau scientifique. Tout d'abord, dans la perspective thérapeutique, il n'y a pour moi pas de doute que la médecine régénératrice basée sur un transfert de cellules progressera et est appelée à un certain avenir, éventuellement brillant, que ces cellules soient dérivées de cellules souches somatiques ou bien de cellules souches embryonnaires. Actuellement, des essais cliniques concernant pas moins d'un millier de malades, ou en tout cas plusieurs centaines, sont en cours avec différentes populations de cellules progénitrices ou de cellules souches somatiques. Outre ce qui vous a été présenté pour le cœur, à l'heure actuelle des essais sont menés au Japon sur la cirrhose du foie, aux Etats-Unis, au Japon et en Corée, sur des conséquences neurologiques d'accidents cardiovasculaires, sur ce que vous a présenté Christian Pinset... L'intérêt de tout cela est que ces résultats seront dépouillés et que dans un ou deux ans, nous saurons ce qu'il faut en penser et quels progrès en matière thérapeutique on pourra en obtenir chez l'homme. Il n'y a pas encore à proprement parler d'essais thérapeutiques utilisant des cellules souches embryonnaires mais il y en aura, je l'espère bientôt, dans la perspective que Philippe Ménasché vous a présenté ce matin. Il n'y a pas de raison de penser que les cellules dérivées de cellules souches embryonnaires, compte tenu de l'extraordinaire multiplicité des types cellulaires que l'on peut obtenir, ne seront pas à un niveau de sécurité tel que l'on puisse raisonnablement lancer d'importants essais cliniques. Les problèmes à surmonter sont de trois ordres, certains l'étant déjà. Parmi ces difficultés rémanentes, on trouve d'une certaine façon quelques « bonnes surprises ». Il s'agit tout d'abord de s'assurer de la non tumorigénicité de ces cellules - car lorsqu'elles ne sont pas différenciées elles sont tumorigènes - ou éventuellement de pouvoir s'en préserver en introduisant un gène qui permettrait de détruire des cellules qui deviendraient tumorales (il s'agit d'une des perspectives développées). Ensuite, il s'agit de comparer sur le long terme la fonction de ces cellules dérivées in vitro de cellules souches embryonnaires à des cellules différenciées dans un champ morphogène in vivo. Même si elles semblent souvent équivalentes, cela mérite d'être vérifié. Il faut également examiner quelle est leur durabilité après transfert. Enfin, le troisième élément à prendre en compte est celui de la tolérance immunologique : il s'agit là, en général, d'allotransplantation lorsque l'on parle de cellules souches dérivées d'embryons surnuméraires. Ici, il y a plutôt de bonnes surprises. Nous nous attendions à des réactions de rejet de greffe tout à fait classiques. Nous ne pouvons pas encore dire que les connaissances sont stabilisées, mais les bonnes surprises sont que très singulièrement, il semble que les cellules souches embryonnaires disposent d'un certain privilège immun. Plusieurs résultats expérimentaux le montrent, dont ceux de Philippe Ménasché, et ce de la manière la plus étonnante. Contre toute attente, et même dans des conditions de xénotransplantation, il y a une tolérance tout à fait singulière à ces cellules. Voilà à peu près où nous en sommes pour ce qui est des visées thérapeutiques. Où en sommes-nous pour ce qui est des transplantations nucléaires et de l'obtention de cellules souches embryonnaires à partir d'embryon obtenues par transfert de noyau ? Vous connaissez les résultats obtenus par les Coréens. Les questions importantes qui se posent portent tout d'abord sur l'origine des ovocytes. A terme, on imagine que pourront être utilisés des ovocytes qui ne seraient pas prélevés après hyperstimulation hormonale de femmes et ponction ovarienne par voie endovaginale qui est habituellement faite pour prélever des ovocytes, mais que l'on pourrait obtenir après différenciation maîtrisée in vitro de cellules souches embryonnaires. Ceci fournirait des ovocytes en théorie en nombre illimité. De fait, il y a trois ans, on a montré que les cellules souches embryonnaires, dans des conditions particulières, pouvaient se différencier en des cellules ayant de nombreuses caractéristiques d'ovocytes. Une année après, on est parvenu à obtenir des cellules ayant beaucoup de caractéristiques de spermatozoïdes, par différenciation maîtrisée in vitro de cellules souches embryonnaires. Ce matériel doit encore être testé et il ne peut être aujourd'hui utilisé - et je ne sais pas quand il le pourra - car les spermatozoïdes ne sont pas fécondants et que les ovocytes-like (les cellules de type ovocytaire obtenus) ne nécessitent pas d'être fécondés ou activés pour commencer à se diviser. Ils effectuent un développement spontané parthénogénétique. Des travaux complémentaires doivent donc être menés. Il y a une possibilité que demain ces cellules soient obtenues en très grandes quantités, ce qui lèverait une difficulté majeure aujourd'hui. Ce n'est pas le cas à ce jour. Aujourd'hui, la fabrication d'embryon par transfert de noyau somatique continue à reposer sur l'obtention d'ovocytes. Quelles que soient les évolutions, il est bien évident qu'il faudra faire extraordinairement attention aux conditions dans lesquelles ce matériel est obtenu. Même si les collègues coréens ont considérablement amélioré la technique et s'ils montrent que nous avons des chances d'obtenir une lignée à partir d'une dizaine d'ovules, il n'empêche que pour des recherches nombreuses et importantes, le besoin en ovules sera énorme et les conditions dans lesquelles ils seront obtenus sont d'un intérêt considérable et doivent être précisées. L'obtention de cellules souches embryonnaires à partir d'embryons clonés a d'évidents intérêts scientifiques. Ces derniers ont déjà été exposés et sont principalement de deux ordres. Le premier est de travailler sur la « reprogrammation » : il s'agit du phénomène par lequel il y a une reprogrammation d'un noyau somatique, initialement programmé pour faire tout autre chose qu'un développement embryonnaire et dont le programme est effacé et reprogrammé chez l'homme. C'est un sujet scientifique intéressant : compte tenu des spécificités d'espèces, ceci peut être réalisé chez différentes espèces de mammifères dont les primates et l'homme. Le deuxième ordre d'intérêt consiste à obtenir des cellules souches embryonnaires à partir desquelles on pourra développer des cellules différenciées qui seront caractéristiques de différents états pathologiques. Le jour où nous les maîtriserons, nous pouvons imaginer obtenir des cellules pancréatiques pour une maladie comme le diabète. Aujourd'hui, on ne sait pas encore le faire mais on le saura probablement lorsque les techniques s'amélioreront. De même, il sera possible d'obtenir des cellules nerveuses pour suivre l'évolution des troubles caractéristiques d'une maladie dégénérative nerveuse. Le plus intéressant sera peut-être, lorsque cela sera parfaitement maîtrisé, d'utiliser de telles cellules à des fins de criblage moléculaire, c'est-à-dire à des fins pharmacologiques. Comme cela a été dit, je confirme totalement que les perspectives d'utiliser de telles cellules à des fins directement thérapeutiques sont à ce jour incertaines et lointaines. C'est la raison pour laquelle on peut hésiter à parler - même si c'est un bon terme - de transfert de noyau somatique ou bien de clonage à visée scientifique. Il est certain que le terme de clonage thérapeutique est un mauvais terme, qui doit être abandonné car il est mystificateur. Il n'y a d'une certaine manière pas besoin d'avancer l'intérêt thérapeutique pour justifier de l'intérêt à permettre cela. Le doute essentiel qui fait que cette méthode est incertaine vient du fait qu'il ne s'agit pas ici de traiter des maladies rares. Il ne s'agit pas de maladies génétiques, même du type de celles qu'Alain Fischer a traitées avec succès. On parle ici de maladies frappant des dizaines ou des centaines de millions de personnes : infarctus du myocarde, maladie d'Alzheimer.... Si à chaque fois que l'on soigne un malade, même avec la meilleure des techniques, il faut commencer par obtenir des ovocytes, créer un embryon cloné, isoler les cellules, les caractériser, vérifier qu'elles ne sont pas pathogènes, ...cela sera certainement difficile. Il faut espérer que d'autres méthodes seront mises au point et seront de ce point de vue plus commodes. Sans doute, les méthodes les plus probables et réalistes consistent à dériver des cellules souches embryonnaires, si tant est que persiste un réel problème d'incohérence immunitaire, mais peut-être aurons-nous une réelle bonne surprise, à savoir que ces cellules seront tellement bien tolérées que nous n'aurons pas besoin de trop faire attention à l'incompatibilité de lignées allogéniques. Dans la mesure où il y a de très nombreux embryons surnuméraires, comme on le fait avec des greffes de moelle, nous pourrons obtenir de très grandes quantités de cellules souches embryonnaires, caractérisées pour les antigènes d'histocompatibilité dans le groupe HLA et s'en servir comme matériel de départ pour tout malade ayant des groupes tissulaires équivalents. L'avantage de cela est que cette méthode se rapproche d'un médicament : les produits sont placés dans des ampoules et envoyés d'un endroit à un autre du monde. Il est même possible, en fonction des maladies les plus fréquentes à soigner, de commencer à dériver le jour où nous saurons le faire toute une série de ces cellules pancréatiques, hépatiques, cardiaques, dopaminergiques... qui seront caractérisées pour leurs fonctions, typées pour les groupes HLA, mises en ampoules scellées et stériles et prêtes à l'emploi de telle sorte que l'on puisse approcher des concepts de médicament cellulaire. C'est ce que l'on peut espérer si l'on veut qu'effectivement cette thérapeutique soit accessible à un nombre croissant de personnes. Pour terminer, quelle est ma position personnelle par rapport à l'évolution de la loi ? Je faisais partie de ceux, très rares, qui n'étaient initialement pas favorables à ce que la loi permît cette expérience passant par la fabrication d'embryons clonés, et ceci pour deux raisons principales. Je m'en suis expliqué maintes fois, il n'y a donc pas de secret sur ce point. J'étais tout d'abord choqué par la stratégie de lobbying présentant les possibilités thérapeutiques comme une évidence face à laquelle on ne pouvait que déférer, mobilisant éventuellement les associations de malades. Pour que le débat pût se développer, il m'a semblé important de rétablir de ce point de vue la situation. Je n'ai en revanche jamais nié l'intérêt scientifique de cette méthode. Ensuite, le problème des ovocytes et la crainte que j'avais que la mise au point de la technique d'obtention d'embryons par transfert de noyau somatique donne la recette à tous ceux qui veulent cloner des enfants (clonage reproductif auquel je suis tout à fait opposé), faisaient que pour moi la balance penchait du côté de la non-autorisation de la recherche. Il n'y a pas de doute que les choses ont changé d'une certaine manière, non pas parce que mon analyse était fausse mais parce que les choses se développent telles qu'elles devaient se développer. Une équipe coréenne tout à fait remarquable a mis au point et a publié partout dans le monde cette technique : celle-ci est à présent accessible à tous ceux qui souhaitent l'utiliser, pour quoi que ce soit, et dans quelque pays que ce soit, quelles que soient ses lois. Je ne soupçonne certainement pas mes collègues en France de fabriquer des embryons par transfert somatique pour cloner des bébés. Cette situation est réellement nouvelle et justifie tout à fait que le débat soit relancé. M. Marc Peschanski, directeur de recherche à l'Inserm : Il est étonnant que je sois dans un duo avec Axel Kahn et que j'indique que je suis parfaitement d'accord avec lui, alors que pendant des années nous nous sommes écharpés sur cette loi. Celle-ci, finalement, nous interdit de travailler sur le transfert nucléaire pour de nombreuses années, sauf si nous avons la chance qu'elle soit réexaminée et que nous puissions véritablement recommencer à parler de sciences et de possibilités de réaliser une recherche dans les conditions habituelles de celle-ci, relatives à l'encadrement et à l'habilitation, et au travers de la justification de nos programmes et du contrôle qui s'exerce sur la réalité de ce que nous faisons. J'ai défendu cette position de principe depuis le départ, qui nous guide en général quelles que soient les activités que nous menons. Il y en a bien d'autres qui tombent sous le coup de la loi lorsque nous les pratiquons en dehors de ce cadre ou sur le trottoir devant notre laboratoire ! Lorsque j'avais l'autorisation de le faire, il était possible dans mon laboratoire de travailler sur la cocaïne ou le LSD. Si j'étais sorti sur le trottoir avec ces produits dans ma poche, je serais allé comme tout le monde en prison. Je suis heureux qu'Axel Kahn soit devenu un défenseur de cette position et que nous puissions recommencer à parler d'une seule voie dans la communauté scientifique pour demander que ces règles soient respectées et que de nouveau la société nous donne en même temps l'encadrement et l'habilitation pour des travaux de recherche dans lesquels nous respectons par définition le principe du respect de l'être humain vivant ou destiné à l'être, être différent de cellules ayant un patrimoine génétique humain mais qui ne sont pas destinées à autre chose qu'à être éliminées. Sur le transfert nucléaire, je prendrai le point de vue du scientifique qui explique pourquoi il en a besoin et à quoi il va essayer de s'en servir si jamais il a la possibilité de le faire, c'est-à-dire si la loi est modifiée. Le transfert nucléaire est le moyen de donner à une lignée de cellules souches embryonnaires un patrimoine génétique connu - pas forcément entièrement -, mais en tout cas qui possède des caractéristiques génétiques qui nous intéressent. Ceci nous intéresse par exemple parce que le patrimoine génétique est celui d'un malade atteint d'une affection liée à une mutation génétique (maladie monogénique) ou atteint d'une maladie plus répandue et lourdement biaisée par le patrimoine génétique qu'il porte, par exemple la psychose maniaco-dépressive, l'autisme, et d'autres maladies qui sont rattachées de manière importante au patrimoine génétique mais qui ne sont pas rattachées à un gène spécifique. La possibilité de créer une lignée de cellules souches embryonnaires qui posséderaient ce patrimoine génétique identifié nous permettrait également de posséder - du moins en théorie - en quantité infinie des cellules de tout phénotype, à tout moment de leur développement ou de leur différenciation, sur lesquelles nous pourrions étudier les mécanismes de la maladie en question et, éventuellement, essayer de les combattre. Nous aurions au travers de cela un modèle pathologique sur lequel nous pourrions, comme l'industrie le fait avec des cibles chimiques, utiliser une cible biologique qui soit une vraie cible pathologique reproduisant entièrement par définition le patrimoine génétique aboutissant à la maladie en question. Ceci permettrait d'utiliser ces centaines de milliers ou ces millions de molécules qui sont dans les placards de l'industrie pharmaceutique, et qui en sortent lorsque l'industrie trouve des cibles sur lesquelles les tester, et dont les résultats sont finalement importants. Par exemple, les traitements anti-rétroviraux utilisés aujourd'hui pour lutter contre le virus du SIDA proviennent de ce criblage, c'est-à-dire de l'essai systématique de centaines de milliers de molécules sur une cible repérée, à savoir ici une des cibles venant du rétrovirus. En ce qui concerne les cellules souches embryonnaires ainsi porteuses d'une mutation, on pourra nous objecter l'existence du diagnostic préimplantatoire dont nous avons parlé ce matin. Effectivement, les lignées de cellules souches embryonnaires dérivées d'embryons écartés au moment du diagnostic préimplantatoire peuvent être disponibles dans les laboratoires - nous travaillons à Evry sur de telles lignées grâce à une première autorisation puis une seconde qui vient apparemment de nous être donnée par le Comité ad hoc - et nous permettent de commencer à travailler. Le diagnostic préimplantatoire est aujourd'hui ouvert à une trentaine de maladies monogéniques. Les spécialistes nous indiquent que ce chiffre pourra évoluer vers quarante ou cinquante maladies. Il y a aujourd'hui plusieurs milliers de maladies identifiées - on parle de 6 000 - qui sont liées à un défaut génétique de ce genre. Nous aurons donc toujours 5 950 et quelques maladies pour lesquelles nous n'aurons pas accès à un embryon par diagnostic préimplantatoire. Mais nous pouvons avoir accès à une lignée de cellules souches embryonnaires par transposition nucléaire à partir d'un malade identifié comme porteur de la maladie. Il y a donc là un véritable bénéfice de recherche et éventuellement à terme, quelque chose qui est à haut risque et qui ne peut être promis aujourd'hui - tout ce que nous pouvons promettre étant de travailler dessus -, à savoir de déboucher sur une thérapie. D'autre part, il y a également une utilisation industrielle autre mais évidente de ce type de cellules souches et de la transposition nucléaire : il s'agit du problème de la toxicologie prédictive, évoqué par David Sourdive. Aujourd'hui, les industriels de la pharmacie testent les médicaments, et ceux de la cosmétique leurs produits sur des modèles plus ou moins éloignés de la situation humaine. Pour des raisons diverses, il est extrêmement difficile aux industriels de la pharmacie d'aller tester l'effet de leurs molécules sur toutes les cellules de tous les tissus de l'organisme humain. De la même façon, pour la cosmétologie, il est relativement difficile d'examiner au long cours l'effet de pommades pour la peau et en particulier dans les systèmes bien organisés. Il est d'autant plus difficile d'envisager cela dans des conditions de patrimoine génétique non pathologique mais différent. Par exemple, une personne particulièrement sensible au soleil, même si elle n'est pas albinos, fera éventuellement une réaction à une pommade X. Dans ce cas, ceci aurait pu être prévu dans un essai de toxicologie prédictive qui aujourd'hui n'a pas de modèle. Au travers d'une transposition nucléaire à partir de quelqu'un présentant ces caractéristiques dans une lignée de cellules souches avec ensuite une différenciation vers un certain nombre de cellules formant la peau, un modèle aurait pu être testé par les industriels des cosmétiques. Il s'agit évidemment de marchés considérables. Le marché de la modélisation et celui de la toxicologie prédictive sont pour les industries pharmaceutiques et des cosmétiques actuellement de véritables bouchons qui bloquent le développement d'un grand nombre de produits. Le fait de posséder des modèles qui soient de véritables modèles humains sur lesquels tester ces médicaments ou ces produits cosmétiques est d'une importance considérable. Ces modèles sont d'une importance considérable également pour nous. Le fait que l'industrie pharmaceutique puisse correctement tester ces médicaments avant de les mettre sur le marché ou que les pommades qu'on s'applique sur la peau ne donnent pas forcément un urticaire géant a un intérêt thérapeutique, même si cela ne peut être inscrit tel quel dans la loi. J'ai souhaité présenter quelques exemples afin que nous ramenions les choses à leur réalité, afin que nous puissions, comme l'a dit Axel Kahn sur la science, les considérer comme des perspectives d'application. Bien évidemment, je ne promets pas cela pour demain. Simplement, la recherche appliquée, celle qui va vers ce type d'utilisation, doit être considérée dès maintenant. Il n'y a pas une recherche fondamentale sur les mécanismes qui devrait se faire immédiatement et une recherche appliquée qui se verrait repoussée par la loi afin de réfléchir ensuite aux applications. Ces deux recherches vont ensemble, fonctionnent en parallèle et en réalité se nourrissent l'une de l'autre. La loi, en imposant un objectif thérapeutique pour une pathologie grave aux demandes d'autorisation d'importation ou de dérivation de lignées de cellules souches embryonnaires, commet une erreur évidente qui va à l'encontre de la nécessité de la recherche fondamentale. Il ne faudrait pas à l'inverse dire qu'il y a d'abord une recherche fondamentale avant qu'il puisse y avoir une recherche appliquée : cela serait également faux. M. Alain Claeys : Avant de passer la parole à Messieurs Sicard et Sureau, je tiens à souligner que nous nous sommes parlés très directement depuis ce matin. A juste titre, vous avez parfois fait des reproches pertinents à la représentation nationale. Ces critiques ont été notamment judicieuses - et je les rejoins - sur un point de l'article 25 de la loi, à savoir que les protocoles de recherches sont acceptés s'ils ont des applications thérapeutiques. Je vous retourne la question. Pourquoi certains membres de la communauté scientifique - y compris des professeurs de médecine autour desquels se fait une importante publicité -, pour justifier la transposition nucléaire, parlent toujours de clonage thérapeutique ? En tant que parlementaire, je trouve scandaleux de dire qu'il y aura demain des applications thérapeutiques. J'en ai souvent discuté avec Axel Kahn : cela a été pour moi une des raisons qui me faisait m'interroger sur la transposition nucléaire. Pourquoi la communauté scientifique s'est-elle laissée aller au fait d'annoncer que les applications thérapeutiques étaient pour demain ? Je rejoins parfaitement ce que vient de dire Marc Peschanski. En tant que chercheurs, lorsque vous entendiez parler de clonage thérapeutique, cela ne vous a-t-il pas gêné ? M. Philippe Ménasché : Bien sûr que oui. Malheureusement ce terme de clonage thérapeutique est né voici quelques années lorsqu'on a voulu opposer le clonage reproductif à un clonage qui n'aurait pas une visée reproductive. Ce malheureux terme de clonage thérapeutique a été trouvé. Tous ceux qui travaillent vraiment dans le domaine des cellules souches ont depuis le début dit qu'il était absurde d'accoler cette épithète « thérapeutique » qui à ce jour n'était validée par aucun travail expérimental. Malheureusement, il sonne bien et il faut reconnaître que les médias ont amplifié le phénomène parce qu'il fait rêver. M. Alain Claeys : Il ne faut pas reprocher aux médias de transcrire ce qu'ils entendent de la bouche de chercheurs et de médecins reconnus qui publient des textes pas plus tard que ce week-end dans des journaux à grands tirages ! M. Philippe Ménasché : Je ne fais pas de reproche aux médias. Je dis simplement que ce terme faisant rêver, il est plus facilement amplifié, et il est ensuite extrêmement difficile - Axel Kahn, Marc Peschanski et Alain Fischer le savent bien - de faire machine arrière et d'expliquer en permanence ce que nous faisons. A ce jour, aucune expérience préclinique sérieuse n'a validé le fait que le clonage aurait véritablement des effets thérapeutiques. Une fois de plus, je ne crois pas que les gens qui travaillent dans ce domaine aient jamais prétendu que le clonage aurait des effets thérapeutiques. M. Alain Claeys : Il faut absolument éduquer la représentation nationale et lui expliquer chaque jour que la recherche fondamentale n'est pas honteuse ! M. Axel Kahn : Je souhaite apporter un petit détail. Je suis conseiller scientifique pour la biologie de l'Oréal. Pour ce qui est de tester des produits sur de la peau, il n'y a aucun problème : on peut créer de la peau d'africain, d'asiatique, d'albinos, etc., car les cellules souches cutanées sont bien connues. S'il y a bien une indication pour laquelle nous n'aurons pas besoin de cellules souches embryonnaires, ce sera pour fabriquer de la peau. La peau ainsi reconstruite est capable de bronzer, de présenter des réactions inflammatoires... Je suis d'accord avec Marc Peschanski pour tout le reste. Pour en revenir à votre question, dans la mesure où vous nous faisiez un reproche, je vais vous en faire un ! J'étais membre du Comité d'éthique jusqu'à il y a encore peu de temps, et je me souviens d'un jour où, étant l'un des orateurs à la tribune, je me trouvai à côté du Premier Ministre. Celui-ci a annoncé que la loi allait autoriser la fabrication de ces « cellules de l'espoir tellement prometteuses »... C'est à ce moment que je me suis senti très choqué, en me disant que quoi que l'on décide, tout était justifiable. Je suis profondément un homme de débat : pour que celui-ci ait lieu, il faut poser la question. Certes, les scientifiques sont coupables, mais il y a là un jeu à trois : scientifiques, politiques et médias. M. Hervé Chneiweiss : Je ne saurai que poursuivre dans la direction d'Axel Kahn. Hélas, nous sommes dans un courant utilitariste qui est né avec la génomique et la biologie à grande échelle, lorsque nos collègues américains ont lancé en 1969 le grand programme génome humain comme nouveau rêve après que l'homme ait mis un pied sur la Lune. Ils ne l'ont pas vendu en tant que connaissance du génome humain mais comme nouvelle frontière pour guérir le cancer. A partir de ce moment a eu lieu une sorte d'entraînement qui a fait que dans tout article scientifique, les auteurs commencent ou terminent en justifiant leur travail par une pathologie. Il y a également un jeu par rapport aux différentes représentations publiques, les médias ou les politiques, pour essayer de justifier cette idée sous-jacente qui traverse tous les partis politiques que la connaissance scientifique pure est quelque chose de noble mais qui ne mérite pas forcément d'aller au combat vis-à-vis de croyances morales profondément enracinées dans l'histoire d'un pays. Il est parfois apparu à certains plus aisé de défendre des positions utilitaristes. Quand, avec un certain courage, le Premier Ministre en question a utilisé les termes scientifiques appropriés, il a été « recadré » par certains scientifiques qui lui ont conseillé d'utiliser le langage commun. M. Alain Claeys : C'est comme cela que l'on écrit l'Histoire. M. Alain Fischer : Je suis naturellement d'accord sur le fait qu'un certain nombre d'expressions scientifiques ou de médecins ne soient pas vraiment acceptables et vendent à très court terme des progrès qui n'existent pas. Par contre, je ne suis pas absolument d'accord avec - si je l'ai bien comprise - l'interprétation que vous en faites, consistant à dire qu'après tout, puisque nous sommes dans un contexte où l'on nous raconte des « bobards », il n'y a du coup pas de raison de s'intéresser à ce sujet. M. Alain Claeys : Je vous arrête tout de suite. Je pense que qualifier de recherche fondamentale la transposition nucléaire suffit à la justifier. M. Alain Fischer : J'ai tout de même entendu que pendant un certain temps - et j'ai cru comprendre que cela a été pendant un moment la position d'Axel Kahn -, certains ont pensé que dans la mesure où on leur vendait des promesses qui n'étaient pas sérieuses, on ne pouvait considérer sérieusement cette approche. D'une certaine façon, ce raisonnement peut être acceptable, mais il n'est absolument pas spécifique à la transplantation nucléaire. Dans un domaine que je connais bien, la thérapie génique, nous avons entendu des propos au moins aussi scandaleux répétés un très grand nombre de fois : ce n'est pas pour autant que l'on a interdit la recherche sur la thérapie génique, heureusement ! Notre rôle de scientifique est bien évidemment de contrôler notre parole mais certaines expressions ont la vie dure. Ce qu'a dit Hervé Chneiweiss est assez juste sur la tendance à vouloir justifier de façon utilitaire toute recherche. Même si nous n'y arrivons pas toujours, c'est de notre devoir que d'essayer de l'éviter. C'est aussi de votre devoir, à vous politiques et aux médias, de faire le tri et néanmoins de considérer dans un domaine en discussion ce qu'il peut avoir d'intéressant. M. Didier Sicard, président du Comité national consultatif d'éthique : Je préside le Comité mais je ne le représente pas ici. Il s'est d'ailleurs exprimé, il y a 3 ou 4 ans, de façon majoritaire en faveur du clonage. J'adresserais aux scientifiques le même reproche que vous, en les renvoyant au Parlement, car vous avez inscrit dans la loi, et je partage l'avis de Marc Peschanski, que l'obligation de travailler sur l'embryon est d'une finalité thérapeutique. Le Parlement est le premier à avoir inscrit l'obligation thérapeutique pour travailler sur l'embryon. Nous sommes face à une qualité d'hommes de sciences, à des découvertes coréennes et à la nécessité des entreprises de biotechnologie de recevoir de l'argent et d'investir. Qu'est-ce que l'éthique dans ce domaine ? Elle est un bruit de fond qui se voudrait porteur d'une vertu et d'une vérité humaine. Il est évident que l'éthique permet simplement de s'interroger. Fondamentalement, la réussite d'un clonage thérapeutique sur le plan industriel constitue un paradoxe car même si nous réussissons à le contourner, le marché ovocytaire ne pourra pas être régulé. Car à partir du moment où cela deviendra un procédé thérapeutique pour les diabétiques, les parkinsoniens, dès l'instant où la thérapie cellulaire deviendra une thérapie antibiotique et anti-hypertensive, les femmes feront inévitablement l'objet d'une marchandisation. Autrement dit, les lois ne pourront rien faire. Nous constatons dans le monde que la marchandisation du vivant est mille fois plus importante qu'en France, qui est encore l'un des rares pays à l'avoir interdite de façon très formelle. Nous avons conscience de ce débat sémantique. Car si nous avions annoncé d'emblée que le transfert nucléaire était destiné à mieux comprendre le début de certaines maladies métaboliques ou génétiques et le vivant, je pense qu'il n'y aurait pas les obstacles de la société avec l'évacuation totale d'une réflexion sur l'ovocyte que l'on essaie de cadrer au moyen de lois ou en créant des cellules souches qui donneront des ovocytes afin d'éviter l'utilisation des femmes. Il est inquiétant de constater que la plupart des pays, notamment d'Asie, ne considèrent pas ce sujet comme un problème. Or j'ai le sentiment qu'il demeure justement un problème existentiel de l'humanité. Considérer que ce n'est pas une question éthique, ou que l'on la balaye de façon légale ou opportuniste, continue à susciter l'inquiétude. Si l'on arrive à faire en sorte que le clonage devienne un procédé industriel pour cribler des antibiotiques, des antiviraux, des antihypertenseurs ou pour essayer des crèmes, autrement dit que la thérapie cellulaire devienne la voie royale de la thérapeutique, son succès serait alors confronté à une impasse. Il reste tant de travaux à effectuer sur la thérapie cellulaire avec les cellules souches embryonnaires et adultes. A partir du moment où le clonage est destiné à réparer une personne et pas dix, on peut imaginer que la thérapie, par ses propres cellules, a un avenir important. J'ai le sentiment que le diagnostic pré-implantatoire est encore réduit, mais il n'est pas nécessaire de travailler sur les 4 953 maladies génétiques, d'emblée. On est d'ailleurs frappé par la hâte de certains à annoncer, coûte que coûte, des résultats. La thérapie cellulaire ne doit pas s'enfermer dans un projet thérapeutique à visée universelle pour la plupart des maladies humaines, ce qui me paraît effrayant dans son concept même alors que d'autres voies prometteuses existent. Effectivement, l'éthique est dérisoire dans ce domaine. Je ne supporte pas le discours de José Bové sur les OGM et l'on pourrait me faire le même reproche en me disant que j'agite une sorte d'apocalypse humaine à travers cette réflexion. Mon sentiment reflète une angoisse irréversible car il faut agir avec prudence. Les deux technologies ne sont pas uniquement centrées sur ces questions. M. Claude Sureau : Tout d'abord, je ne suis pas aussi angoissé que Didier Sicard mais plutôt d'un naturel optimiste. Je vais rappeler un événement qui s'est produit en 2002. Un grand nombre de personnes ici présentes participaient à un colloque sur les lignées cellulaires organisé conjointement par les Académies des sciences, représentée par Jean-François Bach, et de médecine, que je représentais. Ce colloque a débouché sur une prise de position extrêmement forte et nette des deux Académies en faveur de la recherche sur les cellules embryonnaires obtenues à partir d'embryons surnuméraires de fécondation in vitro, mais également en faveur du transfert nucléaire. Pourquoi l'Académie de médecine, réputée très conservatrice, s'est-elle déterminée dans ce sens ? Outre l'intérêt général et le bénéfice thérapeutique pour certaines pathologies, évoqués ce matin, elle a retenu l'amélioration des conditions de la procréation médicalement assistée et de la médecine de l'embryon. Car dans une certaine mesure on a complètement oublié ce qui était l'objet de la loi de 1994, l'amélioration des conditions de la procréation grâce à la procréation médicalement assistée. Cet élément a disparu alors qu'en matière de congélation d'ovocytes, des avancées très importantes restent à obtenir. La médecine de l'embryon, quant à elle, a évolué et bénéficié de l'impulsion de Georges David qui insiste sur la nécessité de la développer. Elle est, selon ses termes, un concept fondamental, pour nous, accoucheurs qui sommes conscients d'une dérive dramatique de la société. En effet, en raison des moyens d'investigations qui se renforcent, les diagnostics de pathologies réelles ou supposées de l'embryon et du fœtus nous contraignent de plus en plus à devenir des « éboueurs de la société ». On nous demande de le faire et nous sommes critiqués pour cela. C'est un drame qui ne pourra que s'aggraver car les méthodes de diagnostic iront en se renforçant. Le seul moyen d'éviter cette dérive est de renforcer la recherche sur l'embryon et les cellules embryonnaires, position que nous avons prise à l'Académie. La médecine de l'embryon n'est pas qu'une partie de la médecine en général appliquée à l'embryon car elle contient une spécificité qui, afin que la recherche soit efficace et puisse progresser, suppose une destruction d'embryons. Les embryons comme les fœtus sont pour nous comme des patients mais nous admettons l'éventualité de les détruire. Concrètement, nous sommes favorables à la recherche sur les embryons qu'ils soient surnuméraires parce qu'ils n'ont pas de destinée, ou pathologiques car ils doiventt être détruits. A cet égard, un point reste à préciser sur les plans philosophique, idéologique voire religieux. Les opinions sont tout à fait divergentes. Un personnage très important de l'Académie me faisait remarquer qu'un embryon in vitro, ce n'est pas plus qu'un globule rouge. Je ne partage pas l'avis de ceux qui pensent que les embryons in vitro ne sont que des amas cellulaires sans consistance ni dignité. J'estime, à titre personnel, contrairement à l'avis du Conseil constitutionnel du 27 juillet 1994, que l'embryon in vitro possède une valeur ontologique personnelle importante. Je pense personnellement qu'il est légitime de passer outre à la protection que la loi lui accorde selon l'article 16 du Code civil pour des raisons reconnues comme valables, qu'il s'agisse de raisons individuelles, dans le cas de grossesses extra-utérines par exemple, ou de raisons collectives comme la recherche. D'autre part, nous sommes tout à fait favorables à la transposition nucléaire et nous insistons sur sa nécessité. Nous avons manqué de chance car l'évolution vers la transposition nucléaire à visée thérapeutique est survenue après le clonage reproductif. Imaginons qu'en 1997 le clonage reproductif ne soit pas découvert avec la brebis Dolly, qu'il ait fallu attendre dix ans et, qu'entre temps, nous ayons découvert des possibilités d'application du transfert nucléaire. Personne ne se serait alors posé la question de l'assimilation des deux concepts. Enfin, je ne crois pas avoir trouvé dans la loi une allusion à la recherche, pourtant nécessaire à mon sens, sur les gamètes et les ovocytes. Cela nous serait pourtant extrêmement utile. Nous pourrions envisager, dans ce cadre, la modification du patrimoine génétique de ces gamètes. Même si l'article 13 de la Convention d'Oviedo s'y oppose, l'article 16.4 du Code civil reconnaît la légitimité de cette recherche dans la mesure où elle permettrait d'éviter l'apparition d'anomalies congénitales. L'embryon pour la recherche est un sujet épineux qui ébranle la communauté des scientifiques et l'ensemble des parlementaires et juristes. Est-il légitime d'interdire de produire des embryons pour la recherche ? C'est ce qu'envisagent les lois, en accord avec l'article 18 de la convention d'Oviedo, et qui me paraît une erreur conceptuelle et majeure, d'ailleurs évitée par les Anglais plus pragmatiques. Hors la tératologie expérimentale à écarter, supposons que nous fassions des progrès en matière de congélation des ovocytes et que nous envisagions leur fécondation par la suite. Nous obtiendrions un embryon, que nous ne transférerions pas parce qu'il pourrait être pathologique, mais que nous étudierions. Qu'aurions-nous fait d'autre qu'un embryon pour la recherche ? La loi contient des lacunes en ce sens que les Anglais ont évité. En contrepoint, nous nous sommes prononcés par la négative lorsque nous avons été consultés afin de recueillir notre approbation sur les décrets d'application de la loi en préparation. Nous déplorons en effet l'absence d'un paragraphe concernant les études qui ne portent pas atteinte à l'embryon mais qui sont susceptibles de déboucher sur un transfert de cet embryon. Il y aurait une utilité considérable, suivant un protocole parfaitement défini et sous surveillance extrêmement étroite, à encourager les progrès qui serviraient notamment à l'amélioration de la fécondation in vitro. S'agissant de la rareté des ovocytes, nous réussirons tôt ou tard à produire une meïose artificielle et à obtenir des gamètes artificiels créés à partir de cellules somatiques à n chromosomes. La situation sera alors fondamentalement modifiée car les stérilités définitives seront résolues et la querelle du clonage reproductif sera ainsi vidée de sa substance. M. Hervé Chneiweiss : La communauté scientifique et médicale ainsi que la représentation politique sont confrontées à la nécessité d'affronter la situation avec réalité et d'expliquer aux citoyens qu'elle a changé. Une proposition a été faite très récemment par un embryologiste célèbre, Rudolf Jaenisch, et reprise par un membre du Comité de l'éthique du Président des Etats-Unis. Il s'agit de rendre l'embryon in vitro non implantable, en ajoutant à la transposition nucléaire un gène siRNA, qui interdirait la possibilité d'implantation. Avons-nous vraiment besoin de cet artifice technique afin, comme l'évoquait Marc Peschanski, de respecter la législation et l'objectif scientifique ? Je ne l'espère pas et il nous faudra beaucoup de courage pour poursuivre notre projet scientifique et l'objectif de dériver des lignées. M. Alain Claeys : Le bureau de l'Assemblée nationale a décidé de confier cette étude à l'OPECST en raison de sujets encore en suspens dans la loi d'août 2004. S'agissant de cette loi s'imposant à tous, quelques urgences sont à traiter. D'abord, il faudra que les décrets d'application paraissent et ne complexifient un peu plus certains articles de la loi. Car si nous fermons totalement le jeu sur la notion de visée thérapeutique des projets scientifiques, nous risquons d'engendrer un système où plus aucun protocole de recherche ne serait accepté. Nous devrons veiller à ce que la publication des décrets se fasse rapidement et dans les meilleures conditions. D'autre part, je suis troublé par la situation de l'Agence de la biomédecine, dont je regrette grandement l'absence malgré la présence d'une représentante, Mme Ott. Il faut, au plus vite, qu'elle puisse instruire ces dossiers de recherche car il n'existe plus de structure capable de le faire actuellement. Ce serait un an de perdu pour certaines équipes. Enfin, ce n'est pas la règle législative mais l'environnement qui nous pose des problèmes pour participer aux appels d'offres européens ou pour la constitution de banques internationales de lignées de cellules souches. Nous devons donc apporter des précisions car c'est essentiel. Nos échanges ont aujourd'hui, non seulement pour les parlementaires mais aussi pour la presse, permis d'établir un état des lieux précis de ce que sont la recherche fondamentale et les espoirs thérapeutiques tout en replaçant les débats dans la réalité et non le fantasme. Je suis convaincu que si ce débat n'est pas partisan aujourd'hui, la représentation nationale pourra avancer. Cela doit se faire dans une transparence totale car il n'existe pas d'oppositions entre la représentation nationale et la communauté scientifique, ni avec les associations de patients. Par rapport aux avancées internationales, nous devrons, le moment venu, prendre nos responsabilités afin de franchir une nouvelle étape. L'Office travaillera le plus vite possible et nous souhaitons, grâce à ce rapport, apporter des réponses et en proposer à la représentation nationale car c'est elle qui décidera d'un certain nombre d'avancées en tenant compte de vos expériences et analyses, des positions des associations, du Comité d'éthique et des Académies. Merci. Annexe 1 : I. - Le titre V du livre Ier de la deuxième partie du code de la santé publique devient le titre VI et les articles L. 2151-1 à L. 2153-2 deviennent les articles L. 2161-1 à L. 2163-2. II. - Il est rétabli, dans le livre Ier de la deuxième partie du même code, un titre V ainsi rédigé : TITRE V RECHERCHE SUR L'EMBRYON ET LES CELLULES EMBRYONNAIRES Chapitre UNIQUE « Art. L. 2151-1. - Comme il est dit au troisième alinéa de l'article 16-4 du code civil ci-après reproduit : « Art. 16-4 (troisième alinéa). - Est interdite toute intervention ayant pour but de faire naître un enfant génétiquement identique à une autre personne vivante ou décédée. » « Art. L. 2151-2. - La conception in vitro d'embryon ou la constitution par clonage d'embryon humain à des fins de recherche est interdite. « Art. L. 2151-3. - Un embryon humain ne peut être ni conçu, ni constitué par clonage, ni utilisé, à des fins commerciales ou industrielles. « Art. L. 2151-4. - Est également interdite toute constitution par clonage d'un embryon humain à des fins thérapeutiques. « Art. L. 2151-5. - La recherche sur l'embryon humain est interdite. « A titre exceptionnel, lorsque l'homme et la femme qui forment le couple y consentent, des études ne portant pas atteinte à l'embryon peuvent être autorisées sous réserve du respect des conditions posées aux quatrième, cinquième, sixième et septième alinéas. « Par dérogation au premier alinéa, et pour une période limitée à cinq ans à compter de la publication du décret en Conseil d'Etat prévu à l'article L. 2151-8, les recherches peuvent être autorisées sur l'embryon et les cellules embryonnaires lorsqu'elles sont susceptibles de permettre des progrès thérapeutiques majeurs et à la condition de ne pouvoir être poursuivies par une méthode alternative d'efficacité comparable, en l'état des connaissances scientifiques. Les recherches dont les protocoles ont été autorisés dans ce délai de cinq ans et qui n'ont pu être menées à leur terme dans le cadre dudit protocole peuvent néanmoins être poursuivies dans le respect des conditions du présent article, notamment en ce qui concerne leur régime d'autorisation. « Une recherche ne peut être entreprise que si son protocole a fait l'objet d'une autorisation par l'Agence de la biomédecine. La décision d'autorisation est prise en fonction de la pertinence scientifique du projet de recherche, de ses conditions de mise en oeuvre au regard des principes éthiques et de son intérêt pour la santé publique. La décision de l'agence, assortie de l'avis du conseil d'orientation, est communiquée aux ministres chargés de la santé et de la recherche qui peuvent, lorsque la décision autorise un protocole, interdire ou suspendre la réalisation de ce protocole lorsque sa pertinence scientifique n'est pas établie ou lorsque le respect des principes éthiques n'est pas assuré. « En cas de violation des prescriptions législatives et réglementaires ou de celles fixées par l'autorisation, l'agence suspend l'autorisation de la recherche ou la retire. Les ministres chargés de la santé et de la recherche peuvent, en cas de refus d'un protocole de recherche par l'agence, demander à celle-ci, dans l'intérêt de la santé publique ou de la recherche scientifique, de procéder dans un délai de trente jours à un nouvel examen du dossier ayant servi de fondement à la décision. « Art. L. 2151-6. - L'importation de tissus ou de cellules embryonnaires ou foetaux aux fins de recherche est soumise à l'autorisation préalable de l'Agence de la biomédecine. Cette autorisation ne peut être accordée que si ces tissus ou cellules ont été obtenus dans le respect des principes fondamentaux prévus par les articles 16 à 16-8 du code civil. « L'exportation de tissus ou de cellules embryonnaires ou foetaux aux fins de recherche est soumise aux mêmes conditions que l'importation définie au précédent alinéa. Elle est subordonnée en outre à la condition de la participation d'un organisme de recherche français au programme de recherche international. « Art. L. 2151-7. - Tout organisme qui assure, à des fins scientifiques, la conservation de cellules souches embryonnaires doit être titulaire d'une autorisation délivrée par l'Agence de la biomédecine. « La délivrance de l'autorisation est subordonnée au respect des dispositions du titre Ier du livre II de la première partie du présent code, des règles en vigueur en matière de sécurité des personnes exerçant une activité professionnelle sur le site et des dispositions applicables en matière de protection de l'environnement, ainsi qu'au respect des règles de sécurité sanitaire. « En cas de non-respect des dispositions mentionnées au deuxième alinéa, l'Agence de la biomédecine peut, à tout moment, suspendre ou retirer l'autorisation. « L'Agence française de sécurité sanitaire des produits de santé est informée des activités de conservation à des fins scientifiques de cellules souches embryonnaires réalisées sur le même site que des activités autorisées par elle en application des articles L. 1243-2 et L. 1243-5. « Les organismes mentionnés au premier alinéa ne peuvent céder des cellules souches embryonnaires qu'à un organisme titulaire d'une autorisation délivrée en application du présent article ou de l'article L. 2151-5. L'Agence de la biomédecine est informée préalablement de toute cession. « Art. L. 2151-8. - Les modalités d'application du présent chapitre sont fixées par décret en Conseil d'Etat, notamment les conditions d'autorisation et de mise en oeuvre des recherches menées sur des embryons humains. » Annexe 2 : Le Premier ministre,
Vu le code civil, et notamment ses articles 16 à 16-8 ; Vu le code de la santé publique, et notamment ses articles L. 2151-5 à L. 2151-8 ; Vu le code des douanes ; Vu la loi n° 78-17 du 6 janvier 1978 relative à l'informatique, aux fichiers et aux libertés modifiée ; Vu la loi n° 2000-321 du 12 avril 2000 relative aux droits des citoyens dans leurs relations avec les administrations ; Vu la loi n° 2004-800 du 6 août 2004 relative à la bioéthique, notamment son article 37 ; Le Conseil d'Etat (section sociale) entendu, Décrète : Article 1 I. - Le titre V du livre Ier de la deuxième partie du code de la santé publique (dispositions réglementaires) devient le titre VI. II. - Le titre V du livre Ier de la deuxième partie du même code est ainsi rédigé : « TITRE V « RECHERCHE SUR L'EMBRYON ET LES CELLULES EMBRYONNAIRES « Chapitre unique « Section 1 « Art. R. 2151-1. - Sont notamment susceptibles de permettre des progrès thérapeutiques majeurs, au sens de l'article L. 2151-5, les recherches sur l'embryon et les cellules embryonnaires poursuivant une visée thérapeutique pour le traitement de maladies particulièrement graves ou incurables, ainsi que le traitement des affections de l'embryon ou du foetus. « Art. R. 2151-2. - Le directeur général de l'agence de la biomédecine peut autoriser un protocole de recherche sur l'embryon ou sur les cellules embryonnaires, après avis du conseil d'orientation, pour une durée déterminée qui ne peut excéder cinq ans. « Outre la vérification des conditions fixées à l'article L. 2151-5, l'agence de la biomédecine s'assure de la faisabilité du protocole et de la pérennité de l'organisme et de l'équipe de recherche. Elle prend en considération les titres, diplômes, expérience et travaux scientifiques du responsable de la recherche et des membres de l'équipe. En outre, l'agence de la biomédecine tient compte des locaux, des matériels, des équipements ainsi que des procédés et techniques mis en oeuvre par le demandeur. Elle évalue les moyens et dispositifs garantissant la sécurité, la qualité et la traçabilité des embryons et des cellules embryonnaires. « Art. R. 2151-3. - I. - Seuls peuvent obtenir l'autorisation de procéder à une recherche sur l'embryon : « 1° Les établissements publics de santé et les laboratoires d'analyses de biologie médicale autorisés à conserver des embryons en application de l'article L. 2142-1, ainsi que les établissements autorisés à pratiquer le diagnostic biologique effectué à partir de cellules prélevées sur l'embryon in vitro en application de l'article L. 2131-4 ; « 2° Les établissements et organismes ayant conclu une convention avec l'un au moins des établissements ou laboratoires mentionnés au 1°. Cette convention prévoit les conditions dans lesquelles l'établissement ou le laboratoire mentionné au 1° conserve et met à disposition des embryons au bénéfice de cet établissement ou organisme. La mise à disposition d'embryons n'est autorisée que pour la seule durée de la recherche. « II. - Seuls peuvent obtenir l'autorisation de procéder à une recherche sur des cellules embryonnaires: « 1° Les établissements et organismes poursuivant une activité de recherche et titulaires de l'autorisation de conservation des cellules souches embryonnaires à des fins scientifiques mentionnée à l'article L. 2151-7 ; « 2° Les établissements et organismes publics et privés poursuivant une activité de recherche ayant conclu une convention avec un établissement ou organisme mentionné au 1° dans laquelle ce dernier s'engage à « Art. R. 2151-4. - I. - Le consentement du couple, ou du membre survivant d'un couple, prévu à l'article L. 2151-5 est recueilli selon l'une des modalités suivantes : « 1° Lorsque le couple n'a plus de projet parental, le praticien agréé en application de l'article L. 2142-1-1 peut proposer aux deux membres du couple, ou en cas de décès de l'un d'entre eux, au membre survivant du couple, de consentir à ce que les embryons conservés fassent l'objet d'une recherche, après avoir été informés des possibilités d'accueil de ces embryons par un autre couple ou d'arrêt de leur conservation. Ils confirment leur consentement par écrit auprès de ce praticien à l'issue d'un délai de réflexion de trois mois. « 2° Après la réalisation du diagnostic biologique effectué à partir de cellules prélevées sur l'embryon in vitro, s'il s'avère que les embryons sont porteurs de l'anomalie recherchée, le praticien agréé en application de l'article L. 2131-4-2 pour la réalisation de ce diagnostic peut proposer aux deux membres du couple ou au membre survivant du couple de consentir par écrit à ce que ces embryons fassent l'objet d'une recherche dès lors qu'ils ne font plus l'objet d'un projet parental. « 3° Lorsque le couple consent à la mise en oeuvre d'une assistance médicale à la procréation auprès du praticien agréé en application de l'article L. 2142-1-1 pour la pratique de la fécondation in vitro, avec ou sans micro-manipulation, il peut lui être proposé, en application de l'article L. 2141-3, de consentir dans le même temps par écrit à ce que les embryons, qui ne seraient pas susceptibles d'être transférés ou conservés, fassent l'objet d'une recherche. « II. - Le responsable de la recherche doit pouvoir justifier à tout moment au cours de celle-ci qu'il s'est assuré de l'existence de ces consentements mentionnés au I. « Art. R. 2151-5. - Les embryons ne peuvent être remis au responsable de la recherche mentionné à l'article R. 2151-8 que par les praticiens agréés en application de l'article L. 2142-1-1 ou de l'article L. 2131-4-2. Ce responsable doit produire l'autorisation du protocole de recherche. Le praticien agréé lui remet le document attestant du recueil des consentements mentionné à l'article R. 2151-4. « La remise de cellules embryonnaires au responsable de la recherche par le titulaire de l'autorisation d'importation prévue à l'article L. 2151-6 ou de l'autorisation de conservation prévue à l'article L. 2151-7 s'effectue sur production des documents mentionnés au précédent alinéa. « Aucune information susceptible de permettre l'identification du couple ou du membre survivant du couple à l'origine des embryons faisant l'objet de la recherche ne peut être communiquée au responsable de la recherche. « Art. R. 2151-6. - La demande d'autorisation d'un protocole de recherche sur l'embryon ou sur les cellules embryonnaires est adressée au directeur général de l'agence de la biomédecine sous pli recommandé avec demande d'avis de réception ou déposée contre récépissé auprès de l'agence dans les mêmes conditions. Cette demande est accompagnée d'un dossier dont la forme et le contenu sont fixés par décision du directeur général de l'agence. « Le directeur général fixe également les périodes pendant lesquelles peuvent être déposés des dossiers de demande d'autorisation. La date de clôture de ces périodes fait courir le délai de quatre mois prévu ci-dessous. « Lorsque des pièces indispensables à l'instruction de la demande font défaut, l'avis de réception fixe le délai dans lequel ces pièces doivent être fournies. « Dans le délai de quatre mois suivant la date de clôture de la période au cours de laquelle a été déposé le dossier complet, le directeur général de l'agence de la biomédecine notifie à l'établissement ou à l'organisme demandeur la décision d'autorisation ou de refus d'autorisation. A l'issue de ce délai, l'absence de décision du directeur général vaut décision implicite de refus d'autorisation. « La décision du directeur général accordant l'autorisation de recherche fait mention du nom de la personne responsable de la recherche. Cette décision est publiée au Journal officiel de la République française. « Le directeur général de l'agence peut demander, par lettre recommandée avec demande d'avis de réception, toute information complémentaire, qu'il estime nécessaire à l'instruction du dossier d'autorisation. Il indique au demandeur le délai dans lequel il doit fournir ces éléments. Cette demande d'information complémentaire suspend le délai mentionné au quatrième alinéa. « Art. R. 2151-7. - La décision du directeur général et l'avis du conseil d'orientation sont transmis simultanément aux ministres chargés de la santé et de la recherche, qui disposent d'un délai d'un mois pour, s'ils l'estiment nécessaire : « 1° Suspendre ou retirer l'autorisation dans le respect d'une procédure contradictoire, en application du cinquième alinéa de l'article L. 2151-5 ; « 2° Demander un nouvel examen du dossier de demande d'autorisation, en application du sixième alinéa de l'article L. 2151-5, en cas de refus de l'agence de la biomédecine. « Art. R. 2151-8. - Toute recherche autorisée au titre de l'article L. 2151-5 est placée sous la direction d'une personne responsable désignée par la demande mentionnée à l'article R. 2151-6. « La personne responsable de la recherche adresse au directeur général de l'agence de la biomédecine un rapport annuel. Elle lui fait parvenir le rapport final de la recherche dès l'achèvement de celle-ci. Ces rapports contiennent en particulier les informations relatives à la destination des embryons et des cellules embryonnaires ayant fait l'objet du protocole, notamment à leur destruction. « Le directeur général de l'agence peut à tout moment demander à la personne responsable de la recherche de rendre compte de l'état d'avancement des travaux. « Art. R. 2151-9. - L'établissement ou l'organisme qui souhaite modifier un élément substantiel du protocole autorisé au titre de l'article L. 2151-5 doit déposer un nouveau dossier de demande d'autorisation. Ce dernier est instruit dans les mêmes conditions que la demande initiale. « Art. R. 2151-10. - En cas de violation des dispositions législatives ou réglementaires ou de prescriptions fixées par l'autorisation, cette dernière peut être suspendue à tout moment pour une durée maximale de trois mois par le directeur général de l'agence de la biomédecine, qui en informe le conseil d'orientation dans les meilleurs délais. L'autorisation peut également être retirée après avis du conseil d'orientation. La décision du directeur général est notifiée au titulaire de l'autorisation et communiquée aux ministres chargés de la santé et de la recherche. « Avant toute décision de suspension ou de retrait d'autorisation, le titulaire de l'autorisation est mis en demeure de mettre fin à ses manquements ou de présenter ses observations dans un délai imparti par le directeur général. « Art. R. 2151-11. - I. - Les établissements et organismes autorisés au titre des première et troisième sections du présent chapitre tiennent un registre des embryons et des cellules embryonnaires qu'ils détiennent. « Ce registre mentionne : « 1° L'organisme ayant fourni les embryons ou les cellules embryonnaires et leur code d'identification après anonymisation ; « 2° L'intitulé du protocole de recherche ; « 3° Le nom du responsable de la recherche ou de l'activité de conservation ; « 4° Le nombre d'embryons et de lignées de cellules embryonnaires faisant l'objet d'une « 5° Le nombre et la désignation de lignées des cellules souches embryonnaires conservées ou obtenues au cours de la recherche ; « 6° Les résultats des analyses concernant les marqueurs biologiques d'infection ; « 7° Le(s) lieu(x) de la recherche et de la conservation ; « 8° La destination des embryons et cellules embryonnaires : recherche, cession ou destruction. « La personne responsable de la recherche ou de la conservation est chargée de la tenue de ce registre. Elle veille à l'exactitude des informations qui sont consignées dans ce registre ainsi qu'à sa conservation dans des conditions de sécurité propres à en garantir l'intégrité et la confidentialité. « II. - L'agence de la biomédecine tient un registre national des embryons et cellules embryonnaires, qui comporte notamment : « 1° Les numéros d'autorisation et les noms des établissements ou organismes autorisés à réaliser des recherches ou à conserver des cellules souches embryonnaires ; « 2° Le nom du responsable de la recherche ou de la conservation ; « 3° L'intitulé du protocole de recherche ; « 4° Le nombre d'embryons et de lignées de cellules embryonnaires faisant l'objet d'une recherche et leur code d'identification ; « 5° Le nombre et la désignation de lignées des cellules souches embryonnaires conservées ou obtenues en cours de recherche ; « 6° Les résultats des analyses concernant les marqueurs biologiques d'infection ; « 7° Le(s) lieu(x) de la recherche et de la conservation ; « 8° La destination des embryons et cellules embryonnaires : recherche, cession ou destruction. « La personne responsable de la recherche ou de la conservation à l'occasion du rapport annuel prévu à l'article R. 2151-8 communique au directeur général de l'agence de la biomédecine les informations nécessaires à ce dernier pour tenir à jour ce registre national. « Le code d'identification attribué à chaque embryon, répertorié dans les registres mentionnés ci-dessus, et à chaque lignée de cellules embryonnaires qui en est dérivée, est établi et rendu anonyme selon le système de codage défini par décision du directeur général de l'agence, après avis de la Commission nationale informatique et libertés. « L'anonymisation de ce code a un caractère réversible afin, le cas échéant, d'accéder aux données permettant d'identifier les personnes à l'origine de l'embryon lorsqu'une finalité médicale ou de sécurité sanitaire l'exige. « Art. R. 2151-12. - Tout établissement ou organisme qui procède à des recherches sur les embryons ou sur des cellules embryonnaires est tenu de conserver pendant dix ans à compter de la fin de cette recherche le protocole prévu à l'article L. 2151-5, le document attestant le respect des conditions fixées à l'article R. 2151-4 ainsi que le rapport final de la recherche et le registre mentionné au I de l'article R. 2151-11. « Section 2 « Art. R. 2151-13. - On entend par tissus ou cellules embryonnaires ou foetaux au sens de la présente section : « - les tissus ou cellules embryonnaires ou foetaux prélevés ou recueillis après interruption de grossesse ; « - les cellules embryonnaires prélevées sur des embryons humains in vitro qui ont été conçus dans le cadre d'une assistance médicale à la procréation et qui ne font plus l'objet d'un projet parental. « Tout organisme qui importe ou exporte des tissus ou cellules embryonnaires ou foetaux mentionnés au présent article doit être en mesure de justifier qu'ils ont été obtenus dans le respect des principes fixés par les articles 16 à 16-8 du code civil, avec le consentement préalable de la femme ayant subi une interruption de grossesse ou du couple géniteur dans le cas d'une assistance médicale à la procréation, et sans qu'aucun paiement, quelle qu'en soit la forme, ne leur ait été alloué. « Art. R. 2151-14. - Seuls peuvent obtenir une autorisation d'importer ou d'exporter à des fins de recherche des tissus ou cellules embryonnaires ou foetaux, les organismes : « 1° Titulaires de l'autorisation de procéder à une recherche sur l'embryon et les cellules embryonnaires prévue à l'article L. 2151-5 ; « 2° Titulaires de l'autorisation de conserver des cellules souches embryonnaires prévue à l'article L. 2151-7 ; « 3° Ayant déposé un protocole de recherche concernant des tissus ou cellules embryonnaires ou foetaux prélevés ou recueillis après interruption de grossesse en application de l'article L. 1241-5. « Art. R. 2151-15. - Le directeur général de l'agence de la biomédecine autorise l'importation et l'exportation de tissus et cellules embryonnaires ou foetaux à des fins de recherche, après avis du conseil d'orientation. Cette autorisation est valable pour la durée d'une année. « Cette autorisation est délivrée pour chaque opération envisagée et comporte les informations mentionnées à l'article R. 2151-16. « Les dispositions des articles R. 2151-6, R. 2151-9, R. 2151-10 et R. 2151-12 s'appliquent aux autorisations prévues à la présente section. « Art. R. 2151-16. - Toute opération d'importation ou d'exportation à des fins de recherche, à l'exclusion du transit et de l'emprunt du territoire douanier à l'occasion d'un transfert entre deux autres Etats membres de la Communauté européenne, des tissus ou cellules embryonnaires ou foetaux définis à l'article R. 2151-13 est subordonnée à l'apposition sur le conditionnement extérieur des informations suivantes : « 1° La mention "tissus ou cellules embryonnaires ou foetaux ; « 2° La désignation des tissus ou cellules concernés ; « 3° L'usage auquel ces tissus ou cellules sont destinés ; « 4° Pour l'importation, le nom et l'adresse de l'organisme étranger fournisseur, de l'organisme autorisé à importer et du destinataire ; « 5° Pour l'exportation le nom et l'adresse de l'organisme autorisé à exporter et du destinataire. « Art. R. 2151-17. - Tout incident se produisant lors du transport des tissus et des cellules embryonnaires ou foetaux doit faire l'objet d'une déclaration au directeur général de l'agence de la biomédecine par le titulaire de l'autorisation d'importation ou d'exportation. « En cas d'incident susceptible d'affecter la sécurité sanitaire, le directeur général de l'agence de la biomédecine en informe immédiatement le directeur général de l'Agence française de sécurité sanitaire des produits de santé et le ministre chargé de la santé. « Section 3 « Art. R. 2151-18. - Tout organisme qui conserve des cellules souches embryonnaires à des fins scientifiques doit être en mesure de justifier qu'elles ont été obtenues dans le respect des principes fondamentaux prévus aux articles 16 à 16-8 du code civil et avec le consentement préalable du couple géniteur et sans qu'aucun paiement, quelle qu'en soit la forme, ne leur ait été alloué. Il doit pouvoir justifier qu'il s'en est assuré. « Art. R. 2151-19. - Le directeur général de l'agence de la biomédecine autorise la conservation de cellules souches embryonnaires, après avis du conseil d'orientation, pour une durée déterminée, qui ne peut excéder cinq ans. L'autorisation fait mention du nom de la personne responsable de l'activité de conservation. « Préalablement à la décision du directeur général, l'agence de la biomédecine évalue les conditions de mise en oeuvre de la conservation. « A cet effet, l'agence vérifie notamment que les conditions d'approvisionnement, de conservation des cellules souches embryonnaires présentent des garanties suffisantes pour assurer le respect des dispositions du titre Ier du livre II de la première partie du présent code, des règles en vigueur en matière de sécurité des personnes exerçant une activité professionnelle sur le site, et des dispositions applicables en matière de protection de l'environnement. « L'agence s'assure de la compétence de l'équipe chargée de la conservation. Elle prend en considération les titres, diplômes, expérience et travaux scientifiques des membres de l'équipe. En outre, l'agence de la biomédecine tient compte des locaux, des matériels, des équipements ainsi que des procédés et techniques mis en oeuvre par le demandeur. Elle évalue les moyens et dispositifs mis en oeuvre garantissant la sécurité, la qualité et la traçabilité des cellules souches embryonnaires. « Lorsque l'organisme demandeur d'une autorisation de conservation exerce simultanément sur le même site des activités prévues aux articles L. 1243-2 et L. 1243-5, le directeur général vérifie que l'organisme a prévu des procédures garantissant contre tout risque de contamination. « Art. R. 2151-20. - Les dispositions des articles R. 2151-6 et R. 2151-8 à R. 2151-12 s'appliquent aux autorisations prévues à la présente section. « Art. R. 2151-21. - Lorsqu'il retire une autorisation de conservation de cellules souches embryonnaires, le directeur général de l'agence de la biomédecine organise le transfert de ces cellules vers un autre organisme autorisé à les conserver. « En cas d'incident susceptible d'affecter la sécurité sanitaire, le directeur général de l'agence de la biomédecine en informe immédiatement le directeur général de l'Agence française de sécurité sanitaire des produits de santé. » Article 2 Les autorisations délivrées en vertu du décret n° 2004-1024 du 28 septembre 2004 relatif à l'importation à des fins de recherche de cellules souches embryonnaires, aux protocoles de recherche et à la conservation de ces cellules et portant application des dispositions de l'article 37 de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique sont maintenues jusqu'à leur échéance. A compter de la date de publication du présent décret, ces autorisations sont régies par les dispositions de ce dernier, à l'exception de celles des articles R. 2151-2, R. 2151-6, R. 2151-7 et R. 2151-19 du code de la santé publique. Article 3 Le décret n° 2004-1024 du 28 septembre 2004 relatif à l'importation à des fins de recherche de cellules souches embryonnaires, aux protocoles de recherche et à la conservation de ces cellules et portant application des dispositions de l'article 37 de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique est abrogé. Toutefois : - les demandes d'autorisation instruites, à la date de publication du présent décret, par le « comité ad hoc » prévu par l'article 37 de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique font l'objet d'une décision des ministres chargés de la santé et de la recherche dans les conditions prévues par cet article et par le décret n° 2004-1024 du 28 septembre 2004 pris pour son application ; - les demandes déposées devant le « comité ad hoc » et non encore instruites à la date de publication du présent décret sont transmises à l'agence de la biomédecine pour être instruites et faire l'objet d'une décision selon les règles fixées par le présent décret. Article 4 Le ministre de l'éducation nationale, de l'enseignement supérieur et de la recherche, le ministre de la santé et des solidarités et le ministre délégué à l'enseignement supérieur et à la recherche sont chargés, chacun en ce qui le concerne, de l'exécution du présent décret, qui sera publié au Journal officiel de la République française. Fait à Paris, le 6 février 2006. Dominique de Villepin Par le Premier ministre : Le ministre de la santé et des solidarités, Xavier Bertrand Le ministre de l'éducation nationale, de l'enseignement supérieur et de la recherche, Gilles de Robien Le ministre délégué à l'enseignement supérieur et à la recherche, François Goulard Annexe 3 : Article 19 I. - Le titre V du livre Ier de la deuxième partie du code de la santé publique devient le titre VI et les articles L. 2151-1 à L. 2153-2 deviennent les articles L. 2161-1 à L. 2163-2. II. - Il est rétabli, dans le livre Ier de la deuxième partie du même code, un titre V ainsi rédigé : « TITRE V « RECHERCHE SUR L'EMBRYON ET LES CELLULES EMBRYONNAIRES « Chapitre unique « Art. L. 2151-1. - Comme il est dit au troisième alinéa de l'article 16-4 du code civil ci-après reproduit : « "Art. 16-4 (troisième alinéa). - Est interdite toute intervention ayant pour but de faire naître un enfant, ou se développer un embryon humain, qui ne seraient pas directement issus des gamètes d'un homme et d'une femme." « Art. L. 2151-2. - La conception in vitro d'embryons humains à des fins de recherche est interdite, sans préjudice des dispositions prévues à l'article L. 2141-1-1. « Art. L. 2151-3. - Est autorisée la recherche menée sur l'embryon humain et les cellules embryonnaires qui s'inscrit dans une finalité médicale, à la condition qu'elle ne puisse être poursuivie par une méthode alternative d'efficacité comparable, en l'état des connaissances scientifiques. « Une recherche ne peut être conduite que sur les embryons conçus in vitro dans le cadre d'une assistance médicale à la procréation qui ne font plus l'objet d'un projet parental. Elle ne peut être effectuée, après un délai de réflexion de trois mois, qu'avec le consentement écrit préalable du couple dont ils sont issus, ou du membre survivant de ce couple, par ailleurs dûment informés des possibilités d'accueil des embryons par un autre couple ou d'arrêt de leur conservation. Les embryons sur lesquels une recherche a été conduite ne peuvent être transférés à des fins de gestation. Dans tous les cas, le consentement des deux membres du couple est révocable à tout moment et sans motif. « Une recherche ne peut être entreprise que si son protocole a fait l'objet d'une autorisation par l'Agence de la procréation, de l'embryologie et de la génétique humaines. La décision d'autorisation est prise en fonction de la pertinence scientifique du projet de recherche, de ses conditions de mise en _uvre au regard des principes éthiques et de son intérêt pour la santé publique. L'agence communique ces protocoles aux ministres chargés de la santé et de la recherche qui peuvent, conjointement, interdire ou suspendre la réalisation de ces protocoles, lorsque leur pertinence scientifique n'est pas établie ou lorsque le respect des principes éthiques n'est pas assuré. « En cas de violation des prescriptions législatives et réglementaires ou de celles fixées par l'autorisation, l'agence suspend l'autorisation de la recherche ou la retire. Les ministres chargés de la santé et de la recherche peuvent, en cas de refus d'un protocole de recherche par l'agence, demander à celle-ci, dans l'intérêt de la santé publique ou de la recherche scientifique, de procéder dans un délai de trente jours à un nouvel examen du dossier ayant servi de fondement à la décision. « Art. L. 2151-3-1 (nouveau). - L'importation de tissus ou de cellules embryonnaires ou f_tales est soumise à l'autorisation préalable du ministre chargé de la recherche. Cette autorisation ne peut être accordée que si ces tissus ou cellules ont été obtenus dans le respect des principes fondamentaux prévus par les articles 16 à 16-8 du code civil. « Art. L. 2151-4. - Les modalités d'application du présent chapitre sont fixées par décret en Conseil d'Etat, notamment les conditions d'autorisation et de mise en oeuvre des recherches menées sur des embryons humains. » A.D.N. Acide désoxyribonucléique. Macromolécule formée de polymères de nucléotides se présentant sous la forme d'une double chaîne hélicoïdale dont les deux brins sont complémentaires et constituant le génome de la plupart des organismes vivants. A.R.N. Acide ribonucléique Macromolécule présente dans le cytoplasme, les mitochondries ainsi que dans le noyau cellulaire, et servant d'intermédiaire dans la synthèse des protéines. Chromatine Substance biologique composée d'A.D.N. et de protéines, présente sous forme de granules dans le noyau des cellules, s'organisant en chromosomes lors de la division de celles-ci. Chromosome Corpuscule du noyau, visible au moment de la division cellulaire et supportant les gènes. Epithélium Tissu non vascularisé constitué d'une ou plusieurs couches de cellules collées les unes aux autres recouvrant et protègeant la surface externe du corps ainsi que ses cavités naturelles. Enzyme Macromolécule de nature protéique caractérisée par son activité catalytique gouvernant des réactions biochimiques spécifiques au sein de l'organisme. Eucaryote Organismes dont les cellules sont composées d'un véritable noyau délimité par une membrane entourés et dont le protoplasme contient des mitochondries et des ribosomes. Ex vivo Se dit de traitements, de modifications, de procédés de thérapie, etc., effectués, en dehors de l'organisme, sur des cellules, des tissus ou des organes prélevés sur un sujet en vue de leur réimplantation sur ce sujet Gène Séquence ordonnée de nucléotides occupant une position précise sur un chromosome déterminé et constituant une information génétique dont la transmission est héréditaire Génotype Ensemble du matériel génétique porté par un individu constituant son patrimoine héréditaire Histone Protéine basique, constituant majeur du nucléosome In vitro Se dit d'une expérience ou d'une réaction se produisant en milieu artificiel, en laboratoire In vivo Se dit d'une expérience ou d'une exploration observée ou pratiquée dans l'organisme vivant Mitose Division du noyau d'une cellule en deux noyaux-filles identiques Noyau Constituant généralement unique de la cellule, de forme souvent sphérique, assurant la transmission des caractères héréditaires et jouant un rôle important dans le métabolisme cellulaire, notamment dans la régulation de la synthèse des protéines Nucléosome Élément de base de la chromatine formé par l'enroulement d'un fragment d'ADN sur des molécules d'histone Phénotype Aspect extérieur d'un individu conditionné par son génotype et l'action du milieu Procaryote Organisme unicellulaire dont le noyau est dépourvu de membrane et réduit à un seul chromosome Trophectoderme Mince enveloppe cellulaire de l'embryon lui permettant de se fixer à l'utérus et d'en tirer sa subsistance Source : D'après le Grand dictionnaire terminologique (Office québécois de la langue française) 1 Une enzyme est une protéine. 2 in « Médecine/ Sciences » n° 5 volume 22 mai 2006. 3 « La brevetabilité du vivant » (2001). « Les conséquences des modes d'appropriation du vivant sur les plans juridique, économique et éthique » (2004). 4 In « Médecine/Sciences » n° 4 volume 21 avril 2005, page 368. 5 Source : http://www.wiley.co.uk/genmed/clinical/. 6 dans l'article cité supra. 7 Lors de l'audition publique du 22 novembre 2005. 8 C'est moi qui souligne. 9 Un micromètre (ou micron), symbole : µm, est égal à un millionième de mètre. 10 Le cytosquelette est le réseau de filaments servant de squelette aux cellules. 11 La glycolyse est la dégradation du glucose. 12 Le terme « adulte » est inapproprié car ces cellules peuvent être trouvées dans des tissus variés aussi bien chez le fœtus, l'enfant ou l'adulte. Comme l'a souligné Mme Marina Cavazzana-Calvo, le 22 novembre 2005, il n'y a pas de notion d'individu adulte mais de tissu différencié. Le terme « adulte » signifie en fait que ces cellules se sont déjà différenciées. Il serait sans doute plus juste d'employer le terme « non embryonnaire » mais le terme « adulte » est devenu d'usage courant. Ce rapport continuera donc à l'employer. 13 Selon le rapport des National Institutes of Health, « Stem Cells : Scientific Progress and Future Research Directions". 14 Le 22 novembre 2005. 15 Un tissu quiescent est un tissu qui ne se renouvelle pas 16 in « Médecine/Sciences » n°7 vol.19 juin-juillet 2003 17 le 22 novembre 2005. 18 « Médecine/Sciences » n°6-7 volume 19 juin-juillet 2003. 19 le 22 novembre 2005. 20 Se dit d'une substance pouvant provoquer une réaction ou une réponse immunitaire. 21 Les chondrocytes sont les cellules formant le cartilage. 22 Les myoblastes sont des cellules précurseurs de cellules musculaires de l'adulte. 23 Les adipocytes sont des cellules adipeuses contenant des lipides. L'ensemble des adipocytes constitue la graisse. 24 Michel Pucéat « Les cellules souches embryonnaires Du développement myocardique à la médecine régénératrice » in « Médecine Sciences » n°12, volume 21, décembre 2005. 25 Nature Genetics, octobre 2005. 26 in « L'affaire Hwang ou les ravages de la course à l'audience », Le Monde 14 janvier 2006. 27 le 22 novembre 2005. 28 le 22 novembre 2005. 29 C'est moi qui souligne. 30 le 22 novembre 2005. 31 C'est moi qui souligne. 32 Sénateur honoraire, membre du Comité international de bioéthique de l'UNESCO, Président de l'Institut Curie, 33 in « Le Figaro » du 6 août 2005 34 in « Médecine Sciences » n°4 volume 18, avril 2002. 35 Une maladie auto-immune est une maladie au cours de laquelle se développent, au sein d'un organisme, des réactions immunitaires contre certains de ses propres antigènes. 36 Le 22 novembre 2005. 37 d'après National Institutes of Health " Regenerative Medicine" 2006. 38 L'A.R.N. (acide ribonucléique) est la macromolécule formée par la polymérisation de nombreux nucléotides dont le sucre est le ribose. Elle est présente dans le cytoplasme, les mitochondries ainsi que dans le noyau cellulaire, et sert d'intermédiaire dans la synthèse des protéines. 39 le 22 novembre 2005. 40 C'est moi qui souligne. 41 C'est-à-dire toute cellule d'un organisme, à l'exclusion des cellules reproductrices. 42 in « Les marchands de clones » Seuil 2003. 43 in "Reproductive Biomedicine Online" volume 11 n°2 Août 2005. 44 Gretchen Vogel "Picking up the Pieces after Hwang" Science volume 312 n°5773 28 avril 2006. 45 le 22 novembre 2005. 46 Nature Medecine, 22 Octobre 2006 "Functional engraftment of human ES cell-derived dopaminergic neurons enriched by coculture with telomerase-immortalized midbrain astrocytes." 47 le 22 novembre 2005. 48 Le 22 novembre 2005. 49 C'est moi qui souligne. 50 C.N.R.S. - Institut Curie - Communiqué de presse du 15 juin 2005 « Cancer colo-rectal : le gène Notch ; nouvel acteur du développement intestinal ». 51 L'apoptose s'inscrit dans un processus actif d'autodestruction (suicide) cellulaire par la fragmentation des constituants de la cellule; les fragments ainsi obtenus étant ensuite éliminés par la phagocytose. 52 In « Le Monde » 18 juin 2005. 53 disponible sur http://conventions.coe.int/Treaty/fr/Reports. 54 Le texte de ce décret figure en annexe. 55 le 22 novembre 2005. 56 le 22 novembre 2005. 57 Source : Commission européenne : « Stem Cells European research projects involving stem cells in the 6th Framework program » 14 décembre 2005. 58 Source : "UK Stem Cell Initiative" novembre 2005. 59 Liste complète dans National Conference of State Legislatures "State Embryonic and Fetal Research Laws" www.ncsl.org/programs/genetics/embfet.htm 60 Source : The Century Foundation - 2006 61 Source : d'après la note de l'Ambassade de France à Singapour du 3 juillet 2006 : « Cellules souches : aperçu de la recherche à Singapour ». 62 D'après : USA ToDay du 10 janvier 2006, Hervé Chneiweiss : « Cloningate ? La publication scientifique et le clonage thérapeutique face à la mystification Hwang » in « Médecine Sciences » n° 2, vol.22, février 2006, The Korea Times du 16 décembre 2005. 63 Jacques Testart « L'affaire Hwang Woo-suk ou les dérives de la science spectacle » in Le Monde - 3 janvier 2006. 64 Brian C. Martinson, Melissa S. Anderson, Raymond de Vries « Scientits behaving badly », Nature 9 juin 2005. 65 In « Une nouvelle affaire sur les cellules souches », Le Monde - 23 novembre 2006. 66 Entretien avec M. Jean-Yves Nau in Le Monde, 11 janvier 2006. 67 www.scienceexpress.org 1er mai 2003. 68 The Guardian, 5 octobre 2006. 69 www.scienceexpress.org, 19 mai 2005. 70 Le Monde, 2 novembre 2006 71 22 septembre 2005. 72 le 22 novembre 2005. 73 Intellectual Property & Technology Law Journal : "Stem cells :The Patent Landscape", janvier 2006. 74 Nature 19 mai 2005 "Licensing fees slow advance of stem cells". 75 Le 22 novembre 2005. 76 C'est moi qui souligne. 77 C'est moi qui souligne. 78 C'est moi qui souligne. 79 le 22 novembre 2005. 80 « Chacun a droit au respect de son corps. 81 « La brevetabilité du vivant », rapport de l'Office parlementaire d'évaluation des choix scientifiques et technologiques, 20 décembre 2001. |