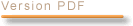

SOMMAIRE
Pages
ACCUEIL 7
INTRODUCTION 8
PREMIÈRE TABLE RONDE, PRÉSIDÉE PAR M. ROLAND COURTEAU, SÉNATEUR, VICE-PRÉSIDENT DE L’OPECST : LES MALADIES À TRANSMISSION VECTORIELLE 11
I. LES CARACTÉRISTIQUES DES MALADIES À TRANSMISSION VECTORIELLE (CHIKUNGUNYA, DENGUE, FIÈVRE JAUNE, PALUDISME, WEST NILE, ZIKA) 11
1. Pr François Rodhain, professeur honoraire, Institut Pasteur – « Caractérisation des populations de moustiques » 11
2. Pr Martin Danis, professeur émérite de parasitologie, Université Pierre-et-Marie-Curie-Paris 6, membre de l’Académie nationale de médecine – « La transmission vectorielle des parasitoses : le cas du paludisme » 13
3. Mme Anna-Bella Failloux, directrice de recherche, Unité arbovirus et insectes vecteurs, Institut Pasteur – « La transmission du virus Zika par des moustiques » 17
4. M. Frédéric Jourdain, ingénieur du génie sanitaire, Centre national d’expertise sur les vecteurs (CNEV) – « Les missions du Centre national d’expertise sur les vecteurs. Contrôle des populations de vecteurs. » 19
5. Mme Catherine Mir, responsable de la sous-direction santé-environnement, produits chimiques et agriculture, Direction générale de la prévention des risques, Ministère de l’environnement, de l’énergie et de de la mer, – « Efficacité et risques des produits insecticides » 22
II. LES ÉPIDÉMIES DE MALADIES À TRANSMISSION VECTORIELLE 25
1. Pr Jean-François Delfraissy, directeur, Agence nationale de recherche sur le Sida et les hépatites virales (ANRS – France Recherche Nord & Sud Sida-HIV Hépatites) et Institut immunologie, inflammation, infectiologie et microbiologie (ITMO I3M) – « Les crises sanitaires infectieuses. Comment organiser la recherche ? » 25
2. M. Christophe Paupy, chargé de recherche, Institut de recherche pour le développement (IRD) – « Émergence des arbovirus » 28
3. M. Paul Castel, directeur général, et M. Manuel Munoz-Rivero, directeur adjoint à la direction santé publique et environnementale, Agence régionale de santé Provence-Alpes-Côte-d’Azur (ARS PACA) – « La lutte contre les moustiques en Provence-Alpes-Côte-d’Azur » 31
4. Mme Marie-Claire Paty, coordinatrice de la surveillance des maladies à transmission vectorielle, Institut national de veille sanitaire (InVS) – « La situation en France métropolitaine et aux Antilles, en Guyane, en Polynésie française et à La Réunion en 2016 » 33
5. Pr Arnaud Fontanet, directeur, Unité d’épidémiologie des maladies émergentes, Institut Pasteur – « Deux complications graves du virus Zika : le syndrome de Guillain-Barré et la microcéphalie à travers le retour d’expérience de la Polynésie » 36
6. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier – « Contrôle des vecteurs et évolution de leurs populations » 39
7. M. Christophe Lagneau, directeur recherche et développement, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée) – « Évolution de la présence des moustiques : procédés, effets et limites de la démoustication » 41
8. Pr Jérôme Depaquit, directeur, Unité de recherche transmission vectorielle et épidémiosurveillance de maladies parasitaires, Université de Reims Champagne-Ardenne – « Les maladies transmises par les phlébotomes » 43
9. Mme Nathalie Boulanger, maître de conférences et praticien attaché au Centre national de référence sur la borréliose de Lyme, Université de Strasbourg, Centre hospitalier de Strasbourg – « Les maladies transmises par les tiques » 46
10. Mme Véronique Chevalier, directrice adjointe, Unité de recherche animal et gestion intégrée des risques (AGIRs), Centre de coopération international en recherche agronomique pour le développement (CIRAD) – « Cartographie des risques des maladies à transmission vectorielle » 48
SECONDE TABLE RONDE, PRÉSIDÉE PAR M. FRANÇOIS COMMEINHES, SÉNATEUR, MEMBRE DE L’OPECST : LE CAS DU VIRUS ZIKA 51
I. INTRODUCTION 51
II. ALERTE ET POINT SUR L’ÉVOLUTION DE LA SITUATION EN FRANCE ET DANS LE MONDE 54
1. M. Jean-Claude Manuguerra, directeur, Cellule d’intervention biologique d’urgence (CIBU), Institut Pasteur/OMS – « 2016 : l’alerte Zika dans le monde » 54
2. Mme Sylvie Quelet, directrice, Département des maladies infectieuses, Institut national de veille sanitaire (InVS) – « Rôle de l’Institut national de veille sanitaire » 55
3. M. Stéphan Rossignol, maire, Ville de La Grande-Motte – « Les moyens d’action d’un élu contre les moustiques » 57
4. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier – « Causes de la modification de la répartition géographique de l’aedes albopictus » 59
5. M. Daniel Bley, anthropologue biologiste, directeur de recherche émérite, Unité mixte de recherche ESPACE, CNRS/Université Aix-Marseille – « La perception par les populations des mesures de lutte contre les maladies à transmission vectorielle » 61
III. LES SOLUTIONS MISES EN œUVRE 64
1. Pr Yazdan Yazdanpanah, chef de service des maladies infectieuses et tropicales, professeur d’université et chercheur, Hôpital Bichat-Claude-Bernard, Université Paris-Diderot, INSERM – « La réponse hospitalière aux maladies tropicales et infectieuses » 64
2. Mme Isabelle Leparc-Goffart, responsable du Centre national de référence des arbovirus, Institut de recherche biomédicale des armées (IRBA) – « L’apport du Centre de référence des arbovirus » 66
3. Pr Gérard Lasfargues, directeur général adjoint scientifique, Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) – « Vecteurs et maladies vectorielles : pour une approche globale » 68
4. M. Frédérick Gay, maître de conférences des universités et praticien hospitalier, groupe hospitalier Pitié-Salpêtrière, Université Pierre-et-Marie-Curie – « Le rôle de la médecine des voyages » 70
5. Dr Vincent Feuillie, responsable du Service médecine passagers, Air France – « Action des compagnies aériennes contre les maladies à vecteurs » 72
6. M. Jean-Louis Gély, directeur de la communication et des relations extérieures, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée) – « Prolifération des moustiques en ville : outils de prévention » 73
7. Mme Anne-Claire Amprou, directrice générale adjointe de la santé, Ministère des affaires sociales et de la santé – « L’action du ministère des affaires sociales et de la santé dans le champ des maladies à transmission vectorielle » 76
IV. CONCLUSION 79
EXTRAIT DE LA RÉUNION DE L’OPECST DU 28 JUIN 2016 PRÉSENTANT LES CONCLUSIONS RELATIVES À L’AUDITION PUBLIQUE DU 7 AVRIL 2016 SUR LES MALADIES À TRANSMISSION VECTORIELLE 83
ANNEXES 95
1. Pr François Rodhain, professeur honoraire, Institut Pasteur 99
2. Pr Martin Danis, professeur émérite de parasitologie, Université Pierre-et-Marie-Curie-Paris 6, membre de l’Académie nationale de médecine 101
3. Mme Anna-Bella Failloux, directrice de recherche, Unité arbovirus et insectes vecteurs, Institut Pasteur 109
4. M. Frédéric Jourdain, ingénieur du génie sanitaire, Centre national d’expertise sur les vecteurs (CNEV) 114
5. M. Christophe Paupy, chargé de recherche, Institut de recherche pour le développement (IRD) 123
6. Mme Marie-Claire Paty, coordinatrice de la surveillance des maladies à transmission vectorielle, Institut national de veille sanitaire (InVS) 127
7. Pr Arnaud Fontanet, directeur, Unité d’épidémiologie des maladies émergentes, Institut Pasteur 134
8. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier 139
9. M. Christophe Lagneau, directeur recherche et développement, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée) 146
10. Pr Jérôme Depaquit, directeur, Unité de recherche transmission vectorielle et épidémiosurveillance de maladies parasitaires, Université de Reims Champagne-Ardenne 156
11. Mme Nathalie Boulanger, maître de conférences et praticien attaché au Centre national de référence sur la borréliose de Lyme, Université de Strasbourg, Centre hospitalier de Strasbourg 163
12. Mme Véronique Chevalier, directrice adjointe, Unité de recherche animal et gestion intégrée des risques (AGIRs), Centre de coopération international en recherche agronomique pour le développement (CIRAD) 167
13. M. Jean-Claude Manuguerra, directeur, Cellule d’intervention biologique d’urgence (CIBU), Institut Pasteur/OMS 172
14. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier 174
15. Pr Yazdan Yazdanpanah, chef de service des maladies infectieuses et tropicales, professeur d’université et chercheur, Hôpital Bichat-Claude-Bernard, Université Paris-Diderot, INSERM 182
16. Mme Isabelle Leparc-Goffart, responsable du Centre national de référence des arbovirus, Institut de recherche biomédicale des armées (IRBA) 188
17. Dr Vincent Feuillie, responsable du Service médecine passagers, Air France 192
18. M. Jean-Louis Gély, directeur de la communication et des relations extérieures, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée) 194
M. Roland Courteau, sénateur, vice-président de l’OPECST
Mesdames et Messieurs, durant des années, dans des régions comme la mienne – qui ne se situe pas, comme vous l’aurez deviné à mon accent, au nord de la France –, nous avons cruellement souffert de ces petits vampires familiers que sont les moustiques car même les lotions citronnées de mon enfance restaient inefficaces. Jusqu’au jour où certains produits comme le dichlorodiphényltrichloroéthane (DDT), autrement dit le dispensateur de la diffusion du tourisme, firent oublier aux vacanciers l’existence de ces insectes aux piqûres importunes.
Depuis quelques années, chacun a pu percevoir, à ses dépens, le retour en force des moustiques. Plus récemment, en de nombreux autres lieux également, on a commencé à redouter non plus une simple démangeaison mais de véritables maladies transmises par lesdits insectes, qualifiés à juste titre de vecteurs, en raison de telle ou telle affection qu’ils colportent d’un individu malade à un individu sain.
Ce nouveau contexte, a conduit à reposer aux fenêtres les moustiquaires ôtées il y a bien longtemps. Au-delà de ce réflexe de conservation et grâce à la vigilance du sénateur François Commeinhes, maire de Sète et membre, comme moi, de l’Office parlementaire d’évaluation des choix scientifiques et technologiques, le Bureau de l’OPECST a jugé indispensable de nous charger d’organiser la présente audition publique afin de faire le point sur les maladies à transmission vectorielle.
En effet, il est nécessaire d’approfondir cette difficile question des maladies, plus ou moins graves ou invalidantes, que sont le paludisme, la dengue, le chikungunya, les fièvres jaunes, West Nile ou celle de la vallée du Rift, la leishmaniose… et de se pencher sur l’identité et les caractéristiques des insectes vecteurs : les tiques pour la borréliose, les phlébotomes pour les leishmanioses, les anophèles pour le paludisme, le moustique aedes albopictus pour la dengue et le chikungunya et, plus récemment, pour le virus Zika dont plus de un million et demie de personnes souffrent. La France métropolitaine et d’outre-mer est particulièrement concernée par ces transmissions qui prennent souvent la forme d’épidémies.
C’est pourquoi, à l’appel de l’OPECST, tant de personnalités éminentes rassemblées aujourd'hui ont accepté de partager leur savoir et de communiquer leur expérience devant un problème mondial.
Ont donc été sollicités non seulement des médecins, des vétérinaires, des pharmaciens, des biologistes, des entomologistes, des infectiologues, des parasitologues, des épidémiologistes, des spécialistes des pathologies tropicales, mais encore des toxicologues, des virologistes, des généticiens, des ingénieurs spécialistes de la lutte antivectorielle ou des biocides, des acteurs de l’élaboration de la politique vaccinale ou de plans santé-environnement comme d’actions de démoustication, des anthropologues et également des élus, comme le maire de La Grande-Motte.
Au nom du Président de l’OPECST, le député Jean-Yves Le Déaut, qui nous rejoindra dans quelques instants, et au nom du sénateur Bruno Sido, Premier vice-président, je tiens à remercier vivement tous les intervenants et les prie, pour la qualité de nos échanges, de bien vouloir condenser leurs propos, qui sont diffusés en vidéo et seront repris, ainsi que les diapositives associées, dans un compte rendu publié par l’Office.
M. François Commeinhes, sénateur, membre de l’OPECST
Mesdames et Messieurs, après les souvenirs d’en France du sénateur Roland Courteau, je souhaiterais vous guider de l’Aude jusqu'à l’Hérault pour vous sensibiliser à l’agacement de la population puis à son inquiétude devant la prolifération des moustiques et devant la gravité des maladies dont ils peuvent devenir des vecteurs. Je le ferai à un triple titre : sénateur, maire de Sète et médecin. À cet égard, ce sera moins le gynécologue-obstétricien qui s’exprimera, toutefois, que le président de la polyclinique Sainte-Thérèse, à Sète, bien placé pour percevoir les évolutions et les préoccupations de santé publique.
Quant au maire, il a fini par s’étonner de ne plus être interpellé dans les rues au motif d’aboiements canins nocturnes mais ce fut pour l’être désormais par des mères de famille lui montrant, sur l’écran de leur téléphone portable, les piqûres spectaculaires subies par leurs enfants ou petits-enfants.
Lorsque j’ai alerté le président et le vice-président de l’OPECST des dangers croissants de la prolifération des moustiques, le bureau de l’Office, comme vient de le rappeler le sénateur Roland Courteau, a immédiatement décidé de me confier l’organisation de la présente audition publique, à laquelle je vous remercie vivement d’avoir accepté de participer.
Le sénateur Roland Courteau et moi-même présiderons chacun l’une des deux tables rondes de cet après-midi : la première, autour des caractéristiques des maladies à transmission vectorielle et de l’identité des vecteurs, parfois responsables de véritables épidémies et, la seconde, principalement centrée sur le cas de la transmission du virus Zika par les moustiques.
Parmi les nombreux éminents spécialistes présents, certains d’entre eux doivent souvent exercer leurs compétences dans l’urgence des crises sanitaires, des épidémies, au milieu des souffrances endurées par les malades, qui sont aussi, souvent, des personnels soignants n’hésitant pas à s’efforcer de poursuivre leur activité en dépit des séquelles invalidantes de certaines des maladies à vecteur. Je voudrais leur rendre hommage et rappeler que j’ai en permanence une pensée pour tous les nombreux malades, parfois gravement atteints.
Nous avons souhaité nous immerger tous, d’un coup, dès le début de cet après-midi, dans le vif du sujet en projetant des images de moustiques en pleine action, comme vous avez pu le voir il y a quelques minutes. Je gage que nombre d’entre nous ont pu s’étonner de la durée inattendue de cette piqûre tandis que d’autres ressentaient déjà des démangeaisons. Effectivement, cette brève séquence filmée est perçue comme étonnamment longue – en réalité presque deux minutes et demie ! Pourtant, tel n’est pas le souvenir gardé d’une piqûre de moustique, qui ne semble durer que l’instant où, alertés par la douleur, nous tentons d’écraser l’importun d’un revers de la main.
Pourquoi existe-t-il un tel écart entre notre perception et la réalité ? C’est parce que, lorsqu’il pique, le moustique inocule à la fois un anesthésiant et un anticoagulant pour faciliter le pompage du sang. De ce fait, la douleur ressentie par nous n’est pas celle du commencement de sa piqûre mais celle de sa fin, celle du moment où le moustique se retire, non sans efforts d'ailleurs. Lorsque nous tentons enfin d’écraser l’importun vampire, il a déjà largement prélevé son butin et, malheureusement, éventuellement introduit dans notre système sanguin quelques-unes des maladies à transmission vectorielle (paludisme, dengue, chikungunya, virus Zika ou autre).
Il importe maintenant de rappeler la complexité des problématiques et des paradoxes liés à cette question. Les piqûres de vecteurs, quels qu’ils soient, dérangent et constituent une nuisance certaine, voire un danger, d’où le désir spontané d’éradiquer tous ces vecteurs. Cependant, l’usage des biocides en quantité suffisante n’est pas sans risque pour la santé humaine ou animale ou pour l’intégrité des milieux.
Les vecteurs jouent un rôle dans l’écosystème et les conséquences de leur limitation, voire de leur éradication, semblent difficiles à identifier et à quantifier.
La causalité entre la piqûre de tel vecteur et telle maladie n’est pas toujours établie scientifiquement au moment où elle a déjà été activement relayée, sans preuves, par les médias et par l’opinion. Par exemple, le virus Zika entraîne-t-il le syndrome de Guillain-Barré, la microcéphalie ou la myélite ?
La forte présence de vecteurs dans un lieu habité conduit à la modification des modes de vie, notamment dans la conception et l’utilisation des habitats. Je pense à l’air conditionné, aux eaux stagnantes (notamment sous les dalles sur plots), aux moustiquaires, imprégnées ou non, que le sénateur Courteau a remises chez lui, aux choix vestimentaires et à la présence ou l’absence de tourisme dans nos territoires.
Certains modes de vie favorisent la multiplication des vecteurs avec l’amplification continue des transports de passagers ou de marchandises dans le monde sans prise en compte simultanée du lien possible avec la multiplication des vecteurs. À cela s’ajoute la difficulté d’appréhender à la fois le court terme et le long terme, les effets sur la santé à court terme (la microcéphalie, par exemple) ou à long terme (l’atteinte du système nerveux par les biocides pouvant entraîner une maladie de Parkinson, ce qui rejoint la problématique des effets des pesticides, tels que le DDT, sur la santé).
Au vu des contradictions entre les demandes simultanées de certains acteurs, il est à noter qu’une réglementation a été nécessaire pour imposer à des industriels, qui se plaignaient de la prolifération des moustiques, d’éliminer toutes les eaux stagnantes liées à leur activité. La solution dépendait donc d’eux-mêmes.
Sur le plan de l’identification des responsabilités, citons l’exemple des importations en France de pneus usagés favorisant l’éclosion des œufs de moustiques. Dans ce cas, le principe pollueur-payeur trouve-t-il à s’appliquer ou bien les maladies, quelles que soient leurs causes, sont-elles considérées comme une fatalité alors même que la prolifération des moustiques a pu être causée par l’activité humaine ?
Des incohérences apparaissent : comment se plaindre de la multiplication des tiques tout en négligeant le nombre accru de chiens, réservoirs de tiques, par exemple dans le sud de la France.
Gageons que ces problématiques et paradoxes ne résisteront pas aux réponses apportées par les intervenants à la première table ronde.
PREMIÈRE TABLE RONDE, PRÉSIDÉE PAR M. ROLAND COURTEAU, SÉNATEUR, VICE-PRÉSIDENT DE L’OPECST : LES MALADIES À TRANSMISSION VECTORIELLE
I. LES CARACTÉRISTIQUES DES MALADIES À TRANSMISSION VECTORIELLE (CHIKUNGUNYA, DENGUE, FIÈVRE JAUNE, PALUDISME, WEST NILE, ZIKA)
1. Pr François Rodhain, professeur honoraire, Institut Pasteur – « Caractérisation des populations de moustiques »
Il existe près de 3 500 espèces de moustiques, dont une quarantaine en France. Elles sont très différentes au regard de leur écologie, de leur biologie, de leurs compétences vectorielles, ce qui implique autant de différences dans l’épidémiologie des maladies qu’ils transmettent et dans les méthodes de contrôle éventuelles. Je me bornerai à évoquer ici les vecteurs de virus (dengue, chikungunya, virus Zika, West Nile, etc.). Je n’évoquerai pas les anophèles, vecteurs de plasmodium (agent du paludisme).
Il existe deux espèces – proches l’une de l’autre – d’aedes qui nous importunent. Ce sont des espèces superbes et faciles à identifier chez nous en Europe. Aedes aegypti est une espèce africaine répandue par l’homme aux xixe et xxe siècles. Elle se trouve aujourd'hui dans l’ensemble des pays tropicaux et subtropicaux. Ce moustique était autrefois présent en Méditerranée, essentiellement dans les ports. Il en a quasiment disparu. Aujourd'hui, nous n’avons identifié sa présence qu’à Madère – où il a donné lieu à une épidémie de dengue il y a quelques années – et, d’autre part, en Géorgie et en quelques points du sud de la Russie.
Ce moustique est très lié à l’homme car ses larves vivent dans de petits gîtes larvaires artificiels créés par l’homme. Il s’agit, dans quelques cas, de gîtes permanents. Dans d’autres cas, ce sont des gîtes temporaires qui se remplissent lors des pluies. Les adultes sont anthropophiles, c'est-à-dire qu’ils piquent de préférence l’homme. Ils sont endophages – ce qui signifie qu’ils piquent essentiellement dans les maisons – et diurnes – ils piquent pendant la journée. Ce moustique a une faible dispersion.
Je n’évoquerai que les femelles car les mâles ne sont pas impliqués dans la transmission. Les femelles se dispersent peu au cours de leur vie. Après la recherche d’un hôte – l’homme, souvent peu éloigné –, c’est la recherche d’un gîte pour déposer les œufs qui les fait se disperser. Ces gîtes sont également nombreux. Elles n’ont donc pas de raison d’aller très loin. Ce sont des moustiques domestiques, souvent urbains et abondants. Ils ont des œufs durables, c'est-à-dire qui supportent la dessiccation durant plusieurs semaines, voire plusieurs mois.
On en connaît plusieurs formes qui diffèrent par leur écologie et par leurs compétences. C’est un vecteur bien connu de fièvre jaune, du virus de la dengue, du virus chikungunya et du virus Zika. Il existe pour ces virus une transmission verticale : le virus qui infecte une femelle peut être transmis à la descendance de celle-ci.
Aedes albopictus est originaire d’Asie et de Madagascar. Il a, lui aussi, été répandu par l’homme, notamment par le commerce des pneus, comme cela a été indiqué en introduction. C’est un moustique qui n’est pas spécifiquement tropical : il existe des populations d’aedes albopictus qui vivent très bien en pays tempéré et même en pays tempéré froid. Il est moins lié à l’homme que le précédent. Ses larves se développent dans des gîtes artificiels mais aussi des gîtes naturels (par exemple, des creux d’arbres). Les adultes piquent l’homme mais aussi un certain nombre d’animaux. Ils sont plutôt exophages, c'est-à-dire qu’ils piquent de préférence à l’extérieur des habitations, et sont diurnes également. Leur écologie est donc plus rurale que celle d’aedes aegypti et périurbaine. Il vit en ville mais plutôt là où se trouvent des espaces verts et des jardins. Il est péridomestique, parfois abondant et lui aussi a des œufs durables, surtout dans les populations des pays tempérés. Aedes albopictus est un vecteur des virus de la dengue, de chikungunya, du virus Zika et peut-être du virus de la fièvre jaune.
Fort différents sont les culex, d’autres moustiques. Certains, comme culex pipiens, sont répandus par l’homme dans la plupart des pays tempérés. Il est fréquent en France. D’autres, comme culex quinquefasciatus, très proche du précédent, sont plutôt situés dans des zones tropicales et subtropicales, en Afrique comme en Amérique ou en Asie. Leurs larves sont très liées à l’homme. Elles se développent dans des gîtes artificiels mais souvent dans des eaux plus ou moins polluées – ce qui n’est pas le cas des aedes précédents et aussi dans des gîtes naturels. Les adultes sont souvent ornithophiles – c'est-à-dire qu’ils piquent les oiseaux. Ils piquent l’homme aussi, surtout en été et en automne. Ce sont des animaux plutôt nocturnes, domestiques, urbains, qui se développent, par exemple, dans des égouts et des bassins des villes et leurs œufs, non durables, ne supportent pas la dessiccation.
Il existe des espèces plus rurales, par exemple culex modestus, qui a été accusé de transmettre le virus West Nile chez nous. Il se développe dans des gîtes ruraux, naturels, par exemple des marécages. Ces culex sont des vecteurs du virus West Nile, avec de nombreuses autres espèces. De ce fait, c’est un virus qui est à la fois urbain et rural et qui a probablement une transmission verticale.
M. Roland Courteau. – Merci, Monsieur le Professeur. Je salue la présence parmi nous du Pr Marc Gentilini, dont le traité sur les maladies à vecteur fait autorité. Je voudrais également saluer la présence parmi nous de nos collègues sénateurs, Mme Catherine Procaccia, Mme Marie-Christine Blandin et M. Gilbert Barbier.
2. Pr Martin Danis, professeur émérite de parasitologie, Université Pierre-et-Marie-Curie-Paris 6, membre de l’Académie nationale de médecine – « La transmission vectorielle des parasitoses : le cas du paludisme »
C’est Alphonse Laveran qui, en 1880, a identifié le parasite responsable du paludisme. Il a reçu le prix Nobel en 1907. Ronald Ross a découvert peu après la transmission vectorielle du paludisme et a, lui aussi, reçu un prix Nobel, un peu plus tôt d’ailleurs. Mme Youyou Tu a mis en évidence au cours des années 1970, dans une plante, artemisia annua, une molécule constituant un antipaludique majeur dans le traitement du paludisme. Elle a reçu le prix Nobel en 2015. Entre 1907 et 2015, aucun prix Nobel n’a récompensé la recherche sur le paludisme. Mme Youyou Tu a partagé son prix Nobel avec William Campbell et Satoshi Omura pour l’ivermectine, un médicament essentiel pour lutter contre deux parasitoses transmises par des moustiques ou des mouches.
J’ai signalé sur la diapositive projetée que l’onchocercose, ou cécité des rivières, et la filariose lymphatique, responsable d’éléphantiasis, étaient des maladies vectorielles. Le vecteur de l’onchocercose est un moucheron tandis que celui des filarioses lymphatiques est un moustique anophèle ou culex.
Ces deux parasitoses sont en voie d’élimination ou, en tout cas, de contrôle, suivant les régions, grâce à la lutte antivectorielle et grâce à l’ivermectine.
Le paludisme est dû à cinq parasites hématozoaires (qui pénètrent dans les globules rouges à la phase pathologique chez l’homme) :
• Plasmodium falciparum, qui tue et sévit principalement en Afrique mais aussi dans plusieurs autres continents ;
• Plasmodium vivax, moins pathogène mais plus mondialement répandu ;
• Plasmodium ovale, peu pathogène, présent en Afrique, moins répandu ;
• Plasmodium malariae, répandu mais rare et peu pathogène ;
• Plasmodium knowlesi, un parasite du singe (principalement les macaques), en Asie du Sud-Est, parasitant l’homme depuis 2000 et parfois mortel, en raison notamment de la destruction des forêts, où les hommes travaillent très près des macaques, favorisant la piqûre par des anophèles, qui piquent autant le singe que l’homme et qui ont rendu ce plasmodium pathogène chez l’homme.
Le paludisme est une maladie vectorielle transmise par plusieurs espèces anophèles. Anopheles gambiae, en Afrique, est un moustique extrêmement efficace pour la transmission du paludisme. Ces moustiques ont besoin de chaleur, d’eau et de sang. Il faut qu’il fasse une température supérieure à vingt degrés, la plupart du temps, pour que le développement du plasmodium puisse s’opérer. De l’eau propre est également nécessaire, ainsi que le sang : les femelles ont besoin de se nourrir de sang pour y prélever des protéines et obtenir leur développement jusqu’à la ponte des œufs qui vont être déposés dans l’eau, éclosent et donnent des larves. Ces anophèles sont indispensables au cycle de vie des plasmodies et à la transmission du paludisme.
En haut du schéma projeté, nous voyons la phase du cycle chez le moustique et, dans la partie « homme », un vaisseau sanguin puis des viscères : le foie et la rate. Un moustique porteur, dans sa salive, de larves du parasite, en bavant, transmet ce parasite à l’homme. Il circule très peu de temps et entre immédiatement dans un hépatocyte, où il va se multiplier puis s’échapper au bout de quelque temps pour pénétrer dans les globules rouges. Il est alors dans la phase pathogène de son évolution, se multipliant dans les globules rouges, donnant de la fièvre et des anémies en faisant éclater les globules rouges et, surtout (notamment pour plasmodium falciparum), en obstruant les petits vaisseaux et donnant des accès pernicieux ou neuro-paludismes et des défaillances dans divers organes. Ce parasite produit également dans le sang des formes sexuées que le moustique va prélever et qui vont se développer pour faire de ce moustique un vecteur potentiel du paludisme.
La transmission du paludisme dans le monde a beaucoup varié entre 1900, où le paludisme était présent en Europe, et aujourd’hui, où vous voyez des zones (en bleu foncé) indemnes, tandis que celles en bleu clair ont une transmission faible et que celles en orangé ou rouge donnent lieu à une transmission intense. Le parasite a ainsi été éliminé dans des zones importantes du monde mais persiste en Asie du Sud-Est, en Amérique du Sud tropicale et surtout en Afrique subsaharienne.
Le paludisme est donc une des maladies infectieuses les plus meurtrières, avec la tuberculose et le Sida. Le Fonds mondial a été créé en 2002 seulement pour mieux financer la lutte contre ces maladies, en particulier le paludisme. Il a distribué 33 milliards de dollars de sa création à 2015 et la France contribue chaque année à hauteur de 340 millions d’euros, ce qui en fait l’un des meilleurs pays contributeurs à ce fonds.
L’OMS, dans son rapport sur le paludisme dans le monde en 2015, fait état d’une grande amélioration de la situation. En dépit de la réduction depuis 2000 de 37 % du nombre de cas de paludisme, l’organisation dénombre encore 214 millions de cas et 438 000 décès par ces accès pernicieux (neuropaludisme, anémies graves) chez des enfants. La région Afrique est encore la zone du monde qui paie le plus lourd tribut au paludisme, avec 80 % des infections, même si la mortalité du paludisme y a baissé. 306 000 décès d’enfants de moins de cinq ans y ont encore eu lieu en 2015, soit près de 1 000 décès d’enfants par jour.
Les moustiquaires imprégnées d’insecticide à longue durée d’action tiennent une place majeure dans les progrès réalisés en Afrique. Les anophèles sont des insectes nocturnes. La moustiquaire imprégnée d’insecticide a constitué un outil de lutte essentiel dans ces progrès en Afrique. En Asie, c’est moins le cas, car les anophèles qui transmettent le paludisme y piquent très tôt le matin ou en fin de journée et ces moustiquaires sont donc moins importantes pour la lutte.
Un autre élément important dans la lutte contre le paludisme au cours de ces dernières années a trait à la mise en place et à la disponibilité de combinaisons thérapeutiques avec deux médicaments, dont un est un dérivé de l’artémisinine, découverte par YouYou Tu, qui, allié à un autre antipaludique, donne des résultats extrêmement rapides du point de vue de la disparition du parasite et de la guérison des patients. L’artésunate injectable, dans les accès graves, fait mieux que la quinine et diminue le nombre de morts dans le cas des accès graves à plasmodium falciparum.
Le paludisme sévit sous forme d’importation dans plusieurs pays. En France métropolitaine, entre 1986 et 2014, le graphique projeté montre le nombre de cas signalés par le réseau du CNR – dont je me suis longtemps occupé –, avec les cas estimés dans l’ensemble de la France métropolitaine (en jaune) et l’évolution du nombre de voyageurs revenant d’une zone d’endémie palustre (courbe bleue). 4 370 cas de paludisme étaient encore recensés en France en 2014, donnant lieu à une dizaine de morts dans les meilleurs services de réanimation français, alors que nous aurions pu éviter cela par une prévention convenablement effectuée ou un traitement efficace d’urgence.
La réintroduction d’un paludisme autochtone, dans les zones où il était éliminé, peut également survenir. Les Grecs en ont fait la triste expérience entre 2009 et 2012 dans les zones agricoles où des Pakistanais ont introduit le plasmodium vivax, lequel s’est traduit par 42 cas autochtones en 2012. Le contrôle est généralement facile dans ces zones géographiques puisqu’on y traite les malades rapidement et que l’on intensifie la lutte antivectorielle. Pour la Corse, un seul cas a été répertorié en 2006.
La lutte contre le paludisme passe par des stratégies nouvelles contre les vecteurs, vue l’extension des résistances des moustiques aux insecticides. De nouveaux insecticides ont été développés : des organophosphates et carbamates sont testés mais coûtent plus cher et sont peut-être moins faciles à utiliser que les perméthrines et la deltaméthrine qui sont utilisés pour imprégner les moustiquaires. Deux publications récentes dans des revues prestigieuses décrivent une approche innovante par modifications des anophèles obtenues par un forçage génétique : Anthony James obtient que les anopheles stephensi ne transmettent plus le plasmodium. Tony Nolan, lui, a forcé génétiquement les anopheles gambiae à ne plus transmettre et à rendre stériles les femelles, suscitant la disparition de cette espèce. D’aucuns émettent des craintes quant aux conséquences écologiques de telles modifications d’espèces lâchées dans la nature.
Quant aux autres perspectives de lutte contre le paludisme, elles portent sur le traitement. Des nouveaux médicaments sont à l’étude, actifs sur tous les stades, sur la forme sanguine et sur les gamétocytes. Traitant en une seule fois tous les stades du parasite chez l’homme, ils permettraient d’arrêter la transmission. Deux médicaments sont en cours de développement à partir de ce principe. Un seul des deux fait l’objet de premiers essais chez l’homme.
Une nouvelle stratégie d’alternance offre également des pistes à explorer : lorsqu’une combinaison est devenue moins efficace, on arrête de la distribuer au profit d’une autre et l’on attend que la sensibilité revienne. Cette stratégie est toutefois difficile à mettre en œuvre.
Un candidat vaccin a obtenu une autorisation de mise sur le marché (en application de l’article 58), seulement dans des zones endémiques. Les protections sont faibles (18 %, 38 %). D’autres sont à l’étude et seront peut- être meilleurs.
Il faut amplifier la formation et l’information, ce que favorise notamment l’organisation de journées mondiales sur le paludisme. L’initiative « Faire reculer le paludisme », financée, entre autres, par le Fonds mondial, a été importante. Ce dernier souligne que nous allons manquer d’argent en 2016 et 2017. L’action des fondations et ONG n’est pas négligeable non plus. À titre d’illustration, la Fondation Bill et Melinda Gates possède un budget supérieur à celui de l’OMS. Tous ces efforts doivent être amplifiés.
La semaine dernière, nous avons, avec le Pr Marc Gentilini, présidé une séance à l’Académie nationale de médecine ayant pour thème la question suivante : l’élimination du paludisme dans le monde est-elle possible ? Nous avions réuni un certain nombre d’acteurs de la lutte sur le terrain du Mali, de Thaïlande, ainsi que Mme Françoise Benoît-Vical, qui s’intéresse aux résistances aux artémisinines, problème émergent très inquiétant. Si ces résistances s’étendaient, ce serait une catastrophe pour le traitement. Mme Sophie Allauzen, de la Fondation Gates, était également présente. Nous avons conclu, avec le Dr Pierre Buffet, spécialiste des plasmodium et des leishmanies, qu’il fallait mieux coordonner les moyens de lutte et que l’élimination du paludisme était possible, peut-être dans vingt ou trente ans.
M. Roland Courteau. - Merci, Professeur, pour cet aperçu d’une maladie qui concerne des millions de personnes dans le monde.
Je vais donner la parole à Mme Anna-Bella Failloux. J’apprécie particulièrement votre présence, Madame, car nombre de personnes nous ont demandé, lorsque nous les avons contactées pour préparer cette audition, si nous vous avions également contactée et si vous seriez présente.
3. Mme Anna-Bella Failloux, directrice de recherche, Unité arbovirus et insectes vecteurs, Institut Pasteur – « La transmission du virus Zika par des moustiques »
Il existe environ 500 à 600 arbovirus. La moitié d’entre eux sont des virus transmis par des arthropodes dont les moustiques, parmi lesquels une centaine sont pathogènes pour l’homme. Tous les arbovirus circulent de façon naturelle dans un cycle dit « sauvage » : le virus est transmis entre des populations de singes et des moustiques zoophiles, qui ne piquent pas l’homme. Les virus de la dengue, de la fièvre jaune, du West Nile, le Zika et le chikungunya, qui appartient à une autre famille, ont tous leur cycle sauvage en Afrique. Ces dernières décennies, de nombreuses choses ont changé sous l’effet d’une expansion mondiale des arbovirus. Ceux-ci sont sortis de leur berceau d’origine et circulent principalement au sein d’un cycle épidémique et urbain. Ils circuleraient entre des populations de virus anthropophiles (aedes aegypti, aedes albopictus, dans certains cas culex pipiens) et les populations humaines.
Le moustique n’est pas une simple seringue : pour que la transmission soit possible, il faut que l’hôte vertébré, homme ou animal, le vecteur (le moustique) et l’agent pathogène évoluent conjointement dans un environnement propice à la transmission. Dans un environnement sauvage existent les cycles enzootiques. Dans les environnements urbains, la plupart des épidémies ont déjà été décrites.
Ce système vectoriel qui comprend le moustique, le virus et l’homme dépend de nombreux facteurs, parmi lesquels la compétence vectorielle, c'est-à-dire la capacité d’un moustique à s’infecter en prélevant du sang sur un être malade, à assurer la multiplication de ce virus et à le faire ensuite sortir par la salive que la femelle va injecter lorsqu’elle va piquer. La durée entre l’entrée du virus dans le moustique et la sortie du virus du moustique est ce qu’on appelle la « période d’incubation extrinsèque ». C’est un facteur – étroitement dépendant de la température – qui va conditionner le succès de la transmission. Lorsqu’on va augmenter la température, on va raccourcir cette période d’incubation extrinsèque.
Le virus Zika a été isolé pour la première fois en Ouganda, en 1947, à partir d’un singe dans la forêt de Zika. Un an plus tard, en 1948, il a été isolé dans un groupe de moustiques, aedes africanus, moustique de canopée qui piquait des singes. Les premiers cas humains ont été détectés en 1952 en Ouganda. Nous avons vu ce virus sortir d’Afrique à partir de 2007, avec une épidémie importante en Micronésie, puis en Polynésie française en 2013, où 66 % de la population ont été atteints. Les symptômes les plus graves associés au Zika ont été observés pour la première fois, c'est-à-dire le syndrome de Guillain-Barré, avec une atteinte du système nerveux périphérique entraînant une paralysie flasque ascendante. Quarante-deux cas de Guillain-Barré ont été répertoriés, ainsi que dix-huit cas de microcéphalie chez des enfants. Le virus s’est ensuite répandu dans tout le Pacifique pour arriver au Brésil (d'abord à Bahia) en mai 2015. Trente et un pays sont aujourd'hui infectés par le virus Zika et 1,5 million de personnes sont touchées en Amérique latine, pour 4 000 à 5 000 cas de microcéphalie.
Aedes aegypti est un moustique qui pique essentiellement l’homme et vit à côté de celui-ci. Nous avons évalué la compétence vectorielle de ce moustique en récoltant des moustiques de Guadeloupe, de Martinique, de Guyane française, du Brésil et du sud des États-Unis d’Amérique. Nous avons infecté ces moustiques avec le virus Zika de génotype asiatique (équivalent à celui qui circule en Amérique du Sud) et en évaluant ensuite le taux d’infection, c'est-à-dire la proportion de moustiques présentant un tube digestif infecté au quatrième jour puis au septième jour après infection. Nous voyons, sur le graphe projeté, que tous ces moustiques sont capables d’être infectés.
La deuxième étape consiste à examiner le taux d’infections disséminées, c'est-à-dire la proportion de moustiques capables de disséminer le virus à l’intérieur du corps du moustique, en passant de façon efficace la paroi de l’estomac. On le fait également au quatrième jour et au septième jour. Le taux d’infections disséminées s’avère moins élevé que le taux d’infection, ce qui signifie que, pour ces moustiques aedes aegypti, la dissémination est moins importante. En d’autres termes, pour la variété étudiée, aedes aegypti parvient à s’infecter sans très bien disséminer le virus.
Nous nous sommes intéressés à une autre espèce de moustique, aedes albopictus ou moustique tigre, qui cohabite avec aedes aegypti en deux endroits, au Brésil et dans le sud des États-Unis. Nous avons évalué la compétence vectorielle de ces deux moustiques vis-à-vis du virus Zika et avons évolué différents paramètres au quatorzième jour après infection. Nous voyons qu’aedes aegypti s’infecte mieux et dissémine mieux le virus Zika. En revanche, le taux de transmission, qui correspond à la proportion de moustiques ayant le virus dans la salive, est relativement faible. Cela signifie que, à quatorze jours après infection, la compétence vectorielle de ces deux espèces, vis-à-vis du virus Zika, est relativement faible.
On peut se demander pourquoi nous constatons aujourd'hui une épidémie de Zika aussi explosive en Amérique du Sud, avec une dynamique relativement rapide. Nous avons face à nous une population humaine très dense, sensible au virus Zika et naïve par rapport à celui-ci. Elle vit à proximité d’une population de moustiques très anthropophiles qui ne piquent pratiquement que l’homme. Ces deux facteurs ont suffi à compenser la faible compétence vectorielle de ces moustiques (aedes aegypti et aedes albopictus).
L’été prochain, aurons-nous un risque de cas autochtones de Zika dans le sud de la France lorsque aedes albopictus entrera en activité ? Les cas importés peuvent venir de la Caraïbe (à la faveur des retours de vacances) ou du Brésil, après la fin des Jeux olympiques. La question reste ouverte et nous aurons la réponse dans très peu de temps.
4. M. Frédéric Jourdain, ingénieur du génie sanitaire, Centre national d’expertise sur les vecteurs (CNEV) – « Les missions du Centre national d’expertise sur les vecteurs. Contrôle des populations de vecteurs. »
Le Centre national d’expertise sur les vecteurs (CNEV) a été mis en place à la suite d’une saisine de l’Institut de recherche pour le développement (IRD) par cinq ministères, en vue de dresser un état des lieux de la lutte antivectorielle en France. Cette saisine a donné lieu à un rapport qui a émis plusieurs recommandations, à commencer par la création d’une structure multidisciplinaire permettant de mobiliser rapidement et efficacement l’ensemble des compétences dans les domaines opérationnels et stratégiques de la lutte antivectorielle en France.
Cette recommandation a été mise en œuvre par les ministères de la santé et de l’agriculture, avec l’appui de l’InVS et de l’ANSES, par l’émission d’un appel à candidatures. Une réponse à cet appel à candidatures a été coordonnée par l’IRD au nom d’un consortium de quarante-deux partenaires institutionnels.
Le schéma organisationnel retenu comportait un laboratoire coordonnateur (l’UMR MIVEGEC de l’IRD) pour les aspects liés à la santé humaine, une unité (CIRAD-INRA) centrée sur les vecteurs de maladies animales, l’EID Méditerranée pour les aspects opérationnels, l’École des hautes études de santé publique pour les questions de sciences humaines et sociales, avec la mobilisation d’un réseau de trente-huit autres partenaires permettant de couvrir l’ensemble des champs disciplinaires concernés par la lutte antivectorielle.
L’origine des participants à ce réseau est très diverse, avec des unités de recherche, des écoles vétérinaires, des universités, des centres hospitaliers, des opérateurs publics de démoustication. C’est donc une structure pluridisciplinaire qui se trouve à l’interface de la recherche et de la gestion des risques. Ses missions sont les suivantes : l’expertise entomologique, l’appui scientifique et technique, l’appui à l’animation technique, la contribution à la formation et à l’orientation de la recherche, la veille scientifique.
Le centre conduit deux grands types d’expertises : des expertises prospectives sur des sujets jugés prioritaires, par exemple l’utilisation des insecticides et la gestion de la résistance, ou la surveillance de vecteurs importants en santé humaine (aedes albopictus) et en santé animale (par exemple les culicoïdes, vecteurs de la fièvre catarrhale ovine).
La seconde grande catégorie d’activités réside dans des appuis scientifiques et techniques auprès des ministères de tutelle, à travers des réponses à des saisines. Ces appuis vont, dans certains cas, contribuer à l’évaluation des risques en appui des agences de sécurité sanitaires et, dans d’autres circonstances, apporter un appui à la gestion.
Nos activités sont étroitement liées au contrôle des vecteurs. Dans ce domaine, il n’y a pas de solution miracle ni de solution unique. Nous nous inscrivons dans le cadre stratégique défini par l’OMS, celui de la gestion intégrée des vecteurs, selon un processus rationnel de prise de décision dans la perspective d’une utilisation optimale des ressources affectées au contrôle des vecteurs. Cette approche vise à améliorer l’efficacité et l’efficience des interventions, tout en réduisant les impacts non intentionnels de la lutte antivectorielle.
Ce cadre stratégique repose sur cinq éléments clés :
• le plaidoyer pour une mobilisation large des différents acteurs concernés ;
• le développement des ressources humaines, de la formation, des structures afin de promouvoir le renforcement des capacités et la mise en œuvre des programmes de contrôle ;
• la collaboration dans le secteur sanitaire et, de manière transversale, avec tous les secteurs concernés par la lutte contre les moustiques (environnement, aménagement du territoire, etc.) ;
• l’intégration des différentes méthodes de lutte, chimiques ou non chimiques (méthode intégrée) ;
• la prise de décision, fondée sur des données probantes, elles-mêmes guidées par la recherche opérationnelle et la surveillance entomologique, épidémiologique voire animale dans le cas de zoonoses.
Dans ce cadre, la lutte antivectorielle a pour but d’interrompre durablement la transmission d’un agent pathogène, en réduisant la population de vecteurs. Pour cela, elle agit à la fois à une échelle individuelle (protection personnelle contre les vecteurs) et à une échelle collective en agissant sur trois paramètres clés de la transmission : la réduction de la densité des vecteurs, la réduction de leur longévité et la réduction du contact hôte-vecteur.
Pour atteindre ces objectifs, différents outils sont disponibles. Des stratégies de contrôle pourront viser les différentes étapes du cycle de développement des insectes, par exemple le développement larvaire, l’accouplement, la recherche de repas sanguins ou celle de repas sucrés. Une lutte intégrée fera ainsi appel à différentes méthodes de lutte qui peuvent être classées en diverses catégories : lutte chimique, lutte mécanique, lutte biologique, lutte génétique.
En matière de lutte mécanique, l’aménagement de l’environnement peut être réalisé de manière définitive. C’est, par exemple, le cas des grands travaux d’aménagement (drainage des eaux, comblement des mares). D’autres techniques de gestion de l’environnement doivent être conduites de manière régulière afin de limiter le développement des larves de moustiques (entretien des canaux et des berges, élimination des plantes aquatiques, gestion des niveaux d’eau). La lutte mécanique inclut aussi l’élimination de tous les récipients pouvant favoriser le développement des larves des moustiques. Cela a une importance considérable dans la lutte contre les aedes, vecteurs d’arbovirus puisque de nombreux gîtes larvaires sont créés, volontairement ou non, par l’homme. On en retrouve très fréquemment dans l’espace péridomiciliaire, voire domiciliaire. Cela permet de souligner un enjeu majeur de la lutte antivectorielle : l’indispensable mobilisation du plus grand nombre pour l’adoption de comportements qui visent à limiter la prolifération des moustiques.
La lutte insecticide conserve une place très importante en matière de lutte contre les vecteurs. Elle est essentiellement mise en œuvre dans le cas de gîtes larvaires non suppressibles et, dans le cas d’une lutte ciblant les moustiques adultes, dans des contextes sanitaires.
La lutte biologique fait appel à des organismes antagonistes, appelé agents de lutte biologique, qui sont des prédateurs, des agents pathogènes comme des virus, des champignons ou encore des bactéries.
La lutte antivectorielle se heurte à plusieurs limites. La résistance des vecteurs aux insecticides est particulièrement problématique, notamment en outre-mer et plus particulièrement dans les départements français d’Amérique, où l’on retrouve des niveaux de résistance, en particulier d’aedes aegypti, très élevés. Cela va de pair avec la diminution drastique de la gamme d’insecticides utilisables en lutte antivectorielle.
La globalisation des échanges de biens et de personnes constitue aussi un enjeu puisqu’elle va favoriser la dissémination des vecteurs (en particulier les espèces invasives) et des virus via les voyages de personnes.
La mobilisation sociale constitue un enjeu majeur. Difficile à mettre en œuvre en cas d’épidémie, elle l’est plus encore dans un cadre de prévention.
Les impacts non intentionnels doivent désormais, à juste titre, être mieux pris en considération mais cet objectif a également pour conséquence de complexifier les actions de lutte.
Je terminerai par l’évocation de quelques techniques innovantes de lutte antivectorielle. Il s’agit de méthodes complémentaires aux méthodes existantes. Je citerai trois techniques qui ciblent les aedes (aegypti ou albopictus). La première est celle de l’insecte stérile, qui consiste à relâcher des mâles préalablement stérilisés par irradiation. Ces mâles vont s’accoupler avec des femelles sauvages qui n’auront donc pas de descendance.
La deuxième technique est l’utilisation d’un groupe de bactéries, appelées Wolbachia. Elle peut être utilisée dans le cadre de stratégies de remplacement de populations ou d’élimination. Ces bactéries peuvent tout d'abord affecter la santé générale de l’insecte, réduire sa durée de vie et le rendre réfractaire à l’infection par des virus comme la dengue. Ces bactéries se transmettent verticalement par les femelles. La descendance est donc infectée, ce qui favorise le remplacement des populations. Enfin, les croisements entre un mâle infecté par la bactérie et une femelle saine est stérile.
La dernière technique est celle de modification génétique, consistant à relâcher massivement dans la nature des mâles transgéniques porteurs d’un nouveau gène qui les rend dépendants à un antibiotique : en l’absence de celui-ci, le moustique ne peut se développer et meurt. Les mâles transgéniques vont ainsi s’accoupler à des femelles sauvages mais leur descendance, porteuse du transgène et privée de l’antibiotique, ne pourra se développer, ce qui conduit à la diminution des populations.
Ces techniques sont actuellement mises en œuvre en différents endroits du monde dans des conditions semi-contrôlées. Il est encore trop tôt, au vu des connaissances disponibles, pour dire si elles sont efficaces à grande échelle.
M. Roland Courteau. - Nous vous remercions et remercions toute votre équipe du Centre national d’expertise, qui a fort obligeamment répondu à nos questions pour nous aider à préparer au mieux cette audition publique.
5. Mme Catherine Mir, responsable de la sous-direction santé-environnement, produits chimiques et agriculture, Direction générale de la prévention des risques, Ministère de l’environnement, de l’énergie et de de la mer, – « Efficacité et risques des produits insecticides »
Je pense que vous aurez compris que la lutte contre les maladies transmises par les insectes vecteurs doit prendre en compte la biologie de ces insectes. Il doit s’agir d’une action intégrée et globale. Elle est coordonnée par le ministère de la santé et repose sur la lutte contre la prolifération des insectes et s’appuie sur toutes les connaissances dont nous disposons, afin de jouer sur les conditions qui sont favorables au développement de ces moustiques.
Bien entendu, cette lutte intégrée peut avoir recours à des produits chimiques insecticides et il faut souvent y avoir recours. Le ministère chargé de l’environnement intervient sur ces questions en tant qu’autorité compétente pour l’usage de ces produits, au titre du règlement européen dit « biocide », qui encadre leur utilisation. D’une manière générale, on distingue deux catégories de produits : ceux qui détruisent les larves d’insectes (larvicides) et les produits qui tuent les insectes adultes (produits adulticides). Dans la pratique, ces produits sont de nature différente. Pour les produits larvicides, la substance active est une bactérie (bacillus thuringiensis israelensis). Il existe deux souches de cette bactérie. C’est alors une lutte qui est plutôt d’ordre biologique. Pour les produits adulticides, ce sont des molécules insecticides souvent utilisées par ailleurs pour lutter contre les moustiques de façon générale, dans le cadre de la démoustication. Ils sont également utilisés en tant que produits phytosanitaires.
Cette lutte contre les vecteurs est très ciblée sur le terrain en France : ces insecticides sont utilisés autour du domicile afin de limiter la transmission entre l’homme et le moustique et inversement. La quantité utilisée dans le domicile et hors de celui-ci est relativement faible comparativement aux usages qui peuvent être faits dans le cadre de la démoustication en général ou en tant que produits phytosanitaires.
Les produits biocides utilisés en lutte antivectorielle ou pour la démoustication sont les mêmes. Ils sont peu nombreux. Avant l’entrée en vigueur de la directive puis du règlement communautaire, il n’existait que quelques substances utilisées car ces produits se positionnent sur un marché relativement restreint, peu rentable pour les industriels. Aujourd’hui, à la suite de la mise en place du règlement, certaines substances n’ont pas été soutenues par les industriels pour être inscrites dans le programme d’évaluation de ces substances en vue d’un usage de démoustication ou de lutte antivectorielle.
Il ne reste ainsi aujourd’hui plus qu’une seule substance. Il est vrai que, outre la problématique de coût qu’induit une demande d’autorisation d’un produit biocide, les industriels ont aussi abandonné certains produits qui présentaient un profil toxicologique et des risques pour la santé en vertu desquels ces produits ne leur semblaient pas intéressants à défendre. La seule substance – en cours d’évaluation au niveau européen – qui peut aujourd’hui être utilisée est la deltaméthrine. D’autres produits ou modalités peuvent être utilisés contre les insectes vecteurs, notamment les moustiquaires imprégnées d’insecticide et les répulsifs appliqués sur la peau, qui sont également des biocides.
S’agissant des substances actives contre les moustiques adultes, et compte tenu du fait qu’il ne reste plus qu’une seule substance, dans les régions françaises où ces substances ont pu être utilisées de façon très régulière en raison des épidémies, on a observé le développement de résistances, en particulier pour la deltaméthrine. Il existait aussi des résistances aux substances utilisées avant la mise en œuvre de la directive.
Ces résistances existent dans les territoires d’outre-mer, notamment en Guyane et dans les Antilles françaises. On n’observe pas de résistance sur le territoire métropolitain puisque ces insecticides y sont peu utilisés. Ces résistances remettent en cause l’efficacité des substances.
Le règlement permet, dans l’hypothèse où il faut utiliser une substance autre que la deltaméthrine, un certain nombre de dérogations. Certaines peuvent être accordées pour une période de cent quatre-vingts jours en cas de nécessité. La France a utilisé cette possibilité à plusieurs reprises par le passé. À chaque fois, l’ANSES et le Haut Conseil de la santé publique ont été consultés, d’une part, quant à la nécessité de recourir à ces substances et, d’autre part, sur les risques que présentent ces produits et les recommandations d’usage qui peuvent être nécessaires à mettre en place dans le cas d’épidémies.
Des autorisations provisoires peuvent également être délivrées pour des travaux de recherche et développement. Bien entendu, ce type de dérogation est peu aisément applicable dans le cadre d’une épidémie puisqu’il s’agit d’autorisations ciblées pour des expérimentations ou des évaluations.
Finalement, hormis les produits larvicides, qui sont à la fois peu dangereux pour l’homme – car ils relèvent de la lutte biologique –, les produits actifs contre les insectes adultes peuvent présenter des risques. De plus, leur efficacité peut être remise en cause par des phénomènes de résistance. C’est la raison pour laquelle M. Frédéric Jourdain a mis en évidence cette problématique de la résistance aux insecticides dans le cadre de la lutte antivectorielle.
Devant cette situation préoccupante, le ministère de l’environnement et celui de la santé ont engagé différentes actions, avec l’objectif prioritaire de trouver des substances chimiques efficaces pour la lutte. L’ANSES a été saisie à plusieurs reprises afin d’identifier des substances parmi celles utilisées en tant que produits phytosanitaires ou en tant que médicaments vétérinaires. Elle a récemment identifié quatre substances qui présentaient l’intérêt d’avoir des données aisément disponibles pour l’instruction de dossiers. En revanche, ces substances présentent des profils toxicologiques préoccupants et des travaux complémentaires doivent être conduits.
Dans le domaine de la recherche, M. Frédéric Jourdain a évoqué les travaux en cours, qui permettent de limiter la résistance à la deltaméthrine. Des méthodes très innovantes permettent l’autodissémination, ce qui réduit l’exposition des personnes. Nous avons saisi le Haut Conseil des biotechnologies sur les techniques d’utilisation des OGM. Citons également les travaux sur la bactérie Wolbachia. Par ailleurs, le ministère de la santé a engagé l’élaboration d’un plan de lutte antivectorielle intégrée.
La recherche de ces substances présente des défis importants consistant à trouver des solutions efficaces, au regard des résistances qui existent, sans présenter des risques pour la santé. Ce sont les industriels qui doivent porter les dossiers relatifs à ces substances au niveau européen. Les aides allouées aux entreprises, par exemple dans le cadre du programme d’investissements d’avenir, ne sont pas adaptées à ce type d’innovation dans les entreprises qui fabriquent les produits chimiques, compte tenu de la faible rentabilité de ces produits.
II. LES ÉPIDÉMIES DE MALADIES À TRANSMISSION VECTORIELLE
1. Pr Jean-François Delfraissy, directeur, Agence nationale de recherche sur le Sida et les hépatites virales (ANRS – France Recherche Nord & Sud Sida-HIV Hépatites) et Institut immunologie, inflammation, infectiologie et microbiologie (ITMO I3M) – « Les crises sanitaires infectieuses. Comment organiser la recherche ? »
Mon propos portera sur l’organisation de la recherche en vue de la réponse rapide à des crises sanitaires. Celles-ci sont présentes depuis fort longtemps. Nous y sommes peut-être plus sensibles depuis quelques années. Nous avons tous été beaucoup marqués par Ébola. Nous avons à peine eu le temps de nous en remettre que le virus Zika est arrivé et qu’Ébola est même reparti en Guinée. Un certain nombre de ces pays vont se retrouver avec des maladies infectieuses émergentes sous-jacentes en permanence.
Ces crises sanitaires peuvent survenir au Nord. La mutation d’un virus grippal, qui a plusieurs fois été évoquée, finira un jour par se produire, ce qui constitue une vraie question pour des pays se considérant à un très haut niveau sanitaire comme la France, l’Europe en général et les États-Unis. Or nous ne sommes pas réellement prêts.
Nous sommes tous d’accord pour considérer que ces crises sanitaires deviennent très rapidement des crises sociétales et des crises politiques. Les décideurs politiques ont à gérer des crises liées au terrorisme, des crises économiques ou des crises liées à des modifications du climat. Un certain nombre d’entre nous revendiquons l’inscription de la crise sanitaire dans l’agenda des crises. Jusqu’à présent, les décideurs politiques se sont quelque peu débarrassés des crises sanitaires en considérant que c’était l’affaire des médecins. La réponse est évidemment non puisque ces crises deviennent très rapidement sociétales et politiques. Il y a notamment, derrière cela, des décisions stratégiques et budgétaires conditionnant la recherche.
Depuis quelques années, nous avons, au travers d’Aviesan, qui regroupe l’ensemble des grands organismes de recherche français, essayé de construire un mécanisme de réponse à ces crises sanitaires à travers la plate-forme REACting. L’objectif de celle-ci est de construire une recherche adaptée, le plus vite possible, en réaction à une nouvelle crise qui se fait jour. Nous ne prédisons évidemment pas l’avenir. Cette plate-forme est essentiellement tournée vers les crises sanitaires infectieuses mais nous pouvons imaginer qu’il puisse s’agir de crises sanitaires non infectieuses. Le Sud n’est pas le seul concerné. Une crise sanitaire infectieuse peut survenir au Nord.
La recherche se met en route de façon souvent spontanée. Il faut cependant déterminer la manière de donner les moyens à ces chercheurs de répondre de façon coordonnée et structurée. Le système de financement de la recherche n’est pas adapté pour répondre dans des délais très courts. Après le type de réponse organisé en France à la suite de H1N1 en 2009, de nombreuses questions de recherche ont été posées. De très nombreux projets de recherche ont été lancés et de nombreuses publications ont été faites. Des financements ont été alloués. Ce n’est pas suffisant. Qu’avons-nous retenu et avons-nous été capables de réagir dans des délais adéquats au cours des crises ultérieures ?
Le chikungunya est survenu dans les Antilles et aux Caraïbes. Il a disparu peu après la mise en place de toutes les cohortes constituées, pour des raisons qu’on ne comprend pas totalement. Ces cohortes servent maintenant pour Zika. L’investissement que nous mettons en place peut, dans certains cas, bénéficier à plusieurs crises successives.
En ce qui concerne Ébola, j’ai été chargé de la réponse française au plan interministériel. Des actions de recherche ont été conduites. Je ne m’y attarde pas, sauf sur un point. Comme vous le savez, on s’est aperçu assez tardivement, après l’épidémie d’Ébola, de la possibilité d’une transmission sexuelle du virus Ébola, ce qui signifiait qu’il existait des réservoirs humains du virus.
Des faits similaires sont en train de se passer pour Zika et pour la dengue. Nous ne connaissons pas encore la portée, en santé publique, de l’existence de cette transmission sexuelle. Une nouvelle page des virus émergents est en tout cas en train de s’écrire autour de cette notion de réservoirs humains potentiels. La reprise de l’épidémie en Guinée est, par exemple, liée à un survivant d’Ébola. Nous avions monté une cohorte de survivants d’Ébola avec une idée complètement différente visant à suivre leur devenir. Cela devient maintenant une étude du réservoir chez les survivants. D’autres réservoirs sont possibles et seront étudiés.
Un point essentiel est sous-estimé en permanence, quels que soient les efforts : la recherche en sciences humaines et sociales. Il s’agit d’un point clé de la crise, durant celle-ci et entre deux crises. Il s’agit nécessairement d’une approche multidisciplinaire. Il n’est pas si facile d’impliquer des représentants des sciences humaines et sociales. Ils aiment souvent être un peu en dehors afin de conserver un esprit critique au regard de ce qui est mis en place. À l’inverse, traiter ce type d’épidémie sans avoir avec soi des équipes de sciences humaines et sociales et une réflexion sur l’environnement ni s’appuyer sur les associations de patients et sur la société civile serait une erreur fondamentale. Nous l’avons bien vu à propos d’Ébola en Guinée.
En ce qui concerne Zika, de nombreuses initiatives, coordonnées par REACTing, sont en cours. Elles s’appuient sur les équipes de l’INSERM et sur les réseaux existants. Nous ne sommes pas en train de constituer des équipes spécialisées. Il s’agit d’une coordination souple. On ne coordonne pas les chercheurs. On peut les inciter à aller vers telle direction, en particulier en recherche translationnelle – surtout lorsqu’on dispose d’un financement pour les aider. La première initiative a été réalisée a posteriori à la suite de ce qui s’était passé en Polynésie française, notamment sous l’égide de l’équipe du Pr Arnaud Fontanet. Deux articles essentiels sont parus dans The Lancet sur la relation Zika, microcéphalie et syndrome de Guillain Barré.
Un autre dispositif est en train de se monter, en urgence cette fois-ci, en s’appuyant sur ce qui avait déjà été réalisé sur le chikungunya avec le suivi des femmes enceintes dans les trois départements français d’outre-mer. Il s’agit du suivi de 5 000 femmes enceintes par an en Martinique, en Guyane et en Guadeloupe. Le suivi des enfants est également prévu. Bien sûr, il y a des cas de microcéphalies. Des enfants peuvent naître normaux de mères ayant développé un Zika durant la grossesse et développer quelque chose plus tardivement au cours de leur première année de vie.
Le troisième élément de la réponse française sera réalisé en collaboration avec le Brésil, à travers la réponse à un appel d’offres européen, porté par M. Xavier de Lamballerie.
Zika constitue un virus particulier en raison de son tropisme pour les cellules originaires du système nerveux central. Lorsqu’on regarde les équipes de neurosciences, on se rend compte que nous avons assez peu de connaissances à ce sujet. Quels sont les récepteurs ? Quelle est l’interaction ? Le virus entre-t-il dans des cellules qui présentent un certain degré de maturité dans le système nerveux central ?
Nous sommes en train d’utiliser là un autre pan de la recherche, à travers des spécialistes de neurosciences qui ont une appétence pour ces thèmes. Nous nous y sommes mis avec un peu de délai. Nous les avons tous réunis, il y a quinze jours, et une série d’équipes, en France, sont en train de travailler sur le sujet au sein de l’Institut Pasteur, de l’INSERM, de l’IRD, etc.
Pour tout cela, il faut de l’énergie. Nous n’en manquons pas. Il faut que les directeurs d’organismes soient d’accord pour accepter une coordination assez souple, qui permette d’embarquer tous les acteurs et la Maison France, au-delà des différents organismes. Il faut aussi une vision avec quelques points fondateurs. Nous les avons. Il existe en France une communauté très importante sur les arbovirus. Les premières interventions vous l’ont montré. Cela n’a rien à voir avec ce que nous avons vu au début avec Ébola, où il n’y avait que trois équipes de recherche. Il existe au moins vingt-cinq équipes très bien organisées et très reconnues au plan international qui travaillent sur les arbovirus.
Le discours du Président de la République, François Hollande, à Lyon, à la fin du mois de mars 2016, autour du règlement sanitaire et de la Global Health Security a constitué un moment important. Ce discours dessine un élément fondateur pour l’équipe de REACTing puisque le Président de la République reconnaît cette activité de coordination et lui donne un financement – ce pour quoi je me suis beaucoup battu –, étant entendu que celui-ci est indispensable, sans attendre les résultats des appels d’offres de l’ANR et du programme hospitalier de recherche clinique (PHRC), qui ne sont absolument pas adaptés à ces crises sanitaires. L’ensemble de ces messages scientifiques ou plus stratégiques peut être retrouvé dans le numéro spécial du Lancet du 28 mai 2016 portant sur les réponses françaises dans le domaine de la santé ou de la diplomatie sanitaire.
2. M. Christophe Paupy, chargé de recherche, Institut de recherche pour le développement (IRD) – « Émergence des arbovirus »
Mon discours se placera en amont des émergences et des crises. Il se focalisera en particulier sur les arbovirus liés à aedes. Nous avons vu le triptyque parasite-hôte-vecteur, formant des systèmes extrêmement équilibrés, fruits de long processus coévolutifs. Il arrive que ces systèmes soient déséquilibrés, permettant le transfert de nouveaux agents infectieux vers de nouveaux hôtes, dont l’homme. Cela permet l’épidémisation et l’extension d’agents infectieux vers de nouveaux territoires et, parfois, l’émergence de nouvelles formes de la maladie. Depuis toujours, l’homme est le principal élément perturbateur, de par son action d’anthropisation des écosystèmes naturels, en raison des processus d’urbanisation et parce qu’il assure la diffusion des agents infectieux et des vecteurs.
Je reviens sur trois arboviroses majeures, à commencer par la dengue, qui a émergé dans les années 1950 sous sa forme grave (la dengue hémorragique) en Asie du Sud-Est avant de gagner d’autres continents (Amériques, Océanie, Afrique) à partir des années 1980. 40 % de la population mondiale sont aujourd’hui exposés et 350 millions de cas se déclarent chaque année, dont 500 000 cas de dengue sévère et plus de 30 000 décès – chiffre largement sous-estimé. Nous avons vu le développement du chikungunya depuis 2005 et, plus récemment encore, l’apparition du virus Zika.
Nous constatons une accélération sans précédent de ces émergences d’arbovirus aedes avec une tendance, depuis dix ans, à la pandémisation de ces virus, ce que reflète notamment la description de formes sévères, pour des virus qui étaient souvent considérés comme bénins. Nous avons très peu de médicaments et aucun vaccin, sauf pour la fièvre jaune. Les territoires français extra-métropolitains sont particulièrement concernés mais la métropole l’est aussi. Des cas importés ont été constatés récemment, même une micro-épidémie de chikungunya à Montpellier, en 2014, ainsi qu’une micro-épidémie de dengue à Nîmes, en 2015.
Tous ces arbovirus (chikungunya, fièvre jaune, Zika, dengue) partagent des cycles enzootiques en commun, en Afrique ou en Asie. Tous, au cours de leur histoire, ont trouvé le moyen de passer chez l’homme. Ils ont pu s’épidémiser, d’abord dans des villages puis dans des villes. En raison des phénomènes de globalisation, ils ont pu se répandre à la surface du monde, soit par le transport aérien moderne (pour les phénomènes les plus récents), soit à la faveur de moyens de transport plus limités.
Il existe aujourd’hui des conditions propices à la transmission de ces virus du fait de la présence de vecteurs invasifs, tels que l’aedes aegypti, originaire d’Afrique et l’aedes albopictus, originaire d’Asie. Ces deux moustiques forestiers, à l’origine, ont, au cours de leur histoire, trouvé le moyen de s’adapter à l’homme, notamment au stockage d’eau, pour se répandre à la surface de la planète (xve et xvie siècles pour l’aedes aegypti, plus récemment pour l’aedes albopictus). Ces deux espèces pullulent aujourd’hui dans les villes et exposent les populations à un risque extrêmement important.
Devons-nous craindre l’émergence de nouveaux virus ? Je crains que oui. Les forêts tropicales regorgent de nombreux virus. Il en existe de très nombreuses collections, notamment en Afrique. Certains virus n’ont pas encore été nommés mais ont été isolés, en particulier des virus transmis par des aedes. Les pressions anthropiques sont de plus en plus grandes sur les écosystèmes forestiers, ce qui accroît les probabilités de passage vers l’homme. Il est donc crucial de surveiller les changements qui s’opèrent, notamment à l’interface des environnements sauvages et des environnements anthropiques.
Il me paraît particulièrement intéressant d’évoquer ici les changements de populations de vecteurs. Il est important, dans ce contexte, de détecter au plus tôt les émergences afin de les anticiper et de lutter contre les phénomènes à la source. Cela nécessite d’avoir une vision à très long terme, sous la forme de questions : combien d’années auront été nécessaires pour que le virus Zika puisse faire valoir son potentiel épidémique alors qu’il a été isolé en 1947 ?
Un exemple de perturbation de l’environnement forestier est constitué par l’invasion d’aedes albopictus en Afrique. Introduit en Afrique depuis les années 2000, il a envahi en particulier l’Afrique centrale, d’abord les villes puis les villages. Il a sans conteste modifié l’épidémiologie des arboviroses en Afrique centrale, suscitant l’émergence de la dengue, du chikungunya mais aussi du virus Zika. Ce moustique est aujourd’hui retrouvé dans des villages à proximité des forêts. Il est réputé pour piquer l’homme mais aussi les animaux. Peut-il aller au contact de cycles enzootiques et permettre l’émergence de nouveaux virus pour l’homme en particulier – qui seraient transférés localement et pourraient s’épidémiser localement avant de se globaliser, à l’image de ce qui a été observé avec le virus Zika ?
Dans le contexte actuel de globalisation, ces émergences d’arbovirus sont finalement assez prévisibles. Nous pouvions prédire l’émergence du virus Zika. Nous ne pouvions peut-être pas prédire où, quand ni comment elle se produirait mais son émergence était prévisible. Il y a encore de nombreux candidats à l’émergence. Autrement dit, nous devons accentuer les efforts de veille, tant pour détecter les vecteurs (veille entomologique) que sur le plan des agents infectieux (veille virologique) dans ces environnements naturels, au plus près de la source et des forêts.
Il faut considérer un phénomène local qui peut devenir très rapidement global, comme nous le voyons avec Zika, afin de traiter ces problèmes d’émergence le plus précocement possible. Cela suppose de renforcer les capacités de réponse et de surveillance, non seulement dans nos pays mais aussi dans les pays du Sud (en particulier en Afrique). Il faut améliorer les outils de prévention, à commencer par la vaccination. Nous avons aujourd’hui de nombreux candidats à l’émergence, ce qui plaide pour un effort d’anticipation et de recherche de vaccins contre ces candidats. Bien entendu, nous devons améliorer les outils de contrôle des vecteurs et encourager l’innovation dans ces domaines.
M. Roland Courteau. - En 2006, les épidémies de chikungunya à La Réunion et de dengue en Guyane française ont donné lieu à des rapports de mission débouchant sur des recommandations. Vous avez, Monsieur, fait partie de ces équipes. Les épidémies actuelles présentent-elles les mêmes caractéristiques qu’en 2006 ? Les recommandations des rapports de mission ont-elles été suivies d’effets ?
M. Christophe Paupy. - Nous parlons, en évoquant les « épidémies actuelles », des épidémies de chikungunya et de dengue. Par comparaison avec le Zika, les virus sont totalement différents mais sont transmis par les mêmes vecteurs. Il s’agit de virus assez similaires du point de vue des grands principes de transmission. Cependant, comme l’a montré l’exposé de Mme Anna-Bella Failloux, il existe de légères différences du point de vue de la dynamique de transmission. Il est donc très difficile de comparer les virus et les épidémies.
Quant au suivi des recommandations, je crois que, après l’épidémie de chikungunya qui a touché La Réunion, un effort important a été fait, pour la recherche et pour structurer les services de lutte antivectorielle. Dans le cas de La Réunion, des baisses de financement importantes avaient eu lieu, malgré des épidémies survenues en 1978 et en 1979, notamment une épidémie de dengue qui avait touché plus de 50 % de la population. Malgré cela et malgré la présence d’aedes albopictus, nous constations une diminution de l’effectif et des moyens alloués à la surveillance entomologique et à la lutte antivectorielle. On a revu la question et davantage de moyens ont été alloués à ces services. La situation s’est donc sensiblement améliorée et il semble que les recommandations ont été suivies.
3. M. Paul Castel, directeur général, et M. Manuel Munoz-Rivero, directeur adjoint à la direction santé publique et environnementale, Agence régionale de santé Provence-Alpes-Côte-d’Azur (ARS PACA) – « La lutte contre les moustiques en Provence-Alpes-Côte-d’Azur »
M. Paul Castel. - Je crois que le dispositif qui existe en région PACA est justifié par la situation de la région, qui est celle présentant le risque le plus élevé de départ épidémique. Depuis 2004, le moustique tigre a colonisé l’ensemble de la région, hormis une partie des Hautes-Alpes. Le nombre de signalements de cas suspects reçus représente environ 40 % de l’ensemble des cas étudiés en métropole.
L’Agence régionale de Santé, qui a notamment des attributions de planification, dans le secteur sanitaire, est un opérateur de l’État en matière de veille et de sécurité sanitaire. L’ARS définit, pour le compte de chaque préfet de département, les zones et modalités de lutte contre les moustiques. Un autre acteur majeur est le conseil départemental, qui a la responsabilité de la mise en œuvre de cette lutte antivectorielle. Il existe aussi un opérateur, dont un représentant est d’ailleurs présent aujourd’hui, chargé de la mise en œuvre effective de la démoustication : l’Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée).
Le rôle de l’ARS réside essentiellement dans la coordination et l’harmonisation du dispositif en région et dans la préparation de réponses à la crise en cas de départ épidémique.
M. Manuel Munoz-Rivero. - Pour répondre à ces enjeux, l’ARS va déployer différentes actions au cours de l’année en distinguant schématiquement deux périodes : la période de repos du moustique, du 1er décembre au 30 avril, qui sera une phase de préparation à froid de la saison ; la période d’activité du moustique, du 1er mai au 30 novembre, durant laquelle une surveillance humaine renforcée sera mise en place, avec le déploiement d’un dispositif antivectoriel autour des cas.
Durant la période de préparation de la saison, l’ARS PACA va essentiellement préparer, sur la base d’un modèle régional, les six arrêtés préfectoraux qui seront soumis à la signature de chaque préfet de département. Le rôle de chacun y est bien défini.
Depuis 2015, en début de saison, l’ARS PACA assiste les préfets de département pour organiser une réunion avec l’ensemble des communes et établissements publics de coopération intercommunale afin de discuter de leur rôle dans le dispositif et de leur fournir des éléments de communication sur ces enjeux de santé publique.
En effet, les communes ont un rôle majeur à jouer, du fait de leurs compétences de police générale en matière de salubrité, notamment, afin de s’inscrire dans une lutte durable et pas uniquement dans une lutte chimique contre les moustiques adultes. Elles sont aussi les mieux placées pour mobiliser la population dans la lutte communautaire.
On réalise aussi une sensibilisation de nos professionnels de santé, en particulier les médecins, libéraux et hospitaliers, ainsi que les biologistes. Nous travaillons avec les établissements de santé, d’abord pour leur rappeler qu’ils doivent mettre en place un programme de réduction des risques lié à aedes albopictus à l’intérieur de leur secteur. L’ARS PACA va également réaliser des inspections et contrôles dans le cadre de l’application du règlement sanitaire international : nous vérifions que la réglementation est appliquée, en particulier sur nos points d’entrée sur le territoire.
Enfin, le rôle de l’ARS est de se préparer à la gestion d’une situation de crise sanitaire. Un travail de fond est effectué depuis plusieurs années auprès des communes afin de favoriser leur implication et leur coopération en cas de départ épidémique. La multiplication des émergences de cas autochtones de dengue en 2014 (quatre cas de dengue sur deux foyers) avait fait craindre un débordement des moyens de lutte de l’opérateur. Nous avions alors proposé aux préfets de zone d’écrire aux conseils départementaux en vue d’une mutualisation des moyens sur l’ensemble de la zone Sud. La mise en œuvre de cette mutualisation reste à éprouver, de même que le niveau de renfort que pourraient apporter les communes en cas de départ épidémique. Nous y travaillons.
Lors de la période d’activité du moustique (du 1er mai au 30 novembre), la lutte antivectorielle sera ciblée autour des cas suspects de chikungunya, de dengue et de Zika. L’ARS met en place une surveillance épidémiologique renforcée des cas suspects afin d’orienter les mesures de lutte antivectorielle autour des cas. Les objectifs de cette surveillance renforcée sont de limiter le risque de circulation de ces trois virus en métropole et de détecter précocement tout cas importé ou autochtone. Si le cas est importé, l’objectif de la lutte antivectorielle sera d’éviter que les moustiques puissent se contaminer au contact de cette personne. Si le cas est autochtone, il témoigne d’une circulation locale du virus. L’objectif est alors de circonscrire la circulation de ce virus afin d’éviter qu’elle ne se propage à un territoire plus étendu.
Dès la notification à l’Agence régionale de Santé des cas suspects, une enquête épidémiologique est réalisée par des professionnels de santé de la veille sanitaire. Le questionnaire d’enquête inclut des informations sur les lieux de vie et les déplacements du patient pendant la phase de circulation du virus à l’intérieur de son sang. L’action de l’ARS sera donc de prescrire le plus rapidement possible des mesures de lutte afin d’interrompre la chaîne de transmission du moustique et d’éteindre les foyers épidémiques.
La région PACA est particulièrement concernée par cette période de surveillance renforcée. En 2015, nous avons dénombré 379 cas suspects qui ont été investigués par les équipes de veille et de sécurité sanitaire, soit 40 % de l’ensemble des cas suspects au niveau national, essentiellement dans nos trois départements littoraux : les Alpes-Maritimes, le Var et les Bouches-du-Rhône. 38 % de ces cas ont fait l’objet d’un signalement à l’Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée), ce qui veut dire que nous avions validé les cas.
Dans la majorité des cas, l’intervention de l’EID s’est limitée à une prospection des gîtes larvaires et des moustiques adultes. Néanmoins, trente-six opérations de lutte antivectorielle ont été réalisées en 2015. La lutte antivectorielle s’opère alors dans le respect des zones naturelles protégées (comme Natura 2000) et comporte en PACA, depuis 2015, un protocole d’alerte des apiculteurs, élaboré en lien avec les acteurs locaux, en particulier la fédération régionale de défense des apiculteurs.
4. Mme Marie-Claire Paty, coordinatrice de la surveillance des maladies à transmission vectorielle, Institut national de veille sanitaire (InVS) – « La situation en France métropolitaine et aux Antilles, en Guyane, en Polynésie française et à La Réunion en 2016 »
Le panorama que je vais vous présenter est fondé sur les données de surveillance épidémiologique. Au sein de l’InVS, la surveillance épidémiologique est coordonnée au niveau national et par ses cellules en région mais est mise en œuvre avec de nombreux partenaires, au premier rang desquels les Agences régionales de santé, le Centre national de référence des arbovirus, les professionnels de santé en général et les chercheurs.
Les données de surveillance servent à guider les mesures de contrôle – c’est-à-dire, en l’espèce, les mesures de lutte antivectorielle – de façon à éviter une circulation autochtone d’arbovirus ou de maladies transmises par les vecteurs. Cette surveillance sert aussi à préciser le poids des maladies sur la santé de la population et le système de soins et à caractériser les risques de transmission.
La surveillance épidémiologique est adaptée aux situations locales et au risque vectoriel. Les outils de cette surveillance dépendront donc de la présence ou non des vecteurs. Ainsi, la surveillance du paludisme n’est pas la même en métropole et en outre-mer. Il en est de même pour la dengue ou le chikungunya, dont la surveillance variera suivant qu’elle est effectuée dans les départements où le vecteur est présent ou dans ceux où il est absent. Enfin, l’endémicité de la maladie entre en ligne de compte. La dengue étant en situation épidémique dans les Antilles, la surveillance que nous y mettons en place n’est pas la même qu’en métropole.
Ce panorama débute par La Réunion, où l’épisode de chikungunya, en 2005-2006, a été l’occasion d’une prise de conscience de l’importance de ces maladies. Plus d’un tiers de la population avait été infecté. Aujourd’hui, la circulation du chikungunya à La Réunion est relativement calme. Une petite résurgence a eu lieu en août 2009 avec cinq cas. Un peu moins de deux cents cas ont été recensés de mars à décembre 2010. Une bonne partie de la population est protégée parce qu’elle a été infectée mais La Réunion reste potentiellement exposée à ce virus. Rappelons que, dans ce territoire, le vecteur est le moustique tigre (aedes albopictus).
Ce territoire n’est pas seulement concerné par le chikungunya : il l’est aussi par la dengue, dont les dernières grandes épidémies datent de la fin des années 1970. Une épidémie beaucoup plus modeste a eu lieu en 2004 et aurait pu servir de signal d’alarme.
Les épisodes de transmission de dengue se répètent, en particulier depuis 2012. Il s’agit d’épisodes modérés, de quelques dizaines de cas. Un tel épisode est en cours actuellement. La courbe épidémique de l’épisode actuel indique un nombre total de moins de cinquante cas à ce jour. Cela rappelle que la dengue n’a pas disparu de La Réunion.
Le paludisme a été déclaré éradiqué par l’OMS en 1979. Le vecteur est néanmoins présent. C’est la raison pour laquelle nous surveillons le paludisme différemment dans les outre-mer et en métropole.
À Mayotte sont présents les deux vecteurs, aedes albopictus et aedes aegypti. Le système de soins y est plus complexe et les mouvements de population plus importants. La surveillance est fondée sur la surveillance des syndromes fébriles « dengue-like » (qui ressemblent à la dengue), en liaison avec le centre hospitalier de Mayotte. Là aussi, nous constatons des épisodes répétés de circulation de la dengue, avec plusieurs centaines de cas. On ne les comptabilise certainement pas tous. Le chikungunya avait aussi infecté plus du tiers de la population en 2005-2006. Un épisode de résurgence très limitée (moins de dix cas identifiés) s’est aussi produit en 2012.
Le paludisme sévit toujours à Mayotte. Comme dans le reste du monde, on observe une chute significative du nombre de cas, qui avait conduit à s’interroger quant à l’évolution des modalités de lutte et de prévention. En 2014, le Haut Conseil de la santé publique a estimé qu’il demeurait une menace importante à Mayotte et qu’il fallait maintenir les mesures de lutte et de prévention qui étaient en place.
Aux Antilles françaises, les vecteurs d’arbovirose sont les moustiques aedes aegypti. La surveillance des maladies infectieuses est intégrée dans des programmes régionaux PSAGE (programmes de surveillance, d’alerte et de gestion des épidémies). La surveillance constitue une dimension de ces programmes, au côté notamment de la lutte antivectorielle. Dans le cas de la dengue, qui est endémo-épidémique sur ce territoire, il existe une circulation permanente du virus et une remontée du nombre de cas lors des épidémies. La dernière épidémie date de 2013. Une épidémie de grande ampleur avait eu lieu en 2010, avec d’importantes conséquences sanitaires.
Le chikungunya a abordé le continent américain par les Antilles françaises, via Saint-Martin, où il avait d’abord été mis en évidence. 160 000 cas avaient été recensés dans l’ensemble des Antilles. Nous ne mettons pas en évidence à l’heure actuelle de circulation de chikungunya. Sans doute le phénomène d’immunité de la population protège-t-il en partie le territoire d’un nouveau phénomène épidémique.
Les Antilles ont aussi été marquées par l’émergence du virus Zika en décembre 2015, mis en évidence grâce au dispositif de surveillance.
S’agissant du paludisme, les derniers cas remontent aux années 1960. Des actions de surveillance des cas de paludisme importés sont conduites, de même que des actions de démoustication, de façon à éviter une reprise de circulation du paludisme aux Antilles.
En Guyane, la situation est un peu différente dans la mesure où ce territoire se trouve sur le continent. Les maladies qui sévissent sont toutefois les mêmes. La dengue y est endémo-épidémique. Une épidémie de chikungunya a eu lieu en 2014. Le Zika – arrivé, cette fois-ci, par le Brésil – a émergé en 2015. Du point de vue des départements et territoires français, la Guyane était en première ligne quant au risque. Le virus a été mis en évidence à peu près en même temps en Guyane et en Martinique.
La Guyane présente une particularité : la fièvre jaune, qui est une arbovirose transmise par aedes, dont le réservoir est animal (singes). La fièvre jaune circule toujours dans la zone. Le dernier cas date de 1998. La vaccination est obligatoire en Guyane où il existe une bonne couverture vaccinale. Le paludisme continue également de circuler. On constate une diminution du nombre de cas mais une persistance du risque.
Nous voyons dans le Pacifique une intensification de la circulation des arbovirus, en particulier depuis 2010. La circulation de la dengue constitue un phénomène mondial qui n’a pas épargné la Polynésie française. L’émergence de Zika a d’abord eu lieu sur ce territoire en 2013, avant une circulation dans la zone, notamment vers la Nouvelle-Calédonie. L’épidémie de Polynésie française fut l’occasion de décrire les premières complications du Zika. Le chikungunya a émergé après le Zika en Polynésie française.
En métropole, le risque est lié à aedes albopictus (moustique tigre), arrivé en 2004 dans les Alpes-Maritimes depuis l’Italie. Il est actuellement présent dans trente départements. Ses incursions vers le Nord de la France vont jusqu’en Alsace. En Île-de-France, il est présent dans le Val-de-Marne.
Nous surveillons, avec les ARS, la dengue et le chikungunya. Nous avons constaté des épisodes de transmission autochtone limités mais qui se répètent, avec, en 2010, deux cas de chikungunya et deux cas de dengue à Fréjus et à Toulon. En 2013, a été révélé un cas de dengue près d’Aix-en-Provence puis, en 2014, quatre cas de dengue en PACA et une petite épidémie de chikungunya à Montpellier. Enfin, en 2015, est survenue une petite épidémie de dengue à Nîmes. Ces épisodes sont limités mais se répètent et tendent à augmenter en taille.
C’est probablement parce que nous avons un système coûteux mais performant que tous ces épisodes ont été mis en évidence en France. En 2007, a eu lieu une épidémie de chikungunya en Italie, qui avait atteint trois cents personnes, ce qui nous indique que, sous nos latitudes, le nombre de cas ne se limite pas nécessairement à quelques personnes infectées si nous ne faisons rien.
M. Roland Courteau. - Merci, Madame, pour ce panorama dont chacun comprend qu’il est très évolutif. Je voudrais également souligner qu’il est possible d’en prendre connaissance en détail grâce à l’excellent site de l’InVS, que j’invite chacun à consulter.
Au-delà des risques, il y a les peurs. Dans le cas du virus Zika, elles sont lourdes. Nous avons vu que le lien de causalité entre ce virus et des pathologies graves n’était pas toujours démontré. À travers le retour d’expérience de la Polynésie française, le professeur Arnaud Fontanet va nous dire ce qu’il en est de deux complications graves du virus Zika, le syndrome de Guillain-Barré et la microcéphalie.
5. Pr Arnaud Fontanet, directeur, Unité d’épidémiologie des maladies émergentes, Institut Pasteur – « Deux complications graves du virus Zika : le syndrome de Guillain-Barré et la microcéphalie à travers le retour d’expérience de la Polynésie »
L’infection par le virus Zika est le plus souvent à l’origine d’une maladie bénigne – lorsque des symptômes se manifestent – et asymptomatique. La première épidémie décrite est celle de l’île de Yap en Micronésie, en 2007. Elle a touché quelques dizaines de personnes. Ces patients symptomatiques avaient un peu de fièvre et une éruption cutanée, qui était sans doute le symptôme le plus caractéristique. Des douleurs articulaires et des conjonctivites étaient parfois présentes. La fièvre était modérée. Tout rentrait dans l’ordre en quelques jours. La maladie était donc décrite comme bénigne et aucune complication n’avait été observée. Lorsqu’une enquête sérologique a été effectuée au décours de cette épidémie en Micronésie, elle a montré que les trois quarts de la population de l’île (7 000 personnes) avaient été infectés et que 80 % de ces personnes avaient été asymptomatiques. Malheureusement, il existe deux complications graves mais rares qui ont été décrites. Ce sera le cœur de mon propos ici, sur la base de l’expérience acquise en Polynésie française. Ce travail a été réalisé avec les équipes du bureau de veille sanitaire de Polynésie française, de l’Institut Louis Malardé, du centre hospitalier de Polynésie française et avec nos collègues de l’AP-HP à Paris.
Sur la première diapositive ici projetée, la courbe épidémique, en orange, se rapporte à l’épidémie de Zika en Polynésie française, qui a débuté en octobre 2013 et a duré jusqu’en avril 2014. Cette courbe a été établie sur la base des déclarations d’un réseau de surveillance local composé de médecins généralistes qui ont rapporté environ 30 000 cas suspects de virus Zika. Les premiers ont été confirmés. Par la suite, la confirmation n’était plus nécessaire compte tenu du caractère bénin de la maladie. En noir, apparaissent les quarante-deux cas de syndrome de Guillain-Barré, qui ont évidemment attiré notre attention.
Ces quarante-deux cas de syndrome de Guillain-Barré, sur une période de six mois, correspondent à une multiplication par dix-sept du taux habituel de syndrome de Guillain-Barré dans ces îles de Polynésie française. Une enquête réalisée en Polynésie française au décours de l’épidémie de Zika a montré que 66 % de la population avait été infectés par le virus Zika durant cette épidémie. Nous avons pu en déduire qu’il y avait 2,4 cas de syndrome de Guillain-Barré pour 10 000 infections par le virus Zika. Il s’agit donc d’une complication rare. Nous sommes néanmoins dans des chiffres proches de ceux observés pour le syndrome de Guillain-Barré, qui survient généralement à raison de deux à cinq cas pour 10 000 infections par la bactérie campylobacter jejuni. La seule différence réside dans le fait que les deux tiers de la population, ici, avaient été touchés.
Le syndrome de Guillain-Barré est une paralysie dite « ascendante ». Les patients sont d’abord touchés par une faiblesse musculaire des membres inférieurs, qui remonte. Lorsqu’elle atteint la cage thoracique, les patients peuvent ne plus être en mesure de respirer. Ils peuvent être hospitalisés en soins intensifs – ce qui représente environ un tiers des cas. Les patients mettent du temps à récupérer et peuvent garder des séquelles. La récupération peut prendre jusqu’à un an.
Dans les cas spécifiques de syndromes de Guillain-Barré observés en Polynésie française, environ une semaine avant le début des symptômes neurologiques, 88 % des patients avaient fait un épisode infectieux typique du virus Zika. Seize des quarante-deux patients atteints par le syndrome de Guillain-Barré (soit 38 % d’entre eux) ont dû être hospitalisés en réanimation. Il faut noter l’aggravation très rapide de l’état de ces patients : il n’y a eu que quatre jours entre le début des symptômes neurologiques et l’admission en soins intensifs. Ceux qui ont été admis en soins intensifs y sont restés un mois.
J’attire votre attention sur le fait que, lorsque plusieurs patients doivent être hospitalisés en soins intensifs avec, peut-être, la nécessité d’y rester un mois, il faut prévoir localement des capacités de lits de soins intensifs. C’est ce qui nous préoccupe aujourd’hui pour des régions comme les Antilles ou la Guyane française. Nous collaborons avec nos collègues de l’InVS, de la Cellule de l’Institut de veille sanitaire en région (CIRE) Antilles-Guyane et des centres hospitaliers locaux afin de nous assurer que toutes les mesures ont été prises pour accueillir les patients si nous devions voir le même nombre de cas, toutes proportions gardées, que celui observé en Polynésie française en 2013-2014.
Les patients qui ont évolué favorablement sont restés une semaine à l’hôpital. À trois mois, plus de la moitié des patients marchait. Le message que les praticiens hospitaliers de Polynésie française nous ont envoyé soulignait une aggravation rapide – au regard de ce que nous connaissions du syndrome de Guillain-Barré – mais une récupération rapide également et plutôt meilleure que ce que nous connaissions dans ce type de cas. Les patients ont tous été traités par immunoglobuline intraveineuse – qui est un médicament coûteux. Un patient a dû recevoir des plasmaphérèses. Aucun décès n’a eu lieu. On atteint généralement 5 % de décès pour les patients atteints du syndrome de Guillain-Barré.
Lorsqu’il a fallu s’assurer que le syndrome de Guillain-Barré était bien lié à l’épidémie de Zika, la concordance spatio-temporelle que vous avez vue sur le graphique précédent a été vérifiée. À l’Institut Louis Malardé, nous avons testé tous ces patients à la recherche d’IgM anti-Zika, qui ont été retrouvés chez 93 % des patients. Les IgM témoignent d’une infection récente. Il y a des possibilités de réactions croisées avec la dengue mais cela n’a pas constitué pour nous un véritable sujet de préoccupation.
Tous les patients touchés par le syndrome de Guillain-Barré avaient des anticorps anti-Zika. Nous avons également pu montrer par une comparaison avec des groupes témoins qu’il était peu probable qu’une dengue antérieure ait pu précipiter le syndrome de Guillain-Barré chez les patients qui l’avaient développé en Polynésie française.
Je passe sur la forme particulière, dite axonale, de ces syndromes de Guillain-Barré. C’est ce qui a été retrouvé chez les patients. Un examen électromyographique est nécessaire à trois mois pour confirmer la nature de cette complication.
En conclusion, pour le syndrome de Guillain-Barré, nous avons relevé une association spatio-temporelle typique, ce qui est à rapprocher d’une infection récente par le virus Zika, avec des anticorps anti-Zika et une évolution rapide mais, heureusement, une fois le stade critique passé, favorable.
Les microcéphalies sont la deuxième complication importante des infections par le virus Zika. En Polynésie française, nous sommes revenus avec nos collègues du centre hospitalier de Polynésie française et des hôpitaux de l’AP-HP à Paris sur les dossiers des grossesses qui avaient eu lieu pendant le passage épidémique du virus Zika en 2013-2014 et sur les dossiers à l’accouchement pour essayer de voir si les microcéphalies mises en évidence au Brésil, en novembre 2015, avaient été observées en Polynésie française. Elles n’avaient pas été notées au moment de l’épidémie même, sans doute parce que ces complications rares étaient en nombre limité.
Néanmoins, nous avons retrouvé sur la période d’épidémie – qui durait six mois – sept cas de microcéphalie alors que nous en avons dénombré un seul au cours d’une période de deux ans autour de l’épidémie. Le cas de microcéphalie isolé correspond à ce qu’on voit habituellement à raison de deux cas pour 10 000 naissances en Europe, aux États-Unis d’Amérique ou en Polynésie française. Les sept cas qui ont eu lieu au moment de l’épidémie représentaient une augmentation d’un facteur 50 de l’incidence de ces microcéphalies en rapport avec l’épidémie du virus Zika. Nous avons également montré, par modélisation mathématique, que la période de vulnérabilité était le premier trimestre de la grossesse, s’agissant des microcéphalies. Ce risque a été estimé à 1 %.
Les microcéphalies ne sont pas les seules complications neurologiques congénitales associées à une infection par le virus Zika durant la grossesse. On sait qu’il y en a d’autres. Les cohortes de femmes enceintes, recrutées aujourd’hui au Brésil, en Colombie et aux Antilles, à travers l’initiative REACTing, sont extrêmement importantes car elles permettront une description de l’ensemble des manifestations neurologiques possibles chez des fœtus ou des enfants nés de mères infectées par le virus Zika. Je m’attends à ce que le chiffre soit de quelques pour cent d’enfants nés avec une malformation congénitale neurologique grave à l’issue d’une grossesse où la mère aurait été infectée par le virus Zika. Le type de malformation neurologique dépendra du moment de l’infection par le virus. S’il s’agit du premier trimestre, ce seront plutôt des microcéphalies. Si l’infection est survenue aux deuxième ou troisième trimestres, il s’agira sans doute d’autres manifestations qui peuvent également être très graves.
6. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier – « Contrôle des vecteurs et évolution de leurs populations »
Nous avons vu que des succès extrêmement importants avaient été remportés récemment, permettant la diminution du nombre de cas par la combinaison de différentes interventions. Cela a été décrit de manière locale et de façon très précise en Afrique de l’Ouest. Nous voyons, sur le graphique projeté, la diminution du nombre de cas de paludisme (falciparum) essentiellement due à la combinaison de dérivés d’artémisinine et de l’utilisation de moustiquaires imprégnées d’insecticide ou de l’utilisation d’insecticides en intra-domiciliaire. Au niveau local et à l’échelle de l’Afrique dans son ensemble, nous voyons des courbes descendantes de parasitémies de 2000 à 2015. Une analyse multivariée parue dans Nature a montré que plus de 60 % de ce gain, en nombre de vies sauvées, était dû à l’utilisation de ces moyens de la lutte antivectorielle, en particulier les moustiquaires imprégnées.
Ce succès est fragile, en raison notamment de l’émergence de résistances à ces insecticides. La plus connue, chez les anophèles vecteurs de paludisme, est la mutation d’un seul acide aminé dans la protéine qui sert de cible à ces insecticides, qu’il s’agisse du DDT ou des pyréthrinoïdes. C’est le canal sodium, sur les neurones des insectes, qui entraîne la paralysie et la mort de l’insecte. Un changement d’un seul acide aminé permet à l’insecte de résister. L’insecticide ne peut plus se fixer sur sa cible. On documente actuellement une montée en fréquence importante de ces résistances dans toutes les populations d’anophèles gambiae d’Afrique. La fréquence au sein des populations naturelles augmente au cours du temps. Plus on a de résistances dans ces populations de moustiques, moins on a de mortalité. L’insecticide ne fonctionne plus. Cela va même plus loin. Nous devons lutter contre des insectes résistants aux insecticides et qui changent leur comportement par rapport aux méthodes de contrôle mises en place.
Les graphes de droite représentent un suivi longitudinal de la transmission, au Bénin, dans des endroits où ont été mises en place des méthodes de contrôle très surveillées dans le cadre de projets de recherche. Les anophèles qui piquaient principalement au milieu de la nuit décalent leur comportement pour piquer plus tôt ou plus tard, en début de soirée ou en début de matinée, lorsque les gens ne sont plus couverts par des moustiquaires imprégnées d’insecticide. Cela a donc un impact sur l’épidémiologie de la transmission. Celle-ci se décale, en dépit du fait que l’on augmente la pression en termes de contrôle des vecteurs.
Un autre mécanisme, moins spécifique, de résistance aux insecticides réside dans l’augmentation, chez les populations d’insectes, de la production d’enzymes de détoxication, qui vont lutter contre les conséquences de l’exposition du moustique aux insecticides, notamment en termes de stress oxydant. Les moustiques sont équipés avec un arsenal d’enzymes permettant la dégradation de l’insecticide ou un meilleur contrôle de son action sur le stress oxydatif des moustiques. Ces enzymes vont aussi permettre aux moustiques de mieux supporter d’autres biocides et polluants urbains et ainsi permettre aux anophèles, qui étaient essentiellement des insectes ruraux, de s’adapter à l’environnement urbain. Vous imaginez ce que cela peut donner avec des concentrations de populations moins exposées au paludisme, qui redeviennent sensibles et perdent leur immunité, dans des villes dont les anophèles étaient absents. Avec l’utilisation des insecticides, on favorise l’adaptation de ces anophèles au milieu urbain.
C’est exactement ce que l’on observe actuellement en Afrique. La photo A décrit un gîte larvaire d’anophèles gambiae qu’évoquait le Pr Martin Danis. Il s’agit d’une espèce essentiellement rurale qui se développe en eau propre, non polluée. On retrouve aujourd’hui des anophèles dans des environnements très pollués, comme on le voit sur la photo B, à droite, qui représente un gîte larvaire anophèle au milieu de la ville de Yaoundé au Cameroun. On change ainsi le lieu de la transmission : celle-ci était rurale, nocturne et intra-domicilaire. Elle devient urbaine, non totalement nocturne, dans une population devenue plus sensible, car moins exposée à la pression du plasmodium. Nous sommes trop performants pour le contrôle des anophèles en Afrique et basons tout sur l’utilisation d’une seule molécule, la deltaméthrine, un insecticide. On a compris avec les médicaments que c’était une bêtise d’utiliser une seule molécule car cela finit par sélectionner des résistances. Nous le faisons encore pour les moustiques, ce qui n’est pas judicieux. Nous voyons déjà des manifestations de cette pression insecticide.
Les villes grandissent en Afrique. Il faut nourrir les populations et le maraîchage se développe. Ce sont des îlots de campagne importés dans des villes, formant des environnements favorables aux anophèles. Ce sont aussi des environnements où l’on utilise énormément d’insecticide. On va ainsi favoriser l’adaptation des anophèles et changer la transmission du paludisme pour les années à venir. Nous devrions nous en soucier fortement.
M. Roland Courteau. - Nous avons bien conscience que nous n’avons fait qu’entrapercevoir l’ampleur de la mission de votre unité de recherche.
J’ai été membre, il y a une quinzaine d’années, du Conseil d’administration de l’EID, dont M. Christophe Lagneau, son directeur de recherche, va nous exposer les procédés de démoustication et leurs limites.
7. M. Christophe Lagneau, directeur recherche et développement, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée) – « Évolution de la présence des moustiques : procédés, effets et limites de la démoustication »
L’opérateur est confronté à des moustiques, en particulier sur le littoral méditerranéen. Il existe soixante-cinq espèces de moustiques en France, dont une quarantaine sur le littoral. La démoustication désigne le maintien de la nuisance à un niveau supportable par les hommes et les animaux. Nous sommes, en réalité, confrontés à une équation à trois inconnues : il faut être efficace et respecter l’environnement, pour un coût contraint. L’intersection de ces paramètres met en évidence les notions de gouvernance, d’évaluation et d’indicateurs.
M. Frédéric Jourdain a passé en revue les méthodes de lutte disponibles. Je me concentrerai ici sur l’utilisation des biocides (insecticides). Comme l’a rappelé Mme Catherine Mir, une directive européenne, attendue et nécessaire, a été adoptée, en 1998, édictant les règles de mise sur le marché des produits biocides destinés à l'hygiène publique. Elle a eu des conséquences particulières. En ce qui concerne la lutte contre les larves de moustiques inféodés aux milieux naturels, si quelques produits restent autorisés, seul le Bti (Bacillus thuringiensis ser israelensis) est encore utilisé en raison de son faible impact. Le Bti est également souvent privilégié en milieu urbain. S’agissant de la lutte contre les adultes, nous sommes devant une gamme d’insecticides proposés par les fabricants mais tous ces produits appartiennent à la famille des pyréthrinoïdes, parmi lesquels le plus connu est la deltaméthrine.
Il existe sur le territoire métropolitain des activités liées à la présence du moustique, en particulier dans les zones humides. La France compte aussi des territoires ultramarins, faisant de l’Hexagone un particularisme européen : la France est un des rares pays de l'Europe continentale à se préoccuper, sur son territoire national, de maladies vectorielles.
C’est dans les marais à mise en eau temporaire que se développent les moustiques aedes ochlerotatus, qui n’ont pas le même comportement que le moustique tigre aedes albopictus. Contrairement à ce dernier qui est essentiellement urbain, ils pondent leurs œufs directement sur le sol des marais au moment de leur assec. Les œufs éclosent et les larves apparaissent à la survenue d'une mise en eau. Les moustiques qui en émergent provoquent des nuisances considérables jusqu'à plusieurs dizaines de kilomètres du lieu de ponte. Ce phénomène rendait le littoral invivable jusqu'à l'avènement de la démoustication confiée en particulier aux ententes interdépartementales dès le début des années 1960. À titre d'exemple, l'EID Méditerranée réalise des traitements antilarvaires chaque année depuis plus de cinquante ans sur quelques 40 000 hectares de gîtes larvaires cumulés.
La répartition des gîtes larvaires de ces espèces fait l’objet d’une cartographie écologique très précise et les opérations de lutte reposent sur un ensemble de procédures répondant aux exigences réglementaires et environnementales en la matière.
Ces milieux naturels sont soumis à des règles européennes de protection de la nature, notamment dans les parcs Natura 2000, ce qui complexifie le métier. Des méthodes de traitement par voie aérienne sont également remises en cause.
L’apparition du moustique tigre sur le territoire métropolitain et en Corse a conduit à introduire une nuisance tout à fait nouvelle, en plus du risque vectoriel. Si les opérateurs publics que nous sommes sont totalement impliqués dans la mise en œuvre des opérations de lutte antivectorielle, en accord avec la DGS et les ARS, la situation est différente du point de vue de la lutte contre la nuisance. Le moustique a introduit une nuisance dans le quotidien des habitants en ville et les gens ne le comprennent pas, en particulier dans les zones touristiques. Une confusion apparaît ainsi entre la nuisance due aux moustiques traditionnels et celle causée par l’aedes.
Quelques pistes sont en train d’être examinées. Nous cherchons à mobiliser tous les acteurs sur ce sujet. L’ANSES effectue un travail important, que nous accompagnons. Il faut trouver un insecticide alternatif au BT mais aussi un adulticide pouvant être utilisé ponctuellement dans les milieux périurbains, voire les milieux naturels, et pouvant remplacer la deltaméthrine afin d’amorcer une gestion de la résistance.
Nous expérimentons actuellement l’autodissémination sur le littoral méditerranéen. Des stations d’autodissémination, contenant un insecticide agissant à très faible dose, sont réparties dans certains quartiers des zones urbaines. Cette station contenant de l’eau, attractive pour les femelles en quête d’un lieu de ponte. Elle va se contaminer et aller contaminer d’autres gîtes lorsqu’elle y pondra. Cette méthode s’avère très prometteuse. Tous les opérateurs sont intéressés par cette approche.
D’autres pistes résident notamment dans les barrières de pièges. Dans les villes et aux interfaces avec les zones humides, le Bti ne suffit pas. Il faut protéger les populations. Nous expérimentons notamment des piégeages au CO2.
En conclusion, il apparaît indispensable et urgent de poursuivre l'évaluation et l'amélioration des stratégies actuelles mais également de développer et d'expérimenter des méthodes alternatives ou innovantes telles que la lutte génétique (lâchers de mâles stériles,...).
8. Pr Jérôme Depaquit, directeur, Unité de recherche transmission vectorielle et épidémiosurveillance de maladies parasitaires, Université de Reims Champagne-Ardenne – « Les maladies transmises par les phlébotomes »
Les phlébotomes sont de petits insectes discrets, relativement peu connus de la population, sauf pour ceux qui en subissent les nuisances puisque leur piqûre est douloureuse dans la mesure où ils coupent la veine au moment où ils piquent. Leurs larves vivent dans la terre et leur dispersion est tout à fait limitée, ce qu’on ne peut comparer aux dispersions des moustiques, qui s’opèrent depuis l’Antiquité à la faveur des transports des larves dans les navires et dans les réserves d’eau douce. Il existe 900, voire 1 000 espèces de phlébotomes aujourd’hui dans le monde.
Leurs mœurs sont plutôt crépusculaires et nocturnes, à quelques exceptions près. Leur taille est très faible (deux à quatre millimètres). Les femelles sont hématophages, c’est-à-dire qu’elles prennent un repas de sang. C’est à l’occasion de ces repas de sang qu’elles vont transmettre diverses maladies. Je n’évoquerai que les leishmanioses. Il existe une vingtaine d’espèces de leishmanies transmises à l’homme dans le monde. Les phlébotomes transmettent essentiellement des phlébovirus que je n’évoquerai pas ici.
Les phlébotomes sont répartis dans le monde entier. Nous ne connaissons pas, chez les phlébotomes, d’espèce invasive. Les leishmanioses transmises par les phlébotomes sont des maladies considérées comme prioritaires par l’OMS. Les formes les plus graves sont les leishmanioses viscérales, causées par deux espèces, leishmania infantum et leishmania donovani.
L’espèce leishmania infantum existe sous forme endémique dans le Sud de la France. Il s’agit d’une maladie essentiellement canine et d’importance vétérinaire. Nous avons environ trente cas humains tandis que 20 % à 50 % des chiens sont positifs, selon les techniques d’analyse utilisées. Les leishmanioses cutanées sévissent dans le monde entier. Il existe également des formes cutanées en France.
En France, tous les cas autochtones de leishmanioses sont causés par leishmania infantum. Le CNR recense environ une trentaine de cas humains par an. La transmission s’effectue à l’étage méditerranéen dit humide, de manière localisée, dans les arrière-pays méditerranéens, idéalement là où les vecteurs sont les plus abondants, c’est-à-dire entre 200 et 800 mètres d’altitude. Le réservoir le plus important est le chien, qui va avoir une maladie chronique évoluant sur plusieurs années, permettant au phlébotome de se charger en parasites pour les transmettre éventuellement à l’homme.
Ces données ont été très bien étudiées par le professeur Rioux, de Montpellier, qui a montré au cours des années 1960 que l’étage idéal de transmission se trouvait là où le vecteur était le plus abondant. C’est ce qu’on appelle l’éco-épidémiologie. Au-delà de la zone à risque, la saisonnalité entre en ligne de compte : la période de transmission va en général de juillet à début octobre. Avec les changements climatiques, cette période à risque tend à s’allonger par rapport à ce qui prévalait il y a vingt ou trente ans.
S’agissant des vecteurs de leishmanioses en France, il existe deux vecteurs principaux : phlebotomus perniciosus (qui a donné lieu à quelques mentions septentrionales dans le pays) et phlebotomus ariasi, plus méditerranéen que perniciosus.
Une étude publiée, en 2010 en France montre que l’on surveille beaucoup plus la leishmaniose canine – en raison du nombre de cas beaucoup plus élevé chez le chien que chez l’homme – et que les cas sont localisés en grande majorité dans le Sud de la France, dans le foyer historique des Cévennes et dans la région de Nice. Quelques cas étaient également observés, entre 1965 et 2007, dans le Sud-Ouest et en Corse. Les mêmes auteurs ont établi des projections pour l’extension des leishmanioses et prédisent, compte tenu des changements climatiques, une septentrionnalisation par la façade atlantique jusqu’au pays nantais. C’est peut-être, à mon sens, négliger un peu trop rapidement une septentrionnalisation éventuelle par le couloir rhodanien, qui ne me paraît pas insurmontable pour les phlébotomes.
Existe-t-il un risque d’introduction d’autres leishmanioses en France ? Nous avons très peu de phlébotomes en France métropolitaine. Six espèces ont été décrites, dont cinq que l’on rencontre parfois et deux à trois qui sont majoritaires. Ces espèces, qui sont majoritaires en France ne sont pas connues pour transmettre d’autres leishmanioses que leishmania infantum. Il existe une autre espèce présente en France, notamment en Corse et dans les Pyrénées-Orientales, phlebotomus sergenti, qui est le principal vecteur d’une leishmaniose cutanée. Il s’agit d’une anthroponose, c’est-à-dire qu’aucun réservoir n’est nécessaire. L’introduction de cette espèce pourrait avoir lieu en France. Néanmoins, à Chypre par exemple, une autre leishmaniose a été importée en 2008 du Moyen-Orient par le biais de leishmania donovani. Elle se transmet en dehors de ses vecteurs habituels, qui ne sont pas présents à Chypre. Le risque d’introduction d’autres leishmanioses transmises par les phlébotomes autochtones me paraît donc faible.
Le risque d’une introduction exotique de phlébotomes est également très faible puisqu’il n’existe pas actuellement de phlébotomes, sur la carte du monde, qui ne soient pas à leur place. Les phlébotomes américains sont présents en Amériques et non en Europe ni en Asie, et réciproquement.
En ce qui concerne la France d’outre-mer, la problématique est un peu plus complexe. Il existe par exemple quatre-vingts espèces de phlébotomes en Guyane. Le risque d’introduction d’autres leishmanioses est méconnu. La déforestation en Guyane amènera en tout cas la leishmaniose viscérale avec son vecteur, lutzomyia longipaldis.
Je voudrais terminer par une alerte sur la perte des connaissances. L’entomologie médicale a longtemps constitué un domaine d’excellence dans la recherche française. Cette excellence est liée, d’une part, à la tradition coloniale de notre pays et aux traditions qui ont existé depuis le début du xxe siècle dans les universités et, d’autre part, au fait que l’entomologie médicale ne s’improvise pas : il faut en général au moins vingt à vingt-cinq ans pour devenir efficace, ce qui implique un compagnonnage à maintenir.
Au cours des années 1960, l’OMS avait déclaré que l’éradication du paludisme était proche – notion, certes, relative. Avec l’avènement de la chloroquine comme principal médicament antipaludique, a débuté un long déclin des entomologistes en France jusqu’aux années 2000. Une prise de conscience de cette négligence « étatique » a été permise par l’épidémie de chikungunya qui a frappé La Réunion. Des maladies d’importance vétérinaire telles que la fièvre catarrhale ovine puis la fièvre chevaline, transmise par les culicoïdes, sont également survenues.
Il faut réellement maintenir ce compagnonnage. Je suis particulièrement fier que ma patronne, qui m’a tout appris, Mme Nicole Léger, soit présente dans cette salle. Ce compagnonnage ne passe pas seulement par la recherche. Je ne suis pas certain qu’il faille être un très grand chercheur pour être compétent sur un groupe d’insectes. Ce n’est pas dénué de sens d’aller sur le terrain et de décrire des espèces nouvelles. Lorsque nous allons sur le terrain pour agir ainsi, ce n’est pas bien valorisable par la recherche et il est difficile de maintenir ces compétences dans le monde de l’instantané dans lequel nous vivons.
M. Roland Courteau. - Nous saluons donc, par la même occasion, votre patronne, Mme Nicole Léger.
Mme Nicole Léger. Bonsoir. Peut-être suis-je la seule ici à être agrégée de pharmacie et de médecine ?
9. Mme Nathalie Boulanger, maître de conférences et praticien attaché au Centre national de référence sur la borréliose de Lyme, Université de Strasbourg, Centre hospitalier de Strasbourg – « Les maladies transmises par les tiques »
Je vous remercie pour votre invitation. Si le moustique va au contact de son hôte, il n’en est pas de même de la tique, notamment la tique dure, qui a un repas sanguin très long. L’homme, notamment, et les animaux qui vont héberger ces tiques vont aller au contact de celles-ci, qui sont à l’affût. Sa salive va moduler la pharmacologie et l’immunologie de son hôte. Les tiques vont attendre l’hôte. Ces caractéristiques auront un impact important sur la transmission des agents infectieux, notamment pour la prévention.
Les tiques, dans leur ensemble, sont constituées de deux grandes familles : les tiques molles (argasidés), avec notamment ornithodoros et les tiques dures, probablement les plus importantes, avec Ixodes et rhipicephalus. On dénombre environ deux cents espèces de tiques molles et sept cents espèces de tiques dures. Sur le plan médical et vétérinaire, les tiques sont le vecteur numéro un. Sur le plan de la médecine humaine uniquement, elles se classent deuxième en termes de transmission d’agents infectieux.
Le spectre des agents infectieux est très large et celui que je présenterai ici n’est pas exhaustif, loin de là. Parmi ces agents se trouvent des virus, notamment l’encéphalite à tique, qui sévit principalement dans l’hémisphère nord. Des parasites sont également transmis. J’attire votre attention sur le fait que ces pathogènes circulent principalement chez les animaux. Il s’agit donc de zoonoses dont la répartition est mondiale. Leur éradication est donc impossible et la prévention remplit une fonction essentielle.
Les bactéries transmises par les tiques dures sont beaucoup plus nombreuses. Outre la borréliose de Lyme, il existe les fièvres récurrentes à tique, les rickettsioses, l’anaplasmose et les ehrlichioses.
Si l’on parle beaucoup du réchauffement climatique dans l’émergence des maladies à tiques, je préfère le terme d’anthropisation, qui a déjà été évoqué. Nous savons que l’homme a modifié les écosystèmes. Il a, par exemple, modifié la culture de la forêt et désertifié les campagnes, faisant apparaître de nouveaux écosystèmes. L’introduction des cervidés en France a également fait exploser la population de tiques ixodes. La disparition des prédateurs, notamment du lynx et du loup, a créé un écosystème parfait pour les tiques, à travers, en particulier, les animaux supportant très bien la prolifération des tiques, dont ces cervidés.
Les changements socio-économiques entrent aussi en ligne de compte. Avec l’effondrement du bloc soviétique, la pauvreté a gagné du terrain dans les pays de l’Est, poussant la population à aller en forêt pour collecter des champignons et baies sauvages, ce qui a fait émerger de nombreuses maladies à tiques, parmi lesquelles l’encéphalite à tique et la borréliose de Lyme.
En ce qui concerne les pays du Sud, les mouvements des animaux, notamment du bétail, posent d’importants problèmes vétérinaires. La mondialisation du commerce du bétail a étendu la carte de répartition des amblyomma et des rhipicephalus. Elle génère aussi de nombreux problèmes pour l’agriculture avec la spoliation sanguine provoquée par les tiques
Ces pathologies circulent probablement depuis de nombreuses années mais leur existence n’est connue que depuis le milieu du XXe siècle car l’on parvient à mieux identifier les tiques, mieux cultiver et détecter les agents infectieux qu’elles transmettent – notamment détection par la biologie moléculaire. De plus, les techniques de diagnostic se sont améliorées avec la sérologie et, notamment la spectrométrie de masse, en large essor.
L’approche translationnelle est essentielle. Il faut donc travailler sur des modèles animaux, ce qui n’est pas toujours évident – car nous n’avons pas toujours le modèle animal adéquat – pour extrapoler à l’homme ce qui a été observé chez l’animal.
L’approche multidisciplinaire est également indispensable. L’interface chimie-biologie est cruciale afin de mettre en commun les connaissances. En France, un réseau de scientifiques travaillant sur les tiques, le Réseau écologie des interactions durables (REID), permet des échanges importants dans le domaine scientifique et de progresser dans le domaine de l’écologie et de la biologie des tiques. Des réseaux européens se sont également créés cette année.
Il existe des tentatives de cartographie des zones à risque, notamment avec l’ECDC (European Centre for Disease Control) pour les tiques les plus importants (ixodes, rhipicephalus et dermacentor). De plus en plus d’informations sont diffusées aux professionnels de santé mais cet effort est encore très insuffisant, notamment vers les médecins et les pharmaciens, en particulier dans les zones où ils sont moins sensibilisés aux maladies à tiques. Cette sensibilisation est particulièrement forte dans l’Est de la France où les tiques et les maladies transmises sont plus nombreuses.
De façon plus pragmatique, en Alsace, l’Agence régionale de santé-Alsace a créé un comité de pilotage « tiques et maladies transmises ». Nous nous sommes retrouvés autour d’une table avec la Mutualité sociale agricole, l’Office national des forêts, le Centre de référence maladie de Lyme, les universitaires et les hospitaliers. Les personnes exposées aux piqûres de tique et aux maladies transmises ont exposé leurs problèmes et nous essayons de trouver des solutions afin d’aboutir à une meilleure prévention. Cela a conduit à une information du grand public sur le risque acarologique, avec la distribution de plaquettes d’information remises aux écoles, aux mairies et aux médecins. Nous installons des panneaux dans des zones particulièrement fréquentées en Alsace afin de parler des tiques et des risques de maladies transmises.
10. Mme Véronique Chevalier, directrice adjointe, Unité de recherche animal et gestion intégrée des risques (AGIRs), Centre de coopération international en recherche agronomique pour le développement (CIRAD) – « Cartographie des risques des maladies à transmission vectorielle »
J’évoquerai ici la cartographie du risque de transmission des maladies vectorielles à travers une seule méthode. Il en existe de nombreuses autres. Mon propos portera sur le West Nile, étant entendu que ces méthodologies peuvent être appliquées à de nombreuses autres maladies, vectorielles ou non.
La fièvre West Nile est provoquée par un flavivirus, transmis de manière selvatique entre des oiseaux sauvages (qui sont des réservoirs ; 150 à 200 espèces pouvant être infectées par ce virus) et des moustiques de type culex. Nous avons parlé de pipiens et de modestus. Ce virus peut être transmis par d’autres vecteurs. Lorsque les conditions sont favorables et que le cycle est suffisamment amplifié, le virus peut être transmis aux chevaux et aux hommes, qui sont des hôtes accidentels chez qui l’infection est le plus souvent asymptomatique. Dans 30 % des cas, elle provoque un symptôme grippal (causant des fièvres et des douleurs) et dans environ 1 % des cas un symptôme encéphalique.
Il existe d’autres modes de transmission, suspectés ou démontrés, d’oiseau à oiseau, notamment chez les oiseaux nécrophages. On sait que le virus se transmet par transfusion de sang d’homme à homme et par transplantation d’organes d’homme à homme. Il peut passer l’hiver dans des zones tempérées, durant la saison chaude (de juillet à septembre ou octobre). Le virus peut passer l’hiver dans des culex adultes qui se cachent et réapparaissent plus tard. Le cycle est donc très complexe. Il existe tout de même des déterminants environnementaux puisque le cycle selvatique se décrit entre des oiseaux et des moustiques.
La maladie est connue dans le pourtour méditerranéen et en Europe depuis les années 1960. Des foyers sont apparus de manière très erratique et imprévisible, dans le Maghreb comme en Europe de l’Est, en Europe de l’Ouest et en Europe centrale jusqu’en 2009. En 2010 est survenue une augmentation sensible du nombre, de la fréquence et de la sévérité des cas, notamment en Grèce en 2010 puis en Europe centrale et en Europe de l’Est.
L’épidémiologie de ces pathologies est complexe et il demeure de nombreuses inconnues. Une forte hétérogénéité spatiale, probablement due à la diversité des oiseaux qui portent le virus et des moustiques pouvant le transmettre, est à noter. Ces émergences sont très difficiles à prédire. Les territoires à risque sont très étendus : le virus a été décrit sur tous les continents (Amérique du Nord, Australie, Inde, Asie) et, les oiseaux volant, les frontières n’ont aucune incidence sur la dissémination. Il n’existe pas de traitement : un vaccin a été mis au point pour le cheval, non pour l’homme. La cartographie prédictive, lorsqu’elle peut être établie, permet d’identifier les « hot spots », c’est-à-dire les zones où la maladie peut être transmise et potentiellement émerger. Ces cartographies permettent de cibler dans le temps et dans l’espace la surveillance, les mesures de lutte (lorsqu’elles existent) et les actions de recherche en prédisant dans le temps et dans l’espace ces émergences.
Un travail publié il y a quelques années, réalisé sous la houlette du centre de contrôle des maladies européen en collaboration avec l’université d’Haïfa, visait à produire une carte de risque d’émergence de cette maladie sur le pourtour méditerranéen et en Europe.
Nous avons utilisé, comme indicateur de risque, la date et les lieux des cas cliniques humains confirmés entre 2002 et 2013. Nous avons utilisé comme variable potentiellement prédictrice de la circulation de la maladie des variables environnementales liées à l’écologie des moustiques et à celle des oiseaux. Nous avons notamment travaillé avec les anomalies de température. Nous savons que la compétence vectorielle, c’est-à-dire la capacité des vecteurs à transmettre certains virus, peut varier en fonction de la température. Plus il fait chaud, plus ils sont compétents. La localisation des zones humides est également importante car c’est là que se concentrent les moustiques et certains oiseaux. La cartographie incluait aussi la localisation des eaux libres et les routes de migration des passereaux. De nombreuses études ont été faites et ces oiseaux sont apparemment les principaux réservoirs de la maladie. Il existe deux routes de migration entre l’Afrique et l’Europe, un couloir « ouest » et un couloir « est ». Un certain nombre d’études montrent que les oiseaux qui utilisent le couloir « est », de l’Afrique vers l’Europe, sont beaucoup plus infectés et ont donc une probabilité plus élevée d’apporter le virus en Europe. La cartographie présentait, enfin, les densités de population et un index de proximité géographique que je ne détaillerai pas.
Sur la carte sont entourées en violet des zones où des cas humains ont été confirmés. En rose ou rouge ont été colorées des zones plus ou moins à risque. Plus la couleur est foncée, plus le risque est élevé. Il existe une très bonne concordance entre ce modèle statistique et ce que l’on observe en réalité. Jusqu’en 2004, 2005 ou 2006, cela colle assez bien. À partir de 2010, les zones prédites à risque par ce modèle correspondent assez bien aux zones dans lesquelles des cas humains ont effectivement été observés.
Il existe de nombreuses limites à ce type de méthode, notamment pour le West Nile, pour lequel les inconnues sont extrêmement nombreuses. Elles tiennent en particulier à la détection des cas cliniques humains. En l’absence d’une définition claire et admise par tous, la définition d’un cas clinique humain peut différer en Roumanie et au Maroc. Il en va de même pour la sensibilité des systèmes de surveillance. Nous n’avions aucune idée des indicateurs de performances de ces systèmes ni de la sensibilité de détection de ces cas. Nous connaissons l’identité de certains oiseaux réservoirs mais nous ne les connaissons pas tous. Nous n’avions pas pris en compte la présence et l’abondance des moustiques. On ne connaît pas grand-chose de la compétence de ces oiseaux et de ces moustiques. Surtout, on ne se projette pas dans l’avenir et on ne prend pas en compte le réchauffement climatique, d’une part, ni des changements d’origine anthropique tels que l’aménagement du territoire, d’autre part. Enfin, cette étude a été réalisée à une très large échelle, ce qui sous-entend un certain nombre de biais et d’incertitudes.
Nous avons refait l’exercice en considérant les cent cinquante espèces d’oiseaux dont nous savons qu’elles sont infectées, en prenant en compte leur présence et leur abondance, en fonction des différents paysages, en Europe et sur le pourtour méditerranéen. Le travail est un peu plus précis et un zoom sur chaque zone fait apparaître, pour chaque pixel, une valeur de risque de transmission de la maladie. Les zones détectées comme à risque sont, globalement, les mêmes.
Un travail qui doit être publié prochainement, concernant la France, considère les présences et les abondances d’un certain nombre d’oiseaux réservoirs et de moustiques vecteurs. En rouge apparaissent les zones à risque. Les étoiles rouges figurent les endroits où ont été identifiés des chevaux séropositifs. On constate une bonne concordance entre la localisation de ces étoiles rouges et les zones les plus à risque de cette carte de risque.
Nous avons maintenant des outils très puissants pour détecter et collecter des informations environnementales, notamment à partir d’imageries satellitaires, avec des résolutions très fines. Il est important de savoir ce que l’on a placé dans ces modèles et de ne pas surinterpréter ces cartes. Nous utilisons, par exemple, des eaux marécageuses comme un indicateur de la présence de moustiques. Or, la plupart du temps, nous ne savons rien de la compétence vectorielle de ces moustiques. Quant au West Nile, les inconnues sont encore nombreuses sur les souches, les vecteurs et les réservoirs. Ces techniques sont, bien sûr, applicables aux autres maladies vectorielles.
SECONDE TABLE RONDE, PRÉSIDÉE PAR M. FRANÇOIS COMMEINHES, SÉNATEUR, MEMBRE DE L’OPECST : LE CAS DU VIRUS ZIKA
M. Jean-Yves Le Déaut, député, président de l’OPECST
Je suis très heureux, en tant que président de l’Office parlementaire d’évaluation des choix scientifiques et technologiques et seul député ici présent, d’être parmi vous aujourd’hui. L’Office parlementaire compte dix-huit députés et dix-huit sénateurs qui peuvent être saisis par les commissions ou par le Bureau de l’Assemblée nationale ou du Sénat de sujets scientifiques et technologiques, plutôt sous l’angle de leurs conséquences économiques, sociales et environnementales. Lorsque le sénateur François Commeinhes nous a proposé de conduire cette étude, nous avons pensé que nous étions là dans notre rôle. Il s’agira de notre 192e rapport.
Nous travaillons en amont de la législation et de la réglementation. La préparation de nombreuses lois, notamment dans le domaine de l’énergie, a été facilitée par le travail préalable de l’Office qui informe les parlementaires, recueille des informations et met en œuvre des évaluations car l’Assemblée nationale et le Sénat ne comptent pas que des spécialistes. Ce travail en amont donne lieu à des rapports. L’Office est également saisi par la loi de certains sujets comme, par exemple, par une loi de 2013 de l’évaluation de la stratégie nationale de la recherche ; ou encore, lors de chaque évolution de la loi de bioéthique, l’Office doit rendre un rapport contenant son analyse et des propositions.
Il n’était pas encore question de Zika lorsque l’Office a envisagé de lancer cette étude sur les maladies à transmission vectorielle. En effet, lorsque des sujets d’actualité surgissent – par exemple le survol des centrales nucléaires par des drones, des fissures dans la cuve de l’EPR, la découverte de logiciels de truquage de la mesure des émissions polluantes chez Volkswagen ou la robotisation croissante des usines du futur –, l’Office organise des auditions, au Sénat ou à l’Assemblée nationale, pour faire le point sur ces sujets.
Pour conduire une évaluation rigoureuse et pour que de bonnes décisions soient prises, il faut être en mesure de s’appuyer sur les meilleures connaissances possibles. Cette connaissance est mondiale et nationale. Dans le cas présent, la France est particulièrement concernée au moins au titre de dix-huit départements du Sud de la France et des départements et territoires d’outre-mer. Il nous faut donc bien connaître les virus responsables des maladies, les vecteurs et les moyens de lutte. Vous l’avez très largement expliqué, depuis la dengue et le chikungunya jusqu’à la fièvre jaune et la fièvre du Nil sans omettre la maladie de Lyme, qui a une importance croissante et des impacts en matière de santé publique notamment dans l’Est de la France.
Vous avez abordé les moyens de lutte, qui incluent les insecticides. Vous avez notamment souligné un inconvénient majeur des insecticides, à savoir la résistance qui se développe par des mécanismes naturels pour contourner l’action de l’homme lorsque celui-ci veut agir sur certaines maladies. Il existe aussi des moyens de lutte biologique. J’ai été notamment très intéressé par l’évocation des formes de piégeage. J’ai moi-même travaillé avec la sénatrice Catherine Procaccia, vice-présidente de l’Office, sur la chlordécone aux Antilles et ai vu les dispositifs de piégeage par les phéromones. Vous avez également mentionné la possibilité de relâcher des insectes stériles.
D’autres moyens passent par l’utilisation de bactéries ou des modifications génétiques. Enfin, vous avez évoqué le développement des vaccins, qui est évidemment important. Lorsqu’un certain nombre de virus mutent de manière très rapide, le développement des vaccins se heurte parfois à des difficultés, même si leur apport à la santé publique, d’une façon générale, est indéniable.
Dans le cadre du réchauffement climatique, marqué par une augmentation continue de la température moyenne, certaines espèces de moustiques pourraient changer de zone d’habitation sur la carte du monde. Nous pourrions ainsi constater l’émergence de maladies en des lieux où elles étaient absentes.
Un rapport est en cours d’élaboration par l’OPECST sur l’évaluation des nouvelles technologies. Le sujet soulève maints problèmes. Certaines personnes nous indiquent les bénéfices que nous pourrions en attendre. D’autres nous mettent en garde et demandent à ne pas travailler sur des systèmes biologiques globaux. À leurs yeux, penser que l’on résoudra une question en s’attaquant à un seul élément des systèmes biologiques peut conduire à des catastrophes. Ce matin, devant l’Office, un de vos collègues de Strasbourg, M. Marois, a développé avec beaucoup de talent la question du forçage génétique. On est parvenu, en quelque sorte, à mettre en place un système contraceptif pour les insectes. Il se trouve que j’ai obtenu une thèse de doctorat d’État en biologie moléculaire, à l’Université Louis Pasteur de Strasbourg, dans le laboratoire de Paul Mendel et Pierre Chambon, ce qui me permet de comprendre un peu ces sujets.
Le forçage génétique, c’est la possibilité, avec des méganucléases et des nucléases, notamment CRISPR/cas9, de venir sur le gène de la fertilité et d’y insérer une nouvelle séquence. Finalement, on fait en sorte que l’insecte qui était fertile ne le soit plus. La question globale de l’utilisation de ces technologies, en les lâchant grandeur nature dans la biosphère, mérite réflexion. Il faut définir un cadre législatif. C’est la raison pour laquelle nous y travaillons. Il faut définir des systèmes biologiques qui soient globaux, comparer les bénéfices et les risques et certainement en débattre avec les populations avant de permettre l’introduction de ces technologies.
J’ai été très heureux de vous écouter et d’appuyer mes collègues du Sud de la France qui étaient sans doute plus encore sensibilisés aux enjeux liés à ces vecteurs. Je suis heureux que vous ayez mentionné également la situation des vecteurs dans l’Est de la France.
II. ALERTE ET POINT SUR L’ÉVOLUTION DE LA SITUATION EN FRANCE ET DANS LE MONDE
1. M. Jean-Claude Manuguerra, directeur, Cellule d’intervention biologique d’urgence (CIBU), Institut Pasteur/OMS – « 2016 : l’alerte Zika dans le monde »
J’ai commencé à travailler sur Zika en 2012, un peu par hasard, dans le cadre d’une étude sur la diversité des arbovirus conduite en collaboration avec l’Institut Pasteur de Bangui en République centrafricaine. Je regardais ce virus comme une curiosité de virologiste. Il existe de très nombreux virus portant des noms souvent exotiques. Nous étions amusés de détecter le virus Zika parmi de nouvelles espèces d’aedes. La question de l’insertion de Zika dans le panel des antigènes viraux détectés s’est même posée.
Cette première alerte était restée lettre morte. Il s’agissait tout de même d’un tournant : soixante ans après la détection du virus Zika, près du lac Victoria, 99 cas confirmés et 900 cas probables étaient dénombrés ! Ce virus semble aujourd’hui particulier mais les effets rares n’apparaissent que lorsque le nombre de cas est important. Cette première alerte est donc passée relativement inaperçue.
La séquence suivante fut la traversée de l’océan Pacifique vers la Polynésie française, où sont apparus les premiers effets rares tels que le syndrome de Guillain-Barré. Nous n’avons pas vu de cas de microcéphalie. Des études ont été lancées et leurs premiers résultats ont été publiés deux ans plus tard.
La deuxième alerte a eu lieu avec l’arrivée du virus en Amérique du Sud – d’abord au Brésil –, générant une explosion du nombre de cas. L’alerte est devenue mondiale lorsque l’OMS a déclaré que cette épidémie était un phénomène de santé publique de portée internationale, en février 2016. Nous ne savons pas très bien ce que cela va donner.
Nous nous demandons, au vu notamment des méthodes de diagnostic chez l’homme, sur quel virus nous devons nous concentrer afin de développer des tests de diagnostic. Il existe des arbovirus. Il y a eu H1N1, puis Ébola, qui nous ont beaucoup occupés. En l’absence de malades et de prélèvements, on ne peut effectuer la validation clinique de ces outils. Les équipes qui développent des vaccins sont confrontées au même problème.
Une autre question demeure ouverte : le virus Zika va-t-il devenir contagieux ? En d’autres termes, s’affranchira-t-il de son mode de transmission par des arthropodes ? On le retrouve dans le liquide séminal mais aussi, de façon plus durable que dans le sang, dans la salive ou dans l’urine. Il ne faut sans doute pas trop s’inquiéter mais la question reste ouverte.
2. Mme Sylvie Quelet, directrice, Département des maladies infectieuses, Institut national de veille sanitaire (InVS) – « Rôle de l’Institut national de veille sanitaire »
J’ai pris la liberté d’élargir le thème que vous m’avez confié en choisissant d’évoquer le rôle de la future Agence nationale de la santé publique. C’est dans ce cadre que s’inscrit la surveillance du virus Zika.
L’Agence nationale de la santé publique, qui sera inaugurée le 3 mai 2016, est inscrite dans la loi de santé adoptée en janvier 2016. Elle résulte de la fusion de quatre entités : l’InVS, l’Inpes, l’Eprus et le GIP Atalis (service de téléphonie santé, qui englobe notamment Tabac Info Service). Les missions de ces quatre structures sont maintenues et l’objectif est d’assurer un continuum entre la veille, l’alerte, la surveillance et l’action en santé publique. C’est ce que nous avons essayé de mettre en œuvre, notamment pour le virus Zika. L’objectif est d’améliorer la sécurité sanitaire à travers une approche populationnelle et un ancrage résolument régional, permis par nos dix-sept Cire, c’est-à-dire nos antennes régionales.
Cette Agence a pour mission de surveiller les maladies infectieuses et de détecter les émergences en lien avec tous nos partenaires du réseau national de santé publique (ARS, médecins, biologistes, centres nationaux de référence), ce qui passe par le recueil et l’analyse des signaux. Nous participons à la surveillance européenne, aux réseaux d’alerte européens et internationaux, en lien avec le CDC de l’OMS. L’objectif principal sera de se préparer afin d’alerter les pouvoirs publics et les agences sanitaires de menaces éventuelles pour la santé publique et d’aider à la décision des pouvoirs publics et à la gestion de crise, avec l’évaluation du risque et des impacts sanitaires, l’évaluation des actions et des stratégies de réponse et la formulation de recommandations appropriées. Enfin, nos épidémiologistes participent à des missions d’expertise.
Ces résultats de surveillance sont communiqués aux autorités sanitaires, aux professionnels de santé et au grand public. Nous avons aussi pour mission de développer des stratégies de prévention et d’éducation pour la santé et des outils de communication. L’Agence prendra à son compte le rôle de l’Eprus aujourd’hui, à savoir apporter des renforts afin d’éviter que ne se développent des situations de crise.
Dans le cas du virus Zika, la surveillance a débuté dès l’émergence du virus au Brésil en s’appuyant sur le dispositif mis en place pour la surveillance du virus chikungunya et de la dengue, avec une surveillance régionale qui repose sur les ARS, les Cire, les médecins, les biologistes et une surveillance nationale reposant sur l’action coordonnée de la Direction générale de la santé (DGS), de l’InVS et du Centre national de référence des arboviroses. Cette situation est adaptée à la situation épidémiologique et entomologique. Elle tient compte de la présence et de l’activité du vecteur. Elle est évolutive en fonction de la phase de l’épidémie avec, tout d’abord, la détection et la confirmation biologique de chaque cas en phase d’introduction et d’émergence. Puis, dès que l’on passe en phase épidémique, elle repose sur la surveillance et la remontée des cas cliniquement évocateurs. Dans le cas du virus Zika, nous surveillons particulièrement les formes graves et inhabituelles.
S’agissant de la surveillance des cas graves, notamment des syndromes de Guillain-Barré, nous surveillons particulièrement les admissions en réanimation afin de pouvoir intervenir sur la mise en tension des systèmes de réanimation, en lien avec les médecins hospitaliers. Le nombre attendu de cas de syndromes de Guillain-Barré et d’admissions en réanimation ont pu être anticipés, en liaison avec l’équipe de modélisation de l’Institut Pasteur.
Les femmes enceintes, notamment celles qui ont été infectées par le virus Zika, sont l’objet d’un suivi attentif et adapté. Nous suivons aussi les issues de grossesse et les anomalies congénitales, en lien avec les centres pluridisciplinaires de diagnostic prénatal (CPDPN), avec lesquels un protocole a été élaboré, et le registre des malformations congénitales. Il faut souligner le lien fort qui existe entre l’InVS et l’Agence en général, d’une part, et avec le Centre national de référence des arboviroses et son réseau de laboratoires, d’autre part, sans lequel la surveillance ne serait pas aussi efficace.
Nous avons un groupe d’expertise interne qui regroupe l’ensemble des épidémiologistes impactés par cette surveillance. Il a pour mission d’assurer une veille bibliographique et d’adapter le dispositif de surveillance à la situation internationale et nationale. Les experts de l’InVS ont participé à l’expertise nationale et notamment aux cinq groupes du Haut Conseil. Nous participons également à la cellule d’aide à la décision de l’ANSM pour l’évaluation du risque transfusionnel ainsi que celle du risque lié à l’assistance médicale à la procréation. Au plan européen, nous avons contribué aux analyses de risque, notamment au risk assessment et à la stratégie de réponse. Une réunion européenne, organisée par le Centre européen pour la prévention et le contrôle des maladies (CEPCM ou ECDE), se tient à ce sujet dans les locaux de l’InVS les 20 et 21 avril 2016.
Cette surveillance est tournée vers l’information des décideurs et des professionnels de santé. Un point épidémiologique est élaboré chaque semaine afin de faire le point sur l’évolution de l’épidémie. Parallèlement, des documents d’information ont été réalisés à destination des professionnels de santé. Ils reprennent les avis du Haut Conseil de la santé publique et ont vocation à les décliner de façon très opérationnelle et de manière réactive.
Quant aux renforts qui ont pu être apportés dans les zones épidémiques par l’Établissement de préparation et de réponse aux urgences sanitaires (EPRUS), ils ont pu consister en l’achat de moustiquaires, de respirateurs, d’échographes. Cet appui s’est manifesté par l’envoi d’experts pour évaluer la situation et l’envoi de professionnels de santé : soignants pour soutenir le service de réanimation du CHU de la Martinique ou techniciens de laboratoire pour aider le CNR. S’agissant du dépistage, un renfort en sages-femmes et en gynécologues sera apporté à la Guyane.
3. M. Stéphan Rossignol, maire, Ville de La Grande-Motte – « Les moyens d’action d’un élu contre les moustiques »
Je vais apporter ici le témoignage d’un élu d’une ville balnéaire particulièrement concernée par la recrudescence de la présence des moustiques, notamment ces deux dernières années. La Grande-Motte est une ville jeune puisqu’elle a moins de cinquante ans. Elle a fait partie des six villes nouvelles construites lors de la mission Racine, créée en 1963 par le général de Gaulle. Cette mission avait notamment pour ambition de créer de nouvelles stations afin de retenir les touristes qui partaient vers l’Espagne alors que le littoral du Languedoc-Roussillon n’était pas aménagé et que la côte d’Azur l’était.
La Grande-Motte n’aurait pu voir le jour si un organisme, l’Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée), n’avait alors été créé pour éradiquer les millions de moustiques qui occupaient à l’époque cette partie du territoire. La Grande-Motte n’était qu’une zone de marécages et de dunes. Il a fallu assécher les marécages, niveler les dunes et, surtout, éliminer les moustiques.
Ces dernières années, nous avions été épargnés. Depuis deux saisons et même davantage, nous avons néanmoins constaté une recrudescence de la présence des moustiques, notamment lors de la saison 2015. Je fais partie des élus, avec M. François Commeinhes, maire de Sète, qui ont alerté les pouvoirs publics sur cette situation, qui pose aujourd’hui de véritables problèmes.
Il s’agit d’abord d’un problème de santé publique. L’été dernier, les pharmaciens de ma ville et les médecins ont observé que de nombreux touristes venaient acheter des produits contre les moustiques. Nous avons constaté de nombreuses allergies.
Le second problème est d’ordre économique puisque ces nuisances très importantes causées par les moustiques ont entraîné l’interruption de séjours de touristes, partis avant la fin de leur séjour. L’Office de tourisme de La Grande-Motte et les professionnels me font part d’appels de visiteurs potentiels qui souhaitent savoir s’il y aura autant de moustiques que l’an passé avant d’effectuer une réservation dans un hôtel, un camping ou dans une résidence de tourisme.
Des actions ont été conduites depuis l’an dernier avec l’EID. La Grande-Motte a notamment fait partie d’une action expérimentale d’installation de pièges-pondoirs, dans différents quartiers de la ville, afin que les moustiques tigres qui s’y posent emportent ensuite avec eux un produit qui rendra leurs congénères stériles ou empêchera la croissance des larves. La lutte avait été engagée contre le moustique des marais mais comme nous sommes passés d’une douzaine d’insecticides utilisables à un seul, cela pose un problème d’acclimatation des insectes à ce produit. On sait la difficulté de lutte contre cette espèce.
Aujourd’hui, nous avons mis en place avec l’EID des actions de prévention et d’information. L’EID était présent la semaine dernière à La Grande-Motte afin de rencontrer les professionnels. Cette initiative n’a pas eu le succès escompté car les professionnels n’étaient pas nombreux lors de cette réunion. C’est aussi ce qui justifie les mesures que nous allons prendre en termes d’information.
Après l’expérimentation que j’évoquais, nous allons informer la population, notamment dans le quartier des villas, qui compte de nombreux résidents qui furent parmi les premiers impactés. Du porte-à-porte sera fait afin d’indiquer les mesures à prendre : ne pas laisser de l’eau s’accumuler dans des coupelles de plantes, faire attention au niveau des piscines, etc. L’information touchera aussi les publics scolaires, qui peuvent être sensibilisés à ces problèmes, aux niveaux des enseignements primaire et secondaire.
Nous informons aussi les conseils de quartier. La ville est découpée en six quartiers et chaque conseil de quartier recevra des informations de l’EID. Nous organisons avec l’EID des stands sur le marché de la ville, qui a lieu tous les dimanches. Il faut enfin communiquer de façon individuelle vis-à-vis de tous les professionnels du tourisme et vers le personnel municipal, celui de l’Office de tourisme, qui est en contact avec la population et avec les touristes, dont on peut comprendre qu’ils soient inquiets devant l’arrivée du moustique tigre et du virus Zika.
Toutes ces actions de sensibilisation et d’information seront conduites au cours des prochains jours. Si La Grande-Motte compte 9 000 habitants l’hiver, sa population atteint 120 000 personnes l’été. Vous imaginez l’impact que ces problèmes de santé publique peuvent y avoir. Ils ont déjà des conséquences en termes de réservation, ce qui en fait aussi un problème économique. Nous espérons, avec mes collègues maires du littoral, que les pouvoirs publics interviennent et que de nouveaux insecticides puissent être homologués afin de pouvoir lutter efficacement. Nous espérons aussi, en cas d’urgence, bénéficier de dérogations. En Espagne, qui se trouve, comme la France, dans l’Union européenne et qui est soumise aux mêmes règles, il y a moins de moustiques que nous n’en avons sur notre littoral.
M. François Commeinhes. - Merci pour ce témoignage qui fait écho à mon expérience. Les autochtones savent se prémunir contre les moustiques mais nos visiteurs ne sont pas toujours habitués à des gestes simples de protection. Peut-être est-ce au cours de l’été qu’il faut déployer les efforts de communication que vous avez décrits, même si les visiteurs qui sont là en vacances ne sont pas nécessairement là pour apprendre comment lutter contre les moustiques.
L’un des objectifs de cette audition est de mettre en relation plus directe de multiples spécialistes des maladies à transmission vectorielle avec les élus, qui sont sollicités au quotidien et se trouvent souvent désarmés pour répondre aux attentes de leurs concitoyens.
Après l’avoir entendu à propos du contrôle des vecteurs, nous avons demandé à Frédéric Simard d’intervenir de nouveau sur les causes de la modification de la répartition géographique de l’aedes albopictus.
4. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier – « Causes de la modification de la répartition géographique de l’aedes albopictus »
L’arrivée du moustique tigre en France, notamment par le Sud, ne constitue pas une résurgence mais bien une nouvelle menace. Le moustique tigre, aedes albopictus, constitue une réelle menace pour la santé publique. Nous l’avons trouvé sur le terrain, infecté par un certain nombre de virus. Nous savons, grâce à un travail de laboratoire effectué par les équipes d’Anna-Bella Failloux et par d’autres chercheurs, qu’il est capable de transmettre de nombreux autres virus. M. Jean-Claude Manuguerra soulignait la perplexité des chercheurs devant le choix des virus sur lesquels décider de travailler. Si nous ne sommes pas capables de le dire, albopictus choisira pour nous le prochain. Il faut en tout cas le surveiller.
Ce moustique est originaire d’Asie. Depuis 1985, il a commencé à envahir le monde entier. Il est présent sur l’ensemble des continents, sauf en Antarctique. À la différence de son cousin aedes aegypti, qui reste cantonné à la zone subtropicale, il a pu pénétrer les zones tempérées, en raison notamment des propriétés de ses œufs, capables d’entrer en diapause dans nos environnements. Une fois que la photopériode (c’est-à-dire la durée du jour) passe en-dessous de treize heures trente, les œufs n’éclosent plus. C’est la raison pour laquelle nous pouvons affirmer que nous connaissons bien la période d’activité du moustique : elle débute lorsque la photopériode excède treize heures trente, en avril. Alors, les œufs éclosent. C’est cette propriété qui a permis au moustique tigre de coloniser les environnements tempérés, en particulier l’Europe, où il est présent depuis 2004.
Il s’agit, à l’origine, d’un moustique selvatique qui vit dans la forêt asiatique. Ses gîtes larvaires sont de petits gîtes naturels tels que des trous d’arbre, où se trouve une très faible quantité d’eau disponible. Le risque majeur, pour le moustique et sa descendance, est que le gîte s’assèche avant que les larves n’aient pu compléter leur développement. Il s’y est adapté et ne dépose pas ses œufs sur l’eau mais juste au-dessus de celle-ci, sur le support, de telle sorte que les œufs éclosent lors des prochaines pluies qui vont pouvoir mettre les œufs en eau.
En Asie, aedes albopictus a été en contact avec l’homme au niveau des forêts, notamment dans les lieux où l’on cultive du latex, ce qui lui fournit le gîte et le couvert. De fil en aiguille, il s’adapte à l’homme. Ses gîtes préférentiels sont les pneus usagés. C’est, notamment, grâce à cette capacité des œufs à attendre leur mise en eau que le moustique a pu se disséminer sur l’ensemble des continents. Les moustiques pondent dans des pneus usagés qui sont expédiés aux quatre coins du monde. On les débarque une fois arrivés à destination. Il pleut sur ces œufs et le cycle peut commencer. L’albopictus est ainsi introduit chaque jour plusieurs fois sur chaque continent. Le commerce du bambou constitue aussi un vecteur par lequel aedes albopictus a pu se disperser sur l’ensemble des continents.
En France, ses gîtes sont connus. Il s’agit par exemple des coupelles de pots de fleurs, comme le soulignait M. Christophe Lagneau. Le moustique est arrivé, par l’Italie à compter de 2004. Il est présent en 2016 dans trente départements. L’EID utilise des pondoirs pièges pour suivre la progression de ce moustique d’année en année. Plus de 1 300 pièges par an ont été mis en place entre 2006 et 2012. Comme un intervenant l’a déjà souligné, la surveillance peut servir à la recherche. C’est ce qu’il s’est passé lors de cette collaboration entre la MIVEGEC et l’EID à Montpellier : nous avons utilisé les données de l’EID pour modéliser la dispersion du moustique tigre en France. Les résultats de ce modèle ont montré, probabilités à l’appui, que les zones urbaines et périurbaines étaient plus favorables à l’installation d’aedes albopictus que les zones agricoles. Cela donne une idée des lieux où cibler le contrôle de l’installation du moustique. Le processus invasif est lié au transport assisté par l’homme. Je rappelle que ce moustique pique le jour. En été, le Languedoc-Roussillon et La Grande-Motte ressemblent encore à ce que nous connaissons de ces endroits.
Le moustique vit avec nous la journée. Il va nous piquer durant la journée et nous suivre dans nos moyens de transport. Ce sont les femelles qui entrent dans les véhicules et piquent. Vous roulez puis faites une pause toutes les deux heures. Le moustique a eu le temps de vous piquer et de sortir sur une aire de repos. Il va ainsi se répandre en tâche d’huile dans la métropole. Lorsqu’on utilise la distance, en termes de temps de trajet, on se rend compte que cette variable est celle qui est la plus fortement corrélée à l’invasion d’aedes albopictus en France métropolitaine.
Nous avons également pu montrer que ce processus s’accélérait. De 2004 à 2014, aedes albopictus a conquis vingt départements. Ce nombre est de trente départements, soit dix départements de plus en deux ans. Le moustique va malheureusement atteindre Nancy. Nous avons introduit des paramètres climatiques dans le modèle. Ils ont un très faible impact. La dispersion, l’invasion et l’installation d’albopictus sont indépendantes du climat, y compris du réchauffement climatique. Ces variables vont jouer sur la dynamique des populations une fois que le moustique est installé, c’est-à-dire sur sa densité, sa longévité et sa capacité à transmettre le virus.
À Montpellier, où le moustique est présent depuis assez longtemps, nous avons suivi les densités de femelles en utilisant des pièges, à partir du mois d’avril puis tout au long de la saison. Nous voyons que ces populations augmentent. En rouge, sur le schéma projeté, figure la température, avec laquelle la densité de présence des moustiques est fortement corrélée. En septembre 2014, alors que nous étions en pente descendante, s’est produit un épisode extrême à Montpellier, avec des pluies diluviennes (250 millimètres en trois heures). Nous nous attendions, en vertu du dogme, à ce que cela lessive les gîtes larvaires et à une diminution des populations de moustiques. Nous avons observé l’inverse. Les températures étaient toujours favorables et les populations de moustiques ont connu un rebond fin 2014, ce qui s’est traduit par une extension de la période de transmission du chikungunya, dont onze cas sont survenus à Montpellier. Il ne faut donc pas voir le climat comme le grand responsable de tout. Il a une contribution mais ne contribue pas à tous les phénomènes qui nous préoccupent ici.
M. François Commeinhes. - L’Office a toujours eu à cœur de compléter ses auditions, sur des thèmes scientifiques ou technologiques, par des éclairages apportés par les sciences humaines. C’est ainsi que nous allons maintenant écouter M. Daniel Bley, qui a notamment conduit des recherches interdisciplinaires en vue de comprendre les représentations et les pratiques des populations en matière de santé-environnement, notamment pour les maladies à transmission vectorielle.
5. M. Daniel Bley, anthropologue biologiste, directeur de recherche émérite, Unité mixte de recherche ESPACE, CNRS/Université Aix-Marseille – « La perception par les populations des mesures de lutte contre les maladies à transmission vectorielle »
Le Pr Jean-François Delfraissy soulignait dans la présente audition l’apport des sciences humaines et sociales dans les moyens de lutte contre les maladies vectorielles, en particulier sur le plan de la lutte antivectorielle.
Les maladies à transmission vectorielle constituent, en effet, un objet d’étude pertinent pour les sciences humaines et sociales. Des travaux ont été effectués par des chercheurs de l’IRD sur le paludisme, il y a un certain temps déjà en termes de perceptions et de comportements. En revanche, ces travaux sont assez rares sur les maladies vectorielles en France. Quelques-uns ont vu le jour au moment de l’épidémie de chikungunya à La Réunion en 2006 et au cours des années qui ont suivi. Mais il y a peu de travaux en cours sur ces questions.
Celles-ci sont pourtant emblématiques des problématiques d’environnement-santé. Elles forment un objet d’étude complexe et traitent d’une question qui s’inscrit dans l’espace public, où elles font l’objet de controverses. Mme Catherine Mir évoquait, par exemple, les dérogations. J’ai participé récemment à la saisine du Haut Conseil de la santé publique sur la dérogation d’usage du malathion en Guyane, ce qui m’a paru assez instructif sur les difficultés dans la réalisation d’une lutte antivectorielle efficace.
En l’absence de thérapie et de l’impossibilité d’éradication des vecteurs, la lutte antivectorielle constitue le principal moyen de contrôle. Il s’agit pour nous d’étudier les populations et l’ensemble des acteurs (collectivités territoriales, professionnels de santé, institutions, etc.) afin de mettre au jour comment tous perçoivent les enjeux et peuvent interagir pour lutter contre l’extension de l’aedes. C’est ce que soulignait M. Frédéric Jourdain, du CNEV, qui animait récemment un rapport sur la mobilisation sociale en soulignant l’enjeu important que celle-ci constitue.
Une des façons, pour les sciences humaines et sociales, de s’intéresser à ces questions est de comprendre comment se mettent en place des stratégies intersectorielles de lutte. Pour la première fois dans le plan national santé-environnement – dont c’est la troisième édition –, cet aspect est pris en charge.
Un projet aedes, financé dans le cadre du programme Risques-Décisions-Territoires du ministère de l’environnement, de l’énergie et de la mer sur la perception des populations, met en évidence un problème en période interépidémique entre nuisances et risques du point de vue de la perception des populations. La plainte émane des populations (touristes et résidents), ce qui conduit à signaler au maire une nuisance. Mais de la nuisance à la perception du risque sanitaire, le chemin est plus complexe. Dans les territoires qui ont été les premiers touchés par des cas autochtones de dengue en 2010 dans les Alpes-Maritimes, par exemple, nos travaux montrent que la perception du risque sanitaire est un peu plus importante qu’elle ne l’est dans les territoires où l’aedes s’est implanté de façon récente, comme en Vendée où aucun cas n’a été déclaré.
Il existe aussi des enjeux institutionnels. Parmi les acteurs importants dans la prise en charge de la lutte antivectorielle figurent les professionnels de santé, souvent considérés comme des relais essentiels entre les directives qui émanent des autorités sanitaires et les patients. La plupart des études montre que ces professionnels ne sont pas plus informés que la moyenne des Français, malgré leur rôle clé. Je parle des médecins généralistes mais aussi des pharmaciens d’officine, qui peuvent aussi avoir un rôle important à jouer d’acteurs de santé publique – constat qui plaide pour la formation et l’information de ces professionnels.
Enfin, nos travaux mettent en exergue de fortes disparités dans l’implication des collectivités. Certaines se sont mobilisées. D’une façon générale, toutefois, les collectivités apparaissent un peu comme le maillon faible, dans la chaîne qui relie les patients à l’ARS, du signalement des cas à la prise en charge en passant par l’intervention de l’EID. Lorsqu’il faut procéder à des opérations de démoustication, cela pose parfois quelques difficultés.
En écoutant les populations évoquer les problématiques d’environnement-santé, on s’aperçoit qu’elles parlent souvent de qualité de vie, ce qui signifie pour elles être en bonne santé et vivre dans un environnement agréable, voire soutenable. Sa prise en compte permettrait d’aller vers des approches de transversalité car la qualité de vie peut s’appréhender à travers trois interfaces : la perception et la mesure, l’individuel et le collectif, le biologique et le social. C’est là qu’il existe des enjeux majeurs à explorer par les sciences humaines et sociales, à mes yeux, pour une lutte antivectorielle et une prise en charge plus efficaces.
L’interface perception-mesure renvoie à la nécessité d’une gouvernance élargie, seule garante, in fine, d’une réelle participation des populations.
La deuxième interface porte sur l’individuel et le collectif. Le baromètre Santé de l’INPES, concernant les maladies vectorielles mais aussi la pollution de l’air, montre que les populations pointent souvent du doigt la responsabilité de l’État, dont elles attendent tout. La volonté de mobilisation sociale et celle de rendre les populations actrices de leur santé ne doit cependant pas conduire à trop les culpabiliser afin qu’elles conservent une capacité d’action et d’implication dans la lutte antivectorielle.
Enfin, l’interface entre le biologique et le social me paraît importante : si la lutte antivectorielle relève de la santé publique, les populations y voient aussi une atteinte écologique, ce qu’ont bien montré certaines interventions. Les populations ont compris que les insecticides étaient dangereux pour la santé. Pourquoi, dès lors, les utiliser alors qu’ils peuvent compromettre leur santé ? Il peut y avoir là un paradoxe de leur point de vue, ce qui représente également un aspect à travailler pour une meilleure prise en charge de la lutte antivectorielle.
M. François Commeinhes. - Merci pour cet éclairage. Je vous propose maintenant que nous visionnions un film de quelques minutes sur une nouvelle technique de lutte contre les moustiques.
Un film d’environ deux minutes est projeté. M. Didier Fontenille, entomologiste médical et directeur de recherche à l’IRD, y évoque notamment les moyens de lutte communautaire et de nouvelles méthodes envisagées de lutte contre les moustiques vecteurs, notamment la lutte génétique.
III. LES SOLUTIONS MISES EN œUVRE
1. Pr Yazdan Yazdanpanah, chef de service des maladies infectieuses et tropicales, professeur d’université et chercheur, Hôpital Bichat-Claude-Bernard, Université Paris-Diderot, INSERM – « La réponse hospitalière aux maladies tropicales et infectieuses »
Le cadre de mon propos sera un peu plus large que celui de la transmission des maladies vectorielles car l’hôpital joue un rôle de soin pour l’ensemble des maladies infectieuses et épidémiques mais également un rôle de santé publique et de prévention qui s’applique beaucoup plus aux maladies transmises de personne à personne, plutôt qu’aux maladies vectorielles.
Je signale, pour commencer, les liens d’intérêt me concernant. Je suis membre de groupes d’experts et ai des activités de formation scientifique. Je bénéficie de prises en charge dans le cadre de congrès scientifiques nationaux et internationaux organisés avec des laboratoires.
J’ai essayé de dresser la liste, de manière non exhaustive, des épidémies localisées ou mondiales liées à une émergence ou une réémergence de maladies infectieuses, notamment depuis 2003, avec l’émergence du SRAS, puis la pandémie H1N1 en 2009, l’épidémie de MERS-CoronaVirus – dans la péninsule arabique mais aussi ailleurs, notamment en Corée du Sud), l’épidémie d’Ébola – qui a fait l’objet d’une réémergence en Guinée et au Libéria, même s’il s’agit d’épidémies de petite taille – et l’épidémie de Zika. Ce sont là des épidémies et des pandémies mais aussi des crises sanitaires contre lesquelles il est extrêmement important de s’organiser.
L’hôpital public a une mission de soin. Il dispose d’une excellence et d’un savoir-faire lui permettant de prendre en charge ces patients de manière concertée, avec un partage d’informations et une mobilisation des compétences épidémiologiques, cliniques et biologiques, au plan national avec l’ensemble des agences et institutions (InVS, ARS, ANSM, DGS, CNR) et au plan international (OMS au plan mondial, ECDC au plan européen). Lorsqu’un malade est pris en charge pour Ébola à l’hôpital Bégin, des conférences téléphoniques ont lieu tous les jours au plan national afin de déterminer la prise en charge à proposer. Des échanges fréquents ont également lieu avec les organismes internationaux.
L’hôpital a aussi un rôle de santé publique. Il faut isoler le patient pour éviter la transmission entre individus au sein de la communauté, notamment pour ces maladies transmises de personne à personne. Le risque représenté par les maladies infectieuses et émergentes ou réémergentes n’est pas seulement individuel mais aussi et, surtout, collectif.
Cette organisation a été mise en place notamment après 2003. Il faut une infrastructure et des compétences qui soient régulièrement mises à jour.
En France, les hôpitaux sont organisés autour d’établissements de santé de référence, qui sont en mesure de prendre en charge des patients. En ce qui concerne Ébola, neuf régions sont, par exemple, dotées d’un centre de santé de référence. À Paris, trois hôpitaux sont en mesure d’accueillir les patients (Bichat, la Pitié-Salpêtrière et l’hôpital d’instruction des armées Bégin). Ces hôpitaux sont organisés pour pouvoir isoler les malades. Chaque fois que nous avons des patients présentant un risque de transmission d’un certain nombre de pathologies, ils sont hospitalisés dans ces centres. Le transport vers ces centres est assuré par le SAMU.
Voyons l’exemple de l’hôpital Bichat, qui comporte un secteur « risque épidémiologique et biologique » (REB), ce qui est aussi le cas des autres hôpitaux pouvant accueillir ces patients. Sept chambres sont équipées à Bichat. Vous voyez, sur la diapositive projetée, l’arrivée à l’hôpital d’un patient suspecté de porter le virus Ébola. L’unité compte deux unités de trois lits et quatre lits, qui peuvent être totalement isolés des autres parties du service. Celui-ci comporte des chambres à pression négative, afin d’éviter que l’air ne puisse sortir de la pièce et contaminer d’autres soignants ou malades présents dans l’hôpital. Il existe des sas d’entrée et de sortie afin de pouvoir s’habiller et se déshabiller hors de la chambre. Le principe consiste à effectuer la réanimation dans ces chambres.
La France est très bien organisée de ce point de vue. À titre d’exemple, il n’existe au Royaume-Uni que deux chambres à pression négative, à Londres. Lorsqu’un malade est suspecté d’avoir été infecté par le virus Ébola, à Glasgow, il est transféré à Londres.
Il faut insister sur la formation des personnels. À l’hôpital Bichat, elle est coordonnée par l’équipe opérationnelle d’hygiène, qui compte une équipe de formateurs dotés d’outils pédagogiques. Une difficulté a trait à la répétition des formations. Ce qui est facile en période d’épidémie, en raison de la sensibilisation de chacun, s’avère plus difficile en période normale, notamment du point de vue du maintien des compétences.
Parmi les points forts de ce dispositif, je citerais volontiers le niveau d’expérience et d’implication du personnel. Je crois que je n’ai jamais senti une ambiance aussi bonne, dans notre service, à l’hôpital Bichat, que durant les dix-huit mois pendant lesquels nous avons vécu l’épisode d’Ébola. Les gens jouent le jeu, sont dévoués et il existe une confiance envers les équipes de soins de même que vis-à-vis des laboratoires ainsi qu’une cohésion. L’articulation de ces équipes avec d’autres services de l’hôpital mais aussi avec les tutelles est très importante. Cela se passe généralement très bien.
Des points doivent cependant faire l’objet d’une réflexion, notamment le maintien d’une formation durable et continue des soignants, ce qui prend du temps, alors que d’autres missions doivent être assurées par l’hôpital.
Il faut aussi préciser les modalités de gestion des ressources humaines qui seront appliquées si ces épidémies durent. Dans nombre d’hôpitaux européens, certains services sont fermés en cas d’épidémie, afin de ne traiter que celle-ci. Nous ne l’avons pas fait mais il faut y réfléchir. L’impact sur le reste de la patientèle – notamment en termes de fermeture de lits – doit aussi être pris en compte. Enfin, il faut réfléchir à l’éventualité d’accueil de plusieurs cas, même si ce cas de figure ne se produit quasiment jamais.
M. François Commeinhes. - Nous allons maintenant entendre Mme Isabelle Leparc-Goffart, responsable du centre national de référence des arbovirus. La responsabilité du centre national de référence des arbovirus n’est pas toujours attribuée à la même entité. Elle l’a été, en dernier lieu, aux armées, ce dont nous ne pouvons que nous féliciter.
2. Mme Isabelle Leparc-Goffart, responsable du Centre national de référence des arbovirus, Institut de recherche biomédicale des armées (IRBA) – « L’apport du Centre de référence des arbovirus »
Les arbovirus sont des virus transmis par les arthropodes suceurs de sang. Nous pensons qu’il existe plus de cent arbovirus pathogènes pour l’homme, dont sept virus responsables de fièvre hémorragique.
Les missions officielles du Centre national de référence figurent dans un cahier des charges établi par le ministère de la santé. La première de ces missions réside dans l’apport d’une expertise. Notre laboratoire doit développer et valider des techniques de diagnostic, qu’il s’agisse de la détection directe du virus ou de la réponse anticorps et, si possible, de nouvelles technologies. Nous devons essayer de créer un réseau de laboratoires et assurons un transfert de technologies vers d’autres laboratoires de diagnostic. Nous nous efforçons de caractériser les arbovirus qui circulent et l’association avec des formes cliniques graves.
Par ailleurs, nous devons contribuer à la surveillance épidémiologique. Nous participons, à ce titre, aux plans nationaux de surveillance de la dengue, du chikungunya, de West Nile, de Toscana et maintenant de Zika. Nous contribuons aux réseaux nationaux, européens et internationaux.
Le Centre national de référence (CNR) des arbovirus appartient au réseau européen des maladies virales importées. Nous sommes un acteur important de ce réseau subventionné par le Centre européen de prévention et contrôle des maladies (CEPCM ou ECDC). Nous devons aussi contribuer à l’alerte. L’an dernier, nous avons reçu du Mali un cas importé de la fièvre de la vallée du Rift. Nous n’avions pas de données de circulation humaine de ce virus. Ce sont des informations qui existent au niveau national et ensuite au niveau international. Nous remplissons ainsi une mission d’alerte aux plans national et international. Nous faisons partie d’un réseau très riche d’entomologistes, d’épidémiologistes, de cliniciens, de biologistes, etc.
Le CNR compte trois laboratoires, dont nous assurons la coordination pour tous les départements français. Nous avons deux laboratoires associés, un CNR associé au CHU de La Réunion pour la zone océan Indien (La Réunion-Mayotte) et un laboratoire associé à l’Institut Pasteur de Guyane pour la région Antilles-Guyane. Ces trois laboratoires vont interagir avec les laboratoires de diagnostic, les cliniciens et les laboratoires de recherche. Nous interagissons aussi avec nos territoires et les laboratoires référents de l’Institut Pasteur de Nouméa, en Nouvelle-Calédonie ainsi que l’Institut Louis Malardé, en Polynésie française et le centre hospitalier de ce territoire.
L’exemple du virus Zika illustre toutes les étapes auxquelles le Centre national de référence des arbovirus peut agir, à commencer par l’anticipation : avant la première alerte d’émergence du virus Zika en Polynésie française, nous avions déjà les outils de détection du virus et les anticorps, ce qui nous mettait en mesure d’effectuer un diagnostic. Nous avons effectué le premier isolement du virus de cette région. Le virus a été séquencé. Cette ressource biologique a été mise à disposition au niveau national et international afin que tous les acteurs de santé publique et de recherche puissent y avoir accès. C’est un de nos rôles importants.
Nous avons beaucoup travaillé avec la Polynésie française et avons pu participer à la mise en évidence de l’implication de ce virus dans les syndromes de Guillain-Barré et dans les microcéphalies. Dans ce second cas, nous avons été le premier laboratoire, au niveau international, à détecter et isoler le virus infectieux dans le liquide amniotique chez des femmes ayant eu un enfant touché par une microcéphalie.
Puis est survenue l’émergence du virus dans les départements français d’Amérique. Le CNR, grâce à son réseau, a détecté l’émergence du virus en Martinique à la fin de l’année 2015 puis en Guyane.
Nous ne pouvons réaliser tous les diagnostics. La première étape consiste à évaluer les kits présents sur le marché afin de pouvoir formuler des recommandations à l’intention de laboratoires de virologie médicale de première ligne. Nous animons depuis trois ans, avec l’Institut national de veille sanitaire, un réseau de laboratoires hospitaliers et de laboratoires privés afin de les aider à mettre en marche le diagnostic de première ligne pour ces virus. C’est ce qui nous permet de nous focaliser sur le diagnostic particulièrement important, celui pour les formes graves et les femmes enceintes. Nous sommes en train d’organiser un contrôle qualité car il est important de connaître la qualité du rendu du diagnostic de ces laboratoires. Ce sera fait à la fin du mois d’avril.
Nous avons pu, en collaboration, isoler et caractériser le virus Zika dans les différentes matrices (sérums, liquide amniotique, sperme). Tout cela est mis à la disposition de la communauté scientifique internationale. Nous avons pu mettre en évidence, de par notre expérience, en collaboration, autour de cette émergence, avec le concours des cliniciens et des biologistes, les premiers cas de transmission sexuelle en France métropolitaine et certaines formes graves d’infection par le virus Zika, dont la méningo-encéphalite, les myocardites et les microcéphalies.
Enfin, rappelons que nous sommes engagés dans un certain nombre de groupes d’experts (Haut Conseil de santé publique, Haute Autorité de santé, ANSM, OMS). Je voudrais remercier tous ceux qui contribuent à ce large travail de réseau.
3. Pr Gérard Lasfargues, directeur général adjoint scientifique, Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail (ANSES) – « Vecteurs et maladies vectorielles : pour une approche globale »
Je vous remercie de m’avoir invité à cette audition. Je voudrais souligner ici deux ou trois messages qui me semblent importants en matière de maladies transmissibles par les vecteurs, à travers l’approche globale qu’adopte l’Agence nationale de sécurité sanitaire de l’alimentation, de l’environnement et du travail sur ces maladies.
En premier lieu, comme des intervenants l’ont rappelé, ces maladies à transmission vectorielle touchent la santé humaine mais aussi la santé animale et végétale. Nous avons intérêt à faire travailler ensemble toutes les disciplines, dans ces différents champs, afin d’améliorer nos connaissances, mieux évaluer les risques liés à ces maladies et pouvoir prendre les mesures préventives qui s’imposent.
Nous sommes responsables de missions d’évaluation de risques en santé végétale, animale et humaine à travers différents métiers (biologistes, entomologistes, épidémiologistes, vétérinaires, infectiologues en santé animale, etc.). L’Agence travaille aussi en partenariat étroit avec des organismes de recherche, d’expertise et différents organismes scientifiques travaillant dans ce domaine.
Grâce à nos laboratoires, nous avons des missions de mise au point de méthodes de référence analytiques pour les pathogènes transmis par les vecteurs (ou pour certains vecteurs eux-mêmes), des missions de surveillance (par exemple, pour les maladies animales transmises par les vecteurs) et l’expertise sur les produits de la lutte antivectorielle.
En 2015, nous avions organisé, avec le CIRAD, l’INRA et le Centre national d’expertise sur les vecteurs, un séminaire qui avait permis de réunir pour la première fois les spécialistes des disciplines de santé humaine et de santé animale. Il avait permis d’établir un état des lieux qui avait mis en exergue des enjeux très importants, pour la recherche et pour l’expertise sur les maladies à transmission vectorielle.
Les besoins de recherche sont clairs. Ils portent notamment aujourd’hui sur la caractérisation des vecteurs. Nous avons besoin de renforcer ou développer un certain nombre de compétences et de champs disciplinaires tels que l’entomologie. Les besoins sont également importants en matière de recherche sur les compétences vectorielles, c’est-à-dire sur les capacités effectives des vecteurs à transmettre les maladies. À titre d’illustration, en santé végétale, 2 000 espèces sont potentiellement vectrices de xylela fastidiosa. Il est important de savoir lesquelles le sont effectivement, pour pouvoir organiser la surveillance de ces vecteurs. Nous pouvons faire la même chose pour de nombreux vecteurs en matière de santé humaine ou animale.
Au-delà de la caractérisation de la compétence vectorielle, il faut pouvoir étudier les résistances et les caractériser de façon à anticiper l’apparition de résistances aux biocides et insecticides chez les vecteurs impliqués.
À l’ANSES, nous nous appuyons sur des compétences fortes en matière de maladies vectorielles animales – avec des mandats de référence aux niveaux national, européen et international –, en ce qui concerne des vecteurs – particulièrement les tiques – et en santé végétale. Au-delà des missions d’expertise, nos laboratoires contribuent à l’amélioration des connaissances, à la surveillance et à la recherche.
Enfin, l’agence conduit des activités d’évaluation des risques et d’expertise sur les produits de la lutte antivectorielle. Nous intervenons régulièrement en appui de nos ministères de tutelle et des autorités sanitaires sur ce sujet, pour répondre à des besoins urgents lors de crises (par exemple, en cas de besoin de dérogation au regard de certaines substances biocides ou insecticides) et pour anticiper les besoins futurs. Nous sommes, en particulier, en train d’identifier, après avoir hiérarchisé un certain nombre de substances actives biocides qui pourraient être utiles, des substances utilisables à court, moyen ou long terme, avec une évaluation de la pertinence de leur utilisation, de la faisabilité de cette utilisation et des risques qui seraient potentiellement encourus par la population.
Je rappelle également que la lutte antivectorielle ne repose pas uniquement sur la lutte au moyen de biocides. L’Agence peut apporter son expertise sur d’autres méthodes préventives ou correctrices pour la lutte antivectorielle.
Enfin, l’agence dispose de laboratoires de référence sur les maladies animales, en complément notamment de l’InVS ou d’autres organismes référents pour les maladies à transmission vectorielle vers l’homme. Il serait souhaitable d’avoir des mandats officiels de référence sur les vecteurs eux-mêmes – et non seulement sur les maladies vectorielles – afin d’améliorer la caractérisation des compétences vectorielles et progresser dans la surveillance en santé animale, végétale et humaine.
M. François Commeinhes. - Les modes de vie actuels ne sont pas sans influence sur la propagation des maladies à transmission vectorielle. C’est pourquoi l’Office a souhaité entendre un spécialiste de la médecine des voyages en la personne de M. Frédérick Gay, maître de conférences des universités et praticien hospitalier à la Pitié-Salpêtrière, Université Pierre-et-Marie-Curie.
4. M. Frédérick Gay, maître de conférences des universités et praticien hospitalier, groupe hospitalier Pitié-Salpêtrière, Université Pierre-et-Marie-Curie – « Le rôle de la médecine des voyages »
Le rôle de la médecine des voyages peut s’appliquer au virus Zika comme à toutes les pathologies liées aux voyages et aux voyageurs sortant de métropole. La médecine des voyages a pour missions de veiller, d’alerter, d’informer, d’éduquer, de prévenir et finalement de soigner.
La veille épidémiologique consiste à suivre les épidémies. Il s’agit de veiller à la dynamique temporelle et spatiale des épidémies jusqu’à l’échelle la plus fine possible et s’assurer des facteurs de risque des personnes concernées. Cela peut se faire par des accès au site Web de l’Organisation mondiale de la santé, à celui du Bulletin épidémiologique hebdomadaire ou au site de Promed, lequel est traduit en de nombreuses langues.
La médecine des voyages doit également alerter les voyagistes quant à la nécessité, pour les voyageurs, de s’informer de tous les risques inhérents au voyage, au plan individuel, afin de personnaliser l’information. Cela se fait à travers divers sites d’information comme celui du ministère des affaires étrangères, celui de la médecine des voyages (qui est une association française). Tout voyageur peut également accéder à la liste de tous les centres de vaccination internationaux.
La troisième fonction de la médecine des voyages est d’informer les voyageurs des mesures antivectorielles devant être adaptées en fonction de leurs conditions de voyage, de leur profil et de la nécessité, éventuellement, de modifier leur projet de voyage, voire les en dissuader s’il existe un projet de grossesse ou une pathologie préexistante comme une immunodéficience.
Informer les voyageurs, c’est aussi s’assurer d’accéder aux voyageurs qui sortent du circuit des voyagistes, à ceux qui ne viennent pas consulter dans les centres de vaccination internationale et corriger les défauts d’information, en particulier les informations contradictoires auxquelles ils peuvent accéder. Il faut donc une information grand public, notamment via l’utilisation des médias et d’Internet. Cela rejoint les propos de M. Daniel Bley. Les profils des voyageurs sont néanmoins très différents, ce qui impose une information individuelle et personnalisée. Les profils de voyageurs que nous sommes amenés à conseiller sont très nombreux, sachant que certains d’entre eux se combinent, ce qui fait toute la complexité de cette discipline.
Il faut également éduquer les patients potentiels que sont les voyageurs, dont la première « assurance-vie » réside dans la prise en compte de tous les symptômes qu’ils manifesteraient à leur retour et au cours des mois suivants. Ils doivent consulter le plus rapidement possible et évoquer leur voyage vis-à-vis des soignants qu’ils seraient amenés à consulter. Ils doivent aussi s’interroger sur la santé de leurs accompagnants. C’est à eux de frapper à la porte du système de santé car ce dernier ne viendra pas à eux.
Il faut prévenir la transmission, ce qui suppose d’informer et convaincre sur cette information. C’est la combinaison de l’information et de la conviction qui permettra d’augmenter l’observance des mesures préventives, laquelle assurera l’efficacité de la prévention.
Enfin, il s’agit de soigner les patients. Le médecin est la deuxième « assurance-vie » du patient après le patient lui-même. Le médecin doit savoir conduire l’interrogatoire du patient et de son entourage, savoir évoquer le ou les diagnostics éventuels, assurer un premier niveau de prise en charge et en référer, si besoin. Enfin, il doit savoir déclarer ou signaler, si nécessaire, selon la législation en vigueur. L’essentiel de la formation relève de la formation initiale du médecin mais beaucoup dépend de sa formation continue et il y aurait probablement un certain nombre de progrès à réaliser de ce point de vue.
En termes de morbidité, les pathologies des voyages les plus nombreuses sont les diarrhées, devant les affections respiratoires supérieures. Puis viennent les dermatoses, les fièvres et, depuis quelque temps, des pathologies non infectieuses plutôt secondaires.
En termes de mortalité, nous dénombrons un décès pour 100 000 personnes par mois de voyages. En cas d’opération humanitaire, ce taux est dix fois plus élevé avec un décès pour 10 000 personnes par mois d’exposition. Les décès ont environ 50 % de causes cardiovasculaires. Le reste se répartit entre les accidents de la voie publique, les noyades et les traumatismes et blessures. 1 % à 3 % de ces décès sont dus aux infections, le plus lourd tribut revenant au paludisme. Les causes de rapatriement sont souvent les mêmes que celles de la mortalité. Elles sont surtout de nature traumatique, cardiologique, vasculaire, neurologique et psychiatrique.
Toutes ces pathologies sont liées au type du voyage, aux destinations et aux conditions de séjour. C’est la raison pour laquelle il est essentiel de personnaliser les recommandations aux voyageurs.
M. François Commeinhes. - Certains acteurs ont une responsabilité particulière à l’égard des voyageurs. Tel est notamment le cas du Dr Vincent Feuillie, responsable du service de médecine passagers à Air France.
5. Dr Vincent Feuillie, responsable du Service médecine passagers, Air France – « Action des compagnies aériennes contre les maladies à vecteurs »
L’avion est en quelque sorte un vecteur un peu différent des moustiques. L’histoire de l’aviation est néanmoins liée aux maladies à vecteur. C’est en 1928 que l’inspection de la quarantaine de New York découvre, dans un Zeppelin, une dizaine de moustiques. Dès les années 1930, les autorités indiennes mettent en place des mesures de démoustication sur les vols arrivant en Inde.
Le Pr Delfraissy a rapidement évoqué le règlement sanitaire international. Les autorités internationales ont mis en place un certain nombre de mesures avec, en 2005, la révision du règlement sanitaire international, mis en application le 15 juin 2007.
Signé par 196 pays, ce règlement prévoit notamment des mesures de désinsectisation des aéronefs et des aéroports. Les articles 63 et 83 du règlement traitent de la fièvre jaune, du paludisme et de la peste. L’article 25 développe le contenu des insecticides devant être utilisés, en rappelant qu’ils ne doivent pas présenter d’inconfort pour les passagers et le personnel ni entraîner de détérioration de l’avion ou présenter des risques au feu. Le règlement impose aussi une déclaration générale d’aéronef qui figure dans tous les avions. Elle comporte notamment une partie « désinsectisation » (annexe 9).
Parmi les méthodes de pulvérisation appliquées figure la méthode « cales enlevées » (« block away »). Elle est effectuée à la fermeture des portes, au moment du roulage, avant de décoller. Le personnel navigant traverse alors l’avion de bout en bout pour administrer de la deltaméthrine et maintenant de la perméthrine.
Une autre technique utilisée réside dans le traitement résiduel, mis en place par les Australiens et Néozélandais dans les années 1980. La plupart des grandes compagnies ont suivi. Cette méthode, adoptée par Air France pour tous ses vols long courrier, est réalisée tous les quarante-cinq jours. La cabine, sans passager à bord, est entièrement traitée, de même que la soute. Il s’agit d’une émulsion de perméthrine à 2 %. Pour nos vols entre la métropole et les Caraïbes, c’est le traitement résiduel qui est appliqué. Concernant nos vols régionaux entre Cayenne et Miami, c’est le traitement « cales enlevées » qui est appliqué.
Une autre méthode que nous n’utilisons pas, comme la plupart des autres compagnies, est la technique « avant vol et début de descente ». Dans l’heure qui précède l’arrivée des passagers, le personnel au sol effectue une administration d’insecticide. En début de descente, une nouvelle administration est effectuée.
En plus du traitement résiduel, nos équipages ont aussi à leur disposition des bombes d’insecticides au cas où ils trouveraient des insectes présents dans l’aéronef.
L’OMS a énoncé un certain nombre de recommandations relatives aux méthodes et aux produits utilisés. La nouvelle réglementation européenne sur les « biocides » nous impacte également. La déphéotrine est, par exemple, retirée du marché. La perméthrine va l’être dans peu de temps, ce qui représente pour nous un enjeu. Nous sommes en contact avec nos fournisseurs afin de trouver des produits alternatifs dans le respect de cette nouvelle réglementation et des recommandations de l’OMS.
6. M. Jean-Louis Gély, directeur de la communication
et des relations extérieures, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée) – « Prolifération des moustiques en ville : outils de prévention »
Comme cela a été souligné à plusieurs reprises, le moustique tigre, qui nous intéresse particulièrement en France métropolitaine, n’est pas seulement un vecteur : il représente une forte nuisance et, en métropole, il est d’abord perçu sous cet angle. Cela peut d’ailleurs conduire à se demander si la dichotomie entre ces deux caractéristiques (moustique vecteur/moustique nuisible) est toujours pertinente car elles peuvent se confondre. Le moustique tigre en est la parfaite illustration. Lorsque nous cherchons à instrumenter des outils permettant d’abaisser le seuil d’exposition des populations au moustique tigre, nous visons à la fois la réduction de la nuisance et l’abaissement du risque sanitaire via la réduction du risque de transmission vectorielle.
M. Daniel Bley soulignait que la perception du risque sanitaire semblait plus importante en métropole qu’en outre-mer, dans des contrées qui ne sont pas atteintes par les maladies vectorielles. En métropole, une distinction me paraît pertinente : celle entre les territoires qui ont une culture du moustique, avec la présence ancienne d’opérateurs de démoustication, et les territoires où cette culture n’est pas présente, en raison de l’absence de nécessité.
Dans les territoires couverts par des opérateurs de démoustication et ayant une culture du moustique, pour le public, un moustique est un moustique, quelles que soient son origine et son espèce. Le moustique tigre intervient comme un parasite, c’est-à-dire comme un intrus qui vient obérer le travail de contrôle de la nuisance effectué par les EID, et par l’EID Méditerranée en particulier, depuis plus d’un demi-siècle.
Partout où le moustique tigre est apparu, personne n’a su développer un outil insecticide, à la différence des moyens que l’on peut utiliser contre les moustiques issus des zones humides littorales, car 80 % des gîtes larvaires se trouvent chez l’habitant. Ils sont très souvent de très petite taille et sont aléatoires dans l’espace et dans le temps. Ils pullulent et ne peuvent être cartographiés ni traités par des larvicides. Ils ne peuvent pas non plus être traités de façon itérative à leur stade adulte car il existe un seul insecticide disponible contre les moustiques adultes en milieu urbain, la deltaméthrine. Qui plus est, cet insecticide a une rémanence courte, c’est-à-dire une persistance d’effet limitée dans le temps. Si nous voulions, par ce moyen, limiter la nuisance, il faudrait intervenir de manière très répétitive, presque partout et tout le temps, ce qui pourrait incommoder certaines personnes fragiles. Surtout, adresser une même substance de façon répétitive à de mêmes espèces risque de susciter un phénomène de résistance. Nous serions alors totalement démunis pour la lutte antivectorielle lorsque nous sont signalés des cas suspects ou a fortiori avérés de dengue, de chikungunya ou maintenant de Zika.
C’est la raison pour laquelle la prévention, les comportements adéquats, individuels et collectifs – ce qu’on appelle la « participation communautaire » – et tous les moyens de mobilisation sociale, au premier chef la communication, ont un poids particulier dans la lutte contre le moustique tigre, par rapport aux autres espèces de moustiques. Il faut prévenir, communiquer, mobiliser et faire participer. C’est toujours une lutte intégrée car il existe des moyens insecticides dans le domaine public et des pistes décrites notamment par mon collègue Christophe Lagneau, telles que l’autodissémination ou les barrières de pièges. Mais la mobilisation et la participation des communautés apparaissent néanmoins et resteront sans doute les composantes du moyen principal de lutte.
Il s’agit d’abord d’identifier les types d’habitats puis la multitude de gîtes larvaires associés. Outre l’habitat individuel, qui représente sans doute la principale problématique, il faut tenir compte de formes d’habitat plus denses telles que les campings, les voiries, les espaces publics non bâtis ou encore les cimetières. Pour chacune de ces situations, nous avons des publics cibles qu’il faut convaincre d’adopter les gestes que nous recommandons. Nous avons établi une stratégie opérationnelle de recommandations accessibles sur notre site : eid-med.org.
Les gestes préconisés incluent la vidange, le rangement, la couverture (pour la gestion des eaux domestiques), le curage (pour les gouttières, ponts, rigoles), le fait de jeter les saletés qui encombrent parfois nos espaces ouverts ou l’entretien des piscines.
Nous avons développé des messages et des supports autour de ces gestes recommandés. Le message diffusé jusqu’à présent, « Soyez secs avec les moustiques », appelle plutôt un comportement individuel qu’un comportement collectif. De plus, il ne s’agit pas seulement de supprimer les eaux puisque d’autres gestes doivent être adoptés dans toute une série de situations particulières. En outre, les eaux stagnantes – souvent sales – ne sont pas seules en cause puisque les eaux claires sont également aptes à enclencher le cycle biologique du moustique tigre une fois que ses œufs sont au contact de l’eau.
Dans notre nouvelle campagne, qui vient d’être validée, nous misons sur le caractère collectif des actions à entreprendre, ce que reflète notre nouveau message, « Faisons équipe avant qu’il pique ». L’objectif est de priver le moustique d’eau, grâce à une pluralité de gestes pouvant permettre ce résultat. Il existe une série de supports associés pour différentes situations particulières (habitat collectif, campings, cimetières, collecteurs d’eau, etc.). Une check list récapitule les situations et les gestes à adopter. Une série de guidelines ont été rédigées, correspondant à des professions particulièrement concernées (gestionnaires de camping, professionnels du bâtiment, commerces à risque tels que métiers verts, garages, etc.) et à des gestes de protection personnelle. Nous avons aussi créé un site Web (http://www.moustiquetigre.org) et sommes présents sur Facebook. Des spots de format publicitaire ont été réalisés pour la télévision et la radio. Ils sont utilisables sur les antennes de télévision à condition de disposer des budgets nécessaires pour la réservation d’espaces. Ils sont actuellement proposés à toutes les communes afin d’être inclus dans le portail de leur site Internet.
L’aspect éducatif est également très important. Nous avons développé en liaison avec l’Éducation nationale un kit pédagogique qui s’adresse plus particulièrement aux élèves des collèges. Un kit de recherche larvaire, plus ludique, est plus adapté aux élèves du primaire. Un jeu de société a aussi été élaboré. Ces éléments sont proposés à l’Éducation nationale mais aussi aux communes, qui gèrent les temps d’activité périscolaires pour le primaire.
L’habitat individuel demeure la cible principale de nos dispositifs. Le maire de La Grande-Motte a évoqué certains dispositifs que nous allons déployer. Nous allons tester un système de lutte intégrée dans des communes pilotes afin de montrer aux communes que lorsqu’on fait converger tous les outils insecticides (traitements larvicides sur la voie publique), l’autodissémination – dont l’expérimentation débute – et tous les moyens de communication et d’éducation, cela marche. Les communes verront ainsi que cela vaut la peine de s’investir.
Pour obtenir la mobilisation des publics cibles directs, il faut passer par des publics relais. Les communes constituent des relais indispensables. Il en est de même des professionnels, à travers leurs fédérations, syndicats et offices. Le milieu associatif de proximité constitue aussi un public relais extrêmement important, de même que les médias. En relation avec les agences régionales de santé, nous travaillons aussi à destination de tous les publics cibles sanitaires et paramédicaux. Nous travaillons en convergence avec les agences régionales de santé.
La dichotomie entre nuisance et santé doit être dépassée, sur le plan opérationnel, afin de permettre une plus grande convergence opérationnelle entre les opérateurs entomologiques tels que les EID et le secteur de la santé. Cela rejoint des évolutions nécessaires de la gouvernance de la lutte antivectorielle au sens large, en incluant la prévention.
Aujourd’hui, la mobilisation des communes est encore faible ou plutôt inégale. Je le confirme, mis à part des communes qui sont très directement intéressées. Sète ou La Grande-Motte constituent, à cet égard, des contre-exemples puisqu’elles sont plus proactives que la moyenne. D’une façon générale, même lorsque les citoyens se plaignent de nuisances épidermiques, nous avons du mal à nous assurer partout de la mobilisation des communes, de celle de leurs personnels, afin qu’elles fassent elles-mêmes les gestes nécessaires dans leur patrimoine bâti public. Mais ça commence à venir.
Les opérateurs de démoustication sont de petits organismes qui ont été conçus pour traiter de façon prioritaire la nuisance des moustiques qui proviennent, chez nous, de zones humides littorales, ainsi que la nuisance des moustiques communs provenant de milieux urbains. Nous ne sommes pas des agences de communication disposant de ressources humaines nombreuses. Nous avons évoqué le porte-à-porte auprès de l’habitat individuel. Ce sont des choses que les communes ne doivent et ne peuvent faire que sous une sorte de maîtrise d’ouvrage et le conseil des EID, là où elles existent. Il faut donc convaincre les élus locaux du caractère indispensable de l’implication concrète des communes dans cette communication opérationnelle.
M. François Commeinhes - Merci, Monsieur le Directeur. En organisant cette audition, nous avions espéré la présence parmi nous de Mme Marisol Touraine, ministre des affaires sociales et de la santé, qui est malheureusement empêchée. Nous avons néanmoins l’honneur et le plaisir d’accueillir Mme Anne-Claire Amprou, directrice générale adjointe de la santé au ministère des affaires sociales et de la santé. Elle est également membre de l’inspection générale des affaires sociales (IGAS) et de la task force interministérielle Ébola mise en place par le Premier ministre en 2013.
7. Mme Anne-Claire Amprou, directrice générale adjointe de la santé, Ministère des affaires sociales et de la santé – « L’action du ministère des affaires sociales et de la santé dans le champ des maladies à transmission vectorielle »
La direction générale de la santé a une mission de prévention et de lutte contre les maladies vectorielles et une mission de gestion d’une épidémie telle que Zika et de coordination de l’ensemble des acteurs.
En ce qui concerne la politique de prévention et de lutte contre les maladies vectorielles, si la direction générale de la santé a un rôle d’élaboration de cette politique, elle a surtout un rôle de coordination de l’ensemble des acteurs intervenant dans le cadre de cette politique de prévention, pour la surveillance des moustiques – avec les conseils départementaux –, la surveillance humaine – en lien avec l’InVS, demain avec l’ANSP dont la direction générale de la santé assurera la tutelle –, la sensibilisation du public – notamment avec l’INPES – et le pilotage et l’action des agences régionales de santé au niveau territorial. Il existe d’autres acteurs qui interviennent et le rôle de la direction générale de la santé, en matière de prévention et de lutte antivectorielle, est de coordonner l’ensemble de ces acteurs.
L’action s’adapte au territoire. En métropole, l’action de la direction générale de la santé vise plutôt à anticiper et à préparer la société à l’extension de l’aire géographique du moustique tigre. Elle s’organise autour du plan antidissémination de la dengue et du chikungunya, qui date de 2006 et qui est réactualisé chaque année. Devant l’extension exponentielle de l’aire géographique d’installation des moustiques, l’actualisation de ce plan est à l’ordre du jour et devient pressante.
En matière de gestion d’une épidémie telle que Zika et de renfort des moyens de réponse, l’action de la direction générale de la santé et du ministère des affaires sociales et de la santé s’est déployée à plusieurs reprises, d’abord en 2013. Lors de l’épidémie en Polynésie française, à la demande du Haut-commissaire de la République en Polynésie française, la direction générale de la santé s’est mobilisée. 1 723 cas suspects avaient été dénombrés, pour un nombre total de cas estimé à plus de 30 000. Il s’agissait de la première épidémie documentée. Des études faites à partir de ces éléments documentés sont précieuses et nous ont permis d’anticiper un certain nombre d’éléments dans l’épidémie de Zika, notamment dans les départements français d’Amérique (DFA).
L’action de la direction générale de la santé visait aussi à coordonner l’ensemble des acteurs et à renforcer les moyens sur place, qu’il s’agisse de ceux de l’EPRUS, de l’InVS ou de l’Établissement français du sang.
Dès le mois de mai 2015 et la constatation des premiers cas de circulation du virus au Brésil, une demande a été faite pour évaluer le risque de propagation du virus dans les DFA. Le Haut Conseil de santé publique a été saisi sur la stratégie de surveillance épidémiologique et sur la prise en charge des formes graves, notamment neurologiques, qui devait être mise en place. C’est sur la base de l’avis rendu par le Haut Conseil de santé publique, en juillet 2005, que la direction générale de la santé a demandé aux agences régionales de santé des DFA d’élaborer un plan d’action. En septembre 2015, les premiers cas autochtones de Zika ont été identifiés dans les DFA. Nous avons alors mis en place un plan d’actions général coordonné par la DGS avec les agences régionales de santé. Ce plan général comportait plusieurs axes, notamment la lutte antivectorielle et le renforcement des capacités de surveillance et de diagnostic au niveau local dans les DFA. La direction générale de la santé a aussi accéléré l’inscription dans la nomenclature d’un test rapide de diagnostic Zika, à partir d’un kit commercial qui a obtenu le marquage CE en janvier 2016 après un avis en urgence de la Haute Autorité de santé. L’arrêté d’inscription en nomenclature a été signé par la ministre des affaires sociales et de la santé.
Un autre axe de réponse dans les DFA réside dans le renforcement de l’offre de soins, en personnel et en matériel. À ce titre, les professionnels de santé, notamment des réservistes de l’EPRUS, ont été envoyés dans les DFA (réanimateurs, gynécologues-obstétriciens, sages-femmes, infirmières), en plus du matériel envoyé dans ces territoires (respirateurs, échographes, moustiquaires). Au total, cinquante-huit réservistes ont été mobilisés, ce qui représente, avec le matériel envoyé, un budget de deux millions d’euros mobilisé pour la prise en charge médicale de l’épidémie Zika en DFA.
Le dernier axe, très important, porte sur l’organisation du suivi des femmes enceintes, puisque le risque de malformations fœtales, pour ces dernières, constitue une spécificité du virus Zika. À ce titre, notamment après un certain nombre de recommandations, un suivi très rapproché des femmes enceintes a été mis en place avec, en particulier, une échographie mensuelle ainsi qu’une prise en charge spécifique en cas de suspicion d’infection.
La direction générale de la santé s’est également mobilisée en termes d’information et de communication, notamment avec le Conseil supérieur de l’audiovisuel. Elle a assuré une coordination entre le niveau national et le niveau international, notamment en participant aux réunions organisées par l’OMS et la Commission européenne.
En métropole, il s’est agi également d’anticiper, en mobilisant le système de santé, notamment les agences régionales de santé des établissements de santé pour la prise en charge des femmes enceintes de retour des zones à risque.
Il existe pour le ministère des affaires sociales et de la santé et, en particulier, pour la direction générale de la santé un enjeu immédiat concernant le suivi des femmes enceintes et la prise en charge médicale des nouveau-nés et nourrissons ayant présenté ou ayant pu présenter une infection par le virus Zika in utero ou présentant une infection congénitale à virus Zika. Un autre a trait à la préparation de la suite, notamment la gestion des périodes intercrises, afin d’éviter d’autres épidémies. Plusieurs axes ont été définis, notamment l’adaptation de la société, en métropole, avec l’élaboration d’une stratégie de mobilisation sociale qui doit s’appuyer et mobiliser l’ensemble des acteurs. Elle peut s’appuyer sur de nouveaux moyens d’information. Elle doit aussi prendre en compte la nécessité de développer un environnement favorable, notamment en matière d’aménagement de l’espace public. Cela renvoie à des axes du plan national santé-environnement, par exemple.
L’autre axe de cet enjeu global vise à rechercher les mesures de lutte de demain, ce qui renvoie à la recherche. Devant le risque de résistance, il faut trouver de nouvelles méthodes et de nouveaux moyens de lutte contre les moustiques de demain.
Enfin, dès lors que cela devient une problématique nationale, il est fondamental d’harmoniser les pratiques et les stratégies d’intervention. Le ministère des affaires sociales et de la santé a un rôle de coordination des acteurs à rappeler à cet égard.
M. François Commeinhes, sénateur, membre de l’OPECST
Je voudrais remercier tous les intervenants pour la grande qualité de leurs interventions et pour l’intérêt manifesté par tous, devant la prolifération des moustiques et le danger sanitaire qu’ils représentent.
Au moment de la recrudescence de la présence des moustiques à Sète, à La Grande-Motte et dans la région, j’ai pu directement constater que le phénomène avait pris une ampleur inquiétante, aux retombées multiples, sur la santé mais aussi sur la vie quotidienne et sur le tourisme, au développement duquel je suis particulièrement attaché.
Il est évident que la priorité va aux questions de santé. En ma qualité de médecin, je ne saurais l’oublier. Comme je l’ai dit à plusieurs reprises, notamment à l’occasion de questions au Gouvernement, il n’est pas envisageable que ces insectes rendent la vie impossible aux habitants de certaines régions françaises, qu’elles soient métropolitaines ou d’outre-mer.
Quant au tourisme, je rappellerai que la situation que nous vivons dans nos régions renvoie cinquante ans en arrière, quand il a fallu engager une démoustication de masse pour jeter les bases d’une industrie touristique, comme le rappelait M. Stéphan Rossignol en évoquant la mission Racine, qui a souhaité développer des stations balnéaires dans une zone qui était totalement impraticable car infestée de moustiques.
Ce n’est évidemment pas l’OPECST, en un après-midi d’auditions publiques, qui sera en mesure d’apporter des solutions pratiques à un problème d’une telle ampleur. Cependant, la contribution de cet Office, à l’autorité reconnue, est opportune car elle permet de prendre le recul nécessaire, jusqu’au niveau mondial s’il le faut pour appréhender l’ampleur d’une question avec l’aide indispensable des meilleurs spécialistes. À cet égard, la présence, cet après-midi, de personnalités reconnues, aux publications scientifiques innombrables, va permettre à l’Office, au Parlement dans son ensemble et au Gouvernement de tirer profit de nos débats de ce jour.
Je reviendrai brièvement sur quelques points déjà évoqués à mon initiative au cours des mois précédents, notamment sur la nécessité de mieux cerner le phénomène auquel nous avons à faire face, de prendre conscience de la difficulté et du rythme des solutions à apporter ainsi que des technologies nouvelles ou éprouvées auxquelles il faudra recourir pour endiguer ce phénomène.
Comme cela a été souligné lors de questions posées au Gouvernement, notamment à l’occasion d’une question d’actualité posée par moi-même à Mme Ségolène Royal, ministre chargée de l’environnement, le 27 janvier 2016, le rôle de l’ANSES pour identifier les molécules biocides utilisables en France et dans le contexte européen est essentiel.
À l’automne 2015, un groupe de contacts a d’ailleurs été mis en place à l’initiative des ministres chargés de l’écologie et de la santé. J’avais insisté sur la nécessité d’une information et d’une concertation aussi larges que possible. Certaines diapositives projetées aujourd’hui ont montré qu’une gamme de brochures et affiches existait déjà afin de sensibiliser les populations aux risques créés par les moustiques : « Soyez secs avec les moustiques » et, aujourd’hui, « Faisons équipe avant qu’ils nous piquent. ». Souhaitons que ces documents permettent d’assimiler plus facilement les gestes indispensables de prévention, notamment à l’aide de kits facilement utilisables.
J’ai été particulièrement attentif à la description, par le Pr François Rhodain, des différents types de vecteurs (anophèles, phlébotomes, tiques, moustiques). J’ai découvert la tique dure et la tique molle et ai noté qu’il existait près de soixante-dix espèces de moustiques en France métropolitaine, une vingtaine aux Antilles et près de deux cents en Guyane française.
Nous avons entendu que ces vecteurs pouvaient transmettre des maladies aussi graves et invalidantes que le paludisme, la filariose, la leishmaniose, divers flavovirus et également le chikungunya, la dengue, le Zika et des fièvres telles que la West Nile, la fièvre jaune et celle de la vallée du Rift.
Pour autant, les raisons d’espérer existent, à travers d’abord les progrès de la recherche, concernant, par exemple, les vaccinations. Une voix très autorisée nous a laissé entrevoir la possibilité d’éradication du paludisme. D’autres ont évoqué de nouveaux vaccins, comme celui contre la dengue, en cours de test actuellement aux Philippines.
Ces problèmes sanitaires et environnementaux ne manquent évidemment pas de rétroagir les uns sur les autres. C’est ainsi qu’il ne suffirait pas d’éliminer tous les moustiques ni tous les vecteurs en général pour atteindre une situation satisfaisante. D’abord parce que cette élimination pourrait prendre la forme d’une diffusion massive de biocides dangereux pour la santé humaine et animale et pour l’environnement, ensuite parce que chacun des vecteurs, aussi importuns qu’ils nous paraissent, joue un rôle dans notre écosystème. Enfin, la piste de la stérilisation des moustiques mâles mérite évidemment d’être évaluée.
L’ANSES a déjà mené d’importants travaux pour réduire de façon drastique le nombre de pesticides à utiliser en fonction de leur nocivité. Bien évidemment, les produits sélectionnés doivent être conformes à la réglementation européenne et conserver leur efficacité dans le temps.
Même si l’OPECST a d’abord pour mission d’appréhender un problème dans toute son ampleur, à travers une approche scientifique et technologique de toutes les maladies, de tous les vecteurs et de tous les milieux, il a également pour habitude de proposer des solutions concrètes, qu’elles soient ou non d’ordre législatif. Cependant, aussi curieux que cela paraisse, des textes peuvent aussi constituer des moyens de lutte contre les vecteurs. C’est ainsi que la création du Centre national d’étude des vecteurs a résulté d’un rapport de l’IRD de 2009.
Comme toute norme française doit se combiner harmonieusement avec une norme européenne et, au-delà avec, une approche mondiale, je rappellerai l’existence du règlement sanitaire international, dont l’importance a été soulignée.
Pour revenir en France métropolitaine, nous avons entendu l’ARS PACA ainsi que l’EID Méditerranée. Il ne faudrait pas en déduire que la recrudescence de la présence des moustiques se limite au Sud de la France, comme on pourrait être tenté de le croire en rapprochant un peu rapidement ce phénomène des changements climatiques. Comme nous l’avons vu, il ne faut pas tout imputer aux changements climatiques. D’ailleurs, si vous consultez la carte de la présence de l’aedes albopictus en France métropolitaine, vous noterez que le département du Val-de-Marne apparaît tout aussi concerné que ceux du bord de la Méditerranée. Pour ma part, j’étais, au mois de juin, à Milan et la situation était impressionnante du point de vue de la concentration de moustiques.
J’ai trouvé comme explication de cette prolifération, à plusieurs reprises, l’importation de pneus usagés venant notamment d’Asie. En effet, l’eau qui stagne dans ces réservoirs inattendus favorise l’éclosion des œufs de moustiques qui peuvent y demeurer plusieurs mois, y compris en période de grand froid ou de forte chaleur.
On peut également souligner en cet instant le rôle du commerce international et, d’une manière générale, de la multiplication sans frein de tous les modes de transport. Nous avons d’ailleurs été partiellement rassurés par l’intervention de la médecine des voyages. La problématique aurait pu être élargie à d’autres intervenants si nous avions pu organiser une journée complète d’auditions. Nombre d’entre nous n’ont-ils pas noté la pratique de pulvérisations dans les habitacles d’aéronefs à destination de certaines contrées ? Au-delà de ces vecteurs géants et mécaniques de transmission de certaines maladies, les zones aéroportuaires, les navires et marchandises du transport maritime, les bagages et les voyageurs en général peuvent faciliter la circulation internationale de vecteurs de maladies.
Il est donc impossible de présenter en cet instant une conclusion exhaustive de nos travaux de ce jour. La présentation du compte rendu de cette audition devant l’Office permettra d’établir une synthèse, sans trahir les propos des intervenants. L’audition de ce jour n’est, en tout état de cause, qu’une phase provisoire et s’inscrit dans un processus où nombre d’acteurs ont un rôle à jouer, non seulement les acteurs institutionnels, le Gouvernement et ses ministères, les agences – dont les agences régionales de santé –, les chercheurs, les établissements hospitaliers, mais également les élus, qu’ils soient régionaux, départementaux ou municipaux, sans oublier chaque individu car la connaissance des risques et dangers des maladies à transmission vectorielle est encore trop lacunaire à ce jour.
En outre, dès l’enfance, chacun peut être éduqué à limiter la reproduction des moustiques, par exemple en évitant la présence de récipients contenant de l’eau stagnante dans nos jardins ou sur nos balcons.
Il serait illusoire et non souhaitable de songer à la disparition totale des vecteurs. Il faut donc vivre avec eux le mieux possible. Toute la question consiste à savoir où placer les limites entre les précautions et mesures d’intervention efficaces et raisonnables et celles qui constitueraient, en elles-mêmes, une atteinte excessive à la santé ou aux milieux.
La présente conclusion improvisée n’avait pas pour but de mettre en valeur tel ou tel intervenant ni tel ou tel propos par rapport à tel autre, d’autant que j’ai pu omettre des points essentiels, mais de vous remercier en vous indiquant ce qui venait d’emblée à l’esprit d’un sénateur membre de l’OPECST à l’origine de l’organisation de la fructueuse audition de ce jour.
L’OPECST ayant coutume de travailler dans la durée, contrairement aux commissions toujours soumises au calendrier frénétique dicté par le Gouvernement, je vous serai reconnaissant de bien vouloir considérer que cette journée n’a constitué qu’une prise de contact et que, désormais, tous les membres de l’OPECST sont devenus pour vous des interlocuteurs au quotidien sur la question des maladies à transmission vectorielle.
Merci encore à toutes et à tous.
EXTRAIT DE LA RÉUNION DE L’OPECST DU 28 JUIN 2016 PRÉSENTANT LES CONCLUSIONS RELATIVES À L’AUDITION PUBLIQUE DU 7 AVRIL 2016 SUR
LES MALADIES À TRANSMISSION VECTORIELLE
M. François Commeinhes, sénateur. – Le 7 avril 2016, l’OPECST a organisé une après-midi d’audition publique sur les maladies à transmission vectorielle à la suite d’une demande que j’avais formulée auprès du Bureau de l’Office. Cette audition a réuni près d’une trentaine d’intervenants qui ont versé au débat des contributions d’une grande qualité relatives à la prolifération de tous les vecteurs, des moustiques en particulier, et sur les dangers sanitaires qu’ils représentent.
Je rappelle que la recrudescence de la présence de vecteurs a pris une ampleur inquiétante pour la santé, la vie quotidienne et le tourisme. C’est ainsi que l’épidémie causée par le virus Zika est présente dans tous les esprits et que les zones géographiques où elle apparaît s’étendent.
Si la priorité va évidemment aux questions de santé, il n’est cependant pas envisageable non plus que ces insectes rendent la vie impossible aux habitants de certaines régions françaises, qu’elles soient métropolitaines ou d’outre-mer. C’est le cas également pour les touristes qui trouvent actuellement dans nos régions à moustiques la même situation qu’il y a cinquante ans, c’est-à-dire celle d’avant la démoustication de masse qui a permis de jeter les bases de l’industrie touristique. Mais l’extension des zones de présence des tiques est également préoccupante.
Même si l’OPECST ne pouvait, en une après-midi d’audition publique, trouver des solutions pratiques à un problème d’une telle ampleur, la contribution de l’Office, avait pour ambition d’appréhender le maximum d’aspects de cette question avec l’aide, indispensable, des meilleurs spécialistes. Il a été rappelé que différents types de vecteurs existent : les anophèles, les phlébotomes, les tiques, les moustiques susceptibles de transmettre des maladies aussi graves et invalidantes que le paludisme, la filariose, les leishmanioses de plusieurs types, différents flavovirus, mais également le chikungunya, la dengue, le Zika et des fièvres comme le West Nile, la fièvre jaune ou encore celle de la vallée du Rift.
Comme à son habitude, l’OPECST a mis à profit cette audition publique pour appréhender tous les aspects scientifiques et technologiques des maladies à transmission vectorielle à travers une approche rigoureuse et aussi complète que possible : toutes les maladies, tous les vecteurs, tous les milieux.
L’audition a ainsi permis de faire émerger des pistes de solutions concrètes – qu’elles soient ou non d’ordre législatif.
Ni le 7 avril ni aujourd’hui, il n’est possible de tirer une conclusion définitive de l’audition publique menée par l’Office. Néanmoins, l’adoption du compte rendu de cette audition aujourd’hui, dans un contexte national et international confirmant les risques et dangers des maladies à vecteurs depuis le jour de l’audition, permettra de diffuser ce point de connaissances multiples résultant de la richesse des propos des intervenants.
Cette audition n’est qu’une phase provisoire qui s’inscrit dans un processus où nombre d’acteurs institutionnels ou privés ont leur rôle à jouer pour que la connaissance des risques et dangers des maladies à transmission vectorielle, encore trop lacunaire à ce jour, permette une lutte plus efficace.
Comment vivre du mieux possible avec les vecteurs ? Où placer les limites entre les précautions et mesures d’intervention efficaces et raisonnables et celles qui constitueraient, en elles-mêmes, une atteinte excessive à la santé ou à la qualité des milieux ?
Cette audition a d’abord permis de mieux cerner le phénomène des arboviroses, de prendre conscience de la difficulté et du rythme des solutions à apporter, et des méthodologies, nouvelles ou éprouvées, auxquelles il faudra recourir pour limiter ou endiguer ce phénomène.
Les conclusions présentées à l’Office s’articulent de la manière suivante : après l’énoncé de quelques informations indispensables, mais pas forcément très connues, sur les vecteurs, seront rappelées les questions qui se posaient à tout un chacun avant l’audition publique avec, en réponse, les principaux éléments d’information tirés de l’audition.
Cette mise en regard montrera que certaines questions étaient mal posées, que des problèmes non perçus sont parfois prépondérants mais, également, qu’une palette de solutions peut être mise en œuvre.
À ce stade, je crois nécessaire de rappeler quelques faits indispensables pour entrevoir la complexité des vecteurs : il existe près de trois mille cinq cents espèces de moustiques dont soixante en France et quarante sur le littoral méditerranéen et il a été dénombré deux cents espèces de tiques molles et sept cents espèces de tiques dures.
C’est le moustique femelle qui pique.
La prolifération du moustique tigre est grandement aidée par la multiplication des petits gîtes larvaires artificiels créés par l’homme qui se plaint de cette prolifération.
Dans ce contexte, quelles sont les principales questions posées par les maladies à transmission vectorielle ?
Avant l’audition publique, certaines évidences semblaient s’imposer comme :
- la prolifération du moustique tigre dans le Sud de la France provenait du réchauffement lié aux changements climatiques ;
- le déplacement des zones d’habitat était surtout spectaculaire pour le moustique tigre ;
- des démoustications par des biocides moins offensifs que l’ancien DDT étaient possibles ;
- des dérogations favorables aux épandages de biocides étaient envisageables ;
- les liens de causalité entre la piqûre de moustique et des maladies étaient déjà scientifiquement établis ; le virus Zika transmettant la microcéphalie, le syndrome de Guillain-Barré ou encore des complications neurologiques ;
- il n’existait pas de transmission sexuelle des arboviroses.
À ces six principales questions, les intervenants de l’audition publique ont apporté des réponses conduisant à largement nuancer ces six certitudes :
- La prolifération du moustique tigre dans le Sud de la France ne provient pas du réchauffement lié aux changements climatiques mais constitue une retombée de la mondialisation des échanges de personnes et de biens. Par exemple, les importations de pneus usés, le recours massif au transport par containers, les passagers du transport aérien… Tout cela entraîne des cas d’arbovirus importés.
De plus, les moustiques vivent très bien en pays tempéré voire en pays tempéré froid ; en réalité, plus que les changements climatiques, c’est la destruction des forêts qui peut avoir un impact sur l’extension de la présence de moustiques ; de même, plutôt que les changements climatiques, les retours de vacances lointaines voire l’organisation de Jeux olympiques, ici ou là, constituent des accélérateurs de la prolifération des vecteurs de maladies.
- La modification des zones d’habitat ne concerne pas seulement le moustique tigre mais tous les moustiques et aussi les tiques – de plus en plus présentes dans l’Est de la France.
- L’extension de la résistance des moustiques aux insecticides et les effets de ces biocides sur la santé humaine et l’environnement doivent être pris en compte de manière prioritaire avant de pouvoir envisager des campagnes massives de démoustication. Une forte résistance des moustiques aux insecticides existe en particulier dans les départements français d’Amérique.
- Parallèlement, la gamme des insecticides utilisables se restreint grandement et il s’agit moins de dérogation juridique à obtenir que de problèmes pratiques de santé publique à surmonter.
- Les liens de causalité entre un vecteur et une affection particulière ne sont pas établis de manière aussi certaine que le relatent les médias.
- Contrairement à ce qui a été longtemps admis, certaines arboviroses semblent se transmettre par voie sexuelle. La transmission sexuelle du virus Zika est maintenant fortement suspectée.
En complément de ces éclaircissements, certaines questions moins médiatisées n’avaient pas été entrevues avant l’organisation de l’audition publique et, de plus, d’autres problématiques émergent.
À noter tout d’abord à nouveau, l’expansion mondiale actuelle des arbovirus et celle des tiques.
Arrivé en 2004 dans les Alpes-Maritimes, le moustique tigre est maintenant présent dans trente départements dont ceux de l’Alsace et du Val-de-Marne. De petites épidémies d’arboviroses ont eu lieu dans le Sud de la France.
L’augmentation des cervidés conjuguée à la baisse des populations de lynx et de loups a entraîné l’augmentation des tiques qui se sont déplacées vers l’Est de la France.
Si la forêt tropicale a toujours regorgé de nombreux virus, désormais, en raison de la déforestation, l’émergence de nouveaux virus peut être redoutée.
La recherche en matière de produits biocides n’est pas aussi dynamique que souhaitable car, pour ces produits, le marché est restreint et donc peu rentable. D’autant que les entreprises qui s’y intéressent ne sont pas susceptibles de recevoir l’aide octroyée aux investissements d’avenir.
Au fil des ans, une seule substance biocide a fini par être considérée comme utilisable, à savoir la deltaméthrine, ce qui restreint l’efficacité de la lutte contre les vecteurs qui développent une accoutumance.
Par ailleurs, la lourdeur et la lenteur du système de financement de la recherche ne sont pas adaptées aux délais très courts de réaction nécessaire en matière de crise sanitaire.
Très peu de médicaments existent contre les arboviroses et aucun vaccin sauf celui contre la fièvre jaune.
Un des moyens de lutte contre la prolifération des anophèles a été la production d’enzymes de détoxication mais cela a favorisé l’adaptation de ces vecteurs au milieu urbain.
Les moustiques adaptent leurs comportements pour déjouer les protections offertes aux personnes par les moustiquaires imprégnées d’insecticides.
Pour affronter ces divers problèmes, quelques solutions réalistes sont recherchées.
Au cours de cette audition publique de bonnes nouvelles ont aussi été enregistrées comme celle de la possibilité de l’élimination du paludisme qui serait envisageable à l’horizon de vingt à trente ans.
De même, il existe de nombreuses méthodes, à utiliser seules ou de manière combinées, tendant à la réduction des populations de vecteurs : la lutte mécanique (barrière de pièges), la lutte insecticide (par la démoustication, l’usage de moustiquaires imprégnées d’insecticides, l’étalement de répulsifs sur la peau), la lutte biologique (incluant la diminution de la durée de vie des vecteurs, leur modification génétique, le recours à des antibiotiques, à des larvicides, à des adulticides).
En outre, d’autres pistes résulteraient de :
- l’existence dans la durée et dans l’ensemble du monde de compétences d’entomologistes ;
- l’accentuation des efforts de veille en raison de virus émergents ;
- l’inscription des crises sanitaires parmi les autres crises : selon la voie tracée par la plate-forme (alliance REACting Aviesan) ;
- l’indispensable augmentation du nombre de lits de soins intensifs puisque, par exemple, un mois d’hospitalisation est nécessaire en cas de syndrome de Guillain-Barré ;
- l’intensification des recherches en sciences humaines et sociales ;
- la cartographie des zones à risques ;
- l’information du grand public sur le risque acariologique ;
- la modification des comportements humains grâce à la mobilisation du plus grand nombre ; les petits gestes du quotidiens ;
- l’autodissémination par les vecteurs eux-mêmes ;
- la limitation de la résistance des vecteurs à la deltaméthrine ;
- la découverte d’une alternative au Bti ;
- le suivi des femmes enceintes ;
- la surveillance épidémiologique renforcée des cas suspects ;
- la vaccination ;
- la multiplication des contacts entre les élus et des spécialistes des maladies à transmission vectorielle.
Compte tenu des observations précédentes, j’ai l’honneur de proposer à l’Office l’adoption du compte rendu et des conclusions de l’audition publique de l’Office relative aux maladies à transmission vectorielle et l’autorisation de sa publication.
M. Jean-Yves Le Déaut, député, président de l’OPECST. – Merci. Y a-t-il des questions ou des commentaires ?
Mme Catherine Procaccia, sénateur, vice-présidente de l’OPECST. – Une précision déjà sur la demande de publication qui vient d’être formulée : s’agit-il de la publication de l’ensemble du dossier ou seulement de celle de la synthèse, très intéressante, qui vient d’être présentée à l’instant ?
M. François Commeinhes. – La publication comprendra l’ensemble dont le compte rendu intégral de l’audition publique.
Mme Catherine Procaccia. – Parce que, à mes yeux, l’audition elle-même, à laquelle j’ai tenté d’assister un peu, était trop dense, avec trop d’intervenants ; elle a été trop longue alors que la synthèse qui vient d’être faite est intéressante ; il est possible d’en tirer quelque chose.
Je voudrais également poser une question sur la dégradation de la situation. Est-ce qu’il y a vraiment, en France, maintenant, autant de moustiques que dans les années 1950 ?
M. François Commeinhes. – Il y a cinquante ans, la mission Racine s’est développée pour réaliser des stations balnéaires sur la côte méditerranéenne dans des zones infréquentables infestées de moustiques. À l’époque, il y a eu démoustication par le DDT et les moustiques ont disparu ; les stations balnéaires se sont créées. Aujourd’hui, cinquante ans après, les stations balnéaires sont là, les touristes aussi mais ils sont sur le point de repartir parce que cela devient invivable et infréquentable, le soir, à partir de dix-huit heures.
De plus, des produits autorisés à l’époque ne le sont plus de nos jours et il n’y a plus d’insecticides vraiment efficaces puisque les moustiques sont capables de muter en vingt-cinq jours pour s’adapter à ces produits ; c’est une course permanente. Si on rate une phase d’un traitement pouvant avoir un effet sur les larves, après on est dévoré par les moustiques tout l’été.
Mme Catherine Procaccia. – Ma seconde question porte sur la vaccination contre la fièvre jaune qu’il fallait renouveler tous les cinq ans. Maintenant, ce serait seulement tous les dix ou quinze ans. Cela signifie-t-il que ce vaccin est devenu plus efficace ?
M. François Commeinhes. – À ma connaissance, le vaccin est toujours le même mais une seule vaccination apparaît désormais suffisante. A une époque j’allais régulièrement effectuer des remplacements de médecins généralistes sur les pétroliers pour procéder à la vaccination des navigateurs contre la fièvre jaune et autres maladies, il s’agissait de protéger des personnes risquant des contaminations fréquentes.
M. Jean-Louis Touraine, député, membre de l’OPECST. – Le vaccin est toujours le même dans ses grandes lignes, même s’il a été légèrement perfectionné, mais les études ont montré la présence d’une immunité plus durable que ce qui avait été anticipé. C’est une bonne immunité mais insuffisante pour les personnes qui auraient un déficit immunitaire au départ. En revanche, pour les personnes d’âge moyen et d’une immunité normale, la durée d’efficacité du vaccin est plus longue que prévu.
On espère qu’il en sera de même pour la dengue, d’autant plus qu’il paraît possible de coupler les deux vaccinations contre la dengue et le virus Zika puisque, maintenant, on sait qu’un même mécanisme immunitaire peut protéger contre les deux, qui appartiennent à la même famille de virus. Donc, là aussi, une seule vaccination protégerait contre les deux et on espère que ce serait de manière suffisamment durable pour ne pas refaire des campagnes de vaccination trop fréquentes dans les pays infestés.
Pour la France, où les cas de dengue ou de Zika en métropole se comptent encore sur les doigts d’une main, une question se pose : à partir de quel seuil faudra-t-il envisager une vaccination de masse ? Une des préoccupations des scientifiques présents à l’audition était de savoir s’il pouvait y avoir transmission sexuelle de ces virus et donc un risque dans nos régions sans même attendre que ce moustique prenne l’avion.
M. Bruno Sido, sénateur, vice-président de l’OPECST. – Nous sommes amenés, les uns et les autres, à voter des lois sur la protection de l’environnement et sur l’interdiction de certains produits. Cela faisait longtemps qu’on avait interdit le DDT lorsqu’on a trouvé du DDT dans la graisse des phoques. On nous dit aujourd’hui qu’il faut manger du thon mais pas plus de deux fois par an puisqu’il est en bout de la chaîne alimentaire et qu’il accumule dans sa chair tous les métaux.
Dans le cadre de la loi du Grenelle de l’environnement, dont j’avais l’honneur d’être rapporteur, j’avais fait accepter que la loi dise que tous les traitements aériens étaient interdits à l’exception, par exemple, du traitement contre la chenille processionnaire du pin car, si vous ne prenez pas un hélicoptère ou un avion pour traiter, tous les pins meurent. Il est donc utile de prévoir des exceptions dans la loi.
On s’aperçoit, avec tes conclusions sur l’audition publique qui sont très bonnes et dont je te remercie – je t’avais déjà écouté avec beaucoup d’intérêt quand tu étais venu me voir pour me suggérer cette audition – que, dans d’autres domaines, par exemple, on utilise des matières actives interdites de plus en plus en agriculture comme, par exemple, le glyphosate. Dans le même temps, il est recommandé de ne pas labourer pour diverses raisons.
Avec la conjonction de ces divers éléments, on arrive maintenant à des impossibilités et je me pose la question de savoir s’il ne faudrait pas que l’Office, un jour, soit saisi pour se pencher sur ces questions afin de parvenir à analyser le rapport entre les services rendus et les problèmes réels liés à l’interdiction d’un certain nombre de produits. Il ne faudrait pas arriver, à un moment donné, à un certain déséquilibre où les hommes mourront tandis que la nature se portera mieux. Cela recoupe d’ailleurs ce que tu m’avais dit ou suggéré.
Il est anormal que, dans le midi de la France hier, maintenant en Alsace et demain à Paris, dès six heures du soir, il faille rentrer chez soi s’enfermer pour éviter les piqûres de moustiques.
Ne pourrait-on réfléchir à cette question très en amont par rapport au problème ? Ceux qui ont été piqués par le moustique tigre souffrent. En exagérant mon propos, ne sera-t-on pas obligé de revenir au DDT ?
M. Roland Courteau, sénateur, vice-président de l’OPECST. – Pour confirmer les propos de M. François Commeinhes, il y a cinquante ou soixante ans, dans des régions comme la nôtre, le Languedoc-Roussillon, c’était l’enfer. Les rares touristes fuyaient les moustiques et les vendangeurs avaient toutes les peines du monde à effectuer leurs travaux. J’ai même connu des périodes où les viticulteurs payaient journée double pour recruter des vendangeurs car on n’en trouvait pas, tellement c’était infernal.
Puis l’entente interdépartementale pour la démoustication a dû traiter pour faire reculer ce véritable fléau ; les moustiques ont reculé et les touristes sont revenus.
Aujourd’hui, effectivement, on assiste à un retour de la prolifération des moustiques et les touristes en sont très affectés ; des menaces pèsent sur le tourisme dans nos régions mais les habitants eux-mêmes sont obligés de se doter de moustiquaires dans toutes les habitations alors que ces accessoires avaient disparu durant des décennies.
Sur tous ces points, je rejoins les sénateurs Bruno Sido et François Commeinhes, un vrai problème existe.
Je voudrais faire une remarque également sur le virus Zika car j’ai lu dans une revue que des chercheurs européens avaient découvert de puissants anticorps susceptibles de le neutraliser et pensaient aboutir à la fabrication d’un vaccin. Ce qui m’a étonné, c’est que ces mêmes anticorps seraient capables de neutraliser également le virus de la dengue. Il y a là de grands espoirs d’éviter que le virus Zika ne provoque des lésions cérébrales, notamment chez le fœtus.
Mme Delphine Bataille, sénatrice, membre de l’OPECST. – L’impact du réchauffement climatique a-t-il été établi sur la prolifération de certaines espèces porteuses de virus ? Par exemple, celle du moustique tigre dans le Sud de la France proviendrait-elle plutôt du brassage des populations que du réchauffement climatique ?
M. François Commeinhes. – D’après les scientifiques, le réchauffement climatique n’y est pour rien. En revanche, les flux de population, les flux de marchandises peuvent induire le transport de petites quantités d'eau dans lesquelles il peut se trouver des larves de moustiques provenant de Thaïlande, du Brésil ou d’ailleurs.
M. Bruno Sido. – Sur ce point très précis, il faut interroger les botanistes et les entomologistes qui constatent que le même insecte ou la même plante remontent vers le nord de la France – et ce phénomène s’observe dans le monde entier – depuis la zone méditerranéenne, de dix ou vingt kilomètres par an, ce qui est énorme ; donc, effectivement, on aura les problèmes des maladies transmises par ces vecteurs, demain, à Paris et, après-demain, à Lille.
M. François Commeinhes. – Je vais vous donner l’exemple d’un impact du réchauffement climatique : dans notre région, on commence à voir des perroquets ou des espèces de grosses perruches comme il s’en trouve dans les arbres des ramblas à Barcelone. Ces bestioles-là peuvent être transporteuses de tiques, de moustiques ou de parasites.
M. Patrick Abate, sénateur, membre de l’OPECST. – Je ne veux pas apparaître trop pessimiste mais on fait référence à la démoustication et aux opérations effectuées, il y a une cinquantaine ou une soixantaine d’années, à des endroits bien précis pour développer le tourisme puisqu’il était absolument impossible d’imaginer ce développement sans démoustiquer. Mais si l’on se démunit de toute possibilité d’intervention, à un moment donné, c’est nous qui allons mourir.
Mais, en même temps, on est bien conscient, si j’ai bien compris, que l’on n’est plus du tout en face du même phénomène consistant à combattre les moustiques, qui seraient les dominants dans un endroit donné, pour que l’homme puisse s’y installer. Aujourd’hui, les choses ont changé et, du fait de la mondialisation des échanges et des hommes, nous sommes dans une situation où les moustiques viennent ici. Dans ces conditions, il faudrait épandre des insecticides à chaque vol d’avion, à chaque transport de marchandises par bateau. Il faudra sûrement avoir l’intelligence collective d’aborder ce problème autrement qu’avec les méthodes et les outils que l’on a connus dans le passé. Le parallèle ne peut pas tout à fait être établi entre la démoustication d’il y a cinquante ans et la situation d’aujourd’hui.
M. François Commeinhes. – La différence avec la situation d’il y a cinquante ans c’est que, à l’époque, il n’y avait pas de transmission, pas de problèmes sanitaires. Il y avait des moustiques qui piquaient, un point c’est tout. Il n’y avait pas de cas de dengue, de chikungunya, de syndrome de Guillain-Barré, de Zika alors que, actuellement, ce sont des pathologies que l’on voit chez nous régulièrement, qui ont été transmises localement et non contractées dans des pays d’outre-mer. Il s’agit d’un problème sanitaire. Et l’on commence à être confronté, dans les services hospitaliers universitaires, à des hospitalisations de plus en plus fréquentes. Il faut donc revoir l’approche du problème : avant, il s’agissait d’une question de confort et, maintenant, il s’agit d’une question sanitaire. Il importe de mesurer les avantages et les risques pour chaque département.
Mme Dominique Gillot, sénatrice, membre de l’OPECST. – Pourquoi, il y a cinquante ans, les moustiques n’étaient-ils perçus que comme désagréables et non comme vecteurs de maladie ? N’est-ce pas parce que, à cette époque, l’épidémiologie ne permettait pas de dépister les maladies dont ils étaient les vecteurs ? De nos jours, avec la mobilité des populations et celle des animaux, des moustiques nouveaux sont arrivés et vous disiez que, avec la déforestation, il y a aussi d’autres vecteurs qui peuvent intervenir.
Je voudrais vous citer les travaux qui ont été menés au Sénat dans le cadre de la délégation à la prospective sur les maladies infectieuses émergentes liées justement, dans les pays du Sud, à la déforestation. Les conclusions des scientifiques à cet égard étaient très inquiétantes. Non seulement les virus ne sont plus cantonnés dans les forêts mais ils entrent en contact avec les populations locales ; ces populations se déplaçant, des vecteurs peuvent amener ces virus chez nous. Il y a donc une stratégie de prévention, d’information et de traitement des maladies liées à ces bactéries ou ces virus qui est à l’étude aujourd’hui ; c’est vraiment quelque chose de très sérieux.
M. Bruno Sido. – Je l’ai lu mais ne l’ai pas vérifié, pardonnez-moi. Mais en 1939-1940, il y a eu une épidémie de malaria à Paris. Pourquoi ? Déjà, tout simplement parce qu’il avait peut-être fait plutôt chaud mais, surtout, du fait d’un brassage de populations et de soldats impaludés qui étaient arrivés à Paris. Le problème est que, avec le brassage actuel des populations, les maladies vont partout, et singulièrement dans le Sud de la France.
M. Gilbert Barbier, sénateur, membre de l’OPECST. – Au-delà de la gêne que le fait d’être piqué par les moustiques peut représenter, notamment pour les touristes, connaît-on le nombre de cas de maladies recensés dans le Sud de la France ? Existe-t-il un recensement dans l’étude qui nous est présentée du nombre de cas de syndrome de Guillain-Barré, de dengue ou autre dans les hôpitaux ?
M. François Commeinhes. – Les services hospitaliers disent qu’il y a une recrudescence du syndrome de Guillain-Barré. Pour les cas de dengue, je crois que, au CHU de Montpellier, par exemple, il y a une soixantaine de cas par an alors que, avant, il n’y en avait jamais.
M. Jean-Yves Le Déaut. – Merci à tous pour ces réflexions, je voudrais juste ajouter deux mots. Premièrement, le nombre d’interventions montre bien que ce sujet intéresse car presque tous les collègues présents ont pris la parole.
Deuxièmement, la mondialisation des échanges et des hommes entraîne une mondialisation des moustiques. Des espèces, qui n’étaient pas présentes à un moment donné, peuvent s’implanter en venant d’autres parties du monde. C’était le cas, sans doute, pendant la guerre, quand il y avait un brassage des populations, et c’est encore plus le cas aujourd’hui. De plus, comme les températures sont un petit peu plus élevées, moins de moustiques, moins de larves meurent en hiver et, donc, ces larves se maintiennent sur le territoire en des lieux où ces moustiques ne proliféraient pas antérieurement.
En cet instant, j’ai envie d’émettre une proposition, une sorte de testament, dans la mesure où notre collègue François Commeinhes n’a pas envisagé de conduire une étude au-delà de l’audition publique du 7 avril 2016. Cette audition a été très intéressante ; elle a permis de faire le point sur la situation mais a montré que beaucoup de questions restent pendantes. Ainsi que le préconisait tout à l’heure notre premier vice-président, Bruno Sido, je pense qu’il serait intéressant d’approfondir ces questions.
Comme une étude dure au moins une année, l’année prochaine ce ne seront plus les mêmes membres de l’Office qui seront autour de cette table. Mon testament consisterait à dire que ce sujet mérite quand même une étude plus poussée sur plusieurs points, dont ceux-ci : de quels moyens de lutte disposons-nous contre les maladies transmises par les moustiques ? Il existe déjà nombre de moyens de lutte mécanique mis en place avec le drainage, l’assainissement, le curage des rivières, des mares ou le recours à des moustiquaires.
Mais on a vu que les moustiques s’adaptent, aujourd’hui, aux produits qui imprègnent les moustiquaires et piquent plus tôt dans la journée. Ce qui veut dire que le moustique, au lieu de commencer à piquer vers vingt-et-une heures, pique maintenant dès dix-sept heures, lorsque vous n’êtes pas sous la moustiquaire. Par ailleurs, il faudrait être capable de mesurer les résistances aux moyens insecticides.
Les autres stratégies sont des moyens de lutte biologique, soit avec des agents pathogènes et des bactéries, et notamment celles du groupe des Wolbachia qui vont attaquer les moustiques.
En outre, il existe tous les moyens des biotechnologies. Avec Mme Catherine Procaccia, nous sommes allés aux États-Unis, à San Diego, dans un laboratoire qui travaille sur ce sujet (Gendrive) et qui a été capable d’introduire un gène de stérilité chez un moustique ou encore un autre gène qui peut, par exemple, empêcher, à un moment donné, un antibiotique d’agir ou, au contraire, le rendre efficace. Toutes sortes de gènes sont utiles dans cette lutte. Grâce au forçage de gène, pour le mettre sur les deux éléments de la paire de chromosomes d’un moustique initial, de façon qu’il soit transmis à la génération suivante, il devient possible que le gène d’intérêt aille automatiquement, par un système de copie, se mettre sur l’autre chromosome. Ce qui signifie que les moustiques vont transmettre une information donnée, qui peut être une information de stérilité, ou une information qui permet de lutter contre certaines maladies.
C’est déjà mis au point et cela pose beaucoup de problèmes. En effet, peut-on se permettre d’éteindre complètement des espèces au nom de la santé humaine ? Sans pouvoir répondre, aujourd’hui, à ce type de questions évoquées par le Président Sido, je pense qu’il serait possible de proposer, en félicitant d’abord les sénateurs Roland Courteau et François Commeinhes qui ont animé les tables rondes de l’audition publique, qu’une étude plus complète de toutes ces questions puisse constituer un futur sujet d’étude de l’Office après le renouvellement de ses membres l’an prochain.
Je mets donc aux voix les conclusions de l’audition publique du 7 avril 2016. Elles sont adoptées à l’unanimité.
I. PROGRAMME DE L’AUDITION PUBLIQUE




1. Pr François Rodhain, professeur honoraire, Institut Pasteur




2. Pr Martin Danis, professeur émérite de parasitologie, Université Pierre-et-Marie-Curie-Paris 6, membre de l’Académie nationale de médecine





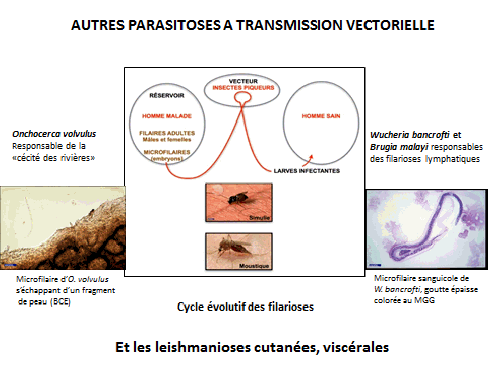
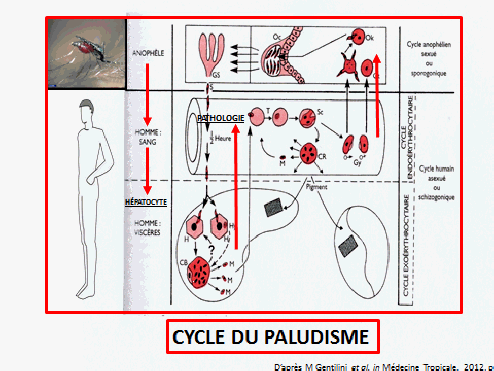
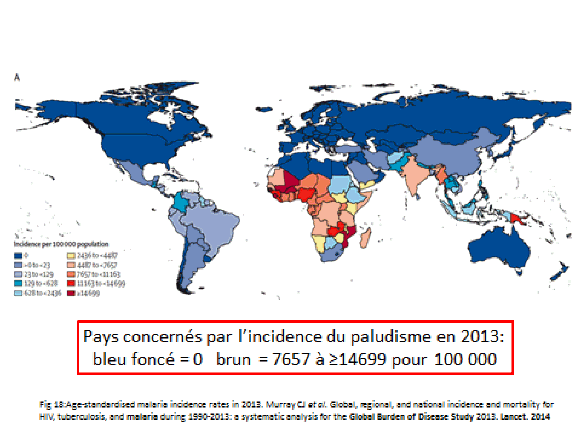


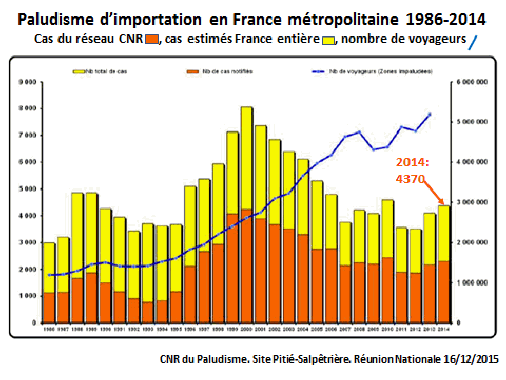
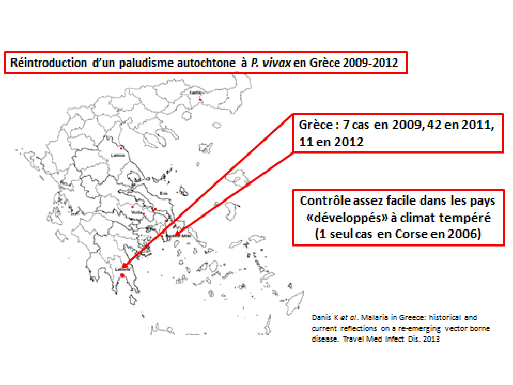



3. Mme Anna-Bella Failloux, directrice de recherche, Unité arbovirus et insectes vecteurs, Institut Pasteur

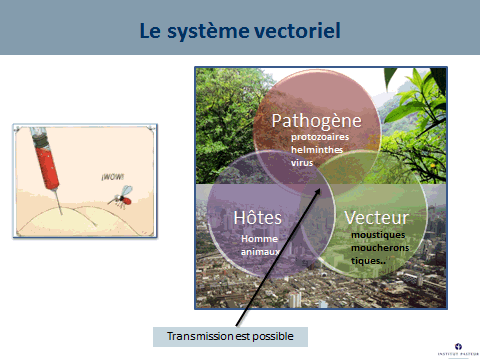
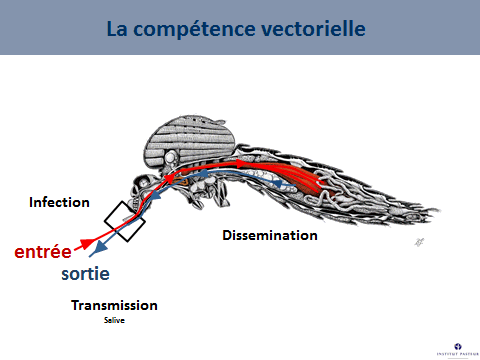
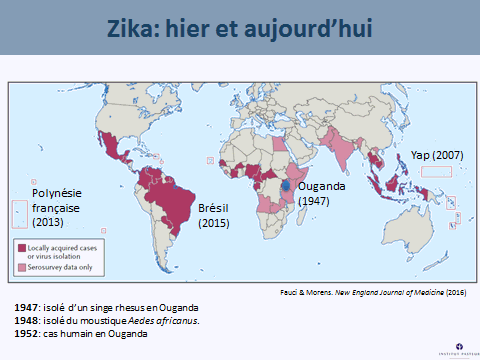
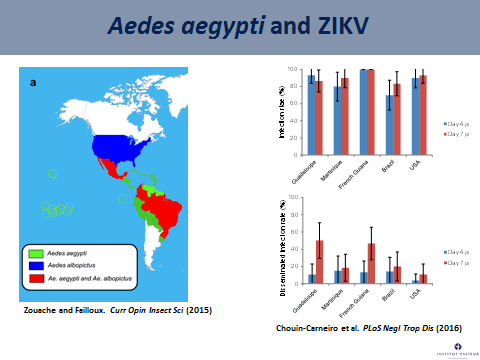
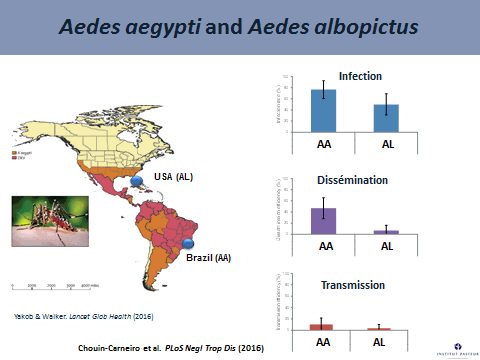
4. M. Frédéric Jourdain, ingénieur du génie sanitaire, Centre national d’expertise sur les vecteurs (CNEV)


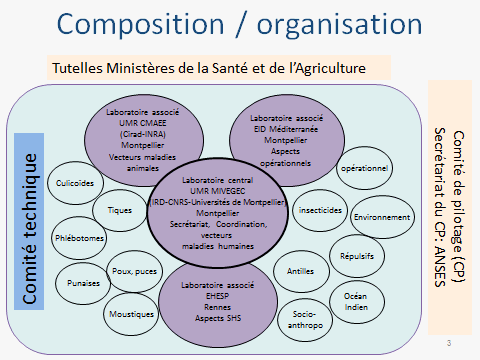




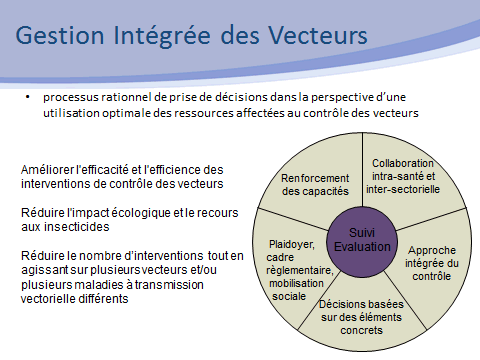

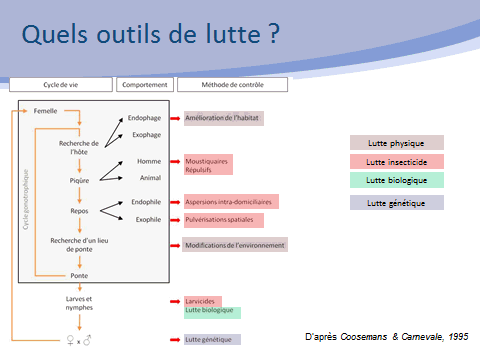






5. M. Christophe Paupy, chargé de recherche, Institut de recherche pour le développement (IRD)



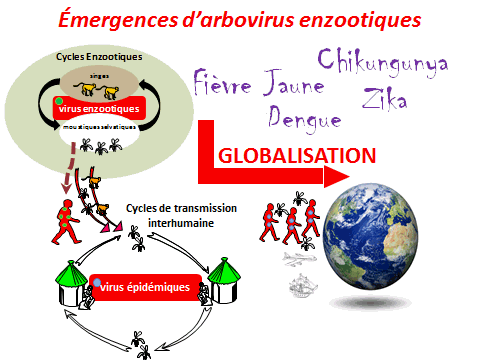
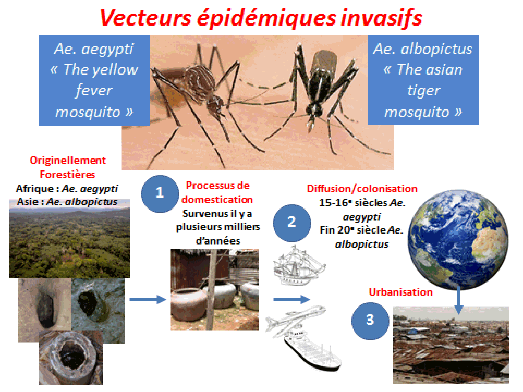

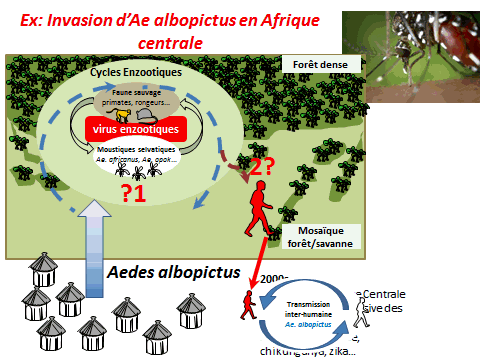

6. Mme Marie-Claire Paty, coordinatrice de la surveillance
des maladies à transmission vectorielle, Institut national de veille sanitaire (InVS)







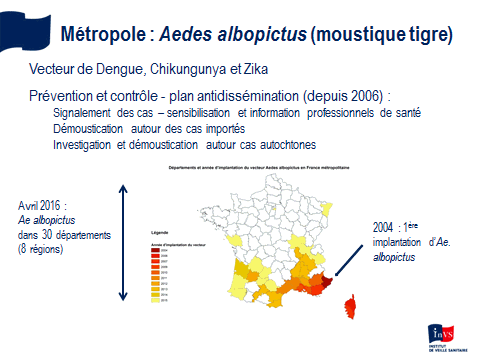
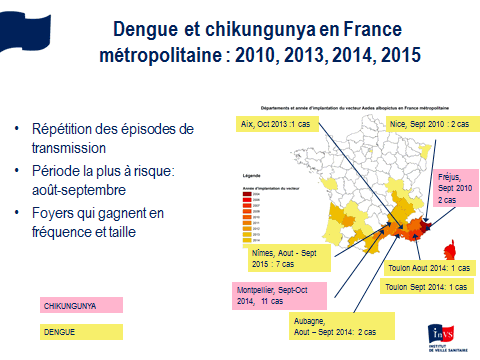
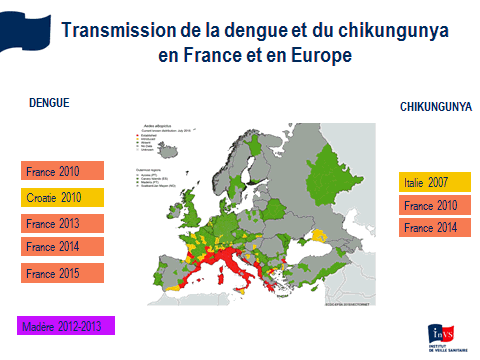
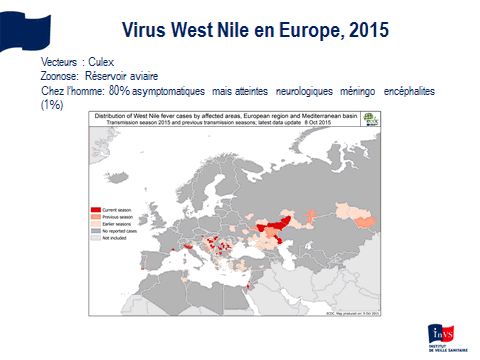
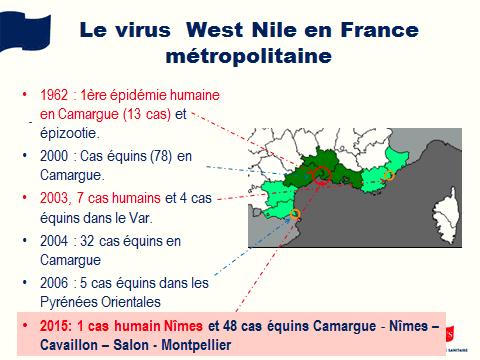

7. Pr Arnaud Fontanet, directeur, Unité d’épidémiologie des maladies émergentes, Institut Pasteur

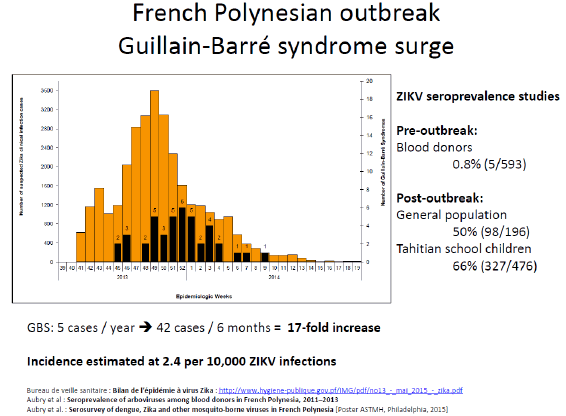
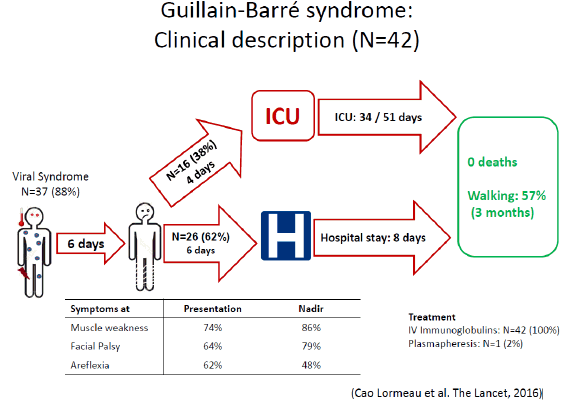
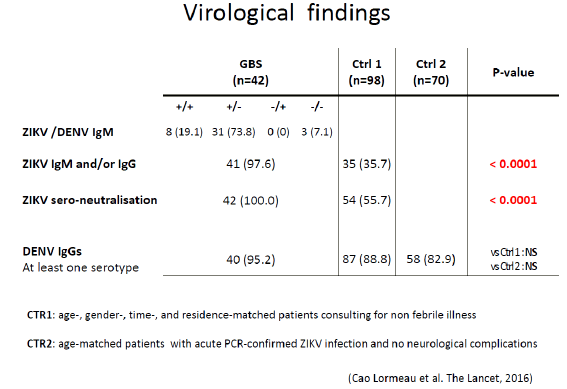



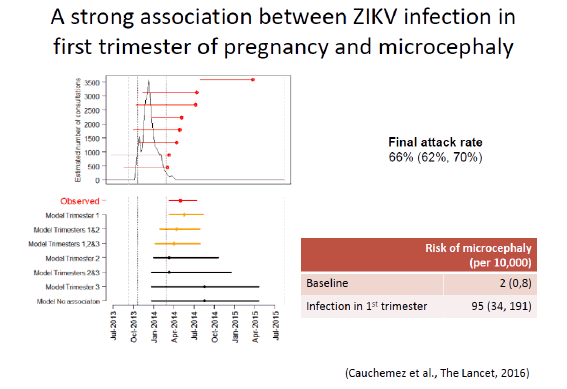

8. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier

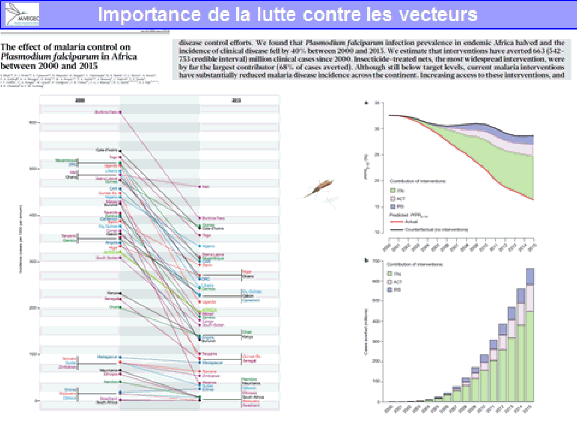
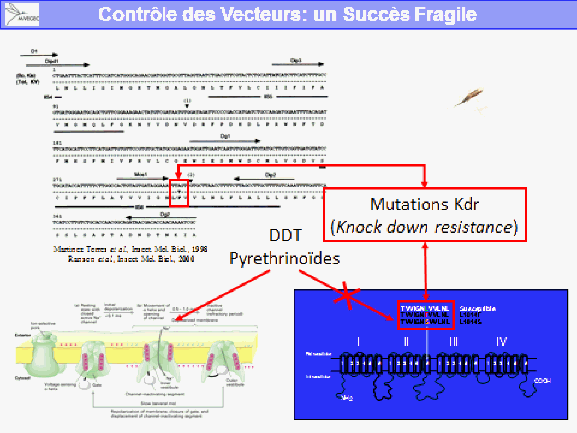
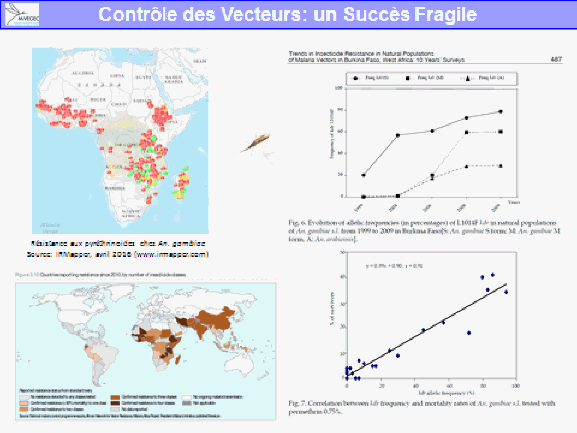
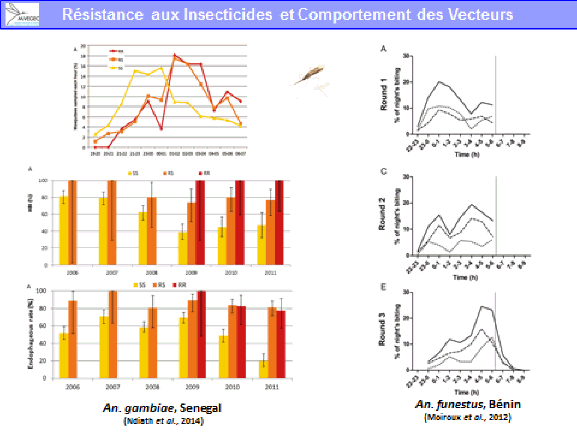
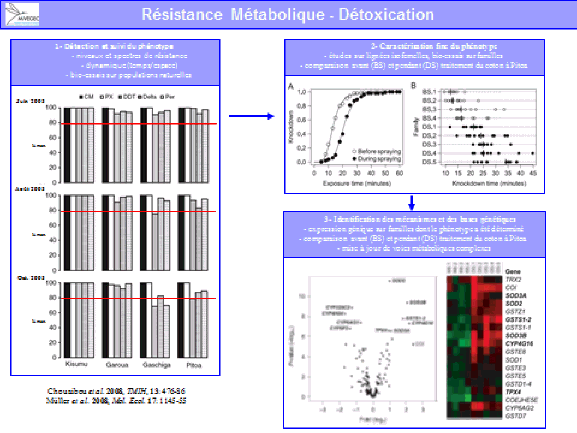
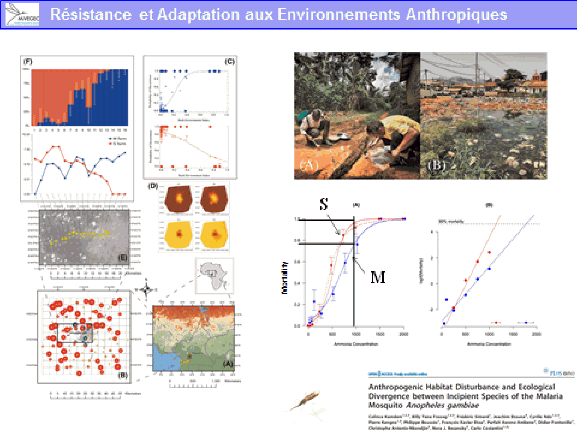
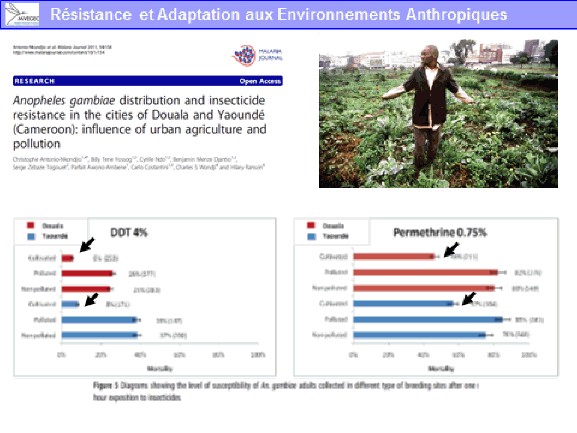



9. M. Christophe Lagneau, directeur recherche et développement, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée)


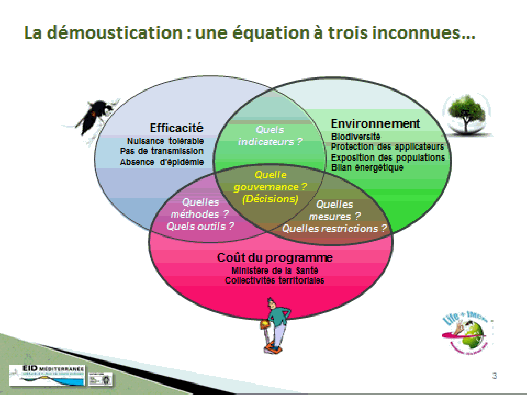
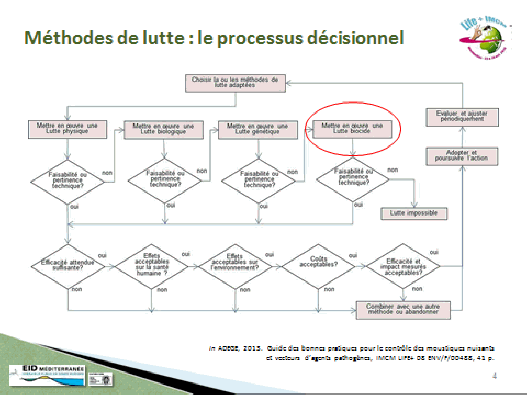

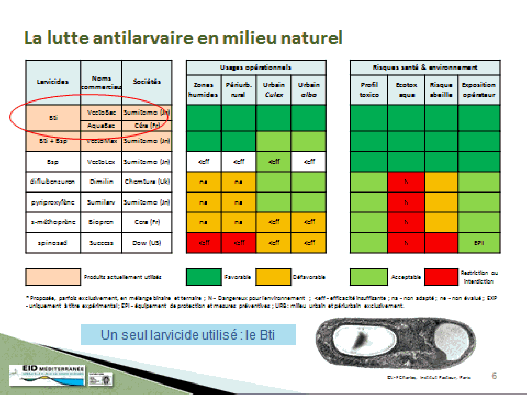
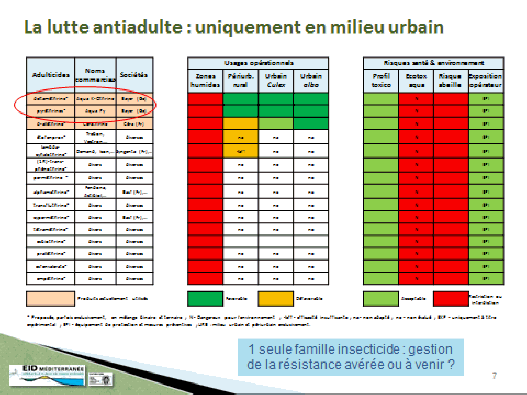
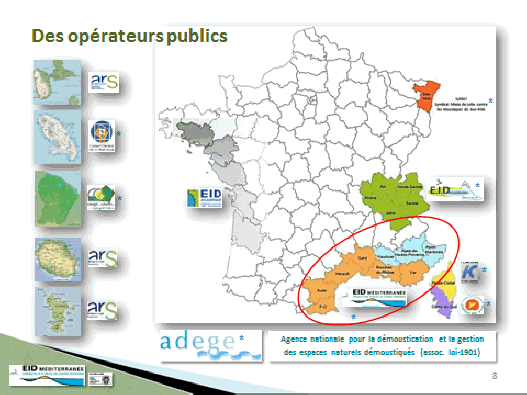









10. Pr Jérôme Depaquit, directeur, Unité de recherche transmission vectorielle et épidémiosurveillance de maladies parasitaires, Université de Reims Champagne-Ardenne



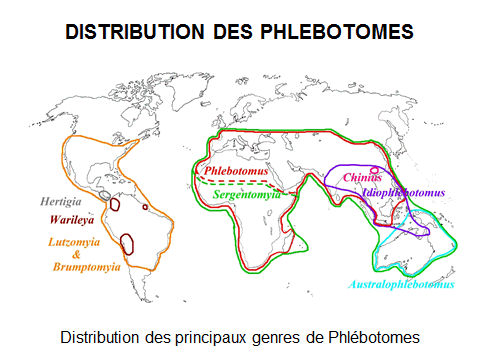
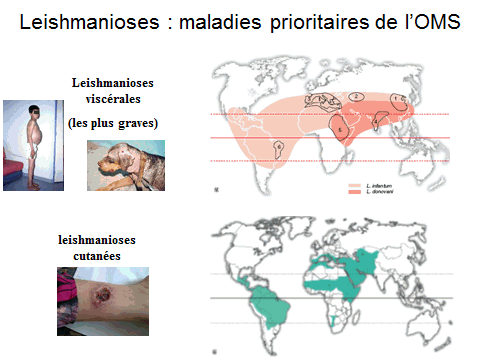

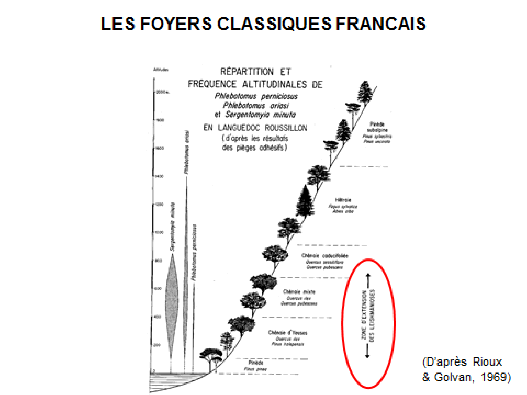
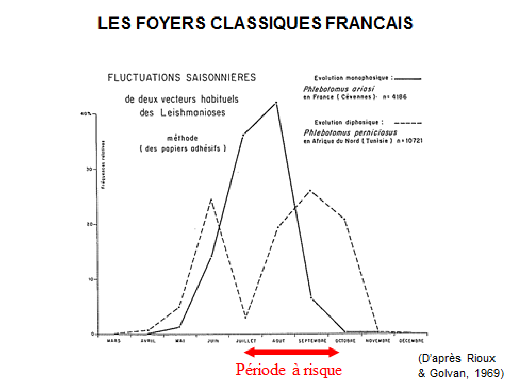
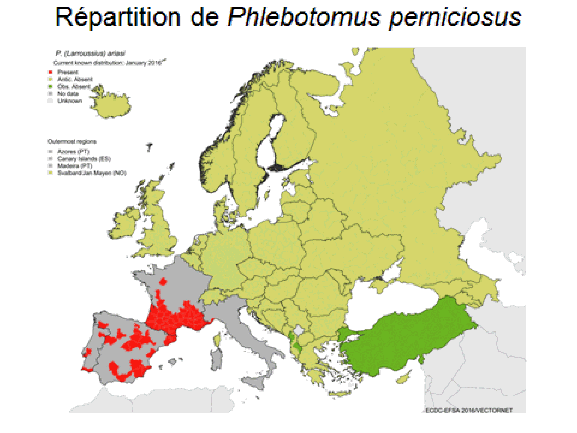
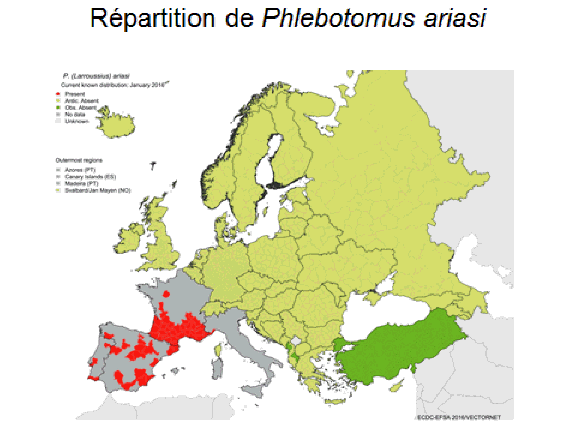
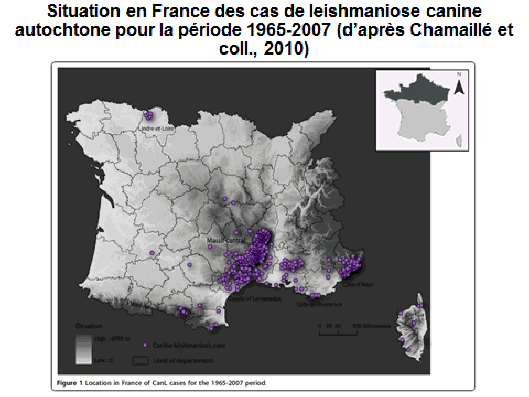
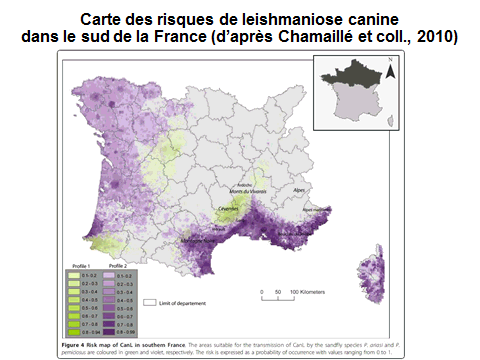


11. Mme Nathalie Boulanger, maître de conférences et praticien attaché au Centre national de référence sur la borréliose de Lyme, Université de Strasbourg, Centre hospitalier de Strasbourg


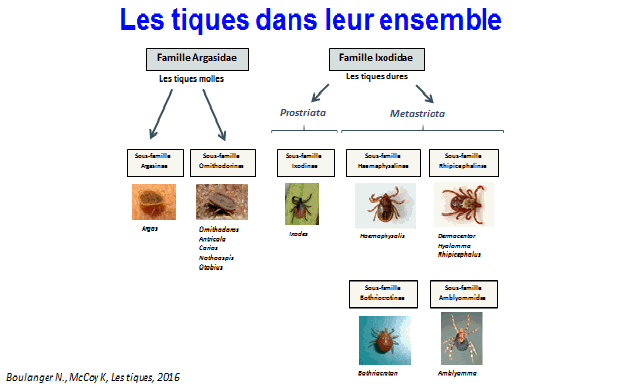
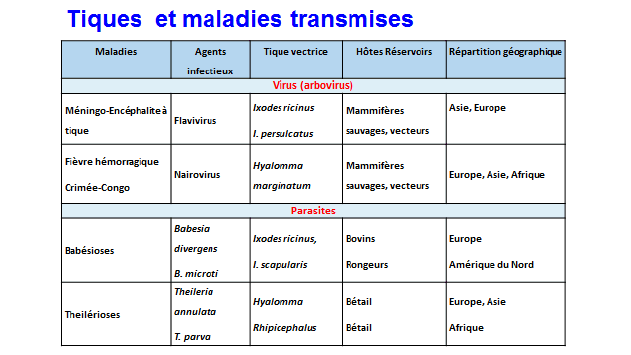
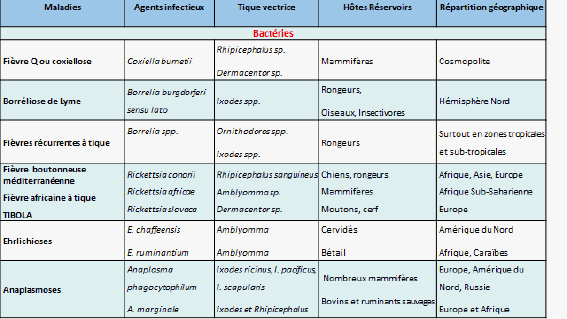
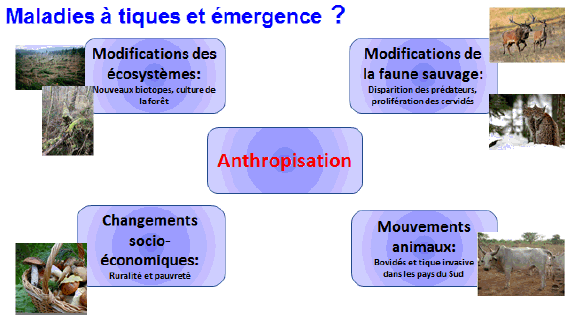
12. Mme Véronique Chevalier, directrice adjointe, Unité de recherche animal et gestion intégrée des risques (AGIRs), Centre de coopération international en recherche agronomique pour le développement (CIRAD)

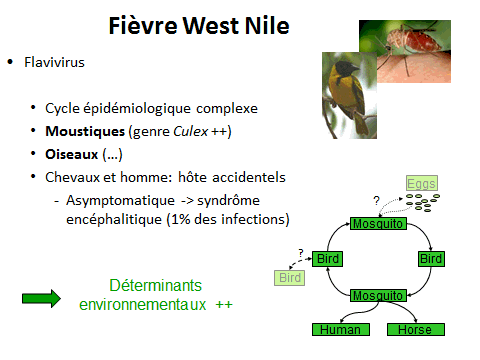
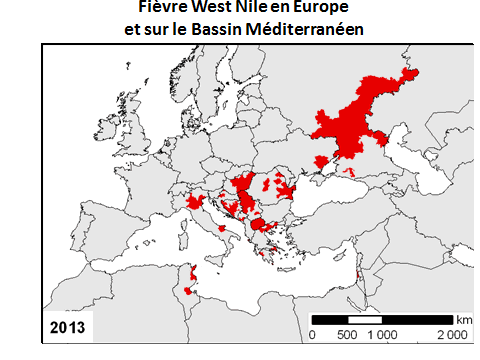


13. M. Jean-Claude Manuguerra, directeur, Cellule d’intervention biologique d’urgence (CIBU), Institut Pasteur/OMS


14. M. Frédéric Simard, directeur, Unité mixte de recherche maladies infectieuses et vecteurs : écologie, génétique, évolution et contrôle (MIVEGEC), IRD/CNRS/Université de Montpellier


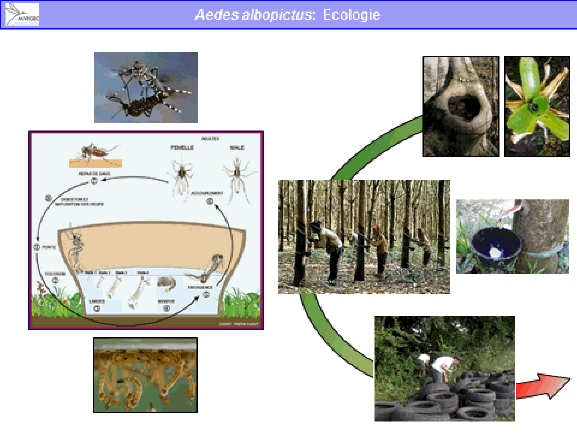


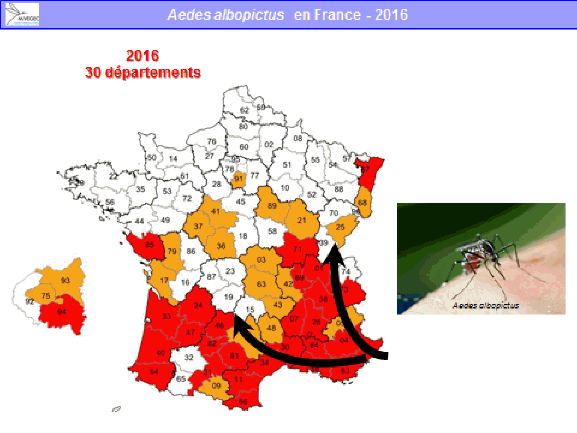
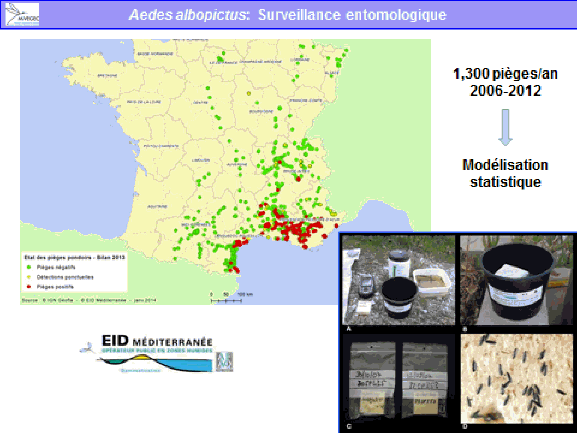

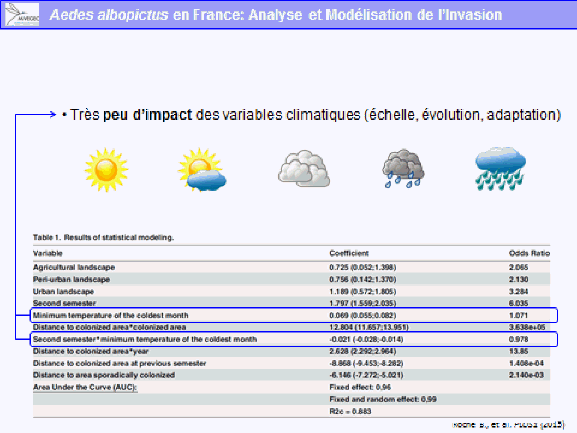
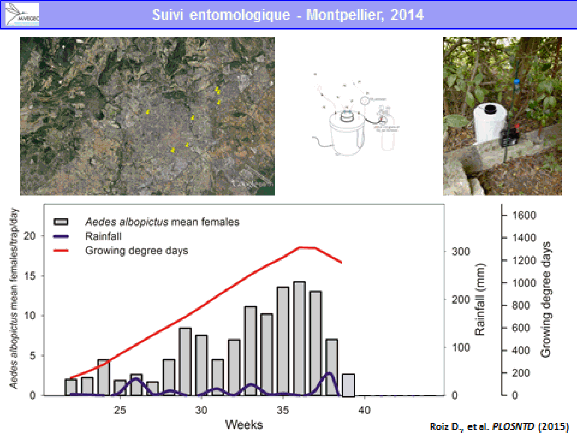
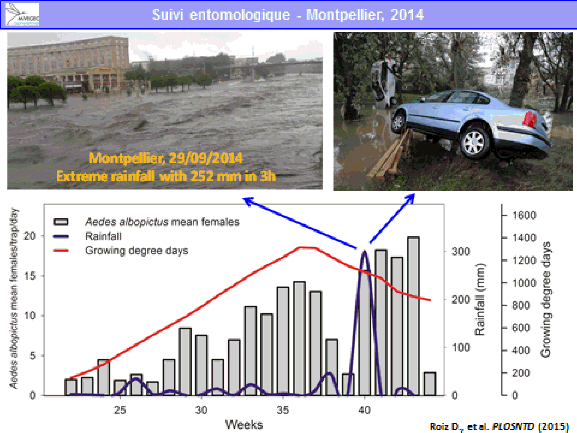
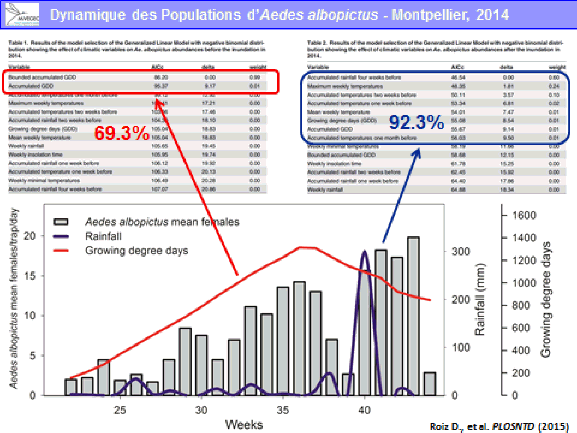

15. Pr Yazdan Yazdanpanah, chef de service des maladies infectieuses et tropicales, professeur d’université et chercheur, Hôpital Bichat-Claude-Bernard, Université Paris-Diderot, INSERM






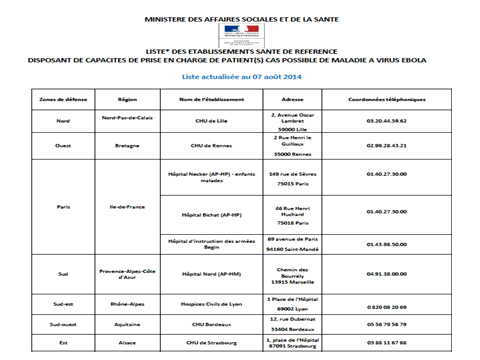
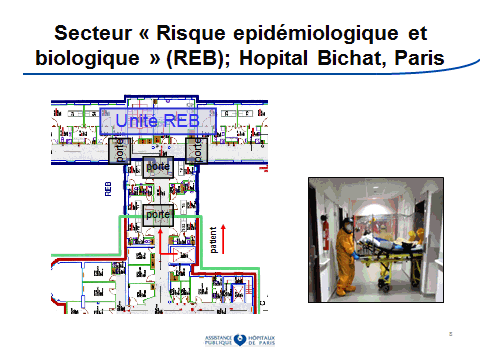
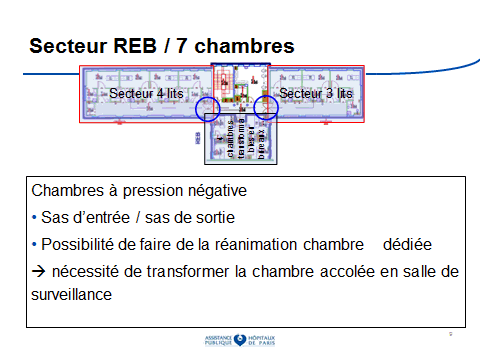



16. Mme Isabelle Leparc-Goffart, responsable du Centre national de référence des arbovirus, Institut de recherche biomédicale des armées (IRBA)



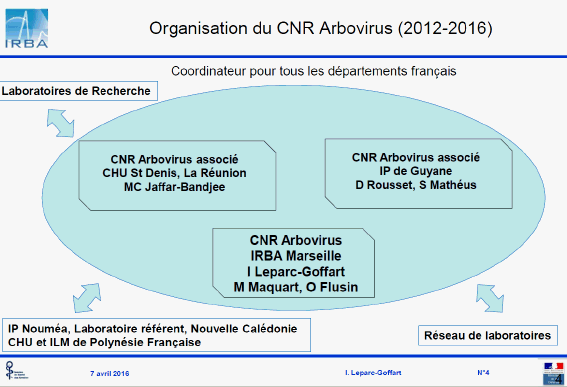



17. Dr Vincent Feuillie, responsable du Service médecine passagers, Air France




18. M. Jean-Louis Gély, directeur de la communication
et des relations extérieures, Entente interdépartementale pour la démoustication du littoral méditerranéen (EID Méditerranée)






























© Assemblée nationale