


TREIZIÈME LÉGISLATURE
Enregistré à la Présidence de l'Assemblée nationale le 13 janvier 2009.
RAPPORT
FAIT
AU NOM DE LA COMMISSION DES AFFAIRES CULTURELLES, FAMILIALES ET SOCIALES SUR LA PROPOSITION DE LOI (n° 1372) de M. Olivier JARDÉ relative aux recherches sur la personne,
PAR M. Olivier JardÉ,
Député.
——
INTRODUCTION 5
I.- LES RECHERCHES SUR LA PERSONNE : UN CADRE JURIDIQUE À LA FOIS COMPLEXE ET INCOMPLET 7
A. UN CADRE JURIDIQUE MIS EN PLACE PAR TOUCHES SUCCESSIVES 7
1. La loi « Huriet-Sérusclat » de 1988, première pierre de l’édifice législatif 7
2. De nombreuses modifications au cours de la dernière décennie 8
B. UN DISPOSITIF COMPLEXE ET INCOMPLET 9
1. Des procédures longues et complexes 9
2. Des recherches observationnelles conduites dans un vide juridique 10
II.- LE DISPOSITIF PROPOSÉ 11
A. UN CADRE UNIQUE POUR L’ENSEMBLE DES RECHERCHES SUR LA PERSONNE 11
1. Une loi consacrée uniquement à la recherche sur la personne 11
2. Un droit commun de la recherche sur la personne 12
B. TROIS CATÉGORIES DE RECHERCHES EN FONCTION DES RISQUES ENCOURUS 13
1. Les recherches interventionnelles 13
2. Les recherches comportant un risque négligeable 13
3. L’encadrement nouveau des recherches non interventionnelles 14
C. UNE SIMPLIFICATION DES PROCÉDURES 14
1. La clarification du régime des collections biologiques 14
2. La simplification des procédures de déclaration 15
Article 1er : Création de trois catégories de recherches sur la personne dans un cadre législatif unique 21
Article 2 : Définition des recherches interventionnelles à finalité non commerciale 33
Article 3 : Simplification et mise en cohérence du régime d’autorisation et de déclaration des recherches utilisant des collections d’échantillons biologiques humains 34
Article 4 : Statut juridique et conditions de retrait d’agrément des comités de protection des personnes 36
TEXTE ADOPTÉ PAR LA COMMISSION 39
ANNEXE 1 : Schémas simplifiés du déroulement des recherches sur les personnes 53
ANNEXE 2 : Liste des personnes auditionnées par le rapporteur (par ordre chronologique) 57
Cette proposition de loi a pour objectifs de moderniser et de simplifier le cadre juridique des recherches sur la personne, à la fois complexe et incomplet, afin d’encourager la recherche dans ce domaine.
On distingue actuellement trois types de recherches :
– les recherches biomédicales, correspondant à l’ancien cadre de la loi n° 88-1138 du 20 décembre 1988, dite loi « Huriet-Sérusclat » ;
– les recherches « visant à évaluer les soins courants », issues de la loi n° 2004-806 du 9 août 2004 de santé publique ;
– les recherches non interventionnelles ou observationnelles, introduites par cette même loi.
Si les recherches biomédicales font l’objet d’un encadrement législatif très complet puisque l’intégralité du titre II du livre Ier de la première partie du code de la santé publique, leur est consacrée, les recherches « visant à évaluer les soins courants » et les recherches non interventionnelles ne sont décrites que de manière incidente dans ce titre II et sont en grande partie exclues de la réglementation des recherches biomédicales. Loin de faciliter leur bon déroulement, cette exclusion du champ de la réglementation handicape le développement de ces deux catégories de recherche, en particulier des recherches non interventionnelles, pourtant complémentaires des recherches biomédicales.
La proposition de loi crée en conséquence une catégorie unique de recherches sur la personne, assortie de règles communes. La création d’un droit commun de la recherche sur la personne est un signal fort puisqu’elle reconnaît l’intérêt scientifique commun de ces catégories de recherche et fonde leur distinction par rapport aux autres types de recherche sur leur sujet d’étude, l’homme, considéré dans son intégralité.
Visant à encourager la recherche sur l’homme, la proposition de loi accroît également la protection dont celui-ci bénéficie en l’associant plus étroitement au processus de recherche. Les règles d’information et de recueil de consentement ou d’opposition seront précisées pour chaque type de recherche et toutes les recherches devront recevoir l’autorisation préalable d’un comité de protection des personnes.
Le texte propose ensuite de définir les catégories de recherches sur la personne en fonction des risques encourus par les personnes qui s’y prêtent et fait bénéficier chacune d’un encadrement détaillé, gradué en fonction de ces risques.
Enfin, la proposition de loi simplifie un certain nombre de démarches afin d’encourager et de sécuriser la recherche.
Cette proposition de loi constitue le premier texte intégralement consacré à la recherche sur la personne. Elle signifie par là la volonté de mettre en cohérence le grand nombre de dispositions législatives votées au cours de ces dernières années, au détour de lois sur la santé publique, la recherche ou la bioéthique afin de placer cette recherche au cœur des priorités nationales. Elle constitue en outre l’aboutissement de réflexions entamées par le rapporteur, qui avait consacré son avis budgétaire 2008 à la recherche biomédicale et évoqué déjà, à cette occasion, l’opportunité de mettre en place un dispositif unique, « éclaté en trois branches pour les essais interventionnels, faiblement interventionnels et non interventionnels » (1).
I.- LES RECHERCHES SUR LA PERSONNE : UN CADRE JURIDIQUE À LA FOIS COMPLEXE ET INCOMPLET
Au lendemain de la Seconde Guerre mondiale, les abus perpétrés en matière de recherche sur l’homme ont conduit la communauté scientifique à prendre position pour qu’une telle barbarie ne puisse se reproduire. Le tribunal de Nuremberg, les 19 et 20 août 1947, en énonçant en préliminaire de sa sentence dix principes fondamentaux sur les conditions de l’expérimentation médicale, parmi lesquels l’exigence du consentement volontaire des sujets d’expérience, fonda un cadre de référence international. En découlèrent plusieurs textes, adoptés par l’Association médicale mondiale créée la même année : le Serment de Genève en septembre 1948, le Code international d’éthique médical en octobre 1949 et la Déclaration d’Helsinki en 1964.
En France, avant 1988, les investigateurs de recherches biomédicales, considérées comme portant atteinte à l’intégrité de la personne humaine sans intention thérapeutique, étaient susceptibles d’encourir des poursuites pénales (2). Pourtant, l’étude de traitements à des fins de santé publique était reconnue par ailleurs comme étant indispensable au progrès médical. En 1984, le Comité consultatif national d’éthique (CCNE), créé par un décret du 23 février 1983, se prononce sur cette contradiction, dans son avis sur les essais de nouveaux traitements chez l’homme : il reconnaît leur nécessité mais recommande un strict encadrement.
La loi n° 88-1138 du 20 décembre 1988 relative à la protection des personnes qui se prêtent à des recherches biomédicales, dite loi « Huriet-Sérusclat », vient ainsi combler le vide juridique concernant l’expérimentation de médicaments sur l’être humain. La motivation de la loi était triple, comme l’exprimait le sénateur M. Claude Huriet lors de sa présentation devant la commission des affaires sociales du Sénat : « Il s’agit de mettre fin à une situation juridique paradoxale, qui, en France, n’assure pas la protection de l’individu, place le médecin dans une situation illégale et qui, plus particulièrement, porte préjudice à l’industrie pharmaceutique ».
La loi de 1988 affirme la légalité de la recherche, en organisant le dispositif d’encadrement à partir de trois principes généraux : « Aucune recherche ne peut être effectuée sur l’être humain :
– si elle ne se fonde pas sur le dernier état des connaissances scientifiques et sur une expérimentation préclinique suffisante ;
– si le risque prévisible encouru par les personnes qui se prêtent à la recherche est hors de proportion avec le bénéfice escompté pour ces personnes ou l’intérêt de cette recherche ;
– si elle ne vise pas à étendre la connaissance scientifique de l’être humain et les moyens susceptibles d’améliorer sa condition ». Elle établit en outre une distinction entre les recherches avec ou les recherches sans bénéfice individuel direct (ABID / SBID).
Elle vise également à garantir la protection des personnes, en définissant les conditions de leur participation aux recherches, en instaurant un régime déclaratif donnant la possibilité aux autorités compétentes de suspendre des projets jugés non conformes, et en créant les comités consultatifs de protection des personnes en matière de recherche biomédicale (CCPPRB), qui rendent des avis sur les conditions de validité de la recherche.
Ce double impératif – encadrer la recherche et protéger les personnes qui s’y prêtent – constitue le socle du droit français en matière de recherches sur l’être humain.
2. De nombreuses modifications au cours de la dernière décennie
Depuis les premières modifications de la loi « Huriet-Sérusclat » par la loi n° 90-86 du 23 janvier 1990 et la loi n° 94-630 du 25 juillet 1994, le dispositif légal applicable aux recherches biomédicales a connu plusieurs adaptations récentes.
Tout d’abord, la loi n° 2002-303 du 4 mars 2002 relative aux droits des malades et à la qualité du système de santé, dite loi « Kouchner », a renforcé les règles concernant le recueil du consentement de la personne, ou d’une personne de confiance ou d’un proche lorsque la personne est hors d’état d’exprimer sa volonté.
La loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique a notamment eu pour objet d’assurer la transposition de la directive européenne n° 2001-20-CE du 4 avril 2001 relative au rapprochement des législations applicables aux bonnes pratiques cliniques dans la conduite d’essais de médicaments à usage humain. Elle a introduit plusieurs innovations importantes par rapport au dispositif de la loi de 1988, parmi lesquelles :
– la suppression de la distinction entre recherche avec bénéfice individuel direct et recherche sans bénéfice individuel direct, remplacée par un examen des projets de recherche fondé essentiellement sur l’évaluation du bénéfice escompté pour la personne ou l’intérêt pour la santé publique au regard du risque prévisible encouru ;
– le remplacement du régime de déclaration par un régime d’autorisation préalable par l’autorité compétente (l’Agence française de sécurité sanitaire des produits de santé – AFSSAPS – pour les recherches portant sur les médicaments et certains produits de cosmétique et d’hygiène corporelle, et le ministère chargé de la santé dans les autres cas) ;
– la transformation des CCPPRB en comités de protection des personnes (CPP), à la composition élargie et aux compétences étendues ;
– le renforcement des conditions de participation des personnes vulnérables aux recherches biomédicales de façon à renforcer leur protection ;
– la création d’une procédure spécifique pour les recherches visant à évaluer les soins courants, définies par un décret n° 2006-477 du 26 avril 2006 comme celles « dont l’objectif est d’évaluer des actes, combinaisons d’actes ou stratégies médicales de prévention, de diagnostic ou de traitement qui sont de pratique courante, c’est-à-dire faisant l’objet d’un consensus professionnel, dans le respect de leurs indications ».
La loi n° 2004-801 du 6 août 2004 relative à la bioéthique a mis en place un système de déclaration des collections de produits biologiques au ministère de la recherche et d’avis des CPP sur l’information et le consentement des personnes à l’origine des prélèvements.
La loi n° 2006-450 du 18 avril 2006 de programme sur la recherche a introduit des dispositions portant sur la prise en charge par les caisses d’assurance maladie des médicaments ou produits faisant l’objet d’une recherche biomédicale autorisée.
Enfin, la loi n° 2008-337 du 15 avril 2008 ratifiant l'ordonnance n° 2007-613 du 26 avril 2007 portant diverses dispositions d'adaptation au droit communautaire dans le domaine du médicament a fait de l’AFSSAPS la seule autorité compétente en matière de recherche biomédicale, les compétences jusqu’ici exercées par le ministère de la santé dans ce domaine lui étant transférées.
B. UN DISPOSITIF COMPLEXE ET INCOMPLET
Cette succession de textes a modifié par touches successives le droit applicable aux recherches sur l’être humain mais, faute de coordination entre certains et à défaut de vision d’ensemble, le dispositif est à la fois complexe et incomplet.
La communauté scientifique partage unanimement le constat d’une extrême complexité de la réglementation sur la recherche sur la personne. La lenteur des circuits administratifs, la multiplicité des guichets d’autorisation ou d’enregistrement constituent autant d’obstacles et de verrous pour la recherche clinique.
À titre d’exemple, un projet de recherche observationnelle simple, sans risque pour la personne qui s’y prête, tel le suivi d’une cohorte assortie de la constitution de collection d’échantillons biologiques humains, exige aujourd’hui le passage devant pas moins de cinq guichets : le Comité consultatif sur le traitement de l’information en matière de recherche dans le domaine de la santé (CCTIRS), la Commission nationale de l’informatique et des libertés (CNIL), le ministère chargé de la recherche, l’Agence régionale d’hospitalisation (ARH) et un comité de protection des personnes (CPP).
La direction de la recherche clinique de l’AP-HP, qui gère plus de 600 projets de recherche « académique » (c’est-à-dire non promus par l’industrie pharmaceutique) a ainsi des délais d’instruction des projets de recherche qui dépassent couramment les deux ans.
L’exemple des collections d’échantillons biologiques humains illustre également parfaitement cette complexité de la réglementation. Le régime issu des lois de santé publique et de bioéthique de 2004 s’avère en effet difficile à mettre en œuvre car, mal coordonné, il exige d’effectuer deux démarches en parallèle : l’une pour lancer la recherche, l’autre pour constituer la collection de produits biologiques. Le régime de constitution des collections de produits biologiques étant en outre lui-même particulièrement complexe, beaucoup de projets de recherche ne démarrent jamais. Si un seul circuit a été prévu pour les recherches biomédicales, les recherches visant à évaluer les soins courants et les recherches non interventionnelles n’en bénéficient pas, ce qui les oblige à passer devant de nombreux guichets.
Un pan entier de la recherche clinique, la recherche non interventionnelle, ou observationnelle, c’est-à-dire le suivi de cohortes de patients, qui a connu un développement considérable ces dernières années, n’a aujourd’hui aucun cadre législatif.
Loin de faciliter ce type de recherches, ce vide juridique présente au contraire de nombreux inconvénients. En l’absence, par exemple, d’obligation de faire appel à un professionnel de santé, de publication de guide de bonnes pratiques par l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS), ces recherches ne bénéficient pas de garanties de qualité, et donc de fiabilité. L’absence d’autorisation préalable par un comité de protection des personnes ne permet pas de vérifier l’intérêt scientifique de ces recherches et pénalise les chercheurs français qui veulent publier dans des revues scientifiques internationales car celles-ci exigent l’avis d’un comité d’éthique. Le traitement des données s’avère également extrêmement lourd car, dans l’impossibilité de bénéficier des procédures simplifiées mises en place par la CNIL pour les recherches biomédicales, les déclarations doivent se faire au cas par cas, devant le CCTIRS puis devant la CNIL. Enfin, on peut souligner que ces recherches souffrent d’un important manque de visibilité puisque aucun répertoire national les concernant n’a été mis en place, ce qui est préjudiciable, en termes de ressources disponibles, tant pour les professionnels de santé que pour l’information du grand public.
La proposition de loi a pour ambition de donner un cadre unique à l’ensemble des recherches sur la personne en créant un « socle commun » à toutes ces recherches. À l’intérieur de ce cadre unique, la proposition de loi définit trois types de recherche sur la personne, selon le niveau de risque encouru par les personnes qui s’y prêtent, puis décline, pour chacune de ces catégories, les procédures applicables. Enfin, la proposition de loi simplifie un certain nombre de démarches afin d’encourager et de sécuriser la recherche.
Pour la première fois, la question des recherches sur la personne n’est pas abordée au détour d’un texte sur la santé publique ou à l’occasion de la révision des lois de bioéthique. Le sujet a suffisamment d’importance pour qu’un texte y soit intégralement consacré.
Si la recherche sur la personne est naturellement une question de santé publique, elle ne constitue cependant pas un simple acte de soins : alors que l’utilité de la recherche est collective, celle du soin est individuelle. Depuis la suppression, en 2004, de la distinction entre « recherches avec un bénéfice individuel direct » et « recherches sans bénéfice individuel direct », l’acte de recherche n’est plus suspect s’il poursuit un but autre que le soin du patient qui s’y prête. La recherche sur la personne n’est plus seulement considérée comme visant à limiter au maximum les atteintes au corps mais également comme un moyen de développer les connaissances scientifiques. S’inscrivant dans cette logique, les recherches sur la personne sont définies par la proposition de loi comme les « recherches organisées et pratiquées sur l’être humain en vue du développement des connaissances biologiques ou médicales ».
Ensuite, à la différence des recherches portant sur des éléments du corps humain qui en ont été préalablement détachés, telles que les recherches sur l’embryon, la recherche sur la personne a pour sujet l’être humain dans sa globalité, Comme le souligne Stéphane Brissy (3), « l’élément central de distinction entre les recherches sur la personne et les autres semble se trouver davantage dans l’idée d’implication de la personne. »
Enfin, afin de lui donner une véritable visibilité, la proposition de loi établit le principe selon lequel « le développement de la recherche sur la personne constitue une priorité nationale ». Cette déclaration de principe vise à encourager des campagnes nationales de sensibilisation de la population, comme cela avait été fait dans le domaine de la greffe d’organe après le vote de la loi de bioéthique, qui comportait une affirmation similaire.
La proposition de loi donne un socle commun à l’ensemble des recherches sur la personne. Alors que les recherches biomédicales issues de la loi « Huriet-Sérusclat » se définissaient essentiellement par l’atteinte au corps humain qu’elles occasionnaient, les recherches sur la personne ont pour ambition d’inclure dans leur champ les recherches peu et non interventionnelles, jusqu’ici exclues du régime applicable aux recherches biomédicales. Il s’agit là, d’une part, de signifier clairement que ces activités sont également de la recherche et, d’autre part, que cette recherche se définit avant tout par son sujet d’études, la personne.
Si les recherches peu ou pas interventionnelles ne semblent pas présenter de risque particulier pour la santé, elles n’en mettent pas moins à contribution une personne. Ce n’est donc pas seulement son intégrité corporelle qu’il s’agit de protéger, mais les autres aspects concernés par son inclusion dans un processus de recherche : l’observation des réactions corporelles à un traitement ou à un acte médical suppose, par exemple, une incursion dans la vie privée du patient. Stéphane Brissy met ainsi en avant que « la préservation de l’autonomie de la personne, et par là de sa dignité, suppose qu’elle puisse consentir à la recherche, et non seulement à l’acte de soins ».
C’est pourquoi la proposition de loi modifie les dispositions relatives à l’information et au consentement de la personne engagée dans un processus de recherche. Désormais, les personnes se prêtant à des recherches, quel que soit le type de recherche, devront recevoir une information minimale sur « l’objectif, la méthodologie et la durée de la recherche » et « les bénéfices attendus ». Il s’agit là d’une grande nouveauté pour les recherches non interventionnelles pour lesquelles aucune mesure d’information n’était jusqu’à présent prévue par les textes. De même que l’autonomie du patient tend à se développer dans la relation de soins, celle de la personne se prêtant à une recherche doit aussi être préservée, en l’associant au processus.
Deuxième élément constitutif de ce socle commun des recherches sur la personne, l’autorisation préalable d’un comité de protection des personnes avant le lancement de toute recherche sera désormais requise. L’intérêt du passage devant le comité de protection des personnes est de s’assurer que les risques que la recherche présente pour la santé des personnes impliquées se justifient au regard de l’utilité scientifique souhaitée. La recherche se distingue en effet de l’acte de soins par l’objectif qu’elle poursuit, la quête de connaissances scientifiques. Si les recherches peu ou non interventionnelles présentent peu de risques pour la personne qui s’y prête, il convient toutefois de s’assurer de leur intérêt scientifique. Comme l’avait souligné le sénateur Fisher au cours des débats sur la loi du 9 août 2004, une évaluation scientifique identique pour toute recherche permettrait d’éviter qu’une recherche, même non interventionnelle, présente un intérêt scientifique réduit et ne dissimule en réalité des intérêts commerciaux (4).
Par ailleurs, la notion de promoteur, personne qui est responsable de la recherche, est étendue à l’ensemble des recherches sur la personne. Il s’agit là d’identifier clairement les personnes qui entreprennent de telles recherches afin que les responsabilités scientifiques et la conduite de l’étude soient clairement établies.
Enfin, toutes les recherches bénéficieront désormais de la même visibilité à l’égard tant des professionnels de santé que du grand public. La proposition de loi crée en effet un répertoire national des recherches peu ou non interventionnelles. À l’image du Répertoire des essais cliniques de médicament, tenu à jour par l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS), ce répertoire national, accessible à tous, permettra notamment aux praticiens mais aussi aux patients et associations de patients d’être au courant de l’existence des essais menés en France.
Les recherches sur la personne seront désormais distinguées selon un seul critère, celui de l’intervention. C’est la graduation de ces interventions qui distinguera désormais les différentes catégories de recherche.
Les recherches interventionnelles sont ainsi définies par la proposition de loi comme des recherches « comportant une intervention non justifiée par la prise en charge médicale habituelle de la personne ». Cette catégorie de recherche remplace les actuelles recherches biomédicales. Le droit applicable, notamment les règles de consentement (accord écrit) et l’autorisation préalable d’un comité de protection des personnes et de l’autorité compétente, ne change pas.
Les recherches « interventionnelles ne comportant que des risques et des contraintes négligeables et ne portant pas sur des médicaments » se substituent aux actuelles recherches « visant à évaluer les soins courants ». Le champ couvert par cette définition est légèrement plus vaste que l’actuelle puisqu’il fait entrer dans cette catégorie des interventions sans risque : prise de sang ou imagerie non invasive, par exemple. La proposition de loi ne modifie le droit existant que pour accroître la protection des personnes et la sécurité des procédures : information du patient plus complète, consentement libre et éclairé, exigences de compétences de l’équipe de recherche accrues, publication de guides de bonnes pratiques ou encore mise en place d’un répertoire national.
La proposition de loi crée un cadre pour les recherches non interventionnelles, ou observationnelles et il s’agit là d’un de ses apports majeurs, qui va dans le sens souhaité par la communauté scientifique internationale. La Commission européenne a publié, en mars 2007, une ligne directrice dans le domaine des essais non interventionnels, le volume 9 A, qui est une incitation à réglementer ce domaine adressée aux États membres. Plus récemment encore, un groupe d’épidémiologistes a publié des recommandations visant à améliorer la qualité des études épidémiologiques observationnelles (5). En France, les participants (6) à la table ronde n° 5 des rencontres nationales de pharmacologie clinique de Giens XXIII-2007 ont plaidé pour une réglementation de cette catégorie de recherche.
Alors qu’elles n’étaient définies que de manière incidente dans le code de la santé publique, les recherches non interventionnelles bénéficient d’une vraie reconnaissance. Leur déroulement fera désormais l’objet d’un encadrement qui offrira de nombreuses garanties en termes de traçabilité de ces recherches, de droits des participants et de qualité du travail effectué.
Tout d’abord, les participants recevront une information préalable avec la possibilité de s’opposer à la recherche. Ensuite, ces projets de recherche seront soumis à l’autorisation préalable d’un comité de protection des personnes. Ce passage devant un comité de protection des personnes facilitera la publication dans les grandes revues scientifiques internationales. En effet, le comité des éditeurs de journaux médicaux (International Commitee for Medical Journals Editors, ICMJE), qualifié souvent de « groupe de Vancouver », exige un avis éthique pour toute recherche sur l’homme. Enfin, des recommandations de bonne pratique seront publiées par l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) et un répertoire national des recherches effectuées sera mis en place.
La proposition de loi étend à l’ensemble des recherches sur la personne le dispositif actuellement en vigueur pour les recherches biomédicales. Désormais, lorsqu’un projet de recherche utilisera des échantillons biologiques d’origine humaine, la collection sera déclarée au sein du protocole de recherche et sera donc soumise au comité de protection des personnes en même temps que le reste du protocole. Ce n’est qu’à l’issue de la recherche qu’une déclaration d’activité sera effectuée auprès du ministère de la recherche. Elle ne sera accompagnée d’un nouvel avis du comité de protection des personnes que dans le cas où la collection d’échantillons constituée ferait l’objet d’un nouveau projet de recherche, différent de celui pour lequel elle avait été initialement constituée. Il n’y aura donc plus deux démarches distinctes, l’une pour effectuer et déclarer la recherche, l’autre pour constituer la collection biologique.
C’est l’un des autres apports majeurs de la proposition de loi, le cadre législatif et réglementaire commun à l’ensemble des recherches sur la personne devrait permettre aux projets de recherches présentant des risques négligeables et aux recherches non interventionnelles de bénéficier d’une méthodologie de référence de la part de la Commission nationale de l’informatique et des
libertés (CNIL).
La CNIL a en effet homologué une méthodologie de référence (procédure MR 001) pour les traitements de données personnelles mis en œuvre dans le cadre des recherches biomédicales, visant à simplifier les formalités de déclaration. Un seul engagement de conformité, adressé directement à la CNIL par le promoteur est en effet suffisant dès lors que le traitement mis en œuvre est conforme à la méthodologie de référence.
Or pour bénéficier d’une méthodologie de référence, les recherches qui font appel à des traitements automatisés de données indirectement nominatives doivent être conduites dans le cadre d’exigences législatives et réglementaires strictes et selon des méthodologies scientifiques standardisées (article 54 de la loi n° 78-17 du 6 janvier 1978). En donnant un cadre de référence aux recherches comportant des risques négligeables et aux recherches non interventionnelles, la proposition de loi permettra à ces projets de recherche de remplir ces conditions, ce qui simplifiera considérablement toutes leurs démarches administratives.
La Commission des affaires culturelles, familiales et sociales a examiné, sur le rapport de M. Olivier Jardé, la proposition de loi relative aux recherches sur la personne (n° 1372) au cours de sa séance du mardi 13 janvier 2009.
Un débat a suivi l’exposé du rapporteur.
M. Jean-Marie Le Guen. Vous nous plongez dans l’embarras ! Il s’agit d’un texte important, et même très important à la fois pour le droit des personnes et pour la recherche. Il met en jeu la confiance qui doit exister entre la recherche ou le soin médical de très haut niveau et les patients, au moment même où certaines déclarations sur les erreurs médicales sont de nature à inquiéter nos compatriotes. Or nous travaillons de façon pour le moins précipitée. Certes, j’étais au courant de l’existence de cette proposition de loi et, sous réserve d’une relecture approfondie, je la crois utile et bonne. Mais nous n’avons pas eu le temps d’en parler au sein de notre groupe – et le 22, je serai au Haut conseil de l’assurance maladie. Nous n’avons pas non plus organisé d’auditions communes. En outre, cette proposition résulte d’un démembrement de la version initiale du projet de loi « Hôpital, patients, santé et territoires ». Franchement, et sans aucun esprit polémique, cette façon de procéder n’a rien de glorieux, au moment où l’opposition reçoit beaucoup de leçons sur la façon dont il faudrait travailler, et alors qu’il s’agit d’un texte fondamental.
M. Jean-Pierre Door. Je me réjouis que Jean-Marie Le Guen ne soit pas défavorable à un texte dont nous avons besoin depuis les premières lois de bioéthique. L’empilement législatif – loi Huriet, loi Kouchner, révision des lois de bioéthique, loi de santé publique – a gêné la recherche clinique française, longtemps classée parmi les plus innovantes. Les grands laboratoires sont obligés d’aller faire leurs essais à l’étranger, en Europe de l’Est ou en Asie. Mme Barré, prix Nobel de médecine, nous a relaté les difficultés auxquelles se heurtait la recherche pour effectuer des essais cliniques de vaccin, en particulier contre le sida. Ce texte apporte la simplification nécessaire en prévoyant un cadre unique, tout en renforçant la protection des personnes puisque l’avis favorable du CPP sera requis. Cela redonnera à notre recherche une ambition sur le territoire national – ce qui est important pour notre croissance, comme le Président de la République l’a rappelé. Les difficultés dont le Lancet a fait état à propos du Plavix montrent bien qu’il est urgent simplifier le système. Néanmoins, que pourra-t-on répondre à ceux qui nous demanderont pourquoi nous n’avons pas attendu la révision des lois de bioéthique ?
Mme Dominique Orliac. Ce texte, bien que je n’aie pas eu le temps d’en faire une analyse fine, me semble vraiment très pertinent et très utile. Il est important d’avancer dans ce domaine, même si je me pose la même question que Jean-Pierre Door.
Mme Catherine Lemorton. J’irai dans le même sens que mes collègues. Si ces dispositions étaient restées dans le projet de loi « Hôpital, patients, santé et territoires », nous aurions eu tout le temps d’auditionner les personnes concernées. La révision des lois de bioéthique aurait pu elle aussi nous fournir l’occasion de les examiner. Mais on nous demande de travailler dans l’urgence, et c’est bien dommage. Pour ma part, j’avais quelques idées sur le sujet et je regrette de ne pas avoir le temps d’auditionner certaines personnes. C’est un rendez-vous manqué.
M. Jean-Frédéric Poisson. Je rejoins l’observation de principe de mes collègues, mais j’ai néanmoins plusieurs remarques à formuler.
Un : le fait d’affirmer que la « recherche sur la personne » est une « priorité nationale » – article 1er, alinéa 4 – ne risque-t-il pas d’apparaître aux yeux des juristes comme une forme d’appropriation de l’individu par le corps social ?
Deux : je suis très surpris que la forme de l’accord de la personne soit définie en fonction du caractère, interventionnel ou non, de la recherche – les sanctions pénales étant ensuite, comme c’est normal, adaptées en conséquence. Les textes de référence en matière d’éthique médicale, qu’ils soient internationaux ou nationaux, font du « consentement éclairé » un principe quasi intangible, que les lois de bioéthique ont consacré. Pourquoi avoir suivi une démarche qui pourrait, au contraire, le fragiliser ? En médecine, le risque encouru ne se mesure-t-il pas essentiellement a posteriori ?
Trois : je ne comprends pas très bien l’alinéa 2 de l’article 3, évoquant la procédure à suivre non seulement pour obtenir le consentement éclairé, mais aussi pour, le cas échéant, recueillir l’opposition de la personne ; il me semble en effet que, lorsque le consentement éclairé est exigé, il va de soi que la personne a la possibilité de ne pas l’accorder.
Quatre : pourquoi l’alinéa 15 du même article supprime-t-il des dispositions concernant la conservation et la préparation de tissus humains, qui me paraissent protectrices des personnes ?
Cinq : pourquoi l’alinéa 2 de l’article 4 donne-t-il aux comités de protection des personnes la personnalité juridique de droit public ? Est-ce pour qu’ils puissent disposer d’un budget, ou pour une autre raison ?
Enfin, il me semble que ces CPP manquent de spécialistes, notamment de juristes.
M. le rapporteur. Leur composition a été revue et comprend des juristes.
M. Jean-Frédéric Poisson. Alors je m’en réjouis.
M. le président Pierre Méhaignerie. Trouve-t-on, chez les membres de l’Union européenne, matière à asseoir cette réforme ?
M. le rapporteur. L’un des problèmes actuels est précisément que le droit français reconnaît la seule recherche biomédicale, alors que nos partenaires européens, de même que les États-Unis, distinguent trois niveaux, comme je propose de le faire.
Pourquoi ne pas avoir attendu la révision des lois de bioéthique ? C’est une excellente question, à laquelle je ferai la réponse suivante : la révision de 2004, la loi relative à la politique de santé publique, la directive européenne, la loi Kouchner, la loi de 2006 sur la recherche ont touché au sujet ; il paraissait nécessaire de simplifier et d’unifier le dispositif au sein d’un texte autonome et cohérent, au profit de la recherche française, qui souffre de cette complexité.
Faire de la recherche une priorité nationale, c’est une bonne chose. La personne reste au cœur du dispositif puisque l’accord des comités de protection des personnes sera obligatoire avant d’entamer des recherches, quel que soit leur niveau.
Quant au consentement, il sera toujours nécessaire mais prendra diverses formes. S’agissant par exemple de suivre le comportement alimentaire d’un groupe de personnes pendant dix ans, les personnes seront informées, et elles auront la possibilité de se soustraire à l’observation. Actuellement, les gens ne sont même pas informés qu’ils font partie d’un groupe d’observation.
S’agissant des collections, les lois de bioéthique issues de la révision de 2004 et la loi relative à la politique de santé publique, publiée la même année, sont en opposition. Aujourd’hui, l’AP-HP doit déclarer ses collections à la fois au ministère de la recherche et aux CPP pour leur conservation et leur préparation par les laboratoires, mais aussi chaque collection avec son protocole et ses consentements. Personne ne sachant par quoi commencer, rien ne se fait. À quoi bon une déclaration globale aux CPP s’ils ont à connaître de toute recherche sur une collection particulière ?
Enfin, la composition des CPP a été modifiée. Ils comportent dorénavant 50 % de médecins, et parmi les autres membres, qui sont notamment des représentants des associations, figure au moins un juriste.
M. Jean-Frédéric Poisson. Je reviendrai sans doute en séance sur la question de la priorité nationale car je m’interroge sur la portée symbolique de la formulation retenue.
Par ailleurs, j’insiste sur le fait qu’en l’état actuel du droit, tout protocole ou toute étude requiert un consentement préalable de la personne concernée. Ce principe, qui remonte au code de Nuremberg, n’est-il pas fragilisé par la gradation du consentement en fonction de ce qu’on estime être le risque de l’expérimentation ? Poser cette question ne signifie évidemment pas que je sois contre l’information des personnes !
M. le rapporteur. Concernant la recherche biomédicale – avec risques –, rien ne change ; la loi Huriet continue de s’appliquer. Il s’agit simplement de tenir compte du développement depuis vingt ans de la recherche interventionnelle ne comportant que des risques négligeables et de la recherche observationnelle.
M. Jean-Pierre Door. Il faut se recentrer sur la recherche biomédicale en France. Notre pays a longtemps été le premier dans ce domaine, mais il s’est laissé distancer parce que les essais cliniques ont été transférés à l’Est – en Hongrie, en Roumanie ou encore en Russie – et en Asie – en Inde, en Chine, en Indonésie. Les grands chercheurs se plaignent des formalités qu’ils doivent accomplir. À cause de l’empilement des textes, il leur faut plusieurs années avant d’obtenir l’autorisation de lancer leurs essais cliniques. En simplifiant radicalement les procédures, ce texte remettrait du carburant dans le moteur des laboratoires qui veulent faire de la recherche en France, tout en conservant les règles des lois Huriet et Kouchner. Il faudra lutter contre les résistances administratives, mais la recherche en sortira gagnante.
M. le rapporteur. Ce texte vise la recherche interventionnelle ne comportant que des risques négligeables et la recherche observationnelle. Actuellement, ou bien cette dernière se fait sans être déclarée, ou bien elle est paralysée par la multiplicité des démarches administratives.
M. Pierre Morange. Je soutiens notre rapporteur, dont la proposition de loi est excellente. L’objectif, c’est bien de combler un vide réglementaire qui touche deux compartiments de la recherche. Ne pas voter ce texte, ce serait laisser perdurer une situation dont on ne peut se satisfaire. Pour le moment, la personne suivie dans le cadre de la recherche observationnelle n’est même pas informée, ce qui est en contradiction avec les principes de la loi de 2002 sur les droits des patients.
Par-delà la clarification et la simplification, le but est aussi l’harmonisation du droit au niveau européen.
Enfin, il n’y aucune contradiction avec les lois de bioéthique et la loi de santé publique dans la mesure où cette proposition aborde un domaine qui n’avait pas été traité, hormis le cas des collections.
Abstraction faite de nos méthodes de travail qui devraient s’améliorer avec la loi organique découlant de la réforme constitutionnelle, le dispositif proposé s’intègre harmonieusement aux réflexions approfondies qui présideront à la révision des lois de bioéthique.
M. le président Pierre Méhaignerie. Avant de passer à l’examen des amendements, je voudrais saluer l’arrivée dans notre commission de Mme Anne Grommerch, à qui je souhaite la bienvenue.
La Commission a examiné les articles de la présente proposition de loi au cours de sa séance du mardi 13 janvier 2009.
Article 1er
Création de trois catégories de recherches sur la personne
dans un cadre législatif unique
Cet article a un triple objet :
– d’une part, il définit trois catégories de recherches sur la personne, différenciées selon le niveau de risque encouru par les personnes ;
– d’autre part, il décline, pour chacune de ces catégories de recherche, les procédures applicables ;
– enfin, il donne un cadre législatif commun à l’ensemble de ces recherches.
À cette fin, l’article 1er procède à une importante refonte de l’architecture du titre II du livre Ier de la première partie du code de la santé publique, qui correspond bien à la philosophie de la proposition de loi : donner un socle commun aux recherches sur la personne.
Ce titre détaille en effet actuellement la procédure applicable aux recherches biomédicales, principes généraux, informations des personnes et recueil des consentements, rôle des comités de protection des personnes, et ne décrit que de manière incidente, essentiellement à l’article L. 1121-1, les principes applicables aux autres types de recherche, recherches « visant à évaluer les soins courants » et recherches non interventionnelles.
L’article modifie l’intitulé du livre II, qui de « Recherches biomédicales », devient « Recherches sur la personne » (paragraphe II de l’article 1er) afin de signifier que celui-ci est consacré à l’ensemble des recherches, et plus seulement aux recherches biomédicales, et, après les avoir définies, détaille, au fil des articles, les procédures applicables à chacune des catégories de recherche (paragraphe I de l’article). Enfin, en substituant, dans la plupart des articles, les mots « recherches sur la personne » aux mots « recherches biomédicales », il étend les garanties et obligations, jusque là réservées aux seules recherches biomédicales, à toutes les recherches sur la personne et crée ainsi un droit commun des recherches sur la personne (paragraphe III de l’article).
1. La création de trois catégories de recherches sur la personne (article L. 1121-1 du code de la santé publique)
Le 1° du I de cet article propose une nouvelle rédaction de l’article L. 1121-1 du code de la santé publique, afin de substituer aux différentes recherches sur l’être humain trois nouvelles catégories de recherches, différenciées selon le niveau de risque encouru par les personnes.
● Le cadre législatif en vigueur
L’article L. 1121-1 du code de la santé publique distingue actuellement trois types de recherches :
– les recherches biomédicales, correspondant à l’ancien cadre de la loi n° 88-1138 du 20 décembre 1988, dite loi « Huriet-Sérusclat » ;
– les recherches « visant à évaluer les soins courants », issues de la loi n° 2004-806 du 9 août 2004 de santé publique ;
– les recherches non interventionnelles ou observationnelles, introduites par cette même loi.
Les recherches biomédicales sont définies par le premier alinéa de l’article L. 1121-1 du code de la santé publique comme des « recherches organisées et pratiquées sur l’être humain en vue du développement des connaissances biologiques ou médicales ». Cette définition, issue de la loi de santé publique de 2004 est plus vaste que la rédaction précédente qui visait les seuls « essais ou expérimentations ». Les recherches biomédicales comprennent les recherches portant sur un médicament, avec pour but de s’assurer de son innocuité ou de son efficacité, mais également les recherches portant sur un dispositif médical. Leur encadrement, lorsqu’il concerne le médicament, est assuré par la directive européenne n° 2001-20-CE du 4 avril 2001 (7), transposé en droit français par la loi de santé publique de 2004, ce qui a occasionné une réécriture complète du titre II du code de la santé publique. Les conditions relatives aux entrepreneurs de la recherche, aux sujets de la recherche, à l’information et au recueil des consentements, aux contrôles préalables et aux autorisations sont ainsi détaillées avec beaucoup de précision par les articles L. 1121-1 à L. 1126-7, ce qui offre de nombreuses garanties en termes de traçabilité de ces recherches, de droits des participants et de qualité du travail effectué.
Le deuxième alinéa de l’article L. 1121-1 du code de la santé publique exclut ensuite du champ d’application du titre II les deux autres types de recherches.
Les recherches « visant à évaluer les soins courants » sont des recherches dont les « actes sont pratiqués et les produits utilisés de manière habituelle » pour lesquelles « des modalités particulières de surveillance sont prévues » selon la définition proposée par le 2° de l’article L. 1121-1 du code de la santé publique. Ces recherches bénéficient d’une procédure « allégée », détaillée par le 2° de ce même article L. 1121-1 et sont donc exclues de la réglementation de la recherche biomédicale. Ce sont des recherches dont les risques et les contraintes sont négligeables, portant sur l’évaluation et/ou la comparaison de stratégies diagnostiques et thérapeutiques, avec des modalités particulières de surveillance prévues par un protocole. Elles ne concernent pas les médicaments, afin de ne pas contrevenir à la directive européenne qui ne prévoit pas de procédure simplifiée dans ce cas. Cette procédure simplifiée fait l’objet du 2° de l’article L. 1121-1. Elle a pour principal objet de soumettre le protocole et l’autorisation de mise en œuvre de la recherche à l’avis d’un comité de protection des personnes.
Enfin, une troisième catégorie de recherche est prévue par le 1° de l’article L. 1121-1 pour les recherches dans lesquelles « tous les actes sont pratiqués et les produits utilisés de manière habituelle, sans aucune procédure supplémentaire ou inhabituelle de diagnostic ou de surveillance ». Ces recherches sont aussi appelées recherches observationnelles. Elles consistent essentiellement à suivre des cohortes de patients et à observer, par exemple, sur une longue période l’utilisation d’un produit, vaccin ou médicament, dans une optique de sécurité sanitaire. Aucune procédure particulière n’est précisée par les textes, ce qui signifie que ce type de recherche se situe actuellement hors du champ de la législation de la recherche sur l’homme.
● Le dispositif proposé
L’importante réécriture de l’article L. 1121-1 qui est proposée par le 1° du I de l’article 1er a pour objet de définir trois nouvelles catégories de recherches sur l’être humain. Le déroulement des procédures, ainsi que les garanties qui y sont attachées, seront désormais déclinées dans les articles suivants.
Tout d’abord, le premier alinéa du nouvel article L. 1121-1 (alinéa 4 de l’article 1er) établit le principe selon lequel « le développement de la recherche sur la personne constitue une priorité nationale ». Cette déclaration de principe vise à encourager des campagnes nationales de sensibilisation de la population, comme cela avait été fait dans le domaine de la greffe d’organe après le vote de la loi de bioéthique, qui comportait une affirmation similaire (article L. 1231-1 A du code de la santé publique).
Les alinéas deux à quatre de l’article L. 1121-1 sont ensuite intégralement réécrits par les alinéas 6 à 9 de l’article 1er.
L’alinéa 6 précise qu’il existe trois catégories de recherches sur la personne. Celles-ci seront désormais distinguées selon un seul critère, celui de l’intervention. La notion d’intervention s’entend comme ce que la recherche va ajouter ou retrancher à la prise en charge habituelle des patients. Le pivot central est cette notion de pratique habituelle, à laquelle il faut confronter les différents éléments d’un protocole de recherche. Deux questions devront toujours être posées : y a-t-il une modification de la prise en charge du malade ? La recherche ajoute-t-elle des examens ou des procédures qui sans elle n’auraient pas été mis en œuvre ? C’est la graduation de ces interventions qui distinguera désormais les différentes catégories de recherche.
L’alinéa 7 définit ainsi les recherches interventionnelles comme des recherches « comportant une intervention non justifiée par la prise en charge médicale habituelle de la personne » (1° du nouvel article L. 1121-1). Cette catégorie de recherche remplace les actuelles recherches biomédicales. Cet alinéa propose ainsi une définition matérielle, par la nature de l’intervention pratiquée, de ces recherches. La définition proposée par l’ancien alinéa 1er de l’article L. 1121-1, « recherches organisées et pratiquées sur l’être humain en vue du développement des connaissances biologiques ou médicales », s’attachait en effet seulement aux buts poursuivis par ces recherches.
L’alinéa 8 de l’article 1er substitue aux recherches « visant à évaluer les soins courants » les recherches « interventionnelles ne comportant que des risques et des contraintes négligeables et ne portant pas sur des médicaments » (2° du nouvel article L. 1121-1). Le champ couvert par cette définition est légèrement plus vaste que l’actuelle puisqu’il fait entrer dans cette catégorie des interventions sans risque : prise de sang ou imagerie non invasive, par exemple.
Enfin, la définition des recherches non interventionnelles reste identique à l’ancienne rédaction du troisième alinéa de l’article L. 1121-1 puisqu’elles demeurent des recherches « dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle, sans aucune procédure supplémentaire ou inhabituelle de diagnostic, de traitement ou de surveillance » (alinéa 9 de l’article 1er, 3° du nouvel article L. 1121-1).
● La clarification des rôles de promoteur et d’investigateur
Le cinquième alinéa de l’article L. 1121-1 définit le promoteur d’une recherche biomédicale comme la personne physique ou morale qui « prend l’initiative d’une recherche » et « en assure la gestion et vérifie que son financement est prévu ». Cette définition est un peu plus large que celle retenue par la directive n° 2001-20-CE précitée qui ne fait référence qu’à la responsabilité du lancement, de la gestion et du financement. Cela s’explique par le contexte dans lequel a été élaborée la loi « Huriet-Sérusclat » qui visait essentiellement à l’origine les recherches dans le domaine du médicament. Le promoteur était alors souvent le laboratoire pharmaceutique qui confiait à des investigateurs, des médecins hospitaliers, une recherche qu’il avait lui-même initié. Or dans le cadre de la recherche à promotion institutionnelle, ce sont pratiquement toujours les investigateurs qui sont à l’initiative des recherches sur la personne, et non les promoteurs.
L’alinéa 11 de l’article 1er propose de mettre en conformité le droit avec les faits et de supprimer la référence à l’initiative dans la définition des promoteurs de recherche. En outre, il étend les notions de promoteur et d’investigateur à l’ensemble des recherches sur la personne.
Les alinéas 12 et 13 mettent également la législation en conformité avec le droit européen en introduisant la notion « d’investigateur principal », responsable de l’équipe de recherche sur un même site. Pour ce faire, la mention « sur un même lieu » est supprimée de l’alinéa 8 du nouvel article L. 1121-1, cet alinéa n’ayant désormais trait qu’aux recherches sur plusieurs lieux, et un nouvel alinéa complète l’article L. 1121-1 pour y introduire la définition « d’investigateur principal ».
2. Des procédures différenciées pour chaque catégorie de recherche
L’article L. 1121-1 étant devenu un facteur commun à l’ensemble de la recherche sur la personne, les alinéas suivants déclinent, pour chaque type de recherche sur la personne, les procédures applicables. Les recherches ne comportant que des risques négligeables et les recherches non interventionnelles bénéficient ainsi désormais, à l’image des anciennes recherches biomédicales, d’un encadrement législatif détaillé, gradué en fonction du degré d’intervention effectué et des risques encourus par les participants.
● Les conditions de réalisation de la recherche (articles L. 1121-3 du code de la santé publique)
L’article L. 1121-3 du code de la santé publique précise les conditions dans lesquelles peuvent être réalisées les recherches biomédicales : qualification de la personne dirigeant la recherche, conditions matérielles et techniques adaptées à la recherche.
Si les conditions applicables aux recherches interventionnelles sont identiques à celles des recherches biomédicales, la nouvelle rédaction de l’article, proposée par le 2° de l’article 1er insère les conditions applicables aux recherches comportant des risques négligeables et aux recherches non interventionnelles.
Alors que le code ne prévoyait aucune condition de qualification particulière, celles-ci seront désormais « effectuées sous la direction et la surveillance d’un professionnel de santé qualifié » (alinéa 17) à condition qu’elles n’aient « aucune influence sur la prise en charge médicale de la personne qui s’y prête ». Dans ce cas, la modification de la prise en charge ne pourra être effectuée que par un médecin (deuxième alinéa du nouvel article L. 1121-3).
Si l’alinéa 18 est un simple alinéa de coordination, l’alinéa 20 a pour but d’étendre l’usage des recommandations de bonnes pratiques, jusqu’ici réservées aux seules recherches biomédicales, aux recherches comportant des risques négligeables et aux recherches non interventionnelles. Ces recommandations sont un outil précieux pour les professionnels de santé dans la conduite de leurs recherches et une garantie de qualité pour les participants à ces recherches. Elles seront fixées par voie réglementaire.
● Les régimes d’autorisation (articles L. 1121-4 du code de la santé publique)
L’article L. 1121-4 du code de la santé publique dispose que les recherches biomédicales ne peuvent être mises en œuvre qu’après avis favorable du comité de protection des personnes et autorisation de l’autorité compétente, l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS) (8).
Les comités de protection des personnes constituent la pierre angulaire de la protection des sujets de recherche. Mis en place par la loi « Huriet-Sérusclat » et profondément remaniés par la loi de santé publique de 2004, ils remplissent le rôle de comité d’éthique prévu par la directive n° 2001-20-CE précitée. Ils autorisent également les recherches visant évaluer les soins courants (article L. 1121-1 du code de la santé publique).
Si les modalités de mise en œuvre des recherches interventionnelles ne changent pas, le 3° de l’article 1er complète l’article L. 1121-4 par trois alinéas afin d’inclure dans son champ les recherches ne présentant qu’un risque négligeable et les recherches non interventionnelles.
L’alinéa 23 de l’article 1er constitue l’une des principales innovations de la proposition de loi puisqu’il dispose que, outre les recherches interventionnelles et les recherches ne comportant que des risques négligeables, les recherches non interventionnelles ne pourront désormais débuter qu’après avoir reçu un avis favorable d’un comité de protection des personnes.
Cet alinéa comble le vide juridique qui subsistait pour ce type de recherches, pose en facteur commun du régime d’autorisation de toutes les recherches sur la personne l’avis favorable d’un comité de protection des personnes et place, par la même occasion, ces comités au centre du dispositif de toutes les recherches sur la personne.
En outre, cette obligation de soumission à un comité de protection des personnes de l’ensemble des recherches sur la personne facilitera les publications des chercheurs français dans les grandes revues internationales, celles-ci exigeant un avis éthique pour toute recherche sur l’homme. Les auteurs français étaient jusqu’ici pénalisés par le refus des comités de protection des personnes de donner des avis sur des recherches qui n’étaient pas situées dans leur champ de compétence, notamment les recherches observationnelles.
L’alinéa 24 est une simple reprise des dispositions déjà prévues par la rédaction actuelle de l’article L. 1121-1 : lorsque les recherches ne présentant qu’un risque négligeable, anciennement « soins courants », portent sur une liste de produits fixée par le ministre chargé de la santé, le comité de protection des personnes s’assure auprès de l’AFSSAPS que les recherches ne présentent que des risques négligeables. La référence à la liste des produits fixée par l’article
L. 5311-1 est supprimée puisque la liste arrêtée par le ministère en charge de la santé, sur proposition du directeur de l’AFSSAPS, sera plus restreinte que la liste des produits de l’article L. 5311-1.
Enfin, l’alinéa 25 permet aux comités de protection des personnes de saisir l’AFSSAPS en cas de « doute sérieux sur la qualification d’une recherche ». Il s’agit là d’une règle de prudence nouvelle, indispensable maintenant que les comités de protection des personnes seront saisis de l’intégralité des projets de recherche sur l’homme.
● L’instauration d’une dérogation exceptionnelle à l’obligation d’affiliation à un régime de sécurité sociale (article L. 1121-11 du code de la santé publique)
Le 4° de l’article 1er complète l’article L. 1121-11 du code de la santé publique afin d’autoriser, sous des conditions très strictes, les recherches sur des personnes qui ne sont pas affiliées à un régime de sécurité sociale.
Les personnes qui ne sont pas affiliées à un régime de sécurité sociale sont essentiellement les populations migrantes, personnes en situation irrégulière sur notre territoire. Elles sont parfois porteuses de maladies graves et contagieuses, telles que la tuberculose multirésistante. Aussi, il est primordial, en termes de santé publique, de pouvoir dépister ces maladies, parfois rares sur notre territoire, pour proposer ensuite des traitements adaptés ces personnes. Cela suppose donc de pouvoir effectuer des prélèvements, analyser des échantillons, évaluer de nouvelles stratégies thérapeutiques adaptées, autant d’éléments qui sont constitutifs d’une recherche sur la personne.
L’intégralité des dispositions relatives aux recherches sur la personne sera naturellement appliquée. Les alinéas 28 à 30 ajoutent donc aux conditions déjà fixées par l’article L. 1121-2 du code de la santé publique (dernier état des connaissances scientifiques, rapport bénéfice/risque pour le sujet de recherche, réduction des inconvénients au minimum) trois nouvelles conditions pour ces catégories de personnes :
« – ces recherches sont importantes en termes de santé publique ;
« – et l’importance du bénéfice escompté pour ces personnes est de nature à justifier le risque prévisible encouru ;
« – ou ces recherches se justifient au regard du bénéfice escompté pour d’autres personnes se trouvant dans la même situation juridique à la condition que des recherches d’une efficacité comparable ne puissent être effectuées sur des personnes affiliées à un régime de sécurité sociale. »
Ces dispositions feront l’objet d’un amendement de clarification rédactionnelle du rapporteur.
● L’autorisation des lieux de recherche (article L. 1121-13 du code de la santé publique)
L’actuel article L. 1121-13 du code de la santé publique dispose que les recherches biomédicales « ne peuvent être réalisées que dans un lieu disposant des moyens humains, matériels et techniques adaptés à la recherche et compatible avec les impératifs de sécurité des personnes qui s’y prêtent ». Aussi, lorsque des recherches ont lieu en dehors des lieux de soin ou lorsque les actes pratiqués ne relèvent pas de la pratique usuelle de ces professionnels ou porte sur des personnes dont la condition clinique ne correspond pas à la compétence du service, le lieu de recherche doit recevoir l’autorisation du représentant de l’État.
L’alinéa 31 (5° de l’article 1er) étend cette obligation d’autorisation préalable aux recherches ne présentant qu’un risque négligeable.
● La création d’un répertoire national des recherches présentant un risque négligeable et des recherches non interventionnelles (article L. 1121-15 du code de la santé publique)
L’article L. 1121-15 dispose que l’autorité compétente met en œuvre les répertoires des recherches biomédicales autorisées. La création, le contenu et les modalités d’utilisation des répertoires sont déterminés dans les conditions définies par la loi du 6 janvier 1978 relative à l’informatique, aux fichiers et aux libertés. En pratique, l’AFSSAPS tient à jour un site Internet intitulé Répertoire des essais cliniques de médicaments. Accessible à tous, il mentionne le titre de l’essai, le nom du promoteur et les traitements étudiés. Très utile pour les professionnels de santé, il permet aussi au grand public, notamment les patients et associations de patients, de connaître l’existence des essais menés en France.
À l’image de ce répertoire, l’alinéa 33 crée un répertoire pour les recherches ne comprenant que des risques négligeables et les recherches non interventionnelles, ce qui leur donnera une visibilité nouvelle. Il s’agit là d’une de nouveautés importantes de la proposition de loi, qui vise à donner toute leur place à ces catégories de recherche.
● Fichier national des personnes se prêtant à des recherches biomédicales (article L. 1121-16 du code de la santé publique)
L’alinéa 34 supprime une disposition inutilisée par les comités de protection des personnes : la possibilité d’inscrire au fichier national des personnes autres que celles « qui ne présentent aucune affection et se prêtent volontairement à ces recherches ainsi que les personnes malades lorsque l'objet de la recherche est sans rapport avec leur état pathologique ».
● La saisine du comité de protection des personnes par le promoteur (article L. 1123-6 du code de la santé publique)
L’alinéa 35 est purement rédactionnel. Il supprime le dernier alinéa de l’article L. 1123-6 qui dispose que le promoteur d’une recherche portant sur des soins courants peut, en cas de refus d’un comité de protection des personnes d’autoriser le lancement d’une recherche, demander au ministre chargé de la santé de soumettre le projet de recherche à un autre comité de protection des personnes.
Le terme « biomédical » étant remplacé par « sur la personne », l’alinéa 67 de l’article 1er étend déjà cette possibilité à toutes les catégories de recherche. Le dernier alinéa de l’article L. 1123-6 devient donc superfétatoire.
● Modification substantielle du projet de recherche après son commencement (article L. 1123-9 du code de la santé publique)
Le 9° fait écho aux dispositions du nouvel article 1121-4. Après le début d’une recherche, toute modification substantielle doit obtenir un nouvel avis favorable du comité de protection des personnes et, dans le cas de recherches interventionnelles, de l’autorité compétente. Aussi, afin que cette modification substantielle n’entraîne pas une nouvelle qualification de la recherche, le comité de protection des personnes peut saisir l’AFSSAPS en cas de doute sérieux.
Là aussi, en cas d’avis défavorable du comité, le promoteur peut saisir le ministre chargé de la santé afin que la demande de modification puisse être examinée par un autre comité.
● Coordination (article 223-8 du code pénal)
Le 11° tire les conséquences de la modification des modalités de recueil de consentement des personnes qui se prêtent à des recherches en procédant à la réécriture des dispositions du code pénal.
● Coordination (article L. 1126-10 du code de la santé publique)
Le 12° est également un alinéa de coordination, qui tire les conséquences du remplacement des mots « recherche biomédicale » par les mots « recherche interventionnelle ».
● Information de la personne qui se prête à une recherche biomédicale et recueil de son consentement (articles L. 1122-1 à L. 1122-2 du code de la santé publique)
Le 13° réécrit l’intitulé du chapitre II du titre II du livre Ier du code de la santé publique en substituant au terme « biomédicale » les termes « sur la personne ». Le chapitre II concerne ainsi désormais l’ensemble des recherches sur la personne et toutes les règles d’information des personnes et de recueil des consentements y sont déclinées.
L’article L. 1122-1, qui détaille les modalités d’information du sujet de la recherche, s’appliquera désormais à l’ensemble des recherches sur la personne (alinéa 67 de l’article 1er). Les alinéas 48 à 52, effectuent, pour coordination, une gradation de l’information à donner, en fonction de la catégorie de recherche concernée. Dans le cas de recherches non interventionnelles, il n’y a en effet pas lieu de fournir des informations sur les risques prévisibles ou les alternatives médicales, par exemple.
Il s’agit d’un autre apport important de la proposition de loi, les règles de consentement sont désormais clairement établies par le nouvel article L. 1122-1-1 (alinéas 55 à 57). Les règles, graduées en fonction du risque encouru par les participants, sont les suivantes :
– Dans le cas de recherches interventionnelles, le participant doit avoir accordé un consentement libre et éclairé, recueilli par écrit. Cela ne change rien par rapport au droit existant pour les recherches biomédicales (alinéa 55).
– Dans le cas des recherches ne présentant que des risques négligeables, le participant doit donner son consentement libre et éclairé. Cela constitue incontestablement un progrès dans la mesure où les règles relatives aux recherches portant sur les soins courants ne prévoyaient qu’une faculté d’opposition de la part du patient (alinéa 56).
– Enfin, les recherches non interventionnelles ne peuvent être pratiquées « sur une personne lorsqu’elle s’y est opposée ». Cette disposition comble un vide juridique (alinéa 57). On peut souligner que la personne aura reçu préalablement les informations mentionnées au nouvel article L. 1122-1.
● Coordination (articles L. 1122-1-2, L. 1122-2, L. 1221-8-1 du code de la santé publique)
Les alinéas 58 à 63 sont des alinéas de coordination visant à prendre en compte les nouveaux termes de « recherche sur la personne ».
Dans le cas de recherches biomédicales comportant un risque négligeable sur un mineur non émancipé, le seul titulaire de l’autorité parentale présent pourra toujours autoriser la recherche. Pour les autres types de recherche, l’accord d’un seul titulaire de l’autorité parentale sera suffisant (alinéa 59).
Ces dispositions feront l’objet d’un amendement de clarification rédactionnelle de la part du rapporteur.
3. La mise en place d’un cadre législatif unique à toute recherche sur la personne
L’alinéa 65 dispose que désormais le titre II du livre Ier de la première partie du code de la santé publique est intitulé « Recherches sur la personne ». Ce nouvel intitulé prend en compte tous les types de recherches pratiquées. Il a pour avantage, par rapport aux termes « recherches biomédicales », de tenir compte des recherches observationnelles, qui ne nécessitent pas d’intervention médicale, et de se définir par rapport à son principal sujet d’études, l’homme, et non les méthodes utilisées. Les termes « la personne » ont été préférés à ceux « d’être humain » afin de ne pas provoquer de confusion avec les autres types de recherche, notamment sur l’embryon, encadrées par la loi de bioéthique.
Le III de l’article 1er prévoit des dispositions de coordination. Il supprime dans l’ensemble du titre II les mots « recherche biomédicale » et les remplace, en fonction des cas, par les mots « recherche sur la personne », « recherche interventionnelle » ou « recherche interventionnelle ou une recherche mentionnée au 2° de l’article L. 1121-1 ».
Outre les dispositions déjà évoquées (avis du comité de protection des personnes, règles d’information et de consentement, création d’un répertoire national, diffusion de règles de bonne pratique), cela a pour conséquence, dans de nombreux cas, d’étendre aux recherches ne comportant que des risques négligeables et aux recherches non interventionnelles les dispositions applicables jusqu’à présent aux seules recherches interventionnelles, anciennement biomédicales.
Parmi ces nombreuses dispositions on peut citer les suivantes :
– toutes les recherches sur la personne sont désignées comme des « recherches organisées et pratiquées sur l’être humain en vue du développement des connaissances biologiques ou médicales » (article L. 1121-1 nouveau, alinéa 67 de l’article 1er) ;
– le respect des conditions fixées par l’article L. 1121-2 (dernier état des connaissances scientifiques, rapport bénéfice/risque, limitation au minimum des contraintes) s’imposent à toutes les recherches, ce qui accroît singulièrement les garanties des personnes qui s’y prêtent ;
– les informations fournies au sujet de recherche, déjà évoquées (article L. 1122-1 nouveau) sont désormais complètes pour tous les types de recherche ;
– les dispositions relatives à certains sujets de recherche particuliers (femmes enceintes, personnes privées de liberté, mineurs, personnes majeures faisant l’objet d’une mesure de protection légale, articles L. 1121-5 à L. 1121-8 du code de la santé publique) s’appliqueront également aux recherches ne comportant que des risques négligeables ;
– les conditions de responsabilité du promoteur de recherches ne comportant que des risques négligeables seront identiques à celles du promoteur de recherches interventionnelles (article L. 1121-10 nouveau du code de la santé publique) ;
– la compétence de l’AFSSAPS pour l’ensemble des recherches sur la personne est reconnue lorsqu’elles portent sur les produits mentionnés à l’article L. 5311-1 nouveau du code de la santé publique.
Enfin, et c’est l’un des apports majeurs de la proposition de loi, le cadre législatif et réglementaire commun à l’ensemble des recherches sur la personne devrait permettre aux projets de recherches présentant des risques négligeables et aux recherches non interventionnelles de bénéficier d’une méthodologie de référence de la part de la Commission nationale de l’informatique et des libertés (CNIL).
La CNIL a en effet homologué une méthodologie de référence (procédure MR 001) pour les traitements de données personnelles mis en œuvre dans le cadre des recherches biomédicales, visant à simplifier les formalités de déclaration. Un seul engagement de conformité, adressé directement à la CNIL par le promoteur est en effet suffisant dès lors que le traitement mis en œuvre est conforme à la méthodologie de référence.
Or, pour bénéficier d’une méthodologie de référence, les recherches qui font appel à des traitements automatisés de données indirectement nominatives doivent être conduites dans le cadre d’exigences législatives et réglementaires strictes et selon des méthodologies scientifiques standardisées (article 54 de la loi n° 78-17 du 6 janvier 1978). En donnant un cadre de référence aux recherches comportant des risques négligeables et aux recherches non interventionnelles, la proposition de loi permettra à ces projets de recherche de remplir ces conditions, ce qui simplifiera considérablement toutes leurs démarches administratives.
*
La Commission adopte successivement dix-sept amendements du rapporteur, seize de nature rédactionnelle et un visant, dans un souci de clarification, à conserver la possibilité actuelle, dans le cas de certaines recherches interventionnelles sur des mineurs non émancipés, de ne recueillir l’accord que du seul titulaire de l’autorité parentale présent, tout en précisant que cette autorisation unique suffit pour les recherches comportant des risques négligeables et pour les recherches non interventionnelles.
Puis elle adopte l’article 1er ainsi modifié.
Article 2
Définition des recherches interventionnelles à finalité non commerciale
L’article L. 1121-16-1 du code de la santé publique définit les conditions de prise en charge, par l’assurance maladie, des médicaments utilisés dans le cadre d’une recherche biomédicale. Cette prise en charge intégrale ne s’applique actuellement que si le promoteur de la recherche est public (alinéa 3 de l’article L. 1121-16-1).
Or cette disposition, introduite par loi n° 2006-450 du 18 avril 2006 de programme pour la recherche, est contraire au droit communautaire dans la mesure où elle se fonde sur une distinction de catégorie juridique pour justifier une aide d’État, ce qui est interdit par l’article 87 du traité instituant la Communauté européenne.
L’article propose donc de substituer à la notion de promoteur public celle d’essai non commercial, présente dans la directive n° 2001-20-CE précitée, afin de fonder la distorsion de traitement sur la finalité de la recherche et non plus sur la différence de statut du promoteur.
L’alinéa 2 définit les recherches interventionnelles à finalité non commerciale comme « les recherches dont les résultats ne sont pas exploités à des fins lucratives, qui poursuivent un objectif de santé publique et dont le promoteur ou le ou ses investigateurs sont indépendants à l'égard des entreprises qui fabriquent ou qui commercialisent les produits faisant l’objet de la recherche ».
L’alinéa 3 réaffirme le principe de gratuité des coûts de la recherche, supportés par le promoteur, conformément aux dispositions de la directive européenne.
Les alinéas 4, 5, 6 et 7 sont la simple reprise des dispositions existantes.
Enfin, l’alinéa 8 prévoit les modalités de remboursement à l’assurance maladie, par le promoteur, des sommes engagées par celle-ci lorsque la recherche ayant bénéficié d’une prise en charge ne répond plus à la définition d’une recherche interventionnelle à finalité non commerciale.
*
La Commission adopte l’article 2 sans modification.
Article 3
Simplification et mise en cohérence du régime d’autorisation et de déclaration des recherches utilisant des collections d’échantillons biologiques humains
Les collections d’échantillons biologiques humains constituent aujourd’hui les compléments indispensables à la plupart des projets de recherche, notamment dans le cas de recherches non interventionnelles. Les conditions de leur prélèvement, de leur utilisation et de leur conservation sont strictement encadrées par les lois de santé publique et de bioéthique de 2004. Or le régime issu de ces lois s’avère difficile à mettre en œuvre car il n’opère pas une distinction claire entre l’activité de conservation et de préparation des échantillons, d’une part, et la collection de ces échantillons dans le cadre d’un projet de recherche, d’autre part.
Cet article a donc pour objet de simplifier et de rendre plus cohérent le dispositif actuel.
● Le dispositif existant
Afin de s’assurer de la pertinence scientifique des projets et du respect des règles d’hygiène et de sécurité, tous les organismes qui ont une activité de conservation et de préparation d’échantillons biologiques d’origine humaine doivent effectuer une déclaration auprès du ministère chargé de la recherche (article L. 1243-3 du code de la santé publique).
Mais, pour que les droits des personnes qui se prêtent à de tels prélèvements soient préservés, la loi de bioéthique a assorti cette déclaration préalable de l’avis d’un comité de protection des personnes sur la « qualité de l’information des participants, les modalités de recueil du consentement et la pertinence éthique et scientifique du projet » (article L. 1243-3 du code de la santé publique).
Loin de l’effet attendu, l’unification des deux démarches, déclaration de l’activité et avis du comité de protection des personnes, a abouti à un véritable blocage des activités de collection d’échantillons. Il est en effet difficile pour les comités de protection des personnes de se prononcer sur la pertinence d’une déclaration d’activité, qui est un document essentiellement technique de recensement des collections et de description des conditions de conservation. Aussi, beaucoup refusent d’émettre un avis, ce qui conduit à l’interruption des projets de recherche faisant appel à des collections d’échantillons.
Cet article vise à dissocier ces deux démarches, à l’image de ce qui existe déjà pour les recherches biomédicales : lorsqu’un projet de recherche biomédicale utilise des échantillons biologiques d’origine humaine, la collection est déclarée au sein du protocole de recherche et elle est donc soumise au comité de protection des personnes en même temps que le reste du protocole. Ce n’est qu’à l’issue de la recherche que la déclaration d’activité est effectuée auprès du ministère chargé de la recherche. Elle n’est accompagnée d’un nouvel avis du comité de protection des personnes que dans le cas où la collection d’échantillons constituée fait l’objet d’un nouveau projet de recherche, différent de celui pour lequel elle avait été constituée.
C’est ce dispositif que l’article 3 étend à l’ensemble des recherches sur la personne.
● Intervention du comité de protection des personnes (article L. 1123-7 du code de la santé publique)
L’article L. 1123-7 du code de la santé publique détaille les critères au regard desquels le comité de protection des personnes se prononce sur les conditions de validité d’une recherche.
L’alinéa 2 de l’article 3 est une simple précision de coordination. Il introduit, à côté du consentement éclairé, exigé pour les recherches interventionnelles et celles présentant des risques négligeables, la vérification des conditions pour recueillir l’opposition des participants aux recherches, dans le cas de recherches non interventionnelles.
L’alinéa 4 ajoute un nouveau critère relatif à « la pertinence scientifique et éthique des projets de constitution de collections d’échantillons biologiques au cours de recherche sur la personne ». Cela signifie que, d’une part, la constitution de ces collections fait désormais partie intégrante du champ des recherches sur la personne et que, d’autre part, le comité de protection des personnes a pour missions d’examiner toutes les constitutions de collections.
L’alinéa 5 supprime, en conséquence, l’alinéa treize devenu inutile.
● Déclaration de l’activité auprès du ministère chargé de la recherche (article L. 1243-3 du code de la santé publique)
L’alinéa 7 supprime l’alinéa 3 de l’article L. 1243-3 du code de la santé publique qui prévoyait les modalités d’intervention du comité de protection des personnes préalablement à la déclaration d’activité auprès du ministère chargé de le recherche. En application du nouvel article L. 1123-7 du code de la santé publique, l’avis du comité de protection des personnes sera en effet désormais donné au moment où lui sera soumis le projet de recherche sur la personne.
Les alinéas 8 et 9 sont de la simple coordination. Ils tirent les conséquences de l’entrée dans le champ des recherches sur la personne la constitution de collections d’échantillons : l’avis du comité de protection des personnes se substitue à l’avis que pouvait émettre le ministère chargé de la recherche sur la pertinence éthique du projet et à l’avis du comité consultatif sur le traitement de l’information en matière de recherche dans le domaine de la santé.
L’alinéa 11 est purement rédactionnel : il substitue aux termes « recherches biomédicales » ceux de « recherches sur la personne », par souci de coordination avec la nouvelle rédaction de l’article L. 1123-7 du code de la santé publique.
*
La Commission adopte deux amendements du rapporteur, l’un de nature rédactionnelle, l’autre de cohérence, visant à supprimer la référence aux agences régionales de santé, les dispositions législatives relatives à celles-ci n’ayant pas encore été examinées par le Parlement.
Elle adopte ensuite l’article 3 ainsi modifié.
Article 4
Statut juridique et conditions de retrait d’agrément
des comités de protection des personnes
Le présent article complète, d’une part, le second alinéa de l’article L. 1123-1 et, d’autre part, l’article L. 1123-5 du code de la santé publique dans le but de préciser le statut juridique des comités de protection des personnes et d’ajouter une condition de retrait possible de l’agrément d’un comité par le ministre chargé de la santé.
Le deuxième alinéa vise à clarifier le statut juridique des comités de protection des personnes (CPP), qui remplacent depuis la loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique les comités consultatifs de protection des personnes en matière de recherche biomédicale (CCPPRB).
Ces CCPPRB, créés par la loi n° 88-1138 du 20 décembre 1988 relative à la protection des personnes qui se prêtent à des recherches biomédicales, dite loi « Huriet-Sérusclat », n’ont jamais été dotés d’un véritable statut juridique. Initialement, la loi ne fixe que leur rôle, leur composition et leur mode de financement. Six ans plus tard, une disposition de la loi n° 94-630 du 25 juillet 1994 précise que « les comités exercent leur mission en toute indépendance. Ils sont dotés de la personnalité juridique ». Il est alors prévu que les statuts types seront fixés par décret en Conseil d’État, décret qui n’est toutefois jamais intervenu.
La nature de la personnalité juridique des comités étant restée indéfinie dans la loi, ceux-ci ont souvent fait le choix de fonctionner sous des statuts proches de ceux d’une association. Ce flou juridique, résultant d’une lacune de la loi, n’a pas été sans entraîner des difficultés, comptables notamment, soulignées en 2001 par le rapport (9) du sénateur M. Claude Huriet : « La définition d’un statut pour les CCPPRB permettrait de mettre un terme aux difficultés rencontrées par certains d’entre eux dans leurs relations avec les services déconcentrés du ministère de l’Economie et des Finances qui ont eu tendance quelquefois à évoquer l’absence de statut pour retarder le versement de la subvention publique qui leur revient. (…) Les comités fonctionnent de fait aujourd’hui comme de quasi-associations. Le statut des associations dites loi 1901 est certes réputé pour sa souplesse, mais il reste peu adapté aux organismes bénéficiant de fonds publics et placés sous la tutelle de l’Etat, compte tenu en particulier des difficultés rencontrées pour contrôler l’utilisation des fonds et des exigences particulières qui incombent à des personnes morales participant à des missions de service public. »
La loi du 9 août 2004, qui convertit les CCPPRB en CPP pour les mettre en conformité avec la directive européenne 2001-20-CE, maintient la personnalité juridique des comités sans en préciser le statut ni la forme. Toutefois, en l’investissant de compétences élargies et d’une mission étendue, la loi affirme implicitement leur statut de droit public. En effet, comme le souligne le rapport de Mme Christine d’Autume, Mme Bernadette Roussille et M. Pierre Aballea, membres de l’Inspection générale des affaires sociales (IGAS), remis en juillet 2005 (10), « en raison des modalités de constitution des comités et des prérogatives de puissance publique que leur donne la loi (avis défavorables à effet exécutoire), il s’agit incontestablement d’une personnalité de droit public. Cette analyse est confortée par le nouvel article L. 1123-7 » qui dispose qu’ « en cas de faute du comité dans l’exercice de sa mission, la responsabilité de l’État est engagée ».
Il apparaît donc aujourd’hui nécessaire de lever les incertitudes en précisant explicitement dans l’article L. 1123-1 du code de la santé publique la nature de la personnalité juridique des comités de protection des personnes. C’est ce que préconisait le rapport de l’IGAS susmentionné : « Pour conforter le caractère sui generis de la personnalité juridique des comités et les rendre sans conteste éligibles aux financements publics dans le cadre de la LOLF, des dispositions législatives nouvelles devraient poser clairement le caractère de droit public de la personnalité morale des CPP ».
L’alinéa 3 introduit un nouveau critère permettant au ministre chargé de la santé de retirer l’agrément d’un comité de protection des personnes.
En l’état actuel du droit, l’article R. 1123-1 du code de la santé publique détermine les conditions d’agrément d’un comité : il « est délivré par le ministre chargé de la santé sur la demande du préfet de la région concernée et après avis de celui-ci ». L’alinéa 3 précise que « l’agrément est délivré pour une durée de six ans. L’arrêté du ministre chargé de la santé prononçant l’agrément détermine la compétence territoriale du comité après avis du préfet de la région concernée. »
Par ailleurs, l’article L. 1123-5 précise les critères selon lesquels l’agrément du comité peut être retiré. Il peut s’agir :
– d’un manquement à l’obligation d’indépendance des membres du comité, inscrite à l’article L. 1123-3 ;
– de problèmes directement liés à la composition du comité (diversité des membres non respectée par exemple) ;
– plus généralement, de problèmes liés au fonctionnement du comité, de sorte qu’il ne peut plus assurer sa mission dans des conditions satisfaisantes.
L’alinéa 3 ajoute à cette liste un quatrième critère, lié à la charge de travail du comité. Ainsi, si le volume d’activité d’un CPP est insuffisant, le ministre chargé de la santé peut retirer l’agrément délivré. Cette disposition permet de ne pas maintenir une structure insuffisamment opérationnelle : s’il n’est en effet pas souhaitable qu’un comité traite plus de soixante dossiers par an, compte tenu des disponibilités des membres – qui exercent leur fonction à titre gracieux –, il apparaît nécessaire que la charge soit équitablement répartie entre les CPP afin que s’exerce au mieux le travail de discussion entre les membres.
Des ajustements peuvent également s’avérer utiles pour optimiser les coûts de production d’avis. Il convient donc d’inscrire dans la loi la possibilité de resserrer le dispositif pour une meilleure articulation du réseau des CPP, actuellement au nombre de 40 (11).
La Commission adopte l’article 4 sans modification.
Elle adopte ensuite l’ensemble de la proposition de loi ainsi rédigée.
*
En conséquence, la Commission des affaires culturelles, familiales et sociales demande à l’Assemblée nationale d’adopter la proposition de loi dont le texte suit.
PROPOSITION DE LOI RELATIVE AUX RECHERCHES SUR LA PERSONNE
Article 1er
![]()
I. – L’intitulé du titre II du livre Ier de la première partie du code de la santé publique est ainsi rédigé : « Recherches sur la personne » ;
![]()
II. – Le titre II du livre Ier de la première partie du même code est ainsi modifié :
![]()
1° L’article L. 1121-1 est ainsi modifié :
![]()
a) Avant le premier alinéa, il est inséré un alinéa ainsi rédigé :
![]()
« Le développement de la recherche sur la personne constitue une priorité nationale. » ;
![]()
b) Les deuxième à quatrième alinéas sont remplacés par quatre alinéas ainsi rédigés :
![]()
« Il existe trois catégories de recherches sur la personne :
![]()
« 1° Les recherches interventionnelles c’est-à-dire les recherches comportant une intervention non justifiée par la prise en charge médicale habituelle de la personne ;
![]()
« 2° Les recherches interventionnelles ne comportant que des risques et des contraintes négligeables et ne portant pas sur des médicaments ;
![]()
« 3° Les recherches non interventionnelles c’est-à-dire les recherches dans lesquelles tous les actes sont pratiqués et les produits utilisés de manière habituelle, sans aucune procédure supplémentaire ou inhabituelle de diagnostic, de traitement ou de surveillance. » ;
![]()
c) La première phrase du cinquième alinéa est remplacée par une phrase ainsi rédigée :
![]()
« La personne physique ou la personne morale qui est responsable d’une recherche sur la personne, en assure la gestion et vérifie que son financement est prévu est dénommée le promoteur. » ;
![]()
d) Au dernier alinéa, les mots : «, sur un même lieu ou » sont supprimés ;
![]()
e) Il est ajouté un alinéa ainsi rédigé :
![]()
« Si, sur un site, la recherche est réalisée par une équipe, l’investigateur est le responsable de l’équipe et peut être appelé investigateur principal. » ;
![]()
2° L’article L. 1121-3 est ainsi modifié :
![]()
a) Le sixième alinéa est ainsi rédigé :
![]()
« Par dérogation aux dispositions précédentes, les recherches mentionnées au 2° de l’article L. 1121-1 ou non interventionnelles et qui n’ont aucune influence sur la prise en charge médicale de la personne qui s’y prête peuvent être effectuées sous la direction et la surveillance d’un professionnel de santé qualifié. Le comité de protection des personnes s’assure de l’adéquation entre la qualification du ou des investigateurs et les caractéristiques de la recherche. » ;
![]()
b) À la deuxième phrase du septième alinéa, après les mots : « autres recherches », est inséré le mot : « interventionnelles » ;
![]()
c) Le septième alinéa est complété par une phrase ainsi rédigée :
![]()
« Pour les recherches mentionnées au 2° de l’article L. 1121-1 et les recherches non interventionnelles, des recommandations de bonnes pratiques sont fixées par voie réglementaire. » ;
![]()
d) Au dernier alinéa, le mot : « biomédicale » est remplacé par les mots : « sur la personne » ;
![]()
3° L’article L. 1121-4 est complété par trois alinéas ainsi rédigés :
![]()
« Les recherches mentionnées au 2° de l’article L. 1121-1 et les recherches non interventionnelles ne peuvent être mises en œuvre qu’après avis favorable du comité de protection des personnes mentionné à l’article L. 1123-1.
![]()
« Lorsque les recherches mentionnées au 2° de l’article L. 1121-1 figurent sur une liste fixée par arrêté du ministre chargé de la santé pris sur proposition du directeur général de l’Agence française de sécurité sanitaire des produits de santé, le comité de protection des personnes s’assure auprès de l’Agence française de sécurité sanitaire des produits de santé que l’utilisation des produits sur lesquels portent la recherche ne présente que des risques négligeables.
![]()
« En cas de doute sérieux sur la qualification d’une recherche au regard des trois catégories de recherches sur la personne définies à l’article L. 1121-1, le comité de protection des personnes saisit l’Agence française de sécurité sanitaire des produits de santé. » ;
![]()
4° Il est inséré un article L. 1121-8-1 ainsi rédigé :
![]()
« Art. L. 1121-8-1. – Les personnes qui ne sont pas affiliées à un régime de sécurité sociale ou bénéficiaires d’un tel régime ne peuvent être sollicitées pour se prêter à des recherches sur la personne que si ces recherches sont importantes en termes de santé publique, que des recherches d’une efficacité comparable ne peuvent être effectuées sur des personnes affiliées à un régime de sécurité sociale et dans les conditions suivantes :
![]()
« – soit l’importance du bénéfice escompté pour ces personnes est de nature à justifier le risque prévisible encouru ;
![]()
« – soit ces recherches se justifient au regard du bénéfice escompté pour d’autres personnes se trouvant dans la même situation juridique. Dans ce cas, les risques prévisibles et les contraintes que comporte la recherche doivent présenter un caractère minimal. » ;
![]()
5° Le cinquième alinéa de l’article L. 1121-11 est supprimé ;
![]()
6° À la première phrase du deuxième alinéa de l’article L. 1121-13, après les mots : « pour une durée déterminée, lorsqu’il s’agit de recherches », sont insérés les mots : « interventionnelles ou mentionnées au 2° de l’article L. 1121-1 » ;
![]()
7° L’article L. 1121-15 est complété par un alinéa ainsi rédigé :
![]()
« Les recherches mentionnées au 2° de l’article L. 1121-1 et les recherches non interventionnelles sont inscrites dans un répertoire rendu public dans des conditions définies par voie réglementaire. » ;
![]()
8° Le dernier alinéa de l’article L. 1121-16 est supprimé ;
![]()
9° Le dernier alinéa de l’article L. 1123-6 est supprimé ;
![]()
10° À l’article L. 1123-9, après les mots : « du comité et », sont insérés les mots : « , dans le cas de recherches interventionnelles, », et sont ajoutés deux alinéas ainsi rédigés :
![]()
« Lorsque la demande de modification substantielle engendre un doute sérieux sur la qualification d’une recherche au regard notamment des trois catégories de recherches sur la personne définies à l’article L. 1121-1, le comité de protection des personnes saisit l’Agence française de sécurité sanitaire des produits de santé.
![]()
« En cas d’avis défavorable du comité, le promoteur peut demander au ministre chargé de la santé de soumettre le projet de recherche, pour un second examen, à un autre comité désigné par le ministre, dans les conditions définies par voie réglementaire. » ;
![]()
11° Au 1° de l’article L. 1126-5, après les mots : « personnes et », sont insérés les mots : « , dans le cas de recherches interventionnelles, » ;
![]()
12° À l’article L. 1126-10, après le mot : « recherche », est inséré le mot : « interventionnelle » et, après les mots : « pour les administrer », sont insérés les mots : « ainsi que les produits autres que les médicaments faisant l’objet de la recherche » ;
![]()
13° L’intitulé du chapitre II est ainsi rédigé : « Information de la personne qui se prête à une recherche sur la personne et recueil de son consentement » ;
![]()
14° L’article L. 1122-1 est ainsi modifié :
![]()
a) Au 2°, après le mot : « attendus », sont insérés les mots : « et, dans le cas de recherches interventionnelles, » ;
![]()
b) Au début des 3° et 4°, sont insérés les mots : « Dans le cas de recherches interventionnelles, » ;
![]()
c) Au 5°, après les mots : « mentionné à l’article L. 1123-1 et », sont insérés les mots : «, dans le cas de recherches interventionnelles, » ;
![]()
d) Le huitième alinéa est ainsi rédigé :
![]()
« Il informe les personnes dont la participation est sollicitée ou, le cas échéant, les personnes, organes ou autorités chargés de les assister, de les représenter ou d’autoriser la recherche, de leur droit de refuser de participer à la recherche ou de retirer leur consentement, ou le cas échéant leur autorisation, à tout moment sans encourir aucune responsabilité ni aucun préjudice de ce fait. » ;
![]()
e) À la première phrase du neuvième alinéa, les mots : « ne porte que sur des volontaires sains et » sont supprimés ;
![]()
15° L’article L. 1122-1-1 est ainsi rédigé :
![]()
« Art. L. 1122-1-1. – Aucune recherche interventionnelle ne peut être pratiquée sur une personne sans son consentement libre et éclairé, recueilli par écrit ou, en cas d’impossibilité, attesté par un tiers, après que lui a été délivrée l’information prévue à l’article L. 1122-1. Ce dernier doit être totalement indépendant de l’investigateur et du promoteur.
![]()
« Aucune recherche mentionnée au 2° de l’article L. 1121-1 ne peut être pratiquée sur une personne sans son consentement libre et éclairé.
![]()
« Aucune recherche non interventionnelle ne peut être pratiquée sur une personne lorsqu’elle s’y est opposée. » ;
![]()
16° À la première phrase de l’article L. 1122-1-2 le mot : « biomédicales » est remplacé par les mots : « sur la personne », après les mots : « qui y sera soumise, », sont insérés les mots : « lorsqu’il est requis, » et, au deuxième alinéa de l’article L. 1122-1-4 nouveau, après les mots : « et son consentement », sont insérés les mots : « , lorsqu’il est requis, » ;
![]()
17° L’article L. 1122-2 est ainsi modifié :
![]()
a) Après le quatrième alinéa du II, il est ajouté un alinéa ainsi rédigé : « Par dérogation aux alinéas précédents, pour les recherches mentionnées aux 2° et 3° de l’article L. 1121-1, cette autorisation peut être donnée par le seul titulaire de l'exercice de l'autorité parentale présent. » ;
![]()
b) Le III est ainsi rédigé : « Le consentement prévu au troisième alinéa du II est donné dans les formes de l'article L. 1122-1-1. Les autorisations prévues aux premier, troisième et quatrième alinéas dudit II sont données par écrit. » ;
![]()
III – Le chapitre Ier du titre II du livre Ier de la première partie du même code est ainsi modifié :
![]()
1° Aux articles L. 1121-1, L. 1121-2, L. 1122-1, L. 1122-2, L. 1123-6, L. 1126-3, L. 1126-5 et L. 1126-7, au premier alinéa de l’article L. 1121-10 et au premier alinéa de l’article L. 1121-11, les mots : « recherche biomédicale » sont remplacés par les mots : « recherche sur la personne » ;
![]()
2° Au premier alinéa de l’article L. 1121-2 et au premier alinéa de l’article L. 1123-6, les mots : « sur l’être humain » sont supprimés ;
![]()
3° Au troisième alinéa de l’article L. 1121-3, les mots : « l’essai » sont remplacés par les mots : « la recherche » ;
![]()
4° Aux premier et cinquième alinéas de l’article L. 1121-3, au deuxième alinéa de l’article L. 1121-11, au premier alinéa de l’article L. 1121-13, au premier alinéa de l’article L. 1121-14 et au 12° de l’article L. 1123-14, le mot : « biomédicales » est supprimé ;
![]()
5° À la première phrase du septième alinéa de l’article L. 1121-3 et du troisième alinéa de l’article L. 1121-11, aux articles L. 1121-15, L. 1121-16, L. 1125-2 et L. 1125-3, le mot : « biomédicales » est remplacé par le mot : « interventionnelles » ;
![]()
6° Aux articles L. 1121-4, L. 1123-8, L. 1123-11, L. 1125-1 et au premier alinéa de l’article L. 1121-12, le mot : « biomédicale » est remplacé par le mot : « interventionnelle » ;
![]()
7° Aux articles L. 1121-5, L. 1121-6, L. 1121-7 et L. 1121-8 le mot : « biomédicales » est remplacé par les mots : « interventionnelles ou des recherches mentionnées au 2° de l’article L. 1121-1» ;
![]()
8° À l’article L. 1121-9 et au quatrième alinéa de l’article L. 1121-10, le mot : « biomédicale » est remplacé par les mots : « interventionnelle ou une recherche mentionnée au 2° de l’article L. 1121-1 » ;
![]()
9° À L’article L. 1123-8, les mots : « du présent article, du 2° de l’article L. 1121-1, » et : « du treizième alinéa de l’article L. 1123-7 » sont supprimés ;
![]()
10° À la première phrase du troisième alinéa de l’article L. 1121-10, les mots : « La recherche biomédicale » sont remplacés par les mots : « Toute recherche interventionnelle ou mentionnée au 2° de l’article L. 1121-1 » ;
![]()
11° a) Le premier alinéa de l’article L. 1123-11 est complété par les mots : « mentionnée au 1° de l’article L. 1121-1. » ;
![]()
b) Au deuxième alinéa de l’article L. 1123-11, le mot : « administrative » est supprimé ;
![]()
c) Le quatrième alinéa de l’article L. 1121-11 est ainsi rédigé :
![]()
« Le promoteur avise le comité de protection des personnes compétent et, pour les recherches mentionnées au 1° de l’article L. 1121-1, l’autorité compétente, que la recherche interventionnelle est terminée et indique les raisons qui motivent l’arrêt de cette recherche quand celui-ci est anticipé. » ;
![]()
12° Le quatrième alinéa de l’article L. 1121-11 est supprimé ;
![]()
13° À la première phrase de l’article L. 1123-2, le mot : « biomédical » est remplacé par les mots : « de la recherche sur la personne » ;
![]()
14° À la première phrase du dernier alinéa de l’article L. 1121-13 et au dernier alinéa de l’article L. 1125-1 le mot : « biomédicales » est supprimé et, à l’article L. 1126-10, le mot : « biomédicale » est supprimé ;
![]()
15° À la première phrase du premier alinéa de l’article L. 1123-10, après le mot : « recherche », sont insérés les mots : « sur la personne » et, à la première phrase du second alinéa du même article, après la référence : « L. 1123-9 », sont insérés les mots : « et pour toutes recherches portant sur la personne » ;
![]()
16° Le dernier alinéa de l’article L. 1123-12 est supprimé ;
![]()
17° Au 9° de l’article L. 1123-14, les mots : « l’Agence nationale d’accréditation et d’évaluation en santé » sont remplacés par les mots : « la Haute Autorité de santé » et le même article est complété par un 13° ainsi rédigé :
![]()
« 13° Le champ des recherches interventionnelles, des recherches mentionnées au 2° de l’article L. 1121-1 et des recherches non interventionnelles. » ;
![]()
IV. – L’article L. 1221-8-1 du même code est ainsi modifié :
![]()
a) Au premier alinéa, après le mot : « biomédicale, », la fin de la deuxième phrase et la troisième phrase sont remplacées par les mots : « soit dans le cadre d’une recherche sur la personne » et, à la dernière phrase, les mots : « lorsque le sang ou ses composants sont prélevés ou utilisés dans le cadre d’une activité de recherche biomédicale » sont remplacés par les mots : « relatives aux recherches sur la personne » ;
![]()
b) Les deuxième et troisième alinéas sont supprimés ;
![]()
V. – Le vingtième alinéa de l’article L. 5311-1 du même code est ainsi rédigé :
![]()
« L'agence participe à l'application des lois et règlements relatifs à certaines recherches sur la personne, celles définies au 1° de l’article L. 1121-1 et celles définies aux 2° et 3° de l’article L. 1121-1 lorsque ces recherches portent sur les produits mentionnés au présent article. L’agence prend, dans les cas prévus par des dispositions particulières, des décisions relatives à ces recherches. » ;
![]()
VI. – Les deux premiers alinéas de l’article 223-8 du code pénal sont remplacés par trois alinéas ainsi rédigés :
![]()
« Le fait de pratiquer ou de faire pratiquer sur une personne une recherche interventionnelle ou mentionnée au 2° de l’article L. 1121-1 du code de la santé publique sans avoir recueilli le consentement libre, éclairé et, le cas échéant, écrit de l’intéressé, des titulaires de l’autorité parentale ou du tuteur ou d’autres personnes, autorités ou organes désignés pour consentir à la recherche ou pour l’autoriser, dans les cas prévus par le code de la santé publique, est puni de trois ans d’emprisonnement et de 45 000 € d’amende.
![]()
« Les mêmes peines sont applicables lorsque la recherche interventionnelle ou la recherche mentionnée au 2° de l’article L. 1121-1 du code de la santé publique est pratiquée alors que le consentement a été retiré.
![]()
« Les mêmes peines sont applicables lorsqu’une recherche non interventionnelle est pratiquée alors que la personne s’y est opposée. » ;
![]()
VII. – Dans l’ensemble des autres dispositions législatives, les mots : « recherche biomédicale » sont remplacés par les mots : « recherche sur la personne » et les mots : « recherches biomédicales » sont remplacés par les mots : « recherches sur la personne ».
Article 2
![]()
L’article L. 1121-16-1 du code la santé publique est ainsi rédigé :
![]()
« Art. L. 1121-16-1. – On entend par recherches interventionnelles à finalité non commerciale, les recherches dont les résultats ne sont pas exploités à des fins lucratives, qui poursuivent un objectif de santé publique et dont le promoteur ou le ou ses investigateurs sont indépendants à l'égard des entreprises qui fabriquent ou qui commercialisent les produits faisant l’objet de la recherche.
![]()
« Les produits faisant l’objet d’une recherche interventionnelle sont fournis gratuitement par le promoteur pour la durée de la recherche interventionnelle à finalité non commerciale.
![]()
« Les caisses d’assurance maladie prennent en charge les produits faisant l’objet de recherches interventionnelles à finalité non commerciale dans les conditions suivantes :
![]()
« 1° Les médicaments bénéficiant d'une autorisation de mise sur le marché ou faisant l'objet d'une autorisation temporaire d’utilisation mentionnée au a de l'article L. 5121-12, inscrits sur la liste mentionnée à l'article L. 5123-2 ou sur la liste prévue à l'article L. 5126-4, ainsi que les produits inscrits sur la liste mentionnée à l'article L. 165-1 du code de la sécurité sociale ou pris en charge au titre des prestations d'hospitalisation mentionnées à l'article L. 162-22-6 du même code, lorsqu'ils sont utilisés dans le cadre d'une recherche interventionnelle à finalité non commerciale autorisée dans les conditions ouvrant droit au remboursement ;
![]()
« 2° À titre dérogatoire, les médicaments ou produits faisant l’objet d'une recherche interventionnelle autorisée à finalité non commerciale, lorsqu'ils ne sont pas utilisés dans des conditions ouvrant droit au remboursement, sous réserve de l'avis conforme de la Haute Autorité de santé et de l'avis conforme de l'Union nationale des caisses d'assurance maladie. Ces instances s’assurent de l'intérêt de ces recherches pour la santé publique et notamment pour l'amélioration du bon usage et pour l’amélioration de la qualité des soins et des pratiques. La décision de prise en charge est prise par arrêté des ministres chargés de la santé et de la sécurité sociale.
![]()
« Dans les cas mentionnés au 1° et 2° du présent article, le promoteur de la recherche interventionnelle s’engage à rendre publics les résultats de sa recherche.
![]()
« Lorsque la recherche ayant bénéficié d’une prise en charge ne répond plus à la définition d’une recherche interventionnelle à finalité non commerciale, le promoteur reverse les sommes engagées pour les recherches concernées aux régimes d’assurance maladie selon les règles prévues à l’article L. 138-8 du code de la sécurité sociale. Le reversement dû est fixé par décision des ministres chargés de la santé et de la sécurité sociale après que le promoteur concerné a été mis en mesure de présenter ses observations. Le produit du reversement est recouvré par les organismes mentionnés à l’article L. 213-1 du même code désignés par le directeur de l’Agence centrale des organismes de sécurité sociale. Le recours présenté contre la décision fixant ce reversement est un recours de pleine juridiction. Les modalités d’application du présent alinéa sont fixées par décret. »
Article 3
![]()
I. – L’article L. 1123-7 du code de la santé publique est ainsi modifié :
![]()
a) Au troisième alinéa, après les mots : « obtenir le consentement éclairé », sont insérés les mots : « , le cas échéant pour recueillir l’opposition » ;
![]()
b) Après le dixième alinéa, il est inséré un alinéa ainsi rédigé :
![]()
« – la pertinence scientifique et éthique des projets de constitution de collections d’échantillons biologiques au cours de recherches sur la personne, de conservation de ces collections à l’issue de ces recherches ainsi qu’en cas de changement substantiel de finalité par rapport au consentement initialement donné. » ;
![]()
c) Au onzième alinéa, après les mots : « de recherche », il est inséré le mot : « interventionnelle » et le treizième alinéa est supprimé.
![]()
II. – L’article L. 1243-3 du même code est ainsi modifié :
![]()
a) Le troisième alinéa est supprimé ;
![]()
b) Au quatrième alinéa, après les mots : « à l’exercice des activités ainsi déclarées si », sont insérés les mots : « la finalité scientifique de l’activité n’est pas établie, si » et la dernière phrase du même alinéa est supprimée ;
![]()
c) Les sixième et dernier alinéas sont supprimés ;
![]()
d) Le septième alinéa est ainsi rédigé :
![]()
« Les activités prévues au premier alinéa dans le cadre d’une recherche sur la personne sont régies par les dispositions spécifiques à ces recherches. » ;
![]()
III. – L’article L. 1243-4 du même code est ainsi modifié :
![]()
a) À la première phrase du premier alinéa, après les mots : « la conservation et la préparation de tissus et cellules », sont insérés les mots : « , des organes, du sang, de ses composants et de ses produits dérivés issus » ;
![]()
b) À la première phrase du même alinéa, les mots : « dans le cadre d’une activité commerciale, », « , y compris à des fins de recherche génétique », « , après avis du comité consultatif sur le traitement de l'information en matière de recherche dans le domaine de la santé, prévu à l'article 40-2 de la loi n° 78-17 du 6 janvier 1978 précitée » et la deuxième phrase du même alinéa sont supprimés ;
![]()
c) Le dernier alinéa est supprimé.
Article 4
![]()
I. – Le dernier alinéa de l’article L. 1123-1 du code de la santé publique est ainsi rédigé :
![]()
« Les comités sont dotés de la personnalité juridique de droit public. Ils exercent leur mission en toute indépendance. »
![]()
II. – À l’article L. 1123-5 du même code, après le mot : « comité », sont insérés les mots : « si l’activité de ce dernier est insuffisante ou ».
ANNEXE 1
SCHÉMAS SIMPLIFIÉS DU DÉROULEMENT DES RECHERCHES SUR LES PERSONNES

Procédures actuelles
Procédures mises en place par la proposition de loi
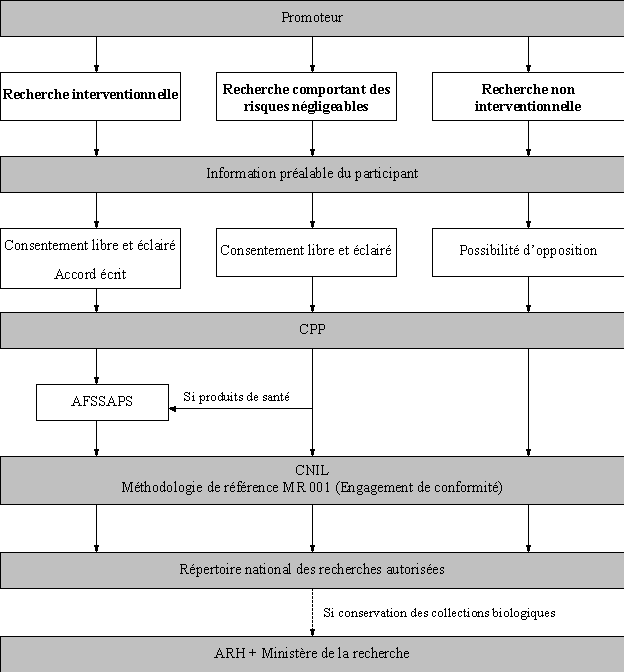
Ø M. Thierry de Rochegonde, président d’un comité de protection des personnes, et
Mme Gignon, enseignante à l’Université Paris-X
Ø Conférence nationale des présidents de comités de protection des personnes (CNCP) – Dr Elisabeth Frija-Orvoen, présidente
Ø Coordination des promoteurs institutionnels (CPI) – Dr Valérie Plattner, Mme Ingrid Cailles, Mme Annie Métro et M. Olivier Chassany
Ø Comité national de la recherche clinique (CNRC) – Pr. Philippe Ravaud et Pr. Loïc Guillevin
Ø Les entreprises du médicament (LEEM) – Mme Catherine Lassale, directrice scientifique et médicale, et Mme Aline Bessis, directrice des relations institutionnelles
Ø Syndicat national de l’industrie des technologies médicales (SNITEM) – Dr Jaber Bensenane, directeur des affaires médicales, économiques et techniques, et M. François-Régis Moulines, directeur des affaires publiques, juridiques et de la communication
Ø Comité national de coordination de la recherche (CNCR) – Pr. Jean-Michel Gomez, doyen de la faculté de médecine de Nantes, Dr Elisabeth Devilliers, directrice de la recherche clinique au CHU de Dijon, Dr Michel Slama, président de la commission médicale d’établissement du CHU d’Amiens, et Dr Odile Gelpi, directrice de la délégation à la recherche du CHU de Lyon
1 () Projet de loi de finances pour 2008, avis d’Olivier Jardé au nom de la commission des affaires culturelles, familiales et sociales sur les crédits de la recherche, n°277, tome 6.
2 () Article 318 du code pénal (ancien) : « Celui qui aura occasionné à autrui une maladie ou incapacité de travail personnel, en lui administrant volontairement, de quelque manière que ce soit, des substances qui, sans être de nature à donner la mort, sont nuisibles à la santé, sera puni d'un emprisonnement d'un mois à cinq ans et d'une amende de 60 F à 15 000 F ».
3 () Stéphane Brissy,Vers une extension de la notion de recherche biomédicale ?, Gazette du Palais du 28 décembre 2008.
4 () Sénat JO, séance du 15 avril 2004.
5 () Von Elm E, Altam DG, et al. The strengthening of the reporting of observational studies in epidemiology (STROBE), statement : guidelines for reporting observational studies. Plos Med 2007.
6 () Notamment François Lemaire, Sophie Ravoire et Danielle Golinelli.
7 () Directive 2001-20-CE du Parlement européen et du Conseil du 4 avril 2001 concernant le rapprochement des dispositions législatives, réglementaires et administratives des États membres relatives à l’application de bonnes pratiques cliniques dans la conduite d’essais cliniques de médicaments à usage humain.
8 () Depuis la loi n° 2008-337 du 15 avril 2008 ratifiant l’ordonnance n° 2007-613 du 26 avril 2007 portant diverses dispositions d’adaptation au droit communautaire dans le domaine du médicament, la seule autorité compétente dans le domaine des recherches biomédicales est l’Agence française de sécurité sanitaire des produits de santé (AFSSAPS), le ministère chargé de la santé lui ayant transféré l’intégralité de ses compétences en la matière.
9 () Rapport d’information n° 267 fait au nom de la commission des affaires sociales du Sénat sur le fonctionnement des comités consultatifs de protection des personnes en matière de recherche biomédicale, 6 avril 2001.
10 () La transformation des comités consultatifs de protection des personnes en matière de recherche biomédicale (CCPPRB) en comités de protection des personnes (CPP) en application de la loi du 9 août 2004, Mme Christine d’Autume, Mme Bernadette Roussille et M. Pierre Aballea, membres de l’Inspection générale des affaires sociales, remis en juillet 2005.
11 () Donnée au 1er octobre 2006, d’après les informations disponibles sur le site : http://www.recherchebiomedicale.sante.gouv.fr
