

N° 2206 -- ASSEMBLÉE NATIONALE CONSTITUTION DU 4 OCTOBRE 1958 DOUZIÈME LÉGISLATURE Enregistré à la Présidence de l'Assemblée nationale le 23 mars 2005. RAPPORT DÉPOSÉ en application de l'article 86, alinéa 8, du Règlement PAR LA COMMISSION DES AFFAIRES CULTURELLES, FAMILIALES ET SOCIALES sur la mise en application de la loi n° 2004-800 du 6 août 2004 ET PRÉSENTÉ PAR M. Pierre-Louis FAGNIEZ, Député. -- INTRODUCTION 5 I. PLUSIEURS DISPOSITIONS DE LA LOI NE REQUIÈRENT AUCUN TEXTE RÉGLEMENTAIRE POUR LEUR APPLICATION 7 A. LES ARTICLES D'APPLICATION DIRECTE 7 1. Droits de la personne et caractéristiques génétiques (titre II) 7 2. Don et utilisation des éléments du corps humain (titre III) 7 3. Protection juridique des inventions biotechnologiques (titre IV) 8 4. Produits de santé (titre V) 8 5. Procréation et embryologie (titre VI) 8 6. Dispositions diverses et transitoires (titre VII) 8 B. LES ARTICLES DONT L'APPLICATION EFFECTIVE EST DIFFÉRÉE 9 II. LA TRÈS GRANDE MAJORITÉ DES TEXTES NÉCESSAIRES À L'APPLICATION DE LA LOI N'A TOUJOURS PAS ÉTÉ PUBLIÉE 10 A. LA MISE EN PLACE DU DISPOSITIF TRANSITOIRE DE RECHERCHE SUR LES CELLULES SOUCHES EMBRYONNAIRES DÈS SEPTEMBRE 2004 10 B. UN RETARD IMPORTANT DANS LA PARUTION DES TEXTES RÉGLEMENTAIRES D'APPLICATION 10 1. Un taux d'exécution particulièrement faible 10 2. Ce retard trouve son origine dans plusieurs facteurs, dont la priorité donnée à l'application de la loi relative à l'assurance maladie 11 III. DE NOMBREUX TEXTES D'APPLICATION SONT CEPENDANT EN COURS DE PRÉPARATION OU DE CONCERTATION 13 A. UNE PREMIÈRE SÉRIE DE TEXTES DEVRAIT ÊTRE PUBLIÉE TRÈS PROCHAINEMENT 13 1. La mise en place prochaine de l'Agence de biomédecine permettra d'accélérer le processus de mise en œuvre de la loi 13 2. D'autres textes importants devraient également être publiés rapidement 13 B. LA PUBLICATION D'UNE DEUXIEME SÉRIE DE TEXTES EST PROGRAMMÉE A PARTIR DE JUILLET 2005 14 TRAVAUX DE LA COMMISSION 19 ANNEXE 1 : Tableau de suivi de la mise en application de la loi n° 2004-800 du 6 août 2004 relative a la bioéthique 25 ANNEXE 2 : Liste des sigles et acronymes utilisés 30 « Ne me parlez pas de vos efforts. Parlez-moi de vos résultats. » (James Joseph Ling) Déposé en juin 2001, avec déjà deux ans de retard par rapport à l'échéance de révision fixée par les trois lois de juillet 1994 (1), le projet de loi sur la bioéthique a connu un cheminement pour le moins laborieux. Fruit d'un long travail gouvernemental et parlementaire sous deux législatures différentes, ce projet de loi a été examiné au cours de deux lectures par chaque assemblée, auxquelles a succédé la convocation d'une commission mixte paritaire. La discussion a été nourrie, les apports parlementaires nombreux et riches. Ce temps du débat était nécessaire et légitime, compte tenu de l'importance des enjeux soulevés et de la difficulté, dans un environnement en constante évolution, de construire un équilibre normatif entre des principes parfois contradictoires, tant il est vrai, comme le soulignait le philosophe Hans Jonas, que « le Prométhée, définitivement déchaîné, réclame une éthique ». (2) Déclarée conforme à la Constitution(3) et enfin promulguée au Journal officiel le 7 août 2004, la loi n° 2004-800 du 6 août 2004 relative à la bioéthique traite de questions aussi fondamentales que l'éthique et la biomédecine, le don et l'utilisation des éléments du corps humain, les droits de la personne, le principe de non-brevetabilité du corps humain ou de la simple découverte d'un de ses éléments ainsi que la procréation et l'embryologie. Le rythme imprimé à la publication des textes réglementaires d'application n'a pourtant pas contribué, loin s'en faut, à compenser le retard accumulé au cours de ces dernières années. C'est pourquoi, conformément aux dispositions prévues par le 8 de l'article 86 du Règlement de l'Assemblée nationale, le présent rapport propose, dans un premier temps, de rappeler l'ensemble des articles d'application directe de la loi, avant de dresser le bilan de la mise en application de ses autres dispositions, plus de six mois après la promulgation de la loi. Une dernière partie sera consacrée à l'état d'avancement des principaux textes réglementaires restant à paraître, à partir des informations recueillies par le rapporteur auprès du gouvernement, qui sont présentées de manière exhaustive en annexe. A titre liminaire, il est important de rappeler qu'en application des articles 21 et 37 de la Constitution et conformément au principe de séparation des pouvoirs, il appartient à l'exécutif, titulaire du pouvoir réglementaire, de déterminer le contenu et le nombre des textes nécessaires à l'application de la loi et, s'il le juge opportun, de compléter ou préciser par voie réglementaire des dispositions de la loi ne prévoyant la parution d'aucun texte pour leur application. I. PLUSIEURS DISPOSITIONS DE LA LOI NE REQUIÈRENT AUCUN TEXTE RÉGLEMENTAIRE POUR LEUR APPLICATION Sur les 40 articles de la loi, 24 ne renvoient pas directement pour leur application à un texte de nature réglementaire et sont donc devenus applicables, dans leur très grande majorité, dès le lendemain de la publication de la loi au Journal officiel, soit le 8 août 2004 (4). Parmi ceux-ci, certains ont une date d'application différée. A. LES ARTICLES D'APPLICATION DIRECTE 1. Droits de la personne et caractéristiques génétiques (titre II) Art. 4 - Les conditions d'examen des caractéristiques génétiques d'une personne sont précisées : l'examen ne peut être entrepris qu'à des fins médicales ou de recherche scientifique et exige le consentement exprès de la personne. 2. Don et utilisation des éléments du corps humain (titre III) Art. 8 - L'article fixe le régime du prélèvement, de la distribution et de l'utilisation du sang et de ses composants. Art. 10 - Le code du service national prévoit qu'une information doit être délivrée sur les modalités de consentement au don d'organes à fins de greffe. Art. 11 - Tous les établissements de santé participent à l'activité de prélèvement d'organes ou de tissus. Art. 13 - Les comités de protection des personnes sont sollicités en cas de constitution d'une collection d'échantillons biologiques et de changement de finalité d'utilisation à des fins scientifiques d'éléments du corps humain. Art. 15 et 16 - Il s'agit de dispositions pénales relatives au non-respect des dispositions régissant le prélèvement d'organes, de tissus, de cellules ou de produits du corps humain. 3. Protection juridique des inventions biotechnologiques (titre IV) Art. 17 et 18 - Les conditions de brevetabilité d'une invention constituant l'application technique d'une fonction d'un élément du corps humain sont précisément encadrées. Il est à noter qu'un rapport d'évaluation des conséquences des dispositions prévues par l'article 17 doit être remis au Parlement dans un délai de trois ans. Les conditions d'exploitation des brevets sont précisées, à travers le renforcement du régime des licences obligatoires de dépendance et des licences d'office prises dans l'intérêt de la santé publique. 4. Produits de santé (titre V) Art. 20 - Il s'agit de dispositions pénales relatives aux conditions de constitution, de distribution, de cession, d'importation ou d'exportation de préparations de thérapie génique ou de thérapie cellulaire xénogénétique. 5. Procréation et embryologie (titre VI) Art. 21 - Le clonage reproductif est interdit, soit toute intervention ayant pour but de faire naître un enfant génétiquement identique à une autre personne vivante ou décédée. Art. 28 et 29 - Sont pénalement sanctionnés le clonage reproductif et l'eugénisme, en tant que « crime contre l'espèce humaine », ainsi que les infractions en matière d'éthique biomédicale, dont le délit de clonage à des fins thérapeutiques ou de recherche. La propagande en faveur du clonage reproductif et l'eugénisme ou l'incitation à ces infractions sont pénalement sanctionnées. Art. 30 et 31 - En cas de condamnations pénales pour infraction contre l'espèce humaine, la dissolution civile de mouvements sectaires peut être prononcée. Les associations de lutte contre les sectes peuvent exercer les droits reconnus à la partie civile pour cette infraction, de nature criminelle ou délictuelle. Art. 32 - Les dispositions concernant le régime pénal applicable en cas d'infraction aux prescriptions relatives au clonage reproductif, l'eugénisme et la recherche sur l'embryon sont reprises dans le code de la santé publique. 6. Dispositions diverses et transitoires (titre VII) Art. 33 - Les mandats des membres des comités d'experts chargés d'autoriser les prélèvements de moelle osseuse sur mineurs, conformément aux dispositions applicables avant l'entrée en vigueur de la loi, sont prorogés jusqu'à l'installation des comités prévus par les article 9 et 12 de la loi (cf. infra). Art. 34 et 35 - Un régime transitoire est mis en place concernant les autorisations délivrées aux établissements de santé pour effectuer des prélèvements de moelle osseuse ou de cellules hématopoïétiques (5). De même, des équivalences sont établies entre les autorisations accordées sous la précédente réglementation pour les produits de thérapie cellulaire et génique et celles prévues par les articles 12 et 19 de la loi. Art. 36 - Un régime transitoire est prévu pour la mise en conformité des organismes se livrant à des activités de conservation et de cession d'éléments du corps humain à des fins de recherche avec les obligations posées par l'article 12. Art. 38 - Sont prorogés de deux ans les autorisations et agréments délivrés pour la réalisation des examens des caractéristiques génétiques d'une personne et les pratiques de diagnostic prénatal (DPN), de diagnostic préimplantatoire (DPI) et d'assistance médicale à la procréation (AMP). En outre, plusieurs dispositions d'autres articles de la loi, nécessitant par ailleurs la parution de textes réglementaires, sont également devenues immédiatement applicables. C'est le cas, par exemple, de la prise en charge intégrale des frais de prélèvement et de collecte par les établissements de santé (art. 7), du caractère de priorité nationale de la greffe et du prélèvement d'organes et du principe d'équité dans la répartition et l'attribution des greffons (art. 9). B. LES ARTICLES DONT L'APPLICATION EFFECTIVE EST DIFFÉRÉE L'application effective de trois autres articles de la loi, ne renvoyant pas à un texte réglementaire pour leur application, a été reportée par la loi à une date ultérieure à celle de sa promulgation. Art. 22 - Au plus tard le 7 août 2005, le gouvernement doit déposer au Parlement un rapport sur les initiatives qu'il aura prises pour élaborer une législation internationale réprimant le clonage reproductif. Art. 26 - Six mois avant la fin de la période de cinq ans pendant laquelle la recherche sur l'embryon est autorisée à titre dérogatoire (6), l'Agence de la biomédecine (ABM) et l'Office parlementaire d'évaluation des choix scientifiques et technologiques (OPESCT) devront établir un rapport évaluant les résultats respectifs des recherches sur les cellules souches embryonnaires et adultes. Art. 40 - Après l'évaluation de son application par l'OPECST dans un délai de quatre ans, la loi doit faire l'objet d'un nouvel examen d'ensemble par le Parlement au plus tard cinq ans après son entrée en vigueur. II. LA TRÈS GRANDE MAJORITÉ DES TEXTES NÉCESSAIRES À L'APPLICATION DE LA LOI N'A TOUJOURS PAS ÉTÉ PUBLIÉE Seize articles de la loi renvoient au moins une fois pour leur application à la parution d'un texte réglementaire. Le rapporteur ne peut dès lors que regretter qu'à ce jour seuls les textes d'application de l'article 37 aient été publiés. A. LA MISE EN PLACE DU DISPOSITIF TRANSITOIRE DE RECHERCHE SUR LES CELLULES SOUCHES EMBRYONNAIRES DÈS SEPTEMBRE 2004 Art. 37 - Afin de ne pas retarder l'application de la loi en matière de recherche sur les cellules souches embryonnaires et, en particulier, permettre aux chercheurs de postuler à l'appel d'offres européen prévu pour le financement de ces recherches, dont la clôture était fixée à l'automne 2004, cet article prévoit la mise en place d'un régime transitoire jusqu'à la date de nomination du directeur de l'Agence de la biomédecine et de publication du décret prévu par l'article 25. Premier texte d'application de la loi, le décret n° 2004-1024 du 28 septembre 2004, complété par un arrêté de même date et par un arrêté du 28 octobre 2004, a permis de mettre en place rapidement ce dispositif, conformément aux engagements pris par le ministre chargé de la santé devant la représentation nationale. La publication, le 16 février 2005, de trois arrêtés conjoints des ministres chargés de la santé et de la recherche autorisant l'importation, la conservation et l'utilisation de cellules souches à des fins de recherche a ainsi constitué la première mise en œuvre de ce régime transitoire. B. UN RETARD IMPORTANT DANS LA PARUTION DES TEXTES RÉGLEMENTAIRES D'APPLICATION 1. Un taux d'exécution particulièrement faible Selon le ministère des solidarités, de la santé et de la famille (cf. tableau en annexe 2), l'application de la loi nécessite la parution de 47 textes de nature réglementaire (une ordonnance (7), 24 décrets et 22 arrêtés), parmi lesquels trois ont été publiés. Au 30 novembre 2004, le taux d'exécution de la loi, défini comme la proportion entre le nombre de décrets publiés et le nombre de ceux prévus par la loi, était ainsi de 4 %, selon les informations communiquées par le Secrétariat général du gouvernement. Ce taux est malheureusement identique au 23 mars 2005, puisque aucun nouveau texte réglementaire n'a depuis lors été publié. Sur les seize articles de la loi nécessitant la parution d'un ou plusieurs textes réglementaires pour leur application, un seul article est donc aujourd'hui applicable, comme l'indique le graphique présenté ci-après. En d'autres termes, plus de sept mois après la publication de la loi, la quasi-totalité (93 %) de ces articles sont inapplicables du fait de l'absence de texte réglementaire. La situation est donc très insatisfaisante.   NB : pourcentages exprimés en nombres d'articles de la loi Source : graphique réalisé d'après les informations communiquées par le ministère des solidarités, de la santé et de la famille et présentées en annexe 2. Ce retard trouve son origine dans plusieurs facteurs, dont la priorité donnée à l'application de la loi relative à l'assurance maladie Conscient de l'importance de ce texte et de la nécessité de le mettre en œuvre rapidement, le ministre chargé de la santé s'était engagé (8) « à accélérer au maximum la rédaction des décrets afin que [ce] travail trouve une application rapide ». Dans les faits, la mise en œuvre de la loi s'est toutefois heurtée à plusieurs obstacles. - Préalablement à la publication de nombreux textes d'application, le gouvernement est tout d'abord tenu de recueillir l'avis de multiples acteurs. Par exemple, le décret en Conseil d'Etat relatif à la mise en place de l'Agence de biomédecine nécessite la consultation d'une dizaine d'organismes (cf. annexe 2). - La loi concerne par ailleurs des sujets très techniques. La rédaction des textes d'application est rendue d'autant plus complexe. Elle est également difficile en raison de l'évolution de l'environnement juridique, notamment des normes fixées par les institutions de l'Union européenne (9). L'élaboration des textes d'application a parfois nécessité des concertations interministérielles et une collaboration étroite entre les services du ministère des solidarités, de la santé et de la famille et ceux du ministère de l'éducation nationale, de l'enseignement supérieur et de la recherche. - Enfin, la coordination avec la rédaction des textes d'application d'autres textes législatifs (10) portant sur des thèmes « sanitaires » a constitué un facteur de complexité supplémentaire. A cet égard, le rapporteur comprend qu'une priorité politique a été donnée à la rédaction et à la publication des textes d'application de la loi relative à l'assurance maladie. Ce travail a énormément sollicité les services de la direction de la sécurité sociale (DSS) et ceux de la direction générale de la santé (DGS), cette dernière étant également chargée de la rédaction des textes règlementaires d'application de la loi relative à la politique de santé publique. Or, suivant un constat déjà établi depuis plusieurs années par de nombreux observateurs, les services du ministère en charge de la santé souffrent d'un certain manque de moyens en personnel, compte tenu des compétences à exercer et de leur extension croissante. Ce problème persistant, même si des agences sanitaires chargées d'exercer des compétences autrefois dévolues au ministère sont créées, est particulièrement préjudiciable lorsqu'il s'agit de piloter l'élaboration, la signature et la publication de textes règlementaires d'application. Ce diagnostic est confimé par les récents développements du dernier rapport public annuel de la Cour des comptes (11)consacrés à la DGS, qui souligne notamment que « la situation des ressources humaines de la DGS continue de comporter des faiblesses structurelles ». III. DE NOMBREUX TEXTES D'APPLICATION SONT CEPENDANT EN COURS DE PRÉPARATION OU DE CONCERTATION A ce jour, la mise en application de la loi nécessite encore la parution de 44 textes réglementaires, dont 23 décrets et 20 arrêtés, qui devrait intervenir d'ici quelques semaines pour plusieurs d'entre eux. A. UNE PREMIÈRE SÉRIE DE TEXTES DEVRAIT ÊTRE PUBLIÉE TRÈS PROCHAINEMENT 1. La mise en place prochaine de l'Agence de biomédecine permettra d'accélérer le processus de mise en œuvre de la loi Art. 2 - L'installation de l'Agence de biomédecine (ABM) constituera un pas important dans la mise en application de la loi. Les textes d'application relatifs à l'agence (un décret en Conseil d'Etat et trois décrets simples) et le décret de nomination du directeur général devraient être publiés dans les prochaines semaines. Le décret précisant les conditions de sa mise en place a été transmis au Conseil d'Etat et pourrait être publié dès avril. Il est également à noter que les crédits de fonctionnement de l'agence sont prévus en loi de finances initiale pour 2005. Dès la nomination de son directeur, la quasi-totalité des dispositions de l'article 2, l'un des articles les plus importants de la loi, entrera ainsi en vigueur. Art. 3 - Il en est de même pour cet article, qui prévoit que le transfert de fichiers de donneurs volontaires de cellules hématopoïétiques à l'ABM intervient dans un délai de six mois après la publication du décret nommant le directeur général de l'agence. L'analyse d'un rapport de l'Inspection générale des affaires sociales (IGAS) permettra de procéder à ce transfert dans les meilleures conditions. Le fonctionnement de l'Agence permettra d'imprimer à la sortie des textes d'application un rythme plus rapide, l'applicabilité de nombreuses dispositions étant suspendue à la mise en place de cet organisme. Par exemple, l'article 12 relatif au régime juridique du prélèvement de tissus, cellules et produits du corps humain comporte plusieurs dispositions exigeant l'avis préalable de l'ABM (12). 2. D'autres textes importants devraient également être publiés rapidement Art. 1er - La rédaction des décrets relatifs au Conseil consultatif national d'éthique (CCNE) a pris un certain retard, alors même que l'essentiel de l'article était rédigé dès l'adoption du projet de loi en deuxième lecture, en décembre 2003. Il devrait néanmoins être publié en avril. Art. 7 - Le décret en Conseil d'Etat relatif aux règles sanitaires applicables au prélèvement d'éléments et la collecte de produits du corps humain, texte de nature très technique, devrait être également publié en avril. Art. 9 - En avril et mai devraient être publiés deux décrets en Conseil d'Etat particulièrement importants, relatifs aux comités d'experts en matière de prélèvement d'organes et de cellules sur personne vivante et aux conditions dans lesquelles le prélèvement d'organes et de tissus est autorisé. Art. 12 et 27- Les conditions dans lesquelles le prélèvement de cellules est autorisé, y compris les tissus et les cellules embryonnaires et fœtaux, seront précisées par un décret en Conseil d'Etat, qui devrait être publié en juin. Pour les services concernés du ministère des solidarités, de la santé et de la famille, la publication de ce texte important constitue une priorité. B. LA PUBLICATION D'UNE DEUXIEME SÉRIE DE TEXTES EST PROGRAMMÉE A PARTIR DE JUILLET 2005 Selon le calendrier prévisionnel transmis par le gouvernement, l'ensemble des décrets d'application de la loi ne serait publié qu'en octobre prochain, soit plus d'an après l'entrée en vigueur de la loi. Le rapporteur, qui regrette le retard accumulé, prend néanmoins acte de ces perspectives en formulant le vœu que ce calendrier, même s'il est très insatisfaisant, soit effectivement tenu. Art. 5 - Le décret en Conseil d'Etat relatif aux conditions d'examen des caractéristiques génétiques devrait être publié en octobre. Cependant, ce retard peut être expliqué par la nécessité de procéder à des consultations et des avis ainsi que par le caractère très délicat des procédures à mettre en place. Art. 7 - Concernant le régime juridique de la collecte, le prélèvement et l'utilisation d'éléments et de produits du corps humain, trois décrets en Conseil d'Etat seront publiés en septembre, dont celui relatif à l'information des jeunes sur le prélèvement d'organes. Art. 9 - En septembre 2005 serait publié le décret fixant les conditions de délivrance, de modification, de renouvellement, de suspension et de retrait des autorisations d'importation et d'exportation des organes, des tissus et des cellules. Art. 12 - Les deux décrets en Conseil d'Etat, l'un relatif aux conditions d'autorisation des établissements préparant les tissus et aux conditions d'autorisation des tissus et de leurs procédés de préparation et l'autre relatif aux établissements préparant des produits de thérapie cellulaire et aux conditions d'autorisation de ces produits, pourraient également être publiés en septembre prochain. Art. 19 - Le nouveau régime juridique des produits de thérapie génique et des préparations de thérapie cellulaire xénogénétique nécessite la parution d'un décret en Conseil d'Etat relatif à la délivrance d'autorisations aux établissements et aux conditions d'intervention de l'AFSSAPS, qui devrait intervenir en septembre. Selon les informations fournies au rapporteur, la complexité de l'élaboration des textes règlementaires d'application tient en partie à la difficulté introduite par la définition du statut des organismes génétiquement modifiés. Art. 23 - Les modalités d'application des dispositions relatives au DPN et au DPI doivent être fixées par un décret en Conseil d'Etat. Le rapporteur souligne à cet égard l'importance de mettre en œuvre rapidement et conformément aux intentions du législateur l'extension encadrée du champ du DPI, dite « bébé du double espoir ». Cinq arrêtés sont en cours de préparation concernant notamment les conditions d'agrément des praticiens habilités à réaliser ces diagnostics. Art. 24 - Le décret en Conseil d'Etat visant à préciser les modalités d'application des prescriptions en matière d'assistance médicale à la procréation (AMP) et de don de gamètes doit être publié d'ici août prochain. Trois arrêtés sont également en cours de préparation. L'application effective de cet article, de même que l'application des articles 12 et 23, nécessite enfin la mise en place de l'ABM, puisqu'elle sera chargée de délivrer les autorisations nécessaires. Art. 25 - Un décret en Conseil d'Etat doit définir les modalités d'application des dispositions relatives à la recherche sur l'embryon et les cellules embryonnaires. En cours de rédaction, ce texte pourrait être publié en août prochain. Le dispositif transitoire prévu à l'article 37 permet toutefois déjà d'importer et de conserver des cellules souches embryonnaires (cf. supra). Ainsi, 33 textes d'application de la loi devraient être publiés d'ici octobre, comme l'indique l'histogramme ci-après. Toutefois, même si ce calendrier était respecté, il resterait encore 10 arrêtés à paraître d'ici juin 2006, soit près de 24 mois après la publication de la loi. Parmi eux figure notamment le guide des bonnes pratiques en génétique. Cette situation est très regrettable ! Evolution prévisionnelle du rythme de parution, entre avril et novembre 2005, des textes d'application de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique 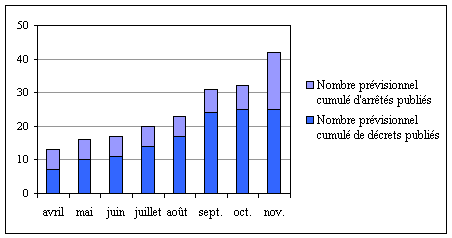 Source : Graphique réalisé d'après les informations communiquées par le ministère des solidarités, de la santé et de la famille et présentées en annexe * La mise en application de la loi relative à la bioéthique connaît un très grand retard. Même si le rapporteur est tout à fait conscient du travail important réalisé par les services du ministère, en particulier la DGS, il estime essentiel d'en comprendre les raisons et d'en tirer les conclusions nécessaires, afin d'éviter l'enlisement du texte et veiller à ce que d'autres textes législatifs ne connaissent pas à l'avenir un sort identique. A cet égard, il serait très opportun, en amont, que le gouvernement veille à mieux organiser le travail parlementaire, afin d'éviter, en aval, un effet d'engorgement au stade de la rédaction des décrets. Comment en effet s'étonner de ce retard dans la mise en application de la loi alors que trois textes majeurs dans le domaine de la santé (13), représentant au total plus de 400 pages au Recueil des lois, ont été promulgués pratiquement la même semaine au Journal officiel ? Rétrospectivement, le retard pris dans l'inscription à l'ordre du jour de l'Assemblée nationale du projet de loi relatif à la bioéthique, après son adoption par le Sénat en première lecture, est d'autant plus regrettable. Dans le même sens, il serait également souhaitable que le travail de rédaction des textes réglementaires soit engagé avant même la promulgation de la loi, au moins pour les articles votés conformes par les deux assemblées. Quant à la méthode de mise en application de la loi, des efforts sont encore à produire, en termes notamment de programmation et de suivi. En particulier, sur le modèle de loi relative à l'assurance maladie, il serait très opportun de définir des niveaux de priorités et des objectifs chiffrés de publication des principaux textes d'application et de suivre très régulièrement leur état d'avancement ou encore de proposer, par exemple sur le site Internet du ministère, une présentation didactique de la loi destinée au grand public et aux professionnels. Pour certains textes particulièrement complexes, la DGS pourrait par ailleurs utilement s'appuyer sur des missions d'expertise technique, par exemple de l'IGAS. En tout état de cause, il est aujourd'hui urgent d'accélérer le mouvement, car la mise en œuvre de la loi est attendue avec impatience par les patients, les familles, les professionnels de santé et les chercheurs. Faut-il enfin rappeler qu'une nouvelle révision de la loi doit avoir lieu dans à peine un peu plus de quatre ans, ce qui suppose, pour avoir un recul suffisant, qu'elle soit pleinement applicable et appliquée aussi rapidement que possible ? TRAVAUX DE LA COMMISSION En présence de M. Philippe Douste-Blazy, ministre des solidarités, de la santé et de la famille, et de M. Xavier Bertrand, secrétaire d'Etat à l'assurance maladie, la commission a examiné, au cours de sa réunion du mercredi 23 mars 2005, le rapport de M. Pierre-Louis Fagniez sur la mise en application de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique. Un débat a suivi l'exposé du rapporteur. M. Alain Claeys, pour le groupe socialiste, a considéré, comme le rapporteur, que l'urgence porte sur la création de l'Agence de biomédecine et la définition des modalités d'application de l'article 23 relatif au DPI, en particulier sur l'élargissement de son champ. Il faut d'ailleurs rappeler, concernant ce type de diagnostic, que les dispositions de la loi du 29 juillet 1994 relative au don et à l'utilisation des éléments et produits du corps humain sont longtemps restées inappliquées faute de parution des textes réglementaires nécessaires. Il faut donc éviter que cette situation se reproduise. De façon plus générale, il serait souhaitable que le gouvernement charge une instance de réfléchir à la question du clonage thérapeutique, puisque la plus grande confusion règne à ce sujet au niveau international. A l'initiative des Etats-Unis, l'Organisation des nations unies (ONU) a en effet adopté une déclaration condamnant toutes les formes de clonage des êtres humains, sans faire aucune distinction entre clonage reproductif et clonage thérapeutique, la France ayant semble-t-il voté contre. Il est donc important de faire le point sur le clonage thérapeutique et ce serait certainement le rôle de l'Agence que d'éclairer le Parlement et le gouvernement sur cette question. Il apparaît enfin nécessaire de réactiver l'initiative franco-allemande qui avait été engagée sur ce sujet il y a quelques années. M. Jean-Luc Préel, pour le groupe UDF, s'est tout d'abord félicité de la tenue de cette réunion importante, première de son espèce, qui permet d'assurer le suivi de l'application de textes législatifs. Il serait cependant souhaitable que ce travail d'évaluation et de suivi soit poursuivi afin notamment de veiller à ce que les textes d'application soient réellement conformes à l'esprit de la loi, puisque cela n'a pas toujours été le cas, loin s'en faut. Par ailleurs, le ministre pourrait-il préciser les initiatives internationales que le gouvernement entend prendre en matière de clonage reproductif, conformément à l'article 22 de la loi, et plus largement sur l'ensemble des questions relatives à la bioéthique ? Enfin, compte tenu du grand retard pris dans l'application de la loi relative à la bioéthique, il est indispensable, comme l'a très justement souligné le rapporteur, d'accélérer le mouvement. Le président Jean-Michel Dubernard a observé que ce n'est malheureusement pas la première fois que des retards sont constatés concernant l'application d'un texte relatif à la bioéthique. En réponse aux intervenants et après s'est déclaré très heureux d'avoir été invité à faire le point sur l'application de trois lois adoptées en août 2004, M. Philippe Douste-Blazy, ministre des solidarités, de la santé et de la famille, a apporté les précisions suivantes : - S'agissant de l'Agence de la biomédecine, le décret relatif aux modalités de sa constitution a été examiné hier en Conseil d'Etat. Il devrait donc pouvoir être publié en avril, ce qui permettra, après la nomination de sa directrice générale, de procéder au lancement attendu par tous de l'agence. Les réflexions sont déjà avancées afin que les nominations aux conseils d'administration et d'orientation aient lieu en même temps. La nouvelle agence, à la différence des précédentes créations, est bâtie sur des fondations solides, un travail préparatoire minutieux ayant été réalisé pour permettre une montée en puissance accélérée. Ainsi, l'Etablissement français des greffes (EFG) a déménagé au début de l'année pour permettre l'accueil de nouveaux personnels. Les travaux engagés par l'Inspection générale des affaires sociales (IGAS) sur le transfert à l'agence des fichiers détenus par l'association « France Greffe de moelle » devraient permettre l'intégration des personnels de l'association dans de bonnes conditions. Le contrat d'objectif et de moyens de l'agence est également en préparation. - S'agissant du clonage thérapeutique, la France doit en effet prendre très rapidement une initiative au niveau international. - Le décret relatif au DPN et au DPI est d'une rédaction délicate en raison de sa technicité et des sujets abordés. C'est en particulier le cas pour l'extension du champ du DPI, dite « bébé du double espoir ». Ce texte est également complexe par l'importance des dispositions à caractère médical et scientifique qu'il contient et la nécessité de prendre en compte l'évolution des techniques et des connaissances en matière de DPI. Son élaboration nécessite par ailleurs une phase importante de concertation avec les différents professionnels concernés, qui a récemment commencée. Le décret sera soumis au Conseil d'Etat courant juillet et publié en août. S'agissant des arrêtés d'application, qui requerront l'expertise préalable de l'Agence de biomédecine, les principaux d'entre eux pourront être publiés à l'automne 2005. - La préparation de la révision de la loi sur la bioéthique reposera sur deux paramètres : l'évaluation des politiques relatives à l'ensemble des domaines de la bioéthique, qui nécessitent des ajustements des dispositifs mis en place, et les évolutions médicales et scientifiques, ces dernières ayant pesé particulièrement lourd dans la révision de la loi de 1994, et c'est ce qui a retardé les échéances fixées par les lois de juillet 1994. Compte tenu de la rapidité et du caractère difficilement maîtrisable des progrès scientifiques, un travail de réflexion approfondi s'impose quant aux réponses à y apporter, car elles ont une portée sociétale importante et peuvent engager une certaine vision de l'humanité, s'agissant notamment du statut de l'embryon ou du clonage. Ce travail d'évaluation tiendra compte des rapports annuels et des analyses de l'Agence de biomédecine. Enfin, la législation en matière de bioéthique ne peut plus se concevoir dans un contexte exclusivement national. Ainsi, au regard de l'expérience passée, le dispositif d'évaluation de la loi est-il conçu à présent pour être pleinement intégré à l'application même du texte. - La parution du décret relatif à la recherche sur l'embryon et les cellules souches embryonnaires est effectivement prévue pour août. Dans l'attente de ce texte, qui confiera à l'agence la responsabilité de délivrer les autorisations nécessaires, le dispositif transitoire pris en application de l'article 37 continuera de fonctionner pour les cellules souches importées. La rédaction du décret bénéficiera de l'expertise scientifique et éthique du conseil d'orientation de l'agence, qui sera consulté sur les protocoles de recherches dans le cadre du dispositif prévu. - S'agissant de la situation de la DGS, force est de reconnaître que les dispositions réglementaires concernant la loi relative à la bioéthique demandent un temps de rédaction beaucoup plus long que celles concernant la loi relative à l'assurance maladie. De plus, il est exceptionnel qu'une même direction - la DGS - ait à traiter de trois lois en même temps. Or, comme le note le rapport de la Cour des comptes, cette direction a d'autres missions essentielles : la gestion des alertes sanitaires, la préparation de plans de réponses à des situations exceptionnelles - pandémie grippale ou plans de lutte contre des actes bioterroristes - et le pilotage des plans de santé, notamment ceux prévus par la loi du 9 août 2004 relative à la politique de santé publique. Même si le calendrier présenté apparaît bien tardif à certains, il faut savoir que la DGS a accompli un effort très important. Au cours des dernières années, cette direction a réussi à préparer, en moyenne, une vingtaine de décrets par an. Or actuellement, il lui est demandé d'en élaborer plus de quatre-vingt-dix tout en poursuivant la transposition des directives avec des délais de retard en nette diminution. On ne saurait donc imaginer que la DGS « traîne les pieds ». M. Jean-Marie Le Guen s'est félicité de l'innovation que constitue cette réunion, en soulignant, pour éviter toute ambiguïté, qu'il s'en tiendrait strictement aux questions relatives à l'application de la loi, sans traiter du fond. Les décrets d'application étant encore loin d'être tous parus, il serait très souhaitable que le ministre prenne l'engagement de revenir dans quelques mois devant la commission pour en décrire la teneur. Cela vaut particulièrement pour ceux qui concernent le DPI et la création de l'Agence de biomédecine, d'une urgence particulière. Le président Jean-Michel Dubernard a souligné que la commission entendait jouer sans relâche son rôle de contrôle et s'est dit certain que, dans ce cadre, le ministre et le secrétaire d'Etat accepteront de s'exprimer à nouveau sur l'application de la loi. M. Jean-Marie Le Guen a souhaité un engagement plus précis et plus ferme. Quant aux observations formulées par la Cour des comptes à propos de la DGS, surchargée de travail, le ministre pourrait-il indiquer les conclusions qu'il a tirées de la recommandation tendant à doter cette direction de nouveaux outils et si des conséquences budgétaires en découleraient ? Le ministre a souligné qu'il reviendrait avec plaisir devant la commission s'il y était convié, à l'automne par exemple, lorsque la rédaction des décrets serait bien avancée. La Cour des comptes a consacré un chapitre de son rapport annuel à la DGS, qui doit en effet être réorganisée pour tenir compte de l'évolution et de l'accroissement de ses missions. Dans cette perspective, il convient tout d'abord d'améliorer la prise en compte des situations urgentes et exceptionnelles et de doter la DGS d'une réactivité supérieure, même si des efforts ont été entrepris dans ce sens, et d'intégrer l'impact de lois récentes, telles que la loi relative à la politique de santé publique, la réforme de l'assurance maladie et la loi organique relative aux lois de finances (LOLF). Il est également important de prendre en compte les évaluations, par le Parlement et par l'IGAS, de la loi du 1er juillet 1998, qui a créé la plupart des agences de sécurité sanitaire, ainsi que de la réforme du ministère des affaires sociales. Une analyse a été menée avec l'aide d'un cabinet de consultants et des pistes ont été tracées. De nombreux chantiers ont été menés concernant la maîtrise des processus de pilotage et de gestion des plans sanitaires et des programmes LOLF ainsi que l'efficacité des modes de fonctionnement interne (planification des activités, niveau de délégation clarifié, partage de l'information formalisé et capacité à fixer des priorités et à procéder à des arbitrages sur les dossiers transversaux). Des premiers résultats sont déjà perceptibles avec la mise en place du département des situations d'urgence sanitaire et la création de plusieurs postes, dont un directeur de projet pour le programme veille et sécurité sanitaire et deux contrôleurs de gestion. Il faut également renforcer les moyens de la DGS dans le domaine de la gestion des stocks des produits de santé achetés dans le cadre de la lutte contre le bioterrorisme et la préparation aux situations sanitaires exceptionnelles. Il est également important d'aider l'encadrement intermédiaire à développer ses capacités de management. Des efforts de formation sont sans doute à produire dans ce domaine et l'amélioration des processus budgétaires et comptables doit être poursuivie. La DGS expérimente par ailleurs un fonctionnement par projet pour l'élaboration et le suivi des décrets d'application de la loi relative à la politique de santé publique. Une équipe dédiée d'une dizaine de personnes, représentant l'ensemble des sous-directions, est chargée de coordonner et de suivre la rédaction des textes. Un tableau de bord est par ailleurs mis à jour de façon bimensuelle. Plusieurs chantiers restent enfin à ouvrir en 2005. Il serait nécessaire de regrouper, à terme, les différentes agences de santé, non pour leur faire perdre leurs spécificités mais pour rassembler et renforcer les expertises. Il est en effet anormal que les entreprises qui interrogent une agence sur un problème donné reçoivent des réponses d'ordre administratif plutôt que sanitaire. Le président Jean-Michel Dubernard a rappelé que la question de la coopération des agences avait été abordée lors de la discussion, en première lecture, du projet de loi relatif à la politique de santé publique. * La commission a autorisé le dépôt du rapport sur la mise en application de la loi n°2004-800 du 6 août 2004 relative à la bioéthique en vue de sa publication. ANNEXE 1 : TABLEAU DE SUIVI DE LA MISE EN APPLICATION DE LA LOI N° 2004-800 DU 6 AOÛT 2004 RELATIVE A LA BIOÉTHIQUE
Source : Ministère des solidarités, de la santé et de la famille ANNEXE 2 : LISTE DES SIGLES ET ACRONYMES UTILISÉS AFSSAPS Agence française de sécurité sanitaire des produits de santé ABM Agence de la biomédecine AMP Assistance médicale à la procréation CCNE Comité consultatif national d'éthique CCNECG Commission consultative nationale en matière d'examens des caractéristiques génétiques à des fins médicales CNCDH Commission nationale consultative des droits de l'Homme CNAMTS Caisse nationale d'assurance maladie des travailleurs salariés CNMBRPD Commission nationale de médecine et de biologie de la reproduction et du diagnostic prénatal CNRS Centre national de la recherche scientifique CNQ Commission du contrôle national de qualité des laboratoires d'analyses de biologie médicale CPDPN Centre pluridisciplinaire de diagnostic prénatal DPI Diagnostic préimplantatoire DPN Diagnostic prénatal DHOS Direction de l'hospitalisation de l'organisation des soins DDASS Direction départementale des affaires sanitaires et sociales DRASS Direction régionale des affaires sanitaires et sociales EFG Etablissement français des greffes FGM Association « France Greffe de Moelle » IGAS Inspection générale des affaires sociales INSERM Institut national de la santé et de la recherche médicale OPESCT Office parlementaire d'évaluation des choix scientifiques et technologiques UNCAM Union nationale des caisses d'assurance maladie --------------- N° 2206 - Rapport sur la mise en application de la loi n° 2004-800 du 6 août 2004 relative à la bioéthique (M. Pierre-Louis Fagniez) 1 () Lois n° 94-548 du 1er juillet 1994 relative au traitement de données nominatives ayant pour fin la recherche dans le domaine de la santé, n° 94-653 du 29 juillet 1994 relative au respect du corps humain et n° 94-654 du 29 juillet 1994 relative au don et à l'utilisation des éléments et produits du corps humain, à l'assistance médicale à la procréation et au diagnostic prénatal. 2 () « Le principe de responsabilité », Hans Jonas, Le Cerf (1990) 3 () Décision du Conseil constitutionnel n° 2004-498 du 29 juillet 2004. 4 () Conformément aux dispositions prévues par l'ordonnance n° 2004-164 du 20 février 2004 prise en application de la loi n° 2003-591 du 2 juillet 2003 habilitant le gouvernement à simplifier le droit. 5 () Ces dispositions s'appliquent jusqu'à la publication du décret prévu par l'article 12 de la loi (non paru à ce jour) et, au plus tard, à l'expiration d'un délai d'un an à compter de la publication de la loi. 6 () Conformément à l'article 25 de la loi, cette période est limitée est à cinq ans à compter de la publication du décret en Conseil d'Etat prévu par l'article L. 2151-8 du même code (décret non paru à ce jour). 7 () L'article 39 autorise le gouvernement, dans un délai de 15 mois après la promulgation de la loi, à prendre par ordonnances les mesures législatives nécessaires à son extension et à son adaptation en outre-mer. 8 () Assemblée nationale, compte rendu de la séance du 8 juillet 2004. 9 () Par exemple, la directive n° 2004/23/CE du Parlement européen et du Conseil, du 31 mars 2004, relative à l'établissement de normes de qualité et de sécurité pour le don, l'obtention, le contrôle, la transformation, le stockage et la distribution de tissus et cellules humains. 10 () Lois n° 2004-810 du 13 août 2004 relative à l'assurance maladie, n° 2004-806 du 9 août 2004 relative à la politique de santé publique et n° 2004-809 du 13 août 2004 relative aux libertés et responsabilités locales. 11 () Rapport public annuel 2004 de la Cour des comptes au Président de la République. 12 () Il s'agit par exemple de l'avis donné par l'ABM sur la liste des établissements dans lesquels le prélèvement des cellules à fins d'administration autologue ou allogénique est autorisé. 13 () loi n° 2004-800 du 6 août 2004 relative à la bioéthique loi n° 2004-806 du 9 août 2004 relative à la politique de santé publique loi n° 2004-810 du 13 août 2004 relative à l'assurance maladie 14 () Nature du texte réglementaire : ordonnance (Ord.), décret en Conseil d'Etat (DCE), décret simple (D) ou arrêté (A). 15 () Article du code de la santé publique. |
